一种肿瘤微环境响应型诊疗一体化纳米探针及其制备方法与流程
本发明涉及生物医学纳米材料技术领域,更具体而言,涉及一种肿瘤微环境响应型诊疗一体化纳米探针及其制备方法。
背景技术:
恶性肿瘤严重威胁着人类的生命健康,实现同步诊断与治疗是目前攻克癌症的重要手段之一。随着纳米技术的快速发展,利用纳米材料良好的生物相容性、可控的空间结构、材料表面易修饰等特性,将药物靶向运输、活体示踪、药物治疗和预后监测等功能结合于一体,为癌症诊疗一体化带来新的希望。
由于实体瘤生长过快,导致肿瘤部位血管发生扭曲变形,血管渗透性提高,内皮细胞排列无规则,从而变得多孔,可使纳米颗粒(小于200nm)渗透进肿瘤细胞间隙。特别是小尺寸纳米颗粒(小于7nm)易于通过血管孔洞进入病灶,具备深度、均匀的肿瘤组织穿透能力,可有效提升肿瘤的诊断与治疗效果。然而,纳米颗粒在病灶部位沉积量是纳米颗粒富集和清除之间动态平衡所呈现的结果,小尺寸颗粒虽可在肿瘤部位快速富集渗透,但在瘤内滞留时间短、清除速率高,易发生肾脏快速代谢。
研究表明,肿瘤微环境具有低ph值、高表达谷胱甘肽和基质金属蛋白酶等特点,特别是利用基质金属蛋白酶剪切作用,将链接在纳米探针外表面可响应肽链进行剪切,使材料结构、表面电荷以及分散程度发生变化,从而实现肿瘤部位高效聚集,提高诊疗效果。从毒性、降解性、稳定性以及合成工艺等因素出发,设计开发内源性白蛋白材料,不仅有望解决安全性问题,还可充分利用内源性物质自身结构与性能特点,构筑临床转化前景更好的诊疗一体化纳米探针。到目前为止,国内外有关利用白蛋白生物矿化法构筑纳米探针并链接可基质金属蛋白酶响应肽链应用于肿瘤诊疗一体化的专利及文献数量较少,且主要局限于疏水性无机材料链接响应性肽链构筑纳米探针的研究。
技术实现要素:
为了克服现有技术中所存在的不足,本发明提供一种肿瘤微环境响应型诊疗一体化纳米探针及其制备方法,该材料在肿瘤微环境受基质金属蛋白酶作用,对肽链进行剪切促使疏水链暴露,导致纳米颗粒疏水性能增大,提升材料在肿瘤部位富集程度,此作用特点可有效提高纳米探针成像与治疗性能。
为了解决上述技术问题,本发明所采用的技术方案为:
一种肿瘤微环境响应型诊疗一体化纳米探针,该纳米探针由bi2s3和mno2功能性材料,与牛血白蛋白相互作用,通过外部链接响应性肽链组成,其中bi2s3占纳米探针的12~17wt%,mno2占纳米探针的8~13wt%,外部链接的基质金属蛋白酶响应性肽链占纳米探针重量的0.4-0.9wt%。
进一步地,所述纳米探针的晶粒直径为15~35nm。
一种肿瘤微环境响应型诊疗一体化纳米探针制备方法,包括以下步骤:
s1、按照牛血清白蛋白:去离子水=0.053~0.01:7222的摩尔比,将牛血清白蛋白加入去离子水中,超声分散15min,室温搅拌15min,形成透明混合溶液;
s2、按照无机铋源:硝酸=3.0~0.495:20的摩尔比,将无机铋源缓慢滴入2mol/l的硝酸溶液中,搅拌10min后快速加至s1中透明混合溶液中,强力搅拌15min;
s3、向s2中混合溶液滴加浓度为2mol/l的氢氧化钠溶液,调整混合溶液ph值为12;
s4、按照无机锰:去离子水=3.8:7222的摩尔比,将无机锰源溶于去离子水中,充分溶解后以1ml/min的速度加至s3中混合溶液,37℃下搅拌10~30h,溶液由透明变成棕黑色;
s5、将s4中棕黑色产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米颗粒;
s6、按照未交联肽链的纳米颗粒与肽链15:0.88~1.32的质量比,肽链:吗啉乙磺酸一水合物:氯化钠:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐:n-羟基硫代琥珀酰亚胺:去离子水=0.1~0.15:126.61:624.57:0.033:0.048:111.1的摩尔比,称量上述原料;
s7、将s5中未交联肽链的纳米颗粒和s6中称量的吗啉乙磺酸一水合物加入氯化钠缓冲溶液中,超声分散30min;
s8、向s7中超声分散后混合溶液中加入s6中称量的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基硫代琥珀酰亚胺,室温搅拌30min;
s9、向s8中混合溶液加入s6中称量的肽链,4℃下高速搅拌12~20h,产物经100kda透析袋纯化、离心分离,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
优选地,s1中超声分散频率50khz。
优选地,所述无机铋源为五水合硝酸铋、三氯化铋或硫酸铋。
优选地,所述无机锰源为高锰酸钾或四水合氯化锰。
优选地,所述s7中超声分散频率为45khz。
优选地,所述肽链具有基质金属蛋白酶响应性能。
优选地,所述肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2。
优选地,所述s9中离心分离采用超滤分离管,转速为3000r/min,时间为15min。
与现有技术相比,本发明所具有的有益效果为:
本发明提供了一种肿瘤微环境响应型诊疗一体化纳米探针及其制备方法,该纳米探针以牛血白蛋白为模板和硫源,通过生物矿化方式,构筑具有bi2s3和mno2的分散均匀、粒径均一的纳米颗粒,利用牛血白蛋白的活化的羧基与肽链的氨基进行交联,链接可基质金属蛋白酶响应的肽链,以提供一种具备多模态成像及治疗的纳米探针,该材料在肿瘤微环境受基质金属蛋白酶作用,对肽链进行剪切促使疏水链暴露,导致纳米颗粒疏水性能增大,提升材料在肿瘤部位富集程度,此作用特点可有效提高纳米探针成像与治疗性能。本工艺过程是一种简单、快速、可控的肿瘤微环境响应型诊疗一体化纳米探针,本发明制备的纳米探针晶粒直径15~35nm,产物纯度达到99.9%。
附图说明
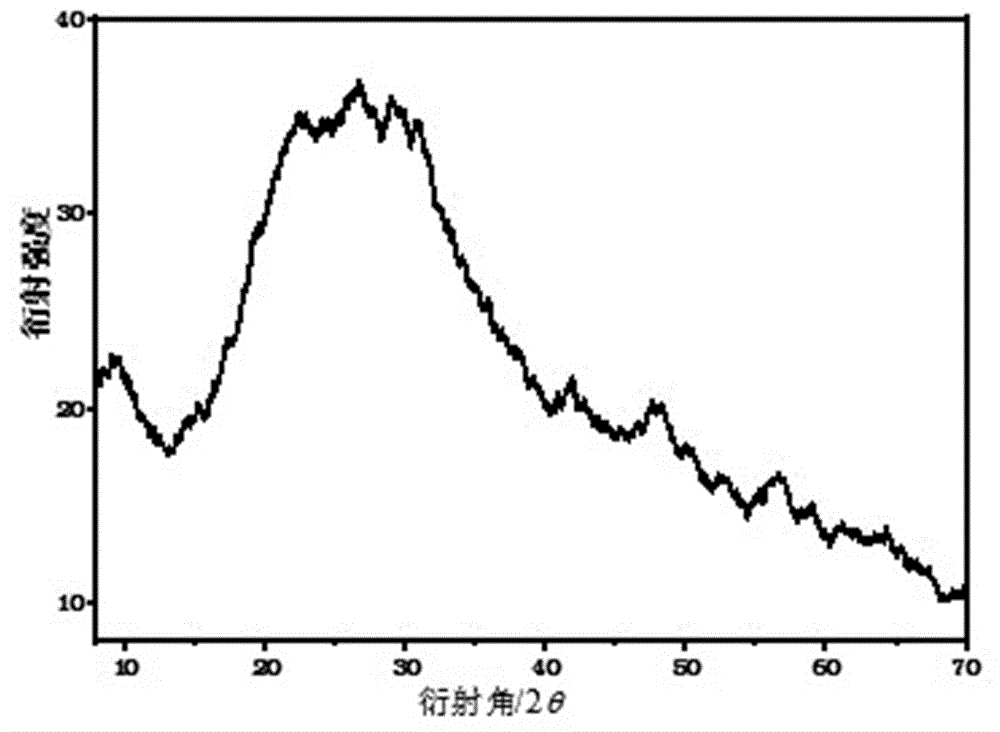
图1为本发明实施例1所合成的诊疗一体化纳米探针的xrd谱图。
图2为本发明实施例1所合成的诊疗一体化纳米探针的透射电子显微镜图。
图3为本发明实施例1所合成的诊疗一体化纳米探针的粒度分析。
图4为本发明实施例1所合成的诊疗一体化纳米探针的xps谱图。图中(a)为bi元素的x射线光电子能谱,图中(b)为mn元素的x射线光电子能谱。
图5为本发明实施例1所合成的诊疗一体化纳米探针不同浓度的光热性能。
图6为本发明实施例1所合成的诊疗一体化纳米探针不同浓度的光热稳定性研究。
图7为本发明实施例1所合成的诊疗一体化纳米探针的细胞毒性cck-8研究。
图8为本发明实施例1所合成的诊疗一体化纳米探针不同浓度细胞光热荧光成像图。
图9为本发明实施例1所合成的诊疗一体化纳米探针不同浓度细胞细胞光热作用后细胞存活率图。
图10为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体光声成像图。
图11为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体mri成像图。
图12为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体光热治疗效果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋1.08g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.8g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,所述肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例2
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白5.25g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋2.25g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.9g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,称取肽链0.2mg,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例3
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白1.5g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋0.36g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.9g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例4
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋1.08g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.8g和去离子水15ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链8mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例5
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋1.08g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.9g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链13.2mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例6
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋1.08g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.8g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌30h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌20h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例7
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋1.08g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.8g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌10h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例8
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取三氯化铋0.702g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取四水合氯化锰1.0g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
实施例9
取浓度为65%的硝酸138.6ml,去离子水806ml,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的硝酸溶液备用;
取氢氧化钠83.33g,去离子水1l,一起加入烧杯充分混合,将混合液移至容量瓶中,配成浓度为2mol/l的氢氧化钠溶液备用;
取去离子水105ml,牛血白蛋白3.75g,一起加入至烧杯中,置于超声波分散仪内进行溶解分散,频率50khz,分散时间15min,室温搅拌15min,形成透明溶液;称取五水合硝酸铋0.786g,缓慢加入15ml预先配好的2mol/l的硝酸溶液中,搅拌10min,将该溶液快速加至以上透明溶液中,强力搅拌30min;利用预先配好的氢氧化钠溶液将混合溶液的ph调节至12;称取高锰酸钾0.8g和去离子水45ml。一起加入烧杯中,室温搅拌20min,形成紫色溶液,将该溶液以1ml/min的速度滴入混合溶液中,加热至37℃恒温搅拌24h,溶液由透明变成棕黑色,产物经去离子水洗涤和离心3次,冷冻干燥,得到未交联肽链的纳米材料固体粉末;
以氯化钠:吗啉乙磺酸一水合物:去离子水=624.57:126.61:111.1为摩尔比,称取氯化钠36.5g,去离子水1.25l,加入烧杯中,充分混合后,称取吗啉乙磺酸一水合物27g加入已混合充分的氯化钠水溶液中,继续充分混合形成缓冲液。取未交联肽链的纳米材料固体粉末1.5g,加入缓冲液中,置于超声波分散仪内进行溶解分散,频率45khz,分散时间30min,形成混合溶液;称取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐6.2mg,n-羟基硫代琥珀酰亚胺5.5mg,室温搅拌15min;称取肽链10mg,肽链采用ac-klvplgrgg-nh2,其氨基酸序列为ac-lys-leu-val-pro-leu-gly-arg-gly-gly-nh2,4℃下高速搅拌12h,产物经100kda透析袋纯化,3000r/min超滤离心管分离15min,留存固体沉淀物,以上步骤重复三次,将固体沉淀物置于烧杯中,冷冻干燥,得到诊疗一体化纳米探针。
本发明将制备得到的诊疗一体化纳米探针溶于pbs缓冲液,通过鼠尾静脉注射进行给药,检测纳米探针的成像性能与治疗效果。
图1为本发明实施例1所合成的诊疗一体化纳米探针的xrd谱图。合成的诊疗一体化纳米探针显示出其特有的特征衍射峰,峰型较为圆滑,下降走向平缓。
图2为本发明实施例1所合成的诊疗一体化纳米探针的透射电子显微镜图,由图可知所合成诊疗一体化纳米探针的形貌,其纳米颗粒分布均匀,形貌为圆形小颗粒。
图3为本发明实施例1所合成的诊疗一体化纳米探针粒度分析,由图可知,所合成诊疗一体化纳米探针的粒度为7nm左右,大小分布均匀。
图4为本发明实施例1所合成的诊疗一体化纳米探针的xps谱图。图中(a)为bi元素的x射线光电子能谱,图中(b)为mn元素的x射线光电子能谱。由图(a)可知,在158.6和164.1ev处xps峰对应bi2s3纳米颗粒的bi4f7/2和4f5/2峰,s在163.5ev处的2p峰由bsa稳定的bi2s3纳米粒中bi和s结合产生。由图(b)可知,图中mn所对应的2p3/2和2p2/1峰为mno2中mn元素所对应的峰。
图5为本发明实施例1所合成的诊疗一体化纳米探针不同浓度的光热性能,由图可知,不同浓度的诊疗一体化纳米探针在近红外辐照(808nm,1w/cm2)下的升温曲线显示,浓度越高升温越快,温度随辐照时间增长的越高。
图6为本发明实施例1所合成的诊疗一体化纳米探针不同浓度光热稳定性研究,由图可知,诊疗一体化纳米探针在水分散体在808nm激光(1w/cm2)照射下的光热稳定性,激光照射5min后关闭并重复5个周期。
图7为本发明实施例1所合成的诊疗一体化纳米探针的细胞毒性cck-8研究。由图可知,不同浓度的诊疗一体化纳米探针对细胞的增值抑制率影像均不明显,表现为低毒性,即使在高浓度的诊疗一体化纳米探针下(800μg/ml)培养,细胞存活率也高于90%。
图8为本发明实施例1所合成的诊疗一体化纳米探针不同浓度细胞光热荧光成像图,图中a为对照组,b为光照组,c为给药组,d为给药125μg/ml+光照组,e为给药250μg/ml+光照组,f为500μg/ml+光照组;由图可知,与对照组相比,随着给药浓度的增加,光热治疗杀死的细胞越多,细胞光热治疗效果好。
图9为本发明实施例1所合成的诊疗一体化纳米探针不同浓度细胞光热作用后细胞存活率图。由图可知,随着给药浓度的增加,在光热治疗后细胞存活率减少,在给药浓度为1000μg/ml时细胞基本全部死亡。
图10为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体光声成像图。由图可知,在裸鼠尾静脉给药后4h肿瘤部位药物聚集浓度最高,光声信号最强,四小时后药物逐渐代谢,肿瘤及全身其他部位药物浓度减小。
图11为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体mri成像图。如图所示,在裸鼠尾静脉给药后4h肿瘤部位药物聚集浓度最高,mr信号最强,四小时后药物逐渐代谢,肿瘤及全身其他部位药物浓度减小。
图12为本发明实施例1所合成的诊疗一体化纳米探针的裸鼠活体光热治疗效果图。如图所示,对裸鼠肿瘤部位进行光热治疗,给裸鼠尾静脉注射诊疗一体化纳米探针与注射pbs相比,肿瘤部位治疗温度可达55度,远高于注射pbs对照组,光热治疗效果好。
上面仅对本发明的较佳实施例作了详细说明,但是本发明并不限于上述实施例,在本领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化,各种变化均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!