以甜菊糖苷为载体的根皮素增溶固体分散体及其制备方法与流程
本发明涉及化合物增溶技术领域,具体涉及一种以甜菊糖苷为载体的根皮素增溶固体分散体及其制备方法。
背景技术:
根皮素(phloretin,pt)是一种二氢查耳酮类植物黄酮,主要存在于苹果树的根皮、茎、叶以及苹果的果皮中,可作为食品用天然香料。大量研究表明,根皮素抗氧化、抑菌、抗肿瘤、抗炎、免疫抑制、细胞保护、抑制酪氨酸酶、降血糖等多种生物活性,在食品、药品、化妆品等领域都有极强的市场前景。目前,根皮素已经作为新型天然美白剂在化妆品领域广泛应用。但是,根皮素在水中溶解度(20μg/ml)极差,口服生物利用度低,在食品、药品领域应用时存在严重问题。
甜菊糖苷(steviosides,ste)是一种从植物甜叶菊中精提的新型天然甜味剂,已通过了jecfa(世界卫生组织和联合国粮农组织联合食品添加剂专家委员会)的安全性评价,作为甜味剂被列入《食品安全国家标准食品添加剂使用标准》(gb2760)。甜菊苷与瑞鲍迪苷a是甜菊糖苷中最主要的两个成分,它们均是由疏水的甜菊醇中心骨架和亲水的双侧糖基组成的萜类化合物,呈典型的两亲性结构,该结构使其成为一种天然的固体表面活性剂,可提高难溶性物质的溶解度。同时,甜菊糖苷不能被消化道的酶分解消化,也不易被微生物利用,血糖生成指数(gi)低,摄入以后血糖浓度不会显著升高,其主要成分甜菊苷可以通过促进胰岛素的释放达到降血糖的目的,用于ⅱ型糖尿病的辅助治疗。
甜菊糖苷和根皮素具有许多共同的优点:都可添加到食品中,安全性高以及具有降血糖效果。
目前研究中,对根皮素增溶的常用技术包括微乳、自微乳、环糊精及其衍生物包埋、固体分散体技术等。但这些制备方法比较复杂,适用范围小,大多数不能运用在食品领域中。例如,根皮素微乳和自微乳的制备需要使用一定量的合成表面活性剂,增加了其毒副作用;环糊精包合技术的包和率低,技术稳定性差,严重影响增溶效果。固体分散体技术虽然制备简单,但目前使用的大部分载体不能添加到食品中。
目前,尚无以甜菊糖苷作为固体分散体的载体材料,以及将其用于根皮素增溶的报道。
技术实现要素:
本发明旨在针对现有技术的技术缺陷,提供一种以甜菊糖苷为载体的根皮素增溶固体分散体及其制备方法,以解决现有技术中,根皮素溶解度极低的技术问题。
本发明要解决的另一技术问题是,针对根皮素的常规增溶方法配方复杂、工艺繁琐。
本发明要解决的再一技术问题是,常规增溶方法所得的根皮素改性产物无法应用于食品中。
本发明要解决的又一技术问题是,常规增溶方法对根皮素的增溶效果有待提升。
为实现以上技术目的,本发明采用以下技术方案:
以甜菊糖苷为载体的根皮素增溶固体分散体,该固体分散体以甜菊糖苷为载体,以根皮素为分散质。
作为优选,所述甜菊糖苷中甜菊苷的质量百分比为0~81.6%,所述甜菊糖苷中瑞鲍迪苷a的质量百分比为10.2~98.6%。
作为优选,所述甜菊糖苷中甜菊苷的质量百分比为0~97.5%,所述甜菊糖苷中瑞鲍迪苷a的质量百分比为0~98.6%。
作为优选,该固体分散体中根皮素的质量百分比为4.94~5.66%。
在以上技术方案的基础上,本发明进一步提供了上述以甜菊糖苷为载体的根皮素增溶固体分散体的制备方法,包括以下步骤:
1)分别取配方量的甜菊糖苷和根皮素,混合均匀,得到混合物;
2)将步骤1)所得的混合物与95%浓度的乙醇混合,而后以40khz的频率超声处理,直至完全溶解;
3)以200rpm的转速对步骤2)所得产物进行搅拌(使溶解的混合物均匀分散于溶液中);
4)将步骤3)搅拌后的产物在40℃下干燥30min(用以除去大部分乙醇得粘稠状流体);
5)将步骤4)干燥后的产物再在40℃下进行真空干燥6h(用以除去残余水分与乙醇得白色固体);
6)将步骤5)所得产物研磨并过筛,收集粒径小于80目的粉末,即得到所述以甜菊糖苷为载体的根皮素增溶固体分散体。
作为优选,步骤2)中,混合物与95%浓度的乙醇的比例为:每500~600mg混合物对应10ml95%浓度的乙醇。
作为优选,步骤2)中,所述超声处理的时长为5~15min。
作为优选,步骤3)中所述的搅拌是利用磁力搅拌装置实现的。
作为优选,步骤3)中,以200rpm的转速对步骤2)所得产物进行搅拌,使溶解的混合物均匀分散于溶液中。
在以上技术方案的基础上,本发明进一步提供了上述以甜菊糖苷为载体的根皮素增溶固体分散体作为口服液添加剂或饮料添加剂的应用。
本发明提供了一种以甜菊糖苷为载体的根皮素增溶固体分散体及其制备方法。该技术方案以甜菊糖苷为载体,根皮素为分散质,通过溶剂法制备而成,每500mg甜菊糖苷可将26~30mg根皮素完全增溶于水中。该固体分散体可有效提高根皮素的溶解度和释放度,同时克服了常规增溶技术所存在的配方复杂、工艺繁琐、不适用于食品等问题;本发明工艺简单安全,对设备要求不高,适用于工业水平的规模化生产;而且,甜菊糖苷和根皮素均为适宜降糖食品的添加剂,可用于各种食品水体系中。
本发明的技术优势集中体现在以下方面:
1、本发明所述的以甜菊糖苷为载体材料的固体分散体中根皮素以无定形态存在,该形态根皮素可在较少的能量输入下溶解于水中,从而显著提高了难溶性根皮素的溶解度,使其能在胃液与肠液中充分释放从而可提高根皮素的生物利用度,且根皮素与甜菊糖苷均为《gb2760食品添加剂使用卫生标准》中允许的食品添加剂,实现了根皮素在食品饮料中的应用。
2、已有技术均利用甜菊糖苷各自组装成胶束的特点对难溶性物质进行增溶,而该增溶方法下,甜菊糖苷阻碍了根皮素与生物活性蛋白的结合,限制了根皮素在人体内的生物活性的发挥。本方法将根皮素以无定形态分散在甜菊糖苷中,大部分的该形态根皮素可直接溶解于水中,其不受甜菊糖苷的包裹,可与葡萄糖苷酶、sglt1、glut2、血清白蛋白等多个生物活性蛋白直接接触发挥功效。
3、本发明所述的固体分散体将天然甜味剂甜菊糖苷与葡萄糖吸收抑制剂根皮素相结合,可作为降血糖食品的添加剂使用,为糖尿病人群所适用的无糖食品的开发提供了良好的原材料,具有很好的社会价值和应用前景。
4、与环糊精及其衍生物包合、化学修饰、微乳、自微乳、微乳凝胶、共结晶、纳米纤维等已有根皮素增溶方法相比较,本发明所采用的原料均可安全食用,且制备方法流程简短、可操作性强,有利于推广和产业化,所得产品可广泛用于口服药品和食品饮料领域。
附图说明
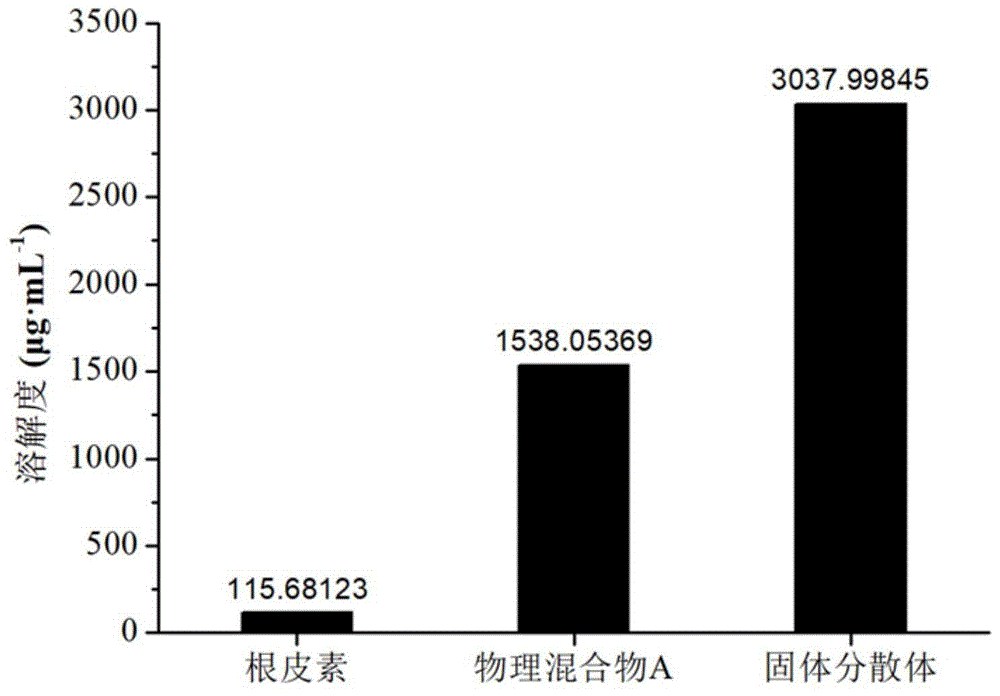
图1为本发明具体实施方式中,以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物a及纯根皮素的增溶能力比较结果图;
图2为本发明具体实施方式中,以含81.6%甜菊苷和10.2%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物b及纯根皮素的增溶能力比较结果图;
图3为本发明具体实施方式中,以含72.5%甜菊苷和20.8%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物c及纯根皮素的增溶能力比较结果图;
图4为发明具体实施方式中,以含60.5%甜菊苷和30.2%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物d及纯根皮素的增溶能力比较结果图;
图5为发明具体实施方式中,以含51.2%甜菊苷和40.2%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物e及纯根皮素的增溶能力比较结果图;
图6为发明具体实施方式中,以含40.2%甜菊苷和50.4%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物f及纯根皮素的增溶能力比较结果图;
图7为发明具体实施方式中,以含30.6%甜菊苷和61.1%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物g及纯根皮素的增溶能力比较结果图;
图8为发明具体实施方式中,以含22.1%甜菊苷和72.5%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物h及纯根皮素的增溶能力比较结果图;
图9为发明具体实施方式中,以含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物k及纯根皮素的增溶能力比较结果图;
图10为发明具体实施方式中,以含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体m、物理混合物及纯根皮素的增溶能力比较结果图;
图11为发明具体实施方式中,以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、含97.5%甜菊苷的甜菊糖苷、物理混合物a及纯根皮素的x射线衍射图谱;
图12为发明具体实施方式中,不同释放介质下以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物a和纯根皮素的体外累计释放量-时间曲线图;
图13为发明具体实施方式中,以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物a及纯根皮素对牛血清白蛋白荧光猝灭的stern-volmer关系图。
具体实施方式
以下将对本发明的具体实施方式进行详细描述。为了避免过多不必要的细节,在以下实施例中对属于公知的结构或功能将不进行详细描述。以下实施例中所使用的近似性语言可用于定量表述,表明在不改变基本功能的情况下可允许数量有一定的变动。除有定义外,以下实施例中所用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
实施例1
按照以下步骤制备以甜菊糖苷为载体材料的根皮素增溶固体分散体:
s1.称取500mg含97.5%甜菊苷的甜菊糖苷和过量的根皮素(约50mg),均匀混合,得物理混合物a;
s2.将10ml95%乙醇加入混合物a中,并用40khz超声处理约5min使混合物完全溶解于乙醇中,得溶液;
s3.将溶液于200r·min-1磁力搅拌下,使溶解的混合物a均匀分散于溶液中;
s4.将溶液在40℃下干燥30min,除去大部分乙醇得粘稠状流体;
s5.将粘稠状流体在40℃下进行真空干燥6小时,除去残余水分与乙醇得白色固体;
s6.将s5所述白色固体充分研磨并过筛,收集粒径80目以下的粉末。
称取550mgs6中所述的粉末、550mg混合物a和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌30min充分溶解平衡后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图1所示,在以含97.5%甜菊苷的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物a的1.98倍,是纯根皮素的26.26倍。每500mg含97.5%甜菊苷的甜菊糖苷可完全增溶30.38mg根皮素,即含97.5%甜菊苷的甜菊糖苷可负载的根皮素质量百分比为5.73%。
实施例2
与实施例1不同的是,采用含81.6%甜菊苷和10.2%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物b,其中超声处理时间约为6min。
称取550mg固体分散体粉末、550mg混合物b和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图2所示,在以含81.6%甜菊苷和10.2%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物b的1.98倍,是纯根皮素的26.23倍。每500mg含81.6%甜菊苷和10.2%瑞鲍迪苷a的甜菊糖苷可完全增溶30.34mg根皮素,即含81.6%甜菊苷和10.2%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.72%。
实施例3
与实施例1不同的是,采用含72.5%甜菊苷和20.8%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物c,其中超声处理时间约为7min。
称取550mg固体分散体粉末、550mg混合物c和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图3所示,在以含72.5%甜菊苷和20.8%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物c的2.00倍,是纯根皮素的26.16倍。每500mg含72.5%甜菊苷和20.8%瑞鲍迪苷a的甜菊糖苷可完全增溶30.26mg根皮素,即含72.5%甜菊苷和20.8%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.71%。
实施例4
与实施例1不同的是,采用含60.5%甜菊苷和30.2%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物d,其中超声处理时间约为8min。
称取550mg固体分散体粉末、550mg混合物d和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图4所示,在以含60.5%甜菊苷和30.2%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物d的2.00倍,是纯根皮素的25.93倍。每500mg含60.5%甜菊苷和30.2%瑞鲍迪苷a的甜菊糖苷可完全增溶30.99mg根皮素,即含60.5%甜菊苷和30.2%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.66%。
实施例5
与实施例1不同的是,采用含51.2%甜菊苷和40.2%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物e,其中超声处理时间约为9min。
称取550mg固体分散体粉末、550mg混合物e和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图5所示,在以含51.2%甜菊苷和40.2%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物e的2.01倍,是纯根皮素的25.70倍。每500mg含51.2%甜菊苷和40.2%瑞鲍迪苷a的甜菊糖苷可完全增溶29.73mg根皮素,即含51.2%甜菊苷和40.2%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.61%。
实施例6
与实施例1不同的是,采用含40.2%甜菊苷和50.4%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物f,其中超声处理时间约为10min。
称取550mg固体分散体粉末、550mg混合物f和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图6所示,在以含40.2%甜菊苷和50.4%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物f的2.00倍,是纯根皮素的25.65倍。每500mg含40.2%甜菊苷和50.4%瑞鲍迪苷a的甜菊糖苷可完全增溶29.67mg根皮素,即含40.2%甜菊苷和50.4%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.60%。
实施例7
与实施例1不同的是,采用含30.6%甜菊苷和61.1%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物g,其中超声处理时间约为11min。
称取550mg固体分散体粉末、550mg混合物g和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图7所示,在以含30.6%甜菊苷和61.1%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物g的2.01倍,是纯根皮素的25.58倍。每500mg含30.6%甜菊苷和61.1%瑞鲍迪苷a的甜菊糖苷可完全增溶29.60mg根皮素,即含30.6%甜菊苷和61.1%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.59%。
实施例8
与实施例1不同的是,采用含22.1%甜菊苷和72.5%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物h,其中超声处理时间约为12min。
称取550mg固体分散体粉末、550mg混合物h和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图8所示,在以含22.1%甜菊苷和72.5%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物h的1.97倍,是纯根皮素的25.12倍。每500mg含22.1%甜菊苷和72.5%瑞鲍迪苷a的甜菊糖苷可完全增溶29.06mg根皮素,即含22.1%甜菊苷和72.5%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.49%。
实施例9
与实施例1不同的是,采用含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物k,其中超声处理时间约为14min。
称取550mg固体分散体粉末、550mg混合物k和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图9所示,在以含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物k的1.94倍,是纯根皮素的24.61倍。每500mg含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷可完全增溶28.47mg根皮素,即含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.39%。
以含9.1%甜菊苷和80.5%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体水溶液长时间存放后会出现白色絮状沉淀,其稳定性较差。
实施例10
与实施例1不同的是,采用含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷制备固体分散体和物理混合物l,其中超声处理时间约为15min。
称取550mg固体分散体粉末、550mg混合物l和50mg根皮素于螺口样品瓶中,加入10ml蒸馏水并搅拌10min充分溶解后,将溶液于5000rpm离心10min,比较上清夜中根皮素的溶解度。
如图10所示,在以含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷为载体材料的固体分散体中,根皮素的溶解度是物理混合物l的2.02倍,是纯根皮素的23.05倍。每500mg含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷可完全增溶26.67mg根皮素,即含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷可负载的根皮素质量百分比为5.06%。
以含0%甜菊苷和98.6%瑞鲍迪苷a的甜菊糖苷为载体材料的根皮素增溶固体分散体水溶液长时间存放后会出现白色絮状沉淀,其稳定性较差。
实施例11(以甜菊糖苷为载体材料的根皮素增溶固体分散体x射线衍射实验)
1、受试样品
以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、含97.5%甜菊苷的甜菊糖苷、物理混合物a和根皮素
2、实验方法
采用x射线衍射仪,分别对样品粉末进行分析,测试条件为cu-ka靶;管电压为40kv;管电流为30ma;扫描速度为8°·min-1;步长为0.02;衍射角度扫描范围为5-50°;发散狭缝为1°;防散射狭缝为1°;接收狭缝为0.03mm。
3.结果
如图11所示。根皮素的2θ值分别在6.9°、9.5°、19.1°、27.1°和28°处显示特征衍射峰,而甜菊糖苷在5°至50°的测试范围内未显示任何峰值。物理混合物a显示与pt相同的衍射图样,但由于甜菊糖苷的稀释效应,其信号较弱。在固体分散体中,根皮素的特征衍射图形消失,这是表明根皮素已从晶态转变为无定形态。该形态的根皮素只需少量的能量便可直接溶解入水中,由此增加了根皮素的溶解度。
实施例12(以甜菊糖苷为载体材料的根皮素增溶固体分散体体外释放实验)
采用反向透析袋法进行体外释放实验。
1、供试样品
以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物a和根皮素
2、实验方法
依据《中国药典》2015版配制人工肠液(sif)与人工胃液(sgf)。
取2mlsgf或sif分别加入到经沸水煮沸10min的透析袋中,并扎紧袋口。将透析袋置于装有100ml的sgf或sif的三角瓶中,向瓶中加入供试样品粉末。每瓶分别设置8个透析袋,温度控制在37±0.5℃,转速控制在100r/min,于一定的时间间隔取出1个透析袋进行分析,同时补充同温度的2ml释放介质。
累积释放量是t时间内体系释放待测物质的总量,用以下公式计算:
mt=vct+∑ct-1v样
其中,mt为t时间体系的累积释放量;ct为t时间取样时根皮素的释放浓度,v为取样前的体积,在本实验中为100ml;ct-1为t时间取样前一个取样时间点的浓度;v样为每次所取样品体积,在本实验中为2ml。
3.结果
如图12所示,在ph1.2sgf中,固体分散体中根皮素在36小时内的累计释放量比物理混合物a高1.3倍,比纯根皮素高9.2倍。在ph6.8sif中,固体分散体中根皮素在36小时内的累计释放量比纯跟皮素高2.4倍,但低于物理混合物a的累计释放率。这是由于根皮素在偏碱性环境下不稳定,且增溶后的根皮素与sif有较大的接触面积,固体分散体中的根皮素在sif中降解速度较快。总体而言,甜菊糖苷为载体材料的固体分散体显著地提高了根皮素在肠胃液中的释放量。
实施例13(以甜菊糖苷为载体材料的根皮素增溶固体分散体与牛血清白蛋白相互作用实验)
1、供试样品
以含97.5%甜菊苷的甜菊糖苷为载体材料的根皮素增溶固体分散体、物理混合物a和根皮素
2、实验方法
各吸取1ml含有3mg/ml根皮素的固体分散体水溶液、物理混合物a水溶液和根皮素乙醇溶液并用蒸馏水稀释至100ml,使各体系中根皮素的最终浓度为0.03mg/ml。
采用荧光光谱研究牛血清白蛋白分别与不同体系中的根皮素之间的相互做用情况。在比色管中依次加入ph7.4tris-hcl缓冲液4ml,10μg/mlbsa溶液2ml,0.05mol/lnacl溶液2ml以及不同量的样品溶液,以蒸馏水定容至10ml,摇匀后静置20min。
荧光光谱扫描的测试条件:激发波长280nm,激发和发射狭缝宽度分别为2.5和5nm,发射波长范围290nm~450nm,记录340nm左右的荧光值。
3.结果
如图13所示,纯根皮素对牛血清白蛋白的猝灭速率(ksv)最大,说明其与牛血清白蛋白结合作用最强。与纯根皮素相比,物理混合物a中根皮素对牛血清白蛋白的猝灭速率显著下降,这是由于根皮素在水溶液中被甜菊糖苷自组装胶束包裹住而阻碍了根皮素与牛血清白蛋白相互作用。而固体分散体中的根皮素对牛血清白蛋白的猝灭速率与纯根皮素几乎相同。可看出,固体分散体溶于水后大部分根皮素溶解状态接近纯根皮素溶液,利于其与生物活性蛋白发生相互作用而发挥生物活性。
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,并不用以限制本发明。凡在本发明的申请范围内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!