一种病灶原位药物控制释放系统及其制备方法与流程
本发明属于医疗器械技术领域,具体涉及一种病灶原位药物控制释放系统及其制备方法。
背景技术:
目前在肿瘤的治疗中,对于不可切除类肿瘤(如t4,m1-m2型),即使采用大剂量放化疗手段,所得到的肿瘤治疗效果甚微,其原因一是放化疗过程药物需要经过周身循环过程,大部分药物会经病人肝脏代谢,导致能停留在肿瘤原位药物浓度低,药物利用率低,对肿瘤细胞抑制和作用效果较差;二是无论放疗或是化疗,均会对肿瘤造成损伤,会存在肿瘤应激反应,导致肿瘤发生过度增殖和多发转移的情况;三是放化疗会对病人造成的二次伤害严重,加重病人痛苦。
所以,降低全身毒性,提高药物的局部利用率一直是肿瘤化疗治疗的核心需求,药物载带系统的研究与应用也是为了这一目标;目前,常见的应用于临床的载药体系有脂质体,纳米小球,静电纺丝纤维膜,然而无论是哪种方式,都存在着载药量限制,药物浸润深度不足,二次伤害严重等问题。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种病灶原位药物控制释放系统及其制备方法,该病灶原位药物控制释放系统能够大幅度提高载药体系的载药量以及药物浸润深度,解决目前载药体系载药量限制与对病灶细胞浸润深度不足的问题。
为达到此发明目的,本发明采用以下技术方案:
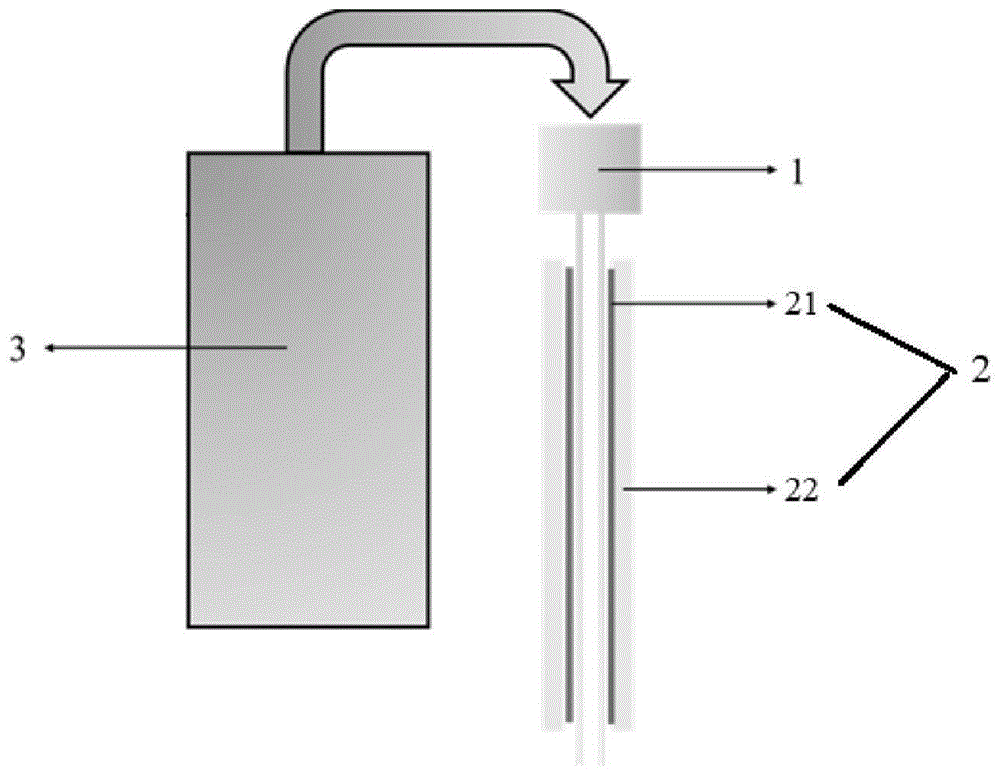
一方面,本发明提供一种病灶原位药物控制释放系统,所述病灶原位药物控制释放系统包括药物注射针头、涂覆于所述药物注射针头外表面的聚合物涂层以及与所述药物注射针头连接的药物推进器。
本发明所涉及的病灶原位药物控制释放系统包括上述三个部分,其示意图如图1所示,其中1为药物注射针头、2为涂覆于所述药物注射针头外表面的聚合物涂层、3为与所述药物注射针头连接的药物推进器,药物推进器中装载药物,用于将药物输送至药物注射针头,并且在针头取出的过程中,利用药物推进器向涂层中空的内径装载药物。且上述三个部分可以进行拆卸分离。
本发明所述病灶包括肿瘤病灶、炎症病灶或细菌感染病灶等,在此不作具体限定。因此,利用该系统装载的药物可以为抗肿瘤药物、抗炎药物或抗菌类药物中的任意一种或至少两种的组合,但不仅限于上述列举的药物类型,药学领域可接受的所有药物类型均可以实现在本发明所述药物控制释放系统中的负载。所述药物包括环丙沙星、盐酸环丙沙星、莫西沙星、左氧氟沙星、头孢拉定、替硝唑、5-氟尿嘧啶、阿霉素、顺铂、紫杉醇、吉西他滨或卡培他滨中的任意一种或至少两种的组合。且涂层中空装载的药物质量是涂层质量的5-60%。
优选地,所述聚合物涂层包括内层聚合物涂层和/或外层聚合物涂层。
本发明所涉及的聚合物涂层包含三种情况:其一是只含有内层聚合物涂层;其二是只含有外层聚合物涂层,其三是同时含有内层聚合物涂层和外层聚合物涂层,所述外层聚合物涂层涂覆于内层聚合物涂层外侧表面。
优选地,所述内层聚合物涂层或外层聚合物涂层沿药物注射针头平行方向的长度独立地为2-3cm,例如2cm、2.2cm、2.4cm、2.5cm、2.8cm或3cm等。
所述长度选择为2-3cm是因为在实际临床治疗中,无论是可切除肿瘤或是不可切除肿瘤,其肿瘤大小相对于人体的比例不会过大,肿瘤内部深度通常1-3cm左右,因此本发明选用2-3cm。
优选地,所述内层聚合物或外层聚合物分别独立地包括合成生物可降解聚合物或天然生物可降解聚合物。
优选地,所述合成生物可降解聚合物包括聚乙二醇、聚乙二醇-聚乳酸共聚物、聚对二氧环己酮、聚羟基乙酸、聚乳酸-羟基乙酸、聚三亚甲基碳酸酯或聚乳酸中的任意一种或至少两种的组合;进一步优选聚乙二醇和聚乳酸-羟基乙酸。首先,聚乳酸-羟基乙酸和聚乙二醇均是通过国际fda认证的材料,是体内可降解高分子聚合物,有优越的生物相容性,该种材料的植入体基本不会或极少发生炎性反应;其次,其降解产物均为小分子有机酸,无毒无害,且降解周期合适,对人体内环境稳态的改变极小,不会引起并发症。
所述至少两种的组合例如聚乙二醇和聚乙二醇-聚乳酸共聚物的组合、聚对二氧环己酮和聚羟基乙酸的组合、聚乳酸-羟基乙酸和聚三亚甲基碳酸酯的组合等,其他任意的组合方式不在此一一赘述。
优选地,所述天然生物可降解聚合物包括多糖、蛋白质、聚酯、木质素或虫胶中的任意一种或至少两种的组合,所述至少两种的组合例如多糖和蛋白质的组合、聚酯和木质素的组合、木质素和虫胶的组合等,其他任意的组合方式不在此一一赘述。
在本发明中,所述聚乙二醇的数均分子量为1000-20000da,例如1000da、2000da、4000da、5000da、8000da、10000da、15000da或20000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚乙二醇-聚乳酸共聚物的数均分子量为1000-20000da,例如1000da、2000da、4000da、5000da、8000da、10000da、15000da或20000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚对二氧环己酮的数均分子量为60000-250000da,例如60000da、80000da、100000da、120000da、150000da、180000da、200000da或250000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚羟基乙酸的数均分子量为20000-145000da,例如20000da、40000da、50000da、70000da、80000da、100000da、120000da或145000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚乳酸-羟基乙酸的数均分子量为40000-100000da,例如40000da、50000da、60000da、70000da、80000da、90000da或100000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚三亚甲基碳酸酯的数均分子量为10000-30000da,例如10000da、15000da、20000da、25000da或30000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
优选地,所述聚乳酸的数均分子量为8000-70000da,例如8000da、10000da、20000da、30000da、50000da、60000da或70000da等。范围内的其他具体点值均可以选择,在此不一一赘述。
上述聚合物的分子量也是影响产品性能的关键因素之一,若超过上述限定范围,分子量增加,会增加植入物的强度,产生一定程度的异物感,可能引起炎性反应;其次,分子量增加,降解周期过长,易引发聚合物残留和游走;另外,分子量增加,分子链缠结紧密,容易产生内部自加速降解,导致降解产物突释,引起炎性反应。若小于上述限定范围,聚合物强度不足;且溶胀速度相对变快,无法控制药物的持续释放。
优选地,所述多糖包括淀粉和/或纤维素。
优选地,所述蛋白质包括明胶、酪蛋白、丝蛋白或羊毛中的任意一种或至少两种的组合,所述至少两种的组合例如明胶和酪蛋白的组合、酪蛋白和丝蛋白的组合、丝蛋白和羊毛的组合等。其他任意的组合方式均不在此一一赘述。
优选地,所述聚酯包括聚羟基烷酸酯。
在本发明中,所述药物注射针头包括注射针头、静电纺丝针头或pvc塑料管。
优选地,所述注射针头的规格为21g-34g,例如21g、22g、23g、25g、27g、30g、32g或34g等。
优选地,所述静电纺丝针头的规格为24g-30g,例如24g、25g、26g、27g、28g或30g等。
优选地,所述药物推进器包括注射器、蠕动泵、旋转泵、容积泵或电液致动泵。
另一方面,本发明提供一种如上所述的病灶原位药物控制释放系统的制备方法,所述制备方法包括:将聚合物溶液涂覆于药物注射针头外表面,然后干燥,得到带有聚合物涂层的药物注射针头,将药物注射针头与药物推进器连接,得到所述病灶原位药物控制释放系统。
优选地,所述制备方法包括如下步骤:
(1)将内层聚合物与第一溶剂混合,得到内层聚合物溶液;将外层聚合物与第二溶剂混合,得到外层聚合物溶液;
(2)用药物注射针头对内层聚合物溶液进行蘸胶,然后干燥,得到带有内层聚合物涂层的药物注射针头;
(3)将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面,然后将药物注射针头与药物推进器连接,得到所述病灶原位药物控制释放系统。
优选地,步骤(1)所述第一溶剂包括去离子水、甲醇、乙醇、丙醇、丙酮或六氟异丙醇中的任意一种或至少两种的组合;所述至少两种的组合例如离子水和甲醇的组合、甲醇和乙醇的组合、丙醇和丙酮的组合等,其他任意的组合方式均不在此一一赘述。
优选地,步骤(1)所述第二溶剂包括n,n-二甲基甲酰胺、丙酮或六氟异丙醇中的任意一种或至少两种的组合;所述至少两种的组合例如n,n-二甲基甲酰胺和丙酮的组合、丙酮和六氟异丙醇的组合等,其他任意的组合方式均不在此一一赘述。
优选地,步骤(1)所述内层聚合物溶液的浓度为40-100%,例如40%、50%、60%、70%、80%、90%或100%等;所述外层聚合物溶液的浓度为50-90%,例如50%、60%、70%、80%或90%等。
优选地,步骤(1)所述混合的温度为30-50℃,例如30℃、35℃、40℃、45℃或50℃等。
优选地,步骤(2)所述蘸胶的温度为0-40℃,例如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃等。
优选地,步骤(2)所述干燥采用自然挥发干燥、真空干燥或冷冻干燥,干燥温度为15-30℃,例如15℃、20℃、25℃或30℃等,干燥时间为1-48h,例如1h、5h、10h、15h、20h、30h或48h等。
优选地,步骤(3)所述将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面的方式为:将带有内层聚合物涂层的药物注射针头对外层聚合物溶液进行蘸胶,干燥。
优选地,步骤(3)所述将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面的方式为:先在聚乙二醇凹膜中灌注外层聚合物溶液,再将带有内层聚合物涂层的药物注射针头竖直插入外层聚合物溶液中,干燥后洗脱聚乙二醇凹膜。
优选地,所述聚乙二醇凹膜的制备温度为0-40℃,例如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃等。
优选地,所述灌注外层聚合物溶液的温度为0-40℃,例如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃等。
优选地,步骤(3)所述将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面的方式为:将外层聚合物溶液填充于大直径药物注射器针头中,再将小直径药物注射器针头插入大直径药物注射器针头中,干燥并取出。
优选地,步骤(3)所述将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面的方式为:先将外层聚合物溶液进行静电纺丝制备静电纺丝纤维膜,将其缠绕于带有内层聚合物涂层的药物注射针头的外表面,然后加热。
优选地,所述静电纺丝纤维膜的厚度为10-80μm,例如10μm、20μm、30μm、40μm、50μm、60μm、70μm或80μm等。
优选地,所述静电纺丝纤维膜的缠绕层数为3-10层,例如3层、4层、5层、6层、7层、8层、9层或10层。
优选地,所述加热的温度为45-70℃,例如45℃、50℃、55℃、60℃、65℃、70℃等,加热时间为0.5-3h,例如0.5h、1h、1.5h、2h、2.5h、3h等。
由上可知,步骤(3)所述将外层聚合物溶液涂覆于步骤(2)所述带有内层聚合物涂层的药物注射针头的外表面的方式有四种。
作为本发明第一种制备方法的优选技术方案,所述制备方法包括如下步骤(其制备过程示意图如图2所示):
(1)将外层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为40-100%,将内层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为50-90%;
(2)采用药物注射针头对内层聚合物溶液在25-30℃条件下进行蘸胶,然后在20-25℃下真空干燥1-5h;
(3)将带有内层聚合物涂层的药物注射针头对外层聚合物溶液在20-25℃的条件下进行蘸胶,然后在20-25℃下真空干燥10-15h,待用。
作为本发明第二种制备方法的优选技术方案,所述制备方法包括如下步骤(其制备过程示意图如图3所示):
(1)将外层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为40-100%,将内层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为50-90%;
(2)采用药物注射针头对内层聚合物溶液在25-30℃条件下进行蘸胶,然后在20-25℃下真空干燥1-5h;
(3)先在聚乙二醇凹膜中20-35℃下灌注外层聚合物溶液,再将带有内层聚合物涂层的药物注射针头竖直插入外层聚合物溶液中,在20-25℃下真空干燥9-12h后用乙醇(95%)洗脱聚乙二醇凹膜。
作为本发明第三种制备方法的优选技术方案,所述制备方法包括如下步骤(其制备过程示意图如图4所示):
(1)将外层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为40-100%,将内层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为50-90%;
(2)采用药物注射针头对内层聚合物溶液在25-30℃条件下进行蘸胶,然后在20-25℃下真空干燥1-5h;
(3)将外层聚合物溶液填充于20g药物注射器针头中,再将30g药物注射器针头以同心方式插入20g药物注射器针头的中空内径中,保持同心性,在20-25℃下干燥9-12h,并取出。
作为本发明第四种制备方法的优选技术方案,所述制备方法包括如下步骤(其制备过程示意图如图5所示):
(1)将外层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为40-100%,将内层聚合物与溶剂在30-35℃条件下加热搅拌溶解,溶液浓度为50-90%;
(2)采用药物注射针头对内层聚合物溶液在25-30℃条件下进行蘸胶,然后在20-25℃下真空干燥1-5h;
(3)先将外层聚合物溶液进行静电纺丝制备静电纺丝纤维膜,厚度为10-80μm,将其缠绕3-10层于带有内层聚合物涂层的药物注射针头的外表面,然后在50-55℃下加热0.5-1h,使其收缩致密。
本发明所述的病灶原位药物控制释放系统装载药物的具体方法如下(其流程示意图如图6所示):
(1)所述病灶原位药物控制释放系统插入病灶内部致密组织,药物注射针头连接药物推进器,向药物注射针头中预先注射一定量的药物,检测药物注射针头是否流通;
(2)将聚合物涂层向下拔出,将药物注射针头反方向取出,并且在针头取出的过程中,利用药物推进器向聚合物涂层中空的内径装载药物;
(3)完全取出药物注射针头,得到装载药物的植入针,从植入针内部释放治疗药物。
相对于现有技术,本发明具有以下有益效果:
(1)本发明所述药物控释系统所使用的外层涂层或内层涂层均属于生物可降解聚合物材料,经过fda认证,安全可靠,无需二次取出,体内可降解;
(2)本发明所述药物控释系统具有中空的针状结构,中空空腔可以极大提高药物装载量,解决了目前应用的载药体系载药量不足的问题;同时该药物控释系统(植入针)长度为2-3cm,可以插入病灶内部致密组织,从内部释放治疗药物,极大提高了植入针系统的药物浸润深度,极大地提高了治愈率和降低了复发性,对科学研究和医学指导都有非常优越的指导意义。
附图说明
图1是本发明所述病灶原位药物控制释放系统的结构示意图(其中,1为药物注射针头、2为涂覆于所述药物注射针头外表面的聚合物涂层(21为内层聚合物涂层,22为外层聚合物涂层)、3为与所述药物注射针头连接的药物推进器);
图2是本发明所述病灶原位药物控制释放系统的第一种制备方法的流程示意图;
图3是本发明所述病灶原位药物控制释放系统的第二种制备方法的流程示意图;
图4是本发明所述病灶原位药物控制释放系统的第三种制备方法的流程示意图;
图5是本发明所述病灶原位药物控制释放系统的第四种制备方法的流程示意图;
图6是本发明所述病灶原位药物控制释放系统装载药物的流程示意图;
图7是实施例1病灶原位药物控制释放系统的释药曲线图;
图8是实施例2病灶原位药物控制释放系统的释药曲线图;
图9是实施例3病灶原位药物控制释放系统的释药曲线图;
图10是实施例4病灶原位药物控制释放系统的释药曲线图;
图11是实施例5病灶原位药物控制释放系统的释药曲线图;
图12是实施例6病灶原位药物控制释放系统的释药曲线图;
图13是实施例7病灶原位药物控制释放系统的释药曲线图;
图14是实施例8病灶原位药物控制释放系统的释药曲线图;
图15是实施例9病灶原位药物控制释放系统的释药曲线图;
图16是实施例10病灶原位药物控制释放系统的释药曲线图;
图17是实施例11病灶原位药物控制释放系统的释药曲线图;
图18是实施例12病灶原位药物控制释放系统的释药曲线图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将聚乳酸-羟基乙酸共聚物与n,n-二甲基甲酰胺,在35℃条件下加热搅拌溶解,溶液浓度为80%;将聚乙二醇与乙醇,在35℃条件下加热搅拌溶解,溶液浓度为85%;
(2)采用26g静电纺丝针头对聚乙二醇溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥2h;
(3)将带有内层涂层的26g纺丝针头对聚乳酸-羟基乙酸共聚物溶液在20℃的条件下进行蘸胶,然后在25℃下真空干燥12h,所述内层涂层质量为外层涂层质量的20%,待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物紫杉醇,紫杉醇质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜pbs溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜pbs溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图7所示,由图7可知:紫杉醇的释放周期持续时间基本为2周,通过调控聚乳酸-羟基乙酸共聚物和聚乙二醇的比例,可以使得释放曲线基本满足线性释放结果,对临床的定期定量给药有指导意义,对药物释放行为的调控更加容易。
实施例2
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法与实施例1一致。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物5-氟尿嘧啶,5-氟尿嘧啶质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜tris-hcl溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜tris-hcl溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图8所示,由图8可知:5-氟尿嘧啶的释放周期基本维持在2周左右,释放前期0-50h,药物释放速率较快增长,达到30%释放量,50小时之后,剩余70%药物释放速率逐渐变缓,缓慢释放,趋于线性,直到释放完全。
实施例3
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法与实施例1一致。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物卡培他滨,卡培他滨质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜pbs溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜pbs溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图9所示,由图9可知:卡培他滨的释放周期接近900h,为一个月左右,在0-40小时内释放较快,存在部分突释,而后释放变缓,在200h时,由于溶胀和部分降解,释放速率加快,药物释放量逐步上升,最终释放完全。
实施例4
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法与实施例1一致。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物环丙沙星,环丙沙星质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜pbs溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜pbs溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图10所示,由图10可知:环丙沙星的释放周期接近600h,25天,前期和后期释放趋于平缓,150h开始,释放速率增加,进入平稳快速释放期,在450h逐渐减缓,直至药物完全释放。
实施例5
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法与实施例1一致。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物头孢拉定,头孢拉定质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜pbs溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜pbs溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图11所示,由图11可知:头孢拉定的释放周期在500h左右,其释放在200小时之后开始快速释放,在300h开始逐渐减缓,最后的400-500h基本变为平台。
实施例6
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的内层聚乙二醇(分子量6000da)涂层、覆于内层涂层外表面的外层聚乳酸-羟基乙酸共聚物(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法与实施例1一致。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法如下:
(1)在产品的中空部分载入药物左氧氟沙星,左氧氟沙星质量为内层涂层和外层涂层总质量的50%,上下用聚乳酸-羟基乙酸共聚物封端,后将其放入装有10ml新鲜pbs溶液的离心管中;
(2)然后将离心管放入空气浴恒温摇床中,温度设为37℃,摇床的速度为100rpm,在指定的时间间隔,分别取出1ml释放溶液,并补充等量的新鲜pbs溶液;
(3)对取出的1ml释放溶液,用紫外可见分光光度计进行测定,并根据标准曲线测定释放的药量;结果平行测定5次,测得的药物释放量表示为平均值±标准偏差。
结果如图12所示,由图12可知:左氧氟沙星整体的释放时间较短约75h,释放行为表现为先快后慢,在前0-20h维持较快释放,20h时出现拐点,释放速率进一步增加,在40h左右,慢慢趋于低速平稳释放,至药物完全释放。
实施例7
本实施例提供一种病灶原位药物控制释放系统,包括25g注射针头、覆于针头外表面的内层聚对二氧环己酮(分子量80000da)涂层、覆于内层涂层外表面的外层聚乳酸(分子量60000da)涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将聚乳酸与n,n-二甲基甲酰胺,在35℃条件下加热搅拌溶解,溶液浓度为80%;将聚对二氧环己酮与六氟异丙醇,在35℃条件下加热搅拌溶解,溶液浓度为85%;
(2)采用25g注射针头对聚对二氧环己酮溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥2h;
(3)在聚乙二醇凹膜中25℃下灌注聚乳酸溶液,再将带有内层聚合物涂层的药物注射针头竖直插入聚乳酸溶液中,在25℃下真空干燥12h后用乙醇(95%)洗脱聚乙二醇凹膜,所述内层涂层质量为外层涂层质量的20%,待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图13所示,由图13可知:药物释放周期接近900h,前72h内,由于材料溶胀较为困难,释放基本不发生,100h开始,释放速率增加,100-400h之内,药物释放量达70%,在400h后,出现平稳的拐点,之后基本保持线性增长,最后趋于平缓。
实施例8
本实施例提供一种病灶原位药物控制释放系统,包括30g药物注射器针头、覆于针头外表面的内层聚三亚甲基碳酸酯(分子量为30000da)涂层、覆于内层涂层外表面的外层聚羟基乙酸(分子量70000da)涂层以及与针头连接的蠕动泵。
其制备方法为:
(1)将聚羟基乙酸与n,n-二甲基甲酰胺,在35℃条件下加热搅拌溶解,溶液浓度为80%;将聚三亚甲基碳酸酯与去离子水,在35℃条件下加热搅拌溶解,溶液浓度为60%;
(2)采用30g药物注射器针头对聚三亚甲基碳酸酯溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥2h;
(3)将聚羟基乙酸溶液填充于20g药物注射器针头中,再将30g药物注射器针头以同心方式插入20g药物注射器针头的中空内径中,保持同心性,在25℃下干燥12h,并取出。所述内层涂层质量为外层涂层质量的50%,待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图14所示,由图14可知:药物的释放周期在240h左右,开始的0-50h释放较快,这是由于内层的聚三亚甲基碳酸酯为亲水材料,溶胀较快,导致药物快速释放,50h以后,释放速率有所减缓,但是仍然保持较快的释放速率,100h之后药物释放量达85%以上,之后开始出现药物平台释放现象。
实施例9
本实施例提供一种病灶原位药物控制释放系统,包括28g静电纺丝针头、覆于针头外表面的内层明胶涂层、覆于内层涂层外表面的外层聚对二氧环己酮(分子量100000da)涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将聚对二氧环己酮与六氟异丙醇,在35℃条件下加热搅拌溶解,溶液浓度为60%;将明胶与去离子水,在60℃条件下加热搅拌溶解,溶液浓度为50%;
(2)采用28g静电纺丝针头对明胶溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥2h;
(3)先将聚对二氧环己酮溶液进行静电纺丝制备静电纺丝纤维膜,厚度为40μm,将其缠绕5层于带有内层聚合物涂层的药物注射针头的外表面,然后在70℃下加热0.5h,使其收缩致密。所述内层涂层质量为外层涂层质量的20%,待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图15所示,由图15可知:由于聚对二氧环己酮的含量占主要成分,溶胀和降解速率较慢,导致药物释放周期较长,前期0-100h药物释放缓慢,基本可以看作无释放,250h聚对二氧环己酮和明胶充分溶胀,明胶生物相容性较好,药物释放开始出现线性释放的结果,释放到1000h时药物释放量达90%,之后进入了平稳释放阶段。
实施例10
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的聚乳酸-羟基乙酸共聚物涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将聚乳酸-羟基乙酸共聚物与n,n-二甲基甲酰胺,在35℃条件下加热搅拌溶解,溶液浓度为80%;
(2)采用26g静电纺丝针头对上述溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥12h;待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图16所示,由图16可知:药物释放周期为500小时,前100h药物释放速率较慢,药物释放量缓慢上升,100h时出现药物突释,这是由于聚合物部分降解,导致扩散到聚合物壁上的药物一部分完全释放出来,150h之后药物释放又趋于平稳,300h时由于降解,药物释放通道打开,药物释放呈现线性释放,药物释放量趋于直线上升,直到释放完全。
实施例11
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的聚对二氧环己酮涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将聚对二氧环己酮与六氟异丙醇,在35℃条件下加热搅拌溶解,溶液浓度为60%;
(2)采用26g静电纺丝针头对上述溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥12h;待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图17所示,由图17可知:由于聚对二氧环己酮的溶胀和降解速率较慢,导致药物释放周期较长约为1000h左右,前期0-200h药物释放的曲线前期非常缓慢为平台期,250h聚对二氧环己酮药物释放行为开始出现近似线性释放的结果,释放到1000h时药物释放量达90%,之后进入了平稳释放阶段,直至药物完全释放
实施例12
本实施例提供一种病灶原位药物控制释放系统,包括26g静电纺丝针头、覆于针头外表面的明胶涂层以及与针头连接的医用注射器。
其制备方法为:
(1)将明胶与去离子水,在60℃条件下加热搅拌溶解,溶液浓度为50%;
(2)采用26g静电纺丝针头对上述溶液在25℃条件下进行蘸胶,然后在25℃下真空干燥12h;待用。
对得到的产品进行药物释放实验,并且绘制释放曲线,方法与实施例1保持一致。
结果如图18所示,由图18可知:明胶为动物源高分子材料,其溶胀速率较快,故前期药物释放速率较快,在前50h释放量接近60%,之后释放有所减缓,但仍维持较快释放速率,释放药物至85%,之后剩余药物随着明胶的降解而释放出来。
申请人声明,本发明通过上述实施例来说明本发明的一种病灶原位药物控制释放系统及其制备方法,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
- 还没有人留言评论。精彩留言会获得点赞!