包含抗IL-17抗体的液体制剂的制作方法
包含抗il-17抗体的液体制剂
技术领域
1.本发明涉及生物药物制剂领域,具体而言,本发明涉及一种稳定的包含抗il-17抗体的液体药物制剂。
背景技术:
2.已知抗il-17单克隆抗体药物可用于治疗自身免疫性疾病和炎性病症等,例如,银屑病、银屑病关节炎、强直性脊柱炎、类风湿性关节炎、多发性硬化、系统性红斑狼疮、骨关节炎或炎症性肠病等,患者可以通过皮下注射抗il-17单克隆抗体药物,得到有效治疗。
3.目前市场已有的抗il-17单克隆抗体药物有诺华(novartis)的抗炎药cosentyx和礼来(eli lilly)的抗炎药taltz,二者均为抗il-17a亚型的单克隆抗体,处方组成包括组氨酸盐或枸橼酸盐缓冲体系、非离子型表面活性剂聚山梨酯80以及糖醇类稳定剂。对这两种药物的处方进行分析,可知:
4.(1)cosentyx:目前有两种剂型的产品,注射笔或预灌装针和冻干制剂。注射笔或预灌装针处方中含甲硫氨酸,主要起抗氧化的作用,推测抗体分子中有氧化热点,这是导致不稳定的风险点。冻干制剂存在生产成本高、生产工艺复杂、使用步骤繁琐等缺陷,使用便利性上不如液体制剂。
5.(2)taltz:处方中含有高浓度nacl(11.69mg/ml),高于等渗的生理盐水(9mg/ml nacl)。此外,处方中的枸橼酸缓冲体系为0.51mg/ml无水枸橼酸和5.11mg/ml二水枸橼酸钠(相当于20mm枸橼酸盐缓冲液),理论计算该药物制剂的渗透压应接近或大于400mosmol/kg。高渗溶液在注射时会带来红细胞的暂时萎缩,引起血细胞和组织细胞脱水,因此临床上通常要求注射剂尽量为等渗溶液,因此taltz的高渗透压在其应用中有较大风险与不利之处。再者,taltz需每次给药两支,患者给药不方便,顺应性不强。
6.因此,本领域仍然存在对抗il-17抗体、特别是抗il-17a/f抗体的新型液体制剂的需要。
技术实现要素:
7.本发明的目的在于提供一种包含抗il-17抗体的液体制剂,该液体制剂可以使该抗体在较高浓度下稳定存在,并且具有尽可能低的粘度和接近等渗的渗透压。
8.本发明的技术方案如下。
9.一方面,本发明提供一种液体制剂,其包含浓度为20mg/ml-200mg/ml的抗il-17抗体,浓度为10mm-50mm的枸橼酸盐缓冲剂,浓度为20mg/ml-120mg/ml的蔗糖或50mm-250mm的精氨酸,浓度为0.1mg/ml-5mg/ml的聚山梨酯80,且所述液体制剂具有ph 6.0
±
0.5。
10.il-17家族的成员包括il-17a、il-17f,以及il-17b、il-17c、il-17d和il-17e。在本发明提供的液体制剂中,所述抗il-17抗体为抗il-17a/f的抗体。在序列组成上,本发明的抗il-17抗体包含重链可变区(vh)并且在所述重链可变区中包含由seq id no:1所示的cdr1(cdr1h)、由seq id no:2所示的cdr2(cdr2h)、由seq id no:3所示的cdr3(cdr3h);和,
所述抗il-17抗体包含轻链可变区(vl)并且在所述轻链可变区中包含由seq id no:4所示的cdr1(cdr1l)、由seq id no:5所示的cdr2(cdr2 l)、由seq id no:6所示的cdr3(cdr3l);
11.优选地,所述抗il-17抗体包含由seq id no:7所示的重链可变区和由seq id no:8所示的轻链可变区。
12.根据本发明的具体实施方式,所述抗il-17抗体包含由seq id no:9所示的重链(hc)和由seq id no:10所示的轻链(lc)。
13.根据本发明的具体实施方式,所述抗il-17抗体为抗il-17a/f的单克隆抗体,包括两条由seq id no:9所示的重链(hc)和两条由seq id no:10所示的轻链(lc)。
14.seq id no:1(cdr1h):
15.gytftdynln
16.seq id no:2(cdr2h):
17.vihpdygttsynqkfkd
18.seq id no:3(cdr3h):
19.yd ygdamdy
20.seq id no:4(cdr1l):
21.rssqslvhsngntylh
22.seq id no:5(cdr2l):
23.kvsnrfs
24.seq id no:6(cdr3l):
25.sqsthvp lt
26.seq id no:7(vh):
27.qfqlvqsgae vkkpgasvkv sckasgytft dynlnwvrqa pgkglewmgv ihpdygttsy nqkfkdrvtm tvdtststvy melsslrsed tavyycvryd ygdamdywgq gtlvtvss
28.seq id no:8(vl):
29.divmtqspls lsvtpgqpas iscrssqslv hsngntylhw ylqkpgqppq lliykvsnrf sgvpdrfsgs gsgtdftlki srveaedvgv yycsqsthvpltfgqgtkle ik
30.seq id no:9(hc):
31.qfqlvqsgae vkkpgasvkv sckasgytftdynlnwvrqa pgkglewmgv ihpdygttsy nqkfkdrvtm tvdtststvy melsslrsed tavyycvryd ygdamdywgq gtlvtvssas tkgpsvfpla psskstsggt aalgclvkdy fpepvtvswn sgaltsgvht fpavlqssgl yslssvvtvp ssslgtqtyi cnvnhkpsnt kvdkkvepks cdkthtcppc papellggps vflfppkpkd tlmisrtpev tcvvvdvshe dpevkfnwyv dgvevhnakt kpreeqynst yrvvsvltvl hqdwlngkey kckvsnkalp apiektiska kgqprepqvy tlppsrdelt knqvsltclv kgfypsdiav ewesngqpen nykttppvld sdgsfflysk ltvdksrwqq gnvfscsvmh ealhnhytqk slslspgk
32.seq id no:10(lc):
33.divmtqspls lsvtpgqpas iscrssqslvhsngntylhw ylqkpgqppq lliykvsnrf sgvpdrfsgs gsgtdftlki srveaedvgv yycsqsthvp ltfgqgtkle ikrtvaapsv fifppsdeql ksgtasvvcl lnnfypreak vqwkvdnalq sgnsqesvte qdskdstysl sstltlskad yekhkvyace vthqglsspv tksfnrgec
34.优选地,所述抗il-17抗体的浓度为80mg/ml-130mg/ml,优选90mg/ml-110mg/ml,更优选为100mg/ml。
35.优选地,所述枸橼酸盐缓冲剂的浓度为15mm-30mm,优选15mm-25mm,更优选为20mm。其中,所述枸橼酸盐缓冲剂由枸橼酸和枸橼酸钠二水合物制备,优选为由0.66mg/ml的枸橼酸和4.95mg/ml的枸橼酸钠二水合物组成。
36.优选地,所述蔗糖的浓度为60mg/ml-100mg/ml,优选70mg/ml-90mg/ml,更优选为80mg/ml;或者,所述精氨酸的浓度为80mm-200mm,优选100mm-170mm,更优选为150mm。
37.优选地,所述聚山梨酯80的浓度为0.1mg/ml-2.0mg/ml,更优选为0.5mg/ml。
38.优选地,所述液体制剂具有ph 6.0
±
0.3,优选ph 6.0。
39.优选地,本发明提供的所述液体制剂不包含抗氧剂,例如甲硫氨酸;并且在包含蔗糖的液体制剂中不包含降粘剂;特别是,本发明提供的所述液体制剂不包含氯化钠。
40.根据本发明的具体实施方式,本发明提供的所述液体制剂包含浓度为100mg/ml的所述抗il-17抗体,浓度为20mm的所述枸橼酸盐缓冲剂,浓度为80mg/ml的蔗糖,浓度为0.5mg/ml的聚山梨酯80,且所述液体制剂具有ph 6.0。或者,本发明提供的所述液体制剂包含浓度为100mg/ml的所述抗il-17抗体,浓度为20mm的所述枸橼酸盐缓冲剂,浓度为150mm的精氨酸,浓度为0.5mg/ml的聚山梨酯80,且所述液体制剂具有ph 6.0。
41.并且,根据本发明的具体实施方式,本发明提供的所述液体制剂经调节ph由所述成分组成。
42.本发明提供的所述液体制剂可以为所述抗il-17抗体的药物制剂;所述液体制剂可以为溶液、乳液或悬浮液的形式,优选为溶液。
43.优选地,所述液体制剂或液体的药物制剂可以是经肠胃外施用的剂型,例如可以包括静脉内、肌内、皮下和腹膜内施用的剂型。优选地,本发明的所述液体制剂为注射制剂,具体为皮下注射制剂。
44.在本申请的上下文中,抗体制剂与抗体的液体制剂可互换使用。
45.另一方面,本发明提供所述液体制剂在制备用于治疗il-17a和/或il-17f相关疾病的药物中的用途;
46.优选地,所述疾病选自银屑病、银屑病关节炎、强直性脊柱炎、类风湿性关节炎、多发性硬化、系统性红斑狼疮、骨关节炎或炎症性肠病。
47.再一方面,本发明提供一种治疗il-17a和/或il-17f相关疾病的方法,所述方法包括给有此需要的受试者施用有效量的本发明提供的所述液体制剂;
48.优选地,所述疾病选自银屑病、银屑病关节炎、强直性脊柱炎、类风湿性关节炎、多发性硬化、系统性红斑狼疮、骨关节炎或炎症性肠病。
49.又一方面,本发明提供一种容器或包含其的药盒,所述容器包含本发明提供的所述液体制剂。
50.本发明针对人il-17a和/或il-17f成功开发出了一种新型的抗体药物液体制剂。本发明提供的液体制剂含有较高浓度的抗il-17a亚型和/或抗il-17f亚型抗体,具体为抗il-17a/f的单克隆抗体,在用于皮下注射时,可提供高剂量的抗体,单次给药一支即可,满足给药需求,提高药物疗效。
51.特别是,本发明提供的液体制剂可不包含抗氧剂或降粘剂,仍然可以使抗体在较
高浓度下稳定存在,并且制剂本身具有小于10cp的低粘度和接近等渗的渗透压,能避免高渗溶液的注射问题,患者顺应性强。
附图说明
52.以下,结合附图来详细说明本发明的实施方案,其中:
53.图1显示了实施例1中对抗体制剂的ph进行筛选时外观和可见异物的检测结果。
54.图2显示了实施例3中对抗体制剂的处方进行筛选的检测结果,其中图2a:sec-hplc,聚体%;图2b:wcx-hplc,主峰%;图2c:ce-非还原,纯度%。
55.图3显示了实施例4中在不同nacl浓度下抗体制剂的理论渗透压和粘度。
56.图4显示了实施例4中对有无nacl时处方稳定性的检测结果,其中图4a:sec-hplc,单体%;图4b:wcx-hplc,主峰%。
57.图5显示了实施例5中对抗体制剂的血清相容性的检测结果。
具体实施方式
58.以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
59.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药物原料、试剂材料等,如无特殊说明,均为市售购买产品,或是按照本领域公知技术可以制得的。
60.下述实施例中采用一种具体的抗il-17a/f的单克隆抗体,其抗体重链为由seq id no:9所示,抗体轻链由seq id no:10所示,抗体序列及其制备可参见pct申请公开文件wo2018161340a1,在本文中简称为“lzm012”。
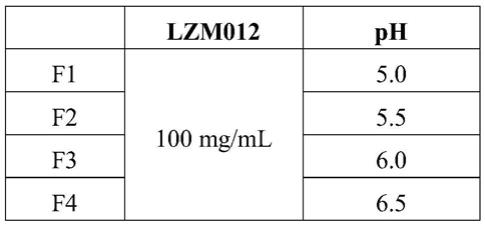
61.包含相关抗体的液体制剂的配制方法为:
62.若原液处方与实验处方成分一致,则取适量lzm012原液,使用ph调节剂(如盐酸或氢氧化钠)调节ph,之后用制剂缓冲液将蛋白浓度直接稀释至100mg/ml;若原液处方与实验处方不同,则取纯化中间品(uf/df后、加入表面活性剂之前的工序),使用超滤离心法置换纯化中间品中的辅料成分,之后加入聚山梨酯80母液,最后用对应的制剂缓冲液将蛋白浓度调至100mg/ml。完成制备的药液使用0.22μm滤器除菌过滤,按照相应的灌装量进行灌装、加塞并轧盖。
63.其中,所涉及的通用方法包括:
64.dsc:样品池用10%decon 90 80℃浸泡30分钟,然后用milliq水冲洗2次,针头冲洗2次。供试品用lzm012缓冲溶液(成分:20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml聚山梨酯80,ph对应筛选条件中的各ph)稀释至0.5mg/ml抗体浓度,然后10,000rpm离心2分钟。扫描样品前,进行多次缓冲扫描至仪器平衡。扫描温度35-95℃,扫描速率90℃/h。
65.sec-hplc:依据《中国药典》2015年版三部通则<0512>测定。采用tosoh公司tsk g3000swxl(5μm,7.8*300mm)色谱柱,以0.1mol/l na2hpo4(ph 6.5)和0.2mol/l nacl为流动相,检测波长280nm,将供试品稀释至约1mg/ml抗体浓度,作为供试品溶液,取供试品溶液20μl注入液相色谱仪,利用面积归一化法计算,单体相对含量:报告数值,聚体相对含量:报告数值,片段含量:报告数值。
66.wcx-hplc:参照《中华人民共和国药典2015年版三部》通则<0513>离子交换色谱法,选用propac wcx-10柱,以含20mm mes,20mm nacl作为流动相a相的溶液以及含20mm mes,200mm nacl作为流动相b相的溶液,流速为1ml/min,柱温为25℃,检测波长280nm,梯度洗脱。按峰面积百分比,计算主峰、酸性峰及碱性峰百分含量。
67.ce-非还原:抗体与表面活性剂十二烷基硫酸钠(sds)结合成复合物,使用n-乙基马来酰亚胺对供试品和标准品的巯基烷基化,以低粘度的线性高分子凝胶溶液为筛分介质,在高电场作用下,片断、完整蛋白及聚体可在ce-sds中依据分子量大小被分离。使用非涂层毛细管(内径50μm,管长30.2~31.0cm,有效长度20~21cm,检测窗口100μm
×
200μm)和citrate-phosphate,1%sds,ph 6.0缓冲液,进样条件5kv 40s,检测波长220nm,通过pda检测器检测片断、完整蛋白及聚体的保留时间和相对强度。
68.可见异物:按照《中国药典》2015版通则<0904>“可见异物检查法”检查。
69.il-17a结合活性:取重组人il-17a蛋白,用pbs(10mm ph 7.4)配制成0.5μg/ml,100μl/孔至酶标板(costar,cat#:9018)内,用保鲜膜封好,5
±
3℃放置过夜;用pbst洗板2次,300μl/孔,加封闭液(含1%脱脂奶粉pbst)至酶标板内,室温震荡孵育1.5小时;使用pbst将供试品、标准品和质控品稀释至500ng/ml,并进行1.9倍梯度稀释,浓度范围是0.43ng/ml-500ng/ml。向封闭好的酶标板内加入预稀释好的分析标准品溶液和供试品溶液各100μl/孔,室温震荡孵育2小时;用洗涤液洗板4次,稀释辣根过氧化物酶标记的羊抗人igg(pbst,1:80000),以100μl/孔加至酶标板内,室温震荡孵育1小时;用洗涤液洗板,以100μl/孔加入底物溶液,室温避光放置30分钟;50μl/加入终止液终止反应。用酶标仪在620nm作为参比波长,在波长450nm处测定吸光度,记录测定结果,并进行比活性计算(公式:100%
×
标准品ec50/供试品ec50)。
70.flowcam:上样前先用milliq水将流通池冲洗3~9遍至无颗粒检出,将供试品用milliq水稀释4倍,室温静置15min,取500ml稀释液进样检测,检测颗粒范围为2μm~2000μm。
71.lc-ms(检测氧化):取样品适量,经变性还原烷基化脱盐处理,之后加入胰蛋白酶酶切,注入uplc样品瓶,待uplc-ms分析。使用waters公司的masslynx 4.1软件处理实验数据,通过提取离子流色谱图(eic)计算氧化比例。
72.粘度检测:使用brookfield dv
-ⅲ
流变仪对样品进行测定,使用标准品调零后,加入0.5~1.0ml样品,选择合适的转速,保证扭矩在10%~100%,读取粘度数值。
73.实施例1ph筛选(lzm012 20170815-liq1)
74.lzm012制剂的ph筛选实验以平台制剂处方(100mg/ml lzm012,25mm组氨酸,80mg/ml海藻糖,0.5mg/ml聚山梨酯80)为基础,设计多个ph梯度(5.0、5.5、6.0、6.5),拟筛选出最适合的ph值。
75.处方设计见表1。
76.表1.lzm012制剂
[0077][0078]
在超净台中,取12ml ph5.5的平台制剂处方,加入0~300μl 0.5m hcl或0.5m naoh溶液将平台制剂处方的ph分别调至5.0、5.5、6.0、6.5,0.22μm针头滤器过滤,以1ml/瓶灌装量将滤后制剂灌装入2ml注射剂瓶内,加塞并轧盖。
[0079]
dsc检测结果见表2,结果显示:在ph 5.0-6.5范围内,随ph升高,tonset和tm1增大;ph5.5~6.5各组间tm2基本无显著性差别,ph 5.0处方的tm2(fab)稍有降低(1~2℃)。因此,ph 5.5-6.5范围内,lzm012分子的热稳定性最优。
[0080]
表2.lzm012制剂的dsc检测结果
[0081]
ftonset(℃)tm1(℃)tm2(℃)f1-ph5.057.5665.9281.25f2-ph5.561.1469.5083.44f3-ph6.063.6371.9983.14f4-ph6.564.1873.9283.68
[0082]
此外,在40℃(40℃
±
2℃)加速条件下,进行表3所示的稳定性检测实验。
[0083]
sec-hplc检测结果显示:ph6.5和ph5.0的聚体较高,聚体较少的较优ph范围为ph5.5~ph6.0。
[0084]
wcx-hplc和nr ce-sds检测结果显示:表面电荷和纯度在ph 5.0-6.5范围内均无显著差异。
[0085]
外观及可见异物检测结果见图1,结果显示:40℃第11天加速条件下,ph 5.0、ph 5.5以及ph 6.5处方均出现不同程度的蛋白质聚集颗粒聚集,其中ph 5.0和ph 6.5处方较为严重,肉眼可见烟雾状聚集,相较而言ph 6.0处方仍为澄清透明,6.0的ph环境更有利于维持蛋白质的天然构象。
[0086]
il-17结合活性检测结果显示:ph 5.0、ph 5.5以及ph 6.5处方样品在制备零时、40℃第11天加速的活性无显著性差异。
[0087]
亚可见颗粒(flowcam)检测结果显示:ph 5.0、ph 5.5以及ph 6.5处方样品在制备零时、40℃第11天加速和40℃第20天加速的亚可见颗粒状态,无显著性差异。
[0088]
具体数据见表3。
[0089]
表3. 40℃加速稳定性结果
[0090][0091]
由此,分别从上述结果综合分析,dsc结果显示ph 5.5-6.5范围内分子的热稳定性最好,ph 5.5-6.0的纯度和外观结果更优,综合评价:中心ph应在5.5~6.0的范围内,且应以尽量接近6.0为佳,所以可确定ph为6.0
±
0.3。
[0092]
实施例2粘度研究(lzm012 20170829-liq3)
[0093]
研究发现,lzm012的蛋白质疏水性和在制剂中的浓度均较高,发现平台处方(100mg/ml lzm012,25mm组氨酸,80mg/ml海藻糖,0.5mg/ml聚山梨酯80,ph 6.0)的粘度为14cp,超过内控标准10cp,考虑加入降粘剂以降低药液粘度。
[0094]
本实施例旨在考察nacl和精氨酸(arginine)两种辅料的降粘能力。处方与粘度检测结果见表4。
[0095]
表4.lzm012 20170829-liq3粘度检测结果
[0096][0097]
取所需量的蛋白原液(130mg/ml lzm012,25mm组氨酸,80mg/ml海藻糖,0.5mg/ml聚山梨酯80),分别加入制剂缓冲液1(25mm组氨酸,80mg/ml海藻糖,39.15mg/ml nacl,0.5mg/ml聚山梨酯80)、制剂缓冲液2(25mm组氨酸,80mg/ml海藻糖,432mm精氨酸,0.5mg/ml聚山梨酯80)和制剂缓冲液3(25mm组氨酸,80mg/ml海藻糖,0.5mg/ml聚山梨酯80)制得表4
所示的f1、f2和f3处方。
[0098]
检测结果表明,9mg/ml nacl和100mm精氨酸均可以使lzm012制剂的粘度降低至10cp以下,且二者的降粘度能力无显著差异。因此,选择nacl或精氨酸作为lzm012制剂的降粘剂。
[0099]
实施例3处方筛选(lzm012 20170925-liq4)
[0100]
参考国内外上市生物制品,聚山梨酯80(ps80)常用的浓度为0.05mg/ml-2mg/ml。在此范围内选择0.5mg/ml ps80加入至lzm012制剂处方中,达到增溶及防止蛋白聚集和吸附的作用。
[0101]
在确定ph 6.0、0.5mg/ml ps80的基础上,继续筛选缓冲体系和稳定剂的种类,主要考察组氨酸(histidine)、枸橼酸盐(citrate)、醋酸盐(hac)3种缓冲体系和海藻糖(trehalose)、蔗糖(sucrose)、精氨酸(arginine)3种稳定剂。由于lzm012的粘度较高,在本实施例中不含精氨酸的处方中均加入9mg/ml nacl降低粘度,具体处方信息见表5。
[0102]
表5.lzm012 20170925-liq4处方信息
[0103][0104]
取适量lzm012纯化中间品,利用超滤离心法按照表5进行缓冲液置换,置换缓冲液后的制剂处方使用对应的制剂缓冲液将蛋白浓度调至100mg/ml。经过0.22μm滤器除菌过滤后灌装入注射剂瓶中,加塞并轧盖。
[0105]
在40℃(40℃
±
2℃)加速条件下,进行以下稳定性检测实验。
[0106]
sec-hplc检测结果见图2a,结果显示:组氨酸和醋酸盐缓冲体系所制处方的聚体
含量显著高于枸橼酸盐处方,枸橼酸盐的缓冲环境更有利于lzm012分子稳定性;在枸橼酸盐的缓冲体系中,三种稳定剂处方之间的聚体含量未见显著差异。
[0107]
wcx-hplc检测结果见图2b,结果显示:组氨酸和醋酸盐缓冲体系所制处方的主峰含量显著低于枸橼酸盐处方;在枸橼酸盐的缓冲体系中,三种稳定剂处方之间的主峰含量未见显著差异。
[0108]
ce-非还原检测结果见图2c,结果显示:组氨酸和醋酸盐缓冲体系所制处方的纯度显著低于枸橼酸盐处方;在枸橼酸盐的缓冲体系中,三种稳定剂处方之间在纯度方面未见显著差异。
[0109]
综上,选择枸橼酸盐的缓冲体系作lzm012的制剂缓冲液。三种稳定剂在维持lzm012蛋白质稳定性方面无明显差异,但在确定了缓冲体系为枸橼酸盐缓冲剂的前提下,糖类可一定程度缓解枸橼酸缓冲液造成的注射痛感,因此,lzm012处方稳定剂优选蔗糖或海藻糖,也可以选择精氨酸。比较两种糖,从经济效益出发,蔗糖成本低于海藻糖,所以可选择蔗糖作为lzm012制剂的稳定剂。
[0110]
实施例4在枸橼酸缓冲体系中的降粘剂研究
[0111]
4.1不同浓度nacl对lzm012制剂粘度的影响
[0112]
通过实施例3的liq4处方筛选,确定优选处方为:100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,9mg/ml nacl,0.5mg/ml ps80,ph 6.0,其渗透压为666mosm/kg。本实施例以此优选处方为基础,考察不同浓度的氯化钠(9、6、3、0mg/ml nacl)对lzm012药液粘度的影响。
[0113]
选取100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml ps80,ph 6.0制剂溶液,加入nacl固体将制剂处方中nacl含量调至9、6、3、0mg/ml。
[0114]
不同浓度的氯化钠处方粘度检测结果见图3,结果显示:随着nacl浓度逐渐降低,药液粘度增加。当氯化钠完全去除时,药液粘度为8.48cp,此时药液的理论渗透压接近等渗。对比实施例2中liq3的实验结果(100mg/ml lzm012,25mm组氨酸,80mg/ml海藻糖,0.5mg/ml聚山梨酯80,ph 6.0,药液粘度为14cp),此现象表明枸橼酸盐缓冲剂自身具有降低粘度的能力,使用枸橼酸盐作为lzm012的缓冲体系时,不用加入降粘剂如nacl等,药液的粘度可符合内控标准(≤10cp)。
[0115]
4.2去除nacl对稳定性的影响(lzm012 20171115-liq5)
[0116]
以liq4处方筛选结果为基础,对比9mg/ml nacl的处方和不含nacl处方的稳定性,考察去除氯化钠是否会影响lzm012分子的稳定性。
[0117]
f1处方为:100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,9mg/ml nacl,0.5mg/ml ps80,ph 6.0;
[0118]
f2处方为:100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml ps80,ph 6.0。
[0119]
取lzm012制剂原液(100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml ps80,ph 6.0),加入适量nacl将nacl浓度调至9mg/ml,此为f1处方;f2处方成分与原液一致。
[0120]
sec-hplc和wcx-hplc检测结果分别见图4a和图4b,结果显示:有无氯化钠对lzm012分子的稳定性无明显影响。
[0121]
4.3降粘剂nacl的研究小结
[0122]
通过对粘度和稳定性的考察,使用枸橼酸盐缓冲体系时,100mg/ml lzm012制剂处方中无需加入nacl等降粘剂。因此,lzm012制剂最终确定的处方为:100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml ps80,ph 6.0;或者,100mg/ml lzm012,20mm枸橼酸盐缓冲剂,150mm精氨酸,0.5mg/ml ps80,ph 6.0。
[0123]
实施例5血清相容性考察(lzm012 20171129-liq7)
[0124]
皮下注射液进入人体后,药液瞬间被血清稀释,此后逐步被人体吸收,药物浓度呈梯度下降。本实施例使用人血清将100mg/ml lzm012制剂稀释至一系列蛋白浓度梯度(20mg/ml、12mg/ml、8mg/ml、4mg/ml、2mg/ml、0mg/ml),模拟100mg/ml lzm012制剂经皮下注射后浓度逐步被吸收的过程。通过可见异物检查监测样品在37℃
±
2℃的变化,考察lzm012蛋白质与人体血清的相容性。
[0125]
样品在37℃
±
2℃加速48小时和加速7天的可见异物检测结果见图5,结果显示:2mg/ml-20mg/ml lzm012范围内,在考察时间内lzm012与人体血清所制备的溶液与血清对照组在外观上无显著差异,透明且无沉淀产生。因此,lzm012分子在确定的处方(100mg/ml lzm012,20mm枸橼酸盐缓冲剂,80mg/ml蔗糖,0.5mg/ml ps80,ph 6.0)中与人血清相容性较好。
[0126]
综上,最终确定lzm012的制剂处方为:100mg/ml重组抗人il-17a/f人源化单克隆抗体lzm012,20mm枸橼酸盐缓冲剂(0.66mg/ml枸橼酸(c6h8o7·
h2o),4.95mg/ml枸橼酸钠(c6h5o7na3·
2h2o)),80mg/ml蔗糖(c
12
h
22
o
11
),0.5mg/ml聚山梨酯80,ph 6.0
±
0.3。
[0127]
实施例6氧气考察(lzm012 20170829-liq2)
[0128]
lzm012制剂为皮下注射液,在生产及储存过程中有较长时间暴露于空气之中,本实施例考察氧气对lzm012制剂中分子稳定性的影响,作为处方设计中是否加入抗氧剂的参考。
[0129]
以lzm012制剂最终处方(100mg/ml lzm012,20mm枸橼酸缓冲液,80mg/ml蔗糖,0.5mg/ml聚山梨酯80,ph 6.0)生产的中试生产样品,使用纯氧通入该lzm012液体制剂中(f1),将此过程持续20分钟以使药液中的氧气含量达到饱和,之后与未处理的对照组(f2)一起置于25℃
±
2℃恒温箱中考察稳定性。
[0130]
稳定性考察结果见表6。
[0131]
表6.lzm012制剂(最终处方)的氧化条件下加速稳定性数据
[0132][0133]
*:m后面的数字代表甲硫氨酸所处的肽段位置,t之前的数字代表轻重链(1为轻链,2为重链),t以及后面的数字代表酶切后的第几条肽段。例如:1t1即为轻链的第一条肽段。
[0134]
结果可知,氧气处理实验组(f1-o2)和对照组(f2-control)间的各项理化检测指标均未见显著差异;且质谱分析结果表明lzm012与氧化较相关的2个met氧化位点均未见明显的差异(2%以上的变化代表有显著差异)。因此,在lzm012的制剂处方中无需添加抗氧剂。
[0135]
实施例7lzm012制剂的活性检测
[0136]
使用最终确定的处方,经过优化后的工艺生产三批中试样品,活性检测数据如表7所示。可见在长期、加速条件下该处方仍有效,具有其生物学作用。
[0137]
表7.lzm012中试批次il-17a结合活性数据
[0138][0139]
注:活性的可接受标准为:与分析标准品相比相对活性应为70%~130%
[0140]
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1