一种治疗肌萎缩性脊髓侧索硬化症的药物及提高血脑屏障开放效果的方法与流程
本发明涉及超声联合微泡技术领域,尤其涉及一种应用超声联合微泡技术的治疗肌萎缩性脊髓侧索硬化症的药物,以及提高血脑屏障开放效果的方法。
背景技术:
肌萎缩性脊髓侧索硬化症(amyotrophiclateralsclerosis,als)也称为卢·贾里格症(lougehrig′sdisease)、渐冻人症、运动神经元病,是一种渐进且致命的神经退行性疾病。肌萎缩侧索硬化症由中枢神经系统内控制骨骼肌的运动神经元退化所致。由于上、下运动神经元退化和死亡,患者肌肉逐渐衰弱、萎缩;最后,大脑完全丧失控制随意运动的能力;最终会造成发音、吞咽,以及呼吸上的障碍。als从发病进展至呼吸麻痹死亡通常年限为3~5年。肌萎缩侧索硬化症是一种罕见疾病,在大多数国家,每年每10万人中有1-2人患病,虽然als的患病率低,但该疾病的快速致死率高。在美国和英国,每500个死去的成年人中有一人是死于als疾病。目前美国fda批准的治疗als的药物只有利鲁唑(riluzole)和依达拉奉(edaravone)。利鲁唑是首个被美国fda批准上市用于治疗als的药物,它的主要作用机制是通过各种途径抑制谷氨酸对神经元的毒性损伤,但它仅仅可延缓als的病情进展。之后20年有超过60种药物因其可能存在的潜在治疗als疗效而进行过临床研究,其中大部分以失败告终。als的治疗亟需有效的药物。时隔22年,依达拉奉于2017年5月成为美国fda批准的第二款als治疗药物。依达拉奉,化学名称为3-甲基-1-苯基-2-吡唑啉-5-酮,是由日本田边三菱制药研发、生产和销售的一种抗氧化药物,用于清除自由基以治疗缺血性脑卒中等心脑血管疾病。动物实验结果表明,依达拉奉给药的小鼠中,sod1过表达的区域减少,腰椎前角运动神经元得到很好的保留,对als具有不错的预防和治疗作用。临床研究显示,通过广泛用于评定肌萎缩侧索硬化症患者的机能状态的临床标准-als患者功能评定量表(alsfrs-r)进行疗效评估,相比安慰剂组,依达拉奉可以延缓患者的身体机能下降达33%。
但是als还是致命的,并不能完全治愈,als治疗药物的探索还是研究热点。利用药物治疗als需要面临的一个问题是中枢神经系统内存在血脑屏障(blood-brainbarrier,bbb)。而这种屏障是大脑的保护性屏障,它能选择血液中的物质进入大脑,能够阻止大多数有毒的物质进入大脑以稳定脑内环境,但它也阻挡了大部分药物进入大脑,成为治疗中枢神经系统疾病的障碍。近年来,低频聚焦超声(focusedultrasound,fus)联合微泡(microbubbles,mb)被证明是一种无创、短暂、可逆、局部地开放血脑屏障的有效方法。针对不同的疾病,某种药物的给药效果与微泡及超声条件密切相关,为了提高依达拉奉入脑的效率及治疗als的效果,有待对依达拉奉与微泡和超声的联合应用条件进行研究。
技术实现要素:
本发明针对现有依达拉奉给药方式的入脑效率及治疗als的效果有待进一步提高的问题,提高一种应用超声联合微泡技术的治疗肌萎缩性脊髓侧索硬化症的药物,以及提高血脑屏障开放效果的方法。
为实现上述目的,本发明采用以下技术方案。
本发明的第一方面,提供一种治疗肌萎缩性脊髓侧索硬化症的药物,由微泡组合物和依达拉奉组成,所述微泡组合物由微泡液和全氟丙烷组成,所述微泡液由发泡体和水合液组成;
所述发泡体由dspc和dspe-peg2000按质量比为(8-10)∶1的组成;
所述水合液由磷酸缓冲盐溶液、甘油和丙二醇按体积比8∶(0.9-1.1)∶1混合组成;
所述微泡液中发泡体的含量是(2.5-3.5)mg/ml。
优选的,所述发泡体由dspc和dspe-peg2000按质量比为9∶1的组成;所述水合液由磷酸缓冲盐溶液、甘油和丙二醇按体积比8∶1∶1混合组成;所述微泡液中发泡体的含量是3mg/ml。
优选的,所述微泡组合物经水平震荡形成粒径为0.4-12μm的微泡,且90%以上的微泡其粒径小于1.81μm,微泡浓度大于等于5.721×109个/ml。
优选的,所述微泡液的体积与全氟丙烷的体积之比为1∶4。
优选的,所述微泡组合物盛装在密封容器中,密封容器内的压强大于或等于密封容器外的压强。
优选的,所述依达拉奉的质量与微泡组合物的体积之比为(70-80)mg∶1ml。
更优选的,所述依达拉奉的质量与微泡组合物的体积之比为75mg∶1ml。
以上所述的治疗肌萎缩性脊髓侧索硬化症的药物,其特征在于,由以下方法制得:
s1、将磷酸缓冲盐溶液、甘油和丙二醇混合均匀,得到水合液;
将dspc和dspe-peg2000溶解于氯仿中,得到混合液;
s2、将混合液中的氯仿蒸发完,形成发泡体;
s4、向发泡体中加入水合液,使发泡体溶解于水合液中,制得微泡液;
s5、将微泡液盛装于密封容器中,然后将微泡液上方的气体置换为全氟丙烷,制得微泡组合物;
s6、由微泡组合物和依达拉奉组合成所述药物。
本发明的另一方面,提供一种提高血脑屏障开放效果的方法,静脉注射以上任一所述的药物后,向两侧脑运动皮层处定向施加超声,超声参数为:中心频率为0.970mhz,声压为0.63mpa,重复频率为1hz,辐照时长为60s,占空比为10%。
与现有技术相比,本发明的有益效果是:
本发明通过将微泡组合物与依达拉奉组合成用于治疗als的药物组合物,用于与超声联合开放血脑屏障输送依达拉奉入脑,可提高依达拉奉入脑的脑药/血药比例百分比。在小鼠实验中,通过本发明所述药物联合超声开放小鼠血脑屏障输送依达拉奉入脑,经过4周的治疗后,超声联合微泡给药组小鼠比模型组的爪抓力提高了10.57%(p<0.05),在转棒上的停留时间相对模型组小鼠延长了79.8%,(p<0.01),相对于eda组延长了57.3%(p<0.05)。结果表明,超声联合微泡输送依达拉奉入脑,相对于传统给药方式,可提高其脑生物利用度,并更有效地延缓了sod1小鼠的疾病进展。
附图说明
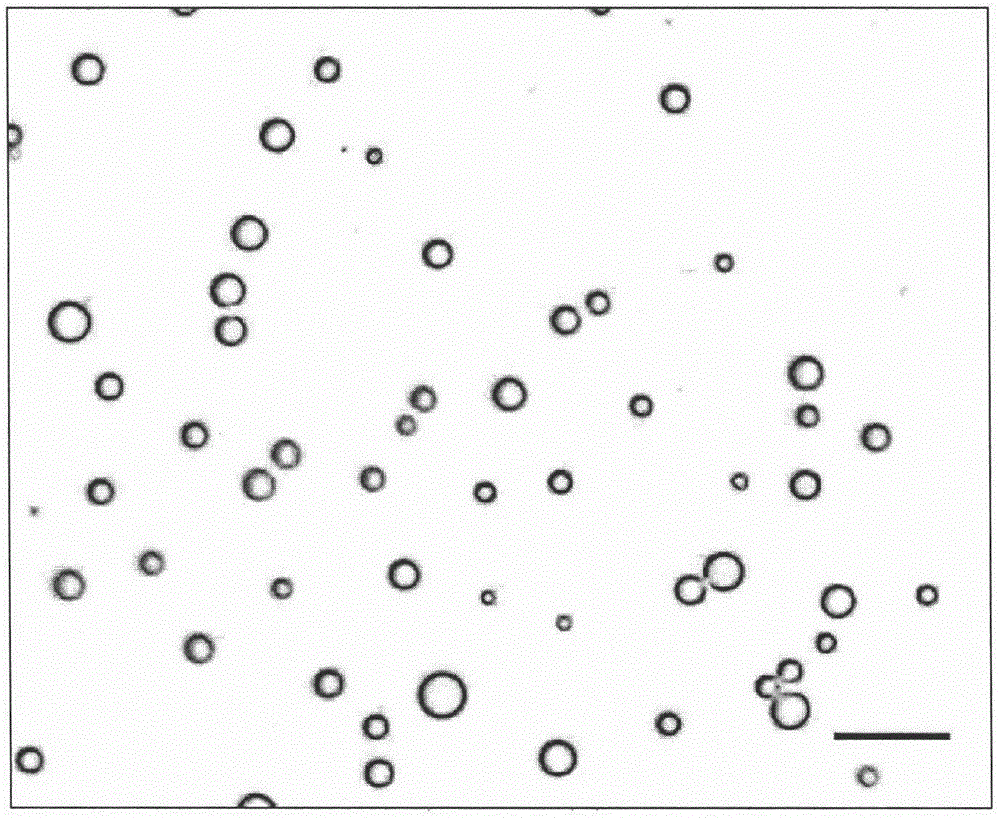
图1为本发明实施例制备的微泡液组合物中,微泡在显微镜下的形态图(标尺:10μm);
图2为本发明实施例制备的微泡液组合物中,微泡粒径分布图;
图3为伊文思蓝进入到小鼠脑部的光镜与荧光成像;
图4为依达拉奉不同给药方式的脑药/血药比例百分比统计图(n=5,*:p<0.05);
图5为治疗前wt鼠与als模型sod1鼠的爪抓力柱状图(****:p<0.0001);
图6为治疗4周后各组小鼠爪抓力柱状图(*:p<0.05,**:p<0.01);
图7为各组小鼠的转棒数据图(*:p<0.05,**:p<0.01);
图8为各组小鼠的腰髓前角运动神经元he染色图(标尺:20μm);
图9为各组小鼠的腰髓前角运动神经元个数统计图(**:p<0.01,****:p<0.0001);
图10为对比试验1中,伊文思蓝进入到小鼠脑部的光镜与荧光成像;
图11为对比试验2中,伊文思蓝进入到小鼠脑部的光镜与荧光成像.。
具体实施方式
为了更充分的理解本发明的技术内容,下面结合具体实施例对本发明的技术方案作进一步介绍和说明。
本发明旨在采用低强度聚焦超声联合微泡开放血脑屏障,提高输送依达拉奉入脑的效率及治疗als的效果,为als治疗药物的输送提供有力的辅助工具。
转基因sod1小鼠是研究家族性als应用最广泛的als动物模型。本发明采用als转基因鼠——sod1-g93a小鼠,突变基因为sod1(由内源性sod1启动子驱动的突变型人源sod1基因,在密码子93处具有甘氨酸的单个氨基酸取代为丙氨酸)。该模型表现为一个或多个肢体瘫痪,与人类肌萎缩侧索硬化相似的表型。基于此,本发明采用超声(0.970mhz,声压为0.63mpa,重复频率为1hz,辐照时长为60s,占空比为10%)联合微泡开放小鼠(13周龄的sod1小鼠)血脑屏障输送依达拉奉入脑,检测依达拉奉的入脑含量,并对sod1-g93a转基因小鼠(sod1)进行为期6周,每周两次的超声联合微泡开放血脑屏障输送依达拉奉入脑治疗,采用握力和转棒实验对als转基因小鼠的运动能力进行评估,治疗结束后对小鼠进行安乐死处理,取小鼠脊髓及脑进行病理学检测以评估治疗效果。
与单纯尾静脉注射相比,超声联合微泡开放血脑屏障输送依达拉奉入脑的脑药/血药比例百分比提高了0.43%(p<0.05)。检测结果显示,与野生型鼠相比,sod1组小鼠在发病初期爪抓力和运动能力都有一定程度的衰退(p<0.05);经过4周的治疗后,在爪抓力测试中,超声联合微泡给药组小鼠比模型组的爪抓力提高了10.57%(p<0.05),而尾静脉注射组与模型组相比没有明显的统计学差异,在转棒测试中,超声联合微泡给药组小鼠在转棒上的停留时间,相对模型组小鼠延长了79.8%,(p<0.01),相对于eda组延长了57.3%(p<0.05)。结果表明,超声联合微泡输送依达拉奉入脑,相对于传统给药方式,可提高其脑生物利用度,并更有效地延缓了sod1小鼠的疾病进展。
具体实验如下文所示。
一、实验动物及分组
转基因sod1小鼠(品系:b6.cg-tg(sod1*g93a)1gur/j)购自美国jackson实验室,与野生型(wt,与sod1小鼠具有相同的基因背景)雌鼠(品系:c57bl/6)杂交繁殖,并通过标准pcr技术鉴定出阳性鼠。
将49只13周龄sod1雌性小鼠随机分成五组,分别为模型组(als组,n=9)、单纯超声组(fus组,n=10)、超声微泡组(fus/mb组,n=10)、尾静脉注射组(eda组,n=10)、超声微泡给药组(fus/mb+eda组),同时取10只wt小鼠作为阴性对照(wt组)。
二、主要试剂及仪器
实验中用到的主要试剂及仪器:爪抓力测试仪,转棒式疲劳仪(淮北正华生物仪器设备有限公司,中国),脑立体定位仪(瑞沃德,中国),小动物麻醉仪(瑞沃德,中国),信号发生器(afg3102c,tektronix,美国),功率放大器(2100l,electronics&innovation,美国),超声换能器(西安博优超声,中国),色谱仪(ultimate3000rs,赛默飞世尔科技(中国)有限公司),质谱仪(qexactive高分辨质谱仪,赛默飞世尔科技(中国)有限公司),伊文思蓝(regal,中国),依达拉奉标准品(美仑生物,中国,hplc>99%)。
三、微泡组合物的制备
采用了机械振荡法,微泡结构为脂质包裹惰性气体全氟丙烷。
微泡制备步骤为:
(1)将磷酸缓冲盐溶液、甘油和丙二醇按照体积比8∶1∶1的比例混合均匀,得到水合液;
将dspc和dspe-peg2000按照质量比9∶1的比例混合溶解于氯仿中,得到混合液;
(2)通过旋转蒸发将混合液中的氯仿蒸发完,形成膜,得到发泡体;
(3)向发泡体中加入水合液,并用超声和65℃水浴进行充分溶解,直至溶液变澄清,发泡体溶解于水合液中,制得微泡液;所述微泡液中发泡体的含量是3mg/ml;
(4)将微泡液分装于西林瓶,然后将西林瓶内微泡液上方的气体置换为全氟丙烷,制得微泡组合物。西林瓶内微泡液的体积与全氟丙烷的体积之比为1∶4,西林瓶内的压强与西林瓶外的压强平衡。
其中,步骤(1)中,混合液中dspc与dspe-peg2000的质量比还可以是(8-10)∶1,水合液中磷酸缓冲盐溶液、甘油和丙二醇的体积比还可以是8∶(0.9-1.1)∶1;步骤(3)中,微泡液中发泡体的含量还可以是(2.5-3.5)mg/ml;步骤(4)中,还可以控制西林瓶内的压强可以大于或等于西林瓶外的压强。
将微泡组合物置于4℃冰箱保存。使用前,将装于西林瓶的溶液用振荡仪水平震荡即可获得形成微泡的溶液。由本实施例微泡组合物形成的微泡其结构为脂质包裹惰性气体全氟丙烷,显微镜下的形态图如图1所示(图中标尺:10μm)。使用库尔特颗粒计数仪multisizer4测量微泡的粒径分布和浓度,测量时采用的小孔管粒径是20μm,测量的范围是0.4-12μm,测量结果为平均粒径1.179μm,其中90%的微泡粒径<1.81μm,微泡浓度达5.721×109个/ml,粒径分布如图2所示。
由微泡组合物和依达拉奉组成本发明所述用于与超声联合开放血脑屏障的治疗治疗肌萎缩性脊髓侧索硬化症的药物,依达拉奉的质量与微泡组合物的体积之比为75mg∶1ml。在其它实施方案中,微泡组合物的体积与依达拉奉的质量之比还可以是(70-80)mg∶1ml。
四、超声治疗
将小鼠固定麻醉在超声平台上,再把超声探头定位到小鼠运动皮层,给小鼠尾静脉注射微泡组合物后,通过对小鼠两侧脑运动皮层处定向施加超声。其中超声参数为:中心频率为0.970mhz,声压为0.63mpa,重复频率为1hz,辐照时长为60s,占空比为10%。
五、荧光成像
取3只c57小鼠,在一次超声治疗后,通过尾静脉注射伊文思蓝作为示踪剂,2小时后使用4%多聚甲醛进行心脏灌注,取脑,将脑放在光镜下拍照后用小动物荧光成像仪进行荧光成像,如图3所示。
六.依达拉奉含量检测
取10只spf级c57bl/6j小鼠,体重20~22g,随机编号后分成两组,分别为单纯尾静脉注射给药组(eda组)和超声联合微泡给药组(fus/mb+eda组),给药剂量为5mg/kg。给药5min后取血和小鼠运动皮层区,通过液质联用方法定量测定血清和组织中依达拉奉的浓度,其中内标物为非那西丁。
七、超声联合微泡输送依达拉奉入脑治疗
将50只13周龄sod1雌性小鼠随机分成五组,分别为模型组(als组,n=10)、单纯超声组(fus组,n=10)、超声微泡组(fus/mb组,n=10)、尾静脉注射组(eda组,n=10)、超声微泡给药组(fus/mb+eda组),同时取10只wt小鼠作为阴性对照(wt组)。
小鼠13周龄开始每周治疗两次,每次给药间隔两到三天,连续六周。fus/mb+eda组给药方式为:将小鼠固定麻醉在超声平台上,再把超声探头定位到小鼠运动皮层,给小鼠尾静脉注射微泡组合物与依达拉奉的混合液后,通过对小鼠两侧脑运动皮层处定向施加超声。其中超声参数为:中心频率为0.970mhz,声压为0.63mpa,重复频率为1hz,辐照时长为60s,占空比为10%;相对小鼠的体重,依达拉奉注射量为15mg/kg,微泡组合物注射量为0.2μl/g。其他组别静脉注射液用生理盐水(als组、fus组)、微泡(fus/mb组)或者依达拉奉注射液(eda组)代替,而als组与eda组不进行超声辐照。
八、行为学检测
小鼠分别在13周龄治疗前、治疗后四周分别进行一次行为学检测。
握力测试:将小鼠放在抓住爪抓力测试网格上,拉动小鼠尾巴使其四肢紧抓住测试网格至松开,记录测试仪上的拉力数据。每只小鼠测三次取最大值。
转棒测试:先让小鼠在50s内从0r/min加速至25r/min的转棒仪上训练3min,训练三次,每次训练的时间间隔为10min。测试期间,小鼠在50s内从0r/min加速至25r/min的转棒仪上因运动功能障碍从棒上跌落,计算机自动记录跌落时的时间,5min内未跌落计时结束,记5min。
九、神经病理学检测
脑组织与脊髓进行石蜡包埋切片和苏木素-伊红(he)染色,并统计神经元个数。
十、统计学处理
采用软件graphpadprism进行统计学分析,计量资料以
十一、实验结果
1、超声联合微泡开放小鼠血脑屏障结果
超声联合微泡开放小鼠bbb输送伊文思蓝入脑后,由取下的脑的光镜图片(图3)可以看出,超声微泡成功地开放了血脑屏障,且让伊文思蓝进到了皮层区。荧光成像中,开放了血脑屏障后伊文思蓝可进入到脑部深处,覆盖到了皮层区(图3)。这说明超声微泡开放了血脑屏障血液中的物质进入了脑组织。
2、依达拉奉含量检测结果
样品中依达拉奉含量测定方法的建立结果为:依达拉奉浓度在20~10000ng/ml范围内线性关系良好,其中以依达拉奉与非那西丁峰面积的比值y为纵坐标,依达拉奉的浓度c为横坐标,以加权系数(1/x2)进行回归得到标准曲线y=-0.00126604+0.00032c,r2=0.9968。
图4显示的是给药的脑药/血药比例百分比,eda组的平均值是0.1846±0.01776(n=5),fus/mb+eda组的平均值是0.6163±0.1316(n=5)。与单纯尾静脉注射相比,超声联合微泡开放血脑屏障输送依达拉奉入脑的脑药/血药比例百分比提高了0.43%(p<0.05)。结果表明,超声联合微泡开放血脑屏障技术提高了依达拉奉的脑生物利用度。
3、行为学结果
在小鼠13周龄治疗之前,sod1组小鼠爪抓力为129.9±2.020mg(n=49),相对于wt小鼠(228.2±8.381mg,n=10),下降了43%(p<0.0001),如图5所示。因此sod1组小鼠,相对于wt组小鼠,爪抓力显著减小。将sod1组小鼠随机分组进行4周的治疗后再测试爪抓力。为了消除每只实验小鼠治疗前的基础差异,数据处理采用相对增长比值统计((治疗4周后爪抓力-治疗前爪抓力)/治疗前爪抓力),如图6所示。fus/mb+eda组小鼠爪抓力相对增长比值为-24.13(n=10),相对als组小鼠(-34.7,n=10),提高了10.57%(p<0.05)。fus/mb+eda组与eda组(-33.24,n=10)提高了9.11%(p<0.05)。
图7显示的是小鼠转棒行为学测试的结果。在小鼠13周龄治疗之前,sod1组小鼠在转棒上的停留时间为263.4±7.331s(n=50,相对于wt小鼠(300.0±0.0s,n=10),下降了36.61±16.34s(p<0.05)。因此sod1组小鼠,相对于wt组小鼠,运动能力有一定程度的衰退。治疗4周后,fus/mb+eda组小鼠在转棒上的停留时间为234.0±20.75s(n=10),相对als组小鼠(130.1+26.12s,n=10),运动时间延长了103.9±33.03s,(p<0.01)。相对于eda组(148.8±18.63s,n=10),运动时间延长了85.20±27.88s(p<0.05)。
这些结果表明,在相同剂量治疗的情况下,超声联合微泡输送依达拉奉入脑,相对于单纯尾静脉注射的给药方式,更有效延缓了sod1小鼠的疾病进展。
4、神经元退化结果
采用he染色观察了wt组、模型组(als组)、依达拉奉治疗组(eda组)和超声联合微泡输送依达拉奉治疗组(fus/mb+eda组)小鼠(每组5只)治疗6周后腰髓前角运动神经元的形态变化并对运动神经元进行计数。he染色结果如图8所示,a:wt组,b:als组,c:eds组,d:fus/mb+eda组),标尺:20μm;als组(b图)小鼠相对于wt组(a图)腰髓前角运动神经元数目明显减少,细胞萎缩,定量分析发现,相对于wt组,als组神经元数目下降了69.0%,eda组神经元数目下降了59.1%,fus/mb+eda组下降了50.7%。结果表明,超声联合微泡输送依达拉奉入脑可以使sod1小鼠腰髓前角神经元形态学病变有所改善,相较单纯给药组更有效果。运动神经元计数结果如图9所示,**:p<0.01,****:p<0.0001。
由上述实验结果可见,在相同剂量治疗的情况下,应用本发明方法,通过超声联合微泡输送依达拉奉入脑,相对于单纯尾静脉注射的给药方式,更有效延缓了sod1小鼠的疾病进展。
十二、不同比例的依达拉奉与微泡组合物组成的药物组合对开放小鼠血脑屏障的影响
小鼠13周龄开始每周治疗两次,每次给药间隔两到三天,连续六周。
给药方式为:将小鼠固定麻醉在超声平台上,再把超声探头定位到小鼠运动皮层,给小鼠尾静脉注射微泡组合物与依达拉奉的混合液(添加有伊文思蓝作为示踪剂)后,通过对小鼠两侧脑运动皮层处定向施加超声。超声参数为:中心频率为0.970mhz,声压为0.63mpa,重复频率为1hz,辐照时长为60s,占空比为10%。
对比试验1的注射量为:相对小鼠体重,依达拉奉注射量为15mg/kg,微泡组合物注射量为0.1μl/g;即依达拉奉的质量与微泡组合物的体积之比是150mg∶1ml。
对比试验2的注射量为:相对小鼠体重,依达拉奉注射量为15mg/kg,微泡组合物注射量为0.3μl/g;即依达拉奉的质量与微泡组合物的体积之比是50mg∶1ml。
超声联合微泡开放小鼠bbb输送伊文思蓝入脑后,由取下的脑的光镜图片可以看出,对比试验1因注射的依达拉奉的质量与微泡组合物的体积之比为150mg∶1ml,小鼠血脑屏障开放较小,如图10所示;而对比试验2因注射的依达拉奉的质量与微泡组合物的体积之比为50mg∶1ml,小鼠血脑屏障过度开放,如图11所示。对比试验1和对比试验2对小鼠血脑屏障的开放程度过小或过大均不利于提高对als的治疗效果。
以上所述仅以实施例来进一步说明本发明的技术内容,以便于读者更容易理解,但不代表本发明的实施方式仅限于此,任何依本发明所做的技术延伸或再创造,均受本发明的保护。
- 还没有人留言评论。精彩留言会获得点赞!