一种二联灭活疫苗及其制备方法与流程
本发明属于疫苗制备领域,具体涉及一种猪圆环病毒2型和猪支原体肺炎的疫苗。
背景技术:
猪圆环病毒2型(porcinecircovirstype2,pcv2)是断奶仔猪多系统综合征(post-weaningmμltisystemicwastingsyndrome,pmws)、猪呼吸道病综合征(porcinerespiratorydiseasecomplex,prdc)和猪皮炎和肾病综合征(porcinedermatitisandnephropathysyndrome,pdns)的主要病原之一。pcv2属于圆环病毒科圆环病毒属,是一种无囊膜,单链dna病毒。pcv2主要有pcv2a,pcv2b,pcv2c,pcv2d和pcv2e共5个基因型,近几年,pcv2d变为主要传染的基因型。cap蛋白由病毒基因组中orf2开放阅读框编码,是主要的结构蛋白,构成病毒的核衣壳,cap蛋白是主要的结构蛋白,研究表明其n端含有一个由41个氨基酸残基组成的核定位信号(nls),且含有大量的大肠埃希菌稀有密码子,这将严重影响外源蛋白的表达。相关研究证实,cap蛋白免疫动物可以产生病毒的中和抗体。orf2基因已经作为研制基因工程疫苗的重点对象。但是,现有技术中cap蛋白采用真核表达系统产量低,分离纯化困难;而orf2编码蛋白的n端存在着大量串联或单联的大肠埃希氏菌稀有密码子,严重影响在大肠杆菌中的表达,所以目前报道进行原核表达的多为截短型cap蛋白,这样虽然蛋白表达量较高,但不是完整的cap蛋白,不能形成完整的病毒样颗粒,同时一些功能性信号区域和保守序列没能表达。对orf2基因进行密码子优化,改变了难以在大肠杆菌中表达的稀有密码子,极大地提高了蛋白的表达量,同时表达的完整cap蛋白氨基酸序列和亲本序列完全一致,没有改变其免疫原性,为保证制备的疫苗免疫效果打下良好的基础。
pcv2对猪的致病性主要表现为免疫系统的损伤,可引起淋巴结肿大、淋巴细胞减少等病变,使感染猪处于严重免疫抑制状态,这是pmws发生的重要原因。
猪支原体肺炎(mps)又称猪喘气病或地方性流行性肺炎,是由猪肺炎支原体(mhp)引起的一种接触性慢性呼吸性传染病。不同年龄不同品种的猪均能感染。患病猪主要表现为咳嗽和气喘,剖解时以肺部病变为主,出现“肉变样”或“胰变样”等实质性病变。有报道成猪肺炎支原体感染后可引起动物机体免疫抑制,造成其抵抗力下降而招致继发感染。对pcv2而言,它会增加它的病毒载量,病延长病毒在动物体内存在的时间,协同其促进肺部和淋巴病变,从而提高pmws的发生率。
临床调查显示,猪圆环病毒和猪支原体肺炎的混合感染极为广泛,发病率严重,给养猪业造成了严重的经济损失。疫苗接种是防治猪圆环病毒和猪支原体肺炎的重要方法。
为了更简单、有效、降低成本的预防和控制猪圆环病毒和猪肺炎支原体感染引起的疾病,我们研制了猪圆环病毒2型、猪支原体肺炎二联灭活疫苗(bl21/pet30a-orf2株+q株),研究其安全性与有效性指标。
技术实现要素:
针对猪圆环病毒2型和猪肺炎支原体已知疫苗的毒株地域性、疫苗灭活剂及佐剂等问题,本发明提供一种预防猪圆环病毒2型和猪支原体肺炎有效的疫苗,本发明的疫苗在受试者中诱导针对猪圆环病毒2型和猪肺炎支原体攻击的保护性免疫应答。
为实现上述目的,本发明采用如下技术方案。
一种二联灭活疫苗,含灭活的猪圆环病毒2型cap蛋白和猪肺炎支原体,所述cap蛋白编码基因序列如seqidno.1所示,所述猪肺炎支原体保藏号为:cgmccno.18879。
一种上述二联灭活疫苗的制备方法,包括以下步骤:
(1)将含有seqidno.1序列的载体转化大肠杆菌得到重组菌,诱导表达获得cap蛋白,灭活后作为疫苗抗原a;
(2)将猪肺炎支原体灭活,制备成疫苗抗原b;
(3)将疫苗抗原a和疫苗抗原b混合搅拌,再与佐剂混合获得疫苗。
所述二联灭活疫苗,含cap蛋白≥100μg/ml,猪肺炎支原体≥5×108ccu/ml。
所述佐剂为isa系列佐剂,优选isa15avg。
本发明具有以下优点:
本发明提供的二联灭活疫苗,含灭活的猪圆环病毒2型cap蛋白和猪肺炎支原体,能够提供更简单、有效、低成本的预防和控制猪圆环病毒和猪肺炎支原体感染引起的疾病。
生物保藏信息
猪肺炎支原体,保藏编号为cgmccno.18879,保藏单位:中国微生物保藏管理委员会普通微生物中心(cgmcc),保藏地址:中国北京北京市朝阳区北辰西路1号院3号,保藏日期:2019年12月12日。
附图说明
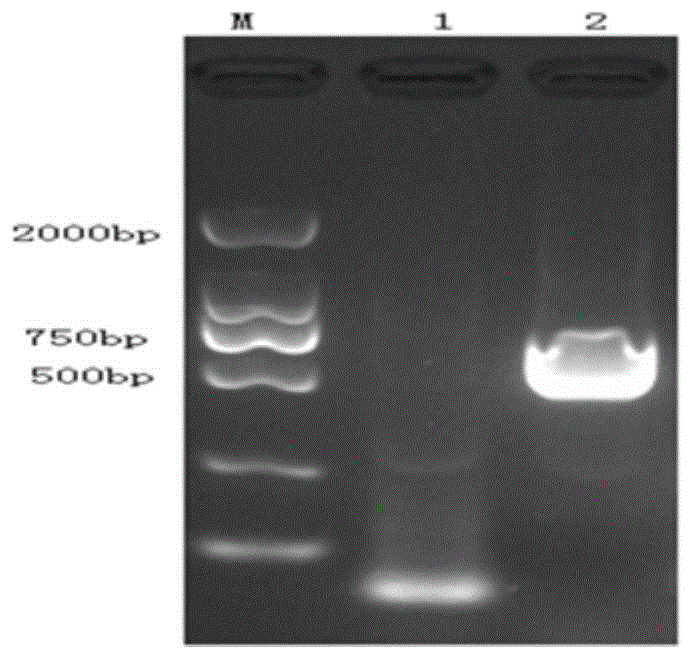
图1:pcv2orf2基因pcr检测结果,其中,m:dl2000dnamarker,1:阴性对照,2:阳性质粒扩增结果;
图2:cap蛋白sds-page电泳检测结果,m:蛋白marker,1:诱导前菌液检测结果,2:诱导后裂解上清检测结果;
图3:cap蛋白western-blot电泳检测结果。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1猪圆环病毒2型、猪支原体肺炎二联灭活疫苗的制备
1.疫苗用cap蛋白的获得
1.1重组表达载体pet30a-orf2的构建与诱导表达
1.1.1orf2基因的获得与密码子优化
将临床分离疑似pmws病理材料处理后接种无pcv2污染的pk-15细胞,盲传三代后,pcr扩增猪圆环病毒2型全基因组,并进行病毒的分离鉴定。引物序列如下:
上游引物序列如下:
p1:5’-gaaccgcgggctggctgaacttttgaaagt-3’
下游引物序列如下:
p2:5’-gcaccgcggaaatttctgacaaacgttaca-3’
对全基因组扩增产物测序。将全基因组序列登陆genbank(no.dq346683)。对该病毒orf2基因进行优化,改造为大肠杆菌嗜好的密码子,能更高效表达cap蛋白,表达率达90%以上。序列如seqidno.1所示。将优化改造后的orf2基因5’端和3’端分别加入bamhi和xhoi限制性内切酶酶切位点,进行人工合成。
1.1.2重组表达载体pet30a-orf2的构建
将合成的重组orf2基因双酶切后与pet30a原核表达载体的相应酶切位点连接,构建pet30a-orf2表达载体。用热应激法将连接产物转化大肠杆菌bl21感受态细胞,涂布含卡那霉素的lb平板,37℃培养。挑取单菌落,在含有卡那霉素的lb培养基中培养,碱裂解法提取质粒,经pcr扩增和bamhi、xhoi双酶切鉴定,阳性质粒获得目的条带,将阳性质粒进行测序,测序结果证明优化后的orf2基因已经成功插入到pet30a质粒中,没有点突变,原核表达载体构建成功,将测序正确的重组质粒命名为pet30a-orf2。
1.1.3重组表达载体pet30a-orf2的pcr
根据改造后的orf2基因序列,设计一对检测引物,扩增orf2基因,引物序列如下所示:
上游引物序列如下:
p3:5’-atggatccatgacctacccgcgtcgtc-3’;
下游引物序列如下:
p4:5’-gtctcgagcttagggttgagcggcggg-3’。
以连接产物为模板,加入以下试剂,建立20μlpcr体系:
premixtaq(takarataqversion2.0plusdye)10μl
模板1μl
10mol/l上、下游引物各1μl
ddh2o7μl
按以下扩增条件:95℃5min;94℃30s,61℃30s,30个循环;72℃延伸10min。
回收pcr产物,-20℃保存备用。以1%的琼脂糖凝胶电泳鉴定pcr产物,如图1所示,其中m为标准dnamarker(dl2000),1为阴性对照,2为阳性质粒扩增结果,含有目的条带,约为700bp。
1.1.4重组表达载体pet30a-orf2的双酶切鉴定
用bamhi和xhoi将纯化后的pet30a-orf2原核表达载体质粒进行双酶切,取酶切产物5µl在2%的琼脂糖凝胶上进行电泳,5v/cm,40min。酶切体系如下:
bamhi1µl
xhoi1µl
10×tbuffer2µl
1%bsa2µl
pet30a-orf24µl
h2o10µl。
1.1.5重组表达菌株bl21/pet30a-orf2的构建、诱导表达及鉴定
1.1.5.1重组质粒转化感受态大肠杆菌bl21
测序正确的pet30a-orf2原核表达载体质粒转化大肠杆菌bl21(neb),得到重组表达菌株bl21/pet30a-orf2。
1.1.5.2重组表达菌株bl21/pet30a-orf2的诱导表达
挑取重组菌单个菌落,接种至10ml含卡那霉素的lb培养基中,于37℃振荡培养至od600达到0.6,加iptg至终浓度为1mmol/l,继续培养5小时。离心收集菌体,弃上清,pbs(0.015mol/l,ph7.2)洗涤后,加入3ml裂解液,超声裂解3min,离心后收集上清,取适量加入5×sds上样缓冲液,用12%的聚丙烯酰胺凝胶进行sds-page检测,剩余样品-20℃冻存备用,同时设立不加iptg诱导的培养物作为对照。
1.1.5.3重组表达菌株bl21/pet30a-orf2表达产物鉴定
收集bl21/pet30a-orf2菌体,进行sds-page电泳,电泳后,经考马斯亮蓝染色显示,结果如图2所示:重组表达质粒分别产生了大约37kda蛋白条带,大小与预期融合蛋白分子量基本一致,表达率达90%以上,而对照无此条带。应用pcv2单克隆抗体对诱导表达的重组蛋白进行western-blot检测,结果显示在37kda处呈现特异性目的条带,如图3所示。
1.2制苗用cap蛋白的制备
1.2.1菌液培养
用培养罐通气培养,按容积装入70%基因工程菌增菌培养基及培养基总量0.05%的消泡剂。灭菌后按培养基总量的2%接种二级种子,同时按总量比例0.1%的量加入10%卡那霉素注射液。37℃通气至od600为0.8时,将灭菌好的诱导剂iptg按终浓度为1.0mmol/l加入,37℃下诱导5小时。培养过程中保持35%-50%溶氧量。
1.2.2菌体裂解
培养结束后,离心收集菌体。收集的菌体用pbs(1×pbs)洗涤2次,将收集的菌体按1g湿菌加10mlpbs(1×pbs预先降温处理)进行悬浮,冰浴下高压破碎,8000rpm离心30min,离心取上清。
1.2.3蛋白纯化
收集上述上清液,10000rpm离心15min。悬液中加入5‰tx114,4℃冰浴约1小时,恢复至室温25℃,10000rpm离心10min,收集上清。
1.2.4cap蛋白含量测定
取上清进行测定,纯化后pcv2cap蛋白含量应不低于240μg/ml,方可用于制备疫苗。
1.2.5内毒素检测
取cap蛋白上清液进行测定,应不高于10000eu/ml。
1.2.6灭活
将上述符合要求的蛋白上清,加入终浓度为0.1%的甲醛,37℃灭活24小时。
2.制苗用猪肺炎支原体的获得
2.1猪肺炎支原体的获得、鉴定、毒力与免疫原性研究
2.1.1将采集的疑似猪支原体肺炎病料进行染色镜检、分离培养和鉴定,确定疑似菌株符合猪肺炎支原体特性,将分离株进行了培养特性、生化特性、血清学试验、pcr试验、序列分析p36基因(seqidno.2)鉴定,确定为猪肺炎支原体,命名为q株。
2.1.2通过猪肺炎支原体分离株对试验猪的毒力试验和免疫原性鉴定试验,确定其毒力较强和免疫原性较好,具体结果见表1和表2。
表1猪肺炎支原体分离株对猪的毒力测定结果
表2攻毒后各试验猪的肺脏肺炎病变评分结果
2.2制苗用猪肺炎支原体的制备
2.2.1菌液培养
采用微生物发酵罐培养猪肺炎支原体菌液。发酵罐加入适当生产用pplo肉汤培养基,按培养基总量的10%接入猪肺炎支原体二级种子液,混合均匀后,37℃培养。开始小气量通气,逐渐增大通气量,ph值约为7.5,通气量为5-6l/分钟,搅拌速度控制在100-200转/分,37℃培养3~7日,待培养基颜色变黄,ph值由7.5降到6.8-7.0时,收获菌液,置-20℃保存备用。
2.2.2活菌滴度测定
按现行《中国兽药典》附录进行,活菌滴度应≥5×108ccu/ml。
2.2.3灭活
加入终浓度为4mmol/l的灭菌bei溶液,37℃搅拌灭活24小时,灭活后加入硫代硫酸钠溶液,使其最终浓度为20mmol/l,在37℃下继续搅拌培养4小时,以中和bei溶液。
3.猪圆环病毒2型、猪支原体肺炎二联灭活疫苗的制备
3.1油相制备
将佐剂15avg121℃高压30分钟,冷却后备用。
3.2水相制备
将检验合格的pcv2cap蛋白灭活液和猪肺炎支原体灭活菌液按1:1的比例制成混合抗原,同时加入最终浓度不超过0.01%(w/v)硫柳汞,搅拌均匀。
3.3乳化
水相与油相按照85:15的比例混合,4500r/min,25℃乳化40分钟制成水包油型(o/w)苗,每ml疫苗中含cap蛋白≥100μg,猪肺炎支原体q株≥5×108ccu/ml。
实施例2动物实验
1.pcv2抗体检测
用14-21日龄pcv2抗原阴性健康易感仔猪10头,分成2组,每组5头,第1组分别肌肉注射制备的基因工程疫苗2.0ml,第2组不接种,作为空白对照,隔离饲养观察。免疫后28日采血,采用elisa方法测定pcv2抗体效价,具体结果如下:
表3二联苗免疫试验猪的血清抗体效价检测结果
从表3可以看出,二联苗免疫组猪的pcv2血清elisa抗体效价不低于1:1600,空白对照组猪的pcv2血清elisa抗体效价不高于1:400。
2.免疫攻毒法
2.1猪圆环病毒
用14-21日龄pcv2抗原抗体阴性健康易感仔猪15头,分成3组,每组5头,第a组为免疫攻毒组,分别肌肉注射疫苗2.0ml,第b组为非免疫攻毒组,第c组为空白对照组(非免疫、非攻毒),3组分别隔离饲养。于攻毒当日,称量所有试验仔猪体重,攻毒猪隔离饲养;并于攻毒前3日和攻毒后3日、6日,所有攻毒组试验仔猪均肌肉注射弗氏不完全佐剂乳化的钥匙孔血蓝蛋白(klh/icfa,0.5mg/ml)5.0ml/头,腹腔注射巯基乙酸培养基10ml/头。连续观察至攻毒后28日,再次称量所有试验组仔猪体重,并于攻毒后前7天每天测量所有攻毒组试验仔猪体温,于攻毒后28日扑杀剖检所有攻毒试验仔猪,取腹股沟淋巴结组织,进行免疫组化检测,根据体温、相对日增重和免疫组化结果进行判定。观察并统计试验组发病及免疫保护情况。免疫攻毒组试验猪至少4头保护,非免疫攻毒组试验猪至少4头发病,空白对照组试验猪应全部不发病。详细试验结果见表4-表7。
表4pcv2攻毒后试验猪的体温变化表
由表4可以看出,a组(二联苗免疫组)攻毒后,试验猪的体温未发生明显的变化;非免疫攻毒组中的5头试验猪体温升高(≥40℃)且持续3日以上。
表5pcv2攻毒后试验猪的体重变化
由表5可以看出,a、b组试验猪使用猪圆环病毒2型sd株病毒液(含106.0tcid50/ml)攻毒后,经用统计学软件spss22.0分析,a组(猪圆环病毒2型、猪支原体肺炎二联灭活疫苗免疫组)平均相对日增重与空白对照组(c组)平均相对日增重相比,p>0.05,差异不显著,该组所有猪没有圆环病毒2型引起的临床症状。非免疫攻毒组(b组)平均相对日增重与空白对照组(c组)平均相对日增重相比,p<0.01,差异极显著,该组所有猪有圆环病毒2型引起的临床症状。
表6各试验组猪pcv2攻毒后28日腹股沟淋巴结免疫组化结果
注:表中“+”表示pcv2阳性,“-”表示pcv2阴性
由表6可以看出,非免疫攻毒组试验猪攻毒后28天均能检出抗原,a组试验猪攻毒后,5头试验猪均不能检出抗原。
表7不同疫苗免疫效力试验结果
注:“+”表示阳性;“-”表示阴性;“\”表示无此项。
2.2猪肺炎支原体
取14-21日龄健康易感仔猪随机分组,试验组10头,分为2组,每组5头。a组颈部肌肉注射二联苗,每头颈部肌肉注射疫苗2.0ml。b组不接种为对照组。接种后28日,连同对照猪5头,各气管注射100mid的猪肺炎支原体济南系强毒cvcc354株f70代冻干肺组织强毒5.0ml(含0.01g肺组织毒),观察28日,剖杀所有试验猪按照goodwin55分计分法对试验猪的肺部喘气病肺炎病变进行评分,试验结果见表8。
表8攻毒后各试验猪的肺脏肺炎病变评分结果
根据表8结果可知,研制的二联苗接种试验猪,用强毒攻毒后,疫苗免疫组平均肺炎病变分别得分为4.8分,攻毒对照组平均肺炎病变得分为28.0分,免疫组肺炎病变平均减少率为82.9%。
综上所述,猪圆环病毒2型、猪支原体肺炎二联灭活疫苗(bl21/pet30a-orf2株+q株)对由猪圆环病毒2型感染引发的疾病具有良好的免疫保护作用。
序列表
<110>山东省农业科学院畜牧兽医研究所
<120>一种二联灭活疫苗及其制备方法
<130>20191108
<160>6
<170>patentinversion3.5
<210>1
<211>705
<212>dna
<213>artificialsequence
<220>
<223>cap
<400>1
atgacctacccgcgtcgtcgttaccgtcgtcgtcgtcaccgtccgcgttctcacctgggt60
cagatcctgcgtcgtcgtccgtggctggttcacccgcgtctgcgttaccgttggcgtcgt120
aaaaacggcatcttcaacacccgtctgtctcgtaccatcggttacaccgttaaagcgacc180
accgttcgcactccaagctgggcggtcgatatgatgcgctttaacatcaacgacttcctg240
ccgccaggtggcggctctaacccgctgaccgttccgttcgaatactaccgtatccgtaaa300
gtgaaagttgaattctggccgtgcagcccgatcacccagggcgatcgcggcgtcggttcc360
accgcagtgatcctggatgataacttcgtgaccaaagcgaacgcgctgacctacgatccg420
tacgttaactattctagccgccacaccatcccgcagccattctcctaccacagccgttat480
ttcaccccgaagccggtgctggatcgtaccatcgactacttccagccgaacaacaaacgt540
aaccagctgtggctgcgtctgcagaccaccggtaacgtggatcacgttggcctgggtact600
gcgttcgaaaactctaaatacgaccaggactacaacattcgtatcaccatgtacgttcag660
ttccgtgagttcaacctgaaagacccgccgctcaaccctaagtaa705
<210>2
<211>393
<212>dna
<213>mycoplaahyopneumoniae
<400>2
cgtttggagggaaccattggaacagtggctaataccggatatgataaaaatttgcatgaa60
tttttattcaaaggagctttcaagcttcaccaagaaatggcggtgcgcaacattagttag120
ttggtagggtaaaagcctaccaagacgatgatgtttagcggggccaagaggttgtaccgc180
cacactgggattgagatacggcccagactcctacgggaggcagcagtaaggaatattcca240
caataagcgaaagcttgatggagcgacacagcgtgcaggatgaagtctttcgggatgtaa300
actgctgttgtaagggaagaaaaaactagataggaaatgctctagtcttgacggtacctt360
attagaaagcgacggcaaactatgtgccaagga393
<210>3
<211>30
<212>dna
<213>artificialsequence
<220>
<223>p1
<400>3
gaaccgcgggctggctgaacttttgaaagt30
<210>4
<211>30
<212>dna
<213>artificialsequence
<220>
<223>p2
<400>4
gcaccgcggaaatttctgacaaacgttaca30
<210>5
<211>27
<212>dna
<213>artificialsequence
<220>
<223>p3
<400>5
atggatccatgacctacccgcgtcgtc27
<210>6
<211>27
<212>dna
<213>artificialsequence
<220>
<223>p4
<400>6
gtctcgagcttagggttgagcggcggg27
- 还没有人留言评论。精彩留言会获得点赞!