利用免疫毒素和检查点抑制剂组合的新辅助癌症治疗的制作方法
利用免疫毒素和检查点抑制剂组合的新辅助癌症治疗
[0001]
对相关申请的交叉引用
[0002]
本申请要求于2018年5月16日提交的美国临时申请62/672,150、2018年5月23日提交的美国临时申请62/675,263和2019年5月8日提交的美国临时申请62/844,857的优先权,每件申请的内容均通过引用整体并入本文。
[0003]
关于联邦政府赞助的研究或开发的声明
[0004]
本发明是在国立卫生研究院(national institute of health)授予的联邦资助号ca197264的政府支持下进行的。政府拥有本发明的某些权利。
技术领域
[0005]
本发明涉及抗肿瘤免疫治疗领域。特别是,本发明涉及在新辅助疗法中利用免疫毒素本身或与免疫检查点抑制剂组合的癌症治疗。
背景技术:
[0006]
胶质母细胞瘤是所有原发性脑和中枢神经系统肿瘤中最严重的恶性脑瘤。使用目前的标准疗法或甚至新开发的药剂的胶质母细胞瘤患者的中位存活时间少于15个月。因此,迫切需要开发先进和有效的治疗方法以改善胶质母细胞瘤患者以及其他表达egfr受体的肿瘤的不良存活前景。
技术实现要素:
[0007]
根据本发明的一个方面,提供了通过新辅助疗法治疗个体的肿瘤的方法。在这种方法中,该个体先前未经历过治疗肿瘤的切除术(例如,未进行减轻肿瘤负荷的手术疗法)。通过新辅助疗法治疗个体的肿瘤的方法包括施用有效量的免疫毒素或治疗有效量的免疫毒素和免疫检查点抑制剂,其中免疫毒素包含与pe38截短的假单胞菌属(pseudomonas)外毒素融合的抗体或其抗原结合区,合适地是单链可变区抗体,然后治疗该个体以减轻肿瘤负荷。在组合疗法中,可以同时或相继将免疫毒素和免疫检查点抑制剂施用于个体。可以例如通过手术切除减轻肿瘤负荷。这种肿瘤切除术可以发生于施用免疫检查点抑制剂和免疫毒素后2周到几个月的时间内。免疫毒素包含与pe38截短的假单胞菌属外毒素融合的抗体或其抗原结合区,例如单链可变区抗体,其中单链可变区抗体具有seq id no:1-6(“d2c7-it”)所示的cdr1、cdr2和cdr3区或包含其抗原结合片段。
[0008]
根据本发明的另一个方面,提供了用于癌症的新辅助免疫疗法的方法,包括:a)向患有肿瘤的个体施用治疗有效量的免疫治疗剂的组合,包括免疫毒素与另一免疫治疗剂例如免疫检查点抑制剂的组合,该免疫毒素包含与pe38截短的假单胞菌外毒素融合的抗体或或其抗原结合区,例如单链可变区抗体,其中所述免疫治疗剂包含在组合疗法中顺序施用的免疫毒素和免疫检查点抑制剂;b)在接受免疫治疗剂后,用有效减轻个体的肿瘤负荷(例如肿瘤量)的选自由手术、放射疗法及其组合组成的组的抗癌疗法治疗个体(即,在抗癌治疗之前施用免疫治疗剂)。免疫治疗剂还可以进一步包括添加药学上可接受的载体。一方
面,免疫毒素包含与外毒素融合的单链可变区抗体,其中单链可变区抗体具有seq id no:1-6(“d2c7-it”)所示的cdr1、cdr2和cdr3区或其抗原结合片段。
[0009]
在这种方法中,个体先前未经历过减轻肿瘤负荷的治疗(例如,未进行减轻肿瘤负荷的治疗)。将免疫检查点抑制剂施用于荷瘤个体。将有效量的免疫毒素施用于个体,其中所述免疫毒素包含可以结合egfrwt和egfrviii的单链可变区抗体(因此,所述免疫毒素靶向在肿瘤细胞的细胞表面上表达的egfrwt和egfrviii),并且其中所述抗体与pe38截短的假单胞菌属外毒素融合。一方面,所述单链可变区抗体具有如seq id no:1-6所示的cdr1、cdr2和cdr3区或其抗原结合片段。在施用包含免疫毒素的新辅助疗法后,个体经历切除肿瘤的手术,或减轻肿瘤负荷的其他疗法。这种肿瘤负荷的减轻可以发生于新辅助疗法后2周到几个月的时间内。新辅助疗法还可以任选地进一步包括向荷瘤个体施用免疫检查点抑制剂。
[0010]
根据本发明的另一方面,本文所述的任一方法还可以包括辅助疗法,其包括在切除肿瘤后向个体施用靶向egfrwt和egfrviii的所述免疫毒素或所述免疫检查点抑制剂中的一种或多种。例如,在切除术之后,可以根据维持疗法的需要向个体施用免疫检查点抑制剂。在另一实例中,如果肿瘤在切除之后复发,则可以向个体施用免疫毒素。
[0011]
根据本发明的另一方面,提供了个体肿瘤的新辅助疗法,和靶向egfrwt和egfrviii的免疫毒素在肿瘤新辅助疗法中作为药物或作为组合物的用途,以及任选地包括免疫检查点抑制剂在肿瘤新辅助疗法中作为药物或作为组合物的用途,其中荷瘤个体先前未经历过治疗肿瘤的切除术。一方面,免疫毒素包含与pe38截短的假单胞菌属外毒素融合的单链可变区抗体,其中所述单链可变区抗体具有seq id no:1-6所示的cdr1、cdr2和cdr3区或其抗原结合片段;并且其中在用治疗有效量的靶向egfrwt和egfrviii的免疫毒素,任选地包括治疗有效量的免疫检查点抑制剂治疗肿瘤后,其中在这种治疗之后,然后切除肿瘤,或以其他方式减轻肿瘤负荷。在切除肿瘤(维持疗法)之后新辅助疗法还可以包括一种或多种疗法,包括施用治疗有效量的免疫毒素或治疗有效量的免疫检查点抑制剂或其组合。
[0012]
提供了个体肿瘤的新辅助疗法,包括向先前未经历过减轻肿瘤负荷治疗的荷瘤个体施用治疗有效量的靶向egfrwt和egfrviii的免疫毒素。该方法还可以进一步包括向所述荷瘤个体施用有效量的免疫检查点抑制剂,其中施用在减轻肿瘤负荷的治疗之前进行。一方面,免疫毒素包含与pe38截短的假单胞菌属外毒素融合的单链可变区抗体,其中所述单链可变区抗体具有seq id no:1-6所示的cdr1、cdr2和cdr3区或其抗原结合片段。在另一方面,用免疫毒素或免疫毒素与免疫检查点抑制剂的组合治疗肿瘤,然后切除肿瘤。与单独使用免疫毒素或使用免疫毒素与免疫检查点抑制剂的组合的辅助疗法相比,新辅助疗法提供了改善的治疗益处。使用本领域技术人员已知的适当反应评价标准,并取决于治疗的癌症的类型(例如,对于淋巴瘤,参见cheson et al.,2014,j.clin.oncology32(27):3059-3067;对于实体非淋巴样肿瘤,参见response evaluation criteria in solid tumors(实体肿瘤的反应评价标准)(recist)),治疗益处可包括以下中的一项或多项:肿瘤部位周围的炎症减轻(切除之前和/或之后);改善总存活率;改善无病存活率;复发的可能性降低(在原发器官复发和/或远处复发);转移性疾病的发生率降低;和增强抗肿瘤免疫应答;或改善总体客观有效率(overall objective response rate)。
[0013]
通过阅读说明书,这些和其他方面对于本领域技术人员而言会是显而易见的,并且为本领域提供了用于治疗癌症的新治疗方案。
附图说明
[0014]
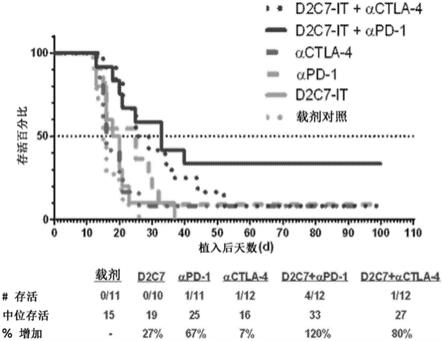
图1.d2c7-it+(αctla-4或αpd-1)mab组合疗法在携带皮下ct2a-d2c7胶质瘤的c57bl/6免疫活性小鼠中的体内疗效。图1显示了所有治疗组(d2c7-it+αctla-4、d2c7-it+αpd-1、αctla-4、αpd-1、d2c7-it、载剂对照(vehicle control))相对于植入后天数的存活百分比,跟踪至第100天(如适用)。
[0015]
图2是显示了以下小鼠相对于肿瘤植入后天数的肿瘤体积的图:用pbs治疗且随后不切除肿瘤的小鼠(
-■-
,pbs+无切除);用d2c7-it-治疗且随后不切除肿瘤的小鼠(
-▲-
,d2c7-it+无切除);用pbs治疗且随后切除肿瘤的小鼠(
-▼-
,pbs+切除);以及用d2c7-it-治疗且随后切除肿瘤的小鼠(
-◆-
,d2c7-it+切除)。
[0016]
图3显示了对于所有治疗组(载剂对照、d2c7-it、d2c7-it+αpd-1、d2c7-it+αpd-l1、d2c7-it+αtim-3、d2c7-it+αlag-3以及d2c7-it+αcd73),跟踪至第80天(如适用),携带皮下ct2a-d2c7胶质瘤的c57bl/6免疫活性小鼠相对于植入后天数的存活百分比。
具体实施方式
[0017]
本发明人通过将d2c7单克隆抗体(mab)的单链可变片段(scfv)与假单胞菌属外毒素a(pe)融合,任选地与kdel肽融合,已经开发出了靶向免疫毒素(it),即d2c7-(scdsfv)-pe38kdel(d2c7-it,seq id no:5)。d2c7-it与野生型表皮生长因子受体(egfrwt)和egfr变体iii(egfrviii)反应,这两种蛋白质都在胶质母细胞瘤中过表达。在免疫受损小鼠的原位胶质瘤异种移植模型中,pe介导d2c7-it的稳健抗肿瘤疗效。除了直接杀伤肿瘤细胞外,免疫毒素单一疗法还通过t细胞的参与诱导再次抗肿瘤免疫应答。在新辅助疗法中将免疫毒素与免疫检查点抑制剂以组合方案施用时,观察到改善的协同效果。
[0018]
其他可以被附着到抗体的部分包括其他提供额外的有益性质的部分。例如,可以将kdel(lys-asp-glu-leu)四肽添加于蛋白质的羧基末端,以保留在内质网中。也可以使用发挥类似功能的变体,例如dkel、rdel和knel。本文描述的单链可变区抗体衍生自d2c7单克隆抗体。其他包含d2c7抗体的抗原结合区的抗体衍生物也可以用于本文所述的方法中。本文所述的抗体和单链可变区抗体的这些抗原结合区或片段,维持了d2c7单克隆抗体的抗原结合能力,也可以用于所述方法中,这些包括单链可变区抗体的片段以及d2c7抗体的片段,例如本文所述的单链可变区抗体。其他抗原结合区可以包括fab、scfv和包括少于所有6个cdr的单结构域或小型化抗体。为了用于本文所述的方法中,免疫毒素包含融合于pe38截短的假单胞菌属外毒素的单链可变区抗体。在一些方面,单链可变区抗体具有seq id no:1-6所示的cdr1、cdr2和cdr3区或其抗原结合片段。“其抗原结合片段”是指这样的肽,其特异性且选择性结合egfrwt和egfrviii,包含两个或更多个被鉴定为seq id no:1-6的cdr,优选seq id no:1-6的三个或更多个cdr,或seq id no:1-6的四个或更多个cdr,或者seq id no:1-6的五个或更多cdr。例如,其抗原结合片段可以包含:(a)seq id no:7的v
h
链,(b)seq id no:9的v
l
链,(c)seq id no:7和seq id no:9的通过合适的接头连接的v
h
链和v
l
链,(d)seq id no:7和seq id no:9的通过接头seq id no:8连接的v
h
链和v
l
链;(e)来自重链和轻
链的两个或更多个保留了特异性结合egfrwt和egfrviii能力的cdr的任何组合,选自v
h cdr1(seq id no:1)、v
h cdr2(seq id no:2)、v
h cdr3(seq id no:3)以及v
l cdr1(seq id no:4)、v
l cdr2(seq id no:5)和v
l cdr3(seq id no:6);(f)连续包含seq id nos:7-4的肽,和(g)其任何组合。其抗原结合片段中的任一个都可以融合于pe38截短的假单胞菌属外毒素,例如pe38kdel(seq id no:10)。免疫毒素的一个合适的实例提供于seq id no:5(编码该免疫毒素的dna序列见于seq id no:12)或与seq id no:5具有至少90%序列同一性的序列。“选择性”或“特异性”是指单链可变区抗体或其片段能够结合egfrwt和egfrviii(其见于肿瘤细胞上),但不结合正常细胞上发现的其他受体。
[0019]
可以治疗的肿瘤是与d2c7抗体或其抗原结合片段反应的任何肿瘤。这些包括但不限于存在至少一种egfrviii等位基因的那些肿瘤。这些可见于乳腺、头颈、脑、多形胶质母细胞瘤、星形细胞瘤、肺或其他肿瘤中。可期望的是在治疗之前确定这种等位基因的存在。这可以使用基于寡核苷酸的技术例如pcr或使用免疫技术例如免疫组织化学进行。可期望的是确定肿瘤中表达egfr和/或egfrviii的细胞的数量、分数、比率或百分比。在表面上表达egfr的细胞越多,这种抗体疗法可能越有益。由于抗体与野生型egfr结合的能力,即使表达很少甚至不表达egfrviii的肿瘤也可以治疗。任选地,可以在治疗前测试肿瘤与d2c7抗体的反应性。免疫毒素本身可以在治疗之前、治疗期间或治疗之后用作免疫组织化学药剂。为了进行检测,可以将第二试剂与免疫毒素一起使用。例如,它可以识别免疫毒素的假单胞菌属成分。
[0020]
免疫毒素可以通过本领域已知的任何技术来施用。为了避免对表达egfr的正常组织的细胞毒性,隔室递送可以是期望的。合适的隔室递送方法包括但不限于递送至脑,递送至手术产生的肿瘤切除腔,递送至天然肿瘤囊肿以及递送至肿瘤实质。
[0021]
可以通过本发明的方法治疗的肿瘤是任何表达表皮生长因子受体(egfr)的肿瘤,无论是野生型、egfrviii还是其他变体。优选地,肿瘤表达的受体的量远远超过正常组织表达的量。高水平表达的机制可以是通过基因扩增或其他改变来进行,无论是遗传的还是表观遗传的。可以治疗的示例性肿瘤包括但不限于:恶性胶质瘤、乳腺癌、头颈部鳞状细胞癌、肺癌。
[0022]
可以针对任何此类靶标,包括但不限于pd-1、pd-l1、tim-3、lag-3、ctla-4和csf-1r以及这类检查点抑制剂的组合,进行t细胞免疫检查点受体的阻断。免疫检查点受体可以位于免疫细胞上,例如t细胞、单核细胞、小胶质细胞和巨噬细胞,但不限于此。宣称免疫检查点阻断的试剂可以是小的化学实体或聚合物、抗体、抗体片段、单链抗体或其他抗体构建体,包括但不限于双特异性抗体和双抗体(diabody)。
[0023]
可以根据本发明使用的免疫检查点抑制剂是破坏细胞毒性t细胞和肿瘤细胞的抑制性相互作用的任何抑制剂。这些抑制剂包括但不限于抗pd-1抗体、抗pd-l1抗体、抗ctla4抗体、抗lag-3抗体和/或抗tim-3抗体。在美国,已批准的检查点抑制剂包括阿特珠单抗、易普米单抗(ipimilumab)、派姆单抗(pembrolizumab)和纳武单抗(nivolumab)。3期临床试验中的其他抑制剂包括替雷利珠单抗(tislelizumab)。抑制剂不必是抗体,而可以是小分子或其他聚合物。如果抑制剂是抗体,则其可以是多克隆、单克隆、片段、单链或其他抗体变体构建体。抑制剂可以靶向本领域已知的任何免疫检查点,包括但不限于ctla-4、pdl1、pdl2、pd1、b7-h3、b7-h4、btla、hvem、tim3、gal9、lag3、vista、kir、2b4、cd160、cgen-15049、chk1、
chk2、a2ar和b-7配体家族。可以使用针对单个靶免疫检查点的抑制剂的组合或针对不同免疫检查点的不同抑制剂。另外,csf-1r阻断可与免疫检查点抑制剂组合使用或用作免疫检查点抑制剂的替代选项,以确保产生有效消除远处转移和复发性肿瘤的有效且持久的免疫力。对csf-1r具有特异性的抗体或抑制或阻断csf-1r的药物可用于此目的,包括但不限于艾马妥珠单抗(emactuzumab)和amg820。检查点抑制剂可商购获得,并且是本领域已知的。例如,替西利姆单抗(tremelimumab),其是抗ctl4抗体,可从medimmune(astrazeneca)获得,并描述于美国专利号6682736和欧洲专利号1141028中;阿特珠单抗是可从genentech,inc.(roche)获得,并描述于美国专利号8217149中的抗pd-l1;易普米单抗是可从bristol-myers squibb co.获得的抗ctla-4,并尤其描述于美国专利号7605238、6984720、5811097和欧洲专利号ep1212422中;派姆单抗是可从merck and co获得并描述于美国专利号8952136、83545509、8900587和ep2170959中的抗pd-1抗体;纳武单抗(nivolumab)是可从bristol-myers squibb co获得的抗pd-1抗体,并描述于美国专利号7595048、8728474、9073994、9067999、8008449和8779105中;替雷利珠单抗可从beigene获得,并描述于美国专利号8735553中;等等。
[0024]
在组合疗法可与免疫毒素一起使用的csf-1r抑制剂的实例包括但不限于临床开发中的以下药剂:plx3397、plx486、rg7155、amg820、arry-382、fpa008、imc-cs4、jnj-40346527和mcs110。这些csf-1r抑制剂可商购获得,例如艾马妥珠单抗(rg7155),其是结合酪氨酸激酶受体集落刺激因子1受体(csf1r)的人源化单克隆抗体,可从genentech/roche获得并描述于us20110165156、美国专利号9499624、9499626和9499625中;amg820,其是抗csf1单克隆抗体,可从amgen获得并描述于8182813中;plx3397(培西达替尼(pexidartinib),即5-[(5-氯代-1h-吡咯[2,3-b]吡啶-3-基)甲基]-n-{[6-(三氟甲基)-3-吡啶基]甲基}-2-吡啶胺)和plx7486,其是csf-1r的抑制剂,可从plexxikon获得;arry-382,其是csf1r激酶抑制剂,可从array biopharma inc.获得,fpa008(卡比拉单抗(cabiralizumab)),可从five prime therapeutics获得并描述于wo2016106180;imc-cs4,其是抗csf1r抗体,可从imclone(eli lilly子公司)获得并描述于wo2011123381中;jnj-40346527,其是抗csfr1抗体(也称为埃克替尼(edicotinib),即小分子4-氰基-1h-咪唑-2-羧酸n-(2-(4,4-二甲基环己-1-烯基)-6-(2,2,6,6-四甲基四氢吡喃-4-基)吡啶-3-基)酰胺),可从medkoo biosciences获得,以及mcs110,其是抗m-csf单克隆抗体,也称为lacnotuzumab,可从novartis获得并描述于pct专利公开wo2007016240a2中,等等。
[0025]
在新辅助疗法的方法中,在个体经历肿瘤负荷减轻之前,施用治疗有效量的一种或多种免疫治疗剂(靶向egfrwt和egfrviii的免疫毒素,或免疫毒素和免疫检查点抑制剂)。通常,在使用两种免疫治疗剂时,治疗剂彼此会在几天之内施用。例如,施用免疫检查点抑制剂,然后在施用免疫检查点抑制剂后30、28、21、14、10、9、8、7、6、5、4、3、2或1天后施用免疫毒素。或者,在施用免疫检查点抑制剂之前施用免疫毒素可能是有利的,其中然后在接受免疫毒素后的几天内将免疫检查点抑制剂施用于个体。免疫毒素引发细胞毒性t淋巴细胞反应可能需要约5天到约14天。检查点抑制剂的给药可以有利地在该引发期之前、之中或之后开始。可以通过本领域已知的用于具体抑制剂的任何适当方式来施用免疫检查点抑制剂。这些方式包括静脉内、口服、腹膜内、舌下、鞘内、腔内、肌肉内和皮下。
[0026]
任何人类肿瘤都可以通过这种新辅助疗法的方法来治疗,包括小儿肿瘤和成人肿
瘤。肿瘤可以在任何器官中,例如脑、前列腺、乳腺、肺、结肠和直肠。可以治疗各种类型的肿瘤,包括例如胶质母细胞瘤、髓母细胞瘤、癌、腺癌等。肿瘤的其他实例包括肾上腺皮质癌、肛门癌、阑尾癌、i级(间变性)星形细胞瘤、ii级星形细胞瘤、iii级星形细胞瘤、iv级星形细胞瘤、中枢神经系统非典型畸胎瘤/横纹样瘤、基底细胞癌、膀胱癌、乳腺肉瘤、支气管癌、支气管肺泡癌、宫颈癌、颅咽管瘤、子宫内膜癌、子宫内膜子宫癌、室管膜母细胞瘤、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤因氏肉瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、纤维组织细胞瘤、胆囊癌、胃癌、胃肠道类癌瘤、胃肠道间质瘤、妊娠滋养细胞瘤、妊娠滋养细胞瘤、胶质瘤、头颈癌、肝细胞癌、肝门部胆管癌、下咽癌、眼内黑素瘤、胰岛细胞瘤、卡波西肉瘤、朗格汉斯细胞组织细胞增生症、大细胞未分化肺癌、喉癌、唇癌、肺腺癌、恶性纤维组织细胞瘤、髓上皮瘤、黑素瘤、merker细胞癌、间皮瘤、内分泌腺瘤、鼻腔癌、鼻咽癌、神经母细胞瘤、口腔癌、口咽癌、骨肉瘤、卵巢透明细胞癌、卵巢上皮癌、卵巢生殖细胞瘤、胰腺癌、乳头瘤病、副鼻窦癌、甲状旁腺癌、阴茎癌、咽喉癌、松果体实质肿瘤、松果体母细胞瘤、垂体瘤、胸膜肺母细胞瘤、肾细胞癌、具有15号染色体变化的呼吸道癌、视网膜母细胞瘤、横纹肌肉瘤、唾腺癌、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、鳞状非小细胞肺癌、鳞颈癌(squamous neck cancer)、幕上原始神经外胚层肿瘤、幕上原始神经外胚层肿瘤、睾丸癌、喉癌、胸腺癌、胸腺瘤、甲状腺癌、肾盂癌、尿道癌、子宫肉瘤、阴道癌、外阴癌和肾母细胞瘤。肿瘤负荷减轻是指肿瘤疗法的去除(例如,手术或“切除术”)或破坏(例如,放射疗法)全部或大量肿瘤(减瘤),从而减少剩余的肿瘤量。
[0027]
新辅助疗法包括施用靶向egfrwt和egfrviii的免疫毒素,或免疫毒素和一种或多种免疫检查点抑制剂,随后手术切除肿瘤或减轻肿瘤负荷,除了该新辅助疗法外,个体的治疗还可以包括一种或多种化学疗法、生物疗法和放射疗法。这些方式可能是目前用于某些人类肿瘤的护理标准。可以在用于治疗肿瘤的护理标准之前、过程中或之后施用新辅助疗法。例如,可以在护理标准失败后施用包含新辅助疗法的免疫毒素和免疫检查点抑制剂的组合。当指定组合时,该组合可以单一组合方案中的两个单独的药剂单独适时施用。或者,可以将两种(或多种)药剂混合施用。
[0028]
免疫毒素可以直接杀伤表达高水平靶向肿瘤抗原的癌细胞。免疫毒素单一疗法可以在免疫受损小鼠的异种移植恶性脑瘤模型中有效且直接地破坏表达诸如pdpn、egfrwt和/或其截短的变体egfrviii等靶向表位的肿瘤细胞。免疫毒素疗法可以在小鼠胶质瘤模型和其他肿瘤模型中诱导再次抗肿瘤免疫应答,这与直接杀伤机制不同,并且需要免疫系统的配合。由于恶性脑瘤始终是异质团块,由于缺乏表位,一些肿瘤细胞有可能逃避免疫毒素疗法的直接靶向攻击。因此,免疫毒素刺激的再次抗肿瘤免疫应答可以在消除那些未被直接靶向的肿瘤细胞中起重要作用。
[0029]
最近,数项研究成功地证明,通过抑制诸如ctla4和pd1等共抑制分子,在鼠胶质瘤模型中实现了肿瘤消退并提高了存活率。基于有希望的临床前数据,一些临床试验已开始研究利用免疫检查点抑制剂作为单一疗法或与其他抗肿瘤剂的组合疗法来治疗恶性脑瘤。
[0030]
但是,与诸如黑色素瘤和nsclc等其他对免疫疗法反应良好的肿瘤相比,包括胶质母细胞瘤在内的恶性胶质瘤的突变率相对较低,而相对较低的突变率产生的抗原较少和微不足道,从而导致基础免疫原性相对较差。因此,使用免疫毒素和免疫检查点抑制剂的靶向细胞毒性免疫疗法的组合可以提供协同抗肿瘤作用。
[0031]
期望的组合治疗方法可以具有较低剂量的包含免疫毒素的靶向细胞毒性免疫疗法,以限制其副作用并获得长期抗肿瘤免疫力。免疫毒素疗法可以通过其独特的细胞毒性机制有效且直接地杀伤表达高水平靶向抗原的癌细胞。被局部免疫毒素疗法破坏的癌细胞释放肿瘤抗原和/或其他新抗原。然后,这些抗原可以由apc呈递给局部引流淋巴结中的t细胞,后者激活ctl迁移并消除在肿瘤部位表达特定肿瘤抗原的剩余或复发性肿瘤细胞。在此整个过程中,t细胞与apc之间和/或t细胞与肿瘤细胞之间的各种共抑制性检查点途径可以触发不同的机制来使t细胞失活,并调节抗肿瘤免疫力的持续性和强度。免疫检查点抑制剂,例如抗ctla4和抗pd1 mab,可以阻断这些免疫抑制途径,因此增加由靶向免疫毒素疗法激活的淋巴细胞引起的肿瘤细胞死亡。
[0032]
虽然相信肿瘤学和医学领域的普通技术人员会充分理解描述本发明时所用的术语,但是为了方便本发明的描述,并且为了提供使用术语的说明性实例,阐述了本文提供的定义
[0033]
本文所用术语“一(a/an)”和“该/所述”表示“一个/种或多个/种”,除非明确指定单数(例如,在短语“单个药剂”中明确指定单数)。
[0034]
本文所用术语“药学上可接受的载体”是指可用于本文所述组合物或组合的给药、递送、储存、稳定性中的任何一种或多种的任何化合物或组合物或载体介质。本领域已知,这些载体包括但不限于制药领域众所周知的稀释剂、水、盐水、合适的载剂(例如脂质体、微粒、纳米颗粒、乳剂、胶囊)、缓冲剂、示踪剂、医药肠胃外媒介物、赋形剂、水溶液、悬浮液、溶剂、乳液、洗涤剂、螯合剂、增溶剂、盐、着色剂、聚合物、水凝胶、表面活性剂、乳化剂、佐剂、填充剂、防腐剂、稳定剂、油、粘合剂、崩解剂、吸收剂、调味剂等。
[0035]“新辅助疗法”在本文中用来表示,在荷瘤个体经历除去或减轻肿瘤量的手术或者减轻肿瘤负荷的其他治疗之前,给予该个体的抗癌疗法。手术可以包括肿瘤的全部切除或部分切除。新辅助疗法可以减轻肿瘤负荷,从而有助于后续切除。
[0036]“辅助疗法”在本文中用来表示,首先在进行切除肿瘤的手术或其他减轻肿瘤负荷的方法之后施用癌症疗法。
[0037]“维持疗法”在本文中用来表示,为了降低疾病进展或复发的可能性而给予的治疗方案。可以根据评估对疗法的反应的临床参数的评估,提供任何时间长度的维持疗法。
[0038]
在本文中“存活率”用来表示治疗后仍存活的个体,包括总存活率和无病存活率。存活率通常通过kaplan-meier方法来测量。无病存活率是指在没有癌症复发迹象的情况下仍然存活的治疗个体。总存活率是指在规定的时间内仍然存活的个体。
[0039]
以上公开内容总体上描述了本发明。通过参考以下具体实施例可以获得更完整的理解,本文提供的这些具体实施例仅出于说明的目的,而无意限制本发明的范围。
[0040]
实施例1
[0041]
仅使用免疫毒素d2c7-it对患有肿瘤的个体进行i期临床试验。肿瘤为复发性胶质母细胞瘤(gbm),肿瘤切除后(辅助疗法)仅施用d2c7-it。截至2018年4月11日,单次瘤内施用d2c7-it的i期剂量递增试验已治疗了41名患者。已研究了十七种剂量水平(剂量水平1=40ng/ml)。剂量水平17(35,032ng/ml)被确定为剂量限制。目前正针对剂量水平16(23,354ng/ml)招募其他患者,以确认中位耐受剂量(2期剂量)。自d2c7-it输注以来,超过32.7个月后,剂量水平2(80ng/ml)的一名患者无需其他治疗便保持不生病。此外,在以剂量水平
10(2,050ng/ml)治疗的一名患者和以剂量水平13(6,920ng/ml)治疗的一名患者中,现在分别在治疗后多于12.8和6.8个月,在无其他治疗的情况下观察到肿瘤反应。现已死亡的三名患者存活了23.7个月、23.2个月和21.4个月。肿瘤内输注d2c7-it后,又有两名患者存活超过18.9个月和18.2个月。
[0042]
实施例2
[0043]
d2c7-(scdsfv)-pe38kdel免疫毒素的构建、表达和纯化。将d2c7 vh结构域的羧基末端通过15个氨基酸的肽(gly4ser)3接头连接于vl结构域的氨基末端。为了获得稳定的it,必须确保在复性过程中vh位于vl附近。这通过将每条链中的单个关键残基突变为半胱氨酸以使二硫键形成稳定来实现。基于使用分子模型进行的预测和利用其他dsfv重组it的经验数据,我们在每条链中选择一个氨基酸突变为半胱氨酸。这些是vh的框架区2(fr2)中的残基44和vl的fr4中的残基100(根据kabat编号)。因此,我们制备了同时包含肽接头和由半胱氨酸残基产生的二硫键的fv,该半胱氨酸残基取代了vh的ser44和vl的gly100。然后将d2c7(scdsfv)pcr片段融合于假单胞菌属外毒素a结构域ii和iii的dna上。此处使用的假单胞菌属外毒素a的版本即pe38kdel具有增加其细胞内滞留性,进而增强其细胞毒性的修饰的c末端。使d2c7-(scdsfv)-pe38kdel(dna序列seq id no:12)在t7启动子的控制下在e.coli中表达,并作为包涵体收获。
[0044]
实施例3
[0045]
本实施例说明了癌症的辅助疗法。建立了过表达d2c7-it抗原小鼠egfrviii(dmegfrviii)的小鼠胶质瘤系ct-2a-dmegfrviii-luc。分别通过流式细胞术和体外细胞毒性试验测定了d2c7-it对ct-2a-dmegfrviii-luc(经修饰表达萤火虫荧光素酶或“ffluc”的肿瘤细胞)的反应性和疗效。通过流式细胞术进一步分析了ct-2a-dmegfrviii-luc的mhc i类和pd-l1表达。在颅内携带ct-2a-dmegfrviii-luc胶质瘤的c57bl/6免疫活性小鼠中评估了d2c7-it或αctla-4或αpd-1单一疗法或d2c7-it+αctla-4或d2c7-it+αpd-1组合疗法的体内疗效。对于肿瘤的这种辅助治疗,将60只小鼠随机分为6个治疗组(载剂对照、d2c7-it、αpd-1、αctla-4、d2c7-it+αpd-1和d2c7-it+αctla-4,10-12只小鼠/组),并从6-9天开始通过对流增强递送(ced)用总剂量为0.1μg的d2c7-it/载剂对照进行治疗。植入ct-2a-dmegfrviii-luc后,在第6、9、12、15和18天,通过腹膜内注射递送五剂250μg/剂量的大鼠igg2a同种型对照抗体、αpd-1抗体或100μg/剂量的αctla-4抗体。通过针对特定神经系统终点(痫样发作、重复转圈(repeating circling)或其他细微变化,例如食欲下降)或死亡的时间增加百分比来评估颅内(ic)肿瘤对治疗的抗肿瘤反应。每天两次观察动物的痛苦或神经系统症状发展的迹象,此时,对小鼠实施安乐死。在d2c7-it+αpd-1组合治疗组中观察到显著的肿瘤生长延迟(中位存活增加120%)和治愈率(4/12小鼠),并且在d2c7-it+αctla-4组合治疗组中观察到显著的肿瘤生长延迟(中位存活增加80%)(图1)。
[0046]
重复此实验,但有以下更改。d2c7-it用于与其他免疫检查点抑制剂的组合疗法中:抗tim-3抗体(图3,“αtim-3”)、抗lag-3抗体(图3,“αlag-3”)、抗pd-l1抗体(图3,“αpd-l1”)和抗cd73抗体(图3,“αcd73”)。因此,不同的组合疗法包括d2c7-it+αpd-1、d2c7-it+αpd-l1、d2c7-it+αtim-3、d2c7-it+αlag-3以及d2c7-it+αcd73。同样,在施用d2c7-it之前开始使用免疫检查点抑制剂的剂量给药。因此,在第3、6、9、12和15天施用免疫检查点抑制剂;从第6-9天开始施用d2c7-it(如上文针对d2c7-it所述)。如图3所示,与其他疗法和载剂对
照相比,在组合疗法中使用d2c7-it和免疫检查点抑制剂αpd-l1显著提高了存活率。
[0047]
实施例4
[0048]
本实施例说明了个体中肿瘤的新辅助疗法,该疗法包括向该个体施用有效量的免疫毒素(例如,d2c7-it),在该治疗之后,然后减轻该个体的肿瘤负荷。在雌性c57b16/j(≈20g;7-8周)小鼠的右侧腹皮下注射3x106个悬浮在100μl pbs中的ct2a-megfrviii-d2c7-ffluc细胞。当植入的肿瘤达到50-100mm3时,随机选择每组十只小鼠进行载剂给药或新辅助(d2c7-it)给药,并进行减少肿瘤负荷的手术或不进行手术。在第12天(肿瘤接种后),通过单次肿瘤内(i.t.)注射4μg在20μl pbs中稀释的d2c7-(scdsfv)-pe38kdel,治疗测试小鼠。以相同方式处理对照小鼠,并仅用20μl pbs治疗。在肿瘤接种后第18天和新辅助疗法后7天,使一组对照和新辅助疗法小鼠处于未治疗状态,而使另一组对照和新辅助疗法小鼠进行肿瘤部分切除,估计剩余肿瘤的体积为0.5-1.5mm3。使用手持式数字卡尺每周三次测量肿瘤,并使用以下公式以立方毫米为单位计算肿瘤体积:([长度]
×
[宽度2])/2。当肿瘤体积达到1500-2000mm3或发生肿瘤溃疡(开放性疮)时,在研究之外测试动物。如图2所示,在用pbs治疗并且没有随后切除肿瘤的小鼠(
-■-
,pbs+无切除)中,10只小鼠有0只的肿瘤完全消退;在用d2c7-it-治疗并且没有随后切除肿瘤的小鼠(
-▲-
,d2c7-it+无切除)中,10只小鼠中有0只的肿瘤完全消退;在用pbs治疗并随后切除肿瘤的小鼠(
-▼-
,pbs+切除术)中,10只小鼠有2只的肿瘤完全消退;在用d2c7-it-治疗并随后切除肿瘤的小鼠(
-◆-
,d2c7-it+切除术)中,10小鼠有5只的肿瘤完全消退。因此,当使用新辅助疗法治疗荷瘤个体时,观察到肿瘤消退增加的治疗益处。本实施例中新辅助治疗方法的另一个例证是包括施用有效量的免疫检查点抑制剂组合(依次)施用有效量的靶向egfrwt和egfrviii的免疫毒素,二者均在手术切除肿瘤或其他减轻肿瘤负荷的方法之前施用。鉴于仅使用d2c7-it的新辅助方法可带来治疗益处,采用使用d2c7-it和免疫检查点抑制剂的新辅助方法组合免疫检查点抑制剂的治疗益处会是显然的(部分由于来自这种组合疗法观察到的治疗益处)。
[0049]
实施例5
[0050]
提供了治疗患有肿瘤的个体的方法,包括在手术切除肿瘤之前向该个体施用治疗有效量的靶向egfrwt和egfrviii的免疫毒素,然后进行手术以从该个体切除肿瘤。新辅助疗法的这种方法还可以进一步包括在切除肿瘤之前向患有肿瘤的个体施用治疗有效量的免疫检查点抑制剂。例如,在开始抗pd-1抗体治疗几天后,然后肿瘤内施用免疫毒素(d2c7-it)(对于患有胶质母细胞瘤的个体而言,会用输注进行肿瘤内给药)。免疫毒素给药后一周后,向个体施用另一剂量的免疫检查点抑制剂(例如,抗pd-1抗体,240mg)。免疫毒素给药后三周后,向个体施用另一剂量的免疫检查点抑制剂(例如,抗pd-1抗体,240mg)。免疫毒素给药后四周后,手术切除肿瘤。免疫毒素给药后五周后,且手术切除后1周后,向个体施用另一剂量的免疫检查点抑制剂(例如抗pd-1抗体,240mg)。免疫毒素给药后7、9、11和13周后,向个体施用另一剂量的免疫检查点抑制剂(例如抗pd-1抗体,240mg)。然后可以根据医学需要进行包括施用免疫检查点抑制剂的维持疗法。例如,在免疫毒素给药后的第17、21、25周和每隔4周直至~101周,可以施用免疫检查点抑制剂,例如,可以每2周一次施用240mg抗pd-1抗体,持续4个月,然后每4周一次施用480mg,最多2年。
[0051]
序列表声明
[0052]
文本格式的序列表是同时提交的,并且通过引用并入,作为本申请的一部分。序列
表提供了免疫毒素成分的氨基酸序列和核酸序列。具体而言,序列表提供了:v
h cdr1的氨基酸序列(seq id no:1)、v
h cdr2的氨基酸序列(seq id no:2)、v
h cdr3的氨基酸序列(seq id no:3)、v
l cdr1的氨基酸序列(seq id no:4)、v
l cdr2的氨基酸序列(seq id no:5)以及v
l cdr3的氨基酸序列(seq id no:6)的氨基酸序列;可变重链(v
h
)的氨基酸序列(seq id no:7)、可变轻链(v
l
链)的氨基酸序列(seq id no:9)、如seq id no:8的连接v
h
和v
l
链的适当氨基酸接头;免疫毒素d2c7-scdsfv-pe38kdel的完整氨基酸序列(seq id no:5)和编码完整免疫毒素d2c7-scdsfv-pe38kdel的核酸序列(seq id no:12);以及d2c7-scdsfv部分的核酸序列(seq id no:13)和pe38kdel部分的核酸序列(seq id no:14)。
[0053]
本领域的技术人员应当容易地理解,本公开非常适合于实现所述目的并获得结果和优点以及其中固有的结果和优点。本文描述的本公开目前代表优选的实施方案,是示例性的,并且无意限制本公开的范围。本领域技术人员会想到其中的变化和其他用途,这些变化和其他用途包含在权利要求书范围所限定的本公开的精神内。
[0054]
不承认本说明书中引用的任何参考文献,包括任何非专利文献或专利文献,构成现有技术。特别是,应当理解的是,除非另有说明,否则本文对任何文件的引用并不构成对这些文献中的任何文献构成美国或任何其他国家的本领域公知常识的一部分的承认。对参考文献的任何讨论均陈述了其作者的主张,并且申请人保留对本文引用的任何文献的准确性和相关性提出质疑的权利。除非另外明确指出,否则本文引用的所有参考文献通过引用完全并入。在所引用的参考文献中发现的任何定义和/或描述之间存在任何差异的情况下,以本公开为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1