多价流感纳米颗粒疫苗的制作方法
多价流感纳米颗粒疫苗
1.相关申请的交叉引用
2.本申请根据美国法典第35篇第119条(e)款,要求2018年3月19日提交的美国临时专利申请号62/644,623和2019年1月3日提交的美国临时专利申请号62/787,980的权利,所述专利申请中的每一项的内容出于所有目的以引用的方式整体并入本文。
3.本申请还将2016年9月6日提交的美国申请号15/257,436和2017年11月21日提交的美国申请号15/819,962的内容出于所有目的以引用的方式整体并入本文。
技术领域
4.本公开总体涉及可用于刺激针对流感的免疫反应的流感疫苗组合物。
背景技术:
5.季节性流感所造成的全球沉重负担已得到充分证明。仅在美国,每年约有140,000至10,000例住院治疗和12,000至56,000例死亡可归因于流感,其中老年人的占比较大,62%的住院治疗和72%的死亡率。季节性流感疫苗接种一直是预防工作的主要内容,并且自2010年以来已在美国普遍推荐。
6.然而,最近的事态发展,包括在美国流感季节占主导的严重的2017
‑
2018 a(h3n2),说明至少在澳大利亚、加拿大和美国,疫苗效力不佳。其他问题,诸如与基于鸡蛋的流感疫苗相关的抗原错配,以及抗原漂移的持续挑战,也都意味着需要提供更有效的疫苗接种策略。
7.因此,对生产针对流感病毒的疫苗有持续的兴趣,并且仍然需要生产有效的疫苗,特别是使用无重组鸡蛋蛋白的方法。
技术实现要素:
8.本公开提供了多价流感组合物。组合物刺激针对多种流感菌株的免疫反应。有利地,免疫反应可包括针对与那些用于制备组合物的菌株不同的菌株的变体的广泛中和抗体。流感突变导致“漂移菌株”,并且所公开的组合物提供针对“漂移菌株”的保护。此外,组合物表现出优良的稳定性,可以长期储存,并且可以在准备施用的预填充注射器中生产。在一些方面,预填充注射器(pfs)可能已经包含佐剂和流感抗原,并且可以长期储存。本文公开的组合物不需要冷藏(2
‑
8℃),在较高温度(例如室温,约25℃)下显示出良好的稳定性。因此,本文公开的组合物提供了极佳的便利性以及极佳的免疫反应。
9.在特定方面,在向受试者施用前,将含有流感抗原的纳米颗粒通过与iscom基质佐剂(在本文中也称为“基质”)混合一段时间以形成hasman(血凝素皂苷基质纳米颗粒),来共配制为疫苗组合物。含有hasman的组合物表现出良好的稳定性和免疫原性,并且因此很适合例如在预填充注射器中包装。实际上,hasman比洗涤剂核心纳米颗粒更稳定。hasman通过差示扫描量热法测量的热稳定性与洗涤剂核心纳米颗粒相比要好约1度。以前,使用iscom基质佐剂的方法包括在即将施用前将疫苗组合物与佐剂在床边混合。在特定方面,本文公
开的组合物消除了该要求,因此提供了诱导免疫反应的改进方法。令人惊讶地发现,hasman的形成根据流感类型而变化。当组合物含有来自a型流感菌株的血凝素(ha)蛋白时,通常形成hasman,但是当ha蛋白来自b型流感菌株时则不形成hasman。
10.在一些实施方案中,多价流感组合物中的iscom基质佐剂是基质m,其是两种类型的基质的组合,第一种类型是含有皂苷级分a的基质a(在本文中也称为级分a基质),第二种类型是含有皂苷级分c的基质c(在本文中也称为级分c基质)。在某些方面,基质m可包含至少约85%(w/w)级分a基质,剩余部分是级分c基质。除非另有说明,否则本文所用的基质m(在本文中也称为基质m1)以85∶15(w/w)的比率包含级分a基质和级分c基质。
11.在一些实施方案中,四价纳米颗粒流感组合物中的每种流感ha蛋白可以来自不同的流感菌株。在一些实施方案中,至少一种菌株可以是亚型a菌株或亚型b菌株。在一些实施方案中,亚型a菌株可与基质m佐剂复合,但亚型b菌株不与基质m佐剂复合。
12.虽然本公开设想了多价组合物,特别是用于季节性疫苗的多价组合物,但是也可用hasman生产单价疫苗组合物,以用于例如针对不时出现的大流行性流感菌株的疫苗接种。
13.稳定性(尤其是室温稳定性)是一种有价值的特性,因为它减少或消除对冷链储存的需要,使配送更便宜且更容易实现。有利地,本文公开的多价组合物在长时间例如在长达3个月、长达6个月、长达12个月并且在这些时期在室温(即,约25℃)下是稳定的。优异的稳定性(特别是当与基质m佐剂一起配制时)意味着疫苗组合物适合以即用型形式输送到临床环境;例如,预填充注射器制剂。
附图说明
14.图1示出了单独的流感ha洗涤剂核心纳米颗粒(左)、单独的基质m(中)以及ha纳米颗粒和基质m的组合(其形成血凝素皂苷基质纳米颗粒(hasman))(右)的透射电子显微镜(tem)图像的实例。
15.图2示出了在t=0、6个月和12个月时,在4℃下高剂量和低剂量四价床边小瓶制剂(240μg/ml/菌株和60μg/ml/菌株)与有或无基质m的预填充注射器(pfs)制剂(120μg/ml/菌株和30μg/ml/菌株)的流感抗原的还原性sds
‑
page凝胶图像。图中的缩写是pfs:预填充注射器;m1:基质m。
16.图3示出了在时间=0时,在4℃下高剂量床边小瓶制剂(240μg/ml/菌株)与有或无基质m的pfs制剂(120μg/ml/菌株)的流感抗原的非还原性和还原性sds
‑
page凝胶图像。
17.图4示出了在3个月的时间点时,在4℃和25℃下高剂量和低剂量床边小瓶制剂(240μg/ml/菌株和60μg/ml/菌株)与有或无基质m的pfs制剂(120μg/ml/菌株和30μg/ml/菌株)的流感抗原的非还原性sds
‑
page凝胶图像。
18.图5示出了在t=0、2周、1个月、3个月、6个月、9个月和12个月时,在2
‑
8℃下有或无基质m的pfs制剂120μg/ml/菌株的剂量的a/hong kong、a/michigan、b/brisbane和b/phuket菌株的单次放射免疫扩散测定法(srid)的结果。图中的缩写是mxm:基质m;hk:hong kong;mi:michigan;bris:brisbane;phu:phuket。
19.图6示出了在t=0、2周、1个月、3个月和6个月时,在25℃下有或无基质m的pfs制剂120μg/ml/菌株的剂量的a/hong kong、a/michigan、b/brisbane和b/phuket菌株的srid结
果。
20.图7示出了与施用针对a/hong kong/4801/2014的商业流感疫苗相比,在小鼠中施用quad
‑
niv共制剂或者有或无基质m的床边混合制剂的血凝抑制抗体反应。抗体反应以hai效价表示。图中的缩写是hai:血凝抑制;ha:血凝素;co
‑
form:共制剂;quad
‑
niv:四价纳米颗粒流感疫苗;qiv:四价流感疫苗。
21.图8示出了与施用商业流感疫苗相比,在小鼠中施用quad
‑
niv共制剂或者有或无基质m的床边混合制剂的针对a/michigan/45/2015的血凝抑制抗体反应。
22.图9示出了与施用商业流感疫苗相比,在小鼠中施用quad
‑
niv共制剂或者有或无基质m的床边混合制剂的针对b/brisbane/60/2008的血凝抑制抗体反应。
23.图10示出了与施用商业流感疫苗相比,在小鼠中施用quad
‑
niv共制剂或者有或无基质m的床边混合制剂的针对b/phuket/3073/2013的血凝抑制抗体反应。
24.图11示出了在小鼠中施用针对a/hong kong/4801/2014、a/michigan/45/2015、b/brisbane/60/2008和b/phuket/3073/2013的quad
‑
niv预混合制剂或有基质m的床边混合制剂的血凝抑制抗体反应。将pfs制剂在4℃下储存3个月。对于床边混合疫苗,将病毒抗原在
‑
60℃下储存3个月,并且就在施用前与基质m佐剂混合。抗体反应以hai gmt效价表示。gmt结果使用95%控制下限和95%控制上限。图中的缩写是hai:血凝抑制;ha:血凝素;gmt:几何平均效价;lcl:控制下限;ucl:控制上限。
25.图12示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/michigan菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
26.图13示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/michigan菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
27.图14示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/hong kong/4801/2014的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
28.图15示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/hong kong菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
29.图16示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/brisbane菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
30.图17示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/brisbane菌株的血凝抑制抗体反应。抗体反应以hai效价表示。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
31.图18示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/phuket菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
32.图19示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/
ml)的床边混合制剂的针对b/phuket菌株的血凝抑制抗体反应。抗体反应以hai效价表示。将预混合的quad
‑
niv共制剂在指定温度下储存6个月。
33.图20示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/hong kong/4801/2014的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
34.图21示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/hong kong菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
35.图22示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/michigan菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
36.图23示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对a/michigan菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
37.图24示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/brisbane菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
38.图25示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/brisbane菌株的血凝抑制抗体反应。抗体反应以hai效价表示。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
39.图26示出了在21天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/phuket菌株的血凝抑制抗体反应。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
40.图27示出了在35天时,在小鼠中施用quad
‑
niv共制剂或者有或无基质m(100μg/ml)的床边混合制剂的针对b/phuket菌株的血凝抑制抗体反应。抗体反应以hai效价表示。将预混合的quad
‑
niv共制剂在4℃下储存12个月。
41.图28示出了在t=0、3个月、6个月、9个月或12个月时,在4℃下quad
‑
niv pfs制剂(120μg/ml)和t=3个月、6个月、9个月或12个月时,在4℃下使用100μg/ml基质m1的quad
‑
niv pfs制剂的auc沉降曲线。
42.图29示出了在研究开始(t0)、1个月、3个月和6个月时,有或无基质m1(100μg/ml)的quad
‑
niv pfs制剂的分析离心(auc)沉降曲线。将制剂在25℃下孵育。
43.图30示出了没有孵育时(t=0)的仅高剂量quad
‑
niv(120μg/ml/菌株)、仅基质m(100μg/ml)、高剂量quad
‑
niv+基质m和低剂量quad
‑
niv(30μg/ml/菌株)+基质m(100μg/ml)的tem图像。
44.图31示出了在4℃或25℃下高剂量quad
‑
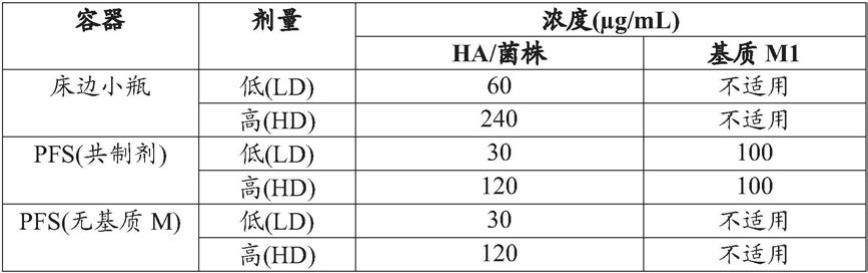
niv(120μg/ml/菌株)+基质m(100μg/ml)与在4℃或25℃下低剂量quad
‑
niv(30μg/ml/菌株)+基质m(100μg/ml)的tem图像。将所有样品孵育4小时。
45.图32示出了在4℃或25℃下高剂量quad
‑
niv(120μg/ml/菌株)+基质m(100μg/ml)与在4℃或25℃下低剂量quad
‑
niv(30μg/ml/菌株)+基质m(100μg/ml)的tem图像。将所有样
品孵育24小时。示例性的hasman被圈出。
46.图33示出了在4℃或25℃下高剂量quad
‑
niv(120μg/ml/菌株)+基质m(100μg/ml)与在4℃或25℃下低剂量quad
‑
niv(30μg/ml/菌株)+基质m(100μg/ml)的tem图像。将所有样品孵育48小时。示例性的hasman被圈出。
47.图34示出了在4℃或25℃下高剂量quad
‑
niv(120μg/ml/菌株)+基质m(100μg/ml)与在4℃或25℃下低剂量quad
‑
niv(30μg/ml/菌株)+基质m(100μg/ml)的tem图像。将所有样品孵育7天。示例性的hasman被圈出。
48.图35示出了在各种温度(2
‑
8℃、25℃和37℃)下孵育1个月的有或无基质m(100μg/ml)的低剂量pfs组(30μg/ml/菌株)的tem图像。
49.图36示出了有或无基质m1(100μg/ml)的120μg/ml/菌株的剂量的quad
‑
niv制剂的dsc曲线。示出了在4℃下孵育3个月、6个月和12个月以及在25℃下孵育3个月和6个月的四价疫苗抗原的摩尔热容(cp:kj/mol.k)。
50.图37示出了使用来自a菌株、b菌株和与foldon融合的c末端修饰a菌株的ha蛋白,通过nha(即洗涤剂核心纳米颗粒)的减少所测量的hasman的形成。
具体实施方式
51.定义
52.除非上下文另有明确规定,否则在本文和所附权利要求中使用的单数形式“一个”、“一种”和“所述”包括复数个指示物。因此,例如,提及“蛋白质”可以指一种蛋白质或此类蛋白质的混合物,并且提及“所述方法”包括提及等效步骤和/或本领域技术人员已知的方法等等。
53.如本文所用,术语“佐剂”是指当与免疫原组合使用时,增大或以其他方式改变或修饰针对免疫原诱导的免疫反应的化合物。免疫反应的修饰可包括增强或扩大抗体和细胞免疫反应中任一者或两者的特异性。
54.如本文中所用,术语“约”或“大约”当在数值之前时,表明数值加或减10%的范围。例如,“约100”涵盖90和110。
55.如本文所用,术语“免疫原”、“抗原”和“表位”是指能够引发免疫反应的物质,诸如蛋白质(包括糖蛋白)和肽。
56.如本文所用,“免疫原性组合物”是包含抗原的组合物,其中向受试者施用所述组合物会导致受试者对抗原的体液和/或细胞免疫反应的发生。
57.如本文所用,“quad
‑
niv”、“quadniv”或“四价纳米颗粒流感疫苗”是指包含来自四种流感菌株的抗原的流感疫苗制剂。
58.如本文所用,术语“床边混合物”、“床边制剂”、“床边疫苗组合物”、“床边小瓶”、“床边小瓶制剂”是指在即将施用前制备的疫苗制剂。此类疫苗制剂包含病毒抗原和佐剂,其分别储存在不同的容器中并向受试者施用(例如,施用两次连续注射,或施用前将抗原和佐剂混合成一次注射)。
59.如本文所用,术语“共制剂混合物”、“共制剂”、“共制剂疫苗组合物”、“预填充注射器”、“预混合物”是指在向受试者施用的时间之前经制备后进行短期至长期储存的疫苗制剂。此类疫苗制剂在同一容器中包含流感抗原和iscom基质佐剂的组合,并且其在足以形成
hasman(血凝素皂苷基质纳米颗粒)的条件下制备。
60.如本文所用,术语“治疗(treat)”、“治疗(treatment)”和“治疗(treating)”是指用于获得有益或期望的结果(例如临床结果)的方法。出于本公开的目的,有益或期望的结果可包括抑制或压制感染或疾病的起始或进展;改善感染或疾病的症状或减少其发生;或其组合。
61.如本文所用,“预防(prevention)”与“预防(prophylaxis)”可互换使用,并且可意指完全预防感染或疾病,或预防此感染或疾病的症状发生;延迟感染或疾病或其症状的发作;或降低随后发生的感染或疾病或其症状的严重性。
62.如本文所用,“有效剂量”或“有效量”是指足以诱导减少至少一种病原体感染症状的免疫反应的免疫原的量。有效剂量或有效量可例如通过测量中和分泌抗体和/或血清抗体的量(例如,通过噬菌斑中和、补体固定、酶联免疫吸附(elisa)、微量中和测定法和hai效价)来测定。
63.如本文所用,术语“疫苗”是指免疫原性组合物,诸如源自病原体的免疫原,其用于诱导提供保护性免疫(例如,保护受试者免受病原体感染和/或降低由病原体感染引起的疾病或病状的严重性的免疫)的针对病原体的免疫反应。保护性免疫反应可包括抗体和/或细胞介导的反应的形成。根据上下文,术语“疫苗”也可以指向受试者施用以产生保护性免疫的免疫原的混悬液或溶液。
64.如本文所用,术语“受试者”包括人和其他动物。通常,受试者是人。例如,受试者可以是成人、青少年、儿童(2岁至14岁)、婴儿(1个月至24个月)或新生儿(至多1个月)。在一些方面,成年人是约65岁或以上,或约60岁或以上的老年人。在典型的方面,成年人是约60至约小于75岁,或至少约75岁的成年人。在一些方面,受试者是孕妇或打算怀孕的妇女。在其他方面,受试者不是人;例如,是非人灵长类动物;例如,狒狒、黑猩猩、大猩猩或猕猴。在某些方面,受试者可以是宠物,诸如狗或猫。
65.如本文所用,术语“药学上可接受的”意指由美国联邦或州政府的监管机构批准的或者在美国药典、欧洲药典或其他通常认可的药典上列出,以用于动物并且更具体地为用于人。这些组合物可用作在脊椎动物中诱导保护性免疫反应的疫苗和/或抗原组合物。
66.纳米颗粒:结构和形态
67.本文公开的组合物包含两种类型的纳米颗粒。第一种类型称为洗涤剂核心纳米颗粒,基本上如先前所描述。参见美国序列号15/257,436,其出于所有目的以引用的方式并入本文。简而言之,通过使用杆状病毒表达系统表达ha蛋白,然后用洗涤剂提取ha蛋白,在昆虫细胞中产生这些纳米颗粒。在纯化过程中,将第一洗涤剂换成第二洗涤剂(通常是非离子型洗涤剂),从而生成具有非离子型洗涤剂核心的纳米颗粒,ha蛋白的末端部分以三聚体形式嵌入其中。图1(左图)示出了如在电子显微镜下观察到的这些结构。
68.第二种类型的纳米颗粒在本文中称为hasman(血凝素皂苷基质纳米颗粒)。图1(右图)示出了如在电子显微镜下观察到的这些结构。ha糖蛋白修饰基质笼状结构。hasman结构是通过制备ha纳米颗粒、然后将其与iscom基质佐剂颗粒一起孵育一段时间来形成。iscom基质颗粒如图1的中心图中所示。值得注意的是,hasman容易由a型流感ha蛋白形成,但不易由b型流感ha蛋白形成。因此,在特定方面,包含具有来自a型和b型的ha蛋白的纳米颗粒的组合物将含有这两个类型的纳米颗粒(即,洗涤剂核心纳米颗粒和hasman)。在一些方面,纳
米颗粒将在两种状态之间过渡,并且因此组合物可包含过渡纳米颗粒。
69.在特定实施方案中,洗涤剂核心纳米颗粒由围绕非离子型洗涤剂核心的多个蛋白三聚体组成。例如,每个纳米颗粒可包含1、2、3、4、5、6、7、8、9、10、11、12或15个三聚体。在一些实施方案中,每个纳米颗粒包含2至6个三聚体。在特定实施方案中,每个纳米颗粒包含2至9个三聚体。
70.ha蛋白与纳米颗粒的含非离子型洗涤剂核心缔合。通常,洗涤剂选自聚山梨酯20(ps20)、聚山梨酯40(ps40)、聚山梨酯60(ps60)、聚山梨酯65(ps65)和聚山梨酯80(ps80)。洗涤剂的存在通过形成组织并呈现抗原的核心来促进纳米颗粒的形成。因此,在某些实施方案中,纳米颗粒包含组装成多寡糖蛋白
‑
ps80蛋白
‑
洗涤剂纳米颗粒的抗原,其头部区域向外突出,并且疏水区域和ps80洗涤剂形成抗原所围绕的中心核心。在特定实施方案中,流感疫苗组合物中的非离子型洗涤剂是ps80。洗涤剂核心纳米颗粒的z
‑
ave大小范围为约25nm至约30nm。然而,一旦将洗涤剂核心纳米颗粒与基质m混合一段时间,就会形成hasman,并且形成的hasman比洗涤剂核心纳米颗粒稍大,约50nm至60nm。除非另有规定,否则通过使用malvern zetasizer的动态光散射(dls)来测量粒度(z
‑
ave)。
71.纳米颗粒:生产
72.本公开的洗涤剂核心纳米颗粒和hasman是非天然存在的产物,其组分在自然界中不一起存在。总体上,本文公开的方法使用洗涤剂交换方法,其中使用第一洗涤剂分离蛋白质,并且然后将此第一洗涤剂交换为第二洗涤剂以形成纳米颗粒。
73.纳米颗粒中的糖蛋白抗原(通常是ha)通常通过在宿主细胞中重组表达来产生。通常,使用杆状病毒系统在昆虫宿主细胞中表达糖蛋白。在优选的实施方案中,杆状病毒是组织蛋白酶
‑
l敲除型杆状病毒。在其他优选的实施方案中,杆状病毒是几丁质酶敲除型杆状病毒。而在其他优选的实施方案中,杆状病毒是组织蛋白酶
‑
l和几丁质酶两者的双重敲除型。在昆虫细胞表达系统中可获得高水平表达。昆虫细胞的非限制性实例是草地贪夜蛾(spodoptera frugiperda)(sf)细胞(例如sf9、sf21)、粉纹夜蛾(trichoplusia ni)细胞(例如high five细胞)和果蝇(drosophila)s2细胞。优选地,细胞是sf9细胞或其衍生物。
74.典型的转染和细胞生长方法可用于培养细胞。可根据本领域众所周知的方法,将载体,例如,包含编码融合蛋白的多核苷酸的载体转染到宿主细胞中。例如,可以通过磷酸钙共沉淀、电穿孔、显微注射、脂质转染和使用多胺转染试剂的转染来实现将核酸引入真核细胞。
75.生长宿主细胞的方法包括但不限于分批、分批进料、连续和灌注细胞培养技术。细胞培养意指细胞在生物反应器(发酵室)中的生长和繁殖,其中细胞繁殖并表达供纯化和分离的蛋白质(例如重组蛋白)。通常,细胞培养在生物反应器中在无菌、控制温度和大气条件下进行。生物反应器是用于培养细胞的室,其中环境条件诸如温度、大气、搅拌和/或ph值可被监测。在一个实施方案中,生物反应器是不锈钢室。在另一个实施方案中,生物反应器是预灭菌的塑料袋(例如,wave biotech,bridgewater,n.j.)。在其他实施方案中,预灭菌的塑料袋为约50l至约3500l的袋。
76.洗涤剂萃取和纳米颗粒的纯化
77.在宿主细胞生长后,可使用洗涤剂和纯化方案从宿主细胞中收获蛋白质。一旦宿主细胞生长48至96小时,就从培养基中分离细胞,并加入含洗涤剂的溶液以溶解细胞膜,从
而释放蛋白质于洗涤剂萃取液中。triton x
‑
100和tergitol(也称为np
‑
9)均是优选的萃取用洗涤剂。洗涤剂可添加至约0.1%至约1.0%的最终浓度。例如,浓度可以是约0.1%、约0.2%、约0.3%、约0.5%、约0.7%、约0.8%或约1.0%。在某些实施方案中,范围可以是约0.1%至约0.3%。优选地,浓度是约0.5%。
78.在其他方面,不同的第一洗涤剂可用于从宿主细胞中分离蛋白质。例如,第一洗涤剂可以是双(聚乙二醇双[咪唑羰基])(bis(polyethylene glycol bis[imidazoylcarbonyl]))、壬苯醇醚
‑
9(nonoxynol
‑
9)、双(聚乙二醇双[咪唑羰基])、9)、双(聚乙二醇双[咪唑羰基])、十甘醇单十二烷基醚、n
‑
癸酰基
‑
n
‑
甲基葡糖胺、正癸基α
‑
d
‑
吡喃葡糖苷、癸基β
‑
d
‑
吡喃麦芽糖苷、正十二烷酰基
‑
n
‑
甲基葡糖酰胺、正十二烷基α
‑
d
‑
麦芽糖苷、正十二烷基β
‑
d
‑
麦芽糖苷、正十二烷基β
‑
d
‑
麦芽糖苷、七甘醇单癸基醚、七甘醇单十二烷基醚、七甘醇单十四烷基醚、正十六烷基β
‑
d
‑
麦芽糖苷、六甘醇单十二烷基醚、六甘醇单十六烷基醚、六甘醇单十八烷基醚、六甘醇单十四烷基醚、igepal ca
‑
630、igepal ca
‑
630、甲基
‑6‑0‑
(n
‑
庚基氨基甲酰基)
‑
α
‑
d
‑
吡喃葡糖苷、九甘醇单十二烷基醚、n
‑
壬酰基
‑
n
‑
甲基葡糖胺、n
‑
壬酰基
‑
n
‑
甲基葡糖胺、八甘醇单癸基醚、八甘醇单十二烷基醚、八甘醇单十六烷基醚、八甘醇单十八烷基醚、八甘醇单十四烷基醚、辛基
‑
β
‑
d吡喃葡糖苷、五甘醇单癸基醚、五甘醇单十二烷基醚、五甘醇单十六烷基醚、五甘醇单己基醚、五甘醇单十八烷基醚、五甘醇单辛基醚、聚乙二醇二缩水甘油醚、聚乙二醇醚w
‑
1、聚氧乙烯10十三烷基醚、聚氧乙烯100硬脂酸酯、聚氧乙烯20异十六烷基醚、聚氧乙烯20油基醚、聚氧乙烯40硬脂酸酯、聚氧乙烯50硬脂酸酯、聚氧乙烯8硬脂酸酯、聚氧乙烯双(咪唑基羰基)、聚氧化乙烯25丙二醇硬脂酸酯、来自皂皮树属(quillaja)树皮的皂苷、皮的皂苷、15
‑
s
‑
12型tergitol、15
‑
s
‑
30型tergitol、15
‑
s
‑
5型tergitol、15
‑
s
‑
7型tergitol、15
‑
s
‑
9型tergitol、np
‑
10型tergitol、np
‑
4型tergitol、np
‑
40型tergitol、np
‑
7型tergitol、np
‑
9型tergitol、tmn
‑
10型tergitol、tmn
‑
6型tergitol、triton x
‑
100或其组合。
[0079]
然后可以使用离心从细胞碎片中分离出纳米颗粒。在一些实施方案中,可以使用梯度离心,诸如使用氯化铯、蔗糖和碘克沙醇。其他技术可以用作替代或补充,诸如标准纯化技术,包括例如离子交换色谱、亲和色谱和凝胶过滤色谱。
[0080]
例如,第一柱可以是离子交换色谱树脂,诸如emd tmae(emd millipore),第二柱可以是小扁豆(lens culinaris)凝集素亲和树脂,而第三柱可以是阳离子交换柱诸如emd so3(emd millipore)树脂。在其他方面,阳离子交换柱可以是mmc柱或nuvia c prime柱(bio
‑
rad laboratories,inc)。优选地,本文公开的方法不使用洗涤剂萃取柱;例如疏水相互作用柱。这种柱经常在纯化过程中用于去除洗涤剂,但可能对此处公开的方法产生负面影响。
[0081]
洗涤剂交换
[0082]
为了形成洗涤剂核心纳米颗粒,用于从宿主细胞中萃取蛋白质的第一洗涤剂基本上被第二洗涤剂替代,以形成纳米颗粒结构。np
‑
9是优选的萃取洗涤剂。通常,当通过hplc测量时,纳米颗粒不包含可检测的np
‑
9。第二洗涤剂通常选自由ps20、ps40、ps60、ps65和ps80组成的组。优选地,第二洗涤剂是ps80。
[0083]
在特定方面,使用亲和色谱以通过糖蛋白的糖部分结合糖蛋白来进行洗涤剂交换。例如,亲和色谱可以使用豆科凝集素柱。豆科凝集素是最初在植物中鉴定出的蛋白质,并发现其与糖残基特异性且可逆地相互作用。参见,例如,sharon和lis,“legume lectins
‑‑
a large family of homologous proteins,”faseb j.1990年11月;4(14):3198
‑
208;liener,“the lectins:properties,functions,and applications in biology and medicine,”elsevier,2012。适合的凝集素包括伴刀豆球蛋白a(concanavalin a,con a)、豌豆凝集素、红豆草凝集素和小扁豆凝集素。小扁豆凝集素由于其结合特性,是优选的供洗涤剂交换用的柱。凝集素柱是可商购获得的;例如,capto小扁豆凝集素(capto lentil lectin),可从ge healthcare获得。在某些方面,小扁豆凝集素柱可使用重组凝集素。在分子水平上,人们认为糖部分与小扁豆凝集素结合,释放蛋白质的氨基酸以在洗涤剂周围联合,从而形成洗涤剂核心,所述洗涤剂核心提供具有多个抗原拷贝的纳米颗粒,例如糖蛋白寡聚体,其可以是锚定在洗涤剂中的二聚体、三聚体或四聚体。
[0084]
当在洗涤剂交换过程中洗涤剂与蛋白质一起孵育以形成纳米颗粒时,在早期纯化步骤中洗涤剂可以达约0.1%(w/v)存在。
[0085]
通常,流感洗涤剂核心纳米颗粒单独制备为单价单一菌株产品。例如,非离子型洗涤剂(例如,ps80)可以是约0.03%至约0.5%的非离子型洗涤剂。在特定方面,单价药物物质可包含约1.5mg/ml通过a280测量的蛋白质和约0.12%ps80,其提供约40∶1的摩尔比。在特定四价组合物中,通过单次放射免疫扩散测定法(srid)所测量,蛋白质浓度可以是约0.48mg/ml,并且计算出ps80的量是约0.04%。
[0086]
洗涤剂交换可用如上所讨论经纯化的蛋白质进行,并且将所述蛋白质纯化、冷冻储存,然后解冻用于洗涤剂交换。
[0087]
hasman的形成
[0088]
本文公开的hasman通过将洗涤剂核心纳米颗粒与包含皂苷级分、胆固醇和磷脂的iscom基质佐剂一起孵育来产生。
[0089]
通常,形成需要在4℃或25℃下孵育约24至48小时。较高温度促进hasman的形成。参见例如,图33和图35。因此,在特定方面,通过在约25℃下孵育至少24小时来形成hasman。在向受试者施用前不久将洗涤剂核心纳米颗粒与iscom基质佐剂混合
‑
即床边混合,不产生hasman。较长的孵育期不会对hasman的形成产生负面影响。
[0090]
纳米颗粒流感ha蛋白
[0091]
用作流感抗原的ha糖蛋白可以来自任何流感病毒菌株。在美国几乎每个冬季,a型和b型人流感病毒都会引起季节性流行病。基于病毒表面上的两种蛋白质:血凝素(ha)和神经氨酸酶(na),a型流感病毒再分为亚型。
[0092]
ha蛋白可选自亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15、h16、h17和h18。从系统发育上看,流感分为若干组。对于ha,组1包含h1、h2、h5、h6、h8、h9、h11、h12、h13、h16、h17和h18,而组2包含h3、h4、h7、h10、h14和h15。
[0093]
在某些方面,流感纳米颗粒是使用中性ph纯化产生的抗胰蛋白酶的纳米颗粒。在ha纳米颗粒的纯化和配制过程中,通过6.9以上至8.5的中性ph范围来实现胰蛋白酶抗性。胰蛋白酶抗性流感糖蛋白和胰蛋白酶抗性流感纳米颗粒;以及其制造方法在美国申请号15/819,962中进行了详细描述,所述申请的内容出于所有目的以引用的方式整体并入本
文。
[0094]
修饰的抗原
[0095]
通常,抗原是全长野生型序列,然而,抗原可以是野生型抗原的变种或突变体。在某些方面,所述抗原可以与所公开的抗原共享同一性;例如,同一性百分比可以是至少80%、至少90%、至少95%、至少97%或至少98%。可使用比对程序clustalw2计算同一性百分比,所述程序可在www.ebi.ac.uk/tools/msa/clustalw2/获得。以下默认参数可用于成对的比对:蛋白质权重矩阵=gonnet;空位开放=10;空位扩展=0.1。
[0096]
可以使用其他变体。ha是其中每个单体由约550个氨基酸残基组成的同源三聚体。ha的每个单体已在概念上分为三个结构域:约515个残基的胞外域构成分子的病毒外部分;27个残基的单段定义了跨膜(tm)结构域;以及约10个残基构成胞质尾区(ct)。虽然抗原可有一些变化,但洗涤剂核心纳米颗粒和hasman两者的形成都需要完整的跨膜(tm)结构域。因此,在特定实例中,修饰的ha蛋白序列在tm和ct结构域上具有100%同一性(即,是野生型),而在剩余的胞外域部分有一定灵活性,其中同一性可以是至少90%或至少95%。所述结构域可通过与melikyan等(mol biol cell.1999 jun;10(6):1821
‑
1836)的图1中所示的japan/305/57ha的tm结构域和ct的氨基酸序列的同源性来鉴定,但应注意的是,胞外域、tm与ct结构域之间的边界可能会因ha蛋白与ha蛋白不同而异,最多相差三个氨基酸。
[0097]
疫苗稳定性
[0098]
有利地,所公开的纳米颗粒流感疫苗制剂是稳定的并且适用于长期储存。本文提供的制剂可以特别适用于共制剂策略(即,其中抗原和基质佐剂在施用前充分混合;例如,在预填充注射器中)。如本文所公开,共制剂流感疫苗策略可以为临床实践提供优势,并且可以作为当前使用的床边混合制剂的具有成本效益的替代物。
[0099]
在一些实施方案中,当共配制的疫苗组合物储存长达12个月时,所述组合物中的流感抗原是稳定的。虽然疫苗组合物可在2
‑
8℃下储存,但它们在25℃下显示出优异的稳定性。
[0100]
预混合的(共配制的)制剂的稳定性可以通过本领域已知的方法和方案评估。可以通过疫苗抗原的降解水平和疫苗的免疫原性来测量稳定性。可以通过评估疫苗中病毒抗原的热稳定性来检测稳定性。
[0101]
疫苗制剂在室温(25℃)下长期的稳定性有利于具有成本效益的疫苗策略,特别是对于冷链配送和储存可能受限制的地区。如who对于评估疫苗稳定性的指南中所述,在制造、配送和储存过程中控制温度链对于确保疫苗功效非常重要(“关于在控制温度链中使用的疫苗的稳定性评估指南;可在www.who.int/biologicals/who_ctc_first_draft_22_dec_2014_amended.pdf获得)。
[0102]
在不受理论约束的情况下,人们认为hasman结构可以有助于共配制的疫苗制剂的稳定性。(参见图36,其显示了在基质佐剂存在下的更好的热稳定性;即,显示了hasman颗粒具有比仅使用洗涤剂核心的制剂更好的稳定性)。将洗涤剂核心纳米颗粒与基质m混合以提供hasman从而提供的疫苗组合物,与仅包含洗涤剂核心纳米颗粒的疫苗组合物相比,温度提高了约0.5℃至约1.0℃(通过差示扫描量热法测量)。
[0103]
这种提高的热稳定性有助于延长疫苗的保质期。在特定方面,疫苗制剂可以稳定长达6个月或长达12个月。如果在2
‑
8℃下储存12个月后,针对测试样品的hai效价与新鲜制
备的样品的hai效价没有统计学差异;并且如果在2
‑
8℃下储存12个月后,单次放射免疫扩散(srid)测定法得到的值为至少约70%,那么在本公开的上下文中,测试样品被认为是“稳定的”。hai效价测量的统计显著性分析按以下方式进行。按组计算几何平均效价(gmt)和相关的95%置信区间(ci)。使用带有jmpl3软件的tukey hsd分析,比较了各组之间hai的logl0转化效价测量值的平均值。p值<0.05表明两个比较组之间的统计显著性差异。
[0104]
疫苗组合物
[0105]
本文公开的组合物可以预防性地或治疗性地使用。本公开包括用于预防流感病毒感染的方法。所述方法包括向受试者施用治疗量或预防量的本公开的免疫原性组合物。优选地,药物组合物是提供保护作用的疫苗组合物。在一些方面,保护作用可包括改善一定比例的暴露人群中与感染有关的症状。例如,与未治疗的受试者相比,组合物可以预防或减少选自以下的一种或多种流感症状:发热疲劳、肌肉疼痛、头痛和喉咙痛。
[0106]
疫苗组合物可包含各种赋形剂、药学上可接受的缓冲剂等。例如,疫苗组合物中的药学上可接受的缓冲剂可包含磷酸钠、氯化钠、组氨酸、盐酸精氨酸和海藻糖中的一种或多种。磷酸钠可以约10mm至约50mm、约15mm至约30mm存在。在特定情况下,存在约25mm的磷酸钠。组氨酸可以约0.1%(w/v)至约2.5%(w/v)的范围内存在;例如,组氨酸可以约0.1%(w/v)、约0.5%(w/v)、约0.7%(w/v)、约1%(w/v)、约1.5%(w/v)、约2%(w/v)或约2.5%(w/v)存在。
[0107]
氯化钠可以在约50mm至约300mm的范围内。通常,当存在于组合物中时,氯化钠为约150mm。
[0108]
盐酸精氨酸可以约50mm至约200mm、约80mm至约150mm或约100mm至约180mm存在。在特定情况下,存在约100mm的盐酸精氨酸。
[0109]
海藻糖可在约1%至约10%的范围内存在;例如,约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%或约10%。
[0110]
流感疫苗组合物的ph范围通常接近中性,并且在纯化过程中和在组合物中保持在ph 6.9以上。例如,缓冲剂和组合物的ph可以是约ph 7.2至约ph 7.8,更优选是约7.2至约7.5。在特定方面,ph是约ph 7.5。避免低于6.9的ph值,因为它们会对ha结构的稳定性产生负面影响。
[0111]
佐剂
[0112]
在某些实施方案中,本文公开的组合物可以与一种或多种佐剂组合以增强免疫反应。在其他实施方案中,组合物是在没有佐剂的情况下制备,因此可以作为无佐剂的组合物施用。
[0113]
特定组合物的免疫原性可通过使用免疫反应的非特异性刺激物(称为佐剂)来增强。有效量的佐剂长期以来一直用于促进针对抗原的免疫的普遍提高(例如,美国专利号4,877,611)。多年来免疫方案一直使用佐剂来刺激反应,并因此,佐剂是本领域普通技术人员众所周知的。一些佐剂影响抗原呈递的方式。例如,当蛋白抗原被明矾沉淀后,免疫反应提高。抗原的乳化也延长了抗原呈递的持续时间。设想包含在vogel等,
″
a compendium of vaccine adjuvants and excipients(第二版)
″
中描述的任何佐剂都在本公开的范围内,所述参考出于所有目的以引用的方式整体并入本文。
[0114]
虽然可以包括各种佐剂,但是使用向受试者施用后仍保持佐剂有效活性的iscom
基质佐剂来产生hasman。因此,在一些方面,可以不将附加的佐剂添加到制剂中。如上所述,这种配制方法允许制备包含疫苗的预填充注射器,而无需在床边混合抗原与佐剂。
[0115]
用于基质的皂苷佐剂
[0116]
使用皂苷级分制备iscom基质。皂苷是源自皂皮树(quillaja saponaria)molina树的树皮的糖苷。通常,使用多步纯化过程制备皂苷,从而产生多个级分。如本文所用,术语“来自皂皮树molina的皂苷级分”总体用来描述皂皮树的半纯化的或限定的皂苷级分或其基本上纯的级分。
[0117]
皂苷级分
[0118]
有若干种方法适用于产生皂苷级分。在美国专利号6,352,697中描述了级分a、b和c,并且所述级分可如下制备。通过色谱法分离来自quil a(粗的水性皂皮树molina萃取物)的亲脂级分,并将其用水中70%乙腈洗脱以回收亲脂级分。然后通过半制备hplc分离此亲脂级分,其中使用酸性水中25%至60%乙腈的梯度进行洗脱。在本文中称为“级分a”或“qh
‑
a”的级分,是或对应于以约39%乙腈洗脱的级分。在本文中称为“级分b”或“qh
‑
b”的级分,是或对应于以约47%乙腈洗脱的级分。在本文中称为“级分c”或“qh
‑
c”的级分,是或对应于以约49%乙腈洗脱的级分。关于级分纯化的附加信息可在美国专利号5,057,540中找到。当如本文所描述进行制备时,皂皮树molina的级分a、b和c各自代表具有可定义特性的化学上密切相关的分子的组或家族。在获得级分的色谱条件下,批次间重复性就洗脱曲线和生物活性而言是高度一致的。
[0119]
已描述了其他皂苷级分。在ep 0436620中描述了级分b3、b4和b4b。在ep03632279b2,q
‑
vac(nor
‑
feed,as denmark),quillaja saponaria molina spikoside(lsconova ab,ultunaall
é
n 2b,75651uppsala,sweden)中描述了级分qa1
‑
qa22。可以使用ep 03632279b2的级分qa
‑
1、qa
‑
2、qa
‑
3、qa
‑
4、qa
‑
5、qa
‑
6、qa
‑
7、qa
‑
8、qa
‑
9、qa
‑
10、qa
‑
11、qa
‑
12、qa
‑
13、qa
‑
14、qa
‑
15、qa
‑
16、qa
‑
17、qa
‑
18、qa
‑
19、qa
‑
20、qa
‑
21和qa
‑
22,尤其是qa
‑
7、qa
‑
17、qa
‑
18和qa
‑
21。所述级分如ep 03632279b2,特别是在第6页以及在第8和9页的实施例1中所描述来获得。
[0120]
本文所述且用于形成佐剂的皂苷级分通常是基本上纯的级分;也就是说,级分基本上不存在其他物质的污染。在特定方面,基本纯的皂苷级分可包含至多40%重量、至多30%重量、至多25%重量、至多20%重量、至多15%重量、至多10%重量、至多7%重量、至多5%重量、至多2%重量、至多1%重量、至多0.5%重量或至多0.1%重量的其他化合物,诸如其他皂苷或其他佐剂物质。
[0121]
其他皂苷级分,诸如qs
‑
7和qs
‑
21级分,其生产和使用如美国专利号5,057,540;美国专利号6,231,859;美国专利号6,352,697;美国专利号6,524,584;美国专利号6,846,489;美国专利号7,776,343和美国专利号8,173,141中所描述。这些级分可以用于本文公开的方法和组合物中。
[0122]
基质颗粒
[0123]
本文公开的基质颗粒佐剂由于其佐剂特性,可用于产生hasman或用作离散颗粒。iscom基质包含脂质和至少一种皂苷级分。脂质至少是固醇,诸如胆固醇。在特定方面,脂质是磷脂。iscom基质复合物还可包含一种或多种其他免疫调节(佐剂活性)物质(不一定是糖苷),并且可以如ep0436620b1中所描述来产生。
[0124]
皂苷级分可以是皂皮树的级分a、级分b或级分c、皂皮树的半纯化制品、皂皮树的纯化制品或任何纯化的亚级分,例如qa 1
‑
21。
[0125]
基质颗粒可以包含皂苷级分的混合物,或者颗粒可以仅使用一种皂苷级分来形成。本文公开的组合物可包含多个颗粒,其中每个颗粒仅包含一种皂苷级分。也就是说,某些组合物可包含一个或多个不同类型的iscom基质,其中每个单独的颗粒包含来自皂皮树molina的一种皂苷级分,其中一个颗粒中的皂苷级分与其他复合物颗粒中的皂苷级分不同。
[0126]
在特定方面,一种类型的皂苷级分或粗皂苷级分可整合到一个iscom基质颗粒中,而另一种类型的基本上纯的皂苷级分或粗皂苷级分可整合到另一个iscom基质颗粒中。组合物或疫苗可包含至少两种类型的复合物或颗粒,每种类型具有整合到物理上不同的颗粒中的一种类型的皂苷。
[0127]
在组合物中,可使用iscom基质颗粒的混合物,其中一种皂苷级分皂皮树molina和另一种皂苷级分皂皮树molina分别掺入不同的iscom基质复合物颗粒和/或iscom复合物颗粒中。
[0128]
各自具有一种皂苷级分的iscom基质可以重量%的任何组合存在于组合物中。在特定方面,组合物可包含0.1%至99.9%重量、5%至95%重量、10%至90%重量、15%至85%重量、20%至80%重量、25%至75%重量、30%至70%重量、35%至65%重量、40%至60%重量、45%至55%重量、40至60%重量或50%重量的含有第一皂苷级分的iscom基质,剩余部分由包含不同皂苷级分的iscom基质组成。在一些方面,剩余部分是仅包含一种皂苷级分的一个或多个iscom基质颗粒。在其他方面,iscom基质颗粒可包含不止一种皂苷级分。
[0129]
在优选的组合物中,第一iscom基质中的皂苷级分是级分a(“级分a基质”),而第二iscom基质或iscom复合颗粒中的皂苷级分是级分c(“级分c基质”)。因此,优选的组合物包含作为佐剂的级分a基质佐剂和级分c基质佐剂。组合物中每种基质的量可以变化。例如,级分a基质的量可以是约80%(w/w)、约85%(w/w)、约90%(w/w)、约92%(w/w)或约95%(w/w),剩余部分是级分c基质。适合的85∶15的级分a基质和级分c基质的组合(在本文中称为基质m或基质m1)的实例可作为matrix
‑
m
tm
得自novavax ab,uppsala,sweden。
[0130]
在一些方面,基质m可用作本文提供的组合物中的佐剂。在一些方面,基质m可用作本文提供的纳米颗粒流感疫苗组合物中的唯一佐剂。
[0131]
在一些实施方案中,每施用剂量中基质m的量可以在约20μg至约140μg的范围内;例如,约20μg、约30μg、约40μg、约50μg、约60μg、约70μg、约75μg、约80μg、约90μg、约100μg、约110μg、约120μg、约130μg或约140μg。在特定方面,佐剂可以约50μg至约75μg存在。
[0132]
其他佐剂
[0133]
示例性佐剂包括完全弗氏佐剂(含有杀死结核分枝杆菌的免疫反应的非特异性刺激物)、不完全弗氏佐剂和氢氧化铝佐剂。其他佐剂包括gmcsp、bcg、mdp化合物(诸如thur
‑
mdp和nor
‑
mdp)、cgp(mtp
‑
pe)、脂质a和单磷酰脂质a(mpl)、mf
‑
59、ribi,其在2%角鲨烯/80乳液中包含从细菌中萃取出的三种组分,即mpl、海藻糖二霉菌酸酯(trehalose dimycolate)(tdm)和细胞壁骨架(cws)。在其他优选方面,使用明矾,诸如2%alhydrogel(al(oh)3)。在一些方面,佐剂可以是少层(paucilamellar)脂质囊泡;例如,)。在一些方面,佐剂可以是少层(paucilamellar)脂质囊泡;例如,是在约100nm至约500nm范围内的少层非磷脂囊泡。其包括brij 72、胆固醇、
油酸和角鲨烯。novasome已显示出是有效的佐剂(参见美国专利号5,629,021、6,387,373和4,911,928。
[0134]
纳米颗粒疫苗组合物的施用和剂量
[0135]
本文公开的组合物可以通过全身性途径或粘膜途径或经皮途径施用或直接施用到特定组织中。如本文所用,术语“全身性施用”包括肠胃外施用途径。特别地,肠胃外施用包括皮下、腹膜内、静脉内、肌肉内或胸骨内注射。通常,组合物通过肌肉内注射施用。在特定方面,所述组合物可通过粘膜施用。如本文所用,术语“粘膜施用”包括口服、鼻内、阴道内、直肠内和气管内。
[0136]
组合物可向需要其的受试者(通常是人)施用。
[0137]
组合物可以单剂量方案或多剂量方案施用。可以在初次免疫方案中或在加强免疫方案中使用多剂量。在多剂量方案中,各种剂量可以通过相同或不同的途径,例如,肠胃外初次和粘膜加强、粘膜初次和肠胃外加强等来给予。在一些方面,在先前剂量后约2周、约3周、约4周、约5周或约6周施用后续加强剂量。
[0138]
在一些实施方案中,四价流感疫苗组合物的四种菌株中的至少一种菌株是a型菌株。例如,四价流感疫苗可包含三种a型菌株和一种b型菌株。
[0139]
疫苗组合物中流感ha的总量可在约25μg至约200μg、约30μg至约150μg、约50μg至约100μg、约45μg至约180μg、约60μg至约190μg或约100μg至约200μg的范围内。在某些实施方案中,疫苗组合物中流感ha蛋白的量可以在每菌株约5μg至每菌株约80μg、每菌株约10μg至约每菌株75μg、每菌株约15μg至每菌株约70μg、每菌株约20μg至每菌株约65μg、每菌株约25μg至每菌株约60μg、每菌株约30μg至每菌株约55μg、每菌株约35μg至每菌株约50μg、每菌株约15μg至每菌株约60μg的范围内。有利地,组合物表现出长达9至12个月的稳定性,使得通过srid测量的剩余量占初始量的较大百分比;例如,初始量的至少约70%、至少约75%或至少约80%。
[0140]
在一些实施方案中,本公开提供了用于纳米颗粒流感疫苗组合物的共制剂(即,预填充注射器或预混合物)策略。当前利用的典型的流感疫苗施用策略是床边混合制剂。也就是说,疫苗组合物和佐剂分别储存并在施用前混合。由于担心流感抗原的稳定性和其随后的免疫原性能力,用于流感疫苗的预混合物、共制剂或预填充注射器策略不太常见。本公开提供了可以预混合的并且预先储存的纳米颗粒流感疫苗组合物。所公开的疫苗接种策略和制剂可以提高疫苗接种效率,并且可以减少床边混合错误的风险,同时保持总体安全性和免疫原性。
[0141]
纳米颗粒流感疫苗的免疫原性
[0142]
本公开提供了预防流感感染的方法。本文公开的纳米颗粒流感疫苗的免疫原性可以使用适合的方法,包括进行hai测定法或通过测量中和抗体来测定。在一些实施方案中,可以将纳米颗粒流感疫苗的免疫原性与可商购获得的流感疫苗组合物进行比较。如本文所用,“可商购获得的流感疫苗组合物”可以是可用于医疗用途的任何流感疫苗组合物。例如,可商购获得的流感疫苗组合物可配制成三价或四价注射剂。在一些方面,用于注射的制剂可包含灭活形式的病毒。在另一个实例中,可商购获得的流感疫苗组合物可配制成鼻喷雾剂。在一些方面,用于鼻喷雾剂的制剂可包含减毒或弱化形式的病毒。
[0143]
与其他疫苗,特别是可商购获得的疫苗(包括四价afluria、四价fluarix、四价
flulaval、四价fluzone、四价flucelvax、皮内四价fluzone、afluria、fluvirin、fluad、高剂量fluzone、四价flublok、flublok和四价flumist)相比,本文公开的组合物提供了非劣等的免疫反应。
[0144]
有利地,本文公开的组合物诱导中和抗体,所述中和抗体与相对于相同流感亚型内的病毒所用的序列已漂移(即经历了轻微突变)的菌株结合。在特定方面,组合物中所用的一种、二种、三种、四种或全部菌株诱导针对一种漂移菌株、针对两种漂移菌株、针对三种漂移菌株、针对四种漂移菌株或针对五种漂移菌株的中和抗体。在不受理论约束的情况下,人们认为组合物中基质佐剂的存在促进了附加抗原的暴露,从而提供了针对漂移菌株的扩大保护。类似地,基质佐剂与亚型a的ha蛋白一起孵育后hasman的形成被认为有助于此过程。
[0145]
重要的是,hasman至少与洗涤剂核心纳米颗粒具有一样的免疫原性。例如,如下表6所示,在第35天,在25℃下,1.5μg预混合制剂针对a/michigan的hai效价是约538,而在25℃下,1.5μg床边混合制剂针对a/michigan的hai效价是约453。在表8所示的另一个实例中,在第35天,在25℃下,1.5μg预混合制剂针对a/hong kong的hai效价是约538,而在
‑
60℃下,1.5μg床边混合制剂针对a/michigan的hai效价是约494。预混合制剂与床边混合制剂之间类似的免疫原性进一步表明,预混合制剂在室温下是稳定的。此外,令人惊奇地,在室温下储存的本发明预混合制剂与在
‑
60℃下孵育的床边混合制剂相比,可以具有类似的免疫原性。
[0146]
容器
[0147]
可以使用各种容器来储存和运输预混合制剂,包括单次施用的注射器和塑料安瓿。在一些情况下,可以使用吹填
‑
密封制造技术或方法来制造塑料安瓿。通常,吹填
‑
密封(bfs)制造方法包括挤出塑料材料(例如,树脂)以形成型坯,然后将其放入模具中并切成一定尺寸。然后使用填充针或心轴对塑料充气,这反过来产生基本上符合模具形状的空心安瓿。一旦充气,就可以将所需体积的液体注射到安瓿中,可以取下填充针或心轴,并且可以密封安瓿。因此,bfs可以是能够在无菌环境中进行而无需人工直接干预的自动化过程。
[0148]
在一些情况下,无菌地制造包含所需液体的无菌安瓿的能力,可以使bfs制造的安瓿特别适用于制药工业。然而,bfs技术并非与所有药物液体、产品等兼容。例如,一些已知的bfs制造方法包括在塑料仍相对较热时将液体或产品递送到安瓿中,这可能会对温度敏感型液体和/或产品诸如疫苗、生物制剂等产生不利影响。不过,冷却bfs技术的进步增加了适用产品、液体等的种类,从而允许将一些疫苗、生物制剂和/或其他温度敏感型药物包含在bfs安瓿中。
[0149]
在一些情况下,bfs安瓿所具有的大小、形状和/或构型可以是至少部分地基于所需的用途和/或安瓿被配置来包含的所需药物液体或剂量。例如,一些已知的bfs安瓿可以包括刺穿式顶部、扭断式顶部、具有公鲁尔或母鲁尔的顶部等等。一些已知的bfs安瓿所具有的大小和/或形状可以是基于被配置来放置在其中的液体或剂量的体积。此外,一些已知的bfs安瓿可以制造成一条多个临时连接的安瓿,这可以提高制造、包装和/或储存效率等等。
[0150]
本文引用的所有专利、专利申请、参考文献和期刊论文出于所有目的明确地以引用的方式整体并入本文。
[0151]
实施例
[0152]
实施例1:ha纳米颗粒的纯化
[0153]
将来自单一菌株的ha蛋白通过杆状病毒感染在sf9细胞中表达,并在收获前使其生长48
‑
96小时。然后通过洗涤剂萃取来收获ha蛋白,并在纯化过程中将其转变成洗涤剂核心纳米颗粒。简而言之,将tmae柱用由25mm tris、ph 8.0、1.5m氯化钠、0.02%np9组成的缓冲液进行预平衡。将样品以≤90cm/h上样(停留时间24分钟),然后用eq缓冲液(25mm tris、ph 8.0、50mm氯化钠或81mm氯化钠(分别针对a菌株、b菌株)、0.02%np
‑
9)洗涤。然后使用1.5cv eq缓冲液洗脱纯化的样品。
[0154]
对于a菌株,将来自tmae柱的产物进行纳滤,然后将其施加到小扁豆凝集素亲和色谱柱上,所述亲和色谱柱用由25mm tris、50mm氯化钠和107mm氯化钠(分别针对a菌株和b菌株)、0.02%(w/v)np
‑
9、ph 8.0组成的3cv的缓冲液预平衡(流速:150cm/h)。在4分钟停留时间处将样品上样。上样后,用3cv的小扁豆凝集素平衡缓冲液进行洗涤。以75cm/h及在8分钟停留时间处收集2cv的产物,用25mm磷酸钠、ph 7.5、200mm氯化钠、500mm甲基
‑
α
‑
d
‑
甘露吡喃糖苷、0.01%(w/v)ps80、ph 7.5洗脱。
[0155]
对于b菌株,使用capto blue柱进一步纯化tmae柱产物。将柱用25mm tris、ph 8.0、107mm氯化钠、0.02%(w/v)np
‑
9预平衡,然后在4分钟停留时间处以225cm/h的流速将tmae产物上样,并用2cv的平衡缓冲液来收集。将来自capto blue柱的产物进行纳滤,然后施加到小扁豆凝集素亲和色谱柱上,所述亲和色谱柱用由25mm tris、50mm氯化钠和107mm氯化钠(分别针对a菌株和b菌株)、0.02%(w/v)np
‑
9、ph 8.0组成的3cv的缓冲液预平衡(流速:150cm/h)。在4分钟停留时间处将样品上样。上样后,用3cv的小扁豆凝集素平衡缓冲液进行洗涤。以75cm/h及在8分钟停留时间处收集2cv的产物,用25mm磷酸钠、ph 7.5、200mm氯化钠、500mm甲基
‑
α
‑
d
‑
甘露吡喃糖苷、0.01%(w/v)ps80、ph 7.5洗脱。
[0156]
将a菌株和b菌株两者的小扁豆凝集素产物浓缩至目标ha浓度,然后进行缓冲液交换为最终的原料药制剂缓冲液。浓缩和缓冲液交换通过超滤和渗滤进行。
[0157]
实施例2
‑
sds page分析
[0158]
为了评估在预填充注射器中共配制quad
‑
niv和iscom基质佐剂(基质m)的稳定性以及了解这种疫苗的物理、化学和生物特性,如下表1所示制备制剂。将测试的疫苗组合物分配为三组:(1)仅包含ha抗原的玻璃床边小瓶;(2)包含与基质m1共配制的ha疫苗抗原的预填充注射器(pfs);以及(3)包含ha疫苗抗原的pfs。用于床边混合物和pfs的玻璃小瓶是商业购得的(schott)。
[0159]
表1.床边小瓶制剂和pfs制剂的比较研究
[0160]
[0161]
图2示出了还原性sds
‑
page凝胶图像,其显示出在4℃下储存的来自床边小瓶的蛋白质条带;或在4℃下储存的有或无基质m1的预填充注射器(pfs)的蛋白质条带。在所有测试的时间点,来自pfs的蛋白质的带型类似于来自床边小瓶的蛋白质的带型,这表明pfs中的蛋白质至少与床边小瓶中的蛋白质一样稳定。基质m的存在或不存在都不会改变pfs组之间的带型,也不会储存6个月甚至12个月。在4℃下ld床边小瓶组和ld pfs组也具有一致类似的带型,虽然在相同时间点与其hd队列相比,ld组具有较弱的带型。
[0162]
图3示出了在非还原性sds
‑
page凝胶和还原性sds
‑
page凝胶上检测的,在4℃下储存的来自pfs或床边小瓶的蛋白质的带型。结果显示,即使在非还原性凝胶上,所有组的蛋白质带型也类似,这进一步表明pfs中的蛋白质与在零时床边小瓶中的蛋白质类似。
[0163]
此外,使用非还原性sds
‑
page测定法(图4)检测在4℃或25℃下储存3个月的床边小瓶组与有或无基质m的pfs组的蛋白质稳定性。与在较低温度(例如4℃)下储存的那些组相比,在较高温度(25℃)下储存的组中的一些倾向于出现分子量较高的条带。在较低温度下储存的组中也观察到蛋白质的较强表达。结果显示,即使在长期的储存(诸如储存3个月)后,pfs中的蛋白质也至少与床边小瓶中的蛋白质一样稳定。
[0164]
这些数据显示,就稳定性而言,pfs共制剂疫苗策略是可行的。pfs共制剂疫苗在4℃和25℃下储存都是可行的。基质m1的存在和储存时间的持续时间(例如,3个月)不会对疫苗制剂的稳定性产生负面影响,从而证实hasman的形成在长时间内不会干扰蛋白质的稳定性。
[0165]
实施例3
‑
srid分析
[0166]
通过对在pfs组中配制的各种流感a菌株和流感b菌株进行srid测定来测试蛋白质的稳定性。srid测定是在2
‑
8℃(例如,4℃)下在t=0、2周、1个月、3个月、6个月、9个月和12个月时;以及在25℃下在t=0、2周、1个月、3个月和6个月时进行的。图5和图6示出了在2
‑
8℃(图5)和25℃(图6)下的有或无100μg/ml基质m的包含a/hong kong、a/michigan、b/brisbane或b/phuket的120μg/ml pfs制剂的srid数据。
[0167]
有基质m的pfs的srid免疫反应性结果类似于或者好于无基质m的pfs的srid免疫反应性结果。数据显示,在25℃下储存时免疫反应性随时间的总体趋势与在4℃下观察到的结果没有明显差异。疫苗免疫反应性不存在明显变化表明quad
‑
niv pfs制剂在各种温度下至少稳定达6个月。quad
‑
niv pfs制剂在室温(25℃)下的稳定性有利地提供了具有成本效益的疫苗策略,因为pfs制剂不需要长期冷藏或限于低温处理。这些数据进一步显示,在诊所进行疫苗接种很久之前,大量生产稳定的预混合疫苗(包含流感抗原和基质m)是可行的方法。
[0168]
实施例4
‑
在雪貂中quad
‑
niv和商业流感疫苗的比较免疫原性研究
[0169]
进行雪貂研究,以比较各种测试疫苗策略(床边和共制剂)与可商购获得的流感疫苗的免疫原性。
[0170]
表2.雪貂中quad
‑
niv和商业疫苗的免疫原性比较研究
[0171][0172]
*
‑
每个b菌株剂量是90μg;并且每个a菌株剂量是60μg。
[0173]
#
‑
图7
‑
图10中描绘的结果对应于第42天。
[0174]
对于quad
‑
niv制剂,使用a/michigan/45/2015
‑
h1n1菌株、a/hong kong/4801/2014
‑
h3n2菌株、b/brisbane/60/2008菌株、b/phuk et/3073/2013菌株。对于fluzone hd(tiv;sanofi pasteur),使用a/michigan/45/2015
‑
h1n1、a/hongkong/4801/2014
‑
h3n2和b/brisban e/60/2008。对于fluzone hd(qiv;sanofi pasteur),使用a/michig an/45/2015
‑
h1n1、a/hongkong/4801/2014
‑
h3n2、b/brisbane/60/2008和b/phuket/3073/2013。对于fluad(tiv;seqirus),使用a/singap ore/gpl908/2015(类似a/michigan/45/2015
‑
h1n1)、a/hongkong/4801/2014
‑
h3n2和b/brisbane/60/2008。对于flublok(qiv;protein scie nces),使用a/michigan/45/2015
‑
h1n1、a/hongkong/4801/2014
‑
h3n2、b/brisbane/60/2008和b/phuket/3073/2013。对于flucelvax(qiv;seqirus),使用a/singapore/gp1908/2015(类似a/michigan/45/2015
‑
h1n1)、a/singapore/gp2050/2015(类似a/hong kong/4801/2014
‑
h3n2)、b/hong kong/259/2010(类似b/brisbane/60/08)和b/utah/9/2014(类似b/phuket/3073/2013)。
[0175]
在研究的第0天和第21天使雪貂免疫。在研究开始的前一天、在研究的第21天和第42天抽血。使用人红细胞进行hai测定以评估测试制剂在雪貂中的免疫原性。实验方案是本
领域已知的,并已在上面讨论。以下hai试剂用于测定中作为vlp形式的参考流感抗原:(1)a/michigan 45/15(bv#001),(2)a/hongkong/4801/14(bv#1808),(3)b/bris/60/08(bv#714),(4)b/phuket/3073/13(bv#1659),(5)a/switzerland/9715293/13(bv#1660),(6)a/singapore/2016(bv#2165),(7)a/texas/50/2012(bv#1324),(8)a/victoria/36/11(bv#1577)和(9)a/perth/16/09。制备流感抗原vlp的方法在,例如,美国专利申请号15/901,000中公开,所述参考出于所有目的以引用的方式整体并入本文。
[0176]
与存在基质m的所有quad
‑
niv制剂相比,所有可商购获得的流感疫苗均具有较低的hai效价,而与给药方案、制剂类型(即床边和共制剂)无关。参见图7(a/hong kong/4801
‑
2014)、图8(a/michiga n/45/2015)、图9(b/brisbane/60/2008)和图10(b/phuket/3073/2013)。
[0177]
总之,与商业疫苗相比,对于本文公开的所有测试的流感菌株,quad
‑
niv制剂可在雪貂中引发更强的免疫原性作用,而随制剂中基质m的存在,差异更为显著。包含hasman的quad
‑
niv共制剂(预混合)与quad
‑
niv床边制剂相比具有类似的免疫原性。在共制剂组当中,在4℃下和在25℃下储存的制剂总体上具有非常类似的免疫原性。
[0178]
实施例5
‑
在4℃下储存的四价纳米颗粒流感疫苗的免疫原性评估
[0179]
表3示出了用于检测预混合pfs疫苗制剂和床边混合疫苗的免疫原性和稳定性的小鼠研究设计。将pfs制剂在4℃下储存3个月。对于床边混合疫苗,将病毒抗原在
‑
60℃下储存3个月,并且就在施用前与基质m佐剂混合。
[0180]
表3.用于免疫原性评估的quad
‑
niv制剂
[0181][0182]
在第0天和第21天肌肉内施用免疫。在研究开始的前一天和再在研究的第42天(或第二次免疫后第21天)采集血样用于免疫原性分析。免疫原性是基于对以下流感a菌株和b菌株:(1)a/hong kong/4801/2014;(2)a/michigan/45/2015;(3)b/brisbane/60/2008和(4)b/phuket/3073/2013的血凝抑制(hai)反应测定的。如《流感实验室诊断和病毒学监测手册》(世界卫生组织2011年,02/15/2018访问,在:www.who.int/influenza/gisrs_laboratory/manual_diagnosis_surveillance_influenza/en/,所述参考的那些公开内容以引用的方式并入)所述测量hai。
[0183]
图11示出了表3中列出的制剂在3个月时针对所有hd组的四种流感菌株的hai效价。结果显示,在4℃下储存3个月的预混合制剂与在
‑
60℃下储存的床边混合制剂相比具有类似的免疫原性。结果还显示,即使当预混合制剂长期储存(诸如3个月)时,基质m也不会改变测试的quad
‑
niv制剂的免疫原性。
[0184]
实施例6
‑
在25℃下预混合物对有基质m的床边混合ha纳米颗粒的免疫原性和长期稳定性
[0185]
组1至组14如下表4所示加以制备。对于预混合组,将ha纳米颗粒和基质m(85:15w/w的级分a基质和级分c基质)混合,并在施用前在4℃下储存6个月或12个月,或者在25℃下储存6个月。对于床边混合组,将ha在25℃下储存或在
‑
60℃下冷冻6个月,或在
‑
60℃下冷冻12个月,然后在即将向小鼠施用前与基质m混合。ha蛋白纳米颗粒包含来自以下菌株的ha:a/michigan h1n1、a/hong kong
‑
h3n2 b/brisbane和b/phuket。
[0186]
表4. 6个月和12个月3的制剂稳定性分析
[0187][0188][0189]1高剂量:120μg/ml/菌株(总计480μg ha)+100μg/ml基质。
[0190]2低剂量:30μg/ml/菌株ha(总计120μg ha)+100μg/ml基质。
[0191]312个月的稳定性研究不包括在25℃下储存的样品。
[0192]
我们针对四种菌株中的每一种测量了hai效价。图12
‑
图19和表5
‑
表12示出了6个月时hd组和ld组针对a/hong kong、a/michigan、b/brisbane和b/phuket菌株的hai效价。
[0193]
表5.第21天a/michigan h1n1
‑
hai效价
[0194][0195]
表6.第35天a/michigan h1n1
‑
hai效价
[0196][0197][0198]
表7.第21天a/hong kong
‑
h3n2 hai效价
[0199][0200]
表8.第35天a/hong kong
‑
h3n2 hai效价
[0201][0202]
表9.第21天b/brisbane hai效价
[0203]
[0204]
表10.第35天b/brisbane hai效价
[0205][0206]
表11.第21天b/phuket hai效价
[0207][0208][0209]
表12.第35天b/phuket hai效价
[0210]
[0211]
图20
‑
图27示出了在12个月时,高剂量(hd)组和低剂量(ld)组的针对a/hong kong菌株、a/michigan菌株、b/brisbane菌株和b/phuket菌株的hai效价。
[0212]
数据显示,通过hai效价的测量,即使在储存6个月或12个月后,床边混合疫苗和预混合疫苗在小鼠中也产生了类似的免疫原性。研究还证实,基质m的存在有利于产生更大的免疫反应。即使长期储存,基质m也不会改变测试的quad
‑
niv制剂的免疫原性。
[0213]
在25℃下的预混合制剂与在25℃下的床边混合制剂相比具有类似的免疫原性。例如,在第21天,在4℃或25℃下储存的1.5μg预混合物组针对a/michigan菌株引发了类似的hai效价反应(表5;gmt:分别是57对67)。结合在25℃下长期储存的预混合制剂的稳定性,因此疫苗特别适用于冷链储存可能受限或缺乏的环境。
[0214]
图12
‑
图27中所示的数据显示,与第21天针对所有菌株的低剂量组相比,高剂量组,特别是预混合制剂,具有更高的hai效价反应。与第21天观察到的hai效价反应相比,针对所有菌株所有组中在第35天的hai效价反应均更高(例如,在第21天对第35天,在25℃下1.5μg预混合制剂的a/hong kong hai效价:22对538),而在第35天在高剂量组与低剂量组之间观察到极小差异。
[0215]
数据证实,由a型ha蛋白形成的hasman颗粒在诱导免疫反应方面至少与具有非hasman形式的洗涤剂核心的ha纳米颗粒一样有效。数据显示,ha纳米颗粒与基质形成hasman的相互作用不会对基质的佐剂作用或ha蛋白本身的免疫原性产生负面影响。虽然ha纳米颗粒似乎可以通过插入洗涤剂核心中来保留ha蛋白的稳定性,但数据因此表明,hasman颗粒可以为ha蛋白结构提供一定的保护,并且还可以对免疫系统的呈递产生积极影响,而无需ha蛋白嵌入洗涤剂核心中。
[0216]
实施例7
‑
沉降系数分析
[0217]
通过分析超速离心(auc)测量沉降速度(sv)以确定粒度,来分析先前在实施例6中在小鼠中测试了稳定性的四价组合物。图28示出了在4℃下在0、3个月、6个月、9个月和12个月时,单独使用120μg/ml/菌株(单独qiv)的quad
‑
niv的结果;或在4℃下在3个月、6个月、9个月和12个月时,使用qiv+100μg/ml m1的结果。数据显示,随着时间的流逝,快速沉降种类(即,在较高值上出现的结构)的量增加,表明ha颗粒随着时间的增加而形成hasman。图29示出了在25℃下在0、3个月或6个月时,单独使用quad
‑
niv或与100μg/ml m1一起使用的结果,并证实在较高温度下hasman的形成较快。
[0218]
实施例8
‑
hasman形成的透射电子显微镜(tem)分析
[0219]
如前所述,图1示出了使用tem观察到的ha纳米颗粒(flu)、基质m和hasman(flu
‑
基质相互作用)的不同结构。如所预期,ha纳米颗粒没有hasman的形成。确切地说,ha纳米颗粒表现出洗涤剂核心结构,ha蛋白围绕核心。基质m表现出笼状结构,其包含皂苷级分(级分a或级分c,但不同时包含)、磷脂和胆固醇。在hasman结构中,ha糖蛋白附着在笼状基质颗粒上,ha头部部分向外延伸。
[0220]
接下来,我们在tem下观察了以下描述的各种样品的时程,以在视觉上评估在不同条件下hasman的形成。下表13示出了通过使用tem来测试预混合quad
‑
niv制剂(高剂量hd和低剂量ld)的纳米颗粒结构的样品条件和时间点。标记“x”表示每个时间点可用的样品条件。此外,在1个月时在各种温度下测试了ld制剂(图35)。
[0221]
图30
‑
图34示出了hasman结构的代表性图像。数据显示,hasman的形成在孵育约4
小时时可见;并且在4小时之前没有hasman形成的证据(图30和图31)。到24小时时,hasman在低温(4℃)和高温(25℃)下均形成;然而,在4℃下在高剂量quad
‑
niv中未观察到hasman的形成。高剂量quad
‑
niv显示在4℃下到48小时时(图33)和在第7天时(图34)形成了hasman。数据还显示,到1个月时,hasman结构仍保留在ld组中,并且在较高温度下,特别是在37℃下更突出(图35)。
[0222]
表13.tem图像:研究设计
[0223][0224][0225]
基质m浓度:所有样品中100μg/ml
[0226]
这些数据显示,hasman的形成需要将ha纳米颗粒与基质m1共孵育约4小时以上。所有条件都显示在48小时内形成了hasman。所形成的hasman颗粒长期下是稳定的。在较高温度及较低给药量quad
‑
niv的条件下,hasman的形成发展较早。
[0227]
这表明包含hasman的预填充注射器制剂可在室温或更高温度(例如37℃)下储存,这将避免低温储存和运输的成本,并且防止在诊所即将接种疫苗前混合和制备疫苗的潜在的不一致。
[0228]
实施例9
[0229]
quad
‑
niv的差示扫描量热法(dsc)曲线
[0230]
通过dsc测定法检测了实施例6和实施例7中所描述的quad
‑
niv制剂的稳定性。在包含25mm napi、150mm nacl、100mm精氨酸、5%海藻糖、0.03%ps80、ph 7.5的缓冲液中制备具有100μg/ml基质m1的120μg/ml/菌株quad
‑
niv。将所有quad
‑
niv样品在4℃下孵育3个月、6个月或12个月;或在25℃下孵育3个月或6个月。以每分钟1℃从4℃到120℃进行dsc扫描,并且测量quad
‑
niv的摩尔热容(cp:kj/mol.k)。
[0231]
图36显示在25℃下孵育的制剂与在4℃下孵育的相同组相比,在熔点温度(t
m
)中具有更小的偏移,并且具有更宽的峰宽。表14显示在25℃下孵育的120μg/ml/菌株quad
‑
niv+基质m1制剂的t
m
比在4℃下在3个月时(59.6℃对60.4℃)和6个月时(59.0℃对60.4℃)的情况都要低。表14还显示在25℃下的制剂达到峰值温度所需的hcal变化小于4℃的情况,这
进一步表明此制剂具有相对较少的hasman复合物。
[0232]
dsc曲线和t
m
是蛋白质热稳定性的量度。结果显示,hasman的形成使ha蛋白的t
m
增加约0.5℃至约1℃,从而提高了与洗涤剂核心纳米颗粒相比hasman中ha蛋白的热稳定性。
[0233]
表14.高剂量和低剂量quad
‑
niv制剂的dsc曲线
[0234][0235]
实施例10
‑
用于hasman的a型菌株而不是b型菌株
[0236]
我们研究了来自不同流感菌株的ha糖蛋白形成hasman的能力。如实施例1中所述,针对以下菌株制备和纯化洗涤剂核心纳米颗粒:a型:a/hunan、a/guangdong(两者都是h7n9亚型)和a/panama和a/hong kong/4801/2014(两者都是h3n2亚型)以及b型:b/brisbane/60/2008。
[0237]
将纳米颗粒与基质m混合(85:15w/w的级分a基质和级分c基质)长达4周。ha的最终浓度是120μg/ml(在0.5ml中每个a菌株60μg+每个b菌株60μg)。测量游离的nha。结果如图37中所示。游离的nha种类的减少对应于hasman的形成。
[0238]
这些数据表明a型菌株ha糖蛋白形成了hasman,而b型菌株ha糖蛋白未形成hasman。我们还测试了在c末端具有foldon的ha糖蛋白融合蛋白。foldon的存在阻止了hasman的形成,这表明c末端必须是游离的以允许ha糖蛋白形成hasman。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1