具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐的制作方法
[0001]
本发明涉及具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐等。
背景技术:
[0002]
近年来,抗体药物复合物(抗体药物偶联物(antibody-drug conjugate:adc))的研究开发在积极进行。如其名称所示,adc是在抗体上偶联药物(例如抗癌剂)而得的药剂,对于癌细胞等具有直接的细胞杀伤活性。作为代表性的adc,有t-dm1(商品名:kadcyla(注册商标))(非专利文献1~3)。
[0003]
以t-dm1为代表的adc从开发初期就存在其不均匀性的问题。即,由于使低分子药物随机地与抗体中存在70~80个左右的lys残基反应,因此药物抗体比(drug antibodyratio:dar)和偶联位置不确定。已知通常若是这样的随机偶联法,则dar在0~8的范围内,产生药物的结合数不同的多种药剂。近年来,有报道称,若改变adc的药物的结合数和结合位置,则体内动力学或药物的释放速度、效果会发生变化。基于这些情况,对于下一代的adc,要求控制偶联的药物的个数和位置。一般认为若个数和位置确定,则所期待的疗效(efficacy)、偶联药剂的多样性、批次差异、即所谓标准化(regulation)的问题会得到解决(非专利文献4)。
[0004]
全球都在研究抗体的位置选择性修饰方法,但几乎都是使用基因工程手段或酶的修饰方法。关于基因工程学修饰方法,虽然可控制位置选择性、个数选择性,但被指出存在抗体本身的表达效率下降(调制adc时的总收率下降)等问题。此外,抗体表达体系的构建等需要较长的时间也成为问题(非专利文献5~7)。
[0005]
另外,近年来报道了利用小分子探针在细胞内这样混杂的环境下对蛋白质进行化学修饰的方法。本方法在进行成像或低分子药物的重新定位方面被用于受体的鉴定等。另外,在生化领域中,使用合成小分子探针的有机化学蛋白质修饰方法受到关注(非专利文献8~11)。
[0006]
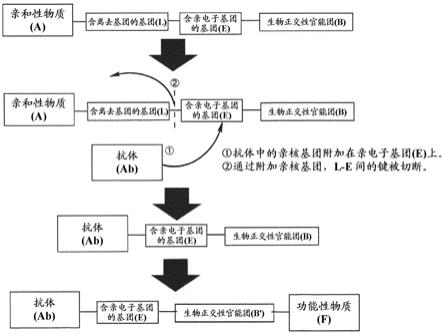
最近,开发出了ccap(亲和性肽化学偶联,chemical conjugation by affinitypeptide)法。本方法通过使在亲和性肽(affinity peptide)上连接nhs活性酯和药物而得到的肽试剂与抗体反应的方法(即,经由含肽部分的接头的adc的制作方法),成功地实现了抗体的位置选择性修饰。本方法是世界上首次通过化学合成手段用药物成功地对抗体fc区进行位置选择性修饰的方法,而且实际使用中也确认到了良好的结果[反应时间为30分钟,收率为70%(dar1的情况),位置选择性为100%]。证实了可通过加入5当量左右的肽试剂而将dar控制为2,还可控制修饰位置,在这方面具有划时代的意义(专利文献1)。
[0007]
现有技术文献
[0008]
专利文献
[0009]
专利文献1:国际公开第2016/186206号;
[0010]
非专利文献
[0011]
非专利文献1:reichert jm等人,nat biotechnol 2005;23:1073-8;
[0012]
非专利文献2:kubota t等人,cancer sci 2009;100:1566-72;
[0013]
非专利文献3:wu am等人,nat biotechnol 2005;23:1137-46;
[0014]
非专利文献4:junutula jr等人,nat biotechnol 2008;26:925-32;
[0015]
非专利文献5:shen bq等人,nat biotechnol 2012;30:184-9;
[0016]
非专利文献6:hofer t等人,biochemistry 2009;48:12047-57;
[0017]
非专利文献7:liu w等人,nat methods 2007;4:239-44;
[0018]
非专利文献8:s.t.laughlin等人,science 2008;320,664;
[0019]
非专利文献9:a.e.speers等人,chembiochem 2004;5,41;
[0020]
非专利文献10:y.takaoka等人,angew.chem.int.ed.2013;52,4088;非专利文献11:s.fujishima等人,j.am.chem.soc,2012;134:3961-64。
技术实现要素:
[0021]
发明所要解决的课题
[0022]
本发明的目的在于开发可实现抗体的修饰、特别是抗体的位置选择性修饰的技术。
[0023]
用于解决课题的手段
[0024]
本发明人进行了深入研究,结果发现了:具有a-l-e这样的结构单元(这里,a为针对抗体的亲和性物质,l为包含规定的离去基团的二价基团,e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力。)的化合物或其盐可用于抗体的位置特异性修饰。例如发现了:式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的规定化合物可用于抗体的位置特异性修饰(例如,图1、各种实施例)。还发现了:式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物或其盐可用于抗体的位置特异性修饰(例如,实施例13、14)。本发明人进一步发现了:通过使用这样的化合物,可调制不含肽部分作为接头、且位置选择性地具有功能性物质(例如药物)的抗体(抗体药物复合物(adc))等。避免使用包含具有潜在的免疫原性且在血中容易水解的肽部分的接头,这是adc的临床应用中所期望的。即,根据本发明人所开发的方法,通过化学合成手段,而且不使用包含肽部分的接头,即可用药物对抗体fc区进行位置选择性地修饰。
[0025]
即,本发明如下。
[0026]
[1]下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐:
[0027]
a-l-e-b
ꢀꢀꢀꢀ
(i)
[0028]
[式中,
[0029]
a为针对抗体的亲和性物质,
[0030]
l为包含离去基团的二价基团,
[0031]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0032]
b为生物正交性官能团,
[0033]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[0034]
[2][1]的化合物或其盐,其中,上述亲和性物质为肽。
[0035]
[3][2]的化合物或其盐,其中,上述肽为对单克隆抗体的恒定区具有结合能力的肽。
[0036]
[4][2]或[3]的化合物或其盐,其中,上述肽为对单克隆抗体的fc区具有结合能力的肽。
[0037]
[5][4]的化合物或其盐,其中,上述肽为对igg的fc区具有结合能力的肽。
[0038]
[6][2]~[5]中任一项的化合物或其盐,其中,上述肽具有10~40个氨基酸残基。
[0039]
[7][2]~[6]中任一项的化合物或其盐,其中,上述肽包含下述的氨基酸序列:
[0040]
(a)在(a-1-1)fnmqqqrrfyealhdpnlneeqrnarirsirdd(seq id no:11)的氨基酸序列、或者
[0041]
(a-1-2)fnmqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:12)的氨基酸序列中,
[0042]
序列中的任意的1~3个氨基酸残基可相同也可不同,且被选自赖氨酸残基、天冬氨酸残基、和谷氨酸残基的各1个氨基酸残基取代,
[0043]
在(a-2-1)β-ala-nmqqqrrfyealhdpnlneeqrnarirsirdd(seq id no:13)的氨基酸序列、或者
[0044]
(a-2-2)β-ala-nmqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:14)的氨基酸序列中,
[0045]
序列中的任意的1~3个氨基酸残基可相同也可不同,且被选自赖氨酸残基、天冬氨酸残基、和谷氨酸残基的各1个氨基酸残基取代;并且
[0046]
(b)对于seq id no:11~14的上述各氨基酸序列具有85%以上的同一性。
[0047]
[8][2]~[6]中任一项的化合物或其盐,其中,上述肽包含下述的任一条氨基酸序列:
[0048]
式1-1:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-i-i-w-c-(x
0-3
)
b
(seq id no:15)
[0049]
式1-2:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-i-v-w-c-(x
0-3
)
b
(seq id no:16)
[0050]
式1-3:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-v-v-w-c-(x
0-3
)
b
(seq id no:17)
[0051]
式1-4:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-a-v-w-c-(x
0-3
)
b
(seq id no:18)
[0052]
式1-5:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-l-w-c-(x
0-3
)
b
(seq id no:19)
[0053]
式1-6:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-i-w-c-(x
0-3
)
b
(seq id no:20)
[0054]
式1-7:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-v-f-c-(x
0-3
)
b
(seq id no:21)
[0055]
式1-8:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-q-v-w-c-(x
0-3
)
b
(seq id no:22)
[0056]
式1-9:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-e-v-w-c-(x
0-3
)
b
(seq id no:23)
[0057]
[式中,
[0058]
(x
0-3
)
a
为不存在、精氨酸残基-甘氨酸残基-天冬酰胺残基、甘氨酸残基-天冬酰胺残基、天冬氨酸残基、或天冬酰胺残基,
[0059]
(x
0-3
)
b
为不存在、苏氨酸残基-酪氨酸残基-组氨酸残基、或苏氨酸残基,
[0060]
xaa1为丙氨酸残基,
[0061]
xaa2为酪氨酸残基、色氨酸残基、或组氨酸残基,
[0062]
xaa3为组氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、精氨酸残基、或甘氨酸残基,
[0063]
xaa4为赖氨酸残基、天冬氨酸残基、或谷氨酸残基,
[0064]
xaa5为甘氨酸残基、丝氨酸残基、天冬酰胺残基、谷氨酰胺残基、天冬氨酸残基、谷氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、组氨酸残基、苏氨酸残基、亮氨酸残基、丙氨酸残基、缬氨酸残基、异亮氨酸残基、或精氨酸残基,
[0065]
xaa6为谷氨酰胺残基、谷氨酸残基、天冬酰胺残基、或天冬氨酸残基。];或者
[0066]
式2-1:(x
0-3
’
)
a-c-(xaa1
’
)-(xaa2
’
)-(xaa3
’
)-(xaa4
’
)-(xaa5
’
)-(xaa6
’
)-l-v-w-c-(x
0-3
’
)
b
(seq id no:24)
[0067]
[式中,
[0068]
(x
0-3
’
)
a
和(x
0-3
’
)
b
分别与上述(x
0-3
)
a
和(x
0-3
)
b
相同,
[0069]
xaa1
’
、xaa2
’
、xaa3
’
、xaa4
’
、xaa5
’
、xaa6
’
分别与上述xaa1、xaa2、xaa3、xaa4、xaa5、xaa6相同。]。
[0070]
[9][1]~[8]中任一项的化合物或其盐,其中,上述离去基团为:(1)选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基);或者(2)杂亚芳基。
[0071]
[10][1]~[9]中任一项的化合物或其盐,其中,上述亲核基团为选自下述的基团:赖氨酸残基的侧链中的nh
2
、酪氨酸残基的侧链中的oh、丝氨酸残基的侧链中的oh、苏氨酸残基的侧链中的oh、和半胱氨酸残基的侧链中的sh。
[0072]
[11][1]~[10]中任一项的化合物或其盐,其中,上述亲电子基团为选自-c(=o)-、-so
2-、和-ch
2-的基团。
[0073]
[12][1]~[11]中任一项的化合物或其盐,其中,上述生物正交性官能团为选自下述的基团:叠氮残基、醛残基、硫醇残基、炔烃残基、烯烃残基、卤素残基、四嗪残基、硝酮残基、羟胺残基、腈残基、肼残基、酮残基、硼酸残基、氰基苯并噻唑残基、烯丙基残基、膦残基、马来酰亚胺残基、二硫化物残基、硫酯残基、α-卤代羰基残基、异腈残基、悉尼酮残基、和硒残基。
[0074]
[13][1]~[12]中任一项的化合物或其盐,其中,上述生物正交性官能团为选自叠氮残基、硫醇残基、炔烃残基、马来酰亚胺残基、和二硫化物残基的基团。
[0075]
[14][1]~[13]中任一项的化合物或其盐,其中,上述式(i)所表示的化合物为下
述式(i-1)所表示的化合物:
[0076]
a-l
1-l
2-e
1-e
2-e
3-b
ꢀꢀꢀꢀꢀꢀ
(i-1)
[0077]
[式中,
[0078]
a和b与上述式(i)中相应符号的含义相同,
[0079]
l
1
为键或二价基团,
[0080]
l
2
为离去基团,
[0081]
e
1
为(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力的亲电子基团,
[0082]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数1~6的烷基。)、n(r
3
)(这里,r
3
为氢原子或碳原子数1~6的烷基。)、o、s、或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
和r
5
分别独立地为氢原子或碳原子数1~6的烷基。)。];或者(b)下述式(i)所表示的基团:
[0083]
[化学式1]
[0084][0085]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0086]
e
3
在e
2
为-x-y-的情况下是二价基团,在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0087]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e
1
上切割并脱离的能力。]。
[0088]
[15][14]的化合物或其盐,其中,上述l
2
为:
[0089]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。];
[0090]
(b)杂亚芳基;或者
[0091]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。]。
[0092]
[16][14]或[15]的化合物或其盐,其中,上述l
2
为选自下述结构式的基团:
[0093]
[化学式2]
[0094][0095]
(这里,ewg为吸电子基团,
[0096]
m为0~4的整数,
[0097]
n为0~3的整数,
[0098]
r为氢原子或碳原子数1~6的烷基,
[0099]
○
(白色圆)为与l
1
的结合键,
●
(黑色圆)为与e
1
的结合键。)。
[0100]
[17][1]~[16]中任一项的化合物或其盐,其中,连接a和e的l或l
1-l
2
的主链由20个以下的原子构成。
[0101]
[18][14]~[17]中任一项的化合物或其盐,其中,上述式(i-1)所表示的化合物为下述式(i-2)所表示的化合物:
[0102]
a-l
1-l
2-e
1-x-y-e
3-b
ꢀꢀ
(i-2)
[0103]
[式中,
[0104]
a、l
1
、x、y和b与上述式(i-1)中相应符号的含义相同,
[0105]
l
2
为:
[0106]
(a)环p-q-[这里,环p选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。];
[0107]
(b)杂亚芳基;或者
[0108]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。],
[0109]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0110]
e
3
为二价基团。]。
[0111]
[19][14]~[17]中任一项的化合物或其盐,其中,上述式(i-1)所表示的化合物为下述式(i-3)所表示的化合物:
[0112]
[化学式3]
[0113][0114]
[式中,
[0115]
a、l
1
、环z和b与上述式(i-1)中相应符号的含义相同,
[0116]
l
2
为:
[0117]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。];
[0118]
(b)杂亚芳基;或者
[0119]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数1~6的烷基。)。],
[0120]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0121]
e
3
为键或二价基团。]。
[0122]
[20]基于生物正交性官能团的抗体的位置选择性修饰试剂,该修饰试剂包含下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐:
[0123]
a-l-e-b
ꢀꢀꢀꢀꢀꢀ
(i)
[0124]
[式中,
[0125]
a为针对抗体的亲和性物质,
[0126]
l为包含离去基团的二价基团,
[0127]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0128]
b为生物正交性官能团,
[0129]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[0130]
[21]具有生物正交性官能团的抗体或其盐的制备方法,该制备方法包括:
[0131]
使下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐与抗体反应,生成下述式(ii)所表示的具有生物正交性官能团的抗体或其盐,
[0132]
a-l-e-b
ꢀꢀꢀꢀꢀ
(i)
[0133]
[式中,
[0134]
a为针对抗体的亲和性物质,
[0135]
l为包含离去基团的二价基团,
[0136]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0137]
b为生物正交性官能团,
[0138]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。];
[0139]
ab-e-b
ꢀꢀꢀꢀꢀ
(ii)
[0140]
[式中,
[0141]
e和b与上述式(i)中相应符号的含义相同,
[0142]
ab为抗体。]。
[0143]
[22]具有功能性物质的抗体或其盐的制备方法,该制备方法包括:
[0144]
(1)使下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐与抗体反应,生成下述式(ii)所表示的具有生物正交性官能团的抗体或其盐,
[0145]
a-l-e-b
ꢀꢀꢀꢀꢀ
(i)
[0146]
[式中,
[0147]
a为针对抗体的亲和性物质,
[0148]
l为包含离去基团的二价基团,
[0149]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0150]
b为生物正交性官能团,
[0151]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。],
[0152]
ab-e-b
ꢀꢀꢀꢀꢀꢀ
(ii)
[0153]
[式中,
[0154]
e和b与上述式(i)中相应符号的含义相同,
[0155]
ab为抗体。];以及
[0156]
(2)使上述式(ii)所表示的具有生物正交性官能团的抗体或其盐经由生物正交性官能团与功能性物质反应,生成下述式(iii)所表示的具有功能性物质的抗体或其盐:
[0157]
ab-e-b
’-
f
ꢀꢀꢀꢀꢀ
(iii)
[0158]
[式中,
[0159]
ab与上述式(ii)中相应符号的含义相同,
[0160]
e与上述式(i)中相应符号的含义相同,
[0161]
b
’
为包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团,
[0162]
f为功能性物质。]。
[0163]
[23]下述式(ii-1)所表示的位置选择性地具有生物正交性官能团的抗体或其盐:
[0164]
ab-e
1-e
2-e
3-b
ꢀꢀꢀꢀꢀ
(ii-1)
[0165]
[式中,
[0166]
ab为抗体,
[0167]
e
1
为与抗体中的亲核基团连接的亲电子基团,
[0168]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立为氢原子或碳原子数1~6的烷基。)、n(r
3
)(这里,r
3
为氢原子或碳原子数1~6的烷基。)、o、s、或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
和r
5
分别独立为氢原子或碳原子数1~6的烷基。)。];或者(b)下述式(i)所表示的基团:
[0169]
[化学式4]
[0170][0171]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0172]
e
3
在e
2
为-x-y-的情况下是二价基团,在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0173]
b为生物正交性官能团。]。
[0174]
[24][23]的抗体或其盐,其中,上述抗体为仅在单克隆抗体的恒定区具有生物正交性官能团的抗体。
[0175]
[25][23]或[24]的抗体或其盐,其中,上述抗体为仅在单克隆抗体的fc区具有生物正交性官能团的抗体。
[0176]
[26][23]~[25]中任一项的抗体或其盐,其中,上述抗体为在人igg fc区中的由246~248位或288~290位的氨基酸残基构成的区域中位置选择性地具有生物正交性官能团的人igg。
[0177]
[27][23]~[26]中任一项的抗体或其盐,其中,上述式(ii-1)所表示的上述抗体
为下述式(ii-2)所表示的位置选择性地具有生物正交性官能团的抗体:
[0178]
ab-e
1-x-y-e
3-b
ꢀꢀꢀꢀꢀꢀ
(ii-2)
[0179]
[式中,
[0180]
ab、x、y和b与上述式(ii-1)中相应符号的含义相同,
[0181]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0182]
e
3
为二价基团。]。
[0183]
[28][23]~[26]中任一项的抗体或其盐,其中,上述式(ii-1)所表示的上述抗体为下述式(ii-3)所表示的位置选择性地具有生物正交性官能团的抗体:
[0184]
[化学式5]
[0185][0186]
[式中,
[0187]
ab、环构成原子x
’
、环z和b与上述式(ii-1)中相应符号的含义相同,
[0188]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0189]
e
3
为键或二价基团。]。
[0190]
[29]下述式(iii-1)所表示的位置选择性地具有功能性物质的抗体或其盐:
[0191]
ab-e
1-e
2-e
3-b
’-
f
ꢀꢀꢀꢀꢀꢀ
(iii-1)
[0192]
[式中,
[0193]
ab为抗体,
[0194]
e
1
为与抗体中的亲核基团连接的亲电子基团,
[0195]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数1~6的烷基。)、n(r
3
)(这里,r
3
为氢原子或碳原子数1~6的烷基。)、o、s、或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
和r
5
分别独立地为氢原子或碳原子数1~6的烷基。)。];或者(b)下述式(i)所表示的基团:
[0196]
[化学式6]
[0197][0198]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0199]
e
3
在e
2
为-x-y-的情况下是二价基团,在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0200]
b
’
为包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团,
[0201]
f为功能性物质。]。
[0202]
[30][29]的抗体或其盐,其中,上述抗体为仅在单克隆抗体的恒定区具有生物正交性官能团的抗体。
[0203]
[31][29]或[30]的抗体或其盐,其中,上述抗体为仅在单克隆抗体的fc区具有生物正交性官能团的抗体。
[0204]
[32][29]~[31]中任一项的抗体或其盐,其中,上述抗体为在人igg fc区中的由246~248位或288~290位的氨基酸残基构成的区域中位置选择性地具有功能性物质的人igg。
[0205]
[33][29]~[32]中任一项的抗体或其盐,其中,上述式(iii-1)所表示的上述抗体为下述式(iii-2)所表示的位置选择性地具有功能性物质的抗体:
[0206]
ab-e
1-x-y-e
3-b
’-
f
ꢀꢀꢀꢀꢀꢀ
(iii-2)
[0207]
[式中,
[0208]
ab、x、y、b
’
和f与上述式(iii-1)中相应符号的含义相同,
[0209]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0210]
e
3
为二价基团]。
[0211]
[34][29]~[32]中任一项的抗体或其盐,其中,上述式(iii-1)所表示的上述抗体为下述式(iii-3)所表示的位置选择性地具有功能性物质的抗体:
[0212]
[化学式7]
[0213][0214]
[式中,
[0215]
ab、环构成原子x
’
、环z、b
’
和f与上述式(iii-1)中相应符号的含义相同,
[0216]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0217]
e
3
为键或二价基团。]。
[0218]
[35]下述式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物或其盐:
[0219]
a-l-e-f
ꢀꢀꢀꢀꢀ
(iv)
[0220]
[式中,
[0221]
a为针对抗体的亲和性物质,
[0222]
l为包含离去基团的二价基团,
[0223]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0224]
f为功能性物质,
[0225]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割
并脱离的能力。]。
[0226]
[36]基于功能性物质的抗体的位置选择性修饰试剂,该修饰试剂包含下述式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物或其盐:
[0227]
a-l-e-f
ꢀꢀꢀꢀꢀ
(iv)
[0228]
[式中,
[0229]
a为针对抗体的亲和性物质,
[0230]
l为包含离去基团的二价基团,
[0231]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0232]
f为功能性物质,
[0233]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[0234]
[37]具有功能性物质的抗体或其盐的制备方法,该制备方法包括:
[0235]
使下述式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物或其盐与抗体反应,生成下述式(iii)所表示的具有功能性物质的抗体或其盐:
[0236]
a-l-e-f
ꢀꢀꢀꢀꢀ
(iv)
[0237]
[式中,
[0238]
a为针对抗体的亲和性物质,
[0239]
l为包含离去基团的二价基团,
[0240]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0241]
f为功能性物质,
[0242]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。];
[0243]
ab-e-f
ꢀꢀꢀꢀꢀ
(iii)
[0244]
[式中,
[0245]
ab为抗体,
[0246]
e和f与上述式(iv)中相应符号的含义相同。]。
[0247]
发明效果
[0248]
具有针对抗体的亲和性物质、和生物正交性官能团或功能性物质的本发明的化合物或其盐例如可用于抗体的位置选择性修饰。
[0249]
位置选择性地具有生物正交性官能团的本发明的抗体或其盐例如可用作位置选择性地具有功能性物质的抗体或其盐的调制中的中间体。
[0250]
位置选择性地具有功能性物质的本发明的抗体或其盐例如可用作药物或试剂(例如诊断药、研究用试剂)。
附图说明
[0251]
[图1]图1是显示本发明的概要的示意图。
[0252]
[图2]图2是显示igg抗体曲妥珠单抗-肽复合物合成中的基于sds-page的分析结
果的图。泳道1、3、6、8:分子量标志物;泳道2:未反应的igg抗体曲妥珠单抗(对照、分子量5万附近的谱带显示重链,分子量2万5千附近的谱带显示轻链);泳道4:由igg抗体曲妥珠单抗和化合物10形成的复合物(分子量5万附近之上的谱带显示在曲妥珠单抗的重链上偶联了化合物10。分子量5万附近之下的谱带显示未反应的重链,分子量2万5千附近的谱带显示未反应的轻链);泳道5:由igg抗体曲妥珠单抗和化合物11形成的复合物(分子量5万附近之上的谱带显示在曲妥珠单抗的重链上偶联了化合物11。分子量5万附近之下的谱带显示未反应的重链,分子量2万5千附近的谱带显示未反应的轻链);泳道7:igg抗体曲妥珠单抗和化合物12偶联后的反应混合物(分子量5万附近的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。没有看到偶联了化合物12的谱带)。
[0253]
[图3]图3是显示向igg抗体曲妥珠单抗中位置特异性地导入马来酰亚胺,之后与具有硫醇的肽试剂偶联而合成的曲妥珠单抗-肽复合物的基于sds-page的分析结果的图。泳道1、9:分子量标志物。泳道2:将igg抗体曲妥珠单抗用化合物22(相对于抗体为10摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道3:将igg抗体曲妥珠单抗用化合物22(相对于抗体为20摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链,分子量2万5千附近的谱带显示未反应的轻链。泳道4:将igg抗体曲妥珠单抗用化合物22(相对于抗体为40摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链,分子量2万5千附近的谱带显示未反应的轻链。泳道5:将igg抗体曲妥珠单抗用化合物23(相对于抗体为10摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道6:将igg抗体曲妥珠单抗用化合物23(相对于抗体为20摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道7:将igg抗体曲妥珠单抗用化合物23(相对于抗体为40摩尔当量)进行处理,再位置选择性地导入马来酰亚胺,之后偶联化合物25而得到的复合物。分子量5万附近之上的谱带显示向曲妥珠单抗的重链中导入马来酰亚胺,并与化合物25偶联。分子量5万附近之下的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道8、10:未反应的igg抗体曲妥珠单抗(对照、分子量5万附近的谱带显示重链,分子量2万5千附近的谱带显示轻链)。泳道11:将igg抗体曲妥珠单抗用化合物24(相对于抗体为10摩尔当量)进行处理,之后加入化合物25而得到的反应混合物。分子量5万附近的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道12:将igg抗体曲妥珠单抗用化合物24(相对于抗体为20摩尔当量)进行处理,之后加入化合物25而得到的反应混合物。分子量5万附近的谱带显示
未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。泳道13:将igg抗体曲妥珠单抗用化合物24(相对于抗体为40摩尔当量)进行处理,之后加入化合物25而得到的反应混合物。分子量5万附近的谱带显示未反应的重链、分子量2万5千附近的谱带显示未反应的轻链。
[0254]
[图4]图4是显示(4-5-1)中合成的曲妥珠单抗-马来酰亚胺修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0255]
[图5]图5是显示(6-1-1)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体1)的还原后条件下的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,上段显示修饰体。
[0256]
[图6]图6是显示(6-1-2)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体3)的还原后条件下的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,上段显示修饰体。
[0257]
[图7]图7是显示(6-1-3)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体6)的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0258]
[图8]图8是显示(6-1-3)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体8)的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0259]
[图9]图9是显示(6-1-3)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体10)的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0260]
[图10]图10是显示(6-1-4)中合成的阿达木单抗-叠氮修饰体(叠氮修饰抗体28)的还原后条件下的esi-tofms的图。上段显示未反应的阿达木单抗的测定结果,下段显示修饰体。
[0261]
[图11]图11是显示(6-1-4)中合成的地诺单抗-叠氮修饰抗体(叠氮修饰抗体29)的还原后条件下的esi-tofms的图。上段显示未反应的地诺单抗的测定结果,下段显示修饰体。
[0262]
[图12]图12是显示(6-1-4)中合成的度匹鲁单抗(dupilumab)-叠氮修饰抗体(叠氮修饰抗体30)的还原后条件下的esi-tofms的图。上段显示未反应的度匹鲁单抗的测定结果,下段显示修饰体。
[0263]
[图13]图13是显示(6-1-4)中合成的利妥昔单抗-叠氮修饰抗体(叠氮修饰抗体31)的还原后条件下的esi-tofms的图。下段显示未反应的利妥昔单抗的测定结果,上段显示修饰体。
[0264]
[图14]图14是显示(8-1-1)中合成的曲妥珠单抗-保护硫醇修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0265]
[图15]图15是显示(8-3-1)中脱保护的曲妥珠单抗-硫醇修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0266]
[图16]图16是显示(9-1-1)中合成的曲妥珠单抗-叠氮修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0267]
[图17]图17是显示(9-1-5)中合成的曲妥珠单抗-叠氮修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0268]
[图18]图18是显示(9-2-2)中合成的曲妥珠单抗-叠氮修饰体的还原后条件下的esi-tofms的图。上段显示未反应的曲妥珠单抗的测定结果,下段显示修饰体。
[0269]
[图19]图19是显示(10-1-1)中合成的曲妥珠单抗-cy3复合物的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,中段显示(6-1-1)中合成的曲妥珠单抗-叠氮修饰体的测定结果,上段显示曲妥珠单抗-cy3复合物。
[0270]
[图20]图20是显示(10-1-2)中处理的曲妥珠单抗-cy3复合物的还原条件下的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,中段显示(6-1-1)中合成的曲妥珠单抗-叠氮修饰体的测定结果,上段显示曲妥珠单抗-cy3复合物。
[0271]
[图21]图21是显示(10-2-2)中合成的曲妥珠单抗-肽复合物的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,中段显示(6-1-1)中合成的曲妥珠单抗-叠氮修饰体的测定结果,上段显示曲妥珠单抗-cy3复合物。
[0272]
[图22]图22是显示(10-2-3)中处理的曲妥珠单抗-cy3复合物在还原条件下的esi-tofms的图。下段显示未反应的曲妥珠单抗的测定结果,中段显示(6-1-1)中合成的曲妥珠单抗-叠氮修饰体的测定结果,上段显示曲妥珠单抗-肽复合物。
[0273]
[图23]图23是显示(10-3-1)中处理的曲妥珠单抗-马来酰亚胺化合物复合物在还原条件下的esi-tofms的图。上段显示曲妥珠单抗的硫醇导入体的测定结果,下段显示曲妥珠单抗-马来酰亚胺化合物复合物。
[0274]
[图24]图24是显示(10-3-2)中处理的反应产物在还原条件下的esi-tofms的图。上段显示曲妥珠单抗的硫醇导入体的测定结果,下段显示曲妥珠单抗-马来酰亚胺化合物复合物。
[0275]
[图25]图25是显示(1)曲妥珠单抗的重链的氨基酸序列(seq id no:2)、(2)曲妥珠单抗的轻链的氨基酸序列(seq id no:4)的图。
[0276]
[图26]图26是显示(1)地诺单抗的重链的氨基酸序列(seq id no:104)、(2)地诺单抗的轻链的氨基酸序列(seq id no:105)的图。
[0277]
[图27]图27是显示(1)度匹鲁单抗的重链的氨基酸序列(seq id no:106)、(2)度匹鲁单抗的轻链的氨基酸序列(seq id no:107)的图。
[0278]
[图28]图28是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0279]
[图29]图29是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0280]
[图30]图30是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgvevhn aktkpr(seq id no:12)的肽片段的ms谱的图。
[0281]
[图31]图31是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的fnwyvdgvevhnaktkpr(seq id no:12)的肽片段的cid谱的图。
[0282]
[图32]图32是显示添加了巯基丙酸的马来酰亚胺修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcp apellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0283]
[图33]图33是显示马来酰亚胺mpa修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0284]
[图34]图34是显示烷基叠氮修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellggpsv flfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0285]
[图35]图35是显示烷基叠氮修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0286]
[图36]图36是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的vvsvltvlhqdw lngkeyk(seq id no:101)的肽片段的ms谱的图。
[0287]
[图37]图37是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的vvsvltvlhqdw lngkeyk(seq id no:101)的肽片段的cid谱的图。
[0288]
[图38]图38是显示叠氮苯甲酸修饰曲妥珠单抗的317位的赖氨酸残基被高度选择性地修饰的基于biopharmafinder的分析结果的图。
[0289]
[图39]图39是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgvevhn aktkpr(seq id no:12)的肽片段的ms谱的图。
[0290]
[图40]图40是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgvevhn aktkpr(seq id no:12)的肽片段的cid谱的图。
[0291]
[图41]图41是显示叠氮苯甲酸修饰曲妥珠单抗的288位或290位的赖氨酸残基被高度选择性地修饰的基于biopharma finder的分析结果的图。
[0292]
[图42]图42是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapel lggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0293]
[图43]图43是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0294]
[图44]图44是显示叠氮苯甲酸修饰曲妥珠单抗的246位或248位的赖氨酸残基被高度选择性地修饰的基于biopharma finder的分析结果的图。
[0295]
[图45]图45是显示乙酰基硫醇修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0296]
[图46]图46是显示乙酰基硫醇修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellgg psvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0297]
[图47]图47是显示乙酰基硫醇修饰曲妥珠单抗的246位或248位的赖氨酸残基被
高度选择性地修饰的基于biopharma finder的分析结果的图。
[0298]
[图48]图48是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellggpsv flfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0299]
[图49]图49是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpapellggpsv flfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0300]
[图50]图50是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgvevhn aktkpr(seq id no:12)的肽片段的ms谱的图。
[0301]
[图51]图51是显示叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgvevhnakt kpr(seq id no:12)的肽片段的cid谱的图。
[0302]
[图52]图52是显示乙酰基硫醇和叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcppcpa pellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱的图。
[0303]
[图53]图53是显示乙酰基硫醇和叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的thtcpp cpapellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的cid谱的图。
[0304]
[图54]图54是显示乙酰基硫醇和叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvd gvevhnaktkpr(seq id no:12)的肽片段的ms谱的图。
[0305]
[图55]图55是显示乙酰基硫醇和叠氮苯甲酸修饰曲妥珠单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的fnwyvdgve vhnaktkpr(seq id no:12)的肽片段的cid谱的图。
[0306]
[图56]图56是显示乙酰基硫醇和叠氮苯甲酸修饰曲妥珠单抗的246位或248位和288位或290位的赖氨酸残基被高度选择性地修饰的基于biopharmafinder的分析结果的图。
[0307]
[图57]图57是显示苯甲酸修饰地诺单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的ccvecppcpappvagpsv flfppkpkdtlmisr(seq id no:102)的肽片段的ms谱的图。
[0308]
[图58]图58是显示苯甲酸修饰地诺单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的ccvecppcpappvagpsvflf ppkpkdtlmisr(seq id no:102)的肽片段的cid谱的图。
[0309]
[图59]图59是显示苯甲酸修饰地诺单抗的247位或249位的赖氨酸残基被高度选择性地修饰的基于biopharma finder的分析结果的图。
[0310]
[图60]图60是显示苯甲酸修饰度匹鲁单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的ygppcppcpapeflggpsvfl fppkpkdtlmisr(seq id no:103)的肽片段的ms谱的图。
[0311]
[图61]图61是苯甲酸修饰度匹鲁单抗的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点的ygppcppcpapeflggpsvfl fppkpkdtlmisr(seq id no:103)的肽片段的cid谱
的图。
[0312]
[图62]图62是显示苯甲酸修饰度匹鲁单抗的251位或253位的赖氨酸残基被高度选择性地修饰的基于biopharma finder的分析结果的图。
[0313]
[图63]图63是显示基于esi-tofms(非还原条件下)的(12-1-1)中合成的曲妥珠单抗-dm1偶联物的分析结果的图。
[0314]
[图64]图64是显示基于esi-tofms(还原条件下)的(12-1-1)中合成的曲妥珠单抗-dm1偶联物的分析结果的图。
[0315]
[图65]图65是显示基于esi-tofms(非还原条件下)的(12-2-1)中合成的曲妥珠单抗-mmae偶联物的分析结果的图。
[0316]
[图66]图66是显示基于esi-tofms(还原条件下)的(12-2-1)中合成的曲妥珠单抗-mmae偶联物的分析结果的图。
[0317]
[图67]图67是显示基于esi-tofms(非还原条件下)的(12-3-1)中合成的利妥昔单抗-dm1偶联物的分析结果的图。
[0318]
[图68]图68是显示基于esi-tofms(还原条件下)的(12-3-1)中合成的利妥昔单抗-dm1偶联物的分析结果的图。
[0319]
[图69]图69是显示基于esi-tofms(非还原条件下)的(12-4-1)中合成的利妥昔单抗-dm1偶联物的分析结果的图。
[0320]
[图70]图70是显示基于esi-tofms(还原条件下)的(12-4-1)中合成的利妥昔单抗-dm1偶联物的分析结果的图。
[0321]
[图71]图71是显示(1)曲妥珠单抗的重链中的fc区和igg1 fc区的共有氨基酸序列(seq id no:1)、以及(2)igg1 fc区的氨基酸序列(seq id no:3)的图。
具体实施方式
[0322]
1.具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐
[0323]
1-1.概要
[0324]
本发明提供式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐:
[0325]
a-l-e-b
ꢀꢀꢀꢀꢀ
(i)
[0326]
[式中,
[0327]
a为针对抗体的亲和性物质,
[0328]
l为包含离去基团的二价基团,
[0329]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0330]
b为生物正交性官能团,
[0331]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[0332]
在关于本发明而示出的式(i)及其他式等的书写中,-(连字符)表示存在于其两侧的2个单元共价键合。因此,在式(i)中,a与l共价键合,l与a及e共价键合,e与l及b共价键合,b与e共价键合。式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合
物或其盐显示:针对抗体的亲和性物质(a)经由a与l的共价键合而包含具有l-e-b的结构单元。因此,在式(i)中,针对抗体的亲和性物质(a)可具有1个具有l-e-b的结构单元或者多个(例如2~5个、优选2~4个、更优选2或3个)具有l-e-b的结构单元(同种或异种)。
[0333]
在其他式中也显示:针对抗体的亲和性物质(a)或抗体(ab)经由共价键合包含式中的特定结构单元(除a或ab以外的结构单元)。因此,在其他式中,针对抗体的亲和性物质(a)或抗体(ab)也可具有1个特定结构单元或多个(例如2~5个、优选2~4个、更优选2或3个)特定结构单元(同种或异种)。
[0334]
1-2.针对抗体的亲和性物质(a)
[0335]
在式(i)中,a为针对抗体的亲和性物质。针对抗体的亲和性物质是指对于抗体具有基于非共价键合的结合能力的物质。
[0336]
本发明中使用的亲和性物质以抗体为靶。抗体可以是经生物分子(例如糖)修饰的抗体,也可以是未经生物分子修饰的抗体。作为抗体,可使用针对来自生物的成分、来自病毒的成分和环境中可见的成分等任意成分的任意抗体,但优选针对来自生物的成分或来自病毒的成分的抗体。作为来自生物的成分,例如可列举:来自哺乳动物、鸟类(例如鸡)等动物、昆虫、微生物、植物、菌类和鱼类的成分(例如蛋白质)。优选来自生物的成分为来自哺乳动物的成分。作为哺乳动物,例如可列举:灵长类(例如人、猴、黑猩猩)、啮齿类(例如小鼠、大鼠、豚鼠、仓鼠、兔)、宠物(例如狗、猫)、家畜(例如牛、猪、山羊)、役畜(例如马、绵羊)。来自生物的成分更优选为来自灵长类或啮齿类的成分(例如蛋白质),从本发明的临床应用的观点来看,更进一步优选为来自人的成分(例如蛋白质)。作为来自病毒的成分,例如可列举:来自于流感病毒(例如禽流感病毒、猪流感病毒)、艾滋病病毒、埃博拉病毒、噬菌体病毒的成分(例如蛋白质)。
[0337]
另外,抗体为多克隆抗体或单克隆抗体,优选为单克隆抗体。作为单克隆抗体,例如可列举:嵌合抗体、人源化抗体、人抗体、附加了规定糖链的抗体(例如以具有n型糖链结合共有序列等的糖链结合共有序列的方式进行了改变的抗体)、双特异性抗体、scfv抗体、fab抗体、f(ab
’
)
2
抗体、vhh抗体、fc区蛋白质、fc融合蛋白质。抗体还可以是二价抗体(例如igg、igd、ige)或四价以上的抗体(例如iga抗体、igm抗体)。
[0338]
作为亲和性物质的靶的抗体还可由任意的氨基酸残基构成,优选由通常构成蛋白质的天然的20种l-α-氨基酸残基构成。作为这样的氨基酸残基,例如可列举:l-丙氨酸(a)、l-天冬酰胺(n)、l-半胱氨酸(c)、l-谷氨酰胺(q)、l-异亮氨酸(i)、l-亮氨酸(l)、l-蛋氨酸(m)、l-苯丙氨酸(f)、l-脯氨酸(p)、l-丝氨酸(s)、l-苏氨酸(t)、l-色氨酸(w)、l-酪氨酸(y)、l-缬氨酸(v)、l-天冬氨酸(d)、l-谷氨酸(e)、l-精氨酸(r)、l-组氨酸(h)或l-赖氨酸(k)和甘氨酸(g)(以下,省略l的书写)。抗体例如可由100个以上、优选120个以上、更优选150个以上、更进一步优选180个以上、特别优选200个以上的氨基酸残基构成。抗体例如还可以是1000个以下、优选900个以下、更优选800个以下、更进一步优选700个以下、特别优选为600个以下。更具体而言,抗体例如可由100~1000个、优选120~900个、更优选150~800个、更进一步优选180~700个以上、特别优选200~600个氨基酸残基构成。在抗体为抗体(例如上述的单克隆抗体)的情况下,上述个数的氨基酸残基可相当于抗体重链的氨基酸残基。
[0339]
作为亲和性物质的靶的抗体还可以是在1个位置或多个位置(优选多个位置)包含
具有可与如后所述的生物正交性官能团反应的侧链或末端(n末端和/或c末端)、优选为侧链的特定氨基酸残基的蛋白质。作为这样的特定氨基酸残基,例如可列举如后所述的氨基酸残基,优选为选自赖氨酸残基、酪氨酸残基、丝氨酸残基、苏氨酸残基和半胱氨酸残基的氨基酸残基。若考虑到本发明的化合物可位置选择性地修饰抗体,则优选在多个位置包含这样的特定氨基酸残基的抗体。作为多个位置,只要是2个以上的位置即可,没有特别限定,例如可以是3个以上的位置,优选5个以上的位置,更优选10个以上的位置,更进一步优选20个以上的位置,特别优选30个以上的位置。多个位置例如还可以是200个以下的位置,优选180个以下的位置,更优选150个以下的位置,更进一步优选120个以下的位置,特别优选100个以下的位置。更具体而言,多个位置例如可以是3~200个位置,优选5~180个位置,更优选10~150个位置,更进一步优选20~120个位置,特别优选30~100个位置。即使是在多个位置包含这样的特定氨基酸残基的抗体,本发明的化合物也可位置选择性地对存在于特定区的1或2个特定氨基酸残基进行修饰。例如,人igg1的赖氨酸残基数,虽然也取决于可变区中的氨基酸组成,但一般认为是70~90个左右。在本发明中,成功实现了位置选择性地对这样的存在于人igg1的特定区的1或2个赖氨酸残基进行修饰。
[0340]
更具体而言,在本发明中,从在维持抗体功能的同时(即,在不使抗体变性而维持原有折叠(native folding)的同时)对存在于抗体中的特定靶位点的氨基酸残基进行修饰的观点来看,优选露出于抗体表面的氨基酸残基的位置选择性修饰。例如,在人igg1等人igg中,露出赖氨酸残基和露出酪氨酸残基存在于以下的位置(基于eu numbering,参照http://www.imgt.org/imgtscientificchart/numbering/hu_ighgnber.html)。
[0341]
(1)露出赖氨酸残基
[0342]
ch2结构域(246位、248位、274位、288位、290位、317位、320位、322位、338位)
[0343]
ch3结构域(360位、414位、439位)
[0344]
(2)露出酪氨酸残基
[0345]
ch2结构域(278位、296位、300位)
[0346]
ch3结构域(436位)
[0347]
(3)露出丝氨酸残基
[0348]
ch2结构域(254位、267位、298位、324位)
[0349]
ch3结构域(375位、400位、415位、440位、442位)
[0350]
(4)露出苏氨酸残基
[0351]
ch2结构域(256位、289位、307位)
[0352]
ch3结构域(335位、359位、393位、437位)
[0353]
因此,人igg1等人igg在赖氨酸残基或酪氨酸残基被修饰的情况下,优选在上述位置的修饰。
[0354]
优选的是,人igg1等人igg在赖氨酸残基、酪氨酸残基、丝氨酸残基或苏氨酸残基被修饰的情况下,在上述(1)~(4)的位置中,可以是存在于向表面的露出性高的以下位置的赖氨酸残基、酪氨酸残基、丝氨酸残基或苏氨酸残基被修饰。
[0355]
(1
’
)露出赖氨酸残基
[0356]
ch2结构域(246位、248位、274位、288位、290位、317位、320位、322位)
[0357]
ch3结构域(360位、414位、439位)
[0358]
(2
’
)露出酪氨酸残基
[0359]
ch2结构域(278位、296位、300位)
[0360]
ch3结构域(436位)
[0361]
(3
’
)露出丝氨酸残基
[0362]
ch2结构域(254位、267位、298位)
[0363]
ch3结构域(400位、415位、440位)
[0364]
(4
’
)露出苏氨酸残基
[0365]
ch2结构域(256位、289位)
[0366]
ch3结构域(335位、359位)
[0367]
因此,人igg1等人igg在赖氨酸残基、酪氨酸残基、丝氨酸残基或苏氨酸残基被修饰的情况下,更优选在上述位置的修饰。
[0368]
更优选的是,人igg1等人igg在赖氨酸残基被修饰的情况下,在上述(1)的位置中,可以是存在于本发明中可有效地进行修饰的ch2结构域中的规定位置(例如246位、248位、288位、290位、317位)的赖氨酸残基被修饰。
[0369]
在特定的实施方式中,作为亲和性物质的靶的抗体,在如上所述在多个位置包含特定氨基酸残基的情况下,可以是在由连续的1~50个氨基酸残基构成的靶区中包含1个以上的特定氨基酸残基、且在除所述靶区以外的非靶区中包含5个以上的特定氨基酸残基。靶区可优选由1~30个、更优选1~20个、进一步优选1~10个、1~5个或1~3个(即1个、2个或3个)氨基酸残基构成。特别优选的是,靶区可以是由存在于特定位置的特定氨基酸残基构成的区域。这样的特定位置也根据靶蛋白质和亲和性物质的种类等而变动,例如可以是抗体的恒定区中的特定区(例如ch1、ch2、ch3)中的特定位置,优选可以是抗体的ch2中的位置。更具体而言,靶区可以是人igg fc中的基于eu numbering的下述残基:
[0370]
(1)lys248残基(以下,本说明书中也简单地书写为“lys248”,相当于人igg ch2区(seq id no:1)的第18个残基)或者lys246残基(以下,本说明书中也简单地书写为“lys246”,相当于人igg ch2区(seq id no:1)的第16个残基);
[0371]
(2)lys288残基(以下,本说明书中也简单地书写为“lys288”,相当于人igg ch2区(seq id no:1)的第58个残基)或者lys290残基(以下,本说明书中也简单地书写为“lys290”,相当于人igg ch2区(seq id no:1)的第60个残基);
[0372]
(3)lys317残基(以下,本说明书中也简单地书写为“lys317”,相当于人igg ch2区(seq id no:1)的第87个残基)。
[0373]
根据本发明,可高度位置选择性地对上述靶区中的特定氨基酸残基进行修饰。这样的位置选择性例如可以是30%以上、优选为40%以上、更优选为50%以上、更进一步优选为60%以上、特别优选为70%以上、80%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上或100%。
[0374]
靶区还可以是存在于特定位置的特定氨基酸残基在以该特定位置为中心分别距n末端侧和c末端侧为a个(这里,a为1~10的任意整数)氨基酸残基的位置为止的区域中,除存在于该特定位置的特定氨基酸残基以外,不含与特定氨基酸残基同种的氨基酸残基的区域。a优选为1~5的整数,更优选为1~3的整数,更进一步优选为1或2,特别优选为1。
[0375]
在优选的实施方式中,抗体为单克隆抗体。作为单克隆抗体等抗体的同种型,例如
可列举:igg(例如igg1、igg2、igg3、igg4)、igm、iga、igd、ige和igy。单克隆抗体为全长抗体或抗体片段(例如f(ab
’
)
2
、fab
’
、fab、fv、单链抗体),但优选全长抗体。特别优选的是,抗体为恒定区中具有人igg(例如igg1、igg2、igg3、igg4)的人抗体、人源化抗体或嵌合抗体。
[0376]
抗体是针对任意抗原的抗体。例如,这样的抗原可以是如上所述的生物或病毒中所发现的成分。作为这样的抗原,例如还可列举:蛋白质[包括寡肽、多肽。可以是经糖等生物分子修饰的蛋白质(例如糖蛋白)]、糖链、核酸、低分子化合物。
[0377]
优选的是,抗体可以是以蛋白质为抗原的抗体。作为蛋白质,例如可列举:细胞膜受体、除细胞膜受体以外的细胞膜蛋白质(例如细胞外基质蛋白质)、配体、可溶性受体。
[0378]
更具体而言,作为抗体的抗原的蛋白质可以是疾病靶蛋白质。作为疾病靶蛋白质,例如可列举以下的蛋白质。
[0379]
(1)癌症领域
[0380]
pd-l1、gd2、pdgfrα(血小板衍生生长因子受体)、cd22、her2、磷脂酰丝氨酸(ps)、epcam、纤维连接蛋白、pd-1、vegfr-2、cd33、hgf、gpnmb、cd27、dec-205、叶酸受体、cd37、cd19、trop2、ceacam5、s1p、her3、igf-1r、dll4、tnt-1/b、cpaas、psma、cd20、cd105(内皮因子)、icam-1、cd30、cd16a、cd38、muc1、egfr、kir2dl1,2,、nkg2a、生腱蛋白c(tenascin-c)、igf(胰岛素样生长因子,insulin-like growth factor)、ctla-4、间皮素(mesothelin)、cd138、c-met、ang2、vegf-a、cd79b、enpd3、叶酸受体α、tem-1、gm2、磷脂酰肌醇蛋白聚糖-3(glypican-3)、巨噬细胞抑制因子(macrophage inhibitory factor)、cd74、notch1(刻缺蛋白1)、notch2、notch3、cd37、tlr-2、cd3、csf-1r、fgfr2b、hla-dr、gm-csf、epha3、b7-h3、cd123、gpa33、frizzled7受体、dll4、vegf、rspo、liv-1、slitrk6、结合素4(nectin-4)、cd70、cd40、cd19、sema4d(cd100)、cd25、met、组织因子(tissue factor)、il-8、egfr、cmet、kir3dl2、bst1(cd157)、p-钙粘蛋白、cea、gitr、tam(肿瘤相关巨噬细胞,tumor associated macrophage)、cea、dll4、ang2、cd73、fgfr2、cxcr4、lag-3、gitr、岩藻糖基gm1(fucosyl gm1)、igf-1、血管生成素2(angiopoietin 2)、csf-1r、fgfr3、ox40、bcma、erbb3、cd137(4-1bb)、ptk7、efna4、fap、dr5、cea、ly6e、ca6、ceacam5、lamp1、组织因子、epha2、dr5、b7-h3、fgfr4、fgfr2、α2-pi、a33、gdf15、caix、cd166、ror1、gitr、bcma、tba、lag-3、epha2、tim-3、cd-200、egfrviii、cd16a、cd32b、pigf、axl、mica/b、thomsen-friedenreich、cd39、cd37、cd73、clec12a、lgr3、转铁蛋白受体、tgfβ、il-17、5t4、rtk、免疫抑制蛋白(immune suppressor protein)、napi2b、路易斯血型b抗原、a34、赖氨酰氧化酶(lysil-oxidase)、dlk-1、trop-2、整合素α9、tag-72(ca72-4)、cd70。
[0381]
(2)自身免疫疾病-炎性疾病
[0382]
il-17、il-6r、il-17r、inf-α、il-5r、il-13、il-23、il-6、actriib、整合素β7(β7-integrin)、il-4αr、has、嗜酸性粒细胞趋化因子1(eotaxin-1)、cd3、cd19、tnf-α、il-15、cd3ε、纤维连接蛋白(fibronectin)、il-1β、il-1α、il-17、tslp(胸腺基质淋巴细胞生成素,thymic stromal lymphopoietin)、lamp(整合素α4β7)、il-23、gm-csfr、tslp、cd28、cd40、tlr-3、baff-r、madcam、il-31r、il-33、cd74、cd32b、cd79b、ige(免疫球蛋白e)、il-17a、il-17f、c5、fcrn、cd28、tlr4、mcam、b7rp1、cxcr1,2配体、il-21、钙粘蛋白11(cadherin-11)、cx3cl1、ccl20、il-36r、il-10r、cd86、tnf-α、il-7r、kv1.3、整合素α9、lifht。
[0383]
(3)脑神经疾病
[0384]
cgrp、cd20、β-淀粉样蛋白、β-淀粉样蛋白原纤维、降钙素基因相关肽受体(calcitonin gene-related peptide receptor)、lingo(ig domain containing 1)、α突触核蛋白(synuclein)、细胞外tau、cd52、胰岛素受体、tau蛋白、tdp-43、sod1、tauc3、jc病毒。
[0385]
(4)感染症
[0386]
艰难梭菌毒素b(clostridium difficile toxin b)、巨细胞病毒、rs病毒、lps、金黄色葡萄球菌α毒素(s.aureus alpha-toxin)、m2e蛋白、psl、pcrv、金黄色葡萄球菌毒素(s.aureus toxin)、甲型流感、藻蛋白酸盐(alginate)、金黄色葡萄球菌、pd-l1、乙型流感、不动杆菌、f蛋白、env、cd3、病原性大肠杆菌、克雷白氏杆菌、肺炎球菌。
[0387]
(5)遗传性-罕见疾病
[0388]
淀粉样蛋白al、sema4d(cd100)、胰岛素受体、angptl3、il4、il13、fgf23、促肾上腺皮质激素、甲状腺素转运蛋白(transthyretin)、亨廷顿蛋白(huntingtin)。
[0389]
(6)眼疾病
[0390]
d因子、igf-1r、pgdfr、ang2、vegf-a、cd-105(内皮因子,endoglin)、igf-1r、β淀粉样蛋白。
[0391]
(7)骨科-整形外科领域
[0392]
硬骨素(sclerostin)、肌抑素(myostatin)、dickkopf-1、gdf8、rnakl、has、siglec-15。
[0393]
(8)血液疾病
[0394]
vwf、ixa因子、x因子、ifnγ、c5、bmp-6、铁转运蛋白(ferroportin)、tfpi。
[0395]
(9)其他疾病
[0396]
baff(b细胞活化因子,b cell activating factor)、il-1β、pcsk9、ngf、cd45、tlr-2、glp-1、tnfr1、c5、cd40、lpa、催乳素受体、vegfr-1、cb1、内皮因子(endoglin)、pth1r、cxcl1、cxcl8、il-1β、at2-r、iapp。
[0397]
在更优选的实施方式中,针对抗体的亲和性物质为针对单克隆抗体的亲和性物质。单克隆抗体的同型,关于抗体与上述相同,但优选igg(例如igg1、igg2、igg3、igg4)。优选的是,单克隆抗体为全长单克隆抗体。
[0398]
在更进一步优选的实施方式中,针对抗体的亲和性物质为针对作为全长单克隆抗体的嵌合抗体、人源化抗体、或人抗体(例如igg1、igg2、igg3、igg4等igg)的亲和性物质。
[0399]
在特别优选的实施方式中,针对抗体的亲和性物质为针对抗体的亲和性物质,该抗体包含选自下述(a)~(c)中的任一种fc区蛋白质、且具有抗原结合能力:
[0400]
(a)包含seq id no:1的氨基酸序列的fc区蛋白质;
[0401]
(b)包含在seq id no:1的氨基酸序列中有1个或多个氨基酸残基被插入、添加、缺失或取代而得到的氨基酸序列的fc区蛋白质;或者
[0402]
(c)包含与seq id no:1的氨基酸序列显示90%以上的同一性的氨基酸序列的fc区蛋白质。
[0403]
seq id no:1的氨基酸序列为fc区蛋白质。已知这样的fc区蛋白质具有分泌能力。因此,上述(a)~(c)的fc区蛋白质可具有分泌能力。另外,包含这样的fc区蛋白质的抗体可具有抗原结合能力。seq id no:1中的18位的氨基酸残基为任意的氨基酸残基,但优选为中
性氨基酸残基,更优选为如后所述的具有非极性侧链的氨基酸残基,更进一步优选为亮氨酸、异亮氨酸或丙氨酸,特别优选为亮氨酸或丙氨酸。seq id no:1中的19位的氨基酸残基为任意的氨基酸残基,但优选为中性氨基酸残基或酸性氨基酸残基,更优选为具有非极性侧链的氨基酸残基或酸性氨基酸残基,更进一步优选为亮氨酸或谷氨酸。seq id no:1中的21位的氨基酸残基为任意的氨基酸残基,但优选为中性氨基酸残基,更优选为具有非极性侧链的氨基酸残基,更进一步优选为甘氨酸或丙氨酸。seq id no:1中的140位的氨基酸残基为任意的氨基酸残基,但优选为酸性氨基酸残基,更优选为谷氨酸或天冬氨酸。seq id no:1中的142位的氨基酸残基为任意的氨基酸残基,但优选为中性氨基酸残基,更优选为具有非极性侧链的氨基酸残基,更进一步优选为蛋氨酸、亮氨酸或异亮氨酸,特别优选为蛋氨酸或亮氨酸。seq id no:1中的177位的氨基酸残基为任意的氨基酸残基,但优选为中性氨基酸残基,更优选为如后所述的具有不带电的极性侧链的氨基酸残基或具有非极性侧链的氨基酸残基,更进一步优选为苏氨酸、丙氨酸或甘氨酸,特别优选为苏氨酸或丙氨酸。
[0404]
在优选的实施方式中,seq id no:1的氨基酸序列可以是由seq id no:2的氨基酸序列中的220~449位的氨基酸残基构成的氨基酸序列。
[0405]
在另一优选的实施方式中,seq id no:1的氨基酸序列可以是由seq id no:3的氨基酸序列中的7~236位的氨基酸残基构成的氨基酸序列。
[0406]
在特定的实施方式中,包含“含有如上所述的氨基酸序列的fc区蛋白质”的抗体,可以是包含“含有如上所述的氨基酸序列的fc区蛋白质”和“抗体的恒定区”的抗体。作为这样的抗体的恒定区,可以是嵌合抗体、人源化抗体、或人抗体(例如igg1、igg2、igg3、igg4等igg)的恒定区。
[0407]
在fc区蛋白质(b)中,1个或多个氨基酸残基可通过选自缺失、取代、添加和插入的1、2、3或4种突变而改变。氨基酸残基的突变可被导入至氨基酸序列中的1个区域,也可被导入至多个不同的区域。术语“1个或多个”表示不大幅破坏蛋白质活性的个数。术语“1个或多个”所示的数量例如为1~100个,优选为1~80个,更优选为1~50个、1~30个、1~20个、1~10个或1~5个(例如1个、2个、3个、4个或5个)。
[0408]
在fc区蛋白质(c)中,与seq id no:1的氨基酸序列的同一性%可以是70%以上、75%以上、80%以上、85%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上或99%以上。在本发明中,肽或多肽(蛋白质)的同一性%的计算可通过算法blastp来进行。更具体而言,多肽的同一性%的计算可使用national center for biotechnology information(ncbi)所提供的算法blastp中默认设定的评分参数(matrix:blosum62;gap costs:existence=11extension=1;compositional adjustments:conditional compositional score matrix adjustment)来进行。此外,多核苷酸(基因)的同一性%的计算可通过算法blastn来进行。更具体而言,多核苷酸的同一性%的计算可使用ncbi所提供的算法blastn中默认设定的评分参数(match/mismatch scores=1,-2;gap costs=linear)来进行。
[0409]
分泌能力中的分泌是与分泌蛋白的分泌(所谓的可溶性)同样的含义。因此,“具有分泌能力”是指与通常的抗体同样,作为抗体发挥作用。
[0410]
上述包含fc区蛋白质的抗体只要保持目标的特性(例如分泌能力、抗原结合能力),可向特定位点导入突变。可保持目标特性的可导入突变的氨基酸残基的位置对本领域
技术人员而言是不言自明的。具体而言,对于本领域技术人员而言,1)比较具有同种特性的多种蛋白质的氨基酸序列,2)明确相对保存的区域和相对不保存的区域,接着3)由相对保存的区域和相对不保存的区域可分别预测对于功能能发挥重要的作用的区域和对于功能不能发挥重要的作用的区域,所以可识别结构/功能的相关性。因此,本领域技术人员可以对上述包含fc区蛋白质的抗体的氨基酸序列中可导入突变的氨基酸残基的位置进行特定。
[0411]
在氨基酸残基通过取代(置换)而被突变的情况下,氨基酸残基的取代可以是保存性取代。在本说明书中使用的情况下,术语“保存性取代”是指,将规定的氨基酸残基用具有类似侧链的氨基酸残基进行取代。具有类似侧链的氨基酸残基的家族在该领域中是周知的。例如,作为这样的家族,可列举具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电的极性侧链的氨基酸(例如天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、具有β位分支侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)、具有芳族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)、具有含羟基(例如醇性、酚性)的侧链的氨基酸(例如丝氨酸、苏氨酸、酪氨酸)、和具有含硫的侧链的氨基酸(例如半胱氨酸、蛋氨酸)。优选的是,氨基酸的保存性取代可以是在天冬氨酸与谷氨酸之间的取代、在精氨酸与赖氨酸与组氨酸之间的取代、在色氨酸与苯丙氨酸之间的取代、在苯丙氨酸与缬氨酸之间的取代、在亮氨酸与异亮氨酸与丙氨酸之间的取代、以及在甘氨酸与丙氨酸之间的取代。
[0412]
作为本发明中使用的抗体或者包含选自上述(a)~(c)中的任一种fc区的抗体,例如可列举:嵌合抗体(例如利妥昔单抗(rituximab)、巴利昔单抗(basiliximab)、英夫利昔单抗(infliximab)、西妥昔单抗(cetuximab)、司妥昔单抗(siltuximab)、达妥昔单抗(dinutuximab)、奥塔昔单抗(altertoxaximab,
オルタトキサシマブ
))、人源化抗体(例如达利珠单抗(daclizumab)、帕利珠单抗(palivizumab)、曲妥珠单抗(trastuzumab)、阿伦单抗(alemtuzumab)、奥马珠单抗(omalizumab)、依法利珠单抗(efalizumab)、贝伐珠单抗(bevacizumab)、那他珠单抗(natalizumab)(igg4)、托珠单抗(tocilizumab)、依库珠单抗(eculizumab)(igg2)、莫加木珠单抗(mogamulizumab)、帕妥珠单抗(pertuzumab)、奥滨尤妥珠单抗(obinutuzumab)、维多珠单抗(vedolizumab)、派姆单抗(pembrolizumab)(igg4)、美泊利单抗(mepolizumab)、埃罗妥珠单抗(elotuzumab)、达雷木单抗(daratumumab)、依奇珠单抗(ixekizumab)(igg4)、瑞利珠单抗(reslizumab)(igg4)、阿特珠单抗(atezolizumab))、人抗体(例如阿达木单抗(adalimumab)、帕尼单抗(panitumumab)、戈利木单抗(golimumab)、优特克单抗(ustekinumab)、卡纳单抗(canakinumab)、奥法木单抗(ofatumumab)、地诺单抗(denosumab)(igg2)、伊匹单抗(ipirimumab)、贝利木单抗(belimumab)、雷昔库单抗(raxibacumab)、雷莫芦单抗(ramucirumab)、纳武单抗(nivolumab)(igg4)、苏金单抗(secukinumab)、依伏库单抗(evolocumab)(igg2)、阿利库单抗(alirocumab)、耐昔妥珠单抗(necitumumab)、柏达鲁单抗(brodalumab)(igg2)、奥拉单抗(olaratumab)、度匹鲁单抗(igg4))(在未提及igg亚型的情况下表示是igg1)。
[0413]
作为如上所述的针对抗体的亲和性物质,例如可列举:肽(包括寡肽、多肽和蛋白质)、低分子化合物、核酸、核酸-肽复合物、肽-低分子化合物复合物、核酸-低分子复合物。
[0414]
在特定的实施方式中,如上所述的针对抗体的亲和性物质可以是肽(包括寡肽、多
肽、蛋白质。也可以是糖蛋白)。作为这样的肽,例如报道有以下的肽:
[0415]
(1)对所有的人igg(即,人igg1、igg2、igg3和igg4,下同)的特定区(ch2区)具有亲和性的igg结合性肽(例如参照国际公开第2016/186206号、国际公开第2013/027796号、国际公开第2008/054030号);
[0416]
(2)对所有的人igg的特定区(ch2区)具有亲和性的蛋白质a模拟肽(protein a mimetic(pam)peptide)(例如参照fassina g等人,journal of molecular recognition,1996,第6卷,564-569);
[0417]
(3)对所有的人igg的特定区(ch2区)具有亲和性的epihrstltall(seq id no:25)(例如参照ehrlich g.k等人,j.biochem.biophys.methods,2001,第49卷,443-454);
[0418]
(4)对所有的人igg的特定区(fc区)具有亲和性的(nh2-cys1-x1-x2-x3-x4)2-lys-gly-oh(例如参照ruvo m等人,chembiochem,2005,第6卷,1242-1253);
[0419]
(5)对所有的人igg的特定区(fc区)具有亲和性的farlvssiry(seq id no:26)、fgrlvssiry(seq id no:27)和twktsrisif(seq id no:28)(例如参照krook m等人,journal of immunological methods,1998,第221卷,151-157);
[0420]
(6)对所有的人igg的特定区具有亲和性的qsyp(seq id no:29)(例如参照jacobs j.m.等人,bio.techniques,2003,第34卷,132-141);
[0421]
(7)对所有的人igg的特定区(fc区)具有亲和性的hwrgwv(seq id no:30)、hyfkfd(seq id no:31)和hfrrhl(seq id no:32)(例如参照carbonell r.g.等人,journal of chromatography a,2009,第1216卷,910-918);
[0422]
(8)对所有的人igg的特定区(fc区)具有亲和性的daag(seq id no:33)(例如参照lund l.n.等人,journal of chromatography a,2012,第1225卷,158-167);
[0423]
(9)对所有的人igg的特定区(fc区)具有亲和性的fc-i、fc-ii和fc-iii(例如参照warren l.delano等人,science,2000,第287卷,1279-1283;国际公开2001/045746号);以及
[0424]
(10)对所有的人igg的特定区(fc区)具有亲和性的narkfykg(seq id no:3418)和nkfrgkyk(seq id no:35)(例如参照biochemical engineering journal,2013,第79卷,33-40)。
[0425]
在另一特定的实施方式中,如上所述的针对抗体的亲和性物质可以是除肽以外的物质。作为这样的物质,例如报道有对人igg(例如人igg1~4)的特定区(ch2区、特别是lys340的侧链)具有亲和性的适体[例如,含有ggugcu和ggugau等ggug(c/a)(u/t)模体(motif)的适体](例如参照国际公开第2007/004748号公报;nomura y等人,nucleic acids res.,2010nov;38(21):7822-9;miyakawa s等,rna.,2008jun;14(6):1154-63)。
[0426]
如上所述的针对抗体的亲和性物质可通过该领域中的任意的已知方法而得到。例如,可使用抗体整体或抗体中的部分肽(例如在抗体表面露出区明确的情况下,存在于该区中的部分肽),通过制作抗体(例如杂交瘤法),或者从可获得亲和性物质的文库(例如肽文库、抗体文库、抗体产生细胞文库、适体文库、噬菌体文库、mrna文库、cdna文库)中筛选亲和性物质(例如噬菌体展示法、selex法、mrna展示法、核糖体展示法、cdna展示法、酵母展示法),来进行获取。另外,在针对抗体的亲和性物质为针对抗体fc区(可溶性区)的亲和性物质的情况下,可通过使用存在于各种抗体(例如igg、iga、igm、igd、ige)的fc区的特定区(例
如ch1、ch2、ch3)中的部分肽,有效地获取可以与抗体的fc区中的任意部分选择性结合的亲和性物质(例如抗体、适体)。在这样获取的亲和性物质中,混入有亲和结合能力相对较强的物质和较弱的物质。但是,即使是亲和结合能力较弱的亲和性物质,也可通过过量使用来补足其亲和结合能力。
[0427]
在优选的实施方式中,针对抗体的亲和性物质为肽。作为这样的肽,优选具有针对单克隆抗体恒定区的结合能力的肽,更优选具有针对单克隆抗体的fc区的结合能力的肽,更进一步优选具有针对igg的fc区的结合能力的肽。作为肽的长度,没有特别限定,例如是由10~40(例如10~20、20~30和30~40)个氨基酸残基构成的肽。作为构成肽的氨基酸残基,可列举构成天然蛋白质的20种l-α-氨基酸残基及其立体异构体(例如d-氨基酸)、它们的异构体(例如β-氨基酸)。
[0428]
在特定的实施方式中,如上所述的针对抗体的亲和性物质可以是包含以下的任一氨基酸序列的肽。
[0429]
包含以下的氨基酸序列的肽:
[0430]
在(a-1-1)fnmqqqrrfyealhd pnlneeqrnarirsirdd(seq id no:11)的氨基酸序列(例如参照化合物22~24、29)、或者
[0431]
(a-1-2)fnmqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:12)的氨基酸序列(已知序列z34c中2个k被r取代而得到的氨基酸序列)中,序列中的任意的1~3个氨基酸残基可相同也可不同,且被选自赖氨酸残基、天冬氨酸残基、和谷氨酸残基的各1个氨基酸残基取代,或者
[0432]
在(a-2-1)β-ala-nmqqqrrfyealhdpnlneeqrnarirsirdd(seq id no:13)的氨基酸序列(例如参照化合物26~28)、或者
[0433]
(a-2-2)β-ala-nmqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:14)的氨基酸序列(已知序列z34c中2个k被r取代、且n末端的f被β-ala取代而得到的氨基酸序列)中,序列中的任意的1~3个氨基酸残基可相同也可不同,且被选自赖氨酸残基、天冬氨酸残基、和谷氨酸残基的各1个氨基酸残基取代;并且
[0434]
(b)相对于seq id no:11~14的上述各氨基酸序列具有85%以上的同一性。
[0435]
这样的肽具有针对单克隆抗体的fc区的结合能力。
[0436]
由于肽试剂合成上的情况,由seq id no:12的氨基酸序列构成的肽是作为z34c已知的亲和性肽中从n末端数第26位和第28位这两个k(赖氨酸)变更为r(精氨酸)的肽。含有包含上述氨基酸序列的肽的本发明的化合物可用于人igg fc中的特定氨基酸残基(例如基于eu numbering的lys248残基或lys246残基、lys288或lys290、lys317、或者除这些残基以外的其他氨基酸残基)的位置选择性修饰。需要说明的是,上述z34c的氨基酸序列为fnmqcqrrfyealhdpnlneeqrna kiksirddc(seq id no:36)(例如参照starovasnik,m.a.等人,structural mimicry of a native protein by a minimized binding domain.,proc.natl.acad.sci.usa.,94,10080-10085(1997))。
[0437]
亲和性肽可具有针对人igg(例如,如上所述的人igg。优选人igg1)的亲和性。在上述亲和性肽包含2个半胱氨酸残基(例如5位和34位)的情况下,两个半胱氨酸残基可进行二硫键合而形成环状肽。
[0438]
作为导入赖氨酸残基、天冬氨酸残基或谷氨酸残基(通过交联剂容易修饰的氨基
酸残基)的位置,只要具有针对人igg1等人igg的亲和性,则可利用任意的位置。对于这样的位置,只要是本领域技术人员,均可容易地鉴定。导入赖氨酸残基、天冬氨酸残基或谷氨酸残基的位置可以是除半胱氨酸残基以外的氨基酸残基。更优选的是,作为导入可通过交联剂容易地进行修饰的氨基酸残基的位置,例如可列举1位、3位、6位、7位、13位、20位、24位、31位和32位的氨基酸残基。
[0439]
优选的是,具有(a)和(b)的特性的上述氨基酸序列还优选在规定位置具有选自赖氨酸残基、天冬氨酸残基、和谷氨酸残基(可通过交联剂容易地进行修饰的氨基酸残基)的1个特定的氨基酸残基(优选赖氨酸残基),并且在除该规定位置以外的位置具有构成天然蛋白质的通常的20种氨基酸残基(优选为除赖氨酸残基、天冬氨酸残基、和谷氨酸残基以外的17种氨基酸残基,更优选除赖氨酸残基以外的19种氨基酸残基)的突变。这样的规定位置没有特别限定,例如可列举1位、3位、6位、7位、13位、20位、24位、31位、和32位。具有(a)和(b)的特性的上述氨基酸序列维持2个半胱氨酸残基,这2个半胱氨酸残基可通过二硫键合而进行结合。对于seq id no:11~14的上述氨基酸序列具有85%以上的同一性的氨基酸序列可以是1~3个(优选1或2个、更优选1个)氨基酸残基通过选自氨基酸残基的缺失、取代、添加和插入的1、2、3或4种突变(优选取代)而改变。氨基酸残基的突变可被导入氨基酸序列中的1个区域,也可被导入多个不同的区域。
[0440]
更优选的是,具有(a)和(b)的特性的上述氨基酸序列可以是以下(c)或(d)。
[0441]
(c)选自以下(1)~(16)的氨基酸序列的氨基酸序列:
[0442]
(1)fnmqqqrrfyealhdpnlneeqrnarirsikdd(seq id no:5);
[0443]
(2)fnmqqqrrfyealhdpnlneeqrnariksirdd(seq id no:6);
[0444]
(3)β-ala-nmqqqrrfyealhdpnlneeqrnarirsirdd(seq id no:7);
[0445]
(4)fnmqqqrrfyealhdpnlneeqrnakiksikdd(seq id no:8);
[0446]
(5)knmqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:37);
[0447]
(6)fnmqcqkrfyealhdpnlneeqrnarirsirddc(seq id no:38);
[0448]
(7)fnmqcqrrfyeakhdpnlneeqrnarirsirddc(seq id no:39);
[0449]
(8)fnmqcqrrfyealhdpnlneeqrkarirsirddc(seq id no:40);
[0450]
(9)fnmqcqrrfyealhdpnlnkeqrnarirsirddc(seq id no:41);
[0451]
(10)fnmqcqrrfyealhdpnlneeqrnarirsikddc(seq id no:42);
[0452]
(11)fnkqcqrrfyealhdpnlneeqrnarirsirddc(seq id no:43);
[0453]
(12)fnmqckrrfyealhdpnlneeqrnarirsirddc(seq id no:44);
[0454]
(13)fnmqcqrrfyealhdpnlneeqrnarirsirkdc(seq id no:45);
[0455]
(14)β-ala-nmqqqrrfyealhdpnleeqrnarirsi(seq id no:97);
[0456]
(15)fnmqqqrrfyealhdpnlnkeqrnarirsirdd(seq id no:98);以及
[0457]
(16)β-ala-nmqqqrrfyealhdpnleeqrnarirsikdd(seq id no:100);或者
[0458]
(d)在上述(1)~(16)中的任一氨基酸序列中,在除1个赖氨酸残基和2个半胱氨酸残基以外的位置(例如1位、3位、6位、7位、13位、20位、24位、31位、和32位的位置)具有除赖氨酸残基以外的19种氨基酸残基的突变的、对于上述(1)~(16)中的任一氨基酸序列具有90%以上的同一性(可以是如上所述的个数的氨基酸残基的修饰)的氨基酸序列。
[0459]
确认到包含这样的氨基酸序列的肽具有对igg的fc区的结合能力。(d)的具有上述
氨基酸序列的亲和性肽优选具有对单克隆抗体的恒定区的结合能力的肽,更优选具有对单克隆抗体的fc区的结合能力的肽,更进一步优选具有对igg的fc区的结合能力的肽。
[0460]
上述亲和性肽只要对于seq id no:11~14的上述氨基酸序列或上述(1)~(16)的氨基酸序列具有85%以上的同一性,除导入通过交联剂容易修饰的1个氨基酸残基以外,还可具有进一步的氨基酸残基的突变。对于可导入进一步的氨基酸突变的位置,只要是本领域技术人员,均可容易地鉴定。例如,即使是1位的苯丙氨酸残基、6位的精氨酸残基、13位的亮氨酸残基、20位的谷氨酸残基、24位的天冬氨酸残基、或31位的精氨酸残基(已导入通过交联剂可容易地进行修饰的氨基酸残基的位置除外)也可利用。作为可通过进一步的氨基酸突变而导入的氨基酸,例如可列举:丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、蛋氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)、缬氨酸(v)、天冬氨酸(d)、谷氨酸(e)、精氨酸(r)、组氨酸(h)、和赖氨酸(l)。优选的是,可利用除赖氨酸以外的这19种氨基酸。氨基酸可以是l体或d体中的任一种,但优选l体(实施例中构成肽的氨基酸残基均为l体)。
[0461]
相对于seq id no:11~14的上述氨基酸序列或(1)~(16)的上述氨基酸序列的同一性%的程度可如上确定。同一性%的程度可优选为90%以上、92%以上,更优选为94%以上,更进一步优选为95%以上,特别优选为97%以上(即,仅具有1个氨基酸残基的突变的序列)。
[0462]
在另一特定实施方式中,如上所述的针对抗体的亲和性物质为包含以下的任一氨基酸序列的肽。
[0463]
式1-1:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-i-i-w-c-(x
0-3
)
b
(seq id no:15)
[0464]
式1-2:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-i-v-w-c-(x
0-3
)
b
(seq id no:16)
[0465]
式1-3:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-v-v-w-c-(x
0-3
)
b
(seq id no:17)
[0466]
式1-4:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-a-v-w-c-(x
0-3
)
b
(seq id no:18)
[0467]
式1-5:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-l-w-c-(x
0-3
)
b
(seq id no:19)
[0468]
式1-6:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-i-w-c-(x
0-3
)
b
(seq id no:20)
[0469]
式1-7:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-l-v-f-c-(x
0-3
)
b
(seq id no:21)
[0470]
式1-8:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-q-v-w-c-(x
0-3
)
b
(seq id no:22)
[0471]
式1-9:(x
0-3
)
a-c-xaa1-xaa2-xaa3-xaa4-xaa5-xaa6-e-v-w-c-(x
0-3
)
b
(seq id no:23)
[0472]
[式中,
[0473]
(x
0-3
)
a
为不存在、精氨酸残基-甘氨酸残基-天冬酰胺残基、甘氨酸残基-天冬酰胺
残基、天冬氨酸残基、或天冬酰胺残基,
[0474]
(x
0-3
)
b
为不存在、苏氨酸残基-酪氨酸残基-组氨酸残基、或苏氨酸残基,
[0475]
xaa1为丙氨酸残基,
[0476]
xaa2为酪氨酸残基、色氨酸残基、或组氨酸残基,
[0477]
xaa3为组氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、精氨酸残基、或甘氨酸残基,
[0478]
xaa4为赖氨酸残基、天冬氨酸残基、或谷氨酸残基,
[0479]
xaa5为甘氨酸残基、丝氨酸残基、天冬酰胺残基、谷氨酰胺残基、天冬氨酸残基、谷氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、组氨酸残基、苏氨酸残基、亮氨酸残基、丙氨酸残基、缬氨酸残基、异亮氨酸残基、或精氨酸残基,
[0480]
xaa6为谷氨酰胺残基、谷氨酸残基、天冬酰胺残基、或天冬氨酸残基。];或者
[0481]
式2-1:(x
0-3
’
)
a-c-(xaa1
’
)-(xaa2
’
)-(xaa3
’
)-(xaa4
’
)-(xaa5
’
)-(xaa6
’
)-l-v-w-c-(x
0-3
’
)
b
(seq id no:24)
[0482]
[式中,
[0483]
(x
0-3
’
)
a
和(x
0-3
’
)
b
分别与上述(x
0-3
)
a
和(x
0-3
)
b
相同,
[0484]
xaa1
’
、xaa2
’
、xaa3
’
、xaa4
’
、xaa5
’
、xaa6
’
分别与上述xaa1、xaa2、xaa3、xaa4、xaa5、xaa6相同。]。
[0485]
这样的肽具有针对单克隆抗体的fc区的结合能力。
[0486]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,(x
0-3
)
a
为不存在、精氨酸残基-甘氨酸残基-天冬酰胺残基、甘氨酸残基-天冬酰胺残基、天冬氨酸残基、或天冬酰胺残基,优选为不存在、精氨酸残基-甘氨酸残基-天冬酰胺残基、天冬氨酸残基、或天冬酰胺残基。
[0487]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,xaa2为酪氨酸残基、色氨酸残基、或组氨酸残基,优选为酪氨酸残基、或色氨酸残基。
[0488]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,xaa3为组氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、精氨酸残基、或甘氨酸残基,优选为组氨酸残基。
[0489]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,xaa4为赖氨酸残基、天冬氨酸残基、或谷氨酸残基,优选为赖氨酸残基。
[0490]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,xaa5为甘氨酸残基、丝氨酸残基、天冬酰胺残基、谷氨酰胺残基、天冬氨酸残基、谷氨酸残基、苯丙氨酸残基、酪氨酸残基、色氨酸残基、组氨酸残基、苏氨酸残基、亮氨酸残基、丙氨酸残基、缬氨酸残基、异亮氨酸残基、或精氨酸残基,优选为甘氨酸残基、苏氨酸残基、亮氨酸残基。
[0491]
在上述式1-1~1-9和式2-1所表示的氨基酸序列中,xaa6为谷氨酰胺残基、谷氨酸残基、天冬酰胺残基、或天冬氨酸残基,更优选为谷氨酰胺残基。
[0492]
优选的是,包含上述式1-1~1-9和式2-1所表示的任一氨基酸序列的肽为包含选自下述的氨基酸序列的肽:
[0493]
(1
’
)rgncayhkgqiiwctyh(seq id no:46);
[0494]
(2
’
)rgncayhkgqivwctyh(seq id no:47);
[0495]
(3
’
)rgncayhkgqvvwctyh(seq id no:48);
[0496]
(4
’
)rgncayhkgqavwctyh(seq id no:49);
[0497]
(5
’
)rgncayhkgqllwctyh(seq id no:50);
[0498]
(6
’
)rgncayhkgqliwctyh(seq id no:51);
[0499]
(7
’
)dcayhkgqivwct(seq id no:52);
[0500]
(8
’
)dcayhkgqvvwct(seq id no:53);
[0501]
(9
’
)dcayhkgqavwct(seq id no:54);
[0502]
(10
’
)rgncayhksqiiwctyh(seq id no:55);
[0503]
(11
’
)rgncayhknqiiwctyh(seq id no:56);
[0504]
(12
’
)rgncayhkdqiiwctyh(seq id no:57);
[0505]
(13
’
)rgncayhkqqiiwctyh(seq id no:58);
[0506]
(14
’
)rgncayhkeqiiwctyh(seq id no:59);
[0507]
(15
’
)rgncayhkfqiiwctyh(seq id no:60);
[0508]
(16
’
)rgncayhkyqiiwctyh(seq id no:61);
[0509]
(17
’
)rgncayhkwqiiwctyh(seq id no:62);
[0510]
(18
’
)rgncayhkhqiiwctyh(seq id no:63);
[0511]
(19
’
)rgncayhktqiiwctyh(seq id no:64);
[0512]
(20
’
)rgncayhklqiiwctyh(seq id no:65);
[0513]
(21
’
)cayhklqivwc(seq id no:66);
[0514]
(22
’
)cayhklqliwc(seq id no:67);
[0515]
(23
’
)cayhksqivwc(seq id no:68);
[0516]
(24
’
)rgncayhkgqlvfctyh(seq id no:69);
[0517]
(25
’
)rgncayhkgqqvwctyh(seq id no:70);
[0518]
(26
’
)rgncayhkgqevwctyh(seq id no:71);
[0519]
(27
’
)cayhkgqlvwc(seq id no:72);
[0520]
(28
’
)rgncayhkaqlvwctyh(seq id no:73);
[0521]
(29
’
)rgncayhkvqlvwctyh(seq id no:74);
[0522]
(30
’
)rgncayhklqlvwctyh(seq id no:75);
[0523]
(31
’
)rgncayhkiqlvwctyh(seq id no:76);
[0524]
(32
’
)rgncayhksqlvwctyh(seq id no:77);
[0525]
(33
’
)rgncayhktqlvwctyh(seq id no:78);
[0526]
(34
’
)rgncayhknqlvwctyh(seq id no:79);
[0527]
(35
’
)rgncayhkdqlvwctyh(seq id no:80);
[0528]
(36
’
)rgncayhkqqlvwctyh(seq id no:81);
[0529]
(37
’
)rgncayhkeqlvwctyh(seq id no:82);
[0530]
(38
’
)rgncayhkfqlvwctyh(seq id no:83);
[0531]
(39
’
)rgncayhkrqlvwctyh(seq id no:84);
[0532]
(40
’
)rgncayhkhqlvwctyh(seq id no:85);
[0533]
(41
’
)rgncayhkwqlvwctyh(seq id no:86);
[0534]
(42
’
)rgncayhkyqlvwctyh(seq id no:87);
[0535]
(43
’
)rgncayfkgqlvwctyh(seq id no:88);
[0536]
(44
’
)rgncayykgqlvwctyh(seq id no:89);
[0537]
(45
’
)rgncaywkgqlvwctyh(seq id no:90);
[0538]
(46
’
)rgncayrkgqlvwctyh(seq id no:91);
[0539]
(47
’
)rgncaygkgqlvwctyh(seq id no:92);
[0540]
(48
’
)dcayhkgqlvwc(seq id no:93);
[0541]
(49
’
)ncayhkgqlvwc(seq id no:94);
[0542]
(50
’
)cayhkgqlvwct(seq id no:95);
[0543]
(51
’
)cayhksqlvwc(seq id no:96);
[0544]
(52
’
)gncayhkgqiiwctyh(seq id no:99);以及
[0545]
(53
’
)rgncayhegqiiwctyh(seq id no:108)。
[0546]
确认到包含这样的氨基酸序列的肽具有针对igg的fc区的结合能力。
[0547]
上述肽的各氨基酸序列中隔开的至少2个半胱氨酸残基可通过二硫键合而形成环状肽。或者,上述肽中2个半胱氨酸残基中的硫醚基可通过以下所表示的含羰基的接头进行连接。
[0548]
[化学式8]
[0549][0550]
上述所表示的含羰基的接头的虚线部分是指与硫醚基的结合部分。该接头对于还原反应等较通常的二硫键合更稳定。这样的肽例如可利用国际公开第2016/186206号中记载的方法进行调制。
[0551]
含有包含上述氨基酸序列的肽的本发明的化合物可用于人igg fc中的特定氨基酸残基(例如基于eu numbering的lys248残基或lys246残基、lys288或lys290、lys317、或者除这些残基以外的其他氨基酸残基)的位置选择性修饰。构成上述肽的氨基酸可为l体或d体的任一种,但优选l体(在实施例中构成肽的氨基酸残基均为l体)。
[0552]
上述肽可通过交联剂修饰特定的氨基酸残基。作为这样的特定氨基酸残基,例如可列举:赖氨酸残基、天冬氨酸残基、和谷氨酸残基,但优选为赖氨酸残基。作为交联剂,例如可列举:dsg(disuccinimidyl glutarate、双琥珀酰亚胺戊二酸酯)、dss(disuccinimidyl suberate、双琥珀酰亚胺辛二酸酯)等的优选包含2个以上的琥珀酰亚胺基的交联剂;dma(dimethyl adipimidate
·
2hcl、二亚胺代己二酸二甲酯二盐酸盐)、dmp(dimethyl pimelimidate
·
2hcl、庚二亚氨酸二甲酯二盐酸盐)、和dms(dimethyl suberimidate
·
2hcl、辛二亚氨酸二甲酯二盐酸盐)等的优选包含2个以上的亚氨酸部分的交联剂;以及dtbp(dimethyl3,3
’-
dithiobispropionimidate
·
2hcl、3,3
’-
二硫代双丙亚氨酸二甲酯二盐酸盐)和dsp(dithiobis(succinimidyl propionate)、二硫代双(琥珀酰亚胺基丙酸酯))等的具有ss键的交联剂(例如国际公开第2016/186206号)。
[0553]
在针对抗体的亲和性物质为肽的情况下,位于肽末端的氨基和羧基可被保护。作为n-末端氨基的保护基,例如可列举:烷基羰基(酰基)(例如乙酰基、丙氧基、叔丁氧基羰基等丁氧基羰基)、烷氧基羰基(例如芴基甲氧基羰基)、芳氧基羰基、芳基烷基(芳烷基)氧基羰基(例如苄氧基羰基)。作为n-末端氨基的保护基,优选乙酰基。作为c-末端羧基的保护
基,例如可列举可形成酯或酰胺的基团。作为可形成酯或酰胺的基团,例如可列举:烷氧基(例如甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基)、芳氧基(例如苯氧基、萘氧基)、芳烷基氧基(例如苄氧基)、氨基。作为c-末端羧基的保护基,优选氨基。
[0554]
1-3.包含离去基团的二价基团(l)
[0555]
式(i)中,l为包含离去基团的二价基团。
[0556]
离去基团是指具有通过抗体中的亲核基团与包含亲电子基团的二价基团(e)中所含的亲电子基团之间的反应而从e上切割并脱离的能力的基团。这样的离去基团为该领域中的技术常识(例如fujishima,s.等人,j.am.chem.soc,2012,134,3961-3964.(上述);chem.sci.20153217-3224.;nature chemistry第8卷,第542-548页(2016))。作为离去基团,只要具有通过如上所述的反应从e上切割的能力,则没有特别限定,例如可列举:(1)选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r表示氢原子或碳原子数为1~6的烷基。);和(2)杂亚芳基。
[0557]
作为碳原子数为1~6的烷基,例如可列举:甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基、己基。作为碳原子数为1~6的烷基,优选碳原子数为1~4的烷基。
[0558]
作为离去基团的例子的选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团为下述(1)或(2):
[0559]
(1)由-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-构成的基团;或者
[0560]
(2)包含-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-或-o-n(r)-和提高其脱离能力的基团的基团。
[0561]
提高-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-的脱离能力的基团是指,与该基团不与-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-相邻存在的情况相比,在该基团与-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-相邻存在的情况下提高-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-从亲电子基团上脱离的能力的基团。换言之,提高-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-的脱离能力的基团是具有吸引氧原子、硫原子、硒原子、或氮原子的电子的能力的基团。
[0562]
作为提高-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-的脱离能力的基团的优选例子,可列举:可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、和2-吡啶酮。亚芳基和杂亚芳基可具有的吸电子基团数为1以上(例如1~3、优选1或2)。作为吸电子基团,例如可列举:卤原子、被卤原子取代的烷基(例如三氟甲基)、硼酸残基、甲磺酰基(mesyl)、甲苯磺酰基(tosyl)、三氟甲磺酸酯、硝基、氰基、苯基、酮基(例如酰基)。
[0563]
作为“可被吸电子基团取代的亚芳基”中的“亚芳基”,优选碳原子数为6~24的亚芳基,更优选碳原子数为6~18的亚芳基,更进一步优选碳原子数为6~14的亚芳基,最优选碳原子数为6~10的亚芳基。可被吸电子基团取代的亚芳基还可被吸电子基团以外的取代
基取代,也可未取代。上述碳原子数中不包括吸电子基团和除其以外的取代基的碳原子数。作为亚芳基,例如可列举:亚苯基、亚萘基、亚蒽基。
[0564]
作为“可被吸电子基团取代的杂亚芳基”中的“杂亚芳基”,优选碳原子数为1~21的杂亚芳基,更优选碳原子数为1~15的杂亚芳基,更进一步优选碳原子数为1~9的杂亚芳基,最优选碳原子数为1~6的杂亚芳基。可被吸电子基团取代的杂亚芳基还可被除吸电子基团以外的取代基取代,也可未取代。上述碳原子数中不包括吸电子基团和除其以外的取代基的碳原子数。杂亚芳基包含选自氮原子、氧原子和硫原子的1个以上(例如1~5、优选1~4、更优选1~3)的杂原子作为环构成原子。作为杂亚芳基,例如可列举:吡咯二基、呋喃二基、噻吩二基、吡啶二基、哒嗪二基、嘧啶二基、吡嗪二基、三嗪二基、吡唑二基、咪唑二基、噻唑二基、异噻唑二基、噁唑二基、异噁唑二基、三唑二基、四唑二基、吲哚二基、嘌呤二基、蒽醌二基、咔唑二基、芴二基、喹啉二基、异喹啉二基、喹唑啉二基、和酞嗪二基。
[0565]
可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、和2-吡啶酮可被吸电子基团等取代基取代,也可未取代。
[0566]
作为离去基团的例子的杂亚芳基是π电子密度低(即,小于1)的杂亚芳基。作为离去基团的杂亚芳基优选含有氮原子作为环构成原子的杂亚芳基。作为含有氮原子作为环构成原子的杂亚芳基,优选含有氮原子作为环构成原子的碳原子数为1~21的杂亚芳基,更优选含有氮原子作为环构成原子的碳原子数为1~15的杂亚芳基,进一步优选含有氮原子作为环构成原子的碳原子数为1~9的杂亚芳基。作为离去基团的杂亚芳基可被吸电子基团等取代基取代,也可未取代。上述碳原子数中不包括取代基的碳原子数。作为含有氮原子作为环构成原子的离去基团的杂亚芳基,例如可列举:咪唑二基、三唑二基、四唑二基、2-吡啶酮二基(即,2-羟基吡啶二基)。
[0567]
作为提高-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、或-o-n(r)-的脱离能力的基团的例子的“可被吸电子基团取代的亚芳基”等基团、以及作为离去基团的例子的“杂亚芳基”例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在如上所述的基团具有取代基的情况下,作为这样的取代基,可列举如下:
[0568]
(i)卤原子;
[0569]
(ii)一价烃基;
[0570]
(iii)芳烷基;
[0571]
(iv)一价杂环基;
[0572]
(v)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或一价烃基。);或
[0573]
(vi)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或一价烃基。);
[0574]
(vii)硝基、硫酸基、磺酸基、氰基、和羧基。
[0575]
作为卤原子,例如可列举:氟原子、氯原子、溴原子、碘原子。
[0576]
作为一价烃基,例如可列举:一价链状烃基、一价脂环式烃基、和一价芳族烃基。
[0577]
一价链状烃基是指仅由链状结构构成的烃基,主链上不含环状结构。然而,链状结构可以是直链状也可以是支链状。作为一价链状烃基,例如可列举:烷基、烯基、炔基。烷基、
烯基、和炔基可以是直链状、或支链状的任一种。
[0578]
作为烷基,优选碳原子数为1~12的烷基,更优选碳原子数为1~6的烷基,进一步优选碳原子数为1~4的烷基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为1~12的烷基,例如可列举:甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基、十二烷基。
[0579]
作为烯基,优选碳原子数为2~12的烯基,更优选碳原子数为2~6的烯基,进一步优选碳原子数为2~4的烯基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为2~12的烯基,例如可列举:乙烯基、丙烯基、正丁烯基。
[0580]
作为炔基,优选碳原子数为2~12的炔基,更优选碳原子数为2~6的炔基,进一步优选碳原子数为2~4的炔基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为2~12的炔基,例如可列举:乙炔基、丙炔基、正丁炔基。
[0581]
作为一价链状烃基,优选烷基。
[0582]
一价脂环式烃基是指仅包含脂环式烃作为环结构、而不包含芳环的烃基,脂环式烃可以是单环、多环的任一种。然而,无需仅由脂环式烃构成,其一部分可包含链状结构。作为一价脂环式烃基,例如可列举:环烷基、环烯基、环炔基,这些可以是单环、多环的任一种。
[0583]
作为环烷基,优选碳原子数为3~12的环烷基,更优选碳原子数为3~6的环烷基,进一步优选碳原子数为5~6的环烷基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为3~12的环烷基,例如可列举:环丙基、环丁基、环戊基、环己基。
[0584]
作为环烯基,优选碳原子数为3~12的环烯基,更优选碳原子数为3~6的环烯基,进一步优选碳原子数为5~6的环烯基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为3~12的环烯基,例如可列举:环丙烯基、环丁烯基、环戊烯基、环己烯基。
[0585]
作为环炔基,优选碳原子数为3~12的环炔基,更优选碳原子数为3~6的环炔基,进一步优选碳原子数为5~6的环炔基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为3~12的环炔基,例如可列举:环丙炔基、环丁炔基、环戊炔基、环己炔基。
[0586]
作为一价脂环式烃基,优选环烷基。
[0587]
一价芳族烃基是指包含芳环结构的烃基。然而,无需仅由芳环构成,其一部分可包含链状结构或脂环式烃,芳环可以是单环、多环的任一种。作为一价芳族烃基,优选碳原子数为6~12的芳基,更优选碳原子数为6~10的芳基,进一步优选碳原子数为6的芳基。上述碳原子数中不包括取代基的碳原子数。作为碳原子数为6~12的芳基,例如可列举:苯基、萘基。
[0588]
作为一价芳族烃基,优选苯基。
[0589]
这些之中,作为一价烃基,优选烷基、环烷基、芳基,更优选烷基。
[0590]
芳烷基是指芳基烷基。芳基烷基中的芳基和烷基的定义、例子和优选例如上所述。作为芳烷基,优选碳原子数为3~15的芳烷基。作为这样的芳烷基,例如可列举:苯甲酰基、苯乙基、萘基甲基、萘基乙基。
[0591]
一价杂环基是指从杂环式化合物的杂环上去除了1个氢原子的基团。一价杂环基为一价芳族杂环基或一价非芳族杂环基。作为构成杂环基的杂原子,优选包含选自氧原子、硫原子、氮原子、磷原子、硼原子和硅原子的1种以上,更优选包含选自氧原子、硫原子和氮原子的1种以上。
[0592]
作为一价芳族杂环基,优选碳原子数为1~15的芳族杂环基,更优选碳原子数为1~9的芳族杂环基,进一步优选碳原子数为1~6的芳族杂环基。上述碳原子数中不包括取代基的碳原子数。作为一价芳族杂环基,例如可列举:吡咯基、呋喃基、噻吩基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、吡唑基、咪唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、三唑基、四唑基、吲哚基、嘌呤基、蒽醌基、咔唑基、芴基、喹啉基、异喹啉基、喹唑啉基、和酞嗪基。
[0593]
作为一价非芳族杂环基,优选碳原子数为2~15的非芳族杂环基,更优选碳原子数为2~9的非芳族杂环基,进一步优选碳原子数为2~6的非芳族杂环基。上述碳原子数中不包括取代基的碳原子数。作为一价非芳族杂环基,例如可列举:环氧乙烷基、氮丙啶基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、吡咯烷基、二氢呋喃基、四氢呋喃基、二氧戊环基、四氢噻吩基、吡咯啉基、咪唑烷基、噁唑烷基、哌啶基、二氢吡喃基、四氢吡喃基、四氢噻喃基、吗啉基、硫代吗啉基、吡嗪基、二氢噁嗪基、四氢噁嗪基、二氢嘧啶基、和四氢嘧啶基。
[0594]
这些之中,作为一价杂环基,优选5元或6元的杂环基。
[0595]
优选的是,取代基可以为如下的基团:
[0596]
(i
’
)卤原子;
[0597]
(ii
’
)碳原子数为1~12的烷基、苯基或萘基;
[0598]
(iii
’
)碳原子数为3~15的芳烷基;
[0599]
(iv
’
)5元或6元的杂环;
[0600]
(v
’
)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或碳原子数为1~12的烷基。);或
[0601]
(vi
’
)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或碳原子数为1~12的烷基。);
[0602]
(vii
’
)与上述(vii)中列举的基团相同的基团。
[0603]
更优选的是,取代基可以为如下的基团:
[0604]
(i”)卤原子;
[0605]
(ii”)碳原子数为1~12的烷基;
[0606]
(iii”)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或碳原子数为1~12的烷基。);或
[0607]
(iv”)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或碳原子数为1~12的烷基。);
[0608]
(v”)与上述(vii)中列举的基团相同的基团。
[0609]
更进一步优选的是,取代基可以为如下的基团:
[0610]
(i
”’
)卤原子;
[0611]
(ii
”’
)碳原子数为1~6的烷基;
[0612]
(iii
”’
)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或碳原子数为1~6的烷基。);或
[0613]
(iv
”’
)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或碳原子数为1~6的烷基。);
[0614]
(v
”’
)与上述(vii)中列举的基团相同的基团。
[0615]
特别优选的是,取代基可以为如下的基团:
[0616]
(i
””
)卤原子;
[0617]
(ii
””
)碳原子数为1~4的烷基;
[0618]
(iii
””
)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或碳原子数为1~4的烷基。);或
[0619]
(iv
””
)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或碳原子数为1~4的烷基。);
[0620]
(v
””
)与上述(vii)中列举的基团相同的基团。
[0621]
更具体而言,作为离去基团,可列举下述(a)~(c)中的任一种。
[0622]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0623]
(b)杂亚芳基;或者
[0624]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。]。
[0625]
作为离去基团,在(a)、(b)和(c)中优选(a)或(b),特别优选(a)。(a)中的环p为可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮中的任一个,其中,更优选被吸电子基团取代的亚芳基、被吸电子基团取代的杂亚芳基、2,5-二酮吡咯烷、2,6-二酮哌啶,更进一步优选被吸电子基团取代的亚芳基、2,5-二酮吡咯烷、2,6-二酮哌啶。
[0626]
(a)中的环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团。这些基团的详情与作为提高-n(r)-、-n(or)-、-o-、-s-、或-se-的脱离能力的基团的优选例而记述的基团相同。
[0627]
(a)中的q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。),其中,优选-o-、-s-、-so
2-o-、或-so
2-n(r)-,更优选-o-或-s-,更进一步优选-o-。
[0628]
(b)为杂亚芳基,优选咪唑二基、三唑二基、四唑二基、或2-吡啶酮二基(=2-羟基吡啶二基),更进一步优选咪唑二基、或2-吡啶酮二基。
[0629]
(c)中的q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。),优选-s-、-c≡c-ch
2-o-、-n(or)-、-n(r)-或-o-n(r)-,更进一步优选s、-n(or)或-o-n(r)-。
[0630]
更具体而言,优选的离去基团可以是选自下述结构式的基团。
[0631]
[化学式9]
[0632][0633]
(这里,ewg为吸电子基团,
[0634]
m为0~4的整数,
[0635]
n为0~3的整数,
[0636]
r为氢原子或碳原子数为1~6的烷基,
[0637]
○
(白色圆)为与l
1
的结合键,
●
(黑色圆)为与e
1
的结合键。)。
[0638]
吸电子基团和碳原子数为1~6的烷基的详情如上所述。m优选为1~4的整数,更优选为1、2或3。n优选为1~3的整数,更优选为1或2。
[0639]
l所表示的包含离去基团的二价基团是由上述离去基团构成的二价基团、或者除上述离去基团以外还包含其他二价基团的二价基团。作为这样的其他的二价基团,例如可列举:二价烃基、二价杂环基、-c(=o)-、-nr
l-(r
l
表示氢原子或上述的取代基)、-o-、-s-、-c(=s)-、和由它们的2个以上(例如2~8、优选2~6、更优选2~4)的组合构成的基团。二价烃基和二价杂环基例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在如上所述的基团具有取代基的情况下,这样的取代基的例子和优选例与上述相同。
[0640]
作为二价烃基,是直链、支链或环状的二价烃基,优选为直链或支链的二价烃基。作为二价烃基,例如可列举:亚烷基、亚烯基、亚炔基、亚芳基。
[0641]
作为亚烷基,优选碳原子数为1~12的亚烷基,更优选碳原子数为1~6的亚烷基,特别优选碳原子数为1~4的亚烷基。上述碳原子数中不包括取代基的碳原子数。亚烷基可以是直链、支链或环状的任一种,但优选直链亚烷基。作为这样的亚烷基,例如可列举:亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基。
[0642]
作为亚烯基,优选碳原子数为2~12的亚烯基,更优选碳原子数为2~6的亚烯基,特别优选碳原子数为2~4的亚烯基。上述碳原子数中不包括取代基的碳原子数。亚烯基可以是直链、支链或环状的任一种,但优选直链亚烯基。作为这样的亚烯基,例如可列举:亚乙烯基、亚丙烯基、亚丁烯基、亚戊烯基、亚己烯基。
[0643]
作为亚炔基,优选碳原子数为2~12的亚炔基,更优选碳原子数为2~6的亚炔基,特别优选碳原子数为2~4的亚炔基。上述碳原子数中不包括取代基的碳原子数。亚炔基可以是直链、支链或环状的任一种,但优选直链亚炔基。作为这样的亚炔基,例如可列举:亚乙炔基、亚丙炔基、亚丁炔基、亚戊炔基、亚己炔基。
[0644]
作为亚芳基,优选碳原子数为6~24的亚芳基,更优选碳原子数为6~18的亚芳基,进一步优选碳原子数为6~14的亚芳基,更进一步优选碳原子数为6~10的亚芳基。上述碳原子数中不包括取代基的碳原子数。作为亚芳基,例如可列举:亚苯基、亚萘基、亚蒽基。
[0645]
二价杂环基为二价芳族杂环基或二价非芳族杂环基。作为构成杂环的杂原子,优选包含选自氧原子、硫原子、氮原子、磷原子、硼原子和硅原子的1种以上,更优选包含选自氧原子、硫原子和氮原子的1种以上。
[0646]
作为二价芳族杂环基,优选碳原子数为1~21的二价芳族杂环基,更优选碳原子数为1~15的二价芳族杂环基,进一步优选碳原子数为1~9的二价芳族杂环基,更进一步优选碳原子数为1~6的二价芳族杂环基。上述碳原子数中不包括取代基的碳原子数。更具体而言,作为二价芳族杂环基,例如可列举:吡咯二基、呋喃二基、噻吩二基、吡啶二基、哒嗪二基、嘧啶二基、吡嗪二基、三嗪二基、吡唑二基、咪唑二基、噻唑二基、异噻唑二基、噁唑二基、异噁唑二基、三唑二基、四唑二基、吲哚二基、嘌呤二基、蒽醌二基、咔唑二基、芴二基、喹啉二基、异喹啉二基、喹唑啉二基、和酞嗪二基。
[0647]
作为二价非芳族杂环基,优选碳原子数为2~21的非芳族杂环基,更优选碳原子数为2~15的非芳族杂环基,进一步优选碳原子数为2~9的非芳族杂环基,更进一步优选碳原子数为2~6的非芳族杂环基。上述碳原子数中不包括取代基的碳原子数。更具体而言,作为二价非芳族杂环基,例如可列举:吡咯二酮二基、吡咯啉二酮二基、吡咯啉二基、环氧乙烷二基、氮丙啶二基、氮杂环丁烷二基、氧杂环丁烷二基、硫杂环丁烷二基、吡咯烷二基、二氢呋
喃二基、四氢呋喃二基、二氧戊环二基、四氢噻吩二基、吡咯啉二基、咪唑烷二基、噁唑烷二基、哌啶二基、二氢吡喃二基、四氢吡喃二基、四氢噻喃二基、吗啉二基、硫代吗啉二基、吡嗪二基、二氢噁嗪二基、四氢噁嗪二基、二氢嘧啶二基、和四氢嘧啶二基。
[0648]
在特定的实施方式中,l可以以l
1-l
2
的形式表示。
[0649]
l
1
为键或二价基团。l
1
所表示的二价基团的定义、例子和优选例与l所表示的包含离去基团的二价基团为除离去基团以外还包含其他二价基团的二价基团的情况下的其他二价基团的含义相同。
[0650]
l
2
为离去基团。l
2
所表示的离去基团的定义、例子和优选例与l中的离去基团的含义相同。
[0651]
优选的是,l
2
所表示的离去基团为上述(a)~(c)中的任一种。l
2
所表示的离去基团的例子和优选例也和上述(a)~(c)中记述的例子相同。
[0652]
连接a(亲和性物质)和e(包含亲电子基团的二价基团)的l(包含离去基团的二价基团)或l
1
(键或二价基团)-l
2
(离去基团)的主链的长度可根据抗体和亲和性物质的种类、以及抗体中的亲和性物质的靶位点与要位置选择性修饰的抗体中的特定氨基酸残基的关系等各种因素适当设计。l或l
1-l
2
的主链是指连接a和e的由通过共价键合连接的多个原子构成的链状结构,氢原子、支链结构部分和取代基除外。若使式(i)所表示的化合物与抗体接触,则首先a与抗体缔合。然后,存在于抗体缔合位点附近的抗体中的要修饰的特定氨基酸残基的侧链中的亲核基团(例如赖氨酸残基的侧链中的氨基)与e中的亲电子基团反应,从而该亲核基团与该亲电子基团结合,另一方面,l或l
1
中所含的离去基团可从e上脱离。此时,在抗体缔合位点与要修饰的特定氨基酸残基之间的附近不另外存在与该特定氨基酸残基同种的氨基酸残基的情况下,即使不严格控制主链的长度,e中的亲电子基团也可位置选择性地与抗体中的要修饰的特定氨基酸残基的侧链中的亲核基团结合。当然,即使是在这样的区域中还另外存在与该特定氨基酸残基同种的氨基酸残基的情况下,通过控制主链的长度,e中的亲电子基团也可位置选择性地与该特定氨基酸残基结合。
[0653]
连接a和e的l或l
1-l
2
的主链的长度只要可位置选择性地修饰抗体中的特定氨基酸残基即可,没有特别限定,例如在位置选择性地修饰人igg fc中的特定氨基酸残基(例如基于eu numbering的lys248残基或lys246残基、lys288或lys290、lys317、或者除这些残基以外的其他氨基酸残基)的情况下,优选为由20个以下的原子构成的长度。l或l
1-l
2
的主链的长度还可优选为1以上,更优选为2以上,更进一步优选为3以上,特别优选为4以上或5以上。l或l
1-l
2
的主链的长度还可优选为50以下,更优选为30以下,更进一步优选为20以下,特别优选为15以下或10以下。更具体而言,l或l
1-l
2
的主链的长度可优选为1~50,更优选为1~30,更进一步优选为1~20,特别优选为1~15或1~10。或者,l或l
1-l
2
的主链的长度可优选为2~30,更进一步优选为3~20,特别优选为4~15或5~10。
[0654]
在主链为不含环结构的结构的情况下,主链的原子数可通过计数链状结构中的原子数(氢原子、支链结构部分和取代基中的原子数除外)来确定。
[0655]
另一方面,在主链为包含环结构的结构的情况下,从规定主链长度的观点来看,可方便地计数主链的原子数。具体而言,这样的情况下的主链的原子数可通过在主链中不含二价环结构的链状结构中的原子数(氢原子、支链结构部分和取代基中的原子数除外)的基础上,再计数连通环结构中的2个结合键的最短路径的原子数来确定(例如参照以下(a)~
s-、-c(=s)-、和由这些的2个以上(例如2~8、优选2~6、更优选2~4)的组合构成的基团。二价烃基和二价杂环基例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在如上所述的基团具有取代基的情况下,这样的取代基的例子和优选例与作为离去基团的例子的杂亚芳基可具有的取代基相同。e(和后述的e
1-e
2-e
3
)可设计成不包含存在具潜在的免疫原性、且在血中容易水解的问题的肽部分。
[0669]
作为二价烃基,是直链、支链或环状的二价烃基,优选为直链或支链的二价烃基。作为二价烃基,例如可列举:亚烷基、亚烯基、亚炔基、亚芳基。
[0670]
作为亚烷基,优选碳原子数为1~12的亚烷基,更优选碳原子数为1~6的亚烷基,特别优选碳原子数为1~4的亚烷基。上述碳原子数中不包括取代基的碳原子数。亚烷基可以是直链、支链或环状的任一种,但优选直链亚烷基。作为这样的亚烷基,例如可列举:亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基。
[0671]
作为亚烯基,优选碳原子数为2~12的亚烯基,更优选碳原子数为2~6的亚烯基,特别优选碳原子数为2~4的亚烯基。上述碳原子数中不包括取代基的碳原子数。亚烯基可以是直链、支链或环状的任一种,但优选直链亚烯基。作为这样的亚烯基,例如可列举:亚乙烯基、亚丙烯基、亚丁烯基、亚戊烯基、亚己烯基。
[0672]
作为亚炔基,优选碳原子数为2~12的亚炔基,更优选碳原子数为2~6的亚炔基,特别优选碳原子数为2~4的亚炔基。上述碳原子数中不包括取代基的碳原子数。亚炔基可以是直链、支链或环状的任一种,但优选直链亚炔基。作为这样的亚炔基,例如可列举:亚乙炔基、亚丙炔基、亚丁炔基、亚戊炔基、亚己炔基。
[0673]
作为亚芳基,优选碳原子数为6~24的亚芳基,更优选碳原子数为6~18的亚芳基,进一步优选碳原子数为6~14的亚芳基,更进一步优选碳原子数为6~10的亚芳基。上述碳原子数中不包括取代基的碳原子数。作为亚芳基,例如可列举:亚苯基、亚萘基、亚蒽基。
[0674]
二价杂环基为二价芳族杂环基或二价非芳族杂环基。作为构成杂环的杂原子,优选包含选自氧原子、硫原子、氮原子、磷原子、硼原子和硅原子的1种以上,更优选包含选自氧原子、硫原子和氮原子的1种以上。
[0675]
作为二价芳族杂环基,优选碳原子数为1~21的二价芳族杂环基,更优选碳原子数为1~15的二价芳族杂环基,进一步优选碳原子数为1~9的二价芳族杂环基,更进一步优选碳原子数为1~6的二价芳族杂环基。上述碳原子数在不包括取代基的碳原子数。更具体而言,作为二价芳族杂环基,例如可列举:吡咯二基、呋喃二基、噻吩二基、吡啶二基、哒嗪二基、嘧啶二基、吡嗪二基、三嗪二基、吡唑二基、咪唑二基、噻唑二基、异噻唑二基、噁唑二基、异噁唑二基、三唑二基、四唑二基、吲哚二基、嘌呤二基、蒽醌二基、咔唑二基、芴二基、喹啉二基、异喹啉二基、喹唑啉二基、和酞嗪二基。
[0676]
作为二价非芳族杂环基,优选碳原子数为2~21的非芳族杂环基,更优选碳原子数为2~15的非芳族杂环基,进一步优选碳原子数为2~9的非芳族杂环基,更进一步优选碳原子数为2~6的非芳族杂环基。上述碳原子数中不包括取代基的碳原子数。更具体而言,作为二价非芳族杂环基,例如可列举:吡咯二酮二基、吡咯啉二酮二基、吡咯啉二基、环氧乙烷二基、氮丙啶二基、氮杂环丁烷二基、氧杂环丁烷二基、硫杂环丁烷二基、吡咯烷二基、二氢呋喃二基、四氢呋喃二基、二氧戊环二基、四氢噻吩二基、吡咯啉二基、咪唑烷二基、噁唑烷二
基、哌啶二基、二氢吡喃二基、四氢吡喃二基、四氢噻喃二基、吗啉二基、硫代吗啉二基、吡嗪二基、二氢噁嗪二基、四氢噁嗪二基、二氢嘧啶二基、和四氢嘧啶二基。
[0677]
在特定的实施方式中,e可以以e
1-e
2-e
3
的形式表示。
[0678]
e
1
为(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力的亲电子基团。e
1
的亲电子基团的定义、例子和优选例与e中的亲电子基团相同。
[0679]
e
2
为下述(a)或(b):
[0680]
(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数为1~6的烷基。)、n(r
3
)(这里,r
3
表示氢原子或碳原子数为1~6的烷基。)、o、s或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
和r
5
分别独立地为氢原子或碳原子数为1~6的烷基。)。];或者
[0681]
(b)下述式(i)所表示的基团:
[0682]
[化学式11]
[0683][0684]
(这里,环z为:与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。)。
[0685]
在e
2
为上述(a)的情况下,r
1
~r
5
中的碳原子数为1~6的烷基与上述的烷基相同。
[0686]
在e
2
为上述(a)的情况下,作为与e
1
结合的x,从提高本发明化合物的反应性和稳定性的观点来看,优选c(r
1
)(r
2
)、n(r
3
)、o、s或se,更优选c(r
1
)(r
2
)、n(r
3
)、o或s,更进一步优选c(r
1
)(r
2
)、n(r
3
)或o,又更进一步优选c(r
1
)(r
2
)或n(r
3
),最优选c(r
1
)(r
2
)。
[0687]
e
2
中的x还可在与离去基团(例如参照l、l
2
)的关系中规定。在x为n(r
3
)、o、s或se等原子或基团的情况下,不仅是离去基团就连x也可从亲电子基团上脱离。然而,在与抗体的反应中使用式(i)所表示的规定量的化合物的情况下,式(i)所表示的至少一部分的化合物中的x可控制反应使不从亲电子基团上脱离,因此在本发明中可使用如上所述的原子或基团作为x。优选的是,从提高式(i)所表示的化合物与抗体的目标反应的效率、进而提高具有生物正交性官能团的抗体的收率的观点来看,可使用较离去基团更难脱离的原子或基团(即,该原子或基团的pka值大于离去基团的pka值)作为x。因此,从更加选择性地使离去基团脱离、并且抑制e
2
中的x的脱离来提高式(i)所表示的化合物与抗体的目标反应效率、进而提高具有生物正交性官能团的抗体的收率的观点来看,作为e
2
中的x,优选脱离能力为离去基团以下的x。作为这样的x,可根据离去基团的种类(例如-n(r)-、-n(or)-、-o-、-s-或-se-、或者杂亚芳基)、以及与离去基团相邻存在的包含提高离去基团的脱离能力的基团的基团的有无及其种类而变动,概述如下。
[0688]
(1)在离去基团为-n(r)-或-n(or)-的情况下,作为x,优选c(r
1
)(r
2
)或n(r
3
),更优选c(r
1
)(r
2
)。
[0689]
(2)在离去基团为-o-的情况下,作为x,优选c(r
1
)(r
2
)、n(r
3
)或o,更优选c(r
1
)(r
2
)或n(r
3
),更进一步优选c(r
1
)(r
2
)。
[0690]
(3)在离去基团为-s-的情况下,作为x,优选c(r
1
)(r
2
)、n(r
3
)、o、或s,更优选c(r
1
)(r
2
)、n(r
3
)或o,更进一步优选c(r
1
)(r
2
)或n(r
3
),又更进一步优选c(r
1
)(r
2
)。
[0691]
(4)在离去基团为-se-的情况下,作为x,优选c(r
1
)(r
2
)、n(r
3
)、o、s或se,更优选c(r
1
)(r
2
)、n(r
3
)、o或s,更进一步优选c(r
1
)(r
2
)、n(r
3
)或o,又更进一步优选c(r
1
)(r
2
)或n(r
3
),最优选c(r
1
)(r
2
)。
[0692]
(5)在离去基团为杂亚芳基的情况下,作为x,优选c(r
1
)(r
2
)、n(r
3
)、o、s或se,更优选c(r
1
)(r
2
)、n(r
3
)、o或s,更进一步优选c(r
1
)(r
2
)、n(r
3
)或o,又更进一步优选c(r
1
)(r
2
)或n(r
3
),最优选c(r
1
)(r
2
)。
[0693]
在e
2
为上述(b)的情况下,环z中所含的与e
1
结合的环构成原子x
’
为碳原子或氮原子。
[0694]
在与e
1
结合的环构成原子x
’
为碳原子的情况下,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基。二价环基例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在二价环基具有取代基的情况下,这样的取代基的例子和优选例与作为离去基团的例子的杂亚芳基可具有的取代基相同。作为这样的二价环基,例如可列举:环状二价烃基(例如亚芳基、环状亚烷基、环状亚烯基、环状亚炔基)和二价杂环基(例如二价芳族杂环基、二价非芳族杂环基)。
[0695]
作为二价烃基,是环状二价烃基,作为二价烃基,例如可列举:环状亚烷基、环状亚烯基、环状亚炔基、亚芳基。
[0696]
作为环状亚烷基,优选碳原子数为3~12的亚烷基,更优选碳原子数为3~10的亚烷基,特别优选碳原子数为5~8的亚烷基。上述碳原子数中不包括取代基的碳原子数。作为这样的亚烷基,例如可列举:环亚丙基、环亚丁基、环亚戊基、环亚己基、环亚庚基、环亚辛基、环亚壬基、环亚癸基。
[0697]
作为环状亚烯基,优选碳原子数为3~12的亚烯基,更优选碳原子数为3~10的亚烯基,特别优选碳原子数为5~8的亚烯基。上述碳原子数中不包括取代基的碳原子数。作为这样的亚烯基,例如可列举:环亚丙烯基、环亚丁烯基、环亚戊烯基、环亚己烯基、环亚庚烯基、环亚辛烯基、环亚壬烯基、环亚癸烯基。
[0698]
作为环状亚炔基,优选碳原子数为6~12的亚炔基,更优选碳原子数为7~12的亚炔基,特别优选碳原子数为8~12的亚炔基。上述碳原子数中不包括取代基的碳原子数。亚炔基可以是直链、支链或环状的任一种,优选直链亚炔基。作为这样的亚炔基,例如可列举:环亚己炔基、环亚庚炔基、环亚辛炔基、环亚壬炔基、环亚癸炔基、环亚十一炔基、环亚十二炔基。
[0699]
作为亚芳基,优选碳原子数为6~24的亚芳基,更优选碳原子数为6~18的亚芳基,进一步优选碳原子数为6~14的亚芳基,更进一步优选碳原子数为6~10的亚芳基。上述碳原子数中不包括取代基的碳原子数。作为亚芳基,例如可列举:亚苯基、亚萘基、亚蒽基。
[0700]
二价杂环基为二价芳族杂环基或二价非芳族杂环基。作为构成杂环的杂原子,优选包含选自氧原子、硫原子、氮原子、磷原子、硼原子和硅原子的1种以上,更优选包含选自
氧原子、硫原子和氮原子的1种以上。
[0701]
作为二价芳族杂环基,优选碳原子数为3~21的二价芳族杂环基,更优选碳原子数为3~15的二价芳族杂环基,进一步优选碳原子数为3~9的二价芳族杂环基,更进一步优选碳原子数为3~6的二价芳族杂环基。上述碳原子数中不包括取代基的碳原子数。更具体而言,作为二价芳族杂环基,例如可列举:吡咯二基、呋喃二基、噻吩二基、吡啶二基、哒嗪二基、嘧啶二基、吡唑二基、异噻唑二基、异噁唑二基、吲哚二基、蒽醌二基、咔唑二基、芴二基、喹啉二基、异喹啉二基、喹唑啉二基、和酞嗪二基。
[0702]
作为二价非芳族杂环基,优选碳原子数为3~21的非芳族杂环基,更优选碳原子数为3~15的非芳族杂环基,进一步优选碳原子数为3~9的非芳族杂环基,更进一步优选碳原子数为3~6的非芳族杂环基。上述碳原子数中不包括取代基的碳原子数。更具体而言,作为二价非芳族杂环基,例如可列举:吡咯啉二酮二基、吡咯啉二基、氮杂环丁烷二基、氧杂环丁烷二基、硫杂环丁烷二基、吡咯烷二基、二氢呋喃二基、四氢呋喃二基、四氢噻吩二基、吡咯啉二基、哌啶二基、二氢吡喃二基、四氢吡喃二基、四氢噻喃二基、吡嗪二基、二氢噁嗪二基、四氢噁嗪二基、二氢嘧啶二基、和四氢嘧啶二基。
[0703]
在与e
1
结合的环构成原子x
’
为氮原子的情况下,环z是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。这样的二价杂环基是包含氮原子作为环构成原子的二价杂环基。作为包含氮原子作为环构成原子的二价杂环基,优选碳原子数为3~21的二价杂环基,更优选碳原子数为3~15的二价杂环基,进一步优选碳原子数为3~9的二价杂环基,更进一步优选碳原子数为3~6的二价杂环基。二价杂环基例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在二价杂环基具有取代基的情况下,这样的取代基的例子和优选例与作为离去基团的例子的杂亚芳基可具有的取代基相同。上述碳原子数中不包括取代基的碳原子数。作为包含氮原子作为环构成原子的二价杂环基,例如可列举:包含氮原子作为环构成原子的二价芳族杂环基、包含氮原子作为环构成原子的二价非芳族杂环基。作为包含氮原子作为环构成原子的二价芳族杂环基,例如可列举:吡咯二基、咪唑二基、吲哚二基、嘌呤二基、咔唑二基。作为包含氮原子作为环构成原子的二价非芳族杂环基,例如可列举:吡咯二酮二基、吡咯啉二酮二基、吡咯啉二基、氮丙啶二基、氮杂环丁烷二基、吡咯烷二基、吡咯啉二基、咪唑烷二基、哌啶二基、吗啉二基、硫代吗啉二基、吡嗪二基、二氢嘧啶二基、和四氢嘧啶二基。
[0704]
优选的是,(b)上述式(i)所表示的基团为(b
’
)下述式(i
’
)所表示的基团:
[0705]
[化学式12]
[0706][0707]
(这里,环z是与e
1
结合的环构成原子及其两邻的环构成原子均为碳原子的二价环基。
·
为结合键。)。关于上述式(i
’
)所表示的基团中的环z的二价环基的定义、例子和优选
例与关于上述式(i)所表示的基团中的环z的二价环基的含义相同。
[0708]
在e
2
为-x-y-的情况下e
3
是二价基团,而在e
2
为式(i)所表示的基团的情况下e
3
为键或二价基团。e
3
所表示的二价基团与e所表示的包含亲电子基团的二价基团为除包含亲电子基团以外还包含其他二价基团的二价基团的情况下的其他二价基团相同。
[0709]
连接l(包含离去基团的二价基团)和b(生物正交性官能团)的e(包含亲电子基团的二价基团)或e
1
(亲电子基团)-e
2
(上述(a)或(b))-e
3
(键或二价基团)的主链的长度与其不能参与式(i)所表示的化合物与抗体之间的反应中的抗体中的特定氨基酸残基的位置选择性修饰,不如可参与该反应后生成的具有生物正交性官能团的抗体中的抗体与生物正交性官能团之间的距离。e或e
1-e
2-e
3
的主链是指连接l和b的由通过共价键合连接的多个原子构成的链状结构,氢原子、支链结构部分和取代基除外。因此,从调节该距离的观点来看,e或e
1-e
2-e
3
的主链长度可适当设计。
[0710]
对连接l和b的e或e
1-e
2-e
3
的主链的长度没有特别限定,可以是由3个以上的原子构成的长度。
[0711]
在主链为不含环结构的结构的情况下,主链的原子数可通过计数链状结构中的原子数(氢原子、支链结构部分和取代基中的原子数除外)来确定。
[0712]
另一方面,在主链为包含环结构的结构的情况下,从规定主链长度的观点来看,可方便地计数主链的原子数。具体而言,这样的情况下的主链的原子数如上所述可通过在主链中不含二价环结构的链状结构中的原子数(氢原子、支链结构部分和取代基中的原子数除外)的基础上,再计数连通环结构中的2个结合键的最短路径的原子数来确定。
[0713]
优选的是,e或e
1-e
2-e
3
的主链可以是e中的“其他二价基团”或e
3
中的“二价基团”不含二价环结构的链状结构。因此,e中的“其他二价基团”或e
3
中的“二价基团”可以是二价的直链或支链烃基、-c(=o)-、-nr
e-(r
e
表示氢原子或上述的取代基)、-o-、-s-、-c(=s)-和由它们的2个以上(例如2~8、优选2~6、更优选2~4)的组合构成的基团。二价的直链或支链烃基例如可具有1~5个、优选1~3个、更优选1或2个取代基,也可不具有取代基。从合成化学结构简洁的化合物的观点来看,优选不具有这样的取代基。另一方面,在如上所述的基团具有取代基的情况下,这样的取代基的例子和优选例与作为离去基团的例子的杂亚芳基可具有的取代基相同。
[0714]
1-5.生物正交性官能团(b)
[0715]
式(i)中,b为生物正交性官能团。
[0716]
生物正交性官能团是指不会与生物构成成分(例如氨基酸、核酸、脂质、糖、磷酸)反应,或者对于生物构成成分的反应速度慢,但选择性地与除生物构成成分以外的成分反应的基团。生物正交性官能团在该技术领域中是周知的(例如参照sharpless k.b.等人,angew.chem.int.ed.40,2004(2015);bertozzi c.r.等人,science 291,2357(2001);bertozzi c.r.等人,nature chemical biology 1,13(2005))。
[0717]
在亲和性物质的靶为抗体(蛋白质)的情况下,生物正交性官能团是针对蛋白质的生物正交性官能团。针对蛋白质的生物正交性官能团是指,不与构成蛋白质的天然的20种氨基酸残基的侧链反应、而与规定的官能团反应的基团。构成蛋白质的天然的20种氨基酸为丙氨酸(a)、天冬酰胺(n)、半胱氨酸(c)、谷氨酰胺(q)、甘氨酸(g)、异亮氨酸(i)、亮氨酸(l)、蛋氨酸(m)、苯丙氨酸(f)、脯氨酸(p)、丝氨酸(s)、苏氨酸(t)、色氨酸(w)、酪氨酸(y)、
缬氨酸(v)、天冬氨酸(d)、谷氨酸(e)、精氨酸(r)、组氨酸(h)、和赖氨酸(l)。在这些天然的20种氨基酸中,无侧链(即氢原子)的甘氨酸以及侧链为烃基(即侧链不含选自硫原子、氮原子、和氧原子的杂原子)的丙氨酸、异亮氨酸、亮氨酸、苯丙氨酸、和缬氨酸对于通常的反应为惰性。因此,针对蛋白质的生物正交性官能团是,对于“对于通常的反应为惰性的具有侧链的这些氨基酸的侧链”不会发生反应,并且对于天冬酰胺、谷氨酰胺、蛋氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、天冬氨酸、谷氨酸、精氨酸、组氨酸、和赖氨酸的侧链也不会发生反应的官能团。
[0718]
作为对于蛋白质不会发生反应的这样的生物正交性官能团,例如可列举:叠氮残基、醛残基、硫醇残基、烯烃残基(换言之,只要具有作为具有碳原子间双键的最小单元的亚乙烯基(ethenylene)部分即可。下同)、炔烃残基(换言之,只要具有作为具有碳原子间三键的最小单元的亚乙炔基部分即可。下同)、卤素残基、四嗪残基、硝酮残基、羟胺残基、腈残基、肼残基、酮残基、硼酸残基、氰基苯并噻唑残基、烯丙基残基、膦残基、马来酰亚胺残基、二硫化物残基、硫酯残基、α-卤代羰基残基(例如在α位具有氟原子、氯原子、溴原子或碘原子的羰基残基。下同)、异腈残基、悉尼酮残基、硒残基。抗体可为不会含游离硫醇的蛋白质。在不会含游离硫醇的蛋白质中,硫醇作为生物正交性官能团发挥作用。因此,在亲和性物质的靶为抗体的情况下,生物正交性官能团包含硫醇。硫醇残基可以是未保护的硫醇残基(即-sh),也可以是被保护的硫醇残基。作为被保护的硫醇残基中的硫醇残基的保护基,例如可列举:烃基[例如烷基、烯基、炔基、环烷基、芳基(例如苯基、萘基)、芳基烷基(芳烷基)]、酰基(例如乙酰基、丙氧基、叔丁氧基羰基等丁氧基羰基、苯甲酰基)、芳基烷基氧基羰基(例如芴基甲氧基羰基)、芳基氧基羰基、芳基烷基(芳烷基)氧基羰基(例如苄氧羰基)、烷基硫醇基(叔丁基硫基)、芳基硫醇基(例如吡啶基二硫基)。或者,被保护的硫醇残基可以是二硫化物残基。芳基烷基(芳烷基)和芳基烷基(芳烷基)氧基羰基中的芳基烷基为在烷基上结合有1个或多个(例如2个、3个、4个、5个)芳基的基团。硫醇残基的保护基的碳原子数例如为1~30个,优选1~20个,更优选1~15个,更进一步优选1~10个,特别优选1~6个。在本发明中,式(i)所表示的化合物中可包含1种或2种以上(例如2种、3种、4种)的生物正交性官能团,优选的是,可包含1种生物正交性官能团。
[0719]
更具体而言,生物正交性官能团可对应于选自下述的任一个化学结构。
[0720]
[化学式13]
[0721][0722]
[式中,
[0723]
r
1f
、一个或多个r
1g
和一个或多个r
1h
相同或不同,为选自(a)~(g)的原子或基团、或者吸电子基团,
[0724]
●
为结合键。]。
[0725]
作为选自(a)~(g)的原子或基团,为选自以下列举的基团:
[0726]
(a)氢原子或卤原子;
[0727]
(b)一价烃基;
[0728]
(c)芳烷基;
[0729]
(d)一价杂环基;
[0730]
(e)r
a-o-、r
a-c(=o)-、r
a-o-c(=o)-或r
a-c(=o)-o-(r
a
表示氢原子或一价烃基。);或
[0731]
(f)nr
b
r
c-、nr
b
r
c-c(=o)-、nr
b
r
c-c(=o)-o-或r
b-c(=o)-nr
c-(r
b
和r
c
相同或不同,表示氢原子或一价烃基。);
[0732]
(g)硝基、硫酸基、磺酸基、氰基、或羧基。
[0733]
(a)~(g)中的卤原子、一价烃基、芳烷基、一价杂环基、和r
a
~r
c
中的一价烃基的定义、例子和优选例与上述(i)~(vii)中的含义相同。特别优选的是,选自(a)~(g)的原子或基团为(a)或(b)的原子或基团。
[0734]
优选的是,从提高反应效率等观点来看,即使在上述的生物正交性官能团中,生物正交性官能团也可以是选自叠氮残基、硫醇残基、炔烃残基、马来酰亚胺残基、和二硫化物残基的基团。
[0735]
作为吸电子基团,例如可列举上述的基团,但优选卤原子、硼酸残基、甲磺酰基、甲苯磺酰基、三氟甲磺酸盐或酯。
[0736]
1-6.式(i)所表示的化合物的优选结构
[0737]
在优选实施方式中,式(i)所表示的化合物可以是下述式(i-1)所表示的化合物:
[0738]
a-l
1-l
2-e
1-e
2-e
3-b
ꢀꢀꢀꢀꢀꢀ
(i-1)
[0739]
[式中,
[0740]
a和b与式(i)中相应符号的含义相同,
[0741]
l
1
为键或二价基团,
[0742]
l
2
为离去基团,
[0743]
e
1
为(i)与离去基团连接、并且(ii)具有与抗体中的亲核基团进行反应的能力的亲电子基团,
[0744]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数为1~6的烷基。)、n(r
3
)(这里,r
3
表示氢原子或碳原子数为1~6的烷基。)、o、s或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
和r
5
分别独立地为氢原子或碳原子数为1~6的烷基。)。];或者(b)下述式(i)所表示的基团:
[0745]
[化学式14]
[0746][0747]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0748]
在e
2
为-x-y-的情况下e
3
为二价基团,而在e
2
为式(i)所表示的基团的情况下e
3
为键或二价基团,
[0749]
离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e
1
上切割并脱离的能力。]。
[0750]
式(i-1)中,l
2
所表示的离去基团优选为上述(a)~(c)中的任一种。l
2
所表示的离去基团的例子和优选例也和上述(a)~(c)中记述的例子相同。
[0751]
在优选的特定实施方式中,式(i-1)所表示的化合物可以是下述式(i-2)所表示的化合物:
[0752]
a-l
1-l
2-e
1-x-y-e
3-b
ꢀꢀ
(i-2)
[0753]
[式中,
[0754]
a、l
1
、x、y和b与式(i-1)中的相应符号的含义相同,
[0755]
l
2
为:
[0756]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0757]
(b)杂亚芳基;或者
[0758]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[0759]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0760]
e
3
为二价基团。]。
[0761]
在另一优选的特定实施方式中,式(i-1)所表示的化合物可以是下述式(i-3)所表示的化合物:
[0762]
[化学式15]
[0763][0764]
[式中,
[0765]
a、l
1
、环z、环构成原子x
’
和b与上述式(i-1)中相应符号的含义相同,
[0766]
l
2
为:
[0767]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0768]
(b)杂亚芳基;或者
[0769]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[0770]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0771]
e
3
为键或二价基团。]。
[0772]
优选的是,式(i-3)所表示的化合物可以是下述式(i-4)所表示的化合物:
[0773]
[化学式16]
[0774][0775]
[式中,
[0776]
a、l
1
和b与上述式(i-1)中的相应符号的含义相同,
[0777]
l
2
为:
[0778]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0779]
(b)杂亚芳基;或者
[0780]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[0781]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0782]
环z是与e
1
结合的环构成原子及其两邻的环构成原子均为碳原子的二价环基,
[0783]
e
3
为键或二价基团。]。
[0784]
在上述式(i-1)~(i-4)所表示的化合物中,a、l
1
、l
2
、e
1
、e
2
、e
3
和b、以及-x-y-、r
1
~r
5
中的碳原子数为1~6的烷基、式(i)所表示的基团(例如二价环基、二价杂环基)的定义、例子和优选例与上述的相应内容相同。另外,作为l
2
的(a)~(c)、以及环z(例如与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基)、环p和q(例如r中的碳原子数为1~6的烷基)等基团的定义、例子和优选例也和上述的相应内容相同。
[0785]
1-7.制备方法
[0786]
具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐可适当调制。具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐用式(i)、优选式(i-1)、更优选式(i-2)、(i-3)或(i-4)表示。
[0787]
作为针对抗体的亲和性物质(a),可适当选择具有任意的官能团的物质。因此,通过利用可与该官能团反应的反应性基团,使亲和性物质与l-e-b所表示的结构单元反应,可调制a-l-e-b所表示的结构单元。例如,这样的反应可在适当的反应体系、例如有机溶剂体系或水溶液体系中,在适当温度(例如约15~200℃)下进行。反应体系可包含适当的催化剂。反应时间例如为1分钟~20小时,优选10分钟~15小时,更优选20分钟~10小时,更进一步优选30分钟~8小时。
[0788]
在反应体系中,l-e-b所表示的结构单元(y)与亲和性物质(x)的摩尔比(y/x)根据该结构单元和亲和性物质的种类、要通过该结构单元修饰的亲和性物质中的位点的数量等而变动,所以没有特别限定,例如为0.1~50,优选为0.5~40,更优选为1~35,更进一步优选为2~25,特别优选为3~15。
[0789]
具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐的生成的确认,虽然也依赖于其具体的原料和产物的分子量,但可通过例如电泳法、层析法(例如凝胶过滤层析法、离子交换层析法、反相柱层析法、hplc)或质谱分析来进行,优选通过质谱分析来进行。具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐可通过层析法(例如上述的层析法和亲和层析法)等任意的方法来适当纯化。
[0790]
1-8.其他
[0791]
在后述的发明[例如式(ii)、(iii)及其下位概念的式以及部分结构式所表示的发明]中,任意的符号(例如a、l、e、b)和与该符号相关表示的术语的详情(例如定义、例子和优选例)与上述式(i)或其下位概念的式所表示的化合物或其盐的发明共通。另外,对于可规定后述发明的特定基团(例如生物正交性官能团、二价基团、取代基)和特定数值等的任意技术要素(例如定义、例子和优选例),也可与上文中说明的内容共通。因此,在无特别说明的情况下,这些事项可在后述的发明中适当援引。同样地,后述的发明中记述的特定的发明技术要素可作为本发明和其他发明的技术要素适当援引。
[0792]
2.具有生物正交性官能团的抗体的制备方法
[0793]
本发明提供具有生物正交性官能团的抗体或其盐的制备方法,所述制备方法包括以下工序。
[0794]
(1)使下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐与抗体反应,生成下述式(ii)所表示的具有生物正交性官能团的抗体或其盐,
[0795]
a-l-e-b
ꢀꢀꢀꢀꢀ
(i)
[0796]
[式中,
[0797]
a为针对抗体的亲和性物质,
[0798]
l为包含离去基团的二价基团,
[0799]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与离去基团连接、并且(ii)具有与抗体中的亲核基团进行反应的能力,
[0800]
b为生物正交性官能团,
[0801]
离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。];
[0802]
ab-e-b
ꢀꢀꢀꢀꢀ
(ii)
[0803]
[式中,
[0804]
e和b与式(i)中相应符号的含义相同,
[0805]
ab为抗体。]。
[0806]
具有生物正交性官能团的抗体的制备方法中使用的抗体与上述抗体相同。优选的是,抗体为单克隆抗体。作为单克隆抗体的同种型,例如可列举:igg(例如igg1、igg2、igg3、igg4)、igm、iga、igd、ige和igy。单克隆抗体为全长抗体或抗体片段(例如f(ab
’
)
2
、fab
’
、fab、fv、单链抗体),但优选全长抗体。特别优选的是,抗体为恒定区中具有人igg(例如igg1、igg2、igg3、igg4)的人抗体、人源化抗体、或嵌合抗体。
[0807]
式(ii)中的ab与上述抗体相同,与e中的亲电子基团进行共价键合。作为供于与e中的亲电子基团共价键合的抗体中的亲核基团,例如可列举:赖氨酸残基的侧链中的nh
2
、酪氨酸残基的侧链中的oh、丝氨酸残基的侧链中的oh、苏氨酸残基的侧链中的oh、和半胱氨酸残基的侧链中的sh。
[0808]
式(ii)中的e与上述式(i)中的e相同。e可用e
1-e
2-e
3
表示。e
1
、e
2
和e
3
与上述的相应符号的含义相同。如上所述,e和e
1-e
2-e
3
可设计成不包含存在具潜在的免疫原性、且在血中容易水解的问题的肽部分。这种情况下,式(ii)所表示的具有生物正交性官能团的抗体可用于调制不存在所述问题的、具有功能性物质的抗体。
[0809]
e中的亲电子基团和e
1
的亲电子基团与抗体中的亲核基团进行共价键合。作为与抗体中的亲核基团进行共价键合的亲电子基团,例如可列举:nh-c(=o)-、nh-so
2-和nh-ch
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)、o-c(=o)-、o-so
2-和o-ch
2-(供于与e进行共价键合的抗体中的亲核基团为酪氨酸残基、丝氨酸残基、或苏氨酸残基的侧链中的oh的情况)、s-c(=o)-和s-ch
2-(供于与e进行共价键合的抗体中的亲核基团为半胱氨酸残基的侧链中的sh的情况)。作为与抗体中的亲核基团进行共价键合的亲电子基团,优选nh-c(=o)-和nh-so
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)、o-c(=o)-和o-so
2-(供于与e进行共价键合的
抗体中的亲核基团为酪氨酸残基的侧链中的oh的情况),更优选nh-c(=o)-和nh-so
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况),更进一步优选nh-c(=o)-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)。
[0810]
式(ii)中的b与上述式(i)中的b相同。
[0811]
优选的是,通过本发明的制备方法制备的具有生物正交性官能团的抗体是位置选择性地具有生物正交性官能团的抗体。在具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐为式(i)所表示的物质的情况下,可制备式(ii)所表示的位置选择性地具有生物正交性官能团的抗体。位置选择性地具有生物正交性官能团的抗体优选为仅在恒定区具有生物正交性官能团的抗体,更优选为仅在fc区具有生物正交性官能团的抗体。
[0812]
在本说明书中,“位置选择性的”或“位置选择性”是指,尽管在抗体中特定的氨基酸残基没有不均匀地存在于特定区,但可与抗体中的特定氨基酸残基结合的规定的结构单元不均匀地存在于抗体中的特定区。因此,“位置选择性地具有”、“位置选择性的结合”、“以位置选择性的结合”等与位置选择性有关的表述是指,包含1个以上的特定氨基酸残基的靶区中的规定的结构单元的结合率或保有率以显著水平高于包含与靶区中的该特定氨基酸残基同种的多个氨基酸残基的非靶区中的该结构单元的保有率或结合率。这样的位置选择性的结合或保有可通过本发明来实现,本发明不是使规定的结构单元随机地与抗体中的特定氨基酸残基进行反应,而是通过使用包含针对抗体的亲和性物质的化合物,可使规定的结构单元优先与抗体中的靶区中的特定氨基酸残基进行反应。
[0813]
更具体而言,抗体(ab)在由连续的1~50个氨基酸残基构成的靶区[例如由人igg fc区中的246~248位的氨基酸残基构成的区域、(b)由人igg fc区中的288~290位的氨基酸残基构成的区域、或(c)由人igg fc区中的317位的氨基酸残基构成的区域]中包含1个以上的特定氨基酸残基(例如赖氨酸残基、酪氨酸残基、苏氨酸残基、丝氨酸残基、半胱氨酸残基)、并且在除上述靶区以外的非靶区中包含5个以上的上述特定氨基酸残基的情况下,除抗体以外的部分结构可以以30%以上的位置选择性与该靶区中所含的1个以上的特定氨基酸残基进行结合。位置选择性可优选为40%以上,更优选为50%以上,更进一步优选为60%以上,特别优选为70%以上、80%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上或100%。
[0814]
通过本发明的制备方法制备的具有生物正交性官能团的抗体可根据重链的数量具有生物正交性官能团(即用e-b表示的结构单元)。位置选择性地具有生物正交性官能团的抗体可如下制备:首先,使式(i)所表示的化合物(a-l-e-b)经由针对抗体的亲和性物质(a)与抗体重链的恒定区缔合,然后使e中的亲电子基团与缔合部位附近(与上述抗体重链为同一重链的恒定区)的特定氨基酸残基的侧链中的亲核基团进行反应,即可制得。因此,通过在本发明的制备方法中使用具有多个(例如1~8个、优选1~4个、更优选2个)抗体重链的抗体,可制备在多个抗体重链的相同靶区中位置选择性地具有用e-b表示的多个结构单元(或其下位概念的多个结构单元)的抗体。例如,通过在本发明的制备方法中使用具有2个抗体重链的抗体(例如igg、igd、ige、f(ab
’
)
2
抗体、fc区蛋白、fc融合蛋白),可制备在2个抗体重链的相同靶区中位置选择性地具有2个用e-b表示的结构单元的抗体。即,在具有生物正交性官能团的抗体中,可使基于生物正交性官能团的修饰方式在多个(例如2个)重链间
相同。
[0815]
具有生物正交性官能团的抗体还可在1个抗体重链的多个(例如2~5个、优选2~4个、更优选2或3个)靶区中具有同种或异种的生物正交性官能团(例如以e-b表示的结构单元)。这种情况下,在具有生物正交性官能团的抗体中,可使基于生物正交性官能团的修饰方式在多个(例如2个)重链间相同。
[0816]
本发明的制备方法还可包括:通过对所生成的抗体赋予特定的处理,生成具有生物正交性官能团、并且进一步被修饰的抗体。作为这样的特定处理,例如可列举:抗体的片段化处理(例如利用木瓜蛋白酶、胃蛋白酶等特定蛋白酶的处理)。
[0817]
在本发明的制备方法中使用式(i)所表示的化合物或其盐的情况下,可制备上述式(ii)所表示的具有生物正交性官能团的抗体。
[0818]
在优选实施方式中,在本发明的制备方法中使用式(i-1)所表示的化合物作为式(i)所表示的化合物的情况下,可制备下述式(ii-1)所表示的具有生物正交性官能团的抗体。
[0819]
ab-e
1-e
2-e
3-b
ꢀꢀꢀꢀꢀꢀ
(ii-1)
[0820]
[式中,
[0821]
ab为抗体,
[0822]
e
1
为与抗体中的亲核基团连接的亲电子基团,
[0823]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数为1~6的烷基。)、n(r
3
)(这里,r
3
表示氢原子或碳原子数为1~6的烷基。)、o、s或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
或r
5
分别独立地为氢原子或碳原子数为1~6的烷基。)。];或(b)下述式(i)所表示的基团:
[0824]
[化学式17]
[0825][0826]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0827]
e
3
在e
2
为-x-y-的情况下是二价基团,而在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0828]
b为生物正交性官能团。]。
[0829]
在优选的特定实施方式中,在本发明的制备方法中使用式(i-2)所表示的化合物作为式(i-1)所表示的化合物的情况下,可制备下述式(ii-2)所表示的具有生物正交性官能团的抗体。
[0830]
ab-e
1-x-y-e
3-b
ꢀꢀꢀꢀꢀꢀ
(ii-2)
[0831]
[式中,
[0832]
ab、x、y和b与式(ii-1)中相应符号的含义相同,
[0833]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0834]
e
3
为二价基团。]。
[0835]
在优选的另一特定实施方式中,在本发明的制备方法中使用式(i-3)所表示的化合物作为式(i-1)所表示的化合物的情况下,可制备下述式(ii-3)所表示的具有生物正交性官能团的抗体。
[0836]
[化学式18]
[0837][0838]
[式中,
[0839]
ab、环构成原子x
’
、环z和b与式(ii-1)中相应符号的含义相同,
[0840]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0841]
e
3
为键或二价基团。]。
[0842]
优选的是,在本发明的制备方法中使用式(i-4)所表示的化合物作为式(i-3)所表示的化合物的情况下,可制备下述式(ii-4)所表示的具有生物正交性官能团的抗体。
[0843]
[化学式19]
[0844][0845]
[式中,
[0846]
ab、环z和b与式(ii-1)中相应符号的含义相同,
[0847]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0848]
e
3
为键或二价基团。]。
[0849]
式(ii)、(ii-1)、(ii-2)、(ii-3)或(ii-4)中的任意符号(例如e、e
1
、e
2
、e
3
、b)和与该符号相关表示的术语(例如抗体、亲电子基团、生物正交性官能团)的详情(例如定义、例子和优选例)与上述式(i)或其下位概念的式中的相应含义共通。
[0850]
具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐因具有e中的亲电子基团或e
1
的亲电子基团,故可与抗体进行反应。这样的反应可在不会引发蛋白质的变性、分解(例如酰胺键的断裂)的条件(温和条件)下来适当进行。例如,这样的反应可在适当的反应体系、例如在缓冲液中、在室温(例如约15~30℃)下来进行。缓冲液的ph例如为5~9,优选为5.5~8.5,更优选为6.0~8.0。缓冲液可包含适当的催化剂。反应时间例如为1分钟~20小时,优选为10分钟~15小时,更优选为20分钟~10小时,更进一步优选为30分钟~8小时。关于这样的反应的详情,例如参照g.j.l.bernardes等人,chem.rev.,115,2174
(2015);g.j.l.bernardes等人,chem.asian.j.,4,630(2009);b.g.davies等人,nat.commun.,5,4740(2014);a.wagner等人,bioconjugate.chem.,25,825(2014)。
[0851]
在反应体系中,具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐(y)与抗体(x)的摩尔比(y/x),根据具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐和抗体的种类、要通过具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐进行修饰的抗体中的位点的数量(例如dar)等而变动,因此没有特别限定,例如为0.1~100,优选为0.5~80,更优选为1~70,更进一步优选为2~50,特别优选为3~30。
[0852]
具有生物正交性官能团的抗体的生成的确认,虽然也依赖于其具体的原料和产物的分子量,但可通过例如电泳法、层析法(例如凝胶过滤层析法、离子交换层析法、反相柱层析法、hplc)或质谱分析来进行,优选通过质谱分析来进行。位置选择性的确认例如可通过肽谱(peptide mapping)来进行。关于肽谱,例如可通过蛋白酶(例如胰蛋白酶、胰凝乳蛋白酶)处理和质谱分析来进行。作为蛋白酶,优选内切蛋白酶。作为这样的内切蛋白酶,例如可列举:胰蛋白酶、胰凝乳蛋白酶、glu-c、lys-n、lys-c、asp-n。具有生物正交性官能团的抗体所保有的生物正交性官能团的个数的确认例如可通过电泳法、层析法或质谱分析来进行,优选通过质谱分析来进行。具有生物正交性官能团的抗体可通过层析法(例如上述的层析法和亲和层析法)等任意的方法来适当纯化。
[0853]
3.使用具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐的具有功能性物质的抗体的制备方法
[0854]
本发明提供具有功能性物质的抗体或其盐的制备方法,所述制备方法包括以下工序。
[0855]
(1)使下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐与抗体进行反应,生成下述式(ii)所表示的具有生物正交性官能团的抗体或其盐,
[0856]
a-l-e-b
ꢀꢀꢀꢀꢀ
(i)
[0857]
[式中,
[0858]
a为针对抗体的亲和性物质,
[0859]
l为包含离去基团的二价基团,
[0860]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与离去基团连接、并且(ii)具有与抗体中的亲核基团进行反应的能力,
[0861]
b为生物正交性官能团,
[0862]
离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。],
[0863]
ab-e-b
ꢀꢀꢀꢀꢀ
(ii)
[0864]
[式中,
[0865]
e和b与上述式(i)中相应符号的含义相同,
[0866]
ab为抗体。];以及
[0867]
(2)使上述式(ii)所表示的具有生物正交性官能团的抗体或其盐经由生物正交性官能团与功能性物质进行反应,生成下述式(iii)所表示的具有功能性物质的抗体或其盐:
[0868]
ab-e-b
’-
f
ꢀꢀꢀꢀꢀ
(iii)
[0869]
[式中,
[0870]
ab与式(ii)中相应符号的含义相同,
[0871]
e与式(i)中相应符号的含义相同,
[0872]
b
’
为包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团,
[0873]
f为功能性物质。]。
[0874]
工序(1)可与具有生物正交性官能团的抗体的制备方法同样地进行。
[0875]
工序(2)中使用的功能性物质(f)只要是对抗体赋予任意功能的物质,则没有特别限定,例如可列举:药物、标记物质、稳定剂,但优选为药物或标记物质。另外,功能性物质可以是单一的功能性物质,或者可以是2种以上的功能性物质连接而得到的物质。
[0876]
作为药物,可以是针对任意疾病的药物。作为这样的疾病,例如可列举:癌症(例如肺癌、胃癌、大肠癌、胰腺癌、肾癌、肝癌、甲状腺癌、前列腺癌、膀胱癌、卵巢癌、子宫癌、骨癌、皮肤癌、脑肿瘤、黑色素瘤)、自身免疫疾病-炎性疾病(例如过敏性疾病、类风湿性关节炎、系统性红斑狼疮)、脑神经疾病(例如脑梗塞、阿尔茨海默氏症、帕金森氏症、肌肉萎缩性侧索硬化症)、感染症(例如细菌感染症、病毒感染症)、遗传性-罕见疾病(例如遗传性球形红细胞增多症、非营养不良性肌强直综合征)、眼疾病(例如老年性黄斑变性、糖尿病性视网膜病变、视网膜色素变性)、骨科-整形外科领域的疾病(例如骨性关节炎)、血液疾病(例如白血病、紫癜)、其他疾病(例如糖尿病、高脂血症等代谢异常疾病、肝脏疾病、肾脏疾病、肺疾病、循环系统疾病、消化系统疾病)。药物可以是治疗或预防规定疾病的药物、或者是减轻针对规定疾病的靶蛋白质的抗体的使用所伴随的副作用的药物。
[0877]
更具体而言,药物为抗癌剂。作为抗癌剂,例如可列举:化疗剂、毒素、放射性同位素或包含其的物质。作为化疗剂,例如可列举:dna损伤剂、代谢拮抗剂、酶抑制剂、dna嵌入剂、dna切割剂、拓扑异构酶抑制剂、dna结合抑制剂、微管蛋白结合抑制剂、细胞毒性核苷、铂化合物。作为毒素,例如可列举:细菌毒素(例如白喉毒素)、植物毒素(例如蓖麻毒素)。作为放射性同位素,例如可列举:氢原子的放射性同位素(例如
3
h)、碳原子的放射性同位素(例如
14
c)、磷原子的放射性同位素(例如
32
p)、硫原子的放射性同位素(例如
35
s)、钇的放射性同位素(例如
90
y)、锝的放射性同位素(例如
99m
tc)、铟的放射性同位素(例如
111
in)、碘原子的放射性同位素(例如
123
i、
125
i、
129
i、
131
i)、钐的放射性同位素(例如
153
sm)、铼的放射性同位素(例如
186
re)、砹的放射性同位素(例如
211
at)、铋的放射性同位素(例如
212
bi)。
[0878]
作为标记物质,例如可列举:酶(例如过氧化物酶、碱性磷酸酶、荧光素酶、β-半乳糖苷酶)、亲和性物质(例如链霉亲和素、生物素、地高辛、适体)、荧光物质(例如荧光素、异硫氰酸荧光素、罗丹明、绿色荧光蛋白、红色荧光蛋白)、发光物质(例如虫荧光素、水母发光蛋白(aequorin)、吖啶酯(acridinium ester)、三(2,2'-联吡啶)钌、鲁米诺)、放射性同位素(例如上述的放射性同位素)或含其的物质。
[0879]
另外,功能性物质为高分子化合物、中分子化合物或低分子化合物,优选为低分子化合物。低分子化合物是指分子量为1500以下的化合物。低分子化合物为天然化合物或合成化合物。低分子化合物的分子量可以是1200以下、1000以下、900以下、800以下、700以下、600以下、500以下、400以下或300以下。另外,低分子化合物的分子量可以是30以上、40以上或50以上。低分子化合物可以是如上所述的药物或标记物质。作为低分子化合物,例如还可
列举:氨基酸、寡肽、维生素、核苷、核苷酸、寡核苷酸、单糖、寡糖、脂质、脂肪酸和它们的盐。
[0880]
功能性物质具有与其结构相应的各种官能团。在功能性物质具有容易与生物正交性官能团反应的官能团的情况下,可使功能性物质的该官能团与生物正交性官能团进行适当反应。容易与生物正交性官能团反应的官能团可根据生物正交性官能团的具体种类而不同。如果是本领域技术人员,则可适当选择适宜的官能团作为容易与生物正交性官能团反应的官能团(例如boutureira等人,chem.rev.,2015,115,2174-2195)。作为容易与生物正交性官能团反应的官能团,例如在生物正交性官能团为炔烃残基的情况下可列举叠氮残基,在生物正交性官能团为醛残基或酮残基的情况下可列举肼残基,在生物正交性官能团为硫醇残基的情况下可列举马来酰亚胺残基和二硫化物残基,但并不限于这些。例如,在生物正交性官能团为炔烃残基、并且容易与生物正交性官能团反应的官能团为叠氮残基的情况下(或其相反的情况),包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团可以是包含三唑残基(可与其他环稠合也可不稠合)的二价基团;在生物正交性官能团为醛残基或酮残基、并且容易与生物正交性官能团反应的官能团为肼残基的情况下(或其相反的情况),包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团可以是包含腙残基的二价基团;在生物正交性官能团为硫醇残基、并且容易与生物正交性官能团反应的官能团为马来酰亚胺残基或二硫化物残基的情况下(或其相反情况),包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团可以是包含硫代琥珀酰亚胺残基的二价基团、或包含二硫化物残基的二价基团(例如,boutureira等人,chem.rev.,2015,115,2174-2195)。包含三唑残基(可与其他环稠合也可不稠合)的二价基团、包含腙残基的二价基团、包含硫代琥珀酰亚胺残基的二价基团、或者包含二硫化物残基的二价基团是包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团的优选例。
[0881]
另一方面,在功能性物质不具有容易与生物正交性官能团反应的官能团的情况下,作为功能性物质,可使用通过衍生物化而具有所期望的官能团的物质。例如,在功能性物质为可溶性蛋白质的情况下,可使用通过衍生物化而具有可溶性蛋白质天然不具有的官能团的物质。
[0882]
衍生物化为该领域中的技术常识(例如国际公开第2004/010957号、美国专利申请公开第2006/0074008号说明书、美国专利申请公开第2005/0238649号说明书)。例如,衍生物化可使用如上所述的交联剂来进行。或者,衍生物化可使用具有所期望的官能团的特定接头来进行。例如,这样的接头可以是能在适当的环境(例如细胞内或细胞外)通过接头的切割而将功能性物质与抗体分离的基团。作为这样的接头,例如可列举:通过特定的蛋白酶[例如,细胞内蛋白酶(例如溶酶体或者核内体中存在的蛋白酶)、细胞外蛋白酶(例如分泌性蛋白酶)]分解的肽基接头(例如美国专利第6,214,345号;dubowchik等,pharm.therapeutics 83:67-123(1999))、可在存在于生物体内的局部酸性部位被切割的接头(例如美国专利第5,622,929号、美国专利第5,122,368号、美国专利第5,824,805号)。接头可以是自解构的(self-immolative)(例如国际公开第02/083180号、国际公开第04/043493号、国际公开第05/112919号)。在本发明中,衍生物化的功能性物质也可仅称为“功能性物质”。
[0883]
式(iii)中的ab与上述抗体相同,与e中的亲电子基团进行共价键合。作为供于与e
中的亲电子基团共价键合的抗体中的亲核基团,例如可列举:赖氨酸残基的侧链中的nh
2
、酪氨酸残基的侧链中的oh、丝氨酸残基的侧链中的oh、苏氨酸残基的侧链中的oh、和半胱氨酸残基的侧链中的sh。
[0884]
式(iii)中的e与上述式(i)中的e相同。e可用e
1-e
2-e
3
表示。e
1
、e
2
和e
3
与上述的相应符号的含义相同。如上所述,e和e
1-e
2-e
3
可设计成不包含存在具潜在的免疫原性、且在血中容易水解的问题的肽部分。这种情况下,式(iii)所表示的具有功能性物质的抗体可适合用作药物。
[0885]
e中的亲电子基团和e
1
的亲电子基团与抗体中的亲核基团进行共价键合。作为与抗体中的亲核基团进行共价键合的亲电子基团,例如可列举:nh-c(=o)-、nh-so
2-和nh-ch
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)、o-c(=o)-、o-so
2-和o-ch
2-(供于与e进行共价键合的抗体中的亲核基团为酪氨酸残基、丝氨酸残基、或苏氨酸残基的侧链中的oh的情况)、s-c(=o)-和s-ch
2-(供于与e进行共价键合的抗体中的亲核基团为半胱氨酸残基的侧链中的sh的情况)。作为与抗体中的亲核基团进行共价键合的亲电子基团,优选nh-c(=o)-和nh-so
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)、o-c(=o)-和o-so
2-(供于与e进行共价键合的抗体中的亲核基团为酪氨酸残基的侧链中的oh的情况),更优选nh-c(=o)-和nh-so
2-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况),更进一步优选nh-c(=o)-(供于与e进行共价键合的抗体中的亲核基团为赖氨酸残基的侧链中的nh
2
的情况)。
[0886]
在特定的实施方式中,在功能性物质具有容易与生物正交性官能团反应的官能团的情况下、或者进行衍生物化而具有容易与生物正交性官能团反应的官能团的情况下,容易与生物正交性官能团反应的官能团可以是选自下述的基团:叠氮残基、醛残基、硫醇残基、炔烃残基、烯烃残基、卤素残基、四嗪残基、硝酮残基、羟胺残基、腈残基、肼残基、酮残基、硼酸残基、氰基苯并噻唑残基、烯丙基残基、膦残基、马来酰亚胺残基、二硫化物残基、硫酯残基、α-卤代羰基残基、异腈残基、悉尼酮残基、硒残基。
[0887]
而且,在特定的实施方式中,在功能性物质具有容易与生物正交性官能团反应的官能团的情况下、或者进行衍生物化而具有容易与生物正交性官能团反应的官能团的情况下,容易与上述生物正交性官能团反应的官能团可以是选自下述式所表示的基团的基团。
[0888]
[化学式20]
[0889][0890]
[式中,
[0891]
r
1f
、一个或多个r
1g
和一个或多个r
1h
相同或不同,为选自上述(i)~(vii)中的原子或基团、或者吸电子基团,
·
为针对功能性物质的结合键。]。
[0892]
式(iii)中的b
’
所表示的、包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团可以是:(1)包含上述的优选例中提及的残基、即三唑残基、腙残基或硫代琥珀酰亚胺残基的二价基团;或者,(2)并非特别限定,例如可以是包含选自下述的残基的二价基团:二硫化物残基(该残基为上述的优选例中提及的残基)、缩醛残基、缩酮残基、酯残基、氨甲酰基残基、烷氧基烷基残基、亚胺残基、叔烷基氧基氨基甲酸酯残基、硅烷残基、含有腙的残基、氨基磷酸酯残基、乌头酰基残基、三苯甲基残基、偶氮残基、邻二醇残基、硒残基、含有具吸电子基团的芳环的残基、含有香豆素的残基、含有砜的残基、含有不饱和键的链残基、糖基残基。
[0893]
另外,包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团并非特别限定,例如可以是包含选自下述的任一个化学结构所对应的残基的二价基团:
[0894]
[化学式21]
[0895][0896]
[这里,与键正交的波浪线表示通过反应而生成的键,
[0897]
多个r
2a
、多个r
2b
和多个r
2c
相同或不同,为氢原子或上述的取代基,
[0898]
j为-ch
2-、-o-或-s-,
[0899]
r为1~4的任意整数,
[0900]
○
(白色圆)表示针对f侧的部分的键,
●
(黑色圆)表示针对b
’
侧的部分的键,
[0901]
在化学结构以切割性部分为中心呈不对称的情况下,可以是
●
表示针对b
’
侧的部分的键,
○
表示针对f侧的部分的键。]。
[0902]
优选的是,通过本发明的制备方法中的工序(2)制备的具有功能性物质的抗体是位置选择性地具有功能性物质的抗体。在位置选择性地具有生物正交性官能团的抗体为式(ii)所表示的抗体的情况下,可制备式(iii)所表示的位置选择性地具有功能性物质的抗体。位置选择性地具有功能性物质的抗体优选为仅在恒定区具有功能性物质的抗体,更优选为仅在fc区具有功能性物质的抗体。
[0903]
抗体(ab)在由连续的1~50个氨基酸残基构成的靶区[例如由人igg fc区中的246~248位的氨基酸残基构成的区域、(b)由人igg fc区中的288~290位的氨基酸残基构成的区域、或(c)由人iggfc区中的317位的氨基酸残基构成的区域]中包含1个以上的特定氨基酸残基(例如赖氨酸残基、酪氨酸残基、苏氨酸残基、丝氨酸残基、半胱氨酸残基)、并且在除上述靶区以外的非靶区中包含5个以上的上述特定氨基酸残基的情况下,除抗体以外的部分结构可以以30%以上的位置选择性与该靶区中所含的1个以上的特定氨基酸残基结合。
位置选择性可优选为40%以上,更优选为50%以上,更进一步优选为60%以上,特别优选为70%以上、80%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上或100%。
[0904]
通过本发明的制备方法制备的具有功能性物质的抗体还可根据重链的数量具有功能性物质(即,用e-b
’-
f表示的结构单元)。这是由于:可由具有可根据重链的数量具有用e-b表示的结构单元的生物正交性官能团的抗体制备具有功能性物质的抗体。因此,通过在本发明的制备方法中使用具有多个(例如1~8个、优选1~4个、更优选2个)抗体重链的抗体,可制备在多个抗体重链的相同靶区中位置选择性地具有用e-b
’-
f表示的多个结构单元(或其下位概念的多个结构单元)的抗体。例如,通过在本发明的制备方法中使用具有2个抗体重链的抗体(例如igg、igd、ige、f(ab
’
)
2
抗体、fc区蛋白、fc融合蛋白),可制备在2个抗体重链的相同靶区中位置选择性地具有2个用e-b
’-
f表示的结构单元的抗体。即,在具有功能性物质的抗体中,可使基于功能性物质的修饰方式在多个(例如2个)重链间相同。
[0905]
具有功能性物质的抗体还可在1个抗体重链的多个(例如2~5个、优选2~4个、更优选2或3个)靶区中具有同种或异种的功能性物质(例如以e-b
’-
f表示的结构单元)。这种情况下,在具有功能性物质的抗体中,可使基于功能性物质的修饰方式在多个(例如2个)重链间相同。
[0906]
本发明的制备方法还可包括:通过对所生成的抗体赋予特定的处理,生成具有功能性物质、并且进一步被修饰的抗体。作为这样的特定处理,例如可列举:抗体的片段化处理(例如利用木瓜蛋白酶、胃蛋白酶等特定蛋白酶的处理)。
[0907]
在本发明的制备方法中使用式(i)所表示的化合物或其盐的情况下,在工序(1)中可制备上述式(ii)所表示的具有生物正交性官能团的抗体,然后,在工序(2)中可制备上述式(iii)所表示的具有功能性物质的抗体。
[0908]
在优选实施方式中,在本发明的制备方法中使用式(i-1)所表示的化合物作为式(i)所表示的化合物的情况下,在工序(1)中可制备上述式(ii-1)所表示的具有生物正交性官能团的抗体,然后,在工序(2)中可制备下述式(iii-1)所表示的具有功能性物质的抗体。
[0909]
ab-e
1-e
2-e
3-b
’-
f
ꢀꢀꢀꢀꢀ
(iii-1)
[0910]
[式中,
[0911]
ab为抗体,
[0912]
e
1
为与抗体中的亲核基团连接的亲电子基团,
[0913]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数为1~6的烷基。)、n(r
3
)(这里,r
3
表示氢原子或碳原子数为1~6的烷基。)、o、s或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
或r
5
分别独立地为氢原子或碳原子数为1~6的烷基。)。];或(b)下述式(i)所表示的基团:
[0914]
[化学式22]
[0915][0916]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基。
·
为结合键。),
[0917]
e
3
在e
2
为-x-y-的情况下是二价基团,而在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0918]
b
’
是包含通过功能性物质与生物正交性官能团之间的反应而生成的部分的二价基团,
[0919]
f为功能性物质。]。
[0920]
在优选的特定实施方式中,在本发明的制备方法中使用式(i-2)所表示的化合物作为式(i-1)所表示的化合物的情况下,在工序(1)中可制备上述式(ii-2)所表示的具有生物正交性官能团的抗体,然后,在工序(2)中可制备下述式(iii-2)所表示的具有功能性物质的抗体。
[0921]
ab-e
1-x-y-e
3-b
’-
f
ꢀꢀꢀꢀꢀꢀ
(iii-2)
[0922]
[式中,
[0923]
ab、x、y、b
’
和f与上述式(iii-1)中相应符号的含义相同,
[0924]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0925]
e
3
为二价基团。]。
[0926]
在另一优选的特定实施方式中,在本发明的制备方法中使用式(i-3)所表示的化合物作为式(i-1)所表示的化合物的情况下,在工序(1)中可制备上述式(ii-3)所表示的具有生物正交性官能团的抗体,然后,在工序(2)中可制备下述式(iii-3)所表示的具有功能性物质的抗体。
[0927]
[化学式23]
[0928][0929]
[式中,
[0930]
ab、环构成原子x
’
、环z、b
’
和f与式(iii-1)中相应符号的含义相同,
[0931]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0932]
e
3
为键或二价基团。]。
[0933]
优选的是,在本发明的制备方法中使用式(i-4)所表示的化合物作为式(i-3)所表示的化合物的情况下,在工序(1)中可制备下述式(ii-4)所表示的具有生物正交性官能团
的抗体,然后,在工序(2)中可制备下述式(iii-4)所表示的具有功能性物质的抗体。
[0934]
[化学式24]
[0935][0936]
[式中,
[0937]
ab、环z、b
’
和f与式(iii-1)中相应符号的含义相同,
[0938]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0939]
e
3
为键或二价基团。]。
[0940]
式(iii)、(iii-1)、(iii-2)、(iii-3)或(iii-4)中的任意符号(例如e、e
1
、e
2
、e
3
、b)和与该符号相关表示的术语(例如抗体、亲电子基团、生物正交性官能团)的详情(例如定义、例子和优选例)与上述式(i)或其下位概念的式中的相应含义共通。
[0941]
具有生物正交性官能团的抗体可经由生体正交性官能团与功能性物质进行反应。这样的反应可在如上所述的不会引发蛋白质的变性、分解(例如酰胺键的断裂)的条件(温和条件)下来适当进行。
[0942]
在反应体系中,功能性物质(z)与具有生物正交性官能团的抗体(y)的摩尔比(z/y)根据生物正交性官能团、功能性物质和抗体的种类、以及要修饰的抗体中的位点的数量(例如dar)等而变动,所以没有特别限定,例如为0.1~100,优选为0.5~80,更优选为1~70,更进一步优选为2~50,特别优选为3~30。
[0943]
具有功能性物质的抗体的生成的确认,虽然也依赖于其具体的原料和产物的分子量,但可通过例如电泳法、层析法(例如凝胶过滤层析法、离子交换层析法、反相柱层析法、hplc)或质谱分析来进行,优选通过质谱分析来进行。位置选择性的确认例如可通过肽谱来进行。关于肽谱,例如可通过蛋白酶(例如胰蛋白酶、胰凝乳蛋白酶)处理和质谱分析来进行。作为蛋白酶,优选内切蛋白酶。作为这样的内切蛋白酶,例如可列举:胰蛋白酶、胰凝乳蛋白酶、glu-c、lys-n、lys-c、asp-n。具有功能性物质的抗体所保有的功能性物质的个数的确认例如可通过电泳法、层析法或质谱分析来进行,优选通过质谱分析来进行。具有功能性物质的抗体可通过层析法(例如上述的层析法和亲和层析法)等任意的方法来适当纯化。
[0944]
4.位置选择性地具有生物正交性官能团或功能性物质的抗体或其盐
[0945]
本发明提供位置选择性地具有生物正交性官能团或功能性物质的抗体或其盐。
[0946]
位置选择性地具有生物正交性官能团的抗体或其盐是上述式(ii-1)所表示的位置选择性地具有生物正交性官能团的抗体。优选的是,作为上述式(ii-1)所表示的位置选择性地具有生物正交性官能团的抗体,提供上述式(ii-2)或(ii-3)所表示的位置选择性地具有生物正交性官能团的抗体。更优选的是,作为上述式(ii-3)所表示的位置选择性地具有生物正交性官能团的抗体,提供上述式(ii-4)所表示的位置选择性地具有生物正交性官能团的抗体。式(ii)、(ii-1)、(ii-2)、(ii-3)或(ii-4)中的任意符号(例如e、e
1
、e
2
、e
3
、b)和与该符号相关表示的术语(例如抗体、亲电子基团、生物正交性官能团)的详情(例如定义、例子和优选例)与上述式(i)或其下位概念的式中的相应含义共通。
[0947]
位置选择性地具有功能性物质的抗体或其盐是上述式(iii-1)所表示的位置选择性地具有功能性物质的抗体。优选的是,作为上述式(iii-1)所表示的位置选择性地具有功能性物质的抗体,提供上述式(iii-2)或(iii-3)所表示的位置选择性地具有功能性物质的抗体。更优选的是,作为上述式(iii-3)所表示的位置选择性地具有功能性物质的抗体,提供上述式(iii-4)所表示的位置选择性地具有功能性物质的抗体。式(iii)、(iii-1)、(iii-2)、(iii-3)或(iii-4)中的任意符号(例如e、e
1
、e
2
、e
3
、b)和与该符号相关表示的术语(例如抗体、亲电子基团、生物正交性官能团)的详情(例如定义、例子和优选例)与上述式(i)或其下位概念的式中的相应含义共通。
[0948]
位置选择性地具有生物正交性官能团或功能性物质的抗体与上述的抗体相同。优选的是,这样的抗体为单克隆抗体。作为单克隆抗体的同种型,例如可列举:igg(例如igg1、igg2、igg3、igg4)、igm、iga、igd、ige和igy。单克隆抗体为全长抗体或抗体片段(例如f(ab
’
)
2
、fab
’
、fab、fv、单链抗体),但优选全长抗体。特别优选的是,这样的抗体是在恒定区具有人igg(例如igg1、igg2、igg3、igg4)的人抗体、人源化抗体或嵌合抗体。
[0949]
位置选择性地具有生物正交性官能团或功能性物质的抗体,优选为仅在抗体的恒定区具有生物正交性官能团或功能性物质的抗体,更优选为仅在抗体的fc区具有生物正交性官能团或功能性物质的抗体。
[0950]
位置选择性地具有生物正交性官能团或功能性物质的抗体在由连续的1~50个氨基酸残基构成的靶区[例如(a)由人igg fc区中的246~248位的氨基酸残基构成的区域、(b)由人igg fc区中的288~290位的氨基酸残基构成的区域、或(c)由人igg fc区中的317位的氨基酸残基构成的区域]中包含1个以上的特定氨基酸残基(例如赖氨酸残基、酪氨酸残基、苏氨酸残基、丝氨酸残基、半胱氨酸残基)、并且在除上述靶区以外的非靶区中包含5个以上的上述特定氨基酸残基的情况下,在该靶区中所含的1个以上的特定氨基酸残基中可以以30%以上的位置选择性具有生物正交性官能团或功能性物质。位置选择性可优选为40%以上,更优选为50%以上,更进一步优选为60%以上,特别优选为70%以上、80%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上或100%。
[0951]
另外,位置选择性地具有生物正交性官能团或功能性物质的抗体可根据重链的数量具有生物正交性官能团(即,用e-b表示的结构单元)或功能性物质(即,用e-b
’-
f表示的结构单元)。在位置选择性地具有生物正交性官能团或功能性物质的抗体具有多个(例如1~8个、优选1~4个、更优选2个)抗体重链的情况下,在多个抗体重链的相同靶区中可位置选择性地具有生物正交性官能团或功能性物质。即,在位置选择性地具有生物正交性官能团或功能性物质的抗体中,可使基于生物正交性官能团或功能性物质的修饰方式在多个(例如2个)重链间相同。
[0952]
另外,位置选择性地具有生物正交性官能团或功能性物质的抗体可在1个抗体重链的多个(例如2~5个、优选2~4个、更优选2或3个)靶区中具有同种或异种的生物正交性官能团(例如用e-b表示的结构单元)或同种或异种的功能性物质(例如用e-b
’-
f表示的结构单元)。这种情况下,在位置选择性地具有生物正交性官能团或功能性物质的抗体中,可使基于生物正交性官能团或功能性物质的修饰方式在多个(例如2个)重链间相同。
[0953]
5.具有针对抗体的亲和性物质和功能性物质的化合物或其盐
[0954]
本发明提供式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物
或其盐。
[0955]
a-l-e-f
ꢀꢀꢀꢀꢀ
(iv)
[0956]
[式中,
[0957]
a为针对抗体的亲和性物质,
[0958]
l为包含离去基团的二价基团,
[0959]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[0960]
f为功能性物质,
[0961]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[0962]
具有针对抗体的亲和性物质和功能性物质的化合物或其盐中的针对抗体的亲和性物质(a)、包含离去基团的二价基团(l)、包含亲电子基团的二价基团(e)和功能性物质(f)的定义、例子和优选例与上述的相应含义相同。因此,在具有针对抗体的亲和性物质和功能性物质的化合物或其盐中,a、l和e可与具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐(例如参照式(i))中的a、l和e同样地进行特定。另外,在具有针对抗体的亲和性物质和功能性物质的化合物或其盐中,f可与具有功能性物质的抗体或其盐(例如参照式(iii))中的f同样地进行特定。
[0963]
在优选实施方式中,式(iv)所表示的化合物可以是下述式(iv-1)所表示的化合物:
[0964]
a-l
1-l
2-e
1-e
2-e
3-f
ꢀꢀꢀꢀꢀ
(iv-1)
[0965]
[式中,
[0966]
a和f与式(iv)中相应符号的含义相同,
[0967]
l
1
为键或二价基团,
[0968]
l
2
为离去基团,
[0969]
e
1
为(i)与离去基团连接、并且(ii)具有与抗体中的亲核基团进行反应的能力的亲电子基团,
[0970]
e
2
为(a)-x-y-[这里,与e
1
结合的x为c(r
1
)(r
2
)(这里,r
1
和r
2
分别独立地为氢原子或碳原子数为1~6的烷基。)、n(r
3
)(这里,r
3
表示氢原子或碳原子数为1~6的烷基。)、o、s或se,与e
3
结合的y为c(r
4
)(r
5
)(这里,r
4
或r
5
分别独立地为氢原子或碳原子数为1~6的烷基。)。];或(b)下述式(i)所表示的基团:
[0971]
[化学式25]
[0972][0973]
(这里,环z是与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子
的二价杂环基。
·
为结合键。),
[0974]
e
3
在e
2
为-x-y-的情况下是二价基团,在e
2
为式(i)所表示的基团的情况下是键或二价基团,
[0975]
离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e
1
上切割并脱离的能力。]。
[0976]
式(iv-1)中,l
2
所表示的离去基团的定义、例子和优选例与上述“1-3.包含离去基团的二价基团(l)”中的关于(a)~(c)而记述的含义相同。
[0977]
在优选的特定实施方式中,式(iv-1)所表示的化合物可以是下述式(iv-2)所表示的化合物:
[0978]
a-l
1-l
2-e
1-x-y-e
3-f
ꢀꢀꢀꢀꢀꢀ
(iv-2)
[0979]
[式中,
[0980]
a、l
1
、x、y和f与式(iv-1)中相应符号的含义相同,
[0981]
l
2
为:
[0982]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0983]
(b)杂亚芳基;或者
[0984]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[0985]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0986]
e
3
为二价基团。]。
[0987]
在优选的另一特定实施方式中,式(iv-1)所表示的化合物可以是下述式(iv-3)所表示的化合物:
[0988]
[化学式26]
[0989][0990]
[式中,
[0991]
a、l
1
、环z、环构成原子x
’
和f与上述式(iv-1)中相应符号的含义相同,
[0992]
l
2
为:
[0993]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[0994]
(b)杂亚芳基;或者
[0995]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[0996]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[0997]
e
3
为键或二价基团。]。
[0998]
优选的是,式(iv-3)所表示的化合物可以是下述式(iv-4)所表示的化合物:
[0999]
[化学式27]
[1000][1001]
[式中,
[1002]
a、l
1
和f与上述式(iv-1)中相应符号的含义相同,
[1003]
l
2
为:
[1004]
(a)环p-q-[这里,环p为选自可被吸电子基团取代的亚芳基、可被吸电子基团取代的杂亚芳基、可缩环的2,5-二酮吡咯烷、可缩环的2,6-二酮哌啶、可缩环的2-酮吡咯烷、可缩环的2-酮哌啶、2-吡啶酮的基团,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。];
[1005]
(b)杂亚芳基;或者
[1006]
(c)-q-[这里,q为选自-o-、-s-、-se-、-so
2-o-、-so
2-n(r)-、-so
2-、-c≡c-ch
2-o-、-n(or)-、-n(r)-、和-o-n(r)-的基团(这里,r为氢原子或碳原子数为1~6的烷基。)。],
[1007]
e
1
为选自-c(=o)-、-so
2-、和-ch
2-的基团,
[1008]
环z是与e
1
结合的环构成原子及其两邻的环构成原子均为碳原子的二价环基,
[1009]
e
3
为键或二价基团。]。
[1010]
在上述式(iv-1)~(iv-4)所表示的化合物中,a、l
1
、l
2
、e
1
、e
2
、e
3
和f、以及-x-y-、r
1
~r
5
中的碳原子数为1~6的烷基、式(i)所表示的基团(例如二价环基、二价杂环基)的定义、例子和优选例与上述的相应含义相同。另外,作为l
2
的(a)~(c)、以及环z(例如,与e
1
结合的环构成原子x
’
及其两邻的环构成原子均为碳原子的二价环基,或者是与e
1
结合的环构成原子x
’
为氮原子、且氮原子的两邻的环构成原子为碳原子的二价杂环基)、环p和q(例如,r中的碳原子数为1~6的烷基)等基团的定义、例子和优选例也和上述的相应含义相同。
[1011]
具有针对抗体的亲和性物质和功能性物质的化合物或其盐可通过使具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐经由生物正交性官能团与如上所述的功能性物质进行反应而适当调制。这样的反应可在适当的反应体系、例如有机溶剂体系或水溶液体系中、于适当温度(例如约15~200℃)下来进行。反应体系可包含适当的催化剂。反应时间例如为1分钟~20小时,优选为10分钟~15小时,更优选为20分钟~10小时,更进一步优选为30分钟~8小时。
[1012]
在反应体系中,具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐
(y)与功能性物质(x)的摩尔比(y/x),根据该结构单元和亲和性物质的种类、要通过该结构单元进行修饰的亲和性物质中的位点的数量等而变动,因此没有特别限定,例如为0.01~100,优选为0.05~20,更优选为0.1~10。
[1013]
具有针对抗体的亲和性物质和功能性物质的化合物或其盐的生成的确认,虽然也依赖于其具体的原料和产物的分子量,但可通过例如电泳法、层析法(例如凝胶过滤层析法、离子交换层析法、反相柱层析法、hplc)或质谱分析来进行,优选通过质谱分析来进行。具有针对抗体的亲和性物质和功能性物质的化合物或其盐可通过层析法(例如上述的层析法和亲和层析法)等任意的方法来适当纯化。
[1014]
6.使用具有针对抗体的亲和性物质和功能性物质的化合物或其盐的、具有功能性物质的抗体的制备方法
[1015]
本发明提供具有功能性物质的抗体或其盐的制备方法,所述制备方法包括以下工序。
[1016]
使下述式(iv)所表示的具有针对抗体的亲和性物质和功能性物质的化合物或其盐与抗体反应,生成下述式(v)所表示的具有功能性物质的抗体或其盐:
[1017]
a-l-e-f
ꢀꢀꢀꢀꢀ
(iv)
[1018]
[式中,
[1019]
a为针对抗体的亲和性物质,
[1020]
l为包含离去基团的二价基团,
[1021]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[1022]
f为功能性物质,
[1023]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。];
[1024]
ab-e-f
ꢀꢀꢀꢀꢀ
(v)
[1025]
[式中,
[1026]
ab为抗体,
[1027]
e和f与上述式(iv)中相应符号的含义相同。]。
[1028]
优选的是,通过本发明的制备方法制备的具有功能性物质的抗体是位置选择性地具有功能性物质的抗体。这种情况下,可制备式(v)所表示的位置选择性地具有功能性物质的抗体。位置选择性地具有功能性物质的抗体优选为仅在恒定区具有功能性物质的抗体,更优选为仅在fc区具有功能性物质的抗体。
[1029]
抗体(ab)在由连续的1~50个氨基酸残基构成的靶区[例如由人igg fc区中的246~248位的氨基酸残基构成的区域、(b)由人igg fc区中的288~290位的氨基酸残基构成的区域、或(c)由人iggfc区中的317位的氨基酸残基构成的区域]中包含1个以上的特定氨基酸残基(例如赖氨酸残基、酪氨酸残基、苏氨酸残基、丝氨酸残基、半胱氨酸残基)、并且在除上述靶区以外的非靶区中包含5个以上的上述特定氨基酸残基的情况下,除抗体以外的部分结构可以以30%以上的位置选择性与该靶区中所含的1个以上的特定氨基酸残基结合。位置选择性可优选为40%以上,更优选为50%以上,更进一步优选为60%以上,特别优选为70%以上、80%以上、90%以上、95%以上、96%以上、97%以上、98%以上、99%以上或
100%。
[1030]
另外,通过本发明的制备方法制备的具有功能性物质的抗体可根据重链的数量具有功能性物质(即,用e-f表示的结构单元)。因此,通过在本发明的制备方法中使用具有多个(例如1~8个、优选1~4个、更优选2个)抗体重链的抗体,可制备在多个抗体重链的相同靶区中位置选择性地具有用e-f表示的多个结构单元(或其下位概念的多个结构单元)的抗体。例如,通过在本发明的制备方法中使用具有2个抗体重链的抗体(例如igg、igd、ige、f(ab
’
)
2
抗体、fc区蛋白、fc融合蛋白),可制备在2个抗体重链的相同靶区中位置选择性地具有2个用e-f表示的结构单元的抗体。即,在具有功能性物质的抗体中,可使基于功能性物质的修饰方式在多个(例如2个)重链间相同。
[1031]
另外,具有功能性物质的抗体可在1个抗体重链的多个(例如2~5个、优选2~4个、更优选2或3个)靶区中具有同种或异种的功能性物质(例如用e-f表示的结构单元)。这种情况下,具有功能性物质的抗体可使基于功能性物质的修饰方式在多个(例如2个)重链间相同。
[1032]
本发明的制备方法还可包括:通过对所生成的抗体赋予特定的处理,生成具有功能性物质、并且进一步被修饰的抗体。作为这样的特定处理,例如可列举:抗体的片段化处理(例如利用木瓜蛋白酶、胃蛋白酶等特定蛋白酶的处理)。
[1033]
在本发明的制备方法中使用式(iv)所表示的化合物或其盐的情况下,可制备上述式(v)所表示的具有功能性物质的抗体。
[1034]
在优选实施方式中,在本发明的制备方法中使用式(iv-1)所表示的化合物作为式(iv)所表示的化合物的情况下,可制备下述式(v-1)所表示的具有功能性物质的抗体。
[1035]
ab-e
1-e
2-e
3-f
ꢀꢀꢀꢀꢀꢀ
(v-1)
[1036]
[式中,
[1037]
ab为抗体,
[1038]
e
1
、e
2
、e
3
和f与上述式(iv-1)中相应符号的含义相同。]。
[1039]
在优选的特定实施方式中,在本发明的制备方法中使用式(iv-2)所表示的化合物作为式(iv-1)所表示的化合物的情况下,可制备下述式(v-2)所表示的具有功能性物质的抗体。
[1040]
ab-e
1-x-y-e
3-f
ꢀꢀꢀꢀꢀꢀ
(v-2)
[1041]
[式中,
[1042]
ab为抗体,
[1043]
e
1
、x、y、e
3
和f与上述式(iv-2)中相应符号的含义相同。]。
[1044]
在优选的另一特定实施方式中,在本发明的制备方法中使用式(iv-3)所表示的化合物作为式(iv-1)所表示的化合物的情况下,可制备下述式(v-3)所表示的具有功能性物质的抗体。
[1045]
[化学式28]
[1046][1047]
[式中,
[1048]
ab为抗体,
[1049]
e
1
、环z、环构成原子x
’
、e
3
和f与上述式(iv-3)中相应符号的含义相同。]。
[1050]
优选的是,在本发明的制备方法中使用式(iv-4)所表示的化合物作为式(iv-3)所表示的化合物的情况下,可制备下述式(v-4)所表示的具有功能性物质的抗体。
[1051]
[化学式29]
[1052][1053]
[式中,
[1054]
ab为抗体,
[1055]
e
1
、环z、e
3
和f与上述式(iv-4)中相应符号的含义相同。]。
[1056]
具有针对抗体的亲和性物质和功能性物质的化合物或其盐因具有e中的亲电子基团或e
1
的亲电子基团,故可与抗体进行反应。这样的反应可在不会引发蛋白质的变性、分解(例如酰胺键的断裂)的条件(温和条件)下来适当进行。例如,这样的反应可在适当的反应体系、例如在缓冲液中、在室温(例如约15~30℃)下来进行。缓冲液的ph例如为5~9,优选为5.5~8.5,更优选为6.0~8.0。缓冲液可包含适当的催化剂。反应时间例如为1分钟~20小时,优选为10分钟~15小时,更优选为20分钟~10小时,更进一步优选为30分钟~8小时。关于这样的反应的详情,例如参照g.j.l.bernardes等人,chem.rev.,115,2174(2015);g.j.l.bernardes等人,chem.asian.j.,4,630(2009);b.g.davies等人,nat.commun.,5,4740(2014);a.wagner等人,bioconjugate.chem.,25,825(2014)。
[1057]
在反应体系中,具有针对抗体的亲和性物质和功能性物质的化合物或其盐(y)与抗体(x)的摩尔比(y/x),根据具有针对抗体的亲和性物质和功能性物质的化合物或其盐和抗体的种类、要通过具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐进行修饰的抗体中的位点的数量(例如dar)等而变动,因此没有特别限定,例如为0.1~100,优选为0.5~80,更优选为1~70,更进一步优选为2~50,特别优选为3~30。
[1058]
具有功能性物质的抗体的生成的确认,虽然也依赖于其具体的原料和产物的分子量,但可通过例如电泳法、层析法(例如凝胶过滤层析法、离子交换层析法、反相柱层析法、hplc)或质谱分析来进行,优选通过质谱分析来进行。位置选择性的确认例如可通过肽谱来进行。关于肽谱,例如可通过蛋白酶(例如胰蛋白酶、胰凝乳蛋白酶)处理和质谱分析来进行。作为蛋白酶,优选内切蛋白酶。作为这样的内切蛋白酶,例如可列举:胰蛋白酶、胰凝乳
蛋白酶、glu-c、lys-n、lys-c、asp-n。具有功能性物质的抗体所保有的功能性物质的个数的确认例如可通过电泳法、层析法或质谱分析来进行,优选通过质谱分析来进行。具有功能性物质的抗体可通过层析法(例如上述的层析法和亲和层析法)等任意的方法来适当纯化。
[1059]
7.盐
[1060]
在本发明中,作为盐,例如可列举:与无机酸的盐、与有机酸的盐、与无机碱的盐、与有机碱的盐、以及与氨基酸的盐。作为与无机酸的盐,例如可列举:与氯化氢、溴化氢、磷酸、硫酸、硝酸的盐。作为与有机酸的盐,例如可列举:与甲酸、乙酸、三氟乙酸、乳酸、酒石酸、富马酸、乙二酸、马来酸、柠檬酸、琥珀酸、苹果酸、苯磺酸、对甲苯磺酸的盐。作为与无机碱的盐,例如可列举:与碱金属(例如钠、钾)、碱土金属(例如钙、镁)和锌、铝等其他金属以及铵的盐。作为与有机碱的盐,例如可列举:与三甲胺、三乙胺、丙二胺、乙二胺、吡啶、乙醇胺、单烷基乙醇胺、二烷基乙醇胺、二乙醇胺、三乙醇胺的盐。作为与氨基酸的盐,例如可列举:与碱性氨基酸(例如精氨酸、组氨酸、赖氨酸、鸟氨酸)和酸性氨基酸(例如天冬氨酸、谷氨酸)的盐。盐优选为与无机酸(例如盐酸)的盐或者与有机酸(例如三氟乙酸)的盐。
[1061]
8.用途
[1062]
具有针对抗体的亲和性物质和生物正交性官能团的本发明的化合物或其盐例如可用于基于生物正交性官能团的抗体的位置选择性修饰。因此,本发明提供基于生物正交性官能团的抗体的位置选择性修饰试剂,其包含具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐。在基于生物正交性官能团的抗体的位置选择性修饰试剂中,具有针对抗体的亲和性物质和生物正交性官能团的化合物或其盐的详情(例如定义、例子和优选例)与上述的相应含义相同。
[1063]
具有针对抗体的亲和性物质和功能性物质的本发明的化合物或其盐例如可用于基于功能性物质的抗体的位置选择性修饰。因此,本发明提供基于功能性物质的抗体的位置选择性修饰试剂,其包含具有针对抗体的亲和性物质和功能性物质的化合物或其盐。在基于功能性物质的抗体的位置选择性修饰试剂中,具有针对抗体的亲和性物质和功能性物质的化合物或其盐的详情(例如定义、例子和优选例)与上述的相应含义相同。
[1064]
在本发明的位置选择性修饰试剂中,被修饰的抗体的位置选择性修饰的详情(例如定义、例子和优选例)与上述的相应含义相同。
[1065]
本发明的位置选择性修饰试剂可以以进一步包含其他成分的组合物的形态提供。作为这样的其他成分,例如可列举:溶液、稳定剂(例如抗氧化剂、防腐剂)。作为溶液,优选水溶液。作为水溶液,例如可列举:水(例如蒸馏水、灭菌蒸馏水、纯净水、生理盐水)、缓冲液(例如磷酸水溶液、tris-盐酸缓冲液、碳酸盐-碳酸氢盐缓冲液、硼酸水溶液、甘氨酸-氢氧化钠缓冲液、柠檬酸缓冲液),但优选缓冲液。溶液的ph例如为5.0~9.0,优选为5.5~8.5。本发明的位置选择性修饰试剂可以以液态或粉末状(例如冻干粉末)提供。
[1066]
位置选择性地具有生物正交性官能团的抗体或其盐例如可用作位置选择性地具有功能性物质的抗体或其盐的制备中的中间体。
[1067]
位置选择性地具有功能性物质的抗体或其盐例如可用作药物或试剂(例如诊断药、研究用试剂),特别是可用作药物。有报道称,如果改变抗体药物复合物(adc)的药物的结合数和结合位置,则体内动力学或药物的释放速度、效果会发生变化。基于这些情况,对于下一代的adc,要求控制偶联药物的个数和位置。一般认为如果个数和位置恒定,则符合
期待的功效、偶联药剂的多样性、批次差异即标准化(regulation)的问题得到解决。位置选择性地具有功能性物质的本发明的抗体或其盐可解决这样的标准化的问题。因此,位置选择性地具有功能性物质的本发明的抗体或其盐可以以药物组合物的形态提供。这样的药物组合物除了包含位置选择性地具有功能性物质的抗体或其盐以外,还可包含药学上可接受的载体。作为药学上可接受的载体,例如可列举:蔗糖、淀粉、甘露糖醇、山梨糖醇、乳糖、葡萄糖、纤维素、滑石、磷酸钙、碳酸钙等赋形剂;纤维素、甲基纤维素、羟丙基纤维素、聚丙基吡咯烷酮、明胶、阿拉伯胶、聚乙二醇、蔗糖、淀粉等粘合剂;淀粉、羧甲基纤维素、羟丙基淀粉、碳酸氢钠、磷酸钙、柠檬酸钙等崩解剂;硬脂酸镁、二氧化硅气凝胶(aerosil)、滑石、十二烷基硫酸钠等润滑剂;柠檬酸、薄荷醇、双甘氨肽铵盐、甘氨酸、橙粉等芳香剂;苯甲酸钠、亚硫酸氢钠、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯等防腐剂;柠檬酸、柠檬酸钠、乙酸等稳定剂;甲基纤维素、聚乙烯基吡咯烷酮、硬脂酸铝等悬浮剂;表面活性剂等分散剂;水、生理盐水、橙汁等稀释剂;可可脂、聚乙二醇、白煤油等基质蜡(base wax)等,但并不限于这些例子。位置选择性地具有功能性物质的本发明的抗体或其盐还可具有实现稳定性的任意的修饰(例如peg化)。
[1068]
适合于口服给药的制剂为:使有效量的配体溶解于水、生理盐水、橙汁等稀释液而得到的液体制剂,以固体或颗粒的形式包含有效量的配体的胶囊剂、小药囊(sachet)或片剂,使有效量的有效成分悬浮于适当的分散介质中的悬浮液剂,使溶解了有效量的有效成分的溶液分散于适当的分散介质并乳化的乳剂等。
[1069]
药物组合物适合于非口服给药(胃肠外给药)(例如静脉注射、皮下注射、肌肉注射、局部注入、腹腔内给药)。作为这样的适合于非口服给药的药物组合物,有水性和非水性的等渗无菌注射液剂,其中可含抗氧化剂、缓冲液、抗菌剂、等渗剂等。还可列举水性和非水性的无菌悬浮液剂,其中可含悬浮剂、助溶剂、增稠剂、稳定剂、防腐剂等。
[1070]
药物组合物的给药量根据有效成分的种类/活性、疾病的严重程度、作为给药对象的动物种类、给药对象的药物耐受性、体重、年龄等而不同,可适当设定。
[1071]
实施例
[1072]
接下来,示出实施例以进一步详细地说明本发明,但本发明并不限定于以下的实施例。
[1073]
[实施例1:igg1 fc亲和性物质的合成]
[1074]
(1-1)针对抗体的亲和性肽的合成
[1075]
作为针对抗体的亲和性物质的下述所示的肽按照完全同样的方法进行调制。通过基于fmoc法的使用了rink酰胺树脂的肽固相合成来调制n末端用乙酰基封端的肽(化合物1、2、32~53)、n末端用3-(三苯基甲硫基)丙酸封端的肽(化合物3、31、54),在三氟乙酸:水:三异丙基硅烷:乙二硫醇=94:2.5:1.0:2.5的溶液中搅拌3小时,从而自树脂上切割并进行脱保护。通过过滤除去树脂,加入二乙醚进行沉淀,通过倾析除去二乙醚,以粗结晶的形式得到了肽。将其通过制备hplc进行纯化,得到了作为产物的亲和性肽。
[1076]
关于作为分子内具有s-s键的肽(含有蛋氨酸的肽除外)的化合物35~53,通过上述所示的方法获取作为前体的直链肽,之后通过以下所示的方法进行合成。将数十mg所得的前体溶解于1ml dmso中,加入100μl nh
3
/meoh、10μl h
2
o
2
,搅拌一夜。通过lcms确认反应结束,之后通过制备hplc进行纯化,得到了作为目标物的亲和性肽。
[1077]
关于作为分子内具有s-s键的肽(含有蛋氨酸的肽)的化合物33、34,通过上述所示的方法获取作为前体的直链肽,之后利用以下所示的方法进行合成。将数十mg所得的前体溶解于20ml 0.1m的tris-hcl缓冲液(ph8.00)中,加入5.0eq谷胱甘肽氧化型,搅拌一夜。通过lcms确认反应结束,之后通过制备hplc进行纯化,得到了作为目标物的亲和性肽。
[1078]
[化学式30]
[1079][1080]
(肽部分的氨基酸序列seq id no:5)
[1081]
ms(esi)m/z:z=3 1392[m+3h]
3+
,z=4 1044[m+4h]
4+
[1082]
[化学式31]
[1083][1084]
(肽部分的氨基酸序列seq id no:6)
[1085]
ms(esi)m/z:z=3 1392[m+3h]
3+
,z=4 1044[m+4h]
4+
[1086]
[化学式32]
[1087][1088]
(肽部分的氨基酸序列seq id no:7)
[1089]
ms(esi)m/z:z=3 1478[m+3h]
3+
,z=4 1108[m+4h]
4+
[1090]
[化学式33]
[1091][1092]
(肽部分的氨基酸序列seq id no:97)
[1093]
ms(esi)m/z:z=2 1892[m+2h]
2+
,z=3 1262[m+3h]
3+
,z=4 946[m+4h]
4+
,z=5 757[m+5h]
5+
[1094]
[化学式34]
[1095][1096]
(肽部分的氨基酸序列seq id no:98)
[1097]
ms(esi)m/z:z=3 1401[m+3h]
3+
,z=4 1051[m+4h]
4+
,z=5 841[m+5h]
5+
[1098]
[化学式35]
[1099][1100]
(肽部分的氨基酸序列seq id no:41)
[1101]
ms(esi)m/z:z=3 1426[m+3h]
3+
,z=4 1070[m+4h]
4+
,z=5 859[m+5h]
5+
[1102]
[化学式36]
[1103][1104]
(肽部分的氨基酸序列seq id no:42)
[1105]
ms(esi)m/z:z=3 1417[m+3h]
3+
,z=4 1063[m+4h]
4+
,z=5 851[m+5h]
5+
[1106]
[化学式37]
[1107][1108]
(肽部分的氨基酸序列seq id no:43)
[1109]
ms(esi)m/z:z=3 1425[m+3h]
3+
,z=4 1069[m+4h]
4+
,z=5 855[m+5h]
5+
[1110]
[化学式38]
[1111][1112]
(肽部分的氨基酸序列seq id no:46)
[1113]
ms(esi)m/z:z=1 2090[m+1h]
+
,z=2 1045[m+2h]
2+
,z=3 697[m+3h]
3+
[1114]
[化学式39]
[1115][1116]
(肽部分的氨基酸序列seq id no:47)
[1117]
ms(esi)m/z:z=1 2074[m+1h]
+
,z=2 1037[m+2h]
2+
,z=3 692[m+3h]
3+
[1118]
[化学式40]
[1119][1120]
(肽部分的氨基酸序列seq id no:48)
[1121]
ms(esi)m/z:z=1 2061[m+1h]
+
,z=2 1031[m+2h]
2+
,z=3 687[m+3h]
3+
[1122]
[化学式41]
[1123][1124]
(肽部分的氨基酸序列seq id no:49)
[1125]
ms(esi)m/z:z=1 2032[m+1h]
+
,z=2 1016[m+2h]
2+
,z=3 678[m+3h]
3+
[1126]
[化学式42]
[1127][1128]
(肽部分的氨基酸序列seq id no:50)
[1129]
ms(esi)m/z:z=1 2089[m+1h]
+
,z=2 1044[m+2h]
2+
,z=3 696[m+3h]
3+
[1130]
[化学式43]
[1131][1132]
(肽部分的氨基酸序列seq id no:51)
[1133]
ms(esi)m/z:z=1 2088[m+1h]
+
,z=2 1044[m+2h]
2+
,z=3 696[m+3h]
3+
[1134]
[化学式44]
[1135][1136]
(肽部分的氨基酸序列seq id no:52)
[1137]
ms(esi)m/z:z=1 1561[m+h]
+
,z=2 781[m+2h]
2+
[1138]
[化学式45]
[1139][1140]
(肽部分的氨基酸序列seq id no:53)
[1141]
ms(esi)m/z:z=1 1548[m+1h]
+
,z=2 774[m+2h]
2+
[1142]
[化学式46]
[1143][1144]
(肽部分的氨基酸序列seq id no:55)
[1145]
ms(esi)m/z:z=2 1059[m+2h]
2+
,z=3 706[m+3h]
3+
[1146]
[化学式47]
[1147][1148]
(肽部分的氨基酸序列seq id no:57)
[1149]
ms(esi)m/z:z=2 1074[m+2h]
2+
,z=3 716[m+3h]
3+
[1150]
[化学式48]
[1151][1152]
(肽部分的氨基酸序列seq id no:59)
[1153]
ms(esi)m/z:z=2 1081[m+2h]
2+
,z=3 721[m+3h]
3+
,z=4 541[m+4h]
4+
[1154]
[化学式49]
[1155][1156]
(肽部分的氨基酸序列seq id no:63)
[1157]
ms(esi)m/z:z=2 1085[m+2h]
2+
,z=3 723[m+3h]
3+
,z=4 543[m+4h]
4+
[1158]
[化学式50]
[1159][1160]
(肽部分的氨基酸序列seq id no:71)
[1161]
ms(esi)m/z:z=2 1045[m+2h]
2+
,z=3 697[m+3h]
3+
[1162]
[化学式51]
[1163]
[1164]
(肽部分的氨基酸序列seq id no:72)
[1165]
ms(esi)m/z:z=1 1345[m+1h]
+
,z=2 673[m+2h]
2+
[1166]
[化学式52]
[1167][1168]
(肽部分的氨基酸序列seq id no:77)
[1169]
ms(esi)m/z:z=2 1052[m+2h]
2+
,z=3 702[m+3h]
3+
[1170]
[化学式53]
[1171][1172]
(肽部分的氨基酸序列seq id no:81)
[1173]
ms(esi)m/z:z=2 1073[m+2h]
2+
,z=3 715[m+3h]
3+
[1174]
[化学式54]
[1175][1176]
(肽部分的氨基酸序列seq id no:82)
[1177]
ms(esi)m/z:z=2 1073[m+2h]
2+
,z=3 716[m+3h]
3+
[1178]
[化学式55]
[1179][1180]
(肽部分的氨基酸序列seq id no:99)
[1181]
ms(esi)m/z:z=2 966[m+2h]
2+
,z=3 644[m+3h]
3+
[1182]
[化学式56]
[1183][1184]
(肽部分的氨基酸序列seq id no:100)
[1185]
ms(esi)m/z:z=3 1381[m+3h]
3+
,z=4 1036[m+4h]
4+
,z=5 829[m+5h]
5+
[1186]
(1-2)针对抗体的亲和性肽叠氮加成物的合成
[1187]
下述所示的肽-叠氮加成物(化合物4、5)如下进行合成。之后使用仅官能团化的残基lys用mtt基保护的氨基酸,通过基于fmoc法的使用了rink酰胺树脂的肽固相合成来调制n末端用乙酰基封端的肽。在二氯甲烷:三氟乙酸:三异丙基硅烷=90:5:5的溶液中搅拌1小时,仅将mtt基脱保护。用dmf洗涤树脂,之后溶解于50摩尔当量的三乙胺、10摩尔当量的叠氮乙酸nhs酯、4ml dmf中进行添加,搅拌16小时。除去溶液后,在三氟乙酸:水:三异丙基硅烷=95:2.5:2.5的溶液中搅拌1小时,从而由树脂切割和进行脱保护。通过过滤除去树脂,加入二乙醚进行沉淀,通过倾析除去二乙醚,以粗结晶的形式得到了肽。将其通过制备hplc进行纯化,得到了作为产物的亲和性肽叠氮加成物。
[1188]
[化学式57]
[1189][1190]
(肽部分的氨基酸序列seq id no:8)
[1191]
ms(esi)m/z:z=3 1401[m+3h]
3+
,z=4 1051[m+4h]
4+
[1192]
[化学式58]
[1193][1194]
(肽部分的氨基酸序列seq id no:6)
[1195]
ms(esi)m/z:z=3 1420[m+3h]
3+
,z=4 1065[m+4h]
4+
[1196]
[实施例2:抗体修饰接头的合成和与igg1 fc亲和性肽叠氮加成物的连接]
[1197]
(2-1)咪唑基羰基化合物的合成
[1198]
(2-1-1)咪唑基羰基化合物(化合物6)的合成
[1199]
[化学式59]
[1200][1201]
将0.100g(1.32mmol)3-丁炔-1-醇和263mg(1.62mmol)羰基二咪唑溶解于thf溶剂,在室温下搅拌1小时。将反应液用乙酸乙酯稀释,用水、食盐水洗涤后加入硫酸钠,静置5分钟。通过过滤除去硫酸钠,在减压下浓缩,从而得到粗产物,之后通过硅胶柱层析进行纯化。回收含产物的级分,减压下浓缩,从而得到了0.180g(1.10mmol)相当于化合物6的1h-咪唑-1-甲酸-3-丁炔酯。
[1202]
1
h nmr(400mhz,氯仿-d)δ2.08(t,j=2.7hz,1h),2.73(td,j=6.6,2.7hz,2h),4.54(t,j=6.6hz,2h),7.11(s,1h),7.43(s,1h),8.18(s,1h).ms(esi)m/z:165[m+na]
+
[1203]
(2-1-2)咪唑基羰基化合物(化合物7)的合成
[1204]
[化学式60]
[1205][1206]
将0.100g(0.745mmol)9-癸炔-1-醇和148mg(0.916mmol)羰基二咪唑溶解于thf溶剂,室温下搅拌1小时。将反应液用乙酸乙酯稀释,用水、食盐水洗涤后加入硫酸钠,静置5分钟。通过过滤除去硫酸钠,在减压下浓缩,从而得到粗产物,之后通过硅胶柱层析进行纯化。回收含产物的级分,通过在减压下浓缩,得到了0.152g(0.612mmol)相当于化合物7的1h-咪唑-1-甲酸-9-丁炔酯。
[1207]
1
h nmr(400mhz,氯仿-d)δ1.33-1.50(m,10h),1.82(m,2h),1.96(t,j=2.6hz,1h)2.21(td,j=6.8,2.6hz,2h),4.43(t,j=6.8hz,2h)7.10(s,1h),7.45(brs,1h),8.16(s,1h).
[1208]
ms(esi)m/z:271[m+na]
+
[1209]
(2-1-3)咪唑基羰基化合物(化合物9)的合成
[1210]
[化学式61]
[1211][1212]
将113mg(0.546mmol)n,n
’-
二环己基碳化二亚胺、78.1mg(0.546mmol)1-羟基苯并
三唑一水合物、53.6mg(0.546mmol)4-戊炔酸溶解于二氯甲烷溶剂,在室温下搅拌1小时后加入0.100g(0.497mmol)12-氨基-十二烷醇,室温下搅拌4小时。将反应液用乙酸乙酯稀释,用水、食盐水洗涤后加入硫酸钠,静置5分钟。通过过滤除去硫酸钠,在减压下浓缩,从而得到了0.102g(0.363mmol)相当于化合物8的12-(戊-4-炔-1-氧代)氨基十二烷-1-醇。
[1213]
ms(esi)m/z:281[m+h]
+
[1214]
[化学式62]
[1215][1216]
将25.0mg(0.089mmol)12-(戊-4-炔酰胺)十二烷-1-醇和29.1mg(0.178mmol)羰基二咪唑溶解于thf溶剂,室温下搅拌1小时。将反应液用乙酸乙酯稀释,用水、食盐水洗涤后加入硫酸钠,静置5分钟。通过过滤除去硫酸钠,在减压下浓缩,从而得到粗产物,之后通过硅胶柱层析进行纯化。回收含产物的级分,在减压下浓缩,从而得到了12.0mg(0.032mmol)相当于化合物9的1h-咪唑-1-甲酸-12-(戊-4-炔-1-氧代)氨基十二烷基酯。
[1217]
1
h nmr(400mhz,氯仿-d)δ1.23-1.50(m,20h),1.81(t,j=2.6hz,1h),2.36(m,2h)2.53(td,j=6.8,2.6hz,2h),3.23(t,j=6.8hz,2h)4.41(t,j=6.8hz,2h),5.64(brs,1h),7.07(s,1h),7.43(brs,1h),8.13(s,1h).ms(esi)m/z:398[m+na]
+
[1218]
(2-2)咪唑基羰基化合物的合成和与亲和性肽叠氮体的连接
[1219]
实施例1中合成的亲和性肽叠氮体(化合物4)和实施例2中合成的咪唑基羰基化合物(化合物6、7、9)通过完全同样的方法进行连接。将肽叠氮体溶解于100mm的磷酸缓冲液(ph7.0),加入20摩尔当量的氨基胍盐酸盐、20摩尔当量的抗坏血酸钠、3摩尔当量的100mg/ml的咪唑基羰基化合物的二甲基亚砜溶液。向该反应混合物中添加另外调制的4摩尔当量的硫酸铜一水合物和20摩尔当量的三(3-羟基丙基三唑基甲基)胺的水溶液,进行搅拌。通过lc-ms进行反应监测,确认原料消失后,通过超滤(amicon ultra,3k mwco)对其重复进行4次浓缩和水稀释,将所得水溶液冷冻干燥,获取了下述所示的肽-咪唑基羰基化合物(化合物10、11、12)。
[1220]
[化学式63]
[1221][1222]
(肽部分的氨基酸序列seq id no:8)
[1223]
ms(esi)m/z:z=3 1455[m+3h]
3+
,z=4 1092[m+4h]
4+
[1224]
[化学式64]
[1225][1226]
(肽部分的氨基酸序列seq id no:8)
[1227]
ms(esi)m/z:z=3 1483[m+3h]
3+
,z=4 1113[m+4h]
4+
[1228]
[化学式65]
[1229][1230]
(肽部分的氨基酸序列seq id no:8)
[1231]
ms(esi)m/z:z=3 1525[m+3h]
3+
,z=4 1144[m+4h]
4+
[1232]
[参考例1:通过模型实验验证因亲和性肽~抗体修饰基团(亲电子基团)的原子数的不同引起的反应性的不同]
[1233]
(1-1)igg抗体曲妥珠单抗-肽复合物的合成
[1234]
将20μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于2.0μl100mm的hepes缓冲液(ph7.2),向抗体中分别加入20摩尔当量的实施例2的(2-2)中合成的肽-咪唑基羰基化合物(化合物10、11、12),在37度下搅拌4小时。通过超滤(amicon ultra,3k mwco)对反应液进行水置换,除去肽试剂使反应停止,得到了igg抗体曲妥珠单抗-肽复合物。(1-2)基于sds-page的igg抗体曲妥珠单抗-肽复合物的分析
[1235]
使用3种肽-咪唑基羰基化合物(化合物10、11、12),通过sds-page(mini-protean tgx凝胶,4~20%,bio-rad;还原条件下;利用考马斯亮蓝g-250染料进行染色)分析(1-1)中得到的3种igg抗体曲妥珠单抗-肽复合物,结果见图2。由该结果可知:在使用化合物10、11时进行抗体的修饰反应,而在使用化合物12时反应没有进行。[实施例3:搭载有马来酰亚胺的抗体亲和性试剂的合成]
[1236]
(3-1)保护硫醇化合物的合成
[1237]
(3-1-1)保护硫醇化合物(化合物14)的合成
[1238]
[化学式66]
[1239][1240]
将100mg(0.287mmol)3-(三苯基甲硫基)丙酸溶解于thf,在0℃下加入42.7μl(0.316mmol)氯碳酸异丁酯、69.4μl(0.631mmol)n-甲基吗啉,搅拌30分钟,来调制对应的混合酸酐。室温下将33.6mg(0.287mmol)5-氨基戊酸溶解于1m氢氧化钠水溶液后,在室温下滴加上述混合酸酐的thf溶液。室温下搅拌16小时后,用水和乙酸乙酯洗涤反应液,回收水相。在水相中加入6m盐酸水溶液,将体系内的ph调节至3.0后,利用乙酸乙酯进行分液提取,之后用食盐水洗涤有机相,之后加入无水硫酸镁,静置5分钟。通过过滤除去硫酸镁,在减压下浓缩,从而得到粗产物,之后通过硅胶柱层析进行纯化。回收含产物的级分,减压下浓缩,从而得到了110mg(0.246mmol)相当于化合物13的5-[3-(三苯基甲基)硫烷基-丙基-1-氧代]氨基-己酸。
[1241]
1
h nmr(400mhz,氯仿-d)δ1.66(m,3h),2.03(t,j=7.3hz,2h),2.39(t,j=7.3hz,2h),2.52(t,j=7.3hz,2h),3.22(q,j=6.6hz,2h),5.37(s,1h),7.19-7.36(m,9h),7.40-7.49(m,6h).
[1242]
ms(esi)m/z:470[m+na]
+
[1243]
[化学式67]
[1244][1245]
将20.2mg(0.045mmol)5-(3-三苯基甲基-丙基-1-氧代)氨基己酸溶解于thf,在0℃下加入6.70μl(0.050mmol)氯碳酸异丁酯、10.9μl(0.0991mmol)n-甲基吗啉,搅拌30分钟,来调制对应的混合酸酐。室温下将16.6μl(0.226mmol)炔丙胺溶解于1m氢氧化钠水溶液,之后在室温下滴加上述的混合酸酐的thf溶液。在室温下搅拌16小时,之后用水和乙酸乙酯洗涤反应液,回收水相。在水相中加入6m盐酸水溶液,将体系内的ph调节至3.0后,利用乙酸乙酯进行分液提取,之后用食盐水洗涤有机相,之后加入无水硫酸镁,静置5分钟。通过过滤除去硫酸镁,在减压下浓缩,从而得到粗产物,之后通过硅胶柱层析进行纯化。回收含产物的级分,在减压下浓缩,从而得到了20.0mg(0.041mmol)相当于化合物14的n-丙炔基-5-(3-三苯基甲基硫烷基-丙基-1-氧代)氨基-己酰胺。
[1246]
1
h nmr(400mhz,氯仿-d)δ1.52(dt,j=8.2,6.5hz,2h),1.59-1.72(m,2h),2.02-2.09(m,2h),2.17-2.28(m,2h)2.52(t,j=7.2hz,2h),3.21(brs,2h),4.01(dd,j=5.3,2.6hz,2h),6.04(s,1h),7.19-7.35(m,9h),7.40-7.49(m,6h).
[1247]
ms(esi)m/z:507[m+h]
+
[1248]
(3-1-2)保护硫醇化合物(化合物15)的合成
[1249]
[化学式68]
[1250][1251]
将100mg(0.287mmol)3-(三苯基甲硫基)丙酸溶解于thf,在0℃下加入42.7μl(0.316mmol)氯碳酸异丁酯、69.4μl(0.631mmol)n-甲基吗啉,搅拌30分钟,来调制对应的混合酸酐。室温下将105μl(1.43mmol)炔丙胺溶解于1m氢氧化钠水溶液后,在室温下滴加上述的混合酸酐的thf溶液。室温下搅拌16小时后,用水和乙酸乙酯洗涤反应液,回收水相。在水相中加入6m盐酸水溶液,将体系内的ph调节至3.0后,利用乙酸乙酯进行分液提取,之后用食盐水洗涤有机相,之后加入无水硫酸镁,静置5分钟。通过过滤除去硫酸镁,在减压下浓缩,从而得到了110mg(0.286mmol)相当于化合物15的n-丙炔基-3-三苯基甲基硫烷基-丙酰胺。
[1252]
1
h nmr(400mhz,氯仿-d)δ2.01(t,j=7.1hz,2h),2.24(t,j=2.8hz,1h),2.53(t,j=7.6hz,2h),3.99(m,2h),5.40(brs,1h),7.19-7.35(m,9h),7.40-7.49(m,6h).
[1253]
ms(esi)m/z:408[m+na]
+
[1254]
(3-2)亲和性肽与保护硫醇化合物的连接
[1255]
(3-2-1)肽-保护硫醇连接体(化合物16)的合成
[1256]
[化学式69]
[1257][1258]
(肽部分的氨基酸序列seq id no:6)
[1259]
将实施例1中合成的化合物5溶解于n,n
’-
二甲基甲酰胺,将5摩尔当量的3-(三苯基甲硫基)丙酸、15摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、15摩尔当量的1-羟基苯并三唑溶解于n,n
’-
二甲基甲酰胺,加入到体系中。在室温下搅拌12小时后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的肽-保护硫醇连接体(化合物16)。
[1260]
ms(esi)m/z:z=3 1502[m+3h]
3+
,z=4 1125[m+4h]
4+
[1261]
(3-2-2)肽-保护硫醇连接体(化合物17、18)的合成
[1262]
实施例1中合成的亲和性肽叠氮体(化合物5)和(4-1-1)、(4-1-2)中合成的保护硫醇化合物(化合物17、18)按照同样的方法进行连接。将肽叠氮体溶解于100mm的磷酸缓冲液(ph7.0),加入20摩尔当量的氨基胍盐酸盐、20摩尔当量的抗坏血酸钠、3摩尔当量的100mg/ml的保护硫醇化合物的二甲基亚砜溶液。向该反应混合物中添加另外调制的4摩尔当量的
硫酸铜一水合物和20摩尔当量的三(3-羟基丙基三唑基甲基)胺的水溶液,进行搅拌。通过lc-ms进行反应监测,确认原料消失后,通过超滤(amicon ultra-4,3k mwco)对其重复进行4次浓缩和水稀释,将所得的水溶液冷冻干燥,得到了肽-保护硫醇连接体(化合物17、18)。
[1263]
[化学式70]
[1264][1265][1266]
(肽部分的氨基酸序列seq id no:6)
[1267]
ms(esi)m/z:z=3 1548[m+3h]
3+
,z=4 1161[m+4h]
4+
[1268]
[化学式71]
[1269][1270]
(肽部分的氨基酸序列seq id no:6)
[1271]
ms(esi)m/z:z=3 1581[m+3h]
3+
,z=4 1186[m+4h]
4+
[1272]
(3-3)肽-保护硫醇连接体(化合物19、20、21)的合成
[1273]
将(3-2)中合成的亲和性肽-保护硫醇连接体(化合物16、17、18)在三氟乙酸:二氯甲烷=1:1溶液中搅拌1小时,从而除去三苯基甲基。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的硫醇-肽连接体(化合物19、20、21)。
[1274]
[化学式72]
[1275][1276]
(肽部分的氨基酸序列seq id no:6)
[1277]
ms(esi)m/z:z=3 1454[m+3h]
3+
,z=4 1091[m+4h]
4+
[1278]
[化学式73]
[1279][1280][1281]
(肽部分的氨基酸序列seq id no:6)
[1282]
ms(esi)m/z:z=3 1468[m+3h]
3+
,z=4 1111[m+4h]
4+
[1283]
[化学式74]
[1284][1285]
(肽部分的氨基酸序列seq id no:6)
[1286]
m/z:z=3 1501[m+3h]
3+
,z=4 1126[m+4h]
4+
[1287]
(3-4)搭載有马来酰亚胺的抗体亲和性肽试剂的合成(1)(化合物22、23、24)
[1288]
将(3-3)中合成的硫醇-肽连接体(化合物19、20、21)溶解于二甲基亚砜,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认原料消失后,加入40摩尔当量的反式-4-[(2,5-二氢-1h-吡咯-1-基)甲基)]环己烷甲酸、30摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、30摩尔当量的1-羟基苯并三唑,搅拌4小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后冷冻干燥,得到了作为产物的马来酰亚胺-亲和性肽试剂(化合物22、23、24)。
[1289]
[化学式75]
[1290][1291]
(肽部分的氨基酸序列seq id no:6)
[1292]
ms(esi)m/z:z=3 1532[m+3h]
3+
,z=4 1150[m+4h]
4+
[1293]
[化学式76]
[1294][1295]
(肽部分的氨基酸序列seq id no:6)
[1296]
ms(esi)m/z:z=3 1578[m+3h]
3+
,z=4 1184[m+4h]
4+
[1297]
[化学式77]
[1298][1299]
(肽部分的氨基酸序列seq id no:6)
[1300]
ms(esi)m/z:z=3 1611[m+3h]
3+
,z=4 1208[m+4h]
4+
[1301]
(3-5)搭載有马来酰亚胺的抗体亲和性肽试剂的合成(2)(化合物56、58)
[1302]
(3-5-1)n-羟基琥珀酰亚胺-肽连接体(化合物55)的合成
[1303]
将(1-1)中合成的化合物3溶解于二甲基亚砜,加入1当量的三乙胺、1.2当量的n-羟基马来酰亚胺的二甲基亚砜溶液,室温下撹拌1小时。通过lc-ms确认反应结束,之后通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的n-羟基琥珀酰亚胺-肽连接体(化合物55)。
[1304]
[化学式78]
[1305][1306]
(肽部分的氨基酸序列seq id no:7)
[1307]
ms(esi)m/z:z=3 1429[m+3h]
3+
,z=4 1072[m+4h]
4+
,z=5 857[m+5h]
5+
,z=6 715[m+6h]
6+
[1308]
(3-5-2)搭載有马来酰亚胺的抗体亲和性肽试剂的合成(化合物56)
[1309]
将(3-5-1)中得到的n-羟基琥珀酰亚胺-肽连接体、20当量的4-(n-马来酰亚胺甲基)环己烷甲酸n-琥珀酰亚胺酯溶解于二甲基亚砜,加入8当量的三乙胺。在室温下搅拌2小时,之后通过lc-ms确认反应进行。通过制备hplc进行纯化,通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为目标物的搭載有马来酰亚胺的抗体亲和性肽试剂(化合物56)。
[1310]
[化学式79]
[1311][1312]
(肽部分的氨基酸序列seq id no:7)
[1313]
ms(esi)m/z:z=3 1502[m+3h]
3+
,z=4 1126[m+4h]
4+
,z=5 901[m+5h]
5+
,z=6 751[m+6h]
6+
[1314]
(3-5-3)n-羟基琥珀酰亚胺-肽连接体(化合物57)的合成
[1315]
将实施例1中合成的抗体亲和性肽(化合物36)溶解于二甲基亚砜,加入10摩尔当量的2-亚氨基硫烷盐酸盐、15摩尔当量的二异丙基乙胺,搅拌1小时。通过lc-ms确认原料消失,之后加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认反应进行后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的羟基马来酰亚胺-亲和性肽体(化合物57)。
[1316]
[化学式80]
[1317][1318]
(肽部分的氨基酸序列seq id no:46)
[1319]
ms(esi)m/z:z=2 1152[m+2h]
2+
,z=3 769[m+3h]
3+
[1320]
(3-5-4)搭載有马来酰亚胺的抗体亲和性肽试剂的合成(化合物58)
[1321]
将(3-5-2)中得到的n-羟基琥珀酰亚胺-肽连接体(h1)、20当量的4-[(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)甲基]苯甲酸溶解于二甲基亚砜,加入8当量的三乙胺。在室温下搅拌2小时后,通过lc-ms确认反应进行。通过制备hplc进行纯化,通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为目标物的搭載有马来酰亚胺的抗体亲和性肽试剂(化合物58)。
[1322]
[化学式81]
[1323][1324]
(肽部分的氨基酸序列seq id no:46)
[1325]
ms(esi)m/z:z=2 1259[m+2h]
2+
,z=3 840[m+3h]
3+
[1326]
[实施例4:位置选择性地向抗her2 igg抗体曲妥珠单抗中导入马来酰亚胺和分析]
[1327]
(4-1)具有硫醇的肽试剂的合成
[1328]
通过基于fmoc法的使用了2-氯三苯甲基树脂的肽固相合成来合成下述的化合物25。固相合成后,在三氟乙酸:水:三异丙基硅烷=95:2.5:2.5的溶液中搅拌1小时,由树脂切割和进行脱保护。通过过滤除去树脂,加入二乙醚进行沉淀,通过倾析除去二乙醚,以粗结晶的形式得到了肽。将其通过制备hplc进行纯化,得到了作为产物的下述化合物25。化合物25不是亲和性肽,而是适合经由马来酰亚胺基导入至位置选择性地具有作为生物正交性官能团的马来酰亚胺的抗体的药物替代品的模型肽化合物。
[1329]
[化学式82]
[1330][1331]
(肽部分的氨基酸序列seq id no:9)
[1332]
ms(esi)m/z:z=2 1482[m+2h]
2+
,z=3 988[m+3h]
3+
[1333]
(4-2)利用马来酰亚胺-亲和性肽试剂对igg抗体曲妥珠单抗进行的位置特异性修饰
[1334]
将实施例4的(4-4)中合成的马来酰亚胺-亲和性肽试剂(化合物22、23、24)溶解于n,n
’-
二甲基甲酰胺使之达到2.18mm。将20.0μg抗her2igg抗体曲妥珠单抗(中外制药)溶解于14.8μl 50mm的hepes缓冲液(ph7.2),向抗体中加入10~40摩尔当量的肽试剂,在37度下搅拌4小时。通过超滤(amicon ultra,10k mwco)将反应液置换成20mm的乙酸缓冲液(ph4.5)。通过重复3次相同的操作,除去亲和性肽试剂,得到了igg抗体曲妥珠单抗-马来酰亚胺修饰体。
[1335]
(4-3)igg抗体曲妥珠单抗-马来酰亚胺修饰体与具有硫醇的肽试剂的偶联
[1336]
通过超滤(amicon ultra,10k mwco)将实施例5的(5-2)中合成的igg抗体曲妥珠单抗-马来酰亚胺修饰体溶剂置换成50mm的hepes缓冲液(ph7.2),使体系内的ph恢复至中性,加入已调制成10mg/ml的化合物25水溶液(相对于抗体为80摩尔当量),搅拌16小时。通过超滤(amicon ultra,10k mwco)对反应液进行水置换,除去肽试剂,使反应停止,得到了igg抗体曲妥珠单抗-肽复合物。
[1337]
(4-4)基于sds-page的igg抗体曲妥珠单抗-肽复合物的分析
[1338]
通过sds-page(mini-protean tgx gel,4~20%,bio-rad;还原条件下;利用考马斯亮蓝g-250染料进行染色)分析(4-3)中得到的igg抗体曲妥珠单抗-肽复合物,结果见图3。由该结果可知:在马来酰亚胺的位置选择性导入反应(5-2)中,在使用化合物22、23时抗体的修饰反应进行,而在使用化合物24时反应没有进行。
[1339]
(4-5)基于还原条件下的esi-tofms分析的igg抗体曲妥珠单抗-马来酰亚胺修饰体的重链选择性的确认
[1340]
(4-5-1)igg抗体曲妥珠单抗-马来酰亚胺修饰体的合成(1)
[1341]
将实施例3的(3-5-2)中合成的搭載有马来酰亚胺的亲和性肽试剂(化合物56)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将250μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于230μl 50mm的hepes缓冲液(ph7.2),向抗体中加入20摩尔当量的2.0mm的肽试剂,在37度下搅拌16小时。通过超滤(amicon ultra,10k mwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-马来酰亚胺修饰体。
[1342]
(4-5-2)基于还原条件下的esi-tofms分析的曲妥珠单抗-马来酰亚胺修饰体的重链选择性的确认(1)
[1343]
在(4-5-1)中合成的曲妥珠单抗-马来酰亚胺修饰体中加入2.0μl(相对于抗体为100当量)7mm的三(2-羧乙基)膦盐酸盐溶液,室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50596、50757观测到重链峰、在23439观测到轻链峰。
反应产物在向重链中导入了与三(2-羧乙基)膦反应的马来酰亚胺而得到的51062、51224和与原料相同的23439观测到轻链峰。esi-tofms分析结果见图4。
[1344]
(4-5-3)igg抗体曲妥珠单抗-马来酰亚胺修饰体的合成(2)
[1345]
与(4-5-1)同样,使用实施例3的(3-5-4)中合成的搭载有马来酰亚胺的亲和性肽试剂(化合物58),得到了igg抗体曲妥珠单抗-叠氮修饰体。(4-5-4)基于还原条件下的esi-tofms分析的曲妥珠单抗-马来酰亚胺修饰体的重链选择性的确认(2)
[1346]
与(4-5-2)同样地进行处理,在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入了与n-乙酰基半胱氨酸反应的马来酰亚胺而得到的50818、50979和与原料相同的23443观测到轻链峰。
[1347]
[实施例5:搭載有叠氮的抗体修饰试剂的合成]
[1348]
(5-1)在抗体修饰基(亲电子基团)的β位具有杂原子的抗体修饰试剂(比较例化合物)的合成
[1349]
[化学式83]
[1350][1351]
(肽部分的氨基酸序列seq id no:7)
[1352]
将实施例1中合成的抗体亲和性肽(化合物2)溶解于二甲基亚砜,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认原料消失后,加入40摩尔当量的11-叠氮-3,6,9-三氧杂十一烷酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-peg-亲和性肽试剂(化合物26)。
[1353]
ms(esi)m/z:z=3 1501[m+3h]
3+
,z=4 1125[m+4h]
4+
[1354]
(5-2)在抗体修饰基(亲电子基团)的β位具有碳原子或杂原子的抗体修饰试剂的合成
[1355]
(5-2-1)通过叠氮试剂与亲和性肽的连接进行的抗体修饰试剂(化合物27、59、60)的合成
[1356]
[化学式84]
[1357][1358]
(肽部分的氨基酸序列seq id no:7)
[1359]
将实施例1中合成的抗体亲和性肽(化合物3)溶解于二甲基亚砜,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认原料消失后,加入40摩尔当量的6-叠氮-己酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-烷基-亲和性肽试剂(化合物27)。
[1360]
ms(esi)m/z:z=3 1475[m+3h]
3+
,z=4 1107[m+4h]
4+
[1361]
利用同样的方法,使用实施例3中合成的n-羟基琥珀酰亚胺-肽连接体(化合物57),得到了叠氮-烷基-亲和性肽试剂(化合物59)。
[1362]
[化学式85]
[1363][1364]
(肽部分的氨基酸序列seq id no:46)
[1365]
ms(esi)m/z:z=2 1222[m+2h]
2+
,z=3 815[m+3h]
3+
[1366]
将6-叠氮-己酸变更为叠氮乙酸,同样地进行合成,得到了叠氮-烷基-亲和性肽试剂(化合物60)。需要说明的是,化合物60是在抗体修饰基(亲电子基团)的β位具有杂原子的比较例化合物。
[1367]
[化学式86]
[1368][1369]
(肽部分的氨基酸序列seq id no:46)
[1370]
ms(esi)m/z:z=2 1193[m+2h]
2+
,z=3 796[m+3h]
3+
[1371]
(5-2-2)通过叠氮试剂与亲和性肽的连接进行的抗体修饰试剂(化合物28、61)的合成
[1372]
[化学式87]
[1373][1374][1375]
(肽部分的氨基酸序列seq id no:7)
[1376]
将实施例1中合成的抗体亲和性肽(化合物3)溶解于二甲基亚砜,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认原料消失后,加入40摩尔当量的4-叠氮苯甲酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-苯基-亲和性肽试剂(化合物28)。
[1377]
ms(esi)m/z:z=3 1478[m+3h]
3+
,z=4 1108[m+4h]
4+
[1378]
利用同样的方法,使用实施例1中合成的抗体亲和性肽(化合物31),得到了叠氮-苯基-亲和性肽试剂(化合物61)。
[1379]
[化学式88]
[1380][1381]
(肽部分的氨基酸序列seq id no:97)
[1382]
ms(esi)m/z:z=3 1348[m+3h]
3+
,z=4 1011[m+4h]
4+
[1383]
(5-2-3)通过叠氮试剂与亲和性肽的连接进行的抗体修饰试剂(化合物29、62~83)的合成
[1384]
[化学式89]
[1385][1386]
(肽部分的氨基酸序列seq id no:5)
[1387]
将实施例1中合成的抗体亲和性肽(化合物3)溶解于二甲基亚砜,加入10摩尔当量的2-亚氨基硫烷盐酸盐、15摩尔当量的二异丙基乙胺,搅拌1小时。通过lc-ms确认原料消失后,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认反应进行后,加入40摩尔当量的4-叠氮苯甲酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-苯基-亲和性肽试剂(化合物29)。
[1388]
ms(esi)m/z:z=3 1512[m+3h]
3+
,z=4 1134[m+4h]
4+
[1389]
利用同样的方法,使用实施例1中合成的抗体亲和性肽(化合物32~53),合成了下述所示的基于叠氮试剂与亲和性肽的连接的抗体修饰试剂(化合物62~83)。
[1390]
使用实施例1中合成的抗体亲和性肽(化合物32)合成的抗体修饰试剂如下。
[1391]
[化学式90]
[1392][1393]
(肽部分的氨基酸序列seq id no:98)
[1394]
ms(esi)m/z:z=3 1521[m+3h]
3+
,z=4 1141[m+4h]
4+
[1395]
使用实施例1中合成的抗体亲和性肽(化合物33)合成的抗体修饰试剂如下。
[1396]
[化学式91]
[1397][1398]
(肽部分的氨基酸序列seq id no:41)
[1399]
ms(esi)m/z:z=3 1546[m+3h]
3+
,z=4 1159[m+4h]
4+
[1400]
使用实施例1中合成的抗体亲和性肽(化合物34)合成的抗体修饰试剂如下。
[1401]
[化学式92]
[1402][1403]
(肽部分的氨基酸序列seq id no:42)
[1404]
ms(esi)m/z:z=3 1537[m+3h]
3+
,z=4 1153[m+4h]
4+
[1405]
使用实施例1中合成的抗体亲和性肽(化合物35)合成的抗体修饰试剂如下。
[1406]
[化学式93]
[1407]
[1408]
(肽部分的氨基酸序列seq id no:43)
[1409]
ms(esi)m/z:z=3 1545[m+3h]
3+
,z=4 1159[m+4h]
4+
[1410]
使用实施例1中合成的抗体亲和性肽(化合物36)合成的抗体修饰试剂如下。
[1411]
[化学式94]
[1412][1413]
(肽部分的氨基酸序列seq id no:46)
[1414]
ms(esi)m/z:z=2 1225[m+h]
+
,z=3 817[m+h]
+
[1415]
使用实施例1中合成的抗体亲和性肽(化合物37)合成的抗体修饰试剂如下。
[1416]
[化学式95]
[1417][1418]
(肽部分的氨基酸序列seq id no:47)
[1419]
ms(esi)m/z:z=2 1217[m+2h]
2+
,z=3 812[m+3h]
3+
[1420]
使用实施例1中合成的抗体亲和性肽(化合物38)合成的抗体修饰试剂如下。
[1421]
[化学式96]
[1422][1423]
(肽部分的氨基酸序列seq id no:48)
[1424]
ms(esi)m/z:z=2 1211[m+2h]
2+
,z=3 807[m+3h]
3+
[1425]
使用实施例1中合成的抗体亲和性肽(化合物39)合成的抗体修饰试剂如下。
[1426]
[化学式97]
[1427][1428]
(肽部分的氨基酸序列seq id no:49)
[1429]
ms(esi)m/z:z=2 1196[m+2h]
2+
,z=3 798[m+3h]
3+
[1430]
使用实施例1中合成的抗体亲和性肽(化合物40)合成的抗体修饰试剂如下。
[1431]
[化学式98]
[1432][1433]
(肽部分的氨基酸序列seq id no:50)
[1434]
ms(esi)m/z:z=2 1224[m+2h]
2+
,z=3 817[m+3h]
3+
[1435]
使用实施例1中合成的抗体亲和性肽(化合物41)合成的抗体修饰试剂如下。
[1436]
[化学式99]
[1437][1438]
(肽部分的氨基酸序列seq id no:51)
[1439]
ms(esi)m/z:z=2 1224[m+2h]
2+
,z=3 817[m+3h]
3+
[1440]
使用实施例1中合成的抗体亲和性肽(化合物42)合成的抗体修饰试剂如下。
[1441]
[化学式100]
[1442][1443]
(肽部分的氨基酸序列seq id no:52)
[1444]
ms(esi)m/z:z=2 961[m+2h]
2+
[1445]
使用实施例1中合成的抗体亲和性肽(化合物43)合成的抗体修饰试剂如下。
[1446]
[化学式101]
[1447][1448]
(肽部分的氨基酸序列seq id no:53)
[1449]
ms(esi)m/z:z=1 1909[m+h]
+
,z=3 955[m+h]
+
[1450]
使用实施例1中合成的抗体亲和性肽(化合物44)合成的抗体修饰试剂如下。
[1451]
[化学式102]
[1452][1453]
(肽部分的氨基酸序列seq id no:55)
[1454]
ms(esi)m/z:z=2 1239[m+2h]
2+
,z=3 827[m+3h]
3+
[1455]
使用实施例1中合成的抗体亲和性肽(化合物45)合成的抗体修饰试剂如下。
[1456]
[化学式103]
[1457]
[1458]
(肽部分的氨基酸序列seq id no:57)
[1459]
ms(esi)m/z:z=2 1253[m+2h]
2+
,z=3 836[m+3h]
3+
[1460]
使用实施例1中合成的抗体亲和性肽(化合物46)合成的抗体修饰试剂如下。
[1461]
[化学式104]
[1462][1463]
(肽部分的氨基酸序列seq id no:59)
[1464]
ms(esi)m/z:z=2 1260[m+2h]
2+
,z=3 841[m+3h]
3+
[1465]
使用实施例1中合成的抗体亲和性肽(化合物47)合成的抗体修饰试剂如下。
[1466]
[化学式105]
[1467][1468]
(肽部分的氨基酸序列seq id no:63)
[1469]
ms(esi)m/z:z=2 1265[m+h]
+
,z=3 844[m+h]
+
[1470]
使用实施例1中合成的抗体亲和性肽(化合物48)合成的抗体修饰试剂如下。
[1471]
[化学式106]
[1472][1473]
(肽部分的氨基酸序列seq id no:71)
[1474]
ms(esi)m/z:z=2 1225[m+2h]
2+
,z=3 817[m+3h]
3+
[1475]
使用实施例1中合成的抗体亲和性肽(化合物49)合成的抗体修饰试剂如下。
[1476]
[化学式107]
[1477][1478]
(肽部分的氨基酸序列seq id no:72)
[1479]
ms(esi)m/z:z=2 853[m+2h]
2+
[1480]
使用实施例1中合成的抗体亲和性肽(化合物50)合成的抗体修饰试剂如下。
[1481]
[化学式108]
[1482][1483]
(肽部分的氨基酸序列seq id no:77)
[1484]
ms(esi)m/z:z=2 1232[m+2h]
2+
,z=3 822[m+3h]
3+
[1485]
使用实施例1中合成的抗体亲和性肽(化合物51)合成的抗体修饰试剂如下。
[1486]
[化学式109]
[1487][1488]
(肽部分的氨基酸序列seq id no:81)
[1489]
ms(esi)m/z:z=2 1253[m+2h]
2+
,z=3 836[m+3h]
3+
[1490]
使用实施例1中合成的抗体亲和性肽(化合物52)合成的抗体修饰试剂如下。
[1491]
[化学式110]
[1492][1493]
(肽部分的氨基酸序列seq id no:82)
[1494]
ms(esi)m/z:z=2 1254[m+2h]
2+
,z=3 836[m+3h]
3+
[1495]
使用实施例1中合成的抗体亲和性肽(化合物53)合成的抗体修饰试剂如下。
[1496]
[化学式111]
[1497][1498]
(肽部分的氨基酸序列seq id no:99)
[1499]
ms(esi)m/z:z=2 1147[m+2h]
2+
,z=3 764[m+3h]
3+
[1500]
[实施例6:利用igg1 fc亲和性肽试剂进行的igg1 fc的位置特异性修饰和基于esi-tofms的分析]
[1501]
(6-1)在抗体修饰基(亲电子基团)的β位具有碳原子的抗体修饰试剂下的抗体修饰反应
[1502]
(6-1-1)使用了亲和性肽试剂(化合物27、化合物59)的抗体修饰反应(叠氮修饰抗体1、2)
[1503]
将实施例5中合成的搭载有叠氮的亲和性肽试剂(化合物27)溶解于n,n
’-
二甲基甲酰胺使之达到0.22mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于1200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的0.22mm的肽试剂,在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。通过蛋白a(aspire protein a tips,thermo)来纯化反应混合物,将洗脱液置换成9.57mm的pbs缓冲液(ph7.0),通过超滤(amicon ultra,10k mwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体1)。
[1504]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物59)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体2)。
[1505]
(6-1-2)使用了亲和性肽试剂(化合物28、化合物61)的抗体修饰反应(叠氮修饰抗体3、4)
[1506]
将实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物28)溶解于n,n
’-
二甲基甲酰胺使之达到0.22mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于1200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的0.22mm的肽试剂,在37度下搅
拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。利用蛋白a(aspire protein a tips,thermo)纯化反应混合物,将洗脱液置换成9.57mm的pbs缓冲液(ph7.0),通过超滤(amicon ultra,10k mwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体3)。
[1507]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物61)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体4)。
[1508]
(6-1-3)使用了亲和性肽试剂(化合物29、化合物62~83)的抗体修饰反应(叠氮修饰抗体5~27)
[1509]
将实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物29)溶解于n,n
’-
二甲基甲酰胺使之达到0.22mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于1200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的0.22mm的肽试剂,在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。利用蛋白a(aspire protein a tips,thermo)纯化反应混合物,将洗脱液置换成9.57mm的pbs缓冲液(ph7.0),通过超滤(amicon ultra,10k mwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体5)。
[1510]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物62)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体6)。
[1511]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物63)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体7)。
[1512]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物64)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体8)。
[1513]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物65)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体9)。
[1514]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物66)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体10)。
[1515]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物67)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体11)。
[1516]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物68)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体12)。
[1517]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物69)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体13)。
[1518]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物70)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体14)。
[1519]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物71)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体15)。
[1520]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物72)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体16)。
[1521]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物73)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体17)。
[1522]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物74)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体18)。
[1523]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物75)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体19)。
[1524]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物76)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体20)。
[1525]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物77)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体21)。
[1526]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物78)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体22)。
[1527]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物79)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体23)。
[1528]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物80)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体24)。
[1529]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物f81)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体25)。
[1530]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物82)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体26)。
[1531]
利用同样的方法,使用搭載有叠氮的亲和性肽试剂(化合物83)进行抗体修饰反应,得到了igg抗体曲妥珠单抗-叠氮修饰体(叠氮修饰抗体27)。
[1532]
(6-1-4)使用了亲和性肽试剂(化合物66)的除曲妥珠单抗以外的抗体修饰反应(叠氮修饰抗体28~31)
[1533]
将实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物66)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将200μg抗tnf-αigg抗体阿达木单抗(eisai)溶解于1200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在25度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。通过蛋白a(aspire protein a tips,thermo)纯化反应混合物,将洗脱液置换成9.57mm的pbs缓冲液(ph7.0),通过超滤(amicon ultra,10k mwco)进行浓缩,从而得到了igg抗体阿达木单抗-叠氮修饰体(叠氮修饰抗体28)。
[1534]
利用与上述同样的方法,使用抗rankl igg抗体地诺单抗(第一三共)进行抗体修饰反应,得到了igg抗体地诺单抗-叠氮修饰体(叠氮修饰抗体29)。
[1535]
利用与上述同样的方法,使用抗il-4/13igg抗体度匹鲁单抗(sanofi)进行抗体修饰反应,得到了igg抗体度匹鲁单抗-叠氮修饰体(叠氮修饰抗体30)。
[1536]
利用与上述同样的方法,使用抗cd20 igg抗体利妥昔单抗(roche公司)进行抗体修饰反应,得到了igg抗体利妥昔单抗-叠氮修饰体(叠氮修饰抗体31)。
[1537]
(6-2)基于还原条件下的esi-tofms分析的igg抗体曲妥珠单抗-叠氮修饰体的重链选择性的确认
[1538]
(6-2-1)通过还原条件下的esi-tofms分析对在修饰反应中使用化合物27、化合物59时的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体1、2)的重链选择性进行确认
[1539]
向实施例6的(6-1-1)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体1)中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入烷基叠氮而得到的50733、50895和与原料相同的23440观测到轻链峰。esi-tofms分析结果见图5。
[1540]
利用同样的方法,还对叠氮修饰抗体2进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰、在23443观测到轻链峰。反应产物在向重链中导入烷基叠氮而得到的50742、50904和与原料相同的23443观测到轻链峰。
[1541]
(6-2-2)通过还原条件下的esi-tofms分析对在修饰反应中使用化合物28、化合物61时的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体3、4)的重链选择性进行确认
[1542]
向实施例6的(6-1-2)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体3)中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。esi-tofms分析结果见图6。
[1543]
利用同样的方法,还对叠氮修饰抗体4进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50597、50758观测到重链峰,在23441观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50716、50877和与原料相同的23441观测到轻链峰。
[1544]
(6-2-3)通过还原条件下的esi-tofms分析对在修饰反应中使用了化合物29、化合物62~83时的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体5~27)的重链选择性进行确认
[1545]
向实施例6的(6-1-3)中合成的曲妥珠单抗-叠氮修饰体(叠氮修饰抗体5)中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。需要说明的是,通过测定前处理,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1546]
利用同样的方法,还对叠氮修饰抗体6进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、5076观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23439中观测到轻链峰。esi-tofms分析结果见图7。
[1547]
利用同样的方法,还对叠氮修饰抗体7进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、5076观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50713、50875和与原料相同的23439观测到轻链峰。
[1548]
利用同样的方法,还对叠氮修饰抗体8进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50721、50883和与原料相同的23442观测到轻链峰。esi-tofms分析结果见图8。
[1549]
利用同样的方法,还对叠氮修饰抗体9进行了esi-tof ms分析。用作对照的原料的
曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23440观测到轻链峰。
[1550]
利用同样的方法,还对叠氮修饰抗体10进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50721、50883和与原料相同的23443观测到轻链峰。esi-tofms分析结果见图9。
[1551]
利用同样的方法,还对叠氮修饰抗体11进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50713、50874和与原料相同的23440观测到轻链峰。
[1552]
利用同样的方法,还对叠氮修饰抗体12进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1553]
利用同样的方法,还对叠氮修饰抗体13进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1554]
利用同样的方法,还对叠氮修饰抗体14进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1555]
利用同样的方法,还对叠氮修饰抗体15进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1556]
利用同样的方法,还对叠氮修饰抗体16进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23440观测到轻链峰。
[1557]
利用同样的方法,还对叠氮修饰抗体17进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1558]
利用同样的方法,还对叠氮修饰抗体18进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1559]
利用同样的方法,还对叠氮修饰抗体19进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23440观测到轻链峰。
[1560]
利用同样的方法,还对叠氮修饰抗体20进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23440观测到轻链峰。
[1561]
利用同样的方法,还对叠氮修饰抗体21进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1562]
利用同样的方法,还对叠氮修饰抗体22进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50875和与原料相同的23440观测到轻链峰。
[1563]
利用同样的方法,还对叠氮修饰抗体23进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50597、50759观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1564]
利用同样的方法,还对叠氮修饰抗体24进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50597、50759观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1565]
利用同样的方法,还对叠氮修饰抗体25进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50597、50759观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1566]
利用同样的方法,还对叠氮修饰抗体26进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50597、50759观测到重链峰,在23440观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50714、50876和与原料相同的23440观测到轻链峰。
[1567]
利用同样的方法,还对叠氮修饰抗体27进行了esi-tof ms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50721、50883和与原料相同的23440观测到轻链峰。
[1568]
(6-2-3)通过还原条件下的esi-tofms分析对在修饰反应中使用了化合物5时的抗体-叠氮修饰体(叠氮修饰抗体28~31)的重链选择性进行确认
[1569]
向实施例6的(6-1-4)中合成的阿达木单抗-叠氮修饰体(叠氮修饰抗体28)中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的阿达木单抗在50645、50764观测到重链峰,在23412观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50763、50926和与原料相同的23412观测到轻链峰。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体(下同)。esi-tofms分析结果见图10。
[1570]
利用同样的方法,还对叠氮修饰抗体29(地诺单抗-叠氮修饰抗体)进行了esi-tof ms分析。用作对照的原料的地诺单抗在50208、50371观测到重链峰,在23487观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50327、50490和与原料相同的23487观测到轻链峰。esi-tofms分析结果见图11。
[1571]
利用同样的方法,还对叠氮修饰抗体30(度匹鲁单抗-叠氮修饰抗体)进行了esi-tof ms分析。用作对照的原料的度匹鲁单抗在50889观测到重链峰,在24022观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的51009和与原料相同的24022观测到轻链峰。esi-tofms分析结果见图12。
[1572]
利用同样的方法,还对叠氮修饰抗体31(利妥昔单抗-叠氮修饰抗体)进行了esi-tof ms分析。用作对照的原料的利妥昔单抗在50515、50678观测到重链峰,在23040观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50635、50797和与原料相同的23040观测到轻链峰(图13)。
[1573]
[比较例1:基于β位具有杂原子的肽试剂的igg1 fc的修饰反应和基于esi-tofms的分析]
[1574]
将实施例5中合成的β位具有杂原子的肽试剂(化合物26)溶解于n,n
’-
二甲基甲酰胺使之达到0.22mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于1200μl 50mm的hepes缓冲液(ph7.2),加入120μl 0.22mm的肽试剂(相对于抗体为20摩尔当量),在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。对其通过超滤(amicon ultra,10k mwco)溶剂置换成pbs溶液,之后加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50595、50757观测到重链峰,在23440观测到轻链峰。同样,反应产物也在50595、50757观测到重链峰,在23440观测到轻链峰,可确认到:抗体修饰基(亲电子基团)的β位具有杂原子的化合物26中的抗体修饰反应没有进行。
[1575]
同样,使用β位具有杂原子的肽试剂(化合物60),进行抗体修饰反应。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。同样,反应产物也在50602、50764观测到重链峰,在23443观测到轻链峰,可确认到:β位具有杂原子的化合物60中的抗体修饰反应没有进行。
[1576]
由该结果可知:在叠氮的位置选择性导入反应(6-2)中,在使用化合物27、28、29时抗体的修饰反应进行,而在使用化合物26时反应没有进行。
[1577]
[实施例7:搭載有硫醇保护体的抗体修饰试剂的合成]
[1578]
(7-1)基于保护硫醇试剂与亲和性肽的连接的抗体修饰试剂(化合物84)的合成
[1579]
将(3-5-3)中合成的羟基马来酰亚胺-亲和性肽体(化合物57)溶解于二甲基亚砜溶剂,加入40摩尔当量的3-(乙酰基硫基)丙酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的乙酰基硫醇-亲和性肽试剂(化合物84)。
[1580]
[化学式112]
[1581][1582]
(肽部分的氨基酸序列seq id no:46)
[1583]
ms(esi)m/z:z=2 1217[m+2h]
2+
,z=3 812[m+3h]
3+
[1584]
(7-2)基于保护硫醇试剂与亲和性肽的连接的抗体修饰试剂(化合物85)的合成
[1585]
将(3-5-3)中合成的羟基马来酰亚胺-亲和性肽体(化合物57)溶解于二甲基亚砜溶剂,加入40摩尔当量的(s)-3-(苯甲酰硫基)-2-甲基丙酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms
确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的苯甲酰基硫醇-亲和性肽试剂(化合物85)。
[1586]
[化学式113]
[1587][1588]
(肽部分的氨基酸序列seq id no:46)
[1589]
ms(esi)m/z:z=2 1255[m+2h]
2+
,z=3 837[m+3h]
3+
[1590]
[实施例8:利用搭載有硫醇保护体的igg1 fc亲和性肽试剂进行的igg1fc的位置特异性修饰和基于esi-tofms的分析]
[1591]
(8-1)在搭载有硫醇保护体的igg1 fc亲和性肽试剂下的抗体修饰反应
[1592]
(8-1-1)使用了亲和性肽试剂(化合物84)的抗体修饰反应
[1593]
将实施例7中合成的搭载有保护硫醇的亲和性肽试剂(化合物84)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10kmwco)浓缩反应液,从而得到了igg抗体曲妥珠单抗-保护硫醇修饰体。
[1594]
(8-1-2)使用了亲和性肽试剂(化合物85)的抗体修饰反应
[1595]
将实施例7中合成的搭载有保护硫醇的亲和性肽试剂(化合物85)溶解于n,n
’-
二甲基甲酰胺溶解达到2.0mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10kmwco)浓缩反应液,从而得到了igg抗体曲妥珠单抗-保护硫醇修饰体。
[1596]
(8-2)基于还原条件下的esi-tofms分析的igg抗体曲妥珠单抗-保护硫醇修饰体的重链选择性的确认
[1597]
(8-2-1)通过还原条件下的esi-tofms分析对在修饰反应中使用了亲和性肽试剂(化合物84)时的曲妥珠单抗-叠氮修饰体的重链选择性进行确认
[1598]
向(8-1-1)中合成的曲妥珠单抗-保护硫醇修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入乙酰基保护硫醇基而得到的50723、50885和与原料相同的23439观测到轻链峰。esi-tofms分析结果见图14。
[1599]
(8-2-2)通过还原条件下的esi-tofms分析对在修饰反应中使用了亲和性肽试剂(化合物3)时的曲妥珠单抗-保护硫醇体的重链选择性进行确认
[1600]
向(8-1-2)中合成的曲妥珠单抗-保护硫醇修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50594、50756观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入苯甲酰基保护硫醇基而得到的50800、50962和与原料相同的23439观测到轻链峰。
[1601]
(8-3)igg抗体曲妥珠单抗-硫醇修饰体的生成确认
[1602]
(8-3-1)igg抗体曲妥珠单抗-乙酰基保护硫醇修饰体的脱保护
[1603]
将(8-2-1)中得到的igg抗体抗体曲妥珠单抗-乙酰基保护硫醇修饰体置换成20mm的乙二胺、0.5m的羟胺水溶液(ph6调制品),室温下静置1小时。通过超滤(amicon ultra,10kmwco)浓缩反应液,从而得到了igg抗体曲妥珠单抗-硫醇修饰体。
[1604]
(8-3-2)基于esi-tofms分析的igg抗体曲妥珠单抗-硫醇修饰体的生成确认
[1605]
向(8-3-1)中脱保护的曲妥珠单抗-硫醇修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),室温下放置20分钟。在通过esi-tofms测定质量时,反应产物观测到了在重链中乙酰基脱保护而得到的50681、50844,可确认到:乙酰基偏离,形成了硫醇。esi-tofms分析结果见图15。
[1606]
(8-3-3)igg抗体曲妥珠单抗-苯甲酰基保护硫醇修饰体的脱保护
[1607]
将(8-2-2)中得到的igg抗体抗体曲妥珠单抗-苯甲酰基保护硫醇修饰体置换成20mm乙二胺、0.5m羟胺水溶液(ph6调制品),室温下静置1小时。通过超滤(amicon ultra,10k mwco)浓缩反应液,从而得到了各自的igg抗体曲妥珠单抗-硫醇修饰体。
[1608]
(8-3-4)基于esi-tofms分析的igg抗体曲妥珠单抗-硫醇修饰体的生成确认
[1609]
向(8-3-3)中脱保护的曲妥珠单抗-硫醇修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),室温下放置20分钟。在通过esi-tofms测定质量时,反应产物观测到了在重链中苯甲酰基脱保护而得到的50696、50858,可确认到:苯甲酰基偏离,形成了硫醇。
[1610]
[实施例9:利用igg1 fc亲和性肽试剂进行的igg1 fc的多个不同靶区的位置选择性修饰和基于esi-tofms的分析]
[1611]
(9-1)阶段性地使用了2种亲和性肽试剂的多个不同靶区的位置选择性修饰和基于esi-tofms的分析
[1612]
(9-1-1)阶段性地使用了2种亲和性肽试剂(化合物66、化合物64)的多个部位的位置特异性的抗体修饰反应
[1613]
将实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物66)溶解于n,n
’-
二甲基甲酰胺使之达到2.04mm。将300μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于300μl 50mm的乙酸钠缓冲液(ph4.7),相对于抗体加入20摩尔当量的2.04mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10k mwco)除去肽试剂残余物,使用200μl50mm的hepes缓冲液(ph7.2)稀释所得的浓缩液。这里,相对于抗体加入20摩尔当量的实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物64)的2.0mm的n,n
’-
二甲基甲酰胺溶液,在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。通过超滤(amicon ultra,10kmwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体。
[1614]
(9-1-2)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮修饰体的
重链选择性进行确认
[1615]
向实施例9的(9-1-1)中合成的曲妥珠单抗-叠氮修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物观测到向重链中导入二个胺苯甲酸而得到的50841、51002。轻链峰则观测到了与原料相同的23443。需要说明的是,通过测定前处理,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。esi-tofms分析结果见图16。
[1616]
(9-1-3)阶段性地使用了2种亲和性肽试剂(化合物64、化合物66)的多个不同靶区的位置选择性修饰反应
[1617]
将实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物64)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将300μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于300μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在37度下搅拌16小时。通过超滤(amiconultra,10kmwco)除去肽试剂残余物,使用200μl 50mm的乙酸钠缓冲液(ph4.7)稀释所得的浓缩液。这里,相对于抗体加入20摩尔当量的实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物66)的2.04mm的n,n
’-
二甲基甲酰胺溶液,在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。通过超滤(amicon ultra,10kmwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体。
[1618]
(9-1-4)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮修饰体的重链选择性进行确认
[1619]
利用与实施例9的(9-1-2)同样的方法,通过esi-tofms测定质量。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物观测到了向重链中导入两个胺苯甲酸而得到的50840、51002。轻链峰则观测到与原料相同的23443。需要说明的是,通过测定前处理,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1620]
(9-1-5)阶段性地使用了2种亲和性肽试剂(化合物84、化合物64)的多个部位的位置特异性抗体修饰反应
[1621]
将实施例7中合成的搭载有硫醇保护体的亲和性肽试剂(化合物84)溶解于n,n
’-
二甲基甲酰胺使之达到2.04mm。将300μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于300μl 50mm的乙酸钠缓冲液(ph4.7),相对于抗体加入20摩尔当量的2.04mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10k mwco)除去肽试剂残余物,使用200μl50mm的hepes缓冲液(ph7.2)稀释所得的浓缩液。这里,相对于抗体加入20摩尔当量的实施例5中合成的搭載有叠氮的亲和性肽试剂(化合物64)的2.0mm的n,n
’-
二甲基甲酰胺溶液,在37度下搅拌16小时。向反应液中加入50μl 10mg/ml的lys水溶液,搅拌30分钟,使反应停止。通过超滤(amicon ultra,10kmwco)进行浓缩,从而得到了igg抗体曲妥珠单抗-叠氮修饰体。
[1622]
(9-1-6)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮-硫醇修饰体的重链选择性进行确认
[1623]
关于(9-1-5)中合成的igg抗体曲妥珠单抗-叠氮修饰体,利用与实施例9的(9-1-2)同样的方法,通过esi-tofms测定质量。用作对照的原料的曲妥珠单抗在50597、50757观测到重链峰,在23439观测到轻链峰。反应产物观测到在重链中导入胺苯甲酸和乙酰基保护硫醇基而得到的50843、51005。轻链峰则观测到了与原料相同的23443。需要说明的是,通过
测定前处理,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。esi-tofms分析结果见图17。
[1624]
(9-2)使用了具有多个衍生化位点的亲和性肽的多个不同靶区的位置选择性修饰和基于esi-tofms的分析
[1625]
(9-2-1)具有多个衍生化位点的亲和性肽(化合物86)的合成
[1626]
将实施例1中合成的抗体亲和性肽(化合物54)溶解于二甲基亚砜,加入10摩尔当量的2-亚氨基硫烷盐酸盐、15摩尔当量的二异丙基乙胺,搅拌1小时。通过lc-ms确认原料消失后,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认反应进行后,加入40摩尔当量的4-叠氮苯甲酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认含目标物的级分后进行冷冻干燥,得到了作为产物的二(叠氮-苯基)-亲和性肽试剂(化合物86)。
[1627]
[化学式114]
[1628][1629]
(肽部分的氨基酸序列seq id no:100)
[1630]
ms(esi)m/z:z=3 1587[m+3h]
3+
,3 1191[m+4h]
4+
[1631]
(9-2-2)使用了具有多个衍生化位点的亲和性肽的多个部位的位置特异性抗体修饰反应
[1632]
将实施例9的(9-2-1)中合成的二(叠氮-苯基)-亲和性肽试剂(化合物86)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将250μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于250μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10k mwco)浓缩反应液,从而得到了igg抗体曲妥珠单抗-叠氮修饰体。
[1633]
(9-2-3)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮修饰体的重链选择性进行确认
[1634]
向实施例9的(9-2-2)中合成的曲妥珠单抗-叠氮修饰体中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物观测到了向重链中导入二个胺苯甲酸而得到的50841、51003。轻链峰则观测到了与原料相同的23443。需要说明的是,通过测定前处理,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。esi-tofms分析结果见图18。
[1635]
[实施例10:曲妥珠单抗的位置特异性叠氮导入体与任意化合物的偶联和产物的esi-tofms分析]
[1636]
(10-1)曲妥珠单抗的位置特异性叠氮导入体与cy3-环炔烃的偶联
[1637]
(10-1-1)曲妥珠单抗的位置特异性叠氮导入体与cy3-dbco的偶联和esi-tofms分析
[1638]
将实施例6的(6-1-2)中合成的曲妥珠单抗的叠氮苯甲酸导入体溶解于20mm pbs缓冲液使之达到0.3mm后,添加20μl sigma aldrich制造的二苯并环辛炔-cy3(0.94mm、溶解于二甲基亚砜),室温下搅拌12小时。通过超滤(amicon ultra,10k mwco)对反应液进行水置换,停止反应。在通过esi-tofms测定质量时,曲妥珠单抗在148060观测到峰,(6-1-2)中合成的曲妥珠单抗的叠氮导入体在148489观测到峰,反应产物在导入了2个cy3而得到的150487观测到峰(图19)。
[1639]
(10-1-2)还原条件下的esi-tofms分析
[1640]
向(10-1-1)中合成的曲妥珠单抗-cy3复合物的pbs溶液中加入2μl7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-cy3复合物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-1)中合成的曲妥珠单抗的叠氮导入体在50714和50876观测到重链峰,在23440观测到轻链峰,曲妥珠单抗-cy3复合物在向重链中导入cy3而得到的51722和51885观测到峰,在与原料相同的23440观测到轻链峰(图20)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1641]
(10-2)曲妥珠单抗的位置特异性叠氮导入体与肽-环炔烃的偶联
[1642]
(10-2-1)肽-环炔烃的合成
[1643]
通过基于fmoc法的使用了2-氯三苯甲基树脂的肽固相合成来合成下述化合物30的肽部分。固相合成后,随时添加2摩尔当量的1-羟基苯并三唑、2摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、2摩尔当量的三乙胺、2.2摩尔当量的5-(5,6-二氢-11,12-二脱氢二苯并[b,f][b,f]吖辛因-5(6h)-基)-氧代戊酸,搅拌19小时。在三氟乙酸:水:三异丙基硅烷=95:2.5:2.5的溶液中搅拌1小时,从而由树脂切割和进行脱保护,在切割后的滤液中加入三乙胺进行中和。通过过滤除去树脂,加入二乙醚进行沉淀,通过倾析除去二乙醚,以粗结晶的形式得到了肽。将其通过制备hplc进行纯化,得到了作为产物的下述化合物30。
[1644]
[化学式115]
[1645][1646]
(肽部分的氨基酸序列seq id no:50)
[1647]
ms(esi)m/z:1200[m+h]
+
[1648]
(10-2-2)曲妥珠单抗的位置特异性叠氮导入体与肽-环炔烃的偶联和esi-tofms分析
[1649]
将实施例6的(6-1-2)中合成的曲妥珠单抗的叠氮苯甲酸导入体溶解于20mm的pbs缓冲液使之达到0.3mm后,添加20μl实施例7的(7-2-1)中合成的肽-环炔烃(化合物29)的0.94mm水溶液,室温下搅拌12小时。通过超滤(amicon ultra,10k mwco)对反应液进行水置换,停止反应。在通过esi-tofms测定质量时,曲妥珠单抗在148060观测到峰,(6-1-2)中合成的曲妥珠单抗的叠氮导入体在148489观测到峰,反应产物在导入2个肽而得到的150912观测到峰(图21)。
[1650]
(10-2-3)还原条件下的esi-tofms分析
[1651]
在(10-2-2)中合成的曲妥珠单抗-肽复合物的pbs溶液中加入2μl7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-肽复合物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-1)中合成的曲妥珠单抗的叠氮导入体在50714和50876观测到重链峰,在23440观测到轻链峰,曲妥珠单抗-肽复合物在向重链中导入肽而得到的51941和52102观测到峰,在与原料相同的23440观测到轻链峰(图22)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1652]
(10-3)曲妥珠单抗的位置特异性硫醇导入体与马来酰亚胺化合物的偶联和esi-tofms分析
[1653]
(10-3-1)曲妥珠单抗的位置特异性硫醇导入体与马来酰亚胺化合物的偶联和esi-tofms分析
[1654]
将实施例8的(8-3-1)中合成的曲妥珠单抗的硫醇导入体溶解于20mm pbs缓冲液使之达到0.3mm后,添加5摩尔当量的m-dpeg(注册商标)
24-mal,室温下搅拌12小时。通过超滤(amicon ultra,10k mwco)处理反应液。在通过esi-tofms测定质量时,曲妥珠单抗在14822观测到峰,(8-3-3)中合成的曲妥珠单抗的硫醇导入体在148243观测到峰,反应产物在导入2个m-dpeg(注册商标)
24-mal而得到的150880观测到峰(图23)。
[1655]
(10-3-2)还原条件下的esi-tofms分析
[1656]
在(10-3-1)中合成的曲妥珠单抗-peg复合物的pbs溶液中加入2μl7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-peg复合物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例8的(8-3-3)中合成的曲妥珠单抗的硫醇导入体在50682和50844观测到重链峰,在23449观测到轻链峰,反应产物在向重链中导入m-dpeg(注册商标)
24-mal而得到的51922和52083观测到峰,在与原料相同的23449观测到轻链峰(图24)。
[1657]
[实施例11:曲妥珠单抗的生物正交性官能团导入体的位置特异性修饰的确认]
[1658]
(11-1)曲妥珠单抗的生物正交性官能团导入体的糖链切割(11-1-1)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割(1)
[1659]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/191817)的方法,对实施例6的(6-1-2)中合成的曲妥珠单抗的叠氮苯甲酸导入体(叠氮修饰抗体3)进行糖链切割和后处理。
[1660]
(11-1-2)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割(2)
[1661]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/191817)的方法,对实施例6的(6-1-3)中合成的曲妥珠单抗的叠氮苯甲酸导入体(叠氮修饰抗体5)进行糖链切割和后处理。
[1662]
(11-1-3)曲妥珠单抗的马来酰亚胺导入体的糖链切割(3)(k246/248)
[1663]
在20摩尔当量的3-巯基丙酸存在下,使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例4的(4-5-1)中合成的曲妥珠单抗的马来酰亚胺导入体进行糖链切割和后处理。
[1664]
(11-1-4)曲妥珠单抗的烷基叠氮导入体的糖链切割(4)(k246/248)
[1665]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-1)中合成的曲妥珠单抗的烷基叠氮导入体(叠氮修饰抗体2)进行糖链切割和后处理。
[1666]
(11-1-5)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割(5)(k317)
[1667]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-3)中合成的曲妥珠单抗的叠氮苯甲酸导入体(叠氮修饰抗体6)进行糖链切割和后处理。
[1668]
(11-1-6)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割(6)(k288/290)
[1669]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-3)中合成的曲妥珠单抗的叠氮苯甲酸导入体(叠氮修饰抗体8)进行糖链切割和后处理。
[1670]
(11-1-7)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割(7)(k246/248)
[1671]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-3)中合成的曲妥珠单抗的叠氮苯甲酸导入体(叠氮修饰抗体10)进行糖链切割和后处理。
[1672]
(11-1-8)曲妥珠单抗的乙酰基保护硫醇导入体的糖链切割(8)(k246/248)
[1673]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例8的(8-1-3)中合成的曲妥珠单抗的乙酰基保护硫醇导入体进行糖链切割和后处理。
[1674]
(11-1-9)曲妥珠单抗的叠氮苯甲酸多个靶区导入体的糖链切割(9)
[1675]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例9的(9-1-3)中合成的曲妥珠单抗的叠氮苯甲酸多个靶区导入体进行糖链切割和后处理。
[1676]
(11-1-10)曲妥珠单抗的叠氮-硫醇多个靶区导入体的糖链切割(10)
[1677]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例9的(9-1-4)中合成的曲妥珠单抗的叠氮-硫醇多个靶区导入体进行糖链切割和后处理。
[1678]
(11-1-11)地诺单抗的叠氮苯甲酸多个靶区导入体的糖链切割(11)
[1679]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-4)中合成的地诺单抗的叠氮苯甲酸导入体(叠氮修饰抗体29)进行糖链切割和后处理。
[1680]
(11-1-12)度匹鲁单抗的叠氮苯甲酸多个靶区导入体的糖链切割(12)
[1681]
使用pngase f(new england biolabs,目录号p0704),按照制造商协议和日本专利(wo2017/19181757)的方法,对实施例6的(6-1-4)中合成的度匹鲁单抗的叠氮苯甲酸导入体(叠氮修饰抗体30)进行糖链切割和后处理。
[1682]
(11-2)曲妥珠单抗的叠氮苯甲酸导入体的胰蛋白酶处理
[1683]
(11-2-1)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(1)
[1684]
在1.5ml低吸附微型试管中添加(11-1-1)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的3.4μl样品溶液、6.6μl 50mm的碳酸氢铵缓冲液,总计10μl,加入50mm碳酸氢铵缓冲液、溶解于20%三氟乙醇的10μl 20mm的二硫苏糖醇水溶液,在65℃下加热1小时,之后添加10μl 50mm的碘乙酰胺水溶液,避光下于室温以300rpm振荡30分钟,使其反应。反应后,加入40μl 50mm的碳酸氢铵缓冲液进行搅拌,添加10μl 20ng/μl的胰蛋白酶水溶液,在37℃下酶消化18小时。消化后,添加2μl 20%的三氟乙酸水溶液,停止反应。之后,用50mm碳酸氢铵缓冲液、0.5%三氟乙酸稀释10倍,用于lc-ms/ms测定。
[1685]
(11-2-2)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(2)
[1686]
在1.5ml低吸附微型试管中加入(11-1-2)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液、50mm碳酸氢铵缓冲液、溶解于20%三氟乙醇的10μl 20mm的二硫苏糖醇水溶液,在65℃下加热1小时,之后添加10μl 50mm的碘乙酰胺水溶液,避光下于室温以300rpm振荡30分钟,使其反应。反应后,加入40μl 50mm的碳酸氢铵缓冲液进行搅拌,添加10μl 20ng/μl的胰蛋白酶水溶液,在37℃下酶消化18小时。消化后,添加2μl 20%的三氟乙酸水溶液,停止反应。之后,用50mm碳酸氢铵缓冲液、0.5%三氟乙酸稀释10倍,用于lc-ms/ms测定。
[1687]
(11-2-3)曲妥珠单抗的马来酰亚胺导入体的糖链切割物的胰蛋白酶处理(3)
[1688]
在1.5ml低吸附微型试管中加入(11-1-3)中得到的曲妥珠单抗的马来酰亚胺导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1689]
(11-2-4)曲妥珠单抗的烷基叠氮导入体的糖链切割物的胰蛋白酶处理(4)
[1690]
在1.5ml低吸附微型试管中加入(11-1-4)中得到的曲妥珠单抗的烷基叠氮导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1691]
(11-2-5)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(5)
[1692]
在1.5ml低吸附微型试管中加入(11-1-5)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1693]
(11-2-6)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(6)
[1694]
在1.5ml低吸附微型试管中加入(11-1-6)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1695]
(11-2-7)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(7)
[1696]
在1.5ml低吸附微型试管中加入(11-1-7)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1697]
(11-2-8)曲妥珠单抗的乙酰基硫醇导入体的糖链切割物的胰蛋白酶处理(8)
[1698]
在1.5ml低吸附微型试管中加入(11-1-8)中得到的曲妥珠单抗的乙酰基硫醇导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1699]
(11-2-9)曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(9)
[1700]
在1.5ml低吸附微型试管中加入(11-1-9)中得到的曲妥珠单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1701]
(11-2-10)曲妥珠单抗的乙酰基硫醇和叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(10)
[1702]
在1.5ml低吸附微型试管中加入(11-1-8)中得到的曲妥珠单抗的乙酰基硫醇和叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1703]
(11-2-11)地诺单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(11)
[1704]
在1.5ml低吸附微型试管中加入(11-1-11)中得到的地诺单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1705]
(11-2-12)度匹鲁单抗的叠氮苯甲酸导入体的糖链切割物的胰蛋白酶处理(12)
[1706]
在1.5ml低吸附微型试管中加入(11-1-12)中得到的度匹鲁单抗的叠氮苯甲酸导入体的糖链切割物的10μl样品溶液,进行与11-2-1同样的处理,得到了lc-ms/ms测定用样品。
[1707]
(11-3)曲妥珠单抗的lc-ms/ms测定条件
[1708]
(分析装置)
[1709]
纳米hplc:easy-nlc 1000(赛默飞世尔科技公司);
[1710]
质谱仪:tribrid质谱仪orbitrap fusion(赛默飞世尔科技公司);
[1711]
(hplc分析条件)
[1712]
捕获柱:acclaimpepmap(注册商标)100,75μm
×
2cm(赛默飞世尔科技公司);
[1713]
分析柱:esi-column(ntcc-360/75-3-125,75μm
×
12.5cm,3μm(日京technos));
[1714]
流动相a:0.1%甲酸水溶液;
[1715]
流动相b:0.1%甲酸、乙腈溶液;
[1716]
加载溶液:0.1%三氟乙酸水溶液;
[1717]
流速:300nl/分钟;
[1718]
样品注入量:0.3-1μl;
[1719]
梯度条件(b%):2%(0.0-0.5分钟)、2%
→
30%(0.5-23.5分钟)、30%
→
75%(23.5-25.5分钟)、75%(25.5-35.0分钟);
[1720]
(质谱仪分析条件)
[1721]
离子化法:esi,正离子模式;
[1722]
扫描类型:数据依赖性获取(data dependent aquisition);
[1723]
活化类型:碰撞诱导离解(collision induced dissociation,cid)。
[1724]
数据的获取使用作为附带软件的xcalibur 3.0(赛默飞世尔科技公司)和thermo orbitrap fusion tune application 2.0(赛默飞世尔科技公司)来进行。
[1725]
(11-4)曲妥珠单抗、地诺单抗和度匹鲁单抗的修饰位点的分析条件
[1726]
关于针对lc-ms/ms测定结果的修饰位点分析,使用biopharma finder 3.0(赛默飞世尔科技公司)来进行。
[1727]
在通过biopharma finder进行的分析中,设定成s/n threshold为1、ms噪音水平
为峰顶强度的0.01%来实施。另外,消化酶设定为胰蛋白酶,特异性设定为high。而且,峰检测时的质量公差为4ppm,肽鉴定时的质量精度为5ppm。在静态修饰中,作为基于碘乙酰胺的半胱氨酸残基的修饰,设定碳酰胺甲基(+57.021da)。关于动态修饰,设定了蛋氨酸的氧化(+15.995da)和对赖氨酸残基的修饰体(马来酰亚胺导入体(+219.090da)、附加有巯基丙酸的马来酰亚胺导入体(+325.098da)、烷基叠氮导入体(+139.075da)、烷基胺导入体(+113.084da)、叠氮苯甲酸导入体(+145.028da)、胺苯甲酸导入体(+119.037da)、乙酰基硫醇导入体(+130.009da)、接受了脲甲基化的乙酰基硫醇导入体(+145.020da))。另外,设定滤波器使置信度评分为80以上,仅为可观测到ms/ms的滤波器。
[1728]
需要说明的是,在消化时为了通过二硫苏糖醇和碘乙酰胺进行还原烷基化,烷基叠氮导入体的一部分被还原,成为烷基胺导入体,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体,乙酰基硫醇导入体接受脲甲基化。
[1729]
另外,作为修饰位点的检索对象的氨基酸序列的数据,关于曲妥珠单抗使用图25所示的(1)~(2),关于地诺单抗使用图26所示的(1)~(2),关于度匹鲁单抗使用图27所示的(1)~(2)。
[1730]
(11-5)消化物的基于lc-ms/ms的修饰位点的分析结果
[1731]
(11-5-1)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(1)
[1732]
作为使用lc-ms/ms的分析的结果,观测了(11-2-1)中得到的曲妥珠单抗叠氮修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸33个残基构成的肽、thtcppcpapellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱(实测值:m/z 945.73328、理论值:945.73350、四价)(图29),由cid谱确认到:显示重链的eunumbering中的246位或248位的赖氨酸残基的修饰的相当于二价y19的m/z 1125.49(理论值:1125.11)的产物离子(图30)。
[1733]
(11-5-2)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(2)
[1734]
作为使用lc-ms/ms的分析的结果,观测了(11-2-2)中得到的曲妥珠单抗叠氮修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸18个残基构成的肽、fnwyvdgvevhnaktkpr(seq id no:12)的肽片段的ms谱(实测值:m/z 760.38287、理论值:760.38390、3价)(图29),由cid谱确认到:显示重链的eu numbering中的288位或290位的赖氨酸残基的修饰的相当于二价y16的m/z 1009.83(理论值:1009.52)的产物离子(图32)。(11-5-3)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(3)
[1735]
作为使用lc-ms/ms的分析的结果,观测了(11-2-3)中得到的曲妥珠单抗马来酰亚胺mpa修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(附加巯基丙酸的马来酰亚胺导入体(+325.098da))的由氨基酸33个残基构成的肽、thtcppcpapellggpsvflfppkpkd tlmisr(seq id no:11)的肽片段的ms谱(实测值:m/z 997.24986、理论值:997.24908、四价)(图33),由cid谱确认到:显示重链的eu numbering中的246位或248位的赖氨酸残基的修饰的相当于二价y20的m/z 1256.96(理论值:1256.65)的产物离子(图34)。
[1736]
由该结果可知:在上述(11-2-3)中,在抗体的重链上位置选择性地对eunumbering中的lys246和lys248进行偶联。
[1737]
(11-5-4)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(4)
[1738]
作为使用lc-ms/ms的分析的结果,观测了(11-2-4)中得到的曲妥珠单抗烷基叠氮修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(烷基叠氮导入体(+139.075da))的由氨基酸33个残基构成的肽、thtcppcpapellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱(实测值:m/z 950.74263、理论值:950.74313、四价)(图35),由cid谱确认到:显示重链的eu numbering中的246位或248位的赖氨酸残基的修饰的相当于二价y20的m/z 1163.92(理论值:1163.64)的产物离子(图36)。
[1739]
由该结果可知:在上述(11-2-4)中,在抗体的重链上位置选择性地对eunumbering中的lys246和lys248进行偶联。
[1740]
(11-5-5)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(5)
[1741]
作为使用lc-ms/ms的分析的结果,观测了(11-2-5)中得到的曲妥珠单抗叠氮苯甲酸修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸19个残基构成的肽、vvsvltvlhqdwlngkeyk(seq id no:101)的肽片段的ms谱(实测值:m/z 783.08731、理论值:783.08690、3价)(图37),由cid谱确认到:显示重链的eunumbering中的317位的赖氨酸残基的修饰的相当于二价y17的m/z 1075.31(理论值:1075.06)的产物离子(图38)。另外,通过biopharma finder中的分析,显示了高度选择性地发生对317位的赖氨酸残基的修饰(图39)。
[1742]
由该结果可知:在上述(11-2-5)中,在抗体的重链上eu numbering中的lys317中位置选择性地进行偶联。
[1743]
(11-5-6)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(6)
[1744]
作为使用lc-ms/ms的分析的结果,观测了(11-2-6)中得到的曲妥珠单抗叠氮苯甲酸修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸18个残基构成的肽、fnwyvdgvevhnaktkpr(seq id no:12)的肽片段的ms谱(实测值:m/z 570.54026、理论值:570.53991、四价)(图40),由cid谱确认到:显示重链的eu numbering中的288位或290位的赖氨酸残基的修饰的相当于三价y16的m/z 673.48(理论值:673.35)的产物离子(图41)。另外,通过biopharma finder中的分析,显示了高度选择性地发生对288位或290位的赖氨酸残基的修饰(图42)。
[1745]
由该结果可知:在上述(11-2-6)中,在抗体的重链上位置选择性地对eunumbering中的lys288和lys290进行偶联。
[1746]
(11-5-7)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(7)
[1747]
作为使用lc-ms/ms的分析的结果,观测了(11-2-7)中得到的曲妥珠单抗叠氮苯甲酸修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸33个残基构成的肽、thtcppcpapellggpsvflfppkpkdtlmisr(seq id no:11)的肽片段的ms谱(实测值:m/z 945.73501、理论值:945.73376、四价)(图43),由cid谱确认到:显示重链的eunumbering中的246位或248位的赖氨酸残基的修饰的相当于二价y20的m/z 1153.87(理论值:1153.62)的产物离子(图44)。另外,通过biopharma finder中的分析,显示了高度选择性地发生对246位或248位的赖氨酸残基的修饰(图45)。
[1748]
由该结果可知:在上述(11-2-7)中,在抗体的重链上位置选择性地对eunumbering中的lys246和lys248进行偶联。
numbering中的lys246或lys248、以及lys288或lys290进行偶联。
[1757]
(11-5-11)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(11)
[1758]
作为使用lc-ms/ms的分析的结果,观测了(11-2-11)中得到的地诺单抗叠氮苯甲酸修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸33个残基构成的肽、ccvecppcpappvagpsvflfppkpkdtlmisr(seq id no:102)的肽片段的ms谱(实测值:m/z 961.72078、理论值:961.71980、四价)(图58),由cid谱确认到:显示重链序列中的编号(即,以n末的氨基酸为第1位。下同)中的247位或249位的赖氨酸残基的修饰的相当于三价y23的m/z 872.08(理论值:871.81)的产物离子(图59)。另外,通过biopharma finder中的分析,显示了高度选择性地发生对247位或249位的赖氨酸残基的修饰(图60)。
[1759]
由该结果可知:在上述(11-2-11)中,在抗体的重链上位置选择性地对序列中的编号中的lys247或lys249进行偶联。
[1760]
(11-5-12)胰蛋白酶消化物的基于lc-ms/ms的修饰位点的分析结果(12)
[1761]
使用lc-ms/ms的分析的结果,观测了(11-2-12)中得到的度匹鲁单抗叠氮苯甲酸修饰体的采用胰蛋白酶消化的包含对赖氨酸残基的修饰位点(胺苯甲酸导入体(+119.037da))的由氨基酸34个残基构成的肽、ygppcppcpapeflggpsvflfppkpkdtlmisr(seq id no:103)的肽片段的ms谱(实测值:m/z 972.99064、理论值:972.98886、四价)(图61),由cid谱确认到:显示重链序列中的编号中的251位或253位的赖氨酸残基的修饰的相当于三价y29的m/z 1105.98(理论值:1105.58)的产物离子(图62)。另外,通过biopharma finder中的分析,显示了高度选择性地发生对251位或253位的赖氨酸残基的修饰(图63)。
[1762]
由该结果可知:在上述(11-2-12)中,在抗体的重链上位置选择性地对序列中的编号中的lys251或lys253进行偶联。
[1763]
[实施例12:4种抗体药物复合物(adc)、曲妥珠单抗-dm1和曲妥珠单抗-mmae、以及利妥昔单抗-dm1和利妥昔单抗-mmae的合成]
[1764]
(12-1)曲妥珠单抗的位置特异性叠氮导入体与dbco-dm1的偶联
[1765]
(12-1-1)位置选择性的曲妥珠单抗-dm1偶联物的合成
[1766]
将实施例6的(6-1-2)中合成的曲妥珠单抗的0.9mg叠氮苯甲酸导入体(叠氮抗体3)溶解于473μl 100mm的pbs、10mm edta缓冲液中,之后添加2μl将51μl n,n
’-
二甲基乙酰胺和dbco-dm1(abzena公司制造、化合物87)溶解于n,n
’-
二甲基乙酰胺使达到4mm而得到的溶液,在25℃下搅拌16小时。反应后,通过nap-5柱提取,去除dm1。
[1767]
[化学式116]
[1768][1769]
(12-1-2)基于esi-tofms的平均dar的计算
[1770]
esi-tofms使用安捷伦公司制造的agilent 6550coupled to agilent 1290uplc with dad detector,autosampler cooling and thermostatted column compartment。软件使用masshunter,计算出dar。产物在导入有2个dm1的150531和导入有1个dm1的149827观测到峰,计算出平均dar为1.8(图64)。
[1771]
(12-1-3)还原条件下的esi-tofms分析
[1772]
在(12-1-1)中合成的曲妥珠单抗-dm1偶联物的pbs溶液中加入2μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-dm1偶联物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-1)中合成的曲妥珠单抗的叠氮导入体在50715和50877观测到重链峰,在23440观测到轻链峰,曲妥珠单抗-dm1偶联物在向重链中导入dm1而得到的51748和519097观察到峰,在与原料相同的23440观测到轻链峰(图65)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1773]
(12-2)曲妥珠单抗的位置特异性叠氮导入体与dbco-mmae的偶联
[1774]
(12-2-1)位置选择性的曲妥珠单抗-mmae偶联物的合成
[1775]
利用与实施例12的(12-1-1)同样的方法,使实施例6的(6-1-2)中合成的曲妥珠单抗的0.5mg叠氮苯甲酸导入体(叠氮抗体3)与dbco-mmae(abzena公司制造、化合物88)反应。反应后,通过nap-5柱提取,去除dbco-mmae。
[1776]
[化学式117]
[1777][1778]
(12-2-2)基于esi-tofms的平均dar的计算
[1779]
利用与实施例12的(12-1-2)同样的方法计算出dar。产物在导入有2个mmae的151336和导入有1个mmae的149972观测到峰,计算出平均dar为1.8(图66)。
[1780]
(12-2-3)还原条件下的esi-tofms分析
[1781]
在(12-2-1)中合成的曲妥珠单抗-mmae偶联物的pbs溶液中加入2μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-dm1偶联物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-1)中合成的曲妥珠单抗的叠氮导入体在50715和50877观测到重链峰,在23440观测到轻链峰,曲妥珠单抗-mmae偶联物在向重链中导入mmae而得到的52154和52316观察到峰,在与原料相同的23440观测到轻链峰(图67)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1782]
(12-3)利妥昔单抗的位置特异性叠氮导入体与dbco-dm1的偶联
[1783]
(12-3-1)位置选择性的利妥昔单抗-dm1偶联物的合成
[1784]
利用与实施例12的(12-1-1)同样的方法,使实施例6的(6-1-4)中合成的利妥昔单抗的叠氮苯甲酸导入体(叠氮修饰抗体101)与dbco-dm1(abzena公司制造、化合物87)反应。反应后,通过nap-5柱提取,去除dbco-dm1。
[1785]
(12-3-2)基于esi-tofms的平均dar的计算
[1786]
利用与实施例12的(12-1-2)同样的方法计算出dar。产物在导入有2个dm1的149549和导入有1个dm1的148845观测到峰,计算出平均dar为1.8(图68)。
[1787]
(12-3-3)还原条件下的esi-tofms分析
[1788]
在(12-3-1)中合成的利妥昔单抗-dm1偶联物的pbs溶液中加入2μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于曲妥珠单抗-dm1偶联物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-4)中合成的利妥昔单抗的叠氮导入体在50635和50797观测到重链峰,在23040观测到轻链峰,利妥昔单抗-dm1偶联物在向重链中导入dm1而得到的51668和51831观察到峰,在与原料相同的23040观测到轻链峰(图69)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1789]
(12-4)利妥昔单抗的位置特异性叠氮导入体与dbco-mmae的偶联
[1790]
(12-4-1)位置选择性的利妥昔单抗-mmae偶联物的合成
[1791]
利用与实施例12的(12-1-1)同样的方法,使实施例6的(6-1-4)中合成的利妥昔单抗的叠氮苯甲酸导入体(叠氮修饰抗体101)与dbco-mmae(abzena公司制造、化合物88)反
应。反应后,通过nap-5柱提取,去除dbco-mmae。
[1792]
(12-4-2)基于esi-tofms的平均dar的计算
[1793]
利用与实施例12的(12-2)同样的方法计算出dar。产物在导入有2个mmae的150354和导入有1个mmae的148994观测到峰,计算出平均dar为1.6(图70)。
[1794]
(12-4-3)还原条件下的esi-tofms分析
[1795]
在(12-4-1)中合成的利妥昔单抗-mmae偶联物的pbs溶液中加入2μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于利妥昔单抗-mmae偶联物为100等量),在室温下搅拌20分钟。在通过esi-tofms测定质量时,作为原料的实施例6的(6-1-4)中合成的利妥昔单抗的叠氮导入体在50635和50797观测到重链峰,在23040观测到轻链峰,利妥昔单抗-mmae偶联物在向重链中导入mmae而得到的52071和52233观察到峰,在与原料相同的23040观测到轻链峰(图71)。需要说明的是,通过测定前处理的7mm三(2-羧乙基)膦盐的还原反应,叠氮苯甲酸导入体被还原,成为胺苯甲酸导入体。
[1796]
[实施例13:使用搭載有效负载模型的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入和基于esi-tofms的分析]
[1797]
(13-1)搭載有效负载模型的igg1 fc亲和性肽试剂的合成
[1798]
(13-1-1)搭載有效负载模型的igg1 fc亲和性肽试剂(化合物89)的合成
[1799]
将实施例1中合成的抗体亲和性肽(化合物36)溶解于二甲基亚砜,加入10摩尔当量的2-亚氨基硫烷盐酸盐、15摩尔当量的二异丙基乙胺,搅拌1小时。通过lc-ms确认原料消失后,加入20摩尔当量的n-羟基马来酰亚胺的二甲基亚砜溶液,搅拌1小时。通过lc-ms确认反应进行后,加入40摩尔当量的fmoc-n-酰胺基-dpeg12酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束后,通过制备hplc进行纯化。通过esi-ms确认包含目标物的级分后冷冻干燥,得到了作为产物的fmoc-n-酰胺基-dpeg12-亲和性肽试剂(化合物89))。
[1800]
[化学式118]
[1801][1802]
(肽部分的氨基酸序列seq id no:46)
[1803]
ms(esi)m/z:z=2 1563[m+2h]
2+
,3 1043[m+3h]
3+
[1804]
(13-1-2)搭載有效负载模型的igg1 fc亲和性肽试剂(化合物90)的合成
[1805]
与实施例(13-1-1)同样的操作,得到了生物素-亲和性肽试剂(化合物90)。
[1806]
[化学式119]
[1807][1808]
(肽部分的氨基酸序列seq id no:46)
[1809]
ms(esi)m/z:z=2 1563[m+2h]
2+
,z=3 1043[m+3h]
3+
[1810]
(13-2)使用搭載有效负载模型的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入和esi-tofms分析
[1811]
(13-2-1)使用搭載有效负载模型dpeg12的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入和esi-tofms分析
[1812]
将(13-1-1)中合成的搭载有有效负载模型的亲和性肽试剂(化合物89)溶解于n,n
’-
二甲基甲酰胺使之达到2.0mm。将200μg抗her2 igg抗体曲妥珠单抗(中外制药)溶解于200μl 50mm的hepes缓冲液(ph7.2),相对于抗体加入20摩尔当量的2.0mm的肽试剂,在25度下搅拌3小时。通过超滤(amicon ultra,10kmwco)浓缩反应液,从而得到了igg抗体有效负载模型dpeg12导入体。
[1813]
在通过esi-tofms测定质量时,曲妥珠单抗在148061观测到峰,反应产物在导入有两个fmoc-dpeg12的149867观测到峰。
[1814]
(13-2-2)使用搭載有效负载模型dpeg12的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入和esi-tofms分析
[1815]
使用(13-1-2)中合成的搭載有有效负载模型的亲和性肽试剂(化合物90),进行与(13-2-1)同样的研究,得到了igg抗体有效负载模型生物素导入体。
[1816]
(13-3)基于还原条件下的esi-tofms的使用搭載有效负载模型的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入的分析
[1817]
(13-3-1)基于还原条件下的esi-tofms的使用搭載有效负载模型dpeg12的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入的分析
[1818]
向(13-2-1)中合成的曲妥珠单抗-有效负载模型中加入2.0μl 7mm的三(2-羧乙基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入fmoc-dpeg12而得到的51425、51584和与原料相同的23443观测到轻链峰。
[1819]
(13-3-2)基于还原条件下的esi-tofms的使用搭載有效负载模型生物素的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载模型导入的分析
[1820]
向(13-2-2)中合成的曲妥珠单抗-有效负载模型中加入2.0μl 7mm的三(2-羧乙
基)膦盐酸盐溶液(相对于抗体为100等量),在室温下放置20分钟。在通过esi-tofms测定质量时,用作对照的原料的曲妥珠单抗在50596、50757观测到重链峰,在23439观测到轻链峰。反应产物在向重链中导入生物素而得到的50820、50982和与原料相同的23439观测到轻链峰。
[1821]
[实施例14:使用搭載有效负载的igg1 fc亲和性肽试剂的igg1 fc的位置特异性有效负载导入和基于esi-tofms的分析]
[1822]
(14-1)搭載mmae的igg1 fc亲和性肽试剂(化合物91)的合成
[1823]
将实施例5中合成的fc亲和性肽试剂(化合物66)溶解于n,n
’-
二甲基甲酰胺使之达到0.22mm。加入dbco-mmae(abzena公司制造、化合物91),在25度下搅拌16小时。通过lc-ms确认原料消失,得到了作为产物的搭載mmae的fc亲和性肽试剂。
[1824]
[化学式120]
[1825][1826]
(肽部分的氨基酸序列seq id no:46)
[1827]
ms(esi)m/z:z=2 1930[m+2h]
2+
,z=3 1287[m+3h]3
+
[1828]
(14-2)使用搭載mmae的igg1 fc亲和性肽试剂的igg1 fc位置选择性曲妥珠单抗-mmae偶联物的合成和esi-tofms分析
[1829]
使用200μg抗her2 igg抗体曲妥珠单抗(中外制药),利用(14-1)中合成的搭載mmae的fc亲和性肽试剂(化合物91)和与实施例13的(13-2)同样的方法使之反应。通过超滤(amicon ultra,10k mwco)浓缩反应液,从而得到了位置选择性的曲妥珠单抗-mmae偶联物。
[1830]
其结果,在通过esi-tofms测定质量时,观测到导入有2个mmae的151336和导入有1个mmae的149972的峰。
[1831]
[实施例15:使用具有来自谷氨酸残基的接头的igg1 fc亲和性肽试剂的igg1 fc的位置特异性修饰和基于esi-tofms的分析]
[1832]
(15-1)针对抗体的亲和性肽的合成
[1833]
利用(1-1)所示的方法,合成、获取了化合物92。
[1834]
[化学式121]
[1835]
[1836]
(肽部分的氨基酸序列seq id no:108)
[1837]
ms(esi)m/z:z=2 1046.4[m+2h]
2+
,z=3 698.3[m+3h]
3+
[1838]
(15-2)使用叠氮试剂和亲和性肽连接的抗体修饰试剂的合成
[1839]
将(15-1)中合成的抗体亲和性肽溶解于二甲基亚砜,加入40摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、40摩尔当量的1-羟基苯并三唑进行搅拌。向其中加入40摩尔当量的2-氨基乙醇溶液和1摩尔当量的三乙胺,在室温下搅拌1小时。测定lc-ms后,通过反相hplc进行分离纯化。通过ms确认各级分,将包含目标物的级分冷冻干燥。将所得化合物溶解于二甲基亚砜,加入1摩尔当量的三乙胺和1.2摩尔当量的n-羟基马来酰亚胺,在室温下搅拌1小时,进行lc-ms测定,确认反应的进行。加入40摩尔当量的4-叠氮苯甲酸、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束,之后通过制备hplc进行纯化。通过esi-ms确认包含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-苯基-亲和性肽试剂(化合物93)。
[1840]
[化学式122]
[1841][1842]
(肽部分的氨基酸序列seq id no:108)
[1843]
ms(esi)m/z:z=2 1204.3[m+2h]
2+
,z=3 803.3[m+3h]
3+
[1844]
(15-3)使用亲和性肽试剂(化合物93)的抗体修饰反应
[1845]
使用(15-2)中合成的搭载有叠氮的亲和性肽(化合物93),按照(6-1-3)所示的方法进行反应,得到了igg抗体曲妥珠单抗-叠氮修饰抗体。
[1846]
(15-4)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮修饰抗体的重链选择性进行确认
[1847]
按照实施例6的(6-2-3)所示的方法对(15-3)中得到的曲妥珠单抗-叠氮修饰体进行还原、esi-tofms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50725、50885和23446观测到轻链峰。
[1848]
[实施例16:使用以巯基乙酸酯作为离去基团的igg1 fc亲和性肽试剂的igg1 fc的位置特异性修饰和基于esi-tofms的分析]
[1849]
(16-1)以巯基乙酸酯作为离去基团的接头(化合物95)的合成
[1850]
将二硫代二乙醇酸溶解于二氯甲烷,加入2.2摩尔当量的甘氨酸叔丁酯、4.8摩尔当量的n,n-二异丙胺、2.4摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐,搅拌1小时。将反应液用水进行分液洗涤后,减压下浓缩所得的有机层。用n,n-二甲基甲酰胺/水(1:1)溶解所得的残余物,加入1.3摩尔当量的三(2-羧乙基)膦盐酸盐,在室温下搅拌
1小时。用乙酸乙酯提取后减压浓缩,用乙酸乙酯/己烷进行硅胶柱处理,得到了化合物94。
[1851]
[化学式123]
[1852][1853]
ms(esi)[2m+h]
+
=411,[m-h]-=204
[1854]
将化合物94溶解于二氯甲烷,加入1摩尔当量的4-叠氮苯甲酸、1.2摩尔当量的1h-苯并三唑-1-基氧基三吡咯烷基磷鎓六氟磷酸盐、1.5摩尔当量的n,n-二异丙基乙胺,在室温下搅拌30分钟。将反应液用硅胶柱进行纯化,之后将所得的白色晶体溶解于二氯甲烷/三氟乙酸(1:1),在室温下搅拌1小时。将反应液冷冻干燥,得到了以巯基乙酸酯作为离去基团的接头(化合物95)。
[1855]
[化学式124]
[1856][1857]
ms(esi)m/z:z=1 295[m+h]
1+
[1858]
(16-2)使用叠氮试剂和亲和性肽连接的抗体修饰试剂的合成
[1859]
在(1-1)中合成的抗体亲和性肽(化合物36)中加入40摩尔当量的(16-1)中合成的接头(化合物95)、32摩尔当量的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、32摩尔当量的1-羟基苯并三唑,搅拌2小时。通过lc-ms确认反应结束,之后通过制备hplc进行纯化。通过esi-ms确认包含目标物的级分后进行冷冻干燥,得到了作为产物的叠氮-苯基-亲和性肽试剂(化合物96)。
[1860]
[化学式125]
[1861][1862][1863]
(肽部分的氨基酸序列seq id no:46)
[1864]
ms(esi)m/z:z=2 1183.3[m+2h]
2+
,z=3 789.2[m+3h]
3+
[1865]
(16-3)使用了亲和性肽试剂(化合物96)的抗体修饰反应
[1866]
使用(16-2)中合成的搭载有叠氮的亲和性肽(化合物96),按照(6-1-3)所示的方法进行反应,得到了igg抗体曲妥珠单抗-叠氮修饰抗体。
[1867]
(16-4)基于还原条件下的esi-tofms分析对igg抗体曲妥珠单抗-叠氮修饰抗体的重链选择性进行确认
[1868]
按照实施例6的(6-2-3)所示的方法对(16-3)中得到的曲妥珠单抗-叠氮修饰体进行还原、esi-tofms分析。用作对照的原料的曲妥珠单抗在50602、50764观测到重链峰,在23443观测到轻链峰。反应产物在向重链中导入胺苯甲酸而得到的50720、50882和与原料相同的23443观测到轻链峰。
[1869]
(总结)
[1870]
汇总以上的结果,实施例中使用的亲和性肽的氨基酸序列、以及可使用实施例中制备的化合物进行制备的具有生物正交性官能团的抗体的概要如下。
[1871]
[表1]
[1872]
表1.亲和性肽的汇总
[1873]
氨基酸序列seq id nofnmqqqrrfyealhdpnlneeqrnarirsikdd5fnmqqqrrfyealhdpnlneeqrnariksirdd6β-ala-nmqqqrrfyealhdpnlneeqrnarirsirdd7fnmqqqrrfyealhdpnlneeqrnakiksikdd8fnmqcqrrfyealhdpnlnkeqrnarirsirddc41fnmqcqrrfyealhdpnlneeqrnarirsikddc42fnkqcqrrfyealhdpnlneeqrnarirsirddc43β-ala-nmqqqrrfyealhdpnleeqrnarirsi97fnmqqqrrfyealhdpnlnkeqrnarirsirdd98β-ala-nmqqqrrfyealhdpnleeqrnarirsikdd100
ꢀꢀ
rgncayhkgqiiwctyh46rgncayhkgqivwctyh47rgncayhkgqvvwctyh48rgncayhkgqavwctyh49rgncayhkgqllwctyh50rgncayhkgqliwctyh51dcayhkgqivwct52dcayhkgqvvwct53rgncayhksqiiwctyh55rgncayhkdqiiwctyh57rgncayhkeqiiwctyh59rgncayhkhqiiwctyh63rgncayhkgqevwctyh71cayhkgqlvwc72rgncayhksqlvwctyh77rgncayhkqqlvwctyh81rgncayhkeqlvwctyh82gncayhkgqiiwctyh99
rgncayhegqiiwctyh108
[1874]
还显示出:可对抗体进行以下述氨基酸残基为代表的特定氨基酸残基的位置选择性修饰:
[1875]
(1)246位和/或248位的赖氨酸残基
[1876]
例如参照关于曲妥珠单抗的246位和/或248位的赖氨酸残基的修饰的实施例11(11-5-1)、(11-5-3)、(11-5-4)、(11-5-7)、(11-5-8)、(11-5-9)和(11-5-10)、关于地诺单抗的247位和/或249位的赖氨酸残基(相当于eu numbering中的人igg的246位和/或248位的赖氨酸残基)的修饰的实施例11(11-5-11)、以及关于度匹鲁单抗的251位和/或253位的赖氨酸残基(相当于eu numbering中的人igg的246位和/或248位的赖氨酸残基)的修饰的实施例11(11-5-12);
[1877]
(2)288位和/或290位的赖氨酸残基
[1878]
例如参照实施例11(11-5-2)、(11-5-6)、(11-5-9)、和(11-5-10);
[1879]
(3)317位的赖氨酸残基
[1880]
例如参照实施例11(11-5-5)。
[1881]
再列举一部分实施例为例,对下述式(i)所表示的具有针对抗体的亲和性物质和生物正交性官能团的化合物进行说明,见以下的表2和表3的汇总。
[1882]
a-l-e-b
ꢀꢀꢀꢀꢀꢀ
(i)
[1883]
[式中,
[1884]
a为针对抗体的亲和性物质,
[1885]
l为包含离去基团的二价基团,
[1886]
e为包含亲电子基团的二价基团,所述亲电子基团为:(i)与上述离去基团连接、并且(ii)具有与上述抗体中的亲核基团进行反应的能力,
[1887]
b为生物正交性官能团,
[1888]
上述离去基团具有通过上述亲核基团与上述亲电子基团之间的反应而从e上切割并脱离的能力。]。
[1889]
[表2]
[1890]
表2.具有针对抗体的亲和性物质和生物正交性官能团的化合物与可由其制备的具有生物正交性官能团的抗体的关系(其一)
[1891][1892]
*从抗体延伸的nh-烷基部分来自抗体的赖氨酸残基侧链(下同)
[1893]
[表3]
[1894]
表3.具有针对抗体的亲和性物质和生物正交性官能团的化合物与可由其制备的具有生物正交性官能团的抗体的关系(其二)(抽取一部分)
[1895][1896]
[表4]
[1897]
表4.具有针对抗体的亲和性物质和生物正交性官能团的化合物与可由其制备的具有生物正交性官能团的抗体的关系(其三)(抽取一部分)
[1898][1899]
[表5]
[1900]
表5.具有针对抗体的亲和性物质和生物正交性官能团的化合物与可由其制备的具有生物正交性官能团的抗体的关系(其四)(抽取一部分)
[1901][1902]
[表6]
[1903]
表6.具有针对抗体的亲和性物质和生物正交性官能团的化合物与可由其制备的具有生物正交性官能团的抗体的关系(其五)(抽取一部分)
[1904][1905]
根据以上内容显示出:在具有针对抗体的亲和性物质、切割性部分和反应性基团的化合物中,通过适当调节亲和性物质的种类、亲和性物质与反应性基团之间的接头的长度、以及接头所导入的亲和性物质中的位置等因素,可位置选择性地修饰抗体。
[1906]
产业实用性
[1907]
本发明例如可用于位置选择性修饰的抗体的制备。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1