色甘酸钠和α-乳糖的粉末化制剂的制作方法
the mechanism underlying late
‑
onset alzheimer disease),nature reviews neurology(2013)1月,9(1):25
‑
34)。阿尔茨海默氏病具有慢性神经炎性成分,其特征是存在与淀粉样斑块相关的大量小胶质细胞。(heneka等人,“pparγ激动剂吡格列酮和布洛芬的急性治疗可降低appv717i转基因小鼠的神经胶质炎症和aβ1
‑
42水平”(acute treatment with the pparγagonist pioglitazone and ibuprofen reduces glial inflammation and abeta1
–
42levels in appv717i transgenic mice)”brain(2005)128,1442
‑
1453;imbimbo等人,“nsaid是否可用于治疗阿尔茨海默氏病或轻度认知障碍”(are nsaids useful to treat alzheimer’s disease or mild cognitive impairment),front.aging neurosci(2010)2(文章19),1
‑
14)。这些吞噬淀粉样低聚物的表达环氧合酶(cox1/cox2)的小胶质细胞被激活以分泌促炎性细胞因子。(hoozemans等,“舒缓发炎的大脑:非甾体类抗炎药对阿尔茨海默氏病病理的影响(soothing the inflamed brain:effect of non
‑
steroidal anti
‑
inflammatory drugs on alzheimer’s disease pathology)”,《中枢神经系统和神经系统疾病
‑
药物靶向(cns&neurological disorders
–
drug targets)》(2011)10,57
‑
67;griffin ts.,“什么导致了阿尔茨海默?(what causes alzheimer’s?)”the scientist(2011)25,36
‑
40;krstic 2013)。这种神经炎症反应还能促进通过血脑屏障(bbb)的局部血管渗漏。zlokovic(zlokovic b.,“阿尔茨海默氏病和其他疾病的神经变性神经血管途径”(neurovascular pathways to neurodegeneration in alzheimer’s disease and other disorders),nature reviews neurosci.(2011)12,723
‑
738)涉及通过调节γ分泌酶活性来进一步驱动异常aβ肽40和42的产生(yan等人,“抗炎药治疗改变了阿尔茨海默氏病动物模型中的β淀粉样蛋白加工和沉积”(anti
‑
inflammatory drug therapy altersβ
‑
amyloid processing and deposition in an animal model of alzheimer’s disease),j.neurosci.(2003)23,7504
‑
7509;karran 2011),并对成年大脑海马神经发生有害(gaparini等,“阿尔茨海默氏病中的非甾体类抗炎药(nsaids):新旧作用机制”(non
‑
steroidal anti
‑
inflammatory drugs(nsaids)in alzheimer’s disease:old and new mechanisms of action),j.neurochem(2004)91,521
‑
536)。因此,神经炎症与淀粉样蛋白低聚物介导的神经元中毒相结合,形成了一个循环,该循环导致进行性神经功能障碍和神经元细胞死亡扩散到患有ad的对象的整个大脑中。
7.多种流行病学研究的令人信服的证据表明,长期服用非甾体类抗炎药(nsaids)可以显著降低老年人的ad风险,包括延缓疾病发作,减轻症状严重程度和减缓认知能力下降。(veld等人,“非甾体类抗炎药和阿尔茨海默氏病的风险”(nonsteroidal anti
‑
inflammatory drugs and the risk of alzheimer’s disease),n.engl.j.med(2001)345,1515
‑
1521;etminan等人,“非甾体抗炎药对阿尔茨海默氏病风险的作用:观察性研究的系统综述和荟萃分析”(effect of non
‑
steroidal anti
‑
inflammatory drugs on risk of alzheimer’s disease:systematic review and meta
‑
analysis of observational studies),brit.med.journal(2003)327,1
‑
5;imbimbo,2010)。对于nsaid如何抑制促成ad进展的过程,已提出了三种机制:i)通过抑制cox活性来减少或预防大脑中的小胶质细胞的活化和细胞因子产生(mackenzie等,“非甾体抗炎药的使用和老年痴呆症的病理类型”(nonsteroidal anti
‑
inflammatory drug use and alzheimer
‑
type pathology in aging),neurology(1998)50,986
‑
990;alafuzoff等,“定期使用非甾体类抗炎药可降低阿
尔茨海默氏病患者的星形胶质细胞和活化的小胶质细胞数量”(lower counts of astroglia and activated microglia in patients with alzheimer’s disease with regular use of non
‑
steroidal anti
‑
inflammatory drugs),j.alz.dis.(2000)2,37
‑
46;yan,2003;gasparini,2004;imbimbo,2010);ii)通过减少淀粉样蛋白沉积(weggen等,“一部分的nsaid降低淀粉样蛋白的aβ42而与环氧合酶活性无关”(a subset of nsaids lower amyloidogenic abeta42independently of cyclooxygenase activity),nature(2001)414,212
‑
216;yan,2003;imbimbo,2010);或iii)通过阻断突触中cox介导的前列腺素e2应答(kotilinek等,“环氧合酶2抑制可改善淀粉样β蛋白介导的记忆力和突触可塑性的抑制”(cyclooxygenase
‑
2inhibition improves amyloid
‑
β
‑
mediated suppression of memory and synaptic plasticity),brain(2008)131,651
‑
664。
8.因此,预计nsaid可通过几种机制来抑制神经炎性反应并影响ad的进展。当与抑制aβ寡聚化的药物一起给药时,提出了联合治疗范例以减轻导致神经变性和神经元死亡的多种触发因素。如果ad在很早的阶段就停止了发展,由于海马神经元的可塑性和神经发生,认知能力的下降可能会逆转(kohman等人,“神经发生,炎症和行为”(neurogenesis,inflammation and behavior),《大脑,行为和免疫》,2013年,第27、22
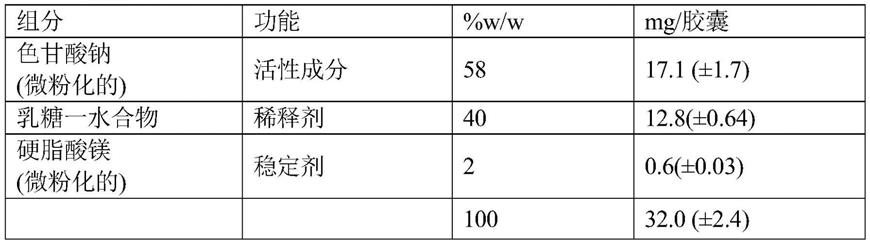
‑
32页)。
技术实现要素:
9.本发明涉及一种组合物,该组合物包含以下组分、基本上由以下组分组成或由以下组分组成:色甘酸钠,α
‑
乳糖和脂肪酸盐,其中,色甘酸钠、α
‑
乳糖和脂肪酸盐经微粉化,以及其中,α
‑
乳糖的粒度分布d
90
为45
‑
70μm,d
50
为10
‑
35μm,d
10
为2
‑
13μm。
10.本发明涉及一种在需要的对象中治疗选自阿尔茨海默氏病,淀粉样变性相关疾病(aac),创伤性脑损伤,亨廷顿氏病,动脉粥样硬化,细胞因子释放综合征(crs),痴呆,头部创伤,感染,神经炎症,朊病毒病,中风,肌萎缩性侧索硬化症(als),帕金森氏病和哮喘的病症的方法,包括给予给予一种组合物,该组合物包含以下组分、或基本上由以下组分组成或由以下组分组成:色甘酸钠,α
‑
乳糖和脂肪酸盐,其中,将色甘酸钠、α
‑
乳糖和脂肪酸盐微粉化,以及其中,α
‑
乳糖的粒度分布d
90
为45
‑
70μm,d
50
为10
‑
35μm,d
10
为2
‑
13μm。
具体实施方式
11.本发明涉及用于吸入递送的组合物。本发明结合了至少两种赋形剂和活性成分的粉末形式,用于通过吸入给药。该组合物可以用于制剂中,以使活性成分能够增强递送至深肺区域,从而提高血浆中活性成分的生物利用度以及通过血脑屏障的吸收,用于治疗神经疾病。目前公开的组合物能够达到足以用于神经学治疗的血浆中活性成分的生物利用度水平,而该活性成分的其他现有制剂被设计为仅用于治疗呼吸道。
12.本发明还涉及用于吸入剂型的组合物,其包含以下组分:色甘酸钠,α
‑
乳糖和镁盐。优选地,镁盐是硬脂酸镁。不受理论的限制,但是据信在混合过程中,通过混合的剪切力以及通过镁盐附着在α
‑
乳糖颗粒的平坦区域和缝隙上,α
‑
乳糖被成形为圆形。据信,α
‑
乳糖和镁盐之间具有更大的附着性,从而包裹α
‑
乳糖,这继而降低了载体和活性成分之间以及活性成分的颗粒之间的粘附/内聚力,从而允许在吸入过程中轻松释放色甘酸。这种更大的附着性,圆形的颗粒形状以及较小尺寸的α
‑
乳糖颗粒有助于将色甘酸更深地沉积到肺区域
中,从而以药物产品形式中较少的色甘酸实现了有效剂量。
13.具体地,本发明适用于患有精神行为受损的疾病(例如阿尔茨海默氏病)的患者,从而以最小的吸入努力确保有效的剂量递送。由于其多功能性,该组合物和制剂还可以用于治疗其他疾病,包括但不限于中风、肌萎缩性侧索硬化症(als)、帕金森氏病和哮喘。
14.本发明的一种应用是适合于吸入的粉末化形式的色甘酸钠和粉末化形式的α
‑
乳糖的组合物作为组合剂型。在这种情况下,每种成分均为粉末化形式,以利于通过吸入给药并实现简单、准确的给药。本发明部分地基于以下发现:当色甘酸钠和α
‑
乳糖均为粉末化形式时,α
‑
乳糖改善了微粒化的色甘酸的空气动力学流动。这项改进使高浓度的色甘酸可以到达患者肺部的更深处,从而以较少的药物达到相同的治疗效果。另一个优点是,通过吸入获得完美剂量对于获得足够的治疗效果可能不是必需的。同时,另一个优点是α
‑
乳糖的存在有助于掩盖色甘酸的苦味,从而使给药令人愉悦。对于身体能力受损的患者(可能是由于诸如阿尔茨海默氏病之类的疾病导致的),可能无法始终做到完美的吸入(完美的“呼吸”);利用本公开,即使吸入不良(不完美的“呼吸”)也将递送足够的药物剂量以治疗期望的疾病。本发明组合物的优点可以应用于具有类似问题的其他疾病,并扩大改进剂型形式可以适用的适应症范围。
15.在一个应用中,可将色甘酸钠、α
‑
乳糖和脂肪酸金属盐的组合物的共同给药用于某些神经疾病的治疗。神经疾病包括但不限于ad、als、帕金森氏病和中风的影响。
16.用于制剂的组合物中使用的α
‑
乳糖是适合吸入的形式。具体地,α
‑
乳糖颗粒被光滑化和修圆以实现更好的载体性质。α
‑
乳糖颗粒大于其负载的颗粒,因此较大的颗粒分布主要是较大的颗粒。更光滑的表面和边缘可防止api滞留在载体颗粒中。另一个先决条件是α
‑
乳糖与色甘酸钠的结合良好,以便通过吸入增强色甘酸钠的递送。具体是,该组合应将色甘酸钠递送至肺深处,例如dpi 4moc(moc的第4阶段,代表由次支气管至肺泡组成的肺部区域)。
17.表征α
‑
乳糖以确定使用吸入递送系统给予治疗有效量所需的参数。该方法包括粒度测定(psd);粉末x射线结晶衍射(pxrd);和重量蒸气吸附(gvs)。
18.本发明涉及制剂,其中α
‑
乳糖的粒度分布d
90
为45
‑
70μm,d
50
为10
‑
35μm,并且d
10
为3
‑
13μm,优选地,d
90
为50
‑
65μm,d
50
为15
‑
30μm,并且d
10
为5
‑
10μm,更优选地,d
90
为50
‑
60μm,d
50
为20
‑
25μm,并且d
10
为3
‑
6μm。
19.组合物制剂中使用的色甘酸主要是为吸入而制造的。通常,将色甘酸微粉化。本发明涉及一种具有色甘酸的组合物,其中色甘酸的尺寸参数约<10μm;但是,粒度还可以包括<5μm。色甘酸微粉化可产生粒度小的超细粉末(d<10μm)。微粉化的色甘酸的规格通常为d
90
≤5μm。
20.制剂还包含润滑剂/稳定剂,其可以是任何药学上可接受的脂肪酸金属盐,例如硬脂酸及其金属盐。可接受的硬脂酸包括但不限于:硬脂酸镁,硬脂酸钙,硬脂酸锌。优选的硬脂酸是硬脂酸镁。镁盐被微粉化以产生足够小的颗粒,用作润滑剂,以与载体乳糖一水合物一起最大限度地减少聚集,并通过降低载体与色甘酸之间的附着/内聚力来改善载体性能。使用微粉化的镁盐的另一个优点是在封装过程中改善了掺混物的混合和流动性。
21.本发明还涉及通过吸入递送的色甘酸钠、α
‑
乳糖和硬脂酸镁的组合物。该组合物包含微粉化的色甘酸钠,微粉化的α
‑
乳糖和硬脂酸镁,其中所述α
‑
乳糖被制备用于吸入并
且优选具有如上所述的粒度。
22.与仅含色甘酸的组合物相比,或与色甘酸和α
‑
乳糖依次(不同时)递送的情况相比,该组合物改善了色甘酸的递送。例如,色甘酸的吸入制剂仅可将剂量的约23%至约29%的治疗有效量的色甘酸递送至深肺。相反,本发明的组合物能够递送剂量的约34%至约53%,优选35%至约44%的治疗有效量的色甘酸。
23.本发明的组合物包含约45
‑
65重量%的色甘酸钠,约30
‑
50重量%的α
‑
乳糖和约1
‑
5重量%的硬脂酸镁。优选的组合物包含约50
‑
60重量%的色甘酸钠,约35
‑
45重量%的α
‑
乳糖和约1
‑
3重量%的硬脂酸镁。更优选地,该组合物包含约58重量%的色甘酸钠,约40重量%的α
‑
乳糖和约2重量%的硬脂酸镁。如本文所用,除非另有说明,否则术语“色甘酸”包括色甘酸,色甘酸钠和色甘酸的药学上可接受的盐的其他形式。
24.制剂1
[0025][0026]
通常,色甘酸钠与α
‑
乳糖的重量比为约1.7:1.12至约1.7:1.28,优选为约1.7:1.34至约1.7:28,更优选为约1.7:1.28。
[0027]
该制剂包含脂肪酸的盐作为药物润滑剂,例如硬脂酸镁。通常,色甘酸钠与硬脂酸镁的重量比为约1.7∶0.057至约1.7∶0.06,优选为约1.7∶0.064至约1.7∶0.6,更优选为约1.7∶0.06。
[0028]
与仅使用色甘酸的制剂相比,使用微粉化的色甘酸、α
‑
乳糖和脂肪酸盐作为药物润滑剂的制剂可改善吸入物质的性能。配制的产品批次的发射剂量与仅使用色甘酸的产品生产的六个临床批次相当。根据阶段4
‑
moc的ngi测试结果总和,单独使用色甘酸递送导致平均1.98%的产品到达深肺区域,而将色甘酸、α
‑
乳糖和硬脂酸镁组合使用则使得平均39.5%吸入的色甘酸到达了深肺区域。因此,本发明的组合物包括色甘酸、α
‑
乳糖和硬脂酸镁组合物,其平均结果为34%至44.3%吸入的色甘酸到达深肺区域。如本文所用,除非另外定义,否则术语“肺部面积”是指阶段4
‑
moc。
[0029]
如表1的数据所示,与仅具有1.98%发射剂量的仅色甘酸的制剂相比,本发明的制剂在深肺区域中具有34%至44%的色甘酸百分发射剂量。另外,本发明的组合物在阶段4
‑
moc中沉积了5.3
‑
6.5mg的色甘酸。
[0030]
表1:吸入试验中色甘酸、α
‑
乳糖和硬脂酸镁制剂的性能。
[0031][0032][0033]
表2,表3和表4列出了测试制剂各成分的粒度分布:
[0034]
表2:色甘酸api(微粉化的)
[0035]
批号#d
10
(μm)d
50
(μm)d
90
(μm)13
‑
01050.51.94.615
‑
00130.61.83.815
‑
0079
‑‑‑‑
4.2
[0036]
表3:α
‑
乳糖(dfe pharma lactohale lh201)
[0037]
批号#d
10
(3
‑
6μm)d
50
(20
‑
25μm)d
90
(50
‑
60μm)13
‑
00943215415
‑
00664235716
‑
012732259
[0038]
表4:硬脂酸镁(微粉化的)
[0039]
批号d
50
(<5μm)d
90
(<10μm)14
‑
00353.566.7415
‑
00774.829.2818
‑
00384.338.04
[0040]
在颗粒呼吸期间,尺寸<3μm的颗粒将沉积在肺的下部区域,然后被吸附。表1证明了制剂的性能,并证明与单独的色甘酸相比,大量api到达了肺的下部区域。根据色甘酸的颗粒分布(d
90
≤5μm),大多数批次的d
90
颗粒分布为≤5μm至≥3.5μm。如果在不使用本发明的α
‑
乳糖和硬脂酸镁的情况下吸入此类颗粒,则色甘酸将主要沉积在口咽和上呼吸道中,因此效果较差。据信,粒度<3μm的超细颗粒可以在与肺组织接触之前被呼出。而且,这些颗
粒仅占剂量的一部分。至关重要的是,在肺的下部区域中要有5μm至3μm的颗粒用于吸附,因为它们占混合物中api的90%。
[0041]
使用由色甘酸和乳糖组成的吸入剂和递送组合物的比较实验(表5
‑
7)表明,与表1中的数据相比,发射剂量的范围大大降低(60%至78%)(gilani等,“制剂变量和吸入装置对色甘酸钠干粉气溶胶沉积曲线的影响(influence of formulation variables and inhalation device on the deposition profiles of cromolyn sodium dry powder aerosols)”,daru j.pharm.sci.(2004)12(3),123
‑
130)。
[0042]
表5:α
‑
乳糖和色甘酸钠的粒度分布。
[0043]
颗粒d
10
d
50
d
90
p450m*2.5
±
0.312.3
±
0.826.5
±
0.3p325m*6.6
±
0.853.5
±
4.374.1
±
3.8色甘酸钠0.7
±
0.11.52
±
0.23.03
±
0.02
[0044]
*p450
–
pharmatose p450α
‑
乳糖;p325
–
pharmatose p325α
‑
乳糖。
[0045]
表6:在使用进行的吸入测试中,色甘酸和α
‑
乳糖制剂的性能。
[0046][0047]
cs
–
色甘酸钠(20mg)
[0048]
表7:在使用进行的吸入测试中,色甘酸和α
‑
乳糖制剂的性能。
[0049][0050]
cs
–
色甘酸钠(20mg)
[0051]
本发明的制剂可包含另外的药学上可接受的赋形剂。干粉吸入器的药学上可接受的赋形剂包括但不限于乳糖一水合物和硬脂酸镁。
[0052]
本发明涉及制备所述的包含α
‑
乳糖(吸入级);微粉化的色甘酸;和微粉化硬脂酸镁的组合物的方法。可以理解的是,我们指的是硬脂酸镁,但是其他适用于吸入的药物润滑剂同样适用。制备本发明的制剂的方法涉及α
‑
乳糖;微粉化的色甘酸;和微粉化的硬脂酸镁。混合可以使用层化原理以确保组分的均匀分布。在一些实施方式中,将色甘酸分配为三个相等的部分。制备制剂的方法包括将色甘酸的第一部分与硬脂酸镁层一起放置,将色甘酸的第二部分与乳糖层一起添加,以及将色甘酸的第三部分添加至层状混合物中。之后,混合层状混合物。制备本发明的制剂的替代方法涉及首先将乳糖与硬脂酸镁混合,将混合的乳糖/硬脂酸镁共混物分成三等份,分别将共混物的每一部分与色甘酸的三分之一部分混合,将每一部分的色甘酸、乳糖/硬脂酸镁共混物层化,再重复两次层化步骤,用高剪切混合
机在500
±
2rpm下将层化的混合物混合5至10分钟但不超过15分钟,以实现90
‑
110%的标签声明的均匀的共混物。
[0053]
可以使用制药领域中常用的标准装置将每种组分微粉化。
[0054]
本发明涉及一种包含色甘酸钠、α
‑
乳糖和脂肪酸盐的组合物,其中,色甘酸钠、α
‑
乳糖和脂肪酸盐经微粉化,以及其中,α
‑
乳糖的粒度分布d
90
为45
‑
70μm,d
50
为10
‑
35μm,d
10
为2
‑
13μm。
[0055]
在一些实施方式中,脂肪酸盐选自:硬脂酸镁、硬脂酸钙和硬脂酸锌,例如,硬脂酸镁。
[0056]
在某些实施方式中,α
‑
乳糖为颗粒形式。
[0057]
在一些实施方式中,α
‑
乳糖颗粒是球形或椭球形。
[0058]
在某些实施方式中,α
‑
乳糖的粒度分布d
90
为50
‑
65μm,d
50
为15
‑
30μm,并且d
10
为5
‑
10μm,例如,粒度分布d
90
为50
‑
60μm,d
50
为20
‑
25μm,并且d
10
为3
‑
6μm。
[0059]
在一些实施方式中,色甘酸钠的粒度分布d
90
≤5μm,例如,粒度分布d
90
≤5μm至≥3.5μm。
[0060]
在某些实施方式中,组合物包含约45
‑
65重量%的色甘酸钠,约30
‑
50重量%的α
‑
乳糖和约1
‑
5重量%的硬脂酸镁,例如,组合物包含约50
‑
60重量%的色甘酸钠,约35
‑
45重量%的α
‑
乳糖和约1
‑
3重量%的硬脂酸镁,例如约58重量%的色甘酸钠,约40重量%的α
‑
乳糖和约2重量%的硬脂酸镁。
[0061]
在一些实施方式中,组合物包含约17.1mg的色甘酸钠。
[0062]
本发明还涉及在需要的对象中治疗选自阿尔茨海默氏病,淀粉样变性相关疾病(aac),创伤性脑损伤,亨廷顿氏病,动脉粥样硬化,细胞因子释放综合征(crs),痴呆,头部创伤,感染,神经炎症,朊病毒病,中风,肌萎缩性侧索硬化症(als),帕金森氏病和哮喘的病症的方法。例如,所述病症是阿尔茨海默氏病。或者,所述病症是淀粉样变性相关疾病(aac)。或者,所述病症是创伤性脑损伤。
[0063]
在某些实施方式中,所述病症是亨廷顿氏病。或者,所述病症是动脉粥样硬化。或者,所述病症是crs。
[0064]
在一些实施方式中,所述病症是痴呆。或者,所述病症是头部创伤。或者,所述病症是感染。
[0065]
在某些实施方式中,所述病症是神经炎症。或者,所述病症是朊病毒病。或者,所述病症是中风。
[0066]
在一些实施方式中,所述病症是als。或者,所述病症是帕金森氏病。或者,所述病症是哮喘。
[0067]
在一些实施方式中,所述组合物通过口服吸入给予。
[0068]
参考文献的引用
[0069]
本文提及的所有出版物和专利均通过引用整体并入本文,就好像每个单独的出版物或专利均被明确地和单独地指出通过引用并入。在发生冲突的情况下,以本申请(包括本文的任何定义)为准。
[0070]
等价形式
[0071]
尽管讨论了本发明的具体实施方式,但以上说明书仅为说明性而非限制性的。本
领域的技术人员阅读了本说明书和所附权利要求后将清楚了解本发明的许多变化。本发明的全部范围应该通过参考所附权利要求书连同其等同物的全部范围,以及说明书连同此类变化来确定。
[0072]
实施例
[0073]
实施例1:批量制剂
[0074]
将色甘酸钠(1,160g)分为三部分。部分1(381.5g);部分2(399.8g)和部分3(379.5g)。将部分1放入剪切批量混合器10l trv混合碗中。将硬脂酸镁(40g)撒在碗中的部分1的色甘酸钠上。将部分2的色甘酸钠加入到碗中,然后层化乳糖一水合物(800g)。将部分3的色甘酸钠添加到乳糖一水合物层的顶部,并封闭碗。将混合物在500rpm下混合15分钟以获得2kg批量制剂。
[0075]
实施例2:粒度分布和发射剂量测量
[0076]
制剂制备
[0077]
将色甘酸钠(58重量%),α
‑
乳糖(58重量%)和硬脂酸镁(2重量%)的混合物封装在3号hpmc胶囊中,每个胶囊含32mg的混合物(含17.1mg色甘酸钠)。
[0078]
发射剂量测量
[0079]
为了进行发射剂量分析,将包含色甘酸钠、α
‑
乳糖和硬脂酸镁制剂的单个胶囊放入吸入器装置中并刺穿。将plastiape rs01干粉吸入器(dpi)装入嘴形适配器,然后装入copley tpk flow controller的进气口。将流量控制器设置为流速80
±
0.5l/s持续3秒脉冲。将装置装载到流量控制器中后,流量控制器即被激活以递送剂量。将发射的粉末收集到样品管中以进行hplc分析,确定从胶囊和装置释放的产品的量。测量结果显示在表2中。
[0080]
粒度分布测量
[0081]
使用下一代冲击器(ngi)进行空气动力学粒度分布分析。将包含色甘酸钠、α
‑
乳糖和硬脂酸镁制剂的胶囊装入plastiape rs01 dpi中并刺穿,然后装载到copley流量控制器上。将流量控制器设置为流速80
±
0.5l/s持续3秒脉冲。ngi设置用于测试,其中,3%v/v甘油,0.1%w/v lutrol f
‑
68在丙酮中的涂覆溶液置于每个ngi阶段杯中(1至7加上微孔收集器(moc))。将已加载的吸入器装置插入到嘴形适配器中,并将该组合件插入到流量控制器的进气口中。激活流量控制器3秒钟,完成后,从装置、喉管和嘴形适配器,ngi上的预分离器,以及ngi上的每个阶段杯中收集样品。使用稀释剂将每个装置的表面冲洗到用于hplc分析的样品管中。在分析每个样品之后,确定产品捕获的量。fpm(精细颗粒质量)是代表阶段3到moc的ngi杯的总和(mg)。测量结果显示在表8中。
[0082]
表8:粒度分布和发射剂量测量
[0083][0084]
*mg st
–
硬脂酸镁
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1