可输送的经导管人工心脏瓣膜及输送方法与流程
相关申请的交叉引用
本申请要求2018年9月20日提交的标题为“side-loadingtranscatheterheartvalvereplacement”的序列号为62/766,611的美国临时申请、2018年9月27日提交的标题为“side-loadingtranscatheterheartvalvereplacement”的序列号为62/737,343的美国临时申请、2018年10月10日提交的标题为“orthogonallydeliveredtranscatheterheartvalvereplacement”的序列号为16/155,890的美国申请、2018年10月22日提交的标题为“guidewiredeliveryoftricuspidvalve”的序列号为62/749,121的美国临时申请、2018年10月18日提交的标题为“orthogonallydeliveredtranscatheterheartvalveframeforvalveinvalveprostheses”的序列号为16/163,577的美国申请、2018年12月8日提交的标题为“compressioncapableannularframesfororthogonaldeliveryoftranscatheterheartvalvereplacement”的序列号为62/777,070的美国临时申请的优先权和权益,所述美国申请中的每一篇通过引用以其整体并入本文。
背景技术:
本文描述了涉及人工心脏瓣膜以及用于输送和部署此类瓣膜的装置和方法的实施方案。
人工心脏瓣膜会对心脏内的输送和部署,特别是对通过导管穿过患者的脉管系统而不是通过外科手术方法进行的输送带来挑战。常规瓣膜具有平行于输送导管的纵向轴线的中心圆柱形轴线,并且从输送导管的端部部署,并从中心环形轴线径向向外扩张,其方式类似于将闭合的弹簧加载伞从套管中推出以使其弹簧打开。常规瓣膜只能在输送导管内径允许的范围内扩张。增加常规瓣膜的扩张直径的努力遇到了试图将太多的材料和结构压缩到太少的空间中的问题。
需要能够通过小直径输送导管输送的瓣膜,特别是自体瓣膜,诸如三尖瓣瓣膜。
技术实现要素:
本文描述的实施方案总体上涉及经导管人工瓣膜和用于输送经导管人工瓣膜的方法。在一些实施方案中,人工瓣膜包括框架和流动控制部件。框架具有围绕中心轴线延伸穿过框架的孔。流动控制部件(flowcontrolcomponent)安装在孔内,并被配置为允许血液沿大致平行于中心轴线的第一方向从流动控制部件的流入端流向流出端,并阻止血液沿与第一方向相反的第二方向流动。所述框架具有扩张构型,所述扩张构型具有沿中心轴线的第一高度、沿垂直于中心轴线的横轴线的第一横向宽度以及沿垂直于中心轴线和横轴线的纵轴线的第一纵向长度。框架具有压缩构型,所述压缩构型具有沿中心轴线的小于第一高度的第二高度和沿横轴线的小于第一横向宽度的第二横向宽度。
附图说明
图1a-图1f是根据实施方案的经导管人工瓣膜的示意性图解。
图2-图4a示出了根据实施方案的经导管人工瓣膜,以及分别在输送导管内被输送到靶组织,被插入靶组织的自体瓣环(nativeannulus)中,以及被部署在靶组织的自体瓣环中。
图4b是根据实施方案的经导管人工瓣膜的局部剖视图,示出了其内部瓣膜套管。
图5是根据实施方案的经导管人工瓣膜的侧视图。
图6-图9示出了将图5的经导管人工瓣膜输送至靶组织的自体瓣环的过程。
图10-图12是根据实施方案的在输送导管内处于压缩构型的经导管人工瓣膜的各种视图。
图13是图10的经导管人工瓣膜的局横截面视图。
图14a-图14c示出了根据实施方案的从扩张构型(图14a)转换成压缩构型(图14c)的经导管人工瓣膜。
图15是在输送导管内处于压缩构型的图14a的经导管人工瓣膜的透视图。
图16a-图16d示出了根据实施方案的从扩张构型(图16a)转换成压缩构型(图16d)的经导管人工瓣膜。
图17a-图17e示出了根据实施方案的从扩张构型(图17a)转换成压缩构型(图17e)的经导管人工瓣膜。
图18a-图18d示出了根据实施方案的从扩张构型(图18a)转换成压缩构型(图18d)的经导管人工瓣膜。
图19a-图19d示出了根据实施方案的从压缩构型(图19a)转换成扩张构型(图19d)的经导管人工瓣膜。
图20是根据实施方案的经导管人工瓣膜的侧面透视图。
图21是图20的经导管人工瓣膜的局部横截面视图。
图22是根据实施方案的两片式(two-panel)经导管人工瓣膜的分解视图。
图23是图22的两片式经导管人工瓣膜的侧视图。
图24是处于压缩构型的图22的两片式经导管人工瓣膜的侧视图。
图25是根据实施方案的两片式经导管人工瓣膜的分解视图。
图26是图25的两片式经导管人工瓣膜的侧视图。
图27是图25处于压缩构型的两片式经导管人工瓣膜的侧视图。
图28和图29分别是根据实施方案的经导管人工瓣膜的侧面透视图和顶视图。
图30和图31分别是根据实施方案的经导管人工瓣膜的侧面透视图和顶视图。
图32a和图32b分别是处于扩张构型和收缩构型的根据实施方案的经导管人工瓣膜的侧面透视图。
图33a-图33e示出了根据实施方案的从扩张构型(图33a)转换成压缩构型(图33e)的经导管人工瓣膜。
图34a和图34b分别示出了处于收缩构型和扩张构型的根据实施方案的经导管人工瓣膜。
图35a和图35b示出了根据实施方案的经导管人工瓣膜。
图36a和图36b示出了根据实施方案的经导管人工瓣膜。
图37a和图37b分别是根据实施方案的经导管人工瓣膜的侧面透视图和顶部透视图。
图37c和图37d是转换成收缩构型的图37a的经导管人工瓣膜的透视图。
图38a-图38c是根据实施方案的经导管人工瓣膜的各种视图。
图39和图40是根据不同实施方案的经导管人工瓣膜的侧面透视图。
图41a-图41g是根据实施方案的经导管人工瓣膜的一个或多个部分的各种视图。
图42-图46是根据实施方案的经导管人工瓣膜的丝框架的一个或多个部分的各种视图。
图47a和图47b是根据不同实施方案的用于形成经导管人工瓣膜的框架的蚀刻金属合金薄板的侧面透视图。
图48和图49是各自根据不同实施方案的部署在靶组织的自体瓣环中的经导管人工瓣膜的侧视图。
图50是被部署并锚定到心脏的自体瓣环中的经导管人工瓣膜的侧视图。
图51a-图51c是根据实施方案的经导管人工瓣膜的各种视图。
图51d和图51e示出了至少部分设置在输送导管内的图51a的经导管人工瓣膜。
图52a和图52b分别示出了部分部署和完全部署在靶组织的自体瓣环中的经导管人工瓣膜。
图53a-图53f是根据实施方案的经导管人工瓣膜的各种视图。
图54a-图54e是根据实施方案的经导管人工瓣膜的各种视图。
图55a是根据实施方案的经导管人工瓣膜的侧面透视图。
图55b是图55a的经导管人工瓣膜的横截面视图。
图56a和图56b分别是处于扩张构型和收缩构型的根据实施方案的经导管人工瓣膜的侧视图。
图57a和图57b分别是处于扩张构型和收缩构型的根据实施方案的经导管人工瓣膜的侧视图。
图58a和图58b分别是根据实施方案的经导管人工瓣膜的侧面透视图和顶视图。
图59和图60分别是根据不同实施方案的经导管人工瓣膜的侧面透视图。
图61-图64是根据实施方案的经导管人工瓣膜的丝框架的一个或多个部分的各种视图。
图65a是显示在心房底部的横截面视图内并部署在自体瓣环内的经导管人工瓣膜的顶视图。
图65b是显示在心室顶部的横截面视图内并部署在自体瓣环内的经导管人工瓣膜的底视图。
图66是根据实施方案的经导管人工瓣膜的丝框架的侧面透视图。
图67是根据实施方案的经导管人工瓣膜的瓣膜套管的侧面透视图。
图68a是根据实施方案的经导管人工瓣膜的瓣膜套管的侧面透视图。
图68b是设置在经导管人工瓣膜的框架内的图68a的瓣膜套管的横截面视图。
图69是根据实施方案的经导管人工瓣膜的瓣膜套管的侧面透视图。
图70a是根据实施方案的经导管人工瓣膜的瓣膜套管的侧面透视图。
图70b是设置在经导管人工瓣膜的框架内的70a的瓣膜套管的横截面视图。
图71a-图71c是根据实施方案的经导管人工瓣膜的各种视图。
图72a-图72c是根据实施方案的用于输送经导管人工瓣膜的输送系统的示意图。
图72d是描述根据实施方案的用于输送经导管人工瓣膜的方法的流程图。
图73a是人心脏解剖的图示,图73b是图73a的人类心脏解剖的一部分的放大图示。
图74是根据实施方案的部署在图73a和图73b的人心脏的自体瓣环内的经导管人工瓣膜的图示。
图75a-图75d、图76a-图76c、图77a-图77d和图78a-图78d示出了根据不同实施方案的将经导管人工瓣膜部署在人心脏的自体瓣环中的过程。
图79a-图79e示出了根据实施方案的从压缩构型(图79a)转换成扩张构型(图79d和图79e)的经导管人工瓣膜。
图80a-图80d示出了根据实施方案的从压缩构型(图80a)转换成扩张构型(图80d)的经导管人工瓣膜。
图80e是在输送导管内处于压缩构型的经导管人工瓣膜的侧视图的图示,并且显示了根据实施方案的被配置成移动瓣膜穿过输送导管的辅助导管(secondarycatheter)。
图81a-图81d是各自根据不同实施方案的包括导丝套环的辅助导管的一部分的侧视图。
图82a-图82c是根据实施方案的用于输送经导管人工瓣膜的输送系统的示意图。
图82d是描述根据实施方案的用于输送经导管人工瓣膜的方法的流程图。
图83a-图83f示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图84a-图84h示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图85a-图85f示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图86a-图86f示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图87a-图87e示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图88a和图88b示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图89a-图89c示出了根据实施方案的在人心脏的自体瓣环中部署经导管人工瓣膜的过程。
图90a-图90c示出了根据实施方案的经由组织锚将经导管人工瓣膜锚定到靶组织的过程。
图91a-图91d是各自根据不同实施方案的组织锚的侧视图。
图92a-图92d示出了将经导管人工瓣膜部署和锚定在靶组织的自体瓣环中的过程。
图93a-图93e示出了将经导管人工瓣膜部署和锚定在靶组织的自体瓣环中的过程。
图94是描述根据实施方案的用于输送经导管人工瓣膜的方法的流程图。
图95是描述根据实施方案的用于将经导管人工瓣膜装载到输送导管中的方法的流程图。
图96a是根据实施方案的经导管人工瓣膜的横截面视图,其示出了设置在框架内的瓣膜套管。
图96b是处于扩张构型的图96a的经导管人工瓣膜的侧视图。
图96c-图96f示出了将图96a的经导管人工瓣膜部署到靶组织的自体瓣环中的过程。
图97a-图97c示出了根据实施方案的经由组织锚将经导管人工瓣膜部署到靶组织的过程。
图98a-图98c示出了根据实施方案的经由组织锚将经导管人工瓣膜部署到靶组织的过程。
图99a-图99d示出了根据实施方案的经导管人工瓣膜的至少一部分。
图100是人心脏的图示,其显示了瓣膜、心房、心室以及进入和离开心脏腔室的相关血管的大致位置。
图101a-图101g示出了根据实施方案的将经导管人工瓣膜部署到靶组织的自体瓣环中的过程。
图102a-图102d示出了根据实施方案的将经导管人工瓣膜部署到靶组织的自体瓣环中的过程。
图103a-图103g示出了根据实施方案的将经导管人工瓣膜部署到人心脏的自体瓣环中的过程。
图104a-图104f示出了根据实施方案的将经导管人工瓣膜部署到人心脏的自体瓣环中的过程。
具体实施方式
所公开的实施方案涉及正交输送的经导管人工瓣膜和/或其部件,以及制造、装载、输送和部署经导管人工瓣膜和/或其部件的方法。经导管人工瓣膜具有管状框架和安装在管状框架的中央腔内的流动控制部件。流动控制部件被配置成允许血液沿第一方向通经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端。所述瓣膜可沿基本平行于输送导管的纵向圆柱形轴线的长轴线压缩和扩张。瓣膜被配置成在用于使用输送导管引入体内的压缩构型与用于在体内的期望位置进行植入的扩张构型之间转换。所述瓣膜被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端。
在一些实施方案中,经导管人工瓣膜在相对于流动控制部件的中心轴线的纵向或正交方向上具有可压缩构型,其可允许使用例如24-36fr输送导管将大直径瓣膜(例如,具有约5-60mm的高度和约20-80mm的直径)从下腔静脉直接输送和部署到二尖瓣瓣膜或三尖瓣瓣膜中,而无需以锐角接近从输送导管输送和部署。
在一些实施方案中,当处于压缩构型时,经导管人工瓣膜具有与第一方向(例如,血流方向)共轴或至少基本平行的中心轴线。在一些实施方案中,瓣膜的压缩构型垂直于第一方向。在一些实施方案中,当处于压缩构型和/或扩张构型时,长轴线以45-135度的与第一方向所成的交角定向。
在一些实施方案中,经导管人工瓣膜包括从管状框架的远端侧延伸的张力臂,所述张力臂可用作例如右心室流出道(“rvot”)接片(tab)。所述张力臂可包括从管状框架延伸出去约10-40mm的金属丝环或金属丝框架、集成框架部或支架。
在一些实施方案中,经导管人工瓣膜包括(i)附接至管状框架的远侧上边缘的上张力臂,上张力臂包括从管状框架延伸出去约2-20mm的金属丝环或金属丝框架,以及(ii)从管状框架的远端侧延伸的下张力臂(例如,用作rvot接片),所述下张力臂由从管状框架延伸出去约10-40mm的丝环或金属丝框架。
在一些实施方案中,经导管人工瓣膜包括至少一个连接至管状框架的组织锚,用于衔接瓣环组织。
在一些实施方案中,经导管人工瓣膜是球囊扩张型瓣膜或自扩张瓣膜之一。
在一些实施方案中,管状框架形成两部分框架。第一部分包括连接到包括圆柱形构件/段的第二部分的扩口式心房套囊(atrialcuff)。所述套囊围绕圆柱形构件/段的顶部边缘的圆周连接到圆柱形构件/段。
在一些实施方案中,管状框架具有平锥形的侧轮廓,其直径r为40-80mm,直径r为20-60mm,高度为5-60mm。在一些实施方案中,管状框架具有沙漏形平圆锥形状的侧轮廓,其顶部直径r1为40-80mm、底部直径r2为50-70mm、内径r为20-30mm以及高为5-60mm。在一些实施方案中,管状框架的外径为20-80mm,内径为21-79mm。
在一些实施方案中,管状框架由编织金属丝、激光切割的金属丝、光刻产生的金属丝单元、3d印刷金属丝单元、由波形、锯齿形或螺旋形的间歇连接的单股金属丝形成的金属丝单元和/或它们的组合形成,并且覆盖有生物相容性材料。在一些实施方案中,管状框架由多个可压缩的金属丝单元形成,所述可压缩的金属丝单元具有基本垂直于瓣膜的中心垂直轴线的定向和单元几何形状,以在管状框架被配置成处于垂直压缩构型、卷起的压缩构型或折叠的压缩构型时最小化金属丝单元应变。
在一些实施方案中,管状框架具有中心通道和外周壁,所述外周壁以扩张构型围绕中心垂直轴线。周壁具有前壁部分和后壁部分,前壁部分和后壁部分沿近端侧连接到近端折叠区域,以及沿远端侧连接到远端折叠区域。前壁部分具有前上套环部分和前下主体部分。后壁部分具有后上套环部分和后下主体部分。在一些实施方案中,处于扩张构型的前下主体部分和后下主体部分形成选自漏斗、圆柱体、平圆锥或圆形双曲面的形状。在一些实施方案中,近端折叠区域和远端折叠区域各自包括缝合接缝、织物片或刚性铰链。在一些实施方案中,近端折叠区域和远端折叠区域各自包括没有任何金属丝单元的柔性织物跨越段(fabricspan)。
在一些实施方案中,管状框架具有覆盖有包含心包组织的生物相容性材料的内表面,以及覆盖有包含编织的合成聚酯材料的生物相容性材料的外表面。
在一些实施方案中,流动控制部件具有20-35mm的内径和5-40mm的高度,和多个心包材料的小叶,所述多个小叶连接以在流入端形成圆形圆柱体并在流出端具有平坦的可关闭的孔。例如,流动控制部件可包括2-4个心包材料的小叶。
在一些实施方案中,流动控制部件由集成到流动控制部件中或安装在流动控制部件上的一个或多个纵向支撑件支撑。一个或多个纵向支撑件选自刚性或半刚性支柱、刚性或半刚性肋、刚性或半刚性撑条、刚性或半刚性片及其组合。
在一些实施方案中,用于部署经导管人工瓣膜的输送系统包括(i)输送导管,其包括具有中心内腔的细长管;(ii)海波管鞘导丝组件,其具有外鞘和内导丝轴,所述内导丝轴被配制成推压压缩的经导管人工瓣膜的张力臂上的导丝套环以输送瓣膜;(ii)经导管人工瓣膜,其具有从管状框架的远端侧延伸的张力臂。所述张力臂包括金属丝环或金属丝框架、集成框架部或支架,从管状框架延伸出去约10-40mm。所述张力臂具有附接至所述张力臂的导丝套环元件,其中所述导丝套环元件的尺寸和构造被设置成具有导丝孔,以允许海波管鞘导丝组件的内导丝轴穿过引导孔,并阻止导丝组件的外鞘穿过导丝孔。
在一些实施方案中,用于制造经导管人工瓣膜的方法包括(i)使用增材或减材金属或金属合金制造来生产管状框架,其中所述增材金属或金属合金制造是3d打印或直接金属激光烧结(粉末熔化),并且其中减材金属或金属合金制造是光刻、激光烧结/切割、cnc加工或放电加工;(ii)在管状框架内安装流动控制部件;(iii)用心包材料或类似的生物相容性材料覆盖管状框架的外表面。
在一些实施方案中,用于将经导管人工瓣膜正交输送至体内的期望位置的方法包括(i)将输送导管推进到体内的期望位置,以及(ii)通过从输送导管释放瓣膜来将经导管人工瓣膜输送至体内的期望位置。所述瓣膜在输送导管中时处于压缩构型。当从输送导管释放时,瓣膜转换成扩张构型。
在一些实施方案中,所述方法还包括将拉线(pullingwire)(例如,刚性细长拉杆/推杆或引线)附接至经导管人工瓣膜的侧壁,并将瓣膜拉入锥形固定装置(taperingfixture)或漏斗(例如,附接至输送导管的近侧端),使得锥形固定装置或漏斗将瓣膜压缩或螺旋成压缩构型以装载到输送导管中。
在一些实施方案中,所述方法包括通过以下步骤从输送导管释放瓣膜:(i)使用可释放地连接到瓣膜远端侧的拉线将瓣膜拉出输送导管,其中推进推杆远离输送导管将压缩的瓣膜拉出输送导管,或者(ii)使用可释放地连接到瓣膜近端侧的拉线将瓣膜推出输送导管,其中将推杆从输送导管推出将压缩的瓣膜推出输送导管。
在一些实施方案中,所述方法包括从输送导管释放瓣膜,同时在瓣膜部署期间通过以下方式增加血流:(i)从输送导管部分释放瓣膜,以建立围绕部分释放的瓣膜的血流和通过流动控制部件的血流;(ii)从输送导管中完全释放瓣膜,同时用定位导管或拉线保持与瓣膜的附接,以过渡到通过流动控制部件的血流增加而瓣膜周围的血流减少的状态;(iii)将所述瓣膜部署到最终安装位置,以过渡到血流完全通过所述流动控制部件并且瓣膜周围血流最少或没有血流的状态;以及(iv)从瓣膜上断开和撤出定位导管或拉线。
在一些实施方案中,所述方法还包括在从瓣膜的部分释放到瓣膜的完全释放的过渡期间,在rvot中插入张力臂(例如,rvot接片)。
在一些实施方案中,所述方法还包括使用可操纵的导管沿平行于瓣膜瓣环平面的轴线旋转经导管人工瓣膜,使得(i)上张力臂被构形压力(conformationallypressure)锁定在瓣环上方组织上,以及(ii)下张力臂被构形压力锁定在瓣环下组织上。
在一些实施方案中,所述方法还包括将附接至瓣膜的一个或多个组织锚锚定到瓣环组织中。
在一些实施方案中,用于将经导管人工瓣膜正交输送至体内的期望位置的方法包括:(i)将第一输送导管推进到体内的期望位置,(ii)通过将管状框架从输送导管释放而将管状框架输送至体内的期望位置,(iii)将第二输送导管推进到体内的期望位置,以及(iv)将流动控制部件输送到管状框架的中心内腔中。当在第一输送导管中时,管状框架处于压缩构型,当在第二输送导管中时,流动控制部件处于压缩构型。当从第一输送导管释放时,管状框架转换成扩张构型,当从第二输送导管释放以安装到管状框架中时,流动控制部件转换成扩张构型。
在一些实施方案中,用于压缩经导管人工瓣膜以便从输送导管纵向正交释放的方法包括(i)将瓣膜展平、卷起或折叠成压缩构型,其中瓣膜的长轴线基本上平行于输送导管的纵向圆柱形轴线。在一些实施方案中,所述方法包括以下之一:(i)从管状框架的一侧将瓣膜单向卷成压缩构型;(ii)从管状框架的两个相对侧将瓣膜双向卷成压缩构型;(iii)将管状框架展平成基本平行于长轴线的两个平行板,然后将展平的管状框架卷成压缩构型;或者(iv)沿垂直轴线展平管状框架,以从顶部到底部减小瓣膜的垂直尺寸。
在一些实施方案中,用于将经导管人工瓣膜正交输送到体内的期望位置的方法包括:(i)将导丝推进到体内的期望位置,所述导丝具有外鞘和内轴;(ii)将输送导管在导丝上推进到期望的位置;(iii)将瓣膜被膜安装到导丝的近侧端上,所述瓣膜被膜包含压缩瓣膜,所述压缩瓣膜具有带螺纹的导丝套环,所述导丝套环具有孔,所述孔的尺寸允许导丝的内轴延伸穿过所述孔并阻止导丝的外鞘延伸穿过所述孔;(iv)将瓣膜被膜装载到输送导管的近侧端;(v)通过在内轴上推进外鞘以将瓣膜部署在期望的位置,将压缩的瓣膜从瓣膜被膜推进到输送导管的内腔中并穿过所述内腔到达体内的期望位置。
在一些实施方案中,用于将经导管人工瓣膜正交输送至人心脏的自体瓣环的方法可包括以下的至少一个步骤:(i)将输送导管经由股静脉通过下腔静脉(ivc)推进到心脏的三尖瓣瓣膜或肺动脉,(ii)经由颈静脉通过上腔静脉(svc)推进到心脏的三尖瓣瓣膜或肺动脉,或者(iii)经由ivc-股静脉或svc-颈静脉途径,通过经心房途径(例如,卵圆窝或更低处),推进到心脏的二尖瓣瓣膜;以及(iv)通过从输送导管释放瓣膜,将经导管人工瓣膜输送到自体瓣环。
在一些实施方案中,所述方法还包括将经导管人工瓣膜的张力臂定位到人心脏的右心室的rvot中。例如,所述方法还可包括(i)将瓣膜的下张力臂定位至右心室的rvot中,以及(ii)将连接至下张力臂的上张力臂定位至瓣环上方位置,使得上张力臂在右心室的方向上提供瓣环上方向下力,并且下张力臂在右心房的方向上提供瓣环下向上力。
在一些实施方案中,人工瓣膜包括管状框架、远端瓣环下锚定张力臂和流动控制部件。管状框架具有侧壁和围绕侧壁的顶部边缘连接的心房套环。远端瓣环上方锚定张力臂附接至管状框架的下远端侧壁并从其延伸出去。流动控制部件安装在管状框架内,并被配置成允许血液沿第一方向流经人工瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经人工瓣膜的流出端。人工瓣膜可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入。在压缩构型中,人工瓣膜具有以45-135度的与第一方向所成的交角定向的,并且基本平行于输送导管的内腔的纵向圆柱形轴线的长轴线。人工瓣膜可扩张至扩张构型,所述构型具有以45-135度的与第一方向所成的交角定向的长轴线。
在一些实施方案中,人工瓣膜包括瓣膜框架和流动控制部件。瓣膜框架具有沿中心轴线延伸穿过瓣膜框架的孔。流动控制部件(flowcontrolcomponent)安装在孔内,并被配置为允许血液沿大致平行于中心轴线的第一方向从流动控制部件的流入端流向流出端,并阻止血液沿与第一方向相反的第二方向流动。所述瓣膜框架具有扩张构型,所述构型具有沿中心轴线的第一高度、沿垂直于中心轴线的横轴线的第一横向宽度以及沿垂直于中心轴线和横轴线的纵轴线的第一纵向长度。瓣膜框架具有压缩构型,所述压缩构型具有沿中心轴线的小于第一高度的第二高度和沿横轴线的小于第一横向宽度的第二横向宽度。
在一些实施方案中,用于人工瓣膜的框架包括管状框架,所述管状框架具有由管状框架的内圆周表面限定的中心内腔,并限定了管状框架的垂直轴线。管状框架具有可与自体瓣环组织衔接的外圆周表面。管状框架可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入。在压缩构型中,瓣膜具有水平长轴线,所述水平长轴线以45至135度的相对于管状框架的垂直轴线所成的交角定向,并且当被设置在输送导管的内腔中时,所述水平长轴线基本平行于输送导管的内腔的纵向圆柱形轴线。所述瓣膜可扩张至扩张构型,所述扩张构型具有以45-135度的相对于管状框架的垂直轴线所成的交角定向的水平长轴线。
在一些实施方案中,用于将人工瓣膜输送到心脏的心室与心房之间的自体瓣膜的方法包括将包含人工瓣膜的输送导管推进到心脏的心房。所述人工瓣膜包括管状框架(所述管状框架具有侧壁和围绕侧壁的顶部边缘附接的心房套环)、远端瓣环下锚定张力臂(所述远端瓣环下锚定张力臂附接至管状框架的下远端侧壁并从其向远端延伸)以及安装在管状框架内的流动控制部件。所述流动控制部件被配置成允许血液沿第一方向流经人工瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经人工瓣膜的流出端。人工瓣膜被以压缩构型设置在输送导管中,并且可扩张至扩张构型,所述压缩构型具有以45-135度的与第一方向所成的交角定向的并且基本平行于输送导管的纵向圆柱形轴线的长轴线,所述扩张构型具有以45-135度的与第一方向所成的交角定向的长轴线。所述方法包括通过从输送导管推开可释放地连接到张力臂的刚性细长推杆,将张力臂从输送导管中拉出,从而从输送导管中释放人工瓣膜的远端瓣环下锚定张力臂。远端瓣环下锚定张力臂被输送到自体瓣膜的瓣环的心室侧。然后将人工瓣膜的剩余部分从输送导管释放至扩张构型,从而将管状框架置于自体瓣膜的瓣环内。
在一些实施方案中,将人工瓣膜输送到心脏的心室与心房之间的自体瓣膜的瓣环的方法包括在心脏的心房中设置具有内腔和纵轴线的输送导管的远端部分,其中输送导管的远侧端指向自体瓣膜的瓣环。所述人工瓣膜被以压缩构型设置在输送导管的远端部分内。所述人工瓣膜具有管状框架和流动控制部件,所述管状框架联接有张力臂,所述流动控制部件被安装在管状框架内并且具有扩张构型,其中所述人工瓣膜被配置成允许血液沿第一方向流经所述人工瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述人工瓣膜的流出端。所述张力臂从管状框架横向延伸,并且当管状框架被设置在瓣环内时,所述张力臂被设置在自体瓣膜的瓣环的心室侧。当处于扩张构型时,人工瓣膜在与第一方向横向的任何方向上的长度都大于输送导管远端部分的内腔直径。当处于压缩构型时,人工瓣膜被设置在输送导管的远端部分内,并且相对于处于扩张构型的人工瓣膜的尺寸,在纵向方向上被拉长,在横向方向上被压缩。人工瓣膜在纵向方向上具有长轴线,所述长轴线平行于输送导管的纵轴线,并且以45至135度的与第一方向所成的交角定向,其中将张力臂在纵向方向上朝向输送导管的远侧端设置在远端。所述方法还包括从导管内腔释放张力臂。张力臂的至少远端部分被设置在自体瓣膜的瓣环的心室侧,而输送导管的远侧端保持在瓣环的心房侧上。人工瓣膜的剩余部分从输送导管的内腔中释放,使得管状框架设置在自体瓣膜的瓣环内。
在一些实施方案中,将人工瓣膜输送到心脏的心室与心房之间的自体瓣膜的瓣环的方法包括在心脏的心房中设置具有内腔和纵轴线的输送导管的远端部分,其中输送导管的远侧端指向自体瓣膜的瓣环。所述人工瓣膜被以压缩构型设置在输送导管的远端部分内。所述人工瓣膜具有管状框架和流动控制部件,所述管状框架联接有张力臂,所述流动控制部件被安装在管状框架内并且具有扩张构型,其中所述人工瓣膜被配置成允许血液沿第一方向流经所述人工瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述人工瓣膜的流出端。所述张力臂从管状框架横向延伸,并且当管状框架被设置在瓣环内时,所述张力臂被设置在自体瓣膜的瓣环的心室侧。管状框架被设置在输送导管的内腔中,其中朝向输送导管的远侧端设置张力臂。所述方法还包括从输送导管内腔释放张力臂。张力臂的至少远端部分被设置在自体瓣膜的瓣环的心室侧,而输送导管的远侧端保持在瓣环的心房侧上。人工瓣膜的剩余部分从输送导管的内腔中释放。以相对于自体瓣膜的瓣环所成的倾斜角保持人工瓣膜,并且允许血液从心房通过自体瓣膜和通过人工瓣膜流到心室,以允许评估自体瓣膜和人工瓣膜的功能。
在一些实施方案中,用于输送人工瓣膜的方法包括在具有直径的导丝上推进输送导管,以将输送导管的远侧端设置在体内的期望位置。导丝的近侧端安装在瓣膜被膜上,所述瓣膜被膜包含处于压缩构型的人工瓣膜。人工瓣膜具有导丝套环,所述导丝套环具有穿过其中的孔,该孔的内径大于导丝的直径。导丝被设置穿过导丝套环的孔。瓣膜被膜被装载入输送导管的近侧端。推动器(pusher)被设置在靠近人工瓣膜的导丝上。推动器的外径大于导丝套环中的孔的内径。通过在导丝上推进推动器,人工瓣膜被从瓣膜被膜推进到输送导管的内腔中并穿过所述内腔到达其远侧端,并且人工瓣膜被从输送导管的远侧端部署到期望的位置。
在一些实施方案中,将人工瓣膜输送到心脏的心室与心房之间的自体瓣膜的瓣环的方法包括在心脏的心房中设置具有内腔和纵轴线的输送导管的远端部分,其中输送导管的远侧端指向自体瓣膜的瓣环。用于人工瓣膜的管状框架被以压缩构型设置在输送导管的内腔中。管状框架限定了具有中心轴线和与其联接的张力臂的中心内腔。管状框架具有其中管状框架的扩张结构。当处于扩张构型时,管状框架在与中心轴线横向的任何方向上的长度大于输送导管的远端部分的内腔直径。当处于压缩构型时,管状框架被设置在输送导管的远端部分内,并且相对于处于扩张构型的管状框架的尺寸,在纵向方向上被拉长,在横向方向上被压缩。管状框架在纵向方向上具有长轴线,所述长轴线平行于输送导管的纵轴线,并且以45至135度的相对于中心轴线所成的交角定向,其中将张力臂在纵向方向上朝向输送导管的远侧端设置在远端。所述方法还包括从导管内腔释放张力臂。张力臂的至少远端部分被设置在自体瓣膜的瓣环的心室侧,而输送导管的远侧端保持在瓣环的心房侧,并且管状框架的剩余部分从输送导管的内腔释放,使得管状框架被设置在自体瓣膜的瓣环内。
在一些实施方案中,人工瓣膜具有限定中心轴线的环形瓣膜框架,并且具有扩张构型,所述扩张构型具有沿中心轴线的垂直高度、沿垂直于中心轴线的横轴线的横向宽度、以及沿垂直于中心轴线和横轴线的纵轴线的纵向长度。用于制备人工瓣膜以通过输送导管输送给患者的方法包括通过将环形支撑框架沿中心轴线的尺寸从扩张构型减小到小于内腔直径的尺寸来垂直地压缩环形支撑框架,所述输送导管具有具有内腔直径的内腔。通过将环形支撑框架沿横轴线的尺寸从扩张构型减小到小于内腔直径的尺寸来横向地压缩环形支撑框架。环形支撑框架的垂直压缩和环形支撑框架的横向压缩共同将环形支撑框架设置成压缩构型。当处于压缩构型时,环形支撑框架被插入到输送导管的内腔中。
在一些实施方案中,将人工瓣膜输送到心脏的心室与心房之间的自体瓣膜的瓣环的方法包括在心脏的心房中设置具有内腔和纵轴线的输送导管的远端部分,其中输送导管的远侧端指向自体瓣膜的瓣环。人工瓣膜被以压缩构型设置在输送导管的远端部分内。人工瓣膜具有管状框架和安装在管状框架内的流动控制部件,所述管状框架具有联接至其远端侧壁的远端下张力臂和远端上张力臂。人工瓣膜具有扩张构型,其中流动控制部件允许血液沿第一方向流经人工瓣膜,并阻止血液沿与第一方向相反的第二方向流经人工瓣膜。人工瓣膜被设置在输送导管的内腔中,其中远端下张力臂和远端上张力臂被设置成朝向输送导管的远侧端。所述方法还包括从输送导管的内腔释放远端下张力臂以及从输送导管的内腔释放远端上张力臂。远端下张力臂的一部分放置在自体瓣膜的瓣环的心室侧,而远端上张力臂保留在瓣环的心房侧。在释放远端下张力臂和远端上张力臂之后,人工瓣膜的剩余部分从输送导管的内腔中释放,并且在部署期间,人工瓣膜被部署到自体瓣膜的瓣环中并固定于其,同时远端上张力臂与瓣环的心房侧上的瓣环上方组织接触,并且远端下张力臂与瓣环的心室侧上的瓣环下组织接触。
参考在附图中示出并在以下描述中详细描述的非限制性实施方案,更全面地解释本文中的实施方案及其各种特征和有利细节。省略了对公知的部件和处理技术的描述,以免不必要地模糊本文中的实施方案。本文使用的实例仅仅旨在便于理解其中可以实施本文的实施方案的方式,并且进一步使得本领域技术人员能够实施本文中的实施方案。因此,所述实例不应被解释为限制本文中的实施方案的范围。相反,提供这些实施方案是为了使本公开全面和完整,并且将向本领域技术人员充分传达本发明概念的范围。贯穿全文,相同的数字表示相同的元件。
本文使用的术语仅用于描述特定实施方案的目的,并不旨在限制权利要求的全部范围。如本文中所用,除非上下文清楚地指示出其它形式,否则单数形式“一个/种(a)”、“一个/种(an)”和“该(the)”也旨在包括复数形式。关于本文中的基本上任何复数和/或单数术语的使用,本领域技术人员可以根据上下文和/或应用将复数翻译成单数并且/或者将单数翻译成复数。为了清楚起见,可在本文中明确地阐述各种单数/复数排列。
本领域的技术人员将理解,一般来说,本文中,尤其是在所附权利要求(例如,所附权利要求的主体)中使用的术语通常被认为是“开放的”术语(例如,术语“包括(including)”应该被解释为“包括但不限于”,术语“具有(having)”应该被解释为“至少具有”,术语“包括(includes)”应该被解释为“包括但不限于”等)。
将进一步理解,当在本说明书中使用时,术语“包含(comprises)”和/或“包含(comprising)”指定所述的特征、整数、步骤、操作、元件和/或部件的存在,但不排除一个或多个其它特征、整数、步骤、操作、元件、部件和/或其组的存在或添加。如本文件中所用,术语“包含(comprising)”意指“包括但不限于”。
如本文中所用,术语“和/或”包括一个或多个相关列出项目的任意和所有组合。
本领域技术人员将进一步理解,无论是在说明书、权利要求书中还是在附图中,呈现两个或更多个替代术语的几乎任何析取词和/或短语都应该被理解为考虑包括术语之一、任一术语或两个术语的可能性。例如,短语“a或b”将被理解为包括“a”或“b”或者“a和b”的可能性。
如本领域技术人员将理解的,出于任何和所有目的,诸如在提供书面描述方面,本文公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围都可以很容易地被识别为充分地描述和使得相同的范围被分解成至少相等的子部分。如本领域技术人员将理解的,范围包括每个单独的成员。
除非另有定义,否则本文所用的所有技术和科学术语具有与本领域普通技术人员通常理解的含义相同的含义。本公开中的任何内容都不应被解释为承认本公开中描述的实施方案无权借助现有发明而早于此公开。
术语“瓣膜假体”或“人工瓣膜”可以指框架和小叶或流动控制结构或部件的组合,并且可以涵盖解剖部分的完全替换(例如,新的机械瓣膜替换自体瓣膜),以及替代和/或辅助、修复或改善现有解剖部分的医疗装置(例如,自体瓣膜留在原位)。
所公开的瓣膜包括构件(例如,框架),所述构件可以安置在自体瓣膜瓣环内,并且可以用作小叶结构、流动控制部件或柔性往复套管或套管-瓣膜的安装元件。根据实施方案,其可以包括或可以不包括这样的小叶结构或流动控制部件。此类构件在本文中可称为“环形支撑框架”、“管状框架”、“金属丝框架”、“凸缘”、“套环”和/或任何其它类似术语。
术语“流动控制部件”可以在非限制性的意义上指具有2、3、4小叶的柔性生物相容性材料(如缝合或连接到环形支撑框架的经处理或未经处理的心包)的小叶结构,以用作人工心脏瓣膜。这种瓣膜可以是心脏瓣膜,诸如三尖瓣瓣膜、二尖瓣瓣膜、主动脉瓣膜或肺动脉瓣膜,其在心脏舒张期间对从心房至心室的血流开放,并且在向外表面施加心室收缩压时关闭。按顺序反复开合可被描述为“往复”。流动控制部件被设想为包括多种(生物)人工心脏瓣膜,包括球瓣膜(例如,starr-edwards)、双叶瓣膜(st.jude)、侧倾盘状瓣膜(tiltingdiscvalves)(例如,bjork-shiley)、带支架心包心脏瓣膜假体(牛、猪、羊)(edwards生物假体系列,st.jude人工瓣膜),以及同种移植物和自体移植物瓣膜。生物人工心包瓣膜可包括生物人工主动脉瓣膜、生物人工二尖瓣瓣膜、生物人工三尖瓣瓣膜和生物人工肺动脉瓣膜。
在一些实施方案中,框架和流动控制部件可以是单独的结构,并且可被一起或单独输送。术语“瓣膜框架”或“人工瓣膜框架”或“瓣膜中的瓣膜(valve-in-valve)”可以指三维结构部件,通常为管状、圆柱形或椭圆形或环形,并且可以安置在自体瓣膜瓣环内,并被用作商购可得的瓣膜的安装元件,所述瓣膜为诸如edwardslifesciences的sapien、sapien3或sapienxt、edwardslifesciences的inspirisresilia主动脉瓣膜、abbott的mastershp15mm瓣膜、bostonscientific的lotusedge瓣膜、livanova/sorin的crownprt小叶结构、sorin的carbomedics家族瓣膜、或其它流动控制部件、或柔性往复套管或套管-瓣膜。
如本文中所用,术语“可扩张的”可指心脏瓣膜的能够从第一输送直径扩张至第二植入直径的部件。因此,可扩张结构并不意指可能因温度升高或其它偶然原因而发生轻微扩张的结构。相反,“不可扩张的”不应被解释为意指完全刚性或尺寸稳定,因为例如可以观察到常规“不可扩张的”心脏瓣膜的一定轻微扩张。
术语“侧向输送的”、“侧向输送”、“正交”、“正交输送”等用于描述与常规经导管心脏瓣膜相比,瓣膜以大约90度的角度被压缩和输送。正交输送是横向输送,其中周边远端侧壁首先离开输送导管,然后是中心孔,接着是近端侧壁。
在数学上,术语“正交”是指两条线或平面之间90度的交角。如本文中所用,术语“基本正交的”是指为90度加上或减去合适的公差的交角。例如,“基本正交的”可以指范围为75度至105度的交角。
所公开的瓣膜实施方案可通过经导管途径输送。术语“经导管”用于定义进入、控制和输送导管内腔内的医疗装置或仪器的过程,所述医疗装置或仪器被部署到心脏腔室(或体内其它期望的位置)中,以及已经由这种过程输送或控制的物品。已知经导管通路包括经股动脉和股静脉、经肱动脉和静脉、经颈动脉和颈静脉、经肋间(肋骨)间隙和经剑突下方。经导管可等同于经腔,在功能上与术语“经皮”相关,因为其涉及心脏瓣膜的输送。
在一些公开的实施方案中,人工瓣膜通过组织锚被部分地固定至自体组织。术语“组织锚”或“折叠组织锚(plicationtissueanchor)”或“第二组织锚(secondarytissueanchor)”,或“镖(dart)”或“销(pin)”是指将上心房框架通常在套环的周围或套环的周围附近连接到自体瓣环组织的紧固装置。锚可被定位成避免刺穿组织,并且仅仅依靠两个板状套环在被捕获的组织上的压缩力,或者锚本身可以或者与集成固定金属丝(securementwire)一起可以刺穿自体组织以提供锚定,或者两者的组合。所述锚可具有专门的固定机构,诸如具有凹槽和凸肩(flangedshoulder)的尖顶端,所述尖顶端被插入或弹出允许锚附接的配合孔或配合孔阵列中,但当孔周边锁定在凸肩附近的凹槽中时防止脱离。固定线可通过任何附接或锚定机构(包括结、缝线、线压接、具有凸轮机构的线锁、或其组合)附接或锚定到与销相对的套环上。
一些公开的实施方案包括支撑柱。术语“支撑柱”是指刚性或半刚性长度的材料,诸如镍钛合金(nitinoltm)或聚醚醚酮(peek),其可安装在带轮辐的框架上,并且轴向延伸,或者沿柔性套环的中心延伸,或者在柔性套环的缝合接缝内延伸。套管可以不附接至支撑柱,或者套管可以直接或间接附接至支撑柱。
术语“身体通道”可用于定义体内的血液导管或血管,所公开的人工瓣膜实施方案的特定应用决定了所讨论的身体通道。例如,主动脉瓣膜置换物将被植入主动脉瓣环中或其附近。同样,三尖瓣瓣膜或二尖瓣瓣膜置换物将被植入三尖瓣瓣环或二尖瓣瓣环。某些特征对于一个或另一个植入部位特别有利。然而,除非所述组合在结构上是不可能的,或者被权利要求语言排除,否则本文所述的任何瓣膜实施方案都可被植入任何身体通道中。
如本文中所用,术语“内腔”可指圆柱体或管的内部。术语“孔”可以指内腔的内径。
在一些实施方案中,部件可由合成材料(诸如聚氨酯或聚四氟乙烯)制成。当将薄的、耐用的合成材料考虑例如用作覆盖物时,可以任选地使用合成聚合物材料,诸如膨体聚四氟乙烯(ptfe)或聚酯。其它合适的材料可以任选地包括热塑性聚碳酸酯聚氨酯、聚醚聚氨酯、嵌段聚醚聚氨酯、硅酮聚醚聚氨酯、聚醚醚酮(peek)、硅酮-聚碳酸酯聚氨酯、聚丙烯、聚乙烯、低密度聚乙烯、高密度聚乙烯和超高分子量聚乙烯。另外的生物相容性聚合物可以任选地包括弹性体、聚烯烃、聚乙二醇、聚醚砜、聚砜、聚乙烯吡咯烷酮、聚氯乙烯、其它含氟聚合物、聚酯、聚对苯二甲酸乙二醇酯(pet)(例如,涤纶(dacron))、聚l-乳酸(plla)、聚乙醇酸(pga)、聚(d,l-丙交酯/乙交酯)共聚物(pdla)、硅酮聚酯、聚酰胺(尼龙)、ptfe、细长ptfe(elongatedptfe)、膨体ptfe、聚氨酯、硅氧烷聚合物和/或低聚物、和/或聚内酯,以及使用它们的嵌段共聚物。
环形支撑框架任选地在内部或外部部分或完全覆盖有生物相容性材料,诸如心包。环形或管状框架也可以任选地在外部部分或完全覆盖有第二生物相容性材料者如聚酯或
在一些实施方案中,框架部件可包括洗脱药物的金属丝框架。洗脱药物的金属丝框架可由三部分组成:金属丝框架平台、涂层和药物。无聚合物涂覆的框架的一些实例是amazonpax(minvasys),其使用amazoniacroco(l605)钴铬(co-cr)线框架,以紫杉醇作为抗增殖剂,腔外涂层被用作药物的载体。biofreedom(biosensorsinc.)使用不锈钢作为基底,以改良的腔外涂层作为抗增殖药物biolimusa9的载体表面。optima(cids.r.i.)使用316l不锈钢丝框架作为用于药物他克莫司的基底,利用集成的涡轮层碳膜作为药物载体。vestasync(mivtherapeutics)使用genx不锈钢(316l)作为基底,利用微孔羟基磷灰石涂层作为药物西罗莫司的载体。yukon选择(translumina)使用316l不锈钢作为用于药物西罗莫司与普罗布考的组合的基底。
生物可吸收聚合物也可在本文中用作药物的载体基质。cypher、taxus和endeavour是生物可吸收des的三种基本类型。cypher(j&j,cordis)使用涂覆有聚乙烯醋酸乙烯酯(peva)和聚甲基丙烯酸丁酯(pbma)的316升不锈钢以用于携带药物西罗莫司。taxus(bostonscientific)使用涂覆有半透明的苯乙烯异戊二烯丁二烯(sibs)共聚物的316升不锈钢丝框架以用于携带紫杉醇,紫杉醇在约为90天的时间内洗脱。endeavour(medtronic)使用钴铬合金驱动丝框架携带佐他莫司(zotarolimus),以磷酰胆碱作为药物载体。biomatrix采用s-wire框架(316l)不锈钢作为基底,具有用于携带抗增殖药物biolimus的聚乳酸表面。elixir-des计划(elixirmedicalcorp)由聚酯和聚丙交酯涂覆盖的金属丝框架组成,所述框架用于携带药物诺瓦莫司(novolimus),以钴-铬(co-cr)作为基底。jactax(bostonscientificcorp.)利用d-聚乳酸(dlpla)涂覆的(316l)不锈钢丝框架以用于携带紫杉醇。nevo(cordiscorporation,johnson&johnson)使用涂覆有聚乳酸-羟基乙酸共聚物(plga)的钴铬(co-cr)丝框架以用于携带药物西罗莫司。
图1a-1f是根据实施方案的经导管人工瓣膜102的各种示意图。经导管人工瓣膜102被配置成部署在身体内(例如,人患者体内)期望的位置,并允许血液沿第一方向流经经导管人工瓣膜102的流入端,并阻止血液沿与第一方向相反的第二方向流经经导管人工瓣膜102的流出端。例如,经导管人工瓣膜102可以是经导管人工心脏瓣膜,其被配置成部署在人心脏的自体三尖瓣瓣膜或自体二尖瓣瓣膜的瓣环内,以补充和/或替代自体瓣膜的功能。
经导管人工瓣膜102(在本文中也称为“瓣膜”)在垂直于瓣膜102的长轴线111(在本文中也称为“水平轴线”、“纵轴线”或“纵向轴线”)的至少一个方向上是可压缩和可扩张的。瓣膜102被配置成在用于在体内的期望位置(例如,人心脏)植入的扩张构型(图1a、图1b、图1c和图1e)与用于使用输送导管(未显示)引入体内的压缩构型(图1d和图1f)之间是可压缩的和可扩张的。
在一些实施方案中,瓣膜102可以居中,或者径向对称。在其它实施方案中,瓣膜102可以是偏心的,或者径向(y轴)不对称的。在一些偏心实施方案中,瓣膜102(或其外部框架)可具有d-形状(从顶部观察),因此平坦部分可以与瓣膜102将被展开的解剖结构相匹配。例如,在一些情况下,瓣膜102可被部署在三尖瓣瓣环中,并且可具有由将在其中安装瓣膜102的解剖结构确定的复杂形状。在三尖瓣瓣环中,三尖瓣瓣膜的圆周可以是圆形椭圆,已知中隔壁基本上是垂直的,并且已知三尖瓣在疾病状态下沿前后线扩大。在其它情况下,瓣膜102可被部署在二尖瓣瓣环中(例如,前小叶附近),并且可具有由将在其中安装瓣膜102的解剖结构确定的复杂形状。例如,在二尖瓣瓣环中,二尖瓣瓣膜的圆周可以是圆形椭圆,已知中隔壁基本上是垂直的,并且已知二尖瓣在疾病状态下扩大。
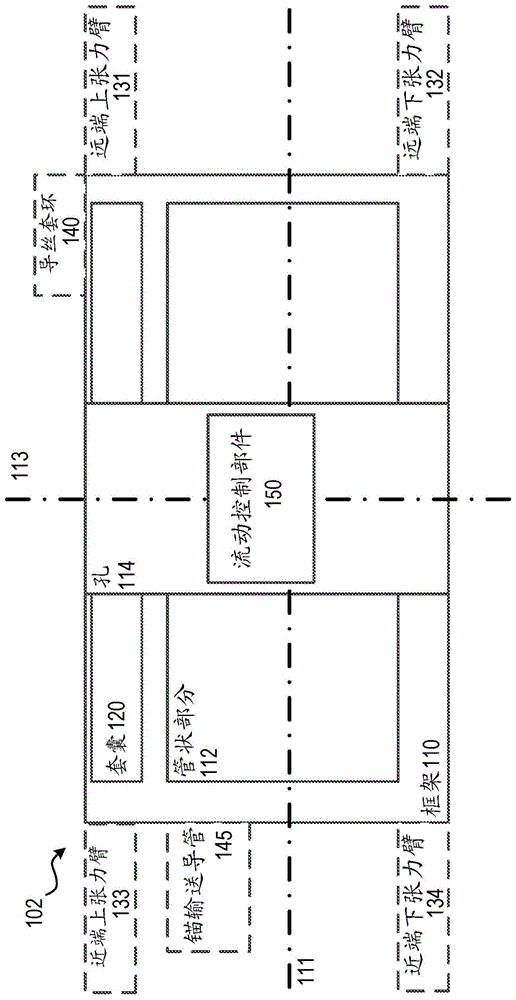
如图所示,瓣膜102通常包括环形支撑框架110和流动控制部件150。另外,瓣膜102和/或瓣膜102的至少环形支撑框架110任选地可包括远端上张力臂131、远端下张力臂132、近端上张力臂133、近端下张力臂134、导丝套环140和/或锚输送导管145中的一种或多种。
环形支撑框架110(在本文中也称为“管状框架”、“瓣膜框架”、“金属丝框架”或“框架”)可具有或可限定沿中心轴线113延伸的孔114。孔114(例如,中心轴向内腔)的尺寸和构造可以被设置成在孔114的直径上接收流动控制部件150。框架110可具有用于衔接自体瓣环组织的外周表面,所述外周表面可抵靠自体瓣环的内侧张紧,以向弱化的自体瓣环环提供结构通畅性。
框架110包括套囊或套环120和管状部分112。套囊或套环120(在本文中称为“套囊”)可以附接至并且/或者形成框架110的上边缘。当瓣膜102被部署在人心脏内时,套囊120可以是心房套囊或套环。心房套环120可被成形为符合自体部署位置。例如,在二尖瓣置换术中,心房套环120将被配置成具有不同的部分以符合自然瓣膜。在一个实施方案中,套环120将具有远端和近端上套环部分。远端套环部分可以大于近端上套环部分,以考虑环形或亚环形几何形状。
框架110可以任选地具有附接至框架110的上(心房)边缘的单独的心房套环,用于部署在心房底部上,用于将血液从心房引导到流动控制部件150中,并密封以防止框架110周围的血液渗漏(瓣周渗漏)。框架110还可任选地具有附接至框架110的下(心室)边缘的单独的心室套环,用于在心室中部署在自体瓣环下方,用于在心脏收缩期间防止反流渗漏,在心脏收缩期间防止瓣膜102移出,将自体瓣环或邻近组织夹在或压缩在心房套环或套囊120上,并且/或者任选地附接至流动控制部件150并支撑所述流动控制部件。一些实施方案可以同时具有心房套环和心室套环,而其它实施方案或者包括单个心房套环、单个心室套环,或者没有额外的套环结构。
在一些实施方案中,框架110可具有在扩张构型中限定孔114和中心轴线113的外周壁。周壁可包围套环120和管状部分112。在一些实施方案中,周壁可被进一步限定为具有前壁部分和后壁部分,它们沿近侧(例如,相对于下腔静脉(“ivc”))或近端侧连接到近端折叠区域,并且沿远侧或远端侧连接到远端折叠区域。前壁部分可被进一步限定为具有前上套环部分和前下主体部分,后壁部分可被进一步限定为具有后上套环部分和后下主体部分。前上套环部分和后上套环部分可以共同形成套环或套囊120。前下主体部分和后下主体部分可以共同形成管状部分112。
框架110可以是环状物或者圆柱形或圆锥形管,但也可具有平圆锥形、倒平圆锥形(顶部较窄,底部较宽)、凹圆柱体(壁向内弯曲)、凸圆柱体(壁向外凸出)、角沙漏、弯曲的、有刻度的沙漏、环状物或具有扩口式顶部、扩口式底部或者两者兼有的圆柱体的侧面轮廓。
考虑到框架110的厚度(例如,形成框架110的金属丝材料),框架110可具有在约5mm至60mm范围内的高度r,可具有在约20mm至80mm范围内的外径尺寸,以及可具有在约21mm至79mm范围内的内径尺寸。
框架110的设计优选地是可压缩的,并且当被释放时具有所述的性质,即它返回到其原始(未压缩的)形状。框架110可被压缩用于经导管输送,并且可使用经导管扩张球囊或作为自扩张形状记忆元件来扩张。在一些情况下,合适的形状记忆材料可包括耐用且生物相容的金属和塑料。例如,框架110可由超弹性金属丝诸如镍钛合金丝或其它类似功能的材料制成。镍钛合金可能是理想的有用材料,因为其可被加工成奥氏体、马氏体或超弹性材料。马氏体和超弹性合金可被加工以显示所需的压缩。所述材料可用于框架110或其任何部分。设想了使用其它形状记忆合金,诸如cu-zn-al-ni合金、cu-al-ni合金以及聚合物复合材料,包括含有碳纳米管、碳纤维、金属纤维、玻璃纤维和聚合物纤维的复合材料。
框架110可被构造成编织物、金属丝或激光切割的金属丝框架。此类材料可从任何商业制造商诸如pulsesystems处获得。金属丝框110的一种可能的构造设想了等径细镍钛合金管的激光切割。激光切割在镍钛合金管上形成规则的切口(cutout)。在一个实施方案中,使镍钛合金管扩张以形成由菱形单元形成的三维结构。所述结构还可具有附加的功能元件(例如环、锚等)用于附接附属部件,诸如生物相容性覆盖物、组织锚、可释放的部署和收回控制导向件、旋钮、附件、索具等。其次,框架110可被放置在所需形状的模具上,加热到相应的马氏体温度,并淬火。以这种方式处理金属丝框架将形成具有形状记忆特性,并且在校准温度下将容易回复到记忆形状的框架110。激光切割的金属丝框架优选由镍钛合金制成,但不限于由不锈钢、钴铬合金、钛和其它功能上等同的金属和合金制成。
或者,框架110可利用简单的编织技术来构造。使用镍钛合金丝(例如0.012”丝)和简单的编织固定装置,可将所述合金丝以简单的上/下编织模式缠绕在编织固定装置上,直到由单根丝形成等径管(例如,框架110)。使用不锈钢或镍钛合金联接管将丝材的两个松散端联接,将松散端放入所述联接管中并压接(crimped)。在一些实施方案中,大约60度的角辫(angularbraid)可能是理想的。其次,将编织的金属丝框架110放置在成形固定装置上,并在指定温度下放置在马弗炉中,以将金属丝框架110设定为期望的形状,并产生期望的马氏体或超弹性性质。
由于框架110由超弹性金属或合金诸如镍钛合金制成,所以框架110是可压缩的。优选地,框架110由多个可压缩的金属丝单元构成,所述金属丝单元具有基本垂直于中心轴线113的定向和单元几何形状,以在框架110被配置成垂直压缩构型、卷起压缩构型或折叠压缩构型时最小化金属丝单元应变。
在特定实施方案中,框架110(例如,人工心脏瓣膜的框架)可以以大致管状构型开始,并且被热成形以提供用于心房密封的上心房套囊或凸缘(例如,套囊120)和下跨瓣环管状或圆柱形部分,所述下跨瓣环管状或圆柱形部分在约60-80%的圆周上具有沙漏形横截面,以沿后瓣环段和前瓣环段符合自体瓣环,同时沿20-40%的瓣环圆周保持基本垂直平坦,以符合中隔瓣环段。
流动控制部件150可以在非限制性的意义上指用于控制通过其中的流体流动的装置。在一些实施方案中,流动控制部件150可以是具有2个、3个、4个或更多个小叶的小叶结构,所述小叶由柔性生物相容材料诸如经处理或未经处理的心包制成。小叶可以缝合或连接到支撑结构并且/或者可以缝合或连接到框架110。流动控制部件150可以安装在框架110内,并被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端。例如,流动控制部件150可被配置成使得瓣膜102例如用作心脏瓣膜,诸如三尖瓣瓣膜、二尖瓣瓣膜、主动脉瓣膜或肺动脉瓣膜,所述瓣膜可在心脏舒张期间向从心房到心室的血流打开,并且可由施加到外表面的心室收缩压关闭。按顺序反复开合可被描述为“往复”。流动控制部件150被设想为包括多种(生物)人工瓣膜,包括球瓣膜(例如,starr-edwards)、双叶瓣膜(st.jude)、侧倾碟瓣膜(tiltingdiscvalves)(例如,bjork-shiley)、带支架心包心脏瓣膜假体(牛、猪、羊)(edwards生物假体系列,st.jude人工瓣膜),以及同种移植物和自体移植物瓣膜。生物人工心包瓣膜可包括生物人工主动脉瓣膜、生物人工二尖瓣瓣膜、生物人工三尖瓣瓣膜和生物人工肺动脉瓣膜。
瓣膜102的布置可以使得商购可得的瓣膜(流动控制部件150)可被框架110接收或接受并且/或者以其它方式安装在框架110中。商购可得的瓣膜(流动控制部件150)可包括,例如,edwardslifesciences的sapien、sapien3或sapienxt、edwardslifesciences的inspirisresilia主动脉瓣膜、abbott的mastershp15mm瓣膜、bostonscientific的lotusedge瓣膜、livanova/sorin的crownprt小叶结构、来自sorin的carbomedics瓣膜家族的瓣膜、或其它一种或多种流动控制部件、或柔性往复套管或套管-瓣膜。
如上所述,瓣膜102和/或至少瓣膜102的框架110可以任选地包括远端上张力臂131、远端下张力臂132、近端上张力臂133、近端下张力臂134、导丝套环140和/或锚输送导管145中的一种或多种。张力臂131、132、133和134可被配置成衔接瓣环组织的一部分,以将框架110安装到在其中部署瓣膜102的自体瓣膜的瓣环上。张力臂131、132、133和/或134可以是任何合适的构型,诸如下面关于特定实施方案所描述的那些。锚输送导管145可以附接至框架110上,并被配置成从中接收组织锚190(图1b)。组织锚190又可以将瓣膜102和/或至少框架110锚定到瓣环组织。
可通过通常包括在导丝(图1a-图1f中未显示)上推进输送导管以将输送导管的远侧端放置在期望的位置处或其附近的过程将瓣膜102输送到体内的期望位置。因此,导丝可被设置在输送导管的内腔中。瓣膜102可被设置在输送导管的内腔中(例如,处于压缩构型),并在导丝上被推进通过输送导管。更具体地,在包括导丝套环140的实施方案中,导丝可以延伸穿过导丝套环140的孔,从而允许瓣膜102在导丝上或沿导丝推进。导丝套环140可以附接至框架110和/或张力臂131、132、133和/或134中的至少一个上。导丝套环140可被配置成选择性地衔接导丝的一部分或导丝组件的一部分,并且/或者可具有如下面关于特定实施方案所述的任何合适的构型。
瓣膜102在扩张构型与压缩构型之间是可压缩的和可扩张的。当瓣膜102在体内的期望位置(例如,自体瓣膜的瓣环)部署或植入(或准备部署或植入)时,其处于扩张构型。当处于图1c所示的扩张构型时,瓣膜102在沿中心轴线113或横向于中心轴线113的任何方向上的长度都大于用于将瓣膜102输送到体内的期望位置的输送导管的内腔直径。换句话说,瓣膜102在垂直于瓣膜111的纵轴线的任何方向上的长度大于输送导管的内腔直径。
当通过输送导管输送到体内的期望位置时,瓣膜102处于压缩构型。当处于图1d所示的压缩构型时,瓣膜102可被设置在输送导管内,并且可以相对于处于扩张构型的瓣膜102的尺寸在横向方向上被压缩,并且可沿纵轴线111在纵向方向上被拉长。纵轴线111可以平行于输送导管的纵轴线,并且可以以45至135度的相对于中心轴线113所成的交角(例如,垂直或以约90度)定向。在一些实施方案中,当处于扩张构型时,瓣膜102的水平x轴(例如,纵轴线111)正交于(90度),或基本正交于(75-105度),或基本倾斜于(45-135度)中心垂直y轴(例如,中心轴线113)。在一些实施方案中,处于压缩构型的瓣膜102的水平x轴(例如,纵轴线111)基本平行于输送导管的纵向圆柱形轴线。
如本文中所用,术语“交角”和/或“正交角”可以指(i)输送导管的纵向圆柱形轴线与压缩瓣膜102的长轴线111之间的关系,其中长轴线111垂直于常规瓣膜的中心轴线113,以及(ii)压缩或扩张的瓣膜102的长轴线111与由流经人工瓣膜102的血液所限定的轴线之间的关系,其中所述血液例如从身体或心脏腔室的一部分流向身体或心脏腔室的另一下游部分,诸如,通过自体瓣环从心房流向心室。
如图1c和图1d所示,当处于扩张构型时,瓣膜102可沿中心轴线113具有第一高度或尺寸,当处于压缩构型时,可沿中心轴线113具有小于第一高度或尺寸的第二高度或尺寸。当处于压缩构型时,瓣膜102的第二高度或尺寸小于输送导管的内腔直径,从而允许瓣膜102从中输送。
瓣膜102还可在另外的方向上被压缩。例如,图1e和图1f分别是处于扩张构型和压缩构型的瓣膜102的顶视图。瓣膜102具有垂直于纵轴线111和中心轴线113的横轴线115。当处于扩张构型时,瓣膜102在沿着或横向于横轴线115的任何方向上的长度大于用于输送瓣膜102的输送导管的内腔直径。换句话说,当处于图1e所示的扩张构型时,瓣膜102可具有沿横轴线115的第一宽度或尺寸,当处于图1f所示的压缩构型时,瓣膜102可具有沿横轴线115的小于第一宽度或尺寸的第二宽度或尺寸。
瓣膜102可以被压缩(如上所述)并以侧向或正交的方式输送,使得纵轴线111基本平行于输送轴线(例如,输送导管的纵轴线)。扩张的瓣膜102的形状可以是具有延伸的套环或套囊(例如,套囊120)的大直径缩短的圆柱体的形状。在一些实施方案中,瓣膜120可以被压缩,其中瓣膜102的中心轴线113大致垂直于(正交于)输送导管的纵向轴线。在一些实施方案中,瓣膜102可以被垂直(例如,沿中心轴线113)压缩,类似于将手风琴式圆柱体的高度从较高压缩为较矮。另外或作为替代,瓣膜102可被横向(例如,沿着横轴线115)压缩,类似于抵靠后片折叠或压缩前片。在其它实施方案中,可以通过卷起来压缩瓣膜102。在其它实施方案中,可使用压缩、折叠和/或卷起的组合来压缩瓣膜102。沿中心轴线113的压缩(例如,在垂直方向上的压缩)和沿横轴线115的压缩(例如,在横向或宽度方向上的压缩)与常规同轴输送的人工瓣膜的压缩形成对比,所述常规同轴输送的人工瓣膜通常沿横轴线(例如,横轴线115)和纵轴线(例如,纵轴线111)压缩以及沿中心轴线(例如,中心轴线113)伸长。
在一些实施方案中,瓣膜102可具有5-60mm的扩张高度(y轴)。在一些实施方案中,瓣膜102可以具有20-80mm,优选40-80mm的扩张直径长度和宽度,并且在某些实施方案中,长度和/或宽度可以变化,并且包括与与长度相同或不同的宽度组合的20mm、25mm、30mm、35mm、40mm、45mm、50mm、55mm、60mm、65mm、70mm、75mm和80mm的长度。
在一些实施方案中,瓣膜102可具有6-15mm,优选8-12mm,更优选9-10mm的压缩高度(y轴)和/或宽度(z轴),以及约5-60mm,优选约5-30mm,更优选约5-20mm或甚至8-12mm或8-10mm的扩张的部署高度。在一些实施方案中,瓣膜102的长度(x轴)不需要压缩,因为当设置在输送导管中时,其可沿输送导管的中心圆柱形轴线的长度延伸。
在一些实施方案中,瓣膜102可被布置成使得流动控制部件150的内部框架或结构保持例如小叶组织的直径为25-29mm,框架110或其部分的直径为50-70mm,框架110的套环结构(套囊120)延伸超出框架110的顶部边缘10-30mm,以在心房底部上提供密封以防止瓣周渗漏(pvl)。
返回参考图1b,瓣膜102可被设置在人心脏内的自体瓣膜例如肺动脉瓣膜(pv)或二尖瓣瓣膜(mv)-或主动脉瓣膜或三尖瓣瓣膜(在图1b中未显示)的瓣环内。如上所述,瓣膜102可以处于压缩构型,并通过输送导管输送至瓣环。瓣膜102可从输送导管释放,并被允许扩张至图1b所示的扩张构型。瓣膜102的部署可包括将远端下张力臂132放置在瓣环下方的心室中,而瓣膜102的其余部分在心房中。瓣膜102可被放置在自体瓣膜(pv或mv)的瓣环中,并且远端下张力臂132的至少一部分可被定位在心室的流出道(例如,rvot,如图1b所示)中。在瓣膜102包括附加张力臂的实施方案中,远端上张力臂131和近端上张力臂133可被设置在自体瓣膜上方的心房中,而近端下张力臂134可被设置在自体瓣膜下方的心室中。这样,包括在瓣膜102中的一个或多个任选的张力臂131、132、133、134可以对自体瓣膜结构或组织施加力,以将瓣膜102安装在自体瓣膜的瓣环内。例如,上张力臂131和/或133可在右心室的方向上施加瓣环上方向下力,下张力臂132和/或134可在右心房的方向上施加瓣环下向上力。
瓣膜102在瓣环中的安装可任选地包括通过组织锚190将瓣膜102锚定至自体瓣膜上。组织锚190可以是例如尖齿或倒钩,其被定位成提供与瓣环附近组织的附接。可通过机械方式,诸如使用球囊导管将组织锚190压入瓣环组织。在一个非限制性实施方案中,组织锚190可以任选地是半圆形钩,其在框架110(或瓣膜102)扩张时,刺穿、旋转进入并牢固地保持瓣环组织。组织锚190可以通过输送导管(例如,经由锚输送导管145)的线上输送来部署。输送导管可具有多个轴向腔,用于输送各种锚定工具,包括锚定位工具、施力工具、钩、勒除工具(snaringtool)、切割工具、射频和放射可视化工具和标志物、以及缝线/线操作工具。一旦一个或多个组织锚190附接至瓣膜,张紧工具可用于调节连接到植入的瓣膜102的一个或多个系链等的长度,以根据正常功能的需要调节和固定植入的瓣膜102。还可以设想,一个或多个组织锚190可以是弹簧加载的,并且可具有内置在一个或多个锚190的系连面中的系链附接或系链捕获机构。锚190或系链可穿过瓣膜102或框架110的锚输送导管145。锚190还可具有向内生长的材料,诸如聚酯纤维,以促进锚向内生长到心脏组织中。在一个实施方案中,在瓣膜102可以包括或可以不包括心室套环的情况下,锚190(例如,镖、尖齿或倒钩)不附接至下心室套环,而是直接附接至瓣环组织或其它用于锚定的组织中。
在一些实施方案中,框架110和流动控制部件150可以是单独的结构,并且一起或单独地被输送到体内的期望位置。例如,流动控制部件150可被定位在框架110的孔114内以形成完整的瓣膜102,并且瓣膜102可被压缩并通过输送导管输送到体内的期望位置,如上文详细描述的。在其它实施方案中,框架110和流动控制部件150可被分别输送到体内的期望位置。例如,框架110可被压缩并通过输送导管输送到体内的期望位置。框架110可从输送导管释放,并部署在例如自体瓣膜的瓣环中。一旦从输送导管释放,框架110就处于扩张构型,因此,在扩张构型中,框架110被部署在自体瓣膜的瓣环中。然后,流动控制部件150可被单独输送(例如,通过输送导管)并安装到部署的框架110中。
下面提供了对经导管人工瓣膜的某些方面或实施方案的讨论。下面针对具体实施方案描述的经导管人工瓣膜(或其方面或部分)可以至少在形式和/或功能上基本上与上面参考图1a-图1f描述的瓣膜102和/或瓣膜102的相应方面类似。因此,在本文中不再对特定实施方案的某些方面进行详细描述。
图2是根据实施方案的低轮廓(例如,8-20mm)侧载人工瓣膜1102的图示。瓣膜1102可以基本上与图1a-图1f所示的瓣膜102类似。图2显示了处于扩张构型并部署到自体瓣环中的瓣膜1102。
图3是具有框架1110和流动控制部件1150的瓣膜1102的图示,所述瓣膜显示为压缩或容纳在输送导管1172内。
图4a是瓣膜1102的图示,所述瓣膜显示为从输送导管1172弹出并抵靠自体瓣环的前侧定位。当通过辅助导管1180以该倾斜角保持瓣膜1102时,评估瓣膜功能和患者状况(如下文更详细描述的),并且如果合适,将瓣膜完全部署在自体瓣环内,并且使用常规锚定元件(例如,组织锚190)锚定。
图4b是根据实施方案的低轮廓、侧面装载的人工瓣膜1202的开放横截面图的图示。瓣膜1202包括内部瓣膜套管或流动控制部件1250和框架1210。瓣膜1202可以与瓣膜1102类似。
图5是根据实施方案的低轮廓、侧面装载的心脏人工瓣膜1302的图示。瓣膜1302具有用于管状框架1310的编织或激光切割的结构,其中瓣膜套管或流动控制部件1350延伸超出管状框架1310的底部。图5显示了用于朝向rvot瓣环下地延伸的较长的下张力臂1332,以及用于在心房底部上方延伸的较短的上张力臂1331。
图6是在输送导管1372内处于压缩构型的瓣膜1302的图示。图6显示了附接至用于弹出、定位和锚定瓣膜1302的可操纵的辅助导管1380的瓣膜1302。辅助导管1380也可用于恢复瓣膜1302的失败部署。
图7是显示处于部分压缩构型、部分在输送导管1372内以及从输送导管1372部分弹出的瓣膜1302的图示。图7显示了当瓣膜1302仍然被压缩时,可通过自体瓣膜的小叶和腱索操纵下张力臂1332,从而为瓣膜1302的远端侧找到稳定的前侧安置。
图8是衔接自体瓣膜的瓣环前侧的组织的瓣膜1302的图示,其中管状框架1310的弯曲远端侧壁围绕自体瓣环密封。图8显示了通过可操纵的辅助导管1380以其中能够评估瓣膜功能的倾斜角保持的瓣膜1302。
图9是完全部署到自体瓣膜的瓣环中的瓣膜1302的图示。瓣膜1350的远端侧显示为衔接自体瓣环前侧上的组织,其中管状框架1310的弯曲远端侧壁周围密封自体瓣环,并且其中近端侧壁被张紧地安装到自体瓣环的后侧。
图10是人工瓣膜1402的实施方案的平面视图的图示,所述人工瓣膜1402显示为在输送导管1472内处于压缩构型。图10显示了向外翻转,导致导管容纳的瓣膜1402的高度降低了50%的管状框架1410。低轮廓、侧面装载的瓣膜1402不需要设计常规的经导管瓣膜来缓解的侵害力、支柱断裂力、组织撕裂力、拆线力。
图11是输送导管1472内的压缩瓣膜1402的横截面视图的图示。该横截面端视图显示了单折压缩构型的一个实施方案,其中管状框架1402和附接的两片式套管或流动控制部件1450向外翻转五次,导致高度降低50%,从而提供了适配在1cm(10mm)输送导管1472的内径内的能力。
图12是折叠在输送导管1472内的压缩瓣膜1402的另一个实施方案的横截面视图的图示。该横截面端视图显示了单折压缩构造的另一个实施方案,其中管状框架1410和附接的两片式套管或流动控制部件1450向外折叠四次,导致高度降低50%,从而提供了适配在1cm(10mm)输送导管1472的内径内的能力。
图13是瓣膜1402的横截面视图的图示,其进一步说明如何能够由于低轮廓、侧面装载的瓣膜1402的最小材料需求而实现折叠和卷起构型。
图14a-图14c示出了低轮廓瓣膜1502被卷成压缩构型以放置在输送导管1572内的顺序。瓣膜1502包括具有孔1514并支撑套管或流动控制部件1550的管状框架1510。
图15是显示已被纵向卷起并装载在输送导管1572内的瓣膜1502以及显示框架1510和套管流动控制部件1550的端视图的图示。
图16a至图16d示出了一个实施方案,其显示了用于压缩人工瓣膜1602以提供与输送导管(未显示)的纵向轴线共面或平行的长轴线(例如,类似于图1a-图1f所示的长轴线111)的四步过程。这些图显示了瓣膜1602是可围绕平行于输送导管的纵向轴线的长轴线压缩的,所述瓣膜1602具有由套囊和跨瓣环管状部分制成的管状框架1610,具有安装在管状框架1610内并被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜1602的流出端的流动控制部件1610。这些图显示了瓣膜1602可压缩至压缩构型以用于使用输送导管引入体内,其中压缩构型具有垂直于血流方向轴线的长轴线(例如,定向成与第一(血流)方向成45-135度(例如,90度)的交(正交)角),并且其中瓣膜1602的压缩构型的长轴线基本平行于输送导管的纵向轴线,其中瓣膜1602的高度约为5-60mm,直径约为25-80mm。
图16a显示了处于未压缩构型的瓣膜1602的图示。图16b显示了框架1610的套囊的初始卷起或折叠的图示。如此处所示,折叠或卷起可以向内,或者可以向外卷起,或者也可以一起变平,以将整个瓣膜1602从底部向上卷起到顶部。图16c显示了瓣膜1602的图示,所述瓣膜1602已经使用多次折叠或卷起沿长轴线卷起或折叠成管形状。图16d显示了完全压缩的瓣膜1602的图示,所述瓣膜1602已被折叠或卷起,例如使用压缩附件折叠或卷起成压缩构型,然后可将其装载到输送导管(未显示)中。当使用形状记忆合金从输送导管释放时,压缩的瓣膜1602可以自扩张,或者一旦瓣膜1602从输送导管释放,瓣膜1602就可在第二过程中进行球囊扩张。
图17a是根据实施方案的具有至少一个折叠区域的可侧向输送的经导管人工瓣膜1702的侧面透视图的图示,所述瓣膜处于扩张构型。图17a显示了瓣环框架1710的套环部分1720中的远端折叠区域1723a,其允许压缩瓣膜1702,而不会使瓣环框架1710或内部流动控制部件1750受到破坏性压缩力。
图17b是瓣膜1702的侧面透视图的图示,其显示了瓣膜1702的套环部分1720的前侧1721开始单边卷起过程,如箭头1763所示。图17b显示了两个折叠区域,近端(近)折叠区域1723a和远端(远)区域1723b。折叠区域1723a和1723b可以没有金属丝单元(金属丝框架部分),或者可由大的或定向的单元组成,以最小化来自压缩过程的折叠或卷起损伤。从这个角度可以看到流动控制部件1750的小叶1753。
图17c是瓣膜1702的侧面透视图的图示,其显示了单边卷起过程1763的第二卷起步骤。前套环1721被卷到中心远端折叠区域1723b和近端折叠区域1723a,其中后中隔套环1722处于展开的扩张构型。
图17d是瓣膜1702的侧面透视图的图示,其显示了单边卷起过程1763的第三卷起步骤。瓣膜1702继续朝向后中隔套环1722卷起压缩。
图17e是瓣膜1702的侧面透视图的图示,其显示了获得压缩构型的单边卷起过程1763的完成。
图18a是处于扩张构型的瓣膜1802的侧面透视图的图示,其显示了瓣膜1802的两侧开始双边卷起过程1864,其中4个折叠区域(显示的)中的2个是远端折叠区域1823b和第二远端折叠区域1824b。瓣膜1802的框架1810的前套环1821和框架1810的后中隔套环1822以虚线显示了外部框架壁1816和小叶1853,以供参考。
图18b是瓣膜1802的侧面透视图的图示,其显示了双边卷起过程1864的第二卷起步骤。环形支撑框架1810的边缘显示为朝向中心轴线1811向内卷起。远端折叠1823b和第二远端折叠124b分别显示为与近端折叠区域1823a和第二近端折叠区域1824a相对。显示了瓣膜1802的流动控制部件1850的流动控制小叶1853以供参考。
图18c是瓣膜1802的侧面透视图的图示,其显示了双边卷起过程1864的第三卷起步骤。此处,卷边(rolledrim)朝着中心轴线1811进一步向内卷起。
图18d是瓣膜1802的侧面透视图的图示,其显示了显示为朝向中心轴线1811向内卷起的双边卷起压缩过程1864的完成。图18d显示了瓣膜1802在输送导管(未显示)内以压缩构型出现的情况。
图19a是处于压缩构型的瓣膜1902的侧面透视图的图示,所述瓣膜1902已使用卷起和折叠过程1965压缩。卷起瓣膜1902的下部,并且围绕中心长轴线1911纵向折叠瓣膜1902的上套环部分。
图19b是部分未压缩的瓣膜1902的侧面透视图的图示,其显示了下主体部分的展开和扁平上套环部分的展开。图19b显示了套环部分中的折叠区域1923a和1923b。
图19c是进一步未压缩的瓣膜1902的侧面透视图的图示,其显示了展开的下主体部分和展开的上套环部分。当瓣膜1902采取其扩张构型时,套环中的折叠区域更宽。
图19d是处于扩张构型的瓣膜1902的侧面透视图的图示,其显示了与先前的视图成90度的不同的侧面/取向。
图20是具有圆形双曲面(沙漏形)形状的瓣膜2002的侧面透视图的图示。金属丝框架细节未显示,因为在实践中,外表面优选诸如用dacron聚酯覆盖以促进向内生长。根据实施方案,近端折叠区域2023a和远端折叠区域2023b沿水平轴线2011显示在框架2010的前套环2021和后中隔套环2022的相对端上,其中显示了前前壁2016和中心通道或孔2014。
图21是瓣膜2002的剖视图的图示。图21显示了流动控制部件的内部小叶2053和内部框架附接至瓣环框架2010的内表面,其中套环部分2020经由壁部分2012附接至瓣环下锚定部分2032。此处,流动控制部件仅附接在框架2010的顶部边缘,尽管可以设想其它非限制性的附接(例如,中间壁、多个附接点等)。
图22是根据实施方案的瓣膜或瓣膜框架2110的分解图的图示,所述瓣膜或瓣膜框架2110具有漏斗形前套环2121、漏斗形后中隔套环2122、前圆柱体主体部分2112a和后中隔圆柱体主体部分2112b。图22显示了一种变型,其中瓣膜框架2110包括用于形成相对片的金属丝单元,所述相对片在近端折叠区域2123a和远端流动区域2123b处使用使织物应变最小化的片连接。图22还显示了流动控制部件2150,其具有安装在内部u形金属丝框架2152上的三叶瓣膜2153。
图23是瓣膜或瓣膜框架2110的侧视图的图示,其显示了瓣膜框架2110的两(2)个片或壁2116a和2116b。所述片或壁2116a可包括前套环部分2121和前圆柱体主体部分2112a,所述片或壁2116b可包括后中隔套环部分2122和后中隔圆柱体主体部分2112b。图23显示了用于套环部分2121的框架2110的菱形金属丝单元2125a在高度上可以是一个大的菱形,而下主体部分2112a可使用两个在高度上较小的菱形金属丝单元来构造。虚线示出了内部流动控制部件的附接位置,但未显示。
图24是处于压缩构型的瓣膜或瓣膜框架2110的两片式实施方案的侧视图的图示。
图25是根据实施方案的瓣膜或瓣膜框架2110的分解图的图示,所述瓣膜或瓣膜框架2110具有漏斗形前套环2221、漏斗形后中隔套环2222、前圆柱体主体部分2212a和后中隔圆柱体主体部分2212b。图25显示了一种变型,其中瓣膜框架2210包括用于形成整个相对片的金属丝单元。图25还显示了流动控制部件2250,其具有安装在内部u形金属丝框架2252上的三叶瓣膜2253。图25还显示了可用于将框架2210锚定在自体瓣膜的瓣环中的瓣环下接片2230。
图26是瓣膜或瓣膜框架2210的侧视图的图示,其显示了瓣膜框架2210的两(2)个片或壁2216a和2216b。图26显示了用于套环部分2221的框架2210的波形金属丝单元(wavewirecell)2225b在高度上可以是一个大的波形单元,而下主体部分2212a可使用一个或两个在高度上较小的波形金属丝单元来构造。虚线示出了内部流动控制部件的附接位置,但未显示。
图27是处于压缩构型的瓣膜或瓣膜框架2210的两片式实施方案的侧视图的图示。
图28是由波形金属丝单元2325b形成的人工瓣膜的框架2310的侧面透视图的图示。框架2310在波形金属丝单元2325b中具有近端折叠区域2323a和远端折叠区域2323b。虚线示出了内部流动控制部件的附接位置,但未显示。
图29是瓣膜框架2310的顶视图的图示,所述顶视图示出了波形金属丝单元2325b中的近端折叠区域或间隙2323a和远端折叠区域或间隙2323b。中央流动控制部件开口显示为水平线性间隙2354。
图30是由菱形金属丝单元2425a形成的人工瓣膜的框架2410的侧面透视图的图示。框架2310在菱形金属丝单元2425a中具有一组折叠区域或间隙2419。虚线示出了内部流动控制部件的附接位置,但未显示。没有显示线框细节,因为在实践中,外表面优选地诸如用dacron聚酯覆盖物2417覆盖,以促进向内生长。
图31是瓣膜的顶视图的图示,其显示了具有菱形金属丝单元2425a的普通环形支撑金属丝框架中的折叠区域或间隙2419。中央流动控制部件开口显示为三叶结构2455。
图32a是根据实施方案的人工瓣膜的框架2510的侧面透视图的图示。框架2510在普通金属丝单元结构中具有一组折叠区域或间隙2519,其中折叠间隙2519被横跨间隙2519的织物网(fabricmesh)覆盖。织物折叠片2519a显示在框架2510的下主体部分的近端侧和远端侧上。还显示了用于框架2510的下主体部分的聚酯覆盖物2517。
图32b是框架2510的侧视图的图示,其显示了处于部分卷起构型的下主体部分。图32b显示了下主体部分朝向自体瓣膜的中隔小叶展开。
图33a是根据实施方案的人工瓣膜的框架2610的侧面透视图的图示。瓣膜2610具有平的套环部分2620和圆柱体主体部分2612。图33a显示了框架2610的套环部分2620中的近端折叠区域2623a和远端折叠区域2623b以及下主体部分2612中的折叠区域2626。
图33b是框架2610的侧面透视图的图示,其显示为扁平和部分压缩的。图33b显示了套环滑动件2620的两侧向内压缩折叠区域2623a、2623b,以收缩中心轴向开口或孔,同时沿折叠区域或接缝2626展平下主体部分2612。
图33c是框架2610的侧面透视图的图示,所述框架2610经显示具有被折叠以变平并被部分压缩的套环部分2620,和被卷起以变平并被部分压缩的下主体部分2612。
图33d是框架2610的侧面透视图的图示,所述框架2610经显示具有被折叠以变平并被部分压缩的套环部分2620和通过卷起到套环部分2620而被完全压缩的下主体部分2612。
图33e是处于其压缩构型的变平的压缩的瓣膜框架2610的侧面透视图的图示,其中下主体部分2612通过卷起并折叠到变平的上套环部分2620上而被压缩。
图34a是复合激光切割的工件在扩张成瓣膜框架2710之前的侧面透视图的图示。图34a显示了与金属丝网或金属丝编织部分2725a组合的金属丝环部分2725c可以与单个金属丝框架结构组合。
图34b是瓣膜2710的侧面透视图的图示,其显示了扩张成处于扩张构型的瓣膜金属丝框架后的复合激光切割的工件。图34b显示了框架2710的套环部分,其具有编织或激光切割的金属丝单元结构2725b和具有金属丝环结构2725c的下主体部分。
图35a是在扩张成一组瓣膜框架片或壁2816a和2816b之前的激光切割的正交单元工件的侧面透视图的图示。图35a示出了不对称的不规则圆形金属丝单元2825d。
图35b是在框架组装之前,扩张成瓣膜线框片或壁2816a和2816b之后激光切割的正交工件的侧面透视图的图示。图35b显示了圆形的、水平定向的金属丝单元2825d,其用于在组装框架的折叠、卷起和压缩过程中最小化金属丝应变。
图36a是在扩张成瓣膜框架片或壁2916a和2916b之前具有之字形/菱形单元2925a的激光切割的正交单元工件的侧面透视图的图示。
图36b是在组装之前,扩张成瓣膜线框片280、282之后具有之字形/菱形单元298的激光切割的正交工件的侧面透视图的图示。图36b示出了菱形、水平定向的金属丝单元298,其用于在折叠、卷起和压缩期间最小化金属丝应变。
图37a是瓣膜线框片或壁3016a和3016b的侧面透视图的图示,将所述瓣膜线框片或壁3016a和3016b沿侧边缘3026a缝合以形成三维瓣膜框架3010,所述瓣膜框架3010具有弧形套环部分3021、3022和圆柱体主体部分,其中内部流动控制部件3050安装在圆柱体主体部分内,并且以收缩或折叠构型显示。
图37b是瓣膜线框片或壁3016a和3016b的顶部透视图的图示,将所述瓣膜线框片或壁沿侧边缘3026a缝合以形成三维瓣膜框架3010,所述三维瓣膜框架3010具有弧形套环部分3021、3022和圆柱体主体部分,其中内部流动控制部件3050安装在圆柱体主体部分内,并以扩张构型显示。
图37c是通过卷起压缩的两片式瓣膜框架3010的侧面透视图的图示。图37c显示了沿连接(缝合,连接)边缘3026缝合的两个片。
图37d是两片式瓣膜框架3010的侧面透视图的图示,所述两片式瓣膜框架3010处于卷起、压缩构造,具有至少1圈、高达1.5圈或至少360度、以及高达至少540度。
图38a是单片金属或金属合金的顶视图的图示,其中可压缩单元被切割或形成为第一和第二套环片以及第一和第二主体部分,以形成金属丝瓣膜框架3110。图38a显示了切割和折叠设计。图38a显示了套环可以折叠的位置,使得套环上的两个点a合在一起,并且下部可以折叠,使得下部上的两个点b合在一起,以形成三维瓣膜框架结构3110,其中部分折叠以最小化对大范围缝合的需求。
图38b是单片瓣膜框架3110在沿开口接缝折叠、组装和附接后的顶部透视图的图示。
图38c是在沿开缝折叠、组装和附接之后处于其扩张构型的单片瓣膜框架3110的侧透视图的图示。
图39是瓣膜框架3210的侧面透视图的图示,所述瓣膜框架3210由一系列在连接点处连接的水平波形金属丝3225e形成,具有上套环部分,和用于下主体部分的沙漏形状,处于其扩张构型。缝合特征沿连接边缘显示。
图40是瓣膜框架3310的侧面透视图的图示,所述瓣膜框架3310由一系列(垂直的)锯齿形金属丝3325b形成,所述锯齿形金属丝3325b在连接点处连接,具有上套环部分,和用于主体部分的沙漏形状,处于其扩张构型。缝合特征沿连接边缘显示。
图41a是根据实施方案的处于其扩张构型的瓣膜框架3410的顶透视图的图示。瓣膜框架3410具有由一系列扇形不对称的、不规则的圆形单元/金属丝3425d形成的上套环部分,所述单元/金属丝3425d周向连接到框架3410的下主体部分的顶部外周边缘。
图41b是瓣膜框架3410的剖视图的图示,其显示了由一系列扇形不对称的、不规则的圆形单元/金属丝3425d形成的上套环部分,所述单元/金属丝3425d周向连接到下主体部分的顶部外周边缘,并且显示了安装有下主体部分的流动控制部件3450的一半。
图41c是处于部分扩张构型的框架3410的上套囊或套环部分的侧面透视图的图示,其显示了细长的扇形不对称、不规则的圆形单元/金属丝3425d如何允许伸长和径向压缩。
图41d是流动控制部件3450的两片式实施方案的侧面透视图的图示。
图41e是具有编织的金属丝单元结构3425b的框架3410的下主体部分的实施方案的侧面透视图的图示。
图41f是具有菱形激光切割的金属丝单元结构3425a的框架3410的下主体部分的实施方案的侧面透视图的图示。
图41g是框架3410的下主体部分的实施方案的侧面透视图的图示,所述框架3410具有连接波形金属丝单元结构3425e。
图42是金属或金属合金的扁平金属丝框架的顶视图的图示,所述框架具有可压缩的金属丝单元,所述金属丝单元以应变最小化取向配置,以便于人工瓣膜的正交装载和输送。当人工瓣膜被压缩成压缩构型时,可压缩的金属丝单元的布置和/或形成允许单元压缩、变形或重新配置,同时使金属丝瓣膜框架内的应变最小化。图42显示了用于金属线框架的套环部分的外部波形单元3525b和用于金属线框架的下主体部分的内部菱形单元3525a。
图43是较小尺寸的扁平金属或金属合金丝框架的顶视图的图示,所述框架具有以应变最小化取向配置以便于人工瓣膜的正交装载和输送的可压缩金属丝单元。图43显示了用于金属丝框架的套环部分的外部波形单元3525b和用于金属丝框架的下主体部分的内部菱形单元3525a。
图44是处于漏斗构型(热定形)的金属丝框架的一部分的侧面透视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图44显示了用于金属丝框架的套环部分的外部菱形单元3525a和用于金属丝框架的下主体部分的内部菱形单元3525a。
图45是处于漏斗构型(热定形)的金属丝框架的一部分的侧面透视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图45显示了用于金属丝框架的套环部分的外部菱形单元3525a和用于金属丝框架的下主体部分的内部菱形单元3525a。
图46是处于漏斗结构(热定形)的金属丝框架的中心轴线的俯视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图46显示了用于金属线框架的套环部分的外部波形单元3525b和用于金属线框架的下主体部分的内部菱形单元3525a。
结合以上几个实施方案描述的两(或更多)片式瓣膜框架结构的一个益处是,每个框架片可以形成为平片,而不是编织物、激光切割的管等。这种平片部件的制造工艺可以比其它技术便宜得多。例如,可使用例如光刻和电阻掩模(resistivemask)来蚀刻片,而不是使用激光在片中切割孔来形成金属丝框架结构。这种技术还使得能够在片的不同区域选择性地将片蚀刻成不同的厚度,从而对片的(以及由此由片形成的瓣膜框架的)不同部分的机械或结构特性提供更多的设计控制。图47a是金属合金片3605a的侧面透视图的图示,所述金属合金片3605a已使用光刻和电阻掩模在单面上进行了部分蚀刻。金属合金片3605a可用于形成金属丝瓣膜框架。
图47b是金属合金片3605b的侧面透视图的图示,所述金属合金片3605b已经使用光刻和电阻掩模以双面配置进行了部分蚀刻。金属合金片3605b可用于形成金属丝瓣膜框架。
如上文参考图1a和图1b所述,瓣膜和/或瓣膜框架可包括许多被配置成将瓣膜和/或瓣膜框架安装、固定或锚定在自体瓣膜的瓣环内的张力臂和/或锚定构件。张力臂可以例如从瓣膜框架延伸,并且可以衔接瓣环上方组织或瓣环下组织。本文所述的瓣膜和/或瓣膜框架中包括的张力臂可以在至少形式和/或功能上基本上与上文参考图1a和图1b所述的张力臂131、132、133和/或134中的至少一种类似。瓣膜和/或瓣膜框架可包括和/或可被联接到锚定构件,所述锚定构件可用于将瓣膜或瓣膜框架安装或锚定在自体瓣膜的瓣环中。本文所述的瓣膜和/或瓣膜构件中包括的和/或与所述瓣膜和/或瓣膜构件一起使用的锚定构件可以至少在形式和/或功能上基本上与上文参考图1a和图1b描述的组织锚190类似。
图48是具有瓣膜框架3710的人工瓣膜的实施方案的平面视图的图示,所述瓣膜框架3710具有安装在并锚定到自体瓣环的前小叶侧的远端上张力臂3731和远端下张力臂3732。框架3710包括机械锚定元件,例如用于锚定在自体瓣环的后中隔侧上的近端密封套囊3720。密封套囊3720可以是瓣膜框架3710后侧上的短接片,或者可以是衔接心房底部以密封瓣环防止瓣周渗漏的半圆形或圆形的套环或套囊(例如,类似于上面参考图1a-图1f描述的套囊120)。瓣膜的部署可包括将瓣膜框架3710放置在自体瓣膜的瓣环处或其附近,并将远端下张力臂3732定位在瓣环下位置,例如rvot中。远端上张力臂3731可以放置在瓣环上方位置,例如,心脏的心房中。这样,远端上张力臂3731可对瓣环组织施加瓣环上方向下力,远端下张力臂132可对瓣环组织的相对侧施加相反的瓣环下向上力。所述力用于将瓣膜框架3710安装或固定在自体瓣膜的瓣环内。
图49是具有瓣膜框架3810的人工瓣膜的一个实施方案的平面图的图示,该瓣膜框架3810具有安装并锚定到自体瓣环的前小叶侧的远端上张力臂3831和远端下张力臂3832。框架3810包括机械锚定元件,例如沙漏形瓣环密封件3820,用于锚定在自体瓣环的后中隔侧上。沙漏形或凹形密封套囊3820可以仅仅是瓣膜后侧上的短段,或者可以是衔接心房底部和心室顶部以密封瓣环防止瓣周渗漏的半圆形或圆形组合的上、下套环或套囊。沙漏形或凹形密封套囊3820可由例如近端上张力臂3833和近端下张力臂3834形成。近端上张力臂3833和近端下张力臂3834可对如与远端张力臂3831和3832一起描述的瓣环组织施加相反的力。该实施方案还可包括具有部分套环的实施方案。该实施方案可与本文所述的其它锚定元件诸如组织锚结合使用。
图50是根据实施方案的人工瓣膜3902的平面视图的图示。瓣膜3902包括具有安装并锚定到瓣环上的远端上张力臂3931和远端下张力臂3932的瓣膜框架3910。图50显示了延伸到rvot中的远端下张力臂3932。瓣膜3902通过下腔静脉的横向或侧面装载输送提供了直接进入自体瓣膜环的途径,而不需要像轴向或垂直装载的常规经导管人工瓣膜的ivc输送那样绕直角转弯输送压缩的瓣膜。图50显示了一个实施方案,其中组织锚3990(诸如螺钉或其它锚定装置)与本文所述的张力安装方法结合使用,其中前小叶侧上的远端上张力臂3931和下张力臂3932将瓣膜3902锚定在适当的位置,并且第二锚定元件(例如,组织锚3990)完成瓣膜3902在瓣环部位中的固定。
图50显示了聚酯网覆盖物3917,其覆盖瓣膜框架3910并环绕流动控制部件(未显示)的可收缩的流动控制套管。图50还显示了框架3910,其具有在生物相容性覆盖物3917内或被生物相容性覆盖物3917覆盖的菱形单元3925a中的镍钛合金丝框架。在一个实施方案中,框架可在顶部具有心包材料,在底部具有聚酯材料,例如外科手术用dacron,以与自体瓣环接触并促进向内生长。
图51a是根据实施方案的处于扩张构型的低轮廓(例如,10mm高)人工瓣膜4002的平面视图的图示。瓣膜4002包括具有并且/或者形成金属丝环形支撑环的框架4010。框架4010包括并且/或者形成(或者金属丝环包括并且/或者形成)远端上张力臂4031和远端下张力臂4032,所述张力臂可以形成为单一或整体部分,并覆盖有生物相容性材料。该实施方案显示了低轮廓、侧面装载的瓣膜4002如何能够具有非常大的直径(40-80mm),而不必用不期望的大输送导管来输送瓣膜4002,否则将用于输送使用常规垂直或轴向取向输送的大直径瓣膜。
图51b是瓣膜4002的顶视图的图示,其显示了内部两片式套管或流动控制部件4050和位于下端的用于将血液输送到心室的往复可收缩孔4054。
图51c是瓣膜4002的底侧视图的图示,其显示了内部两片式套管或流动控制部件4050和在心室侧的可收缩末端孔4054的平面视图。
图51d是处于压缩构型并设置在输送导管4072内的瓣膜4002的图示。图51d示出了使用侧面装载的大直径瓣膜4002如何能够通过输送导管4072输送。
图51e是处于压缩构型的瓣膜4002被部分弹出并部分设置在输送导管4072内的图示。图51e显示了瓣膜4002如何能够被部分输送以定位在瓣环中。当瓣膜体、管状框架4010仍在可操纵的输送导管4072内时,远端下张力臂4034可用于操作穿过自体三尖瓣小叶和腱索。
图52a是部分安装在自体瓣膜瓣环内的人工瓣膜4102的平面视图的图示。通过使用所公开的实施方案的侧面装载的瓣膜4102,远端上张力臂4133和远端下张力臂4132可以抵靠自体瓣环的前侧安装,并且可在完全安置瓣膜4102之前评估瓣膜功能。通过允许两条血流路径,第一条通过靠近后小叶的自体瓣膜,第二条通过人工瓣膜4102的中心孔,医师可以确定心脏是否失代偿或瓣膜功能是否不理想。图52a还显示了近端上张力臂4133,其可与远端张力臂4131和4132结合作用,以将瓣膜4102安装、安置并且/或者锚定在自体瓣环中。
图52b是完全位于瓣膜瓣环内的人工瓣膜4102的平面视图的图示。图52b显示了一旦瓣膜功能评估显示部署成功,瓣膜4102就可被固定在适当的位置。重要的是,由于瓣膜4102是低轮廓瓣膜,并且容易安装在标准(例如,8-12mm)输送导管内,而不需要典型的经导管瓣膜的强力装载,侧面装载瓣膜4102可以容易地使用用于部署瓣膜的同一输送导管取回。
图53a是在输送导管4272内处于压缩构型的根据实施方案的人工瓣膜4202的图示。瓣膜4202包括具有并且/或者形成金属丝环形支撑环的框架4210。框架4210包括并且/或者形成(或金属丝环包括并且/或者形成)远端上张力臂4231和远端下张力臂4232,所述张力臂可以形成为单一或整体部分,并覆盖有生物相容性材料。下张力臂4231和上张力臂4232向右伸长,人工瓣膜4202显示为在输送导管4272中横向压缩。横向压缩是使用最小结构材料的函数,例如,流动控制部件4250(图53c)的最小内部瓣膜套管,以及框架4210的相对矮的高度。这种横向输送提供给非常大的,例如高达80mm或更大的人工瓣膜。当使用ivc股动脉路径输送瓣膜4202时,侧向输送还避免了执行90度右转的需要。当输送常规瓣膜时,这种尖锐的输送角度也限制了现有瓣膜假体的尺寸和组成,并且瓣膜4202的侧向输送避免了此类限制。
图53b是处于扩张构型的瓣膜4202的金属丝框架4210的轮廓视图或平面视图的图示。图53b显示了远端上张力臂4231附接至管状框架4210,而远端下张力臂4232成形为s形,并且仅连接到远端上张力臂4231。
图53c是设置在自体三尖瓣瓣膜中的瓣膜4202的顶视图的图示。图53c显示了管状框架4210和缝合到框架4210的中心孔4214中的内部套筒或流动控制部件4250,其中两(2)个片沿心室方向向下延伸(进入页面)。图53c显示了朝向围绕自体三尖瓣瓣膜的心房底部的前小叶侧定向的远端上张力臂4231,其以虚线轮廓显示。
图53d是瓣膜4202的平面视图的图示,而图53e是瓣膜4202的剖视平面图的图示。图53e显示了安装在由管状框架4210限定的内部空间或孔4214内的内部片式瓣膜套管或流动控制部件4250。图53e显示了延伸到瓣环下小叶空间中的细长的两片式瓣膜套管或流动控制部件4250。图53e所示的管状框架4210的高度约为10mm,瓣膜套管或流动控制部件4250在管状框架4210的底部下方延伸约10mm,导致瓣膜4202的总高度为20mm。
图53f是瓣膜4202的底视图的图示,其显示了具有缝合到中心孔4214中的内部套管或流动控制部件4250的管状框架4210,其中两个片沿心室方向向上延伸(离开页面)。图53f显示了朝向自体三尖瓣瓣膜的心室顶部的前小叶侧定向的远端下张力臂4242,其以虚线轮廓显示。
图54a是处于扩张构型的根据实施方案的人工瓣膜4302的轮廓视图或平面视图的图示。瓣膜4302具有编织或激光切割的框架4310。图54a显示了附接至管状框架4310的上边缘的远端上张力臂4331,以及附接至管状框架4310的下边缘的远端下张力臂4332。
图54b是设置在自体三尖瓣瓣膜中的瓣膜4302的顶视图的图示。图54b显示了具有缝合到框架4310的中心孔中的内部套筒或流动控制部件4350的管状框架4310,其中两个片沿心室方向向下延伸(进入页面)。图54b显示了朝向自体三尖瓣瓣膜的心房底部的前小叶侧定向的远端上张力臂4331,其以虚线轮廓显示。
图54c是瓣膜4302的平面视图的图示,而图54d是瓣膜4302的剖视平面视图的图示。图54d显示了安装在由管状框架4310限定的内部空间或中心孔内的内部片式瓣膜套管或流动控制部件4350。
图54e是瓣膜4302的顶视图的图示,其显示了具有缝合到中心孔中的内部套管或流动控制部件4350的管状框架4210,其中两(2)个片在心室方向上向上延伸(离开页面)。图54e显示了朝向心室顶部的前小叶侧定向的远端下张力臂4334,其以虚线轮廓显示。
图55a是处于扩张构型的具有圆形双曲面(沙漏)形状的根据实施方案的瓣膜4402的侧面透视图的图示。瓣膜4402包括具有延伸的rvot接片4430的框架4410。rvot接片4430可与本文所述的远端下张力臂相类似。金属丝框架细节未显示,因为在实践中,外表面优选被诸如用dacron聚酯覆盖以促进向内生长。框架4410包括近端折叠区域4423a和远端折叠区域4423b,所述折叠区域沿水平长轴线4411显示在前套环4421和后中隔套环4422的相对端上。框架4410限定了接受流动控制部件的中心通道或孔。
图55b是瓣膜4402的剖视图的图示,其显示了其圆形双曲面(沙漏)形状和rvot接片4430(例如,远端下张力臂)。图55b显示了内部小叶4453和流动控制部件内部框架(不可见)附接至瓣环框架4410的内表面,其中套环部分4420经由壁部分4412附接至rvot接片或瓣环下锚定部分4430。此处,流动控制部件仅附接在顶部边缘,尽管也考虑了其它非限制性附接,例如中壁、多个附接点等。
图56a是垂直可压缩瓣膜4502的侧面视图的图示,所述瓣膜4502具有一组内部非延伸的小叶(例如,流动控制部件)和可压缩的正交(宽)金属丝单元,并且显示为处于用于植入体内的期望位置的扩张构型。
图56b是垂直可压缩瓣膜4502的侧视图的图示,所述瓣膜显示为处于用于将压缩瓣膜4502输送到体内的期望位置的压缩构型。
图57a是垂直可压缩瓣膜4602的侧视图,所述瓣膜4602具有延伸的小叶4653(例如,流动控制部件)和可压缩的正交(宽)金属丝单元,并且显示为处于用于植入体内的期望位置的扩张构型。
图57b是垂直可压缩瓣膜4602的侧视图的图示,所述瓣膜显示为处于用于输送压缩瓣膜4602的压缩构型,其中金属丝框架的高度降低(垂直压缩),并且扩张的小叶被卷起。
图58a和图58b分别是具有金属丝框架4710的瓣膜4702的侧面透视图和顶视图的图示,所述金属丝框架4710由单根连续金属丝形成,具有上套环部分、具有沙漏形状的下主体部分以及从框架4710的下主体部分的下边缘延伸出去的rvot接片或远端下张力臂。瓣膜4702被显示为处于扩张构型。
图59是瓣膜框架4810的侧面透视图的图示,所述瓣膜框架4810由一系列在连接点处连接的波形金属丝4825e形成,具有上套环部分、具有沙漏形状的下主体部分以及从框架4810的下主体部分的下边缘延伸出去的rvot接片或远端下张力臂。瓣膜框架4810显示为处于扩张构型。缝合特征沿连接边缘显示。
图60是瓣膜框架4910的侧面透视图的图示,所述瓣膜框架4910由一系列在连接点处连接的水平波形金属丝4925f形成,具有上套环部分、具有沙漏形状的下部主体部分以及从离框架4910的下部主体部分的下边缘延伸出去的rvot接片或远端下张力臂。瓣膜框架4910显示为处于扩张构型。缝合特征沿连接边缘显示。
图61是金属或金属合金的扁平丝框架的顶视图的图示,所述框架具有以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图61显示了用于金属线框架的套环部分5025b的外部菱形单元5025a和用于金属丝框架的下主体部分的内部波形单元5025b,以及用于瓣环下接片5030(例如,远端下张力臂)的菱形单元5025a。
图62是处于漏斗构型(热定形)的金属丝框架的一部分的顶视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图62显示了用于金属丝框架的套环部分的外部菱形单元5025a和用于金属丝框架的下主体部分的内部菱形单元5025a,以及瓣环下接片5030(例如,远端下张力臂)。
图63是处于漏斗构型(热定形)的金属丝框架的一部分的侧视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图63显示了用于金属丝框架的套环部分的外部菱形单元5025a和用于金属丝框架的下主体部分的内部菱形单元5025a,以及瓣环下接片5030(例如,远端下张力臂)。
图64是处于漏斗构型(热定形)的金属丝框架的一部分的侧面透视图的图示,其显示了以应变最小化取向配置以便于人工三尖瓣瓣膜的正交装载和输送的可压缩金属丝单元。图64显示了用于金属丝框架的套环部分的外部菱形单元5025a和用于金属丝框架的下主体部分的内部菱形单元5025a,以及用于瓣环下接片5030(例如,远端下张力臂)的不规则形状的单元。
图65a是根据实施方案的人工瓣膜5102的顶视图的图示,所述人工瓣膜5102具有编织的或激光切割的金属丝框架5110,并且在心房底部的截面视图中显示为安装在在自体三尖瓣瓣膜的瓣环处。
图65b是瓣膜5102的底视图的图示,所述瓣膜5102具有编织或激光切割的金属丝框架5110,所述框架包括并且/或者形成远端下张力臂5132,并且在心室顶部的横截面视图内显示为安装在自体三尖瓣瓣膜的瓣环处。图65b显示了处于打开位置并设置在框架5110的中心孔5114内的两片式瓣膜套管或流动控制部件5150。例如,对于心房收缩和心室舒张,流动控制部件5150可处于打开位置。
图66是处于扩张构型的根据实施方案的人工瓣膜5202的图示。瓣膜5202包括框架5210,所述框架5210具有并且/或形成金属丝瓣环支撑环,两个垂直支撑柱5252在内部套管或流动控制部件5250的相对侧上沿边缘向下延伸。在压缩到输送导管中的过程中,柱5252被设计成水平折叠,并且在弹出过程中弹性展开,以部署瓣膜套管或流动控制部件5252。图66还显示了具有远端上张力臂5231和远端下张力臂5232的框架5210,所述框架5210可形成为单一或整体部分,并且覆盖有生物相容性材料。图66还示出了近端接片5230,其可以是例如张力臂和/或锚定柱或点。
图67是内部瓣膜套管或流动控制部件5350的两片式实施方案的图示。在一些实施方案中,图66所示的框架5210可适于接收流动控制部件5350。
图68a和图68b分别是具有两个刚性支撑柱5452的流动控制部件5450的侧面透视图和剖视平面图的图示。图68b显示了流动控制部件5450,其具有安装在由管状框架5410限定的内部空间或中心孔内的两个刚性支撑柱5452,其中框架5410包括从框架5410延伸出来的远端上张力臂5431和远端下张力臂5432。
图69是根据实施方案的内部瓣膜套管或流动控制部件5550的三片式实施方案的图示。
图70a是根据实施方案的具有三个刚性支撑柱5552的内部瓣膜套管或流动控制部件5550的三片式实施方案的图示。
图70b是安装在由管状框架5510限定的内部空间或中心孔内的三片式三柱瓣膜套管或流动控制部件5550的剖视平面图的图示,其中框架5510包括从框架5510延伸出来的远端上张力臂5531和远端下张力臂5532。
图71a是具有框架5710和流动控制部件5750的低轮廓(例如,8-20mm)侧面装载的人工瓣膜5702的三叶实施方案的局部剖视内部视图的一个实施方案的图示。框架5710包括远端下张力臂5732。流动控制部件5750是具有三个刚性支撑柱5752的三叶流动控制部件。
图71b是低轮廓(例如,8-20mm)侧面装载的人工瓣膜5702的三叶实施方案的局部剖视内部视图的另一个实施方案的图示,所述人工瓣膜在非剖视图中显示了流动控制部件5750。
图71c是低轮廓(例如,8-20mm)侧面装载的人工瓣膜5702的三叶实施方案的顶视图的图示。
图72a-图72c是根据实施方案的用于输送经导管人工瓣膜202的输送系统270的各种示意图。经导管人工瓣膜202被配置成部署在身体内(例如,人患者体内)期望的位置,并允许血液沿第一方向流经经导管人工瓣膜202的流入端,并阻止血液沿与第一方向相反的第二方向流经经导管人工瓣膜202的流出端。例如,经导管人工瓣膜202可以是经导管人工心脏瓣膜,其被配置成部署在人心脏的自体三尖瓣瓣膜或自体二尖瓣瓣膜的瓣环内,以补充和/或替代自体瓣膜的功能。
经导管人工瓣膜202在垂直于瓣膜202的长轴线的至少一个方向上是可压缩和可扩张的。瓣膜202被配置成在用于植入体内的期望位置(例如,人心脏)的扩张构型与用于通过输送系统270引入体内的压缩构型之间是可压缩的和可扩张的。
在一些实施方案中,人工瓣膜202可与上面参考图1a-图1f描述的瓣膜102类似或基本相同。例如,图72b显示了瓣膜202可包括环形支撑框架210和流动控制部件250。环形支撑框架210可以类似于框架110,并且可包括套囊或套环部分220和管状部分(例如,下管状主体部分)212,以及导丝套环240。另外,环形支撑框架210限定了孔214,所述孔214沿框架210的中心轴线213或在该中心轴线的方向上延伸。虽然未显示,但框架210和/或瓣膜202还可包括一个或多个张力臂、锚定接片等。流动控制部件250可以类似于上面参考图1a-图1f描述的流动控制部件150。在本文中不对与瓣膜102基本上类似的瓣膜202进行进一步详细描述。
如图72a-图72c所示,输送系统270包括输送导管272、辅助导管280和导丝285。输送系统270可被配置成将压缩的瓣膜202和/或瓣膜202的部分(例如,压缩的框架210或压缩的流动控制部件250)正交输送到体内的期望位置,例如,人心脏的自体三尖瓣瓣膜的瓣环和/或自体二尖瓣瓣膜的瓣环。如上文参考瓣膜102所详细描述的,输送系统270可以正交输送瓣膜202,已通过沿中心轴线213(图72b)压缩或在横向方向(例如,垂直于输送导管272的中心轴线213和中心纵向轴线275)上压缩将所述瓣膜202压缩成压缩构型。这种压缩可导致瓣膜202沿纵轴线(图72a-72c中未显示)伸长,所述纵轴线基本平行于输送导管272的中心纵向轴线275。
输送导管272限定了内腔274,所述内腔274沿中心纵向轴线275或在中心纵向轴线275的方向上延伸。输送导管272的内腔274可具有足够的直径,以从中接收压缩瓣膜202。例如,输送导管272可为22-34fr,具有任何合适的相应内腔直径和/或足以接收处于压缩构型的人工瓣膜202的内腔直径。
导丝285延伸或穿过辅助导管280、瓣膜202和输送导管272。导丝285可以是例如至少部分由辅助导管280包覆的有鞘导丝。导丝285被配置成被推进穿过身体的解剖结构,并被放置在相对于自体组织(例如,自体瓣膜)的期望位置中。在一些情况下,可推进导丝285以提供导丝途径(例如,用于输送导管272、瓣膜202等)至rvot。导丝285延伸穿过瓣膜202的导丝套环240,以提供沿其推进瓣膜202的导丝路径。
辅助导管280可以是鞘、管、环形杆或金属丝等。在一些实施方案中,辅助导管280是围绕导丝285的一部分设置的海波管鞘(例如,辅助导管280和导丝285共同形成有鞘导丝或有鞘导丝组件)。辅助导管280可具有相对较小的尺寸,从而允许辅助导管280被推进通过输送导管272并且/或者被至少部分地设置在导丝套环240中或以其它方式与导丝套环240衔接。如图72a-图72c所示,辅助导管280具有内径大于导丝285的内腔,从而允许导丝285从中穿过。
推动器281被设置在辅助导管280内,并被配置成推动瓣膜202的一部分,以推进瓣膜202通过并且/或者离开输送导管272。在一些实现方式中,推动器281被配置成推压瓣膜202的导丝套环240的一部分。例如,导丝套环240可以允许导丝285被推进通过导丝套环240,以及可以阻止并且/或者基本上防止推动器281推进超出导丝套环240(或其至少一部分)。虽然推动器281显示为被设置在辅助导管280中,但在一些实施方案中,辅助导管280可用作推动器281。在此类实施方案中,输送系统270不需要包括单独的推动器281。
瓣膜的导丝套环240(图72b)可以是任何合适的元件,其选择性地允许导丝285从中推进,同时阻止或防止辅助导管280和/或推动器281的推进超出导丝套环240。在一些实施方案中,导丝套环240可包括在框架210的套囊220中、由所述套囊形成并且/或者附接至所述套囊。在一些实施方案中,导丝套环240可包括在张力臂(例如,远端上张力臂、远端下张力臂等)中、由所述张力臂形成并且/或者附接至所述张力臂。在某些实施方案中,远端下张力臂可以形成并且/或者可以包括形成导丝套环240的特征。由于导丝285和远端下张力臂都插入或指向rvot,所以可能希望将导丝套环240附接至远端下张力臂。
在一些实施方案中,导丝套环240可以是球或张力臂的特征,其限定了足够大到允许导丝285穿过但不够大到允许辅助导管280和/或推动器281穿过的孔或内腔。这样,辅助导管280和/或推动器281可因辅助导管280和/或推动器281相对于导丝套环240的孔或内腔的较大圆周而停靠于导丝套环240。这种布置允许辅助导管280和/或推动器281推动导丝套环240,从而推动与其附接的张力臂(例如,远端下张力臂)。当导丝套环240附接至远端张力臂时,对导丝套环240的推动可操作地将瓣膜202拉过并且/或者拉出输送导管272。可以设想,导丝套环240可具有任何合适的构型,所述构型使导丝套环240允许导丝285的推进,同时限制、阻止或防止辅助导管280和/或推动器281的推进。此外,释放机构282可被配置成例如在瓣膜202部署之后从导丝套环240释放导丝285、辅助导管280和/或推动器281。
图72c显示了输送系统270将瓣膜202输送到自体瓣膜,诸如二尖瓣瓣膜或肺动脉瓣膜(或三尖瓣瓣膜或主动脉瓣膜)。导丝285被推进穿过自体瓣膜的瓣环,并被设置在心室内(例如,rvot内)。可在导丝285上推进输送导管272,并将其输送到瓣环处或其附近的期望位置。一旦输送导管272处于期望的位置,就可通过推动辅助导管280和/或推动器281,在导丝285上以及在输送导管272内推进瓣膜202。当导丝套环240附接至瓣膜202或框架210的远端或前侧时,辅助导管280和/或推动器281的推动作用类似于相对于例如瓣膜框架210的管状部分212和/或瓣膜202的流动控制部件250的拉力。此外,辅助导管280和/或推动器281可用于从输送导管272中弹出瓣膜202。一旦从输送导管272中弹出,瓣膜202就被允许扩张至扩张构型,并且可被安置在自体瓣膜的瓣环内。在一些实施方案中,辅助导管280、推动器281和/或导丝285可从导丝套环240释放,以允许辅助导管280、推动器281和/或导丝285缩回和/或撤回。在一些实施方案中,辅助导管280和/或推动器281可用于将瓣膜202或瓣膜框架210的至少近端侧推入瓣环中,从而完全安置并且/或者部署瓣膜202。虽然在图72a-图72c中未显示,但在一些实施方案中,辅助导管280和/或推动器281可被进一步用于将组织锚递送并且/或者锚定到瓣膜202或瓣膜框架210的近端侧。因此,输送系统270可以输送常规压缩的瓣膜或者正交输送垂直和/或横向压缩的瓣膜202。
图72d是描述根据实施方案的用于输送诸如本文公开的任何瓣膜等的低轮廓、侧面装载的人工瓣膜的方法300的流程图。在302处,方法300包括在心脏的心房中设置指向心脏的自体瓣膜的瓣环的输送导管的远端部分,所述输送导管包含处于压缩构型的人工瓣膜的框架。所述瓣膜可以是本文公开的任何瓣膜。例如,所述瓣膜至少在形式和/或功能上类似于上述瓣膜102和/或202。在一些实施方案中,所述瓣膜可以是(i)其中所述瓣膜具有管状框架的瓣膜,所述管状框架内安装有流动控制部件,(ii)其中所述瓣膜或流动控制部件被配置成允许血液沿第一方向流经所述瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述瓣膜的流出端的瓣膜,(iii)其中瓣膜是可压缩的和可扩张的并且具有以45-135度的与第一方向所成的交角定向的长轴线的瓣膜,以及(iv)其中长轴线平行于用于输送瓣膜的输送导管的纵向圆柱形轴线的瓣膜。
在304处,人工瓣膜框架的张力臂从输送导管中释放。张力臂可以是例如瓣膜框架的远端下张力臂。瓣膜在输送导管内的布置可以使得远端下张力臂远离瓣膜体。换句话说,压缩瓣膜被设置在输送导管内,使得长轴线(纵轴线)基本平行于输送导管的长轴线或纵向轴线,其中远端下张力臂从瓣膜体向远端方向延伸。因此,远端下张力臂通常在瓣膜体之前从输送导管释放。
在306处,张力臂的远端部分被设置在自体瓣膜的瓣环的心室侧,而输送导管的远侧端保持在瓣环的心房侧。张力臂(例如,远端下张力臂)可以延伸穿过自体瓣环,并且至少部分地设置在rvot内。在一些情况下,张力臂可以衔接瓣环下组织,以至少部分地将瓣膜的远侧端部分固定至自体瓣环组织,同时使瓣膜的其余部分保持在瓣环的心房侧内的瓣环上方位置。
在308处,人工瓣膜框架的剩余部分从输送导管释放。如以上关于特定实施方案所详细描述的,释放人工瓣膜的剩余部分允许人工瓣膜从输送导管内的压缩构型扩张至输送导管外的扩张构型,并适于部署到自体瓣环中。
在310处,方法300任选地可包括相对于自体瓣膜环以一定角度保持人工瓣膜框架。所述角度可以是例如相对于自体瓣膜的瓣环所成的倾斜角。在一些实施方案中,输送系统等可包括辅助导管或推/拉杆,其可用于(1)推进瓣膜通过输送导管,以及(2)暂时将人工瓣膜保持在相对于自体瓣膜的瓣环的角度。在312处,如果人工瓣膜保持在该角度,则可允许血液部分地通过围绕人工瓣膜框架的自体瓣膜的瓣环,以及部分地通过人工瓣膜从心房流到心室。在314处,血流可用于任选地评估瓣膜功能。如果人工瓣膜未表现出正常功能,则可更换瓣膜而不必移除完全部署的瓣膜。
在316处,将框架的管状部分设置在自体瓣膜的瓣环内。例如,在一些实施方案中,辅助导管或推/拉杆可用于将瓣膜的至少近侧端部分推入自体瓣环中。在一些实现方式中,瓣膜的一个或多个壁和/或一个或多个近端或远端张力臂可用于将人工瓣膜安置在自体瓣环内。例如,张力臂可以施加相反的力,所述力可以至少部分地将人工瓣膜固定到瓣环组织上。在一些实施方案中,张力臂和/或框架的任何其它部分可以形成抵靠瓣环组织的旋转或压力锁定。当框架的管状部分位于自体瓣膜的瓣环内时,人工瓣膜可被完全部署。
在318处,方法300任选地可包括将人工瓣膜框架的远端部分锚定到自体瓣膜周围的组织。例如,可使用本文所述的任何组织锚和/或锚定方法来锚定框架的远端部分。在一些实现方式中,可使用组织锚来锚定框架的远端部分,所述组织锚衔接框架的一部分并插入自体瓣膜周围的组织中。
在320处,方法300任选地可包括向人工瓣膜框架的孔输送流动控制装置。例如,如上文参考图1a-图1f所示的瓣膜102所描述的,所述瓣膜可作为单个集成部件部署在自体瓣膜的瓣环中,所述瓣膜包括瓣膜框架和设置在瓣膜框架的孔中的流动控制部件。然而,在其它实施方案中,瓣膜可在两个或更多个独立或分开的过程中部署在自体瓣膜的瓣环中。在一些情况下,将瓣膜门分成两个或更多个部分进行输送可使单独输送的部件被压缩成更小或更紧的压缩结构。在一些此类情况下,瓣膜框架可被压缩并输送到自体瓣膜的瓣环,如以上文方法300中所述。在将瓣膜框架完全安置或部署在自体瓣膜的瓣环中之后,可将流动控制部件压缩并输送到瓣膜框架。流动控制部件可以是自扩张瓣膜部件,或者一旦放置在瓣膜框架内的期望位置就可以被球囊扩张。
以下提供了对经导管人工瓣膜、输送系统和/或输送方法的某些方面或实施方案的讨论。下文关于特定实施方案描述的经导管人工瓣膜(或其方面或部分)、输送系统和/或输送方法至少在形式和/或功能上与瓣膜202和/或瓣膜202的相应方面、输送系统270和/或上文关于图72a-图72d所描述的输送方法300基本相似。因此,在本文中不再对特定实施方案的某些方面进行详细描述。
图73a是人心脏解剖结构的侧视图的图示,图73b是图73a的人心脏解剖结构的一部分的放大图,显示了下腔静脉(ivc)、三尖瓣瓣膜的三个小叶尖端(前、后、中隔-rvot)和肺动脉(pa)之间的几何关系。
图74是与自体三尖瓣瓣环一起安置的侧送瓣膜5802的侧面透视图的图示,其中瓣膜5802(或瓣膜框架)的套环部分5820在心房中位于三尖瓣瓣环和小叶上方,下主体部分延伸进入并穿过瓣环,以从流动控制部件提供校正的血流动力学流量。图74还显示了设置在rvot中的rvot脚部接片或远端下张力臂5832。
图75a是人心脏的自体右心房的平面视图的图示,并且显示了上腔静脉(svc)、下腔静脉(ivc)、右心房(ra)、三尖瓣瓣膜和瓣环(tcv)、前小叶(a)、后小叶(p)、中隔小叶(s)、右心室(rv)和右心室流出道(rvot)。
图75b是被输送至三尖瓣瓣膜瓣环的根据实施方案的人工瓣膜5902的图示。图75b显示了具有编织/激光切割的框架5910的瓣膜5902,所述瓣膜5902具有远端下张力臂5932,所述远端下张力臂5932从输送导管5972弹出,被引导穿过瓣环并朝向右心室流出道。
图75c是瓣膜5902的图示,其显示了编织/激光切割的框架5910,其中远端下张力臂5932和远端上张力臂5931经由辅助导管和/或推动器5980从输送导管5972弹出,远端下张力臂5932被引导穿过瓣环并进入rvot,而远端上张力臂5931停留在瓣环上方位置,并导致瓣膜5902的远端侧围绕瓣环的被动结构锚定。
图75d是瓣膜5902的图示,其显示了从输送导管5972弹出的整个编织/激光切割的框架5910,远端下张力臂5932被引导穿过瓣环并进入rvot,而远端上张力臂5931保持在瓣环上方位置,并导致瓣膜的远端侧围绕瓣环的被动结构锚定,以及至少一个组织锚(未显示)将假体的近端侧锚定到瓣环组织中。
图76a是被输送到三尖瓣瓣膜瓣环的根据实施方案的人工瓣膜6002的图示。图76a显示了从输送导管弹出并被引导通过瓣环并朝向rvot的瓣膜6002的远端下张力臂6032。在该实例中,瓣膜6002的输送可包括瓣膜评估过程。
图76b显示了从输送导管弹出的远端下张力臂6032和远端上张力臂6031,远端下张力臂6032被引导穿过瓣环并进入rvot,而远端上张力臂6031停留在瓣环上方位置,并导致瓣膜6002的远端侧围绕瓣环的被动结构锚定。图76b显示了可以以一定的倾斜角将瓣膜6002保持(例如,通过辅助导管(未显示))在预附接位置,使得瓣膜可被评估,并且一旦瓣膜功能和患者状况正确,则辅助导管可将瓣膜6002的近端侧从其倾斜角向下推入瓣环中。通过允许两条血流路径,第一条通过靠近后小叶的自体瓣膜,第二条通过人工瓣膜6002的中心孔,医师可以确定心脏是否失代偿或瓣膜功能是否不太理想。然后,辅助导管可将一个或多个锚定元件安装在自体瓣膜中或以其它方式将瓣膜6002固定在自体瓣膜中。
图76c是瓣膜6002的图示,其显示了从输送导管弹出的整个编织/激光切割的框架瓣膜6002,远端下张力臂6032被引导穿过瓣环并进入rvot,而远端上张力臂6031停留在瓣环上方位置,并导致瓣膜6002的远端侧围绕瓣环的被动结构锚定,并且任选地至少一个组织锚(未显示)将瓣膜6002的近端侧锚定到瓣环组织中。
图77a是瓣膜6102的侧面透视图的图示,所述瓣膜6102被垂直压缩而没有折叠成压缩构型,并且被装载到输送导管6172中。通过使用水平的而不是常规的垂直菱形形状的单元,可将瓣膜6102的框架6110从上到下压缩。这允许正交输送比使用常规轴向压缩输送的直径大得多的瓣膜。另外,正交输送使用瓣环下远侧锚定接片或远端下张力臂6132提供从ivc到三尖瓣瓣环的通路。通常,在排出常规的经导管的轴向压缩瓣膜之前,输送导管需要右转90-120度。相反,垂直压缩的瓣膜6102(例如,沿中心孔的方向或通过瓣膜6102的血流方向压缩的)可被直接排出到三尖瓣瓣环的远端侧。
图77b是从输送导管6172部分排出或释放的瓣膜6102的侧面透视图的图示,所述瓣膜6102允许从通过自体三尖瓣瓣膜的自体血流和人工瓣膜6102周围并进入自体瓣环的部分血流过渡到通过人工瓣膜6102的流入端(在图77b中由标记为“流入”的箭头指示的),并从其流出端(在图77b中由标记为“流出”的箭头指示的)流出进入自体瓣环的部分血流。导丝6185显示成猪尾状进入心脏的肺动脉。在一些实施方案中,刚性拉杆/线、推动器和/或辅助导管6180被设计成跨在导丝6185上,从而允许瓣膜6102被正确地输送到预期的位置。远端瓣环下接片或远端下张力臂6132被导入rvot,并被配置成在瓣膜6102被定位和评估时为瓣膜6102提供锚定。
图77c是从输送导管6172完全排出或释放成扩张构型的瓣膜6102的侧面透视图的图示。利用远端接片或远端下张力臂6132将瓣膜6102抵靠瓣环的远端表面安置,并在瓣膜6102完全部署之前,利用刚性拉杆/丝或推动器6180以升高的角度将瓣膜6102保持在自体瓣环上方。这允许从通过自体三尖瓣瓣膜的自体血流和围绕人工瓣膜6102并进入自体瓣环的部分血流的进一步过渡,以及通过人工瓣膜6102的流入端并从其流出端流出,进入或通过自体瓣环的部分血流不断增加。图77c还显示了猪尾状进入心脏肺动脉(通过lvot)的导丝6185。图77c还显示了近端瓣环下锚定接片或近端下张力臂(近端接片)6134,一旦瓣膜6102完全部署在自体瓣环中,其可有利于瓣膜6102的安装或锚定。
图77d是从输送导管6172完全排出或释放并被完全安置在自体瓣环中的瓣膜6102的侧面透视图的图示。刚刚描述的瓣膜6102的输送允许从自体血流到通过人工瓣膜6102并因此通过自体瓣环的完全完整的血流的平稳过渡。瓣膜6102使用瓣环下远端接片(远端下张力臂)6132、瓣环下近端接片(近端下张力臂)6134和瓣环上方(心房)上张力臂(远端上张力臂)6131来锚定。使用瓣膜6102的校正后的置换流通过经过人工瓣膜6102(从而经过自体瓣环)的流入端的流入和经过其流出端的流出来显示。
图78a是瓣膜6202的侧面透视图的图示,所述瓣膜6202被垂直压缩(而不折叠)成压缩构型并被装载到输送导管6272中,并且显示了处于卷起构型的流动控制部件6250。导丝6285和rvot接片或远端下张力臂6232显示为延伸到肺动脉中,并允许瓣膜6202被精确输送。
图78b是从输送导管6272部分排出或释放的瓣膜6202的侧面透视图的图示,其中流动控制部件6250的内部小叶6253部分展开和延伸。图78b显示了从自体三尖瓣瓣膜的自体血流和围绕人工瓣膜6202并进入自体瓣环的部分血流到通过人工瓣膜6202的流入端(在图78b中由标记为“流入”的箭头指示的)并从流出端(在图78b中由标记为“流出”的箭头指示的)流出进入自体瓣环的部分血流的过渡。在一些实施方案中,刚性拉杆/丝、推动器和/或辅助导管6280被设计成跨在导丝6285上。rvot接片或远端下张力臂6232被导入rvot,并被配置成在瓣膜6202被定位和评估时为其提供锚定。瓣膜6202在rvot接片或远端下张力臂6232上方具有远端中壁拱,用于衔接自体瓣环。
图78c是从输送导管6272完全排出或释放成扩张构型的瓣膜6202的侧面视透视图的图示,其中流动控制部件6250的内部小叶6253完全展开和延伸。利用远侧接片或远端下张力臂6232将瓣膜6202抵靠瓣环的远端表面安置,并且在完全部署之前,利用刚性牵拉器/推动器或辅助导管6280将瓣膜6202以一定的角度升高地保持在自体瓣环上方。这允许从通过自体三尖瓣瓣膜的自体血流和围绕人工瓣膜6202并进入自体瓣环的部分血流的进一步过渡,而增加的部分血流通过人工瓣膜6202的流入端并从流出端流出,进入或通过自体瓣环。图78c显示了衔接远端自体瓣环的远端中壁拱,并显示了近端中壁拱在自体瓣环上方升高,以准备当瓣膜6202完全安置在自体瓣环中时平稳过渡到假体血流。
图78d是从输送导管6272完全排出或释放并完全安置到自体瓣环中的瓣膜6202的侧面透视图的图示。刚刚描述的瓣膜6202的输送允许从自体血流到通过人工瓣膜6202并因此通过自体瓣环的完全完整的血流的平稳过渡。瓣膜6202使用瓣环下远端接片或远端下张力臂6232、瓣环下近端接片或近端下张力臂6234以及瓣环上方(心房)接片或远端上张力臂6231来锚定。通过展开和延伸的小叶6253的校正的置换流由通过人工瓣膜6202(从而通过自体瓣环)的流入端的流入和通过所述人工瓣膜的流出端的流出来显示。
图79a是根据实施方案的在输送导管6372内处于压缩构型的瓣膜6302的侧视图的图示。图79a显示了如何能将中心管/丝或辅助导管6380在远侧附接至远侧边缘、rvot接片或远端下张力臂6332,以及通过推动刚性管/丝或辅助导管6332,压缩瓣膜6202可从导管6372的近侧端被拉到输送导管6372的远侧部署端。这种牵拉动作避免了将瓣膜6302推出输送导管6302,这可能导致额外的径向扩张和径向力,当瓣膜6302在输送导管6372内被压缩时,这可能损坏瓣膜6302。
图79b是从输送导管6372部分压缩和部分释放的瓣膜6302的侧视图的图示,并显示了血流如何能够开始过渡。通过使用附接至远端瓣环下锚定接片或远端下张力臂6332的刚性推动器或辅助导管6380拉动瓣膜6302,从自体流动到通过人工瓣膜6302的流动的渐进、平稳过渡避免了括约肌效应,在所述括约肌效应中,心脏被切断流动,导致干泵动作,这可导致心力衰竭。当瓣膜6302部分打开(部分释放),仅将瓣膜6302的框架的套环部分6320的一部分暴露于一小部分穿过人工瓣膜6302的右心房血流时,冲洗效果提供了向通过瓣膜6302的更大体积的平稳过渡。
图79c是从输送导管6372部分压缩和部分释放的瓣膜6302的侧视图的图示,并且示出了血流如何能够开始其过渡。通过从远端瓣环下锚定接片或远端下张力臂6332拉动,从自体流动到通过流入端(在图79c中由标记为“流入”的箭头指示的)流入瓣膜6302并从人工瓣膜6302的流出端(在图79c中由标记为“流出”的箭头指示的)流出的渐进、平稳过渡避免了括约肌效应,所述括约效应中,心脏被切断流动,导致干泵动作,并导致心力衰竭。当瓣膜部分打开,仅将套环部分6320的一部分暴露于一小部分最初穿过人工瓣膜6302的右心房血流时,随着从瓣膜6302周围的血流过渡到通过瓣膜6302的血流的量增加,冲洗效果提供了向通过瓣膜6302的更大体积的平稳过渡。
图79d是瓣膜6302的侧视图的图示,所述瓣膜6302完全扩张或未压缩成扩张构型,并从输送导管6372正交释放,并且仍然通过远侧接片/rvot接片或远端下张力臂6332可释放地附接至远侧拉线/部署控制线或海波管(辅助导管)6380。框架的套环部分6320和下主体部分6312完全扩张,从而允许流动控制部件6350发挥作用。图79d显示了可通过使用刚性拉线310来定位或重新定位瓣膜。由于血流没有被阻断,介入医生被允许有机会和时间来确保瓣膜6302的正确定向,尤其是在远侧接片(二尖瓣)/rvot接片(三尖瓣)或远端下张力臂6332用于辅助锚定的情况下。一旦实现了正确的定向,瓣膜6302可以缓慢地安置在自体三尖瓣瓣环中,提供从自体血流到假体血流的平稳血流过渡。图79d还显示了释放机构6382,其用于通过拉动附接至释放钩、锁、珠或其它释放机构的触发线,从瓣膜体或远端下张力臂6332释放刚性拉动装置或辅助导管6380。
图79e是完全扩张或未压缩的瓣膜6302的侧视图的图示,其显示了在抵靠心房底部的前套环部分6321和后中隔套环部分6322的心房密封期间或由此导致的到全部血流通过瓣膜6302的流动控制部件6350并且瓣膜6302周围无血液的过渡。
图80a是瓣膜6402的侧视图的图示,所述瓣膜6402在输送导管6472内被卷成压缩构型,并由附接至瓣膜框架6410的套环6420的前缘的远侧刚性拉丝/引丝或辅助导管6480(或远侧推拉线)推进。
图80b是瓣膜6402的侧视图的图示,所述瓣膜6402通过推杆或辅助导管6480在套环6420的远侧上边缘上的作用从输送导管6472部分展开和部署。
图80c是从输送导管6472部分展开和部署的瓣膜6402的侧视图的图示,并且显示了推杆或辅助导管6480保持与瓣膜6401的连接,同时前套环部分6421展开并且流动控制部件的小叶6453未被覆盖。
图80d是被完全释放并展开成扩张构型的瓣膜6402的侧视图的图示,在所述扩张构型中刚性牵拉装置或辅助导管6480用于将瓣膜6402定位在自体瓣环内,并通过前套环部分6421和后中隔套环部分6422获得良好的瓣膜周围密封,以过渡到通过小叶6453的血流。图80d还显示了释放机构6482,其用于通过拉动附接至释放钩、锁、珠或其它释放机构的触发线,从瓣膜体或套环6420释放刚性拉动装置或辅助导管6480。
图80e是根据实施方案的瓣膜6502的侧视图的图示。图80e显示了瓣膜6502可具有如上参考图34a所述的组合金属丝单元框架结构,并且可在输送导管6572内被压缩成压缩构型,并且显示了引丝/拉线或辅助导管6580可以附接至压缩瓣膜6502的前端,并且可被推动以将瓣膜6502拉过并且/或者拉出输送导管6572。图80e还显示了瓣膜6502和引丝/拉线或辅助导管6580定位在导丝6585上。
图81a是输送导管6672的侧面或平面透明视图的图示,所述输送导管6672装载有处于压缩构型的侧面输送(正交)瓣膜6602。瓣膜6602具有框架,所述框架具有张力臂(例如,远端下张力臂)6632、附接至张力臂6632的导丝套环元件6640、以及延伸穿过导丝套环元件6640的导丝6685,其中导丝鞘或辅助导管6680推压导丝套环元件6640。放大的插图显示了附接至张力臂6632的导丝套环元件6640的非限制性实例,其中导丝6685延伸穿过由导丝套环元件6640和海波管鞘或辅助导管6680限定的孔,所述海波管鞘或辅助导管6680由于导丝套环元件6640的较大圆周而停靠于导丝套环元件6640,从而允许推动张力臂(例如,远端下张力臂)6632以将瓣膜6602拉过并且/或者拉出输送导管6672。
图81b是附接至张力臂6632的导丝套环元件6640a的另一个非限制性实例,其中导丝6685延伸穿过导丝套环元件6640a的孔,并且海波管鞘或辅助导管6680因海波管鞘或辅助导管6680的相对于由导丝套环元件6640a限定的孔的较大圆周而被阻挡,从而允许推动张力臂(例如,远端下张力臂)6632以将瓣膜6602拉出输送导管6672。图81b显示了基本上中空或环形的张力臂6632,其限定了延伸贯穿其中的内腔。导丝套环元件6640a被显示为限制延伸穿过张力臂6632的内腔的结构(例如,圆形结构),海波管鞘或辅助导管6680具有比限制更大的圆周,从而允许推动张力臂(例如,远端下张力臂)6632以将瓣膜6602拉过并且/或者拉出输送导管6672。
图81c是附接至张力臂6632的导丝套环元件6640b的另一个非限制性实例,其中导丝6685延伸穿过导丝套环元件6640b的孔,并且当海波管鞘或辅助导管6680在导丝6685上滑动时,海波管鞘或辅助导管6680被导丝套环元件6640b阻挡-所述导丝在海波管鞘或辅助导管6680的内腔中-因海波管鞘或辅助导管6680相对于由导丝套环元件6640b限定的孔的较大圆周而被阻挡,从而允许推动张力臂(例如,远端下张力臂)6632以将瓣膜6602拉过并且/或者拉出输送导管6672。
图81d是附接到张力臂6632的导丝套环元件6640c的另一个非限制性实例,其中导丝6685延伸穿过导丝套环元件6640c的孔,海波管鞘或辅助导管6680因海波管鞘或辅助导管6680相对于导丝套环元件6640c的较大圆周而被阻挡,从而允许推动张力臂(例如,远端下张力臂)6632以将瓣膜6602拉过并且/或者拉出输送导管6672。
图82a-图82c是根据实施方案的用于输送经导管人工瓣膜402的输送系统470的各种示意图。经导管人工瓣膜402被配置成部署在身体内(例如,人患者体内)期望的位置,并允许血液沿第一方向流经经导管人工瓣膜402的流入端,并阻止血液沿与第一方向相反的第二方向流经经导管人工瓣膜402的流出端。例如,经导管人工瓣膜402可以是经导管人工心脏瓣膜,其被配置成部署在人心脏的自体三尖瓣瓣膜或自体二尖瓣瓣膜的瓣环内,以补充并且/或者替代自体瓣膜的功能。
经导管人工瓣膜402在垂直于瓣膜402的长轴线的至少一个方向上是可压缩和可扩张的。瓣膜402被配置成在用于植入体内期的望位置(例如,人心脏)的扩张构型与用于通过输送系统470引入体内的压缩构型之间是可压缩的和可扩张的。
在一些实施方案中,人工瓣膜402可与上文参考图1a-图1f所描述的瓣膜102类似或基本相同。例如,图82b显示了瓣膜402可包括环形支撑框架410和流动控制部件450。环形支撑框架410可以类似于框架110,并且可包括套囊或套环部分420和管状部分(例如,下管状主体部分)412,以及导丝套环440。另外,环形支撑框架410(在本文中称为“框架”)限定了孔414,所述孔沿框架410的中心轴线413延伸或在所述轴线的方向上延伸。虽然未显示,但框架410和/或瓣膜402还可包括一个或多个张力臂、锚定接片等。流动控制部件450可以类似于上面参考图1a-图1f所描述的流动控制部件150。在本文中不对与瓣膜102基本上类似的瓣膜402进行进一步详细描述。
如图82a-图82c所示,输送系统470包括输送导管472、被膜476、辅助导管480和导丝485。输送系统470可被配置成将压缩的瓣膜402和/或瓣膜402的部分(例如,压缩的框架410或压缩的流动控制部件450)正交输送到体内的期望位置,例如,人心脏的自体三尖瓣瓣膜的瓣环和/或自体二尖瓣瓣膜的瓣环。如上文参考瓣膜102所详细描述的,输送系统470可以正交输送瓣膜402,所述瓣膜402已通过沿中心轴线413压缩(图82b)或在横向方向(例如,垂直于输送导管472的中心轴线413和中心纵向轴线475)上压缩而被压缩成压缩构型。这种压缩能导致瓣膜402沿纵轴线伸长(在图82a-图82c中未显示),所述纵向轴线基本平行于输送导管472的中心纵向轴线475。
输送导管472限定了内腔474,所述内腔474沿中心纵向轴线475或在中心纵向轴线475的方向上延伸。输送导管472的内腔474可具有足够的直径,以从中接收压缩瓣膜402。例如,输送导管472可为22-34fr。
被膜476被配置成便于以压缩构型放置到瓣膜402的输送导管472中。图82a显示了设置在被膜476内的瓣膜402和辅助导管480的至少一部分、推动器481、释放机构482和导丝485,所述被膜476又被定位在输送导管472的近侧端部分内或近侧端部分处。如上所详细描述的,可从这样的构型压缩瓣膜402,在所述构型中,在与输送导管472的纵向轴线475正交的平面中的瓣膜402的圆周大于输送导管472的内腔474的圆周或直径。被膜476可被配置成将瓣膜402压缩成压缩构型,或者接收已经被压缩成压缩构型的瓣膜402,使得胶囊476内的压缩瓣膜402的圆周小于输送导管472的内腔474的圆周或直径。
被膜476可以是任何合适的胶囊、导管、压缩构件和/或装置,其被配置成将瓣膜402压缩成压缩构型或者接收已经被压缩成压缩构型的瓣膜402。在一些实施方案中,被膜476可以是被配置成对瓣膜402施加压缩力(例如,挤压)的压缩导管或套管。在一些实施方案中,被膜476可被配置成在将瓣膜402输送到输送导管472中之前将瓣膜402保持在卷起或折叠的构型(例如,压缩构型)。在一些实施方案中,输送系统470可包括锥状或漏斗形固定装置,所述固定装置可将瓣膜402压缩成压缩构型,然后可将其插入被膜476中。在一些实施方案中,被膜476可被配置成将瓣膜402输送到输送导管472的近侧端,并且一旦输送,就可被移除并且/或者瓣膜402可从被膜476弹出进入输送导管472中。在其它实施方案中,瓣膜402可保持在被膜476内,所述瓣膜被共同推进穿过输送导管472。
导丝485延伸或穿过辅助导管480、瓣膜402和输送导管472。导丝485可以是例如至少部分由辅助导管480包覆的有鞘导丝。导丝485被配置成被推进穿过身体的解剖结构,并被放置在相对于自体组织(例如,自体瓣膜)的期望位置中。在一些情况下,可推进导丝485以提供导丝途径(例如,用于输送导管472、瓣膜402等)至rvot。导丝485延伸穿过瓣膜402的导丝套环440,以提供沿其推进瓣膜402的导丝路径。
辅助导管480可以是鞘、管、环形杆或金属丝等。在一些实施方案中,辅助导管480是围绕导丝485的一部分设置的海波管鞘(例如,辅助导管480和导丝485共同形成有鞘导丝或有鞘导丝组件)。辅助导管480可具有相对较小的尺寸,从而允许辅助导管480被推进通过输送导管472并且/或者被至少部分地设置在导丝套环440中或以其它方式与导丝套环440衔接。如图82a-图82c所示,辅助导管480的直径大于导丝485,从而允许导丝485从中穿过。
推动器481被设置在辅助导管480内,并被配置成推动瓣膜402的一部分,以推进瓣膜402通过并且/或者离开输送导管472。在一些实现方式中,推动器481被配置成推压瓣膜402的导丝套环440的一部分。例如,导丝套环440可以允许导丝485被推进通过导丝套环440,以及可以阻止并且/或者基本上防止推动器481推进超出导丝套环440(或其至少一部分)。虽然推动器481显示为被设置在辅助导管480中,但在一些实施方案中,辅助导管480可用作推动器481。在此类实施方案中,输送系统470不需要包括单独的推动器481。
瓣膜的导丝套环440(图82b)可以是任何合适的元件,其选择性地允许导丝485从中推进,同时阻止或防止辅助导管480和/或推动器481超出导丝套环440的推进。在一些实施方案中,导丝套环440可包括在框架410的套囊420中、由所述套囊形成并且/或者附接至所述套囊。在一些实施方案中,导丝套环440可包括在张力臂(例如,远端上张力臂、远端下张力臂等)中、由所述张力臂形成并且/或者附接至所述张力臂。在某些实施方案中,远端下张力臂可以形成并且/或者可以包括形成导丝套环440的特征。由于导丝485和远端下张力臂都插入或指向rvot,所以可能希望将导丝套环440附接至远端下张力臂。
在一些实施方案中,导丝套环440可以是球或张力臂的特征,其限定了足够大到允许导丝485穿过但不够大到允许辅助导管480和/或推动器481穿过的孔或内腔。这样,辅助导管480和/或推动器481可由于辅助导管480和/或推动器481相对于导丝套环440的孔或内腔的较大圆周而停靠于导丝套环440。这种布置允许辅助导管480和/或推动器481推动导丝套环440,从而推动与其附接的张力臂(例如,远端下张力臂)。当导丝套环440附接至远端张力臂时,对导丝套环440的推动可操作地将瓣膜402拉过并且/或者拉出输送导管472。可以设想,导丝套环440可具有任何合适的构型,所述构型使导丝套环440允许导丝485的推进,同时限制、阻止或防止辅助导管480和/或推动器481的推进。此外,释放机构482可被配置成例如在瓣膜402部署之后从导丝套环440释放导丝485、辅助导管480和/或推动器481。
图82c显示了输送系统470将瓣膜402输送到自体瓣膜,诸如二尖瓣瓣膜或肺动脉瓣膜(或三尖瓣瓣膜或主动脉瓣膜)。导丝485被推进穿过自体瓣膜的瓣环,并被设置在心室内(例如,在右心室流出道内)。可在导丝485上推进输送导管472,并将其输送到瓣环处或其附近的期望位置。瓣膜402可以以压缩构型(例如,通过卷起、折叠和/或其组合)放置,并且可被设置在被膜476内。一旦输送导管472位于期望的位置并且压缩瓣膜402位于被膜476中,被膜476就可用于将压缩瓣膜402输送到输送导管472的内腔474中。
图82a显示了被膜476将压缩瓣膜402输送到输送导管472的近侧端。在一些情况下,一旦瓣膜402位于输送导管472的内腔474中,被膜476就可被移除并且/或者瓣膜402可从被膜476中弹出。在其它实施方案中,当通过输送导管472推进瓣膜402时,瓣膜402可保留在被膜476中。通过推动辅助导管480和/或推动器481,可在导丝485上并在输送导管472内推进瓣膜402。当导丝套环440附接至瓣膜402或框架410的远端或前侧时,辅助导管480和/或推动器481的推动作用类似于相对于例如瓣膜框架410的管状部分412和/或瓣膜402的流动控制部件450的拉力。
图82c显示了从输送导管472部分弹出并从被膜476完全弹出的瓣膜402。将瓣膜402从被膜476和输送导管472中弹出可以是单个集成过程或步骤,或者可在许多独立过程和/或步骤中执行。或者,一旦瓣膜402被输送到输送导管472的内腔474中,就可移除被膜476。
辅助导管480和/或推动器481可用于将瓣膜402从输送导管472中弹出。一旦从输送导管472中弹出,瓣膜402就被允许扩张至扩张构型,并且可被安置在自体瓣膜的瓣环内。在一些实施方案中,辅助导管480、推动器481和/或导丝485可从导丝套环440释放,以允许辅助导管480、推动器481和/或导丝485缩回和/或撤回。在一些实施方案中,辅助导管480和/或推动器481可用于将瓣膜402或瓣膜框架410的至少近端侧推入瓣环中,从而完全安置并且/或者部署瓣膜402。尽管未在图82a-图82c中显示,但在一些实施方案中,辅助导管480和/或推动器481可被进一步用于将组织锚输送并且/或者锚定到瓣膜402或瓣膜框架410的近端侧。因此,输送系统470可以输送常规压缩的瓣膜或正交输送垂直和/或横向压缩的瓣膜402。此外,输送系统470包括被膜476,所述被膜476可使瓣膜402保持压缩构型,至少直至瓣膜402被输送到输送导管472中。
图82d是描述根据实施方案的用于输送可压缩人工瓣膜(诸如本文所述的任何人工瓣膜)的方法500的流程图。方法500包括在502处,在导丝上推进输送导管,以将输送导管的远侧端设置在体内的期望位置。例如,体内的期望位置可以是人心脏内的自体瓣膜的瓣环。在推进输送导管之前,可将导丝推进到期望的位置,并放置在例如右心室流出道内或相对于瓣环的另一个期望的位置。
在504处,瓣膜被膜被安装在导丝的近侧端上,其中瓣膜被膜包含处于压缩构型的人工瓣膜,并且具有导丝套环,所述导丝套环具有贯穿其中的孔,所述孔的内径大于导丝的直径,其中导丝被设置成穿过该孔。人工瓣膜、导丝套环、导丝和被膜的布置可以基本上类似于上面参考输送系统470所描述的布置。在一些实施方案中,瓣膜被膜可被配置成在人工瓣膜被输送并且/或者装载到输送导管中之前将人工瓣膜放置并且/或者保持在压缩构型。
在506处,瓣膜被膜被装载到输送导管的近侧端。瓣膜被膜的外径或周长可以小于输送导管内腔的直径或周长,从而允许瓣膜被膜被设置在内腔中。此外,瓣膜被膜可以将人工瓣膜保持在压缩构型,并且瓣膜被膜的装载类似地将人工瓣膜装载到输送导管的近侧端。
在508处,将推动器靠近人工瓣膜设置在导丝上,其中推动器的外径大于导丝套环中的孔的内径。推动器可以类似于上面参考图82a-图82c描述的推动器481。在一些实施方案中,推动器可以是能够形成导丝鞘的辅助导管等。在其它实施方案中,推动器可被插入或至少部分设置在辅助导管内。
在510处,将人工瓣膜从瓣膜被膜向远侧推进到输送导管的内腔并穿过其到达输送导管的远侧端。在一些实施方案中,当瓣膜被膜相对于输送导管移动或在输送导管内移动时,将瓣膜被膜装载并且/或者输送到输送导管的近侧端可以开始从瓣膜被膜弹出人工瓣膜。在其它实施方案中,人工瓣膜可以保留在瓣膜被膜内,直至人工瓣膜位于或接近输送导管的远侧端。在一些实施方案中,瓣膜被膜可以是压缩导管或套管,其可以滑离或相对于人工瓣膜滑动,以允许人工瓣膜从瓣膜被膜向远侧移动。如上文参考输送系统470所述,可以通过推动推动器和/或第二导管向远侧推进人工瓣膜,这又可在远侧方向上推动或拉动过人工瓣膜穿过输送导管。
在512处,将人工瓣膜从输送导管的远侧端部署到期望的位置。如上所述,推动器或辅助导管可用于从输送导管的远侧端弹出人工瓣膜。此外,可以类似地相对于瓣膜被膜推进人工瓣膜,或者从瓣膜被膜弹出人工瓣膜。因此,当人工瓣膜被设置在输送导管的外部和远侧(例如,在心脏的心房内)时,人工瓣膜可被允许扩张到适于部署到自体瓣膜的瓣环中的扩张构型。在一些情况下,推动器和/或辅助导管可用于将人工瓣膜推入自体瓣膜的瓣环中,并且当人工瓣膜在其中部署时,其可与自体瓣环组织形成密封。
以下提供了对经导管人工瓣膜、输送系统和/或输送方法的某些方面或实施方案的讨论。下文关于具体实施方案描述的经导管人工瓣膜(或其方面或部分)、输送系统和/或输送方法至少在形式和/或功能上基本类似于上面参考图82a-图82d描述的瓣膜402和/或瓣膜402的相应方面、输送系统470和/或输送方法500。因此,在本文中不再对特定实施方案的某些方面进行详细描述。
图83a-图83f显示了将正交经导管人工瓣膜6702输送到人心脏的三尖瓣瓣环的过程。图83a是其中将具有海波管鞘或辅助导管6780的导丝6785输送到rvot的输送过程的第一步骤的图示。导丝6785的直径约为0.035英寸(或约0.889mm)。
图83b显示了在导丝6772上被推进到自体三尖瓣瓣环并穿过其到达右心室的输送导管6772。
图83c显示了设置在被膜/压缩导管6776内的处于压缩构型的瓣膜6702。被膜6776被装载到输送导管6772的近侧端,并且瓣膜6702从被膜6776撤回到输送导管6772中,其中有鞘导丝6785穿过瓣膜6702,并且提供通向rvot(计划的部署位置)的金属丝传导路径。在另一个实施方案中,其中设置有瓣膜6702的被膜6776可通过输送导管6772的至少一部分来推进。导丝6785可延伸穿过瓣膜6702的导丝套环元件6740,同时海波管鞘或辅助导管6780相对于导丝套环元件6740的孔的较大圆周阻挡了海波管鞘或辅助导管6780穿过导丝套环元件6740。
图83d显示了瓣膜6702,所述瓣膜6702被从输送导管6772排出并且/或者释放而变成扩张构型,并通过抵靠导丝套环元件6740推动海波管鞘或辅助导管6780,以拉动瓣膜6702穿过输送导管6772并进入自体三尖瓣瓣环中的位置而被部署到自体瓣环中。张力臂(例如,远端下张力臂)6732用于将扩张的瓣膜6702定位在自体瓣环中。
图83e显示了辅助导管6780或可操纵的导管,用于将瓣膜6702的近端侧推入自体瓣环内的位置。
图83f显示了输送系统(例如,导丝6785和输送导管6772)的撤出以及瓣膜6702的近端侧(例如,后中隔侧)至瓣环组织的锚定。图83f显示了扩张的瓣膜6702,其具有面向心房的心房密封套环、部署在自体瓣环内并从心房延伸到心室的瓣膜体(例如,下管状体部分)、在瓣环下延伸进入rvot区域的锚定张力臂或远端下张力臂6732,以及位于张力臂6732的远侧端的导丝套环/球6740。撤出导丝6785和输送导管6772。
图84a-84f显示了将正交经导管人工瓣膜6802输送到人心脏的三尖瓣瓣环的过程。图84a是其中将导丝6885从股动脉通过下腔静脉(ivc)推进到右心房的输送过程的第一步骤的图示。导丝6885为8fr导丝(或直径约为2.667mm)。
图84b显示了球囊导管6889,所述球囊导管6889在导丝6885上被推进穿过自体瓣环并进入rvot,以扩张并推开自体瓣膜和小叶组织、可能会缠绕瓣膜6802的经导管输送的腱索。
图84c显示了具有被输送到rvot的海波管鞘或辅助导管6880的导丝6885。导丝6885的直径约为0.035英寸(或约0.889mm)。
图84d显示了在导丝6872上被推进到自体三尖瓣瓣环并穿过其到达右心室的输送导管6872。
图84e显示了被设置在被膜/压缩导管6876内的处于压缩构型的瓣膜6802。胶囊6876被装载到输送导管6872的近侧端,并且压缩的瓣膜6802被推进通过输送导管6872,其中有鞘导丝6885穿过瓣膜6802,并且提供通向rvot(计划的部署位置)的金属丝传导路径。
图84f显示了瓣膜6802,所述瓣膜6802被推进通过输送导管6872、排出、扩张至扩张构型,并且通过推动导丝6885的外鞘或辅助导管6880以拉动瓣膜6802(从包含在张力臂(例如,远端下张力臂)6832的远侧端中或与所述远侧端联接的导丝套环6840拉动),穿过输送导管6872并进入自体瓣环中的位置,从而至少部分地部署到自体瓣环中。张力臂6832用于定位瓣膜6802。
图84g显示了海波管鞘或辅助导管6880,或可操纵的导管,其用于将最靠近ivc或入口点的瓣膜6802的近端侧推入三尖瓣瓣环内的位置。
图84h显示了输送系统(例如,导丝6885和输送导管6872)的撤出和瓣膜6802的近端侧(例如,后中隔侧)到瓣环组织的锚定,以及使用瓣环下锚定张力臂6832对瓣膜6802的远端侧的锚定。撤出导丝6885和输送导管6872。
图85a-图85f显示了用于将正交经导管人工瓣膜6902输送到人心脏的三尖瓣瓣环的过程。图85a是输送过程的第一步骤的图示,并且显示了压缩的可侧向输送的瓣膜6902,所述瓣膜6902被设置在输送导管6972中,并且使用推进鞘或杆或辅助导管6980从中进行推进。通过跟随导丝6985的轨迹,输送导管6972在导丝6985上被推进到自体瓣环,所述导丝6985至少被部分地设置在推进鞘或辅助导管6980的内腔中。
图85b显示了推动外鞘或辅助导管6980以及导丝6985穿过导丝套环元件6940(所述导丝套环元件6940包含在瓣膜6902的张力臂(例如,远端下张力臂)6932中并且/或者与所述张力臂联接),以将瓣膜6902沿输送导管6972向上拉至适当的位置,部分地排出瓣膜6902,其中张力臂6932被置于rvot中,并且瓣膜6902的远端侧抵靠自体瓣环壁安置。
图85c显示了瓣膜6902从输送导管6972完全排出,成为扩张构型,并且从输送导管6972延伸的推进导管或辅助导管6980用于将瓣膜6902的近端侧推进到自体三尖瓣瓣环内的位置。
图85d显示了如何使用张力臂(例如,远端下张力臂)6932来定位瓣膜6902,同时使用推进导管或辅助导管6980来将瓣膜6902的近端侧推进到自体瓣环内的适当位置,以允许近端瓣环下锚定接片(近侧接片)或近端下张力臂6934衔接瓣膜6902并将瓣膜6902固定于自体组织。
图85e显示了推进导管和/或辅助导管6980如何能够用于输送组织锚6990,所述组织锚6990用于将瓣膜6902的近端侧固定到自体瓣环组织。
图85f显示了输送系统(例如,辅助导管6980、导丝6985和输送导管6972)的撤出以及瓣膜6902的近端侧经由组织锚6990到自体瓣环组织的锚定。辅助导管6980可用于将组织锚6990推入自体瓣环组织,以将组织锚6990固定到自体瓣环组织。
图86a-图86f显示了用于将经导管人工瓣膜7002输送到人心脏的三尖瓣瓣环的过程。图86a是其中具有海波管鞘或辅助导管7080的导丝7085通过上腔静脉(svc)被输送到rvot的输送过程的第一步骤的图示。导丝7085的直径约为0.035英寸(或约0.889mm)。
图86b显示了在导丝7085上被推进到自体三尖瓣瓣环并穿过其到达右心室的输送导管7072。
图86c显示了被设置在胶囊/压缩导管7076内的处于压缩构型的瓣膜7002。被膜7076被装载到输送导管7072的近侧端,并且瓣膜7002从被膜7076被撤回到输送导管7072中以用于进一步推进,或者被膜7076被用于在输送导管7072内推进瓣膜7002,其中有鞘导丝7085穿过瓣膜7002并且提供到通向rvot(计划的部署位置)的金属丝传导路径。导丝7085可延伸穿过瓣膜7002的导丝套环元件7040,同时海波管鞘或辅助导管7080相对于导丝套环元件7040的孔的较大圆周阻挡了海波管鞘或辅助导管7080穿过导丝套环元件7040。导丝套环元件7040可联接到张力臂(例如,远端下张力臂)7032。
图86d显示了瓣膜7002,所述瓣膜7002被向上推进并从输送导管7072中排出而变成扩张构型,并通过推动外鞘或辅助导管7080以通过导丝套环元件(球)7040将瓣膜7002向上拉到输送导管7072上并进入适当位置而部署到自体瓣环中。张力臂或远端下张力臂7032用作导丝套环元件(球)7040的安装件,以在部署期间定位瓣膜7002,并在远端侧提供瓣环下锚定。
图86e显示了从输送导管7072延伸并用于将瓣膜7002的近端侧推进到自体瓣环内的适当位置的推进导管或辅助导管7080。
图86f显示了输送系统(例如,导丝7085和输送导管7072)的撤出以及扩张瓣膜7002的近端侧到自体瓣环组织的锚定。图86f显示了扩张的瓣膜7002,其具有面向心房的心房密封套环、部署在自体瓣环内并从心房延伸到心室的瓣膜体(例如,下管状主体部分)、在瓣环下方延伸到rvot区域的锚定张力臂或远端下张力臂7032,以及位于张力臂7032的远侧端的导丝套环/球7040。撤出导丝7085、辅助导管7080和输送导管7072。
图87a是低轮廓(例如,8-20mm)侧面装载的人工二尖瓣瓣膜7102的经中隔(股动脉-ivc)输送的图示。图87a显示了部分容纳在输送导管7172内,并且部分弹出以部署到自体二尖瓣瓣环中的瓣膜7102。
图87b是低轮廓、侧面装载、垂直压缩的人工二尖瓣瓣膜7102的图示,其被显示为以压缩构型容纳在输送导管7172内。
图87c是低轮廓、侧面装载的人工二尖瓣瓣膜7102的图示,其被显示为部分地容纳在输送导管7172内,并且部分地从输送导管7172侧向弹出,并被定位成抵靠自体二尖瓣瓣环的前侧部署。图87c显示了部分扩张的瓣膜7102,其中瓣膜7102的流动控制部件7150开始展开或扩张。
图87d是低轮廓、侧面装载的人工二尖瓣瓣膜7102的图示,所述二尖瓣瓣膜被显示为从输送导管7172弹出而变成扩张构型,并抵靠自体二尖瓣瓣环的前侧定位。图87d显示了辅助导管7180,其可被推动以拉动瓣膜7102穿过输送导管7172,并从输送导管7172弹出瓣膜7102。图87d显示了处于扩张构型的瓣膜7102,其中瓣膜7102的流动控制部件7150展开并扩张。
图87e是低轮廓、侧面装载的人工瓣膜7102的侧视图或平面视图的图示,所述人工瓣膜7102显示为部署到自体二尖瓣瓣环中。图87e显示了处于扩张构型的瓣膜7102,其中瓣膜7102的流动控制部件7150展开并扩张,并且显示了撤出的输送系统(例如,输送导管7172和辅助导管7180)。
图88a是根据实施方案的瓣膜7202的侧面透视图的图示,所述瓣膜7202被部分地输送到自体瓣环。瓣膜7202是旋转锁定瓣膜实施方案,其中人工瓣膜7202被输送到自体瓣环,其中偏置的瓣环下张力臂(off-setsub-annulartensionarm)/接片(例如,远端下张力臂)7232被定位在自体瓣环下方,偏置的瓣环上方张力臂/接片(例如,远端上张力臂)7231被定位在自体瓣环上方,同时围绕纵轴线从瓣环平面部分地偏置地卷起瓣膜7202(或至少其管状瓣膜框架7210)。
图88b是瓣膜7202的侧面透视图的图示,其显示了输送到自体瓣环的人工瓣膜7202,其中偏置的瓣环下张力臂/接片(例如,远端下张力臂)7232被定位在自体瓣环下方,而偏置的瓣环上方张力臂/接片(例如,远端上张力臂)7231位于自体瓣环上方,同时瓣膜7202(或至少管状瓣膜框架7210)被部分地卷成与瓣环平面平行的功能性或完全部署的位置。一旦瓣膜7202卷到适当位置,张力臂7231和7232分别锁定在瓣环下组织和瓣环下组织上。瓣膜7210也可使用本文公开的常规锚定元件进一步锚定。图88b还显示了流动控制部件。
图89a是被输送到三尖瓣瓣膜瓣环的根据实施方案的人工瓣膜7302的图示。图89a显示了瓣膜7302或瓣膜框架的金属丝框架远端下张力臂7332,所述张力臂7332从输送导管7372弹出,并被引导穿过瓣环并朝向rvot。图89a显示了手风琴式压缩的低轮廓瓣膜7302的实施方案,并显示了当瓣膜7302在输送导管7372内或基本在输送导管7372内处于压缩构型时,朝向前小叶的远端下张力臂7332用于放置到rvot中。
图89b显示了从输送导管7372弹出的金属丝框架远端下张力臂7332和远端上张力臂7331,远端下张力臂7332被引导穿过自体瓣环并进入rvot,而远端上张力臂7331停留在瓣环上方位置,导致瓣膜7302的远端侧围绕瓣环的被动结构锚定。图89b还显示了附接到近侧锚定接片7330的可操纵的锚定导管或辅助导管7380。当瓣膜7302在预安置位置保持扩张构型时,瓣膜7302可被评估,并且一旦瓣膜功能和患者状况正确,可操纵的锚定导管7380就可用于将瓣膜7302的近端侧从其相对于自体瓣环平面所成的倾斜角向下推入瓣环中。然后,可操纵的锚定导管或辅助导管7380可用于安装一个或多个锚定元件7390。
图89c显示了从输送导管7372弹出的整个瓣膜7302,被引导穿过瓣环并进入rvot的金属丝框架远端下张力臂7332,停留在瓣环上方位置,并导致瓣膜7302的远端侧围绕瓣环的被动结构锚定的金属丝框架远端上张力臂7331,以及将瓣膜7302的近端侧锚定到瓣环组织中的至少一个组织锚7390。
图90a-图90c显示了组织锚7490的平面视图,所述组织锚7490具有头部7491a和螺钉7491b,所述螺钉7491b可以插入并且/或者拧入自体瓣环组织中。组织锚7490在组织锚7490的远侧端(例如,在螺钉7491b的一端)包括浮动的不透辐射的标记物7492,并与瓣环组织的心房表面接触。图90b显示了被推进到瓣环组织中的组织锚7490的螺钉7491b,其中不透辐射的标记物7492被拧入到组织锚7490上,并保持在瓣环组织的心房表面上的位置。图90c显示了组织锚7490,所述组织锚7490被完全推进到瓣环组织中,使得组织锚740和带螺纹的浮动不透辐射的标记物7492现在相邻,指示了组织锚7490相对于瓣环组织的期望深度、张力和/或折叠(plication)。
图91a-图91d示出了各种组织锚配置的平面视图。图91a显示了根据实施方案的具有直螺纹和恒定螺距的组织锚7590。图91b显示了根据实施方案的具有直螺纹和可变螺距的组织锚7690。图91c显示了根据实施方案的具有锥形螺纹和恒定螺距的组织锚7790。图91d显示了根据实施方案的具有凹陷的锥形螺纹和可变螺距的组织锚7890。
图92a-图92d显示了用于将较低轮廓的人工瓣膜7902夹住并且/或者锚定到瓣环组织(例如,自体瓣环的近端侧或前侧)的过程。图92a显示了插入到自体瓣膜的瓣环中的瓣膜7902,瓣膜7902具有整体锚输送导管或通道7997,其具有设置在锚输送导管或通道7997的内腔中的组织锚7990和附接至组织锚7990的锚输送导管或推动器7998。
图92b显示了完全部署在自体瓣膜的瓣环中的瓣膜7902和整体锚输送导管或通道7997,所述整体锚输送导管或通道具有设置在通道7997的内腔中的锚7990和附接至锚7998的锚输送导管或推动器7998。
图92c显示了被推出锚输送导管或通道7997的内腔并进入瓣环组织的锚7990。锚输送导管或推动器7998可用于推进锚7990穿过锚输送导管或通道7997。
图92d显示了锚7990,所述锚7990在被推出输送导管或通道7997的内腔(例如,经由锚输送导管或推动器7998)并进入瓣环组织之后处于锁定位置,从而将低轮廓瓣膜7902的近端侧锚定到自体瓣环组织的近端侧或前侧。
图93a-图93e显示了用于将较低轮廓人工瓣膜8002夹住并且/或者锚定到瓣环组织(例如,自体瓣环的近端侧或前侧)上的过程。图93a显示了完全部署在自体瓣膜的瓣环内的瓣膜8002。图93a还显示了通过锚输送导管或推动器8098输送附接线8093,其中夹子或锚8090容纳在锚输送导管8098的内腔中。附接线8093附接至人工瓣膜8002的近端侧或前侧。附接线8093被配置成衔接或联接到夹子或锚8090,以将瓣膜8002联接到夹子或锚8090。
图93b显示了插入到瓣环内空间的锚输送导管8098,并显示了附接至瓣膜8002的近端侧或前侧的附接线8093。夹子或锚8090容纳在锚输送导管8098的内腔中,并且未显示。
图93c显示了从锚输送导管8098弹出并被定位在待捕获的组织后面的夹子或锚8090的接收器元件或部分8094。接收器元件或部分8094与附接线8093衔接或连接。
图93d显示了穿过瓣环组织的夹子或锚8090的锚定元件或部分8095,所述接收器元件或部分8094被定位在所述瓣环组织之后方。锚定元件或部分8095穿过瓣环组织并插入到夹子或锚8090的接收器元件或部分8094中。夹子或锚8090或至少夹子或锚8090的接收器元件或部分8094通过附接线8093附接至低轮廓瓣膜8002。
图93e显示了延伸穿过瓣环组织的夹子或锚8090的锚元件或部分8095。夹子或锚8090的接收器元件或部分8094和夹子或锚8090的锚元件或部分8095彼此连接并连接到瓣环组织,并通过附接线8093连接到低轮廓瓣膜8002。撤出锚输送导管8098,并且保留夹子或锚8090。
图94是示出根据实施方案的用于将可植入的人工瓣膜正交输送到体内的期望位置的方法8100的流程图。在8101处,方法8100包括提供可压缩和可扩张的人工瓣膜。可压缩和可扩张的人工瓣膜可以是本文公开的任何瓣膜。例如,可压缩和可扩张的人工瓣膜可以是这样的瓣膜:(i)其中瓣膜具有具有安装在管状框架内的流动控制部件的管状框架,(ii)其中瓣膜或流动控制部件被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端,(iii)其中瓣膜是可压缩和可扩张的,并且具有以45-135度的与第一方向所成的交角定向的长轴线,以及(iv)其中长轴线平行于用于输送瓣膜的输送导管的纵向圆柱形轴线。在8102处,输送导管被推进到体内的期望位置。在8103处,输送可压缩和可扩张的人工瓣膜,其中可压缩和可扩张的人工瓣膜的高度约为5-60mm,直径约为25-80mm的。在使用输送导管引入或输送到体内的过程中,瓣膜可压缩至压缩构型。在8104处,可压缩和可扩张的人工瓣膜从输送导管中释放,其中瓣膜在从输送导管中释放后可扩张至扩张构型,用于将瓣膜植入体内的期望位置。
图95是显示根据实施方案的用于将可压缩和可扩张的人工瓣膜正交装载到输送导管中的方法8200的流程图。在8201处,方法8200包括提供可压缩和可扩张的人工瓣膜。可压缩和可扩张的人工瓣膜可以是本文公开的任何瓣膜。例如,可压缩和可扩张的人工瓣膜可以是这样的瓣膜:(i)其中瓣膜具有具有安装在管状框架内的流动控制部件的管状框架,(ii)其中瓣膜或流动控制部件被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端,(iii)其中瓣膜是可压缩和可扩张的,并且具有以45-135度的与第一方向所成的交角定向的长轴线,(iv)其中长轴线平行于用于输送瓣膜的输送导管的纵向圆柱形轴线,以及(v)其中瓣膜的高度约为5-60mm,直径约为25-80mm。在8202处,将可压缩和可扩张的人工瓣膜装载到附接至输送导管的锥形固定装置或漏斗中,以将瓣膜压缩成压缩构型,以便使用输送导管引入体内,用于植入体内的期望位置。
如上参考图1a和图1b所描述的,经导管人工瓣膜可包括瓣膜框架和流动控制部件,所述瓣膜框架和流动控制部件是整体部件或者是在输送到体内期望位置之前联接的独立部件。然而,本文所述的任何人工瓣膜可包括瓣膜框架和流动控制部件,所述瓣膜框架和流动控制部件是分开输送并联接或安装在体内的期望位置的独立部件。例如,瓣膜框架诸如本文所述的那些可被压缩并通过输送导管输送到体内的期望位置。所述框架可从输送导管中释放,并且例如部署在自体瓣膜的瓣环中。一旦从输送导管中释放,框架就处于扩张构型,因此,被以扩张构型部署在自体瓣膜的瓣环中。然后,流动控制部件诸如本文所述的那些中的任一种可被单独输送(例如,通过输送导管或单独的输送导管或辅助输送导管)并安装到部署的框架中。在一些实施方式中,这种布置可以允许商购可得的流动控制部件,所述流动控制部件被部署在本文描述的任何框架内,所述框架先前已被部署在自体瓣环中并且/或者被单独部署在自体瓣环中。
以下提供了对经导管人工瓣膜、输送系统和/或输送方法的某些方面或实施方案的讨论。下文关于具体实施方案描述的经导管人工瓣膜(或其方面或部分)、输送系统和/或输送方法至少在形式和/或功能上与上文参考图1a-图1f所描述的瓣膜102和/或瓣膜102的相应方面、用于输送瓣膜102的输送系统和/或输送方法基本类似。因此,在本文中不再对特定实施方案的某些方面进行详细描述。
图96a是低轮廓、侧面装载的人工瓣膜框架8310的开放横截面视图的图示,并且显示了安装在由框架8310的内表面限定的中心孔8314内的商购可得的瓣膜或流动控制部件8350的实例。
图96b是具有编织或激光切割的结构的瓣膜框架8310的图示。图96b显示了用于向rvot瓣环下延伸(上文详细描述的)的较长的远端下张力臂8332,以及用于在心房底部上方延伸(上文详细描述的)的较短的远端上张力臂8331。图96b中所示的管状框架8310的高度约为10mm,由框架8310接收的商购可得的瓣膜套管或流动控制部件8350在被接收在管状框架8310中时,可在管状框架8310的底部下方延伸约10mm,导致瓣膜的总高度为20mm。
图96c是具有编织或激光切割的结构的瓣膜框架8310和在输送导管8372内处于压缩构型的商购可得的瓣膜套管或流动控制部件8350的图示。图96c显示了附接至瓣膜框架8310的第二可操纵的导管8380,其用于将瓣膜框架8310弹出、定位和锚定在自体瓣环内。辅助导管8310也可用于取回瓣膜框架8310的失败部署。瓣膜框架8310可被输送到其中预先安装有瓣膜套管或流动控制部件8350的自体瓣环,使得瓣膜框架8310和流动控制部件8350可被一起输送,或者可在单独的过程中输送。
图96d是具有编织或激光切割的结构的瓣膜框架8310的图示,所述瓣膜框架8310显示为在输送导管8372内被部分压缩,并且从输送导管8372部分弹出。图96d显示了当瓣膜框架8372仍然被压缩时,远端下张力臂8332可通过小叶和腱索进行操纵,以找到瓣膜框架8310的远端侧的稳定前侧安置。图96d还显示了没有瓣膜套管或流动控制部件8350的瓣膜框架8310,其显示了框架8310可在流动控制部件8350的输送之前被输送到自体瓣环,并且/或者与流动控制部件8350的输送相分开地输送到自体瓣环。
图96e是瓣膜框架8310的图示,所述瓣膜框架8310具有编织或激光切割的结构,并且衔接自体瓣环的前侧上的组织,其中管状框架8310的弯曲的远端侧壁将自体瓣环周围密封。图96e显示了在评估瓣膜框架8310功能时,通过可操纵的辅助导管8380以一定的倾斜角保持的瓣膜框架8310。图96e显示了流动控制部件8350尚未被输送到自体瓣环。
图96f是人工瓣膜的图示,所述人工瓣膜具有完全部署到三尖瓣瓣环中的编织或激光切割的管状框架8310。瓣膜框架8310的远端侧显示为衔接自体瓣环前侧上的组织,其中管状框架8310的弯曲远端侧壁将自体瓣环周围密封,并且其中近端侧壁被张力安装到自体瓣环的后侧。图96f显示了被输送到自体瓣环(在输送瓣膜框架8310之后)并安装在瓣膜框架8310中的瓣膜套管或流动控制部件8350。瓣膜套管或流动控制部件8350可以是商购可得的流动控制部件。
图97a是根据实施方案的被输送到三尖瓣瓣膜瓣环的瓣膜框架8410的图示。图97a显示了具有编织/激光切割的金属丝框架结构的瓣膜框架8410,其具有从输送导管8410弹出并被引导穿过瓣环并朝向rvot的远端下张力臂8432。
图97b显示了被部分设置在输送导管8472内的瓣膜框架8410,其中远端下张力臂8432和远端上张力臂8431从输送导管8472弹出。远端下张力臂8432被引导穿过瓣环并进入rvot。远端上张力臂8432显示为停留在瓣环上方位置,并导致瓣膜框架8410的远端侧围绕瓣环的被动结构锚定。图97b显示了可操纵的锚定导管或辅助导管8480可将瓣膜框架8410以一定的倾斜角保持在预附接位置,使得可评估瓣膜框架8410,并且一旦瓣膜框架功能和患者状况正确,可操纵的锚定导管或辅助导管8480就可将瓣膜框架8410的近端侧从其倾斜角向下推入自体瓣环中。然后,可操纵的锚定导管或辅助导管8480可任选地安装一个或多个锚定元件。
图97c是瓣膜框架8410的图示,其显示了从输送导管8410弹出的整个编织/激光切割的框架8410。远端下张力臂8432被引导穿过瓣环并进入rvot。远端上张力臂8431停留在瓣环上方位置,并导致瓣膜框架8410的远端侧围绕瓣环的被动结构锚定。至少一个组织锚(未显示)可用于将瓣膜框架8410的近端侧锚定到瓣环组织中。图97c显示了框架8410的开口或孔如何能够允许血液流经该孔,然后如何能够将商业瓣膜套管或流动控制部件8450二次输送到孔中并部署在其中,以及固定到瓣膜框架8410上。
图98a是根据实施方案的被输送到三尖瓣瓣膜瓣环的瓣膜框架8510的图示。图98a显示了具有编织/激光切割的金属丝框架结构的框架8510,其中远端下张力臂从输送导管(未显示)弹出,并且指向并且/或者穿过自体瓣环并并朝向rvot。瓣膜框架8510的输送还可包括瓣膜或瓣膜框架评估过程。
图98b显示了编织/激光切割的金属丝框架8510,其中远端下张力臂和远端上张力臂从输送导管弹出。远端下张力臂穿过瓣环并进入rvot。远端上张力臂保持在瓣环上方位置,并导致瓣膜框架8510的远端侧围绕瓣环的被动结构锚定。可将瓣膜框架8510以一定的倾斜角保持在预附接位置(例如,通过可操纵的锚定导管或辅助导管,未显示),使得瓣膜框架8510能够被评估,并且一旦瓣膜框架功能和患者状况正确,就可将瓣膜框架8510的近端侧从其倾斜角向下推入自体瓣环中。
图98c显示了从输送导管弹出的整个编织/激光切割的框架瓣膜框架8510,其中远端下张力臂被引导穿过瓣环并进入rvot,远端上张力臂停留在瓣环上方位置,并导致瓣膜框架8510的远端侧围绕瓣环的被动结构锚定。尽管未显示,但至少一个组织锚可用于将瓣膜框架8510的近端侧锚定到瓣环组织中。图98c显示了商业瓣膜套管或流动控制部件8550如何能够被二次部署到框架8510的开口或孔中。
图99a是可安装在本文公开的任何框架内的商业瓣膜套管或流动控制部件8650的图示。
图99b是商业瓣膜套管或流动控制部件8650的图示,其显示了可使用并且/或者具有两个刚性支撑柱8652来将流动控制部件8650可安装在本文公开的任何框架内。
图99c是可安装在本文公开的任何框架内的商业瓣膜套管或流动控制部件8750a的图示。流动控制部件8750a显示为三片式实施方案。
图99d是可安装在本文公开的任何框架内的商业瓣膜套管或流动控制部件8750b的图示。流动控制部件8750b显示为具有三个刚性支撑柱8752的三片式实施方案。
图100是心脏的图示,并且显示了瓣膜、左心房和右心房、左心室和右心室以及进入和离开心脏腔室的血管的大致位置。
图101a是低轮廓(例如,8-20mm)的侧面装载的瓣膜框架8810的图示,所述瓣膜框架8810显示为处于垂直压缩的构型并容纳在输送导管8872内。
图101b显示了瓣膜框架8810,所述瓣膜框架8810被部分压缩并且部分容纳在输送导管8872内,并且从输送导管8872部分横向弹出,并且被定位成抵靠自体瓣膜(诸如三尖瓣瓣膜或二尖瓣瓣膜)的瓣环的前侧部署。
图101c显示了从输送导管8872弹出并抵靠自体瓣环的前侧定位的瓣膜框架8810。可通过可操纵的锚定导管或辅助导管8880将瓣膜框架8510以一定的倾斜角保持在预附接位置,使得瓣膜框架8510能被评估,并且一旦瓣膜框架功能和患者状况正确,可经由可操纵的锚定导管或辅助导管8880将瓣膜框架8810的近端侧从其倾斜角向下推入自体瓣环。
图101d显示了部署到心脏瓣膜的自体瓣环中的瓣膜框架8810。
图101e-图101g显示了可被插入部署的框架8810中的瓣膜或流动控制部件8850的侧视图。图101e显示了可由合适的相应输送导管二次输送的流动控制部件8850的两个替代形式。在图101e左侧的实施方案中,流动控制部件是自扩张的,并且从输送导管的内腔输送,并且允许扩张到瓣膜框架8810的内腔或孔中。在图101e右侧的实施方案中,流动控制部件是商业上认可的经导管的球囊可扩张型流动控制部件8850,其在球囊导管8889上输送,在球囊导管8889上,其可以扩张到瓣膜框架8810的内腔或孔中。图101f显示了瓣膜或流动控制部件8850的自扩张实施方案被部署在瓣膜框架8810中,并被允许在框架8810的内腔或孔内扩张成扩张构型。图101g显示了球囊可扩张的瓣膜或流动控制部件8850可被垂直部署到已经(横向地、水平地、正交地)部署的瓣膜框架8810的中心内腔或孔中。
图102a-图102d显示了用于将同轴经导管人工瓣膜8902输送到人心脏的自体瓣膜的瓣环的过程。图102a显示了处于同轴压缩构型的瓣膜8902,其使用压缩被膜或压缩导管8976装载到输送导管8972的远侧端。图102a显示了海波管或鞘(辅助导管)8980、穿过联接到例如远端张力臂的导丝套环8940的导丝8985。压缩被膜或导管8976被配置成将同轴人工瓣膜压缩到适于插入输送导管8972的尺寸。
图102b显示了被输送到输送导管8972的远侧端的同轴压缩瓣膜8902,其中将海波管或辅助导管8980和有鞘导丝8985穿过附接至例如远端张力臂的通道型导丝套环8940或设置在所述其通道型导丝套环8940中。导丝套环8940可包括并且/或者形成配置成允许推进导丝8985穿过导丝套环8940并阻止辅助导管8980推进的缢缩部或其它特征,所述辅助导管8980可用于在输送导管8972内推进瓣膜8902。
图102c显示了从输送导管8972部分排出的同轴压缩瓣膜8902,其中远端张力臂和/或通道型导丝套环8940定位在自体瓣膜的心室流出道(例如,rvot)中。远端张力臂可以形成并且/或者限定通道型导丝套环8940,从而组合功能或特征。
图102d显示,一旦定位,自扩张瓣膜8902就可从输送导管8972完全排出,并作为与本文公开的任何人工瓣膜类似的人工瓣膜部署。
图103a-图103g显示了用于将同轴经导管人工瓣膜9002输送到人心脏的三尖瓣瓣膜的过程。图103a是输送过程的第一步骤的图示,在所述输送过程具有海波管鞘或辅助导管9080的导丝9085通过上腔静脉(svc)被输送到rvot。导丝9085的直径约为0.035英寸(或约0.889mm)。
图103b显示了在导丝9085上被推进穿过svc至自体三尖瓣瓣环并穿过其到达右心室的输送导管9072。
图103c显示了压缩被膜9076内处于压缩构型的瓣膜9002。被膜9076可用于将瓣膜9002压缩到压缩瓣膜9002适配在输送导管9072内的程度。图103c显示了被膜9076被装载到输送导管9072的近侧端中,并且瓣膜9002从被膜9076撤出/输送到输送导管9072中,其中有鞘导丝9085穿过瓣膜9002,并且提供了通向rvot(计划的部署位置)的金属丝传导路径。
图103d显示了将瓣膜9002沿输送导管9072推进,并通过推动外部海波管鞘或辅助导管9080以将瓣膜9002沿输送导管9072拉动并进入适当位置来部署到自体瓣环中。图103d显示了瓣膜9002的张力臂9030用于将瓣膜9002定位在自体瓣环中。
图103e显示了用于将处于扩张构型的瓣膜9002的近端侧推入自体瓣环内的位置的可操纵的球囊导管9089。
图103f显示了同轴瓣膜9002在自体瓣环中的球囊扩张。可将瓣膜9002的近端侧锚定到瓣环组织上。
图103g显示了输送系统(例如,输送导管9072、辅助导管9080、导丝9085等)的撤出。使用本文所述的任何锚定方法将扩张的瓣膜9002的近端侧锚定到瓣环组织上。
图104a-图104f显示了用于将同轴球囊扩张型经导管人工瓣膜9102输送到人心脏的三尖瓣瓣环的过程。图104a显示了在导丝9185上推进以部署到自体瓣环中的输送导管9172。
图104b显示了在压缩被膜9176内处于压缩构型的同轴球囊扩张型瓣膜9102。被膜9176可用于将瓣膜9102压缩到压缩瓣膜9102适配在输送导管9172内的程度。图104b显示了被膜9176被装载到输送导管9172的近侧端中,以及瓣膜9102从被膜9176撤回/输送到输送导管9172中,其中有鞘导丝9085穿过瓣膜9102,并且提供了通向rvot(计划的部署位置)的金属丝传导路径。图104b显示了包括通道型导丝套环9140的瓣膜9102,导丝9185被穿过该通道型导丝套环9140。
图104c显示了被输送到输送导管9172的近侧端的同轴瓣膜9102,其中有鞘导丝9180穿过张力臂和/或导丝套环9140。导丝套环9140可联接到远端张力臂或者可以至少部分形成远端张力臂。导丝套环9140可包括并且/或者形成被配置成允许推进导丝9185穿过导丝套环9140并阻止海波管鞘或辅助导管9180推进的缢缩部或其它特征,所述海波管鞘或辅助导管9180可用于在输送导管9172内推进瓣膜9102。
图104d显示了同轴瓣膜9102从输送导管9172部分地排出,成为扩张构型,其中远端张力臂和/或导丝套环9140被定位在rvot中。图104d显示了连接到瓣膜9102的球囊导管9189。
图104e显示,一旦被球囊导管9189定位和扩张,球囊扩张的同轴瓣膜9102就可完全部署到自体瓣环的内周中,以用作人工瓣膜。图104f显示了撤除了输送系统(例如,输送导管9172、辅助导管9180、导丝9185、球囊导管9189等)的部署的瓣膜9102。
图104f是用于将同轴人工瓣膜143输送至三尖瓣瓣环的6步过程的步骤6的图示。图104f显示了部署的瓣膜。
实施例.正交输送的经导管人工瓣膜的一个实施方案具有具有流动控制部件的管状框架,所述流动控制部件安装在管状框架内,并且被配置成允许血液沿第一方向流经瓣膜的流入端,并阻止血液沿与第一方向相反的第二方向流经瓣膜的流出端,其中所述瓣膜可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与第一方向所成的交角定向的长轴线,并且可扩张至扩张构型,所述扩张构型具有以45-135度的与第一方向所成的交角定向的长轴线,其中瓣膜的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜的高度约为5-60mm,直径约为25-80mm。重要的是,这种心脏瓣膜替代物不具有常规瓣膜构型,可使用下腔静脉(压缩在导管内的ivc/股动脉经导管的输送路径)输送到心脏,并从导管中排出以在无需进行心内直视手术的情况下部署。
实施例.在经导管瓣膜的另一个实施方案中,包括:高度约为5-60mm、外径约为25-80mm的圆柱形管状框架,所述管状框架包括具有大致圆形的中心孔的编织物、金属丝或激光切割的金属丝框架,所述管状框架部分覆盖有生物相容性材料;设置在中心孔内的可收缩流动控制部件,所述套管具有约5-60mm的高度,并且包括至少两个相对的小叶,所述小叶提供从心房到心室的往复可关闭通道;附接至管状框架的远侧上边缘的上张力臂,所述上张力臂包括支架、管状框架段、从距离管状框架约10-30mm处延伸的金属丝环或金属丝框架;从管状框架的远端侧延伸的下张力臂,所述下张力臂包括支架、管状框架段、从管状框架延伸出去约10-40mm的金属丝环或金属丝框架;和至少一个将管状框架与自体组织连接的组织锚。
实施例.在经导管瓣膜的另一个实施方案中,提供了其中套管成形为圆锥形圆柱,所述顶端的直径为30-35mm,所述底端的直径为8-20mm的特征。
实施例.在经导管瓣膜的另一个实施方案中,提供了其中覆盖物包括聚酯、聚对苯二甲酸乙二醇酯、脱细胞心包或其分层组合的特征。
实施例.在实施方案中,还提供了用于将可植入的人工瓣膜正交输送到体内的期望位置的方法,其中所述方法包括(i)将输送导管推进至体内的期望位置,并通过从输送导管释放瓣膜而将可扩张的人工瓣膜输送至体内的期望位置,其中所述瓣膜包括具有流动控制部件的管状框架,所述流动控制部件安装在所述管状框架内,并且被配置成允许血液沿第一方向流经所述瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述瓣膜的流出端,其中所述瓣膜可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与第一方向所成的交角定向的长轴线,并且可扩张至扩张构型,所述扩张构型具有以45-135度的与第一方向所成的交角定向的长轴线,其中瓣膜的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜的高度约为5-60mm,直径约为25-80mm。
实施例.在一个实施方案中,还提供了用于将可植入的人工瓣膜正交装载到输送导管中的方法,其中所述方法包括将可植入的人工瓣膜侧面装载到附接至输送导管的锥形固定装置或漏斗中,其中所述瓣膜包括具有流动控制部件的管状框架,所述流动控制部件安装在管状框架内,并且被配置成允许血液沿第一方向流经所述瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述瓣膜的流出端,其中所述瓣膜可压缩至压缩构型,以便使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与第一方向所成的交角定向的长轴线,并可扩张至扩张构型,所述扩张构型具有以45-135度的与第一方向所成的交角定向的长轴线,其中瓣膜的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜的高度约为5-60mm,直径约为25-80mm。
实施例.在实施方案中,还提供了用于将可植入的人工瓣膜正交装载到输送导管中的方法,其中所述方法包括(i)将可植入的人工瓣膜装载到附接至输送导管的锥形固定装置或漏斗中,其中所述瓣膜包括具有流动控制部件的管状框架,所述流动控制部件安装在所述管状框架内,并且被配置成允许血液沿第一方向流经所述瓣膜的流入端,并阻止血液沿与所述第一方向相反的第二方向流经所述瓣膜的流出端,其中所述负载垂直于或基本上垂直于所述第一方向,其中所述瓣膜可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与第一方向所成的交角定向的长轴线,并且可扩张至扩张构型,所述扩张构型具有以45-135度的与第一方向所成的交角定向的长轴线,其中瓣膜的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜的高度约为5-60mm,直径约为25-80mm。
实施例.可使用经导管的方法通过以下路径经皮输送经导管人工瓣膜心脏瓣膜:经股动脉通过ivc、颈动脉、剑突下、穿过胸壁的肋间通路,以及经中隔通过卵圆窝到达二尖瓣瓣环。所述装置通过导管输送到右心房或左心房,并从与导管内腔内径适配的压缩形状扩张。在患者体外将压缩的瓣膜装载入输送导管,然后当被膜到达心房时将其推出导管。心脏治疗技术人员使用可用的成像技术诸如荧光透视法或超声波来使这种输送可视化,并且在实施方案中,瓣膜在从导管中释放时自行扩张,因为其部分由形状记忆材料例如
在另一个实施方案中,瓣膜可由在被膜已从导管弹出进入心房中之后需要球囊扩张的材料构成。
当心房套环/框架和流动控制部件被部署到自体瓣环中时,它们被扩张到它们的功能直径,从而提供径向张力以固定瓣膜。一旦框架在三尖瓣瓣环周围部署,紧固件就将装置固定在自体瓣环周围。可以将所述装置附加地紧固到自体结构上,并完成部署。考虑使用血液动力学成像技术进行进一步的调整,以确保所述装置是安全的,按计划定位和定向,并作为自体三尖瓣瓣膜的替代物或后继物。
实施例-正交输送的经导管人工瓣膜框架的一个实施方案具有管状框架,其中瓣膜框架可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定位的长轴线,并且可扩张至扩张构型,所述扩张构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定位的长轴线,其中瓣膜的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜的高度约为5-60mm,直径约为25-80mm。该心脏瓣膜框架可使用下腔静脉(压缩在导管内的ivc/股动脉经导管的输送路径)输送到心脏,并从导管中排出以在无需进行心内直视手术的情况下部署。
实施例-在经导管瓣膜框架的另一个实施方案中,提供高度约为5-60mm、外径约为25-80mm的圆柱形管状框架,所述管状框架包括具有基本圆形中心孔的编织物、金属丝或激光切割的金属丝框架,所述管状框架部分覆盖有生物相容性材料;附接至管状框架的远侧上边缘的上张力臂,所述上张力臂包括支架、管状框架段、从距管状框架约10-30mm处延伸的金属丝环或金属丝框架;从管状框架的远端侧延伸的下张力臂,所述下张力臂包括支架、管状框架段、从距离管状框架约10-40mm处延伸的金属丝环或金属丝框架;和至少一个将管状框架连接到自体组织的组织锚。
实施例-在实施方案中,还提供了用于将可植入的人工瓣膜框架正交输送到体内的期望位置的方法,其中所述方法包括(i)将输送导管推进至体内的期望位置,并通过从输送导管释放瓣膜框架来将可扩张的人工瓣膜框架输送到体内的期望位置,其中所述瓣膜框架可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定向的长轴线,并且可扩张至扩张构型,所述扩张构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定向的长轴线,其中瓣膜框架的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜框架的高度约为5-60mm,直径约为25-80mm。
实施例-在实施方案中,还提供了用于将可植入的人工瓣膜框架正交装载到输送导管中的方法,其中所述方法包括将可植入的人工瓣膜框架侧面装载到附接至输送导管的锥形固定装置或漏斗中,其中瓣膜框架可压缩至压缩构型以用于使用输送导管引入体内,用于在体内的期望位置植入,所述压缩构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定向的长轴线,并可扩张至扩张构型,所述扩张构型具有以45-135度的与自体瓣环的中心圆柱形轴线所成的交角定向的长轴线,其中瓣膜框架的压缩构型的长轴线基本平行于输送导管的纵向圆柱形轴线,其中瓣膜框架的高度约为5-60mm,直径约为25-80mm。
实施例-可使用经导管的方法通过以下路径经皮输送经导管人工心脏瓣膜:经股动脉通过下腔静脉(ivc)、上腔静脉(svc)、颈静脉、肱静脉、剑突下、穿过胸壁的肋间通路和经中隔通过卵圆窝。所述装置通过导管输送到右心房或左心房,并从与导管内腔的内径适配的压缩形状扩张。在患者体外将压缩的瓣膜装载入输送导管,然后当被膜到达心房时将其推出导管。心脏治疗技术人员使用可用的成像技术诸如荧光透视法或超声波来使这种输送可视化,并且在实施方案中,瓣膜框架在从导管中释放时自行扩张,因为它部分地由形状记忆材料诸如
在另一个实施方案中,瓣膜框架可被构造成在被膜已从导管弹出进入心房中之后与球囊扩张一起使用。心房套环/框架扩张至其功能直径,并部署到自体瓣环中,提供径向张力以固定瓣膜框架。一旦框架在三尖瓣瓣环周围部署,紧固件就将装置固定在自体瓣环周围。可以将所述装置附加地紧固到自体结构上,并完成部署。考虑使用血液动力学成像技术进行进一步的调整,以确保装置是可靠的、按计划定位和定向的,并且是起作用的。
实施例-压缩方法。在另一个实施方案中,提供了压缩方法,其中可使用以下方式中的至少一种将可植入人工心脏瓣膜卷起或折叠成压缩构型:(i)从环形支撑框架的一侧单边卷起成压缩构型;(ii)从环形支撑框架的两个相对侧双边卷起成压缩构型;(iii)将环形支撑框架展平成基本平行于长轴线的两个平行片,然后将展平的环形支撑框架卷成压缩构型;以及(iv)沿垂直轴线展平环形支撑框架,以从顶部到底部减小瓣膜的垂直尺寸。
对于本领域技术人员来说显而易见的是,在不脱离其精神和范围的情况下,可以进行许多修改和变化。除了本文列举的那些之外,根据前面的描述,本公开范围内的功能等同的方法和仪器对于本领域技术人员来说将是显而易见的。此类修改和变化旨在落入所附权利要求的范围内。本公开仅由所附权利要求的条款以及此类权利要求所授权的等同物的全部范围来限制。应当理解,本公开不限于特定的方法、试剂、化合物、组合物或生物系统,所述方法、试剂、化合物、组合物或生物系统当然可以变化。还应当理解,本文使用的术语仅仅是为了描述特定的实施方案,而不是为了限制。
虽然上面已经描述了各种实施方案,但是应当理解,它们仅作为实例而非限制来呈现。当上述方法指示某些事件以某种顺序发生时,可以修改某些事件的顺序。另外,当可能时,某些事件可以在并行过程中同时执行,也可以如上所述顺序执行。
在上面描述的示意图和/或实施方案指示以特定方向或位置布置的特定组件的情况下,可以修改组件的布置。虽然已经具体显示和描述了实施方案,但是应当理解,可以在形式和细节上进行各种改变。除了互斥的组合外,本文描述的装置和/或方法的任何部分可以以任何组合进行组合。本文描述的实施方案可包括所描述的不同实施方案的功能、组件和/或特征的各种组合和/或子组合。
- 还没有人留言评论。精彩留言会获得点赞!