具有巯基多重接头的ADC的制作方法
具有巯基多重接头的adc
1.相关申请的交叉引用
2.本技术请求享有提交于2018年12月21日的美国申请号62/783,707和提交于2018年12月21日的美国申请号62/783,582的优先权,其内容通过引用全文纳入本文。
背景技术:
3.抗体
‑
药物偶联物(adc)结合了单抗的肿瘤靶向特异性和细胞毒性弹头的有力细胞杀伤活性。部分由于最近adc的临床成功,设计新形式adc的兴趣激增,这些成功包括:本妥昔单抗凡多汀(brentuximab vedotin,)获批用于复发性霍奇金淋巴瘤和间变性大细胞淋巴瘤,以及阿多曲妥珠单抗美坦(ado
‑
trastuzumab mertansine,)获批用于her2阳性转移性乳腺癌。这些新方法大部分集中在解决现有临床分子的某些缺点,例如异质药物加载、有限的药物
‑
接头稳定性、以及弹头活性仅限于癌症类型的亚类。为了获得改进的adc,在本领域中已取得了许多显著的进展。这些进展包括:实现同质加载的位点特异性药物
‑
接头偶联策略、具有改善稳定性的药物
‑
接头附接方式、强力的新有效荷载以及采用其他释放机制的接头策略。
4.本文中,我们描述了既可用于天然、非工程化改造igg也可用于工程化改造igg的可及性多重化偶联技术,并展示了有效荷载附接的首次应用,在该应用中通过单次连接化学反应获得了高载药量。然后,有赖于有效荷载附接的空间参数、链间二硫偶联的应用以及通过工程化改造半胱氨酸残基的偶联,制得了与常规adc相比体内外活性增强的adc。
5.发明概述
6.本文提供了多重体连接组装(mla)化合物、包含抗体和1
‑
10个共价附接的多重体连接组装(mla)单元的巯基多重化抗体药物偶联物(tm
‑
adc),其中各所述1
‑
10个共价附接的多重体连接组装单元共价附连于来自由所述抗体的还原链间二硫键提供的半胱氨酸巯基的硫原子和/或来自引入所述抗体的工程化改造半胱氨酸残基的硫原子。各共价附连的多重体连接组装单元具有与其附连的2
‑
4个药物部分(d
m
)和可任选的分区基团(y)。多重体接头组装(mla)化合物的具体实施方式如下文的式(ia)所示,所述化合物是tm
‑
adc中mla单元的前体:
[0007][0008]
其中,a1是第一连接基团;
[0009]
各a2独立地为键或为独立选择的第二连接基团;
[0010]
各a1和a2包含0或1个分区基团(y),其共价附连于第一或第二连接基团,或为第一
或第二连接基团的二价连接元件;
[0011]
m为多重化基团或第一巯基多重化基团(t
mc1
);
[0012]
各t
mc2
独立地为巯基多重化基团;
[0013]
下标m为0或1;其中:
[0014]
当下标m为0时,m为二硫化物形式中的第一巯基多重化基团(t
mc1
),或为附接于两个药物部分(d
m
)的第一巯基多重化基团(t
mc1
);以及
[0015]
当下标m为1时,各t
mc2
为二硫化物形式、具有合适硫原子保护的二巯基形式或附接于两个药物部分(d
m
)。
[0016]
本文还提供了巯基多重化抗体药物偶联物(tm
‑
adc),其通常用式ia的mla化合物制备。
[0017]
在另一方面,本文提供了式(i)和(ii)的式ia化合物:
[0018][0019]
或其盐,其中r为h或氨基保护基,且r1选自下组:
[0020][0021]
在另一方面,本文提供了采用所描述tm
‑
adc来治疗疾病的药物组合物和方法。
附图说明
[0022]
图1显示了制备巯基多重化抗体药物偶联物(tm
‑
adc)的示例性反应流程。在第一
反应(左侧)中,来自半胱氨酸的抗体巯基与共价附接于巯基多重化(t
mc
)基团的连接基团(a1)(“a1‑
t
mc”元件)反应形成中间体,其中巯基多重化(t
mc
)基团的二硫官能团是完整的。参考第二个反应箭头,还原剂(诸如tcep)裂解巯基多重化(t
mc
)基团中的二硫键,新形成的巯基官能团与n
‑
乙基马来酰亚胺(nem)反应形成具有“仿(dummy)”药物部分的tm
‑
adc。在该例子中,终产物为n
‑
乙基马来酰亚胺(nem)封端的巯基多重化抗体偶联物,其中马来酰亚胺部分已被转化为巯基取代的琥珀酰亚胺部分。为了制备巯基多重化抗体药物偶联物(tm
‑
adc),用所需药物部分(d
m
)替换反应流程中的nem。注意:右侧的抗体图显示了开环或水解形式的a1基团琥珀酰亚胺环。中间的抗体图也可为开环形式,因为质谱解析不能区分具有闭环形式环的na+加成产物和具有开环形式的产物。
[0023]
图2提供了获自完全还原的cac10抗体的加载16个奥瑞他汀的tm
‑
adc的plrp色谱法和质谱数据,该抗体中来自二硫键还原反应的各半胱氨酸残基已用式a1‑
t
mc
的多重体接头组装(mla)化合物烷基化,其中a1由马来酰亚胺部分组成,且奥瑞他汀药物单元的疏水性通过各药物部分接头元件的peg化减小。
[0024]
图3提供了获自完全还原的cac10抗体的加载16个奥瑞他汀tm
‑
adc的plrp色谱法和质谱数据,该抗体中来自二硫键还原反应的各半胱氨酸残基已用式a1‑
t
mc
的多重体接头组装(mla)化合物烷基化,其中a1包含马来酰亚胺部分,且奥瑞他汀药物部分的疏水性通过各药物部分接头元件的peg化减小。
[0025]
图4a显示将a1‑
t
mc
示例性添加于来自半胱氨酸残基的抗体巯基,以及后续的巯基多重体(t
mc
)基团的二硫键还原。在该描述的实施方式中,右侧的抗体表示是中间抗体所示化学结构的缩写表示。
[0026]
图4b显示了用4个药物部分(d
m
)制备巯基多重化抗体药物偶联物(tm
‑
adc)的示例性反应流程。标号为1和2的步骤与图4a中所示的类似,除了在本例中的反应在抗体的10个不同半胱氨酸残基处同时进行。步骤1和2之后,每个生长的多重体连接组装单元具有两个巯基官能团。步骤3显示“a2‑
t
mc2”基团添加到各巯基官能团,然后步骤4中还原各t
mc2
基团中的二硫键以提供其中各多重体连接组装单元(共10个)分别具有4个巯基官能团(共40个)的抗体。步骤5中,将药物部分(d
m
)附接于各巯基官能团以形成具有40个药物部分(d
m
)的tm
‑
adc。用于步骤3中的“a2–
t
mc2”的示例性化学结构如反应流程下方所示。
[0027]
图5显示了如下制备路线:附接8个mla单元,然后进行二硫键还原和药物部分附接,得到包含16个附连药物部分的adc。
[0028]
图6显示了采用能够参加点击偶联反应的引入修饰官能团附接两个mla单元的制备路线。在该示例中,用mpr
‑
peg
‑
叠氮化合物共价修饰工程化改造的半胱氨酸,然后使其与具有炔基的药物部分前体的合适mla基团反应。
[0029]
图7显示适于共价附接2个或4个药物部分的各种mla化合物。
[0030]
图8显示具有可变药物抗体比的亲水性枝状吉西他滨adc的滞留时间。
[0031]
图9显示具有可变药物抗体比的亲水性枝状吉西他滨adc对霍奇金淋巴瘤细胞系l540cy的体外细胞毒性。
[0032]
发明的具体实施方式
[0033]
概述
[0034]
本文提供了式(ia)、(ib)和(ic)及其(iia)、(iiia)和相关子式的多重体连接组装
(mla)单元和巯基多重化抗体药物偶联物(tm
‑
adc)。本文所述的tm
‑
adc和mla单元由于多重体连接组装单元的存在,在单个连接组装体中有利地提供了比常规adc更高的载药量。由单个多重体连接组装体提供的更高载药量归因于本文所述多重体连接组装单元的分枝性质。例如,在一些方面中,单个多重体连接组装单元提供了对2
‑
32个或更多个药物部分(d
m
)的共价附接,每个药物部分包含结构对应于游离药物的药物单元(d
u
)。因此,本公开提供了具有高载药量的多重体连接组装单元,其仅需要与抗体的单个附接化学反应。当多个多重体连接组装单元与单个抗体附接时,可实现对显著更大剂量游离药物的递送(例如10个多重体连接组装(mla)单元,每个单元具有与其附接的4个药物部分,提供总共40个药物单元)。
[0035]
本文所述tm
‑
adc和多重体连接组装(mla)单元的重要元件是巯基多重体(t
mc
)基团。如下文中更详细所述,巯基多重体基团是多重体连接组装单元的元件,其提供了共价附接药物部分(d
m
)或包含额外t
mc
基团的接头基团(a)的两个点(巯基基团)。因此,多重体连接组装单元的巯基多重体(t
mc
)基团提供了在单个连接组装体内提供了抗体与多个药物部分的共价附接。
[0036]
图1以及图2a和图2b提供了如何制备包含多重体连接组装(mla)单元的示例性巯基多重化抗体药物偶联物(tm
‑
adc)的示意图。
[0037]
定义
[0038]
除非另有说明,本文所用的下列术语和词语将具有下列意义:本文中使用商品名时,该商品名包括商品名产品的产品制剂、仿制药和药物活性成分,除非上下文另有指示。
[0039]
如本文所用,术语“抗体”以最广泛的含义使用,并且具体包括完整的单克隆抗体、多克隆抗体、单特异性抗体、多特异性抗体(例如,双特异性抗体)、包括表现出期望的生物活性的完整抗体和抗原结合抗体片段,条件是所述抗原结合抗体片段具有用于所期望数量附接药物
‑
接头部分所需要数量的附接位点。抗体的天然形式是四聚体,由两对相同的免疫球蛋白链组成,每一对具有一条轻链和一条重链。在各对中,轻链和重链可变区(vl和vh)一起在与抗原的结合中起主要作用。轻链和重链可变结构域包含掺杂有三个高变区(也称作“互补决定区”或”“cdr”)的框架区。恒定区可被免疫系统识别并与其相互作用。(参见例如,janeway等2001,immuno.biology,第5版,garland出版社,纽约)。抗体包括任何同种型(例如,igg、ige、igm、igd和iga)或其亚类(例如,igg1、igg2、igg3、igg4、iga1和iga2)。抗体可源自任何合适的物种。在一些方面中,抗体为人或鼠来源,而在一些方面中,抗体为人、人源化或嵌合抗体。
[0040]
本文所用术语“单克隆抗体”指获自基本均一抗体群体的抗体,即除了存在少数可能天然发生的突变外,群体包含的单独抗体均是相同的。单克隆抗体具有针对单个抗原性位点的高度特异性。修饰语“单克隆”指示该抗体获自基本均质的抗体群这一特点,而不应被解释为需要通过任何特定的方法来产生该抗体。
[0041]“完整抗体”是指包含抗原结合可变区以及适合抗体类型的轻链恒定域(c
l
)和重链恒定域c
h
1、c
h
2、c
h
3和c
h
4的抗体。恒定结构域是天然序列恒定结构域(例如,人天然序列恒定结构域)或其氨基酸序列变体。
[0042]“抗体片段”包括完整抗体的部分,包括其抗原结合或可变区部分。本公开的抗体片段包括至少一个半胱氨酸残基(天然或工程化改造的),所述残基提供多重体连接组装物的附接位点。在一些实施方式中,抗体片段包括fab、fab
′
、f(ab
′
)2。
[0043]“抗原”是抗体特异性结合的实体。
[0044]
术语“特异性结合”以及“特异地结合”是指抗体或其抗体片段将以选择性的方式与其相应的目标抗原结合,而不与众多的其他抗原结合。典型的抗体或抗体衍生物结合亲和力至少约为1x10
‑7m,更典型为10
‑8m
‑
10
‑9m、10
‑
10
m、10
‑
11
m或10
‑
12
m,且与预定抗原的结合亲和力比其与非预定抗原或密切相关抗原的非特异性抗原(例如bsa、酪蛋白)的结合亲和力高至少两倍。
[0045]
术语“抑制”或“对
……
的抑制”是指降低可测量,或完全阻止(例如100%抑制)。
[0046]
术语“治疗有效量”指在哺乳动物中有效治疗疾病或病况的本文所述tm
‑
adc量。在癌症的情况下,治疗有效量的偶联物提供如下一种或多种生物学效果:癌细胞数量减少;肿瘤尺寸减小;抑制(即一定程度上减缓,更优选停止)癌细胞侵润入外周器官;抑制(即一定程度上减缓,更优选停止)肿瘤转移;在一定程度上抑制肿瘤生长;和/或一定程度上缓解与癌症相关的一种或多种症状。如果从tm
‑
adc释放的游离药物能够抑制现有癌细胞的生长和/或杀死现有癌细胞,则该游离药物具有细胞抑制和/或细胞毒性。对于癌症治疗,在某些方面中,可以通过评估疾病进展时间(ttp)和/或确定响应率(rr)来衡量疗效。
[0047]
除非上下文中另有说明或暗示,术语“实质上”或“大体上”是指混合物或样品的大多数,即>群体的50%,通常多于群体的50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
[0048]
术语“细胞内裂解”和“细胞内的裂解”是指细胞内对巯基多重抗体药物偶联物(tm
‑
adc)的代谢过程或反应,其中细胞机制作用于tm
‑
adc或其片段,以在细胞内从tm
‑
adc释放游离药物或它的其他降解产物。由此,由代谢过程或反应获得的部分为细胞内代谢产物。
[0049]
术语“细胞毒活性”是指药物或巯基多重抗体药物偶联物(tm
‑
adc)或tm
‑
adc的细胞内代谢产物的细胞杀伤效果。细胞毒活性通常用ic
50
值来表示,其为接触细胞毒剂后半数细胞存活时的每单位体积浓度(摩尔或质量)。
[0050]
术语“细胞抑制活性”是指细胞抑制剂或包含作为其药物(d
m
)的细胞抑制剂的tm
‑
adc或其胞内代谢物(其中所述代谢物为细胞抑制剂)的非细胞杀伤性的抗增殖效果。
[0051]
本文所用术语“细胞毒剂”是指具有细胞毒活性以及引起细胞破坏的物质。该术语意在包括化疗剂和毒素,例如细菌、真菌、植物或动物来源的小分子毒素或酶促活性毒素,包括其合成类似物和衍生物。
[0052]
本文所用术语“细胞抑制剂”是指具有细胞抑制活性的物质,例如抑制细胞负责或参与细胞生长或增殖的功能的物质。细胞抑制剂包括抑制剂,例如蛋白质抑制剂,例如酶抑制剂。
[0053]
术语“癌症”和“癌的”是指或描述典型特征为细胞生长失控的哺乳动物生理病症或病状。“肿瘤”包括多个癌细胞。
[0054]
本文中“自身免疫性疾病”是指由个体自身组织或蛋白质引起且针对自身组织或蛋白质的疾病或病状。
[0055]
本文所用“患者”是指被给予tm
‑
adc的对象。“患者”的例子包括但不限于哺乳动物,例如人、大鼠、小鼠、豚鼠、非人灵长类、猪、羊、牛、马、狗、猫、鸟和家禽。通常,对象是大鼠、小鼠、狗、非人灵长类或人。在一些方面中,患者为需要有效量tm
‑
adc的人。
[0056]
除非上下文另有说明或暗示,术语“治疗”或“处理”指治疗性处理或预防性措施以防止复发,其中目的是抑制或减缓(减少)不良生理改变或异常,例如癌症发展或扩散。对于本发明的目的,有益或所需的临床结果包括但不限于可检测或不可检测的缓解症状、减轻疾病程度、稳定疾病状态(即不恶化)、延迟或减缓疾病进展、改善或减轻疾病状态和缓解(部分或完全)。在一些方面中,“治疗”也可以指与不接受治疗的期望存活相比延长生存期。需要治疗的对象包括已经患有该疾病或病症的那些,且在一些方面中,还包括易于患该疾病或病症的那些。
[0057]
在癌症的情况下,术语“治疗”包括如下任何或全部:抑制肿瘤细胞、癌细胞或肿瘤生长;抑制肿瘤细胞或癌细胞复制、减轻总体肿瘤负荷或减少癌性细胞的数量,以及改善与该疾病相关的一种或多种症状。
[0058]
在自身免疫性疾病的情况下,术语“治疗”包括如下任何或全部:抑制与自身免疫性疾病状态相关的细胞(包括但不限于产生自身免疫性抗体的细胞)的复制、减轻自身免疫性抗体负荷和改善自身免疫性疾病的一种或多种症状。
[0059]
如本文所用的术语“盐”是指化合物(例如药物部分(d
m
)、多重体连接组装(mla)单位或tm
‑
adc)的有机或无机盐。在一些方面中,化合物包含至少一个氨基基团,因此可以与该氨基基团形成酸加成盐。示例性的盐包括但不限于:硫酸盐、三氟乙酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、柠檬酸、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡萄糖酸盐、葡糖醛酸盐、蔗糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即1,1
’‑
亚甲基
‑
双(2
‑
羟基3
‑
萘甲酸盐)。盐可涉及包括另一种分子,例如乙酸根离子、琥珀酸根离子或其他抗衡离子。抗衡离子可以是任何能稳定母体化合物上电荷的有机或无机部分。此外,盐在其结构中具有一个或多个带电原子。例如,如有多电荷原子作为盐的部分时,有时会存在多个抗衡离子。因此,盐可具有一个或多个带电原子和/或一个或多个抗衡离子。“药学上可接受的盐”是适合于如本文所述给予对象的盐,并且在一些方面包括如下所述的盐:p.h.stahl和c.g.wermuth编撰,《药用盐手册:性质、选择和使用》(handbook of pharmaceutical salts:properties,selection and use),weinheim/z
ü
rich:wiley
‑
vch/vhca,2002,特意将其中盐的罗列通过引用纳入本文。
[0060]
除非文中另有说明或暗示,术语“烷基”本身或作为其他术语的部分是指未取代的直链或支链、饱和烃基,其具有指示个数的碳原子(例如
“‑
c1‑
c8烷基”或
“‑
c1‑
c
10”烷基是指分别具有1
‑
8个或1
‑
10个碳原子的烷基)。当未指出碳原子的数目时,烷基部分具有1至8个碳原子。代表性的直链
“‑
c1‑
c8烷基”基团包括但不限于:
‑
甲基、
‑
乙基、
‑
正丙基、
‑
正丁基、
‑
正戊基、
‑
正己基、
‑
正庚基、
‑
正辛基;而支链的
‑
c1‑
c8烷基包括但不限于:
‑
异丙基、
‑
仲丁基、
‑
异丁基、
‑
叔丁基、
‑
异戊基和
‑2‑
甲基丁基;术语“烯基”本身或作为其他术语的部分是指不饱和
‑
c2‑
c8烷基,包括但不限于:
‑
乙烯基、
‑
丙烯基、
‑1‑
丁烯基、2
‑
丁烯基、
‑
异丁烯基、
‑1‑
戊烯基、
‑2‑
戊烯基、
‑3‑
甲基
‑1‑
丁烯基、
‑2‑
甲基
‑2‑
丁烯基、
‑
2,3二甲基
‑2‑
丁烯基、
‑1‑
己烯基、2
‑
己烯基、3
‑
己烯基;术语“炔基”本身或作为其他术语的部分是指具有一个或多个三键的不饱和
‑
c2‑
c8烷基,例如
‑
乙炔基、
‑
丙炔基、
‑1‑
丁炔基、
‑2‑
丁炔基、
‑1‑
戊炔基、
‑2‑
戊炔基和
‑3‑
甲基
‑1‑
丁炔基。
[0061]
除非文中另有说明或暗示,“亚烷基”本身或作为其他术语的部分是指所指定碳原子数(通常为1
‑
10个碳原子)的取代或未取代饱和或不饱和支链或直链或环状双游离基,其具有从母烷烃的同一或两个不同碳原子去除两个氢原子而得的两个单价游离基中心。典型的亚烷基包括但不限于:亚甲基(
‑
ch2‑
)、1,2
‑
亚乙基(
‑
ch2ch2‑
)、1,3
‑
亚丙基(
‑
ch2ch2ch2‑
)、1,4
‑
亚丁基(
‑
ch2ch2ch2ch2‑
)等。在一些方面中,亚烷基是支链或直链烃基(即其不是环烃基)。在其他方面中,亚烷基是通常非环烃基的饱和亚烷基。
[0062]
除非文中另有说明或暗示,“芳基”本身或作为其他术语的部分是指6
‑
20个碳原子(优选6
‑
14个碳)的取代或未取代单价碳环芳香烃基,其通过去除母芳香环系统单个碳原子的一个氢原子衍生某些芳基以示例性的结构“ar”表示。典型的芳基包括但不限于衍生自苯、经取代的苯、萘、蒽、联苯基等的基团。示例性的芳基是苯基。
[0063]
除非上下文中另有说明或暗示,“亚芳基”本身或作为其他术语的部分是如前所定义的芳基其中芳基的一个氢原子被键取代(即其为二价),如以下结构式中以苯基为示例性基团所示,其可为对位、间位或邻位方向:
[0064][0065]
除非上下文中另有说明或暗示,“c3‑
c8杂环”本身或作为其他术语的部分是指具有3
‑
8个碳原子(也称环成员)和1
‑
4个选自n、o、p或s杂原子环成员的单价取代或非取代芳香性或非芳香性单环或二环的环系统,其通过从母环系统的环原子去除一个氢原子衍生。在一些方面中,杂环中的一个或多个n、c或s原子被氧化。在一些方面中,包含杂原子的环是芳香性的,而在另一些方面中则是非芳香性的。除非另有说明,杂环与其侧基在任何杂原子或碳原子处附接形成稳定的结构。c3‑
c8杂环的代表性例子包括但不限于:吡咯烷基、吖丁啶基、哌啶基、吗啉基、四氢呋喃基、四氢吡喃基、苯并呋喃基、苯并噻吩、吲哚基、苯并吡唑基、吡咯基、硫代苯基(噻吩)、呋喃基、噻唑基、咪唑基、吡唑基、嘧啶基、吡啶基、吡嗪基、哒嗪基、异噻唑基和异噁唑基。
[0066]
除非上下文中另有说明或暗示,“c3‑
c8杂环基”本身或作为其他术语的部分是指如上所定义的c3‑
c8杂环基团,其中该杂环基团中的氢原子之一被键所取代(即其为二价)。在某些方面中,例如当多重体连接组装体的一部分包含杂环基时,该杂环基是如上文所定义的杂环基团,其中一个或两个杂环基团的氢原子被键所取代(即该杂环基是二价或三价)。
[0067]
除非上下文中另有说明或暗示,“c3‑
c8碳环”本身或作为其他术语的部分,是指3元、4元、5元、6元、7元或8元的单价、取代或未取代、饱和或不饱和非芳香单环或双环的碳环,其由母环系统的环原子去除一个氢原子衍生获得。代表性的
‑
c3‑
c8碳环包括但不限于:环丙基、环丁基、环戊基、环戊二烯基、环己基、环己烯基、1,3
‑
环己二烯基、1,4
‑
环己二烯基、环庚基、1,3
‑
环庚二烯基、1,3,5
‑
环庚三烯基、环辛基和环辛二烯基。
[0068]
除非上下文中另有说明或暗示,“c3‑
c8碳环基”本身或作为其他术语的部分是指如上所定义的c3‑
c8碳环基团,其中该碳环基团中的另一个氢原子被键所替代(即其为二价)。在某些方面中,例如当多重体连接组装体的一部分包含碳环基时,该碳环基是如上文所定义的碳环基团,其中一个或两个碳环基团的氢原子被键所替代(即该碳环基是二价或三
价)。
[0069]
除非另有说明,术语“杂烷基”本身或作为其他术语的部分是指稳定的直链或支链烃或其组合,其完全饱和或包含1
‑
3的不饱和度,由所指示数量的碳原子和1
‑
10个,优选1
‑
3个选自o、n、si和s的杂原子组成,且在一些方面中包括其中n和/或s原子被氧化的情况,以及氮杂原子被季铵化的情况。杂原子o、n和s被置于在杂烷基基团的任何内部位置和/或被置于烷基基团与分子其余部分相连的位置。杂原子si被置于杂烷基基团的任何位置,包括被置于烷基基团与分子其余部分相连的位置。非限制性例子包括:
–
ch2‑
ch2‑
o
‑
ch3、
‑
ch2‑
ch2‑
nh
‑
ch3、
‑
ch2‑
ch2‑
n(ch3)
‑
ch3、
‑
ch2‑
s
‑
ch2‑
ch3、
‑
ch2‑
ch2‑
s(o)
‑
ch3、
‑
nh
‑
ch2‑
ch2‑
nh
‑
c(o)
‑
ch2‑
ch3、
‑
ch2‑
ch2‑
s(o)2‑
ch3、
‑
ch=ch
‑
o
‑
ch3、
‑
si(ch3)3、
‑
ch2‑
ch=n
‑
o
‑
ch3和
–
ch=ch
‑
n(ch3)
‑
ch3。最多达两个杂原子可以是连续的,例如
‑
ch2‑
nh
‑
och3和
–
ch2‑
o
‑
si(ch3)3。在优选的方面中,c1‑
c4杂烷基或杂亚烷基具有1
‑
4个碳原子和1或2个杂原子,c1‑
c3杂烷基或杂亚烷基具有1
‑
3个碳原子和1或2个杂原子。在其他优选的方面中,杂烷基或杂亚烷基是饱和的。
[0070]
除非上下文中另有说明或暗示,术语“杂亚烷基”本身或作为其他术语的部分是指衍生自杂烷基(如前所述)的二价基团,其示例为
–
ch2‑
ch2‑
s
‑
ch2‑
ch2‑
和
–
ch2‑
s
‑
ch2‑
ch2‑
nh
‑
ch2‑
。对于杂亚烷基,在一些方面中,杂原子占据链的一端或两端。更进一步,对于亚烷基和杂亚烷基连接基团,不意味该连接基团具有方向性。在某些方面中,例如当连接基团或拘束基团(tethering group)包含杂亚烷基时,该杂亚烷基是如上文所定义的杂烷基基团,其中一个或两个杂烷基基团的氢原子被键所取代(即该杂亚烷基是二价或三价)。
[0071]“取代的烷基”和“取代的芳基”分别指其中一个或多个氢原子被各自独立地被取代基替换的烷基和芳基。典型的取代基包括但不限于:
‑
x、
‑
o
‑
、
‑
or、
‑
sr、
‑
s
‑
、
‑
nr2、
‑
nr3、=nr、
‑
cx3、
‑
cn、
‑
ocn、
‑
scn、
‑
n=c=o、
‑
ncs、
‑
no、
‑
no2、=n2、
‑
n3、
‑
nrc(=o)r、
‑
c(=o)r、
‑
c(=o)nr2、
‑
so3‑
、
‑
so3h、
‑
s(=o)2r、
‑
os(=o)2or、
‑
s(=o)2nr、
‑
s(=o)r、
‑
op(=o)(or)2、
‑
p(=o)(or)2、
‑
po
‑3、
‑
po3h2、
‑
aso2h2、
‑
c(=o)x、
‑
c(=s)r、
‑
co2r、
‑
co2‑
、
‑
c(=s)or、c(=o)sr、c(=s)sr、c(=s)nr2或c(=nr)nr2,其中各x独立地为卤素:
‑
f、
‑
cl、
‑
br或
‑
i;且各r独立地为
‑
h、
‑
c1‑
c
20
烷基、
‑
c6‑
c
20
芳基、
‑
c3‑
c
14
杂环基、保护基或前药部分。典型的取代基还包括(=o)。如前所述的亚烷基、碳环、碳环基、亚芳基、杂烷基、杂亚烷基、杂环或杂环基团是未取代的或类似取代的。在一些方面中,“烷基”和“亚烷基”的取代基包括:
‑
x、
‑
o
‑
、
‑
or、
‑
sr、s
‑
、nr2、cx3、cn、ocn、scn、
‑
nrc(=o)r、
‑
c(=o)r、
‑
c(=o)nr2、
‑
so3‑
、
‑
so3h或
‑
co2r。在一些实施方式中,“芳基”、“碳环”、“碳环基”、“亚芳基”、“杂烷基”、“杂亚烷基”、“杂环”和“杂环基”的取代基包括:
‑
x、
‑
o
‑
、
‑
c1‑
c
20
烷基、
‑
or、
‑
sr、
‑
s
‑
、nr2、cx3、cn、ocn、
‑
scn、
‑
nrc(=o)r、
‑
c(=o)r、
‑
c(=o)nr2、
‑
so3‑
、
‑
so3h或
‑
co2r,其中各x独立地为
‑
f或
‑
cl,且r独立地为
‑
h或
‑
c1‑
c8烷基。
[0072]
如本文所用,术语“游离药物”是指未与tm
‑
adc的任何其他部分直接或间接共价附接的生物活性物质,或是指tm
‑
adc作为药物部分的降解产物。因此,游离药物是指药物部分,通过释放机制从多重体连接组装单元裂解后立即存在的药物部分,这种释放机制可由tm
‑
adc中的药物接头(d
l
)提供或提供给后续的细胞内转换或代谢。在一些方面中,游离药物将具有式h
‑
d
u
或可存在为带电部分。游离药物是能够发挥所需生物学效应的药理学活性物质。在一些方面中,药理学上活性物质是母体药物,在其他方面中,包括多重体连接组装
单元未经后续细胞内代谢的组分或残余物。
[0073]
如本文所用,术语“分区基团”是掩蔽特定药物单元(d
u
)或多重体连接组装(mla)单元的疏水性的结构单元。在一些方面中,分区基团提高了mla单元的亲水性能。在其他方面中,分区基团改善了与之附接的tm
‑
adc的药代动力学性质。
[0074]
如本文所用,术语“自稳定接头组装(物)”是指取代的琥珀酰亚胺,其具有邻近琥珀酰亚胺的碱性官能团,该官能团能够催化该取代琥珀酰亚胺的羰基
‑
氮键水解。碱性官能团对取代琥珀酰亚胺的水解形成了自稳定接头。对于自稳定接头组装物的更详细描述可见于wo2013/173337,通过引用将其具体纳入本文。在一些方面中,自稳定接头组装物是mdpr,其具有如本文中所述的结构。
[0075]
如本文所用,术语“工程化改造的半胱氨酸残基”或“ecys残基”是指掺入抗体中的半胱氨酸氨基酸或其衍生物。可将一个或多个ecys残基掺入抗体中,通常,可将ecys残基掺入抗体的重链或轻链。总体而言,ecys残基掺入抗体通过如下方式进行:将母体抗体的核酸序列诱变为编码一个或多个具有半胱氨酸或其衍生物的氨基酸残基。合适的突变包括用半胱氨酸或其衍生物替代抗体轻链或重链中的预期残基,在抗体轻链或重链的预期物质掺入额外的半胱氨酸或其衍生物,以及在预期重链或轻链氨基酸的n末端和/或c末端加入额外的半胱氨酸或其衍生物。半胱氨酸(cys)衍生物包括但不限于β
‑2‑
cys、β
‑3‑
cys、高半胱氨酸和n
‑
甲基半胱氨酸。
[0076]
方面和实施方式
[0077]
本文提供了:巯基多重化抗体药物偶联物(tm
‑
adc,如下文所述);以及,多重连接组装(mla)化合物(其结构掺入tm
‑
adc)和具有附接药物部分(d
m
)的mla单元(如果药物部分不含药物接头(dl),则其包含药物单元(d
u
)),以及附接药物单元(d
u
)的药物接头(d
l
)。tm
‑
adc、mla单元或具有附接药物部分(d
m
)的mla单元将可任选地具有分区基团(y),该基团附接于巯基多重体(t
mc
)基团或tm
‑
adc部分的连接基团元件的位点处或为其部分。
[0078]
本文所述的巯基多重化技术很容易地提供了具有附接的多个药物部分的抗体药物偶联物(adc)。有利地,具有较高载药量的抗体能够提供一种或多种游离药物的治疗有效剂量,其与常规adc相比减少了待给予抗体的总量。目标抗原拷贝数低时是有利的。此外,本文所述的多重体连接组装化合物在制备tm
‑
adc时采用了公知的巯基/马来酰亚胺化学反应,以及巯基/卤代乙酰基化学反应。在各情况下,共价附接条件是温和的且能够被抗体上或接头组装物本身的其他部分上的其他官能团良好耐受。
[0079]
多重体连接组装
[0080]
多重体连接组装(mla)单元的特征如下:(1)至少一个接头基团(a1),其提供(i)mla与抗体或抗体的抗原结合片段的共价附接,或mla与已有可用合适附接位点的抗体或抗体的抗原结合片段(例如具有用于参与点击化学反应或diels
‑
alder加成反应的附接叠氮或炔基组分)的共价附接,并提供(ii)与巯基多重体(t
mc
)基团或多重化基团(m)的共价附接;以及(2)至少一个巯基多重体(t
mc
)基团。如下文中进一步详细描述,巯基多重体(t
mc
)基团是具有两个新生(nascent)巯基官能团的部分,这些巯基官能团以环状二硫化物形式或二硫键形式(其中的硫原子被适当保护)或以支化形式存在,其中两个巯基形成与药物部分(d
m
)或其他连接基团(a)的硫醚键。与其他连接接头(a)的连接提供了与其他巯基多重体(t
mc
)基团的额外共价附接,其进而提供了在单个多重体连接组装(mla)单元上加载额外药
物的机会。在一些实施方式中,mla单元还包括与其附接的一个或多个分区基团(y)。下标m表示本文所述化合物中具体基团的数目,例如在式(i)的mla化合物中,当下标m为1时,存在两个(a2‑
t
mc2
)单元。具体化合物中的各下标m具有相同的值。例如,式(i)的mla化合物具有两例下标m。这两个下标相同:如果一个下标m为0,则另一个下标m也为0;如果一个下标m为1,则另一个下标也为1。
[0081]
在一个主要的实施方式中,本文提供了具有式(i)的多重体连接组装(mla)化合物:
[0082][0083]
其中:
[0084]
a1是第一连接基团;
[0085]
各a2独立地为键或为独立选择的第二连接基团;
[0086]
各a1和a2包含0或1个分区基团(y),其共价附接于第一或第二连接基团,或为第一或第二连接基团的二价连接元件;
[0087]
m为多重化基团或第一巯基多重化基团(t
mc1
);
[0088]
各t
mc2
独立地为第二巯基多重化基团;
[0089]
下标m为0或1;其中:
[0090]
当下标m为0时,m为二硫化物形式的t
mc1
或为适当被保护的二硫基形式或为与两个药物部分(d
m
)附接的第一巯基多重化基团(t
mc1
);以及
[0091]
当下标m为1时,各t
mc2
为二硫化物形式,或与两个药物部分(d
m
)连接。
[0092]
在一组实施方式中,本文提供了具有式(ia)的多重体连接组装(mla)化合物:
[0093][0094]
其中:
[0095]
a1为连接基团,其还包含与第一连接基团或连接基团的二价连接元件附接的0或1个分区基团(y);
[0096]
t
mc1
为巯基多重化基团;
[0097]
各s为巯基多重化基团(t
mc1
)的硫原子;
[0098]
各d
m
为药物部分。
[0099]
在另一组实施方式中,本文提供了具有式(ib)的多重体连接组装(mla)化合物:
[0100][0101]
其中:
[0102]
a1是第一连接基团;
[0103]
各a2独立地为键或为独立选择的第二连接基团,其相同或不同;
[0104]
各a1和a2包含0或1个分区基团(y),其共价附接于第一或第二连接基团,或为第一或第二连接基团的二价连接元件;
[0105]
m为多重化基团或第一巯基多重化(t
mc1
)基团;
[0106]
各t
mc2
独立地为第二巯基多重化基团;
[0107]
各s为巯基多重化(t
mc2
)基团的硫原子;以及
[0108]
各d
m
为药物部分。
[0109]
巯基多重体(t
mc1
和t
mc2
)基团
[0110]
下文中参考4个示例显示本文所述巯基多重体基团的概念性方法。在所示的各个转化中,共价附接于单个位点的基团(示为“a”)开环或闭环以形成用于进一步附接(如
‘
c’中)的两个位点的两个巯基(b)。在本文所示的化合物和偶联物中,标记t
mc1
和t
mc2
用于表示闭环(或二硫化物)形式、适当保护的二硫键形式或三价形式'c',这取决于mla化合物或tm
‑
adc。通常,在末端位置,t
mc
基团可为闭环(或二硫化物)形式'a',开环形式(或二巯基)形式b',或适当保护的二巯基形式,示为b',或附接于药物部分(d
m
),所述药物部分为药物单元(d
u
)或药物单元/药物接头(d
u
/d
l
)组合(和呈形式'c')。不在多重体连接组装物末端位置的任何t
mc
基团可为形式'c'。
[0111][0112]
如上图所示,巯基多重体(t
mc
)基团是多重体连接组装单元的部分,其以形式
‘
a’、b或b’或
‘
c’存在,其中,形式
‘
a’:二硫化物形式的环状部分;形式b或b':非环状部分;形式
‘
c’:具有两个硫醚连接的支化线性部分。总体而言,环形式的二硫键或适当保护的非环状形式是具有两个硫醚连接的支化(非环状)部分的前体。从形式a到形式b或从形式b'到形式b的转化如下实现:还原二硫键,从而开环并提供两个巯基官能团或还原性去除乙酰胺保护基来提供这些基团。各巯基官能团为药物部分(d
m
)或其他(a
‑
t
mc
)部分的连接基团(例如a2)提供共价附接位点。
[0113]
除了这两个巯基官能团以外,巯基多重体(t
mc
)基团还包含提供共价附接于连接基团(例如a1)的第三官能团。巯基多重体(tmc)基团的第三官能团取决于提供与巯基多重体(tmc)基团共价附接的连接基团(a1、a2等)中官能团的化学特性。如上图所示,巯基多重体(t
mc
)基团的第三官能团是环或环外胺(参考前述的形式
‘
a’)。本领域普通技术人员将认识到有许多电子供体/电子受体对可提供所述的共价附接。例如,在一些实施方式中,巯基多重体(t
mc
)基团的第三官能团是氨基,在连接基团(a1、a2等)中提供共价附接的基团是羧酸或酯基。在一些实施方式中,巯基多重体(t
mc
)基团的第三官能团是羧酸或酯基,在连接基团(a1、a2等)中提供共价附接的基团是胺。
[0114]
用于巯基多重化adc和多重体连接组装化合物中的巯基多重体连接组装单元有时基于可市售获得的组分,其通常具有5、6、7或8元碳环,其中两个相邻环顶点被硫取代——形成1,2
‑
二硫环戊烷(1,2
‑
dithiolanes)、1,2
‑
二硫环己烷(1,2
‑
dithianes)、1,2
‑
二硫环庚烷(1,2
‑
dithiepanes)和1,2
‑
二硫环辛烷(1,2
‑
dithiocanes)。有鉴于“多重化”合成(见上文)的一般性质,5元和6元环通常具有适于本文所述合成化学反应的环外官能团。在一些实施方式中,较大的7元和8元环具有适于本文所述合成化学反应的环外官能团,在另一些实施方式中,其他环顶点被替代,例如被有时用作所提供的连接化学反应中的官能团的氮(胺)所替代。
[0115]
合适巯基多重体基团(二硫化物形式)的例子如下所示:
[0116][0117]
其他合适的巯基多重体基团基于如下市售可得的胺和羧酸。
[0118]
[0119][0120]
连接基团(a1和a2)
[0121]
连接基团(a1和a2)是指多重体连接组装体(mla)中提供与如下部分共价且均一附接的部分:其与抗体、或具有引入的反应性元件(针对a1)的抗体、或多重体基团(m)上或mla中巯基多重体(t
mc
)基团的其他反应性基团的共价且均一附接。在一些实施方式中,第一连接基团a1包含提供与抗体半胱氨酸巯基的共价附接的官能团。在其他实施方式中,第一连接基团终止于将用于点击化学反应中以附接经修饰抗体的元件中,所述经修饰抗体具有相容性点击元件。例如,在某些实施方式中,第一连接基团a1终止于具有足够应变炔基官能团的元件,所述炔基官能团对具有适宜叠氮官能团的经修饰抗体具有反应性。然后,由点击化学反应中这两种官能团的偶极环加成得到三唑杂环基。在另一个实施方式中,用diels
‑
alder型化学反应(4+2环加成,反电子需求)将具有末端1,2,4,5
‑
四嗪的mla共价附接于带有适宜反式环辛烯官能团的经修饰抗体。为了说明,分别在a)和b)中示出点击化学反应和diels
‑
alder(4+2环加成)反应的总体描述。本领域普通技术人员将理解各种修饰均有可能,包括但不限于:改变反应性元件的取代模式,转换各反应性元件附接的部分(ab或mla)(例如,在点击化学反应中,炔基反应性元件可先于与带有叠氮的mla的反应之前存在于抗体部分上)。
[0122][0123]
连接基团a2提供与m(或t
mc1
)的反应性部分的共价附接,该反应性部分在很多情况下为巯基多重体(t
mc
)基团的巯基官能团。在一些实施方式中,a2为键,且t
mc1
通过共价键与t
mc2
直接连接。
[0124]
连接基团还提供了结构上的分离,其包括炔基基团、氨基酸基团(例如w
w
,其中下
标w是0
‑
12的整数,各w为天然或非天然氨基酸)、分区基团(y)或其他下文所讨论的结构元件。
[0125]
适宜作为巯基连接基团的许多官能团已描述于文献中,且被熟知用于巯基部分的附接。这些官能团包括马来酰亚胺基部分(例如马来酰亚胺基己酰和自稳定化部分,例如mdpr,参见wo2013/173337,通过引用纳入本文)。
[0126]
本公开范围内的连接基团(与含巯基部分附接前)的示例包括式(v)和(vi)的基团:
[0127][0128]
其中,lg为离去基团,右侧波浪线为与巯基多重体(t
mc
)基团的附接处,或与连接基团(a)其余部分的附接处,且r
a
如下所定义。本领域普通技术人员将认识到式(v)的马来酰亚胺能够与抗体的半胱氨酸巯基反应以形成巯基取代的琥珀酰亚胺部分,可任选为水解形式,并且参考式vi,抗体的半胱氨酸巯基将会通过亲核攻击共价附接于带lg的碳以置换离去基团(lg)。适宜的离去基团是本领域普通技术人员熟知的,包括卤素、甲苯磺酰基和甲磺酸基
[0129]
在一些实施方式中,r
a
为c1‑
c
10
亚烷基
‑
、c1‑
c
10
杂亚烷基
‑
、c3‑
c8碳环基
‑
、
‑
o
‑
(c1‑
c8烷基)
‑
、
‑
亚芳基
‑
、c1‑
c
10
亚烷基
‑
亚芳基
‑
、
‑
亚芳基
‑
c1–
c
10
亚烷基
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8碳环基)
‑
、(c3
‑
c8碳环基)
‑
c1‑
c
10
亚烷基
‑
,c3‑
c8杂环基
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8杂环基)、(c3‑
c8杂环基)
‑
c1‑
c
10
亚烷基
‑
、c1‑
c
10
亚烷基
‑
c(=o)
‑
、c1‑
c
10
杂亚烷基
‑
c(=o)
‑
、c3‑
c8碳环基
‑
c(=o)
‑
、
‑
o
‑
(c1‑
c8烷基)
‑
c(=o)
‑
、
‑
亚芳基
‑
c(=o)、c1‑
c
10
亚烷基
‑
亚芳基
‑
c(=o)
‑
、
‑
亚芳基
‑
c1‑
c
10
亚烷基
‑
c(=o)
‑
、c1‑
c8亚烷基
‑
(c3‑
c8碳环基)
‑
c(=o)
‑
、(c3‑
c8碳环基)
‑
c1‑
c
10
亚烷基
‑
c(=o)
‑
、c3‑
c8杂环基
‑
c(=o)
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8杂环基)
‑
c(=o)
‑
、(c3‑
c8杂环基)
‑
c1‑
c
10
亚烷基
‑
c(=o)
‑
、c1‑
c
10
亚烷基
‑
nh
‑
、c1‑
c
10
杂亚烷基
‑
nh
‑
、c3‑
c8碳环基
‑
nh
‑
、
‑
o
‑
(c1‑
c8烷基)
‑
nh
‑
、
‑
亚芳基
‑
nh、c1‑
c
10
亚烷基
‑
亚芳基
‑
nh、
‑
亚芳基
‑
c1‑
c
10
亚烷基
‑
nh
‑
、c1‑
c
10
亚烷基
‑
(c3
‑
c8碳环基)
‑
nh
‑
、(c3‑
c8碳环基)
‑
c1‑
c
10
亚烷基
‑
nh
‑
、c3‑
c8杂环基
‑
nh
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8杂环基)
‑
nh
‑
、(c3‑
c8杂环基)
‑
c1‑
c
10
亚烷基
‑
nh
‑
、c1‑
c
10
亚烷基
‑
s
‑
、c1‑
c
10
杂亚烷基
‑
s
‑
、c3c8碳环基
‑
s
‑
、
‑
o
‑
(c1‑
c8烷基)
‑
s
‑
、
‑
亚芳基
‑
s
‑
、c1‑
c
10
亚烷基
‑
亚芳基
‑
s
‑
、
‑
亚芳基
‑
c1‑
c
10
亚烷基
‑
s
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8碳环基)
‑
s
‑
、(c3‑
c8碳环基)
‑
c1‑
c8亚烷基
‑
s
‑
、c3‑
c8杂环基
‑
s
‑
、c1‑
c
10
亚烷基
‑
(c3‑
c8杂环基)
‑
s
‑
或(c3‑
c8杂环基)
‑
c1‑
c
10
亚烷基
‑
s
‑
。任一r
19
取代基可被取代或未被取代。在一些实施方式中,r
19
取代基是未被取代的。
[0130]
在一些实施方式中,r
a
为氨基酸或包含2
‑
12个天然或非天然氨基酸的肽。在一些实施方式中,r
a
为上述一个或多个元件的组合,具有1个或多个(最多12个)氨基酸。在一些实施方式中,r
a
为二肽或三肽。在一些实施方式中,r
a
肽单元中的氨基酸独立地选自:缬氨酸、丙氨酸、β
‑
丙氨酸、甘氨酸、赖氨酸、亮氨酸和瓜氨酸。
[0131]
在一些实施方式中,连接基团(a)在与含巯基部分共价附接前具有式(vii):
[0132][0133]
其中,右侧的波浪线与巯基多重体(t
mc
)基团或连接基团(a)附接处,r
c
为氢、c1‑
c6烷基、c1‑
c6卤代烷基或保护基,且r
b
为
‑
nh
‑
c1‑5亚烷基
‑
c(=o)
‑
或单、二、三、四或五肽。在一些实施方式中,r
b
为
‑
nh
‑
ch2‑
c(=o)
‑
。在一些实施方式中,r
b
为二肽或三肽。在一些实施方式中,r
b
肽单元中的氨基酸独立地选自:缬氨酸、丙氨酸、β
‑
丙氨酸、甘氨酸、赖氨酸、亮氨酸和瓜氨酸。
[0134]
在一些实施方式中,式(v)和(vi)的r
a
取代基可任选地被取代。在一些实施方式中,式(v)的r
a
取代基是未取代的或被碱性单元,例如
‑
(ch2)
x
nhr
c
或
‑
(ch2)
x
nr
c2
取代,其中x是1
‑
4的整数,各r
c
独立地选自h、c1‑
c6烷基和c1‑
c6卤代烷基,或者两个r
c
基团与它们连接的氮一起形成叠氮基、吡咯烷基或哌啶基。
[0135]
在一些实施方式中,连接基团(a1或a2)在与含巯基部分附接前包含:
[0136][0137]
其中,右侧的波浪线为与巯基多重体(t
mc
)基团或连接基团(a1或a2)的其余部分(例如氨基酸或二肽或三肽)的附接处。
[0138]
在一些实施方式中,连接基团(a1或a2)包括结构特征的组合,例如一个或多个氨基酸、一个或多个聚乙二醇片段(例如peg
24
、peg
12
、peg6、peg3)或丙酰胺单元(例如
–
nh
–
c(o)
–
ch2–
ch2‑
)。
[0139]
本公开的连接基团(a1或a2)并不总是仅包含线性部分。例如,在一些实施方式中,连接基团(a1)包含如下部分:
[0140][0141]
其中左侧的波浪线和右侧的部分指示与连接基团(a1)其余部分的附接。
[0142]
应理解如上段落中的三唑环基团是通过包含叠氮基和如下基团的叠氮
‑
炔基极性环加成反应(“点击化学反应”)形成的:
[0143][0144]
在一些实施方式中,mla中的一个或多个连接基团(a2)是键。
[0145]
在一些实施方式中,mla中的一个或多个连接基团(a1或a2)包含赖氨酸基团。在一些实施方式中,赖氨酸侧链上的胺基与分区基团(y)共价结合。在一些实施方式中,与赖氨酸侧链上的胺基共价连接的分区基团(y)是末端羧化的聚乙二醇基团。
[0146]
在一些实施方式中,一个或多个连接基团(a1或a2)包含二肽,其中各氨基酸独立地选自甘氨酸、丙氨酸、β
‑
丙氨酸、缬氨酸、亮氨酸、苯丙氨酸和脯氨酸。
[0147]
在一些实施方式中,一个或多个连接基团(a1或a2)包含三肽,其中各氨基酸独立地选自甘氨酸、丙氨酸、β
‑
丙氨酸、缬氨酸、亮氨酸、苯丙氨酸和脯氨酸。
[0148]
在一些实施方式中,一个或多个连接基团(a1或a2)包含单肽、二肽或三肽,其中至少一个氨基酸选自天冬氨酸、谷氨酸、赖氨酸和精氨酸。
[0149]
通过阅读本技术和本文所提供的实例,本领域普通技术人员将认识到本文所描述的多重体连接组装化合物和tm
‑
adc的可操作性不依赖于任何一个连接基团(a)的确切结构,本文中未书面描述的其他结构特征也能够用纳入一个或多个连接基团(a)中而不脱离本公开的范围。
[0150]
此外,本领域普通技术人员也将会理解诸如对抗体的特定附接化学反应能够改变获得产物的合成步骤。具体而言,当与抗体上巯基的附接通过巯基反应性
‘
a’基团进行时,与抗体的该附接将在还原环状巯基多重化部分(t
mc
)之前发生,以防止连接基团中的巯基与巯基反应性
‘
a’基团之间的不利或脱靶反应。
[0151]
将上面关于巯基多重体(t
mc
)和连接基团(a)的讨论置于上下文中,参考下面的方案。在步骤(1)中,将“a1‑
t
mc1”附接于抗体巯基基团(通常为通过还原链间二硫基团或通过引入(工程化改造)半胱氨酸部分而产生的巯基)。附接的“a1‑
t
mc1”基团的多重性如括号所示,为简化在方案的其余部分中未示出下标p。在步骤(2)中,“t
mc1”基团被还原,打开t
mc1
环,且提供两个巯基。在步骤(3)中通过共价连接(1)中产生的有利巯基和a2的马来酰亚胺部分加入a2‑
t
mc2
基团。在步骤(4)中,如步骤(1)中所述还原t
mc2
基团,获得两个游离巯基基团。在步骤(5)中,将药物部分(d
m
)共价连接于t
mc2
的各巯基单元。
[0152][0153]
制备本公开mla的其他图例可见于图1和图2a及图2b。本领域普通技术人员将理解在与抗体附接前,还可采用保护基来进行以d
m
附接为终的mla单元构建。例如,在如下方案中,在构建具有4个附接药物部分(d
m
)的mla化合物构建中采用了保护基(pg)。然后去除pg并加入
‘
a1’
(例如具有巯基反应性马来酰亚胺的基团)来完成mla组装。
[0154][0155]
药物部分(d
m
)
[0156]
在一些实施方式中,所描述的mla化合物具有附接的药物部分(d
m
)。各药物部分(d
m
)共价附接于巯基多重体(t
mc
)基团的衍生自巯基官能团的硫原子以形成硫醚连接。
[0157]
本描述中的药物部分(d
m
)包括:通过硫醚连接共价连接至巯基多重体(t
mc
)的药物单元(d
u
),或药物单元/药物接头(d
u
/d
l
)组合,该组合中药物单元(d
u
)共价连接于药物接头(d
l
),而药物接头(d
l
)则通过硫醚连接共价连接于巯基多重体(t
mc
)基团。
[0158]
药物接头(d
l
)
[0159]
在一些实施方式中,包含药物接头(d
l
)是为了例如便于药物单元(d
u
)附接到巯基多重体(t
mc
),或者是为了引入可裂解连接基团。
[0160]
本领域中已知用于将药物单元附接到抗体中所存在的官能团或组装单元上位点的多种药物接头——这些接头在本文中可用于将药物单元(d
l
)附接到多重体连接组装体的巯基多重体(t
mc
)上。
[0161]
在一些实施方式中,药物接头(d
l
)包含末端马来酰亚胺,允许与各巯基多重体(t
mc
)基团的可靠共价附接。应理解末端马来酰亚胺官能团在共价附接至巯基多重体(t
mc
)基团中最有用,所述t
mc
基团包含亲核基团,例如巯基官能团,尤其是抗体半胱氨酸巯基。
[0162]
在一些实施方式中,药物接头(d
l
)包含共价附接于药物单元(d
u
)的对
‑
氨基苄氧羰基(pabc)基团。在一些实施方式中,pabc基团被糖(例如葡萄糖)或其衍生物取代以形成葡糖苷酸单元(如wo2007/011968中进一步详细描述,通过引用纳入本文作为参考)。
[0163]
在一些实施方式中,药物接头(d
l
)具有式(viii)或(ix):
[0164][0165]
其中,r
c
为氢或保护基,下标p为1
‑
5的整数,r
b
为
‑
nh
‑
c1‑5亚烷基
‑
c(=o)
‑
、
‑
nh
‑
c1‑5亚烷基
‑
c(=o)
‑
nh
‑
亚苯基
‑
ch2‑
o
‑
c(=o)
‑
、
‑
(二肽)
‑
nh
‑
亚苯基
‑
ch2‑
o
‑
c(=o)
‑
或单肽、二、三、四或五肽。在一些实施方式中,前文所提及基团中的亚苯基被糖(例如葡萄糖)或其衍生物取代以形成葡糖苷酸单元。在一些实施方式中,r
b
的胺基可包含替代h的甲基(ch3)。在一些实施方式中,r
b
为二肽或三肽。在一些实施方式中,r
b
为
‑
nh
‑
ch2‑
c(=o)
‑
。在一些实施方式中,r
b
肽单元中的氨基酸独立地选自:缬氨酸、丙氨酸、β
‑
丙氨酸、甘氨酸、赖氨酸、亮氨酸和瓜氨酸。应理解如上各式所示为连接巯基多重体(t
mc
)基团之前。“波浪线”指示了与药物单元(d
u
)的附接点。在一些方面中,根据药物单元和用于药物单元(d
u
)和药物接头(d
l
)之间的连接化学反应,如上所列r
b
基团中的末端部分也可包含亲核基团,例如与末端羰基官能团附接的胺基或羟基。
[0166]
在一些实施方式中,药物接头(d
l
)具有式(viiia)或(ixa):
[0167][0168]
其中,r
c
为氢或保护基,下标p为1
‑
5的整数,且r
b
为
‑
nh
‑
c1‑5亚烷基
‑
c(=o)
‑
nh
‑
亚苯基
‑
ch2‑
o
‑
c(=o)
‑
杂环基
‑
c1‑4亚烷基
‑
b1‑
杂环基
‑
b2‑
;
‑
(二肽)
‑
nh
‑
亚苯基
‑
ch2‑
o
‑
c(=o)
‑
杂环基
‑
c1‑4亚烷基
‑
b1‑
杂环基
‑
b2‑
;其中b1和b2独立地为键或选自nh或o的杂原子,其中各杂环基为具有1
‑
3个选自n、o和s的杂原子环成员的5或6元环;且其中各杂环基团可任选地被1
‑
3个选自下组的基团所取代:c1‑4烷基、羟基、烷氧基、羰基和
‑
c(=o)
‑
c1‑4烷基。在一些实施方式中,b1和b2各自为选自下组的杂原子或杂原子部分:nh和o。r
b
的胺基还可包含替代h的甲基(ch3)。在一些实施方式中,r
b
为二肽或三肽。在一些实施方式中,r
b
为
‑
nh
‑
ch2‑
c(=o)
‑
。在一些实施方式中,r
b
肽单元中的氨基酸独立地选自:缬氨酸、丙氨酸、甘氨酸、亮氨酸和瓜氨酸。应理解如上各式所示为共价附接巯基多重体(t
mc
)基团之前。“波浪线”指示了与药物单元(d
u
)的附接点。
[0169]
在一些实施方式中,药物接头(d
l
)是可释放型药物接头(d
rl
)。在一些其他方面中,药物接头(d
l
)是不可释放型药物接头。在不含可释放药物接头的实施方式中,通过总蛋白质降解途径(即非可裂解途径)来释放药物单元(d
u
)。
[0170]
对于其中药物接头(d
l
)为可释放药物接头(d
rl
)的那些实施方式,该基团允许在靶细胞处有效释放游离药物,足以提供例如抗增殖效果。优选地,设计可释放药物接头(d
rl
)用于在tm
‑
adc被内化入靶细胞后立即有效释放游离药物,但也可设计为在靶细胞附近释放游离药物。裂解的适宜识别位点是可允许有效释放tm
‑
adc的药物单元的位点。优选地,识别位点为肽裂解位点(例如在基于肽的可释放接头组装物中)、糖裂解位点(例如在基于糖的可
释放组装体物中,其为或包含wo2007/011968中所描述的葡糖苷酸单元)、或二硫化物裂解位点(例如基于二硫化物的可释放接头组装物)。肽裂解位点的例子包括那些被细胞内蛋白酶(例如存在于溶酶体中的那些蛋白酶)所识别的位点。糖裂解位点的例子包括被糖苷酶识别的位点,所述糖苷酶包括葡萄糖醛酸酶,例如β
‑
葡萄糖醛酸酶。
[0171]
在一些实施方式中,各可释放药物接头(d
rl
)为二肽。在一些实施方式中,二肽为
‑
val
‑
cit
‑
、
‑
phe
‑
lys
‑
或
‑
val
‑
ala
‑
。
[0172]
在一些实施方式中,各可释放药物接头(d
rl
)独立地选自下组:马来酰亚胺基
‑
己酰基(mc)、马来酰亚胺基
‑
己酰基
‑
缬氨酸
‑
瓜氨酸(mc
‑
vc)、马来酰亚胺基
‑
己酰基
‑
缬氨酸
‑
瓜氨酸
‑
对氨基苯氧基羰基(mc
‑
vc
‑
pabc)和mdpr
‑
vc。应理解在一些实施方式中,d
rl
被碱性部分(例如氨基烷基,一种示例性碱性单元)进一步取代以形成前文所讨论且在wo 2013/173337中有更多详情的自稳定化琥珀酰亚胺接头。
[0173]
在一些所选的实施方式中,在附接至抗体巯基前,药物接头(d
l
)为例如可被蛋白酶裂解的含马来酰亚胺基接头。因此,用于本文所述tm
‑
adc、可被蛋白酶裂解的示例性d
l
基团包括如下:其中s为巯基多重体(t
mc
)基团的巯基官能团,右侧的波浪线为药物单元(d
u
),左侧的波浪线为巯基多重体(t
mc
):
[0174][0175]
以及
[0176][0177]
共价附接药物单元(d
u
)和药物接头(d
l
)的总体方法是本领域中已知的,可将本领
域中常规用于adc的已知接头用于本公开的tm
‑
adc。例如,目前临床上开发了奥瑞他汀和美登素adc用于癌症治疗。单甲基奥瑞他汀e通过蛋白酶可裂解的肽接头偶联到抗体,单甲基奥瑞他汀f通过马来酰亚胺基己酸残基直接偶联到抗体,美登素dm1通过二硫化物偶联或通过异双官能smcc接头直接偶联,美登素dm4通过二硫键接头偶联。在优选实施方式中,这些接头系统与本文所述的tm
‑
adc一起使用,并根据所用的接头系统通过可酶促裂解或非酶促裂解系统提供游离药物的释放。二硫键、硫醚键、肽键、肼键、酯键或氨基甲酸酯键均为可用于将药物单元(d
u
)连接至药物接头(d
l
)的键的实例。
[0178]
可通过药物接头(d
l
)的任何适宜原子连接可任选的分区基团(y)。获得这类接头的方法在本领域是已知的。
[0179]
药物单元(d
u
)
[0180]
如前所讨论,药物单元(d
u
)通过巯基多重体(t
mc
)基团共价附接于mla单元,或者通过药物接头(d
l
)附接mla单元。应理解药物接头(d
l
)可在mla单元附接之前与药物单元(d
u
)附接,或者在药物单元(d
u
)附接之前与mla附接。
[0181]
在一些实施方式中,药物单元(d
u
)是具有1
‑
100nm细胞毒活性的药物。有多种不同的试验可用于确定tm
‑
adc是否对细胞系发挥细胞抑制或细胞毒效果。在确定tm
‑
adc是否对细胞系发挥细胞抑制或细胞毒效果的一个实例中,采用了胸苷掺入试验。例如在96孔板中以5000个细胞/孔的密度培养细胞72小时,在该72小时的最后8小时期间使细胞暴露于0.5μci的3h
‑
胸苷,在tm
‑
adc存在或不存在的情况下测定掺入培养物中细胞内的3h
‑
胸苷。如果与在相同条件下培养但未接触tm
‑
adc的同细胞系细胞相比,培养物细胞的3h
‑
胸苷掺入减少,则该tm
‑
adc对该细胞系有细胞抑制或细胞毒作用。
[0182]
在另一实例中,为了确定tm
‑
adc是否对细胞系发挥细胞抑制或细胞毒效果,通过测定细胞中染料吸收来测定细胞活力,所述染料为例如中性红、台盼蓝或alamar
tm
蓝(参见例如page等,1993,intl.j.of oncology 3:473
‑
476)。在该试验中,将细胞孵育于含有染料的培养基中,清洗细胞,采用分光光度法测定剩余的染料反映出细胞的染料吸收。也可采用蛋白质结合染料磺酰若丹明b(srb)来测定细胞毒性(skehan等,1990,j.nat’l cancer inst.82:1107
‑
12)。优选的tm
‑
adc包括对细胞系的ic
50
值(定义为获得50%细胞杀伤的mab浓度)小于1000ng/ml,优选小于500ng/ml,更优选小于100ng/ml,最优选小于50或甚至于小于10ng/ml的那些tm
‑
adc。
[0183]
在一些实施方式中,药物单元是具有以下细胞效力的那些:在偶联8个或更少的药物/mab时,预期其在体外不会提供活性adc。在一些实施方式中,药物单元纳入的药物是疏水性的或具有≤2.5的clogp。在一些实施方式中,药物所具有的clogp为约0~约2.5,约0~2,约0~约1.5,约0~约1,或约0~约0.5。在一些实施方式中,药物单元纳入的药物具有更亲水的性质——例如药物单元具有≤1.0的clogp。在一些实施方式中,药物所具有的clogp为约0~约1,例如约0、约0.1、约0.2、约0.3、约0.4、约0.5、约0.6、约0.7、约0.8、约0.9或约1。
[0184]
在一些实施方式中,药物单元是具有带电残基(酸、胺、磷酸根)、糖或聚羟基化基团的那些药物。在一些实施方式中,药物单元选自核苷类似物;hdac抑制剂;蒽环类药物;nampt抑制剂;亲水性药物;sn
‑
38葡糖苷酸;磷酸依托泊苷;低分子量药物(例如分子量小于600的药物);氮芥(美法仑);以及蛋白酶体抑制剂(雷纳度胺)。
[0185]
在一些实施方式中,药物单元选自嘧啶拮抗剂和嘌呤拮抗剂。在一些实施方式中,药物单元选自抗代谢剂,例如叶酸拮抗剂:甲氨蝶呤、培美曲塞、l
‑
亚叶酸、gw1843、雷替曲塞(raltitrexid)、zd9331、普拉曲沙(pralatrexed)和洛美曲索(lometrexol)。.
[0186]
药物单元(d
u
)通常将在结构上对应于细胞毒性、细胞抑制或免疫抑制药物,在本文中也指作为细胞毒性、细胞抑制或免疫抑制药物。在一些实施方式中,纳入药物单元(d
u
)中的游离药物具有能够与巯基多重体(t
mc
)基团形成键的原子。在另一些实施方式中,纳入药物单元(d
u
)中的游离药物具有能够与巯基多重体(t
mc
)形成键的羧酸或酯。
[0187]
在一些实施方式中,药物单元(d
u
)具有与药物接头(d
l
)形成键的原子。在一些实施方式中,药物单元(d
u
)具有与药物接头(d
l
)形成键的氮原子。在另一些实施方式中,药物单元(d
u
)具有与药物接头(d
l
)形成键的羧酸残基。在其他实施方式中,药物单元(d
u
)具有来自游离药物巯基官能团的硫原子,羧酸硫原子与药物接头(d
l
)形成键。在其他实施方式中,药物单元(d
u
)具有来自游离药物羟基的杂原子或来自含醇游离药物的杂原子,或具有来自游离药物的羰基官能团,其与药物接头(d
l
)形成键。
[0188]
药物单元(d
u
)优选纳入亲水性药物或中等疏水药物,从而适于可通过本发明获得的较高载药量。如果药物过于疏水,则在所得tm
‑
adc中可能发生不利量的聚集,但在某些情况下,可通过如下改善至可接受的程度:在多重体连接组装物中纳入分区基团和/或采用亲水性接头基团(a)和/或采用亲水性药物接头(d
l
),具体为在生理ph值下基本上以电离形式存在的那些。示例性亲水性接头基团(a)包含自稳定化部分,其含有水解形式的琥珀酰亚胺部分和碱性单元(bu)。由于具有质子化形式胺的bu和展示羧化阴离子的水解琥珀酰亚胺部分,自稳定化部分为亲水性。示例性亲水性药物接头包含葡糖苷酸单元,其中的糖为葡萄糖醛酸。中等疏水性至亲水性药物具有2.5或更小的clogp和/或80平方埃或更大的极性表面积。在一些实施方式中,待用于本发明中的药物的clogp值将为2.5或更小,2.0或更小,1.5或更小,l.0或更小,0.5或更小,0或更小,
‑
0.5或更小,或
‑
1.0或更小。在其他实施方式中,待如本文所述使用的游离药物具有的极性表面将为约80平方埃或更大,约90平方埃或更大,约100平方埃或更大,约110平方埃或更大,约120平方埃或更大。在一些实施方式中,待如本文所述使用的药物具有的极性表面将为约80平方埃~约140平方埃,或其间的任何值。例如,约80平方埃,约90平方埃,约100平方埃,约80平方埃,约110平方埃,约120平方埃,约130平方埃,约140平方埃,或其间的任何值。
[0189]
将药物连接于接头的一般过程是本领域中已知的。参见例如美国专利号8,163,888、7,659,241、7,498,298,美国专利公开号us20110256157以及国际申请号wo2011023883和wo2005112919,其各自通过引用纳入本文,尤其是其中关于前述一般过程的部分。
[0190]
分区基团(y)
[0191]
如本文某些实施方式中所述,mla和tm
‑
adc包含附接的分区基团(y)。分区基团用于例如掩蔽特定药物单元或多重体连接组装物的疏水性。因此,多个分区基团将发挥提高其所附接tm
‑
adc亲水性质以减少adc聚集的作用,这可使得clogp为约2.5~约1或极性表面积为约80~约100平方埃的中等亲水性药物获得最高的载药量。
[0192]
代表性分区基团包括聚乙二醇(peg)单元、环糊精单元、聚酰胺、亲水性肽、多糖和树状聚合物。在一些实施方式中,分区基团y包含聚乙二醇基团。
[0193]
当分区基团包含于a、d
m
、m、t
mc
基团中的一个或多个时,该基团可包含赖氨酸残基,
该残基提供了分区基团与多重体连接组装物的单官能偶联。
[0194]
聚乙二醇单元(peg)
[0195]
可采用多分散peg、单分散peg和离散peg来制备本发明的化合物。多分散peg是大小和分子量的异质混合物,而单分散peg通常是从异质混合物中纯化的,因此提供了单一的链长度和分子量。优选的peg单元是离散peg,其是以逐步方式而非通过聚合过程合成的化合物。离散peg提供具有确定和指定链长的单个分子。
[0196]
本文所提供的peg单元包含一个或多个聚乙二醇链。聚乙二醇链能够连接在一起,例如以线性、支化或星形结构连接。通常,peg单元的至少一个聚乙二醇链在一端衍生化以用于共价附接于多重体连接组装单元元件(例如a、m、t
mc
或d
m
)上的适宜位置。与多重体连接组装单元的示例性附接通过非条件型可裂解键或通过条件型可裂解键实现。示例性的附接为通过酰胺键、醚键、酯键、腙键、肟键、二硫键、肽键或三唑键实现。在一些方面中,与多重体连接组装单元的附接通过非条件型可裂解键实现。在一些方面中,与多重体连接组装单元的附接不通过酯键、腙键、肟键或二硫键实现。在一些方面中,与多重体连接组装单元的附接不通过腙键实现。
[0197]
条件型可裂解键是指在血浆中循环时对裂解基本上不敏感,但在细胞内或肿瘤内环境中对裂解敏感的键。非条件型可裂解键在被给予tm
‑
adc的对象中的任何生物学环境中对裂解都基本上不敏感的键。腙的化学水解、二硫键的还原以及肽键和糖苷键的酶促裂解是条件型可裂解键的实例。
[0198]
peg单元将直接在多重体连接组装单元处直接附接于tm
‑
adc(或其中间物)。peg单元的一个或多个其他末端将是游离和无束缚的(即不共价附接),且可为甲氧基、羧酸、醇或其他适宜的官能团形式。甲氧基、羧酸、醇或其他适宜的官能团起到peg单元末端聚乙二醇亚单元的帽的作用。“无束缚”是指pcg单元在该无束缚位点将不与药物部分、抗体、或药物单元和/或抗体的连接元件共价附接。该设置将允许足够长的peg单元相对于疏水性药物部分(d
m
)或药物单元(d
u
)采取平行取向,以掩蔽疏水性,如本文中更详细的讨论,从而允许在这种情况下由mla单元提供更高的载药量。对于其中的peg单元包含多于一个聚乙二醇链的那些实施方式,可对多个聚乙二醇链进行独立选择,例如选择相同或不同的化学部分(例如分子量或亚单位数量不同的聚乙二醇链)。具有多个聚乙二醇链的peg单元在单个附接位点与多重体连接组装单元附接。本领域技术人员将理解peg单元除了包含重复的聚乙二醇亚单元以外还包含非peg材料(例如为了促进多个聚乙二醇链彼此联结或促进联接到多重体连接组装单元)。非peg材料是指peg单元中的不为重复
–
ch2ch2o
‑
亚单位部分的原子。在本文所提供的一些实施方式中,peg单元包含通过非peg元件彼此附接的两条单体pe聚乙二醇g链。在本文所提供的其他实施方式中,peg单元包含附接于中心核的两条线性聚乙二醇链,该中心核附接多重体连接组装单元(即peg单元本身是分支的)。
[0199]
在一些实施方式中,peg单元是二价连接元件。即,两个末端均附接于多重体连接组装单元的元件。在一些实施方式中,peg单元的附接点是多重体连接组装单元的相同元件(例如连接基团(a))。在一些实施方式中,peg单元的附接点是多重体连接组装单元的两个不同元件(例如连接基团(a)和多重体基团(m))。在一些实施方式中,peg单元是连接基团的二价连接元件。
[0200]
本领域普通技术人员可获得多种peg附接方法,[参见例如goodson,等(1990)bio/
technology 8:343(pegylation of interleukin
‑
2at its glycosylation site after site
‑
directed mutagenesis(“定点突变后白介素
‑
2在其糖基化位点的peg化”));ep 0 401 384(coupling peg to g
‑
csf(“peg与g
‑
csf的偶联”));malik等,(1992)exp.hematol.20:1028
‑
1035(pegylation of gm
‑
csf using tresyl chloride(“采用三氟乙磺酰氯peg化gm
‑
csf”));pct公开号wo 90/12874(pegylation of erythropoietin containing a recombinantly introduced cysteine residue using a cysteine
‑
specific mpeg derivative(“采用半胱氨酸特异性mpeg衍生物peg化含重组导入半胱氨酸残基的促红细胞生成素”));美国专利号5,757,078(pegylation of epo peptides(“epo肽的peg化”));美国专利号5,672,662(poly(ethylene glycol)and related polymers monosubstituted with propionic or butanoic acids and functional derivatives thereof for biotechnical applications(“用于生物技术应用的聚乙二醇和丙酸或丁酸单取代相关聚合物及其功能衍生物”));美国专利号6,077,939(pegylation of an n
‑
terminal.alpha.
‑
carbon of a peptide(“肽的n末端α碳的peg化”));veronese等,(1985)appl.biochem.bioechnol 11:141
‑
142(pegylation of an n
‑
terminalα
‑
carbon of a peptide with peg
‑
nitrophenylcarbonate("peg
‑
npc")or peg
‑
trichlorophenylcarbonate(“用peg
‑
硝基苯基碳酸酯(
‘
peg
‑
npc’和peg
‑
三氯苯基碳酸酯peg化肽n末端α碳)”));以及veronese(2001)biomaterials 22:405
‑
417(review article on peptide and protein pegylation(“肽和蛋白质peg化综述文章”))]。
[0201]
例如,peg单元可通过含聚乙二醇化合物与氨基酸残基的反应性基团共价连接氨基酸残基。氨基酸残基的反应性基团包括对活化peg分子具有反应性的那些基团(例如游离氨基或羧基)。例如,n末端氨基酸残基和赖氨酸(k)残基具有游离氨基;c末端氨基酸残基具有游离羰基。巯基(例如存在于半胱氨酸残基上)也可用作反应性基团以形成与peg单元的共价附接。此外,特异于多肽c末端以导入活化基团(例如酰肼、醛和芳香氨基)的酶协助方法已有描述(参见schwarz等,(1990)methods enzymol.184:160;rose等,(1991)bioconjugate chem.2:154;以及gaertner等,(1994)j.biol.chem.269:7224]。
[0202]
在一些实施方式中,含聚乙二醇化合物采用甲氧基化peg(“mpeg”)与具有不同反应性部分的氨基共价附接。此类反应性部分的非限制性实例包括琥珀酸琥珀酰亚胺(ss)、碳酸琥珀酰亚胺(sc)、mpeg
‑
亚氨基酯、对硝基苯基碳酸酯(npc)、琥珀酰亚胺棕榈酸酯和三聚氯氰。此类mpeg的非限制性实例包括:mpeg
‑
琥珀酰亚胺基琥珀酸酯(mpeg
‑
ss)、mpeg2‑
琥珀酰亚胺基琥珀酸酯(mpeg2‑
ss);mpeg
‑
琥珀酰亚胺基碳酸酯(mpeg
‑
sc)、mpeg2‑
琥珀酰亚胺基碳酸酯(mpeg2‑
sc);mpeg
‑
亚氨基酯、mpeg
‑
对硝基苯基碳酸酯(mpeg
‑
npc)、mpeg
‑
亚氨基酯;mpeg2‑
对硝基苯基碳酸酯(mpeg2‑
npc);mpeg
‑
琥珀酰亚胺基丙酸酯(mpeg
‑
spa);mpeg2‑
琥珀酰亚胺基丙酸酯(mpeg,
‑‑
spa);mpeg
‑
n
‑
羟基
‑
琥珀酰亚胺(mpeg
‑
nhs);mpeg2‑
n
‑
羟基
‑
琥珀酰亚胺(mpeg2‑‑
nhs);mpeg
‑
三聚氯氰;mpeg2‑
三聚氯氰;mpeg2‑
赖氨酰基
‑
npc和mpeg2‑
lys
‑
nhs。
[0203]
通常,组成peg单元的至少一条聚乙二醇链经功能化以提供与多重体连接组装单元的共价附接。在peg单元之前的含聚乙二醇化合物功能化包括例如,通过胺基、巯基、nhs酯、马来酰亚胺、炔基、叠氮基、羰基或其他官能团。在一些实施方式中,peg单元还包含非peg材料(即该材料不包含
–
ch2ch2o
‑
),该此类提供与多重体连接组装单元的偶联,或在含聚
乙二醇化合物的构建中包含非peg材料,或者peg单元促进两个或更多个聚乙二醇链的偶联。
[0204]
多重体连接组装单元中peg单元的存在能够对所得tm
‑
adc的药代动力学产生两种可能的影响。所期望的影响是降低清除率(以及由此暴露的增加),其因药物单元暴露的疏水元素引起的非特异性相互作用的减少。第二种影响是不利的,其为有时由tm
‑
adc分子量的提高引起的降低体积和速率分布。增加聚乙二醇单元数量提高了偶联物的流体动力学半径,通常引起扩散性降低。由此,扩散性降低通常消减了tm
‑
adc渗透入肿瘤的能力(schmidt和wittrup,mol cancer ther 2009;8:2861
‑
2871)。由于这两种竞争性的药代动力学效果,希望使用足够大的peg以降低tm
‑
adc清除,从而提高血浆保留,但该peg又不会因过大而消减其扩散性到干扰tm
‑
adc到达所期望靶细胞群的能力(参见例如通过引用纳入本文的us2016/0310612中的实施例1、18和21,关于为特定药物接头部分选择优选peg大小的方法)。
[0205]
在一组实施方式中,peg单元包含一个或多个线性聚乙二醇链,其各自至少2个亚单元,至少3个亚单元,至少4个亚单元,至少5个亚单元,至少6个亚单元,至少7个亚单元,至少8个亚单元,至少9个亚单元,至少10个亚单元,至少11个亚单元,至少12个亚单元,至少13个亚单元,至少14个亚单元,至少15个亚单元,至少16个亚单元,至少17个亚单元,至少18个亚单元,至少19个亚单元,至少20个亚单元,至少21个亚单元,至少22个亚单元,至少23个亚单元,或至少24个亚单元。在优选实施方式中,peg单元合计包含至少6个亚单元,至少8个,至少10个亚单元或至少12个亚单元。在一些此类实施方式中,peg单元总计包含不超过约72个亚单元,优选总计不超过约36个亚单元。在一些实施方式中,peg单元包含约2
‑
12个亚单元。
[0206]
在另一种实施方式中,peg单元总计包含4~72,4~60,4~48,4~36或4~24个亚单元,5~72,5~60,5~48,5~36或5~24个亚单元,6~72,6~60,6~48,6~36或6~24个亚单元,7~72,7~60,7~48,7~36或7~24个亚单元,8~72,8~60,8~48,8~36或8~24个亚单元,9~72,9~60,9~48,9~36或9~24个亚单元,10~72,10~60,10~48,10~36或10~24个亚单元,11~72,11~60,11~48,11~36或11~24个亚单元,12~72,12~60,12~48,12~36或12~24个亚单元,13~72,13~60,13~48,13~36或13~24个亚单元,14~72,14~60,14~48,14~36或14~24个亚单元,15~72,15~60,15~48,15~36或15~24个亚单元,16~72,16~60,16~48,16~36或16~24个亚单元,17~72,17~60,17~48,17~36或17~24个亚单元,18~72,18~60,18~48,18~36或18~24个亚单元,19~72,19~60,19~48,19~36或19~24个亚单元,20~72,20~60,20~48,20~36或20~24个亚单元,21~72,21~60,21~48,21~36或21~24个亚单元,22~72,22~60,22~48,22~36或22~24个亚单元,23~72,23~60,23~48,23~36或23~24个亚单元,或24~72,24~60,24~48,24~36或24个亚单元。
[0207]
可用于本文所提供的任何实施方式中的线性peg单元的示例如下:
[0208][0209]
其中,波浪线指示与多重体连接组装单元附接的位点,各n独立地选自4~72,6~72,8~72,10~72,12~72,6~24或8~24。在一些实施方式中,下标b为约8,约12或约24。
[0210]
如本文所述,对peg单元进行选自从而使其改善所得tm
‑
adc的清除率,但不会显著影响该偶联物渗透入肿瘤的能力。在其中tm
‑
adc中药物部分和多重体连接组装单元具有与马来酰亚胺基衍生的葡糖苷酸mmae药物部分相当的疏水性的实施方式中,待选择使用的peg单元将优选具有8个亚单元~约24个亚单元,更优选约12个亚单元。在其中tm
‑
adc中药物部分和多重体连接组装单元具有大于马来酰亚胺基衍生的葡糖苷酸mmae药物部分的疏水性的实施方式中,有时需要peg单元具有更多的亚单元。
[0211]
在本公开优选的实施方式中,peg亚单元为约300道尔顿~约5千道尔顿;约300道尔顿~约4千道尔顿;约300道尔顿~约3千道尔顿;约300道尔顿~约2千道尔顿;约300道尔顿~约1千道尔顿;或其间的任意数值。在该方面的某些部分中,peg单元具有至少8个、10个或12个亚单元。在该方面的某些部分中,peg单元具有至少8个、10个或12个亚单元,但不超过72个亚单元,优选不超过36个亚单元。
[0212]
在本公开的优选实施方式中,除了peg单元以外,在多重体连接组装物中不存在其他peg亚单元(即在本文所提供的偶联物和接头的任何其他元件中均没有peg亚单元)。在本发明的其他方面中,除了peg单元以外,在多重体连接组装物中存在不超过8个,不超过7个,不超过6个,不超过5个,不超过4个,不超过3个,不超过2个,不超过1个其他聚乙二醇亚单元(即在本文所提供的tm
‑
adc的任何元件中存在不超过8、7、6、5、4、3、2、1个其他聚乙二醇亚单元)。
[0213]
应理解,当涉及peg的聚乙二醇亚单元时,根据上下文,亚单元的数目可表示平均数,例如当涉及tm
‑
adc群体或其中间体化合物和/或采用多分散性peg时。
[0214]
其他多重体连接组装物实施方式
[0215]
除了上文所讨论的多重体连接组装物(mla)(式i、ib和ic),本公开还提供了如下文所述的其他mla实施方式。下式中巯基多重体(t
mc1
、t
mc2
),连接基团(a1和a2),分区基团(y)和药物部分(d
m
)具有与前文部分中的相同含义。
[0216]
多重体(m)基团
[0217]
本文所述的mla化合物和tm
‑
adc中的多重体(m)基团用作分支元件(或三官能连接基团)。初始多重体(m)基团提供了与连接基团(a1)的共价附接以及与两个(a2‑
t
mc2
)基团的共价附接。用1
‑
3个官能团实现与连接基团(a1)以及与两个(a2‑
t
mc2
)基团的共价附接。例如,在一些实施方式中,多重体(m)基团包含单个官能团,例如单个叔胺,提供了与连接基团(a1)以及与两个(a2‑
t
mc2
)基团的共价附接。或者,在一些实施方式中,多重体(m)基团包含两个或三个官能团,这些基团提供了与连接基团(a1)以及与两个(a2‑
t
mc2
)基团的共价附接。例
如,在一些实施方式中,巯基、羟基、胺基或其他亲核基团提供了与连接基团(a1)的共价附接,而巯基、羟基、胺基或其他亲核基团则提供了与(a2‑
t
mc2
)基团之一或两者的共价附接。在多重体(m)基团包含两个或多个官能团的情况下,所述两个或多个官能团通过各种适宜的基团(例如分支或不分支的c1‑8亚烷基部分)连接。
[0218]
在一些实施方式中,多重体(m)基团由具有下式的部分表示:
[0219][0220]
其中,右侧的波浪线是(a2‑
t
mc2
)部分,左侧的波浪线是a1基团。
[0221]
在一些实施方式中,多重体(m)基团由具有下式的部分表示:
[0222][0223]
其中,右侧的波浪线是(a2‑
t
mc2
)部分,左侧的波浪线是a1基团。
[0224]
在一些实施方式中,多重体(m)基团由具有下式的部分表示:
[0225][0226]
其中,右侧的波浪线是(a2‑
t
mc2
)部分,左侧的波浪线是a1基团。
[0227]
在一些实施方式中,多重体(m)基团由具有下式的部分表示:
[0228][0229]
其中,右侧的波浪线是(a2‑
t
mc2
)部分,左侧的波浪线是a1基团。
[0230]
在一些实施方式中,多重体(m)基团由具有下式的部分表示:
[0231][0232]
其中,右侧的波浪线是(a2‑
t
mc2
)部分,左侧的波浪线是a1基团。
[0233]
基于上述描述,很明显巯基多重体(t
mc
)基团是多重体(m)的一种类型。
[0234]
上述的多重体(m)基团的官能团均是亲核基团;然而,本领域普通技术人员将认识到用于共价附接a1或(a2‑
t
mc2
)的亲核基团或亲电子基团的选择可有所变化而不脱离本公开的范围。很明显亲核基团或亲电子基团的选择取决于提供与a1或(a2‑
t
mc2
)中多重体(m)基团共价附接的官能团的化学特性。
[0235]
虽然上述描述集中于提供与连接基团(a1)共价附接以及与两个(a2‑
t
mc2
)基团共价
附接的多重体(m)基团,多重体(m)基团可以在任何适宜的分支位置。
[0236]
抗体(ab)
[0237]
可用于本文所述tm
‑
adc的抗体实质上是靶向与临床相关疾病状态相关抗原的任何抗体或其片段。这包括具有4个可及链间二硫键或通过还原这些链间二硫键产生的8个巯基的抗体片段以及抗体。本公开的抗体可为非工程化改造的抗体——所述抗体中不含引入额外氨基酸或肽的修饰,或者可为工程化改造的抗体——所述抗体中有一个或多个工程化改造的半胱氨酸残基掺入抗体或其片段中。
[0238]
在一些实施方式中,本公开的抗体包含一个或多个工程化改造半胱氨酸(ecys)残基。ecys残基是掺入抗体重链或轻链中的半胱氨酸氨基酸或其衍生物,通常通过母体抗体的诱变将一个或多个ecys残基掺入抗体中。进一步的信息可见于美国专利号9,000,130,其内容出于全部目的纳入本文。在一些实施方式中,半胱氨酸(cys)衍生物包括但不限于β
‑2‑
cys、β
‑3‑
cys、高半胱氨酸和n
‑
甲基半胱氨酸。
[0239]
在一些实施方式中,抗体(ab)是完整或完全还原的抗体。术语“完全还原”是指抗体中全部4个链间二硫键均已被还原以提供可附接接头基团a1的8个巯基。
[0240]
在一些实施方式中,抗体(ab)是完整或完全还原的抗体,或者是带有工程化改造半胱氨酸基团的抗体,所述半胱氨酸基团被能够参与例如点击化学反应或其他环加成反应以附接本文所述mla元件的官能团修饰。
[0241]
在一组实施方式中,巯基多重化抗体药物偶联(tm
‑
adc)化合物由式i
ab
表示:
[0242][0243]
其中:
[0244]
ab来自抗体;
[0245]
s*是来自还原链间二硫键的硫原子或来自抗体工程化改造半胱氨酸单元的硫原子,或者s*代表引入抗体或其部分中以共价附接该抗体的经修饰官能团,其获自点击化学反应、diel
‑
alder化学反应或其他环加成反应;
[0246]
a1是第一连接基团;
[0247]
各a2独立地为键或为独立选择的第二连接基团;
[0248]
各a1和a2可任选地包含分区基团(y),其与第一或第二连接基团共价连接,或为第一或第二连接基团的二价连接元件;
[0249]
m为多重化基团或第一巯基多重化基团(t
mc1
);
[0250]
各d
m
为药物部分;以及
[0251]
下标p是1至10的整数。
[0252]
在一些实施方式中,本文提供的巯基多重化抗体药物偶联化合物由式i
ab
a表示:
[0253][0254]
其中:
[0255]
ab来自抗体;
[0256]
s*是来自还原链间二硫键的硫原子或来自抗体工程化改造半胱氨酸单元的硫原子,或者s*代表引入抗体或其部分中以共价附接该抗体的经修饰官能团,其获自点击化学反应、diel
‑
alder化学反应或其他环加成反应;
[0257]
a1为第一连接基团,其可任选地包含分区基团(y),其与第一连接基团共价连接或为第一连接基团的二价连接元件;
[0258]
t
mc1
为巯基多重化基团;
[0259]
各s为巯基多重化(t
mc1
)基团的硫原子;
[0260]
各d
m
为药物部分;以及
[0261]
下标p是1至10的整数。
[0262]
在一组实施方式中,巯基多重化抗体药物偶联(tm
‑
adc)化合物由式ii
ab
表示:
[0263][0264]
其中:
[0265]
ab来自抗体;
[0266]
s*是来自还原链间二硫键的硫原子或来自抗体工程化改造半胱氨酸单元的硫原子,或者s*代表引入抗体或其部分中以共价附接该抗体的经修饰官能团,其获自点击化学反应、diel
‑
alder化学反应或其他环加成反应;
[0267]
a1是第一连接基团;
[0268]
各a2独立地为键或为独立选择的第二连接基团;
[0269]
各a1和a2可任选地包含分区基团(y),其与第一或第二连接基团共价连接,或为第一或第二连接基团的二价连接元件;
[0270]
m为多重化基团或第一巯基多重化基团(t
mc1
);
[0271]
各t
mc2
为还原形式的第二巯基多重化基团;
[0272]
各d
m
为与还原形式t
mc2
基团的硫原子连接的药物部分;以及
[0273]
下标p是1至10的整数。
[0274]
在一组实施方式中,巯基多重化抗体药物偶联物(tm
‑
adc)由式i
ab
b表示:
[0275][0276]
其中:
[0277]
ab来自抗体;
[0278]
s*是来自抗体的还原链间二硫键的硫原子或来自抗体工程化改造半胱氨酸单元的硫原子,或者s*代表引入抗体或其部分中以共价附接该抗体的经修饰官能团,其获自点击化学反应、diel
‑
alder化学反应或其他环加成反应;
[0279]
a1是第一连接基团;
[0280]
各a2独立地为键或为独立选择的第二连接基团;
[0281]
各a1和a2包含0或1个分区基团(y),其共价附接于第一或第二连接基团,或为连接基团的二价连接元件;
[0282]
m为多重化基团或第一巯基多重化基团(t
mc1
);
[0283]
各t
mc2
独立地为第二巯基多重化基团;
[0284]
各s为第二巯基多重化基团(t
mc2
)的硫原子;以及
[0285]
各d
m
为药物部分。
[0286]
在一组实施方式中,用于本文所述任何tm
‑
adc的抗体针对癌细胞抗原。在另一组实施方式中,抗体针对细菌相关抗原。在另一组实施方式中,抗体针对自身免疫细胞抗原。应理解tm
‑
adc中的抗体元件是残基形式的抗体从而本文所述tm
‑
adc结构中的ab合并该抗体结构。
[0287]
有用的多克隆抗体是衍生自被免疫动物血清的异质抗体分子群。有用的单克隆抗体是针对特定抗原决定簇(例如癌细胞抗原、病毒抗原、微生物抗原、蛋白质、肽、碳水化合物、化学品、核酸或其片段)的均质抗体群。针对目标抗原的单克隆抗体(mab)可采用本领域中已知的任何技术制备,所述技术提供通过培养物中的连续细胞系生产抗体分子。
[0288]
有用的单克隆抗体包括但不限于人单克隆抗体、人源化单克隆抗体或嵌合人
‑
小鼠(或其他物种)单克隆抗体。抗体包括全长抗体及其抗原结合片段。人单克隆抗体可通过本领域中已知的众多技术制备(例如teng等,1983,proc.natl.acad.sci.usa.80:7308
‑
7312;kozbor等,1983,immunology today 4:72
‑
79;和olsson等,1982,meth.enzymol.92:3
‑
16)。
[0289]
在一些方面中,术语“抗体”还包括抗体的功能性活化片段、衍生物或类似物,其免疫特异性结合靶细胞(例如癌细胞抗原、病毒抗原或微生物抗原)或其他结合于肿瘤细胞或基质的抗原。就此而言,“功能化活化”是指该片段、衍生物或类似物能够免疫特异性结合靶细胞。为了确定哪些cdr序列结合该抗原,通常在结合试验中采用包含所述cdr序列的合成
肽和该抗原,以本领域中已知的任何结合试验方法进行试验(例如,bia核心试验)(参见例如,kabat等,1991,sequences of proteins of immunological interest(“免疫学目标蛋白质的序列”),第五版,国立卫生研究院(national institute of health),马里兰州贝塞斯达;kabat e等,1980,j.immunology 125(3):961
‑
969)。
[0290]
此外,包含人和非人部分的重组抗体,例如嵌合和人源化单克隆抗体,通常采用标准重组dna技术获得,是有用的抗体。嵌合抗体是其中不同部分衍生自不同动物物种,例如具有衍生自鼠单克隆的可变区和人免疫球蛋白恒定区的那些抗体。(参见,例如,美国专利号8,197,872、4,816,397和9,200,091,其公开内容通过引用其全文的方式纳入本文。)人源化抗体是来自非人物种的抗体分子,其具有来自非人物种的一个或多个互补决定区(cdr)以及来自人免疫球蛋白分子的框架区。(参见例如美国专利第5,585,089号,该专利通过引用完全纳入本文。)此类嵌合和人源化单克隆抗体可通过本领域中已知的重组dna技术生产,例如采用如下文献中所述的方法:国际公开号wo 87/02671;欧洲专利公开号0 184 187;欧洲专利公开号00 171 496;欧洲专利公开号00 173 494;国际公开号wo 86/01533;美国专利号4,816,567;欧洲专利公开号0012 023;berter等1988,science 240:1041
‑
1043;liu等,1987,proc.natl.acad.sci.usa 84:3439
‑
3443;liu等,1987,j.immunol.139:3521
‑
3526;sun等,1987,proc.natl.acad.sci.usa 84:214
‑
218;nishimura等,1987,cancer.res.47:999
‑
1005;wood等,1985,nature 314:446
‑
449;以及shaw等,1988,j.natl.cancer inst.80:1553
‑
1559;morrison,1985,science 229:1202
‑
1207;oi等,1986,biotechniques 4:214;美国专利号5,225,539;jones等,1986,nature 321:552
‑
525;verhoeyan等,1988,science 239:1534;和beidler等,1988,j.immunol.141:4053
‑
4060;其各自通过引用以全文纳入本文。
[0291]
在一些实施方式中,完整人抗体是尤为希望的,且通常采用无法表达内源性免疫球蛋白重链和轻链基因,但能够表达人重链和轻链基因的转基因小鼠生产。
[0292]
免疫特异于癌细胞抗原的抗体可市售获得或采用本领域技术人员已知的任何方法生产,例如化学合成或重组表达技术。编码免疫特异性针对癌细胞抗原的抗体的核苷酸序列可获自例如genbank数据库或类似数据库、书面公开物或通过常规克隆和测序。
[0293]
在特定实施方式中,采用了用于治疗癌症的已知抗体。免疫特异于癌细胞抗原的抗体可市售获得或采用本领域技术人员已知的任何方法生产,例如重组表达技术。编码免疫特异性针对癌细胞抗原的抗体的核苷酸序列可获自例如genbank数据库或类似数据库、书面公开物或通过常规克隆和测序。
[0294]
在另一特定实施方式中,根据本发明的组合物和方法使用治疗自身免疫性疾病的抗体。免疫特异于负责产生自身免疫性抗体的细胞抗原的抗体可市售获得或采用本领域技术人员已知的任何方法生产,例如化学合成或重组表达技术。
[0295]
在某些实施方式中,有用的抗体针对活化淋巴细胞上表达的受体或受体复合物。受体或受体复合物可包含免疫球蛋白基因超家族成员、tnf受体超家族成员、整合素、细胞因子受体、趋化因子受体、主要组织相容性蛋白、凝集素或补体控制蛋白。
[0296]
与抗体的示例性附接通过硫醚键。
[0297]
癌细胞抗原
[0298]
可得的用于癌症治疗的抗体以及结合肿瘤相关抗原的中和抗体的实例综述于如
下文献中:franke,a.e.,sievers,e.l.,和scheinberg,d.a.,“cell surface receptor
‑
targeted therapy of acute myeloid leukemia:a review”(极性髓性白血病的细胞表面受体靶向治疗)cancer biother radiopharm.2000,15,459
‑
76;murray,j.l.,“monoclonal antibody treatment of solid tumors:a coming of age”(实体瘤的单克隆抗体治疗:时代来临)semin oncol.2000,27,64
‑
70;breitling,f.,和dubel,s.,recombinant antibodies(重组抗体),约翰威利父子出版公司(john wiley and sons),纽约,1998。
[0299]
连接组装单元和tm
‑
adc的选择实施方式
[0300]
在一些实施方式中,如式i、ii、iii所示的mla的a1包含马来酰亚胺基团。
[0301]
由式i和ii所示的mla,其中a1是自稳定化部分。
[0302]
在一些所选的实施方式中,式(i)和(ii)的mla化合物中的a1具有选自下组的式:
[0303][0304]
其中,r选自下组:h和胺保护基;y为分区基团;波浪线指示与t
mc1
的附接。
[0305]
在一些所选的实施方式中,式(i)的mla化合物中的t
mc1
为硫化物形式,且选自下组:
[0306][0307]
在一些所选的实施方式中,式(i)的mla化合物中下标m为0,m为t
mc1
,且t
mc1
选自下组:
[0308][0309]
在一些所选的实施方式中,式(i)的mla化合物中的下标m为0,t
mc1
选自下组:
[0310][0311]
在一些所选的实施方式中,式(ii)的mla化合物中的下标m为1,t
mc1
选自下组:
[0312]
以及
[0313]
t
mc2
是二硫化物形式,且选自下组:
[0314][0315]
在一些所选的实施方式中,式(ii)的mla化合物中t
mc1
和t
mc2
各自独立地选自下组:
[0316]
且各t
mc2
还连接两个药物部分。
[0317]
在一些所选的实施方式中,式(ii)的mla化合物中各(a2‑
t
mc2
)具有独立地选自下组的式:
[0318][0319]
其中,位于琥珀酰亚胺环左侧的波浪线指示与t
mc1
的硫醚附接,硫原子右侧的各波浪线指示与药物部分(d
m
)的共价附接。
[0320]
在一些实施方式中,式(i)或(ii)的mla化合物中附接药物部分,各所述药物部分具有选自下组的式:mc
‑
vc
‑
pab
‑
d
u
、mc
‑
d
u
、mc
‑
vc
‑
d
u
、mdpr
‑
d
u
、mdpr
‑
lys(peg)
‑
d
u
和d
u
;其中,mc为马来酰亚胺
‑
衍生的琥珀酰亚胺部分,可任选地为水解形式,以及各d
u
是纳入选自下组的游离药物结构的药物单元:核苷化学治疗药物;hdac抑制剂;蒽环类药物;nampt抑制剂;亲水前药(例如sn
‑
38葡糖苷酸,磷酸依托泊苷);低分子量药物(例如分子量小于约600的药物);氮芥(例如,美法仑);以及蛋白酶体抑制剂(例如雷诺利迪酰胺(lenolidomide))。在一些实施方式中,掺入d
u
的游离药物的结构选自下组:核苷化疗剂和抗代谢物,例如抗叶酸(例如甲氨蝶呤、培美曲塞、l
‑
亚叶酸、gw1843、雷替曲塞、zd9331、普拉曲塞、洛美曲索)。
[0321]
在一些实施方式中,式(i)的mla化合物具有选自下组的式:
[0322][0323][0324]
其中各r为h或胺保护基;各d
m
为药物部分;且y是分区基团。在一些实施方式中,分区基团(y)为peg单元。
[0325]
在一些实施方式中,式(i
‑
1a)或(i
‑
2a)的mla化合物中d
m
为具有选自下式的药物部分:mc
‑
vc
‑
pab
‑
d
u
、mc
‑
d
u
、mc
‑
vc
‑
d
u
、mdpr
‑
d
u
、mdpr
‑
lys(peg)
‑
d
u
和d
u
;其中,mc为马来酰亚胺
‑
衍生的琥珀酰亚胺部分,可任选地为水解形式,以及各d
u
是纳入选自下组的游离药物结构的药物单元:核苷化学治疗药物;hdac抑制剂;蒽环类药物;nampt抑制剂;亲水前药(例如sn
‑
38葡糖苷酸,磷酸依托泊苷);低分子量药物(例如分子量小于约600的药物);氮芥(例如,美法仑);以及蛋白酶体抑制剂(例如雷诺利迪酰胺)。在一些实施方式中,掺入d
u
的游离药物的结构选自下组:核苷化疗剂和抗代谢物,例如抗叶酸(例如甲氨蝶呤、培美曲塞、l
‑
亚叶酸、gw1843、雷替曲塞、zd9331、普拉曲塞、洛美曲索)。
[0326]
在一些所选实施方式中,式i、ii和iii所示多重体连接组装化合物的各药物接头(d
l
)为mdpr
‑
vc接头。
[0327]
在一些实施方式中,式i、ii和iii所示mla化合物的各药物接头(d
l
)独立地选自下组:马来酰亚胺基
‑
己酰基(mc)、马来酰亚胺基
‑
己酰基
‑
缬氨酸
‑
瓜氨酸(mc
‑
vc)和马来酰亚胺基
‑
己酰基
‑
缬氨酸
‑
瓜氨酸
‑
对氨基苯氧基羰基(mc
‑
vc
‑
pabc)。
[0328]
为了易于参考本文所述的化合物和组装物,元件mc
‑
vc
‑
pab
‑
d
u
具有如下结构,其中mc为马来酰亚胺衍生的琥珀酰亚胺部分:
[0329][0330]
元件mc
‑
va
‑
pab
‑
d
u
具有如下结构,其中mc为马来酰亚胺衍生的琥珀酰亚胺部分:
[0331][0332]
元件mc
‑
va
‑
d
u
具有如下结构,其中mc为马来酰亚胺衍生的琥珀酰亚胺部分:
[0333][0334]
以及,mdpr
‑
pab(gluc)
‑
d
u
具有如下结构,其中mdpr为马来酰亚胺衍生的琥珀酰亚胺部分:
[0335][0336]
其中mc
‑
vc
‑
pab
‑
d
u
、mc
‑
va
‑
pab
‑
d
u
、mc
‑
va
‑
d
u
和mdpr
‑
pab(gluc)
‑
d
u
中的mc和mdpr为马来酰亚胺衍生的琥珀酰亚胺部分,是结合多重体连接组装单元的示例性
‑
d
m
部分,且其中波浪线指示mc或mdpr的琥珀酰亚胺环与存在于巯基多重体(t
mc
)基团上的巯基的共价连接。
[0337]
在上述马来酰亚胺衍生的琥珀酰亚胺部分中的任一者中,琥珀酰亚胺环可任选地为水解形式,而对于衍生自mdpr的琥珀酰亚胺部分而言,该琥珀酰亚胺环优选为水解形式。
[0338]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0339][0340]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0341][0342]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0343][0344]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0345][0346]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0347][0348]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0349][0350]
在一些实施方式中,式(i)或(ii)的mla化合物是其中a1–
t
mc1
包含如下结构的化合物:
[0351][0352]
使用方法
[0353]
癌症治疗
[0354]
tm
‑
adc可用于抑制肿瘤细胞或癌细胞的增殖,引起肿瘤或癌细胞的凋亡,或用于在患者中治疗癌症。tm
‑
adc可相应用于各种环境中以治疗癌症。tm
‑
adc可用于将药物递送
到肿瘤细胞或癌细胞。不希望受限于理论,在一个实施方式中,tm
‑
adc的抗体结合癌细胞或肿瘤细胞相关抗原或与癌细胞或肿瘤细胞相关抗原相关,且tm
‑
adc可被摄入(内化)肿瘤细胞或癌细胞内,该摄入通过受体介导的内吞作用或其他内化机制进行。抗原可附于肿瘤细胞或癌细胞或可为与肿瘤或癌细胞相关的细胞外基质蛋白。一旦位于细胞内,药物通过可裂解机制释放于细胞内。在其他实施方式中,从肿瘤细胞或癌细胞外的tm
‑
adc裂解出药物或药物单元,然后该药物或药物单元穿透细胞。
[0355]
在一些实施方式中,所述抗体结合至肿瘤细胞或癌细胞。
[0356]
在另一实施方式中,抗体结合肿瘤细胞或者癌细胞抗原,其位于肿瘤细胞或癌细胞的表面上。
[0357]
在另一实施方式中,抗体结合肿瘤细胞或者癌细胞抗原,其为与肿瘤细胞或癌细胞相关的胞外基质蛋白。
[0358]
用于特定肿瘤细胞或癌细胞的抗体特异性对于确定那些肿瘤或癌症能被最有效地治疗而言是很重要的。例如,在治疗血液学恶性肿瘤的一些实施方式中,tm
‑
adc靶向存在于造血癌细胞上的癌细胞抗原。在其他实施方式中,tm
‑
adc靶向存在于实体瘤的异常细胞上的癌细胞抗原以治疗该实体瘤。
[0359]
在其他实施方式中,tm
‑
adc针对造血癌症,例如淋巴瘤(霍奇金淋巴瘤和非霍奇金淋巴瘤)以及白血病和实体瘤中的异常细胞。
[0360]
癌症的多模式治疗
[0361]
通过给予tm
‑
adc来治疗或抑制癌,所述癌包括但不限于,肿瘤、转移瘤或以异常细胞为特征的其他疾病或病症,上述异常细胞的特征在于不受控的细胞生长。
[0362]
在其他实施方式中,提供了治疗癌症的方法,包括给予有需要的患者有效量的tm
‑
adc和化疗剂。在一个实施方式中,化疗剂是用其在癌症治疗中未发现复发的癌症的治疗。在另一个实施方式中,化疗剂是在癌症治疗中发现癌症复发的化疗剂。在一些实施方式中,将tm
‑
adc给予已经过手术以治疗癌症的患者。
[0363]
在一些实施方式中,患者还接受了其它治疗,例如放疗。在特定的实施方式中,同时给予tm
‑
adc与化疗剂或放疗。在另一特定实施方式中,给予化疗剂或放疗之前或之后给予tm
‑
adc。
[0364]
在其他实施方式中,在一系列疗程中给予化疗剂。可给予任何一种化疗剂或其组合,例如作为治疗标准化疗药物。
[0365]
此外,提供用tm
‑
adc治疗癌症的方法作为化疗或放疗的替代,其中化疗或放疗已被证明或能够被证明对所治疗对象毒性太高,例如导致不可接受或不可承受的副作用。在一些实施方式中,用tm
‑
adc治疗的患者也用其他癌症疗法治疗,例如手术、放疗或化疗,这取决于哪种治疗可接受或可承受。
[0366]
自身免疫性疾病的治疗
[0367]
tm
‑
adc可用于杀伤产生自身免疫性疾病的细胞或抑制其复制,或用于治疗自身免疫性疾病。
[0368]
因此,在一些实施方式中,tm
‑
adc相应用于各种环境中以治疗患者中的自身免疫性疾病。在其他实施方式中,将tm
‑
adc用于递送药物至靶细胞。不希望受限于理论,在那些实施方式之一中,tm
‑
adc化合物与靶细胞表面上的抗原关联,然后该tm
‑
adc化合物通过受
体介导的内吞作用被摄入靶细胞内。一旦进入细胞,接头单元被裂解,导致药物或药物单元释放。然后释放的药物能够在细胞溶质中自由迁移,并诱导细胞毒性或细胞抑制活性。在其他实施方式中,从靶细胞外的tm
‑
adc裂解出药物,然后该药物或药物单元穿透细胞。
[0369]
在一个实施方式中,抗体结合自身免疫性抗原。在一个实施方式中,抗原位于涉及自身免疫病状的细胞的表面。
[0370]
在另一实施方式中,抗体结合位于细胞表面上的自身免疫性抗原。
[0371]
在一个实施方式中,抗体结合与自身免疫性疾病状态相关的活化淋巴细胞。
[0372]
在其他实施方式中,tm
‑
adc杀伤产生与具体自身免疫性疾病相关的自身免疫性抗体的细胞或抑制其复制。
[0373]
可用tm
‑
adc治疗的自身免疫性疾病的具体种类包括但不限于:th2淋巴细胞相关病症(例如特应性皮炎、特应性哮喘、鼻结膜炎、变应性鼻炎、欧曼氏综合征、系统性硬化症、移植物抗宿主病);th1淋巴细胞相关疾病(如类风湿性关节炎、多发性硬化症、银屑病、肖格伦综合征、桥本氏甲状腺炎、格雷夫氏病、原发性胆汁性肝硬化、韦格纳氏肉芽肿病和结核病);活化的b淋巴细胞相关疾病(如系统性红斑狼疮、肾炎综合征、类风湿性关节炎和i型糖尿病)。
[0374]
自身免疫性疾病的多药物治疗
[0375]
还公开了治疗自身免疫性疾病的方法,其包括给予有此需要的患者有效量的tm
‑
adc和已知用于自身免疫性疾病治疗的其他治疗剂。
[0376]
组合物和给药方法
[0377]
本方面提供了包含本文所述tm
‑
adc和药学上可接受载体的药物组合物。tm
‑
adc可为允许其给予患者以治疗与抗体所结合的抗原表达相关病症的任何形式。例如,tm
‑
adc可为液体或固体形式。优选的给药途径是胃肠道外。胃肠道外给药包括皮下注射、静脉、肌肉内、胸骨内注射或输注技术。在一些实施方式中,胃肠外给予所述组合物。在那些实施方式之一中,经静脉给予偶联物。给药通常通过任何常规途径进行,例如通过输注或推注。
[0378]
将tm
‑
adc的药物组合物配制为允许其在将组合物给予患者后是生物可利用的。组合物可为一种或多种可注射剂型单位的形式。
[0379]
用于制备药物组合物的材料在使用量下是无毒的。对于本领域普通技术人员很明显的是药物组合物中活性成分的最佳剂量将取决于各种因素。相关因素包括但不限于:动物类型(例如人)、化合物的具体形式、给药方式以及所用组合物。
[0380]
tm
‑
adc组合物通常为液体、悬浮液或冻干固体形式。液体组合物或悬浮液可用于通过注射递送,冻干固体适于用适于注射用的稀释剂重构成液体或悬浮液。对于旨在通过注射给药的组合物,通常可包含表面活性剂、防腐剂、润湿剂、分散剂、助悬剂、缓冲剂、稳定剂和等张剂中的一种或多种。
[0381]
在一些实施方式中,液体组合物无论是溶液、悬浮液或其他类似形式,也可包括如下的一种或多种:无菌稀释剂,如注射用水、盐水溶液,优选生理盐水、林格氏溶液、等渗氯化钠,混合油例如可用作溶剂或悬浮介质的合成甘油单酯或甘油二酯、聚乙二醇、甘油、环糊精、丙二醇或其它溶剂;抗菌剂,如苄醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂,如氨基酸、乙酸盐、柠檬酸盐或磷酸盐;和洗涤剂,例如非离子型表面活性剂、多元醇;以及用于调节张力的试剂,如氯化钠或右旋糖。胃肠
外组合物通常封闭在玻璃、塑料或其他材料的多剂量药瓶、安瓿瓶或一次性针筒中。生理盐水是示例性佐剂。可注射组合物优选为灭菌的液体组合物。
[0382]
有效治疗特定疾病或病症的tm
‑
adc量将取决于该疾病或病症的性质,该量通常通过标准临床技术测定。此外,有时可采用体外或体内试验来帮助确定最优的剂量范围。组合物中将采用的精确剂量还将依赖于胃肠道外给药的途径,和疾病或病症的严重性,并且应根据医生的判断和每个患者的情况决定。
[0383]
组合物包含有效量的tm
‑
adc,从而将获得适应的剂量。通常,该量为tm
‑
adc占组合物重量的至少约0.01%。
[0384]
一般而言,给予患者的tm
‑
adc剂量通常为约0.01mg/kg~约100mg/kg,约1~约100mg/kg或约0.1~约25mg/kg对象体重。在一些实施方式中,给予患者的剂量是为约0.01mg/kg~约15mg/kg对象体重。在一些实施方式中,给予患者的剂量是为约0.1mg/kg~约15mg/kg对象体重。在一些实施方式中,给予患者的剂量是为约0.1mg/kg~约20mg/kg对象体重。在一些实施方式中,给药剂量是为约0.1mg/kg~约5mg/kg,约0.1mg/kg~约10mg/kg对象体重。在一些实施方式中,给药剂量是为约1mg/kg~约15mg/kg对象体重。在一些实施方式中,给药剂量是为约1mg/kg~约10mg/kg对象体重。在一些实施方式中,在一个治疗周期中,给药剂量优选为约0.1mg/kg~4mg/kg,更优选约0.1~3.2mg/kg,或更优选0.1~2.7mg/kg对象体重。
[0385]
术语“载体”是指与化合物以其给予的稀释剂、佐剂或赋形剂。此类药物载体为液体。当静脉内给予化合物时,水是示例性的载体。盐水溶液和右旋糖水溶液和甘油溶液也可用作注射液的液体载体。适宜的药学载体还包括丙三醇、丙烯、乙二醇或乙醇。如果需要,在一些实施方式中,本发明的组合物也可含有少量润湿剂或乳化剂和/或ph缓冲剂。
[0386]
在一些实施方式中,根据常规程序将偶联物配制成适于向动物,尤其是人类静脉内给药的药物组合物。通常,用于静脉内给药的载体或载剂是无机等渗水性缓冲溶液。当需要时,在一些实施方式中组合物还可包括分区基团。有时,用于静脉内给药的组合物包含局部麻醉剂例如利多卡因以缓解注射部位的疼痛。通常,成分可以单独提供或者也可以以单位剂型混合在一起,例如,指明活性剂量的密封容器如安瓿或药囊中干燥的冻干粉末或无水浓缩物。通过输液给予tm
‑
adc时,有时可用含有无菌药物级水或盐水的输液瓶分配tm
‑
adc。通过注射给予该偶联物时,通常提供一安瓿的无菌注射用水或盐水,以便在给药前能够混合药物成分。
[0387]
药物组合物通常配制为无菌的基本上等渗且完全符合美国食品和药物管理局的所有良好生产规范(gmp)法规。
实施例
[0388]
除非另有说明,所有溶剂和试剂均从市售来源购得,具有最高可得纯度且在用前无需进一步纯化包括二甲基甲酰胺(dmf)和ch2cl2的脱水溶剂购自aldrich公司。
[0389]
通过急骤柱色谱以biotage isolera one flash纯化系统(夏洛特,nc)纯化产物。制备型hplc在waters 2454二元梯度模块统计递送系统上用waters 2998pda检测器进行。除非另有说明,如下纯化产物:用适宜直径的phenomenex max
‑
rp 4μm synergisynergi250mm反相柱,以0.05%三氟乙酸水溶液和0.05%三氟乙酸乙腈溶液洗脱。uplc
‑
ms使用以下方法
之一在与waters acquity uplc系统接口的waters单四检测器质谱仪上进行的。
[0390]
beh c18通用方法:acquity uplc beh c18 2.1x50mm,1.7μm反相柱;溶剂a
‑
0.1%甲酸;溶剂b
–
含0.1%甲酸的乙腈。
[0391]
时间(分钟)流速(ml/分钟)a%b%梯度起始0.5973 1.700.54060线性2.000.5595线性2.500.5595线性2.800.5973线性3.000.5973线性
[0392]
beh c18疏水性方法:acquity uplc beh c18 2.1x50mm,1.7μm反相柱;溶剂a
‑
0.1%甲酸;溶剂b
–
含0.1%甲酸的乙腈。
[0393]
时间(min)流速(ml/min)a%b%梯度起始0.5973 1.000.54060线性1.500.5595线性2.500.5595线性2.800.5973线性3.000.5973线性
[0394]
cortecs c18通用方法:waters cortecs c18 1.6μm,2.1x50mm,反相柱;溶剂a
‑
0.1%甲酸水溶液;溶剂b
–
含0.1%甲酸的乙腈。
[0395]
时间(分钟)流速(ml/min)a%b%梯度起始0.6973 1.700.64060线性2.000.6595线性2.500.6595线性2.800.6973线性3.000.6973线性
[0396]
cortecs c18疏水性方法:waters cortecs c18 1.6μm,2.1x50mm,反相柱;溶剂a
‑
0.1%甲酸水溶液;溶剂b
–
含0.1%甲酸的乙腈。
[0397]
时间(分钟)流速(ml/min)a%b%梯度起始0.6973 1.500.6595线性2.400.6595线性2.500.6973线性2.800.6973线性
[0398]
cortecs c18疏水性方法:waters cortecs c18 1.6μm,2.1x50mm,反相柱;溶剂a
‑
0.1%甲酸水溶液;溶剂b
–
含0.1%甲酸的乙腈。
[0399]
时间(分钟)流速(ml/min)a%b%梯度起始0.6973 1.700.66733线性2.000.6595线性2.500.6973线性2.800.6973线性
[0400]
实施例1
[0401][0402]
((s)
‑3‑
(((s)
‑
1,2
‑
二噻烷
‑4‑
基)氨基
‑2‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)
‑3‑
氧代丙基)氨基甲酸叔丁酯:将碘(10mg/ml)加至二硫代丁胺hcl盐的甲醇溶液(2,25mg,0.144mmol)直至溶液的紫色持续,指示了二硫化物的氧化。数小时后,浓缩混合物。将残留物溶解于dmf(0.5ml),加入boc
‑
dpr
‑
osu(3,55mg,0.144mmol),并用dipea(100μl)处理该混合物。搅拌反应混合物1h,并浓缩。加入乙酸乙酯,通过过滤去除不溶性材料。所得溶液在1mm径向色谱板上用5~10%甲醇/二氯甲烷洗脱进行色谱层析。含产物的部分在1mm径向色谱板上用50%乙酸乙酯的正己烷溶液洗脱来进一步纯化,然后用100%乙酸乙酯洗脱,给出12mg(21%)标题化合物(4)。分析uplc
‑
ms(beh c18通用方法):t
r
=1.85分钟。lc
‑
ms(esi):402.
[0403][0404]
(s)
‑3‑
氨基
‑2‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)
‑
n
‑
((s)
‑
1,2
‑
二噻烷
‑4‑
基)丙酰胺,三氟乙酸盐:在0℃向boc保护的胺(4,12mg)dcm(4.5ml)溶液加入三氟乙酸(0.5ml)。搅拌混合物2h,uplc
‑
ms分析显示转化为所需的胺。减压浓缩该反应混合物。加入干燥dcm,第二次浓缩该混合物为残留物。然后在干燥二氯甲烷中提取材料然后将该材料放入干燥的二氯甲烷中,在n2流(2x)下浓缩,然后在高真空中产生16.5mg的白色固体作为标题化合物的三氟乙酸盐(mla
‑
1tfa)。
[0405]
mla
‑
1是式ia的多重体接头组装化合物的示例。分析uplc
‑
ms(beh c18通用方法)::t
r
=0.92分钟。ms(esi+):302.
[0406]
实施例2
[0407][0408]
((2s)
‑1‑
((1,2
‑
二噻烷
‑4‑
基)氨基)
‑6‑
氨基
‑1‑
氧代己
‑2‑
基)氨基甲酸叔丁酯:2,5
‑
二氧代吡咯烷
‑1‑
基n6‑
(((9h
‑
芴
‑9‑
基)甲氧基)羰基)
‑
n2‑
(叔丁氧羰基)
‑
l
‑
赖氨酸(5,1.03g,1.82mmol),1,2
‑
二噻烷
‑4‑
胺(6,235mg,1.74mmol)根据lyon,r.p.等,nature biotechnol.(2014),32(10)1059
‑
1065的过程制备,dipea(0.61ml,3.48mmol)混合于无水dmf(4ml)中。在室温下搅拌反应混合物,用lcms监测。lcms在2小时后指示二硫化物的完全转化。真空除去溶剂,用硅胶色谱纯化粗产物(5%meoh的dcm溶液)以提供二硫化物中间体(9h
‑
芴
‑9‑
基)甲基叔丁基((5s)
‑6‑
((1,2
‑
二噻烷
‑4‑
基)氨基)
‑6‑
氧代己烷
‑
1,5
‑
二基)二氨基甲酸酯(7,652mg,1.11mmol,64.1%)lcms:t
r
=2.32分钟;m/z=608.05[m+na]
+
)。然后在30%二乙胺/dcm(4ml)中复溶该二硫化物中间体,在室温下再搅拌2h。2h后,真空去除溶剂,将粗产物复溶于dmso/水中,并通过制备hplc纯化以提供白色固体形式的标题化合物(8,462mg,1.00mmol,89.9%)。分析uplc
‑
ms(beh c18通用方法):t
r
=1.39分钟;m/z=386.07[m+na]
+
。
[0409]
实施例3
[0410][0411]
n
‑
((5r)
‑6‑
((1,2
‑
二噻烷
‑4‑
基)氨基)
‑5‑
氨基
‑6‑
氧代己基)
‑
2,5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71
‑
二十四氧杂七十四烷(tetracosaoxatetraheptacontan)
‑
74
‑
酰胺2,2,2
‑
三氟乙酸酯:将((2s)
‑1‑
((1,2
‑
二噻烷
‑4‑
基)氨基)
‑6‑
氨基
‑1‑
氧代己
‑2‑
基)氨基甲酸叔丁酯(8,102.2mg,0.281mmol)溶于无水dmf(3ml)(含dipea(98ul,0.562mmol))。然后加入白色固体peg
24
‑
osu(9,375.5mg,0.309mmol)。将反应混合物在室温下搅拌3小时。3h后,去除溶剂,通过硅胶色谱法纯化粗产物(5%meoh的dcm溶液)以提供二硫化物中间体化合物(10,295.2mg,0.202mmol,71.8%)。分析uplc
‑
ms(beh c18通用方法):t
r
=1.81分钟;m/z=1463.42[m+h]
+
。然后将化合物10(108mg,0.074mmol)复溶于10%tfa/dcm中,并在室温搅拌30分钟。30分钟后,去除溶剂,将粗产物形式的标题化合物(11)不经纯化直接用于下一步。分析uplc
‑
ms(beh c18通用方
法):t
r
=1.33分钟;m/z=1363.28[m+h]
+
。
[0412]
实施例4
[0413][0414]
n
‑
((5s)
‑6‑
((1,2
‑
二噻烷
‑4‑
基)氨基)
‑5‑
((s)
‑3‑
氨基
‑2‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酰氨基)
‑6‑
氧代己基)
‑
2,5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71
‑
二十四氧杂七十四烷
‑
74
‑
酰胺:将胺tfa盐(11,109mg,0.074mmol)溶于无水dmf(1ml)中,然后加入dipea(38.6μl,0.221mmol)。然后加入2,5
‑
二氧代吡咯烷
‑1‑
基(s)
‑3‑
((叔丁氧羰基)氨基)
‑2‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酸酯(12,25.3mg,0.066mmol)的无水dmf(0.1ml)溶液。将反应混合物在室温下搅拌2小时。2h后,用hoac(40μl)酸化反应,用dmso/水稀释,通过制备hplc纯化以提供马来酰亚胺中间体(13,101.1mg,0.062mmol,84.0%)。分析uplc
‑
ms(通用方法):t
r
=1.73分钟;m/z=1628.95[m+h]
+
。将化合物13(101.1mg,0.062mmol)复溶于10%tfa的dcm溶液中,并在室温搅拌90分钟。90分钟后,去除溶剂,将粗产物溶于dmso/水中,并通过制备hplc纯化以提供无色液体形式的标题化合物(14,79.1mg,0.048mmol,77.6%)。分析uplc
‑
ms(beh c18通用方法):t
r
=1.36分钟;m/z=1529.40[m+h]
+
。
[0415]
实施例5
[0416][0417]
双(2
‑
(1,2,5
‑
二硫氮杂庚环烷
‑5‑
甲酰胺基)乙基)氨基甲酸叔丁酯:将双(2
‑
氨基乙基)氨基甲酸叔丁酯(15,220mg,1.08mmol)和二(1h
‑
1,2,4
‑
三唑
‑1‑
基)甲酮(16,1.07g,6.49mmol)溶于dcm(10ml),然后加入三乙胺(0.30ml,2.16mmol)。将反应混合物在室温下搅拌30分钟。30分钟后,lcms指示二胺的完全转化。去除溶剂,通过硅胶色谱法纯化粗产物(0
‑
5%meoh的dcm溶液)以提供浅黄色固体形式的双(2
‑
(1h
‑
1,2,4
‑
三唑基
‑1‑
甲酰氨基)乙基)氨基甲酸叔丁酯(17,379.0mg,0.963mmol,89.0%)。分析uplc
‑
ms(behc18通用方法):t
r
=1.31分钟;m/z=394.22[m+h]
+
。将化合物17(201mg,0.511mmol)复溶于dmf(3ml),然后加入三甲胺(0.21ml,1.53mmol)和1,2,5
‑
二硫氮杂环庚烷(141.6mg,1.05mmol)。将反应化合物加热至45度持续5小时。5h后,将反应冷却至室温。在减压下去除溶剂,通过硅胶色谱法纯化粗产物(0
‑
7%meoh的dcm溶液)以提供浅黄色固体形式的标题双二硫化物化合物(19,233.3mg,0.444mmol86.8%)。分析uplc
‑
ms(beh c18通用方法):t
r
=1.91分钟;m/z=525.97[m+h]
+
。
[0418]
实施例6
[0419][0420]
n,n'
‑
(氮烷二基双(乙烷
‑
2,1
‑
二基))双(1,2,5
‑
二硫氮杂庚烷
‑5‑
甲酰胺)2,2,2
‑
三氟乙酸酯:将双(2
‑
(1,2,5
‑
二硫氮杂庚烷
‑5‑
甲酰胺基)乙基)氨基甲酸叔丁酯(19,135.2mg,0.257mmol)溶于20%tfa/dcm(3ml),在室温搅拌反应化合物1h。1h后,真空去除溶剂,将作为粗产物的标题化合物(20)直接用于下一步。分析uplc
‑
ms(beh c18通用方法):t
r
=1.17分钟;m/z=426.04[m+h]
+
。
[0421]
实施例7
[0422][0423]
将dbco
‑
peg5‑
酸(21,20.8mg,0.035mmol,broadpharm公司)溶于无水dmf(200μl)中,然后加入hatu(13.9mg,0.036mmol)和dipea(0.018ml,0.1mmol)。在室温下搅拌5分钟后,加入二硫化物胺盐(20,17.9mg,0.033mmol)在100μl dmf中的溶液。将反应混合物在室温下搅拌30分钟。30分钟后,将粗产物稀释于dmso/水中,通过制备hplc纯化以提供白色固体形式的dbco双
‑
二硫化物化合物(22,22.7mg,0.023mmol,68.1%)。分析uplc
‑
ms(beh c8通用方法):t
r
=2.00分钟;m/z=1004.18[m+h]
+
。
[0424]
实施例8
[0425][0426][0427]
将dbco
‑
双
‑
二硫化物化合物(22,50mm in dma,20μl,1.0μmol)溶于20μl 1:1dma/水中,然后加入dtpa(500mm,1.5μl),ph 8.0tris
‑
缓冲液(1m,6μl)和tcep(23,105mm,21μ
l)。将反应混合物加温至37度2h。2h后,lcms指示化合物22中的所有二硫键均被还原。然后加入实施例1的多重体接头组装化合物(mla
‑
1,200mm的dma溶液,35μl,7μmol),将反应温度保持在37度又30分钟。30分钟后,lcms指示起始材料的完全转化。将粗反应混合物稀释于dmso,通过制备hplc纯化以提供白色固体形式的dabco
‑
四双二硫化物化合物(24,1.18mg,0.442umol,44.2%)。分析uplc
‑
ms(beh c18疏水性方法):t
r
=1.00分钟;m/z=1107.51[m+h]
+
。化合物24是式ii的mla化合物的示例。
[0428]
实施例9
[0429][0430]
将叠氮基胺(25,2.26mg,10.3um,broadpharm公司)溶于dma(0.25ml),加入含马来酰亚胺
‑
osu(26,2.5mg,9.39um)的另一小瓶中。将反应在室温下搅拌30分钟。30分钟后,lcms指示化合物26被消耗,形成了所需的叠氮基
‑
马来西亚站化合物(27)。将溶液(37.6mm基于马来酰亚胺)不经进一步纯化直接用于与抗体半胱氨酸巯基或抗体的抗原结合片段(如实施例11所述)反应。分析uplc
‑
ms(beh c18通用方法):t
r
=1.26分钟;m/z=370.16[m+h]
+
。
[0431]
由抗体展示的叠氮官能团能够与实施例8的双二硫化物化合物(22)的应变炔基反应或与实施例9的四个二硫化物化合物(24)通过点击反应发生反应(例如c参见chio,t.i.和bane,s.l.,antibody dr conjugates:methods and protocols;method in molecular biology(抗体药物偶联物:方法与方案;分子生物学方法),tumey,l.n.(编),2002,第2078卷,第6章,springer nature出版社)。当使用实施例8中的mla和完全还原的抗体,抗体总共展示8
×
2个环状二硫化物,其能够提供总共32个巯基官能团用于药物部分的附接。使用实施例9的mla化合物时,抗体总共展示8
×
4个环状二硫化物,以提供总共64个巯基官能团用于药物部分的附接。
[0432][0433]
实施例10
[0434]
(s)
‑
n,n'
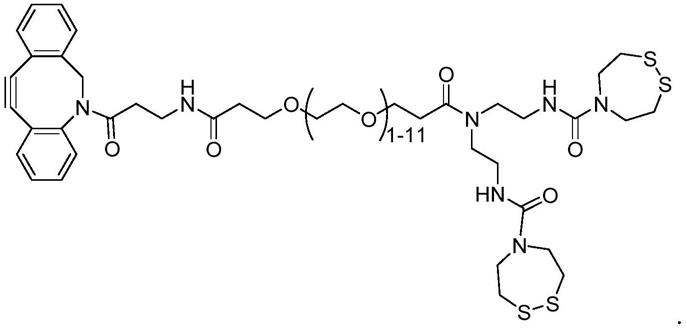
‑
(((2
‑
(3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酰氨基)丁烷
‑
1,4
‑
二基)双(硫烷二基))双(亚甲基))二乙酰胺。在小瓶中转入(s)
‑2‑
酰胺基丁烷
‑
1,4
‑
二巯基盐酸(28,200mg,1.15mmol)和n
‑
(羟甲基)乙酰胺(29,308mg,3.45mmol),并悬浮在水中
(0.6ml)。在冰水浴中冷却悬浮液,逐滴加入盐酸(11.7m,0.2ml,2.34mmol)。将反应缓慢升温至室温。搅拌过夜后,在45℃浓缩反应物以提供澄清半固体形式的中间体(s)
‑
n,n'
‑
(((2
‑
氨基丁烷
‑
1,4
‑
二基)双(硫烷二基))双
‑
(亚甲基))
‑
二乙酰胺盐酸盐(30)。分析uplc
‑
ms(beh c18通用方法):t
r
=0.57分钟,m/z(es+)计算值280.1(m+h)
+
,实验值280.0。在小瓶中合并化合物30(232mg,0.73mmol)和2,5
‑
二氧代吡咯烷
‑1‑
基3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)丙酸酯(26,391mg,1.47mmol),溶于dmf(2.5ml)中,并逐滴加入dipea(0.51ml,2.94mmol)。室温搅拌2h后,用乙酸(0.25ml)淬灭反应,用甲醇稀释,并通过制备hplc纯化,冻干至干燥提供标题化合物(31,42mg,13.3%)。分析uplc
‑
ms(通用方法):t
r
=0.89分钟,m/z(es+)计算值431.1(m+h)
+
,实验值431.1;计算值453.1(m+na)
+
,实验值453.0。
[0435]
实施例11
[0436]
抗体多重体药物偶联物的一般制备和分析表征。
[0437]
制备:以下提供由实施例1的式多重体接头组装化合物(mla
‑
1)制备式i
ab
的抗体多重体药物偶联物的方法。
[0438]
用过量还原剂处理人源化非结合对照igg1抗体以完全还原其链间二硫键,由此获得8个可及半胱氨酸残基,这些残基可用于与mla
‑
1的马来酰亚胺部分的michael加成反应(根据us2003/00883263的过程)。简而言之,对含有非结合抗体(5
‑
10mg/ml)的磷酸缓冲盐水(伴1mm乙二胺四乙酸(edta)),采用10当量三(2
‑
羧乙基)膦处理,以磷酸氢二钾中和至ph 7.4,在37℃孵育45分钟。采用尺寸排阻色谱在sephadex g25柱上实现对低分子量组分的分离。
[0439]
然后用过量mla
‑
1类似物根据us 2005/0238649的过程处理完全还原的抗体。简而言之,将mla
‑
1的dmso溶液加入完全还原的非结合抗体的pbs(含edta)和过量dmso溶液中,达到15%v/v的总反应共溶剂浓度。环境温度下30分钟后,在化合物中加入过量n
‑
乙酰半胱氨酸淬灭所有未反应的马来酰亚胺基团。采用sephadex g25树脂通过脱盐至pbs缓冲液纯化反应混合物。从人igg1抗体完全还原的链间二硫键和马来酰亚胺与所得半胱氨酸的反应,抗体的各轻链将具有单个马来酰亚胺修饰,各重链将包含三个马来酰亚胺修饰,其中mla
‑
1的马来酰亚胺部分已被转化为巯基取代的琥珀酰亚胺部分。由于mla
‑
1中
‑
ch2nh2取代基的存在,琥珀酰亚胺环将在mla单元的二硫键还原之前和/或之后经历式i
ab
偶联物中的自发水解,从而提供开环形式(如wo 2013/173337中更一般地描述)。
[0440]
分析表征:为简便起见,图1显示了mla
‑
1对抗体轻链之一的半胱氨酸残基的修饰。与mla
‑
1反应前,轻链的m/z为23152amu,与mla
‑
1反应后预期即刻提高至23476amu(参见分图a)。然后用tcep还原ab
‑
mla中间体8个mla单元的各环二硫键,以展示总共16个反应性巯基官能团。然后使这些巯基与用作仿药物部分前体的n
‑
乙基
‑
马来酰亚胺(nem)反应,采用如前所述的相同方式使抗体半胱氨酸巯基与mla
‑
1反应。其时,琥珀酰亚胺环将经历自发水解。然而,该水解可在nem反应之前发生,因图1中所显示的na
+
加成物将无差别地来自原初形成的马来酰亚胺ab
‑
mla加成物的开环形式,这归因于质谱仪分辨率不足。所得轻链偶联物中的两个仿nem药物部分已通过一个多重体连接组装单元的中介性共价附接于单个半胱氨酸巯基,该轻链偶联物预期显示23723amu的m/z(参见分图b)。分图b所表征的结构与式i
ab
的tm
‑
adc类似。
[0441]
实施例12
[0442]
奥瑞他汀巯基多重体抗体药物偶联物的制备和分析表征
[0443]
制备:奥瑞他汀巯基多重化抗体药物偶联物(cac10
‑
mla1
‑
d
m1
)的制备根据实施例11的一般性过程进行,在该过程中,未结合的对照抗体被cd30
‑
结合的嵌合抗体cac10替代,nem“仿”药物部分前体被具有如下结构的peg化奥瑞他汀药物部分(d
m1
)前体替代:
[0444][0445]
根据wo 2015/057699和wo 2016/149535的过程制备peg化奥瑞他汀药物部分前体。
[0446]
其他奥瑞他汀巯基多重化抗体药物偶联物(cac10
‑
mla1
‑
d
m2
)的制备根据实施例11中的一般性过程进行,该过程采用cac10和具有如下结构的亲水性奥瑞他汀药物部分前体:
[0447][0448]
根据wo 2015/123679的过程制备亲水性奥瑞他汀药物部分前体(d
m2
)。
[0449]
表征:基于实施例11mdl
‑
1的16加载奥瑞他汀adc的尺寸排阻层析(sec)显示高分子量物质(cac10
‑
mla1
‑
d
m1
和cac10
‑
mla1
‑
d
m2
为2%)的低百分比。
[0450]
plrp层析法(图2,分图a):l
‑
mla1
‑
d
m1
(2)t
r
=1.29分钟;h
‑
mla1
‑
d
m1
(6)t
r
=1.97分钟。各轻链和重链分别纳入1分子和3分子的peg化mla1
‑
d
m1
,从而各轻链偶联于总共两个奥瑞他汀药物单元,各重链偶联于总共6个peg化奥瑞他汀药物单元。附接于一分子mla
‑
1的cac10轻链的质谱示于图2的分图b中。附接于一分子peg化mla1
‑
d
m1
从而偶联两个奥瑞他汀药物单元的cac10轻链的质谱示于图2的分图c中。偶联三分子peg化mla1
‑
d
m1
从而偶联6个奥瑞他汀药物单元的cac10重链的质谱示于图2的分图d中。分图d中的多重峰归因于重链的g0、g1和g2寡糖形式。
[0451]
plrp层析法(图3,分图a):l
‑
mla1
‑
d
m2
(2)t
r
=0.33分钟;h
‑
mla1
‑
d
m2
(6)t
r
=1.00。附接于一分子亲水性mla1
‑
d
m1
从而偶联两个奥瑞他汀药物单元的cac10轻链的质谱示于图2的分图b中。偶联三分子亲水性mla1
‑
d
m2
从而偶联6个奥瑞他汀药物单元的cac10重链的质谱
示于图2的分图c中。分图c中的多重峰归因于重链的g0、g1和g2寡糖形式。
[0452]
实施例13
[0453]
吉西他滨药物部分的制备
[0454][0455]
(1
‑
((2r,4r,5r)
‑
3,3
‑
二氟
‑4‑
羟基
‑5‑
(羟甲基)
‑
四氢呋喃
‑2‑
基)
‑2‑
氧代
‑
1,2
‑
二氢嘧啶
‑4‑
基)氨基甲酸(9h
‑
芴
‑9‑
基)甲酯:将吉西他滨(32,782.6mg,2.973mmol)溶于无水吡啶(10ml)中。将tmscl(1.89ml,14.9mmol)经5分钟加入剧烈搅拌的反应中。搅拌反应15分钟,形成白色沉淀物。将fmoc
‑
cl(961.5mg,3.717mmol)一次性加入反应中。然后反应变黄,30分钟后变无色,在反应过程中持续存在白色沉淀物。加入h2o(2ml),搅拌反应2h以水解tms基团和过量氯甲酸酯。用etoac(100ml)稀释反应混合物,用1m hcl(3x100ml)洗涤,mgso4干燥,过滤并真空浓缩。通过急骤层析以100gkp
‑
sil 50
‑
100%etoac的hex溶液纯化粗标题化合物。r
f
(33)=0.15(1:2hex:etoac)。含有所需产品的部分真空浓缩以提供白色固体形式的标题化合物(33,1.169g,2.407mmol,80.9%).t
r
=1.71分钟(cortecs c18一般方法);ms(m/z)[m+h]
+
针对c
24
h
22 f2n3o6的计算值486.45,实验值486.12。
[0456][0457]
(2r,3s,4r,5r,6r)
‑2‑
(2
‑
(2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)(甲基)氨基)
‑
乙酰胺基)
‑4‑
(((((((2r,3r,5r)
‑5‑
(4
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
4,4
‑
二氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)甲基)(2
‑
(甲磺酰基)乙基)
‑
氨基甲酰基)氧基)甲基)苯氧基)
‑6‑
(甲氧基羰基)四氢
‑
2h
‑
吡喃
‑
3,4,5
‑
三基三乙酸酯。将mac接头中间体化合物(34,185mg,0.206mmol)溶于dcm(2ml)中,所述中间体以类似于wo 2015/095755和kolakowski,r.v.等angew.chem.int’l ed.(2016)55:7948
‑
7951所述的过程制备。加入多聚甲醛(185mg,6.18mmol),然后加入tmscl(1ml)。搅拌反应10分钟,此时通过将2ul等份加入98ul meoh中并通过uplc
‑
ms观察meoh加成物观察到完全转化。用针筒过滤器过滤反应物,以dcm(1ml)冲洗,加入甲苯(2ml)以在浓缩时共沸最终混合物。洗脱液真空浓缩以提供无色固体。fmoc
‑
吉西他滨(33)与甲苯共沸并在用前于高真空下干燥。将化合物33(100mg,0.206mmol)悬浮于无水dcm(2ml)中,加入dipea(71.8μl,0.412mmol)。将活化的接
头溶于无水dcm(2ml),并逐滴以10ml/h的速度加入搅拌的反应中。搅拌反应45分钟,此时观察到完全转化。用meoh(0.1ml)淬灭反应,过滤并真空浓缩洗脱液以提供无色固体形式的标题化合物,其不经纯化用于下一步(35,182mg,0.130mmol,粗物质,63%)。t
r
=1.56分钟(cortecs c18疏水性方法);ms(m/z)[m+h]
+
针对c
67
h
69
f2n6o
23
s的计算值1395.41,实验值1395.40。
[0458][0459]
(2r,3r,4r,5s,6r)
‑6‑
(4
‑
(((((((2r,3r,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
4,4
‑
二氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)甲基)(2
‑
(甲磺酰基)乙基)氨基甲酰基)
‑
氧基)甲基)
‑2‑
(2
‑
(甲基氨基)乙酰胺基)苯氧基)
‑
3,4,5
‑
三羟基三羟基四氢
‑
2h
‑
吡喃
‑2‑
羧酸:将化合物35(182mg,0.130mmol)溶于thf:meoh 1:1(2ml)。用冰/水浴冷却反应溶液,冷却后加入lioh(31.2mg,1.30mmol)。搅拌所得反应混合物30分钟,然后加入h2o(1ml)。然后搅拌反应60分钟。通过hplc
‑
ms测定脱保护化合物的完全转化。用acoh(30μl)淬灭反应化合物,真空浓缩,通过制备hplc用21.2x250mm max
‑
rp柱以梯度5
‑
35
‑
95%mecn的h2o 0.05%tfa溶液纯化。将含有所期望脱保护化合物的部分真空浓缩以提供无色固体形式的标题化合物(36,65.1mg,0.0803mmol,62%)。t
r
=0.82分钟(cortecs c18亲水性方法);ms(m/z)[m+h]
+
针对c
30
h
41 f2n6o
16
s的计算值811.23,实验值811.04。
[0460][0461]
(2r,3r,4r,5s,6r)
‑6‑
(4
‑
(((((((2r,3r,5r)
‑5‑
(4
‑
氨基
‑2‑
氧代嘧啶
‑
1(2h)
‑
基)
‑
4,4
‑
二氟
‑3‑
羟基四氢呋喃
‑2‑
基)甲氧基)甲基)(2
‑
(甲磺酰基)乙基)氨基甲酰基)氧基)
‑
甲基)
‑2‑
(2
‑
(3
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)
‑
n
‑
甲基丙酰胺基)乙酰胺基)
‑
苯氧基)
‑
3,4,5
‑
三羟基四氢
‑
2h
‑
吡喃
‑2‑
羧酸:将化合物36(65.1mg,0.0803mmol)溶于无水dmf(0.5ml)中。将dipea(26.5μl,0.160mmol)加入反应中,然后加入n
‑
琥珀酰亚胺基3
‑
马来酰亚胺基丙酸酯(26,23.5mg,0.0883mmol,购自tci美国产品号s0427)。搅拌反应15分钟,通过uplc
‑
ms观察到完全转化。用acoh(0.020ml)淬灭反应,通过制备hplc以5
‑
35
‑
95%mecn的h2o 0.05%tfa溶液洗脱在21.2x250mm max
‑
rp上进行纯化。冻干含有所需产品的部分以提供无色粉末形式的标题化合物(37,41.2mg,0.0428mmol,53.3%)。t
r
=1.29分钟(cortecs c18亲水性方法);ms(m/z)[m+h]
+
针对c
37
h
46 f2n7o
19
s的计算值962.25,实验值
962.06。
[0462]
采用奥瑞他汀tm
‑
adc制备部分中所述的方式处理mal化合物37和实施例11的ab
‑
mla中间体(其中人源化非结合对照igg1抗体被嵌合单克隆cac10替代)以提供吉西他滨tm
‑
adc类似物。
[0463]
虽然通过阐述和举例的方式详细描述了上述发明以进行清晰理解,但本发明技术人员应理解可在所附权利要求书范围内实施某些改变和修改。此外,本文提供的各参考文献通过引用全文纳入本文,就如同各参考文献单独通过引用纳入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1