脂质体增强腹腔内化学疗法的制作方法
1.本发明的领域涉及卵巢肿瘤和腹膜肿瘤的治疗。
背景技术:
2.2014年,美国新检测出的卵巢癌病例为21980例,而欧盟新检测出的卵巢癌病例为65697例。由于没有简单的筛查测试可用来检测卵巢癌,因此仅有15%卵巢癌女性患者表现出局部疾病。卵巢癌的治疗还面临着其他重大挑战,包括约有80%的卵巢癌患者在治疗期间产生了耐药性。
3.总体来说,自20世纪70年代以来,卵巢癌的护理标准基本保持不变。尽管常规的最佳手术和紫杉醇
‑
卡铂辅助化学疗法可以提高生生存率,但是70%接受这种治疗方案的患者在3年内复发。其他的治疗方案(包括:血管生成抑制剂贝伐单抗(bevacizumab)聚adp核糖聚合酶(“parp”)抑制剂(比如,奥拉帕尼(olaparib)芦卡帕尼(rucaparib)和尼拉帕利(niraparib)以及细胞减灭术(“crs”)外加辅助化学疗法(铂类联合紫杉醇)也未被证明具有长期可靠的成功性,并且不能避免降低生活质量的不良影响和高成本。因此,急需更多的卵巢癌疗法。
4.在所有的妇科癌症中,iii期卵巢癌的死亡率最高。治疗iii期卵巢癌的常规疗法是crs和6个周期的静脉内(“iv”)紫杉醇
‑
卡铂化学疗法或者3个周期iv化学疗法之后进行crs。但是,已经被证明的是:在腹腔内进行化疗能够比iv化学疗法更有效地提高腹膜表面的药物输送,并且能够通过消除显微镜下可见腹膜疾病来提高总生存期。事实上,腹膜表面是卵巢癌标准治疗之后疾病复发的主要部位,并且iv化学疗法和腹腔内化学疗法的联合治疗已经被证明能够在对iii期卵巢癌患者进行初次crs之后延长总体生存率。但是,与腹腔内进行化疗有关的腹膜导管相关问题提高了对患者的要求。特别是,肠胃和肾脏副作用妨碍了腹腔内装置的应用。
5.然而,根据三次多中心随机三期临床试验的结果,现在已经证明:腹腔内化学疗法优于标准的iv化学疗法以及小体积残留晚期上皮性卵巢癌的初级化疗管理。实施这种治疗及实现其临床实践的障碍似乎是毒性问题以及缺乏腹膜输液装置的专业技术知识。
6.dietrich等人在1978年发表的稿件介绍了一项理论建模研究,该研究支持检查腹膜内施用抗肿瘤药物作为卵巢癌的管理策略,表明腹膜腔中肿瘤可以暴露于局部治疗的细胞毒性药物浓度比采用全身用药所可能安全实现的暴露浓度高出1至数个对数。较早的一期临床研究证明:相比于全身疗法施用所能暴露的浓度,腹膜腔可暴露于浓度显著更高的具有已知活性的卵巢癌细胞毒性药剂浓度,例如:顺铂和卡铂高10至20倍浓度,紫杉醇高1000倍以上浓度。随后进行的大部分基于顺铂的二期临床试验显示,部分小体积残留卵巢癌患者在二线腹腔内化疗后达到手术记录的完全缓解,而所述同一患者在初次铂类化疗后并未达到这种临床状态。此外,腹腔内顺铂方案与总生存期中值从41个月提高至(versus)49个月的统计学显著改善(p=0.02)有关。
7.在一期研究中还试验了在腹腔内施用紫杉醇,其中剂量限制性毒性是腹痛。第二
次腹腔内紫杉醇试验表明,每周较低剂量方案的耐受性有所改善。在随后进行的三期研究中,对第二次剖腹探查术呈阳性且残留肿瘤节结小于0.5cm的女性进行了腹腔内紫杉醇(每周60mg/m2,共16周)治疗,61%的显微镜下可见残留患者达到了手术完全缓解。在31名患有肉眼可见残留癌的女性中,仅有一人达到了完全缓解。
8.在另一次三期试验中,研究了基于腹腔内施用顺铂的疗法和腹腔内施加紫杉醇,包括:第1天24小时内静脉施用紫杉醇(135mg/m2),第2天腹腔内施用顺铂(100mg/m2),以及第8天腹腔内施用紫杉醇(60mg/m2)。对照组和这项研究为标准的24小时iv紫杉醇(135mg/m2)输液和第2天iv顺铂(75mg/m2)输液。腹腔内治疗方案在统计学上非常显著地改善了无进展生存期(中值,从18.3个月提高至24个月;p=0.027)和总生存期(中值,从49.7个月提高至65.6个月;p=0.017)。但是,腹腔内方案与更高的毒性有关联,导致了骨髓抑制、呕吐、神经病和腹部不适。这项研究还包括正式的生活质量分析(为期12个月的跟踪调查)。该分析显示,尽管与全身给药相比,接受腹腔内疗法的患者短期内的生活质量下降幅度更大,但是两个治疗臀肌组之间的生活质量并无差异。
9.手术结束时进行腹腔内化疗可以避免大多数这些缺点,同时保持其优势。考虑到这点,在三期试验中评估了腹腔热灌注化疗(“hipec”),结果表明,在接受细胞减灭术(联合或不联合)的iii期卵巢癌患者的总生存期方面有优势。(van driel wj等人)在该试验中,以100mg/m2的剂量、1l/min的流速输入顺铂,并将灌入液加热至40℃。总体来看,hipec程序使crs手术总共增加了120分钟。
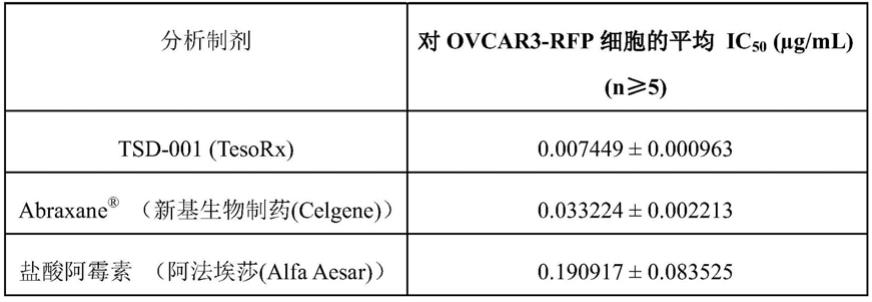
10.除了方便之外,手术中单个hipec程序的优势还包括总生存期为11.8个月,优于单独的crs外加新辅助静脉化疗。hipec对术后并发症发生率(3级或4级不良事件发生率)方面的安全性也几乎没有影响,并且手术+hipec组和手术组之间与健康相关的生活质量结果没有显著地不同。
11.鉴于hipec相对于其他卵巢癌标准治疗方案的优点,本公开描述了脂质体增强腹腔内化学疗法(“leipc”),其作为通过腹腔滴注法进行化疗的备选方法来治疗卵巢癌和腹膜癌(如腹膜假性粘液瘤)。leipc采用化疗药物(例如但不限于紫杉醇、多西他赛(docetaxel)和顺铂)的特殊脂质体制剂,以提高腹腔滴注化疗的渗透性和耐受性。与hipec和常规卵巢癌疗法相比,leipc的优点包括提高了无进展生存期和总成功率,同时缩短了患者在手术室的时间。与hipec相比,患者对leipc的耐受性更好,并且因为可以使用即用型密闭包装系统进行leipc滴注,所以无需与医学肿瘤学家或药剂师协调治疗。
技术实现要素:
12.本文所描述的发明涉及通过腹腔内施用化疗药物的脂质体制剂来治疗肿瘤。因此,在本发明的实施方案中,通过例如将脂质体制剂滴注到腹膜腔中向有需要的受试者的腹腔内施用一种化疗药物的脂质体制剂,以治疗肿瘤。在优选的实施方案中,本发明的方法和组合物用于治疗卵巢癌或原发性腹膜癌(比如,腹膜假粘液瘤(“pmp”))。
13.根据本发明施用的化疗药物的脂质体制剂通常是通过水合化疗药物和一种或多种脂质组分的前体脂质体粉末分散体来制备的,如美国专利申请系列号16/066,836和16/348,801以及它们各自相应的pct申请wo 2018/089759和wo 2017/120586中所述,这些申请的全部内容并入本发明中。相对于常规化学疗法,本发明的脂质体制剂的优点包括提高了
滴注后的驻留时间,并改善了化疗药物向肿瘤目标的输送。
14.在各种实施方案中,本发明所述的脂质体包括化疗剂(例如,紫杉烷或铂药物)、第一磷脂组分和第二磷脂组分。在本发明的一个优选实施方案中,所述脂质体制剂包括紫杉醇、dmpg和dmpc,其w/w/w比为(1):(1.43):(0.567),在本文应理解为还包括上述比例的近似值,例如包括(1):(1.4):(1.6)或(1):(1.4):(1.567)。
15.本发明的方法和组合物还可以适用于试剂盒,所述试剂盒例如可以采取封闭包装系统的形式,其降低了与常规化疗输送方案相关联的复杂性和人员要求。
附图说明
16.图1a
‑
c分别示出了三次分析的结果,以确定tsd
‑
001紫杉醇脂质体制剂(pac(紫杉醇):dmpc:dmpg=1:1.43:0.567)在72小时中对培养的ovcar rfp卵巢癌细胞系的剂量曲线和ic
50
剂量。图1a
‑
c中分析的平均ic
50
剂量=7.449
×
10
‑3±
9.63
×
10
‑4μg/ml;
17.图1a示出了tsd
‑
001紫杉醇脂质体制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=3个孔/测试浓度;72小时的ic
50
=6.327
×
10
‑3μg/ml);
18.图1b示出了tsd
‑
001紫杉醇脂质体制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=3个孔/测试浓度;72小时的ic
50
=6.802
×
10
‑3μg/ml);
19.图1c示出了tsd
‑
001紫杉醇脂质体制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=4个孔/测试浓度;72小时的ic
50
=7.553
×
10
‑3μg/ml);
20.图2a
‑
c分别示出了三次分析的结果,以确定紫杉醇制剂(纳米颗粒白蛋白结合紫杉醇)在72小时中对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线和ic
50
剂量。图2a
‑
c中分析的平均ic50剂量=3.322
×
10
‑2±
2.21.
×
10
‑3μg/ml;
21.图2a示出了紫杉醇制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=3个孔/测试浓度;72小时的ic
50
=3.36
×
10
‑2μg/ml);
22.图2b示出了紫杉醇制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=4个孔/测试浓度;72小时的ic
50
=3.308
×
10
‑2μg/ml);
23.图2c示出了紫杉醇制剂对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=4个孔/测试浓度;72小时的ic
50
=3.301
×
10
‑2μg/ml);
24.图3a
‑
c分别示出了三次分析的结果,以确定盐酸阿霉素在72小时中对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线和ic
50
剂量。图3a
‑
c中分析的平均ic
50
剂量=1.910
×
10
‑1±
8.353
×
10
‑2μg/ml;
25.图3a示出了盐酸阿霉素对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=3个孔/测试浓度;72小时的ic
50
=1.703
×
10
‑1μg/ml);
26.图3b示出了盐酸阿霉素对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=3个孔/测试浓度;72小时的ic
50
=1.322
×
10
‑1μg/ml);
27.图3c示出了盐酸阿霉素对培养的ovcar
‑
rfp卵巢癌细胞系的剂量曲线。(n=4个孔/测试浓度;72小时的ic
50
=1.66
×
10
‑1μg/ml)。
具体实施方式
28.本文所描述的发明涉及通过腹腔内施用化疗药物的脂质体制剂来治疗肿瘤。因此,本发明涉及化疗药物的脂质体制剂通过使肿瘤细胞与脂质体制剂接触来治疗肿瘤的方法和用途,所述脂质体制剂通过腹腔内给药来施用。因此,在本发明的实施方案中,化疗药物的脂质体制剂是通过腹腔内给药的方式施用给有需要的受试者用于治疗肿瘤。在这些实施方案中,施用的脂质体制剂含有有效量的化疗药物,所述化疗药物与肿瘤接触足够长的时间,从而治疗肿瘤。
29.赘生物。赘生物是由异常生长的细胞组成的组织。因此,肿瘤疾病的特征在于导致赘生物产生的异常且不受控制的细胞生长。术语“赘生物(neoplasm)”与术语“肿瘤”同义。患有肿瘤疾病的个体被定义为具有至少一种赘生物。赘生物可以是良性的或恶性的。良性肿瘤作为分离的团块限于局部位置。恶性肿瘤是转移性的,即它可以通过血液和淋巴系统等扩散到身体的其他部位。存在一种系统可以根据恶性程度(1级(轻度恶性)至4级(高度恶性))来划分恶性组织。术语“恶性肿瘤”与术语“癌症”等(比如,“癌性肿瘤”)同义。
30.在优选的实施方案中,本发明的方法可用于治疗卵巢癌。卵巢癌的实例包括但不限于:上皮性卵巢癌、恶性性索间质肿瘤(malignant sex cord
‑
stromal tumor)、恶性生殖细胞肿瘤、卵巢低度恶性(lmp)肿瘤和输卵管癌。因此,本发明的方法可用于治疗上皮性卵巢癌、恶性性索间质肿瘤、恶性生殖细胞肿瘤、卵巢低度恶性(lmp)肿瘤或输卵管癌。
31.在其它优选的实施方案中,本发明的方法可用于治疗腹膜癌,其也可称为“原发性腹膜癌”。腹膜癌的实例包括但不限于卵巢癌、结直肠癌、阑尾癌、胃癌、胰腺癌、腹膜间皮瘤、粘液性腺癌和腹膜假粘液瘤(“pmp”,一种癌症形式,其特征是肿瘤细胞分泌的粘蛋白在腹膜腔中过度积聚)。因此,本发明的方法可用于治疗卵巢癌症、结直肠癌、阑尾癌、胃癌、胰腺癌、腹膜间皮瘤、粘液性腺癌或pmp。
32.实际上,在一个优选的实施方案中,本发明的方法治疗pmp。腹膜假粘液瘤(pmp)是一种癌症,其特征在于,由肿瘤细胞分泌的粘蛋白在腹膜腔中过度积聚。pmp肿瘤细胞主要来源于阑尾,但是,结肠、直肠、胃、胆囊、小肠、膀胱、肺、乳腺、胰腺和卵巢的播散性癌症也可能导致该疾病。分泌的粘液性团块在腹腔内积聚,导致消化道内压增加,这与营养不良导致的显著发病率和死亡率相关联。
33.脂质体制剂。根据本发明所施用的化疗药物的脂质体制剂通常按以下方式制备:将化疗药物和一种或多种脂质组分的前体脂质体粉末分散体进行水合,如美国专利申请系列号16/066,836和16/348,801以及它们各自相应的pct申请wo 2018/089759和wo 2017/120586中所述,这些申请的全部内容并入本发明中。
34.本发明所述的化疗药物是可以被配制成由磷脂分子和任选胆固醇组成的脂质体的任意试剂(例如,小分子化合物)。磷脂是具有两个主要部分(由有机分子的磷酸盐组成的亲水性头部部分和一个或多个疏水性脂肪酸尾部)的分子。天然存在的磷脂通常具有由胆碱、甘油和磷酸盐组成的亲水部分和由脂肪酸组成的两个疏水部分。当将磷脂置于水性环境中时,亲水性头部以线性构型聚集在一起,而疏水性尾部基本上彼此平行对齐。然后,由于疏水性尾部试图避开水性环境,第二行分子与第一行分子尾尾(tail
‑
to
‑
tail)对齐。为了最大程度地避免在例如双分子层边缘处与水性环境接触,而同时将表面积与体积之比最大程度地最小化,并且保持最低能量构象,则被称为磷脂双分子层或片层的两行磷脂会聚
成脂质体。在此过程中,脂质体将水介质以及可能溶解或悬浮在其中的任何物质截留在球体的核心中。
35.可应用于本发明包含化疗药物的脂质体制剂的磷脂实例包括但不限于:二硬脂酰磷脂酰胆碱(dspc)、二棕榈酰磷脂酰胆碱(dppc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、卵磷脂酰胆碱(卵
‑
pc)、大豆磷脂酰胆碱(大豆
‑
pc)、二肉豆蔻酰磷脂酰甘油钠(dmpg)、1,2
‑
二肉豆蔻酰
‑
磷脂酸(dmpa)、二棕榈酰磷脂酰甘油(dppg)、二棕榈酰磷酸盐(dpp)、1,2
‑
二硬脂酰
‑
sn
‑
甘油
‑3‑
磷
‑
rac
‑
甘油(1,2
‑
distearoyl
‑
sn
‑
glycero
‑3‑
phospho
‑
rac
‑
glycerol)(dspg)、1,2
‑
二硬脂酰
‑
sn
‑
甘油
‑3‑
磷脂酸(dsgpa)、磷脂酰丝氨酸(ps)、鞘磷脂(sm)或任何上述磷脂的组合。
36.本发明所述的脂质体典型地但并非必须地含有第一和第二磷脂。例如,在本发明的优选实施方案中,脂质体含有:(a)化疗剂;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。例如,本发明的优选脂质体制剂可以含有上述组分(a)、(b)和(c),其重量/重量/重量(“w/w”)比范围(a):(b):(c)为(1):(1.3
–
4.5):(0.2
–
1.5),或其中的任何比例。因此,在各种实施方案中,w/w比(a):(b):(c)可以是(1):(1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4或4.5):(0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4或1.5),或其中的任何比例。
37.在本发明的其他优选实施方案中,除了含有:(a)化疗剂;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg,脂质体还含有组分(d),即胆固醇。例如,在其他的优选实施方案中,本发明的脂质体制剂可以含有上述组分(a)、(b)、(c)和(d),(a):(b):(c):(d)的w/w比的范围为(1):(1
‑
4.5):(0.1
‑
2.5):(0.1
‑
2.0),或其中的任何比例。因此,在各种实施方案中,(a):(b):(c):(d)的w/w比可以为(1):(1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4或4.5):(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5):(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0),或其中的任何比例。
38.在本发明的各种实施方案中,施用的脂质体配制的化疗药物是紫杉烷药剂,例如但不限于:紫杉醇、多西他赛、卡巴他赛(cabazitaxel)、替西他赛(tesetaxel)、dj
‑
927、tpi 287、拉洛他赛(larotaxel)、奥他赛(ortataxel)和dha
‑
紫杉醇。在本发明的优选实施方案中,脂质体含有(a)紫杉烷药剂;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。
39.本发明的紫杉醇脂质体制剂的优选实施方案含有:(a)紫杉醇;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。例如,本发明的脂质体制剂可以含有上述组分(a)、(b)和(c),(a):(b):(c)的w/w比的范围为(1):(1.3
‑
3.8):(0.2
–
1.5),或其中的任何比例。因此,在各种实施方案中,(a):(b):(c)的w/w比可以是(1):(1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7或3.8):(0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4或1.5),或其中的任何比例。此类紫杉醇制剂的实例包括但不限于(a):(b):(c)的w/w比为(1):(3.15):(1);(1):(3.20):(1.05);(1):(3.25):(1.10);并且在特别优选的实施方案中,为(1):(1.43):(0.567)。也可以用四舍五入的比例来描述,例如,(1):(1.4):(1.6)或(1):(1.4):(1.567)。
40.本发明的多西他赛脂质体制剂的优选实施方案含有:(a)多西他赛;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。例如,本发明的脂质体制剂可以含有上述组分(a)、(b)和(c),(a):(b):(c)的w/w比的范围为(1):(1
–
2):(0.2
–
0.7),或其中的任何比例。因此,在各种实施方案中,重量比(a):(b):(c)可以是(1):(1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0):(0.2、0.3、0.4、0.5、0.6或0.7),或其中的任何比例。此类紫杉醇制剂的实例包括但不限于(a):(b):(c)的w/w比为(1):(3.15):(1);(1):(3.20):(1.05);(1):(3.25):(1.10);并且在特别优选的实施方案中,(1):(1.43):(0.567)。
41.在本发明的各种其他实施方案中,施用的脂质体配制的化疗药物是铂类药物(通常称为“铂药物”),例如但不限于顺铂(顺铂是顺
‑
二氯二氨合铂(ii)的通用名称)和卡铂。在本发明的优选实施方案中,脂质体含有(a)铂药物;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。例如,本发明的脂质体制剂可以含有上述组分(a)、(b)和(c),(a):(b):(c)的w/w比的范围为(1):(2.5
‑
4.5):(1
–
2.5),或其中的任何比例。因此,在各种实施方案中,(a):(b):(c)的w/w比可以是(1):(2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4或4.5):(1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5),或其中的任何比例。
42.本发明的顺铂脂质体制剂的优选实施方案含有:(a)顺铂;(b)第一磷脂dmpc;以及(c)第二磷脂dmpg。因此,本发明的脂质体制剂可以含有上述组分(a)、(b)和(c),(a):(b):(c)的w/w比为(1):(2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4或4.5):(1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5),或其中的任何比例。此类顺铂制剂的实例包括但不限于(a):(b):(c)的w/w比为(1):(2.7):(1.2);或(1):(2.75):(1.21);或(1):(2.76):(1.22);或(1):(2.77):(1.2);或(1):(2.78):(1.22);或其中所含的任何比例。
43.本发明的顺铂脂质体制剂的其他优选实施方案含有:(a)顺铂;(b)第一磷脂dmpc;(c)第二磷脂dmpg;以及(d)胆固醇。例如,本发明的脂质体制剂可以含有上述组分(a)、(b)、(c)和(d),(a):(b):(c):(d)的w/w比为(1):(2.5
‑
4.5):(1
‑
2.5):(0.5
–
1),或其中的任何比例。因此,本发明的脂质体制剂可以含有上述组分(a)、(b)、(c)和(d),(a):(b):(c):(d)的w/w比为(1):(2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4或4.5):(1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5):(0.5、0.6、0.7、0.8、0.9或1.0),或其中的任何比例。此类顺铂制剂的实例包括但不限于(a):(b):(c):(d)的w/w比为(1):(2.7):(1.2):(0.6);或(1):(2.75):(1.21):(0.65);或(1):(2.76):(1.22):(0.7);或(1):(2.77):(1.2):(0.75);或(1):(2.78):(1.22):(0.8);或(1):(2.78):(1.22):(0.9);或其中所含的任何比例。
44.本发明所述的脂质体制剂还可以包括至少一种药学上可接受的赋形剂。示例性的药学上可接受的赋形剂包括:冷冻保护剂,比如甘露醇、淀粉、乳糖(例如乳糖一水合物)、蔗糖、葡萄糖、海藻糖和硅酸。
45.滴注
46.本发明的脂质体制剂用于腹腔内施用,并且可以通过本领域常规使用的方法给药,以滴注到腹膜腔中。这可以在手术中进行,无论该手术是开放性手术还是腹腔镜腹部手术。脂质体制剂可以在高温、常温或等温条件下进行滴注,这些条件是给药临床医生基于本
领域对这些条件的常规定义认为合适的条件。
47.例如,含有本发明组合物的溶液的给药可以包括:(a)插入导管(比如,坦基霍夫(tenckhoff)导管或类似装置)穿过腹壁,直到其出口位于腹膜腔中治疗外科医生确定的适当位置;(b)滴注适当体积的含有待施用组合物的适当流体,滴注浓度可以由主治临床医生来确定;以及(c)使滴注的脂质体制剂在其中驻留至少15分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时或任何时长。在本发明的某些实施方案中,在细胞减灭术(crs)后将脂质体制剂滴注到受试者体内,以去除例如大于约5.0mm宽的肿瘤或结节。在crs后,可将患者从手术室带到麻醉后恢复室(“pacu”),夹好腹腔内导管,准备进行滴注步骤。腹腔内驻留时间结束后,打开腹腔内导管,脂质体制剂通过重力引流从腹膜腔中排出。
48.有效量
49.根据本文所描述的发明,化疗药物或带有化疗药物的脂质体制剂的有效量通常是这样的:其能够在一定程度上表现出治疗效果,例如改善所治疗的疾病、紊乱或病症。换句话说,施用给受试者的本发明脂质体制剂的有效量含有足够剂量的化疗药物,以对受试者的肿瘤具有抗增殖治疗作用。在本发明的一个实施方案中,通过腹腔内给药的方式施用脂质体制剂而输送的化疗药物穿透腹膜的深度为腹膜下4或5层以上的细胞层,以到达肿瘤细胞,停留深度为表面下2.5mm。
50.在一些实施方案中,本文所述的脂质体制剂的有效量可以是足以对癌细胞或肿瘤产生所需结果的剂量,包括但不限于例如:抑制转移、减小肿瘤大小、减小肿瘤体积、减少实体瘤的血管形成、减少或消除肿瘤复发、减少肿瘤生长复发或减少受试者体内癌细胞的数量。在某些实施方案中,本发明所述脂质体制剂的有效量可以是所含化疗药物的剂量能够使肿瘤缩小或抑制百分比为大于约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约99%或约100%的剂量。肿瘤的缩小可以通过本领域已知的多种方法来确定,例如,将肿瘤从受试者身上取出,并使用例如卡尺测量肿瘤的尺寸,或者采用成像技术(例如,超声波、计算机断层扫描(ct)或磁共振成像(mri)扫描),测量体内肿瘤的尺寸。
51.关于卵巢癌,细胞标记物,癌抗原125(“ca
‑
125”)是卵巢癌检测中最常用的生物标记物。(nossov等人)事实上,约90%女性晚期卵巢癌患者血清中ca
‑
125的水平升高,使得ca
‑
125成为症状发作后检测卵巢癌的有用工具。(gupta d等人)因此,监测ca
‑
125血清水平对于确定卵巢癌如何响应治疗(无病生存期与ca
‑
125下降率相关)以及预测患者治疗后的预后也很有用。(bast rc等人以及p等人)。因此,在本发明的一些实施方案中,相对于治疗前基线ca
‑
125水平,本发明腹腔内施用的脂质体制剂的有效量和与小于20天的ca
‑
125半衰期相关联的剂量相关。
52.此外,本文所述的脂质体制剂或化疗药物的有效量将根据所治疗的受试者而变化。事实上,针对任何特定受试者的特定治疗有效量水平将取决于多种因素,包括:所治疗的肿瘤和肿瘤疾病的严重程度;所采用的特定化疗药物的活性;所采用的具体成分;患者的年龄、体重、总体健康状况、性别及饮食情况;给药时间;治疗的持续时间;与所采用的特定化疗药物联用或同时使用的药物;以及医学领域公知的类似因素。
53.本文所述脂质体制剂的腹腔内给药可以作为单个事件、周期性事件或在治疗的时间进程中发生。例如,脂质体制剂可以每周施用一次,持续2周、3周、4周、5周、6周、7周、8周、
9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周或20周。作为另一个实例,脂质体制剂可以每1
‑
9周、每2
‑
9周、每3
‑
9周、每4
‑
9周、每5
‑
9周、每6
‑
9周、每7
‑
9周、每8
‑
9周、每2周、每3、每4周、每5周、每6周、每7周、每8周或每9周施用一次。普通技术人员,诸如临床医生,应当理解的是,这些方案是示例性的,并且可以设计其他合适的周期性方案。例如,本发明所述的脂质体制剂可以在本发明所述的最后一次治疗1个月、2个月、3个月、4个月、5个月、6个月、7个月或8个月后施用。
54.试剂盒
55.本发明所述液体或粉末形式的脂质体制剂可以在适于通过腹腔滴注法输送本文所述脂质体制剂的试剂盒中提供。所述试剂盒可以是封闭包装系统的形式,其包括脂质体制剂和腹腔内导管,并且在某些实施方案中,包括给药说明书。当作为试剂盒提供时,试剂可以在单独的容器中提供,例如,无菌水或盐水,用于添加到单独包装的冻干或其它类型的前体脂质体形式的脂质体制剂组分中。例如,密封的玻璃安瓿可能装有冻干组分,并且在单独的安瓿中装有无菌水、无菌盐水或无菌溶液,其中每一种是已经包装好的,并且均是在中性非反应气体(比如,氮气)下进行包装的。安瓿可以由任何合适的材料组成,比如,玻璃、有机聚合物(比如,聚碳酸酯、聚苯乙烯)、陶瓷、金属或任何其他通常用于盛装试剂的材料。合适容器的其他实例包括:由与安瓿类似的物质制成的瓶子以及由金属箔衬里(如铝或合金)组成的包袋。其他容器包括试管、小瓶、烧瓶、瓶子、注射器等。容器可具有无菌入口,比如瓶塞可被皮下注射针刺穿的瓶子。其他容器可以有两个隔室,这两个隔室由一个易移除的隔膜分隔开,该隔膜在被移除时可使组分混合。可移除的隔膜可以是玻璃、塑料、橡胶等。在某些实施方案中,试剂盒也可以与说明书材料一起提供。说明书可以打印在纸张或其他基材上,也可以作为电子可读介质提供。详细的说明书可能与试剂盒没有物理联系。相反,可以将用户引导至由试剂盒制造商或经销商指定的互联网网站。
56.实施例
57.实施例1。tsd
‑
001处理的人卵巢癌细胞中紫杉醇ic
50
的测定。采用基于磺酰罗丹明b(srb)分析法来测定紫杉醇对于ovcar3
‑
rfp人卵巢癌细胞(抗癌公司(anticancer inc.))的抑制浓度(ic
50
),使用tsd
‑
001脂质体制剂(紫杉醇:dmpc:dmpg=1:1.43:0.567)对ovcar3
‑
rfp人卵巢癌细胞进行处理。为了用于分析,将冻干的tsd
‑
001与无菌注射级水重新配制,使浓度为6mg/ml,然后在rpmi细胞培养基(含l
‑
谷氨酰胺的rpmi
‑
1640,corning公司)中连续稀释。进行了三次独立的剂量曲线分析。在其中两次分析中,tsd
‑
001的系列稀释液浓度在0.05μg/ml至0.391ng/ml之间,在第三次分析中,tsd
‑
001的系列稀释液浓度在0.0128μg/ml至2.147ng/ml之间。
58.还制备了紫杉醇制剂(纳米粒白蛋白结合的紫杉醇)和盐酸阿霉素的系列稀释液,以在ovcar3
‑
rfp细胞中进行对比剂量曲线分析。为了这些分析,将冻干的溶解于rpmi培养基中至浓度为1mg/ml,将盐酸阿霉素溶解于少量的dmso中,并在rpmi培养基中稀释至浓度为1mg/ml。对进行三次独立的剂量曲线分析。在一次分析中,的系列稀释液浓度在0.04μg/ml至0.078ng/ml之间。在第二次分析中,的系列稀释液浓度在0.04μg/ml至8.39ng/ml之间,而在第三次分析中,的系列稀释液浓度在0.032μg/ml至8.39ng/ml之间。还对盐酸阿霉素进行了三
ovarian cancer(clinical follow
‑
up and prognostic studies)]“.orvosi hetilap(in hungarian).134(17):915
‑
8.pmid 8479736.
68.gupta d,lis cg(2010).
″
pretreatment serum albumin as a predictor of cancer survival:a systematic review of the epidemiological literature
″
.nutrition journal.9:69.doi:10.1186/1475
‑
2891
‑9‑
69.pmc 3019132 freely accessible,pmid 21176210.
69.nossov v,amneus m,su f,lang j,janco jm,reddy st,farias
‑
eisner r(sep 2008).
″
the early detection of ovarian cancer:from traditional methods to proteomics,can we really do better than serum ca
‑
125?
″
.american journal of obstetrics and gynecology,199(3):215
‑
23.
70.willemien j.van driel,et al.
″
hyperthermic intraperitoneal chemotherapy in ovarian cancer
″
.new eng.j,of med.378:230
‑
240.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1