抗GPC3嵌合抗原受体(CAR)与反式共刺激分子的组合及其治疗用途的制作方法
相关申请
本申请要求于2018年11月7日提交的美国临时申请号62/756,683的申请日的权益。先前申请的全部内容以引用的方式并入本文。
发明背景
癌症免疫疗法(包括基于细胞的疗法)用于激发攻击肿瘤细胞的免疫反应,同时保留正常组织。这是治疗各种类型癌症的有前途的选择,因为它有可能逃避耐药性的遗传和细胞机制,并在保留正常组织的同时靶向肿瘤细胞。
基于细胞的疗法可能涉及具有反应性偏向癌细胞的细胞毒性t细胞。eshhar等人,proc.natl.acad.sci.u.s.a.;1993;90(2):720-724;geiger等人,jimmunol.1999;162(10):5931-5939;brentjens等人,nat.med.2003;9(3):279-286;cooper等人,blood.2003;101(4):1637-1644;以及imai等人,leukemia.2004;18:676-684。一种方法是表达嵌合受体,其具有与一个或多个t细胞活化信号传导结构域融合的抗原结合结构域。癌症抗原经由抗原结合结构域的结合导致t细胞活化并触发细胞毒性。在临床试验中已证明表达嵌合受体的自体t淋巴细胞在治疗b细胞前体急性淋巴细胞白血病(all)中的功效。pule等人,nat.med.2008;14(11):1264-1270;porter等人,nengljmed;2011;25;365(8):725-733;brentjens等人,blood.2011;118(18):4817-4828;till等人,blood.2012;119(17):3940-3950;kochenderfer等人,blood.2012;119(12):2709-2720;以及brentjens等人,scitranslmed.2013;5(177):177ra138。
对开发新的策略以增强基于细胞的免疫疗法的功效有极大的兴趣。
技术实现要素:
本公开基于对共表达共刺激多肽和抗gpc3嵌合抗原受体(car)以用于基于细胞的免疫疗法(即,表达两个单独的多肽)的策略的开发。共刺激途径的调节可通过在造血细胞(例如,造血干细胞、免疫细胞诸如t细胞或自然杀伤细胞)中表达(例如,过度表达)一种或多种共刺激多肽(诸如本文所述的那些)来实现。在一些情况下,预期共表达一种或多种共刺激多肽和抗gpc3car的造血细胞表现出优越的生物活性,例如细胞增殖、活化(例如,增加的细胞因子产生,例如il-2或ifn-γ产生)、细胞毒性和/或体内抗肿瘤活性。
因此,本文提供了修饰的(例如,基因修饰的)造血细胞(例如,造血干细胞、免疫细胞诸如t细胞或自然杀伤细胞),其相对于相同类型的野生型造血细胞具有调节共刺激途径的能力。在一些情况下,修饰的造血细胞可以表达或过度表达共刺激多肽。共刺激多肽可以是b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体。b7/cd28超家族的示例性成员或其配体包括但不限于cd28、cd80、cd86、icos、icosl、b7-h3、b7-h4、vista、tmigd2、b7-h6、b7-h7及其变体。tnf超家族的示例性成员或其配体包括但不限于4-1bb、4-1bbl、baff、baffr、cd27、cd70、cd30、cd30l、cd40、cd40l、dr3、gitr、gitrl、hvem、light、tnf-β、ox40、ox40l、relt、taci、tl1a、tnf-α和tnfrii。另外的实例包括bcma、edar2、troy、ltbr、edar、ngfr、opg、rank、dcr3、tnfr1、fn14(tweakr)、april、eda-a2、tweak、ltb(tnf-c)、ngf、eda-a1、淀粉样前体蛋白(app)、trail。
在一些实施方案中,b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体是野生型序列。在一些实施方案中,b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体是变异序列(即,与野生型序列相比,包含一个或多个插入、缺失或突变)。例如,4-1bbl可以是4-1bblq89a、4-1bbll115a、4-1bblk127a或4-1bblq227a。在一些实施方案中,b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体可能缺乏胞质结构域。在一个示例性实施方案中,4-1bbl缺乏胞质结构域。在一些实施方案中,tnf超家族成员或其配体不是4-1bbl。
在一些实施方案中,与本文所述的任何抗gpc3car共表达的共刺激多肽不含任何f506结合蛋白(fkbp),诸如fkbpv36。在一些实例中,共刺激多肽不含源自myd88的信号传导结构域。
修饰的造血细胞可进一步表达抗gpc3car,其可以包含(a)细胞外抗原结合结构域,其中细胞外结合结构域结合gpc3;(b)跨膜结构域;及(c)胞质信号传导结构域。在一些实例中,(c)位于抗gpc3car的c端。在一些情况下,抗gpc3car可进一步包含至少一个共刺激信号传导结构域。在其它情况下,抗gpc3car可不含共刺激信号传导结构域。
在一些实例中,(a)的细胞外抗原结合结构域是对gpc3具有特异性(即结合)的单链抗体片段。
在一些实施方案中,在任何car多肽中(b)的跨膜结构域可以是单程膜蛋白的,例如,cd8α、cd8β、4-1bb、cd28、cd34、cd4、fceriγ、cd16a、ox40、cd3ζ、cd3ε、cd3γ、cd3δ、tcrα、cd32、cd64、vegfr2、fas和fgfr2b。或者,(b)的跨膜结构域可以是非天然存在的疏水蛋白区段。
在一些实施方案中,如果适用,本文所述的car多肽的至少一个共刺激信号传导结构域可以是共刺激分子的,其可以是4-1bb、cd28、cd28ll→gg变体、ox40、icos、cd27、gitr、icos、hvem、tim1、lfa1和cd2。在一些实例中,所述至少一个共刺激信号传导结构域是cd28共刺激信号传导结构域或4-1bb共刺激信号传导结构域。在一些情况下,car多肽可以包含两个共刺激信号传导结构域。在一些情况下,共刺激信号传导结构域之一是cd28共刺激信号传导结构域;且另一个共刺激结构域可以是4-1bb共刺激信号传导结构域、ox40共刺激信号传导结构域、cd27共刺激信号传导结构域或icos共刺激信号传导结构域。特定实例包括但不限于cd28和4-1bb;或cd28ll→gg变体和4-1bb。
在一些实施方案中,在本文所述的任何car多肽中(c)的胞质信号传导结构域可以是cd3ζ或fcεr1γ的胞质结构域。
在一些实施方案中,当适用时,本文所述的任何car多肽的铰链结构域可以是cd28、cd16a、cd8α,或igg的。在其它实例中,铰链结构域是非天然存在的肽。例如,非天然存在的肽可以是延伸的重组多肽(xten)或(gly4ser)n多肽,其中n是3-12的整数,包含端点。在一些实例中,铰链结构域是短区段,其可以含有至多60个氨基酸残基。
在特定实例中,car多肽包含(i)cd28共刺激结构域或4-1bb共刺激结构域;和(ii)cd28跨膜结构域、cd28铰链结构域或其组合。在一些实施方案中,car多肽包含(i)cd28共刺激结构域或4-1bb共刺激结构域;和(ii)cd8跨膜结构域、cd8铰链结构域或其组合。例如,car多肽可以包含seqidno:1或seqidno:2的氨基酸序列。
在一些实施方案中,基因工程改造的造血细胞共表达car多肽和共刺激多肽。在一些实施方案中,car多肽包含cd28共刺激分子的共刺激结构域,并且所述共刺激多肽是baffr或cd27。在一些实施方案中,car多肽包含cd28共刺激分子的共刺激结构域,并且所述共刺激多肽是baffr。在一些实施方案中,car多肽包含cd28共刺激分子的共刺激结构域,并且所述共刺激多肽是cd27。cd28共刺激分子可以包含seqidno:12的氨基酸序列。baffr可以包含seqidno:62的氨基酸序列,而cd27可以包含seqidno:33的氨基酸序列。在其它实施方案中,car多肽包含4-1bb共刺激分子的共刺激结构域,并且所述共刺激多肽是cd70、light或ox40l。4-1bb共刺激分子可以包含seqidno:22的氨基酸序列。cd70可以包含seqidno:34的氨基酸序列,light可以包含seqidno:43的氨基酸序列,并且ox40l可以包含seqidno:47的氨基酸序列。
表达共刺激多肽和抗gpc3car的本文所述的造血细胞可以是造血干细胞或其后代。在一些实施方案中,造血细胞可以是免疫细胞,诸如自然杀伤细胞、单核细胞/巨噬细胞、中性粒细胞、嗜酸性粒细胞或t细胞。免疫细胞可以衍生自外周血单核细胞(pbmc)、造血干细胞(hsc)或诱导性多能干细胞(ipsc)。在一些实例中,免疫细胞是t细胞,其中内源性t细胞受体、内源性主要组织相容性复合物、内源性β-2-微球蛋白或其组合的表达已被抑制或消除。
本文所述的任何造血细胞可以包含核酸或核酸组,其共同包含:(a)编码共刺激多肽的第一核苷酸序列;和(b)编码car多肽的第二核苷酸序列。在一些实施方案中,核酸或核酸组是rna分子或rna分子组。在一些情况下,免疫细胞包含核酸,该核酸包含第一核苷酸序列和第二核苷酸序列两者。在一些实施方案中,共刺激多肽的编码序列在car多肽的编码序列的上游。在一些实施方案中,car多肽的编码序列在共刺激多肽的编码序列的上游。这样的核酸可进一步包含位于第一核苷酸序列与第二核苷酸序列之间的第三核苷酸序列,其中第三核苷酸序列编码核糖体跳跃位点(例如,p2a肽)、内部核糖体进入位点(ires)或第二启动子。
在一些实例中,核酸或核酸组包含在载体或载体组内,其可以是表达载体或表达载体组(例如,病毒载体,诸如逆转录病毒载体,其任选地是慢病毒载体或γ逆转录病毒载体)。核酸组或载体组是指两个或更多个核酸分子或两个或更多个载体的组,各自编码感兴趣的多肽之一(即,共刺激多肽和car多肽)。本文所述的任何核酸也在本公开的范围内。
另一方面,本公开提供了一种药物组合物,其包含本文所述的任何造血细胞和药学上可接受的载剂。
此外,本文提供了抑制受试者中表达gpc3的细胞(例如,减少此类细胞的数量、阻断细胞增殖和/或抑制细胞活性)的方法,所述方法包括向有此需要的受试者施用本文所述的造血细胞群(其可以共表达共刺激多肽和car多肽)和/或本文所述的药物组合物。
在一些实例中,造血细胞是自体的。在其它实例中,造血细胞是同种异体的。在本文所述的任何方法中,造血细胞可以离体被活化、扩增或这两者。在一些情况下,造血细胞包括包含t细胞的免疫细胞,其在抗cd3抗体、抗cd28抗体、il-2、植物凝集素和工程改造的人工刺激细胞或颗粒中的一种或多种存在下被活化。在其它情况下,免疫细胞包括自然杀伤细胞,其在4-1bb配体、抗4-1bb抗体、il-15、抗il-15受体抗体、il-2、il-12、il-18、il-21、k562细胞和工程改造的人工刺激细胞或颗粒中的一种或多种存在下被活化。
在一些实例中,将通过本文所述的方法治疗的受试者可以是患有癌症的人类患者。可通过本公开的方法治疗的癌症的特定非限制性实例包括例如乳腺癌、胃癌、神经母细胞瘤、骨肉瘤、肺癌、皮肤癌、前列腺癌、结肠直肠癌、肾细胞癌、卵巢癌、横纹肌肉瘤、白血病、间皮瘤、胰腺癌、头颈癌、视网膜母细胞瘤、神经胶质瘤、胶质母细胞瘤、甲状腺癌、肝细胞癌、食道癌和宫颈癌。在某些实施方案中,癌症可以是实体瘤。
下文的描述中阐述了本公开的一个或多个实施方案的细节。本公开的其它特征或优点将由若干实施方案的详细描述及所附权利要求书而将变得显而易见。
附图说明
以下附图构成本说明书的一部分,并且被包括在内以进一步说明本公开的某些方面,通过参考这些附图中的一个或多个并结合本文给出的特定实施方案的详细描述可以更好地理解这些方面。
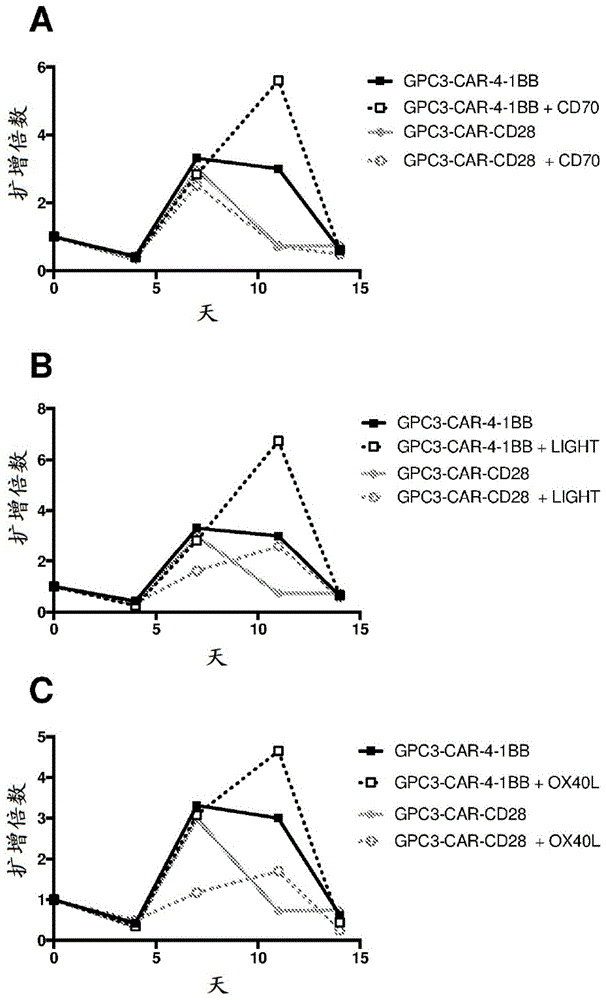
图1是一系列图,示出了在用表达gpc3的hep3b细胞刺激后,t细胞相对于t细胞的先前时间点的倍数扩增。在此实验中评价的t细胞单独(a、b和c)或与cd70(a;seqidno:34)、light(b;seqidno:43)或ox40l(c;seqidno:47)组合表达具有4-1bb共刺激结构域(seqidno:1)的抗gpc3car;或单独(a、b和c)或与cd70(a;seqidno:34)、light(b;seqidno:43)或ox40l(c;seqidno:47)组合表达具有cd28共刺激结构域(seqidno:2)的抗gpc3car。
图2是一系列图,示出了在用表达gpc3的jhh7细胞刺激后,t细胞相对于t细胞的先前时间点的倍数扩增,其随刺激轮数(图a)及针对il-2(图b)、ifn-γ(图c)和il-17a(图d)的第二轮刺激后的细胞因子产生而变化。示出了单独或与cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)组合表达具有4-1bb共刺激结构域(seqidno:1)的抗gpc3car的t细胞的数据。
图3是一系列图,示出了表达具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)的t细胞及共表达gpc3-car-4-1bb和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的t细胞的il-2产生(图a)和增殖(图b)。
图4是一系列图,展示了表达具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)或与cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)组合表达gpc3-car-4-1bb的t细胞的功能。评价t细胞在慢性刺激下产生il-17a(图a)和增殖(图b)的能力。另外,评价t细胞在单次刺激后的增殖能力(图c)。
图5是一系列图,展示了表达具有cd28共刺激结构域的抗gpc3car多肽(gpc3-car-cd28;seqidno:2)或与cd27(seqidno:33)组合表达gpc3-car-cd28的t细胞的功能。评价t细胞的增殖(图a和b)及产生细胞因子(图c和d)的能力。
图6是一系列图,展示了表达具有cd28共刺激结构域的抗gpc3car多肽(gpc3-car-cd28;seqidno:2)或与cd27(seqidno:33)组合表达gpc3-car-cd28的t细胞的功能。评价t细胞在免疫抑制性髓源抑制细胞(mdsc;图a)或调节性t细胞(treg;图b)存在下增殖的能力。
图7是一系列图,示出了表达具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)或与cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)组合表达gpc3-car-4-1bb的t细胞的抗肿瘤活性。在nsg小鼠中评价hepg2(图a)、hep3b(图b)和jhh7(图c)肿瘤异种移植模型。
图8是示出了在nsg小鼠的jhh7肿瘤异种移植模型中表达具有cd28共刺激结构域的抗gpc3car多肽(gpc3-car-cd28;seqidno:2)或与cd27(seqidno:33)组合表达gpc3-car-cd28的t细胞的抗肿瘤活性的图。
图9是一系列图,示出了来自nsg小鼠的hepg2(图a)和hep3b(图b)肿瘤异种移植模型的小鼠血液中t细胞的量。示出了单独或与cd70(seqidno:34)组合表达具有4-1bb共刺激结构域(seqidno:1)的抗gpc3car的t细胞(图a)及单独或与cd27(seqidno:33)组合表达具有cd28共刺激结构域(seqidno:2)的抗gpc3car的t细胞(图b)的数据。
图10是一系列图,示出了在单独或与cd70(seqidno:34)组合表达具有4-1bb共刺激结构域(seqidno:1)的抗gpc3car的t细胞上的cd70表达(图a和b)或在单独或与cd27(seqidno:33)组合表达具有cd28共刺激结构域(seqidno:2)的抗gpc3car的t细胞上的cd27表达(图c和d)。
具体实施方式
嵌合抗原受体(car)是人工细胞表面受体,其将表达这种抗原受体的免疫细胞(例如t细胞)的结合特异性重定向到患病细胞(诸如癌细胞),从而通过例如免疫细胞的效应子活性来消除靶疾病细胞。car构建体通常包含与至少一个细胞内信号传导结构域融合的细胞外抗原结合结构域。细胞外抗原结合结构域(例如,单链抗体片段)对目标抗原(例如,肿瘤抗原)具有特异性,并且细胞内信号传导结构域可以介导导致免疫细胞活化的细胞信号传导。这样,表达car构建体的免疫细胞可以与表达靶抗原的患病细胞(例如肿瘤细胞)结合,从而导致免疫细胞的活化和患病细胞的消除。
本公开至少部分基于用于增强共表达抗磷脂酰肌醇聚糖-3(gpc3)嵌合抗原受体(car)多肽的效应免疫细胞的活性的策略的开发。具体来说,本公开的特征在于通过效应免疫细胞赋予调节合适的共刺激途径的能力,从而增强它们的生长和生物活性的方法。例如,共表达包含4-1bb共刺激结构域和某些共刺激分子(例如cd70、light和ox40l)的抗gpc3car的t细胞及共表达包含cd28共刺激结构域和某些共刺激分子(例如cd27)的抗gpc3car的t细胞显示出增强的细胞增殖和细胞因子产生。实体瘤内的免疫抑制特征会限制工程改造的t细胞疗法的成功。本文所公开的方法涉及抗gpc3car和共刺激多肽(其提供反式共刺激信号)的共表达,旨在至少部分克服肿瘤治疗中的这一关键挑战,特别是实体瘤的治疗。
在一些情况下,可以在正常细胞环境中观察到效应免疫细胞调节共刺激途径的能力。在其它情况下,可以在肿瘤微环境中所见的条件下观察到效应免疫细胞调节共刺激途径的能力。本公开提供了调节(例如刺激)共刺激途径的各种方法,包括例如通过表达或过度表达共刺激多肽。用于本公开内容中的共刺激多肽可以是b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体,它们在一种或多种类型的免疫细胞中起共刺激因子的作用。共刺激因子是指增强主要抗原特异性信号并完全活化免疫细胞的受体或其配体。
因此,本公开提供了修饰的(例如,基因工程改造的)造血细胞(例如,造血干细胞、免疫细胞诸如t细胞或自然杀伤细胞),其具有调节(例如,增强)共刺激途径的能力。在一些实施方案中,这样的修饰的造血细胞可以表达一种或多种共刺激多肽,诸如本文所述的那些,以赋予相对于未修饰的造血细胞调节共刺激途径的能力。这样的基因工程改造的造血细胞可进一步表达car多肽(作为相对于共刺激多肽的单独多肽)。在基因工程改造的造血细胞中表达的car多肽和共刺激多肽均由免疫细胞外源性的核酸编码(即,通过重组技术引入免疫细胞中)。它们不由缺少所涉及的基因工程改造的造血细胞的内源性基因编码。本公开还提供了包含所述基因工程改造的造血细胞的药物组合物和试剂盒。
表达(例如,过度表达)共刺激肽的本文所述的基因工程的造血细胞可至少赋予以下优点。共刺激多肽的表达将具有调节共刺激途径的能力。因此,基因工程改造的造血细胞与不表达(或不过度表达)共刺激多肽的造血细胞相比可更好地增殖、产生更多的细胞因子、表现出更大的抗肿瘤细胞毒性和/或表现出更高的t细胞存活率,从而导致更高的细胞因子产生、存活率、细胞毒性和/或抗肿瘤活性。
i.共刺激多肽
如本文所用,共刺激多肽是指具有调节(例如,刺激)共刺激途径的能力的多肽。这样的多肽可以通过任何机制调节(例如增强)共刺激途径。在一些实例中,共刺激多肽可以包含共刺激受体或其共刺激信号传导结构域。在其它实例中,如果适用,共刺激多肽可以包含共刺激受体的配体或其信号传导结构域。此类配体在与同源共刺激受体结合后可以触发共刺激信号传导途径。或者,共刺激多肽可以是模拟天然存在的配体对本文所公开的任何共刺激受体的活性的非天然存在的多肽。这种非天然存在的多肽可以是对共刺激受体具有特异性的单链激动性抗体,例如,对4-1bb具有特异性并且模拟4-1bbl的活性的scfv。
示例性共刺激多肽可以包括但不限于:b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体(例如cd28、cd80、cd86、icos、icosl、b7-h3、b7-h4、vista、tmigd2、b7-h6、b7-h7、4-1bb、4-1bbl、baff、baffr、cd27、cd70、cd30、cd30l、cd40、cd40l、dr3、gitr、gitrl、hvem、light、tnf-β、ox40、ox40l、relt、taci、tl1a、tnf-α或tnfrii)。另外的实例包括bcma、edar2、troy、ltbr、edar、ngfr、opg、rank、dcr3、tnfr1、fn14(tweakr)、april、eda-a2、tweak、ltb(tnf-c)、ngf、eda-a1、淀粉样前体蛋白(app)、trail。可以考虑将来自任何合适的物种(例如,哺乳动物,诸如人)的任何此类多肽与本文所述的组合物和方法一起使用。在一些实施方案中,共刺激多肽不包含cd40与myd88的组合。
如本文所用,共刺激多肽(其是b7/cd28超家族的成员或tnf超家族的成员)是指在任何类型的免疫细胞的活化中起共刺激作用的任一超家族的成员。这样的成员可以是任一超家族的天然存在的受体或配体。或者,这种成员可以是天然存在的受体或配体的变体。相对于天然对应物,变体可以具有提高或降低的活性。在一些实例中,相对于天然对应物,变体缺少胞质结构域或其一部分。以下描述了可用于本公开中的示例性共刺激多肽。
cd28(分化簇28)是在t细胞上表达的蛋白质,其提供t细胞活化和存活所需的共刺激信号。它是cd80和cd86蛋白的受体,并且是在幼稚t细胞上组成性表达的唯一b7受体。以下提供了示例性人cd28的氨基酸序列:
cd28(seqidno:12)
mlrlllalnlfpsiqvtgnkilvkqspmlvaydnavnlsckysynlfsrefraslhkgldsavevcvvygnysqqlqvysktgfncdgklgnesvtfylqnlyvnqtdiyfckievmypppyldneksngtiihvkgkhlcpsplfpgpskpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
cd80(分化簇80;b7-1)是在树突细胞、活化的b细胞和单核细胞上所见的蛋白质。它提供t细胞活化和存活所必需的共刺激信号。cd80是cd28和ctla-4两者的配体。以下提供了示例性人cd80的氨基酸序列:
cd80(seqidno:13)
mghtrrqgtspskcpylnffqllvlaglshfcsgvihvtkevkevatlscghnvsveelaqtriywqkekkmvltmmsgdmniwpeyknrtifditnnlsivilalrpsdegtyecvvlkyekdafkrehlaevtlsvkadfptpsisdfeiptsnirriicstsggfpephlswlengeelnainttvsqdpetelyavsskldfnmttnhsfmclikyghlrvnqtfnwnttkqehfpdnllpswaitlisvngifviccltycfaprcrerrrnerlrresvrpv
cd86(分化簇86;b7-2)是i型膜蛋白,它是免疫球蛋白超家族的成员。cd86在提供t细胞活化和存活所必需的共刺激信号的抗原呈递细胞上表达。cd86是cd28和ctla-4两者的配体。以下提供了示例性人cd86的氨基酸序列:
cd86(seqidno:14)
mdpqctmglsnilfvmafllsgaaplkiqayfnetadlpcqfansqnqslselvvfwqdqenlvlnevylgkekfdsvhskymgrtsfdsdswtlrlhnlqikdkglyqciihhkkptgmirihqmnselsvlanfsqpeivpisnitenvyinltcssihgypepkkmsvllrtknstieydgvmqksqdnvtelydvsislsvsfpdvtsnmtifciletdktrllsspfsieledpqpppdhipwitavlptviicvmvfclilwkwkkkkrprnsykcgtntmereeseqtkkrekihipersdeaqrvfkssktsscdksdtcf
icos(cd278;诱导型t细胞共刺激物;或cvid1)是cd28超家族的成员。icos在活化的t细胞上表达。以下提供了示例性人icos的氨基酸序列:
icos(seqidno:15)
mksglwyfflfclrikvltgeingsanyemfifhnggvqilckypdivqqfkmqllkggqilcdltktkgsgntvsikslkfchsqlsnnsvsfflynldhshanyyfcnlsifdpppfkvtltggylhiyesqlccqlkfwlpigcaafvvvcilgcilicwltkkkysssvhdpngeymfmravntakksrltdvtl
icosl(icoslg;b7-h2;cd275)是一种蛋白质,它是t细胞特异性蛋白icos的配体。icosl充当t细胞增殖和细胞因子分泌的共刺激信号。以下提供了示例性人icosl的氨基酸序列:
icosl(seqidno:16)
mrlgspgllfllfsslradtqekevramvgsdvelscacpegsrfdlndvyvywqtsesktvvtyhipqnsslenvdsryrnralmspagmlrgdfslrlfnvtpqdeqkfhclvlsqslgfqevlsvevtlhvaanfsvpvvsaphspsqdeltftctsingyprpnvywinktdnslldqalqndtvflnmrglydvvsvlriartpsvnigccienvllqqnltvgsqtgndigerdkitenpvstgeknaatwsilavlcllvvvavaigwvcrdrclqhsyagawavspeteltghv
b7-h3(cd276;分化簇276)是免疫球蛋白超家族的成员,认为其参与t细胞介导的免疫反应的调节。以下提供了示例性人b7-h3的氨基酸序列:
b7-h3(seqidno:17)
mlrrrgspgmgvhvgaalgalwfcltgalevqvpedpvvalvgtdatlccsfspepgfslaqlnliwqltdtkqlvhsfaegqdqgsayanrtalfpdllaqgnaslrlqrvrvadegsftcfvsirdfgsaavslqvaapyskpsmtlepnkdlrpgdtvtitcssyqgypeaevfwqdgqgvpltgnvttsqmaneqglfdvhsilrvvlgangtysclvrnpvlqqdahssvtitpqrsptgavevqvpedpvvalvgtdatlrcsfspepgfslaqlnliwqltdtkqlvhsftegrdqgsayanrtalfpdllaqgnaslrlqrvrvadegsftcfvsirdfgsaavslqvaapyskpsmtlepnkdlrpgdtvtitcssyrgypeaevfwqdgqgvpltgnvttsqmaneqglfdvhsvlrvvlgangtysclvrnpvlqqdahgsvtitgqpmtfppealwvtvglsvcliallvalafvcwrkikqsceeenagaedqdgegegsktalqplkhsdskeddgqeia
vista(t细胞活化的v结构域ig抑制子;b7-h5;pd-1h)是i型跨膜蛋白,其用作免疫检查点。vista经由tmigd2(cd28h)共刺激t细胞。以下提供了示例性人vista的氨基酸序列:
vista(seqidno:18)
mgvptaleagswrwgsllfalflaaslgpvaafkvatpyslyvcpegqnvtltcrllgpvdkghdvtfyktwyrssrgevqtcserrpirnltfqdlhlhhgghqaantshdlaqrhglesasdhhgnfsitmrnltlldsglycclvveirhhhsehrvhgamelqvqtgkdapsncvvypsssqdsenitaaalatgacivgilclplilllvykqrqaasnrraqelvrmdsniqgienpgfeasppaqgipeakvrhplsyvaqrqpsesgrhllsepstplsppgpgdvffpsldpvpdspnfevi
tmigd2(含跨膜和免疫球蛋白结构域2;cd28h)是tmigd2,认为其经由akt依赖性信号传导级联增加t细胞增殖和细胞因子产生。以下提供了示例性人tmigd2的氨基酸序列:
tmigd2(seqidno:19)
mgspgmvlgllvqiwalqeasslsvqqgpnllqvrqgsqatlvcqvdqatawerlrvkwtkdgailcqpyitngslslgvcgpqgrlswqapshltlqldpvslnhsgayvcwaaveipeleeaegnitrlfvdpddptqnrnriasfpgflfvllgvgsmgvaaivwgawfwgrrscqqrdsgnspgnafysnvlyrprgapkksedcsgegkdqrgqsiystsfpqpaprqphlasrpcpsprpcpsprpghpvsmvrvsprpsptqqprpkgfpkvgee
b7-h6(ncr3lg1;自然杀伤细胞细胞毒性受体3配体1)是在肿瘤细胞上选择性表达的b7家族的成员。b7-h6与nkp30相互作用,导致自然杀伤(nk)细胞活化和细胞毒性。以下提供了示例性人b7-h6的氨基酸序列:
b7-h6(seqidno:20)
mtwraaastcaallillwalttegdlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfsihwwpisfigvglvllivlipwkkicnksssaytplkcilkhwnsfdtqtlkkehliffctrawpsyqlqdgeawppegsvnintiqqldvfcrqegkwsevpyvqaffalrdnpdlcqccridpalltvtsgksiddnstksekqtprehsdavpdapilpvspiwepppattsttpvlssqpptlllplq
b7-h7(hhla2;herv-hltr-相关2)是见于单核细胞表面上的蛋白质配体。b7-h7被认为通过结合t淋巴细胞上的受体并抑制t细胞中的增殖来调节细胞介导的免疫。以下提供了示例性人b7-h7的氨基酸序列:
b7-h7(seqidno:21)
mkaqtalsfflilitslsgsqgifplaffiyvpmneqivigrldediilpssfergsevvihwkyqdsykvhsyykgsdhlesqdpryanrtslfyneiqngnaslffrrvslldegiytcyvgtaiqvitnkvvlkvgvfltpvmkyekrntnsflicsvlsvyprpiitwkmdntpisennmeetgsldsfsinsplnitgsnssyectiensllkqtwtgrwtmkdglhkmqsehvslscqpvndyfspnqdfkvtwsrmksgtfsvlayylsssqntiinesrfswnkelinqsdfsmnlmdlnlsdsgeylcnissdeytlltihtvhvepsqetashnkglwilvpsailaaflliwsvkccraqlearrsrhpadgaqqerccvppgercpsapdngeenvplsgkv
4-1bb(cd137;tnfrsf9)是由活化的t细胞表达的肿瘤坏死因子(tnf)超家族成员。4-1bb的交联增强t细胞增殖、il-2分泌、存活和溶细胞活性。以下提供了示例性人4-1bb的氨基酸序列:
4-1bb(seqidno:22)
mgnscynivatlllvlnfertrslqdpcsncpagtfcdnnrnqicspcppnsfssaggqrtcdicrqckgvfrtrkecsstsnaecdctpgfhclgagcsmceqdckqgqeltkkgckdccfgtfndqkrgicrpwtncsldgksvlvngtkerdvvcgpspadlspgassvtppaparepghspqiisfflaltstallfllffltlrfsvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
4-1bbl(tnfsf9;4-1bb配体)是属于tnf超家族的2型跨膜糖蛋白受体。4-1bbl在活化的t淋巴细胞上表达并与4-1bb结合。以下提供了某些示例性人4-1bbl多肽(包括天然和变体)的氨基酸序列:
4-1bbl(seqidno:23)
meyasdasldpeapwppapraracrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bbl-cd(缺少胞质结构域;seqidno:24)
mrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bblq89a(seqidno:25)
meyasdasldpeapwppapraracrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlragmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bblq89a/cd(缺乏胞质结构域)(seqidno:26)
mrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlragmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bbll115a(seqidno:27)
meyasdasldpeapwppapraracrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpgaagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bbll115a/cd(seqidno:28)
mrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpgaagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bblk127a(seqidno:29)
meyasdasldpeapwppapraracrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsyaedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse
4-1bblq227a(seqidno:30)
meyasdasldpeapwppapraracrvlpwalvaglllllllaaacavflacpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawaltqgatvlglfrvtpeipaglpsprse
baff(b细胞活化因子;tnfsf13b)是tnf配体家族的成员,并充当受体tnfrsf13b/taci、tnfrsf17/bcma和tnfrsf13c/baff-r的配体。baff是有效的b细胞活化剂,并在b细胞增殖和分化中起重要作用。以下提供了示例性人baff的氨基酸序列:
baff(seqidno:31)
mddstereqsrltsclkkreemklkecvsilprkespsvrsskdgkllaatlllallsccltvvsfyqvaalqgdlaslraelqghhaeklpagagapkagleeapavtaglkifeppapgegnssqnsrnkravqgpeetvtqdclqliadsetptiqkgsytfvpwllsfkrgsaleekenkilvketgyffiygqvlytdktyamghliqrkkvhvfgdelslvtlfrciqnmpetlpnnscysagiakleegdelqlaiprenaqisldgdvtffgalkll
baffr(b细胞活化因子受体;tnfrsf13c)是tnf受体超家族的膜蛋白,并充当baff的受体。baffr增强b细胞存活,并且是外周b细胞群的调节剂。以下提供了示例性人baffr的氨基酸序列:
baffr(seqidno:32)
mrrgprslrgrdapaptpcvpaecfdllvrhcvacgllrtprpkpagasspaprtalqpqesvgagageaalplpgllfgapallglalvlalvlvglvswrrrqrrlrgassaeapdgdkdapepldkviilspgisdatapawpppgedpgttppghsvpvpatelgstelvttktagpeqq
cd27(tnfrsf7)是tnf受体超家族的成员,并且是t细胞免疫的产生和长期维持所必需的。cd27与cd70结合,并还在b细胞活化和免疫球蛋白合成的调节中发挥作用。以下提供了示例性人cd27的氨基酸序列:
cd27(seqidno:33)
marphpwwlcvlgtlvglsatpapkscperhywaqgklccqmcepgtflvkdcdqhrkaaqcdpcipgvsfspdhhtrphcescrhcnsgllvrnctitanaecacrngwqcrdkectecdplpnpsltarssqalsphpqpthlpyvsemleartaghmqtladfrqlpartlsthwppqrslcssdfirilvifsgmflvftlagalflhqrrkyrsnkgespvepaepchyscpreeegstipiqedyrkpepacsp
cd70(cd27lg;tnfsf7)是在高度活化的淋巴细胞上表达的蛋白质。cd70充当cd27的配体。以下提供了示例性人cd70的氨基酸序列:
cd70(seqidno:34)
mpeegsgcsvrrrpygcvlraalvplvaglviclvvciqrfaqaqqqlpleslgwdvaelqlnhtgpqqdprlywqggpalgrsflhgpeldkgqlrihrdgiymvhiqvtlaicssttasrhhpttlavgicspasrsisllrlsfhqgctivsqrltplargdtlctnltgtllpsrntdetffgvqwvrp
cd30(tnfrsf8)是由活化的t细胞和b细胞表达的tnf受体超家族的成员。cd30是细胞膜蛋白,已显示与cd30l、traf1、traf2、traf3和traf5相互作用。以下提供了示例性人cd30的氨基酸序列:
cd30(seqidno:35)
mrvllaalgllflgalrafpqdrpfedtchgnpshyydkavrrccyrcpmglfptqqcpqrptdcrkqcepdyyldeadrctacvtcsrddlvektpcawnssrvcecrpgmfcstsavnscarcffhsvcpagmivkfpgtaqkntvcepaspgvspacaspenckepssgtipqakptpvspatssastmpvrggtrlaqeaaskltrapdspssvgrpssdpglsptqpcpegsgdcrkqcepdyyldeagrctacvscsrddlvektpcawnssrtcecrpgmicatsatnscarcvpypicaaetvtkpqdmaekdttfeapplgtqpdcnptpengeapastsptqsllvdsqasktlpiptsapvalsstgkpvldagpvlfwvilvlvvvvgssafllchrracrkrirqklhlcypvqtsqpklelvdsrprrsstqlrsgasvtepvaeerglmsqplmetchsvgaayleslplqdaspaggpssprdlpeprvstehtnnkiekiyimkadtvivgtvkaelpegrglagpaepeleeeleadhtphypeqetepplgscsdvmlsveeegkedplptaasgk
cd30l(cd30lg;tnfsf8)是tnf受体超家族的成员。cd30l充当cd30的配体,并在诱导的t细胞和单核细胞/巨噬细胞上表达。以下提供了示例性人cd30l的氨基酸序列:
cd30l(seqidno:36)
mdpglqqalngmappgdtamhvpagsvashlgttsrsyfylttatlalclvftvatimvlvvqrtdsipnspdnvplkggncsedllcilkrapfkkswaylqvakhlnktklswnkdgilhgvryqdgnlviqfpglyfiicqlqflvqcpnnsvdlklellinkhikkqalvtvcesgmqtkhvyqnlsqflldylqvnttisvnvdtfqyidtstfplenvlsiflysnsd
cd40(tnfrsf5)是在b细胞、单核细胞、树突细胞、内皮细胞和上皮细胞表面上表达的细胞表面受体。已证明cd40参与t细胞依赖性免疫球蛋白类别转换、记忆b细胞发育和生发中心形成。以下提供了示例性人cd40的氨基酸序列:
cd40(seqidno:37)
mvrlplqcvlwgclltavhpepptacrekqylinsqccslcqpgqklvsdctefteteclpcgesefldtwnrethchqhkycdpnlglrvqqkgtsetdtictceegwhctseacescvlhrscspgfgvkqiatgvsdticepcpvgffsnvssafekchpwtscetkdlvvqqagtnktdvvcgpqdrlralvvipiifgilfaillvlvfikkvakkptnkaphpkqepqeinfpddlpgsntaapvqetlhgcqpvtqedgkesrisvqerq
cd40l(cd40lg;trap;tnfsf5)是在b淋巴细胞、上皮细胞和一些癌细胞上表达的tnf超家族的成员。cd40l是跨膜蛋白,已知与cd40相互作用以介导b细胞增殖、粘附和分化。以下提供了示例性人cd40l的氨基酸序列:
cd40l(seqidno:38)
mietynqtsprsaatglpismkifmylltvflitqmigsalfavylhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeetkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl
dr3(tnfr25;apo3;tramp;lard;wsl-1)是在淋巴细胞中表达的tnf受体超家族成员。dr3被认为是负责tl1a诱导的t细胞共刺激的受体。以下提供了示例性人dr3的氨基酸序列:
dr3(seqidno:39)
meqrprgcaavaaalllvllgaraqggtrsprcdcagdfhkkiglfccrgcpaghylkapctepcgnstclvcpqdtflawenhhnsecarcqacdeqasqvalencsavadtrcgckpgwfvecqvsqcvssspfycqpcldcgalhrhtrllcsrrdtdcgtclpgfyehgdgcvscptstlgscpercaavcgwrqmfwvqvllaglvvplllgatltytyrhcwphkplvtadeagmealtpppathlspldsahtllappdssekictvqlvgnswtpgypetqealcpqvtwswdqlpsralgpaaaptlspespagspammlqpgpqlydvmdavparrwkefvrtlglreaeieaveveigrfrdqqyemlkrwrqqqpaglgavyaalermgldgcvedlrsrlqrgp
gitr(糖皮质激素诱导的tnfr相关蛋白;aitr;tnfrsf18)是tnf受体超家族的成员,并且在包括t淋巴细胞、nk细胞和抗原呈递细胞的几种细胞和组织中表达。gitr与其配体(gitrl)的相互作用诱导共活化信号。以下提供了示例性人gitr的氨基酸序列:
gitr(seqidno:40)
maqhgamgafralcglallcalslgqrptggpgcgpgrlllgtgtdarccrvhttrccrdypgeeccsewdcmcvqpefhcgdpccttcrhhpcppgqgvqsqgkfsfgfqcidcasgtfsggheghckpwtdctqfgfltvfpgnkthnavcvpgsppaeplgwltvvllavaacvllltsaqlglhiwqlrsqcmwpretqlllevppstedarscqfpeeergersaeekgrlgdlw
gitrl(tnfsf18)是属于tnf配体家族的细胞因子,并且充当gitr的受体。gitr与其配体(gitrl)的相互作用诱导共活化信号,并已证明调节外周组织中t淋巴细胞的存活。以下提供了示例性人gitrl的氨基酸序列:
gitrl(seqidno:41)
mtlhpspitceflfstalispkmclshlenmplshsrtqgaqrsswklwlfcsivmllflcsfswlififlqletakepcmakfgplpskwqmasseppcvnkvsdwkleilqnglyliygqvapnanyndvapfevrlyknkdmiqtltnkskiqnvggtyelhvgdtidlifnsehqvlknntywgiillanpqfis
hvem(疱疹病毒进入介体;tnfrsf14;cd270)是细胞表面受体,并且是tnf受体超家族的成员。hvem与light(tnfsf14)接合后向t细胞提供刺激信号;或与免疫球蛋白(ig)超家族的配体成员b和t淋巴细胞衰减子(btla)结合时对t细胞提供抑制信号。以下提供了示例性人hvem的氨基酸序列:
hvem(seqidno:42)
meppgdwgpppwrstpktdvlrlvlyltflgapcyapalpsckedeypvgseccpkcspgyrvkeacgeltgtvcepcppgtyiahlnglskclqcqmcdpamglrasrncsrtenavcgcspghfcivqdgdhcaacrayatsspgqrvqkggtesqdtlcqncppgtfspngtleecqhqtkcswlvtkagagtssshwvwwflsgslvivivcstvgliicvkrrkprgdvvkvivsvqrkrqeaegeatviealqappdvttvaveetipsftgrspnh
light(tnfsf14;cd258;hveml)是tnf配体家族的成员,其与hvem一起用作共刺激因子。已证明,light刺激t细胞的增殖并触发各种肿瘤细胞的凋亡。以下提供了示例性人light的氨基酸序列:
light(seqidno:43)
meesvvrpsvfvvdgqtdipftrlgrshrrqscsvarvglglllllmgaglavqgwfllqlhwrlgemvtrlpdgpagsweqliqerrshevnpaahltganssltgsggpllwetqlglaflrglsyhdgalvvtkagyyyiyskvqlggvgcplglastithglykrtprypeelellvsqqspcgratsssrvwwdssflggvvhleageevvvrvlderlvrlrdgtrsyfgafmv
tnf-α(tnfsf2)是已知由例如巨噬细胞和活化的cd4阳性t细胞分泌的tnf配体超家族的成员。已知tnf-α会诱导某些共刺激分子,诸如b7h和tnfrii。以下提供了示例性人tnf-α的氨基酸序列:
tnf-α(seqidno:44)
mstesmirdvelaeealpkktggpqgsrrclflslfsflivagattlfcllhfgvigpqreefprdlslisplaqavrsssrtpsdkpvahvvanpqaegqlqwlnrranallangvelrdnqlvvpseglyliysqvlfkgqgcpsthvllthtisriavsyqtkvnllsaikspcqretpegaeakpwyepiylggvfqlekgdrlsaeinrpdyldfaesgqvyfgiial
tnf-β(tnfsf1;淋巴毒素α)是tnf超家族的成员,其参与细胞存活、增殖、分化和凋亡的调控。以下提供了示例性人tnf-β的氨基酸序列:
tnf-β(seqidno:45)
mtpperlflprvcgttlhllllglllvllpgaqglpgvgltpsaaqtarqhpkmhlahstlkpaahligdpskqnsllwrantdraflqdgfslsnnsllvptsgiyfvysqvvfsgkayspkatssplylahevqlfssqypfhvpllssqkmvypglqepwlhsmyhgaafqltqgdqlsthtdgiphlvlspstvffgafal
ox40(tnfrsf4;cd134)是tnf受体超家族的成员。ox40与ox40l结合并有助于t细胞扩增、存活和细胞因子产生。以下提供了示例性人ox40的氨基酸序列:
ox40(seqidno:46)
mcvgarrlgrgpcaallllglglstvtglhcvgdtypsndrcchecrpgngmvsrcsrsqntvcrpcgpgfyndvvsskpckpctwcnlrsgserkqlctatqdtvcrcragtqpldsykpgvdcapcppghfspgdnqackpwtnctlagkhtlqpasnssdaicedrdppatqpqetqgpparpitvqpteawprtsqgpstrpvevpggravaailglglvlgllgplaillalyllrrdqrlppdahkppgggsfrtpiqeeqadahstlaki
ox40l(tnfsf4;cd252)是tnf配体超家族的成员,并且在例如活化的cd4和cd8t细胞以及许多其它淋巴样和非淋巴样细胞上表达。ox40l与ox40相互作用,以调节例如t细胞扩增、存活和细胞因子产生。以下提供了示例性人ox40l的氨基酸序列:
ox40l(seqidno:47)
mervqpleenvgnaarprfernklllvasviqglglllcftyiclhfsalqvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl
relt(tnfrsf19l)是tnf受体超家族的成员。relt是i型跨膜糖蛋白,并且被认为能够在cd3信号传导存在下共刺激t细胞增殖。以下提供了示例性人relt的氨基酸序列:
relt(seqidno:48)
mkpsllcrplscflmllpwplatltsttlwqcppgeepdldpgqgtlcrpcppgtfsaawgsspcqpharcslwrrleaqvgmatrdtlcgdcwpgwfgpwgvprvpcqpcswaplgthgcdewgrrarrgvevaagassggetrqpgngtraggpeetaaqyaviaivpvfclmgllgilvcnllkrkgyhctahkevgpgpggggsginpayrtedanedtigvlvrlitekkenaaaleellkeyhskqlvqtshrpvsklppappnvphicphrhhlhtvqglaslsgpccsrcsqkkwpevllspeavaattpvpsllpnptrvpkagakagrqgeitilsvgrfrvaripeqrtssmvsevktiteagpswgdlpdspqpglppeqqallgsggsrtkwlkppaenkaeenryvvrlsesnlvi
taci(跨膜活化剂和caml相互作用剂;tnfrsf13b;cd267)是tnf受体超家族成员,例如见于b细胞表面上。已知taci与配体baff和april相互作用。以下提供了示例性人taci的氨基酸序列:
taci(seqidno:49)
msglgrsrrggrsrvdqeerfpqglwtgvamrscpeeqywdpllgtcmsckticnhqsqrtcaafcrslscrkeqgkfydhllrdciscasicgqhpkqcayfcenklrspvnlppelrrqrsgevennsdnsgryqglehrgseaspalpglklsadqvalvystlglclcavlccflvavacflkkrgdpcscqprsrprqspakssqdhameagspvstspepvetcsfcfpecraptqesavtpgtpdptcagrwgchtrttvlqpcphipdsglgivcvpaqeggpga
tl1a(tnfsf15)是已知与dr3结合的tnf配体超家族的成员。tl1a可用于增加t细胞增殖和t细胞的细胞因子产生。以下提供了示例性人tl1a的氨基酸序列:
tl1a(seqidno:50)
maedlglsfgetasvemlpehgscrpkarsssarwaltcclvllpflaglttyllvsqlraqgeacvqfqalkgqefapshqqvyaplradgdkprahltvvrqtptqhfknqfpalhwehelglaftknrmnytnkfllipesgdyfiysqvtfrgmtsecseirqagrpnkpdsitvvitkvtdsypeptqllmgtksvcevgsnwfqpiylgamfslqegdklmvnvsdislvdytkedktffgafll
tnfrii(tnfrsf1b)是与tnf-α结合的tnf受体超家族成员。tnfrii已显示充当t细胞的共刺激受体,并且是调节性t细胞(treg)和髓样抑制细胞发育的关键因子。以下提供了示例性人tnfrii的氨基酸序列:
tnfrii(seqidno:51)
mapvavwaalavglelwaaahalpaqvaftpyapepgstcrlreyydqtaqmccskcspgqhakvfctktsdtvcdscedstytqlwnwvpeclscgsrcssdqvetqactreqnrictcrpgwycalskqegcrlcaplrkcrpgfgvarpgtetsdvvckpcapgtfsnttsstdicrphqicnvvaipgnasmdavctstsptrsmapgavhlpqpvstrsqhtqptpepstapstsfllpmgpsppaegstgdfalpvglivgvtalglliigvvncvimtqvkkkplclqreakvphlpadkargtqgpeqqhllitapsssssslessasaldrraptrnqpqapgveasgagearastgssdsspgghgtqvnvtcivnvcsssdhssqcssqasstmgdtdsspsespkdeqvpfskeecafrsqletpetllgsteekplplgvpdagmkps
bcma是tnf受体超家族的细胞表面受体,并与肿瘤坏死因子超家族成员13b(tnfsf13b)结合,导致nf-κb和mapk8/jnk活化。它优先在成熟的b淋巴细胞上表达,并在b细胞的发育、功能和调节中起关键作用。以下提供了示例性人bcma的氨基酸序列:
bcma(seqidno:52)
mlqmagqcsqneyfdsllhacipcqlrcssntppltcqrycnasvtnsvkgtnailwtclglsliislavfvlmfllrkinseplkdefkntgsgllgmanidleksrtgdeiilprgleytveectcedcikskpkvdsdhcfplpameegatilvttktndyckslpaalsateieksisar
eda2r是tnfr(肿瘤坏死因子受体)超家族的iii型跨膜蛋白,并含有3个富含半胱氨酸的重复序列和1个跨膜结构域。它与外异蛋白的eda-a2亚型结合,在维持毛发和牙齿方面起着重要作用。以下提供了示例性人eda2r的氨基酸序列:
eda2r(seqidno:53)
mdcqeneywdqwgrcvtcqrcgpgqelskdcgygeggdayctacpprryksswghhrcqscitcavinrvqkvnctatsnavcgdclprfyrktrigglqdqecipctkqtptsevqcafqlslveadtptvppqeatlvalvssllvvftlaflglfflyckqffnrhcqrggllqfeadktakeeslfpvppsketsaesqvsenifqtqplnpileddcsstsgfptqesftmasctseshshwvhspiecteldlqkfsssasytgaetlggntvestgdrlelnvpfevpsp
troy或tnfr(肿瘤坏死因子受体)超家族成员19是1型细胞表面受体,在胚胎和成年cns及发育中的毛囊中高度表达。当在细胞中过度表达时,它会活化jnk信号传导途径,与traf家族成员相互作用,并且可以通过非胱天蛋白酶依赖性机制诱导凋亡。以下提供了示例性人troy的氨基酸序列:
troy(seqidno:54)
malkvlleqektfftllvllgylsckvtcesgdcrqqefrdrsgncvpcnqcgpgmelskecgfgygedaqcvtcrlhrfkedwgfqkckpcldcavvnrfqkancsatsdaicgdclpgfyrktklvgfqdmecvpcgdppppyephcaskvnlvkiastassprdtalaavicsalatvllallilcviyckrqfmekkpswslrsqdiqyngselscfdrpqlheyahraccqcrrdsvqtcgpvrllpsmcceeacspnpatlgcgvhsaaslqarnagpagemvptffgsltqsicgefsdawplmqnpmggdnisfcdsypeltgedihslnpelesstsldsnssqdlvggavpvqshsenftaatdlsrynntlvesastqdaltmrsqldqesgavihpatqtslqvrqrlgsl
ltbr或肿瘤坏死因子受体超家族成员3(tnfrsf3)是与淋巴毒素膜形式(淋巴毒素-α与淋巴毒素-β的复合物)结合的细胞表面受体。它在细胞凋亡、脂质代谢及淋巴组织和转化细胞的发育和组织中发挥作用。以下提供了示例性人ltbr的氨基酸序列:
ltbr(seqidno:55)
mllpwatsapglawgplvlglfgllaasqpqavppyasenqtcrdqekeyyepqhriccsrcppgtyvsakcsrirdtvcatcaensynehwnylticqlcrpcdpvmgleeiapctskrktqcrcqpgmfcaawalecthcellsdcppgteaelkdevgkgnnhcvpckaghfqntsspsarcqphtrcenqglveaapgtaqsdttcknpleplppemsgtmlmlavllplafflllatvfsciwkshpslcrklgsllkrrpqgegpnpvagsweppkahpyfpdlvqpllpisgdvspvstglpaapvleagvpqqqspldltrepqlepgeqsqvahgtngihvtggsmtitgniyiyngpvlggppgpgdlpatpeppypipeegdpgppglstphqedgkawhlaetehcgatpsnrgprnqfithd
edar(外异蛋白a受体)是外异蛋白a的细胞表面受体,并且在胚胎发育以及毛发、牙齿和其它外胚层衍生物的发育中起关键作用。它可以活化核因子-κb、jnk及非胱天蛋白酶依赖性细胞死亡途径。以下提供了示例性人edar的氨基酸序列:
edar(seqidno:56)
mahvgdctqtpwlpvlvvslmcsaraeysncgeneyynqttglcqecppcgpgeepylscgygtkdedygcvpcpaekfskggyqicrrhkdcegffratvltpgdmendaecgpclpgyymlenrprniygmvcyscllappntkecvgatsgasanfpgtsgsstlspfqhahkelsgqghlataliiamstifimaiaivliimfyilktkpsapacctshpgksveaqvskdeekkeapdnvvmfsekdefekltatpakptksendasseneqllsrsvdsdeepapdkqgspelcllslvhlareksatsnksagiqsrrkkildvyanvcgvveglsptelpfdclektsrmlsstynsekavvktwrhlaesfglkrdeiggmtdgmqlfdristagysipelltklvqierldaveslcadilewagvvppasqphaasngfr(神经生长因子受体)是神经营养蛋白的低亲和力细胞表面受体,神经营养蛋白是刺激神经元细胞存活和分化的蛋白质生长因子。ngfr还与神经营养蛋白原结合,并与其它受体伴侣(包括sort1(sortilin)、lingo1和rtn4r)一起用作共受体。它在脾脏、肾上腺和脑以及其它组织中广泛表达。以下提供了示例性人ngfr的氨基酸序列:
ngfr(seqidno:57)
mgagatgramdgprlllllllgvslggakeacptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeanhvdpclpctvcedterqlrectrwadaeceeipgrwitrstppegsdstapstqepeappeqdliastvagvvttvmgssqpvvtrgttdnlipvycsilaavvvglvayiafkrwnsckqnkqgansrpvnqtpppegeklhsdsgisvdsqslhdqqphtqtasgqalkgdgglysslppakreevekllngsagdtwrhlagelgyqpehidsftheacpvrallaswatqdsatldallaalrriqradlveslcsestatspv
opg(骨保护素)是由tnfrsf11b基因编码的肿瘤坏死因子(tnf)受体超家族的细胞因子受体,它与tnf相关的凋亡诱导配体(trail)结合并抑制trail诱导的特定细胞(包括肿瘤细胞)凋亡。它用作骨吸收的负调节剂,并在破骨细胞发育、肿瘤生长和转移、心脏病、免疫系统发育和信号传导、心理健康、糖尿病以及预防妊娠期先兆子痫和骨质疏松症中起重要作用。以下提供了示例性人opg的氨基酸序列:
opg(seqidno:58)
mnnllccalvfldisikwttqetfppkylhydeetshqllcdkcppgtylkqhctakwktvcapcpdhyytdswhtsdeclycspvckelqyvkqecnrthnrvceckegryleiefclkhrscppgfgvvqagtperntvckrcpdgffsnetsskapcrkhtncsvfgllltqkgnathdnicsgnsestqkcgidvtlceeaffrfavptkftpnwlsvlvdnlpgtkvnaesverikrqhssqeqtfqllklwkhqnkdqdivkkiiqdidlcensvqrhighanltfeqlrslmeslpgkkvgaediektikackpsdqilkllslwrikngdqdtlkglmhalkhsktyhfpktvtqslkktirflhsftmyklyqklflemignqvqsvkiscl
rank(核因子κb的受体活化剂)是rank-配体(rankl)的受体,并且是调节破骨细胞分化和活化的rank/rankl/opg信号传导途径的一部分。它是t细胞与树突细胞之间相互作用的重要调节剂,并且在骨骼重塑和修复、免疫细胞功能、淋巴结发育、体温调节和乳腺发育中起重要作用。以下提供了示例性人rank的氨基酸序列:
rank(seqidno:59)
maprarrrrplfallllcallarlqvalqiappctsekhyehlgrccnkcepgkymsskctttsdsvclpcgpdeyldswneedkcllhkvcdtgkalvavvagnsttprrcactagyhwsqdceccrrntecapglgaqhplqlnkdtvckpclagyfsdafsstdkcrpwtnctflgkrvehhgteksdavcssslparkppnephvylpgliilllfasvalvaaiifgvcyrkkgkaltanlwhwineacgrlsgdkessgdscvsthtanfgqqgacegvllltleektfpedmcypdqggvcqgtcvgggpyaqgedarmlslvskteieedsfrqmptedeymdrpsqptdqllfltepgskstppfseplevgendslsqcftgtqstvgsescncteplcrtdwtpmssenylqkevdsghcphwaaspspnwadvctgcrnppgedceplvgspkrgplpqcaygmglppeeeasrteardqpedgadgrlpssaragagsgsspggqspasgnvtgnsnstfissgqvmnfkgdiivvyvsqtsqegaaaaaepmgrpvqeetlarrdsfagngprfpdpcggpeglrepekasrpvqeqggaka
dcr3(诱饵受体3)是肿瘤坏死因子受体超家族的可溶性蛋白,其在抑制fasl和light介导的细胞死亡中起调节作用,并且是与死亡受体竞争配体结合的诱饵受体。它在胃肠道肿瘤中过度表达。以下提供了示例性人dcr3的氨基酸序列:
dcr3(seqidno:60)
mralegpglsllclvlalpallpvpavrgvaetptypwrdaetgerlvcaqcppgtfvqrpcrrdspttcgpcpprhytqfwnylercrycnvlcgereeearachathnracrcrtgffahagfclehascppgagviapgtpsqntqcqpcppgtfsassssseqcqphrnctalglalnvpgssshdtlctsctgfplstrvpgaeeceravidfvafqdisikrlqrllqaleapegwgptpragraalqlklrrrltellgaqdgallvrllqalrvarmpglersvrerflpvh
tnfr1(肿瘤坏死因子受体1)是一种与肿瘤坏死因子-α(tnfα)结合的普遍存在的膜受体,其可以活化转录因子nf-κb、介导细胞凋亡并用作炎症调节剂。以下提供了示例性人tnfr1的氨基酸序列:
tnfr1(seqidno:61)
mglstvpdlllplvllellvgiypsgviglvphlgdrekrdsvcpqgkyihpqnnsicctkchkgtylyndcpgpgqdtdcrecesgsftasenhlrhclscskcrkemgqveissctvdrdtvcgcrknqyrhywsenlfqcfncslclngtvhlscqekqntvctchagfflrenecvscsnckkslectklclpqienvkgtedsgttvllplviffglcllsllfiglmyryqrwksklysivcgkstpekegelegtttkplapnpsfsptpgftptlgfspvpsstftssstytpgdcpnfaaprrevappyqgadpilatalasdpipnplqkwedsahkpqsldtddpatlyavvenvpplrwkefvrrlglsdheidrlelqngrclreaqysmlatwrrrtprreatlellgrvlrdmdllgcledieealcgpaalppapsllr
fn14(成纤维细胞生长因子诱导型14)在组织损伤的情况下在多种细胞类型中被诱导,并由tnf样弱凋亡诱导剂(tweak)活化,它是tnf配体家族的成员,可以控制许多细胞活动,包括增殖、迁移、分化、凋亡、血管生成和炎症。nfat1与脂质运载蛋白2一起调控fn14及其配体tweak的表达,以增强乳腺癌细胞的侵袭性。以下提供了示例性人fn14的氨基酸序列:
fn14(seqidno:62)
margslrrllrllvlglwlallrsvageqapgtapcsrgsswsadldkcmdcascrarphsdfclgcaaappapfrllwpilggalsltfvlgllsgflvwrrcrrrekfttpieetggegcpavaliq
april(诱导增殖的配体)是tnfrsf17/bcma的配体,它是tnf受体家族的成员。april及其受体都对b细胞发育很重要。它在淋巴组织中低水平表达,并被许多肿瘤过度表达。以下提供了示例性人april的氨基酸序列:
april(seqidno:63)
mpasspfllapkgppgnmggpvrepalsvalwlswgaalgavacamalltqqtelqslrrevsrlqgtggpsqngegypwqslpeqssdaleawengersrkrravltqkqkkqhsvlhlvpinatskddsdvtevmwqpalrrgrglqaqgygvriqdagvyllysqvlfqdvtftmgqvvsregqgrqetlfrcirsmpshpdraynscysagvfhlhqgdilsviipraraklnlsphgtflgfvkl
eda-a2是ii型跨膜蛋白,它是tnf超家族(tnfsf)的成员,并用作同三聚体,其在外胚层器官发育过程中可参与细胞-细胞信号传导。该基因的缺陷是无汗型外胚层发育不良的原因,也被称为x连锁的少汗性外胚层发育不良。以下提供了示例性人eda-a2的氨基酸序列:
eda-a2(seqidno:64)
mgypeverrellpaaaprergsqgcgcggaparagegnscllflgffglslalhlltlccylelrselrrergaesrlggsgtpgtsgtlsslggldpdspitshlgqpspkqqplepgeaalhsdsqdghqmallnfffpdekpyseeesrrvrrnkrsksnegadgpvknkkkgkkagppgpngppgppgppgpqgppgipgipgipgttvmgppgppgppgpqgppglqgpsgaadkagtrenqpavvhlqgqgsaiqvkndlsggvlndwsritmnpkvfklhprsgelevlvdgtyfiysqvyyinftdfasyevvvdekpflqctrsietgktnyntcytagvcllkarqkiavkmvhadisinmskhttffgairlgeapas
tweak(tnf相关的凋亡弱诱导剂)是一种细胞因子,其属于肿瘤坏死因子(tnf)配体家族,并且是fn14/tweakr受体的配体。它具有与tnf重叠的信号传导功能,但显示出广泛得多的组织分布。它在内皮细胞的凋亡、增殖和迁移以及血管生成中起重要作用。以下提供了示例性人tweak的氨基酸序列:
tweak(seqidno:65)
maarrsqrrrgrrgepgtallvplalglglalaclglllavvslgsraslsaqepaqeelvaeedqdpselnpqteesqdpapflnrlvrprrsapkgrktrarraiaahyevhprpgqdgaqagvdgtvsgweearinsssplrynrqigefivtraglyylycqvhfdegkavylkldllvdgvlalrcleefsataasslgpqlrlcqvsgllalrpgsslrirtlpwahlkaapfltyfglfqvh
lta(淋巴毒素-α)是由淋巴细胞产生的细胞因子,并且以膜结合状态和可溶性状态存在。它与淋巴毒素-β形成异三聚体,后者将淋巴毒素-α锚定在细胞表面,其参与次级淋巴器官的形成,并介导多种炎性、免疫刺激和抗病毒反应。以下提供了示例性人lta的氨基酸序列:
ltb(seqidno:66)
mgalglegrggrlqgrgslllavagatslvtlllavpitvlavlalvpqdqgglvtetadpgaqaqqglgfqklpeeepetdlspglpaahligaplkgqglgwettkeqafltsgtqfsdaeglalpqdglyylyclvgyrgrappgggdpqgrsvtlrsslyraggaygpgtpelllegaetvtpvldparrqgygplwytsvgfgglvqlrrgervyvnishpdmvdfargktffgavmvg
ngf(神经生长因子)是神经营养因子和神经肽,主要参与某些目标神经元的生长、维持、增殖和存活的调节。更具体地说,ngf对于交感神经和感觉神经元的存活至关重要。以下提供了示例性人ngf的氨基酸序列:
ngf(seqidno:67)
msmlfytlitafligiqaephsesnvpaghtipqahwtklqhsldtalrrarsapaaaiaarvagqtrnitvdprlfkkrrlrsprvlfstqppreaadtqdldfevggaapfnrthrskrssshpifhrgefsvcdsvsvwvgdkttatdikgkevmvlgevninnsvfkqyffetkcrdpnpvdsgcrgidskhwnsycttthtfvkaltmdgkqaawrfiridtacvcvlsrkavrra
eda-a1是属于tnf超家族的ii型跨膜蛋白,其用作同三聚体,并且可参与外胚层器官发育过程中的细胞-细胞信号传导。eda-a1与外异蛋白a受体的附着触发一系列化学信号,这些信号会影响诸如分裂、生长和成熟的细胞活动。以下提供了示例性人eda-a1的氨基酸序列:
eda-a1(seqidno:68)
mgypeverrellpaaaprergsqgcgcggaparagegnscllflgffglslalhlltlccylelrselrrergaesrlggsgtpgtsgtlsslggldpdspitshlgqpspkqqplepgeaalhsdsqdghqmallnfffpdekpyseeesrrvrrnkrsksnegadgpvknkkkgkkagppgpngppgppgppgpqgppgipgipgipgttvmgppgppgppgpqgppglqgpsgaadkagtrenqpavvhlqgqgsaiqvkndlsggvlndwsritmnpkvfklhprsgelevlvdgtyfiysqvevyyinftdfasyevvvdekpflqctrsietgktnyntcytagvcllkarqkiavkmvhadisinmskhttffgairlgeapas
app(淀粉样前体蛋白)是在许多组织中表达并集中在神经元突触中的完整膜蛋白。它在包括脑和脊髓的许多组织中表达,并通过一系列连续的蛋白酶(包括膜内γ-分泌酶复合物)以快速且高度复杂的方式代谢,该蛋白酶也加工其它关键调节分子。以下提供了示例性人app的氨基酸序列:
app(seqidno:69)
mlpglallllaawtaralevptdgnagllaepqiamfcgrlnmhmnvqngkwdsdpsgtktcidtkegilqycqevypelqitnvveanqpvtiqnwckrgrkqckthphfvipyrclvgefvsdallvpdkckflhqermdvcethlhwhtvaketcsekstnlhdygmllpcgidkfrgvefvccplaeesdnvdsadaeeddsdvwwggadtdyadgsedkvvevaeeeevaeveeeeadddeddedgdeveeeaeepyeeaterttsiatttttttesveevvrevcseqaetgpcramisrwyfdvtegkcapffyggcggnrnnfdteeycmavcgsamsqsllkttqeplardpvklpttaastpdavdkyletpgdenehahfqkakerleakhrermsqvmreweeaerqaknlpkadkkaviqhfqekvesleqeaanerqqlvethmarveamlndrrrlalenyitalqavpprprhvfnmlkkyvraeqkdrqhtlkhfehvrmvdpkkaaqirsqvmthlrviyermnqslsllynvpavaeeiqdevdellqkeqnysddvlanmiseprisygndalmpsltetkttvellpvngefslddlqpwhsfgadsvpantenevepvdarpaadrglttrpgsgltnikteeisevkmdaefrhdsgyevhhqklvffaedvgsnkgaiiglmvggvviatvivitlvmlkkkqytsihhgvvevdaavtpeerhlskmqqngyenptykffeqmqn
trail(tnf相关的凋亡诱导配体)是诱导细胞凋亡的细胞因子。它与两个死亡受体dr4(trail-ri)和dr5(trail-rii)以及两个诱饵受体dcr1和dcr2结合。trail通过与死亡受体结合,募集fas相关的死亡结构域并活化胱天蛋白酶8和10来起作用,从而导致凋亡。以下提供了示例性人trail的氨基酸序列:
trail(seqidno:70)
mammevqggpslgqtcvliviftvllqslcvavtyvyftnelkqmqdkysksgiacflkeddsywdpndeesmnspcwqvkwqlrqlvrkmilrtseetistvqekqqnisplvrergpqrvaahitgtrgrsntlsspnsknekalgrkinswessrsghsflsnlhlrngelvihekgfyyiysqtyfrfqeeikentkndkqmvqyiykytsypdpillmksarnscwskdaeyglysiyqggifelkendrifvsvtnehlidmdheasffgaflvg
b7-h4,也称为含v-set结构域的t细胞活化抑制剂1(vtcn1),它是b7家族的成员。发现该蛋白质在抗原呈递细胞的表面上表达,并与t细胞上的配体诸如cd28或mim186760相互作用。以下提供了示例性人b7-h4的氨基酸序列:
b7-h4(seqidno:71)
maslgqilfwsiisiiiilagaialiigfgisgrhsitvttvasagnigedgilsctfepdiklsdiviqwlkegvlglvhefkegkdelseqdemfrgrtavfadqvivgnaslrlknvqltdagtykcyiitskgkgnanleyktgafsmpevnvdynassetlrceaprwfpqptvvwasqvdqganfsevsntsfelnsenvtmkvvsvlynvtinntyscmiendiakatgdikvteseikrrshlqllnskaslcvssffaiswallplspylmlk
在特定实例中,用于本公开中的共刺激多肽包括cd30l、cd40、cd40l、cd27、cd70、gitrl、icos、icosl、light、ox40、ox40l、tl1a、baffr、4-1bb或4-1bbl。在一些情况下,用于本公开中的共刺激多肽不是cd80或cd86。
共刺激多肽可以是来自合适物种的天然存在的多肽,例如,哺乳动物共刺激多肽,诸如衍生自人或非人灵长类的那些。这样的天然存在的多肽在本领域中是已知的,并且可以例如使用上述氨基酸序列中的任一个作为搜索可公开获得的基因数据库(例如genbank)的查询来获得。用于本公开中的共刺激多肽可与上述任何示例性蛋白质具有至少85%(例如,90%、95%、97%、98%、99%或以上)的序列同一性。在一些实施方案中,b7/cd28超家族的成员、肿瘤坏死因子(tnf)超家族的成员或其配体可能缺乏胞质结构域。在一个示例性实施方案中,4-1bbl缺乏胞质结构域。在一些实施方案中,tnf超家族成员或其配体不是4-1bbl。
使用karlin和altschulproc.natl.acad.sci.usa87:2264-68,1990(如在karlin和altschulproc.natl.acad.sci.usa90:5873-77,1993中所修改)的算法测定两个氨基酸序列的“同一性百分比”。这种算法被并入altschul等人j.mol.biol.215:403-10,1990的nblast和xblast程序(2.0版)中。可以用xblast程序(评分=50,字长=3)进行blast蛋白质搜索,以获得与本发明的蛋白质分子同源的氨基酸序列。在两个序列之间存在缺口的情况下,可如altschul等人,nucleicacidsres.25(17):3389-3402,1997中所述利用gappedblast。当利用blast和gappedblast程序时,可以使用各个程序的默认参数(例如xblast和nblast)。
或者,共刺激多肽可以是天然对应物的功能变体。这样的功能变体可以在天然对应物的功能结构域内(例如,在酶的活性位点内)包含一个或多个突变。这样的功能变体可以在天然对应物的功能结构域之外包含一个或多个突变。天然共刺激多肽的功能结构域可以是本领域中已知的,或者可以基于其氨基酸序列来预测。预期功能结构域外的突变不会实质性影响蛋白质的生物活性。在一些情况下,功能变体可以具有相对于天然对应物调节(即,刺激)共刺激途径的能力。
或者或另外,功能变体可在天然对应物的一个或多个位置(例如,至多20个位置、至多15个位置、至多10个位置、至多5、4、3、2,1个位置)处包含保守突变。如本文所用,“保守氨基酸取代”是指不改变进行氨基酸取代的蛋白质的相对电荷或大小特征的氨基酸取代。可以根据本领域普通技术人员已知的用于改变多肽序列的方法来制备变体,诸如在编译这些方法的以下参考文献中所见,例如,molecularcloning:alaboratorymanual,j.sambrook等人,编著,第二版,coldspringharborlaboratorypress,coldspringharbor,newyork,1989或currentprotocolsinmolecularbiology,f.m.ausubel等人,编著,johnwiley&sons,inc.,newyork。氨基酸的保守取代包括在以下组内的氨基酸之间进行的取代:(a)m、i、l、v;(b)f、y、w;(c)k、r、h;(d)a、g;(e)s、t;(f)q、n;及(g)e、d。
本文所述的共刺激多肽可能不需要化学诱导的(例如,rimiducid诱导的)二聚化以调节表达这种酶的免疫细胞的活性。例如,共刺激多肽可以不含f506结合蛋白(fkbp)或其片段(例如,fkbpv36结构域),其允许由rimiducid诱导的二聚化。
ii.抗gpc3car多肽
如本文所用,car多肽(又名car构建体)是指可以在宿主细胞表面上表达的非天然存在的分子,并且包含细胞外抗原结合结构域、跨膜结构域和胞质信号传导结构域。细胞外抗原结合结构域可以是与靶抗原特异性结合(即,对其具有特异性)的任何肽或多肽,包括与医学病状(例如疾病)相关的天然存在的抗原或与靶向疾病相关抗原的治疗剂缀合的抗原部分。
在一些实施方案中,本文所述的car多肽可进一步包含至少一个共刺激信号传导结构域。car多肽被构造以使得当在宿主细胞上表达时,细胞外抗原结合结构域位于细胞外以结合靶分子和胞质信号传导结构域。任选的共刺激信号传导结构域可以位于胞质中以触发活化和/或效应子信号传导。
在一些实施方案中,如本文所述的car多肽从n端到c端可包含细胞外抗原结合结构域、跨膜结构域和胞质信号传导结构域。在一些实施方案中,如本文所述的car多肽从n端到c端包含细胞外抗原结合结构域、跨膜结构域、至少一个共刺激信号传导结构域和胞质信号传导结构域。在其它实施方案中,如本文所述的car多肽从n端到c端包含细胞外抗原结合结构域、跨膜结构域、胞质信号传导结构域和至少一个共刺激信号传导结构域。
如本文所用,短语“蛋白质x跨膜结构域”(例如,cd8跨膜结构域)是指给定蛋白质的任何部分,即跨膜蛋白x,其在膜中是热力学稳定的。
如本文所用,短语“蛋白质x胞质信号传导结构域”(例如cd3ζ胞质信号传导结构域)是指与细胞或细胞器内部相互作用的蛋白质(蛋白质x)的任何部分,其能够如本领域所知传递初级信号,从而导致免疫细胞的增殖和/或活化。如本文所述的胞质信号传导结构域不同于共刺激信号传导结构域,其传递次级信号以完全活化免疫细胞。
如本文所用,短语“蛋白质x共刺激信号传导结构域”(例如cd28共刺激信号传导结构域)是指给定的共刺激蛋白(蛋白质x,诸如cd28、4-1bb、ox40、cd27或icos)可以将共刺激信号(次级信号)转导到免疫细胞(诸如t细胞)中从而导致免疫细胞的完全活化的部分。
在一些实施方案中,本文所述的car多肽可进一步包含铰链结构域,其可位于抗原结合结构域的c端和跨膜结构域的n端。铰链可以具有任何合适的长度。在其它实施方案中,本文所述的car多肽可以根本不具有铰链结构域。在又其它实施方案中,本文所述的car多肽可具有缩短的铰链结构域(例如,包含至多25个氨基酸残基)。
除非上下文另外明确规定,如本说明书和所附权利要求书中使用的单数形式“一个”、“一种”和“所述”包括复数指示物。
a.细胞外抗原结合结构域
本文所述的car多肽包含细胞外抗原结合结构域,其重定向表达car多肽的免疫细胞的特异性。如本文所用,“细胞外抗原结合结构域”是指对目标靶抗原(例如,gpc3)具有结合特异性的肽或多肽。如本文所述的细胞外抗原结合结构域不包含fc受体的胞外结构域,并且可以不结合至免疫球蛋白的fc部分。不与fc片段结合的胞外结构域意指使用常规测定法无法检测到两者之间的结合活性,或者使用常规测定法仅检测到背景或生物学上不显著的结合活性。
在一些情况下,细胞外抗原结合结构域可以是单链抗体片段(scfv),其可以衍生自以高结合亲和力结合靶细胞表面抗原的抗体。细胞外抗原结合结构域可以包含衍生自已知抗-gpc3抗体(例如,曲妥珠单抗)的抗原结合片段(例如,scfv)。
在一些实施方案中,scfv包含重链可变区,其包含以下氨基酸序列:qvqlvqsgaevkkpgasvkvsckasgytftdyemhwvrqapgqglewmgaldpktgdtaysqkfkgrvtltadkststaymelssltsedtavyyctrfysytywgqgtlv(seqidno:74)。
在一些实施方案中,scfv包含轻链可变区,其包含以下氨基酸序列:dvvmtqsplslpvtpgepasiscrssqslvhsnrntylhwylqkpgqspqlliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedvgvyycsqnthvpptfgqgtklei(seqidno:75)。
本文所述的任何car多肽的细胞外抗原结合结构域可对gpc3具有合适的结合亲和力。如本文所用,“结合亲和力”是指表观结合常数或ka。ka是解离常数(kd)的倒数。用于本文所述的car多肽中的细胞外抗原结合结构域可对靶抗原或抗原表位具有的结合亲和力(kd)为至少10-5、10-6、10-7、10-8、10-9、10-10m或更低。增加的结合亲和力对应于减小的kd。细胞外抗原结合结构域对第一抗原的结合亲和力比第二抗原更高可通过针对结合第一抗原的ka(或更小的数值kd)比针对第二抗原的ka(或数值kd)更高来指示。在这种情况下,细胞外抗原结合结构域对第一抗原(例如,具有第一构象的第一蛋白或其模拟物)相对于第二抗原(例如,具有第二构象的相同第一蛋白或其模拟物;或第二蛋白)具有特异性。结合亲和力(例如,针对特异性或其它比较)的差异可以是至少1.5、2、3、4、5、10、15、20、37.5、50、70、80、91、100、500、1000、10,000或105倍。
结合亲和力(或结合特异性)可以通过多种方法测定,这些方法包括平衡透析、平衡结合、凝胶过滤、elisa、表面等离子体共振或光谱法(例如,使用荧光测定法)。用于评价结合亲和力的示例性条件是在hbs-p缓冲液(10mmhepesph7.4、150mmnacl、0.005%(v/v)表面活性剂p20)中。这些技术可用于测量随靶蛋白浓度而变化的结合的结合蛋白的浓度。结合的结合蛋白的浓度([结合])通常与游离靶蛋白的浓度([游离])有关,其关系式如下:
[结合]=[游离]/(kd+[游离])
但是,不一定总要精确测定ka,因为有时足以获得亲和力的定量测量值(例如,使用诸如elisa或facs分析的方法测定的亲和力与ka成正比),且因此可以用于比较,诸如确定较高的亲和力(例如高2倍)是否能获得亲和力的定性测量结果,抑或获得亲和力的推断结果,例如通过功能测定中的活性,例如体外或体内测定。
b.跨膜结构域
本文所述的car多肽的跨膜结构域可以呈本领域已知的任何形式。如本文所用,“跨膜结构域”是指在细胞膜(优选真核细胞膜中)热力学稳定的任何蛋白质结构。适用于本文所用的car多肽中的跨膜结构域可获自天然存在的蛋白质。或者,其可以是合成的、非天然存在的蛋白质区段,例如在细胞膜中热力学稳定的疏水蛋白质区段。
跨膜结构域根据跨膜结构域的三维结构进行分类。例如,跨膜结构域可以形成α螺旋、多于一个α螺旋的复合体、β桶状结构或能够跨越细胞的磷脂双层的任何其它稳定结构。此外,跨膜结构域也可以或替代地基于跨膜结构域拓扑进行分类,包括跨膜结构域跨膜通过的次数和蛋白质的取向。例如,单程膜蛋白穿过细胞膜一次,而多程膜蛋白穿过细胞膜至少两次(例如2、3、4、5、6、7次或更多次)。
膜蛋白可被定义为i型、ii型或iii型,这取决于它们的末端和相对于细胞内部和外部的膜通过区段的拓扑。i型膜蛋白具有单个跨膜区并且被取向为使得蛋白质的n端存在于细胞脂质双层的细胞外侧,而蛋白质的c端存在于胞质侧。ii型膜蛋白也具有单个跨膜区,但被取向以使得蛋白质的c端存在于细胞脂质双层的细胞外侧,而蛋白质的n端存在于胞质侧。iii型膜蛋白具有多个跨膜区段,并且可以根据跨膜区段的数量以及n和c端的位置进一步细分。
在一些实施方案中,本文所述的car多肽的跨膜结构域衍生自i型单程膜蛋白。单程膜蛋白包括但不限于cd8α、cd8β、4-1bb/cd137、cd27、cd28、cd34、cd4、fcεriγ、cd16、ox40/cd134、cd3ζ、cd3ε、cd3γ、cd3δ、tcrα、tcrβ、tcrζ、cd32、cd64、cd64、cd45、cd5、cd9、cd22、cd37、cd80、cd86、cd40、cd40l/cd154、vegfr2、fas和fgfr2b。在一些实施方案中,跨膜结构域来自选自以下的膜蛋白:cd8α、cd8β、4-1bb/cd137、cd28、cd34、cd4、fcεriγ、cd16、ox40/cd134、cd3ζ、cd3ε、cd3γ、cd3δ、tcrα、cd32、cd64、vegfr2、fas和fgfr2b。在一些实例中,跨膜结构域是cd8的(例如,跨膜结构域是cd8α的)。在一些实例中,跨膜结构域是4-1bb/cd137的。在其它实例中,跨膜结构域是cd28的。在一些情况下,这样的car多肽可以不含任何铰链结构域。或者或另外,这样的car多肽可以包含两个或更多个如本文所述的共刺激区。在其它实例中,跨膜结构域是cd34的。在又其它的实例中,跨膜结构域不衍生自人cd8α。在一些实施方案中,car多肽的跨膜结构域是单程α螺旋。
来自多程膜蛋白的跨膜结构域也可以相容用于本文所述的car多肽中。多程膜蛋白可以包含复杂的α螺旋结构(例如,至少2、3、4、5、6、7个或更多个α螺旋)或β折叠结构。优选地,多程膜蛋白的n端和c端存在于脂质双层的相对侧,例如,蛋白质的n端存在于脂质双层的胞质侧,而蛋白质的c端存在于细胞外侧。来自多程膜蛋白的一个或多个螺旋通道可用于构建本文所述的car多肽。
用于本文所述的car多肽中的跨膜结构域还可以包含合成的非天然存在的蛋白质区段的至少一部分。在一些实施方案中,跨膜结构域是合成的非天然存在的α螺旋或β折叠。在一些实施方案中,蛋白质区段是至少约20个氨基酸,例如,至少18、19、20、21、22、23、24、25、26、27、28、29、30个或更多个氨基酸。合成的跨膜结构域的实例是本领域已知的,例如在美国专利号7,052,906b1和pct公布号wo2000/032776a2中,其各自的相关公开内容以引用的方式并入本文。
在一些实施方案中,跨膜结构域的氨基酸序列不包含半胱氨酸残基。在一些实施方案中,跨膜结构域的氨基酸序列包含一个半胱氨酸残基。在一些实施方案中,跨膜结构域的氨基酸序列包含两个半胱氨酸残基。在一些实施方案中,跨膜结构域的氨基酸序列包含多于两个半胱氨酸残基(例如3、4、5个或更多个)。
跨膜结构域可以包含跨膜区和位于跨膜结构域的c端侧处的胞质区。跨膜结构域的胞质区可以包含三个或更多个氨基酸,并且在一些实施方案中,有助于使跨膜结构域在脂质双层中的取向。在一些实施方案中,一个或多个半胱氨酸残基存在于跨膜结构域的跨膜区中。在一些实施方案中,一个或多个半胱氨酸残基存在于跨膜结构域的胞质区中。在一些实施方案中,跨膜结构域的胞质区包含带正电荷的氨基酸。在一些实施方案中,跨膜结构域的胞质区包含氨基酸精氨酸、丝氨酸和赖氨酸。
在一些实施方案中,跨膜结构域的跨膜区包含疏水性氨基酸残基。在一些实施方案中,跨膜区主要包含疏水性氨基酸残基,诸如丙氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、色氨酸或缬氨酸。在一些实施方案中,跨膜区是疏水的。在一些实施方案中,跨膜区包含聚亮氨酸-丙氨酸序列。
蛋白质或蛋白质区段的亲水性、疏水性或亲水性特征可以通过本领域已知的任何方法来评估,包括例如kyte和doolittle亲水性分析。
c.共刺激信号传导结构域
除了刺激抗原特异性信号外,许多免疫细胞还需要共刺激,以促进细胞增殖、分化和存活,以及活化细胞的效应子功能。在一些实施方案中,本文所述的car多肽包含至少一个共刺激信号传导结构域。在某些实施方案中,car多肽可以包含cd28共刺激信号传导结构域或4-1bb(cd137)共刺激信号传导结构域。如本文所用,术语“共刺激信号传导结构域”是指共刺激信号传导蛋白的至少一个片段,其介导细胞内的信号转导以诱导免疫应答,诸如效应子功能(次级信号)。如本领域中已知,诸如t细胞的免疫细胞的活化通常需要两个信号:(1)通过t细胞受体(tcr)与由抗原呈递细胞呈递的抗原肽/mhc复合物的接合触发的抗原特异性信号(初级信号),其通常由cd3ζ作为tcr复合物的组分驱动;以及(ii)通过共刺激受体与其配体之间的相互作用触发的共刺激信号(次级信号)。共刺激受体转导共刺激信号(次级信号),作为tcr触发信号的补充,并调节由免疫细胞(诸如t细胞、nk细胞、巨噬细胞、中性粒细胞或嗜酸性粒细胞)介导的反应。
共刺激信号传导结构域在宿主细胞(例如免疫细胞)中的活化可以诱导细胞增加或减少细胞因子的产生和分泌、吞噬特性、增殖、分化、存活和/或细胞毒性。任何共刺激分子的共刺激信号传导结构域可以相容用于本文所述的car多肽中。共刺激信号传导结构域的类型是根据多种因素选择的,诸如将在其中表达car多肽的免疫细胞的类型(例如t细胞、nk细胞、巨噬细胞、中性粒细胞或嗜酸性粒细胞)和所需的免疫效应子功能。用于car多肽中的共刺激信号传导结构域的实例可以是共刺激蛋白的胞质信号传导结构域,包括但不限于b7/cd28家族的成员(例如,b7-1/cd80、b7-2/cd86、b7-h1/pd-l1、b7-h2、b7-h3、b7-h4、b7-h6、b7-h7、btla/cd272、cd28、ctla-4、gi24/vista/b7-h5、icos/cd278、pd-1,pd-l2/b7-dc和pdcd6);tnf超家族的成员(例如,4-1bb/tnfsf9/cd137、4-1bb配体/tnfsf9、baff/blys/tnfsf13b、baffr/tnfrsf13c、cd27/tnfrsf7、cd27配体/tnfsf7、cd30/tnfrsf8、cd30配体/tnfsf8、cd40/tnfrsf5、cd40/tnfsf5、cd40配体/tnfsf5、dr3/tnfrsf25、gitr/tnfrsf18、gitr配体/tnfsf18、hvem/tnfrsf14、light/tnfsf14、淋巴毒素-α/tnf-β、ox40/tnfrsf4、ox40配体/tnfsf4、relt/tnfrsf19l、taci/tnfrsf13b、tl1a/tnfsf15、tnf-α和tnfrii/tnfrsf1b);slam家族的成员(例如,2b4/cd244/slamf4、blame/slamf8、cd2、cd2f-10/slamf9、cd48/slamf2、cd58/lfa-3、cd84/slamf5、cd229/slamf3、cracc/slamf7、ntb-a/slamf6和slam/cd150);及任何其它共刺激分子,诸如cd2、cd7、cd53、cd82/kai-1、cd90/thy1、cd96、cd160、cd200、cd300a/lmir1、hlai类、hla-dr、ikaros、整合素α4/cd49d、整合素α4β1、整合素α4β7/lpam-1、lag-3、tcl1a、tcl1b、crtam、dap12、dectin-1/clec7a、dppiv/cd26、ephb6、tim-1/kim-1/havcr、tim-4、tslp、tslpr、淋巴细胞功能相关抗原-1(lfa-1)和nkg2c。在一些实施方案中,共刺激信号传导结构域是4-1bb、cd28、ox40、icos、cd27、gitr、hvem、tim1、lfa1(cd11a)或cd2或其任何变体的。
同样在本公开的范围内的是本文所述的任何共刺激信号传导结构域的变体,使得该共刺激信号传导结构域能够调节免疫细胞的免疫应答。在一些实施方案中,与野生型对应物相比,共刺激信号传导结构域包含至多10个氨基酸残基突变(例如1、2、3、4、5或8个),诸如氨基酸取代、缺失或添加。包含一个或多个氨基酸变异(例如,氨基酸取代、缺失或添加)的此类共刺激信号传导结构域可被称为变体。
与不含突变的共刺激信号传导结构域相比,共刺激信号传导结构域的氨基酸残基的突变可导致信号转导的增加和对免疫应答的刺激的增强。与不含突变的共刺激信号传导结构域相比,共刺激信号传导结构域的氨基酸残基的突变可导致信号转导的减少和对免疫应答的刺激的减弱。例如,天然cd28氨基酸序列的残基186和187的突变可导致car多肽的共刺激结构域的共刺激活性增加和免疫应答的诱导。在一些实施方案中,突变是在位置186和187的每个处用cd28共刺激结构域的甘氨酸残基对赖氨酸的取代,称为cd28ll→gg变体。可在共刺激信号传导结构域中制造的可提高或降低该结构域的共刺激活性的额外突变对于本领域普通技术人员将是显而易见的。在一些实施方案中,共刺激信号传导结构域是4-1bb、cd28、ox40或cd28ll→gg变体的。
在一些实施方案中,car多肽可以包含单个共刺激结构域,例如像,cd27共刺激结构域、cd28共刺激结构域、4-1bb共刺激结构域、icos共刺激结构域或ox40共刺激结构域。
在一些实施方案中,car多肽可以包含一个以上的共刺激信号传导结构域(例如2、3个或更多个)。在一些实施方案中,car多肽包含两个或更多个相同的共刺激信号传导结构域,例如cd28的共刺激信号传导结构域的两个拷贝。在一些实施方案中,car多肽包含来自不同共刺激蛋白(诸如本文所述的任两个或更多个共刺激蛋白)的两个或更多个共刺激信号传导结构域。共刺激信号传导结构域的类型的选择可以基于诸如与car多肽一起使用的宿主细胞的类型(例如,t细胞或nk细胞)和所需的免疫效应子功能的因素。在一些实施方案中,car多肽包含两个共刺激信号传导结构域,例如cd28的共刺激信号传导结构域的两个拷贝。在一些实施方案中,car多肽可以包含来自不同共刺激受体的两个或更多个共刺激信号传导结构域,诸如本文所述的任何两个或更多个共刺激受体,例如,cd28和4-1bb、cd28和cd27、cd28和icos、cd28ll→gg变体和4-1bb、cd28和ox40、或cd28ll→gg变体和ox40。在一些实施方案中,两个共刺激信号传导结构域是cd28和4-1bb。在一些实施方案中,两个共刺激信号传导结构域是cd28ll→gg变体和4-1bb。在一些实施方案中,两个共刺激信号传导结构域是cd28和ox40。在一些实施方案中,两个共刺激信号传导结构域是cd28ll→gg变体和ox40。在一些实施方案中,本文所述的car构建体可包含cd28与icosl的组合。在一些实施方案中,本文所述的car构建体可包含cd28与cd27的组合。在某些实施方案中,4-1bb共刺激结构域位于cd28或cd28ll→gg变体共刺激信号传导结构域的n端。
在一些实施方案中,本文所述的car多肽不包含共刺激信号传导结构域。
d.胞质信号传导结构域
任何胞质信号传导结构域可用于产生本文所述的car多肽。这样的胞质结构域可以是参与触发细胞信号传导(初级信号传导)的任何信号传导结构域,所述触发导致免疫细胞增殖和/或活化。如本文所述的胞质信号传导结构域不是共刺激信号传导结构域,如本领域所知,其传递共刺激或次级信号以完全活化免疫细胞。
本文所述的胞质结构域可以包含基于免疫受体酪氨酸的活化基序(itam)结构域,或者可以不含itam。如本文所用,“itam”是保守的蛋白质基序,其通常存在于许多免疫细胞中表达的信号传导分子的尾部。基序可以包含由6-8个氨基酸分隔的氨基酸序列yxxl/i的两个重复,其中每个x独立地是任何氨基酸,从而产生保守基序yxxl/ix(6-8)yxxl/i。信号传导分子内的itam对于细胞内的信号转导很重要,该信号转导至少部分由信号传导分子活化后itam中的酪氨酸残基的磷酸化介导。itam还可以充当信号传导途径中涉及的其它蛋白质的停泊位点。
在一些实例中,胞质信号传导结构域是cd3ζ或fcεr1γ。在其它实例中,胞质信号传导结构域不是源自人cd3ζ。
在一个特定实施方案中,可以将几个信号传导结构域融合在一起以产生累加或协同作用。有用的额外信号传导结构域的非限制性实例包括以下中的一个或多个的一部分或全部:tcrζ链、cd28、ox40/cd134、4-1bb/cd137、fcεriy、icos/cd278、il2r-β/cd122、il-2r-γ/cd132和cd40。
在其它实施方案中,本文所述的胞质信号传导结构域不含itam基序。实例包括但不限于:jak/stat、toll-白介素受体(tir)和酪氨酸激酶的胞质信号传导结构域。
e.铰链结构域
在一些实施方案中,本文所述的car多肽还包含位于细胞外抗原结合结构域与跨膜结构域之间的铰链结构域。铰链结构域是通常见于蛋白质的两个结构域之间的氨基酸区段,并且可以允许蛋白质的柔性及一个或两个结构域相对于彼此的运动。可以使用提供这种柔性及细胞外抗原结合结构域相对于car多肽的跨膜结构域的运动的任何氨基酸序列。
本领域已知的包含铰链结构域的任何蛋白质的铰链结构域均相容用于本文所述的car多肽中。在一些实施方案中,铰链结构域是天然存在的蛋白质的铰链结构域的至少一部分,并且赋予car多肽以柔性。在一些实施方案中,铰链结构域是cd8的。在一些实施方案中,铰链结构域是cd8的铰链结构域的一部分,例如,包含cd8的铰链结构域的至少15个(例如20、25、30、35或40个)连续氨基酸的片段。在一些实施方案中,铰链结构域是cd28的。在一些实施方案中,铰链结构域是cd28的铰链结构域的一部分,例如,包含cd28的铰链结构域的至少15个(例如20、25、30、35或40个)连续氨基酸的片段。
抗体诸如igg、iga、igm、ige或igd抗体的铰链结构域也相容用于本文所述的car多肽中。在一些实施方案中,铰链结构域是连接抗体的恒定结构域ch1和ch2的铰链结构域。在一些实施方案中,铰链结构域是抗体的,并且包含抗体的铰链结构域和抗体的一个或多个恒定区。在一些实施方案中,铰链结构域包含抗体的铰链结构域和抗体的ch3恒定区。在一些实施方案中,铰链结构域包含抗体的铰链结构域以及抗体的ch2和ch3恒定区。在一些实施方案中,抗体是igg、iga、igm、ige或igd抗体。在一些实施方案中,抗体为igg抗体。在一些实施方案中,抗体是igg1、igg2、igg3或igg4抗体。在一些实施方案中,铰链区包含igg1抗体的铰链区以及ch2和ch3恒定区。在一些实施方案中,铰链区包含igg1抗体的铰链区和ch3恒定区。
非天然存在的肽也可用作本文所述的car多肽的铰链结构域。
在一些实施方案中,介于细胞外抗原结合结构域的c端与跨膜结构域的n端之间的铰链结构域是肽接头,诸如(glyxser)n接头,其中x和n可以独立地是介于3与12之间的整数,包括3、4、5、6、7、8、9、10、11、12或更大。在一些实施方案中,铰链结构域是(gly4ser)n(seqidno:3),其中n可以是介于3与60之间的整数,包括3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60。在某些实施方案中,n可以是大于60的整数。在一些实施方案中,铰链结构域是(gly4ser)3(seqidno:4)。在一些实施方案中,铰链结构域是(gly4ser)6(seqidno:5)。在一些实施方案中,铰链结构域是(gly4ser)9(seqidno:6)。在一些实施方案中,铰链结构域是(gly4ser)12(seqidno:7)。在一些实施方案中,铰链结构域是(gly4ser)15(seqidno:8)。在一些实施方案中,铰链结构域是(gly4ser)30(seqidno:9)。在一些实施方案中,铰链结构域是(gly4ser)45(seqidno:10)。在一些实施方案中,铰链结构域是(gly4ser)60(seqidno:11)。
在其它实施方案中,铰链结构域是延伸的重组多肽(xten),其是由不同长度的亲水性残基(例如10-80个氨基酸残基)组成的非结构化多肽。xten肽的氨基酸序列对本领域技术人员将是显而易见的,并且可见于例如美国专利号8,673,860中,其相关公开内容以引用的方式并入本文。在一些实施方案中,铰链结构域是xten肽并且包含60个氨基酸。在一些实施方案中,铰链结构域是xten肽并且包含30个氨基酸。在一些实施方案中,铰链结构域是xten肽并且包含45个氨基酸。在一些实施方案中,铰链结构域是xten肽并且包含15个氨基酸。
用于制造如本文所述的car多肽的任何铰链结构域可含有至多250个氨基酸残基。在一些情况下,car多肽可含有相对较长的铰链结构域,例如,含有150-250个氨基酸残基(例如150-180个氨基酸残基、180-200个氨基酸残基或200-250个氨基酸残基)。在其它情况下,car多肽可含有中等大小的铰链结构域,其可含有60-150个氨基酸残基(例如60-80、80-100、100-120或120-150个氨基酸残基)。或者,car多肽可含有短铰链结构域,其可含有少于60个氨基酸残基(例如1-30个氨基酸或31-60个氨基酸)。在一些实施方案中,本文所述的car构建体不含有铰链结构域。
f.信号肽
在一些实施方案中,car多肽还在多肽的n端包含信号肽(也称为信号序列)。通常,信号序列是将多肽靶向细胞中的所需位点的肽序列。在一些实施方案中,信号序列将car多肽靶向细胞分泌途径,并将允许将car多肽整合及锚定到脂质双层中。信号序列包括天然存在的蛋白质的信号序列或合成的、非天然存在的信号序列,其相容用于本文所述的car多肽中,所述信号序列对本领域技术人员来说是显而易见的。在一些实施方案中,信号序列来自cd8α。在一些实施方案中,信号序列来自cd28。在其它实施方案中,信号序列来自鼠类κ链。在又其它实施方案中,信号序列来自cd16。
g.car多肽的实例
表1提供本文所述的示例性car多肽。这些示例性构建体从n端到c端依次具有信号序列、抗原结合结构域(例如,对gpc3具有特异性的scfv片段)、铰链结构域和跨膜,而任选的共刺激结构域与胞质信号传导结构域的位置可以交换。
表1:car多肽的示例性组分
以下提供了示例性car多肽的氨基酸序列(信号序列以斜体示出)。
seqidno:1:
seqidno:2:
iii.表达共刺激多肽和抗gpc3car多肽的造血细胞
本文提供了表达一种或多种如本文所述的共刺激多肽和抗gpc3car多肽(例如,表达car的细胞,例如cart细胞)的基因工程改造的宿主细胞(例如,造血细胞,诸如造血干细胞和免疫细胞,例如t细胞或nk细胞)。在一些实施方案中,宿主细胞是造血细胞或其后代。在一些实施方案中,造血细胞可以是造血干细胞。在其它实施方案中,宿主细胞是免疫细胞,诸如t细胞或nk细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。在其它实施方案中,免疫细胞可以是建立的细胞系,例如nk-92细胞。
在一些情况下,待引入宿主细胞中的共刺激多肽与宿主细胞的内源性蛋白质相同。相对于天然对应物,将共刺激多肽的编码序列的另外拷贝引入宿主细胞将提高多肽的表达水平(即,过度表达)。在一些情况下,待引入宿主细胞中的共刺激多肽与宿主细胞是异源的,即在宿主细胞中不存在或不表达。这样的异源共刺激多肽可以是不在宿主细胞中天然地表达的天然存在的蛋白质(例如,来自不同物种)。或者,异源共刺激多肽可以是天然蛋白质的变体,诸如本文所述的那些。在一些实例中,编码核酸的外源(即非宿主细胞原生的)拷贝可以在染色体外存在。在其它实例中,编码序列的外源拷贝可以整合到宿主细胞的染色体中,并且可以位于与内源性基因的天然基因座不同的位点处。
这样的基因工程改造的宿主细胞具有调节共刺激途径的能力。鉴于其预期的高增殖率、生物活性和/或存活率,预期基因工程改造的细胞诸如t细胞和nk细胞相比于不表达或表达较低水平或较小活性形式的共刺激多肽的cart细胞将具有更高的治疗功效。
免疫细胞群可从任何来源获得,诸如外周血单核细胞(pbmc)、骨髓或组织(诸如脾脏、淋巴结、胸腺、干细胞或肿瘤组织)。或者,免疫细胞群可以衍生自干细胞,例如造血干细胞和诱导性多能干细胞(ipsc)。适合获得所需宿主细胞类型的来源对本领域技术人员来说是显而易见的。在一些实施方案中,免疫细胞群衍生自pbmc,其可以获自需要本文所述的治疗的患者(例如人类患者)。所需的宿主细胞类型(例如,t细胞、nk细胞、或t细胞和nk细胞)可以在通过将细胞与刺激性分子共温育而获得的细胞群内扩增。作为非限制性实例,抗cd3和抗cd28抗体可用于t细胞的扩增。
为了构建表达本文所述的任何共刺激多肽和抗gpc3多肽的免疫细胞,用于稳定或瞬时表达共刺激多肽和/或car多肽的表达载体可以通过如本文所述的常规方法来产生,并将其引入免疫宿主细胞中。例如,编码共刺激多肽和/或car多肽的核酸可被克隆到一个或两个合适的表达载体中,诸如与合适的启动子可操作连接的病毒载体或非病毒载体。在一些情况下,car多肽和共刺激多肽的每个编码序列在两个单独的核酸分子上,并且可被克隆到两个单独的载体中,所述载体可以同时或顺序地引入合适的宿主细胞中。或者,car多肽和共刺激多肽的编码序列在一个核酸分子上,并且可以被克隆到一个载体中。car多肽和共刺激多肽的编码序列可与两个不同的启动子可操作地连接,使得两个多肽的表达由不同的启动子控制。或者,car多肽和共刺激多肽的编码序列可以与一个启动子可操作地连接,使得两个多肽的表达由单个启动子控制。可以在两个多肽的编码序列之间插入合适的序列,从而可以从单个mrna分子转译出两个单独的多肽。这样的序列(例如ires或核糖体跳跃位点)在本领域中是众所周知的。下面提供了另外的描述。
可以在合适的条件下使核酸和载体与限制酶接触,以在每个分子上产生可以彼此配对并与连接酶连接的互补端。或者,可以将合成核酸接头连接到编码共刺激多肽和/或抗gpc3car多肽的核酸的末端。合成接头可含有对应于载体中的特定限制性位点的核酸序列。表达载体/质粒/病毒载体的选择将取决于表达共刺激多肽和/或car多肽的宿主细胞的类型,但应适于在真核细胞中整合及复制。
多种启动子可用于表达本文所述的共刺激多肽和/或抗gpc3car多肽,包括但不限于巨细胞病毒(cmv)中间早期启动子、病毒ltr(诸如劳斯肉瘤病毒ltr、hiv-ltr、htlv-1ltr、猿猴病毒40(sv40)早期启动子、人ef1-α启动子或单纯疱疹tk病毒启动子。用于表达共刺激多肽和/或car多肽的另外启动子包括免疫细胞中的任何组成型活性启动子。或者,可以使用任何可调节的启动子,从而可以在免疫细胞内调节其表达。
另外,载体可含有例如以下的一些或全部:选择标记基因,诸如新霉素基因或卡那霉素基因,用于在宿主细胞中选择稳定或瞬时转染子;来自人cmv的立即早期基因的增强子/启动子序列,用于高水平转录;人ef1-α基因的内含子序列;来自sv40的转录终止和rna加工信号,用于确保mrna稳定;sv40多瘤病毒的复制起点和cole1,用于适当的游离型复制;内部核糖体结合位点(irese),通用的多克隆位点;t7和sp6rna启动子,用于体外转录有义和反义rna;“自杀开关”或“自杀基因”,当触发时会导致携带该载体的细胞死亡(例如,hsv胸苷激酶或诱导型胱天蛋白酶,诸如icasp9);以及报告基因,用于评估共刺激多肽和/或抗gpc3car多肽的表达。
在一个特定的实施方案中,此类载体还包括自杀基因。如本文所用,术语“自杀基因”是指使表达自杀基因的细胞死亡的基因。自杀基因可以是在表达该基因的细胞上赋予对试剂例如药物的敏感性并且当该细胞与该试剂接触或暴露于该试剂时导致该细胞死亡的基因。自杀基因是本领域已知的(参见,例如,suicidegenetherapy:methodsandreviews,springer,carolinej.(cancerresearchukcentreforcancertherapeuticsattheinstituteofcancerresearch,sutton,surrey,uk),humanapress,2004),并且包括单纯疱疹病毒(hsv)胸苷激酶(tk)基因、胞嘧啶脱氨酶、嘌呤核苷磷酸化酶、硝基还原酶和胱天蛋白酶(诸如胱天蛋白酶8)。
合适的载体和用于产生包含转基因的载体的方法是本领域中众所周知及可获得的。用于表达共刺激多肽和/或抗gpc3car多肽的载体的制备实例可见于例如us2014/0106449中,该文献以引用的方式整体并入本文。
包含编码本文所述的共刺激多肽和/或抗gpc3car多肽的核酸序列的任何载体也在本公开的范围内。这种载体或其中所含的编码共刺激多肽和/或car多肽的序列可以通过任何合适的方法被递送到宿主细胞诸如宿主免疫细胞中。递送载体到免疫细胞的方法是本领域众所周知的,并且可以包括dna电穿孔、rna电穿孔、使用诸如脂质体的试剂的转染或病毒转导(例如逆转录病毒转导,诸如慢病毒转导)。
在一些实施方案中,用于表达共刺激多肽和/或抗gpc3car多肽的载体通过病毒转导(例如逆转录病毒转导,诸如慢病毒或γ逆转录病毒转导)被递送到宿主细胞。用于递送的示例性病毒方法包括但不限于重组逆转录病毒(参见,例如,pct公布号wo90/07936;wo94/03622;wo93/25698;wo93/25234;wo93/11230;wo93/10218;和wo91/02805;美国专利5,219,740和4,777,127;gb专利号2,200,651;及欧洲专利号0345242)、基于α病毒的载体和腺相关病毒(aav)载体(例如,参见pct公布号wo94/12649;wo93/03769;wo93/19191;wo94/28938;wo95/11984;和wo95/00655)。在一些实施方案中,用于表达共刺激多肽和/或car多肽的载体是逆转录病毒。在一些实施方案中,用于表达共刺激多肽和/或car多肽的载体是慢病毒。
描述逆转录病毒转导的参考文献的实例包括anderson等人,美国专利号5,399,346;mann等人,cell33:153(1983);temin等人,美国专利号4,650,764;temin等人,u.s.pat.no.4,980,289;markowitz等人,j.virol.62:1120(1988);temin等人,美国专利号5,124,263;1995年3月16日公开的dougherty等人的国际专利公布号wo95/07358;以及kuo等人,blood82:845(1993)。wo95/07358描述了原代b淋巴细胞的高效转导。出于本文所引用的目的和主题,还参见wo2016040441a1,该文献以引用的方式并入本文。
在其中编码共刺激多肽和/或抗gpc3car多肽的载体使用病毒载体被引入宿主细胞的例子中,能够感染免疫细胞并携带载体的病毒颗粒可以通过本领域已知的任何方法产生,并且可见于例如wo1991/002805a2、wo1998/009271a1和美国专利6,194,191中。病毒颗粒从细胞培养上清液中收获,并且可以在病毒颗粒与免疫细胞接触之前被分离和/或纯化。
在一些实施方案中,编码如本文所述的任何共刺激多肽和/或抗gpc3car多肽的rna分子可以通过常规方法(例如,体外转录)来制备,然后经由已知方法(例如rabinovich等人,humangenetherapy17:1027-1035)引入合适的宿主细胞(例如本文所述的那些)中。
在一些情况下,可以将编码共刺激多肽的核酸和编码合适的抗gpc3car多肽的核酸克隆到单独的表达载体中,所述表达载体可以同时或顺序地引入合适的宿主细胞中。例如,可以首先将用于表达共刺激多肽的表达载体(或rna分子)引入宿主细胞,并且可以分离并在体外培养表达共刺激多肽的转染宿主细胞。然后可以将用于表达合适的car多肽的表达载体(或rna分子)引入表达共刺激多肽的宿主细胞中,并且可以分离表达两种多肽的转染细胞。在另一个实例中,分别用于表达共刺激多肽和car多肽的表达载体(或rna分子)可被同时引入宿主细胞,并且可以通过常规方法分离表达两种多肽的转染宿主细胞。
在其它情况下,可以将编码共刺激多肽的核酸和编码抗gpc3car多肽的核酸克隆到同一表达载体中。用于表达car和共刺激多肽的多核苷酸(包括这种多核苷酸可操作地连接到至少一个调节元件上的载体)也在本公开的范围内。本公开的有用载体的非限制性实例包括病毒载体,例如像逆转录病毒载体,包括γ逆转录病毒载体、腺相关病毒载体(aav载体)和慢病毒载体。
在一些情况下,编码共刺激多肽和/或抗gpc3car多肽的核酸可以经由转座子被递送到宿主细胞中。在一些情况下,可以经由例如crispr、talen、zfn或大范围核酸酶的基因编辑将编码核酸递送到宿主细胞中。
在一些情况下,本文所述的核酸可以包含两个编码序列,一个编码如本文所述的抗gpc3car多肽,另一个编码能够调节共刺激途径的多肽(即,共刺激多肽)。包含本文所述的两个编码序列的核酸可被构造以使得可以将由两个编码序列编码的多肽表达为独立的(和物理上分开的)多肽。为了实现该目的,本文所述的核酸可含有位于第一与第二编码序列之间的第三核苷酸序列。此第三核苷酸序列可以例如编码核糖体跳跃位点。核糖体跳跃位点是损害正常肽键形成的序列。此机制导致转译来自一个信使rna的另外的开放阅读框。此第三核苷酸序列可以例如编码p2a、t2a或f2a肽(参见,例如,kim等人,plosone.2011;6(4):e18556)。作为非限制性实例,示例性p2a肽可以具有atnfsllkqagdveenpgpseqidno:72的氨基酸序列。
在另一个实施方案中,第三核苷酸序列可以编码内部核糖体进入位点(ires)。ires是rna元件,它允许以非末端依赖性方式进行转译起始,还允许转译来自一个信使rna的另外的开放阅读框。或者,第三核苷酸序列可以编码控制第二多肽表达的第二启动子。第三核苷酸序列还可以编码一个以上的核糖体跳跃序列、ires序列、另外的启动子序列或其组合。
核酸还可以包含另外的编码序列(包括但不限于第四和第五编码序列),并且可被构造以使得由另外的编码序列编码的多肽被表达为其它独立且物理上分离的多肽。为此,可以通过编码一个或多个核糖体跳跃序列、ires序列或另外的启动子序列的一个或多个核苷酸序列,将另外的编码序列与其它编码序列分开。
在一些实例中,核酸(例如,本文所述的表达载体或rna分子)可以包含共刺激多肽(例如,本文所述的那些)和合适的抗gpc3car多肽两者的编码序列,这两个编码序列以任何顺序被编码p2a肽的第三核苷酸序列(例如,atnfsllkqagdveenpgp;seqidno:72)分开。结果,可以从这样的核酸产生两个单独的多肽,即共刺激多肽和car,其中p2a部分atnfsllkqagdveenpg(seqidno:73)连接到上游多肽(由上游编码序列编码)并且来自p2a肽的残基p与下游多肽(由下游编码序列编码)连接。在一些实例中,car多肽是上游多肽,而共刺激多肽是下游多肽。在其它实例中,共刺激多肽是上游多肽,而car多肽是下游多肽。
在一些实例中,上述核酸可进一步编码介于编码序列的两个区段之间,例如介于上游多肽与p2a肽之间的接头(例如,gsg接头)。
在特定实例中,本文所述的核酸被构造以使得其在转染了该核酸的宿主细胞中表达两种单独的多肽:(i)从n端至c端含有合适的抗gpc3car(例如seqidno:1或seqidno:2)、肽接头(例如,gsg接头)及源自p2a肽的atnfsllkqagdveenpg(seqidno:73)区段的第一多肽;和(ii)从n端至c端含有源自p2a肽的p残基和共刺激多肽(例如,seqidno:12-71中的任一个)的第二多肽。
在一些实例中,基因工程改造的免疫细胞共表达抗gpc3car与共刺激多肽诸如4-1bb、4-1bbl(例如,天然4-1bbl的变体,诸如本文所述的那些)、icos、icosl、ox40、ox40l、cd70、light、cd30l、gitrl、cd40、cd40l、tl1a、baffr或cd27的组合。在其它实例中,基因工程改造的免疫细胞共表达car构建体与共刺激多肽诸如4-1bbl(例如,天然4-1bbl的变体,诸如本文所述的那些)、icosl、ox40l、cd70、light、gitrl、cd40l或tl1a的组合。或者,基因工程改造的免疫细胞可以共表达包含cd28共刺激结构域的car与也包含cd28共刺激结构域的共刺激多肽的组合。
在一些实施方案中,car多肽包含cd28共刺激分子的共刺激结构域,并且所述共刺激多肽是cd70、light、ox40l、tl1a、baffr、cd40、cd40l、cd27、4-1bb或icos。在一些实施方案中,car多肽包含cd28共刺激分子的共刺激结构域,并且所述共刺激多肽是baffr或cd27。cd28共刺激分子可以包含seqidno:12的氨基酸序列。baffr可以包含seqidno:31的氨基酸序列,而cd27可以包含seqidno:33的氨基酸序列。
在其它实施方案中,car多肽包含4-1bb共刺激分子的共刺激结构域,并且所述共刺激多肽是cd70、light、ox40l、baffr、cd27或ox40。在其它实施方案中,car多肽包含4-1bb共刺激分子的共刺激结构域,并且所述共刺激多肽是cd70、light或ox40l。4-1bb共刺激分子可以包含seqidno:22的氨基酸序列。cd70可以包含seqidno:34的氨基酸序列,light可以包含seqidno:43的氨基酸序列,并且ox40l可以包含seqidno:47的氨基酸序列。
在其它实施方案中,基因工程改造的免疫细胞共表达具有4-1bb共刺激结构域(诸如seqidno:1)的抗gpc3car与共刺激多肽诸如4-1bb、4-1bbl(例如,天然4-1bbl的变体,诸如本文所述的那些)、icos、icosl、ox40、ox40l、cd70、light、cd30l、gitrl、cd40、cd40l、tl1a、baffr(例如,天然baffr的变体,诸如本文所述的那些)或cd27的组合。在一些实施方案中,基因工程改造的免疫细胞共表达具有4-1bb共刺激结构域(诸如seqidno:1)的抗gpc3car与共刺激多肽icosl、baffr(例如,天然baffr的变体,诸如本文所述的那些)、light、cd30l或cd27的组合。
在又其它实施方案中,基因工程改造的免疫细胞共表达具有cd28共刺激结构域(诸如seqidno:2)的抗gpc3car与共刺激多肽诸如4-1bb,4-1bbl(例如,天然4-1bbl的变体,诸如本文所述的那些)、icos、icosl、ox40、ox40l、cd70、light、cd30l、gitrl、cd40、cd40l、tl1a、baffr(例如,天然baffr的变体,诸如本文所述的那些)或cd27的组合。在一些实施方案中,基因工程改造的免疫细胞共表达具有cd28共刺激结构域(诸如seqidno:2)的抗gpc3car与共刺激多肽icosl、baffr(例如,天然baffr的变体,诸如本文所述的那些)、light、cd30l或cd27的组合。
或者,基因工程改造的免疫细胞可以共表达包含共刺激结构域(诸如4-1bb或cd28)的car与也包含相同共刺激结构域的共刺激多肽的组合。在其它实施方案中,基因工程改造的免疫细胞可以共表达包含共刺激结构域诸如4-1bb或cd28的car与不同共刺激多肽例如4-1bb、4-1bbl(例如(例如,天然4-1bbl的变体,诸如本文所述的那些)、icos、icosl、ox40、ox40l、cd70、light、cd30l、gitrl、cd40、cd40l、tl1a、baffr或cd27的组合。
在一些实施方案中,基因工程改造的免疫细胞可以共表达包含共刺激结构域(诸如4-1bb或cd28)和铰链结构域的car与也包含共刺激结构域的共刺激多肽的组合。在一些实施方案中,共刺激结构域、铰链结构域和共刺激多肽来自相同的共刺激分子,诸如4-1bb或cd28。在一些实施方案中,共刺激结构域、铰链结构域和共刺激多肽来自不同的共刺激分子。或者或另外,本文公开的car构建体可以包含cd8的跨膜结构域或其一部分。
在一些实施方案中,基因工程改造的免疫细胞可以共表达不含铰链结构域的car与共刺激多肽例如4-1bb、4-1bbl(例如,天然4-1bbl的变体,诸如本文所述的那些)、icos、icosl、ox40、ox40l、cd70、light、cd30l、gitrl、cd40、cd40l、tl1a、baffr(例如,天然baffr的变体,诸如本文所述的那些)或cd27的组合。在一些实施方案中,基因工程改造的免疫细胞共表达不含铰链结构域的car与共刺激多肽icosl、baffr(例如,天然baffr的变体,如本文所述的那些)、light、cd30l或cd27的组合。
在一些实施方案中,基因工程改造的免疫细胞可以共表达car(例如,本文所述的那些)和共刺激多肽,其为4-1bbl。在一些情况下,4-1bbl可以是天然存在的4-1bbl(例如人4-1bbl)的功能变体,例如,本文公开的任何变体(例如4-1bblq89a、4-1bbll115a、4-1bblk127a或4-1bblq227a)。在一些实例中,4-1bbl多肽是天然存在的对应物的截短变体,其中截短的变体缺少胞质片段。
在一些实施方案中,基因工程改造的免疫细胞(例如,t细胞)共表达:(a)包含4-1bb共刺激结构域(例如,seqidno:1)或cd28共刺激结构域(例如seqidno:2)的car构建体,和(b)共刺激分子(外源性),如本文所公开的那些(例如,cd70、light、ox40l或cd27),并且相对于表达相同car但不表达外源性共刺激分子的免疫细胞表现出更高的生物活性(这可以由更多的il-2分泌来证明)和/或更高的增殖活性。在一些实施方案中,基因工程改造的免疫细胞(例如t细胞)共表达:(a)包含具有4-1bb共刺激结构域的抗gpc3car的car构建体(例如,包含seqidno:1的car构建体),和(b)cd70。在一些实施方案中,基因工程改造的免疫细胞(例如,t细胞)共表达:(a)包含具有4-1bb共刺激结构域的抗gpc3car的car构建体(例如,包含seqidno:1的car构建体),和(b)light。在一些实施方案中,基因工程改造的免疫细胞(例如,t细胞)共表达:(a)包含具有4-1bb共刺激结构域的抗gpc3car的car构建体(例如,包含seqidno:1的car构建体),和(b)ox40l。在一些实施方案中,基因工程改造的免疫细胞(例如,t细胞)共表达:(a)包含cd28共刺激结构域的car构建体(例如,包含seqidno:2的car构建体),和(b)cd27。
如以下实施例显示,当与它们的共刺激分子一起表达时,这种car构建体相对于其各自的亲本car构建体表现出:改善的增殖;改善的细胞因子产生;在体内小鼠肿瘤模型中改善的功效;增加的t细胞持久性;对mdsc抑制改善的抗性;和/或对treg抑制改善的抗性。在一些情况下,还可以将另外的目标多肽引入宿主免疫细胞中。
在编码本文提供的任何共刺激多肽和/或抗gpc3car多肽的载体或编码抗gpc3car多肽和/或共刺激多肽(例如,rna分子)的核酸引入宿主细胞之后,可以在允许表达共刺激多肽和/或car多肽的条件下培养细胞。在其中编码共刺激多肽和/或car多肽的核酸受到可调节启动子调节的例子中,可以在可调节启动子被活化的条件下培养宿主细胞。在一些实施方案中,启动子是诱导型启动子,并且在诱导分子的存在下或在产生诱导分子的条件下培养免疫细胞。确定共刺激多肽和/或car多肽是否表达对本领域技术人员来说是显而易见的,并且可以通过任何已知方法进行评估,例如,通过定量逆转录酶pcr(qrt-pcr)检测编码共刺激多肽和/或car多肽的mrna,或者通过包括蛋白质印迹、荧光显微镜和流式细胞术的方法检测共刺激多肽和/或car多肽蛋白。
或者,抗gpc3car多肽的表达可以在将免疫细胞施用于受试者之后在体内进行。如本文所用,术语“受试者”是指任何哺乳动物,诸如人、猴、小鼠、兔或家养哺乳动物。例如,受试者可以是灵长类动物。在一个优选的实施方案中,受试者是人。
或者,共刺激多肽和/或抗gpc3多肽在本文公开的任何免疫细胞中的表达可通过引入编码共刺激多肽和/或car多肽的rna分子来实现。这种rna分子可以通过体外转录或通过化学合成来制备。然后可以通过例如电穿孔将rna分子引入合适的宿主细胞,诸如免疫细胞(例如,t细胞、nk细胞、或t细胞和nk细胞两者)中。例如,可以按照rabinovich等人,humangenetherapy,17:1027-1035和wowo2013/040557中所述的方法合成rna分子并将其引入宿主免疫细胞中。
在某些实施方案中,包含共刺激多肽和/或抗gpc3car多肽的载体或rna分子可以在体内被引入宿主细胞或免疫细胞中。作为非限制性实例,这可以通过向受试者直接施用(例如,通过静脉内施用)编码本文所述的一种或多种共刺激多肽和/或一种或多种car多肽的载体或rna分子,从而在体内产生包含共刺激多肽和/或car多肽的宿主细胞来实现。
用于制备表达本文所述的任何共刺激多肽和/或抗gpc3car多肽的宿主细胞的方法还可以包括离体活化宿主细胞。活化宿主细胞意指将宿主细胞刺激成活化状态,在该状态下细胞可能能够执行效应子功能(例如,细胞毒性)。活化宿主细胞的方法将取决于用于表达共刺激多肽和/或car多肽的宿主细胞的类型。例如,可以在一种或多种分子的存在下离体活化t细胞,这些分子包括但不限于:抗cd3抗体、抗cd28抗体、il-2、植物凝集素、工程改造的人工刺激细胞或颗粒或其组合。工程改造的人工刺激细胞可以是本领域中已知的人工抗原呈递细胞。参见,例如,neal等人,j.immunol.res.ther.2017,2(1):68-79及turtle等人,cancerj.2010,16(4):374-381,出于本文引用的目的和主题,这些文献各自相关的公开内容以引用的方式并入本文。
在其它实例中,nk细胞可以在一种或多种分子诸如4-1bb配体、抗4-1bb抗体、il-15、抗il-15受体抗体、il-2、il12、il-18、il-21、k562细胞和/或工程改造的人工刺激细胞或颗粒的存在下离体活化。在一些实施方案中,表达本文所述的任何共刺激多肽和/或抗gpc3car多肽的宿主细胞(表达car和/或共刺激多肽的细胞)在向受试者施用之前离体活化。确定宿主细胞是否活化对于本领域技术人员来说是显而易见的,并且可以包括评估与细胞活化、细胞因子的表达或分泌以及细胞形态相关的一种或多种细胞表面标记的表达。
用于制备表达本文所述的任何共刺激多肽和/或抗gpc3car多肽的宿主细胞的方法可以包括离体扩增宿主细胞。扩增宿主细胞可能涉及导致表达共刺激多肽和/或car多肽的细胞数量增加以例如允许宿主细胞增殖或刺激宿主细胞增殖的任何方法。用于刺激宿主细胞扩增的方法将取决于用于表达共刺激多肽和/或car多肽的宿主细胞的类型并且是本领域技术人员显而易见的。在一些实施方案中,表达本文所述的任何共刺激多肽和/或car多肽的宿主细胞在向受试者施用之前离体扩增。
在一些实施方案中,表达共刺激多肽和/或抗gpc3car多肽的宿主细胞在向受试者施用所述细胞之前离体扩增并活化。宿主细胞的活化和扩增可用于使病毒载体整合到基因组中并表达编码本文所述的共刺激多肽和/或抗gpc3car多肽的基因。如果使用mrna电穿孔,则可能不需要活化和/或扩增,但在活化细胞上进行时,电穿孔可能更有效。在一些情况下,共刺激多肽和/或car多肽在合适的宿主细胞中瞬时表达(例如3-5天)。如果存在潜在毒性,则瞬时表达可为有利的,并且在临床测试的初始阶段应对可能的副作用有帮助。
表达共刺激多肽和/或抗gpc3car多肽的任何宿主细胞都可以与药学上可接受的载剂混合以形成药物组合物,这也在本公开的范围内。
短语“药学上可接受的”在与本公开的组合物结合使用时是指这种组合物的分子实体和其它成分,其在生理上可耐受并且当施用于哺乳动物(例如,人)时通常不产生不良反应。优选地,如本文所用的术语“药学上可接受的”意指由联邦监管机构或州政府批准的或者在美国药典或其它通常认可的药典上列出,用于哺乳动物且更具体地用于人。“可接受的”意指载剂与组合物的活性成分(例如,核酸、载体、细胞或治疗性抗体)相容,并且不对组合物所施用于的受试者产生负面影响。待用于本方法中的任何药物组合物可以包含冻干形式或水溶液形式的药学上可接受的载剂、赋形剂或稳定剂。
药学上可接受的载剂(包括缓冲剂)是本领域中众所周知的,并且可包括磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂;低分子量多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;氨基酸;疏水聚合物;单糖;二糖;及其它碳水化合物;金属配合物;和/或非离子表面活性剂。参见,例如remington:thescienceandpracticeofpharmacy第20版(2000)lippincottwilliams和wilkins编著k.e.hoover。
本公开的药物组合物还可以含有被治疗的特定适用症所必需的一种或多种另外的活性化合物,优选地具有不会不利地互相影响的互补活性的那些。可能的另外的活性化合物的非限制性实例包括例如il-2以及本领域已知并且在下面组合治疗的讨论中列出的各种试剂。iv.使用本文所述的基因工程改造的造血细胞进行的免疫疗法
共表达共刺激多肽和抗gpc3car多肽的基因工程改造的宿主细胞,诸如造血细胞,例如本文所述的免疫细胞,可用于免疫疗法诸如t细胞疗法或nk细胞疗法中,所述疗法用于抑制表达car多肽直接或间接(例如,经由缀合至car多肽结合至的标签的治疗剂)靶向的抗原的患病细胞。在免疫细胞中与car多肽共表达的共刺激多肽将通过使细胞生长来促进基于细胞的免疫疗法和/或在低葡萄糖、低氨基酸、低ph和/或低氧环境中,例如在肿瘤微环境中有效地发挥作用。可以通过使用mrna电穿孔瞬时表达共刺激多肽和/或car多肽以限制任何潜在的非肿瘤特异性反应来进一步提高临床安全性。
本文所述的方法可以包括将治疗有效量的基因工程改造的宿主细胞诸如免疫细胞(例如t淋巴细胞或nk细胞)引入受试者中,所述宿主细胞共表达本公开的共刺激多肽和car多肽。受试者(例如,人患者,诸如人类癌症患者)可另外已用抗癌疗法治疗或正在接受抗癌疗法的治疗,所述抗癌疗法包括但不限于抗癌治疗剂。
在本公开的上下文中,只要涉及本文所述的任何疾病状况,术语“治疗(treat)”、“治疗(treatment)”等意指缓解或减轻与该状况相关的至少一种症状或减慢或逆转这种状况的发展。在本公开的含义内,术语“治疗”还表示阻止、延迟疾病的发作(即在疾病的临床表现之前的时期)和/或降低疾病发展或恶化的风险。例如,术语“治疗”与癌症结合时可意指消除或减轻患者的肿瘤负担,或预防、延迟或抑制转移等。
如本文所用,术语“治疗有效的”当应用于剂量或量时是指化合物或药物组合物在向有此需要的受试者施用后足以产生所需活性的量。注意,当施用活性成分的组合(例如,包含表达共刺激多肽和/或嵌合抗原受体(car)构建体的t淋巴细胞或nk细胞群和另外的抗癌治疗剂的药物组合物)时,所述组合的有效量可包括或不包括如果单独施用的话将有效的每种成分的量。在本公开的上下文中,术语“治疗有效的”是指足以延迟通过本公开方法治疗的病症的表现、阻止其进展、减轻或缓解其至少一种症状的化合物或药物组合物的量。
a.提高基于细胞的免疫疗法的功效
表达本文所述的共刺激多肽和抗gpc3car多肽的宿主细胞(例如免疫细胞,诸如t细胞和nk细胞)适用于抑制表达靶抗原的细胞和/或促进免疫细胞在低葡萄糖环境、低氨基酸环境、低ph环境和/或低氧环境中,例如在肿瘤微环境中的生长和/或增殖。在一些实施方案中,受试者是哺乳动物,诸如人、猴、小鼠、兔或家养哺乳动物。在一些实施方案中,受试者是人。在一些实施方案中,受试者是人类癌症患者。在一些实施方案中,受试者另外已用本文所述的任何治疗性抗体治疗或正在接受其治疗。
为了实施本文所述的方法,有效量的表达本文所述的任何共刺激多肽和car多肽的免疫细胞(nk细胞和/或t淋巴细胞)或其组合物可以通过合适的途径诸如静脉内施用向需要所述治疗的受试者施用。如本文所用,有效量是指相应试剂(例如,表达共刺激多肽、car多肽或其组合物的nk细胞和/或t淋巴细胞)在施用后可对受试者产生治疗效果的量。确定本文所述的细胞或组合物的量是否实现治疗效果对于本领域技术人员来说是显而易见的。如本领域技术人员所认识的,有效量根据所治疗的特定病状、病状的严重程度、个体患者参数(包括年龄、身体状况、体型、性别、性和体重)、治疗持续时间、同步疗法(如果有的话)的性质、特定施用途径以及卫生保健从业人员的知识和专长内的类似因素而变化。在一些实施方案中,有效量缓和、缓解、改良、改善、减轻症状或延迟与gpc3+细胞有关的受试者的任何疾病或病症的进展。在一些实施方案中,受试者是人。在一些实施方案中,需要治疗的受试者是人类癌症患者。
本公开的方法可以用于治疗任何癌症或任何病原体。可以通过本公开的方法治疗的癌症的特定非限制性实例包括,例如,乳腺癌、胃癌、肺癌、皮肤癌、前列腺癌、结肠直肠癌、肾细胞癌、卵巢癌、横纹肌肉瘤、生殖细胞癌、肝母细胞瘤、间皮瘤、胰腺癌、头颈癌、神经胶质瘤、胶质母细胞瘤、甲状腺癌、肝细胞癌、食道癌和宫颈癌。在某些实施方案中,癌症可以是实体乳腺癌、肺癌或肝细胞癌。在某些实施方案中,癌症可以是实体瘤。
本公开的方法还可以用于治疗由细菌感染、病毒感染或真菌感染引起的传染性疾病。在这种情况下,可以将基因工程改造的免疫细胞与靶向病原性抗原(例如与引起感染的细菌、病毒或真菌相关的抗原)的含fc的治疗剂(例如抗体)共同使用。病原性抗原的特定非限制性实例包括但不限于细菌、病毒和/或真菌抗原。下面提供一些实例:流感病毒神经氨酸酶、血凝素或m2蛋白;人呼吸道合胞病毒(rsv)f糖蛋白或g糖蛋白;单纯疱疹病毒糖蛋白gb、gc、gd或ge;衣原体momp或porb蛋白;登革热病毒核心蛋白、基质蛋白或糖蛋白e;麻疹病毒血凝素;2型单纯疱疹病毒糖蛋白gb;脊髓灰质炎病毒ivp1;hiv1的包膜糖蛋白;乙型肝炎核心抗原或表面抗原;白喉毒素;链球菌24m表位;淋球菌纤毛蛋白;伪狂犬病病毒g50(gpd)、伪狂犬病病毒ii(gpb)、伪狂犬病病毒iii(gpc)、伪狂犬病病毒糖蛋白h、伪狂犬病病毒糖蛋白e;传染性胃肠炎糖蛋白195、传染性胃肠炎基质蛋白或人丙型肝炎病毒糖蛋白e1或e2。
在一些实施方案中,以有效抑制了表达gpc3的细胞至少20%和/或至少2倍,例如使表达靶抗原的细胞抑制了50%、80%、100%、2倍、5倍、10倍、20倍、50倍、100倍或更多的量向受试者施用免疫细胞。
可以使用另外的治疗剂(例如,基于抗体的免疫治疗剂)来治疗、缓解或减轻认为该治疗剂在受试者中有用的任何疾病或病症的症状。
如本文所述的基于细胞的免疫疗法的功效可以通过本领域已知的任何方法来评估,并且对于熟练的医学专业人员将是显而易见的。例如,可以通过受试者的生存率或受试者或其组织或样品中的肿瘤或癌症负担来评估基于细胞的免疫疗法的功效。在一些实施方案中,将免疫细胞以使得基于细胞的免疫疗法的功效与在不存在表达共刺激多肽和/或car多肽的免疫细胞的情况下的功效相比有效提高了至少20%和/或至少2倍,例如使基于细胞的免疫疗法的功效提高了50%、80%、100%、2倍、5倍、10倍、20倍、50倍、100倍或更多倍的量施用于需要治疗的受试者。
在本文所述的任何组合物或方法中,免疫细胞(例如nk和/或t细胞)对于受试者可以是自体的,即,免疫细胞可以从需要治疗的受试者获得,被基因工程改造以表达共刺激多肽和/或car多肽,然后施用于同一受试者。在一个特定的实施方案中,在重新引入受试者之前,自体免疫细胞(例如,t淋巴细胞或nk细胞)离体活化和/或扩增。与非自体细胞的施用相比,向受试者施用自体细胞可以导致宿主细胞排斥的减轻。
或者,宿主细胞是同种异体细胞,即,所述细胞获自第一受试者,被基因工程改造以表达共刺激多肽和/或car多肽,并施用于与第一受试者不同但属于相同物种的第二受试者。例如,同种异体免疫细胞可源自人供体,并施用于不同于供体的人受者。在一个特定的实施方案中,t淋巴细胞是其中内源t细胞受体的表达已受到抑制或消除的同种异体t淋巴细胞。在一个特定的实施方案中,在引入受试者之前,同种异体t淋巴细胞离体活化和/或扩增。t淋巴细胞可以通过本领域已知的任何方法,例如在抗cd3/cd28、il-2、植物凝集素、工程改造的人工刺激细胞或颗粒或其组合存在下活化。
nk细胞可以通过本领域已知的任何方法,例如在一种或多种选自由以下组成的组的试剂存在下活化:cd137配体蛋白、cd137抗体、il-15蛋白、il-15受体抗体、il-2蛋白、il-12蛋白、il-18、il-21蛋白和k562细胞系和/或工程改造的人工刺激细胞或颗粒。参见,例如美国专利号7,435,596和8,026,097,其描述了用于扩增nk细胞的有用方法。例如,可通过暴露于缺乏或不良表达主要组织相容性复合物i和/或ii分子并且已被基因修饰以表达膜结合的il-15和4-1bb配体(cdi37l)的细胞来优先扩增用于本公开的组合物或方法中的nk细胞。此类细胞系包括但不一定限于k562[atcc,ccl243;lozzio等人,blood45(3):321-334(1975);klein等人,int.j.cancer18:421-431(1976)]和威尔姆氏瘤细胞系hfwt(fehniger等人,intrevimmunol20(3-4):503-534(2001);haradah等人,exphematol32(7):614-621(2004))、子宫内膜瘤细胞系hhua、黑色素瘤细胞系hmv-ii、肝母细胞瘤细胞系huh-6、肺小细胞癌细胞系lu-130和lu-134-a、神经母细胞瘤细胞系nb19和n1369、来自睾丸nec14的胚胎癌细胞系、子宫颈癌细胞系tco-2和骨髓转移的神经母细胞瘤细胞系tnb1[harada等人,jpn.j.cancerres93:313-319(2002)]。优选地,所使用的细胞系缺乏或不良表达mhci和ii分子,诸如k562和hfwt细胞系。可以使用固体支持物代替细胞系。这种支持物优选应在其表面上附着至少一个能够与nk细胞结合并诱导初级活化事件和/或增殖反应的分子或能够结合具有这种作用的分子从而充当支架。支持物可以在其表面上附着cd137配体蛋白、cd137抗体、il-15蛋白或il-15受体抗体。优选地,支持物将在其表面上结合有il-15受体抗体和cd137抗体。
在所述组合物或方法的一个实施方案中,将t淋巴细胞、nk细胞、或t淋巴细胞和nk细胞引入(或重新引入)受试者,然后向受试者施用治疗有效量的il-2。
根据本公开,可通过以每公斤体重约105至1010个或更多个细胞(细胞/kg)输注治疗有效剂量的包含本公开的共刺激多肽和/或car多肽的免疫细胞诸如t淋巴细胞或nk细胞来治疗患者。输注可根据患者可以耐受的次数重复多次,直到实现所需反应为止。适当的输注剂量和时间表因患者而异,但可以由主治医师针对特定患者确定。通常,将输注约106个细胞/kg的初始剂量,递增至108个或更多个细胞/kg。可以共同施用il-2来扩增输注的细胞。il-2的量为每平方米体表约1-5x106个国际单位。
术语“约”或“大约”意指对于特定值来说在可接受的误差范围内,如本领域普通技术人员所测定的,这将部分取决于如何测量或测定该值,即,测量系统的极限值。例如,按照本领域的实践,“约”可以表示在可接受的标准偏差内。或者,“约”可以表示以下范围:给定值的至多±20%、优选至多±10%、更优选至多±5%且仍更优选至多±1%。或者,特别是关于生物系统或过程,该术语可以表示在一个数量级内,优选在值的两倍内。在本申请和权利要求书中描述具体值时,除非另有说明,术语“约”是隐含的,并且在此上下文中表示该具体值在可接受的误差范围内。
本文所述的组合物或方法的功效可以通过本领域已知的任何方法来评估,并且对于熟练的医学专业人员将是显而易见的。例如,本文所述的组合物或方法的功效可以通过受试者的生存率或受试者或其组织或样品中的癌症或病原体负担来评估。在一些实施方案中,本文所述的组合物和方法可基于例如对受试者的疗法(例如,施用表达共刺激多肽和car多肽的免疫细胞)的安全性或毒性,例如通过受试者的整体健康状况和/或不良事件或严重不良事件的存在进行评估。
b.组合治疗
本公开中描述的组合物和方法可以与其它类型的癌症疗法诸如化学疗法、手术、放射线、基因疗法等或抗感染疗法结合使用。可以与根据本公开的免疫疗法同时或相继(以任何顺序)施用此类疗法。当与另外的治疗剂共施用时,由于相加作用或协同作用,每种试剂的合适治疗有效剂量可降低。
在一些情况下,表达本文公开的任何共刺激多肽和/或抗gpc3car多肽的免疫细胞(例如t淋巴细胞和/或nk细胞)可施用于已用或正在用另外的治疗剂(例如,另外的抗癌治疗剂)治疗的受试者。例如,可以将免疫细胞与另外的治疗剂同时施用于人受试者。或者,可以在另外的治疗剂之前将免疫细胞施用于人受试者。或者,可以在另外的治疗剂之后将免疫细胞施用于人受试者。
对标签有特异性的共表达共刺激多肽和car多肽的的基因工程改造的免疫细胞(例如,t细胞或nk细胞)可以与缀合至标签的治疗剂共同使用。经由能够结合至与患病细胞诸如肿瘤细胞相关的抗原的治疗剂,这种基因工程改造的免疫细胞可以与患病细胞接合并抑制其生长。
本公开的治疗可以与其它免疫调节治疗组合,例如像治疗性疫苗(包括但不限于gvax、dc基疫苗等)、检查点抑制剂(包括但不限于阻断ctla4、pd1、lag3、tim3等的试剂)、治疗性抗体(例如,用于adcc或adc)或活化剂(包括但不限于增强41bb、ox40等的试剂)。
适于与本公开的免疫疗法组合使用的其它治疗剂的非限制性实例包括:(i)抗血管生成剂(例如,tnp-470、血小板因子4、血小板反应蛋白-1,金属蛋白酶的组织抑制剂(timp1和timp2)、催乳素(16-kd片段)、血管抑素(纤溶酶原的38-kd片段)、内皮抑素、bfgf可溶性受体、转化生长因子β、干扰素α、可溶性kdr和flt-1受体、胎盘增殖素相关蛋白,以及由carmeliet和jain(2000)列出的那些;(ii)vegf拮抗剂或vegf受体拮抗剂,诸如抗vegf抗体、vegf变体、可溶性vegf受体片段、能够阻断vegf或vegfr、中和抗vegfr抗体的适体、vegfr酪氨酸激酶抑制剂及其任何组合;以及(iii)化疗化合物,例如像嘧啶类似物(5-氟尿嘧啶、氟尿苷、卡培他滨、吉西他滨和阿糖胞苷)、嘌呤类似物、叶酸拮抗剂和相关抑制剂(巯基嘌呤、硫鸟嘌呤、喷司他丁和2-氯脱氧腺苷(克拉屈滨));抗增殖/抗有丝分裂剂包括诸如长春花生物碱(长春花碱、长春新碱和长春瑞滨)的天然产物、诸如紫杉烷(紫杉醇、多西紫杉醇)的微管破坏剂、长春新碱、长春花碱、诺考达唑、埃博霉素和长春瑞滨、表鬼臼毒素类(依托泊苷和替尼泊苷)、dna损伤剂(放线菌素,安吖啶、蒽环类、博来霉素、白消安、喜树碱、卡铂、苯丁酸氮芥、顺铂、环磷酰胺(cytoxan)、更生霉素、柔红霉素、多柔比星、表柔比星、六甲基三聚氰胺草酸铂、异环磷酰胺、美法仑、氮芥、丝裂霉素、米托蒽醌、亚硝基脲、普卡霉素、丙卡巴肼、他克唑、泰素帝、替尼泊苷、三亚乙基硫代磷酰胺和依托泊苷(vp16));抗生素,诸如更生霉素(放线菌素d)、柔红霉素、阿霉素(多柔比星)、伊达比星、蒽环类、米托蒽醌、博来霉素、普卡霉素(光神霉素)和丝裂霉素;酶(l-天冬酰胺酶,其全身代谢l-天冬酰胺,并且剥夺没有能力合成自己的天冬酰胺的细胞);抗血小板剂;抗增殖/抗有丝分裂烷化剂,诸如氮芥(二氯甲基二乙胺、环磷酰胺及类似物、美法仑、苯丁酸氮芥)、乙烯亚胺和甲基三聚氰胺(六甲基三聚氰胺和噻替派)、烷基磺酸盐-白消安、亚硝基脲(卡莫司汀(bcnu)及类似物、链脲菌素)、曲西汀-达卡巴嗪(dtic);抗增殖/抗有丝分裂抗代谢物,诸如叶酸类似物(甲氨蝶呤);铂配位复合物(顺铂、卡铂)、丙卡巴嗪、羟基脲、米托坦、氨鲁米特;激素、激素类似物(雌激素、他莫昔芬、戈舍瑞林、比卡鲁胺、尼鲁米特)和芳香酶抑制剂(来曲唑、阿那曲唑);抗凝剂(肝素、合成肝素盐和其它凝血酶抑制剂);纤维蛋白溶解剂(诸如组织纤溶酶原活化剂、链激酶和尿激酶)、阿司匹林、双嘧达莫、噻氯匹定、氯吡格雷、阿昔单抗;抗迁移剂;抗分泌剂(布雷菲德菌素);免疫抑制剂(环孢霉素、他克莫司(fk-506)、西罗莫司(雷帕霉素)、硫唑嘌呤、霉酚酸酯);抗血管生成化合物(例如tnp-470、染料木素、贝伐单抗)和生长因子抑制剂(例如成纤维细胞生长因子(fgf)抑制剂);血管紧张素受体阻断剂;一氧化氮供体;反义寡核苷酸;抗体(曲妥单抗);细胞周期抑制剂和分化诱导剂(维甲酸);akt抑制剂(诸如mk-22062hcl、哌立福辛(krx-0401)、gsk690693、伊帕曲替尼(gdc-0068)、azd5363、uprosertib、阿呋塞替尼(afuresertib)或曲西立滨);mtor抑制剂、拓扑异构酶抑制剂(多柔比星(阿霉素)、安吖啶、喜树碱、柔红霉素、放线菌素、依诺泊苷、表柔比星、依托泊苷、伊达柔比星、米托蒽醌、托泊替康和伊立替康)、皮质类固醇(可的松、地塞米松、氢化可的松、甲基强的松龙、强的松和泼尼松龙);生长因子信号转导激酶抑制剂;线粒体功能障碍诱导剂和胱天蛋白酶活化剂;以及染色质破坏剂。
有关另外有用试剂的例子,另请参见physician'sdeskreference,第59版,(2005),thomsonpdr,montvalen.j.;gennaro等人,编著remington'sthescienceandpracticeofpharmacy第20版,(2000),lippincottwilliams和wilkins,baltimoremd.;braunwald等人,编著harrison'sprinciplesofinternalmedicine,第15版,(2001),mcgrawhill,ny;berkow等人,编著themerckmanualofdiagnosisandtherapy,(1992),merckresearchlaboratories,rahwayn.j。
可以通过任何合适的途径来进行另外的治疗剂的施用,包括全身性施用以及直接施用于疾病部位(例如,施用于肿瘤)。
在一些实施方案中,所述方法包括以一个剂量将另外的治疗剂施用于受试者。在一些实施方案中,所述方法包括以多个剂量(例如,至少2、3、4、5、6、7或8个剂量)将另外的治疗剂施用于受试者。在一些实施方案中,以多个剂量向受试者施用另外的治疗剂,其中在施用表达共刺激多肽和/或car多肽的免疫细胞之前约1、2、3、4、5、6或7天向所述受试者施用第一剂的另外的治疗剂。在一些实施方案中,在施用表达共刺激多肽和/或car多肽的免疫细胞之前约24-48小时之间,向受试者施用第一剂的另外的治疗剂。
在一些实施方案中,在施用表达共刺激多肽和/或car多肽的免疫细胞之前,向受试者施用另外的治疗剂,随后大约每两周。在一些实施方案中,前两剂另外的治疗剂间隔约一周(例如,约6、7、8或9天)施用。在某些实施方案中,第三和后续的剂量大约每两周施用一次。
在本文所述的任何实施方案中,另外的治疗剂的施用时间是近似的,并且包括在指定日期之前三天和之后三天(例如,每三周的施用包括在第18天、第19天、第20天、第21天、第22天、第23天或第24天施用)。
本文所述方法的功效可以通过本领域已知的任何方法来评估,并且对于熟练的医学专业人员和/或本文所述的那些将是显而易见的。例如,可以通过受试者的生存率或受试者或其组织或样品中的癌症负担来评估基于细胞的免疫疗法的功效。在一些实施方案中,基于细胞的免疫疗法基是根据对受试者的疗法(例如,施用表达共刺激多肽和/或car多肽的免疫细胞)的安全性或毒性,例如通过受试者的整体健康状况和/或不良事件或严重不良事件的存在进行评估。
v.治疗用试剂盒
本公开还提供了用于本文所述的组合物的试剂盒。例如,本公开还提供了试剂盒,其包含表达共表达共刺激多肽和抗gpc3car多肽的免疫细胞(例如,t淋巴细胞或nk细胞)以用于抑制患病细胞(例如肿瘤细胞)的生长和/或增强免疫细胞在低葡萄糖环境、低氨基酸环境、低ph环境和/或低氧环境中,例如在肿瘤微环境中的生长和/或增殖。所述试剂盒可进一步包含缀合至标签的治疗剂(例如,本文所述的那些),在免疫细胞上表达的car多肽与标签结合。此类试剂盒可包括一个或多个容器,所述容器包含本文所述的基因工程改造的免疫细胞(例如t淋巴细胞和/或nk细胞)群,其共表达共刺激多肽和car多肽(诸如本文所述的那些);和任选的缀合至标签的治疗剂。
在一些实施方案中,本文所述的试剂盒包含在体外扩增的表达共刺激多肽和car的免疫细胞,以及对活化的t细胞上存在的细胞表面抗体有特异性的抗体,例如抗cd5抗体、抗cd38抗体或抗cd7抗体。表达共刺激多肽和car的免疫细胞可以表达本领域已知或本文公开的任何car构建体。
或者,本文公开的试剂盒可包含如本文所述的核酸或核酸组,其共同编码任何car多肽和也如本文所述的任何共刺激多肽。
在一些实施方案中,试剂盒可另外包含用于本文所述的任何方法的说明书。所包括的说明书可以包括对第一和第二药物组合物施用于受试者以实现预期活性,例如抑制受试者中的靶细胞生长和/或促进免疫细胞在低葡萄糖环境、低氨基酸(例如低谷氨酰胺环境)环境、低ph环境和/或低氧环境(例如低葡萄糖、低氨基酸、低ph或缺氧肿瘤微环境)中的生长和/或增殖的描述。试剂盒可进一步包括基于鉴别受试者是否需要治疗来选择适合于治疗的受试者的描述。在一些实施方案中,说明书包括对施用基因工程改造的免疫细胞群的描述及任选地施用缀合标签的治疗剂的描述。
与本文所述的免疫细胞和任选的缀合标签的治疗剂的使用有关的说明书通常包括关于预期治疗的剂量、给药方案和施用途径的信息。容器可以是单位剂量、散装包装(例如,多剂量包装)或亚单位剂量。在本公开的试剂盒中提供的说明书通常是在标签或包装插页上的书面说明书。标签或包装插页表明所述药物组合物用于治疗、延缓发作和/或减轻受试者的疾病或病症。
本文提供的试剂盒在适当的包装中。合适的包装包括但不限于小瓶、瓶、广口瓶、软包装等。还考虑了与特定装置诸如吸入器、鼻腔施用装置或输注装置结合使用的包装。试剂盒可具有无菌进入口(例如,容器可以是具有通过皮下注射针可刺穿的塞子的静脉内溶液袋或小瓶)。所述容器也可以具有无菌进入口。第一药物组合物中的至少一种活性剂是表达如本文所述的car多肽和共刺激多肽的免疫细胞(例如,t淋巴细胞或nk细胞)群。
试剂盒可以任选地提供另外的组分,诸如缓冲液和解释性信息。试剂盒通常包括容器和在所述容器上或与所述容器相关联的标签或包装插页。在一些实施方案中,本公开提供了包含上述试剂盒的内容物的制品。
通用技术
除非另有说明,本公开的实践将采用以下常规技术:分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学,其在本领域的技术范围内。此类技术在以下文献中得到充分解释,诸如molecularcloning:alaboratorymanual,第二版(sambrook等人,1989)coldspringharborpress;oligonucleotidesynthesis(m.j.gait编著1984);methodsinmolecularbiology,humanapress;cellbiology:alaboratorynotebook(j.e.cellis编著,1989)academicpress;animalcellculture(r.i.freshney编著1987);introductiontocellandtissueculture(j.p.mather和p.e.roberts,1998)plenumpress;cellandtissueculture:laboratoryprocedures(a.doyle,j.b.griffiths和d.g.newell,编著1993-8)j.wileyandsons;methodsinenzymology(academicpress,inc.);handbookofexperimentalimmunology(d.m.weir和c.c.blackwell编著):genetransfervectorsformammaliancells(j.m.miller和m.p.calos编著,1987);currentprotocolsinmolecularbiology(f.m.ausubel等人编著1987);pcr:thepolymerasechainreaction,(mullis等人编著1994);currentprotocolsinimmunology(j.e.coligan等人编著,1991);shortprotocolsinmolecularbiology(wileyandsons,1999);immunobiology(c.a.janeway和p.travers,1997);antibodies(p.finch,1997);antibodies:apracticeapproach(d.catty.编著,irlpress,1988-1989);monoclonalantibodies:apracticalapproach(p.shepherd和c.dean编著,oxforduniversitypress,2000);usingantibodies:alaboratorymanual(e.harlow和d.lane(coldspringharborlaboratorypress,1999);theantibodies(m.zanetti和j.d.capra编著harwoodacademicpublishers,1995);dnacloning:apracticalapproach,第i和ii卷(d.n.glover编著1985);nucleicacidhybridization(b.d.hames&s.j.higgins编著(1985》;transcriptionandtranslation(b.d.hames&s.j.higgins编著(1984》;animalcellculture(r.i.freshney编著(1986》;immobilizedcellsandenzymes(lrlpress,(1986》;以及b.perbal,apracticalguidetomolecularcloning(1984);f.m.ausubel等人(编著)。
无需进一步阐述,据信本领域技术人员可以基于以上描述,以其最大程度利用本公开。因此,以下特定实施方案应解释为仅具有说明性,而不以任何方式限制本公开的其余部分。本文引用的所有出版物出于本文引用的目的或主题以引用的方式并入。
实施例
实施例1:通过共表达共刺激多肽提高表达抗gpc3car变体的t细胞的活性。
此实施例证实,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽或b7/cd28超家族共刺激肽相对于单独的抗gpc3car可提高t细胞的活性。
在这些实验中,将t细胞用以下病毒转导:单独编码具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)的病毒;单独编码具有cd28共刺激结构的抗gpc3car多肽(gpc3-car-cd28;seqidno:1)的病毒;或编码这些car变体中的每个与共刺激多肽cd30l、cd40l、cd70、gitrl、icosl、light、ox40l、tl1a、baffr、cd40、cd27、ox40、icos和4-1bb的组合的病毒。在包括增殖、细胞因子释放、细胞毒性和重复刺激的一组功能测定中评价转导的t细胞(参见以下实施例中的测定详情)。从这项研究中获得的结果显示,任一抗gpc3car或两者与一种或多种上述共刺激多肽的组合增加t细胞增殖、增加某些细胞因子的产生和/或提高细胞毒性。
这些实验表明,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽或b7/cd28超家族共刺激肽与在具有4-1bb共刺激结构域的抗gpc3car多肽和具有cd28共刺激结构域的抗gpc3car多肽的背景下单独的抗gpc3car多肽相比可以提高t细胞的活性。赋予改善的活性的共刺激多肽视在同一t细胞中共表达哪种car变体而变化。
实施例2:表达抗gpc3car和tnf共刺激多肽的t细胞活性的提高取决于在重复刺激测定中car中的共刺激结构域的身份。
此实施例证实,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽cd70、light和ox40l与在多个再刺激条件下单独的抗gpc3car相比提高t细胞的活性,并且提高的水平取决于car中共刺激结构域的身份。在这些实验中,将t细胞用以下病毒转导:单独编码具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)的病毒;单独编码具有cd28共刺激结构域的抗gpc3car多肽(gpc3-car-cd28;seqidno:2)的病毒;或编码由p2a核糖体跳跃序列分隔的这些car变体中的每个和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的病毒。经由用抗cd70抗体染色,通过流式细胞术评价表达gpc3-car-4-1bb的t细胞以及共表达gpc3-car-4-1bb和cd70的细胞的cd70表达。共表达gpc3-car-4-1bb和cd70的t细胞比仅表达gpc3-car-4-1bb的t细胞显示出更多的cd70表面表达,如由更高的平均荧光强度所证明(图10,图a和b)。
将转导的t细胞(效应子)和表达gpc3的hep3b细胞(靶标)在2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)下在补充有10%胎牛血清的rpmi1640培养基中以200μl的反应体积温育。将反应在37℃下于5%co2培养箱中温育。每3或4天,通过将一半体积的t细胞转移到含有50,000个新鲜靶细胞的新平板中(在100μl培养基中)再刺激t细胞,并将最终体积调整为200μl。再刺激细胞3次。在每个时间点,将剩余的细胞用抗cd3抗体和活/死染料进行染色。通过流式细胞术评价活cd3阳性细胞的数目,作为t细胞增殖的量度。相对于先前时间点的t细胞扩增倍数绘制为时间的函数(图1)。
在所有刺激轮次后,共表达gpc3car-4-1bb和cd70的t细胞与仅表达gpc3car-4-1bb的t细胞相比表现出相似或更好的扩增(图1,图a)。相反,在所有刺激轮次后,与仅表达gpc3car-cd28的t细胞相比,共表达gpc3car-cd28和cd70的t细胞显示出相似的扩增。在所有刺激轮次后,与仅表达gpc3car-4-1bb的t细胞相比,共表达gpc3car-4-1bb和light的t细胞显示出相似或更好的扩增(图1,图b)。相反,在大多数时间点,与仅表达gpc3car-cd28的t细胞相比,共表达gpc3car-cd28和light的t细胞显示出相似的扩增,并且在第三轮刺激后,扩增得到适度改善。在所有刺激轮次后,与仅表达gpc3car-4-1bb的t细胞相比,共表达gpc3car-4-1bb和ox40l的t细胞表现出相似或更好的扩增(图1,图c)。相反,与仅表达gpc3car-cd28的t细胞相比,在大多数时间点,共表达gpc3car-cd28和ox40l的t细胞显示出相似或较弱的扩增,并且在第三轮刺激后,扩增得到适度改善。
这些实验表明,在还表达具有4-1bb共刺激结构域的抗gpc3car的t细胞中共表达tnf超家族成员多肽像cd70、light和ox40l可以在多次再刺激后提高t细胞活性。相反,当与抗gpc3-cd28car共表达时,cd70、light和ox40l不会提高t细胞的活性。
实施例3:在重复刺激测定中共表达具有4-1bb共刺激结构域的抗gpc3car及tnf超家族成员多肽cd70、light和ox40l的t细胞显示出增强的增殖和细胞因子释放。
此实施例证实,与具有4-1bb共刺激结构域的抗gpc3car组合在t细胞中表达肿瘤坏死因子(tnf)超家族共刺激多肽cd70、light和ox40l与单独的抗gpc3car相比提高t细胞的活性。在这些实验中,将t细胞用编码具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)的病毒或编码由p2a核糖体跳跃序列分隔的gpc3-car-4-1bb和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的病毒转导。
将转导的t细胞(效应子)和表达gpc3的jhh7细胞(靶标)在2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)下在补充有10%胎牛血清的rpmi1640培养基中以200μl的反应体积温育。将反应在37℃下于5%co2培养箱中温育。在第3天和第6天,通过将一半体积的t细胞转移到含有50,000个新鲜靶细胞的新平板中(在100μl培养基中)再刺激t细胞,并将最终体积调整为200μl。在每个时间点,将剩余的细胞用抗cd3抗体和活/死染料进行染色。通过流式细胞术评价活cd3阳性细胞的数目,作为t细胞增殖的量度。将相对于先前时间点的t细胞扩增倍数绘制为每个再刺激轮次时间点的时间的函数(图2,图a)。
在第4天,第二次刺激后24小时,从反应中去除上清液,并分析细胞因子的产生。根据制造商说明书,使用u-plex测定试剂盒(mesoscalediscovery)测量细胞因子。根据在第3天测得的孔中的细胞数量,将il-2、ifn-γ和il-17a的测量值归一化以得到pg/ml/细胞值并绘制为如第6天测量所测量的第3天刺激后观察到的扩增倍数的函数(图2,图b、c和d)。
共表达gpc3car-4-1bb和cd70、light或ox40l的t细胞在前两轮刺激后与仅表达gpc3car-4-1bb的t细胞相比表现出相似的扩增,并在第三轮刺激后表现出更好的扩增(图2,图a)。共表达gpc3car-4-1bb和cd70、light或ox40l的t细胞与仅表达gpc3car-4-1bb的t细胞相比在第二轮刺激后24小时显示出更好的il-2(图2,图b)、ifn-γ(图2,图c)和il17-a(图2,图d)。
这些实验表明,在还表达具有4-1bb共刺激结构域的抗gpc3car的t细胞中共表达tnf超家族成员多肽像cd70、light和ox40l可以提高t细胞活性。
实施例4:共表达具有4-1bb共刺激结构域的抗gpc3car及tnf超家族成员多肽cd70、light和ox40l的t细胞显示出增加的细胞因子释放和增殖。
此实施例证实,与具有4-1bb共刺激结构域的抗gpc3car组合在t细胞中表达肿瘤坏死因子(tnf)超家族共刺激多肽cd70、light和ox40l与单独的抗gpc3car相比提高t细胞的活性。在这些实验中,将t细胞用编码具有4-1bb共刺激结构域的抗gpc3car多肽(gpc3-car-4-1bb;seqidno:1)的病毒或编码由p2a核糖体跳跃序列分隔的gpc3-car-4-1bb和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的病毒转导。
将转导的t细胞(效应子)和表达gpc3的hep3b细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)铺板,并在37℃下于5%co2培养箱中温育24小时。从反应中除去上清液,并根据制造商说明书,使用人il-2测定试剂盒(cisbio)分析il-2。将上清液中il-2的浓度绘制为所测试变体的函数(图3,图a)。与仅表达gpc3-car-4-1bb的t细胞相比,共表达gpc3-car-4-1bb和cd70、light或ox40l的t细胞均表现出更好的il-2产生。
将转导的t细胞(效应子)和表达gpc3的hepg2细胞(靶标)在1:1的效应子与靶标比率下混合,并在37℃下于5%co2培养箱中温育12天。在第6天和第12天采集样品,并用活性染料和抗cd3抗体染色,并通过流式细胞术进行分析。将活的cd3+细胞的数量(作为t细胞增殖的量度)绘制为所测试变体和时间点的函数(图3,图b)。与仅表达gpc3-car-4-1bb的t细胞相比,共表达gpc3-car-4-1bb和cd70、light或ox40l的t细胞在第6天显示出相似的增殖水平,并在第12天表现出更好的增殖。
这些实验表明,在还表达具有4-1bb共刺激结构域的抗gpc3car的t细胞中共表达tnf超家族成员多肽像cd70、light和ox40l可以提高t细胞活性。
实施例5:共表达具有4-1bb共刺激结构域的抗gpc3car和cd70的t细胞与共表达具有4-1bb共刺激结构域的抗gpc3car和light或ox40l的t细胞相比具有更高的活性。
此实施例证实,与其它肿瘤坏死因子(tnf)超家族成员相比,共刺激多肽cd70(seqidno:34)与含有4-1bb主要共刺激结构域(gpc3-car-4-1bb;seqidno:1)的抗gpc3car组合时,提供实质性的功能优势。在这些实验中,将t细胞用仅编码car多肽(seqidno:1)或编码由p2a核糖体跳跃序列分隔的car多肽和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的病毒转导。
对于一些实验,将转导的t细胞t(效应子)和hep3b细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)铺于补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中,每3-4天用50,000个新鲜靶细胞再刺激。根据制造商说明书,使用u-plex测定试剂盒(mesoscalediscovery)随时间测量来自培养上清液的细胞因子产生(il-17a)。在整个实验过程中,il-17a的水平被描述为pg/ml(图4图a)。共表达gpc3-car-4-1bb和cd70的t细胞与仅表达gpc3-car-4-1bb的t细胞及共表达gpc3-car-4-1bb和light或ox40l的t细胞相比表现出更好的il-17a产生。
在其它实验中,将转导的t细胞t(效应子)和hep3b细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)铺于补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中,每7天用50,000个新鲜靶细胞再刺激;通过流式细胞术评价cd3阳性细胞的数量,作为t细胞随时间的增殖的量度。cart细胞的增殖表示为相对于先前时间点的倍数变化(图4图b)。共表达gpc3-car-4-1bb和cd70的t细胞与仅表达gpc3-car-4-1bb的t细胞及共表达gpc3-car-4-1bb和light或ox40l的t细胞相比表现出更好的增殖。
在其它实验中,将转导的t细胞(效应子)与hepg2靶细胞一起以1:1的效应子与靶标比率(30,000个效应细胞;30,000个靶细胞)铺于补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中,并通过流式细胞术评价cd3阳性细胞的数量,作为12天后t细胞增殖的量度。t细胞增殖以cd3+t细胞总计数表示(图4图c)。共表达gpc3-car-4-1bb和cd70的t细胞与仅表达gpc3-car-4-1bb的t细胞及共表达gpc3-car-4-1bb和light或ox40l的t细胞相比表现出更好的增殖。
这些实验一起证实,与其它肿瘤坏死因子(tnf)超家族成员相比,共刺激多肽cd70(seqidno:34)当与含有4-1bb主要共刺激结构域的抗gpc3car(seqidno:1)组合时提供实质性的功能优势。
实施例6:共表达具有cd28共刺激结构域的抗gpc3car和tnf超家族成员多肽cd27的t细胞显示出增加的细胞因子释放和增殖。
此实施例证实,当与含有cd28主要共刺激结构域的抗gpc3car(gpc3-car-cd28;seqidno:2)组合时,共刺激多肽cd27(seqidno:33)为t细胞提供实质性的功能优势。在这些实验中,将t细胞用仅编码car多肽(seqidno:2)或编码由p2a核糖体跳跃序列分隔的car多肽和cd27(seqidno:33)的病毒转导。通过用抗cd27抗体染色,经由流式细胞术评价表达gpc3-car-cd28的t细胞以及共表达gpc3-car-cd28和cd27的细胞的cd27表达。共表达gpc3-car-cd28和cd27的t细胞与仅表达gpc3-car-cd28的t细胞相比显示出更多的cd27表面表达,如由更高的平均荧光强度所证实(图10,图c和d)。
在一些实验中,将t细胞和hep3b以2:1的e:t比率(60,000个效应细胞;30,000个靶细胞)在补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中混合,然后温育7天。通过流式细胞术测量t细胞增殖。将cd3阳性细胞的数量绘制为t细胞变体的函数(图5,图a)。同样,还评价了在用hepg2靶细胞以1:1的效应子与靶标比率(30,000个效应细胞;30,000个靶细胞)在补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中单次刺激后的t细胞增殖(图5,图b)。这些实验证明,与仅表达gpc3-car-4-1bb的t细胞相比,表达gpc3-car-4-1bb和cd27序列的t细胞具有改善的增殖。
在一些实验中,将t细胞(效应子)和hep3b或hepg2细胞(靶标)以4:1的效应子与靶标比率(120,000个效应细胞;30,000个靶细胞)铺于补充有10%热灭活的胎牛血清(fbs)的rpmi1640培养基中,然后温育24小时。使用人il-2测定试剂盒(cisbio)或人ifn-γ测定试剂盒测定(cisbio),分别按照制造商说明书测量来自反应上清液的il-2(hep3b,图5,图c)和ifn-γ(hepg2,图5,图d)。这些实验证明,与仅表达gpc3-car-4-1bb的t细胞相比,表达gpc3-car-4-1bb和cd27序列的t细胞具有改善的细胞因子产生。
此实施例证实当与含有cd28主要共刺激结构域的抗gpc3car组合时,共刺激多肽cd27为t细胞提供实质性的功能优势。
实施例7:共表达具有cd28共刺激结构域的抗gpc3car和tnf超家族成员多肽cd27的t细胞在抑制性mdsc和调节性t细胞存在下表现出提高的活性。
此实施例证实,在含有抑制性髓样来源的抑制细胞(mdsc)或调节性t细胞(treg)的测定中,当与含有cd28主要共刺激结构域的抗gpc3car(gpc3-car-cd28;seqidno:2)组合时,共刺激多肽cd27(seqidno:33)为t细胞提供实质性的功能优势。在这些实验中,将t细胞用单独编码gpc3-car-cd28(seqidno:2)或编码由p2a核糖体跳跃序列分隔的gpc3-car-cd28和cd27(seqidno:33)的病毒转导。
在一些实验中,mdsc是由供体匹配的pbmc的cd14+单核细胞产生的。简言之,根据制造商的方案,使用easysephumancd14阳性选择试剂盒ii(gibco)分离cd14阳性细胞。将cd14+细胞在gmcsf(10ng/ml)和pge2(1ng/ml)存在下,在补充有10%胎牛血清的rpmi1640培养基中培养。将细胞在co2(5%)培养箱中在37℃下温育6天。第2天向培养物中补充gmcsf(10ng/ml)和pge2(1ng/ml);第4天,移去培养基并补充新鲜的rpmi1640,在该培养基中补充有10%胎牛血清及gmcsf(10ng/ml)和pge2(1ng/ml)。第6天,收获细胞以用作测定中的mdsc。通过流式细胞术表征细胞,以确认它们是cd14低/hla-dr低/cd33高/pdl1高的。将t细胞(效应子)和hepg2细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)在3:1的效应子与mdsc存在下铺板,并在37℃+5%co2下温育7天。培养基中含有重组膜联蛋白v蛋白(1μg/ml)以阻断mdsc对活化t细胞的吞噬。通过流式细胞术评价活car+cd3+细胞的数量,且结果表示为无mdsc时最大反应的百分比(图6,图a)。与仅表达gpc3-car-cd28的t细胞相比,共表达gpc3-car-cd28和cd27的t细胞显示出更高的反应,表明它具有克服mdsc抑制的更大能力。
在一些实验中,诱导型treg是用雷帕霉素和htgf-b,由供体匹配的pbmc产生的,并使用miltenyicd4+/cd25+/cd127dim/-人调节性t细胞分离试剂盒ii进行分离。将t细胞(效应子)和hep3b细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)在不同比率的treg与celltraceviolet标记的car-t细胞(1:1、1:2、1:4的treg与car-t细胞)存在下铺板,并在37℃+5%co2下温育7天。通过流式细胞术评价celltraceviolet标记的car+细胞的数量,作为增殖的量度(图6图b)。共表达gpc3-car-cd28和cd27的t细胞比仅表达gpc3-car-cd28的t细胞显示出更多的增殖,表明它具有克服treg抑制的更大能力。
总之,这些实验表明,与仅表达gpc3-car-cd28的t细胞相比,共表达gpc3-car-cd28和cd27的t细胞显示出克服由mdsc或treg施加的免疫抑制的更大能力。
实施例8:共表达具有4-1bb共刺激结构域的抗gpc3car和tnf超家族成员多肽cd70、light或ox40l的t细胞在小鼠肿瘤异种移植模型中显示出提高的活性。
此实施例证实,与单独的gpc3-car-4-1bb相比,gpc3-car-4-1bb中肿瘤坏死因子(tnf)超家族共刺激肽cd70、light和ox40l的表达导致表达gpc3的小鼠异种移植模型中抗肿瘤活性的提高。在nsgtm(nodscidgamma,nod.cg-prkdcscidil2rgtm1wjl/szj,品系005557)小鼠中建立皮下人肝细胞癌(hcc)异种移植模型(hepg2、hep3b和jhh7)。
通过在右胁腹皮下注射5x106个细胞,建立hepg2hcc(atcchb-8065)异种移植物。当肿瘤体积达到约100mm3(接种后第19天)时,开始用gpc3car-t细胞的治疗。根据肿瘤体积,将小鼠随机分为每组5只小鼠的治疗组,并用仅表达gpc3-car-4-1bb(seqidno:1)或表达gpc3-car-4-1bb和cd70(seqidno:34)、light(seqidno:43)或ox40l(seqidno:47)的t细胞进行治疗,在第1天和第8天静脉内给予5x105个car+细胞的剂量。在实验过程中,每周测量肿瘤体积和体重两到三次。
在所评价的car剂量下,表达gpc3-car-4-1bb的t细胞及共表达gpc3-car-4-1bb和light的t细胞对hepg2异种移植物无活性;肿瘤生长与未经治疗的对照相当(图7,图a)。共表达gpc3-car-4-1bb和ox40l的t细胞与仅表达gpc3-car-4-1bb的t细胞相比适度更具活性,其中在5只动物中有异质反应。共表达gpc3-car-4-1bb和cd70的t细胞有高度活性,导致所有动物在第40天时肿瘤完全消退,随后所有动物都复发。
通过在右胁腹皮下注射5x106个细胞,建立hep3bhcc(atcc,hb-8064)异种移植物。当肿瘤体积达到约100mm3(接种后第20天)时,开始用gpc3car-t细胞的治疗。根据肿瘤体积,将小鼠随机分为每组5只小鼠的治疗组,并用仅表达gpc3-car-4-1bb的t细胞、共表达gpc3-car-4-1bb和cd70的t细胞或共表达gpc3-car-4-1bb和light的t细胞进行治疗,在第1天和第8天静脉内给予1x106个car+细胞的剂量。在实验过程中,每周测量肿瘤体积和体重两到三次。
在所评价的car剂量下,表达gpc3-car-4-1bb的t细胞对hep3b异种移植物无活性;肿瘤生长与未处理的对照相当(图8,图b)。共表达gpc3-car-4-1bb和cd70的t细胞有高度活性,其中5只动物中有4只的肿瘤完全消退,第60天后所有肿瘤都复发。共表达gpc3-car-4-1bb和light的t细胞在研究中最具活性,导致所有动物的肿瘤完全消退,第70天后5只动物中有2只复发。
通过在右胁腹皮下注射5x106个细胞建立jhh7hcc(jcrb,1031)异种移植物。当肿瘤体积达到约50mm3(接种后第8天)时,开始用gpc3car-t细胞的治疗。根据肿瘤体积,将小鼠随机分为每组5只小鼠的治疗组,并用仅表达gpc3-car-4-1bb的t细胞、共表达gpc3-car-4-1bb和cd70的t细胞或共表达gpc3-car-4-1bb和light的t细胞进行治疗,在第1天和第8天静脉内给予5x106个car+细胞的剂量。在实验过程中,每周测量肿瘤体积和体重两到三次。
表达gpc3-car-4-1bb的t细胞在所评价的car剂量下对jhh7异种移植物具有中等活性,其中在治疗组之间具有异质反应(图7,图c)。在三只动物中,肿瘤生长与未治疗的对照相当,而5只动物中有2只经历了肿瘤的完全消退。共表达gpc3-car-4-1bb和light的t细胞有高度活性,其中5只动物中有4只肿瘤消退,包括两个完全反应。共表达gpc3-car-4-1bb和cd70的t细胞有高度活性,其中5只动物中有4只的肿瘤完全消退。在gpc3-car-4-1bb治疗组中,任何具有完全消退的动物均无肿瘤复发。
这些实验表明,与仅表达具有4-1bb共刺激结构域的抗gpc3car的t细胞相比,共表达具有4-1bb共刺激结构域的抗gpc3car及tnf超家族成员cd70、light和ox40l的t细胞在小鼠异种移植模型中显示出提高的抗肿瘤活性。
实施例9:共表达具有cd28共刺激结构域的抗gpc3car和tnf超家族成员多肽cd27的t细胞在小鼠肿瘤异种移植模型中显示出提高的活性。
此实施例证实,与仅表达gpc3-car-cd28的t细胞相比,在t细胞中共表达肿瘤坏死因子(tnf)超家族共刺激肽cd27和gpc3-car-cd28在表达gpc3的小鼠异种移植模型中导致抗肿瘤活性的提高。在nsgtm(nodscidgamma,nod.cg-prkdcscidil2rgtm1wjl/szj,品系005557)小鼠中建立皮下人肝细胞癌(hcc)异种移植模型(jhh7)。
通过在右胁腹皮下注射5x106个细胞建立jhh7hcc(jcrb,1031)异种移植物。当肿瘤体积达到约50mm3(接种后第8天)时,开始用gpc3car-t细胞的治疗。根据肿瘤体积,将小鼠随机分为每组5只小鼠的治疗组,并用仅表达gpc3-car-cd28(seqidno:2)的t细胞或共表达gpc3-car-cd28和cd27(seqidno:33)的t细胞进行治疗,在第1天和第8天静脉内给予5x106个car+细胞的剂量。在实验过程中,每周测量肿瘤体积和体重两到三次。
仅表达gpc3-car-cd28的t细胞在所评价的car剂量下对jhh7异种移植物有高度活性,导致到第15天时5只动物中有4只的肿瘤完全消退,所有肿瘤后来都复发(图8)。共表达gpc3-car-cd28和cd27的t细胞有高度活性,到第10天时所有动物的肿瘤均消退,并且在实验的其余部分继续进行肿瘤控制,没有肿瘤复发。
这些实验证明,与仅表达具有cd28共刺激结构域的抗gpc3car的t细胞相比,共表达具有cd28共刺激结构域的抗gpc3car和tnf超家族成员cd27的t细胞在小鼠异种移植模型中显示出提高的抗肿瘤活性。
实施例10:在小鼠异种移植模型中,单独或与tnf超家族多肽组合表达抗gpc3car的t细胞的扩增。
此实施例证实在gpc3-car-4-1bb中肿瘤坏死因子(tnf)超家族共刺激肽cd70的表达和在gpc3-car-cd28中cd27的表达导致携带肿瘤的nsg小鼠中car-t的体内扩增增强。
当肿瘤体积达到约100mm3(接种后第19天)时,用gpc3car-t细胞治疗携带皮下hepg2异种移植物的动物。将每组5只小鼠分别用表达gpc3-car-4-1bb(seqidno:1)的t细胞或共表达gpc3-car-4-1bb和cd70(seqidno:34)的t细胞治疗,在第1天和第8天静脉内给予5x105个car+细胞的剂量。在第7、14、27、42和56天在异氟烷麻醉下通过眼眶出血收集全血样品(20μl),并用bambanker冷冻保护剂冷冻,直至进行流式细胞术处理。使红细胞溶解,将样品用活/死染料和抗人cd3染色,并通过流式细胞仪进行分析。结果表示为每μl血液中cd3+活细胞的数量(图9,图a)。每个时间点代表5只动物的平均值,但由星号后接所评价的样品数量的表示例外。
在所有时间点,在外周血样品中检测人cd3+细胞,其中计数范围从第7天(car第2剂之前)每μl约1开始,且随着时间的推移,表达gpc3-car-4-1bb的t细胞及共表达gpc3-car-4-1bb和cd70的t细胞的计数均增加(图9,图a)。检测到共表达gpc3-car-4-1bb和cd70的t细胞的cd3+细胞计数增加,其计数在第27天达到峰值,并在第56天测量到t细胞计数的持续持久性,而在仅表达gpc3-car-4-1bb的t细胞下,在第56天未检测到cd3+细胞。cd70的表达为gpc3-car-4-1bbcar-t的体内扩增和持久性提供益处。
当肿瘤体积达到约100mm3(接种后第20天)时,用gpc3car-t细胞治疗携带皮下hep3b异种移植物的动物。将每组5只小鼠用表达gpc3-car-cd28(seqidno:2)的t细胞或共表达gpc3-car-cd28和cd27(seqidno:33)的t细胞治疗,在第1天和第8天静脉内给予1x106个car+细胞的剂量。在第15、25、40和60天在异氟烷麻醉下通过眼眶出血收集全血样品(20μl),并用bambanker冷冻保护剂冷冻,直至进行流式细胞术处理。使红细胞溶解,将样品用活/死染料和抗人cd3染色,并通过流式细胞仪进行分析。在图9图b中,结果以每μl血液中cd3+活细胞的数量表示。每个时间点代表5只动物的平均值,但由星号后接所评价的样品数量的表示例外。
在所有时间点,在外周血样品中检测人cd3+细胞,计数范围从第15天每μl约100开始,且对于仅表达gpc3-car-cd28的t细胞及共表达gpc3-car-cd28和cd27的t细胞,其计数皆随时间而波动。在第40天和第60天检测到共表达gpc3-car-cd28和cd27的t细胞的cd3+细胞计数的增加,其计数在第40天达到峰值,比仅表达gpc3-car-cd28的t细胞高约10倍水平。cd27的表达为gpc3-car-cd28car-t的体内扩增和持久性提供益处。
这些实验表明,与仅表达抗gpc3car变体的t细胞相比,共表达抗gpc3car变体和tnf超家族多肽(如cd70和cd27)的t细胞在小鼠肿瘤模型中可显示出增强的t细胞体内扩增和持久性。
实施例11:通过共表达共刺激多肽提高表达抗gpc3car变体的t细胞的体外和体内活性。
以上实施例证明,与单独的抗gpc3car相比,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽或b7/cd28超家族共刺激肽可提高t细胞的体外和体内活性。以上数据可以总结如下:
●gpc3-4-1bbcar+cd70、gpc3-4-1bbcar+light和gpc3-4-1bbcar+ox40l
○与car-4-1bb亲本相比,在重复刺激测定中,相对于car-4-1bb亲本,其增殖改善
■对car-4-1bb+light组合有特异性,car-cd28+light并未显示比car-cd28亲本有改善
○与car-4-1bb亲本相比,在反复刺激后,il-2、ifn-γ和il-17a的产生改善
○与car-4-1bb亲本相比,在单次刺激增殖测定中增殖改善
○与car-4-1bb亲本相比,刺激后的il-2产生改善
●gpc3-4-1bbcar+cd70,gpc3-4-1bbcar+light
○与car-4-1bb亲本相比,在小鼠肿瘤模型中的体内功效提高
●gpc3-4-1bbcar+cd70
○与car-4-1bb亲本相比,在小鼠肿瘤模型中的体内t细胞持久性得到增加
●gpc3-cd28car+cd27
○与car-cd28亲本相比,增殖得以改善
○与car-cd28亲本相比,il-2产生增加
○与car-cd28亲本相比,对mdsc抑制的抗性提高
○与car-cd28亲本相比,对treg抑制的抗性提高
○与car-cd28亲本相比,在小鼠肿瘤模型中的体内功效提高
实施例12:通过共表达共刺激多肽提高表达抗gpc3car变体的t细胞的活性。
此实施例证实,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽或b7/cd28超家族共刺激肽相对于单独的抗gpc3car可提高t细胞的活性。
在这些实验中,将t细胞用以下病毒转导:单独编码具有4-1bb共刺激结构域的抗gpc3car多肽的(gpc3-car-4-1bb;seqidno:1)的病毒;编码具有cd28共刺激结构域的抗gpc3car多肽(gpc3-car-cd28;seqidno:2)的病毒;或编码由p2a核糖体跳跃序列分隔的这些car变体中的每个和表2中列出的共刺激多肽的组合的病毒。与表达gpc3的hep3b靶细胞一起温育后,评价转导的t细胞增殖和产生细胞因子(il-2)的能力。将转导的t细胞t(效应子)和hep3b细胞(靶标)以2:1的效应子与靶标比率(100,000个效应细胞;50,000个靶细胞)铺于补充有10%热灭活的胎牛血清(fbs)的rpmi1640中,在14天测定期间,每3到4天用50,000个新鲜靶细胞进行再刺激。通过流式细胞术评价cd3阳性细胞的数量,作为每个再刺激时间点下t细胞增殖的量度,并根据计数对时间的绘图,使用macosx,graphpadsoftware,lajollacaliforniausa的graphpadprism77.0a版计算总cd3+t细胞计数的曲线下面积(auc)。根据制造商方案,使用mesoscalediscoveryv-plex人il-2试剂盒在24小时时测量培养上清液中的细胞因子产生(il-2)。如表2中所示,在每个测定内,在没有另外的共刺激多肽的情况下,将相对il-2浓度和增殖auc值计算为对照同源gpc3car变体(亲本)的值的百分比。在一些情况下,将表达gpc3-car-cd28与共刺激多肽的组合的t细胞的活性与表达gpc3-car-4-1bb的t细胞的活性相比较。如果在il-2产生和增殖方面的活性>115%的同源亲本或在这些测定的至少一个中>140%,则确定共刺激肽的共表达能增强功能。
这些实验表明,在t细胞中与抗gpc3car组合表达肿瘤坏死因子(tnf)超家族共刺激多肽或b7/cd28超家族共刺激肽与在具有4-1bb共刺激结构域的抗gpc3car多肽和具有cd28共刺激结构域的抗gpc3car多肽的背景下单独的抗gpc3car相比可以提高t细胞的活性,但并非所有共刺激多肽均提高活性。共表达cd27共刺激多肽提高了表达gpc3-car-4-1bb的t细胞的活性;共表达cd40l和tl1a共刺激多肽提高了表达gpc3-car-cd28的t细胞的活性。
表2.与亲本含4-1bb或亲本含cd28的car变体相比,共表达抗gpc3car和共刺激多肽的变体的体外增殖和il-2释放的评分。
*当与gpc3-car-cd28共表达时,相对于单独的gpc3-car-4-1bb变体对这些变体进行评分。
其它实施方案
本说明书中公开的所有特征都可以任何组合来组合。本说明书中公开的每个特征都可由具有相同、等同或相似目的的替代特征代替。因此,除非另有明确说明,所公开的每个特征仅是一系列等效或相似特征的实例。
从上面的描述中,本领域技术人员可容易确定本公开的基本特征,并且在不背离本发明的精神和范围的前提下,可对本公开做出各种改变和修改以使其适应于各种用途和条件而没有过度的实验。因此,其它实施方案也在权利要求之内。
等效方案
尽管已经在本文中描述和说明了几个发明实施方案,但是本领域普通技术人员将容易想到执行功能和/或获得结果和/或本文所述的一个或多个优点的多种其它方式和/或结构,并且每个此类变型和/或修改被认为在本文描述的发明实施方案的范围内。更一般来说,本领域技术人员将容易理解,本文描述的所有参数、尺寸、材料和配置仅是示例性的,并且实际参数、尺寸、材料和/或配置将取决于使用本发明教导的特定应用或多种应用。本领域技术人员仅使用常规试验便将认识到或者能够确定本文所述的特定发明实施方案的很多等效方案。因此,应当理解,前述实施方式仅以举例的方式给出,并且在所附权利要求及其等效方案的范围内,可以不同于具体描述和要求保护的方式来实践本发明的实施方案。本公开的发明实施方案涉及本文所述的每个单独特征、系统、物品、材料、试剂盒和/或方法。此外,两个或更多个此类特征、系统、物品、材料、试剂盒和/或方法的任何组合包括在本公开的发明范围内,如果此类特征、系统、物品、材料、试剂盒和/或方法彼此不矛盾的话。
如本文定义和使用的所有定义应理解为优于字典定义、以引用方式并入的文献中的定义和/或所定义的术语的普通含义。
本文所公开的所有参考文献、专利和专利申请关于其所引用的主题以引用的方式并入本文,在一些情况下,所述主题可以涵盖文献的全部内容。
除非明确相反指出,如本文在说明书和权利要求书中使用的不定冠词“一个”和“一种”应理解为表示“至少一个/种”。
如本文在说明书和权利要求书中所用的短语“和/或”应理解为意指如此结合在一起的要素中的“一个或两个”,即,在一些情况下联合存在而在其它情况下分别存在的要素。用“和/或”列出的多个要素应以相同方式来解释,即,如此结合的要素中的“一个或多个”。可以任选地存在其它要素,而不是由“和/或”条款明确标识的要素,无论与明确标识的那些要素相关还是无关。因此,作为非限制性实例,对“a和/或b”的提及当与诸如“包含”之类的开放式语言结合使用时,在一个实施方案中可仅指代a(任选地包括除b之外的要素);在另一个实施方案中,仅指代b(任选地包括除a以外的要素);在又一个实施方案中,指代a和b两者(任选地包括其它要素);等等。
如本文在说明书和权利要求书中所用,“或”应理解为具有与如上定义的“和/或”相同的含义。例如,当将列表中的项目分开时,“或”或者“和/或”应解释为是包含性的,即,包含多个要素或要素列表中的至少一个,但也包括多于一个,以及任选的另外未列出的项目。仅明确相反指出(诸如“仅其中之一”或“恰好其中之一”,或当在权利要求书中使用时,“由...组成”)的术语将指的是包含多个要素或要素列表中的恰好一个要素。一般而言,如本文所用的术语“或”仅应在排他性术语(诸如“任一个”、“其中之一”、“仅其中之一”或“恰好其中之一”)开头时解释为表示排他性替代(即“一个或另一个,但不是两个都”)。。当在权利要求书中使用时,“基本上由...组成”应具有在专利法领域中所使用的普通含义。
如本文在说明书和权利要求书中所用,在提及一个或多个要素的列表时,短语“至少一个”应理解为是指从要素列表中的任何一个或多个要素中选择的至少一个要素,但不一定包括要素列表中具体列出的每个要素中的至少一个,并且不排除要素列表中的要素的任何组合。此定义还允许除了短语“至少一个”所指代的要素列表中明确标识的要素之外的要素可以任选地存在,无论与那些明确标识的要素有关还是无关。因此,作为非限制性实例,“a和b中的至少一个”(或等效地,“a或b中的至少一个”,或等效地,“a和/或b中的至少一个”)在一个实施方案中可以指代至少一个,任选地包括一个以上a,不存在b(且任选地包括除b以外的要素);在另一个实施方案中,至少一个,任选地包括一个以上b,不存在a(且任选地包括除a以外的要素);在又一个实施方案中,至少一个,任选地包括一个以上a,和至少一个,任选地包括一个以上b(且任选地包括其它要素);等等。
还应理解,除非明确相反地指出,在本文要求保护的包括一个以上步骤或动作的任何方法中,所述方法的步骤或动作的顺序不一定限于所述方法的步骤或动作所列举的顺序。
- 还没有人留言评论。精彩留言会获得点赞!