具有消炎镇痛作用的冲击波治疗新型耦合剂及其制备方法与流程
本发明涉及医用耦合剂领域,特别是涉及一种具有消炎镇痛作用的冲击波治疗新型耦合剂及其制备方法。
背景技术:
体外冲击波(extracorporealshockwave,esw)是一种可传递能量的声波,并且较超声波具有更多的特性,通过其机械效应、空化效应和热效应作用于人体组织。如治疗时冲击波通过治疗探头和耦合剂将声波能量传至人体内的目标细胞,再通过治疗探头的定位和移动,可作用于人体疼痛发生较广泛的区域,治疗区域广泛,操作简单,风险小,无副作用,能对肌筋膜疼痛综合症、椎间盘疾患、坐骨神经痛、脊柱异常、颈肩痛等起到较好的治疗效果。
现有的耦合剂一是起润滑作用,减小探头面与皮肤之间的摩擦;二是充填治疗探头与病人皮肤之间的空隙,不使这些空隙间的微量空气影响声波的穿透;三是通过耦合剂的“过渡”作用,使探头与皮肤之间的声阻抗差减小,从而减小声波能量在此界面的反射损失。但并不具有治疗作用。
经皮给药能够避免口服给药和静脉注射等传统方式带来的诸多弊端,其优势在于增加了病人的依从性和避免了肝首过效应,长期维持稳定有效的给药浓度。但是由于角质层(sc)的皮肤屏障功能对药物制剂有严格要求,且药物的吸收率较低。
本申请发明人就是在现有技术的基础上,创设的一种新的具有消炎镇痛作用的冲击波治疗新型耦合剂及其制备方法,使该耦合剂还具有抗炎治疗作用,能实现冲击波治疗的同时增强抗炎药物的透皮吸收效果,综合提高临床疗效。
技术实现要素:
本发明要解决的技术问题是提供一种具有消炎镇痛作用的冲击波治疗新型耦合剂,使该耦合剂增加抗炎治疗作用,能实现冲击波治疗的同时增强抗炎药物的透皮吸收效果,综合提高临床疗效。
为解决上述技术问题,本发明提供一种具有消炎镇痛作用的冲击波治疗新型耦合剂,所述耦合剂采用载药透明质酸纳米微乳,所述载药透明质酸纳米微乳中载有非甾体类抗炎药物。
进一步改进,所述载药透明质酸纳米微乳的制备方法为:
(1)将透明质酸和n-n’环己基碳化二亚胺分别溶于磷酸盐缓冲溶液(ph=7.3-7.4)中,溶液混合搅拌2-5h,形成a溶液,其中所述透明质酸和n-n’环己基碳化二亚胺的摩尔比为1:1-1.2;
(2)制备含有甘油单硬脂酸酯的丙酮溶液,形成b溶液;
(3)使用蠕动泵将所述a溶液按1滴/秒的速度,逐滴加入到b溶液中,且所述透明质酸与甘油单硬脂酸酯的摩尔比为1:1-1.5,32-38℃反应10-14h,离心取沉淀,透析纯化后冻干,形成ha-gms粉末;
(4)取所述ha-gms粉末和非甾体类抗炎药物按质量比1:1-2溶于去离子水中,形成c溶液,再将吐温-80、d-α-生育酚聚乙二醇1000琥珀酸酯顺序滴入所述c溶液中,磁力搅拌至混匀,超声20-40s,形成包裹非甾体类抗炎药物的透明质酸纳米微球溶液,然后再缓慢滴入海藻糖分散剂,继续搅拌20-40min,低温超声3-7min,得到所述载药透明质酸纳米微乳。
进一步改进,所述非甾体类抗炎药物采用双氯芬酸钠、布洛芬、阿司匹林或吲哚美辛。
本发明还通过一种具有消炎镇痛作用的冲击波治疗新型耦合剂的制备方法,所述冲击波耦合剂的制备方法包括如下步骤:
(1)将透明质酸和n-n’环己基碳化二亚胺分别溶于磷酸盐缓冲溶液(ph=7.3-7.4)中,溶液混合搅拌2-5h,形成a溶液,其中所述透明质酸和n-n’环己基碳化二亚胺的摩尔比为1:1-1.2;
(2)制备含有甘油单硬脂酸酯的丙酮溶液,形成b溶液;
(3)使用蠕动泵将所述a溶液按1滴/秒的速度,逐滴加入到b溶液中,且所述透明质酸与甘油单硬脂酸酯的摩尔比为1:1-1.5,32-38℃反应10-14h,离心取沉淀,透析纯化后冻干,形成ha-gms粉末;
(4)取所述ha-gms粉末和非甾体类抗炎药物按质量比1:1-2溶于去离子水中,形成c溶液,再将吐温-80、d-α-生育酚聚乙二醇1000琥珀酸酯顺序滴入所述c溶液中,磁力搅拌至混匀,超声20-40s,形成包裹非甾体类抗炎药物的透明质酸纳米微球溶液,然后再缓慢滴入海藻糖分散剂,继续搅拌20-40min,低温超声3-7min,得到所述冲击波耦合剂。
进一步改进,所述非甾体类抗炎药物采用双氯芬酸钠、布洛芬、阿司匹林或吲哚美辛。
采用这样的设计后,本发明至少具有以下优点:
1.本发明通过利用透明质酸具有良好透皮吸收和保湿润滑的特性,将其制备成载药的纳米微乳,使其不仅能用于体外冲击波治疗探头用的耦合剂,还能配合冲击波,使其在冲击波的作用下,提高其中包裹的抗炎药物的透皮吸收效果,则更好的实现了冲击波治疗和经皮给药治疗的抗炎作用,操作简单,疗效显著。
2.本发明载药透明质酸纳米微乳的制备方法中通过采用甘油单硬脂酸酯对透明质酸进行改性,得到稳定性更好、机械强度适当的改性透明质酸纳米微乳,使其能抵抗一定的冲击波作用,则在较小冲击波作用下促进透明质酸纳米微球向人体深部组织运动,当冲击波逐渐增大时,可介导纳米微球破裂,从而使其包裹的药物在人体深部组织释放,提高药物的透皮效果,达到治疗炎症的目的。
附图说明
上述仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,以下结合附图与具体实施方式对本发明作进一步的详细说明。
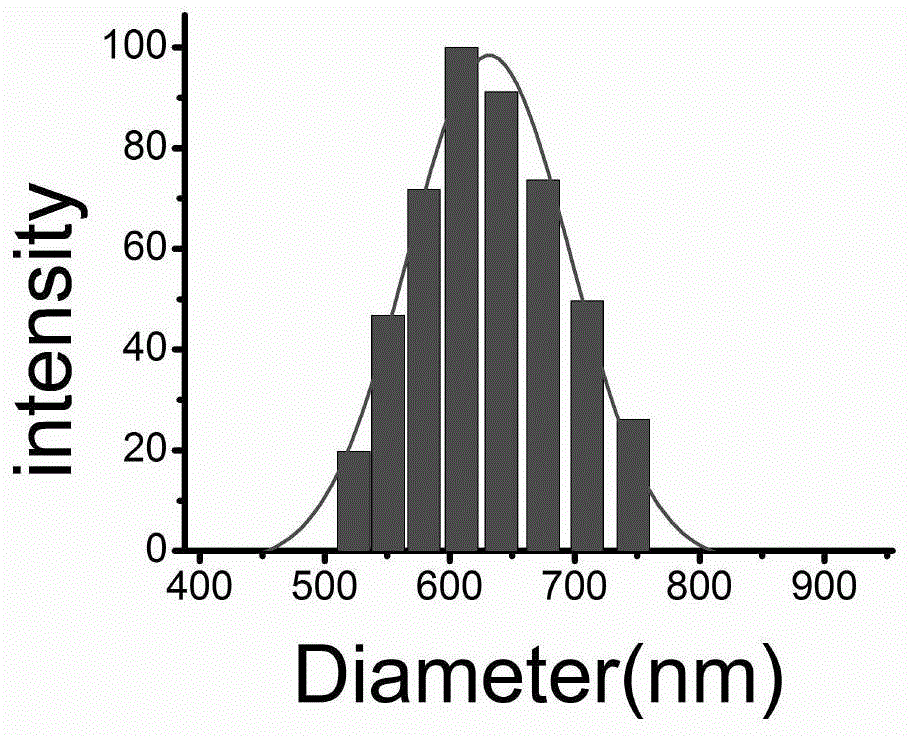
图1是本发明具有消炎镇痛作用的冲击波治疗新型耦合剂中载药透明质酸纳米微乳的粒径分布图。
图2是本发明具有消炎镇痛作用的冲击波治疗新型耦合剂中载药透明质酸纳米微乳的电镜扫描形态图。
图3是本发明具有消炎镇痛作用的冲击波治疗新型耦合剂结果实施例中实验组和对照组在不同时间点的渗透药物检测结果图。
具体实施方式
实施例1
首先,配置ph=7.4的磷酸盐缓冲溶液(即pbs溶液),将37.932mg透明质酸(ha)和20.633mgn-n’环己基碳化二亚胺(edc)分别溶于90mlpbs溶液中,通过磁力搅拌器以100rpm的速度混合搅拌3h,形成a溶液。
再将d-α-甘油单硬脂酸酯(gms)53.7mg溶于10ml丙酮中,搅拌至完全溶解,形成b溶液。
再使用蠕动泵将a溶液按1滴/秒的速度,逐滴加入到b溶液中,并使ha与gms的摩尔比为1:1.5,在35℃搅拌反应10h,最终形成100ml体系溶液,然后12000rpm离心10min,取沉淀透析,拦截分子量8000-10000的物质,纯化后冻干,形成ha-gms粉末,即由d-α-甘油单硬脂酸酯改性的透明质酸粉末。
接着,取2.0mgha-gms粉末和2.0mg双氯芬酸钠药物溶于70ml去离子水中,形成c溶液,再将1.5g吐温-80、0.75gd-α-生育酚聚乙二醇1000琥珀酸酯(tpgs)顺序滴入c溶液中,100rpm磁力搅拌至混匀,超声30s,形成包裹双氯芬酸钠的透明质酸纳米微球溶液,然后再缓慢滴入0.5mmol海藻糖溶液进入反应体系,继续搅拌30min,4℃超声5min,得到该载药透明质酸纳米微乳,即具有消炎镇痛作用的冲击波治疗新型耦合剂1。
实施例2
首先,配置ph=7.3的磷酸盐缓冲溶液(即pbs溶液),将56.898mg透明质酸(ha)和30.949mgn-n’环己基碳化二亚胺(edc)分别溶于90mlpbs溶液中,通过磁力搅拌器以100rpm的速度混合搅拌5h,形成a溶液。
再将d-α-甘油单硬脂酸酯(gms)53.7mg溶于10ml丙酮中,搅拌至完全溶解,形成b溶液。
再使用蠕动泵将a溶液按1滴/秒的速度,逐滴加入到b溶液中,并使ha与gms的摩尔比为1:1,在32℃搅拌反应10h,最终形成100ml体系溶液,然后12000rpm离心10min,取沉淀透析,拦截分子量8000-10000的物质,纯化后冻干,形成ha-gms粉末,即由d-α-甘油单硬脂酸酯改性的透明质酸粉末。
接着,取1.0mgha-gms粉末和1.5mg双氯芬酸钠药物溶于70ml去离子水中,形成c溶液,再将1.5g吐温-80、0.75gd-α-生育酚聚乙二醇1000琥珀酸酯(tpgs)顺序滴入c溶液中,100rpm磁力搅拌至混匀,超声30s,形成包裹双氯芬酸钠的透明质酸纳米微球溶液,然后再缓慢滴入0.5mmol海藻糖溶液进入反应体系,继续搅拌30min,4℃超声5min,得到该载药透明质酸纳米微乳,即具有消炎镇痛作用的冲击波治疗新型耦合剂2。
实施例3
首先,配置ph=7.4的磷酸盐缓冲溶液(即pbs溶液),将18.966mg透明质酸(ha)和12.379mgn-n’环己基碳化二亚胺(edc)分别溶于90mlpbs溶液中,通过磁力搅拌器以100rpm的速度混合搅拌2h,形成a溶液。
再将d-α-甘油单硬脂酸酯(gms)21.48mg溶于10ml丙酮中,搅拌至完全溶解,形成b溶液。
再使用蠕动泵将a溶液按1滴/秒的速度,逐滴加入到b溶液中,并使ha与gms的摩尔比为1:1.2,在32℃搅拌反应10h,最终形成100ml体系溶液,然后12000rpm离心10min,取沉淀透析,拦截分子量8000-10000的物质,纯化后冻干,形成ha-gms粉末,即由d-α-甘油单硬脂酸酯改性的透明质酸粉末。
接着,取0.75mgha-gms粉末和0.9mg布洛芬药物溶于70ml去离子水中,形成c溶液,再将1.5g吐温-80、0.75gd-α-生育酚聚乙二醇1000琥珀酸酯(tpgs)顺序滴入c溶液中,100rpm磁力搅拌至混匀,超声30s,形成包裹布洛芬的透明质酸纳米微球壳溶液,然后再缓慢滴入0.5mmol海藻糖溶液进入反应体系,继续搅拌30min,4℃超声5min,得到该载药透明质酸纳米微乳,即具有消炎镇痛作用的冲击波治疗新型耦合剂3。
当然,本申请中的非甾体类抗炎药物还可采用阿司匹林、吲哚美辛等药物或恩赛类的其它药物。
结果实施例1
对上述实施例制备得到的样品冲击波耦合剂1、2、3,利用激光粒径仪(dls,brookhaveninstrument-omni,usa)测定透明质酸纳米微乳的粒径大小和分布,并用扫描电镜(sem)表征其形态,结果如附图1和2所示,该样品载药的透明质酸纳米微乳平均粒径为650nm。
结果实施例2
透皮试验:对实施例一中制备得到的样品冲击波耦合剂1采用franz透皮扩散仪进行体外皮肤渗透试验。具体操作如下:
c57bl/6小鼠(购于北京科宇动物养殖中心)6只,2%戊巴比妥钠(300μl/100g)腹腔注射麻醉后脱颈处死,用电剃刀去除小鼠背部毛发,用剪刀仔细剪下已经暴露的皮肤。用沾有生理盐水的棉球擦拭皮肤的真皮层,去除皮下组织,生理盐水洗涤后擦干,至于-20℃冰箱中,备用。
将准备好的皮肤随机分为对照组和实验组,每组3个样本,并分别固定于franz扩散池的供给室与接收室之间,其中皮肤的表层面向供给室,该扩散池的供给有效渗透面积为3.164cm2。向接收室加入体积为12ml的pbs溶液(ph=7.4),使得液面与皮肤能够紧密接触。实验过程中采用循环水浴加热,使温度保持在37℃,并以200rpm的转速搅拌。
用移液枪取实施例一制备好的样品4ml(浓度为0.5mg/ml),分别加入到各个供给室中,并用保鲜膜密封以防止样品蒸发。此时,实验组(esw组)使用体外放散式冲击波治疗仪在供给室的侧壁,与皮肤垂直的方向对供给室进行冲击波干预,冲击波干预参数为(1000s,6hz);对照组(ctrl组)不采用体外冲击波干扰。
分别在规定时间(1.0、2.0、3.0、6.0、12.0h)抽取接收室溶液50μl,将抽取的样品用pbs溶液稀释后经过滤纸过滤,用紫外分光光度计测定溶液中透过药品的吸收值,计算随时间变化透过皮肤的药品积累量,以及透过皮肤的最大值,结果如附图3所示。
结论:实验组(使用冲击波干预)的双氯芬酸钠积累渗透量明显高于对照组(未用冲击波干预)的双氯芬酸钠积累渗透量,这表明体外冲击波在载药的透明质酸纳米微乳经皮吸收上有非常好的促渗效果。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,本领域技术人员利用上述揭示的技术内容做出些许简单修改、等同变化或修饰,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!