奥巴托克在制备广谱抗冠状病毒药物中的应用
本发明属于医药技术领域,具体涉及奥巴托克(obatoclaxmesylate)在制备广谱抗冠状病毒药物中的新应用,具体涉及奥巴托克在制备抗人冠状病毒,如sars-cov,mers-cov,2019-ncov,hcov-nl63,hcov-229e,hcov-oc43、hcov-hku1等;其他脊椎动物冠状病毒,如猪传染性胃肠炎病毒(tgev)、猪流行性痢疾病毒(pedv)、猪急性腹泻综合征冠状病毒(sads-cov)、传染性支气管炎病毒(ibv)等药物中的应用。本发明包含奥巴托克在冠状病毒预防或治疗中的单独或联合应用。
背景技术:
本世纪以来,间歇性出现了数次高致病性人冠状病毒的暴发和流行,包括萨斯冠状病毒(sars-cov),莫斯冠状病毒(mers-cov)和新型冠状病毒(2019-ncov)。这几种病原感染人均引起急性呼吸系统疾病。除上述高致病性冠状病毒之外,其他人类冠状病毒如hcov-nl63,hcov-229e,hcov-oc43、hcov-hku1等,感染人类可引起轻微的上呼吸道疾病,为低致病性病毒,免疫力低下者为易感人群。此外,冠状病毒对家畜和家禽养殖业也存在着重大威胁,典型病毒有猪传染性胃肠炎病毒(tgev)、猪急性腹泻综合征冠状病毒(sads-cov)、猪流行性痢疾病毒(pedv)、传染性支气管炎病毒(ibv)等。可见,冠状病毒是一种宿主广泛且非常高危的重要病原体。
由于高致病性冠状病毒的暴发往往在短时间内引起巨大的社会恐慌,对人类健康和生命安全造成严重威胁,且存着在新发、再发的风险,因此冠状病毒受到了全球科学研究者的广泛关注,其进化历程、病原结构、致病机理等越来越多地被阐明。尽管如此,目前尚无针对冠状病毒感染的特效药物。sars和mers的临床治疗中,使用的抗病毒药物主要有利巴韦林、洛匹那韦、利托那韦、糖皮质激素、干扰素或者这几种药物的组合物,但其治疗效果有限或者根本没有效果,而且这几类药物治疗具有产生后遗症的风险。因此,开发高效特异的抗冠状病毒药物是一项重大且艰巨的任务。
obatoclaxmesylate,中文译名甲磺酸奥巴托克或奥巴托克。由geminx公司发现,也称为gx15-070,以下简称olx。olx是一种bcl-2家族蛋白的拮抗剂,可以抑制由mcl-1蛋白介导的抗凋亡途径,起到诱导癌细胞凋亡的效果。olx作为抗肿瘤药物,其安全性和治疗效果已经在美国一期和二期临床研究中经过验证。近年有研究发现olx具有特异的抗病毒功能,已经证实其对流感病毒a、甲病毒属的几种病毒(包括基孔肯雅病毒和辛德比斯病毒)和寨卡病毒都有抑制作用,但是否对其他种属病毒具有抑制作用研究甚少。
技术实现要素:
为了克服现有技术中存在的不足,本发明的目的是提供一种药物甲磺酸奥巴托克新的应用,甲磺酸奥巴托克在制备广谱抗冠状病毒药物中的应用。本发明通过mhv-a59冠状病毒感染系统,进行了高通量的化合物库的筛选,筛选到了一种美国食品药品监督管理局(fda)批准的药物obatoclaxmesylate(又名gx15-070,以下简称olx)。发现olx在纳摩尔浓度下对mhv-a59具有高效抑制作用,同时olx的细胞毒性很低。进一步发现olx作用在冠状病毒进入细胞的阶段,阻止病毒进入细胞,是病毒进入抑制剂。此外,olx对sars-likecovwiv1、mers-cov、2019-ncov等几种高致病性冠状病毒均具有抑制作用,表明olx是一种广谱的预防或治疗冠状病毒药物。
本发明的第二个目的是提供含有甲磺酸奥巴托克的药物组合物在制备预防或治疗冠状病毒药物中的应用。
为了实现上述目的,本发明提供了如下技术方案:
第一方面,提供具有结构式(i)所示的甲磺酸奥巴托克或其衍生物在制备预防或治疗冠状病毒药物中的应用,
优选地,上述应用中,甲磺酸奥巴托克的衍生物包括其药学上可接受的盐类,或式(1)结构减少或增加一个或几个基团形成的具有同等功能的化合物。
第二方面,提供含有如结构式(i)所示的甲磺酸奥巴托克或其衍生物的药物组合物在制备预防或治疗冠状病毒药物中的应用。
优选地,上述的应用中,所述的组合物还含有其他的抗病毒药。
优选地,上述的应用中,所述的组合物还含有药学上可接受的载体或赋形剂。
优选地,上述的应用中,所述的冠状病毒为感染人类的冠状病毒,选自重症急性呼吸综合征冠状病毒sars-cov(severeacuterespiratorysyndromecoronavirus,sars-cov),中东呼吸综合征冠状病毒mers-cov(middleeastrespiratorysyndromecoronavirus,mers-cov),新型冠状病毒2019-ncov,人冠状病毒hcov-nl63(humancoronavirusnl63),人冠状病毒hcov-229e(humancoronavirus229e),人冠状病毒hcov-oc43(humancoronavirusoc43)、人冠状病毒hcov-hku1(humancoronavirushku1);其他脊椎动物冠状病毒,选自猪传染性胃肠炎病毒(tgev)、猪流行性痢疾病毒(pedv)、猪急性腹泻综合征冠状病毒(sads-cov)、传染性支气管炎病毒(ibv)、小鼠肝炎病毒mhv-a59。
进一步优选地,上述的应用中,所述的冠状病毒为重症急性呼吸综合征冠状病毒sars-cov、中东呼吸综合征冠状病毒mers-cov、新型冠状病毒2019-ncov、小鼠肝炎病毒mhv-a59。
第三方面,提供具有结构式(i)所示的甲磺酸奥巴托克或其衍生物或含有如结构式(i)所示的甲磺酸奥巴托克或其衍生物的药物组合物在制备抑制冠状病毒进入宿主细胞药物中的应用。
本发明化合物或含有它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔粘膜、眼、肺和呼吸道、皮肤、阴道、直肠等。
给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括o/w型、w/o型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等;固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。
本发明化合物可以制成普通制剂、也可以制成缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将本发明化合物制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;润湿剂可以是水、乙醇、异丙醇等;黏合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将给药单元制成胶囊剂,可以将有效成分本发明化合物与稀释剂、助流剂混合,将混合物直接置于硬胶囊或软胶囊中。也可将有效成分本发明化合物先与稀释剂、黏合剂、崩解剂制成颗粒或微丸,再置于硬胶囊或软胶囊中。用于制备本发明化合物片剂的各稀释剂、黏合剂、润湿剂、崩解剂、助流剂品种也可用于制备本发明化合物的胶囊剂。
为将本发明化合物制成注射剂,可以用水、乙醇、异丙醇、丙二醇或它们的混合物作溶剂并加入适量本领域常用的增溶剂、助溶剂、ph调剂剂、渗透压调节剂。增溶剂或助溶剂可以是泊洛沙姆、卵磷脂、羟丙基-β-环糊精等;ph调剂剂可以是磷酸盐、醋酸盐、盐酸、氢氧化钠等;渗透压调节剂可以是氯化钠、甘露醇、葡萄糖、磷酸盐、醋酸盐等。如制备冻干粉针剂,还可加入甘露醇、葡萄糖等作为支撑剂。
此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂或其他添加剂。
为达到用药目的,增强治疗效果,本发明的药物或药物组合物可用任何公知的给药方法给药。
本发明的化合物或组合物可单独服用,或与其他治疗药物或对症药物合并使用。当本发明的化合物与其他治疗药物存在协同作用时,应根据实际情况调整它的剂量。
有益效果:
本发明中,当olx的使用浓度为0.005μm-0.5μm时,可以有效抑制鼠肝炎病毒mhv-a59(genbankaccession:ay700211)[1]在宿主细胞(neuro-2a)中的复制,ec50为11.4nm,细胞毒性极低。mhv-a59感染后4-12小时加入olx药物,亦可以有效降低病毒在宿主细胞中的复制(图2)。
本发明中,当olx的使用浓度为0.5μm时,在细胞水平对蝙蝠来源的类sars冠状病毒sars-likecovwiv1(genbankaccession:kf367457.1)[2]抑制效率达95%,对重组mers-cov(genbankaccession:mh734115)[3]活病毒的抑制作用达到94%。同时,olx能够抑制2019-ncovwiv04(gisaidaccessionno.epi_isl_402124,国家病毒资源库,保藏编号:ivcas6.7512)[4]病毒的复制,ec50为398nm(图4-图6)。
本发明中,用鼠肝炎病毒mhv-a59经肝部注射的方式构建小鼠急性肝炎模型,用于评估olx在动物水平的抗冠状病毒作用。这部分结果表明,与对照组小鼠(只注射病毒不注射药物)相比,间隔两次尾静脉注射0.05μg/golx可有效降低mhv-a59在小鼠肝内的复制,减轻小鼠因病毒感染引起的症状,可保护小鼠免受mhv-a59感染致死(图7)。
此药物对人体的安全性已经在美国一期和二期临床研究中经过验证,本发明确定了甲磺酸奥巴托克广谱抗冠状病毒的明显药效,避免了新药研发的漫长周期,这为我们进一步的研发抗冠状病毒尤其是抗新型冠状病毒2019-ncov提供了强有力的理论基础和实践基础,具有重要的开发价值和推广意义。
本发明所使用的化合物obatoclaxmesylate,中文译名甲磺酸奥巴托克,或奥巴托克。由geminx公司发现,也称为gx15-070。甲磺酸奥巴托克采购于selleck公司,货号s1057。网页链接为https://www.selleck.cn/products/obatoclax-mesylate.html。
附图说明
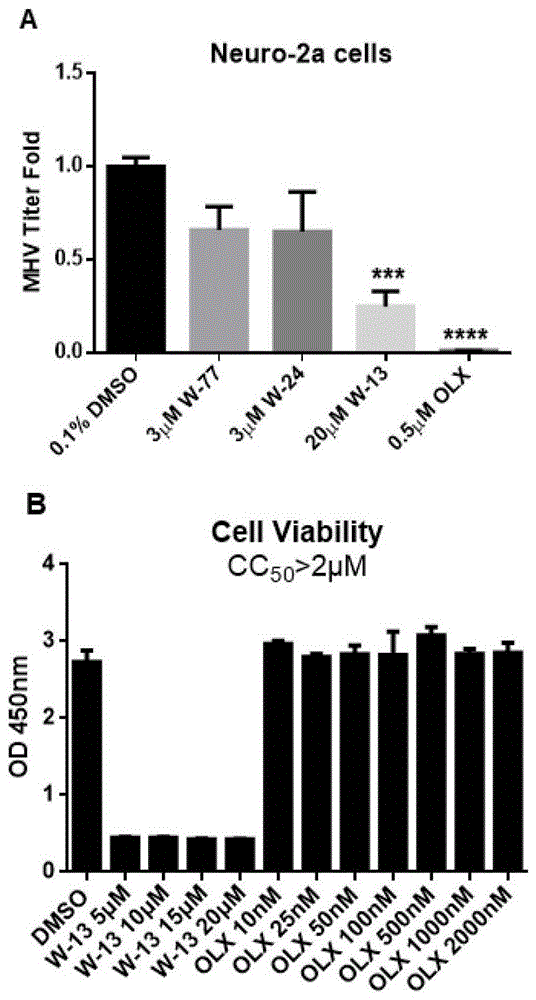
图1为筛选得到的4种小分子药物对mhv-a59复制的影响以及其细胞毒性。结果表明药物olx具有高效的抗病毒作用且细胞毒性小。
a:初筛得到的4种小分子药物(w-77,w-24,w-13,olx)对mhv-a59病毒复制的影响。以4种药物的溶剂dmso(浓度为0.1%)作为对照,加入mhv-a59病毒的同时加入相应浓度药物。病毒吸附结束后更换新鲜培养基,同时继续加入对应浓度的药物,直至收样。病毒感染16h后收细胞上清,用噬斑实验测试病毒滴度。四种药物的浓度分别为w-77:3μm,w-24:3μm,w-13:20μm,olx:0.5μm;moi=0.1,细胞系为neuro-2a。从结果可以看出,药物w-13和olx在不同浓度下可以显著抑制mhv-a59在宿主细胞中的复制,olx的效果最为明显。
b:检测药物w-13和olx的细胞毒性。以0.1%dmso为对照,向neuro-2a细胞中加入相应浓度药物,孵育48h后用cck8试剂盒检测细胞活性。加入cck8试剂孵育1h后,检测细胞液在450nm处的吸光度,数值越大代表细胞活性越好。结果表明药物w-13在其发挥抗病毒作用的浓度范围内(20μm)具有非常强的细胞毒性。而当olx的浓度达到2μm时,细胞毒性依然很小(cc50>2μm),而这个范围内olx可以发挥高效的抗病毒作用,说明olx不仅具有显著的抗冠状病毒功效,其安全性也非常高。因此我们选取olx作为进一步研究的目标。
图2为olx对冠状病毒mhv-a59复制的抑制效果。
a:olx抗mhv-a59病毒的ec50测定。以0.1%dmso为对照,在加入mhv-a59病毒的同时加入不同浓度olx,吸附结束后换新鲜培养基,同时继续加入同样浓度药物孵育细胞,直至收样。感染后16h收上清,用噬斑法检测上清中的病毒滴度。moi=0.1,细胞系为neuro-2a。从图中可以看出,olx抑制mhv-a59的ec50为11.4nm,在极低的药物浓度下具有非常好的抗冠状病毒效果,且抗病毒效果呈现剂量依赖性。结果图1b,其si(cc50/ec50)>175。
b:病毒感染后olx对mhv-a59复制的抑制效果。将mhv-a59病毒液加入neuro-2a细胞但不加入药物,moi=0.1。吸附结束后弃掉病毒液,pbs清洗细胞,换新鲜培养基。以加入病毒的时间作为感染起点,分别在病毒感染后的4、8、12小时加入浓度为0.1μm的olx。药物孵育16小时后收上清,用噬斑法检测病毒滴度。此外,细胞加trizol裂解,提取细胞总rna,经反转录后用q-pcr的方法检测mhv-a59mrna7的相对表达量。在mrna水平上,病毒感染4h后加入olx其mrna7变化不显著,但感染8h后,olx的抗病毒效果非常明显。
c:病毒感染后olx对mhv-a59复制的抑制效果。上述处理后收上清所得样品,用噬斑法检测病毒滴度。结果说明在活病毒水平上,感染后4、8、12h加入olx,都可以呈现出非常好的抗病毒效果。以上结果说明药物olx在病毒感染后用药仍然可以发挥作用。
图3为olx抗冠状病毒作用节点的初步研究,通过药物作用时间节点分析表明,olx在病毒进入阶段发挥作用。
取moi=0.1,在mhv-a59病毒感染前后的不同时间节点加入浓度为0.1μm的olx,孵育不同的时间段,病毒感染8小时后收细胞上清。随后用噬斑法检测样品中的病毒滴度。a图表示时间节点示意图。b图表示olx在病毒感染前后不同时间孵育后的抑制效果。结果表明,若在感染前2小时加药,病毒吸附进入过程中存在olx(-2to0h)的抑制效果是吸附进入过程中不存在olx(-2toattach)抑制效果的2.5倍。另外,若在感染后加药,0-1h(0to1)和4-8h(4to8)加药的效果最差,而0-8h(0to8)和2-8h(2to8)加药的抑制效果相似。mhv在neuro-2a细胞中完成一轮复制并释放的时间在2-4h之间,因此olx存在于0-8h或2-8h正好可以抑制释放至细胞外的病毒第二轮感染,这可以解释为什么在上述时间加入olx具有较好的抑制效果。而在0-1h或4-8h之间,第一轮或第二轮病毒大部分已完成了进入,药物无法起到抑制其进入的功能。因此olx作用于病毒的进入阶段,olx的抗冠状病毒作用跟抑制病毒的进入相关。
图4为olx对sars-like冠状病毒wiv1的抑制作用。sars-likecovwiv1是一种从蝙蝠身上分离出来的冠状病毒,和sars-cov十分相似,使用人的ace2为受体,具有感染人的能力。
在sars-likecovwiv1吸附的同时加入浓度为0.5mm的olx。吸附2h后,弃掉病毒液,pbs清洗细胞,更换新鲜培养基,同时继续加入同样浓度的olx孵育。吸附结束后24小时收细胞上清,噬斑法检测sars-likecovwiv1的病毒滴度。从结果来看,0.5μmolx能够有效抑制sars-likecovwiv1复制,抑制效果能达到95%。
图5为olx对mers-cov的抑制作用。
本实验中用到的mers-cov为重组活病毒[3]。加入mers-cov吸附的同时加入浓度为0.5μm的olx。吸附2h后,弃掉病毒液,pbs清洗细胞,更换新鲜培养基,同时继续加入同样浓度的olx孵育。吸附结束后24小时,分别收细胞上清和细胞反复冻融液,噬斑法检测mers-cov病毒滴度。图为噬斑实验检测结果。从结果来看,0.5μmolx抑制mers-cov复制的效率能达到94%。
图6为olx对2019-ncovwiv04的抑制作用及ec50测定。
2019-ncovwiv04为从icu病人样本中分离得到的毒株(国家病毒资源库,保藏编号:ivcas6.7512)[4]。2019-ncovwiv04病毒以感染复数moi=0.01感染veroe6细胞,加入病毒的同时加入不同浓度olx,吸附结束后换新鲜培养基,同时继续加入同样浓度药物孵育细胞,直至收样。实验中以0.1%dmso作为对照。24h后,提取细胞rna,用rt-qpcr的方法检测病毒复制水平。olx抑制2019-ncovwiv04的ec50为398nm。
图7为olx对感染mhv的c57bl/6小鼠水平的保护作用。c57bl/6小鼠经肝脏注射106pfumhv,同时用腹腔注射的方法在第0天和第2天注射相应药量。每组给药量分别为0.01μg/g、0.05μg/g。
a:小鼠体重变化。给药后,对其中一半小鼠(n=5)进行生存状态观察并记录,同时记录体重变化。从图中可知,两组注射药物的小鼠的体重降低值比无药物对照组小鼠的体重降低值小。
b:小鼠生存率。从每组的小鼠生存率来看,0.01μg/golx组的小鼠总体生存率高于无olx组的小鼠,但低于0.05μg/golx组的小鼠。0.05μg/golx组的小鼠全部存活,该剂量可完全保护小鼠免受mhv感染致死。
c:小鼠肝脏病毒滴度。另一半小鼠(n=5)在感染3天后解剖,取肝脏,称重,研磨匀浆后离心,取上清检测组织中病毒滴度。结果表明,0.01μg/g、0.05μg/g的剂量均可有效降低mhv在小鼠肝脏中的复制,随着剂量增加,病毒抑制效果更好。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
以下为实施例中涉及的常规实验:
1.细胞培养
本次实验使用的细胞系有neuro-2a和l2,由本实验室提供。细胞培养时使用添加了含10%fbs和含1%青霉素和链霉素的dmem培养基,于37℃培养箱中培养,环境co2浓度5%。
2.病毒扩增
本次实验需要用到的mhv病毒需要在neuro-2a细胞中进行扩增。将neuro-2a细胞接种于10cm皿,待细胞长至70%-90%密度后加入病毒母液,吸附2h后换新鲜培养基。观察细胞病变程度,当病毒感染形成的合胞体达75%(一般16-24小时)后,采用反复冻融法收获病毒。1000rpm离心去除细胞碎片,将病毒分装后于-80℃冻存。
3.噬斑法测定病毒滴度
噬斑实验(plaqueassay)又称空斑实验,是病毒学实验中用于测定病毒效价的一种常用手段。其原理简单,结果可靠,测定的是能感染细胞达到增值的活病毒粒子量。如果细胞的培养环境为液体环境,释放到环境中病毒可以自由流动到各个部位侵染其他细胞。如果将细胞的培养环境换成固体或者半固体培养基,释放到环境中的病毒不能自由流动扩散,只能继续停留在原始位置,侵染原本宿主附近的其他细胞。如此病毒经过几轮复制,就会将原始侵染宿主附近的细胞全都侵染继而令细胞死亡,形成了一个没有细胞的“空斑”。此时利用染色试剂(如结晶紫或中性红)进行染色,细胞被染色,空斑处无法染色,于是便可以数出原本侵染这些细胞的病毒一共有多少个。计算出来的结果称为空斑形成单位(plaqueformingunit,pfu),每单位能形成多少空斑,可以视为活病毒的数量。
在实际操作中,首先需要对待测病毒液进行连续10倍的稀释,然后将稀释液按顺序加入可以形成空斑的单层细胞中,吸附1-2h。吸附结束后,用固体或半固体培养基覆盖细胞,于37℃培养箱培养,形成肉眼可见的空斑后进行染色,随后记录空斑个数,再根据稀释倍数和加样体积来计算原液中的病毒数目。在本实验中,mhv的滴度用l2细胞检测。采用1.9%的琼脂培养基限制病毒游离,用中性红溶液对细胞进行染色以计算空斑。具体步骤如下(以mhv-a59为例):
a.细胞铺板:将l2细胞接种至六孔板中,一个样品预备六个孔。培养细胞至密度达到90%以上,注意培养时间不要超过两天,以免细胞老化。
b.稀释病毒液:准备6个1.5ml离心管,每个离心管中加入900μl无血清培养基dmem,编号1-6,以视为稀释滴度10-1至10-6。将原始浓度病毒液充分混匀后,依次吸取100μl梯度稀释,充分震荡混匀。如此反复,将混匀后的病毒液加入至编号下一个的离心管中。直至稀释至最后一个滴度。充分混匀备用。
c.病毒吸附:将培养至密度90%以上的细胞取出,吸弃旧培养基。将稀释好的病毒液加入六孔板中。将细胞放置于培养箱中吸附1-2h。
d.准备固体培养基:将琼脂加热融化,放置到55℃水浴锅中冷却平衡。准备2xdmem培养基,加入10%胎牛血清制备成含血清的2xdmem培养基。将2xdmem培养基分装至离心管中,温热备用。
e.加入固体培养基:吸附结束后,吸去上清液。用预先温热好的pbs或者无血清dmem润洗一遍细胞。将琼脂加入预热好的2xdmem培养基中,快速混匀,加入到六孔板中。
f.培养:待培养基凝固,放置到培养箱中继续培养。
g.染色观察计数:培养至形成肉眼可见的空斑后进行染色。用无血清dmem为溶剂,将0.7%的中性红保存液配制成含6%中性红保存液的染色液,加入孔中。继续培养6-8h后,将固体培养基挖出,对空斑进行计数,根据计数结果计算病毒效价。
4.实时定量pcr检测病毒滴度
在本发明中,我们除了通过空斑的方法以外,还会通过测定病毒基因组的量来检测病毒的复制水平。因为病毒的基因组是rna,较为难以测定,因此要先将病毒的基因组反转录成cdna再进行测定。
1)细胞内rna提取:
a.向细胞中加入适量trizol(6孔板对应1ml),用枪头反复吹打使细胞裂解充分。将冻存于-80℃的细胞液在室温下放置5-10min,恢复至室温。
b.向裂解液加入0.2倍体积的氯仿(相对于初始trizol体积),剧烈震荡15sec,12,000rpm,4℃离心15min。
c.转移上层水相(约初始trizol体积的60%)到新的ep管中,加入0.5倍体积的异丙醇混匀,室温下放置5-10min沉淀rna。沉淀结束后12,000rpm,4℃离心10min。
d.除去上清,加入适量75%乙醇,轻柔重悬rna沉淀以去除蛋白杂质。12,000rpm,4℃离心10min。
e.弃掉上清,室温下放置数分钟直至rna沉淀干燥。加入适当体积(50-100μl)的无rnaseh2o溶解rna沉淀,必要时用移液器小心吹打帮助rna溶解。
f.取1μlrna样品,用分光光度计测量rna浓度并稀释到100-300ng/μl,用于逆转录反应。剩余rna样品冻存于-80℃。
2)逆转录:
本实验中使用的试剂盒为invtrogen公司生产提供。以下为逆转录实验步骤:
a.将2μgrna、1μgoligodt混合,加decp水至12μl,65℃孵育5min。
b.将样品取出放于冰上静置2-3min。
c.向样品加入如下组分:
轻柔混匀后,于42℃孵育1小时。
3)荧光定量pcr
a.引物设计:本发明中涉及到的引物为编码mhvn蛋白的模板。
b.荧光定量pcr体系(20μl):
pcr程序设定:
95℃10min
95℃15sec
60℃30sec
从2开始重复循环40次
每个样品设置三个完全相同的平行组。
5.细胞毒性检测(cck8试剂盒)
cellcountingkit-8(简称cck-8)是一种实验室常用于检测分析细胞增殖情况,以及以此分析药物毒性的试剂。它操作简便,结果可靠,被广泛应用于各种癌症或药物及其他各类相关研究。其试剂中含有wst-8,即2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2h-四唑单钠盐。这种化合物在电子载体1-methoxypms(即1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯)存在的情况下,可以被细胞中的脱氢酶还原,形成黄色甲瓒产物(formazandye)。这种产物可溶于水,呈黄色,生成的量和活细胞的数量呈正比关系。因此利用这种试剂可以用来检测活细胞的数量。具体检测方法如下:
a.细胞接种:将细胞接种到96孔板当中,每个药物浓度至少需要3-4个重复孔。细胞放于培养箱中培养,待细胞生长到80%左右进行实验。
b.药物孵育:每孔加入对应需要检测的药物,加入后摇晃混匀。随后细胞放置于培养箱中继续孵育。孵育时间根据实验需要更改,检测药物毒性一般为24小时以上。
c.cck8试剂检测:将细胞取出,每孔加入10μlcck8试剂,摇晃混匀,细胞放置于培养箱中孵育。半小时后取出观察培养基是否已经变黄。如果培养基变黄可以立即检测,否则继续放于37℃孵育,直到细胞培养液变黄。培养液变黄后,测定在450nm下的吸光度。其数值越大代表细胞活性越好。
【实施例1】检测筛选得到的4种小分子药物对mhv复制的影响以及其细胞毒性(以mhv-a59为例)
1.检测初筛得到的4种小分子药物对mhv病毒复制的影响
将neuro-2a细胞铺至12孔板,待长至80%进行实验。本测试在bsl-2实验室环境内完成。以moi=0.1加入病毒。以4种药物(w-77,w-24,w-13,olx)的溶剂dmso(浓度为0.1%)作为对照,加入mhv病毒的同时加入相应浓度药物(w-77:3μm,w-24:3μm,w-13:20μm,olx:0.5μm)。病毒吸附结束后更换新鲜培养基,同时继续加入对应浓度的药物,直至收样。病毒感染16h后收细胞上清,用噬斑实验测试病毒滴度。从结果可以看出,药物w-13在20μm浓度下能够抑制mhv在宿主细胞中的复制,而olx在0.5μm的浓度下对mhv的抑制效果更好(图1a)。
2.检测药物w-13和olx的细胞毒性
鉴于药物w-13和olx在不同浓度下具有抗病毒作用,我们检测了它们各自发挥抗病毒效果的浓度范围下的细胞毒性。以0.1%dmso为对照,向neuro-2a细胞中加入相应浓度药物,孵育48h后用cck8试剂盒检测细胞活性。加入cck8试剂孵育1h后,检测细胞液在450nm处的吸光度,数值越大代表细胞活性越好。由图可见,药物w-13在其发挥抗病毒作用的浓度范围内(20μm)具有非常强的细胞毒性。而当olx的浓度在0.5μm以下时,基本检测不到细胞毒性,而这个范围内olx可以发挥高效的抗病毒作用,说明olx不仅具有显著的抗冠状病毒功效,其安全性也非常高(图1b)。因此我们选取olx作为后面的研究对象。
【实施例2】检测olx在不同阶段对mhv复制的抑制效果(以mhv-a59为例)
1.olx抗mhv病毒的ec50测定
为了明确olx抑制冠状病毒mhv复制的有效浓度范围,我们测定了olx抑制mhv病毒的ec50值。以moi=0.1感染neuro-2a细胞。以0.1%dmso为对照,在加入mhv病毒同时加入梯度浓度olx,吸附结束后换新鲜培养基,同时继续加入同样浓度药物孵育细胞,直至收样。感染后16h收上清,用噬斑法检测上清中的病毒滴度。结果表明,olx抑制mhv的ec50为11.4nm,在纳摩尔级别的药物浓度下具有非常好的抗冠状病毒效果,且抗病毒效果呈现剂量依赖性(图2a)。
2.检测病毒感染后olx对mhv复制的抑制效果
由于在病毒感染的实际治疗中,往往需要先确诊病毒感染再对症使用药物,因此我们检测了mhv感染后再使用olx是否还能发挥抗病毒作用。以moi=0.1将mhv病毒液加入neuro-2a细胞,此时不加入药物。吸附结束后弃掉病毒液,pbs清洗细胞,换新鲜培养基。以加入病毒的时间作为感染起点,分别在病毒感染后的4、8、12小时加入浓度为0.1μm的olx。药物孵育16小时后收上清,用噬斑法检测病毒滴度。同时细胞加trizol裂解,提取细胞总rna,经反转录后用q-pcr的方法检测mhvmrna7的相对表达量。结果说明,在mrna7水平上,病毒感染4h后加入olx的抑制效果不显著,但感染8h后,olx的抗病毒效果非常明显,相比对照组mhv复制水平降低了1倍(图2b)。在活病毒水平上,感染后4、8、12h加入olx,都呈现出非常好的抗病毒效果,相比对照组olx抑制mhv复制达3倍以上(图2c)。以上结果说明药物olx在病毒感染后用药仍然可以发挥作用。
【实施例3】对于olx抗冠状病毒作用机制的初步研究(以mhv-a59为例)
为了探究olx抗冠状病毒的具体作用于病毒复制的哪一阶段,我们进行了药物作用时间节点分析。取moi=0.1感染neuro-2a细胞,在mhv病毒感染前后的不同时间点加入浓度为0.1μm的olx,孵育不同的时间段,其中,(-2to0):提前两小时加药,感染病毒的同时也加了药;(-2toattach):提前两小时加药,感染病毒前去掉药物,再感染病毒,病毒感染的同时没有加药;(0to1):病毒感染完成后,再加药,药物作用1小时,去掉药物;(0to8):病毒感染完成后,再加药,药物作用8小时,去掉药物;(2to8):病毒感染完成2小时之后再加药,药物作用6小时,去掉药物;(4to8):病毒感染完成4小时之后再加药,药物作用4小时,去掉药物。收细胞上清,随后用噬斑法检测样品中的病毒滴度。结果表明,若在感染前加药,吸附过程中存在olx(-2to0h)的抑制效果是吸附过程中不存在olx(-2toattach)抑制效果的2.5倍。另外,若在感染后加药,0to1h和4to8h加药的效果最差,而0to8h和2to8h加药的抑制效果相似(图3)。mhv在neuro-2a细胞中完成一轮复制并释放的时间在2-4小时之间,因此olx存在于0to8h或2to8h正好可以抑制释放至细胞外的病毒第二轮感染,这可以解释为什么在上述时间加入olx具有较好的抑制效果。而在0to1h或4to8h之间,第一轮或第二轮病毒大部分已完成了进入,药物无法起到抑制其进入的功能。因此olx作用于病毒的进入阶段,olx的抗冠状病毒作用跟抑制病毒的进入相关。
【实施例4】检测olx对sars-like冠状病毒wiv1的抑制作用
sars-like冠状病毒是一种从蝙蝠身上分离出来的冠状病毒,和sars-cov十分相似,具有感染人的能力,可以引起人较为轻微的呼吸系统的病症。本测试在p3实验室环境内完成。在sars-like冠状病毒吸附vero细胞的同时加入浓度为0.5μm的olx。吸附2h后,弃掉病毒液,pbs清洗细胞,更换新鲜培养基,同时继续加入同样浓度的olx孵育。吸附结束后24小时收细胞上清,噬斑法检测sars-like病毒滴度。从结果来看,olx能够有效抑制sars-like冠状病毒的复制,抑制效果能达到95%(图4)。
【实施例5】检测olx对mers-cov冠状病毒的抑制作用
mers-cov是高致病性冠状病毒。本测试在p3实验室环境内完成。mers-cov以moi=0.1感染caco2细胞,在病毒吸附的同时加入浓度为0.5μm的olx。吸附2h后,弃掉病毒液,pbs清洗细胞,更换新鲜培养基,同时继续加入同样浓度的olx孵育。吸附结束后24小时,分别收细胞上清和细胞反复冻融液,噬斑法检测mers-cov病毒滴度。图为噬斑实验检测结果。从结果来看,olx能够抑制mers-cov复制,抑制效果达到94%(图5)。
【实施例6】检测olx对2019-ncovwiv04的抑制作用及其ec50测定。
2019-ncovwiv04为从icu病人样本中分离得到的毒株(国家病毒资源库,保藏编号:ivcas6.7512)[4]。本测试在bsl-3实验室环境内完成。2019-ncovwiv04病毒以moi=0.01感染veroe6细胞,加入病毒的同时加入不同浓度olx,吸附结束后换新鲜培养基,同时继续加入同样浓度药物孵育细胞,直至收样。同时以0.1%dmso作为对照。孵育结束后提取细胞rna,用rt-qpcr的方法检测病毒复制水平。检测靶向s基因,引物如下(来源于参考文献4):
rbd-qf1:5’-caatggtttaacaggcacagg-3’;
rbd-qr1:5’-ctcaagtgtctgtggatcacg-3。
结果显示olx抑制2019-ncovwiv04的ec50为398nm(图6)。
【实施例7】检测olx在c57bl/6小鼠水平对mhv-a59的抑制作用以及olx对mhv感染c57bl/6小鼠的保护作用
本测试在abslii实验室完成。购买spf级3周龄雄性c57bl/6小鼠,按如下实验方案分组:
肝内注射106pfumhv,同时以尾静脉注射的方法在感染第0天和第2天注射相应药量(如上表),每组给药量分别为0.01μg/g、0.05μg/g。
给药后,对其中一半小鼠(n=5)进行生存状态观察并记录,同时记录体重变化。从图中可知,两组注射药物的小鼠的体重降低值比无药物对照组小鼠的体重降低值小(图7a)。从每组的小鼠生存率来看,0.01μg/golx组的小鼠总体生存率高于无olx组的小鼠,但低于0.05μg/golx组的小鼠。0.05μg/golx组的小鼠全部存活,该剂量可完全保护小鼠免受mhv-a59感染致死(图7b)。剩余小鼠在感染3天后解剖,取肝脏,称重,研磨匀浆后离心,取上清检测组织中病毒滴度。结果表明,0.01μg/g、0.05μg/g的剂量均可有效降低mhv-a59在小鼠肝脏中的复制,随着剂量增加,病毒抑制效果更好(图7c)。
参考文献:
1.wang,y.,etal.,coronavirusnsp10/nsp16methyltransferasecanbetargetedbynsp10-derivedpeptideinvitroandinvivotoreducereplicationandpathogenesis.jvirol,2015.89(16):p.8416-27.
2.ge,x.y.,etal.,isolationandcharacterizationofabatsars-likecoronavirusthatusestheace2receptor.nature,2013.503(7477):p.535-8.
3.ommeh,s.,etal.,geneticevidenceofmiddleeastrespiratorysyndromecoronavirus(mers-cov)andwidespreadseroprevalenceamongcamelsinkenya.virolsin,2018.33(6):p.484-492.
4.zhou,p.,etal.,discoveryofanovelcoronavirusassociatedwiththerecentpneumoniaoutbreakinhumansanditspotentialbatorigin.biorxiv,2020:p.2020.01.22.914952.
序列表
<110>武汉大学
<120>奥巴托克在制备广谱抗冠状病毒药物中的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
caatggtttaacaggcacagg21
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctcaagtgtctgtggatcacg21
- 还没有人留言评论。精彩留言会获得点赞!