具有用于食管的热保护的二氧化碳递送系统的经食管导管的制作方法
相关申请的交叉引用
本专利申请为2018年9月11日提交的美国专利申请16/127,461的部分继续申请,该美国专利申请要求2018年2月15日提交的美国临时申请62/631359的权益。
背景技术:
1.技术领域
本发明涉及用于预防食管损伤和瘘形成的系统、方法和装置,并且更具体地涉及用于预防在左心房的心脏内导管消融之后的食管损伤和瘘形成的系统、方法和装置。
2.相关领域的讨论
心律失常和心房纤颤一直是常见且危险的医学疾病,在老年人中尤为如此。对于具有正常窦性节律的患者,由心房、心室和兴奋传导组织构成的心脏在电刺激的作用下以同步、模式化方式搏动。对于具有心律失常的患者,心脏组织的异常区域不会像具有正常窦性节律的患者那样遵循与正常传导组织相关联的同步搏动周期。相反,心脏组织的异常区域不正常地向邻近组织传导,从而将心动周期打乱为非同步心律。之前已知这种异常传导发生于心脏的各个区域处,例如窦房(sa)结区域中、沿房室(av)结和希氏束的传导通路或形成心室和心房心腔的壁的心肌组织中。
心房纤颤影响数百万美国人。具有心房纤颤的患者患有中风、心脏病发作、腿损失和其他不良事件的风险显著性增加。心脏内导管消融已成为用于治疗心房纤颤的主要疗法。通过创建左心房中的瘢痕组织的全厚度线,分离保持心房纤颤所必需的电活动的混沌波形,并且患者的心律转换成常规组织的心律。瘢痕组织的线必须是全厚度,即必须从心脏的内衬心内膜延伸一直穿过心房壁的整个厚度至外衬心外膜。如果瘢痕组织仅为部分厚度,则电波仍可围绕瘢痕传播。
biosensewebster是在治疗心房纤颤领域中的全球领导者。biosensewebster
当创建左心房瘢痕的已被标识为最有效于转换心房纤颤的模式时,有必要创建横跨左心房的后壁延伸的线。在创建该线期间,食管可能形成瘢痕。这特别具有挑战性,因为在规程期间通常没有证据表明食管已受伤。经典的演示是在“成功”消融之后两周恢复并患有未知来源的低热或小中风的患者。在进一步探索后,显示出该患者发展了心内膜炎(心脏和心脏内膜的感染),其由食管内容物排入心脏中而引起,或者患者患有中风,其由从穿入左心房中的食管腔产生的小气泡引起。无论演示如何,心房食管瘘或异常通道的发展是潜在的严重并发症。如果要避免危机,患者通常必须经过大胸部操作。
用于将心房纤颤转换成正常组织节律的导管消融需要在整个左心房中以规定模式成功创建瘢痕组织的全厚度线。该线之一必然穿过后壁,其中左心房和食管非常接近。在相当大百分比的病例中,食管在此灼烧形成期间无意中受伤,该灼烧有时(0.5百分比至1.5百分比)导致延迟形成(大约两周后)左心房至食管瘘。如果灼烧不涉及左心房壁的全厚度,则治疗不太可能成功。电流仍可通过活心肌的部分厚度行进,并且心房纤颤持续存在。由于对这种并发症的认识有所增加,电生理学家在他们穿过后壁时不太积极地消融组织,并且因此较少患者受益于成功转换成常规节律。电生理学家一致认为需要一种解决方案来允许积极治疗左心房而没有该潜在并发症的风险。
其他人提出了解决方案。这两种主要类型为:1)利用成形球囊、杆或镍钛诺结构试图使食管远离左心房的后壁的装置,因此电生理学家可更积极地创建后灼烧;或者2)向下经过食管的测量温度、阻抗或其它量度的装置,以在消融期间通知电生理学家何时灼烧安全和何时不安全或者何时加热食管,因此电生理学家可以立即停止。
第一种类型的挑战包括需要电生理学家操纵他们通常不太熟悉的食管,以及移动食管的挑战。两个结构食管和左心房在气密空间中彼此直接相邻。当拉动食管远离左心房时,心房在一定程度上与食管一起拉动。此外,存在当试图通过将牵引从其内腔施加至食管来拉动食管时的食管损伤的报道。这些损伤包括偶尔的食管血肿,这可能需要外科治疗。
使用食管温度监测的挑战以其反应性质为中心。此监测仅允许电生理学家确定食管腔的温度增加,这表明已发生对食管壁的热侵害。虽然这种测量允许电生理学家立即停止灼烧并且在这样做时限制热暴露的程度,但该测量不能预防此类损伤发生。
因此,需要一种用于预防在左心房的心脏内导管消融期间的食管瘘形成的可靠系统、方法和装置。
技术实现要素:
本发明涉及系统、方法和装置,其中有足够体积的二氧化碳气体被注入位于食管与左心房的后壁之间的结缔组织层,以创建将预防食管热损伤同时有意地在左心房中创建全厚度灼烧的绝缘保护层。本发明克服了与如上简要描述的现有技术相关联的许多限制。
根据一个方面,本发明涉及用于将二氧化碳递送到食管与心脏之间的纤维脂肪组织以用于预防在左心房的心脏内消融期间的食管损伤和/或瘘的基于导管的系统。该系统包括:经食管导管,该经食管导管被构造用于穿过患者的食管引入,该经食管导管包括针递送装置和相关联的针以及锚固机构;气体供应部,该气体供应部被构造成将气体穿过经食管导管递送到针,该气体供应部被连接在经食管导管的近侧端部处;以及反馈控制系统,该反馈控制系统被构造成调节压力和气体从气体供应部到针的流速。
与这些其它方法不同,二氧化碳吹注在食管周围创建绝缘套管,实际上分开了食管与后左心房壁。参考文献“anatomicrelationsbetweentheesophagusandleftatriumandrelevanceforablationofatrialfibrillation”,circulation2005;112:1400–1405描述了关于插置在食管与左心房之间的纤维脂肪组织的量和厚度的异质性。在将近一半解剖的尸体中,厚度小于5mm。当将二氧化碳注入该纤维脂肪层时,组织充气,并且变成“肺气肿”,该术语描述输注有气体的固体组织。来自非医学世界的最佳类似示例是来自食品,诸如棉花糖或草棉糖。每个示例由小体积的糖制成,该糖的体积通过注入室内或环境空气而增加。糖具有1.6g/cm3的密度并且草棉糖具有约0.4g/cm3的密度。体积通过用空气浸润而增加四倍(4)。类似地,棉花糖具有0.005g/cm3的密度。它超过百分之九十九(99)的空气。棉花糖看起来像房屋建筑商在建筑高能效住宅时使用的绝缘也不是巧合。捕获的气体,即,通过轻风或移动不能自由吹走的气体是优良的绝缘体。这解释了为什么
根据本发明,分开后左心房壁与食管的3mm至6mm纤维脂肪组织层将被转换成更厚的气体输注组织层,该气体输注组织层将围绕食管并且提供足够的热绝缘,从而预防其受伤。利用二氧化碳代替空气以利用二氧化碳水溶解度。这对二氧化碳充当绝缘体的能力没有影响,因为它在这方面将像空气一样起作用,但如果二氧化碳直接注入左心房中,就不会有不利的后遗症。二氧化碳是如此可溶的,使得在加压时其容易溶解。这使得几乎不可能产生二氧化碳气体栓塞,从而使得在左心房内部以小于3ml/kg的剂量使用是安全的。重要的是要注意,耐受已引入到颅内循环系统中的小于3ml/kg的剂量的二氧化碳而不具有神经毒性,但在颅内系统中确实存在导致栓塞性中风的可能(https://www.ncbi.nlm.nih.gov/pmc/articles/pmc4603680/)。因为正在注入气体,待利用的针可能足够小,例如约27号针,使得基本上不存在对左心房或食管的潜在损伤的风险。
附图说明
从以下如附图所示的本发明优选实施方案的更具体的描述,本发明的上述及其它特征和优点将显而易见。
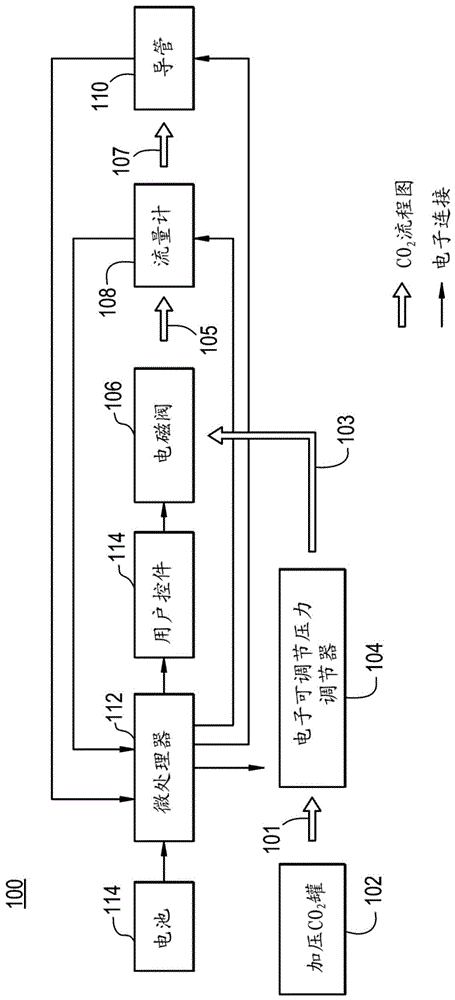
图1为根据本发明的用于预防在心脏内消融期间的食管损伤和/或瘘的示例性系统的框图表示。
图2为根据本发明的示例性导管系统的近侧部分的图解示意图。
图3为根据本发明的注射导管的示例性tuohyborst阀部分的图解示意图。
图4a至图4d为根据本发明的第一示例性导管系统的远侧部分的图解示意图。
图5为根据本发明的第二示例性导管系统的远端部分的图解示意图。
图6为根据本发明的用于解剖结构的不同区域的流速对比针穿透深度的图形表示。
图7为根据本发明的用于解剖结构的不同区域的电压对比针穿透深度的图形表示。
图8a为根据本发明的具有未膨胀球囊和未部署针的第一示例性经食管导管的图解示意图。
图8b为根据本发明的具有已膨胀球囊和已部署针的第一示例性经食管导管的图解示意图。
图9a为根据本发明的具有未膨胀球囊和已部署针的第二示例性经食管导管的图解示意图。
图9b为根据本发明的第二示例性经食管导管的针偏置部件的详细剖视图的图解示意图。
图9c为根据本发明的经食管导管的针的第一视图的图解示意图。
图9d为根据本发明的经食管导管的针的第二视图的图解示意图。
图10为根据本发明的指示器轮的图解示意图。
图11为根据本发明的吹注过程的流程图。
图12为根据本发明的经食管导管的滑块机构的图解示意图。
具体实施方式
本发明涉及用于预防在左心房的心脏内消融期间由于无意的热消散而引起的食管瘘或食管组织损伤形成或使其最小化的系统、方法和装置。在本发明中,二氧化碳被注射或输注到分开后左心房壁与食管的纤维脂肪组织中,以扩张组织并在此之间形成绝缘层。在二氧化碳输注的组织绝缘层就位时,导管消融可以用于在损伤食管并形成食管瘘的风险最小的情况下创建全厚度瘢痕组织。下文所给出的实验说明展示了本发明概念的可行性和功效。
进行八只动物研究,以展示可通过从股静脉插入右心房并通过右心房壁插入到心包膜的导管来安全注射二氧化碳以有利于获得心包接入。研究展示二氧化碳可以安全地注入到生物组织中。研究还展示二氧化碳相对于空气提供了许多优点,包括高溶解度、低粘度、射线半透明度以及优异的热和电绝缘性质。更具体地,二氧化碳比氮气更可溶五十四倍,并且比氧气更可溶二十八倍,通常在小于两小时内再吸收,并且由于其在水中的溶解度极不可能导致气体栓塞,即使在大量的情况下也如此。二氧化碳具有低粘度,从而允许其通过小至33号针的针。在移除之后来自此尺寸针的穿孔几乎立即密封,甚至在系统肝素存在下也如此,从而减少并发症的可能性。二氧化碳在x射线荧光镜透视检查下也是可见的,从而允许通过在x射线荧光镜透视检查下创建食管的轮廓来可见确认成功吹注。最后,二氧化碳是良好的电和热绝缘体,这正是在心脏内导管消融期间保护食管所需要的。
在八只动物研究之后进行两次单独的急性动物实验。在每个实验中,通过左胸廓切开术露出猪的食管。因为食管不会在猪的左心房后面延伸,所以可以直接观察作为二氧化碳注入可行性的指标的食管旁组织以形成保护性阻隔层。二氧化碳源连接到管塞,该管塞允许60-cc注射器连接到待纯二氧化碳填充的27号针。将二氧化碳注入食管周围的软组织中。二氧化碳立即分开通过食管周围的软组织并通过创建气肿(二氧化碳输注组织)增加纤维脂肪层的厚度。二氧化碳输注通过一直在食管周长周围的组织,并且直到食管暴露后向头部和尾部追踪。通过切割通过其中来展示阻隔层的厚度。气体输注组织的厚度在x射线上可见,呈现为在食管周围的透明光晕。还可理解食管由于二氧化碳气肿的周边性质而远离脊柱移动。基本上,二氧化碳气肿将食管与所有其它解剖结构分离。
在完成猪研究后,进行了两次人类尸体研究,以展示通过创建气肿在食管周围形成绝缘层的可行性。在这两次尸体中,通过注射120cc(两个完整的60cc注射器)二氧化碳通过左心房的后壁来进行简单的探索。这也在直视下完成,因为在每具尸体中的心脏已被解剖。此项研究是尝试证明通过创建气肿或间距形成绝缘层的概念的可行性。在切割通过后左心房壁之后,观察到在左心房与食管之间形成肺气肿组织,如在利用二氧化碳的动物研究中所形成。
然后用附加的步骤重复该动物实验。利用食管温度探针监测组织温度,同时有意地使用消融导管在食管的外表面上形成病灶。在使用二氧化碳吹注和未使用二氧化碳吹注的情况下执行食管壁的消融,以了解二氧化碳对热能的传导的影响。
在这些评估中,食管通过大的左胸廓切开术暴露。将多极温度探针通过猪的口腔放置并在x射线指导下向下放置到食管。将该消融导管直接应用于食管的外表面并且消融电极通过x射线与温度传感器的十二(12)个磁极中的一个对准。然后使消融导管通电。所测量的温度几乎立即开始上升,从36.6℃的基线温度,在小于五(5)秒内达到临界的0.2℃增加。在连续能量应用的情况下,在三十(30)秒之后温度上升至40℃。然后在相同条件下重复实验,其中唯一的区别在于将二氧化碳吹注添加到方案中,如随后更详细地解释。
在消融期间输注二氧化碳以测试食管的热绝缘之前,执行二氧化碳在注射到食管周空间之后保持就位多长时间的探索。在将120cc二氧化碳注入到食管周纤维脂肪组织中之后,该组织将立即用二氧化碳充气,从而变得相当厚。然而,在大约五(5)分钟之后,组织将逐渐恢复到基线几何结构。根据该简单测试,可以合理地推断,当在消融规程期间需要时,用二氧化碳连续吹注将是优选的以确保绝缘层保持就位。
基于此观察,将附接至长静脉内延伸管的27号针直接附接至加压二氧化碳的小罐的调节器。当针被插入到食管周围的纤维脂肪组织时,它立即充气,如先前已观察到的。但是,在二氧化碳的供应停止之前,该腔保持充气。使用调节器手动地随意滴定二氧化碳递送的速率至尽可能低。
当使用消融导管和温度探针(根据x射线再次将该电极与温度传感器对准)并在相同功率设置下执行消融灼烧来重复该实验时,该温度读数显著不同于在二氧化碳输注之前观察到的温度读数。在持续灼烧三十(30)秒之后,温度仅上升0.1℃,从36.6℃至36.7℃,相比之下当不存在二氧化碳时观察到3.4℃;即,36.6℃至40.0℃。因此,注入到食管周围的脂肪组织中的二氧化碳在此类规程期间为食管提供了热绝缘。
在仅120cc二氧化碳注射或输注之后,食管周组织的解剖显示出周向包围食管的8mm肺气肿组织护套或层。向该组织输注气体并且不良地传导射频能量和热量。此8mm层应推动后左心房壁和食管彼此远离,从而允许跨越后左心房壁形成积极灼烧而不必担心食管损伤。
用于执行此规程的系统应优选地对于电生理学家而言使用简单并且不妨碍底层心脏内导管消融规程。系统应优选地在消融期间保持就位,并且不会对左心房、食管或任何生物组织造成损伤。该系统还可通过利用反馈控制器对抗全身性二氧化碳吸收的影响以根据需要递送附加的二氧化碳,从而保持需要的组织分开。该系统可包括温度探针。最初,医生可将温度探针放置在食管中以确保二氧化碳输注的组织确实形成隔热层。一旦存在足够的证据证明食管为热绝缘的,则可能不需要温度探针。该系统也可以仅在心脏内导管消融规程开始时利用一次,以达到在食管与左心房之间期望的分离并且然后随后被移除以允许进行消融规程的其余部分,条件是二氧化碳吸收的影响是可忽略的。
根据本发明的系统优选地包括可逆地部署的针,该针从导管的端部推进短距离并锁定在该位置,但与允许在标测装置诸如
更具体地,用于施用二氧化碳通过左心房壁的作为上述系统的一部分的注射导管优选地具有某些属性。注射导管应通过标准8.5法国经中隔护套装配,并且具有集成的停止旋塞和注射器以允许抽吸和递送无菌二氧化碳。在另选的示例性实施方案中,注射导管可以包括减少设置时间并使得更容易利用的整合的无菌二氧化碳罐。注射导管应优选地具有正确的处理特性和柱强度,以允许针在期望的点处精确地推进。在一个示例性实施方案中,针组件应优选地包括仅延伸到心外膜以确保准确的二氧化碳递送的27号针。在另选的示例性实施方案中,27号针可延伸超过心外膜。
在另选的示例性实施方案中,可以利用具有球囊和可部署针的导管放置,该针通过咽并进入食管中以允许通过食管壁将二氧化碳注入这些相同的纤维脂肪组织中,换言之从食管腔“向外”。在此另选的示例性实施方案中,导管将类似于上述导管。
现在参见图1,其中示出了根据本发明的用于预防在心脏内导管消融期间的食管损伤和/或瘘的系统100的示例性实施方案。系统100被构造成通过微创导管经中隔递送二氧化碳,以在左心房的后壁与食管之间形成气袋。该袋用于热分离并在消融期间分开食管与左心房,以预防食管损伤或心房食管瘘的形成。重要的是,应注意,系统100可利用离散部件的组合作为一体的、集成的系统和/或它们的组合来实现。
系统100被构造为闭环反馈控制系统并且为了便于解释以框图格式示出。纯化用于生物应用中的二氧化碳从加压罐102中供应并通过管道101传送至压力调节器104。如上文所列出,可利用特殊连接器来预防利用除二氧化碳之外的气体供应。虽然示出为单个离散的二氧化碳罐,但气体可从任何合适的来源(例如,中心供应部)供应。此外,压力调节器104可直接连接到加压罐102。压力调节器104是电子可调节的,并且用于设置并保持二氧化碳被递送的压力。压力调节器104的操作与在scuba罐或家用压缩机上的压力调节器相同。压力调节器简单地将待释放的气体压力保持在设定值下以用于下游用途。压力调节器104通过管道103连接到电磁控制阀106。电磁控制阀106用来控制来自罐102或其它供应部的二氧化碳的流速。电磁控制阀106经由管道105连接到流量计108。流量计108测量排出电磁控制阀106的二氧化碳的流速,以确保其处于用于该规程中的期望的流速。流量计108通过管道107连接到注射110。注射导管110包括随后更详细描述的针组件,其用于将二氧化碳精确地递送到如本文所述的主体内的期望位置。管道101、103、105和107可包括不与二氧化碳反应的任何合适的材料,例如金属材料,诸如不锈钢,以及聚合物材料,诸如聚硅氧烷。
系统100还包括微处理器或微控制器112。微处理器或微控制器112由功率源114供电。功率源114可包括电池(一次电池或二次电池)和/或用于将从另一来源(例如厂用电)供应的功率转换为适用于系统100的微处理器112和其它部件的电压和电流水平的电路。微处理器112被编程用于基于来自每个以及预先编程的控制参数的反馈信号将控制信号输出至流量计108和导管110。微处理器112还将控制信号输出至压力调节器104,以根据需要调节气体的压力,并输出至用户控件114。用户控件114被构造成允许系统100的用户(例如医师或电生理学家)经由其与电磁控制阀106的连接来设置操作参数,并且作为控制回路的前馈路径的一部分来操作。通过其反馈控制过程,微处理器112根据用户的设置自动调节并且保持系统100的操作。微处理器112可包括任何合适的处理器和相关软件和存储器以实现系统100的操作。
重要的是需注意,所有电子器件和电连接都以适用于在操作或规程手术室中使用的方式进行保护。这些预防措施是必要的,以预防氧气源与电火花之间的任何相互作用。此外,所有部件优选地被制造用于医疗级使用。
现在参见图2,示出根据本发明的可用于干预规程的示例性导管的近侧区域的图解示意图。示例性导管包括具有近侧端部和远侧端部的细长主体。示例性导管200包括经由海波管206连接到tuohyborst阀204的tuohyborst阀204的近侧阀端部208处的鲁尔母固定连接器202。图1所示的二氧化碳供应部或加压罐102经由此连接点连接到注射导管200。如上文所列出,可利用独特连接器来预防与不同气体供应部的连接。此外,此连接点202可用于连接用于冲洗该系统的任何合适的装置。tuohyborst阀204还包括y连接210。出于许多目的,y连接210可用来引入流体,该目的包括递送用于荧光镜可视化的造影剂。近侧轴212在一端上经由外轴鲁尔轮毂216连接到tuohyborst阀204的鲁尔连接器214,并且在另一端上连接到远侧轴(未示出)。tuohyborst阀204、鲁尔连接器214和外轴轮毂216被旋转地固定在一起以用作一体结构。通过这种构型,tuohyborst阀204的旋转便于朝导管轴向下传输扭矩至固定线圈,如随后详细描述的,以在规程期间接合固定线圈并将固定线圈推进到心脏壁中。示例性导管200的远侧端部或区域与本文所述的近侧端部或区域相连;然而,由于涉及本发明,为了便于解释,说明书和附图均独立地给出。该基本导管结构可用于任何数量的干预规程,包括引入和使用注射导管以用于递送二氧化碳。随后给出tuohyborst阀和注射导管的近侧部分以及如上所述的本发明的注射导管的针组件或远侧部分的详细描述。
图3为根据本发明的tuohyborst阀300的图解示意图。tuohyborst阀300基本上是根据本发明的注射导管的近侧区域。tuohyborst阀300包括具有螺钉锁304的近侧阀302。近侧阀302是螺纹的,以打开和关闭阀。近侧阀302的螺钉锁304可顺时针旋转以在引入通过其中的任何仪器例如海波管周围形成液密密封,以提供静气和止血密封。tuohyborst阀300还包括螺纹鲁尔连接器306,其将tuohyborst阀300连接到如上文简述且随后更详细描述的导管的图2所示的轴鲁尔轮毂216。
可变形的o形环308定位在近侧阀302内,使得本发明的注射导管的海波管310部分从中穿过。其通过该海波管310并且最终附接至针以将二氧化碳引入到期望的组织中。重新参见图1,海波管310是导管块110的一部分。随着近侧阀302的螺钉锁304被拧紧(对于右旋螺纹而言顺时针地),o形环308被压缩,由此使其内径减小。此作用在注射导管的海波管310上创建压缩摩擦锁,该压缩摩擦锁可用于一旦达到期望的组织深度就将针锁定就位。第二o形环312定位在螺纹鲁尔连接器306内,以形成用于连接到图2所示的轴鲁尔轮毂216的压缩密封件。本发明的海波管310包括止动机构413。止动机构314是安装在海波管310周围的在tuohyborst阀300的o形圈308和312之间的区域中的结构。止动机构314的直径或尺寸足以防止海波管310通过非压缩o形环308、312,以预防针意外地过度部署到目标组织中以及注射导管从如本文更详细描述的经中隔护套无意地过度回缩。海波管310可包括任何合适的生物相容性材料,包括当前用于导管中的任何海波管材料。止动机构314也可包括任何合适的生物相容性材料。在示例性实施方案中,止动机构314包括聚合材料并且利用任何合适装置(包括焊接和粘合剂)粘结到海波管310。
图4a至图4d为根据本发明的示例性注射导管的远侧部分的图解示意图。图4a为注射导管的外部护套400的远侧区域的部分或剖视图。外部护套400包括管状结构402,其中内部护套408被同轴定位。固定线圈404附接至外部护套400的远侧端部。固定线圈404包括螺旋形构型,其充当可逆的锚固系统以确保在二氧化碳吹注期间将注射导管固定就位。固定线圈404附连到管状结构402的远侧端部的外表面,使得其第一部分被密封到管状结构402并且其第二部分延伸穿过管状结构的端部以锚固在心肌中。为了确保固定线圈404和管状结构402作为一体结构移动并操作,固定线圈404通过任何合适的方式永久地粘结到管状结构402。在一个示例性实施方案中,利用uv可固化粘合剂。固定线圈404的尖端包括图4d所示的尖点406,以容易刺穿心脏组织。管状结构402可包括任何合适的刚性生物相容性材料,该材料可通过曲折的脉管系统导航。可利用标准导管材料。固定线圈404可包括合适的刚性生物相容性材料,该生物相容性材料可绞合到心脏组织中并锚固在其中。可利用金属材料(例如不锈钢)或聚合物材料。在示例性实施方案中,固定线圈包括不锈钢。外部护套400的最远侧端部的特征也在于用于荧光镜可视化的不透射线标记或带401。不透射线标记401可由任何合适的材料例如钽形成,并且利用任何合适的装置粘结到外部护套400。不透射线标记401定位在外部护套400的外表面上并且粘结在固定线圈404的内径内。
在操作中并在图4b所示的针410部署之前,将注射导管导航到靠近左心房的位置,使得固定线圈404可被螺纹拧入左心房的心肌中,以便在二氧化碳吹注期间保持导管位置。实质上,固定线圈404通过注射导管的简单扭转运动来将外部护套400可逆地锚固到患者的心脏。如上文所述,由医师扭转或旋转tuohyborst阀204(图2)有利于通过外部护套400传输扭矩。
图4b为内部护套408的远侧区域的部分或剖视图。内部护套408包括可通过左心房的后壁推进到食管旁空间或纤维脂肪组织的针410,以在心脏内导管消融规程期间递送受控剂量的二氧化碳并且然后移除。外部护套400预防针410在将注射导管导航到靶向吹注位点期间接触周围的脉管系统。在完成该规程后,针410可回缩回外部护套400中。针410可包括任何合适的材料并且尺寸可如本文所述地设定,该针经由塑料挤出物412连接到图3所示的海波管310。在示例性实施方案中,针410包括外科用钢,可包括任何其它合适的金属材料,在另选的实施方案中包括镍钛诺和高度不透射线材料。针410与塑料挤出物412的连接以及塑料挤出物412与海波管310的连接可通过任何合适的方式制成,使得可实现二氧化碳的无阻碍流动,同时允许三个部件充当一体结构。在操作中,通过在锚固于心肌中的外部护套400内移动海波管310来推进和回缩针410。针410和塑料挤出物412同轴定位在编织轴的内腔内,从而在定心元件414内部形成内部护套408。针410也可滑动地密封到内部护套408的尖端。定心元件414和密封件416可由任何合适的生物相容性材料制成。
图4c示出具有定位在外部护套400内的内部护套和从其延伸的针410的组装的注射导管远侧部分。图4d示出组装的注射导管远侧部分的部分或剖面图。如本文所述,注射导管被导航通过脉管系统并导航进入接近左心房心肌的位置。注射导管利用固定线圈404锚固到位置。当正确锚固时,针410在近侧端部处经由海波管310推进,直到达到期望的组织深度。然后将二氧化碳注入到纤维脂肪组织中,该纤维脂肪组织经由图1所示的示例性系统使后左心房壁与食管分开,直到完成消融规程。在完成后,通过在相对的方向上扭转外部护套400以用于插入来移除固定线圈404,并且可以移除注射导管。注射导管不会以任何方式妨碍左心房消融规程。此外,重要的是需注意,本发明的注射导管可经由相同的引导器或经中隔护套作为消融导管或完全不同的导管引入。
尽管为了便于解释注射导管的远侧部分和近侧部分以不同的说明示出,但两个部分形成具有内部护套和外部护套的连续结构。
在另选的示例性实施方案中,针可使用固定线圈固定就位。其中在上文所述的示例性实施方案中,针独立于固定线圈通过海波管的纵向运动而移动,在此另选的示例性实施方案中,针相对于线圈保持固定。换句话讲,随着固定线圈被绞合进出心脏组织,针相应地推进或回缩。图5示出此另选的示例性实施方案。如图所示,针502定位在固定线圈504内并且两者均通过如上文所述流体连通的针502附接至外部护套500的端部。
如上文所述,针尖导管或注射导管被推进通过左心房的后壁进入纤维脂肪组织或食管旁空间以在消融规程期间递送受控剂量的二氧化碳,从而扩张组织并创建绝缘层。在优选的实施方案中,二氧化碳的递送在消融期间是连续的而不是通过离散递送以便安全地保持组织扩张。在该规程完成后,针可回缩到导管的外部护套中。为了精确递送二氧化碳,该系统可采用一种或多种方法来确定针的部署深度而无需直接视觉确认。重要的是需注意,视觉确认将是可行的另选方法,但涉及附加的复杂性。
在一种示例性方法中,可监测排出针的二氧化碳的流速以确定流动阻力。左心房空间、心肌组织和纤维脂肪组织全部都具有不同的气体流动电阻率。因此,医师可通过参考组织层流速表征图来简单地确定针尖端驻留在哪个组织层。在另选的实施方案中,微处理器112(图1)可使用身体内的不同组织或介质的流动电阻率编程并且从流量计108接收关于从针排出的流速的反馈,经由待显示的一些合适的信号或指示针已达到适当位置的听觉信号来自动生成警报。可利用流量计来测量针尖端处的流动阻力,并且直接向医师或通过微处理器112而不是流量计108提供反馈。
图6为二氧化碳在不同区域/组织中的相对流速的图形表示。竖直轴表示体积流速,并且水平轴表示以mm计的针穿透深度。在表示心房内空间的第一区域602中,二氧化碳的流速相对于其它区域为高的,如人们所期望的。在表示心脏壁的第二区域604中,二氧化碳的流速显著降低,使得第一区域602给定心脏组织的密度。在表示食管周组织的第三区域606中,二氧化碳的流速由于组织密度较低而高于心脏壁中,但低于心房内空间中的二氧化碳的流速。通过在针前进时测量流速,可确定针位置。
在另一种示例性方法中,可以监测针所定位的组织中的电活动。心肌具有比左心房空间和周围组织明显不同的电活动轮廓。通过用针尖端监测该活动,医师可以确定针已接触并随后通过心肌并进入纤维脂肪组织的点。在此示例性实施方案中,该针可被构造成向独立的感测电路或为微处理器的一部分的电路提供反馈。感测电路可被构造成测量电活动,例如电压/电势和/或电阻/阻抗。如在先前所述的实施方案中,该信息可以通过将会自动做出测定的微处理器112发送或者发送至任何合适的装置以用于改变医师。
图7为电压或电势的竖直轴对比针穿透深度的水平轴的图形表示。如图所示,在对应于心房内空间的第一区域702中,由针感测的电压是稳态且低的。在对应于心脏壁的第二区域704中,电活动不是稳态,并且处于高于第一区域的电势下。在对应于食管周组织的第三区域706中,电活动再次为稳态的并且具有低于心脏壁的心脏组织的电势。
在两个示例性实施方案中,实现针位置的实时监测而不需要直接可视化。
根据如上文所简要列出的另选方法,放置到食管中的另选装置由具有球囊和可部署针的导管组成,并且可用于将二氧化碳注入到食管与心脏之间的纤维脂肪组织内。该装置在下文中将被称为经食管导管,并且其各种部件可经由包括气管内装置或通过鼻胃管的多种方法引入到食管中。在一个示例性实施方案中,装置110(示于图1中)被构造用于将针直接部署在球囊近侧。在第二示例性实施方案中,装置110被构造用于将针部署在球囊远侧,其中针经由驻留在位于装置尖端处的部件中的弯曲通孔而侧向地偏离。在这些实施方案中的每个中,利用球囊而非如上所述的固定线圈来将装置锚固就位。球囊的顺应性性质允许使用者膨胀球囊直到其达到食管的等效内径,从而使装置并不受限于食管解剖结构(食管直径、曲率、纵向变化等)的变化。其他非顺应性球囊材料可用于被精确地设定尺寸以符合患者的食管解剖结构。球囊膨胀和收缩是利用导管领域中已知的技术来实现的。无论构型如何,该装置允许医师通过微创导管递送二氧化碳,以在左心房的后壁与食管之间形成气袋。该袋用于在消融期间使食管与左心房热绝缘并且分离,以预防食管损伤和/或心房食管瘘的形成。在这些实施方案中,导管以不同方式进行构造,但其连接和操作与上述实施方案相同。
根据经食管导管的第一示例性实施方案,该装置包括两个粘结导管;本文中称为针导管和球囊导管。针导管驻留在保护护套内,该保护护套用于防止针导管末端处的针尖在放置期间损伤食管。球囊导管包括具有高扭矩加强编织的柔性导管轴,以有助于将装置放置在食管内的目标吹注位点处。此外,球囊导管中的高扭矩编织为使用者对装置在食管内的旋转定位提供精确控制,从而允许将针精确地对准到食管的侧向表面。球囊导管包括可膨胀球囊,该可膨胀球囊粘结到柔性导管并且具有位于导管的近侧端部处的膨胀侧端口。球囊用于在吹注期间将导管固定就位。此外,球囊可用于偏置注射针以更紧密地侧向接合食管腔。如上文所简要列出,在该实施方案中,针导管的末端方位处的针在膨胀球囊的近侧与食管腔接合。经食管导管还可包括三维位置跟踪装置,以将导管尖端定位在相对于周围解剖结构的空间中以及测量吹注。该装置可优选地与
现在参见图8a和图8b,示出了根据本发明的第一示例性经食管导管800。经食管导管800连接到近侧轴212,参见图2。在图8a中,球囊802附接至球囊导管804并且以其未膨胀状态示出,并且以虚线示出的针806被定位成完全位于针导管808的外部护套内或处于未部署状态。如上文所列出,球囊导管804和针导管808粘结在一起。在另选的实施方案中,可利用具有两个内腔的单个导管。在例示的实施方案中,两个导管804和808经由带810粘结在一起,但可以任何合适的方式进行接合,包括粘合剂。球囊802可包括任何合适的球囊。在更优选的实施方案中,球囊802可包括位于其外表面上的呈肋状物、刺突、棱锥、隆起、绒毛或类似突起形式的一个或多个防滑抓持件812。此外,一个或多个不透射线的标记物或材料814(例如硫酸钡或不透射线的金属标记物)可附接或嵌入在球囊802内,以帮助使用者相对于患者的解剖结构来取向装置,由此对准针806。在规程期间,球囊802将经食管导管800可逆地在食管内固定就位。换句话讲,当球囊802未膨胀时,导管800可被定位并且/或者可在规程之后被移除。然而,当球囊802膨胀时(图8b),导管被固定就位并且不可被移除。针806为25号针,该针能够通过针导管808推进穿过食管的内腔而进入内衬食管空间的纵向表面的纤维脂肪组织,以递送受控剂量的二氧化碳。图8b示出了从导管808部署的针806。针806可在吹注完成之后安全地回缩到导管中。如同其它实施方案,医师被引导以实现适当的针深度和通过本文所公开的装置控制的二氧化碳的流速。
现在参见图9a和图9b,示出了根据本发明的第二示例性经食管导管900。第二示例性导管包括三个同轴嵌套导管;即,外部护套、针导管和球囊导管。外部护套包括具有高扭矩加强编织的柔性导管轴,以有助于将装置放置在食管内的目标吹注位点处。此外,球囊导管中的高扭矩编织为使用者对装置在食管内的旋转定位提供精确控制,从而允许将针精确地对准到食管的侧向表面。球囊导管驻留在外部护套的内腔内,并且包括可膨胀球囊,该可膨胀球囊粘结到柔性导管并且具有位于导管的近侧端部处的膨胀侧端口。球囊用于在吹注期间将导管固定就位。针导管驻留在球囊导管的内腔内,并且用作通路以供二氧化碳气体将在针导管的末端处流过针。如上文所简要列出,在该实施方案中,针导管的末端方位处的针在膨胀球囊的近侧与食管腔接合。经食管导管还可包括三维位置跟踪装置,以将导管尖端定位在相对于周围解剖结构的空间中以及测量吹注。可利用多于一种方式来完成经食管导管的定位或跟踪。例如,在一个实施方案中,可确定导管自身的位置是否改变。另选地,定位在心脏内的二次导管可用于使用两个传感器来测量左心房与食管之间的空间。在任一实施方案中,该装置可优选地与
在图9a中,经食管导管900在其离开外部护套905时构成前述球囊导管的远侧表面。联接部件902用于将球囊导管901连接到针偏置部件904。球囊导管内腔的内部内的针导管903从装置的最近侧端部处的二氧化碳入口延伸并且端接在针偏置部件904内。针偏置部件904用于使针906弯曲或偏置侧向角度,该侧向角度允许适当地进入食管周空间内的纤维脂肪组织中。此外,针偏置部件904用作保护护套,针在未部署状态下驻留在该保护护套中以预防在装置放置期间的食管损伤。针导管903的二氧化碳入口附接至使用者控制的柱塞机构或其他合适的装置(包括海波管310(图3))以推进针,并且当柱塞被使用者按压时,针导管903同样在球囊导管901的内腔内平移,从而将针部署穿过针偏置部件的弯曲通孔。图9b示出了针偏置部件904的详细截面。针偏置部件904包括管道908,针906通过该管道推进到出口910。针偏置部件904可包括任何合适的构型并且优选地为基本上圆柱形的形状。在针偏置部件的构造中使用较润滑的材料将允许较急剧变化的曲率并且因此允许小直径的针偏置部件904。在示例性实施方案中,针偏置部件904包括亦即标准三维打印材料的polyjet,但可包括任何合适的生物相容性和润滑材料,使得针906可容易地从中穿过。球囊912安装到医师近侧的经食管导管900,使得针906的部署相对于球囊912位于远侧,如上文所列出。球囊912也可包括位于其外表面上的呈肋状物、刺突、棱锥、隆起、绒毛或类似突起形式的防滑抓持件914。此外,一个或多个不透射线的标记物或其它不透射线的材料916可附接或嵌入在球囊912内,以帮助使用者在体内取向装置。针906和球囊912与上述示例性实施方案相同。此外,针的部署和回缩是经由本文所述的机构来实现的。
在观察经食管导管900的近侧端部时,球囊导管901连接到鲁尔适配器920,该鲁尔适配器连接到tuohyborst阀/组件922,该tuohyborst阀/组件连接到滑块机构924,该滑块机构连接到近侧鲁尔连接器926,该近侧鲁尔连接器连接到本文所述的二氧化碳供应部。滑块机构924用于针906推进,并且将在下文参照图12进行更详细地描述。
在前述实施方案中,公开了各种位置感测方法。在经食管导管实施方案中,三维位置传感器918可定位在针偏置部件904内,如图9b所示。该传感器918可用于将经食管导管的尖端定位在相对于周围解剖结构的空间中以及用于测量吹注。通过结合biosensewebster
本文所列出的任何示例性实施方案中的针(包括可供装置正刺穿食管的针)由该示例性实施方案中的镍钛诺合金制成,然而,也可使用多种其他材料。优选地,针在本质上为非铁的。此外,施用到针的涂料可用于增加其润滑性,例如聚四氟乙烯或ptfe,以有助于食管穿刺和/或利用抗菌剂预防感染。可使用抗粘合剂表面涂料(包括离子和聚合物涂料),该抗粘合剂表面涂料使用表面化学和功能性的概念。针表面可涂覆有杀菌物质,诸如脱乙酰壳多糖-万古霉素和银。纳米地形表面改性剂也可用作抗粘合剂或杀菌特征。此外,可将不透射线的镀层(例如,金或铂)施用到针,以有助于针的荧光镜可视化。示例性针906示于图9c和图9d中。如上文所列出,滑块机构924用于针906推进或回缩。参见图12,滑块机构包括连接到针906的平移套管921、其上可供平移套管921行进的平移导轨923、以及防止针906的过部署的止挡件925。平移导轨923在其近侧端部处连接到近侧鲁尔连接器926。
另外重要的是需注意,用于上述示例性实施方案中的球囊可包括任何合适类型的导管递送球囊,并且可以标准方式进行膨胀和收缩。
该装置还可具有位于该装置的柄部表面上的“时钟”指示器,以引导使用者进行导管旋转取向和定位,由此有助于正确地推进针。图10为此类指示器系统的图解示意图。如图所示,指示器轮1002包括凸起边缘1004或其他合适的标界以提供触觉标记物和视觉标记物,由此引导医师进行针部署。指示器轮1002将形成图3所示的tuohyborst阀300的柄部组件的一部分。指示器轮1002将以指示针的推进或回缩的方式附接至导管。例如,指示器轮1002可邻近螺纹鲁尔连接器306附接至海波管310。可利用优选地为针部署矢量提供触觉标记物和视觉标记物两者的任何合适的布置。
现在参见图11,示出了整个过程的简单流程图。在步骤1102中,医师将导管放置在期望的解剖位置,例如,邻近心脏左心房的食管。一旦导管就位,就记录导管在三维空间中相对于源场的坐标(步骤1104)。一旦这些初始坐标已被记录,就将二氧化碳递送到食管周空间中(步骤1106)。在步骤1108中,再次记录导管尖端在三维空间中的位置。在步骤1110处,执行检查以查看是否已实现治疗吹注。如果治疗吹注还未被实现,则递送附加的二氧化碳(步骤1112)。如果治疗吹注已被实现(步骤1114),则停止二氧化碳的递送(步骤116)。在步骤1118处,重复进行导管尖端在三维空间中的测量。在步骤1120处,作出有关导管尖端是否位于距最终期望位置的特定距离(例如,1mm)内的决策。可按照先前所述的方式作出决策。此值用作示例。实际值可为考虑二氧化碳吸收所需的任何距离。如果导管尖端不在距最终期望位置的预定距离内(步骤1122),则前进到其中将附加的二氧化碳递送到食管周空间中的步骤1124,其中重复步骤1118。如果导管尖端位于预定位置内(步骤1126),则停止二氧化碳递送(步骤1116)。逻辑和计算经由系统的微处理器112来执行。尽管所示出和描述的据信是最为实用和优选的实施方案,但显而易见的是,本领域的技术人员可对所描述和所示出的具体设计和方法作出变更,并且可在不脱离本发明的实质和范围的情况下使用这些变更形式。本发明并不局限于所述和所示的具体构造,而是应当构造成与可落入所附权利要求书的范围内的全部修改相符。
- 还没有人留言评论。精彩留言会获得点赞!