一种治疗复发/难治T细胞淋巴瘤的新型联合靶向药物的制作方法
本发明属于医药技术领域。更具体地,涉及一种治疗复发/难治t细胞淋巴瘤的新型联合靶向药物。
背景技术:
t细胞淋巴瘤是一种高度异质性和侵袭性的非霍奇金淋巴瘤,t细胞淋巴瘤包括nk/t细胞淋巴瘤(nk/tcelllymphoma,nktl)、外周t细胞淋巴瘤(peripheralt-celllymphoma,ptcl)和皮肤t细胞淋巴瘤(cutaneoust-celllymphoma,ctcl)等。其中,nk/t细胞淋巴瘤是起源于成熟nk/t细胞的淋巴系统恶性肿瘤。nk细胞和t细胞具有共同的祖细胞,两者在功能和某些抗原的表达上具有相似之处,nk/t细胞淋巴瘤因起源于这两种细胞而得名。与其他类型的淋巴瘤类似,进行性无痛性淋巴结肿是最常见的临床表现。鼻腔是nk/t细胞淋巴结最常见的结外原发部位,可表现为鼻塞、鼻出血、面部肿胀等,同时伴有恶臭和面中线部结构的坏死性改变;其次是皮肤,主要表现为分布于躯干或四肢的多发性斑块或肿块,可伴有溃疡形成;部分患者还可伴有发热、盗汗、体重下降等全身症状。
目前,t细胞淋巴瘤患者的预后极差,且治疗手段十分有限。目前常用的治疗方法包括化疗和放疗。对于病变局限的患者,以放疗为主。对于病变广泛累及者,应以全身化疗为主。但相对于其它类型淋巴瘤,该类型对放化疗比较抗拒,因此预后相对较差。
研究显示,t细胞性淋巴瘤患者可从hdac抑制剂西达本胺(chidamide)靶向治疗中获益:实验证实,t细胞性淋巴瘤患者可从组蛋白去乙酰化酶(hdac)抑制剂靶向治疗中获益。组蛋白去乙酰化酶(hdac)抑制剂可通过抑制组蛋白去乙酰化修饰来诱导肿瘤细胞分化、阻碍肿瘤细胞增殖及诱导凋亡等机制发挥抗肿瘤作用。相较其他抗肿瘤药物,hdac抑制剂具有抗癌效果好、针对性强、不良反应少等特点,逐渐成为抗癌治疗和肿瘤靶向治疗联合用药领域的新热点。目前fda已经批准多种hdac抑制剂用于t细胞淋巴瘤的治疗,其中伏立诺他(vorinostat,saha)和贝利司他(belinostat)分别被fda批准用于外周t细胞淋巴瘤(peripheralt-celllymphoma,ptcl)和皮肤t细胞淋巴瘤(cutaneoust-celllymphoma,ctcl)的治疗,而罗米地辛(romidepsin,fk228)则先后被批准用于复发/难治的ctcl和ptcl患者的治疗。然而,虽然多临床试验显示hdac抑制剂在治疗复发/难治t细胞淋巴瘤具有较好的应用前景,但是上述药物在t细胞淋巴瘤的治疗中的客观缓解率仅为20-30%,且其临床反应具有不可预测性。因此,进一步鉴定预测hdac抑制剂临床反应的分子标志物及相关耐药机理研究将对晚期复发/难治的t细胞淋巴瘤治疗起着重大促进作用。
另外,近年有一种新型hdac抑制剂西达本胺(chidamide)在t细胞淋巴瘤的临床应用:新型hdac抑制剂西达本胺(chidamide,商品名为爱谱沙/epidaza)是由我国深圳微芯生物科技有限公司自主研发的具有全新化学结构且获全球专利授权的口服hdac抑制剂,可选择性抑制i类hdac1、hdac2、hdac3以及iib类hdac10,该药已于2015年被国家食品药品监督管理总局(cfda)批准用于复发或难治性外周t细胞性淋巴瘤的治疗,目前已在美国完成i期临床试验。西达本胺用于ptcl的临床研究结果显示其对ptcl患者具有明显的长期生存(os)获益。相比其它二线治疗,西达本胺可以使得患者的总体生存期延长到21.4个月,而其它疗法能够给ptcl患者带来不同的生存期,分别为化疗(6.5月)、普拉曲沙(14.5月)、罗咪酯肽(11.3月)、贝利司他(7.9月)。西达本胺对ptcl的主要疗效指标客观缓解率为28%,且大多数反应发生在治疗前6周内,3个月的持续缓解率为24%。
由于hdac抑制剂是一类新型的抗肿瘤药物,对其具体作用机制如对同类肿瘤不同分型之间的疗效差异性、获得性耐药性形成机制等方面的研究仍有待深入。
技术实现要素:
鉴于hdac抑制剂西达本胺对ptcl具有良好的治疗效果,本发明人团队对它在另一类t细胞淋巴瘤nk/t细胞淋巴瘤的临床治疗效果进行了评估,前期临床试验结果显示,西达本胺对复发/难治的nktl患者进行治疗后患者得到完全缓解,表明hdac抑制剂西达本胺可作为新靶向治疗药物用于t细胞淋巴瘤的标准化治疗,但是患者个体差异化严重,患者对西达本胺的应答率差异巨大,且一半左右的患者对西达本胺表现出原发耐药,这些因素限制了西达本胺在nk/t细胞淋巴瘤治疗中的临床应用。目前仍缺乏有效的分子标记对hdac抑制剂治疗nk/t细胞淋巴瘤的疗效进行预测。因此,鉴定西达本胺治疗t细胞淋巴瘤过程中的分子标志物及阐明其治疗耐药形成机制,将有助于提高西达本胺在t细胞淋巴瘤的临床治疗效果。
因此,本发明旨在探究揭示对西达本胺产生耐药的机制,提供能够精准预测评估nk/t细胞淋巴瘤患者对hdac抑制剂的敏感性及耐药情况,将t细胞淋巴瘤患者进行前期分组后进行西达本胺治疗可使患者获得最大获益。并且进一步找出可克服hdac抑制剂治疗耐药的药物靶点并制定相应的联合治疗策略,使得无法从hdac抑制剂治疗中获益的t细胞淋巴瘤患者得到有效的治疗,从而将显著改善我国治疗t细胞淋巴瘤的临床治疗现状。
本发明的目的是提供jak-stat信号通路下游靶标tnfrsf8(cd30)在作为预测t细胞淋巴瘤患者(尤其是nk/t细胞淋巴瘤)对hdac抑制剂(包括西达本胺)敏感性的生物标记物中的应用。
本发明另一目的是提供hdac抑制剂与jak-stat信号通路抑制剂联用在制备t细胞淋巴瘤(尤其是nk/t细胞淋巴瘤)治疗药物中的应用。
本发明再一目的是提供治疗t细胞淋巴瘤,尤其是针对复发/难治的nk/t细胞淋巴瘤的药物。
本发明上述目的通过以下技术方案实现:
本发明通过对敏感和耐药的nktl细胞的转录组测序和染色质免疫共沉淀测序的数据进行整合分析,发现jak-stat信号通路异常活化介导了染色质重塑,从而导致对西达本胺耐药,揭示了对西达本胺产生耐药的机制。同时发明人还发现jak-stat信号通路下游靶标tnfrsf8(cd30)可作为预测nk/t细胞淋巴瘤患者对西达本胺敏感性的生物标记物。
进一步地,本发明基于该分子标志物提供了hdac抑制剂联合jak-stat信号通路抑制剂治疗t细胞淋巴瘤的新方案,使用jak-stat信号通路抑制剂处理西达本胺耐药细胞,可促进染色质重塑的重编程,可使细胞染色质重塑成对西达本胺敏感的状态,从而逆转耐药。体外实验表明,联合jak-stat信号通路抑制剂与hdac抑制剂显著协同抑制nktl增殖及诱导凋亡,从而达到良好的协同治疗效果。该方案目前在临床试验中证明对nk/t细胞淋巴瘤复发难治患者的治疗实验中取得了良好的治疗效果。
因此,本发明提供以下应用:
jak-stat信号通路下游靶标tnfrsf8(cd30)在作为预测t细胞淋巴瘤患者对hdac抑制剂敏感性的生物标记物中的应用。
jak-stat信号通路下游靶标tnfrsf8(cd30)的检测试剂在制备预测t细胞淋巴瘤患者对hdac抑制剂敏感性的试剂盒中的应用。
jak-stat信号通路下游靶标tnfrsf8(cd30)的免疫组化检测试剂在制备预测t细胞淋巴瘤患者对hdac抑制剂敏感性的试剂盒中的应用。
hdac抑制剂与jak-stat信号通路抑制剂联用在制备t细胞淋巴瘤治疗药物中的应用。
hdac抑制剂、jak-stat信号通路抑制剂与pd1单抗(sintilimab)三者联用在制备t细胞淋巴瘤治疗药物中的应用。
其中优选地,所述t细胞淋巴瘤是nk/t细胞淋巴瘤(nktl)。
优选地,所述nk/t细胞淋巴瘤是指复发/难治的nk/t细胞淋巴瘤。
更具体地,所述nk/t细胞淋巴瘤是指经hdac抑制剂治疗后复发/难治的nk/t细胞淋巴瘤。
另外,优选地,所述hdac抑制剂包括西达本胺(chidamide)、trichostatina(tsa)、伏立诺他(vorinostat,saha)、贝利司他(belinostat)、罗米地辛(romidepsin)、帕比司他(panobinostat)、remetinostat或恩替诺特(entinostat)。
优选地,所述jak-stat信号通路抑制剂包括针对jak家族分子上下游相关靶标的抑制剂,如芦可替尼(ruxolitinib)、托法替尼(tofacitinib)、stattic、pacritinib、来他替尼(lestaurtinib)或opb-31121。
基于上述成果,本发明还提供一种治疗nk/t细胞淋巴瘤的药物,含有hdac抑制剂与jak-stat信号通路抑制剂。
优选地,所述治疗nk/t细胞淋巴瘤的药物还可包含pd1单抗(sintilimab)。
优选地,所述药物是用于治疗复发/难治的nk/t细胞淋巴瘤的药物。更具体是指用于治疗经hdac抑制剂治疗后复发/难治的nk/t细胞淋巴瘤的药物。
本发明具有以下有益效果:
基于本发明的研究成果,即jak-stat信号通路下游靶标tnfrsf8(cd30)可作为预测nk/t细胞淋巴瘤患者对hdac抑制剂(包括西达本胺、tsa、saha等)敏感性的生物标记物,可以通过分子标志物的检测对t细胞淋巴瘤患者进行评估并前期分组后,再进行hdac抑制剂(包括西达本胺、tsa、saha等)治疗,可使患者获得最大获益。
此外,本发明深入研究了hdac抑制剂(包括西达本胺、tsa、saha等)治疗t细胞淋巴瘤的耐药性形成机制,提出了可克服hdac抑制剂(包括西达本胺、tsa、saha等)治疗耐药的药物靶点并制定了相应的联合治疗策略,即将jak-stat信号通路抑制剂与hdac抑制剂联用,可使细胞染色质重塑成对hdac抑制剂敏感的状态,从而逆转耐药,使得无法从hdac抑制剂治疗中获益的t细胞淋巴瘤患者得到有效的治疗,从而将显著改善我国治疗t细胞淋巴瘤的临床治疗现状。
本发明有助于推广hdac抑制剂在复发/难治的t细胞淋巴瘤治疗中的临床应用,为t细胞淋巴瘤的治疗提供个性化的精准治疗方案,进而提高患者存活率。
附图说明
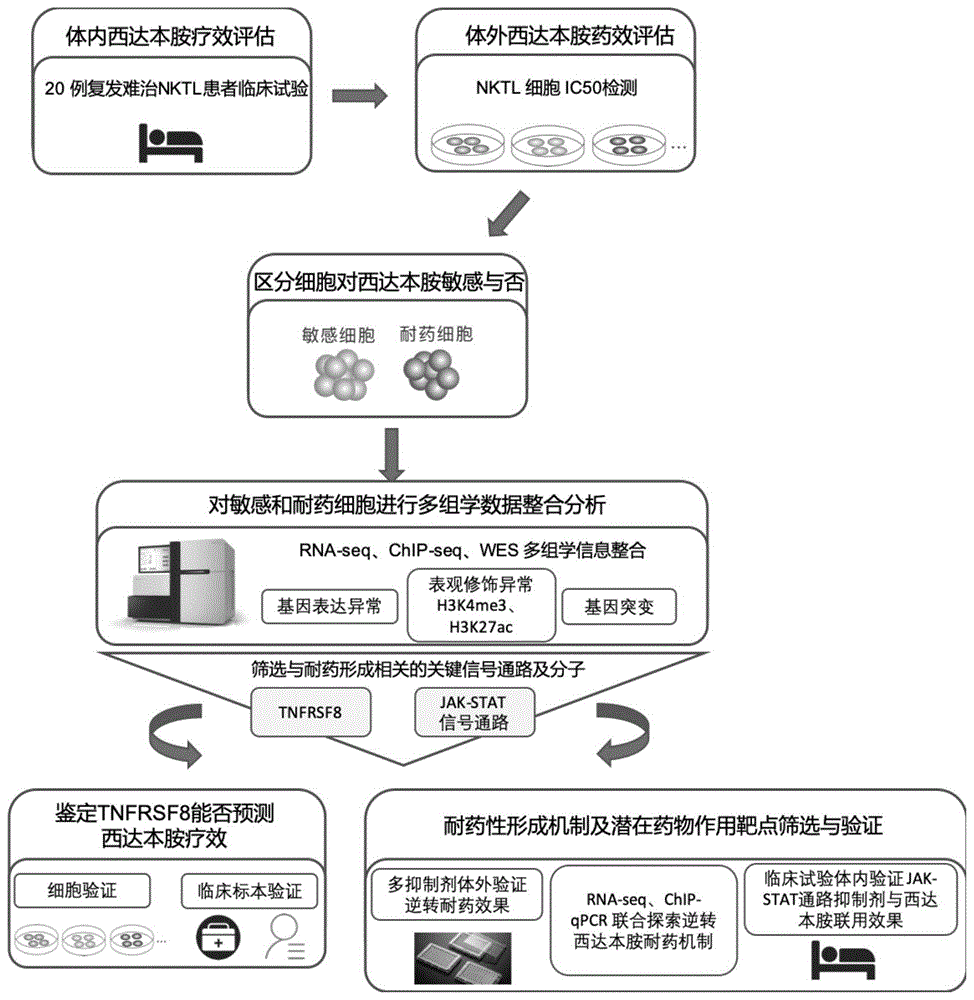
图1为本发明研究技术路线。
图2为20位nktl患者使用西达本胺临床试验结果。
图3是几种hdac抑制剂对nktl细胞的杀伤效果实验结果。
图4为西达本胺耐药和敏感的nktl细胞染色质免疫共沉淀测序和转录组测序结果。
图5是对四株细胞的h3k4me3chip-seq结果进行聚类分析结果。
图6为证明jak-stat信号通路在耐药的nktl中组成型激活的相关实验结果。
图7为证明jak-stat信号通路抑制剂可以克服nktl细胞对西达本胺耐药的相关实验结果。
图8为证明jak-stat信号通路抑制剂可以克服nktl细胞对saha、tsa耐药的相关实验结果。
图9为证明jak抑制剂tofacitinib、ruxolitinib均可通过改变jak-stat通路介导的染色质重塑从而逆转西达本胺耐药的相关实验结果。
图10是经西达本胺、pd1抗体治疗无效的nktl患者,使用jak-stat信号通路抑制剂芦可替尼(ruxolitinib)与西达本胺、pd1抗体联合治疗经过及治疗效果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
本发明采用“多组学整合分析策略”对西达本胺治疗t细胞淋巴瘤耐药性形成过程中的分子机制进行深入研究,以获得可预测西达本胺治疗效果的分子标志物并提出可逆转治疗瘤耐药性形成的治疗策略,其技术路线如图1所示。本团队首先利用全外显子测序(wes)、转录组测序(rna-seq)、染色质免疫共沉淀-测序(chip-seq)等高通量测序技术等组学研究技术对不同药物敏感性的nk/t细胞淋巴瘤细胞株、nk/t细胞淋巴瘤患者的肿瘤组织及血液样品、健康人来源的血液样品等进行分析获得相应的组学数据;随后,通过将上述组学数据与临床病理预后数据、公共数据库(肿瘤基因组大数据tcga、icgc和基因表达调控数据库encode、roadmap等)已有数据相整合后,我们将利用基因表达调控网络分析确定耐药性形成的具体分子机制,筛选得到可预测西达本胺敏感性的候选分子标志物和潜在可逆转西达本胺耐药性的药物作用靶点及相应的靶向药物;最终,在体内外研究模型和临床样本中验证候选分子标志物和靶向治疗药物的有效性。经西达本胺、pd1抗体治疗无效的nktl患者,使用jak-stat信号通路抑制剂芦可替尼(ruxolitinib)与西达本胺、pd1抗体联合治疗后,目前患者恢复情况良好。
具体实施例实验及结果如下:
实施例1评估西达本胺对nktl的治疗效果
1、本团队募集了20位nktl患者,使用西达本胺开展临床试验。
为了评估西达本胺治疗复发难治的nktl患者的疗效,我们于2016年8月至2018年4月在中山大学肿瘤防治中心(sysucc)入组20例复发难治的nktl患者进行了一项二期前瞻性临床试验。难治性被定义为在至少两个化疗周期后根据恶性淋巴瘤的评价标准(lugano2014标准)仍未达到pr或cr。年龄在18-75岁之间接受以天冬酰胺酶为基础的化疗或放化疗后诊断为复发难治性的nktl患者,ecog评分≤2,器官和骨髓功能正常,没有严重的造血功能、心脏、肺、肝、肾、甲状腺功能障碍,至少有一个可测量或评估的病变,则符合入选条件。有中枢神经系统受累或噬血细胞综合征的患者被排除在试验之外。该研究由sysucc的审查委员会根据《赫尔辛基宣言》和临床实践指南批准。所有患者在参与试验前均获得书面知情同意。他们在西达本胺治疗前28天内未接受任何全身抗肿瘤治疗,西达本胺每周两次(biw)30mg或每天10mg(qd),直至病情进展或不可耐受。主要终点是研究人员根据lugano2014标准评估的客观缓解率(orr),次要终点包括反应时间、反应持续时间、无进展生存期、总生存期和安全性。该试验在clinicaltrials.gov上注册,编号为nct2878278。sysucc伦理委员会批准了肿瘤收集和分析的研究方案。
2、实验结果:
图2a是在20例nktl患者中使用西达本胺治疗,有5例完全缓解,5例部分缓解,2例疾病稳定,8例疾病进展。
图2b是20例使用西达本胺治疗的nktl患者出现缓解的时间及其临床疗效。
图2c是第18号和第20号nktl患者使用西达本胺治疗前后的病灶对比。
综上结果表明,在20例复发难治nktl患者中,西达本胺的客观缓解率达50%,疗效较好。
实施例2研究西达本胺等hdac抑制剂对nktl细胞的杀伤效果
1、本团队检测了西达本胺在11株nktl细胞系中的ic50,并使用西达本胺、trichostatina(tsa)、saha三种hdac抑制剂处理这11株nktl细胞,通过atp检测评估细胞的存活率,在此基础上挑选了两株敏感和两株耐药的nktl细胞系作后续研究。进一步通过细胞活力检测、细胞周期与细胞凋亡实验显示了西达本胺对nktl细胞的杀伤效果。
nktl细胞系来源:hank1和yt分别由dr.yoshitoyokagami和dr.c.clayberger提供。snk6,snt8,snk1和nkys由dr.norioshimizu提供。mec04由dr.paulcoppo和dr.philippegaulard提供。khyg1和kai-3购自jcrb细胞库,nk92购自atcc,nk-s1由一个nktcl异种移植物构建。
细胞活力检测实验:
细胞周期实验:荧光染料碘化丙啶(pi)是一种可对dna染色的细胞核染色试剂。
(1)取对数生长期的细胞离心、重悬并计数。
(2)将细胞种在6孔板中,每孔2x105个细胞,2ml培养基,设置不加药阴性对照组,实验组加入所需浓度的药物,在37℃、5%二氧化碳条件下培养72h。
(3)72h后收集细胞,1100rpm离心3min,去上清。
(4)用pbs洗涤细胞两次,1100rpm离心3min,去上清,轻弹离心管,分散细胞团。
(5)加入1.2ml预冷的70%乙醇固定细胞,固定1h以上。
(6)1100rpm离心4min,去固定液,轻弹离心管,分散细胞团。
(7)预冷的pbs洗涤细胞两次,去上清,轻弹离心管,分散细胞团。
(8)每个样品加入100μg/ml的rnasea100μl,室温孵育5min。
(9)再加入50μg/ml的pi染料400μl,避光孵育30min。
(10)使用流式细胞仪检测,分析细胞周期检测结果。
细胞凋亡实验:
(1)取对数生长期的细胞离心、重悬并计数。
(2)将细胞种在6孔板中,每孔2x105个细胞,2ml培养基,设置不加药阴性对照组,实验组加入所需浓度的药物,在37℃、5%二氧化碳条件下培养72h。
(3)72h后收集细胞,1000rpm离心5min,4℃,去上清。
(4)用预冷的pbs洗涤细胞两次,1000rpm离心5min,4℃,去上清,轻弹离心管,分散细胞团。
(5)加入100μl1xbingding,混匀。
(6)加入5μlannexinv-fitc及5μlpistainingsolution,混匀,避光,室温孵育10min;再加400μl1×bindingbuffer,混匀。染色后样品在1h内用流式细胞仪检测。
2、实验结果:
图3a是西达本胺在11株nktl细胞系中的ic50。
图3b是西达本胺对11株nktl细胞的杀伤效果。
图3c是tsa、saha对11株nktl细胞的杀伤效果。
图3d是低剂量和高剂量西达本胺对两株敏感(khyg1、mec04)和两株耐药(hank1、snk6)的nktl细胞进行处理后的生长曲线。
图3e是低剂量和高剂量西达本胺对敏感(khyg1)和耐药(hank1)的nktl细胞进行处理后细胞周期检测(sub-g1期代表死亡细胞)。
图3f是西达本胺处理khyg1和hank1细胞后通过流式检测细胞凋亡。
综上结果表明,部分nktl细胞系对西达本胺较为敏感,部分较为耐药。西达本胺明显抑制敏感细胞的增殖,并通过凋亡诱导细胞死亡。
实施例3分别对西达本胺耐药和敏感的nktl细胞进行染色质免疫共沉淀测序和转录组测序
1、实验方法
h3k27ac是增强子(enhancer)的标记,本团队使用两株敏感和两株耐药的nktl细胞进行h3k27acchip-seq分析,以此分析染色质在对西达本胺耐受的状态下增强子的获得与丢失,并且进一步通过rna-seq与chip-seq数据结合,确定在对西达本胺耐药状态下富集的信号通路。
nktl细胞系来源:khyg1购自jcrb细胞库。mec04由dr.paulcoppo和dr.philippegaulard提供。hank1由dr.yoshitoyokagami提供。snk6由dr.norioshimizu提供。
染色质免疫共沉淀测序(chip-seq):收集细胞,1%甲醛交联10min,甘氨酸中止交联。离心,tbse洗涤细胞3遍,去上清,-80℃冰箱保存。100μlsds裂解液裂解细胞,非接触式全自动超声波破碎仪超声16次(30s开,30s关),dynabeads蛋白g预处理染色质溶液1h,4℃;dynabeads蛋白g和抗体结合1h,4℃;预处理后的染色质溶液加入与抗体结合后的dynabeads蛋白g,4℃旋转孵育过夜。第二天洗涤4遍样品后,洗脱,pronasea解交联dna,纯化沉淀dna。检测dna质量合格后使用
rna-seq:取1μgrna用于建库。使用
rna-seq数据分析方法:通过fastp软件对原始数据进行质量检测并去除低质量reads,用star(版本2.7.0f)将cleanreads和人类基因组(hg38)进行比对。用rsem进行样本特异性表达分析,edger(p-value<0.05)鉴定差异表达基因。我们使用定制的r脚本来生成可视化图,如ma图、相关性图和聚类热图。基于超几何检验的基因集富集分析(gsea)是将耐药细胞和敏感细胞中的差异表达基因与h3k27ac的gain区域和loss区域合并之后进行分析的。使用来自deeptools的bamcoverage软件生成igv中可视化的track。
2、实验结果:
图4a是对四株细胞的h3k27acchip-seq结果进行聚类分析。对西达本胺耐药和敏感的细胞株在增强子的获得和丢失上有明显差异。
图4b是通过韦恩图分析对西达本胺耐药和敏感两类细胞增强子的丢失与获得。
图4c是通过manorm3软件对四株细胞的chip-seq结果的maplot。红色点代表耐药细胞中获得的增强子,蓝色点代表耐药细胞中丢失的增强子。
图4d是通过热图表示增强子获得和丢失区域10kb以内的h3k27ac信号。
图4e是通过学习homer软件分析了chip-seq结果中富集的motif。
图4f是chip-seq与rna-seq结果结合分析后,所确定的通过增强子调控的差异表达基因。
图4g是图4f筛选出来差异基因的热图。
图4h是通过基因集富集分析(gsea)的方法对差异基因进行超几何分析的结果;发现jak-stat通路是上调通路中最主要的通路。
图4i是通过igv软件呈现h3k27ac在两个代表基因的信号。
图5是对四株细胞的h3k4me3chip-seq结果进行聚类分析。对西达本胺耐药和敏感的细胞株在启动子区域活性的改变上并无明显差异。
综上结果表明,在nktl中,异常的jak-stat信号通路诱导的染色体重塑介导了西达本胺耐药。
实施例4jak-stat信号通路在耐药的nktl中组成型激活
1、实验方法
本团队检测了stat3、stat5在敏感和耐药细胞中的磷酸化水平,分析了jak-stat信号通路中差异基因的聚类情况,得到了6个在耐药细胞中表达上调的基因,进一步通过qrt-pcr对这6个基因在敏感和耐药(各三株)的nktl细胞的表达水平进行验证。本团队在16例复发难治型nktl患者中通过免疫组织化学发现西达本胺的疗效与tnfrsf8(cd30)的表达水平呈负相关,提示cd30可作为预测西达本胺疗效的潜在生物标记。
2、实验结果:
图6a是通过蛋白印迹检测stat3、stat5在敏感和耐药细胞中的磷酸化水平,jak-stat信号在耐药细胞中明显活化。
图6b中热图显示了jak-stat信号通路中差异基因的聚类情况,得到了6个在耐药细胞中表达上调的基因。
图6c是通过qrt-pcr对这6个基因在敏感和耐药nktl细胞中表达水平的验证。
图6d是cd30表达水平与16例复发难治型nktl患者对西达本胺应答效果的统计。
图6e是cd30免疫组织化学检测的代表图。
综上结果表明,jak-stat信号通路在耐药的nktl细胞中异常激活。tnfrsf8(cd30)是jak-stat通路的下游靶点,它可能是nktl对西达本胺耐药的潜在预测生物标志物。
实施例5jak-stat信号通路抑制剂可以克服nktl细胞对hdac抑制剂耐药
1、实验方法
本团队在hank1和snk6两株西达本胺耐药的nktl细胞中评估了西达本胺与jak-stat通路抑制剂tofacitinib的联用效果,并进一步在hank1细胞中评估了hdac抑制剂西达本胺、saha、tsa与另外两种jak-stat通路抑制剂ruxolitinib和stattic的联用效果。
nktl细胞系来源、细胞活力检测实验、细胞周期实验及细胞凋亡实验方法同实施例2。
联合指数(ci):在96孔白板上接种2000个细胞/孔,每孔100μl。分别用不含药物的培养基或含不同浓度的药物的培养基培养96h,加入50μlatp检测液,混匀2min,室温静置10min,使用tecan多功能酶标仪读取细胞活力。每种处理设三个复孔以减少实验误差。ci值由药物处理后的细胞抑制率和计算机软件calcusyn测定。
2、实验结果:
图7a是通过calcusyn软件计算西达本胺与tofacitinib在hank1和snk6细胞的联用效果,当联合指数等于1时,表示两药效果叠加;当联合指数大于1时,表示两药效果拮抗;当联合指数小于1时,表示两药具有协同效应。此结果表明西达本胺与tofacitinib有着良好的协同效应。
图7b是atp检测西达本胺与tofacitinib联用后hank1和snk6细胞的增殖情况。
图7c是细胞周期实验检测西达本胺与tofacitinib联用后hank1和snk6细胞的死亡情况,sub-g1期细胞为死亡细胞。
图7d是细胞活性检测西达本胺分别与ruxolitinib和stattic联用后hank1细胞的增殖情况。
图7e是细胞周期实验检测西达本胺分别与ruxolitinib和stattic联用后hank1细胞的死亡情况,sub-g1期细胞为死亡细胞。
图7f是细胞凋亡实验检测西达本胺分别与tofacitinib和ruxolitinib联用后hank1细胞的凋亡情况。
图8a是细胞周期实验检测saha分别与tofacitinib、ruxolitinib联用后hank1细胞的死亡情况,sub-g1期细胞为死亡细胞。
图8b是细胞周期实验检测tsa分别与tofacitinib、ruxolitinib联用后hank1细胞的死亡情况,sub-g1期细胞为死亡细胞。
图8c是细胞凋亡实验检测saha、tsa分别与ruxolitinib和stattic联用后hank1细胞的凋亡情况。
综上结果表明:jak-stat信号通路抑制剂(tofacitinib、ruxolitinib和stattic)与hdac抑制剂(西达本胺、saha和tsa)联用可以克服nktl细胞对hdac抑制剂的耐药性。
实施例6jak抑制剂tofacitinib、ruxolitinib均可通过改变jak-stat通路介导的染色质重塑逆转西达本胺耐药
1、实验方法
分别使用tofacitinib、ruxolitinib处理hank1细胞后进行rna-seq分析。
nktl细胞系来源、rna-seq、chip实验方法同实施例3。
蛋白质印迹法(westernblot):将细胞种在6孔板中,每孔5x105个细胞,2ml培养基,设置不加药阴性对照组,实验组加入所需浓度的药物,在37℃、5%二氧化碳条件下培养24h后收样,裂解蛋白,蛋白上样量30μg,体积15μl。短暂离心后,95℃热激5min,冰上静置1min,最高速离心1min后上样。连接电极后恒压80v电泳,待样品过了浓缩胶进入分离胶后转为120v,当溴酚蓝条带到达分离胶底端时停止电泳,将凝胶取出。于冰中转膜,300ma转膜1.5h。使用染色液染至可看条带,观察不同样品间条带强弱是否一致,如果一致则继续进行下一步实验。脱色液洗2次后用tbst洗膜3次,室温封闭1h,一抗4℃孵育过夜,第二天洗膜后二抗室温孵育1h,再次洗膜后用bio-rad化学发光成像系统成像。
2、实验结果
本团队通过分别使用tofacitinib、ruxolitinib处理hank1细胞后进行的rna-seq分析结果发现,介导染色质重塑成耐药状态的jak-stat通路被明显抑制,且通过chip实验发现耐药细胞中jak-stat通路上调的差异基因h3k27ac所富集片段显著降低。这一结果表明tofacitinib、ruxolitinib可通过抑制jak-stat通路介导的染色质重塑从而逆转西达本胺耐药。
图9a是分别使用tofacitinib、ruxolitinib处理hank1细胞后进行的rna-seq,对差异基因进行聚类分析。
图9b是使用gsea软件分析tofacitinib、ruxolitinib处理hank1细胞后jak-stat通路在差异基因中的富集。结果显示jak-stat通路在tofacitinib、ruxolitinib处理后富集程度降低。
图9c是免疫印迹检测tofacitinib、ruxolitinib处理西达本胺耐药的nktl细胞后jak-stat通路的活性。结果显示tofacitinib、ruxolitinib处理后可以有效抑制耐药细胞中jak-stat通路的活性。
图9d是qrt-pcr检测tofacitinib、ruxolitinib处理后jak-stat通路中差异基因的表达水平。
图9e是chip-qpcr检测tofacitinib、ruxolitinib处理后耐药细胞中jak-stat通路的上调的差异基因h3k27ac所富集片段的丰度。结果显示,tofacitinib、ruxolitinib处理后耐药细胞中jak-stat通路上调的差异基因h3k27ac所富集片段显著降低。
综上结果表明,jak抑制剂tofacitinib和ruxolitinib可使耐药的nktl细胞的染色质重塑重编程到药敏状态。
实施例7西达本胺、pd1单抗(sintilimab)、ruxolitinib联用成功治愈了一例西达本胺耐药的nktl患者
1、患者来自中山大学肿瘤防治中心(sysucc)。该患者被确诊为nktlstageiia(病灶:左鼻腔、鼻中隔、左上牙槽骨牙龈),化疗治疗复发后,给予西达本胺(30mg口服,1周2次)和sintilimab(200mg静脉注射,每21天1次)联合治疗,4个疗程之后疾病进展,并出现了新的病灶,外周血eb病毒含量增高。根据我们的研究,考虑联合使用jak抑制剂ruxolitinib,故给予西达本胺(30mg口服,1周2次)、sintilimab(200mg静脉注射,每21天1次)和ruxolitinib(10mg口服,1天2次)联合治疗,2疗程后部分缓解,4疗程后评价为病理学完全缓解(影像学上残余小部分病灶,取活检,ebers-,病理提示为符合粘膜慢性炎,伴肉芽组织增生)。此外,在西达本胺、sintilimab和ruxolitinib联合治疗前,免疫组化检测cd30为阳性,也提示cd30可能是预测nktl对西达本胺是否耐药的生物标志物。西达本胺和jak-stat抑制剂联合治疗可能是治疗复发/难治nktl患者的新选择。
2.图10a上图是治疗期间复发/难治nktl患者外周血中eb病毒dna拷贝数的动态变化。蓝色箭头表示西达本胺和sintilimab治疗的起始时间,紫色箭头表示西达本胺、sintilimab和ruxolitinib联合治疗的起始时间。中图是治疗方案的临床反应。下图是患者分别使用西达本胺+sintilimab和西达本胺+sintilimab+ruxolitinib治疗前后的pet-ct的代表性病灶对比。红色箭头表示病变位置。
图10b是患者接受西达本胺+sintilimab+ruxolitinib联合治疗前后pet-ct的全身对比。
图10c是患者接受西达本胺+sintilimab+ruxolitinib联合治疗前的he和cd30免疫组化的代表性图片,比例尺为50μm。
结果表明:经西达本胺、pd1抗体治疗无效的nktl患者,使用jak-stat信号通路抑制剂芦可替尼(ruxolitinib)与西达本胺、pd1抗体联合治疗后,患者达到病理学完全缓解。目前患者恢复情况良好。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!