NRF2蛋白在制备用于调节生物节律的药物中的应用的制作方法
本发明涉及调节生物节律技术领域,具体涉及nrf2蛋白在制备用于调节生物节律的药物中的应用。
背景技术:
生物节律是机体内从分子、细胞、器官、系统以及行为等各种不同水平表现出的按一定时间顺序、周而复始的生命活动现象。生物节律广泛调控着各种生理功能,如体温、心血管活动、呼吸、免疫反应、激素分泌、行为、认知功能等。
生物节律的核心机制是生物节律基因的转录和转录后调控所形成的分子振荡。clock、bmal1蛋白是生物节律的分子标志和核心。节律基因启动后,经转录翻译生成相应的蛋白质,当蛋白质浓度达一定程度后,反馈作用于基因启动子,使其浓度呈现24h周期振荡。
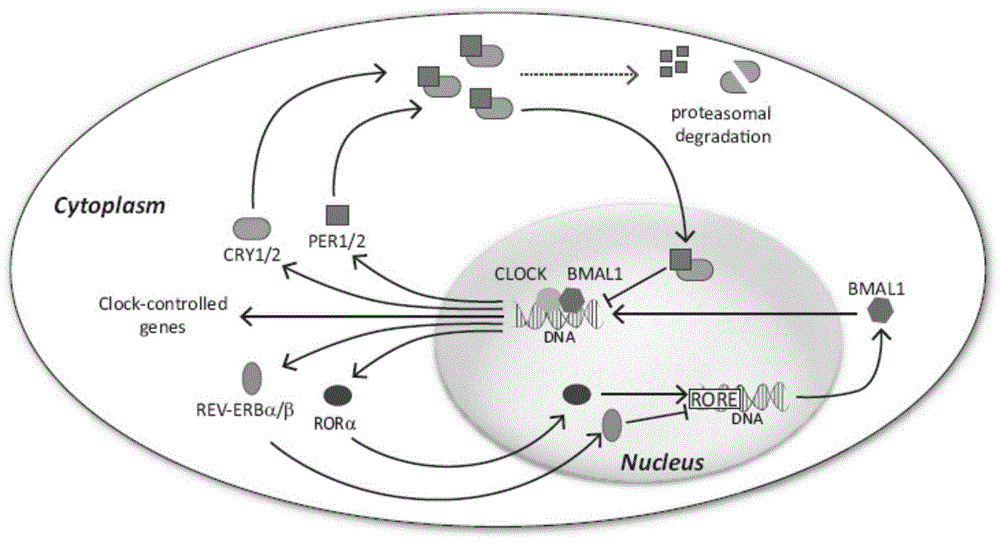
节律基因转录的自激振荡由多个反馈环组成,其中有2个环路最重要,如图1所示:
(1)clock和bmal1蛋白形成异二聚体,结合到节律基因per1-3和cry1/2基因,从而激活其基因转录。per和cry系列蛋白从胞浆转移至胞核,与clock和/或bmal1作用,抑制clock-bmal1的活性,从而抑制per1-3和cry1/2的转录。
(2)clock-bmal1同时也激活孤儿核受体rev-erbα转录,其表达蛋白rev-erbα可与bmal1基因结合,阻遏bmal1的转录。
基因转录和蛋白入核需要一定时间,使节律分子振荡的周期正好维持在24h左右。这种分子振荡不但per1-3、cry1/2的表达呈现生物节律,而且使clock-bmal1异二聚体的转录活性也具有节律特征。
nrf2蛋白可间接调节机体clock-bmal1的表达。nrf2蛋白是细胞氧化应激的主要调节因子。正常情况下,nrf2存在于细胞胞浆中并维持在较低水平。其中,kelch-likeech-associatedprotein1(keap1)与nrf2结合诱导其发生降解,因此nrf2处于失活状态。在氧化应激条件下,keap1发生氧化,导致其与nrf2解离,解除了对nrf2的降解,使nrf2在胞浆内累积进而转入细胞核。在其它辅助活化蛋白的协助下,nrf2与ii相酶和抗氧化酶基因结合,启动这些酶基因的表达,最终降低细胞内ros水平以改善脂质过氧化等氧化损伤。氧化应激除了促使nrf2与keap1的解离,还可诱导pkc、mapk、pi3k/akt、ck2等多种激酶对nrf2的磷酸化而使其入核并激活,如图2所示。nrf2能够诱导超过250个基因的表达。
研究表明,上述clock-bmal1反馈环中的重要环节——rev-erbα基因存在着nrf2调控序列。目前已发现,nrf2可通过影响rev-erbα和cry2而间接调节clock、bmal1含量。
而nrf2蛋白可间接调节生物节律:nrf2蛋白与生物节律反馈因子rev、ror、per、cry等对应的基因rev、ror、per、cry结合,改变rev、ror、per、cry在细胞核的表达,从而改变它们的含量。这些因子出核后,与节律蛋白clock、bmal1对应的基因clock、bmal1相关结合,改变节律蛋白clock、bmal1在细胞核的表达,从而改变clock、bmal1蛋白的含量,进而改变生物节律,如图3所示。
但现有技术也存在生物节律调节技术反应速度慢、易受干扰的缺点。
现在技术通过增加nrf2蛋白含量,使得nrf2蛋白与生物节律相关反馈因子rev、ror的基因结合,改变rev、ror的含量,然后这些因子进入细胞核,与节律基因bmal1的基因结合,从而改变节律蛋白的含量。此技术涉及3个步骤:
(1)增加nrf2蛋白含量;
(2)nrf2与生物节律反馈因子rev、ror等的基因相结合,从而改变rev、ror的含量;
(3)rev、ror改变节律蛋白的含量。
上述步骤涉及众多的蛋白与基因结合、基因表达为蛋白等过程,反应速度较慢;第(2)、(3)步“rev、ror的含量变化”和“rev、ror改变节律蛋白的含量”,在生物体内有多种补偿方式。比如尽管改变rev、ror,可能其它反馈因子如cry等很快进行补偿,导致不能出现预期的节律蛋白的含量变化,因此容易受到干扰。
技术实现要素:
本发明的目的就是针对上述现有技术中生物节律调节技术反应慢、易受干扰等缺陷,提供了nrf2蛋白在制备用于调节生物节律的药物中的应用。能够有效提高生物节律的调节速度,减少细胞内其它因素对生物节律调节的干扰,实现生物节律的快速调节和无干扰调节。
为了实现上述目的,本发明提供的技术方案为:nrf2蛋白在制备用于调节生物节律的药物中的应用。
进一步的,上述的应用,所述nrf2蛋白的氨基酸序列如序列表中序列1所示。
序列简写为:
mdlidilwrqdidlgvsrevfdfsqrrkeyelekqkklekerqeqlqkeqekafftqlqldeetgeflpiqpaqhtqsetsgsanysqvahipksdalyfddcmqllaqtfpfvddnevssatfqslvpdipghiespvfiatnqaqspetsvaqvapvdldgmqqdieqvweellsipelqclniendklvettmvpspeakltevdnyhfyssipsmekevgncsphflnafedsfssilstedpnqltvnslnsdatvntdfgdefysafiaepsisnsmpspatlshslsellngpidvsdlslckafnqnhpestaefndsdsgislntspsvaspehsvesssygdtllglsdseveeldsapgsvkqngpktpvhssgdmvqplspsqgqsthvhdaqcentpekelpvspghrktpftkdkhssrleahltrdelrakalhipfpvekiinlpvvdfnemmskeqfneaqlalirdirrrgknkvaaqncrkrkleniveleqdldhlkdekekllkekgendkslhllkkqlstlylevfsmlrdedgkpyspseyslqqtrdgnvflvpkskkpdvkkn。
进一步的,上述的应用,调节生物节律是采用以下两种方式实现的:
1)通过激活nrf2蛋白实现生物节律的调节;
2)通过促进nrf2蛋白与生物节律相关基因的结合实现生物节律的调节。
进一步的,上述的应用,所述nrf2蛋白的激活以及促进nrf2蛋白与生物节律相关基因的结合均是通过nrf2激动剂实现的。
进一步的,上述的应用,所述nrf2激动剂为硼替佐米。
本发明的有益效果为:本发明提供的nrf2蛋白在制备用于调节生物节律的药物中的应用,可实现对生物节律的快速调节和无干扰调节,具体为:
(一)快速调节:
一是通过直接激活nrf2蛋白,使nrf2快速进入细胞核发挥作用。避开了“增加nrf2含量”这种“dna-mrna-蛋白”过程的慢速调节途径。
二是通过促进nrf2蛋白与生物节律相关基因的结合,直接增加生物节律蛋白的含量,从而快速调节生物节律。避开了“通过生物节律反馈蛋白间接增加生物节律蛋白含量”这种慢速调节途径。
(二)无干扰调节:
通过促进nrf2蛋白与生物节律相关基因的结合,直接增加生物节律蛋白的含量,避开了生物节律反馈蛋白对生物节律蛋白含量的干扰。
附图说明
图1显示为哺乳动物的生物节律基因转录反馈环路。
图2显示为应激条件下nrf2活化并促进下游抗氧化酶基因表达。
图3显示为nrf2蛋白间接调节生物节律。
图4显示为不同nrf2sirna100nm处理24h对nih/3t3细胞clock、bmal1表达的影响,其中,数据以平均值±标准差表示,n=4。*p<0.05与nc-fam处理组相比。
图5显示为不同浓度nrf2sirna-1208处理24h对nih/3t3细胞clock、bmal1表达的影响,其中,数据以平均值±标准差表示,n=4。*p<0.05,**p<0.01与nc-fam处理组相比。
图6显示为不同浓度brusatol处理4h对nih/3t3细胞存活率的影响,其中,数据以平均值±标准差表示,n=4。
图7显示为不同浓度brusatol处理4h对nih/3t3细胞clock、bmal1蛋白表达的影响,其中,数据以平均值±标准差表示,n=4,*p<0.05,**p<0.01与dmso处理组相比。
图8显示为pcmv6-entry-myc-nrf2质粒处理24h对nih/3t3细胞clock、bmal1表达的影响,其中,数据以平均值±标准差表示,n=4,*p<0.05与2000ngnc-myc处理组相比。
图9显示为nrf2sirna处理24h对马血清诱导nih/3t3细胞clock、bmal1节律性的影响,其中,数据以平均值±标准差表示,n=4;hs,马血清;*p<0.05nrf2sirna+hs处理组与hs处理组对应的时间点相比。
图10显示为brusatol处理4h对马血清诱导nih/3t3细胞clock、bmal1节律性表达的影响,其中,数据以平均值±标准差表示,n=4;hs,马血清;*p<0.05为brusatol+hs处理组与hs处理组对应的时间点相比。
图11显示为nrf2激动剂btz和抑制剂atra对nih/3t3细胞nrf2活性的影响,其中,数据以平均值±标准差表示,n=4;*p<0.05,**p<0.01;a、不同浓度btz处理24h对nih/3t3细胞胞浆和胞核nrf2活性的影响;b、atra和btz处理24h对nih/3t3细胞胞浆和胞核nrf2活性的影响。
图12显示为不同浓度btz处理24h对nih/3t3细胞胞浆和胞核clock、bmal1表达的影响,其中,数据以平均值±标准差表示,n=4;*p<0.05,**p<0.01与0.01%dmso相比。
图13显示为btz和atra处理24h对nih/3t3细胞胞浆和胞核clock、bmal1表达的影响,其中,数据以平均值±标准差表示,n=4;*p<0.05,**p<0.01。
图14显示为btz和atra处理24h对nih/3t3细胞clock、bmal1节律性的影响,其中,数据以平均值±标准差表示,n=4;p<0.05与dmso处理组相比。
图15显示为btz和atra处理24h对nih/3t3细胞nrf2与clock、bmal1基因结合的影响,其中,数据以平均值±标准差表示,n=4;a、btz处理24h对nih/3t3细胞nrf2与clock、bmal1基因结合的影响;b、btz和atra处理24h对nih/3t3细胞nrf2与clock、bmal1基因结合的影响。
具体实施方式
实施例1:
nrf2蛋白对生物节律的调节研究,其目的是:以小鼠胚胎成纤维细胞系nih/3t3细胞为研究对象,分别通过减少nrf2蛋白的合成、促进nrf2的分解和增加nrf2的合成的方式研究nrf2对生物节律蛋白clock、bmal1表达和节律性的变化,研究nrf2蛋白对生物节律的影响。
过程和结果如下所示。
一、减少nrf2的合成可以调节节律蛋白clock、bmal1的含量:
1、能够减少nrf2合成的nrf2sirna筛选:
a.实验方法:
rna干扰技术是减少蛋白合成的常用技术。通过细胞转染技术使rna干扰剂sirna与目标蛋白对应的信使rna完全配对结合,抑制目标蛋白的转录和翻译,从而达到减少细胞内目标蛋白合成的目的。
实验分组如下(n=4):
(1)dmem组:用正常培养基dmem培养nih/3t3细胞24h;
(2)opti-mem组:用细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(3)lipo2000组:用含有细胞转染试剂脂质体2000(lipo2000)的细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(4)nc-fam组:对nih/3t3细胞转染绿色荧光对照nc-fam,即用含有细胞转染试剂lipo2000和nc-fam的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(5)sirna-331组:对nih/3t3细胞转染rna干扰剂sirna-331,即用含有细胞转染试剂lipo2000和rna干扰剂100nmsirna-331的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(6)sirna-793组:对nih/3t3细胞转染rna干扰剂sirna-793,即用含有细胞转染试剂脂质体2000(lipo2000)和rna干扰剂100nmsirna-793的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(7)sirna-1208组:对nih/3t3细胞转染rna干扰剂sirna-1208,即用含有细胞转染试剂脂质体2000(lipo2000)和rna干扰剂100nmsirna-1208的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h。
其中,各组对应的nrf2sirna序列如下表1所示。
表1nrf2sirna序列
然后收集各组细胞,通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)表达。
b.实验结果:
与nc-fam处理组相比,sirna-1208处理组nrf2表达显著降低,sirna-331或sirna-793处理均不改变nrf2表达。因此sirna-1208能够减少nrf2合成。
与nc-fam处理组相比,sirna-1208处理后,细胞clock、bmal1的表达均显著下降(p<0.05),图4。
c.实验小结
本实验初步证明,减少nrf2的合成可以降低细胞内节律蛋白clock、bmal1的含量。
2、不同浓度nrf2sirna对clock、bmal1的含量的影响:
a.实验方法:
实验分组如下(n=4):
(1)dmem组:用正常培养基dmem培养nih/3t3细胞24h;
(2)opti-mem组:用细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(3)lipo2000组:用含有细胞转染试剂脂质体2000(lipo2000)的细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(4)50nmnc组:对nih/3t3细胞转染非荧光对照nc,即用含有细胞转染试剂脂质体2000(lipo2000)和50nmnc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(5)100nmnc组:对nih/3t3细胞转染非荧光对照nc,即用含有细胞转染试剂脂质体2000(lipo2000)和100nmnc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(6)200nmnc组:对nih/3t3细胞转染非荧光对照nc,即用含有细胞转染试剂脂质体2000(lipo2000)和200nmnc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(7)50nmsirna-1208组:对nih/3t3细胞转染rna干扰剂sirna-1208,即用含有细胞转染试剂脂质体2000(lipo2000)和50nmsirna-1208的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(8)100nmsirna-1208组:对nih/3t3细胞转染rna干扰剂sirna-1208,即用含有细胞转染试剂脂质体2000(lipo2000)和100nmsirna-1208的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(9)200nmsirna-1208组:对nih/3t3细胞转染rna干扰剂sirna-1208,即用含有细胞转染试剂脂质体2000(lipo2000)和200nmsirna-1208的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h。
其中,各组对应的nrf2sirna序列如下表2所示。
表2nrf2sirna序列
然后收集各组细胞,通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)表达。
b.实验结果:
与对应浓度的nc处理组相比,转染不同浓度的sirna-120824h后细胞nrf2表达显著降低,且clock、bmal1的表达显著下降(p<0.05),其中,50nmsirna-1208处理组细胞bmal1表达无显著性差异,如图5所示。
c.实验小结:
本实验进一步证明,减少nrf2的合成可以降低细胞内节律蛋白clock、bmal1的含量。
二、促进nrf2的分解可以调节节律蛋白clock、bmal1的含量:
1、不同浓度鸦胆子苦醇处理对细胞存活率的影响:
a.实验方法:
文献报道,鸦胆子苦醇(brusatol)可促进nrf2在细胞内的降解。本实验利用brusatol促进nih/3t3细胞nrf2蛋白的分解。
brusatol水溶性差,需要以二甲基亚砜dmso溶解。文献报道,0.1%dmso对细胞无损伤,本实验利用终浓度0.01%dmso溶解brusatol。
实验分组如下(n=4):
(1)dmem组:用正常培养基dmem培养nih/3t3细胞4h;
(2)dmso组:用含有0.01%dmso(brusatol溶剂)的dmem培养nih/3t3细胞4h;
(3)1nmbrusatol组:用含有1nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(4)10nmbrusatol组:用含有10nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(5)100nmbrusatol组:用含有100nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(6)1000nmbrusatol组:用含有1000nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h。
利用细胞存活率检测试剂盒(promega,g3580)检测nih/3t3细胞存活率。
b.实验结果:
与dmem组或dmso组相比,1、10、100、1000nm的brusatol处理4h后,nih/3t3细胞存活率无显著性变化,如图6所示。
c.实验小结:
这些结果表明,1-1000nmbrusatol处理4h对细胞存活无影响。
2、不同浓度鸦胆子苦醇处理对clock、bmal1含量的影响:
a.实验方法:
实验分组如下(n=4):
(1)dmem组:用正常培养基dmem培养nih/3t3细胞4h;
(2)dmso组:用含有0.01%dmso(brusatol溶剂)的dmem培养nih/3t3细胞4h;
(3)1nmbrusatol组:用含有1nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(4)10nmbrusatol组:用含有10nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(5)100nmbrusatol组:用含有100nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h;
(6)1000nmbrusatol组:用含有1000nmbrusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h。
然后收集各组细胞,通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)表达。
b.实验结果:
与dmso处理组相比,1-1000nmbrusatol处理4h后,nih/3t3细胞nrf2表达显著降低,表明brusatol促进了nrf2在细胞内的降解。
与dmso处理组相比,不同浓度brusatol处理4h后clock、bmal1的表达显著下降(p<0.05),其中,10nmbrusatol处理组细胞clock表达无显著性差异,如图7所示。
c.实验小结:
本实验证明,促进nrf2的分解可以降低细胞内节律蛋白clock、bmal1的含量。
三、增加nrf2的合成可以调节节律蛋白clock、bmal1的含量:
a.实验方法:
基因过表达技术是增加细胞内蛋白合成的常用技术。通过细胞转染过表达质粒pcmv6-entry-myc-nrf2,使其整合到细胞基因组上,可增强nrf2蛋白的转录和翻译,从而增加nrf2蛋白的合成。其中,myc是验证基因过表达成功与否的标志。myc是一类小分子标签基因,可编码myc蛋白,在哺乳动物体内没有此类蛋白。细胞转染过表达质粒pcmv6-entry-myc-nrf2后,若检测到myc蛋白,则表明基因过表达成功。
实验分组如下(n=4):
(1)dmem组:用正常培养基dmem培养nih/3t3细胞24h;
(2)opti-mem组:用细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(3)lipo2000组:用含有细胞转染试剂脂质体2000(lipo2000)的细胞转染培养基opti-mem培养nih/3t3细胞6h,然后改用正常培养基dmem培养18h;
(4)500ngnc-myc组:对nih/3t3细胞转染过表达质粒的对照质粒nc-myc,即用含有细胞转染试剂脂质体2000(lipo2000)和500ngnc-myc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(5)1000ngnc-myc组:对nih/3t3细胞转染过表达质粒的对照质粒nc-myc,即用含有细胞转染试剂脂质体2000(lipo2000)和1000ngnc-myc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(6)2000ngnc-myc组:对nih/3t3细胞转染过表达质粒的对照质粒nc-myc,即用含有细胞转染试剂脂质体2000(lipo2000)和2000ngnc-myc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(7)500ngnrf2-myc组:对nih/3t3细胞转染过表达质粒pcmv6-entry-myc-nrf2,即用含有细胞转染试剂脂质体2000(lipo2000)和500ngpcmv6-entry-myc-nrf2的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(8)1000ngnrf2-myc组:对nih/3t3细胞转染过表达质粒pcmv6-entry-myc-nrf2,即用含有细胞转染试剂脂质体2000(lipo2000)和1000ngpcmv6-entry-myc-nrf2的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h;
(9)2000ngnrf2-myc组:对nih/3t3细胞转染过表达质粒pcmv6-entry-myc-nrf2,即用含有细胞转染试剂脂质体2000(lipo2000)和2000ngpcmv6-entry-myc-nrf2的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h。
然后收集各组细胞,通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)和myc蛋白的表达。
b.实验结果:
nrf2-myc组myc蛋白检测阳性,nc-myc组和其它组myc蛋白检测阴性;与对应浓度的nc-myc组相比,nrf2-myc组nrf2表达明显升高,表明基因过表达成功,实现了nrf2合成的增加。与2000ngnc-myc组相比,2000ngnrf2-myc组nih/3t3细胞clock、bmal1表达显著上调(p<0.05),如图8所示。
c.实验小结:
实验结果表明,增加nrf2的合成可以增加节律蛋白clock、bmal1的含量。
四、减少nrf2的合成可以调节节律蛋白clock、bmal1的节律性:
a.实验方法:
马血清hs诱导细胞同步化技术研究细胞生物节律的常用技术。nih/3t3细胞一般不具有节律性,马血清可诱导nih/3t3细胞同步化,表现为节律蛋白clock、bmal1含量在24h内的高低起伏变化,从而使细胞呈现生物节律。
实验分组如下(n=4):
(1)nc+hs组:对nih/3t3细胞转染非荧光对照nc,即用含有细胞转染试剂脂质体2000(lipo2000)和nc的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h,然后以含50%马血清的dmem培养基培养2h;
(2)nrf2sirna+hs组:对nih/3t3细胞转染nrf2sirna,即用含有细胞转染试剂脂质体2000(lipo2000)和nrf2sirna的细胞转染培养基opti-mem培养细胞6h,然后改用正常培养基dmem培养18h,然后以含50%马血清的dmem培养基培养2h;
(3)hs组:nih/3t3细胞以正常培养基dmem培养24h,然后以含50%马血清的dmem培养基培养2h;
24h内每隔4h采集1次细胞样本(ct0、ct4、ct8、ct12、ct16、ct20共6次),通过免疫印迹技术检测各时间各组细胞内生物节律蛋白clock、bmal1的表达和内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)的表达。
b.实验结果:
与ct8时间点的hs处理组相比,nrf2sirna+hs处理组ct8时间点clock表达显著下降(p<0.05);
与ct4时间点的hs处理组相比,nrf2sirna+hs处理组ct4时间点bmal1表达显著上升(p<0.05),如图9所示。
c.实验小结:
这表明,减少nrf2的合成可以调节节律蛋白clock、bmal1的节律性。
五、促进nrf2的分解可以调节节律蛋白clock、bmal1的节律性:
a.实验方法:
实验分组如下(n=4):
(1)dmso+hs组:用含有0.01%dmso(brusatol溶剂)的dmem培养nih/3t3细胞4h,然后以含50%马血清的dmem培养基培养2h;
(2)brusatol+hs组:用含有brusatol(以0.01%dmso溶解)的dmem培养nih/3t3细胞4h,然后以含50%马血清的dmem培养基培养2h;
(3)hs组:以正常培养基dmem培养nih/3t3细胞24h,然后以含50%马血清的dmem培养基培养2h。
24h内每隔4h采集1次细胞样本(ct0、ct4、ct8、ct12、ct16、ct20共6次),通过免疫印迹技术检测各时间各组细胞内生物节律蛋白clock、bmal1的表达和内参蛋白β-actin(在免疫印迹技术中用于指示总蛋白含量)的表达。
b.实验结果:
与ct4时间点的hs处理组相比,brusatol+hs处理组ct4时间点clock和bmal1表达均显著下调(p<0.05),如图10所示。
c.实验小结:
这些结果表明,促进nrf2的分解可以调节生物节律蛋白clock、bmal1的节律性。
由以上实验可以看出,nrf2蛋白可以调节细胞生物节律蛋白clock、bmal1的含量和节律性,因此nrf2蛋白可以调节生物节律。
实施例2:
硼替佐米btz对生物节律的调节及机制研究,其目的是:以小鼠胚胎成纤维细胞系nih/3t3细胞为研究对象,利用硼替佐米btz激活nrf2,利用全反式维甲酸atra抑制nrf2的活性,研究硼替佐米对生物节律蛋白clock、bmal1的含量和节律性的影响;通过检测nrf2蛋白与clock、bmal1基因的结合情况,研究硼替佐米调节生物节律的分子机制。
过程和结果如下所示。
一、btz可以调节节律蛋白clock、bmal1的含量:
1、不同浓度btz和atra处理对nrf2活性的影响:
a.实验方法
nrf2蛋白被激活(不一定是含量增加)后,进入细胞核,与下游基因结合,促进这些基因表达和蛋白合成,从而增加nrf2下游蛋白的含量。
文献报道,硼替佐米btz可以增强nrf2的活性,全反式维甲酸atra可以抑制nrf2的活性。btz和atra水溶性差,需要以二甲基亚砜dmso溶解。文献报道,0.1%dmso对细胞无损伤,本实验利用终浓度0.01%或0.1%dmso溶解btz,利用终浓度0.1%dmso溶解atra。
实验分组如下(n=4):
实验a:
(1)0.01%dmso组:用含有0.01%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)5nmbtz组:用含有5nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(3)50nmbtz组:用含有50nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(4)500nmbtz组:用含有500nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
实验b:
(1)0.1%dmso组:用含有0.1%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)50nmbtz组:用含有50nmbtz(以0.1%dmso溶解)的dmem培养细胞24h;
(3)100μmatra组:用含有100μmatra(以0.1%dmso溶解)的培养细胞24h;
(4)50nmbtz+100μmatra组:用含有50nmbtz和100μmatra(以0.1%dmso溶解)的dmem培养细胞24h;
然后收集各组细胞,提取胞浆(cytoplasmicextract)和胞核(nuclearextract),利用nrf2活性检测试剂盒(activemotif,50296)检测nrf2的活性。
b.实验结果:
实验a中,与对应的0.01%dmso处理组相比,50、500nmbtz处理24h后,nih/3t3细胞胞浆(p<0.05)和胞核(p<0.01)nrf2活性均显著增强;5nmbtz处理不影响nrf2的活性。
实验b中,50nmbtz处理24h后,nih/3t3细胞胞核nrf2活性显著增强(p<0.01),100μmatra可抑制(p<0.01)btz导致的nrf2活性增强,如图11所示。
c.实验小结:
本实验验证了硼替佐米btz对nrf2活性的增强作用和全反式维甲酸atra对nrf2活性的抑制作用。
2、不同浓度btz对clock、bmal1含量的影响:
a.实验方法:
实验分组如下(n=4):
(1)0.01%dmso组:用含有0.01%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)5nmbtz组:用含有5nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(3)50nmbtz组:用含有50nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(4)500nmbtz组:用含有500nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
然后收集各组细胞,提取胞浆(cytoplasm)和胞核(nucleus),通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、胞浆内参蛋白β-actin(在免疫印迹技术中用于指示胞浆蛋白含量)表达和胞核内参蛋白histoneh3(用于指示胞核蛋白含量)表达。
b.实验结果:
对于胞浆,与对应的0.01%dmso处理组相比,不同浓度btz处理24h后,细胞nrf2表达无明显变化;对于胞核,除500nmbtz处理组显著降低nrf2表达(p<0.05)外,其余浓度处理组胞核nrf2表达无明显变化。
对于胞浆,与对应的0.01%dmso处理组相比,不同浓度btz处理24h后,clock、bmal1表达无明显变化;对于胞核,50、500nmbtz处理后clock表达则显著上调(p<0.05),bmal1表达无明显变化,如图12所示。
c.实验小结:
这些结果表明,btz可以调节节律蛋白clock、bmal1的含量,这种调节可以不依赖于nrf2含量变化。
3、btz和atra对clock、bmal1含量的影响:
a.实验方法
实验分组如下(n=4):
(1)0.1%dmso组:用含有0.1%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)50nmbtz组:用含有50nmbtz(以0.1%dmso溶解)的dmem培养细胞24h;
(3)100μmatra组:用含有100μmatra(以0.1%dmso溶解)的dmem培养细胞24h;
(4)50nmbtz+100μmatra组:用含有50nmbtz和100μmatra(以0.1%dmso溶解)的dmem培养细胞24h;
然后收集各组细胞,提取胞浆蛋白(cytoplasm)和核蛋白(nucleus),通过免疫印迹技术检测细胞内生物节律蛋白clock、bmal1表达、nrf2蛋白表达、胞浆内参蛋白β-actin(在免疫印迹技术中用于指示胞浆蛋白含量)表达和胞核内参蛋白histoneh3(用于指示胞核蛋白含量)表达。
b.实验结果:
对于胞浆或胞核,与对应的dmso处理组相比,不同浓度btz或atra处理24h后,细胞nrf2表达无明显变化。
对于胞浆,与dmso处理组相比,50nmbtz处理显著上调了clock、bmal1表达(p<0.01);对于胞核,单独给予100μmatra处理不影响核内clock、bmal1表达,但可抑制btz所致的表达上调(p<0.05),如图13所示。
c.实验小结:
这些结果进一步表明,btz可以通过不依赖于nrf2含量变化的方式调节生物节律蛋白clock、bmal1的含量。
二、btz可以调节节律蛋白clock、bmal1的节律性:
a.实验方法
实验分组如下(n=4):
(1)dmso组:用含有0.1%dmso(btz和atra的溶剂)的dmem培养nih/3t3细胞24h,然后以含50%马血清的dmem培养基培养2h;
(2)btz组:用含有50nmbtz(以0.1%dmso溶解)的dmem培养nih/3t3细胞24h,然后以含50%马血清的dmem培养基培养2h;
(3)btz+atra组:用含有50nmbtz和100μmatra(以0.1%dmso溶解)的dmem培养nih/3t3细胞24h,然后以含50%马血清的dmem培养基培养2h。
24h内每隔4h采集1次细胞样本(ct0、ct4、ct8、ct12、ct16、ct20共6次),通过免疫印迹技术检测各时间各组细胞生物节律蛋白clock、bmal1的表达和内参蛋白gapdh(在免疫印迹技术中用于指示总蛋白含量)的表达。
b.实验结果:
如图14所示,与dmso处理组相比,btz处理组在ct4、ct12时间点的clock表达水平均显著升高(p<0.05),并可被atra处理所抑制。
与dmso处理组相比,btz处理组在ct4时间点的bmal1表达水平显著升高(p<0.05),并可被atra处理所抑制。
另外,与dmso处理组相比,atra处理组在ct0的bmal1表达水平显著降低(p<0.05)。
c.实验小结:
这些结果表明,btz可以调节生物节律蛋白clock、bmal1的节律性。
三、btz通过促进nrf2与clock、bmal1基因结合调节clock、bmal1:
a.实验方法:
实验分组如下(n=4):
实验a:
(1)0.01%dmso组:用含有0.01%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)5nmbtz组:用含有5nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(3)50nmbtz组:用含有50nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
(4)500nmbtz组:用含有500nmbtz(以0.01%dmso溶解)的dmem培养细胞24h;
实验b:
(1)0.1%dmso组:用含有0.1%dmso(btz溶剂)的dmem培养nih/3t3细胞24h;
(2)50nmbtz组:用含有50nmbtz(以0.1%dmso溶解)的dmem培养细胞24h;
(3)100μmatra组:用含有100μmatra(以0.1%dmso溶解)的dmem培养细胞24h;
(4)50nmbtz+100μmatra组:用含有50nmbtz和100μmatra(以0.1%dmso溶解)的dmem培养细胞24h;
然后收集各组细胞,提取核蛋白,利用染色质免疫共沉淀技术检测nrf2与clock、bmal1基因的结合。
b.实验结果:
如图15所示,与0.01%dmso处理组相比,50、500nmbtz处理24h可增强细胞核内nrf2与clock、bmal1基因的结合(p<0.05)。
与50nmbtz组相比,50nmbtz+100μmatra组nrf2与clock基因的结合显著减弱(p<0.01),nrf2与bmal1基因的结合有减弱的趋势,无统计学差异。
c.实验小结:
这些结果表明,btz通过促进nrf2与clock、bmal1基因的结合调节clock、bmal1。
通过以上实验结果可以看出,硼替佐米btz通过激活nrf2蛋白,促进nrf2与clock、bmal1基因结合,调节节律蛋白clock、bmal1的含量和节律性,从而发挥其调节生物节律的作用。
本发明所要求保护的技术方案核心内容为:硼替佐米btz通过激活nrf2蛋白,促进nrf2与生物节律相关基因结合,调节生物节律蛋白的含量和节律性,从而发挥其调节生物节律的作用。其最重要的技术手段为:(1)通过激活nrf2蛋白调节生物节律;(2)通过促进nrf2蛋白与生物节律相关基因的结合调节生物节律。
同时,还有三种可能相似的方式有可能完成相应目的,具体如下:
1、通过其它方式激活nrf2。
激活nrf2的方式包括nrf2激动剂、解除keap-1对nrf2蛋白的抑制、促进nrf2蛋白发生磷酸化、增加nrf2含量等。
因此,此类替代技术包括但不限于以下4种:
(1)给予本发明(硼替佐米)以外的nrf2激动剂,以激活nrf2蛋白。如叔丁基对苯二酚tbhq、二噻环戊二烯硫酮类化合物d3t、三萜类化合物cddo-im等;
(2)给予keap-1蛋白抑制剂,解除keap-1对nrf2蛋白的抑制(keap-1蛋白一般与nrf2结合以防止nrf2被激活),以间接激活nrf2蛋白。如ml334(lh601a)、keap1-nrf2in1(compound35)等;
(3)给予磷酸激酶激活剂,促进nrf2蛋白发生磷酸化,从而激活nrf2蛋白。如磷脂酰肌醇-3-激酶pi3k激动剂vegf、fgf、pdgf、igf-1和蛋白激酶c(pkc)激动剂佛波肉荳蔻醋酸pma等;
(4)本发明(通过细胞转染过表达质粒pcmv6-entry-myc-nrf2)以外的增加nrf2含量的方式,如增加nrf2mrna水平、减少nrf2蛋白的降解等方式。
2、通过其它方式促进nrf2蛋白与clock、bmal1基因结合。
此类替代技术包括但不限于对蛋白与基因结合所需的环境条件进行的改良,如优化溶液ph值、优化相关酶活性、优化结合辅助因子浓度等。
3、通过nrf2蛋白与其它生物节律相关基因结合,从而调节生物节律。
本发明(clock、bmal1基因)以外的生物节律相关基因包括但不限于cry1、cry2、per1、per2、per3、rev-rebα、rev-rebβ、rorα等。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>中国人民解放军63919部队
<120>nrf2蛋白在制备用于调节生物节律的药物中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>589
<212>prt
<213>nrf2(nrf2)
<400>1
metaspleuileaspileleutrpargglnaspileaspleuglyval
151015
serarggluvalpheasppheserglnargarglysglutyrgluleu
202530
glulysglnlyslysleuglulysgluargglngluglnleuglnlys
354045
gluglnglulysalaphephethrglnleuglnleuaspglugluthr
505560
glyglupheleuproileglnproalaglnhisthrglnsergluthr
65707580
serglyseralaasntyrserglnvalalahisileprolysserasp
859095
alaleutyrpheaspaspcysmetglnleuleualaglnthrphepro
100105110
phevalaspaspasngluvalserseralathrpheglnserleuval
115120125
proaspileproglyhisilegluserprovalpheilealathrasn
130135140
glnalaglnserprogluthrservalalaglnvalalaprovalasp
145150155160
leuaspglymetglnglnaspilegluglnvaltrpglugluleuleu
165170175
serileprogluleuglncysleuasnilegluasnasplysleuval
180185190
gluthrthrmetvalproserproglualalysleuthrgluvalasp
195200205
asntyrhisphetyrserserileprosermetglulysgluvalgly
210215220
asncysserprohispheleuasnalaphegluaspserpheserser
225230235240
ileleuserthrgluaspproasnglnleuthrvalasnserleuasn
245250255
seraspalathrvalasnthrasppheglyaspgluphetyrserala
260265270
pheilealagluproserileserasnsermetproserproalathr
275280285
leuserhisserleusergluleuleuasnglyproileaspvalser
290295300
aspleuserleucyslysalapheasnglnasnhisprogluserthr
305310315320
alaglupheasnaspseraspserglyileserleuasnthrserpro
325330335
servalalaserprogluhisservalglusersersertyrglyasp
340345350
thrleuleuglyleuseraspsergluvalglugluleuaspserala
355360365
proglyservallysglnasnglyprolysthrprovalhisserser
370375380
glyaspmetvalglnproleuserproserglnglyglnserthrhis
385390395400
valhisaspalaglncysgluasnthrproglulysgluleuproval
405410415
serproglyhisarglysthrprophethrlysasplyshisserser
420425430
argleuglualahisleuthrargaspgluleuargalalysalaleu
435440445
hisilepropheprovalglulysileileasnleuprovalvalasp
450455460
pheasnglumetmetserlysgluglnpheasnglualaglnleuala
465470475480
leuileargaspileargargargglylysasnlysvalalaalagln
485490495
asncysarglysarglysleugluasnilevalgluleugluglnasp
500505510
leuasphisleulysaspglulysglulysleuleulysglulysgly
515520525
gluasnasplysserleuhisleuleulyslysglnleuserthrleu
530535540
tyrleugluvalphesermetleuargaspgluaspglylysprotyr
545550555560
serproserglutyrserleuglnglnthrargaspglyasnvalphe
565570575
leuvalprolysserlyslysproaspvallyslysasn
580585
- 还没有人留言评论。精彩留言会获得点赞!