抗冠状病毒中药组合物及其用途的制作方法
抗冠状病毒中药组合物及其用途
发明领域
1.本发明属于药物研究开发领域,具体涉及抗冠状病毒中药组合物及其 用途。
2.发明背景
3.进入21世纪以来,人类面临着冠状病毒的严重威胁,包括2002-2003 年爆发的由sars-cov病毒引起的严重急性呼吸综合征(severe acuterespiratory syndrome,简称sars,又称“传染性非典型肺炎”),2012年 开始的由中东呼吸系统综合征冠状病毒(middle east respiratory syndromecoronavirus,简称mers-cov)引起的中东呼吸系统综合征,以及最近爆 发的由sars-cov-2病毒引起的新冠肺炎(ncp,世卫组织称为covid
-ꢀ
19)。sars-cov、mers-cov和sars-cov-2这些冠状病毒都对人类社 会造成了巨大的威胁,引起了全球关注。
4.尽管冠状病毒对人类社会造成了巨大的威胁,但是迄今仍未发现抗冠 状病毒的特效药物,亦没有令人满意的临床治疗方案。因而研究与开发预 防和治疗冠状病毒疾病的有效药物是医药界面临的一项迫切任务。
5.中药(tcm)在中国已有数千年的使用历史。中药主要是基于植物制 剂中的多种化学成分,其通过多种分子靶点和细胞机制而相互作用并且同 时发挥作用。所述多种成分具有不同的功能:某些可以发挥治疗有效性, 而另外一些可以减少毒性或者提高生物利用度。目前,植物提取物的混合 物已经在世界范围内广泛用于疾病的控制并且越来越被西方国家所接受。 基于中药组合物的抗病毒药物的开发已经有人进行了尝试,但是目前的研 究仍处于初步探索阶段,缺少令人信服的实验数据。因此,抗冠状病毒的 中药组合物也是令人非常期待的。
技术实现要素:
6.因此,提供一种具有抗冠状病毒活性的药物是人们所期望的。尤其是, 人们迫切需要一种能有效对抗sars-cov、mers-cov和sars-cov-2等 冠状病毒的药物或能够有效治疗和预防这些冠状病毒导致的疾病的药物。
7.在第一方面,本发明提供了一种抗冠状病毒中药组合物(即,能用于 预防或治疗冠状病毒感染性疾病或病症的中药组合物),所述中药组合物 为原料药蒲公英、百部、山慈菇、葛根、白术、白薇、可选的地骨皮、可 选的桑白皮的提取物,其中各原料药的相对比例如下:蒲公英为30-70重 量份,百部为20-40重量份,山慈菇为20-40重量份,白薇为20-50重量份, 葛根为20-50重量份,白术为20-60重量份,地骨皮如存在为20-60重量份, 桑白皮如存在为20-60重量份。
8.在第二方面,本发明提供了一种中药组合物在制备用于预防或治疗冠 状病毒所引起的疾病的药物中的用途,其中所述中药组合物为根据本发明 第一方面所述的中药组合物。
9.在第三方面,本发明提供了一种中药组合物在用于预防或治疗冠状病 毒所引起的疾病中的用途,其中所述中药组合物为根据本发明第一方面所 述的中药组合物。
10.在第四方面,本发明提供了一种为有治疗需要的患者治疗或预防冠状 病毒感染性疾病或病状的方法,该方法包括给患者施用有效量的中药组合 物,其中所述中药组合物为根据本发明第一方面所述的中药组合物。
具体实施方式
11.在2018年11月22日公开的pct申请wo2018/210228a1(该专利文 献通过引用全文并入本技术说明书)中公开了一种抗病毒中药组合物,所 述中药组合物为原料药蒲公英、百部、山慈菇、葛根、白术、白薇、可选 的地骨皮、可选的桑白皮的提取物,其中各原料药的相对比例如下:蒲公 英为30-70重量份,百部为20-40重量份,山慈菇为20-40重量份,白薇为 20-50重量份,葛根为20-50重量份,白术为20-60重量份,地骨皮如存在 为20-60重量份,桑白皮如存在为20-60重量份。根据wo2018/210228a1, 体外体内实验表明该中药组合物对于甲型流感病毒(包括h1n1、h7n7和 h9n2病毒等)、寨卡病毒、登革热病毒(包括登革热i型和登革热ii型病 毒)、基孔肯雅病毒等具有显著的抗病毒活性;并且在极高剂量下对恒河 猴连续给药30天后未产生毒副作用,具有很好的安全性。
12.但是,wo2018/210228a1并未公开所述中药组合物对于冠状病毒是否 有效。鉴于流感病毒与冠状病毒的巨大结构差异,以及新冠肺炎爆发期间 公开报道的多种抗流感病毒药物被证明对于冠状病毒无效,本领域技术人 员难以预期wo2018/210228a1所述中药组合物对于冠状病毒是否有效。
13.发明人出人意料地发现wo2018/210228a1中所公开的中药组合物具有 显著的抗冠状病毒效力,尤其是对于sars-cov、mers-cov和sars
-ꢀ
cov-2等多种急性传染病病毒具有高效抗病毒活性,并在临床实验中对于 新冠肺炎表现出显著的疗效。
14.因此,在一些具体实施方式中,本发明提供了一种抗冠状病毒中药组 合物,所述中药组合物为原料药蒲公英、百部、山慈菇、葛根、白术、白 薇、可选的地骨皮、可选的桑白皮的提取物,其中各原料药的相对比例如 下:蒲公英为30-70重量份,百部为20-40重量份,山慈菇为20-40重量份, 白薇为20-50重量份,葛根为20-50重量份,白术为20-60重量份,地骨皮 如存在为20-60重量份,桑白皮如存在为20-60重量份。
15.在一些具体实施方式中,各原料药的优选相对比例如下:
16.蒲公英:优选30-60重量份,更优选35-55重量份,最优选40-50重量 份;
17.百部:优选25-35重量份,最优选25-30重量份;
18.山慈菇:优选25-35重量份,最优选25-30重量份;
19.白薇:优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
20.葛根:优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
21.白术:优选20-55重量份,更优选20-50重量份,最优选30-40重量份。
22.当各药材的重量比在以上优选的范围内时,根据本发明的中药组合物 的抗冠状病毒活性尤其显著。
23.在本发明的抗冠状病毒中药组合物中引入地骨皮和桑白皮后,本发明 的中药组合物更加适合体内应用。例如在本发明的抗冠状病毒中药组合物 中额外加入地骨皮和桑白皮后,其还具有优异的解热作用,而解热作用有 助于增强患者本身对病毒的抵抗力,从而进一步增强了本发明的中药组合 物的抗病毒效力。
tuberosa lour.的干燥块根。
40.在本说明书中,术语“山慈菇”是指兰科植物杜鹃兰cremastraappendiculata(d.don)makino干燥假鳞茎,亦称“毛慈菇”。
41.在本说明书中,术语“葛根”(radix puerariae)是指豆科植物野葛 pueraria lobata(willd.)ohwi或甘葛藤pueraria thomsonii benth.的干燥根。
42.在本说明书中,术语“白术”(rhizoma atractylodis macrocephalae) 是指菊科植物白术atractylodes macrocephala koidz.的干燥根茎。
43.在本说明书中,术语“白薇”(radix cynanchi atrati)是指萝藦科植 物白薇cynanchum atratum bge.或蔓生白薇cynanchum versicolor bge.的干 燥根及根茎。
44.在本说明书中,术语“地骨皮”(cortex lycii)是指茄科植物枸杞 lycium chinense mill.或宁夏枸杞lycium barbarum l.的干燥根皮。
45.在本说明书中,术语“桑白皮”(cortex mori)是指桑科植物桑 morus alba l.的干燥根皮。
46.在本说明书中,术语“提取物”是指通过使用水或有机溶剂提取中药 材原料而获得的提取物。优选地,可以使用提取溶剂如水、c1-c6醇、己 烷、氯仿、乙酸甲酯、乙醚等获得的提取物,更优选地,提取溶剂为水、 甲醇、乙醇、丙醇、丁醇、戊醇、己醇或其组合,最优选地,提取溶剂选 自水、乙醇或其组合。
47.最优选地,本发明所述的中药组合物中的提取物为各原料药的水提取 物和乙醇提取物的组合。这里,“水提取物”是指采用水(包括冷水、温 水或热水)提取中药材获得的提取物。这里,“乙醇提取物”是指采用纯 乙醇或乙醇水溶液提取中药材获得的提取物。
48.优选的,本发明所述的中药组合物中的提取物是经干燥的。最优选的, 本发明所述的中药组合物中的提取物是干燥的粉末或颗粒形式。
49.为了获得提取物组合物形式的本发明的中药组合物,例如,可以用水 对各中药材进行提取,获得水提取物;也可以用各种浓度(例如40-95%) 乙醇水溶液对各种药材进行提取,获得乙醇提取物;也可以将水提取物和 乙醇提取物两者合并在一起,得到水提取物和乙醇提取物的组合。在一些 优选实施方式中,本发明的中药组合物包括水提取物和乙醇提取物的组合。 最优选地,本发明的中药组合物通过包括如下步骤的方法进行制备:
50.1)取蒲公英、百部、白薇、任选的桑白皮以及任选的其他药材,加 醇提取,得醇提取物;
51.2)将步骤1)醇提取物的制备中生成的药渣与葛根、白术、山慈菇、 任选的地骨皮以及任选的其他药材合并,加水提取,将所得水提取液浓缩 后加醇沉淀,取上清液得水提取物;
52.3)合并步骤1)所得醇提取物和步骤2)所得水提取物,经任选的后 处理即得到所述抗冠状病毒中药组合物。
53.优选的,以上步骤所述醇是指乙醇的水溶液,例如为40-95%的乙醇水 溶液、或40-80%的乙醇水溶液。取决于具体实施方式,可以使用60%、 65%、70%、75%、90%等各种浓度的乙醇水溶液。
54.步骤3)所述的“后处理”是本领域公知的常规后处理步骤,本领域 技术人员根据最终想要的组合物形式可以适当确定所需的后处理操作。例 如,如果只需要溶液形式的组
合物作为中间产品,则不需要任何后处理步 骤。另一方面,如果需要固体形式的组合物,则后处理步骤可以包括浓缩、 然后干燥从而获得固体形式的组合物。所述干燥可以采用制药领域常用的 任何干燥方法,例如喷雾干燥、微波干燥、真空干燥等。
55.以上所述步骤1)、步骤2)、步骤3)之前、之后或步骤中间都可以 包括其他额外操作,例如为了操作方便,对步骤1)获得的醇提取物可以 进行浓缩,对步骤2)获得的水提取物也可以进行浓缩。必要时,也可以 进行灭菌操作。
56.本说明书中,用“任选的”修饰的药材、组分等表示该药材或组分根 据需要在某些实施方式中可以存在,而在其他某些实施方式中可以不存在。 类似地,用“任选的”或“任选地”修饰的操作或步骤表示该步骤或操作 根据需要在某些实施方式的方法中可以存在,而在其他某些实施方式的方 法中可以不存在。
57.每一步骤中的具体提取时间、重复次数、乙醇溶液的浓度、提取溶剂 的用量等操作参数可以根据需要进行适当调整。
58.在一些实施方式中,步骤1)所述醇提取物的制备方法为:取蒲公英、 百部、白薇、任选的桑白皮,加6-10倍量乙醇回流提取1-3次,每次1-2 小时,过滤,合并提取液,减压浓缩,即得所述醇提取物。例如,可以加 8倍量40-95%乙醇(例如60%、75%或90%的乙醇水溶液)提取1个半小 时,过滤;然后再加8倍量40-95%乙醇(例如60%、75%或90%的乙醇水 溶液)提取1个半小时,过滤;合并两次所得滤液,即得醇提取物。
59.在一些实施方式中,步骤2)所述水提取物的制备方法为:取所述醇 提取物的制备中生成的药渣与葛根、山慈菇、白术、任选的地骨皮合并, 加6-12倍量水回流提取1-3次,每次1-4小时,过滤,合并所得滤液,浓 缩成稠膏;然后向稠膏中加乙醇水溶液(例如70-95%乙醇水溶液)至乙醇 终浓度为60-80%,静置沉淀12-48小时,过滤除去滤渣,即得所述水提取 物。例如,取所述醇提取物的制备中生成的药渣,与葛根、白术、山慈菇 药材合并,加10倍量水提取2个小时,过滤;然后再加10倍量水提取2 个小时,过滤,合并两次所得滤液,即得水提液;浓缩成稠膏,加75%或 90%的乙醇水溶液至乙醇终浓度为约70%,静置沉淀36小时,过滤除去滤 渣得水提取物;
60.在一些实施方式中,步骤3)所述操作为:合并步骤1)所得醇提取物 和步骤2)所得水提取物,浓缩并喷雾干燥,得到所述抗冠状病毒中药组 合物。
61.本发明的抗冠状病毒中药组合物由蒲公英、百部、山慈菇、葛根、白 术、白薇等药材为原料药制备而成。如果需要,本发明所述的中药组合物 可以包含其他中药材(或中药材提取物)。
62.在另一些具体实施方式中,本发明的中药组合物除了蒲公英、百部、 山慈菇、葛根、白术、白薇、任选的地骨皮和任选的桑白皮外,还可以根 据需要或为了其他目的而含有其他中药材。
63.本发明的中药组合物,作为药物活性物质,需要时可加入药物可接受 的载体或助剂,按照制剂学常规技术制成所需的制剂。制剂中的药物活性 物质,可以是0.1-99.9%(例如1-99%或50-98%或50-95%等),其余作为 药物可接受的载体或助剂。
64.本发明的制剂可以是任何可药用的剂型,包括:颗粒剂,片剂,糖衣 片剂,薄膜衣片剂,肠溶衣片剂,胶囊剂,口服液,滴丸剂,冲剂,丸剂, 散剂,混悬剂,粉剂等。
65.优选的,本发明的制剂是口服剂型,如:颗粒剂,片剂,胶囊剂,丸 剂等。
66.优选的,本发明的药物制剂,以单位剂量形式存在,所述单位剂量形 式是指制剂的单位,如片剂的每片,颗粒剂每袋,胶囊的每粒胶囊等。
67.单位剂量形式的制剂中优选含1%左右至90%左右(例如20%-80%或30-60%)的活性成分。例如,胶囊、片剂或糖衣丸等单次给药的单位剂型 可含有约1mg至约100g(例如10mg至80g、50mg至50g、1g-20g等)的 活性成分。
68.为了制成合适的剂型,作为药物活性物质的本发明的中药组合物可以 任选地与适于给药的无机或有机、固体或液体可药用载体或助剂混合或结 合。例如,适合的载体特别包括填充剂如糖(例如乳糖)、甘露醇或山梨 醇、纤维素制品和/或磷酸钙(磷酸三钙或磷酸氢钙);粘合剂如淀粉糊、 明胶、甲基纤维素和/或聚乙烯乙烯吡咯烷酮;崩解剂如淀粉、羧甲基淀粉、 交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐(如海藻酸纳)。
69.在一些具体实施方式中,本发明还提供了为有治疗需要的患者治疗冠 状病毒感染性疾病或病状的方法,该方法包括给患者施用有效量的根据本 发明任一实施方式的中药组合物。其中,所述患者优选是哺乳动物,尤其 优选人。所述施用优选是经口施用。
70.在一些具体实施方式中,本发明还提供了根据本发明任一实施方式的 中药组合物在治疗患者的由冠状病毒导致的疾病或病状方面的用途。其中, 所述患者优选是哺乳动物,尤其优选人。
71.在一些具体实施方式中,本发明还提供了根据本发明任一实施方式的 中药组合物在制备用于治疗冠状病毒感染性疾病或病症的药物中的用途。 其中,所述疾病或病症优选是哺乳动物、尤其是人的疾病或病症。所述药 物优选是口服药物。
72.在本说明书中,术语“治疗”指对冠状病毒感染性疾病或病症的预防 性或防止性治疗、以及治愈性或缓解性治疗。
73.在本说明书中,术语“冠状病毒”是指套式病毒目(nidovirales)冠 状病毒科(coronaviridae)冠状病毒属(coronavirus)的病毒。冠状病毒 通常是具囊膜(envelope)、基因组为线性单股正链的rna病毒,是自然 界广泛存在的一大类病毒。
74.目前已知的7种可以感染人的冠状病毒分别是hcov-229e、hcov
-ꢀ
oc43、hcov-nl63、hcov-hku1、sars-cov、mers-cov和sars
-ꢀ
cov-2(也被称为2019-ncov),其中sars-cov、mers-cov和sars
-ꢀ
cov-2会引发严重的疾病。本技术的中药组合物特别适合于抗sars-cov、 mers-cov和sars-cov-2。
75.在本说明书中,术语“冠状病毒感染性疾病或病症”是指由冠状病毒 引起或导致的疾病或病症。
76.特别适合于用本技术的中药组合物进行预防或治疗的疾病是sars (严重急性呼吸综合征)、mers(中东呼吸系统综合征)、covid-19 (新冠肺炎,也称ncp)以及它们的相关疾病或并发症。
77.治疗中给药的具体方式和剂量可以由主治医生考虑患者的具体情况, 尤其是年龄、体重、生活方式、活动水平、疾病严重程度等条件来选择。
78.一般情况下,哺乳动物的单次给药量约在1-20,000mg/kg范围内。例 如,对于优选的治疗人类患者来说,当以中药提取物预混物形式给药时, 合适的剂量可以在1-2,000mg/kg、2-1,000mg/kg、5-500mg/kg或10-100 mg/kg范围内。如果需要,也可以把此给药量分成任选地平均的几份服用。 以上提及的剂量可以按照一定间隔重复施用,例如,每天三次、每
天一次、 每周一次等等。
79.本说明书中,“mg/kg”或“mg
·
kg-1”的意思是按照待治疗的哺乳动 物(包括人)的每公斤体重计给药的毫克数,“g/kg”或“g
·
kg-1”的意 思是按待治疗的哺乳动物(包括人)的每公斤体重计给药的克数。
80.以上所提到的本发明的各个具体实施方式和各个特征的优选级和优选 方面可以任意组合,其组合所得各种技术方案都在本发明的范围内。
81.本发明的有益效果表现在:
82.体外药效学试验结果证明本发明的中药组合物具有显著抗冠状病毒作 用,尤其是抗sars-cov、mers-cov和sars-cov-2病毒,临床实验表 明本发明的中药组合物对于新冠肺炎有确切疗效,并且对于临床使用是安 全的。
83.因此,本发明中药组合物可以用于预防和治疗多种冠状病毒感染性疾 病,同时安全性良好且使用方便,将是这一疾病领域的临床治疗的革新性 重大突破。
84.具体实施例
85.以下通过实施例的具体实施方式再对本发明的上述内容作进一步的详 细说明。应当理解,此处所描述的具体实例仅仅用以解释本发明,并不用 于限定本发明。在不脱离本发明的精神和原则之内做的任何修改,以及根 据本领域普通技术知识和惯用手段做出的等同替换或者改进,均应包括在 本发明的保护范围内。
86.以下实施例中所报道的数字是尽可能精确的,但是本领域技术人员理 解由于不可避免的测量误差和实验操作问题,每一个数字都应该被理解为 约数,而不是绝对准确的数字。例如,由于称量器具的误差,关于各实施 例组合物中各药物的重量值,应该理解为其可能具有
±
2%或
±
1%的误差。
87.实施例1:中药组合物的制备
88.重复wo2018/210228a1中的实施例6,获得本技术实施例1的中药组 合物。具体而言,实施例1的中药组合物中所用原料药如下:
89.蒲公英:480g
90.百部:290g
91.山慈菇:290g
92.白薇:320g
93.葛根:320g
94.白术:385g
95.桑白皮:320g
96.地骨皮:385g
97.所用的原料药之中,蒲公英采集自中国河北省,白薇采集自中国河南 省,葛根采集自中国河北省,百部采集自中国广西省,山慈菇采集自中国 四川省,白术采集自中国浙江省,桑白皮采集自中国山东省,地骨皮采集 自中国宁夏回族自治区。
98.实施例1的中药组合物具体制备工艺如下:
99.(1)取480g蒲公英、290g百部、320g白薇、320g桑白皮药材,加8 倍量60%乙醇提取1个半小时,过滤;然后再加8倍量60%乙醇提取1个 半小时,过滤;合并两次所得滤液,即得醇提液;
100.(2)取所述醇提液的制备中生成的药渣,合并320g葛根、290g山慈 菇、385g白术、385g地骨皮药材,加10倍量水提取2个小时,然后再加 10倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90% 乙醇并搅拌直至乙醇终浓度为约70%,静置36小时,取上清液,得水提 液;
101.(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后 即得实施例1中药组合物。所得组合物为棕色粉末状,重量约0.48kg,直 接用于下面的体外及临床实验。
102.下面对实施例1所述中药组合物(该组合物在实验中被称为“受试药物
”ꢀ
或“受试物”)进行各种药效学研究,以验证其药效。
103.实施例2:中药组合物体外抑制sars-cov实验
104.1.实验材料
105.1)受试药物:实施例1中药组合物
106.2)细胞:非洲绿猴肾细胞(vero-e6),由中国军事医学科学院微生 物流行病研究所分子生物学研究室提供。
107.3)病毒:sars病毒(sars-cov)bj-01株,由中国军事医学科学院 微生物流行病研究所病毒室提供。
108.2.cpe法测定病毒对vero-e6细胞的半数毒性浓度(tcid
50
)
109.将vero-e6细胞接种于96孔板,每孔100μl,含细胞2
×
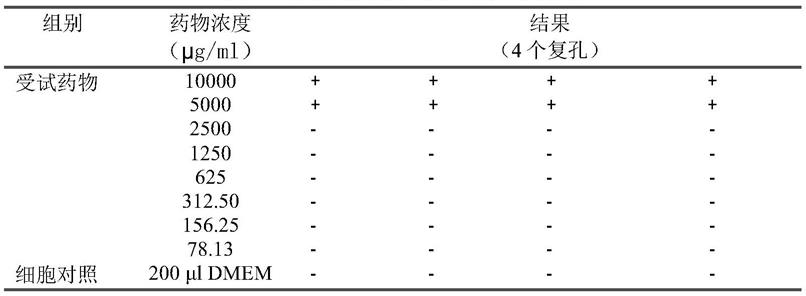
104个/孔,5% 37℃、5%co2培养24小时,细胞长成单层。将病毒原液用培养液依次10 倍稀释共9个浓度加至细胞孔内,每浓度4孔,37℃、5%co2温箱培养。 每天用倒置显微镜观察细胞病变(cpe)。细胞病变在25%以下为+,26% 至50%病变为++,51%至75%病变为+++,76%至100%病变为++++。记录 细胞病变程度(cpe)。用reed-muench法计算病毒半数感染剂量 (tcid
50
)。
110.用cpe法测定sars病毒bj-01株对vero-e6细胞的tcid
50
为10-7
。
111.3.mtt法测定受试药物对vero-e6细胞的半数抑制浓度(tc
50
)
112.将vero-e6细胞接种于96孔板,每孔100μl,含细胞2
×
104个/孔, 37℃培养24小时,细胞长成单层。吸去上清,分别加入5000、2500、 1250、625、312.5μg/ml受试药物,每浓度4孔,设细胞对照(细胞+培养 基)。观察5天后加mtt染色4小时,吸去上清加dmso溶解0.5小时, 用酶联检测仪测定od570nm吸收值,用reed-muench法计算tc
50
。
113.实验表明,受试药物(实施例1中药组合物)的最大无毒浓度为2500 μg/ml,在此浓度下细胞形态与对照细胞相同;用reed-muench法计算受试 药物对细胞的半数抑制浓度tc
50
为3869
±
125μg/ml(三次实验测量值分别 为3750、4000、3856μg/ml)。
114.4.mtt法测定受试药物抗病毒活性
115.将vero-e6细胞接种于96孔板,每孔100μl,含细胞2
×
104个/孔, 37℃培养24小时,细胞长成单层。每孔加100μl sars病毒(100tcid
50
, 即10-5
稀释度),吸附2小时后,弃去含病毒上清。然后在不同的孔中分 别加入2500、1250、625、312.5、156.25μg/ml受试药物,每浓度4孔。同 时设病毒对照(细胞+病毒+培养液)、细胞对照(细胞+培养液)、药物 对照(2500μg/ml的药物+细胞+培养液)。当病毒对照孔细胞病变为++++ 时,记录细胞病变结果(细胞病变在25%以下为+,26%至50%病变为++, 51%至75%病变为+++,76%至100%病变为++++,正常细胞为-),mtt 染色法测定细胞活性。试验重复3次。用reed-muench法计算药物对病毒 的半数抑制浓度ic
50
。
116.三次实验的ic
50
值分别为1327、1127、1357μg/ml,均值为1270
±ꢀ
125μg/ml。则受试药物的治疗指数ti=tc
50
/ic
50
约为3.0。
117.以上测试结果表明实施例1的中药组合物有明显的体外抑制sars
-ꢀ
cov作用。
118.实施例3:中药组合物体外抑制sars-cov-2实验
119.1.实验材料
120.1)受试药物:实施例1中药组合物
121.2)细胞:非洲绿猴肾细胞(vero-e6),由中国医学科学院医学实验 动物研究所病原中心提供。
122.3)病毒:新冠病毒(sars-cov-2),由中国医学科学院医学实验动 物研究所病原中心-80℃保存。
123.2.受试药物细胞毒性实验
124.(1)取无菌96孔培养板,每孔加入100μl浓度为5
×
104个/ml的 vero-e6细胞,37℃、5%co2培养24小时;
125.(2)受试药物用dmem培养基(含2%青霉素-链霉素混合液和 16μg/ml胰蛋白酶)依次等比例系列稀释,原液、1:2、1:4、1:8、1:16、 1:32、1:64、1:128共8个稀释度;
126.(3)弃去96孔培养板中细胞培养液,分别加入稀释好的药物,每孔 100μl,每浓度4个复孔,每孔再加入100μl dmem培养基(含2%青霉素
ꢀ-
链霉素混合液和16μg/ml胰蛋白酶);
127.(4)同时设立细胞对照:每孔200μl dmem培养基(含2%青霉素
ꢀ-
链霉素混合液和16μg/ml胰蛋白酶)加入至长成单层的vero-e6细胞96孔 培养板中,共4个复孔;
128.(5)37℃、5%co2孵箱孵育3天;
129.(6)光学显微镜下观察细胞病变(cpe),细胞有cpe变化记为
ꢀ“
+”,细胞无cpe变化或正常细胞形态记为
“-”
。
130.药物对细胞半数毒性浓度(cc
50
)的计算公式为:
[0131][0132]
其中,a:大于50%细胞病变率的百分数,b:小于50%细胞病变率的百 分数,c:log(稀释倍数),d:log(小于50%细胞病变率所对应的药物浓度)。
[0133]
受试药物分别设置8个浓度进行测试,测定结果显示受试药物在 5000μg/ml及以上浓度对细胞有毒性,结果见表1,根据cc
50
计算公式得 出cc
50
=3548.13μg/ml。
[0134]
表1受试药物毒性测试结果
[0135]
[0136]
3.受试药物抗病毒实验
[0137]
(1)取无菌96孔培养板,每孔加入100μl浓度为5
×
104个/ml的 vero-e6细胞,37℃、5%co2培养24小时;
[0138]
(2)受试药物稀释成5个浓度,每个浓度孔再加入等体积100 tcid
50
病毒,混匀后37℃、5%co2孵箱作用lh;
[0139]
(3)弃去96孔培养板中细胞培养液,加入上述混合液,每受试药物 浓度4个复孔,每孔100μl;
[0140]
(4)同时设立细胞对照、病毒对照;
[0141]
细胞对照:每孔200μl dmem培养基(含2%青霉素-链霉素混合液和 16μg/ml胰蛋白酶)加入至长成单层的vero-e6细胞96孔培养板中,共4 个复孔;
[0142]
病毒对照:每孔100μl dmem培养基(含2%青霉素-链霉素混合液和 16μg/ml胰蛋白酶),再加入等体积100tcid
50
病毒,共4个复孔,37℃ 作用lh,lh后弃去96孔培养板中细胞培养液,加入上述病毒液。
[0143]
(5)细胞在37℃、5%co2孵箱孵育4-5天;
[0144]
(6)光学显微镜下观察细胞病变(cpe),细胞有cpe变化记为
ꢀ“
+”,细胞无cpe变化或正常细胞形态记为
“-”
。
[0145]
药物抑制病毒百分率定义为:
[0146]
药物抑制病毒百分率%=((病毒对照病变率%-测试细胞病变率%)/病毒 对照病变率%)
×
100%
[0147]
药物抑制病毒半数有效浓度(ec
50
)计算公式为:
[0148][0149]
其中,a:大于50%抑制率的百分数,b:小于50%抑制率的百分数,c: log(稀释倍数),d:log(小于50%抑制率所对应的药物浓度)。
[0150]
测试结果见表2,根据ec
50
计算公式,得出药物抑制病毒半数有效浓 度ec
50
=1766.04μg/ml。另外,受试药物的选择指数si=cc
50
/ec
50
约为2。
[0151]
表2受试药物抗sars-cov-2效果
[0152][0153]
以上测试结果表明实施例1的中药组合物有明显的体外抑制sars
-ꢀ
cov-2作用。
[0154]
实施例4:中药组合物临床治疗新冠肺炎(covid-19)的研究
[0155]
为了验证本发明的中药组合物对于(由sars-cov-2病毒感染导致的) 新冠肺炎是否具有治疗效果,以中国湖北省某市定点医院收治的61名新冠 肺炎病人(含无症状感染者)作为研究对象,采用平行对照、非双盲的方 式进行研究。
[0156]
1、研究方法
[0157]
1.1实验周期
[0158]
自2020年2月1日至2020年2月20日。
[0159]
1.2—般情况及分组情况
[0160]
61例患者均来自于湖北某市新冠肺炎定点收治机构。所有患者均经流 行病学史调查,并进行血常规及生化、ct、核酸检测等。其中a组21例 为无症状感染者,患者无发热、咳嗽等症状,但核酸检查阳性。b组和c 组均为新冠肺炎患者,其中b组20例患者平均年龄(45
±
15.56)岁,c组 20岁患者平均年龄(50.4
±
18.26)岁,无统计学差异(p>0.05)。
[0161]
各组干预措施如下:
[0162]
观察组(a组):针对a组无症状感染者,仅单纯给予实施例1组合 物,剂量为1.5g/次,3次/天。
[0163]
实验组(b组):给予实施例1组合物,剂量为1.5g/次,3次/天;同 时,根据《新型冠状病毒肺炎诊疗方案(第五版)》的方案,给予相应的标 准治疗方案处理,包括氧疗、抗病毒、抗菌等。
[0164]
常规对照组(c组):根据《新型冠状病毒肺炎诊疗方案(第五版)》 的方案,给予相应的标准治疗方案处理,包括氧疗、抗病毒、抗菌等。
[0165]
a组的21例无症状感染者,单独观察实施例1组合物的效果;b组20 例与c组20例作为同期平行对照。
[0166]
1.3纳入与排除标准
[0167]
纳入标准:1)符合《新型冠状病毒肺炎诊疗方案(第五版)》以及《新 型冠状病毒肺炎防控方案(第四版)诊断标准,诊断为新冠肺炎(covid
-ꢀ
19);2)年龄在18至80岁之间;3)按诊疗标准属轻型或普通型,或无症 状感染者。
[0168]
排除标准:1)不能配合治疗方案者;2)有心、肝、肾等其他脏器严重 基础疾病者;3)孕妇。
[0169]
1.4统计分析方法
[0170]
用spss24.0进行统计分析,计量资料用t检验比较,计数资料用卡方 检验比较。以p值小于0.05作为显著性依据。
[0171]
2、实验结果
[0172]
2.1观察组(a组)总体转阴率
[0173]
a组21例中,5天后共18例转阴,总体阴转率85.71%。所有患者在 治疗期间未观察到不良反应,无新症状出现。
[0174]
2.2症状改善情况:
[0175]
下面的表3示出了实验组和对照组两组症状改善情况的比较。
[0176]
表3两组症状改善情况的比较
[0177]
[0178]
与对照组相较,实验组总体症状改善率(97.06%vs 38.71%)明显为 优,且p<0.001,在统计学上具有极为显著性差异。其中尤其对于发热的 效果明显。新冠肺炎常见的乏力症状由于在b组总共才2例,故未进行统 计分析。
[0179]
2.2平均退热时间:
[0180]
b组平均退热时间为2.35
±
0.72小时,而c组平均退热时间为7.36
±
[0181]
1.52小时,p=0.0000。这说明,对对照组比较,实验组平均退热时间明显 缩短,在统计学上具有极为显著的差异。
[0182]
2.3治愈出院率
[0183]
下面的表4示出了实验组和对照组两组治愈出院率的比较。
[0184]
表4两组治愈出院率的比较
[0185][0186]
与对照组相较,实验组治愈率(70%vs 35%)更高,且差异具有统计 学意义(p<0.05);与对照组相较,实验组有效率(90%vs 60%)更高, 且差异具有统计学意义(p<0.05)。
[0187]
2.4重症转化率
[0188]
对两组患者的重症转化进行比较,结果如下:
[0189]
表5两组治愈出院率的比较
[0190][0191]
实验组重症转化较对照组更少,差异具有显著性意义(p<0.05)。
[0192]
3、研究结论
[0193]
在观察组的21例,共18例转阴,总体阴转率85.71%,且所有患者在 治疗期间未观察到不良反应。
[0194]
在总体症状改善率(97.06%vs 38.71%,p<0.001)、平均退热时间 (2.35
±
0.72vs 7.36
±
1.52,p<0.001)、有效率(90%vs 60%,p<0.05)、 治愈率(70%vs 35%,p<0.05)、重症转化率(0%vs 20%)等方面,以 实施例1中药组合物进行治疗的实验组均明显优于对照组,在改善发热、 乏力、咳嗽等新冠肺炎相关主要症状方面效果明显,总有效率及治愈率亦 明显高于对照组;尤其在退热方面的作用十分显著,平均退烧时间较常规 治疗明显缩短,对观察到的14例患者全部有效(100%),且退烧后无反 弹。
[0195]
因此,本发明的中药组合物对于临床使用是安全的,且对于新冠肺炎 有确切疗效,无论从提高转阴率、改善症状,还是提高有效率、治愈率等 方面均有显著作用,尤其是退热作用,起效快而稳定无反弹。
[0196]
尽管上文已经对具体实施例进行了具体描述,本领域的技术人员可以 理解的是,在不脱离本发明的精神的范围内可进行形式和细节上的改变和 组合。可以理解,在不脱离本文披露的和根据所附权利要求所解释的较宽 的范围内,可以对不同实施例的适应性描述做出各种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1