PHBVHHx纳米缓释载体及其应用的制作方法
本发明属于纳米药物领域,涉及一种缓释纳米载体及其在治疗疾病中的应用。
背景技术:
自身免疫病(ads)是指机体对自身抗原发生广泛免疫反应而导致自身组织损害的疾病,主要包括类风湿关节炎(ra)、系统性红斑狼疮(sle)、干燥综合征、多发性硬化症、硬皮病等。其中,sle是一种慢性多系统自身免疫性疾病,其特征主要为自身抗原不耐受,并产生自身抗体,导致器官、组织的自我攻击。
sle治疗药物主要包括非固醇类抗炎药(如塞来昔布)、糖皮质激素、免疫抑制剂(如霉酚酸、硫唑嘌呤)、激素等。这些药物主要以化学小分子药物为主,能够缓解部分病痛,控制病情恶化,但同时也存在多种问题,例如:分子量小,易被肝脏、肾脏清除,体内半衰期短;体内药物浓度变化大,副作用明显,病人依从性差;药物通常为疏水性,不易溶于水,常需要增溶在有机溶剂中;易产生耐药性,治疗效果有限等。解决这些临床问题的有效方法之一是将化学小分子药物装载于纳米载体。纳米药物一方面可以通过高通透性和滞留效应被动靶向到病灶部位,降低系统性毒性;另一方面,由于纳米载药体系的逐步降解、药物的缓慢释放,可以间接地提高药物的生物利用度,延长药物作用时间,大幅度提高药物治疗效果。
目前,纳米药物广泛应用于癌症和病毒性疾病的治疗,但很少用于自身免疫性疾病,尤其是sle。此外,现有的纳米载体存在缺陷,如生物相容性差、免疫原性高、生产成本高、原材料有限等;因此,目前只有阿布拉氧烷、多西林、oncaspar和feridex几种纳米药物被美国食品和药物管理局(fda)批准用于癌症治疗,而没有一种纳米药物被批准用于sle疾病的缓解。
聚乳酸(pla)和共聚物聚乳酸-羟基乙酸(plga)作为药物载体已经被开发出来。然而,这些材料有两大缺点,阻碍了它们的广泛应用。首先,乳酸(la)的快速释放导致体内生物降解速度快,循环半衰期短。其次,la的降解往往伴随着非感染性炎症,使得周围的细胞难以生存。
聚羟基烷酸酯(phas)是一类由多种细菌在过量碳源和氮源条件下合成的非细胞毒性聚酯,具有疏水性、光学异构性、生物降解性和生物相容性。天然线型聚酯在医学领域越来越受到重视,尤其是在药物传递方面。pha的降解产物3-羟基丁酸酯(3hb)的离解常数(pka)为4.70,比la(pka=3.08)的离解常数(pka)要小得多,对周围细胞的生长的影响较少。pha能够缓慢释放3hb,有效延长其循环半衰期。此外,3hb在生理活动中也起着重要作用:(1)3hb是酮体的重要组成部分,是葡萄糖的替代品;(2)3hb可以通过l型钙通道增加细胞内钙,这在骨修复中是重要的;(3)pha可减少ros的生成,抑制细胞凋亡,稳定线粒体膜电位。基于这些特性,pha是一种无毒、生物相容、可生物降解的生物材料,可用于pla替代的,特别是在自身免疫性疾病治疗领域。
技术实现要素:
为了解决上述问题,本发明提供一种基于新型生物相容性pha三聚体聚(3-羟基丁酸-3-羟基戊酸-3-羟基己酸)(phbvhhx)的药物递送纳米载体,用于疏水性化学小分子药物的缓慢释放。
本发明提供聚(3-羟基丁酸-3-羟基戊酸-3-羟基己酸三聚物)作为纳米缓释载体在递送药物和/或示踪剂中的应用。
其中,所述的药物为疏水性的药物,优选为疏水性小分子化学药物、多糖、肽类物质和/或蛋白质。
其中,所述的疏水性小分子化学药物为治疗自身免疫性疾病、肿瘤、细菌性或病毒性传染病、退行性神经疾病、器官移植后免疫抑制等重大疾病的药物。
其中,所述的自身免疫性疾病包括但不限于类风湿关节炎(ra)、系统性红斑狼疮(sle)、干燥综合征、多发性硬化症、硬皮病等。
其中,所述的治疗自身免疫性疾病的药物种类包括但不限于非固醇类抗炎药,优选为塞来昔布、布洛芬、洛索洛芬、萘普生、双氯芬酸、吲哚美辛、美洛昔康、氯诺昔康、萘丁美酮、对乙酰氢基酚,激素类药,优选为氢化可的松、泼尼松、甲泼尼龙、地塞米松、倍他米松、氟美松,免疫抑制剂类药物,优选为环磷酰胺、环孢素、硫唑嘌呤。
所述的治疗肿瘤、细菌性或病毒性传染病、退行性神经疾病或器官移植后免疫抑制的药物包括但不局限于苯丁酸氮芥、卡莫司汀、马法兰、马利兰、氮烯咪胺、甲氨蝶呤、阿糖胞苷、氟达拉滨、吉西他滨、氟尿嘧啶、羟基脲、阿霉素、柔红霉素、平阳霉素、放线菌d、多柔比星、表柔比星、长春新碱、长春地辛、高三尖衫酯碱、紫杉醇等。
所述的示踪剂为疏水性示踪剂,包括但不局限于香豆素、cyanine7、吖啶橙(acridineorange,ao)、溴化乙锭(ethidiumbromide,eb)、碘化丙啶(propidiumiodide,pi)、dapi、hoechst、dii、dio、did、dir。
其中,聚(3-羟基丁酸-3-羟基戊酸-3-羟基己酸三聚物)的平均分子量分布范围可以从100到1000,0000。
在本发明一个实施方案中,通过乳浊法将所述药物和/或示踪剂包裹在聚(3-羟基丁酸-3-羟基戊酸-3-羟基己酸三聚物)内。
本发明以硫唑嘌呤(aza)为例,优化该免疫抑制剂的生物分布并提高其治疗效果。本发明以phbvhhx作为载体,成功制备aza-phbvhhx纳米药物(以下均标记为aza-pha),并应用在sle小鼠的治疗。与原药aza相比,该纳米药物在sle小鼠体内的治疗效果增强,副作用减少。
本发明的药物还与pla纳米药物作了对比。aza-pha和aza-pla纳米颗粒具有相似的水合半径和抗细胞增殖活性,但展现出更优异的体外缓释效果和体内驻留效果,并且能更有效的抑制sle疾病的进一步恶化。
本发明以pha家族中生物相容性优异的新型材料聚(3-羟基丁酸-3-羟基戊酸-3-羟基己酸三聚物)(phbvhhx)为原料,建立通用的药物缓释平台。本发明以常用的治疗自身免疫病的药物aza为例,成功将aza负载在phbvhhx纳米载体上,与原药aza和对照aza-pla纳米颗粒相比,aza-pha纳米颗粒不易被肾脏排出,并能够有效在脾脏中累积。在sle患病小鼠体内实验中,aza-pha纳米颗粒能够显著降低患病小鼠尿蛋白、igg、抗dsdna和ana的浓度,且组织学或血液学毒性较小。本发明结果表明,phbvhhx具有良好的生物相容性和生物可降解性,是一种有效和安全的载体,可以提高治疗效果,减少药物的副作用,同时也可以用于其他疏水性小分子药物的负载和其他疾病的治疗。
附图说明
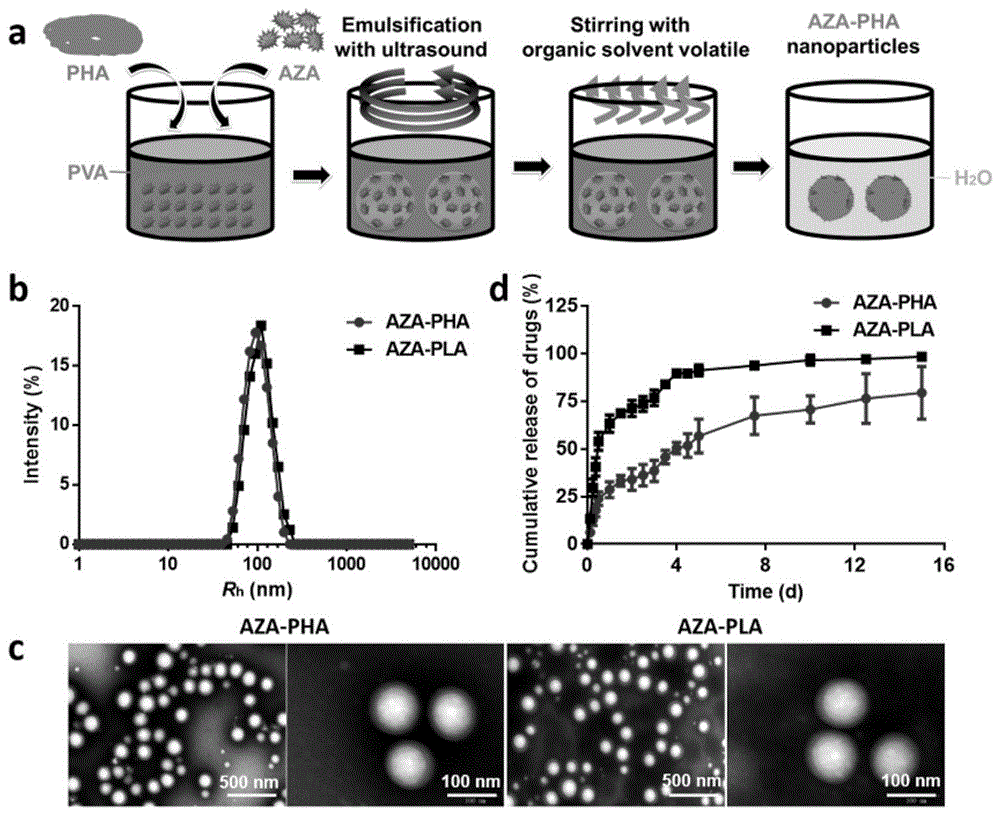
图1所示为aza-pha纳米颗粒的合成及物理化学性质表征。(a)乳浊法合成aza-pha技术路线图。(b)dls分析aza-pha纳米颗粒。(c)aza-pha和aza-pla纳米颗粒电镜图。(d)aza-pha和aza-pla纳米粒在37℃、ph7.4时的药物释放动力学。
图2所示为aza-pha和aza-pla纳米颗粒在jurkat(a)和raji(b)细胞摄取情况。细胞核用dapi染成蓝色;细胞膜用麦胚凝集素染成红色;aza-pha和aza-pla用香豆素6标记成绿色。
图3所示为aza-pha和aza-pla纳米颗粒对jurkat细胞(a)和raji细胞(b)的体外细胞毒性情况。
图4所示为pha和pla纳米颗粒对jurkat细胞(a)和raji细胞(b)的体外细胞毒性情况。
图5所示为aza-pha和aza-pla纳米颗粒在mrl/lpr小鼠中的组织分布情况。(a)纳米颗粒在器官内的动态荧光图像(1:肾脏;2:心脏;3:脾脏;4:肠道;5:胰腺;6:肺;7:胃;8:肝脏)。(b)静脉注射后2、6、24和48h,纳米颗粒在肝、肾和脾中的分布情况。
图6所示为aza-pha纳米颗粒在mrl/lpr小鼠的治疗作用。(a)小鼠尿蛋白的浓度。(b)小鼠血浆中ana滴度。(c)小鼠血浆中抗dsdna滴度。(d)小鼠血浆中igg的浓度。(e)肾脏和脾脏的h&e和免疫荧光染色。肾脏:细胞核用dapi染成蓝色;igg用抗igg-abs染成绿色;igm用抗igm-abs染成红色;c3用抗c3-abs染成白色。箭头表示肾小球。脾脏:细胞核用dapi染成蓝色;b220用anti-b220-abs染成绿色,代表各发育阶段的b细胞、活化b细胞或t、nk细胞亚群;gl7用anti-gl7-abs染成红色代表前b细胞和未成熟b细胞、活化t、b细胞。b220和gl7的重叠显示脾脏生发中心。
图7所示为aza-pha纳米颗粒的体内毒性分析。(a)肝功能alt和ast的临床生化指标。(b)肝脏的h&e染色。(c)肾功能cre和bun的临床生化指标。(d)红细胞和白细胞的变化情况。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1:aza-pha纳米颗粒的合成及物理化学性质表征
本发明采用乳浊法制备了aza-pha纳米粒子。如图1所示,1gphbvhhx(bluepha生物技术有限公司)和100mgaza(百灵威)在室温下溶于30ml二氯甲烷中6h,形成有机相。200ml0.5%聚乙烯醇(pva,87-89%,平均分子量13000-23000)溶液在80℃下缓慢搅拌2h,作为水相。将有机相倒入水相,并用超声波(输出功率的95%)处理5min,冰水浴,形成乳液。随后,在室温下以200-400rpm搅拌该乳液8h,蒸发溶剂并将aza固化负载在phbvhhx内。为了去除残留的pva和未负载的aza,12000rpm离心10分钟,在ddh2o中洗涤3次,最后将纳米颗粒分散在pbs中。作为对照,用相同的方法制备了aza-pla纳米颗粒。
利用离心法测定aza-pha纳米颗粒的包封率,即包封的aza与合成过程中使用的总aza(w0)的比值。在制备aza-pha纳米颗粒的过程中,12000rpm离心10分钟,收集上清液,上清液中未负载在pha纳米颗粒的aza量(w1)可通过酶标仪(thermoscientific)测出,其od值为378nm。不同浓度溶解在0.5%pva溶液可作为标准曲线。包封率计算公式为:包封率(%)=(w0-w1)/w0×100%(w0为制备aza-pha纳米颗粒时使用的总aza,w1为上清液中未包封的aza,w0-w1为已包封的aza)。
动态光散射(dls)测定纳米颗粒的水合半径可通过malvernzetasizernanozs90粒径仪进行测量,激光波长为633nm、散射角为90°。
纳米颗粒的形貌可通过透射电子显微镜(jem1200ex)进行表征,加速电压为120kv。样品溶解在5mmpbs、25mmnacl、ph7.4中,1%水性磷钨酸进行负染色。
将样品置于透析袋(3kmwco)中,在10mmpbs、150mmnacl、ph7.4,黑暗环境中进行透析,进而测定aza在纳米颗粒aza-pha的释放动力学情况。通过在特定时间点收集透析液,12000rpm离心10min,酶标仪测定上清液中释放的游离aza(w3),aza释放动力学计算公式为:释放率(%)=(w2-w3)/w2×100%(w2为aza-pha纳米颗粒中的总aza,w3为透析过程中释放的游离aza)。
如图1b,动态光散射显示了aza-pha和aza-pla纳米颗粒的水合半径(rh)分别为95.7nm和100.1nm。透射电子显微镜(tem)进一步确认了尺寸和形貌(图1c)。在pbs中透析15天,观察纳米颗粒的可控释放(图1d)。aza-pha纳米颗粒中,在初始30分钟内迅速释放50%的aza,在第4天aza几乎完全从pla载体中释放出来。相比之下,pha-aza纳米颗粒表现出不同的释放模式:在最初的30分钟内只有约20%的aza被释放,随后在15天内缓慢但相对稳定的释放速率;在第4天,累积释放值仅为50%。aza-pha纳米颗粒释放aza的速度缓慢且可控,毒性相对较低。
实施例2:aza-pha纳米颗粒体外细胞摄取表征
本发明利用jurkat和raji细胞研究纳米颗粒在细胞内的吞噬行为。在含有10%胎牛血清和1%青霉素/链霉素的rpmi-1640培养基(gibco)中培养jurkat和raji细胞(细胞从中国医学科学院肿瘤医院获得)。以每孔5000个细胞的密度接种在24孔板(nunc)中过夜。如上所述制备aza-pla-香豆素6(aza-pla-coumarin6)和aza-pha-香豆素6(aza-pha-coumarin6)纳米颗粒。香豆素6是一种荧光化合物,可用于追踪细胞中的纳米颗粒。将细胞与20μmaza-pla-香豆素6和aza-pha-香豆素6一起孵育,在特定时间(15min、30min、1h、2h、4h、8h、24h和36h)收集细胞,pbs洗涤三次,悬浮在100μlpbs中,并滴在涂有聚赖氨酸的载玻片上。用4%多聚甲醛固定后,用2μg/ml小麦胚芽凝集素(wheatgermagglutinin)alexafluor594和2μg/mldapi分别对细胞膜和细胞核染色15分钟。将带有细胞的载玻片用pbs洗涤四次,凝胶固定,并用lsm710激光扫描共聚焦显微镜(carlzeiss)成像。dapi、香豆素6和麦胚凝集素的激发和发射波长分别为364/454nm、466/504nm和590/617nm。
由于系统性红斑狼疮是一种以t/b细胞过度活化为特征的自身免疫性疾病,本发明使用人类t淋巴细胞jurkat细胞和人类伯基特淋巴瘤raji细胞研究了细胞内递送过程。如图2,通过共聚焦激光扫描显微镜观察可以看到,在最初的30分钟内,aza-pha纳米颗粒(绿色)很少与细胞膜结合(红色)。1小时后,药物在细胞膜上变得清晰可见,随着孵育时间的增加,更多的颗粒聚集在细胞核周围的细胞质中,直到24小时。aza-pla纳米颗粒显示出类似的细胞吞噬行为。这些结果表明,t细胞和b细胞能够有效吞噬和摄取aza-pha和aza-pla纳米纳米颗粒。
实施例3:aza-pha纳米颗粒体外活性表征
aza是一种抑制t和b淋巴细胞增殖的免疫抑制剂。本发明中,我们使用jurkat或raji细胞表征纳米颗粒的体外活性。在96孔板中,在96孔板中接种一定浓度的细胞悬浮液(50μl/孔,7,500个细胞)。将样品进行系列稀释(4000、2000、1000、500、250、125、62.5、31.3、15.6、7.81和3.91μm)至50μl,纯培养基和培养基处理细胞的对照组分别被定义为0%和100%细胞活力。孵育48小时后,使用细胞增殖测定试剂盒(promega)通过mtt测定来定量细胞生存力。3h后用酶标仪测定各孔490nm波长的吸收值,比较不同样品处理后细胞增殖的程度。数据拟合和ic50值计算采用graphpadprism5.0软件。
如图3所示,值得注意的是,aza对t细胞和b细胞具有明显的细胞毒性,其半数最大抑制浓度(ic50)分别为68.02和48.72μm。aza-pha纳米颗粒对jurkat细胞的ic50值为193.4μm,对raji细胞的ic50值为147.2μm,分别是aza的2.84和3.02倍。纳米载体的毒性或生物相容性也是临床应用的重要指标之一。我们研究了纳米载体的毒性,发现pha和pla即使在非常高的浓度为5mg/ml时,均未显示任何毒性(如图4)。以上结果表明,纳米载体pha对t/b细胞具有很好的安全性,并能很好地保持纳米复合物形式的化学药物的细胞毒性。
实施例4:aza-pha纳米颗粒在组织中的分布情况
为了分析纳米颗粒的各组织中的分布情况,本发明按上述制备方法合成了标记有菁7(cyanine7,cy7)的纳米颗粒。在活体成像中,cy7具有远波长,能够利用生物组织的近红外窗口提高组织的透明度,降低光谱范围内的背景。平均体重约25g的雌性mrl/lpr小鼠(9周)静脉注射5mg/kgaza-pla或aza-pha纳米颗粒,注射2、6、24、48h后处死小鼠,取肝、心、肾、脾、肺、肠、胃、胰腺等主要脏器。使用ivisluminaii活体成像系统(caliperlifesciences)对器官的荧光值进行表征。cy7的激发波长为749nm,发射波长为767nm。
如图5所示,纳米颗粒在肝、肾、肠和脾中积累,但在心、肺、胃和胰腺中很少保留,表明aza-pha和aza-pla纳米颗粒能够靶向肝、肾和脾(图5a)。通过量化器官的荧光值,特别是肝、肾和脾的荧光值时,我们发现这两种颗粒在肝脏中累积情况相似(图5b)。然而,在肾脏中,aza-pla纳米颗粒2h、6h和24h在肾脏中浓度是aza-pha纳米颗粒纳米浓度的1.52-、1.53-和1.83倍,表明aza-pla从肾脏的清除速度较快(图5b)。给药后2小时,脾脏中的aza-pha和aza-pla纳米粒的初始浓度非常高(图5b)。然而,aza-pha纳米粒显示出更有效的体内滞留效果,在6h、24h和48h时,脾脏中的aza-pha纳米颗粒是aza-pla纳米颗粒的1.74-、2.56-和1.88倍。以上结果表明,与aza-pla纳米颗粒相比,aza-pha纳米颗粒在体内清除速率较慢,能够有效停留在体内发挥作用。
实施例5:aza-pha纳米颗粒在mrl/lpr小鼠的治疗作用
本发明选择sle模型小鼠mrl/lpr小鼠表征纳米颗粒的体内治疗效果。当尿蛋白水平达到0.6~1mg/ml(~9周)时,雌性mrl/lpr小鼠随机分为6组(n=5~8/组),从10~17周开始每周静脉注射5mgaza当量/kgpbs、aza、aza-pla或aza-pha。称重小鼠,每周收集尿液。根据小鼠白蛋白elisa试剂盒(bethyllaboratoriesinc.)的指示监测尿蛋白。血液每两周从尾静脉收集一次。4℃静置30min,2000×g离心15min后,用小鼠抗核抗体(ana)elisa试剂盒(alphadiagnosticintl.inc.)、抗双链dna抗体elisa试剂盒(dsdna)(alphadiagnosticintl.inc.)和iggelisa试剂盒(alphadiagnosticintl.inc.)分别测定小鼠血清中ana、抗dsdna和igg的浓度。对照组mrl/mpj小鼠在相同条件下饲养,但不给予任何实验处理。
体内药效实验结束后(19周),处死小鼠,取肝、脾、肾等主要脏器,用4%中性多聚甲醛(pfa)溶液固定。石蜡包埋后,肝、脾、肾切片4μm厚,贴于聚赖氨酸玻片上,苏木精-伊红染色。所有切片的形态学观察和成像使用nikoneclipse80i。
脾脏和肾脏的pfa固定后的石蜡包埋切片也用于免疫荧光染色。切片按照标准程序脱水和水合,然后用0.01m、ph6.0柠檬酸进行微波抗原恢复。用pbs清洗两次后,用0.4%tritonx-100渗透10分钟,用封闭缓冲液(2%fbs,0.2%bsa,ph7.4)封闭60min,抗体4℃孵育过夜。抗体使用及浓度如下:肾脏染色使用山羊抗鼠igg-fc(fitc)(1:100,abcam),山羊抗鼠igmmu链(1:200,alexa
如图6所示,mrl/lpr小鼠在第九周开始出现蛋白尿(0.6~1.0mg/ml),预示小鼠开始发病。每周注射aza、aza-pla或aza-pha纳米颗粒。与aza相比,aza-pha纳米颗粒能够有效降低小鼠尿(图6a)。治疗17周后,用aza-pha纳米颗粒治疗的小鼠尿蛋白值为1.92mg/ml,分别是aza(3.20mg/ml)和pbs(3.91mg/ml)低1.67倍和2.04倍。该结果与sle疾病活动的主要血清指标抗核抗体(ana)、抗双链dna抗体(anti-dsdna)和igg水平的显著降低是一致的(图6b-d)。治疗7周后,aza-pla治疗的小鼠的ana、抗dsdna和igg是aza-pha治疗的小鼠的1.33-、1.39-和1.40倍(图6b-d)。
此外,苏木精-伊红(h&e)染色显示,aza处理的mrl/lpr小鼠肾脏出现严重的肾小球系膜细胞增生、炎性细胞浸润和毛细血管环压迫,脾脏生发中心明显扩张,淋巴细胞浸润增加,白髓增大;而aza-pha纳米颗粒治疗小鼠的肾脏和脾脏显示出所有实验组中损伤最轻,与对照mrl/lpj小鼠相比无显著差异(图6e)。免疫荧光染色显示,aza-pha纳米粒处理的mrl/lpr小鼠肾小球igg、igm和补体3(c3)沉积减少,脾生发中心减少(图6e)。这些数据均表明,aza-pha纳米颗粒具有比aza和aza-pla纳米颗粒在治疗sle方面中更优异的疗效。
实施例6:aza-pha纳米颗粒安全性表征
为了评价aza-pha纳米颗粒的生物安全性,本发明对小鼠血液学参数和生化指标进行了测定。在小鼠体内实验结束时,采集全血,用血液分析仪(sysmex)测定血液学参数,包括白细胞(wbcs)和红细胞(rbcs)的数量。采集血清,用日立全自动生化分析仪(hitachi)测定血清天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、肌酐(cre)和血尿素氮(bun)的临床生化指标。
如图7a,aza-pha纳米颗粒治疗后小鼠肝功能的指标,丙氨酸转氨酶(alt)和天冬氨酸转氨酶(ast)的临床生化指标低于aza治疗后小鼠的指标。肝脏的h&e染色显示,aza治疗后的小鼠的肝脏中广泛分布着肝小叶紊乱和肝细胞坏死,而aza-pha纳米颗粒组中只观察到少量坏死细胞,尽管在药物分布实验中肝脏中积聚了大量纳米颗粒(图7b)。此外,各实验组中,在肾功能方面指标包括血清肌酐(cre)和血尿素氮(bun)水平以及血液学指标包括白细胞(wbc)和红细胞(rbc),均没有显著差异(图7c-d)。综上所述,aza-pha纳米颗粒具有比aza具有更好的生物安全性和更低的毒性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!