一种自交联透明质酸和明胶复合水凝胶注射剂及其制备方法和应用与流程
本发明属于生物材料技术领域,具体为自交联透明质酸和明胶复合水凝胶注射剂及其制备方法和应用。该注射剂可用于组织工程及再生医学,在组织再生、创伤修复等方面具有良好的应用前景。
背景技术:
自从组织工程的概念被提出以来,研究者们已经将其广泛地应用在生物医学的多个领域,不仅在动物模型中构建出了各种各样的工程化组织和器官,而且也将其应用于临床,并取得了一定的成效。
组织工程技术与传统的器官移植相比,不会或很少发生免疫排斥反应,还避免了供体来源不足以及伦理方面的问题,并且有望实现组织和器官的重建,从而解决临床中的难题。在组织工程中,有三个要素最为重要,分别是种子细胞、支架材料和生长因子,组织工程的核心是要构建出包含细胞和生物材料的三维复合体,这与传统的二维培养有着很大的区别。三维培养通过生物材料支架来重建受损组织的形态,可以形成在形态、结构和功能上与天然组织相似的工程化组织,进而对病损组织进行重建。支架材料作为组织工程的三要素之一,在重建受损组织和器官的过程中发挥着重要的作用。在早期,大多选择人工合成的聚合物作为支架材料使用,虽然人工聚合物种类丰富,性能可控,但其生物相容性差,缺少细胞的粘附位点,没有生物学功能,导致细胞在支架内难以正常生长。
透明质酸、胶原等作为细胞分泌的天然物质,具有良好的生物相容性和生物学功能,但结构简单,在体内的降解速度过快,力学强度不足,限制了它们在组织工程中的应用。水凝胶是通过单个聚合物链的物理或化学交联形成,具有三维的网络结构,能够很好地模拟细胞外基质,是理想的细胞支架材料。同时水凝胶能够吸收大量的水而在水中不溶解,具有一定的力学强度,内部的孔隙结构有利于营养物质和氧气的传输以及代谢产物的排出。对于应用于组织工程的水凝胶来说,不仅要有良好的生物相容性,还要能够随着新生组织的生成逐渐降解。
因此,提供一种水凝胶,具有良好的生物相容性和力学性能,并且可降解,能够维持多种细胞的正常形态和生理功能,并促进其增值和发育,成为了本领域技术人员亟待解决的问题。
技术实现要素:
本发明的目的在于针对上述问题,提供一种自交联透明质酸和明胶复合水凝胶注射剂,该制剂材料选择上仿生天然细胞外基质中的多糖和蛋白成分,交联方式上仿生蛋白质中二硫键的连接,解决现有技术中传统水凝胶需要外源性引发,生物相容性差,制备过程复杂,难以维持多种细胞增值和生物功能的问题。
本发明还提供了该自交联透明质酸和明胶复合水凝胶注射剂的制备方法。
为了实现以上发明目的,本发明的具体技术方案为:
一种自交联透明质酸和明胶复合水凝胶注射剂,其结构如式ⅰ所示,
其中
本发明所述的自交联透明质酸和明胶复合水凝胶注射剂的制备方法,其步骤为:将两种巯基改性的天然材料通过自发发生氧化反应形成二硫键化学交联,制得所述复合水凝胶注射剂。其反应式为:
其中,所述巯基化天然材料
作为优选,所述天然材料以透明质酸和明胶为例,具体步骤如下:
步骤1.配液:配置巯基化透明质酸和巯基化明胶混合溶液;
步骤2.氧化反应:将步骤1配制的巯基化透明质酸和巯基化明胶混合溶液搅拌均匀,静置,使巯基化透明质酸和巯基化明胶发生氧化反应形成水凝胶;
巯基化透明质酸与巯基化明胶的质量比为1~50:1~25。
所述巯基化透明质酸的结构式如式ⅱ所示。
作为优选,所述巯基化透明质酸和巯基化明胶混合溶液的ph值为7.0~8.0,浓度为3.0wt%~20.0wt%。
巯基化透明质酸和巯基化明胶混合溶液用去离子水作为溶剂。
作为优选,所述步骤2中,在室温条件下进行氧化反应。
作为优选,所述巯基化透明质酸的制备方法为:将透明质酸溶解于去离子水中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和n-羟基琥珀酰亚胺活化1~24h(优选1-2h),保持溶液ph值在4.75~5,然后加入半胱胺盐酸盐在低温下反应1~24h(优选15-24h),透析,得到巯基化透明质酸;透明质酸钠、n-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐与半胱胺盐酸盐的用量按需调整进行增减。其中,透明质酸的分子量为1~5000kda。
作为优选,所述巯基化明胶的制备方法为:将明胶溶解于60℃去离子水中,冷却至室温后加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和n-羟基琥珀酰亚胺活化1~24h(优选1-2h),保持溶液ph值在4.75~5,然后加入半胱胺盐酸盐室温下反应1~24h(优选15-24h),透析,得到巯基化明胶;明胶、n-羟基琥珀酰亚胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐与半胱胺盐酸盐的用量按需调整进行增减。
本发明所述的自交联透明质酸和明胶复合水凝胶注射剂的作为组织工程支架、或/和其他生物材料负载细胞、药物及生物活性物质的应用
作为优选,所述应用以负载细胞的组织工程三维支架为例。
作为优选,所述组织工程三维支架的制备方法为:
步骤a.将结构式如式ⅱ所示且巯基化程度为1%~99%的巯基化透明质酸和巯基基化明胶用培养基溶解形成浓度为1.0wt%~40.0wt%(优选3.0wt%~20.0wt%)的混合溶液;巯基化透明质酸与巯基化明胶的用量质量比为1~50:1~25。
步骤b.将步骤a制得的巯基化透明质酸和巯基化明胶的混合溶液灭菌,然后加入细胞悬浮液混匀,调节ph值至7.0~8.0。
进一步地,将调节ph值后的混合溶液立即注射至生物体内的待修复部位形成水凝胶,得到组织工程三维支架;或者注入模具中,静置成胶,而后将所得水凝胶从模具中取出并浸没于培养基中,置于培养箱中在34~40℃、3%~5%的co2的条件下培养至少1天,得到组织工程三维细胞支架,培养期间定期更换培养基。
其中,所述培养基是在α-mem基础培养基的基础上加入青霉素和链霉素混合液、抗坏血酸以及胎牛血清得到,α-mem培养基中青霉素和链霉素混合液的浓度为0.8%~1.2%,抗坏血酸的浓度为0.15%~0.25%,胎牛血清的浓度为8%~12%。
作为优选,细胞悬液的加入量为:按照1×105~5×106cells/ml的比例向基于天然材料透明质酸和明胶的自交联透明质酸和明胶复合水凝胶注射剂混合液中加入细胞悬液。
作为优选,本发明中所述的天然材料具有羧基官能团或可被修饰成巯基的官能团,包括但不限于透明质酸、羧甲基壳聚糖、明胶、胶原、丝素蛋白、海藻酸钠、硫酸软骨素中的任意一种或几种;所述的生物活性物质包括但不局限于细胞、药物、蛋白类活性因子中的一种或几种。
与现有技术相比,本发明的积极效果体现在:
(一)、本发明设计科学,制剂材料选择上仿生天然细胞外基质的多糖和蛋白成分,交联方式上仿生蛋白质中二硫键的连接,解决现有技术中传统水凝胶制备过程繁琐,价格昂贵,生物相容性差,难以维持细胞正常功能的问题。
(二)、操作简便,制剂有良好的亲水性、生物相容性,可降解,能够很好的支持细胞的形态和增殖,促进细胞外基质的分泌,是理想的组织工程和再生医学材料。
(三)、本发明的自交联透明质酸和明胶复合水凝胶注射剂,使用天然细胞外基质成分透明质酸和明胶作为原材料,进行巯基化改性,通过巯基间自发地氧化反应构建出了仿生天然细胞外基质的三维结构,能够很好的维持细胞的形态和结构,同时保证细胞正常生命活动并促进其增殖。将细胞和/或其他生物活性因子包裹在水凝胶前驱体溶液中,其可注射性能够填充任意形状的组织缺损部位,同时快速成胶可以防止细胞流失,使手术操作更加简便,可控性强,在组织工程领域和再生医学中具有重要的应用价值。
附图说明
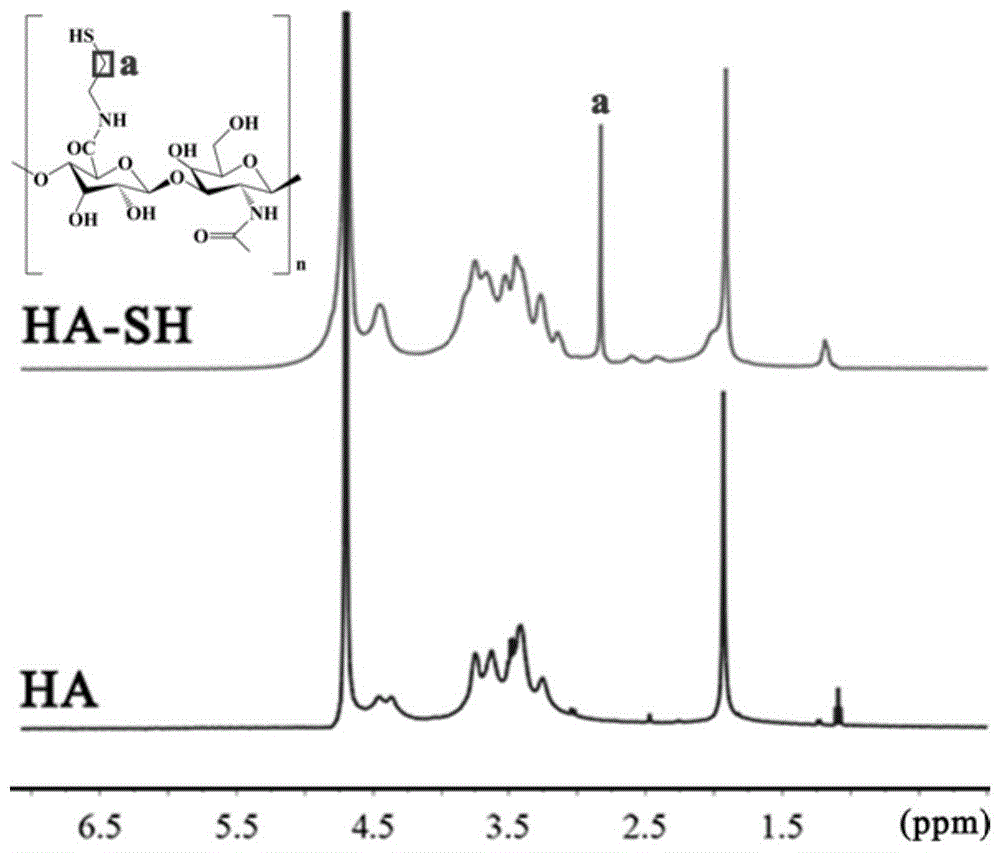
图1为实施例1中巯基化透明质酸的核磁共振氢谱图。
图2为实施例1中巯基化透明质酸的傅里叶红外光谱图。
图3为实施例2中巯基化明胶的核磁共振氢谱图。
图4为实施例3制得的水凝胶宏观图。
图5为实施例3制得的水凝胶水接触角图。
图6为实施例3制得的水凝胶的微观结构的扫描电镜图。
图7为实施例3制得的水凝胶的力学性能曲线。
图8为实施例3制得的水凝胶在pbs溶液下的降解曲线图。
图9为实施例3制得的水凝胶在二硫苏糖醇(dtt)溶液下的降解曲线图。
图10为实施例9制得的水凝胶组织工程支架培养不同时间得到的细胞增殖图。
图11为实施例9制得的水凝胶组织工程支架培养不同时间得到的的激光共聚焦扫描显微镜图。
图12为实施例9制得的水凝胶组织工程支架培养不同时间得到的扫描电镜图。
图13为实施例9制得的水凝胶组织工程支架培养不同时间得到的gags/dna图。
图14为实施例9制得的水凝胶组织工程支架培养不同时间得到的二型胶原免疫组化染色图。
图15为实施例9制得的水凝胶组织工程支架培养不同时间得到的rt-pcr检测图。
具体实施方式
以下通过实施例对本发明提供的自交联透明质酸和明胶复合水凝胶注射剂的制备及其应用作进一步说明。有必要指出,以下实施例只用于对本发明作进一步说明,不能理解为对本发明保护范围的限制,所属领域技术人员根据上述发明内容,对本发明做出一些非本质的改进和调整进行具体实施,仍属于发明保护的范围。
本发明实施例中透析所用的透析袋的规格为cutoffmw=8000~13000。
实施例1
本实施例公开了巯基化透明质酸的制备方法,具体步骤如下:
(1)将分子量为340kda的透明质酸钠溶解于去离子水中,加入n-羟基琥珀酰亚胺(nhs),充分溶解,然后加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc·hcl),充分溶解,用0.1mol/l和1mol/l的naoh溶液和0.1mol/l和1mol/l的hcl溶液调节混合液的ph值至4.75~5.5,在室温反应1~2h,然后加入半胱胺盐酸盐,在低温下反应24h。
该步骤中,透明质酸钠、n-羟基琥珀酰亚胺(nhs)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc·hcl)和半胱胺盐酸盐的摩尔比为1:1:3:3。
(2)步骤(1)所得反应液在ph值为3.3~3.5的盐酸溶液中透析5天,冷冻干燥,得到巯基化透明质酸(ha-sh),该ha-sh中巯基化程度约为35%。
如附图1所示,本实施例制得的巯基化透明质酸的特征峰在2.8ppm处,而纯的透明质酸在该处无特征峰出现。
如附图2所示,本实施例制得的巯基化透明质酸的特征吸收峰在1740cm-1,而未改性的透明质酸在该处无特征峰出现。
实施例2
本实施例公开了巯基化明胶的制备方法,具体步骤如下:
(1)将明胶溶解于60℃的去离子水中,冷却至室温后加入n-羟基琥珀酰亚胺(nhs),充分溶解,然后加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc·hcl),充分溶解,用0.1mol/l和1mol/l的naoh溶液和0.1mol/l和1mol/l的hcl溶液调节混合液的ph值至5.0左右,在室温反应1.5h,然后加入半胱胺盐酸盐,在室温下反应20h。
该步骤中,明胶、n-羟基琥珀酰亚胺(nhs)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc·hcl)、半胱胺盐酸盐的质量比为0.5:2:4:1。
(2)步骤(1)所得反应液在ph值为3.3~3.5的盐酸溶液中透析5天,冷冻干燥,得到巯基化明胶(gelsh),该gelsh中巯基的含量约为400μmol/g。
如附图3所示,本实施例制得的巯基化明胶的特征峰在3.3ppm处,而未改性的明胶在该处无特征峰出现。
实施例3
本实施例中制备自交联透明质酸和明胶复合水凝胶注射剂,步骤如下:
(1)将透析冻干得到的巯基化透明质酸和巯基化明胶用去离子水充分溶解,浓度为6.0wt%,其中巯基化透明质酸和巯基化明胶的质量比为1:1。
(2)室温条件下,用0.1mol/l和1mol/l的naoh和0.1mol/l和1mol/lhcl溶液调节混合溶液的ph值至7.5,立即用注射器吸取混合溶液,迅速注入模具中,室温下静止成胶。
附图4为该水凝胶的宏观图。
实施例4
将实施例3制成的水凝胶置于接触角测量仪下,用去离子水作为测试液测量水凝胶的亲水性,结果如附图5所示。从图5中发现,该水凝胶具有良好的亲水性表面,有利于细胞的接触与粘附。
实施例5
将实施例3制成的水凝胶置于电镜下扫描,结果如附图6所示。该水凝胶具有相互贯通的孔隙结构,这种结构保证了营养物质和氧气的输送,同时三维网络结构更有利于细胞的生长和增殖。
实施例6
将实施例3制成的水凝胶在室温下置于动态力学分析仪(tainstrumentsq800,usa)上,在多频模式(1~10hz)下测量水凝胶的储能模量(g′)的变化曲线,结果如附图7所示,该水凝胶的储能模量(g′)为4~7kpa,为细胞支架提供了一定的力学支撑。
实施例7
将实施例3制备的水凝胶样品冷冻干燥并称重,记作wo,然后浸入pbs缓冲液中,置于恒温箱37℃下缓慢降解,每隔一段时间将水凝胶取出,再次冻干并称重,记作wr,按以下公式计算降解率:
降解率=(wo-wr)/wo×100%
根据不同时间段的降解率,绘制降解曲线。实施例3制成的水凝胶在pbs溶液中的降解曲线附图8所示,结果显示该水凝胶能够长时间的在pbs溶液中存在而不溶解,有利于长时间的支持细胞粘附与生长。
实施例8
将实施例3制备的水凝胶样品冷冻干燥并称重,记作wo,然后浸入二硫苏糖醇(dtt)溶液中,置于恒温箱37℃下降解,每隔一段时间将水凝胶取出,再次冻干并称重,记作wr,按以下公式计算降解率:
降解率=(wo-wr)/wo×100%
根据不同时间段的降解率,绘制降解曲线。实施例3制成的水凝胶在dtt溶液中的降解曲线附图9所示,结果显示该水凝胶能够在还原性条件(dtt)下被快速降解,证明了其内部是由氧化反应得到的二硫键交联形成的。
实施例9
本实施例公开了组织工程三维支架的制备方法,具体为:
步骤a.将实施例1制得的巯基化透明质酸和实施例2制得的巯基化明胶分别灭菌,然后用培养基溶解形成浓度为3wt%混合溶液,其中巯基化透明质酸和巯基化明胶的质量比为1:1;
步骤b.将步骤a制得混合溶液用0.1mol/l和1mol/l的naoh和0.1mol/l和1mol/l的hcl溶液调节ph值至6.0~7.0,然后按照3×106cells/ml的比例加入细胞悬浮液混匀。
步骤c.将步骤b制得的混合溶液立即用注射器吸取并注入模具中,放入培养箱中在37℃、5%的co2的条件下静置成胶,而后将所得水凝胶从模具中取出并浸没于培养基中,置于培养箱中在37℃、5%的co2的条件下培养,培养期间定期每隔一天更换一次培养基,得到组织工程三维细胞支架。
所述细胞悬液以p2代软骨细胞为例。所述培养基是在α-mem基础培养基的基础上加入青霉素和链霉素混合液、抗坏血酸以及胎牛血清得到,α-mem培养基中青霉素和链霉素混合液的质量浓度为1%,抗坏血酸的质量浓度为0.2%,胎牛血清的质量浓度为10%。本实施例中青霉素和链霉素混合液由hyclone公司提供。
培养1天、3天后取出三维细胞支架,使用cck-8测试支架中细胞的增殖情况。结果如附图10所示。培养3天、7天和14天后,取出三维细胞支架,用pbs缓冲液清洗2遍,将清洗后的三维细胞支架浸没于含有fda和pi的pbs溶液中染色1min,通过激光共聚焦扫描显微镜(clsm)观察三维支架中的细胞的生长状态和分布情况,如附图11所示。将培养7天和14天后的三维细胞支架取出并做临界点干燥,之后用扫描电子显微镜观察细胞形态,结果如附图12所示。可以看出随着时间的增加,细胞增殖情况明显,并且在后期出现该细胞典型的团聚生长现象,呈现典型的球状。结果表明,该水凝胶有利于细胞的生长,能够促进其在支架内的增殖。
实施例10
将实施例9制得的组织工程三维细胞支架培养3天、7天和14天后取出,冻干后用木瓜蛋白酶溶液在60℃下消化12h,之后使用试剂盒检测三维细胞支架中细胞的dna和gags含量,结果如附图13所示。所述试剂盒分别为quant-itpicogreendsdnaassaykit(thermofisherscientific,usa)和dimethylmethylenebluedyeassay(biocolor,germany)。将培养3天和7天的三维细胞支架取出,用石蜡包埋,切成6μm的切片,进行二型胶原免疫组化染色,结果如附图14所示。培养3天、7天和14天后的三维细胞支架被取出,提取出mrna,并逆转录为cdna并进行扩增,软骨标志基因检测的结果如附图15所示。可以看出,随着时间的增加,细胞不仅数量有所增加,而且该细胞特异性的细胞外基质成分的分泌和相关特异性基因的表达也增加了,表明该水凝胶不但能够促进细胞的增殖,还有助于细胞分泌细胞外基质和上调相关基因,维持正常的生理功能。
综上所述,本发明的自交联透明质酸和明胶复合水凝胶注射剂制备操作简便,有良好的亲水性、生物相容性,可降解,能够很好的支持细胞的形态和增殖,促进细胞特异性基质的分泌,是理想的组织工程和再生医学材料。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!