经由球囊表面温度测量的球囊导管消融电极的接触指示的制作方法
1.本发明一般涉及医疗探头,并且具体地涉及心脏射频(rf)球囊消融导管。
背景技术:
2.先前在专利文献中提出了在其远侧端部处配备有生物物理传感器的医疗探头。例如,美国专利申请公布2014/0276709描述了包括消融导管的医疗系统。消融导管包括细长轴,该细长轴具有近侧端部、远侧端部和设置在近侧端部和远侧端部之间的管腔。消融导管还包括与管腔流体连通的可充胀元件、能够操作以测量第一温度的第一温度传感器;以及第二温度传感器,该第二温度传感器能够操作以测量第二温度。第一温度传感器和第二温度传感器通过可充胀元件的至少一部分彼此纵向分离。使用充胀流体的连续流,保持在第一温度传感器处测量的第一温度与在第二温度传感器处测量的第二温度之间的温差。保持温差可使得闭合评估更容易。具体地讲,当完全闭合时,第一温度传感器处的第一温度将比第二温度传感器处的第二温度低数摄氏度。
3.又如,美国专利申请公布2016/0157914描述了用于预测消融灶质量的方法、系统和设备。具体地讲,可基于使用盐水注入对肺静脉闭合的评估以及对由位于治疗设备的冷沉淀球囊远侧的热电偶记录的温度测量的评估,来预测消融灶质量。闭合的质量可基于由热电偶记录的温度从约32℃增加到约38℃所花费的时间、在预先确定的时间段内的温度变化速率和/或具有一定体积的造影介质的盐水的肺静脉内的耗散速率来评定。例如,闭合的质量可被评定为良好、一般或差。该评估可快速且容易地传达给操作者。
4.美国专利申请公布2008/0097422描述了部署与组织区域接触的电极结构的系统和方法。电极结构在电极结构上的已知位置处承载传感器以监测操作条件。系统和方法提供界面,该界面生成电极结构的理想化图像和指示器图像,以表示理想化图像上对应于传感器在电极结构上的位置的空间位置中监测的操作条件。界面显示包括理想化图像和指示器图像的视图图像。系统和方法使电极结构施加能量以加热组织区域,同时在显示屏上显示视图图像。在一个实施方案中,每个电极承载一个或多个温度传感器。每个电极可承载两个温度传感器,一个用于感测电极的暴露远侧端部附近的温度条件,并且另一个用于感测电极外部的电绝缘位置中的温度条件。
技术实现要素:
5.本发明的实施方案提供了一种方法,该方法包括将联接到导管的远侧端部的可膨胀球囊定位在患者的器官内的目标位置处,该可膨胀球囊包括多个电极和靠近每个电极的一个或多个传感器,其中一个或多个传感器各自被配置成测量血液特性。可膨胀球囊在目标位置处膨胀。流体流过导管的内腔并进入每个电极附近的血液中。经由靠近每个电极的一个或多个传感器测量血液特性对时间的依赖性。使用处理器,基于所测量的血液特性的依赖性来确定每个电极是否与组织物理接触。将每个电极是否与组织物理接触的指示输出给用户。
6.在一些实施方案中,使流体流动包括经由球囊连续施加冲洗流体。在其它实施方案中,使流体流动包括推注流体。
7.在一些实施方案中,一个或多个传感器中的每个传感器包括温度传感器,并且血液特性包括温度。
8.在一个实施方案中,一个或多个传感器中的每个传感器包括第一电极和第二电极,并且血液特性包括双极电阻抗。在另一个实施方案中,一个或多个传感器中的每个传感器包括第一电极和第二电极,该第二电极是参考电极,并且血液特性包括单极电阻抗。
9.在一些实施方案中,一个或多个传感器中的每个传感器包括ph传感器,并且血液特性包括ph。
10.在一些实施方案中,确定每个电极是否与组织物理接触包括确定血液特性的基线,以及将该基线与所测量的时间依赖性进行比较。
11.在一个实施方案中,确定基线包括使用电极的一个或多个传感器来测量血液特性,该电极被有意地操纵成不与组织接触。
12.在一些实施方案中,确定每个电极是否与组织物理接触包括估计在停止流体的流动之后血液特性返回到初始值的速率。在其它实施方案中,确定每个电极是否与组织物理接触包括估计从流体的流动开始直到血液特性达到稳态值的时间段。
13.在一个实施方案中,确定每个电极是否与组织物理接触包括确定每个电极附近达到的血液特性的极值。
14.在另一个实施方案中,测量特性的依赖性包括将特性与校准的特性进行比较。
15.在一些实施方案中,流体包括冷却剂。
16.在一些实施方案中,流体包括盐水。
17.在一个实施方案中,使流体流动包括通过用于注入造影流体的管腔注入流体。在另一个实施方案中,使流体流动包括通过球囊中的冲洗孔注入流体。
18.在一些实施方案中,腔包括心脏的肺静脉和心脏的左心房中的一者。
19.根据本发明的实施方案,本文另外提供了一种包括导管和处理器的系统。导管包括用于在患者的器官内的目标位置处插入该器官的腔中的轴,该轴具有用于使流体流动以引起血液的瞬态特性的内腔。导管还包括联接到轴的远侧端部的可膨胀球囊,该可膨胀球囊包括多个电极和靠近每个电极的一个或多个传感器,其中一个或多个传感器各自被配置成测量血液特性。处理器被配置成基于所测量的血液特性的依赖性来确定每个电极是否与组织物理接触,并且向用户输出每个电极是否与组织物理接触的指示。
20.结合附图,通过以下对本发明的实施方案的详细描述,将更全面地理解本发明,其中:
附图说明
21.图1为根据本发明的实施方案的基于导管的定位-跟踪和球囊消融系统的示意性图解;
22.图2是根据本发明的实施方案的部署在肺静脉(pv)及其口的区域中的图1的球囊导管的远侧端部的示意性绘画侧视图;
23.图3是示出根据本发明的实施方案的作为时间的函数的图1的球囊导管的两个消
融电极附近的感测温度的曲线图;
24.图4是根据本发明的实施方案的示意性示出指示图1的球囊导管的消融电极接触的方法的流程图。并且
25.图5是示出根据本发明的实施方案的作为时间(包括在rf消融期间)的函数的图1的球囊导管的消融电极附近的感测温度的曲线图。
具体实施方式
26.概述
27.为了利用医疗探头诸如心内球囊导管进行有效消融,重要的是,设置在球囊上方的消融电极在组织被消融之前与组织良好地物理接触。例如,对于肺静脉(pv)隔离,所有消融电极应良好地在pv的口的周边上接触。然而,例如通过检查远侧血管(例如,pv血管)的闭合来检查与组织诸如口的组织的良好接触是繁琐的,并且通常依赖于另一种形式,诸如荧光镜透视检查。此外,如果存在非完全闭合,则难以使用荧光镜透视检查识别哪个特定消融电极不具有良好的组织接触。
28.本文所述的本发明的实施方案提供了用于例如在即将消融之前监测心脏球囊的消融电极是否接触组织以及接触的良好程度的改善技术。所公开的技术提供了可使用局部冲洗和/或注入具有与血液不同的特性的流体来估计电极的物理接触程度并测量所得的血液特性的瞬时变化的系统和方法。基于所感测的血液特性的瞬态变化,处理器可确定球囊消融导管的每个消融电极是否正在接触组织。
29.在一些实施方案中,提供了一种系统,该系统包括导管,该导管包括(i)用于在患者的器官内的目标位置处插入该器官的腔中的轴,该轴具有内腔,其中该内腔被配置成流过流体以引起血液的瞬时特性,以及(ii)联接到轴的远侧端部的可膨胀球囊,该可膨胀球囊包括多个电极和靠近每个电极的一个或多个传感器,其中该一个或多个传感器各自被配置成测量血液特性。该系统还包括处理器,该处理器被配置成(a)基于所测量的血液特性的依赖性来确定每个电极是否与组织物理接触,(b)向用户输出每个电极是否与组织物理接触的指示。
30.在一个实施方案中,处理器通过确定血液特性的基线并将该基线与所测量的时间依赖性进行比较来确定每个电极是否与组织物理接触。
31.在一些情况下,确定基线包括使用电极的一个或多个传感器来测量血液特性,该电极被有意地操纵成不与组织接触。
32.在一些实施方案中,处理器通过在停止注入流体之后估计血液特性返回到初始值的速率来确定每个电极是否与组织物理接触。在另一个实施方案中,确定每个电极是否与组织物理接触包括确定每个电极附近达到的血液特性的极值。
33.在一些实施方案中,一个或多个传感器中的每个传感器包括温度传感器,并且血液特性包括温度。对血液具有冷却作用的流体,诸如盐水溶液,通过冲洗孔从球囊泵出并进入血流中。设置在球囊的消融电极中的每个消融电极上的一个或多个温度传感器在释放流体之后采集(电极中的每个电极的)随时间推移的温度。温度特征图(随时间推移的温度变化)根据电极是否与组织良好接触而不同。
34.在另一个实施方案中,为了实现对温度的增强的瞬态效应,可通过单独的管腔诸
如用于注入造影流体的管腔注入冷却流体,例如低温下的盐水或葡萄糖溶液。
35.在一个实施方案中,测量每个电极附近的血液特性对时间的依赖性包括将该特性与校准的特性进行比较。例如,与体内血液温度相比,制备具有给定的较低温度的冷却剂。在冷却剂注入之后,可相对于原始冷却剂温度校准与组织和与血液接触的电极温度之间的所得峰值差。基于该校准,现场医师获得对电极温度的预期峰值差的预测,该预期峰值差指示确实实现了电极和组织之间的物理接触。
36.加以必要的变更,可使用所公开的技术生成、感测和分析其它物理效应。例如,泵送或注入的流体可局部影响血液ph,并且设置在球囊的消融电极中的每个消融电极上的ph传感器在释放流体之后采集(电极中的每个电极的)随时间推移的不同ph。又如,泵送或注入的流体可局部影响血液的co2含量,并且设置在球囊的消融电极中的每个消融电极上的co2传感器在释放流体之后采集(电极中的每个电极的)随时间推移的不同pco2。pco2在本文中被定义为二氧化碳在血液中的分压。上述物理效应中的每个物理效应的峰值和/或稳态差异也与(i)血液中、(ii)体内和(iii)体外流体中的这些值之间的差异相关,并且这些关系可被校准。可对预期峰值差做出预测,并且该预测用于指示物理接触的水平。
37.在一个实施方案中,由两个电极制成的传感器测量作为瞬态血液特性的函数的双极电阻抗的变化,该瞬态血液特性对经由血液和经由心脏组织的电极间阻抗具有不同的影响。在另一个实施方案中,传感器使用一个电极和参考电极来测量作为瞬态血液特性的函数的单极电阻抗。例如,血液的阻抗可在存在泵送盐水的情况下改变,并且利用两个不同的传感器测量阻抗和温度曲线两者可进一步改善该技术。
38.在一些实施方案中,基于所公开的技术,处理器被进一步配置成在无接触和全接触之间的标度上提供接触值,并且在视觉上指示球囊的每个电极的接触值。
39.通过在消融球囊的整个周边上提供每个电极的组织接触指示,所公开的技术可改善球囊导管抵靠组织定位的准确性,从而改善球囊消融的有效性。此外,所公开的技术不需要使用造影材料进行x射线荧光镜透视检查成像,因此对于患者和医师两者而言都更安全。
40.因此,所公开的技术提供了对单个球囊电极与组织接触的完整且安全的实时评估,这可改善作为心律失常的治疗的心脏球囊消融治疗诸如肺静脉(pv)隔离的结果。
41.系统描述
42.图1为根据本发明的实施方案的基于导管的定位-跟踪和球囊消融系统20的示意性图解。系统20包括导管21,如在插图25中所示,在该导管的轴22的远侧端部22a处适配有rf消融可膨胀球囊40。如插图25进一步所示,远侧端部22a包括磁性传感器39,该磁性传感器容纳在正好在可膨胀球囊40近侧的远侧端部22a内。
43.导管21的近侧端部连接到控制台24。控制台24包括冲洗模块46,该冲洗模块允许系统20控制为远侧端部22a提供的冲洗。在本文所述的实施方案中,导管21可用于任何合适的治疗目的和/或诊断目的,诸如心脏26中的组织的电感测和/或射频(rf)消融。为了执行其功能,系统20还包括温度感测模块49,其功能在下文进行了描述。
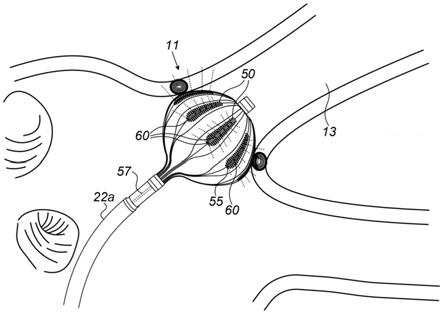
44.医师30将轴22的远侧端部22a通过护套23插入到躺在工作台29上的患者28的心脏26中。医师30通过使用靠近导管的近侧端部的操纵器32操纵轴22来将轴22的远侧端部导航至心脏26中的目标位置,以及/或者使轴的远侧端部相对于护套23偏转。在远侧端部22a的插入期间,球囊40由护套23保持在塌缩构型中。通过将球囊40包含在塌缩构型中,护套23还
用于使目标位置沿途的血管创伤最小化。
45.在远侧端部22a在心脏26中的导航期间,控制台24响应于来自外部场发生器36的磁场,接收来自磁性传感器39的信号,例如,用于测量消融球囊40在心脏中的位置,并且任选地,将跟踪位置呈现在显示器27上。磁场发生器36放置在患者28外部的已知位置处,例如,在患者的工作台29下方。控制台24还包括被配置成驱动磁场发生器36的驱动电路34。
46.在一个实施方案中,从位置传感器39接收的位置信号指示消融球囊40在位置跟踪与消融系统20的坐标系中的位置。使用外部磁场的位置感测方法在各种医疗应用场景中实现,例如,在由biosensewebsterinc.(加利福尼亚州尔湾(irvine,california))生产的carto
tm
系统中实现,并且详细地描述于美国专利5391199、6690963、6484118、6239724、6618612和6332089、以及pct专利公布wo96/05768、和美国专利申请公布2002/0065455a1、2003/0120150a1和2004/0068178a1,这些专利的公开内容全部以引用方式并入本文。
47.一旦轴22的远侧端部22a已到达目标位置,医师30就缩回护套23并使球囊40充胀,并且进一步操纵轴22以使球囊40接触肺静脉的口,如图2所示。如图所示,球囊40包括设置在球囊40的周边上方的多个rf消融电极44。每个电极结构包括一个或多个温度传感器,如图2所示。
48.控制台24包括:处理器41,通常为通用计算机,具有合适的前端部;以及接口电路38,用于接收来自导管21的信号,以及用于经由导管21将rf能量治疗施加于心脏26的左心房,并用于控制系统20的其它部件。处理器41通常包括系统20的存储器48中的软件,该软件被编程为实施本文所述的功能。该软件可通过网络以电子形式被下载到计算机,例如或者其可另选地或另外地设置和/或存储在非临时性有形介质(诸如磁存储器、光存储器或电子存储器)上。具体地,处理器41运行如本文所公开的包括在图4中的专用算法,该专用算法使得处理器41能够执行本发明所公开的步骤,如下文进一步所述。
49.经由球囊表面温度测量的球囊导管消融电极的接触指示
50.图2是根据本发明的实施方案的部署在肺静脉(pv)13及其口11的区域中的图1的球囊导管的示意性绘画侧视图。球囊导管用于消融口11以隔离心律失常的源。球囊40可类似于在heliostar多电极rf球囊消融导管(由biosense webster制造)中使用的球囊,该导管具有设置在其上方的十个大面积电极50。在消融灶形成期间,可根据组织将不同水平的rf能量独立地递送到十个电极中的每个电极。此外,heliostar球囊设计使得可以通过单次施加rf能量来实现隔离,诸如pv隔离。
51.如图2所示,远侧端部22a包括流体诸如盐水可流过的内腔57。球囊40具有形成有冲洗孔55的外膜,流体(例如,盐水)可通过该冲洗孔从球囊40的内部排出以冷却口11组织消融部位。尽管图2示出了作为射流离开球囊40的流体,应当理解,流体可以任何期望的流速或压力离开球囊,包括使流体从球囊渗出的速率。
52.如图2中进一步所示,球囊40的膜支撑并承载消融电极50,其中每个电极结构中包括一个或多个温度传感器60。由传感器60测量的温度用于指示消融电极与口组织的接触,如下所述。
53.图2中所示的绘画侧视图是以示例的方式选择的,其中其它实施方案也是可能的。例如,在另一个实施方案中,冷却流体可通过单独的管腔(未示出)排出并进入pv 13,诸如目前用于注入造影流体的管腔。
54.盐水冲洗方法
55.图3是示出根据本发明的实施方案的作为时间的函数的图1的球囊导管的两个消融电极附近的感测温度的曲线图70和72的图。曲线图70和曲线图72分别示出了在所公开的接触检测过程期间,与组织接触的电极50和未接触的电极50的温度在一段时间内如何变化。需注意,该曲线图不包括图5中描述的消融的效果。
56.最初,在约t=0的时间和之前,冲洗仍处于低流速(例如,5ml/min),这保持球囊40放气并且电极温度几乎与血液温度(37℃)相同。然后,在时间t=0之后的几秒内,例如由医师施加高流速(例如,35ml/min)冲洗以准备消融。冲洗盐水从球囊40流过冲洗孔55,如图2所示,并且还使球囊40完全充胀。此时,在时间t=0之后几秒,球囊40已经定位在目标组织处,例如与口11接触。现在可假定由医师牢固地定位成与组织接触的球囊40会闭合pv13,除了可能的分段泄漏区域之外。
57.如左手侧(直到t=28s)所示,所得的在闭合电极(曲线图70示出良好接触)上传感器和非闭合电极(曲线图72示出不良的接触)上传感器的温度和时间曲线图存在显著差异。
58.冷却剂注入方法
59.在时间t=28s处(线74),医师通过单独的管腔将少量的一次分量冷却稀释流体(例如,在低温下20ml的盐水或葡萄糖)注入pv 13。这种注入由泵在短时间间隔(诸如几秒)内手动地或自动地执行,其中确切时间取决于体积和注入速率,该注入也可被描述为冷却流体的增压注入(推注)。
60.注入的冷却流体导致如由两个传感器感测到的血液温度的进一步快速下降,但是由于接触不良,该下降在曲线图72中特别明显,其中温度在时间t=32s之后几秒内从34℃下降到约27℃(线76)。
61.引起快速温度下降的一种机制是血流本身,其中冷却的流动血液通过对流从电极移除热量。当电极与组织接触时,通过组织并且通过球囊膜(进入球囊内部的较冷盐水中)的较慢热传导机制导致温度降低较慢且效果较温和。
62.如图3所示,两个电极处的温度在t=32s之后具有显著不同的恢复速率:闭合区域温度保持较低(~26℃),而泄漏区域温度快速升高至30℃。如进一步所见,在时间65<t<105秒期间,分别达到不同稳态温度的周期75和77:约26℃以及约30℃。在闭合电极和非闭合电极之间测量的四度(4℃)的差值可用于检测部分闭合以及球囊周边上发生部分闭合的位置,这为医师提供了改善球囊导管与口11接触的方式。
63.最后,当在时间t=105s处释放闭合时(线78),所有电极的温度返回到血液温度(约37℃)。例如,通过在执行消融之后回缩球囊40来移除闭合状况,留下对血流完全重新打开的口11。
64.图3中的图以举例的方式给出。增压注入可独立施加或添加到冲洗,例如以加速冷却。当单独使用冲洗时,实现类似的稳态温度,对于接触的电极和未接触的电极,分别为约26℃以及约30℃。
65.其它流体类型和感测方法可适用于在闭合电极和非闭合电极之间产生可测量的差值。例如,可注射低渗盐水或高渗盐水,并通过压力传感器在电极处测量所得的瞬时血压波。如上所述,血液的瞬态化学特性诸如ph和co2含量也可与设置在电极处的相关流体注入和相关传感器一起使用。
66.图4是根据本发明的实施方案的示意性示出指示图1的球囊导管的消融电极50接触的方法的流程图。根据所展示的实施方案,算法实施过程,该过程始于在球囊导管定位步骤80处,当医师30将球囊导管定位在患者的器官的腔内的目标位置处(诸如在口11处)时。接下来,在球囊扩张步骤82处,医师30例如通过以增加的冲洗速率使球囊40充胀以闭合腔来膨胀球囊40。在该阶段,医师30可进一步操纵球囊40以使膨胀的球囊40与组织更紧密接触,例如,在口11的整个周长上。接下来,在冷却剂注射步骤84处,医师30通过导管的内腔注射冷却的流体。在随后的温度监测步骤86处,处理器41使用来自一个或多个温度传感器的测量结果来监测消融电极附近的所得温度。处理器41可监测在每个电极附近达到并维持一定持续时间(通常几十秒)的温度下降量和/或稳态温度。
67.在后续接触监测步骤88中,处理器41基于监测到的所得温度为每个球囊电极提供接触指示。
68.在一些实施方案中,接触指示是音频和/或视觉二进制指示(接触/无接触)。在其它实施方案中,使用模糊度量接触指示,示出电极接触多少(100%=完全接触,0%=无接触,90%=几乎完全接触等)。模糊指示可被实现为不同的色调、不同的声节、不同的音量、所显示的数字诸如百分比、仪表等。在一些实施方案中,处理器41被进一步配置成提供在无接触和全接触之间范围内的接触指数,并且在视觉上指示每个球囊电极的接触指数。
69.最后,在指示步骤90处,处理器41向医师30指示所评估的物理接触。
70.图4中所示的示例性流程图完全是为了概念清晰而选择的。在可供选择的实施方案中,可执行另外的步骤,诸如注射造影剂,然后进行荧光镜透视检查成像。还可施加接触力感测以在消融之前监测球囊定位的质量。
71.图5是示出根据本发明的实施方案的作为时间(包括在rf消融期间)的函数的图1的球囊导管的消融电极附近的感测温度的曲线图。图5是在所公开的技术的临床研究期间获得的。
72.如图所示,曲线图170和曲线图172分别示出了在所公开的接触检测过程中,与组织良好接触的两个电极50的温度和未接触的电极50的温度在一段时间内如何变化。
73.最初,在t=4200秒之前的时间,冲洗仍处于低流速(例如,5ml/min),这保持球囊40放气并且电极温度略微低于血液温度(即,处于约35℃)。然后,在时间t=4200秒之后的几秒内,由医师施加高流速(例如,35ml/min)冲洗以准备消融。
74.如图5所示,紧接在t=4200秒之后,所得的在闭合电极(曲线图170示出良好接触)上的传感器和非闭合电极(曲线图172示出不良的接触)的传感器的温度和时间曲线图之间存在显著差异。在稳态温度阶段,在时间4260<t<4310期间,两个闭合区域中的温度保持较低(~27.5℃),而泄漏区域温度快速升高至31℃。通常,与组织接触不良的电极的温度将更受血液温度(即,约37℃)的影响,这导致泄漏区域中的温度快速升高,如曲线图172所示。
75.如进一步所见,在rf消融期间,在时间4310<t<4360秒处,由所公开的技术发现与组织良好接触的电极达到在45℃-50℃范围内的临床有效消融温度。另一方面,由所公开的技术发现,与组织不良接触的电极在很大程度上不能被加热到高于35℃,因为其将rf能量耗散到周围的流动血液中。
76.除了测量温度之外,还可以测量消融电极中的每个消融电极与附接到患者皮肤的表面电极之间的阻抗。当电极接触组织时,与闭合电极的显著温度下降相对应(即,与曲线
图170良好对应),阻抗的变化可在时序处观察到。另一方面,预期阻抗响应对于非闭合电极保持平坦(作为时间的函数),因为在球囊充胀之后电极仍然浸没在血液中。使用这两种检测方法(即,温度变化和阻抗响应)可改善所公开技术的准确性。
77.尽管本文所述的实施方案主要涉及肺静脉隔离,但是本文所述的方法和系统也可以用于需要确定闭合的其它应用,诸如电生理标测和交感神经去神经支配。
78.因此应当理解,上面描述的实施方案以举例的方式被引用,并且本发明不限于上文特定示出和描述的内容。相反,本发明的范围包括上文描述的各种特征的组合和子组合以及它们的变型和修改,本领域的技术人员在阅读上述描述时将会想到该变型和修改,并且该变型和修改并未在现有技术中公开。以引用方式并入本专利申请的文献被视为本申请的整体部分,不同的是如果这些并入的文献中限定的任何术语与本说明书中明确或隐含地给出的定义相冲突,则应仅考虑本说明书中的定义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1