补骨脂宁的新用途及其药物组合物
1.本发明属于医药技术领域,具体而言,涉及补骨脂宁的新用途及其药物组合物。
背景技术:
2.骨是人体内的一种动态组织,它通过持续的骨重塑来维持自身的结构稳定。破骨细胞的骨吸收功能与成骨细胞的骨形成功能失调将导致骨疾病的发生,如骨质疏松症(osteoporosis)。骨质疏松症是以破骨细胞过度活化、骨量减少、骨的微观结构退化为特征的全身代谢性骨骼疾病,其特点是致使骨的脆性增加及易于发生骨折。此外,与破骨细胞过度活化相关的疾病还包括恶性骨肿瘤,炎症相关骨破坏(类风湿性关节炎和脓毒性关节炎等)。由破骨细胞过度活化导致的骨破坏病人数量庞大,仅绝经后骨质疏松症的患者在全世界就有上亿人。
3.破骨细胞分化抑制剂近年来已成为一类药物,可用于原发性骨质疏松症等多种由破骨细胞过度活化导致的骨破环疾病。由破骨细胞过度活化导致的骨疾病,病种及病因具有多样性。直接抑制破骨细胞分化形成的药物可直接阻断骨破坏进展,改善骨破坏症状,并有效减轻病人骨折等痛苦。但临床上,有效及安全的破骨细胞分化抑制剂很少。目前,常用的破骨细胞分化抑制剂有双磷酸盐类和rankl抑制地诺单抗(denosumab)。这两种药物最初均作为治疗绝经后骨质疏松症的药物被批准上市,近年来都被批准增加了新的临床适应症—肿瘤转移性骨破坏。然而,这两类药物存在严重副作用,如颌骨环死、非典型性股骨坏死、心血管系统损伤、肾衰、关节疼痛、头痛等,并且生物制品地诺单抗的价格昂贵。因此,寻找有效、低毒、方便的新型破骨细胞分化抑制剂药物,对于破骨细胞过度活化导致的骨破环疾病的防治具有重大意义。
技术实现要素:
4.为解决上述现有技术中所存在的问题,本发明提供了补骨脂宁的新用途及其药物组合物。
5.具体而言,本发明提供了:
6.(1)补骨脂宁在制备用于抑制破骨细胞生成和/或活性、和/或抑制破骨细胞前体细胞的活性的药物中的应用。
7.(2)根据(1)所述的应用,其中所述破骨细胞前体细胞的活性包括破骨细胞前体细胞分化为破骨细胞的活性。
8.(3)根据(1)所述的应用,其中所述药物为用于治疗和/或预防破骨细胞功能亢进相关疾病的药物。
9.(4)根据(3)所述的应用,其中所述破骨细胞功能亢进相关疾病包括骨质疏松症、骨肿瘤、骨髓瘤、成软骨细胞瘤和炎症性骨破坏。
10.(5)根据(4)所述的应用,其中所述炎症性骨破坏包括类风湿性关节炎和脓毒性关节炎。
11.(6)补骨脂宁在制备用于抑制破骨细胞分化相关转录因子的转录和/或表达的药物中的应用。
12.(7)根据(6)所述的应用,其中所述破骨细胞分化相关转录因子包括活化t细胞核因子c1和c-fos。
13.(8)补骨脂宁在制备用于抑制破骨细胞分化特征性基因的表达的药物中的应用。
14.(9)根据(8)所述的应用,其中所述破骨细胞分化特征性基因包括编码抗酒石酸酸性磷酸酶(trap)的基因、编码组织蛋白酶k(ctsk)的基因、编码降钙素受体的基因(ctr)、编码树突状细胞-特异性跨膜蛋白(dc-stamp)的基因、编码基质金属蛋白酶-9(mmp-9)的基因、编码囊泡型atp酶d2亚单位(atp6v0d2)的基因。
15.(10)补骨脂宁在制备用于抑制抗酒石酸酸性磷酸酶的活性的药物中的应用。
16.(11)一种药物组合物,包含活性成分和可药用的辅料,其中所述活性成分为补骨脂宁。
17.本发明与现有技术相比具有以下优点和积极效果:
18.本发明发现补骨脂宁可显著抑制破骨细胞分化标记酶——抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,trap)的活性,减少破骨细胞的形成、数量、大小及其活性,因此可直接抑制破骨细胞的成熟分化和活性。另外,本发明还发现补骨脂宁可抑制破骨细胞分化关键转录因子活化t细胞核因子c1(nuclear factor of activated t cells c1,nfatc1)的表达和c-fos的转录,从而抑制多种破骨细胞分化特征标记基因的表达,从而阐明了补骨脂宁抑制破骨细胞分化的机理。
19.基于以上发现,本发明提供了补骨脂宁在抑制破骨细胞分化生成方面的新用途,其可作为破骨细胞分化抑制剂,阻止或缓解过度骨吸收骨破坏症状,并用于制备治疗和/或预防骨质疏松症等破骨细胞功能亢进相关疾病的药物,临床应用前景良好。另外,由于本发明发现了补骨脂宁对抑制破骨细胞分化的靶向性及有效性,其应用前景将不局限于抗骨质疏松症药物的开发,同时其也有利于抗恶性骨肿瘤及炎症性骨破坏疾病的药物研发。
20.另外,本发明发现补骨脂宁对破骨细胞无明显的细胞调亡作用,对破骨细胞前体细胞也没有细胞毒性,因此具有安全性。
附图说明
21.图1示出补骨脂宁的细胞毒性分析结果。
22.图2示出补骨脂宁对由rankl诱导的破骨细胞生成标记酶trap的活性抑制效果;其中图2a示出实验流程图;图2b示出补骨脂宁对trap活性的抑制效果。图中,“*”表示p《0.05,“***”表示p《0.001,与阴性对照组相比;“#”表示p《0.05,“###”表示p《0.001,与rankl处理组(阳性对照)相比。
23.图3示出补骨脂宁对由rankl诱导的破骨细胞生成(细胞数量及大小)的抑制效果;其中图3a示出trap组织染色的显微镜照片,下方图片为上方图片标星号位置的放大图,图片的标尺为200μm。从左至右依次为rankl-补骨脂宁-,rankl+补骨脂宁-,rankl+补骨脂宁1μm,rankl+补骨脂宁3μm,rankl+补骨脂宁10μm;图3b和图3c分别示出用补骨脂宁处理对破骨细胞生成的细胞数量和细胞大小的影响。图中,“***”表示p《0.001,与阴性对照组相比;“#”表示p《0.05,“###”表示p《0.001,与rankl处理组(阳性对照)相比。
t cells c1),从而激活破骨细胞分化特征基因的表达,促进破骨细胞分化成熟,加速骨基质的重吸收。
32.本发明经药理实验证明,补骨脂宁能抑制核因子κb受体活化因子配体(rankl)诱导的破骨细胞的分化,其作用机理在于补骨脂宁通过影响破骨细胞关键转录因子——活化t细胞核因子c1的表达,从而抑制抗酒石酸性酸性磷酸酶(trap)、组织蛋白酶k(cathepsin k,ctsk)和降钙素受体(calcitonin receptor,ctr)等破骨细胞分化特征基因的表达。本发明还发现补骨脂宁可显著抑制破骨细胞分化标记酶——抗酒石酸酸性磷酸酶的活性,减少破骨细胞的形成、数量及大小,因此可直接抑制破骨细胞的成熟分化。
33.基于上述发现,本发明提供了补骨脂宁在制备用于抑制破骨细胞生成和/或活性、和/或抑制破骨细胞前体细胞的活性的药物中的应用。
34.其中所述破骨细胞前体细胞的活性包括破骨细胞前体细胞分化成熟为破骨细胞的活性。
35.由于补骨脂宁的上述生物学功能,其可用于治疗和/或预防破骨细胞功能亢进相关疾病。
36.在本发明中,术语“破骨细胞功能亢进”是指破骨细胞前体细胞过度活化,从而分化生成破骨细胞的数量过多,破骨细胞的破骨能力过度增强,其可导致多种疾病,包括骨质疏松症、恶性骨肿瘤、骨髓瘤、成软骨细胞瘤、炎症相关骨破坏等(类风湿性关节炎和脓毒性关节炎等)。
37.因此,补骨脂宁可用于治疗和/或预防骨质疏松症、骨肿瘤、骨髓瘤、成软骨细胞瘤和炎症性骨破坏,例如类风湿性关节炎和脓毒性关节炎。
38.因此,本发明提供了补骨脂宁在制备用于治疗和/或预防破骨细胞功能亢进相关疾病的药物中的应用,所述应用包括制备用于治疗和/或预防骨质疏松症、骨肿瘤、骨髓瘤、成软骨细胞瘤和炎症性骨破坏(例如类风湿性关节炎和脓毒性关节炎)的药物。
39.本发明还发现补骨脂宁能够抑制破骨细胞分化关键转录因子活化t细胞核因子c1的转录和表达,也能够抑制调节破骨细胞分化的重要转录因子c-fos的转录。
40.因此,本发明还提供了补骨脂宁在制备用于抑制破骨细胞分化相关转录因子的转录和/或表达的药物中的应用。
41.优选地,所述破骨细胞分化相关转录因子包括活化t细胞核因子c1和c-fos。
42.本发明还发现补骨脂宁能够抑制破骨细胞分化特征性基因的表达,包括编码抗酒石酸酸性磷酸酶的基因、编码组织蛋白酶k的基因、编码降钙素受体的基因、编码树突状细胞-特异性跨膜蛋白(dendritic cell-specific transmembrane protein,dc-stamp)的基因、编码基质金属蛋白酶-9(matrix metalloprotein-9,mmp-9)的基因、编码囊泡型atp酶d2亚单位(vacuolar(h+)atpase v0 subunit d2,atp6v0d2)的基因。
43.因此,本发明还提供了补骨脂宁在制备用于抑制破骨细胞分化特征性基因的表达的药物中的应用。所述基因包括编码抗酒石酸酸性磷酸酶的基因、编码组织蛋白酶k的基因、编码降钙素受体的基因、编码树突状细胞-特异性跨膜蛋白的基因、编码基质金属蛋白酶-9的基因、编码囊泡型atp酶d2亚单位的基因。
44.如上文所述,本发明发现补骨脂宁能够抑制抗酒石酸酸性磷酸酶的活性,因此,提供了补骨脂宁在制备用于抑制抗酒石酸酸性磷酸酶的活性的药物中的应用。
45.基于本发明所述补骨脂宁的上述应用,本发明还提供了一种药物组合物,包含活性成分和可药用的辅料,其中所述活性成分为补骨脂宁。
46.在用于治疗和/或预防破骨细胞功能亢进相关疾病时,补骨脂宁的每日剂量可以为1.5-3mg,优选1.698-2.547mg。
47.所述药物组合物的给药方式可以为口服,并且可以制成胶囊剂、片剂、微囊片剂或口服液的形式。
48.在单剂的所述药物组合物中,所述补骨脂宁的含量可以为每日剂量。
49.所述辅料可以根据所需剂型进行选择。例如,当剂型为口服制剂时,所述辅料可以为选自填充剂、崩解剂、润滑剂中的一种或多种。填充剂可选自微晶纤维素、乳糖、淀粉、甘露醇等中的一种或多种,崩解剂可选自交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠等中的一种或多种,润滑剂可选自硬脂酸镁、微粉硅胶、滑石粉等中的一种或多种。
50.可药用的辅料在单剂药物组合物中的含量可以根据实际需要在本领域常用的范围内调整。
51.以下通过例子的方式进一步解释或说明本发明的内容,但这些例子不应被理解为对本发明的保护范围的限制。
52.例子
53.以下除非特别说明,否则以下例子中所用实验方法均使用本领域的常规实验流程、操作、材料和条件进行。
54.实施例1:细胞毒性分析
55.为评估本发明的补骨脂宁在破骨细胞前体细胞(小鼠骨髓单核/巨噬细胞)中是否具有细胞毒性,使用mtt法进行检测,分析细胞存活率。
56.骨髓单核/巨噬细胞从小鼠(香港科技大学apcf中心)的长骨中按照已知的常规方法分离得到,在补充有10%fbs、1%青霉素/链霉素的mem-α培养基中进行培养。然后制成细胞浓度为1
×
104个/ml的细胞悬浮液并接种在96孔板上,放入co2培养箱(5%co2、37℃)中培养24小时。然后分别加入如图1所示不同终浓度的补骨脂宁,并设置不加补骨脂宁的对照组,继续培养24或48小时后,吸去96孔板中的培养基,加入0.5mg/ml的mtt溶液,放入培养箱中培养3小时。培育完毕,加入150μl dmso溶液并在摇床上振摇5分钟,测量570nm处吸光度进而分析细胞的生存活力。
57.如图1所示,小鼠骨髓单核/巨噬细胞在0.3-30μm补骨脂宁的浓度下均未显示出细胞数量减少。这些结果说明补骨脂宁在所应用的浓度范围内不会对骨髓单核/巨噬细胞产生不利影响,具有一定的安全性。
58.实施例2:破骨细胞生成及活性抑制试验
59.使用不同浓度的补骨脂宁处理细胞,然后测量破骨细胞生成的标记酶trap的活性、破骨细胞分化形成的大小及数量。
60.小鼠骨髓单核/巨噬细胞(细胞浓度为1
×
105个细胞/ml)在补充有20ng/ml m-csf、10%fbs、1%青霉素/链霉素的mem-α培养基中,在co2培养箱(5%co2、37℃)中培养72小时后,把此时间点视为第0天。将小鼠骨髓巨噬细胞(bone marrow macrophages,bmms)制成细胞浓度为3
×
105个/ml的悬浮液并接种在6孔板上,用补充有如图2和图3所示不同终浓度的补骨脂宁、20ng/ml m-csf(得自r&d systems,明尼阿波利斯市)、20ng/ml rankl(得自r&
d systems,明尼阿波利斯市)、10%fbs、1%青霉素/链霉素的mem-α培养基,在co2培养箱(5%co2、37℃)中培养48小时。不加rankl及不加补骨脂宁的细胞组作为阴性对照,加有rankl及不加补骨脂宁的细胞组作为阳性对照。每48小时重复换一次培养液。在设定的第0,2、3、和4天分别测量trap活性。第4天同时使用trap特异性试剂盒(sigma-aldrich)按照制造商提供的方法进行trap组织染色鉴定破骨细胞的生成。
61.测量trap活性的实验方法如下:收集细胞,用pbs清洗1~2遍后加入细胞裂解液(得自polyplus transfection,纽约)提取细胞内总蛋白。0.8mg总蛋白加入100μl柠檬酸盐缓冲液(50mm,ph 4.6,含10mm酒石酸钠和5mm对硝基苯基磷酸酯),孵育1小时。反应混合液中加入100μl 0.1mm的naoh终止反应。取200μl反应液加入到96孔板中,使用酶标仪检测其在405nm下吸光度值,trap活性以相对阴性对照组倍数表示。
62.如图2b和图3所示,rankl作为阳性对照,其处理可明显促进trap的活性及破骨细胞的生成,具有时间依赖性的特点。经过补骨脂宁处理后trap的活性以及由rankl诱导的破骨细胞的生成被显著抑制,且具有浓度依赖性的特点。这些结果表明,补骨脂宁可以抑制由rankl诱导的破骨细胞的生成,并且可以抑制trap的活性,从而抑制破骨细胞的破骨活性。
63.实施例3:补骨脂宁抑制破骨细胞分化成熟相关标记基因的表达
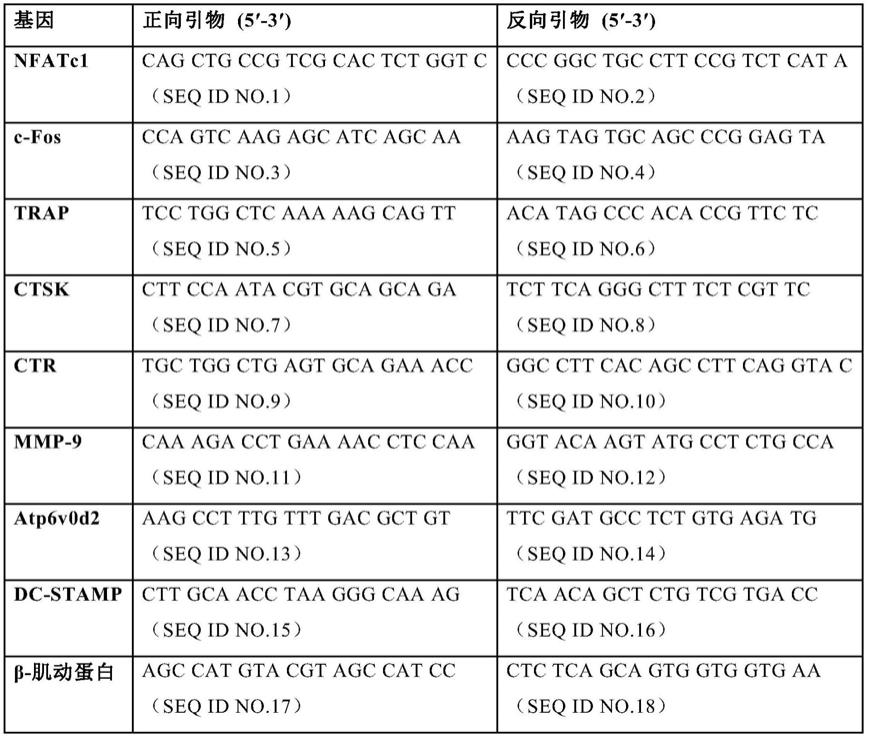
64.为了进一步确认补骨脂宁对破骨细胞分化抑制的活性,使用rt-pcr(real time-pcr)测量抗酒石酸酸性磷酸酶(trap)、组织蛋白酶k(ctsk)、降钙素受体(ctr)、树突状细胞-特异性跨膜蛋白(dc-stamp)、基质金属蛋白酶-9(mmp-9)、囊泡型atp酶d2亚单位(atp6v0d2)基因的转录水平,并且测量活化t细胞核因子c1(nfatc1)、c-fos基因的转录水平,以β-肌动蛋白基因的转录水平作为内参。
65.细胞培养与加药方式如实施例2所述,补骨脂宁的添加量终浓度如图4b所示。以用药物处理细胞当天作为第0天,在设定的第0,1,3,4和5天分别收集培养的细胞提取rna,并使用表1所列引物进行rt-pcr。图4a示出固定补骨脂宁浓度(5μm)处理细胞,不同作用天数(第0,1,3和5天)的pcr结果图。图4b示出固定作用天数(第4天),不同补骨脂宁浓度(0.5-5μm)处理细胞后的pcr结果图。
66.表1.rt-pcr所用破骨细胞分化特征基因的引物
[0067][0068]
如图4所示,补骨脂宁可显著抑制nfatc1、c-fos、抗酒石酸性酸性磷酸酶、组织蛋白酶k、降钙素受体、树突状细胞-特异性跨膜蛋白、基质金属蛋白酶-9、囊泡型atp酶d2亚单位基因的转录水平,且呈作用时间、作用剂量双依赖的特点。这些结果表明,补骨脂宁通过抑制与破骨细胞生成相关的基因的表达而抑制由rankl诱导的破骨细胞生成。
[0069]
实施例4:补骨脂宁使nfatc1和ctsk蛋白表达降低
[0070]
使用蛋白质免疫印迹实验(western blot)检测补骨脂宁是否会影响nfatc1和ctsk的蛋白表达水平。实验步骤如下:
[0071]
细胞培养与加药方式如实施例2所示,以用药物处理细胞当天作为第0天,在设定的第0,2,4天收集细胞,加入裂解液(0.125m tris-cl,ph 6.8,4%sds,20%甘油,2%2-巯基乙醇和0.02%溴酚蓝)进行细胞裂解,于4℃以13200r/分钟离心10分钟,转移上清液于ep管中,以bradford法测定蛋白浓度。取等量(20μg)蛋白进行sds-page电泳并转移至硝酸纤维素膜上,采用化学发光法检测,并进行图像分析,用相对灰度值表示蛋白相对含量。所用的抗体分别为:鼠源anti-nfatc1(santa cruz biotechnology,cat#sc-7294,稀释比例1:200)、anti-组织蛋白酶k(santa cruz biotechnology cat#sc-48353,稀释比例1:200)、anti-β-肌动蛋白(sigma-aldrich cat#a5316,稀释比例1:10,000)和过氧化物酶(hrp)缀合的抗小鼠二抗(稀释比例1:5,000)。
[0072]
如图5所示,补骨脂宁以时间依赖方式显著抑制了nfatc1和ctsk的蛋白表达水平,且在第4天对nfatc1和ctsk都有抑制作用。
[0073]
实施例5:磷脂结合蛋白v(annexinv)-fitc/pi双标记法检测补骨脂宁对破骨细胞
凋亡率的影响
[0074]
参照annexinv-fitc/pi双染色试剂盒(bd biosciences,富兰克林湖,nj)的说明书进行细胞处理。细胞培养与加药方式如实施例2所示,在设定的第3天收集细胞,并用pbs液清洗2次。加100μl结合缓冲液制备细胞悬液,再加入5μl磷脂结合蛋白-异硫氰酸荧光素(annexinv-fitc)和5μl碘化丙啶(pi)混匀,室温避光反应15分钟。接着,加入400μl结合缓冲液终止反应,细胞悬液经200目筛网过滤分装到流式管,立即用流式细胞仪(bd biosciences,圣何塞,ca;型号bd facsaria iii)检测。
[0075]
如图6所示,补骨脂宁对破骨细胞的凋亡没有明显作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1