卟啉类化合物在制备抗冠状病毒药物中的应用的制作方法
[0001]
本发明涉及医药领域,特别是抗病毒药物技术领域,具体涉及卟啉类化合物在制备抗冠状病毒药物中的应用。
背景技术:
[0002]
冠状病毒(coronaviruses,covs)是一类具有囊膜的球状正链单股rna病毒。它们广泛存在于人类与其他哺乳动物中,能引发呼吸道、肠道、肝脏和神经等多系统疾病。自发现以来,冠状病毒在本世纪已经造成了3起致命性传染病的大暴发,对人类健康构成了巨大威胁。
[0003]
2019年12月暴发了一场由新型冠状病毒(sars-cov-2)感染引起的全球传染性肺炎疫情,目前已经涉及了全球上百个国家。这也是至今发现的第7种可以感染人类的冠状病毒。根据对该冠状病毒的系统发育关系的分析,sars-cov-2与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,sars-cov)具有大约79%的同源性,与中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,mers-cov)具有大约50%的同源性,这两者的致死率分别是10%和37%。sars-cov-2也同样具有传播速度快、范围广和可以引起具有致命性肺炎等特点,造成了对世界范围内的严重威胁。
[0004]
但是,迄今为止,仍未发现直接抑制sars-cov-2的特异性抗病毒药物,目前对于sars-cov-2的治疗方案多以缓解症状、减少并发症发生、预防继发感染、进行器官功能支持为主。因此,面对sars-cov-2危害的日益严重,以及缺少特异性抗病毒药物的局面,为了抗击疫情,寻找开发新型的抗病毒活性化合物并研究其抗病毒机理具有非常重要的意义。
[0005]
然而,现有技术并未见具有抗冠状病毒活性的化合物,因此,提供一种具有抗冠状病毒活性尤其是抗新型冠状病毒活性的化合物显得很有必要。
技术实现要素:
[0006]
本发明的目的在于针对现有技术的不足,开发新的高效、低毒的抗sars-cov-2活性成分。本发明通过无数次筛选实验,并通过大量的生物学实验验证,发现卟啉类化合物对sars-cov-2具有较高的抑制活性,其在低浓度下对sars-cov-2表现出显著的抑制效果,低毒,有效作用浓度对细胞无不利影响,可以作为新型冠状病毒抑制剂。基于该发现,本发明提供一种卟啉类化合物在制备抗冠状病毒药物中的应用。
[0007]
本发明的第一目的是提供卟啉类化合物或其药学上可接受的盐在制备抗冠状病毒药物中的应用,所述卟啉类化合物的结构式如下:
[0008][0009]
其中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
分别或同时选自如下基团:
[0010][0011]
优选地,冠状病毒为严重急性呼吸综合征冠状病毒、中东呼吸综合征冠状病毒或新型冠状病毒。
[0012]
进一步地,冠状病毒为新型冠状病毒。
[0013]
进一步地,所述卟啉类化合物为tmpyp4或nmm,所述卟啉类化合物优选为tmpyp4。
[0014]
其中,tmpyp4的结构式如下式2所示:
[0015][0016]
nmm的结构式如下式3所示:
[0017][0018]
进一步地,卟啉类化合物或其药学上可接受的盐在制备抗冠状病毒药物中的应用,包括不同卟啉类化合物或其药学上可接受的盐的药物联用。
[0019]
本发明的第二目的是一种抗冠状病毒的药物,包括卟啉类化合物或其药学上可接受的盐。
[0020]
进一步地,上述药物还包括药剂学可接受的辅料和载体。
[0021]
进一步地,上述药物的药物制剂是颗粒剂、片剂、丸剂、胶囊剂、注射剂或栓剂。
[0022]
本发明的有益效果在于:
[0023]
1、本发明卟啉类化合物在低浓度下对冠状病毒尤其是新型冠状病毒(sars-cov-2)表现出显著的抑制效果;
[0024]
2、本发明卟啉类化合物低毒,在有效作用浓度下对细胞无不利影响;
[0025]
3、本发明卟啉类化合物在有效浓度下均可溶于水,不易降解、稳定性高,可以作为新型冠状病毒抑制剂,易于制备抗新型冠状病毒药物制剂。
附图说明
[0026]
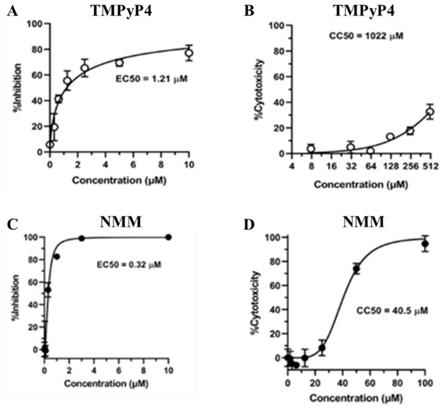
图1为tmpyp4和nmm的细胞毒性与抗sars-cov-2效果图。
具体实施方式
[0027]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0028]
实施例1:细胞与病毒培养
[0029]
测试细胞为vero e6(atcc crl-1586),培养基为dmem(添加2%胎牛血清、100iu/ml青霉素和100μg/ml链霉素),细胞在co2恒温培养箱(37℃,5%co2)中培养。sars-cov-2毒株(ncov-2019betacov/wuhan/wiv04/2019)获自中国科学院武汉病毒研究所国家病毒资源库(national virus resource,wuhan institute of virology,chinese academy of sciences)。
[0030]
实施例2:化合物溶液的配制
[0031]
根据试验剂量设计,分别准确称取tmpyp4和nmm于1.5ml离心管中,分别加入一定量的去离子水和二甲基亚砜(dmso)配成浓度为20mm的母液,并使其充分溶解。实验时,稀释至设计的终浓度,并分别以去离子水和dmso作为空白对照。
[0032]
实施例3:细胞毒性测定
[0033]
本实施例中使用cell counting kit-8(cck8)(中国,碧云天)评估了化合物对vero e6细胞的细胞毒性。将vero e6细胞以5
×
103cells/well的密度接种在96孔细胞培养板中,并在co2恒温培养箱(37℃,5%co2)中培养24小时。然后,将细胞分别暴露于不同浓度的tmpyp4(0、7.8125、15.625、31.25、62.5、125和500μm)和nmm(0、1.5625、3.125、6.25、12.5、25、50和100μm)24小时后,弃去孔内培养基,并添加含有10%cck-8溶液的新鲜dmem培养基,并在37℃下孵育1.5小时。最后,用酶标仪(synergyh1,biotek,usa)监测450nm处的吸光值(od
450
值)。
[0034]
分别计算tmpyp4和nmm对于细胞的半数中毒浓度(median cytotoxic concentration,cc50)。
[0035]
使用cck8细胞毒性测定试剂盒测定了这两种化合物的细胞毒性,tmpyp4的细胞毒性结果如图1b所示,结果表明,tmpyp4的cc50(50%细胞毒性浓度)高于1000μm(图1b),nmm的细胞毒性结果如图1d所示,结果表明,nmm的cc50(50%细胞毒性浓度)为40.5μm(图1d)。
[0036]
实施例4:抗病毒测定
[0037]
将vero e6细胞以1
×
105cells/well的密度接种到24孔细胞培养培养板中,并添加各种浓度(0,0.15625、0.3125、0.625、1.25、2.5、5、10μm)的化合物后,用0.005moi的sars-cov-2感染细胞。感染后24小时后,从每个孔的上清液中提取病毒总rna,并通过定量实时荧光pcr(qrt-pcr)确定病毒的产量,以计算病毒抑制率。具体而言,使用带有探针5'-fam-tggttgacctacacaggtgccatca-bhq1-3'的引物orf1ab-f(5'-ccctgtgggttttacacttaa-3')和orf1ab-r(5'-acgattgtgcatcagctga-3')引物用于检测orf1ab的表达量。
[0038]
分别用不同浓度的tmpyp4和不同浓度的nmm处理感染sars-cov-2的vero-e6细胞,确定了tmpyp4和nmm对sars-cov-2的抗病毒活性。具体而言,设计了靶向orf1ab的引物,通过qrt-pcr对化合物处理后的病毒rna进行定量分析。tmpyp4对sars-cov-2的抗病毒活性结果如图1a所示,nmm对sars-cov-2的抗病毒活性结果如图1c所示,结果表明,两种化合物在感染细胞中均表现出剂量依赖性的sars-cov-2抑制活性,tmpyp4和nmm的ec
50
(半数有效浓度)分别为1.21μm和0.32μm。
[0039]
综合实施例3的结果(tmpyp4的cc
50
(50%细胞毒性浓度)高于1000μm(图1b),而nmm的cc
50
为40.5μm(图1d))可知,vero e6细胞对tmpyp4和nmm的选择性指数(si,cc50/ec50)分别高于844和126,由此表明这两种化合物具有良好的安全性。
[0040]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例
性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1