包括15-HEPE的组合物以及使用其治疗或预防纤维化的方法与流程
包括15-hepe的组合物以及使用其治疗或预防纤维化的方法
[0001]
本申请是申请号为201580074543.0,申请日为2015年12月02日,发明名称为“包括15-hepe的组合物以及使用其治疗或预防纤维化的方法”的分案申请。
[0002]
优先权要求
[0003]
本申请要求2014年12月2日提交的美国临时专利申请序列号62/086,535的优先权,将其全部内容通过引用结合在此。
技术领域
[0004]
本披露提供组合物、配制品以及通过向对其有需要的受试者给予包括15-羟基二十碳五烯酸(也称为15-hepe或15-ohepa)的药物组合物治疗或预防纤维化(例如肝纤维化)的方法。
背景技术:
[0005]
纤维化的特征在于在器官或组织中形成过量的结缔组织。典型地,纤维化是响应于器官或组织的损伤而发生的。因为该过程可以包括结缔组织分子的交联,所以用于逆转纤维化的有效疗法是少之又少。虽然预防性疗法早已被理论化,但纤维化机制迄今已被证明太复杂以至于难以克服。例如,至今没有经fda批准的肝纤维化疗法,而在过去二十年中,只有少数提出的治疗方法已经示出了希望。参见例如,舒潘(schuppan)和金姆(kim),临床研究杂志(j.clin.invest.),第123(5)卷,第1887-1901页(2013)。
[0006]
因此需要用于治疗和/或预防纤维化的改进的疗法。
技术实现要素:
[0007]
在一些实施例中,本披露提供在对其有需要的受试者中治疗和/或预防纤维化的方法,该方法包括向该受试者给予包括15-hepe的组合物。
[0008]
在一些实施例中,本披露提供在进行纤维化疗法的受试者中治疗纤维化的方法,该方法包括向受试者给予包括15-hepe的组合物。
[0009]
在一些实施例中,本披露提供用于在对其有需要的受试者中治疗和/或预防纤维化的组合物,其中该组合物包括有效量的15-hepe。
[0010]
在一些实施例中,本披露提供15-hepe在制造用于在受试者中治疗和/或预防纤维化的药物中的用途。
[0011]
本文披露的技术的其他特征和优点将从以下详细描述中变得明显。
附图说明
[0012]
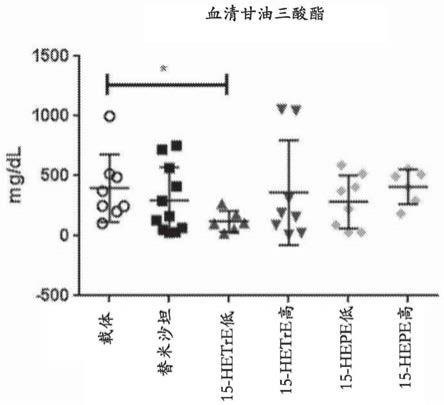
图1示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦(2-(4-{[4-甲基-6-(1-甲基-1h-1,3-苯并咪唑-2-基)-2-丙基-1h-1,3-苯并咪唑-1-基]甲基}苯基)苯甲酸,也称为)、15-羟基二十碳-8(z),11(z),13(e)-三烯酸(15-hetre)或15-hepe治疗8周的小鼠的血清甘油三酸酯的差异。
[0013]
图2示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre或15-hepe治疗8周的小鼠的极低密度脂蛋白(vldl)水平的差异。
[0014]
图3示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre或15-hepe治疗8周的小鼠的低密度脂蛋白(ldl)水平的差异。
[0015]
图4示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre或15-hepe治疗8周的小鼠的总胆固醇水平的差异。
[0016]
图5示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre或15-hepe治疗8周的小鼠的羟脯氨酸水平的差异。
[0017]
图6示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre或15-hepe治疗8周的小鼠的血浆丙氨酸转氨酶(alt)水平的差异。
[0018]
图7a示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体治疗8周的小鼠中,示出胶原形成的组织学(天狼星红染色,200x)。图7b示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用替米沙坦治疗8周的小鼠中,示出胶原形成的组织学(天狼星红染色,200x)。图7c示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用15-hepe治疗8周的小鼠中,示出胶原形成的组织学(天狼星红染色,200x)。图7d图示了在图7a-7c的组织学样品中观察到的天狼星红染色的程度。
[0019]
图8a示出了从出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体治疗8周的小鼠中获得的肝组织的组织学(苏木精和伊红染色,200x)。图8b示出了从出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用替米沙坦治疗8周的小鼠中获得的肝组织的组织学(苏木精和伊红染色,200x)。图8c示出了从出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用15-hepe治疗8周的小鼠中获得的肝组织的组织学(苏木精和伊红染色,200x)。图8d示出在出生之后给予单剂量的链脲佐菌素,喂食高脂肪饮食4周,然后用载体、替米沙坦、15-hetre(低或高剂量)或15-hepe(低或高剂量)治疗8周的小鼠的nafld活性评分(nas)。
[0020]
图9示出了在小鼠模型中4周之后,与载体、替米沙坦和epa相比,15-hepe的作用。
[0021]
图10示出了100ug/ml的as 15-hepe对tgf-β诱导的α-sma的抑制。
[0022]
图11示出了与未治疗的动物相比,给予15-hepe(ds102)500mg/kg 7天的动物中的肝和肺15-hepe浓度。
具体实施方式
[0023]
本披露提供包括15-hepe的组合物,以及使用其用于在对其有需要的受试者中治疗和/或预防纤维化的方法。
[0024]
15-羟基-二十-5,8,11,13,17-五烯酸是具有化学式(i)中所示的一般结构的功能化的脂肪酸。
[0025][0026]
根据本领域已知的方法,可以从二十碳五烯酸(epa)合成15-hepe。如在此使用的,术语“15-hepe”可以指处于其游离酸形式的15-hepe(例如,15-羟基-二十-5,8,11,13,17-五烯酸;在化学式(i)中r=r
′
=h)和/或与化学式(i)一致的其衍生物,如药学上可接受的酯(r≠h)、缀合物、或盐(r是离子)、或任何前述项的混合物。可以使用15-hepe的衍生物(例如,r≠h和/或r
′
≠h)作为代替。在一些实施例中,将15-hepe以游离酸形式(即r=h)使用。可替代地,在本披露的某些实施例中使用15-hepe的药学上可接受的酯或盐。在一些实施例中,15-hepe是处于c
1-4
烷基酯的形式,如甲基酯(r=ch
3
)或乙基酯(r=ch
2
ch
3
)形式。15-hepe是手性分子并且可以按15(s)-或15(r)-对映异构体形式、对映异构性富集形式或作为外消旋混合物使用。在此使用的“15-hepe”包括所有此类形式,而不限于立体专一性。在另一个实施例中,15-hepe包括15(s)形式:15(s)-羟基-(5z,8z,11z,13e,17z)-二十碳五烯酸,或其衍生物。在一些实施例中,可以将15-hepe以其乙基酯的形式使用。
[0027]
如在此使用的,“epa”是指二十碳-5,8,11,14,17-五烯酸,也称为20:5n-3、ω-3脂肪酸。通过商业来源容易地可获得epa。
[0028]
因此,在本披露的一方面,提供在受试者中治疗和/或预防纤维化的方法,该方法包括向该受试者给予治疗有效量的包括15-hepe的组合物。
[0029]
本披露提供15-hepe或包括15-hepe的组合物,用于在治疗和/或预防纤维化中使用。
[0030]
本披露提供15-hepe或包括15-hepe的组合物在制造用于治疗和/或预防纤维化的药物中的用途。
[0031]
在另一方面,本披露提供包括治疗有效量的15-hepe的药物组合物。15-hepe可以是在药物组合物以及如在此所陈述的方法和用途中唯一的活性成分(例如,api)。15-hepe可以是唯一的活性成分。可替代地,15-hepe可以与用于治疗和/或预防纤维化的另外的一种或多种药剂组合用于共制剂或共同给予。如果使用另外的一种或多种活性药剂,15-hepe可以共配制为单一剂量单位,或15-hepe和另外的纤维化治疗剂可以配制为两个至多个剂量单位,用于协同、组合或相伴给予。
[0032]
本披露还提供15-hepe的配制品和包括15-hepe的配制品,以及使用这些配制品用于治疗和/或预防纤维化的方法。
[0033]
本披露进一步提供用于口服递送的、包括15-hepe的药物组合物。该组合物可以包括药学上可接受的赋形剂。15-hepe可以处于如在此讨论的任何形式。15-hepe可以从约
50mg至约3000mg存在。
[0034]
15-羟基二十碳五烯酸(15-hepe)
[0035]
在一个实施例中,本披露的组合物包括作为活性成分的15-hepe。15-hepe是对于15-羟基二十碳五烯酸(二十碳五烯酸(epa)的代谢产物)的缩写,可以经由本领域已知的方式进行合成,如将二十碳五烯酸暴露于酶(15-脂氧合酶)。如在此使用的,术语“15-hepe”是指以其游离酸形式存在的15-hepe(例如,15-羟基二十碳五烯酸)和/或其药学上可接受的酯、缀合物或盐,或任何前述项的混合物。可以使用15-hepe的衍生物作为代替,尽管这不包括缺少15-hepe的羟基基团的任何衍生的化合物。在本背景下,术语“药学上可接受的”意指所讨论的物质不会对受试者产生不可接受的毒性或与不会与组合物中的其他组分相互作用。
[0036]
在一个实施例中,15-hepe是处于酯的形式(在此也称为e-15-hepe或乙基-15-hepe)。在另一个实施例中,15-hepe包括15-hepe的c
1-c
5
烷基酯。在另一个实施例中,15-hepe包括15-hepe甲基酯、15-hepe丙基酯、或15-hepe丁基酯。在仍另一个实施例中,15-hepe包括光学活性15(s)-羟基-(5z,8z,11z,13e,17z)-二十碳五烯酸。此同分异构体可以按任何上文讨论的形式使用。
[0037]
在另一个实施例中,15-hepe包括15-hepe锂,15-hepe单、二或三甘油酯,或者15-hepe的任何其他酯或盐,或者15-hepe的游离酸形式。
[0038]
在不同实施例中,本披露提供药物组合物,例如包括15-hepe的口服可递送的组合物。在一个实施例中,组合物包括治疗有效量的15-hepe。在一个实施例中,药物组合物包括按重量计约0.1%至约99%、约1%至约95%、约5%至约90%的15-hepe。
[0039]
在一个实施例中,药物组合物包括按重量计约至少约70%、至少约80%或至少约90%的15-hepe。在一个实施例中,药物组合物包括按重量计至少约50%、至少约60%、至少约70%、至少约80%或至少约90%的15-hepe。
[0040]
在另一个实施例中,15-hepe以约1mg至约10,000mg、25mg至约7500mg、约25mg至约5000mg、约50mg至约5000mg、约50mg至约3000mg、约75mg至约2500mg、或约100mg至约1000mg的量存在于本披露的组合物中,例如约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、约925mg、约950mg、约975mg、约1000mg、约1025mg、约1050mg、约1075mg、约1100mg、约1025mg、约1050mg、约1075mg、约1200mg、约1225mg、约1250mg、约1275mg、约1300mg、约1325mg、约1350mg、约1375mg、约1400mg、约1425mg、约1450mg、约1475mg、约1500mg、约1525mg、约1550mg、约1575mg、约1600mg、约1625mg、约1650mg、约1675mg、约1700mg、约1725mg、约1750mg、约1775mg、约1800mg、约1825mg、约1850mg、约1875mg、约1900mg、约1925mg、约1950mg、约1975mg、约2000mg、约2025mg、约2050mg、约2075mg、约2100mg、约2125mg、约2150mg、约2175mg、约2200mg、约2225mg、约2250mg、约2275mg、约2300mg、约2325mg、约2350mg、约2375mg、约2400mg、约2425mg、约2450mg、约2475mg、约2500mg、约2525mg、约2550mg、约2575mg、约2600mg、约2625mg、约2650mg、约2675mg、约2700mg、约2725mg、约2750mg、约2775mg、约2800mg、约2825mg、约2850mg、约
2875mg、约2900mg、约2925mg、约2950mg、约2975mg、约3000mg、约3025mg、约3050mg、约3075mg、约3100mg、约3125mg、约3150mg、约3175mg、约3200mg、约3225mg、约3250mg、约3275mg、约3300mg、约3325mg、约3350mg、约3375mg、约3400mg、约3425mg、约3450mg、约3475mg、约3500mg、约3525mg、约3550mg、约3575mg、约3600mg、约3625mg、约3650mg、约3675mg、约3700mg、约3725mg、约3750mg、约3775mg、约3800mg、约3825mg、约3850mg、约3875mg、约3900mg、约3925mg、约3950mg、约3975mg、约4000mg、约4025mg、约4050mg、约4075mg、约4100mg、约4125mg、约4150mg、约4175mg、约4200mg、约4225mg、约4250mg、约4275mg、约4300mg、约4325mg、约4350mg、约4375mg、约4400mg、约4425mg、约4450mg、约4475mg、约4500mg、约4525mg、约4550mg、约4575mg、约4600mg、约4625mg、约4650mg、约4675mg、约4700mg、约4725mg、约4750mg、约4775mg、约4800mg、约4825mg、约4850mg、约4875mg、约4900mg、约4925mg、约4950mg、约4975mg、约5000mg、约5025mg、约5050mg、约5075mg、约5100mg、约5125mg、约5150mg、约5175mg、约5200mg、约5225mg、约5250mg、约5275mg、约5300mg、约5325mg、约5350mg、约5375mg、约5400mg、约5425mg、约5450mg、约5475mg、约5500mg、约5525mg、约5550mg、约5575mg、约5600mg、约5625mg、约5650mg、约5675mg、约5700mg、约5725mg、约5750mg、约5775mg、约5800mg、约5825mg、约5850mg、约5875mg、约5900mg、约5925mg、约5950mg、约5975mg、约6000mg、约6025mg、约6050mg、约6075mg、约6100mg、约6125mg、约6150mg、约6175mg、约6200mg、约6225mg、约6250mg、约6275mg、约6300mg、约6325mg、约6350mg、约6375mg、约6400mg、约6425mg、约6450mg、约6475mg、约6500mg、约6525mg、约6550mg、约6575mg、约6600mg、约6625mg、约6650mg、约6675mg、约6700mg、约6725mg、约6750mg、约6775mg、约6800mg、约6825mg、约6850mg、约6875mg、约6900mg、约6925mg、约6950mg、约6975mg、约7000mg、约7025mg、约7050mg、约7075mg、约7100mg、约7125mg、约7150mg、约7175mg、约7200mg、约7225mg、约7250mg、约7275mg、约7300mg、约7325mg、约7350mg、约7375mg、约7400mg、约7425mg、约7450mg、约7475mg、约7500mg、约7525mg、约7550mg、约7575mg、约7600mg、约7625mg、约7650mg、约7675mg、约7700mg、约7725mg、约7750mg、约7775mg、约7800mg、约7825mg、约7850mg、约7875mg、约7900mg、约7925mg、约7950mg、约7975mg、约8000mg、约8025mg、约8050mg、约8075mg、约8100mg、约8125mg、约8150mg、约8175mg、约8200mg、约8225mg、约8250mg、约8275mg、约8300mg、约8325mg、约8350mg、约8375mg、约8400mg、约8425mg、约8450mg、约8475mg、约8500mg、约8525mg、约8550mg、约8575mg、约8600mg、约8625mg、约8650mg、约8675mg、约8700mg、约8725mg、约8750mg、约8775mg、约8800mg、约8825mg、约8850mg、约8875mg、约8900mg、约8925mg、约8950mg、约8975mg、约9000mg、约9025mg、约9050mg、约9075mg、约9100mg、约9125mg、约9150mg、约9175mg、约9200mg、约9225mg、约9250mg、约9275mg、约9300mg、约9325mg、约9350mg、约9375mg、约9400mg、约9425mg、约9450mg、约9475mg、约9500mg、约9525mg、约9550mg、约9575mg、约9600mg、约9625mg、约9650mg、约9675mg、约9700mg、约9725mg、约9750mg、约9775mg、约9800mg、约9825mg、约9850mg、约9875mg、约9900mg、约9925mg、约9950mg、约9975mg、或约10,000mg。
[0041]
在一个实施例中,存在于本披露的组合物中的15-hepe包括按重量计至少90%的15-hepe。15-hepe组合物可以包括甚至更高纯度的15-hepe,例如按重量计至少95%15-hepe、或按重量计至少97%15-hepe,其中15-hepe是处于如本文所述的15-hepe的任何形
式。15-hepe的纯度可以通过在此提供的任何15-hepe的描述进一步定义(例如,杂质分布)。
[0042]
上文讨论了在药物组合物中的15-hepe的量及其纯度。必需脂肪酸的性质及其合成是这样:使得15-hepe组合物可以来自包括来自必需脂肪酸代谢级联中其他必需脂肪酸的部分。
[0043]
在一个实施例中,本披露的组合物包含按重量计不超过约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、不超过约1%或不超过约0.5%的其他ω-3脂肪酸(包括α亚麻酸、十八碳四烯酸、二十二碳六烯酸(dha))或其衍生物。在其他实施例中,基本上不存在或不存在此类其他ω-3脂肪酸。
[0044]
在另一个实施例中,15-hepe代表存在于本披露的组合物中的按重量计至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%、至少约99%、或100%的所有脂肪酸。
[0045]
从15-hepe的合成可以存在一些残余的二十碳五烯酸。可以存在按重量计不超过约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%、不超过约1%、或不超过约0.5%的epa。可替代地,基本上没有或没有处于其未被修饰为羟基形式的形式的epa。
[0046]
另外的活性剂
[0047]
在一个实施例中,该药物组合物进一步包括至少一种或多种另外的活性剂。在一个实施例中,该药物组合物包括小于此药剂普遍认可的治疗有效量的另外的活性剂的量。在一个实施例中,该药物组合物包括等于或大于此药剂剂普遍认可的治疗有效量的另外的活性剂的量。
[0048]
在一些实施例中,该另外的活性剂是丙型肝炎病毒(hcv)非抗病毒剂、hcv抗病毒剂、乙型肝炎病毒(hbv)非抗病毒剂、hbv抗病毒剂、原发性胆汁性肝硬化药剂、酒精性肝炎药剂、原发性硬化性胆管炎药剂、非酒精性脂肪性肝炎(nash)药剂、自身免疫性肝炎药剂、肺纤维化药剂、囊胞性纤维病药剂、肾纤维化药剂、皮肤纤维化药剂、骨髓纤维化药剂、嗜酸细胞性食管炎药剂、抗-tgf-β药剂、抗-ctgf药剂、重组人血清淀粉样蛋白p药剂、抗-il-4药剂、抗-il-5药剂(例如,美泊利单抗)、抗-il-13药剂、神经化学受体药剂、抗-il-17a药剂、hh或hh(r)smo拮抗剂、ccr5拮抗剂、ccr4细胞募集抑制剂、cxcr4拮抗剂、抗-cxcr4药剂、cxcr3拮抗剂、抗-ccl17药剂、nox抑制剂、醋酸格拉替雷、脂联素、ampk激动剂、y-box结合蛋白-1、成肌纤维细胞募集抑制剂、抗-th17 mmp诱导剂、抗细胞外基质沉积化合物、腺苷受体拮抗剂、微小-rna(mir)药剂、干细胞、替诺福韦、抗胶原交联剂(例如,simtuzumab、莫加木珠单抗(mogamulizumab))、或选自下组的血管紧张素ii受体阻断剂(arb),该组由以下各项组成:缬沙坦、替米沙坦、洛沙坦、厄贝沙坦、阿齐沙坦、依普沙坦、奥美沙坦、或任何前述项的组合。
[0049]
在一个实施例中,该一种或多种另外的活性剂包括、基本上由、或者由替米沙坦组成。
[0050]
在一个实施例中,15-hepe和一种或多种活性剂存在于本披露的组合物中,或以约1:1000至约1000:1、约1:500至约500:1、约1:100至约100:1、约1:50至约50:1、约1:25至约25:1、约1:10至约10:1、约1:5至约5:1、约1:4至约4:1、约1:3至约3:1、约1:2至约2:1或约1:
1的15-hepe:另外的药剂的重量比共给予。
[0051]
剂型
[0052]
用于根据本披露使用的组合物可以配制为一个或多个剂量单位。术语“剂量单位(dose unit和dosage unit)”在本文中是指这样的药物组合物的一部分,该部分包含适用于单次给予从而提供治疗效果的治疗剂的量。这样的剂量单位可以每天给予一次至多次(即,1至约10,1至8,1至6,1至4或1至2次),或者引起治疗反应所需要的许多次。
[0053]
在一些实施例中,本披露的组合物是处于口服可递送的剂形或单位的形式。适合的剂形的非限制性实例包括片剂(例如悬浮液片剂、咬悬浮液片剂、快速分散片剂、咀嚼片剂等)、囊片、胶囊(例如软或硬明胶胶囊或hpmc胶囊)、锭剂、小药囊、扁囊剂、糖锭剂、丸剂、悬浮液、酏剂、糖浆)或适合口服给予的任何其他固体剂型。术语“口服递送”和“口服给予”在本文中包括任何形式的递送,其中将该药剂或组合物放置于在治疗下的受试者的口中,不管是否被吞咽。因此这包括口颊的和舌下的给予,连同食道给予。
[0054]
可替代地,本披露的组合物还可以配制用于直肠的、局部的或胃肠道外的(例如皮下的、肌内的、静脉内的和真皮内的或输注)递送。
[0055]
在讨论本披露的组合物中的15-hepe的量时,这可以分成若干种剂型。关于用于口服给予的规模是存在限度的。如果一天将1至4克的15-hepe给予受试者,这可以多达4个胶囊,每个胶囊提供1g 15-hepe。
[0056]
本披露的组合物可以是处于直接吸入的液体剂型或剂量单位的形式,或者它们可以在摄入之前与食物或饮料混合。适合的液体剂型的非限制性实例包括溶液、悬浮液、酏剂、糖浆、液体气雾剂配制品等。
[0057]
在另一个实施例中,本披露的组合物包括一种或多种药学上可接受的赋形剂。术语“药学上可接收的赋形剂”在本文中意指以下所述的任何物质,自身不是治疗剂,所述的物质被用作运载体或载体从而用于将治疗剂递送给受试者,或者该物质添加至药物组合物中,从而改进该组合物的处理或储存特性,或者允许或有利于形成单位剂量的组合物,并且其不产生不可接受的毒性或不与组合物中的其他组分相互作用。仅通过举例的方式,根据本披露的药物组合物可以包括以下各项中的一个或多个:抗氧化剂、表面活性剂、防腐剂、调味剂、共溶剂、粘度助剂、悬浮助剂、和亲脂相。
[0058]
在一个实施例中,该药物组合物包括一种或多种抗氧化剂,如抗坏血酸、棕榈酸、抗坏血酸棕榈酸酯、α-生育酚、艾地苯醌、泛醌、阿魏酸、辅酶q10、番茄红素、绿茶、儿茶素、表没食子儿茶素-3-没食子酸酯(egcg)、绿茶多酚(gtp)、水飞蓟素、咖啡浆果、白藜芦醇、葡萄籽、石榴提取物、金雀异黄素、碧萝芷、烟酰胺、丁基化羟基甲苯(bht)、丁基化羟基苯甲醚(bha)等。在一个实施例中,药物组合物包括约0.01wt.%至约2wt.%的抗氧化剂,例如约0.01wt.%、约0.02wt.%、约0.03wt.%、约0.04wt.%、约0.05wt.%、约0.06wt.%、约0.07wt.%、约0.08wt.%、约0.09wt.%、约0.1wt.%、约0.11wt.%、约0.12wt.%、约0.13wt.%、约0.14wt.%、约0.15wt.%、约0.16wt.%、约0.17wt.%、约0.18wt.%、约0.19wt.%、约0.2wt.%、约0.21wt.%、约0.22wt.%、约0.23wt.%、约0.24wt.%、约0.25wt.%、约0.26wt.%、约0.27wt.%、约0.28wt.%、约0.29wt.%、约0.3wt.%、约0.31wt.%、约0.32wt.%、约0.33wt.%、约0.34wt.%、约0.35wt.%、约0.36wt.%、约0.37wt.%、约0.38wt.%、约0.39wt.%、约0.4wt.%、约0.41wt.%、约0.42wt.%、约
0.43wt.%、约0.44wt.%、约0.45wt.%、约0.46wt.%、约0.47wt.%、约0.48wt.%、约0.49wt.%、约0.5wt.%、约0.51wt.%、约0.52wt.%、约0.53wt.%、约0.54wt.%、约0.55wt.%、约0.56wt.%、约0.57wt.%、约0.58wt.%、约0.59wt.%、约0.6wt.%、约0.61wt.%、约0.62wt.%、约0.63wt.%、约0.64wt.%、约0.65wt.%、约0.66wt.%、约0.67wt.%、约0.68wt.%、约0.69wt.%、约0.7wt.%、约0.71wt.%、约0.72wt.%、约0.73wt.%、约0.74wt.%、约0.75wt.%、约0.76wt.%、约0.77wt.%、约0.78wt.%、约0.79wt.%、约0.8wt.%、约0.81wt.%、约0.82wt.%、约0.83wt.%、约0.84wt.%、约0.85wt.%、约0.86wt.%、约0.87wt.%、约0.88wt.%、约0.89wt.%、约0.9wt.%、约0.91wt.%、约0.92wt.%、约0.93wt.%、约0.94wt.%、约0.95wt.%、约0.96wt.%、约0.97wt.%、约0.98wt.%、约0.99wt.%、约1wt.%、约1.1wt.%、约1.2wt.%、约1.3wt.%、约1.4wt.%、约1.5wt.%、约1.6wt.%、约1.7wt.%、约1.8wt.%、约1.9wt.%、或约2wt.%的一种或多种抗氧化剂。
[0059]
治疗方法
[0060]
在此披露的组合物和配制品可以用于治疗纤维化。在一个实施例中,该纤维化与器官或组织相关,该器官或组织与肺、肝、心脏、肾脏、一个或多个眼睛、纵隔、骨髓、腹膜后腔、皮肤、肠、关节、生殖器官或其组合相关。在一些实施例中,该纤维化与肝组织相关。在一个实施例中,该纤维化包括特发性肺纤维化。
[0061]
在一些实施例中,该纤维化与非酒精性脂肪肝疾病(nafld)相关。在一些实施例中,在给予组合物之后在受试者中的nafld活性评分(nas)减小。在一些实施例中,与基线相比,在受试者中的nas减小。在一些实施例中,与没有给予组合物的第二受试者相比,nas减小。在一些实施例中,已经向该第二受试者给予安慰剂。在一些实施例中,该第二受试者是进行纤维化疗法。
[0062]
在一些实施例中,该受试者是进行纤维化疗法。在一些实施例中,在给予组合物期间继续纤维化疗法。在其他实施例中,在给予组合物期间中断纤维化疗法。例如,在一些实施例中,受试者是进行替米沙坦疗法,并且在开始治疗方法(该治疗方法包括给予如在此披露的包括15-hepe的组合物)之后,中断替米沙坦疗法。
[0063]
在一些实施例中,该组合物是口服给予。
[0064]
在一些实施例中,15-hepe是组合物中的唯一活性成分。在其他实施例中,该组合物进一步包括影响纤维化疗法的另外的药剂。
[0065]
在一些实施例中,本披露提供在进行纤维化疗法的受试者中治疗纤维化的方法,该方法包括向受试者给予包括15-hepe的组合物。在一些实施例中,该纤维化与选自下组的器官或组织相关,该组由以下各项组成:肺、肝、心脏、肾脏、眼睛、纵隔、骨髓、腹腔后膜、皮肤、肠、关节、生殖器官及其组合。在一些实施例中,该纤维化是肝纤维化。在一些实施例中,该纤维化与非酒精性脂肪肝疾病(nafld)相关。在一些实施例中,在给予组合物之后在受试者中的nafld活性评分(nas)减小。在一些实施例中,与基线相比,在受试者中的nas减小。在一些实施例中,与没有给予组合物的第二受试者相比,nas减小。在一些实施例中,已经向该第二受试者给予安慰剂。在一些实施例中,该第二受试者是进行纤维化疗法。在一些实施例中,该纤维化疗法包括给予hcv非抗病毒剂、hcv抗病毒剂、hbv非抗病毒剂、hbv抗病毒剂、原发性胆汁性肝硬化药剂、酒精性肝炎药剂、原发性硬化性胆管炎药剂、nash药剂、自身免疫
性肝炎药剂、肺纤维化药剂、囊胞性纤维病药剂、肾纤维化药剂、皮肤纤维化药剂、骨髓纤维化药剂、嗜酸细胞性食管炎药剂、抗-tgf-β药剂、抗-ctgf药剂、重组人血清淀粉样蛋白p药剂、抗-il-4药剂、抗-il-5药剂(例如,美泊利单抗)、抗-il-13药剂、神经化学受体药剂、抗-il-17a药剂、hh或hh(r)smo拮抗剂、ccr5拮抗剂、ccr4细胞募集抑制剂、cxcr4拮抗剂、抗-cxcr4药剂、cxcr3拮抗剂、抗-ccl17药剂、nox抑制剂、醋酸格拉替雷、脂联素、ampk激动剂、y-box结合蛋白-1、成肌纤维细胞募集抑制剂、抗-th17mmp诱导剂、抗细胞外基质沉积化合物、腺苷受体拮抗剂、微小-rna(mir)药剂、干细胞、替诺福韦、抗胶原交联剂(例如,simtuzumab、莫加木珠单抗(mogamulizumab))、或选自下组的血管紧张素ii受体阻断剂(arb),该组由以下各项组成:缬沙坦、替米沙坦、洛沙坦、厄贝沙坦、阿齐沙坦、依普沙坦、奥美沙坦或任何前述项的组合。在一些实施例中,该受试者是进行纤维化疗法。在一些实施例中,在给予组合物期间继续纤维化疗法。在一些实施例中,该第二受试者是进行纤维化疗法。在一些实施例中,该组合物是口服给予。
[0066]
在此披露的方法一些实施例中,15-hepe是组合物中的唯一活性成分。在一些实施例中,该组合物进一步包括影响纤维化疗法的另外的药剂。
[0067]
在一些实施例中,该方法进一步包括在给予包括15-hepe的组合物之前鉴定受试者为患有纤维化。在一些实施例中,该方法进一步包括在给予包括15-hepe的组合物之前鉴定受试者为具有发展纤维化的增加的风险。在一些实施例中,鉴定的步骤包括确定与受试者相关的nas。在一些实施例中,与受试者相关的nas是至少3。在一些实施例中,鉴定的步骤包括括筛选与受试者相关的核酸分子中的遗传突变。在一些实施例中,鉴定的步骤包括获得与受试者相关的血液和/或血清的分析。在一些实施例中,鉴定的步骤包括检查与受试者相关的组织。在一些实施例中,检测的步骤包括分析与受试者相关的组织学组织样品(例如,活组织检查)。
[0068]
在一些实施例中,本披露的方法引起在受试者中nas值减小。在一些实施例中,该方法进一步包括在给予组合物一段时间之后,确定与受试者相关的第二更低的nas值。
[0069]
在一个实施例中,该方法包括向受试者每天一次、每天两次、每天三次、或每天三次以上给予如在此披露的药物组合物。
[0070]
在一个实施例中,本发明提供15-hepe或包括15-hepe的组合物在对其有需要的受试者中治疗或预防纤维化的用途,并且任选地其中(a)直至(m)中的任何一项或多项是真实的:
[0071]
(a)该纤维化与选自下组的器官或组织相关,该组由以下各项组成:肺、肝、心脏、纵隔、骨髓、腹腔后膜、皮肤、肠、关节、生殖器官及其组合;
[0072]
(b)该纤维化是肝纤维化或特发性肺纤维化;
[0073]
(c)该纤维化与非酒精性脂肪肝疾病(nafld)相关;
[0074]
(d)在给予组合物之后,在受试者中的nafld活性评分(nas)减小;
[0075]
(e)与基线相比,在受试者中的nas减小;
[0076]
(f)与没有给予组合物的第二受试者和/或已经给予安慰剂的第二受试者相比,nas减小;
[0077]
(g)该受试者是进行纤维化疗法;
[0078]
(h)在给予组合物期间继续纤维化疗法;
[0079]
(i)15-hepe或组合物是口服给予;
[0080]
(j)15-hepe是处于游离酸形式;
[0081]
(k)15-hepe是处于酯化的形式;
[0082]
(l)该酯化的形式是烷基酯形式或甘油三酸酯形式;
[0083]
(m)15-hepe是处于盐形式;
[0084]
(n)15-hepe包括15(s)-hepe;和/或
[0085]
(o)15-hepe包括15(r)-hepe。
[0086]
除非另外定义,否则在此所使用的所有技术和科学术语具有与本披露所属领域的普通技术人员通常所理解相同的含义。尽管与本文描述那些相似或等价的方法和材料可以用于本披露的实践中,但下文描述了合适的方法和材料。在此提及的所有出版物、专利申请、专利以及其他参考文献通过引用以其全文明文规定地结合在此。在有矛盾的情况下,将以本说明书(包括定义)为准。此外,本文描述的材料、方法和实例仅是说明性的并不旨在是限制性的。
[0087]
尽管本披露能够以不同形式体现,但是本说明书的以下若干个实施例是为了理解本披露内容被认为是本披露的示例而举出的,并不旨在将本披露的技术限制于所示的具体实施例中。标题仅为方便起见而提供,不应被解释为以任何方式限制本文披露的技术。可以将在任何标题下所述的实施例与任何其他标题下所述的实施例相组合。
[0088]
除非另有明确表示,否则在本申请中规定的不同定量值中使用数值陈述为近似为陈述范围内的附有前缀词语“约”的最小值和最大值。以这种方式,可以使用与规定值的轻微变化来实现与规定值基本相同的结果。而且,范围的披露内容旨在作为包括所列举的最小值和最大值之间的每个值的连续范围连同可以由这样的值所形成的任何范围。本文还披露了可以通过将所列举的数值分为任何其他列举的数值而形成的任何和所有比率(和任何这样的比率的范围)。因此,技术人员将理解的是,许多这样的比率、范围、和比率的范围可以明确来源于本文给出的数值,并且在所有情况下,如比率、范围和比率的范围都表示本披露的不同实施例。
[0089]
如在此使用的,疾病、障碍或病症的“治疗(treating或treatment)”至少部分地包括:(1)预防疾病、障碍、或病症,即使疾病、障碍、或病症的临床症状不在暴露于或易患疾病、障碍、或病症但尚未经历或显示疾病、障碍、或病症的症状的哺乳动物中发展;(2)抑制疾病、障碍、或病症,即阻止或减小疾病、障碍、或病症或其临床症状的发展;或(3)缓解疾病、障碍、或病症,即引起疾病、障碍、或病症或其临床症状的消退;与给出疾病或障碍相关的术语“预防”意指:如果没有发作,预防疾病发展的发作,预防疾病或障碍在易患障碍或疾病但尚未诊断患有障碍或疾病的受试者中发生,和/或如果已经存在,预防疾病/障碍的进一步发展。
[0090]
如在此使用的“有效量”是指赋予受试者治疗效果需要的活性组合物的量。本文所用术语“治疗有效量”指使所治疗疾病、障碍或病症的一种或多种症状得到某种程度缓解的药剂或化合物的充足给予量。在一些实施例中,结果是征象、症状、或疾病原因的减少和/或缓和,或者任何其他需要的生物系统变化。例如,在一些实施例中,治疗用途的“有效量”是包括本文披露的化合物的组合物用于临床提供疾病症状的显著减少而没有过度不良副作用的所需量。在一些实施例中,任何个案中的适当“有效量”是使用例如剂量增加研究等技
术确定的。术语“治疗有效量”包括例如预防有效量。在其他实施例中,在此披露的化合物(如具有化学式(a)或化学式(i)的化合物)的“有效量”是有效实现所希望的药理学效果或治疗改进而没有过度不良的副作用的量。在其他实施例中,应理解的是,对不同的受试者“有效量”或“治疗有效量”不同,是由于新陈代谢、年龄、体重、受试者的整体状态、被治疗的病症、被治疗的病症的严重程度和处方医师的判断的变化。在本背景下,术语“药学上可接受的”意指所讨论的物质不会对受试者产生不可接受的毒性或与不会与组合物中的其他组分相互作用。
[0091]
无需进一步描述,认为本领域普通技术人员可使用前述说明和以下说明性实例制造且利用本披露的这些药剂并实践所要求保护的方法。提供以下工作实例以便于本披露的实践,且不应理解为以任何方式限制本披露的其余部分。
[0092]
实例
[0093]
实例1.
[0094]
本研究的目的是检查与载体或相比于替米沙坦相比,15-hepe和15-hetre在nafld的小鼠模型中的作用。
[0095]
方案
[0096]
将获得自美国查尔斯河实验室(charles river laboratories)的c57/bl6小鼠分为如下的6个研究组:
[0097]
组1(载体):在出生之后,向十二个小鼠各自给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以10ml/kg的体积每天一次喂食载体。
[0098]
组2(替米沙坦):在出生之后,向十二个小鼠各自给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以5mg/kg的量每天一次喂食替米沙坦。
[0099]
组3(15-hepe,低剂量):在出生之后,向十二个小鼠各自给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以50mg/kg的量每天一次喂食15-hepe。
[0100]
组4(15-hepe,高剂量):在出生之后,向十二个小鼠各自给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以500mg/kg的量每天一次喂食15-hepe。
[0101]
组5(15-hetre,低剂量):在出生之后,向十二个小鼠各自给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以10mg/kg的量每天一次喂食15-hetre。
[0102]
组6(15-hetre,高剂量):在出生之后,向十二个小鼠给予单剂量的链脲佐菌素,并喂食高脂肪饮食四周。然后将小鼠从5至12周龄以100mg/kg的量每天一次喂食15-hetre。
[0103]
在12周龄,评估所有小鼠在以下各项的改变:
[0104]
·
血清生化(例如alt水平、ldl水平、vldl水平、hdl水平、甘油三酸酯水平、总胆固醇含量水平),
[0105]
·
纤维化(例如,组织学,使用天狼星红染色),和
[0106]
·
nafld活性评分(包括例如h&e染色组织学)
[0107]
结果
[0108]
如图1所示,低剂量15-hetre组的血清甘油三酸酯比载体显著更低(曼惠特尼
(mann whitney)检验)。类似地,与载体相比,低剂量15-hetre组的vldl和ldl水平显著更低(图2-3)。与载体相比,低剂量15-hetre组和低剂量15-hetre组的总胆固醇水平显著更低(图4)。如图5所示,与载体相比,任何组中的羟脯氨酸水平没有显著差异。如图6所示,与载体相比并与高剂量15-hetre组相比,高剂量15-hepe组中的血浆alt水平显著更低。值得注意的是,与载体相比,替米沙坦组的血清甘油三酯、vldl、ldl、总胆固醇、羟脯氨酸、或血浆alt未示出统计学上的显著减少。
[0109]
组织学结果(天狼星红染色)示出在图7a-7d中,并揭示当替米沙坦与载体相比时,高剂量15-hepe组发展了统计学上相当低量的纤维化。
[0110]
如揭示在图8a-d中,与安慰剂相比(图8a),高剂量15-hepe组(图8c)中的小鼠示出显著更低的nas(p<0.01)。与载体相比,替米沙坦组(图8b)也示出显著地更低的nas(p<0.001)。
[0111]
实例2.
[0112]
通过在出生后两天单次皮下注射200μg的链脲霉素(西格玛奥德里奇公司(sigma aldrich)),并且在4周龄后用高脂肪饮食(57kcal%脂肪,clea公司,日本)喂食,在小鼠中诱导非酒精性脂肪性肝炎(nash)。在随机化之后,从5至9周龄,每只小鼠每天一次口服给予载体、替米沙坦(10mg/kg)、15-hepe(500mg/kg)或epa(500mg/kg)。在第9周结束时,将小鼠处死并进行分析。
[0113]
如图9所示,在小鼠模型中,在治疗和/或预防肝纤维化时,15-hepe(500mg/kg)比epa(500mg/kg)或载体(图9)更有效。
[0114]
实例3.
[0115]
来自特发性肺纤维化(ipf)患者的肺成纤维细胞在其各自生长培养基中以每孔10000个细胞铺板并允许贴壁过夜。在贴壁之后,将细胞用在其各自测定培养基中用15(s)-hepe预治疗2小时。在2小时之后,然后将细胞用化合物+/-tgfβ(20ng/ml)处理48小时。在48小时之后,将条件培养基收集并在-80℃下冷冻用于未来的胶原分析。在收集之后,将细胞针对sma i表达染色。根据制造商的说明书进行胶原elisa。如图10所示,100ug/ml的15-hepe抑制tgf-β诱导的α-sma的产生。没有观察到细胞毒性。
[0116]
实例4.
[0117]
将大鼠(n=5)用15-hepe(ds102)500mg/kg给药7天,并切除器官以分析治疗的动物比未治疗的动物组织中的15-hepe水平。如图11所示,与未治疗的对照相比,治疗的动物的肝和肺中的15-hepe显著更多。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1