尼麦角林及其衍生物在制备治疗肿瘤药物中的用途的制作方法
1.本发明涉及制备治疗肿瘤药物技术领域,特别是涉及尼麦角林及其衍生物在制备治疗肿瘤药物中的用途。
背景技术:
2.肺癌是当今发病率和死亡率最高的恶性肿瘤。2018年世界肺癌新发病例209.4万,死亡176.1万例,居恶性肿瘤发病率和死亡率的首位。肺癌按组织病理学分类,主要包含非小细胞肺癌(non-small cell lung cancer,nsclc)和小细胞肺癌(small cell lung cancer,sclc)两大类。其中,nsclc约占肺癌总数的85%。而在nsclc中,腺癌(lung adenocarcinoma,luad)和鳞癌(lung squamous cell carcinoma,lusc)是两种主要类型,lusc是第二大最常见的肺癌亚型,约占nsclc总数的30%。每年导致全球约40万人死亡。
3.过去的十几年中,分子靶向治疗在晚期肺腺癌的治疗中取得了里程碑式的进展,如人表皮生长因子(epidermal growth factor receptor,egfr)抑制剂吉非替尼,厄洛替尼和埃克替尼以及间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)抑制剂克唑替尼,色瑞替尼等,使得肺腺癌患者的生存质量和总生存期得到明显的改善。但是,由于肺鳞癌患者中egfr基因突变及alk融合基因比较少见,egfr基因突变率仅为4.5%,alk融合基因的发生率《2.5%,导致了分子靶向药物在晚期肺鳞癌患者中疗效并不明确。与肺腺癌相比,晚期鳞癌患者至今没有有效的分子靶向药物可用,标准的一线治疗方案仍旧是含铂双药的化学治疗,对放化疗的敏感性不及未分化癌,大多数患者经历了一线,二线治疗失败后都面临无药可用的状态。因为治疗选择有限,近年来患者生存率无明显提高,lusc患者的五年存活率仅为15%,迫切需要开发新的肺鳞癌药物以提高lusc患者的临床疗效。
4.因此,寻找一种能有效治疗肺鳞癌从而提高肺鳞癌患者生存期的药物是发明需要解决的主要内容。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供尼麦角林及其衍生物在制备治疗肿瘤药物中的用途,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明提供尼麦角林、或其药学上可接受的盐在制备用于治疗肿瘤的药物中的用途。
7.在本发明的一些实施方式中,所述肿瘤为肺癌。
8.在本发明的一些实施方式中,所述肺癌为非小细胞肺癌。
9.在本发明的一些实施方式中,所述非小细胞肺癌选自肺磷癌、或肺腺癌。
10.在本发明的一些实施方式中,所述肿瘤为哺乳动物中的肿瘤。
11.在本发明的一些实施方式中,所述尼麦角林、或其药学上可接受的盐为唯一药效成分。
12.在本发明的一些实施方式中,所述药物选自片剂、胶囊剂、注射剂中的一种。
13.在本发明的一些实施方式中,所述尼麦角林的给药方式选自经口给药、胃肠外给药、经皮给药中的一种。
14.在本发明的一些实施方式中,所述尼麦角林、或其药学上可接受的盐的给药浓度为0.5~2.5mg/ml。
15.在本发明的一些实施方式中,所述尼麦角林、或其药学上可接受的盐的给药量0.5~2.7mg/kg/d。
附图说明
16.图1显示为实施例3中cck8实验检测尼麦角林、安乃近和丁洛地尔三种药物的肿瘤抑制效果(药物作用后72h后数据)
17.图2显示为实施例4中cck8实验检测不同浓度的尼麦角林药物的肿瘤抑制效果(药物作用后120h后数据)
18.图3显示为实施例5中动物体内疗效实验中肿瘤体积趋势图。
19.图4显示为实施例5中肿瘤大小的示意图。
具体实施方式
20.肿瘤药物开发经历了第一代的细胞毒性药物和第二代的分子靶向药物后,现已进入第三代的分子和细胞免疫药物。通过恢复或激发人体自身免疫潜能治愈疾病已经成为共识。如何找到并利用这种潜能是当前的研究热点。
21.临床实践中经常观察到肿瘤患者的异质性,即使背景相似的患者,相同治疗后的预后也并不相同,甚至相差非常大。这意味着患者自身存在着某种因素或机制有助于抵抗疾病和维持健康。患者的遗传背景与这种机制高度相关,患者自身的基因表达特征有可能导致了不同的生存期。如果能够找到这些特殊的基因并发现维持这些基因表达特征的物质,就可以利用这些物质治疗患者疾病和维持患者的健康。本发明的申请人就是利用这种机制进行药物重定位的,这是一种基于“相似”的策略。常见的“相似”策略认为相似(结构相似,表达谱相似,靶点相似)的药物具有相似的功能,相似的疾病可以被相同或相似的药物治疗。而本研究中将这种“相似”从单纯的药物或者疾病“相似”扩展到药物与健康的“相似”,通过寻找人体内存在的健康特征谱进行药物重定位研究。
22.通过对肿瘤异质性的洞察,运用tcga(the cancer genome atlas)中493例肺鳞癌病人的数据进行生存分析构建了180个基因组成的“长生存期”特征谱,进而应用基于特征谱的药物重定位研究,通过计算特征谱“相似性”的方法发现了潜在的肺鳞癌候选药物。而体外和体内结果证实了尼麦角林具有潜在的肿瘤特别是肺鳞癌肿瘤抑制作用,有望开发成一种肿瘤特别是肺鳞癌治疗的药物,提高肿瘤患者的生存期。在此基础上,完成了本发明。
23.本发明提供尼麦角林、或其药学上可接受的盐在制备治疗肿瘤药物中的用途。其中,“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
24.在本发明所提供的用途中,一优选实施例中,所述肿瘤为肺癌。
25.在本发明所提供的用途中,所述肿瘤为哺乳动物中的肿瘤。尤其是哺乳动物中的肺癌。例如哺乳动物是人类。
26.在本发明所提供的用途中,肺癌选自非小细胞肺癌、小细胞肺癌。优选选自非小细胞肺癌。在一些实施例中,本发明的肺癌是中晚期非小细胞肺癌,尤其是指化疗后的非小细胞肺癌。
27.其中,非小细胞肺癌例如可以是肺磷癌、肺腺癌、大细胞肺癌、腺鳞癌、肉瘤样癌、类癌瘤以及唾液腺等。本发明优选选自肺磷癌、肺腺癌。更优选选自肺鳞癌。
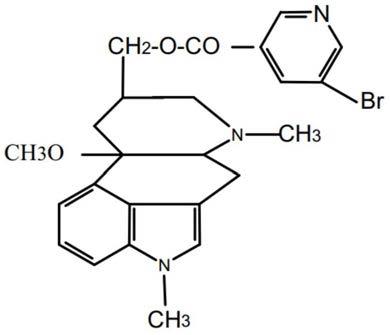
28.在本发明所提供的用途中,尼麦角林其化学名称为:10α-甲氧基-1,6-二甲基麦角林-8β-甲醇基-5-溴烟酸酯。分子式:c
24h26
o3n3br,分子量:484.40,其化学结构式:
[0029][0030]
在本发明所提供的用途中,尼麦角林的衍生物例如可以是麦角新碱、麦角胺等。
[0031][0032]
在本发明所提供的用途中,所述尼麦角林、或其药学上可接受的盐为唯一药效成分。
[0033]
进一步的,本发明中,除非特别说明,药物的剂型并无特别限定,可以被制成片剂、胶囊剂、注射剂等剂型,可通过常规方法进行制备。药物的剂型选择应与给药方式相匹配。本发明的优选实施方案中,可以被制成注射剂、胶囊剂和片剂等剂型。
[0034]
给药方式选自经口给药、胃肠外给药、经皮给药,所述胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射,优选经口给药。
[0035]
在本发明所提供的用途中,所述尼麦角林、或其药学上可接受的盐的给药浓度为
0.5~2.5mg/ml。在一些实施例中,尼麦角林及其衍生物的给药浓度例如可以为0.5~1mg/ml,1~1.5mg/ml,1.5~2mg/ml,或2~2.5mg/ml。
[0036]
在本发明所提供的用途中,所述尼麦角林、或其药学上可接受的盐的给药量0.5~2.7mg/kg/d。在一些实施例中,尼麦角林、或其药学上可接受的盐的给药量为0.5~1.0mg/kg/d、1.0~1.5mg/kg/d、1.5~2.0mg/kg/d,或2.0~2.7mg/kg/d。
[0037]
综上,本发明中,尼麦角林在临床上其他疾病中已有过广泛应用,作为老药新用对节省社会资源等有重大意义。尼麦角林用于治疗肿瘤的药物,可以有效治疗肿瘤尤其是肺鳞癌,从而提高肿瘤患者尤其是肺鳞癌患者生存期。
[0038]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0039]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0040]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0041]
实施例所用的材料来源:尼麦角林(上海阿拉丁生化科技股份有限公司)。本发明的其他药物均为市售。
[0042]
实施例1
[0043]
肺鳞癌病例的生存分析
[0044]
下载tcga肺鳞癌病例的临床信息数据和样本测序数据,删除生存数据不完整的病例后共得到490例肺鳞癌病例测序数据,每个样本包含20530个基因表达数据。对这20530个基因批量做生存分析,结果发现180个基因与较长生存期相关(p《0.01),其中上调基因149个,下调基因31个。表1和表2分别列出了排名前50上调基因和31个下调基因。
[0045]
表1排名前50上调基因列表
[0046][0047][0048]
表2 31个下调基因列表
[0049][0050]
实施例2
[0051]
肺鳞癌药物的重定位计算
[0052]
将生存分析得到的基因特征谱(149个上调,31个下调)进行基于特征谱的药物重定位计算,计算结果中排名前20的候选药物中如表3所示。排名前20的候选药物中包含了6种用于或者处于研究中的肿瘤治疗药物,作为一个阳性参考说明了本发明的计算方法的可行性。药物重定位计算方法是参考文献(wu h,huang j,zhong y,et al.drugsig:a resource for computational drug repositioning utilizing gene expression signatures[j].plos one,2017,12(5):e0177743.)
[0053]
表3特征谱重定位排名前20的候选药物
[0054][0055]
[0056]
其中,
[0057]
尼麦角林针对的18个基因分别是ntrk3,prkcdbp,pcdha2,pde1b,pdzk1ip1,timp3,jph2,nav3,kiaa0408,cd14,dpp4,rnase1,ptgir,glp1r,crtac1,trem1,znf345,gpr37l1。
[0058]
奥利司他针对的18个基因分别是ereg,cox7a1,ror1,aoc3,timp3,jph2,hnmt,hspb7,kcne4,nav3,kiaa0408,esr1,dlg2,f5,cd14,slc11a1,rnase1,cxcr1。
[0059]
氯戊米特针对的17个基因分别是bmp5,cox7a1,ablim3,cldn5,rgn,timp3,jph2,fstl3,znf835,esr1,folr2,gas6,loxl2,aldh7a1,cldn14,pfn2,lhx2。
[0060]
坦螺旋霉素针对的17个基因分别是cfb,lox,alpl,ntrk3,pcdha2,hspb8,vav2,rgn,timp3,nos3,znf835,c4bpb,siglec9,slc11a1,khdrbs2,ptgir,spon1。
[0061]
头孢唑林针对的17个基因分别是lox,pknox2,scg5,arhgap6,fat4,mfsd7,sh3tc1,nav3,folr2,cd14,slc11a1,rnase1,ptgir,glp1r,crtac1,trem1,s100a1。
[0062]
溴必利针对的16个基因分别是ntrk3,bmp5,pknox2,ror1,fcn3,acsm1,arhgap6,nos3,nav3,znf835,esr1,c4bpb,dlg2,ugt2b4,dpp4,cxcr1。
[0063]
雄酮针对的16个基因分别是sgca,prkcdbp,pcdha2,scg5,acsm1,pdzk1ip1,timp3,nos3,hnmt,hspb7,kcne4,esr1,slc11a1,glp1r,spon1,lhx2。
[0064]
核糖霉素针对的16个基因分别是alpl,sgca,hspb8,tcf21,pdzk1ip1,rgn,kcne4,nav3,kiaa0408,znf835,znf257,c4bpb,fbp1,loxl2,glp1r,fbxo2。
[0065]
匹氨青霉素针对的16个基因分别是lox,arhgap6,fat4,jph2,hspb7,nav3,znf835,esr1,dlg2,pou2f2,loxl2,slc11a1,dpp4,rnase1,glp1r,spon1。
[0066]
安乃近针对的16个基因分别是cfb,pknox2,pcdha2,cldn5,trhde,pdzk1ip1,aoc3,hnmt,f13a1,pou2f2,f5,hkdc1,dpp4,rnase1,znf345,fbxo2。
[0067]
6-氮杂胸腺嘧啶针对的16个基因分别是hopx,pdzk1ip1,rgn,timp3,f13a1,kcne4,itgb6,fga,folr2,crisp3,pou2f2,ceacam6,slc11a1,rnase1,spon1,gpr37l1。
[0068]
氟伏沙明针对的16个基因分别是ntrk3,sgca,prkcdbp,hopx,cldn5,arhgap6,itgb6,esr1,siglec5,c4bpb,crisp3,loxl2,ugt2b4,slc11a1,ptgir,spon1。
[0069]
氟苯尼考针对的16个基因分别是cfb,ereg,lox,ntrk3,scg5,pdzk1ip1,rgn,f13a1,esr1,dlg2,pou2f2,f5,slc11a1,rnase1,glp1r,s100a1。
[0070]
炔诺醇针对的16个基因分别是ereg,ntrk3,pknox2,acss3,fcn3,nav3,znf257,itgb6,fga,folr2,dlg2,siglec9,hkdc1,slc11a1,trem1,spon1。
[0071]
左甲状腺素钠针对的15个基因分别是cfb,pknox2,pcdha2,ablim3,ror1,znf835,fga,esr1,c4bpb,gas6,sod3,loxl2,ugt2b4,pcdhga11,glp1r。
[0072]
丁咯地尔针对的15个基因分别是pknox2,pcdha2,ablim3,magel2,ror1,tcf21,acsm1,pde1b,nav3,kiaa0408,sod3,loxl2,pcdhga11,dpp4,spon1。
[0073]
莫西赛利针对的15个基因分别是cfb,ntrk3,acot11,pknox2,tnfsf15,ror1,rgn,aoc3,esr1,siglec5,c4bpb,loxl2,ugt2b4,rnase1,gpr37l1。
[0074]
澳洲茄胺针对的15个基因分别是cfb,ntrk3,pknox2,cox7a1,znf385d,ror1,hspb8,rgn,esr1,folr2,ceacam6,dpp4,rnase1,lhx2,gpr37l1。
[0075]
螺内酯针对的15个基因分别是cfb,cldn5,ror1,pde1b,pdzk1ip1,kiaa0408,
esr1,c4bpb,dlg2,cd14,slc11a1,dpp4,rnase1,glp1r,spon1。
[0076]
n-乙酰-l-亮氨酸针对的15个基因分别是lox,ntrk3,prkcdbp,cox7a1,pcdha2,ablim3,arhgap6,timp3,kcne4,pou2f2,loxl2,rnase1,cldn14,spon1,fbxo2。
[0077]
实施例3
[0078]
重定位药物筛选实验
[0079]
细胞培养:
[0080]
nci-h1650,a549,nci-h1703用含10%胎牛血清的rpmi-1640培养基培养,sk-mes-1用含10%胎牛血清的mem培养基培养,以上培养基均补加了青霉素-链霉素双抗,终浓度为青霉素100iu/ml,链霉素100μg/ml。细胞培养在37℃,5%co2的培养箱中培养,当细胞长到80%汇合度时,加入0.25%的胰酶进行消化传代。
[0081]
将培养皿中待测细胞加pbs(1~2ml)清洗后加含胰蛋白酶和edta的培养基(1~2ml)消化约2~5min,加培养基中和后转入10ml离心管并定容至10ml,同时将细胞混匀,取10ul进行细胞计数,其余离心(1000rpm,5min)后制备浓度为5
×
104个/ml的细胞悬液,按照104/孔接种在96孔板中,体积为100μl,每个实验组接种3个复孔。
[0082]
药物使用:
[0083]
每种药物设置组观察值,分别为day0,day1,day2和day3;待细胞贴壁后,使用cck8法检测day0的od值,待day0天测量结束后,剩余96板孔分别加入不同浓度的尼麦角林,安乃近和丁洛地尔(分别为10,50um),在药物作用24h,48h和72h后进行cck8的检测。
[0084]
cck8检测方法:
[0085]
待细胞贴壁后,吸去day0天细胞的培养基,按1:10混匀cck8与rpmi1640,在day0的每个孔中加入100μl混合液,放入细胞培养箱中1小时后取出,每孔吸取80μl上清,使用酶标仪测od450;
[0086]
每隔24h,依次对第1~3天的细胞重复上述操作;
[0087]
每天测得每组的3个复孔od值,取其平均数,记为该组当天的od值。检测第0天至第3天的细胞增殖情况,建立生长曲线。通过计算药物组和空白组的显色比例,显示药物组的肿瘤抑制效果。
[0088]
细胞学验证结果
[0089]
用cck8方法检测了筛选出的3种药物对4种肺癌细胞(腺癌2种:a549和h1650,鳞癌2种:sk-mes-1和nci-h1703)的抑制效果,结果如图1所示,在药物作用72h后,尼麦角林对肺鳞癌(h1703和sk-mes-1)细胞均有抑制效果,对a549也有轻微效果。安乃近和丁咯地尔对肺癌细胞系的抑制效果较差,无论是腺癌和鳞癌均没有比较明显的抑制效果,2种药物仅仅对sk-mes-1细胞有轻微的抑制效果。肿瘤细胞增殖抑制实验的结果显示,尼麦角林对肺鳞癌有潜在的抑制效果。
[0090]
实施例4
[0091]
不同浓度尼麦角林体外实验
[0092]
体外实验采用与实施例3相同的cck8检测方法进行检测,对不同浓度尼麦角林的抑制效果进行进一步的细胞学验证,共验证了6种肺癌细胞系,分别是4种鳞癌(nci-h226,sk-mes-1,nci-h1703,nci-h2170)和2种腺癌(nci-h1650和ltep-a-2)。
[0093]
细胞培养:
[0094]
nci-h226,nci-h1703,nci-h2170,nci-h1650和ltep-a-2d都用含10%胎牛血清的rpmi-1640培养基培养,sk-mes-1用含10%胎牛血清的mem培养基培养,以上培养基均补加了青霉素-链霉素双抗,终浓度为青霉素100iu/ml,链霉素100μg/ml。细胞培养在37℃,5%co2的培养箱中培养,当细胞长到80%汇合度时,加入0.25%的胰酶进行消化传代。
[0095]
将培养皿中待测细胞加pbs(1~2ml)清洗后加含胰蛋白酶和edta的培养基(1~2ml)消化约2~5min,加培养基中和后转入10ml离心管并定容至10ml,同时将细胞混匀,取10ul进行细胞计数,其余离心(1000rpm,5min)后制备浓度为5
×
104个/ml的细胞悬液,按照104/孔接种在96孔板中,体积为100μl,每个实验组接种3个复孔。
[0096]
药物使用:
[0097]
每种药物设置组观察值,分别为day0,day1,day2和day3;待细胞贴壁后,使用cck8法检测day0的od值,待day0天测量结束后,剩余96板孔分别加入不同浓度的尼麦角林(分别为0,50,60,80um),在药物作用24h,48h和72h后进行cck8的检测。
[0098]
如图2,实验结果显示尼麦角林对鳞癌细胞具有较好的增殖抑制效果,特别是对鳞癌细胞系nci-h226和sk-mes-1的效果最好,对鳞癌细胞系h1703的效果一般,对nci-h2170的效果较差,而对腺癌细胞系的抑制效果就相对比较差了,无论是对腺癌nci-h1650或者ltep-a-2,抑制效果都比较差。
[0099]
实施例5
[0100]
动物体内疗效试验
[0101]
(1)动物模型的建立
[0102]
选取同一批次的5周龄裸鼠bal/c裸鼠10只,体重18~24g,将体外培养的细胞,进行消化计数后将nci-h226细胞浓度调至1
×
107个/ml,注射200μl至其腋窝皮下,正常饲养至成瘤体积达到100mm3,周期3-4周。
[0103]
将成瘤成功的小鼠解剖后取肿块分离成小块,注射进50只bal/c裸鼠肩背部皮下,正常饮食至肿瘤体积长大到100mm3,周期4-5周。
[0104]
(2)给药治疗
[0105]
用游标卡尺测量移植瘤直径,待肿瘤生长至100mm3以上后,选择裸鼠体内瘤体积达到100mm3的裸鼠入组实验,裸鼠实体瘤肿瘤模型当日分组开始给药,给药方式采用腹腔给药,给药周期为21天,每天给药一次,详细给药方案如表4所示:
[0106]
表4给药方案表
[0107][0108]
注:此处给药量为裸鼠给药量,按照等效剂量折算成人的给药剂量时,应该以裸鼠的给药剂量除以折算系数9.1。
[0109]
(3)治疗后肿瘤体积比较
[0110]
用药开始后每周2次测量裸鼠体重和肿瘤大小,并依据下列肿瘤体积计算公式计
算每次测量的肿瘤体积。
[0111][0112]
(a为肿瘤长度,b为肿瘤宽度)
[0113]
在抑瘤率呈下降趋势时处死动物测量实体瘤重量。阴性对照组肿瘤平均瘤重小于1克,或20%肿瘤重量小于400毫克,表示肿瘤生长不良,试验作废。
[0114]
用药当天给药前测一次裸鼠体重和肿瘤大小,之后每周在给药前测量并记录2次裸鼠体重和肿瘤大小,3周给药周期内共测量了7次,肿瘤体积按照上述公式计算。对记录的肿瘤大小数据进行分析,结果如图3所示。
[0115]
从图3中可以看出,对照组的肿瘤体积增长较快,用药组的肿瘤体积增长明显弱于对照组,但是中高剂量组的肿瘤体积前期表现为高剂量组的体积高于中剂量组的体积,后期才表现为中剂量组的体积高于高剂量组的体积。可能与入组时高剂量组的平均瘤体积较中剂量组的瘤体积高有关,随着肿瘤的不断长大,原先的差异才逐渐被药物抑制趋势所取代,从而表现为随着药物剂量的增大,肿瘤抑制也在增强。对肿瘤大小数据进行双因素方差分析,结果显示肿瘤体积在不同给药组之间有显著差异,p值《0.001。
[0116]
(4)肿瘤抑制疗效评价
[0117]
最后一次给药后第二天处死裸鼠,并解剖取出肿瘤,并进行称重。取出的肿瘤如图4所示。
[0118]
采用称瘤重的方法评价药物疗效。通过下列的疗效评价公式进行判定。
[0119]
疗效评价公式:
[0120][0121]
评价标准:肿瘤生长抑制率《40%为无效;肿瘤生长抑制率≥40%,并经统计学处理p《0.05为有效。
[0122]
肿瘤生长抑制的疗效评价依据上述的疗效评价公式进行肿瘤抑制率计算,结果如下:
[0123]
中剂量组肿瘤抑制率=(0.2817-0.1867)/0.2817=0.3372=33.7%,(p=0.023)。
[0124]
高剂量组肿瘤抑制率=(0.2817-0.1700)/0.2817=0.3965=40%,(p=0.0096)。
[0125]
根据计算结果,高剂量组肿瘤抑制率达到了40%,且p《0.05,依据疗效判定的通常标准,判定尼麦角林具有肺癌尤其是肺鳞癌肿瘤抑制效果。
[0126]
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0127]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1