一种胃部靶标口服大分子载体及其制备方法与流程
[0001]
本发明属于生物医学材料领域,涉及一种口服大分子载体,尤其涉及一种胃部靶标口服大分子载体及其制备方法。
背景技术:
[0002]
大分子具有低毒、高特异性的优势,为治疗癌症、获得性免疫缺陷综合征、糖尿病等严重疾病开创了新时代。目前,人体摄取大分子的方法主要包括口服和注射两种,在这两种方法中,口服是首选,因为患者的依从性更好,制造成本更低,而且没有引起疼痛。一般情况下,口服的大分子物质在被吸收前必须通过胃酸和肠道的厚黏液和上皮屏障,导致系统生物利用度低。为了解决这一局限性,如何提高口服大分子的生物利用度已成为科学关注的焦点。因此,许多方法,如渗透增强剂,微针,黏液粘附装置已被提出以促进口服大分子的吸收摄取。其中,新兴的微针是一种尖端锋利的微型针,由于其尖端锋利,能够刺入粘膜屏障,是最有前途的策略。胃壁的粘膜表面积大,厚度为4~6mm,提供了更宽的保护层和更大的插入药物的空间。此外,胃组织再生迅速,粘液屏障的流动性可以弥补暂时性的内衬缺损。通常载有大分子的微针被包裹成胶囊,随着胶囊在消化道的降解,触发微针插入粘膜层,促进大分子的吸收。然而,这些口服大分子给药微针依靠外部装置驱动穿刺运动,而外部装置的消化不仅给消化系统带来负担,也增加了设计难度。因此,关于如何开发具有自驱动特性的微针的见解有望为口服大分子递送开辟新的途径。
[0003]
微马达是一种能够将其他形式的能量转化为动能而实现自主推进的装置,目前已被广泛应用于传感、生物医学、外科、成像等多种生物领域。特别地,微马达的自驱动特性推动了疾病在体诊断和治疗领域的发展。在科学家大的不断努力下,已经有许多不同推进机制的微马达被发明出来,包括气泡推进、自扩散泳透、自穴位泳透、自电泳等,其中气泡推进机制由于其在复杂生物环境下的可行性,是微型电机在体内应用最广泛的机制。除了推进机制外,微马达的形貌也是研究热点。然而,据我们所知,目前还未有微针形貌的微马达被开发出来。
技术实现要素:
[0004]
本发明提供一种胃部靶标口服大分子载体及其制备方法,以克服现有技术的缺陷。
[0005]
为实现上述目的,本发明提供一种胃部靶标口服大分子载体,具有这样的特征:包括连续的负载药物的微针组件和负载燃料的尾翼组件;微针组件为圆锥形的针尖,尾翼组件相接于微针组件的圆锥底面,且向外侧突出于圆锥底面,从而在载体突破胃黏膜屏障时避免穿孔;微针组件由混有大分子药物的水凝胶预溶液固化而成;尾翼组件由混有燃料物质的水凝胶预溶液固化而成。
[0006]
进一步,本发明提供一种胃部靶标口服大分子载体,还可以具有这样的特征:其中,水凝胶预溶液为甲基丙烯酸酐化明胶和光引发剂的混合水溶液,其中甲基丙烯酸酐化
明胶的质量分数为15~30%,光引发剂的质量分数为1%。
[0007]
进一步,本发明提供一种胃部靶标口服大分子载体,还可以具有这样的特征:其中,燃料物质为镁颗粒或锌颗粒。
[0008]
本发明还提供上述胃部靶标口服大分子载体的制备方法,具有这样的特征:包括以下步骤:
[0009]
步骤一、微针组件的制备:将水凝胶预溶液与大分子药物的混合溶液置于阴模板中;阴模板具有连接相通的圆锥针尖部分和尾翼部分;使混合溶液充满阴模板的圆锥针尖部分,去除多余的空气,固化混合溶液,获得负载药物的微针组件。
[0010]
步骤二、尾翼组件的制备:将水凝胶预溶液置于含有微针组件的阴模板中,填满阴模板的尾翼部分,去除多余的空气;使用具有凸起结构的阳模板覆盖尾翼部分,阳模板的凸起结构插入在阴模板的尾翼部分内;固化水凝胶预溶液,剥去阳模板,形成燃料负载腔;随后,将燃料物质与水凝胶预溶液混合,注入燃料负载腔,固化混合溶液,完成尾翼组件的制备;
[0011]
步骤三、载体的获得:将制备好的水凝胶整体剥离阴模板,获得胃部靶标口服大分子载体。
[0012]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,去除多于空气的方法为抽真空法或离心法。
[0013]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,固化方式为紫外光聚合;阳模板透明。
[0014]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,阴模板的圆锥针尖部分为高度为4毫米、底面半径为500微米的圆锥体。阴模板的尾翼部分由位于中心的圆柱体及从该中心圆柱体向外延伸的若干长方体构成,厚度均为500微米;阳模板的凸起结构插入在阴模板尾翼部分的圆柱体内。
[0015]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,尾翼部分中的长方体数量为两个、三个或四个;长方体数量为两个时,两个长方体分别在圆柱体两侧呈180度夹角排列;长方体数量为三个时,三个长方体在圆柱体周围呈120度夹角排列;长方体数量为四个时,四个长方体在圆柱体周围呈90度夹角排列。
[0016]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,阳模板的凸起结构为半径为400微米、高为400微米的圆柱体。
[0017]
进一步,本发明提供一种胃部靶标口服大分子载体的制备方法,还可以具有这样的特征:其中,阴模板和阳模板为聚二甲基氧烷模板。
[0018]
本发明的有益效果在于:本发明提供一种胃部靶标口服大分子载体的制备方法,该口服大分子载体具有用于载药的前端微针组件和用于负载燃料以及防穿孔的尾翼组件,可以在胃腔内实现自主运动,突破胃壁粘膜进行药物释放且有效防止穿孔,能有效提高口服大分子药物的生物利用度。且本发明制备过程简单,成本低,通用性高,推进了口服大分子在生物医学领域的应用。
附图说明
[0019]
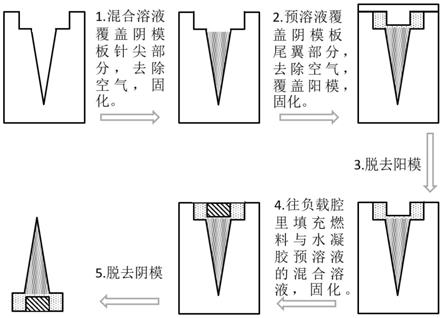
图1是胃部靶标口服大分子载体制备过程示意图;
[0020]
图2a-d是阴模板的结构示意图:图2a是阴模板的侧视图,图2b是双尾翼阴模板的俯视图,图2c是三尾翼阴模板的俯视图,图2d是四尾翼阴模板的俯视图;
[0021]
图3a-b是阳模板的结构示意图:图3a是阳模板的侧视图,图3b是阳模板的俯视图;
[0022]
图4a-c分别是双尾翼阴模板、三尾翼阴模板及四尾翼阴模板制得的胃部靶标口服大分子载体的实物图;
[0023]
图5是胃部靶标口服大分子载体的实时速率图;
[0024]
图6是胃部靶标口服大分子载体的胰岛素释放百分比图。
具体实施方式
[0025]
以下结合具体实施例对本发明作进一步说明。
[0026]
本发明提供一种胃部靶标口服大分子载体,包括连续的负载药物的微针组件和负载燃料的尾翼组件。微针组件为圆锥形的针尖,尾翼组件相接于微针组件的圆锥底面,且向外侧突出于圆锥底面,从而在载体突破胃黏膜屏障时避免穿孔。
[0027]
微针组件由混有大分子药物的水凝胶预溶液固化而成。尾翼组件由混有燃料物质的水凝胶预溶液固化而成。
[0028]
其中,水凝胶预溶液为甲基丙烯酸酐化明胶和光引发剂的水溶液,其质量分数为15~30%,其中光引发剂的质量分数为1%。
[0029]
燃料物质为镁颗粒或锌颗粒。
[0030]
该胃部靶标口服大分子载体的工作机理为,进入胃腔后,口服大分子载体中的燃料物质在胃部消化液的作用下产生大量气泡,推动口服大分子载体运动,使其负载药物的微针组件突破胃黏膜屏障,尾翼组件仍留在胃黏膜屏障外防止刺穿,口服大分子载体在此状态下释放药物。
[0031]
该胃部靶标口服大分子载体的制备过程如图1所示,具体包括以下步骤:
[0032]
步骤一、微针组件的制备:
[0033]
将水凝胶预溶液与大分子药物的混合溶液置于阴模板中。
[0034]
如图2a-d所示,阴模板具有连接相通的圆锥针尖部分和尾翼部分。
[0035]
其中,其中,阴模板的圆锥针尖部分为高度为4毫米、底面半径为500微米的圆锥体。阴模板的尾翼部分由位于中心的圆柱体及从该中心圆柱体向外延伸的若干长方体构成,厚度均为500微米。
[0036]
尾翼部分中的长方体数量为两个、三个或四个。长方体数量为两个时,两个长方体分别在圆柱体两侧呈180度夹角排列,如图2b所示;长方体数量为三个时,三个长方体在圆柱体周围呈120度夹角排列,如图2c所示;长方体数量为四个时,四个长方体在圆柱体周围呈90度夹角排列,如图2d所示。
[0037]
使混合溶液充满阴模板的圆锥针尖部分,去除多余的空气,固化混合溶液,获得负载药物的微针组件。
[0038]
步骤二、尾翼组件的制备:将水凝胶预溶液置于含有载药微针组件的阴模板中,填满阴模板的尾翼部分,去除多余的空气。
[0039]
使用具有凸起结构的阳模板覆盖尾翼部分,阳模板结构如图3a-b所示,阳模板的凸起结构可插入在阴模板的尾翼部分内。具体的,阳模板的凸起结构插入在阴模板尾翼部
分的圆柱体内。阳模板的凸起结构为半径为400微米、高为400微米的圆柱体。
[0040]
固化水凝胶预溶液,剥去阳模板,形成燃料负载腔。
[0041]
随后,将燃料物质与水凝胶预溶液混合,注入燃料负载腔,固化混合溶液,完成尾翼组件的制备。
[0042]
步骤三、载体的获得:将制备好的水凝胶整体剥离阴模板,获得胃部靶标口服大分子载体。不同形状尾翼部分的阴模板制得的胃部靶标口服大分子载体如图4a-c所示。
[0043]
其中,去除多于空气的方法为抽真空法或离心法。
[0044]
固化方式为紫外光聚合。阳模板透明,从而实现紫外光条件。
[0045]
其中,阴模板和阳模板为聚二甲基氧烷模板。
[0046]
实施例1
[0047]
本实施提供一种胃部靶标口服大分子载体的制备方法,包括如下步骤:
[0048]
步骤一、微针组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为15%,光引发剂的质量分数为1%)与胰岛素水溶液的混合溶液置于设计好的聚二甲基氧烷阴模板中使其充满模板的圆锥针尖部分,抽真空去除多余的空气,紫外光照射聚合固化混合溶液,获得微针组件部分。
[0049]
步骤二、尾翼组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为15%,光引发剂的质量分数为1%)置于含有微针组件的阴模板中,填满阴模板的尾翼部分,抽真空去除多余的空气。
[0050]
使用具有凸起结构的透明阳模板覆盖,紫外光照射聚合固化水凝胶预溶液,剥去阳模板,获得燃料负载腔。
[0051]
随后,将锌颗粒与水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为15%,光引发剂的质量分数为1%)混合,注入燃料负载腔,紫外光照射固化混合溶液,完成尾翼组件的制备。
[0052]
步骤三、载体的获得:将制备好的水凝胶整体剥离模板,获得胃部靶标口服大分子载体。
[0053]
实施例2
[0054]
本实施提供一种胃部靶标口服大分子载体的制备方法,包括如下步骤:
[0055]
步骤一、微针组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)与胰岛素水溶液的混合溶液置于设计好的聚二甲基氧烷阴模板中使其充满模板的圆锥针尖部分,5000rpm离心5分钟去除多余的空气,紫外光照射聚合固化混合溶液,获得微针组件部分。
[0056]
步骤二、尾翼组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)置于含有微针组件的阴模板中,填满阴模板的尾翼部分,5000rpm离心2分钟去除多余的空气。
[0057]
使用具有凸起结构的透明阳模板覆盖,紫外光照射聚合固化水凝胶预溶液,剥去阳模板,获得燃料负载腔。
[0058]
随后,将镁颗粒与水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)混合,注入燃料负载腔,紫外光照射固化混合溶液,完成尾翼组件的制备。
[0059]
步骤三、载体的获得:将制备好的水凝胶整体剥离模板,获得胃部靶标口服大分子载体。
[0060]
对上述制得的胃部靶标口服大分子载体进行速率性能表征:将胃部靶标口服大分子载体置于人工胃液中,并用显微镜观察其实时运动速率,其速度与时间的关系如图5所示,其速率起初逐渐增大至最大值而后逐渐下降。
[0061]
实施例3
[0062]
步骤一、微针组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)与荧光标记胰岛素水溶液的混合溶液置于设计好的聚二甲基氧烷阴模板中使其充满模板的圆锥针尖部分,5000rpm离心5分钟去除多余的空气,紫外光照射聚合固化混合溶液,获得微针组件部分。
[0063]
步骤二、尾翼组件的制备:将水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)置于含有微针组件的阴模板中,填满阴模板的尾翼部分,5000rpm离心2分钟去除多余的空气。
[0064]
使用具有凸起结构的透明阳模板覆盖,紫外光照射聚合固化水凝胶预溶液,剥去阳模板,获得燃料负载腔。
[0065]
随后,将镁颗粒与水凝胶预溶液(甲基丙烯酸酐化明胶和光引发剂的水溶液,其中甲基丙烯酸酐化明胶的质量分数为25%,光引发剂的质量分数为1%)混合,注入燃料负载腔,紫外光照射固化混合溶液,完成尾翼组件的制备。
[0066]
步骤三、载体的获得:将制备好的水凝胶整体剥离模板,获得胃部靶标口服大分子载体。
[0067]
对上述制得的胃部靶标口服大分子载体进行胰岛素释放表征:将胃部靶标口服大分子载体置于人工胃液中,每隔一段时间通过检测人工胃液中荧光强度来获得其中胰岛素的含量,胰岛素释放速率-时间的关系如图6所示,在12小时内可释放百分之七十以上的胰岛素。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1