Fah基因缺失动物的程序化慢性肝损伤维持及其在制备异源化肝脏模型中的应用
fah基因缺失动物的程序化慢性肝损伤维持及其在制备异源化肝脏模型中的应用
技术领域
1.本发明属于生物技术及动物模型制备领域,更具体地,本发明涉及fah基因缺失动物的程序化慢性肝损伤维持方法及其在制备异源化肝脏模型中的应用。
背景技术:
2.肝脏是人体药物代谢和清除的主要场所,也是许多特异性病原体的宿主。由于物种间的差异,这些人肝脏特有的功能和特征很难在其他动物中得到有效模拟。目前,肝脏人源化已经通过移植人原代肝细胞(phh)在小鼠模型上获得成功(m dandri,et al.,hepatology.33(4):981
‑
988.2001;df mercer,et al.,nat med.7(8):927
‑
933.2001;c tateno,et al.,am j pathol.165(3):901
‑
912.2004),可用于精确预测人体肝脏特异性药物代谢和病原体感染过程。此外,人源化动物模型还可以作为生物反应器生产大量功能性的人肝细胞用于多种用途,如需要大量肝细胞支持的“人工肝系统”(h azuma,et al.,nat biotechnol.25(8):903
‑
910.2007;e michailidis,et al.,proc natl acad sci u s a.117(3):1678
‑
1688.2020)。近十多年来的研究和发展成果成功推动了人源化肝脏小鼠模型上的高效和稳定制备(h azuma,et al.,nat biotechnol.25(8):903
‑
910.2007;c tateno,et al.,plos one.10(11):e0142145.2015;em wilson,et al.,stem cell res.13(3pt a):404
‑
412.2014;m hasegawa,et al.,biochem biophys res commun.405(3):405
‑
410.2011;kd bissig,et al.,j clin invest.120(3):924
‑
930.2010;ml washburn,et al.,gastroenterology.140(4):1334
‑
1344.2011)。然而,小鼠的体型大小严重制约了其所能提供的生物样本量,如药学分析所需的血液和胆汁,及再生医学研究所需的肝细胞(k yoshizato,et al.,expert opin drug metab toxicol.9(11):1419
‑
1435.2013).
3.与小鼠相比,大鼠体型至少大10倍,在生理和病理上也更为接近人类(pm iannaccone,et al.,dis model mech.2(5
‑
6):206
‑
210.2009)。美国fda指导原则也建议使用大鼠进行临床前研究,特别是药物代谢和毒理(hj jacob,et al.,nat rev genet.3(1):33
‑
42.2002)。此外,当大鼠达到完全肝脏人源化置换后,理论上可以提供109以上人肝细胞。因此,在大鼠模型上构建人源化肝脏比在小鼠上具有更为重要的意义,特别是在药物开发和再生医学研究领域。然而,由于缺少能有效支持人源肝细胞异种移植的大鼠模型,极大阻碍了肝脏人源化大鼠上的开发。与此同时,目前也缺少在小鼠以外的大动物中实施肝脏人源化的实践经验。
4.本发明人前期参与了延胡索酰乙酰乙酸水解酶(fah)基因缺失联合重症免疫缺陷的frg(fah
‑
/
‑
rag2
‑
/
‑
il2rg
‑
/
‑
)大鼠(中国专利实审中,申请号:201810621840.8)的构建,该大鼠用于构建人源化肝脏,并证实了该大鼠模型具有构建人源化肝脏的潜力。然而,对于移植大鼠的长期维持上,还需进一步探寻有效的肝损伤调控模式,以达到稳定且高效的人源化置换水平。
技术实现要素:
5.本发明的目的在于提供一种fah基因缺失大鼠非急性致死的可持续性的慢性肝损伤的维持方法,并利用该方法实现人肝实质细胞在大鼠体内的稳定扩增,最终获得高置换率的异源化肝脏。
6.本发明的目的还在于提供系统或试剂盒,其能用于培育fah基因缺失大鼠模型且维持其慢性肝损伤,以及能用于培育fah基因缺失大鼠模型且维持其慢性肝损伤。
7.在本发明的第一方面,提供一种维持fah基因缺失(fah
‑
/
‑
)动物模型的慢性肝损伤的方法,所述方法包括使fah基因缺失动物模型按照以下程序服用尼替西农(ntbc):(1)持续3~12天每天服用低剂量尼替西农,所述低剂量为0.005~0.1mg/kg动物体重/天;(2)持续2~6天每天服用高剂量尼替西农,所述高剂量为0.25~1.5mg/kg动物体重/天;(3)进行步骤(1)和(2)的循环。
8.在本发明的第一方面,提供一种制备异源化肝移植动物模型方法,所述动物模型具有异源化肝脏,所述方法包括:(1)持续3~12天每天服用低剂量尼替西农,所述低剂量为0.005~0.1mg/kg动物体重/天;(2)持续2~6天每天服用高剂量尼替西农,所述高剂量为0.25~1.5mg/kg动物体重/天;(3)进行步骤(1)和(2)的循环;并且,在上述程序起始后的第3~30天,对动物进行异源肝细胞的移植。
9.在本发明的一个优选例中,在进行所述程序之前,还包括:以惹卓碱(retrorsine)预处理所述动物;较佳地,惹卓碱的用量为10~50mg/kg动物体重;更佳地,惹卓碱的用量为20~40mg/kg动物体重;进一步更佳地,惹卓碱的用量为25~35mg/kg动物体重。
10.在本发明的另一优选例中,步骤(1)中,持续4~10天每天服用低剂量尼替西农;较佳地,持续5、6、7、8或9天每天服用低剂量尼替西农。
11.在本发明的另一优选例中,步骤(1)中,所述低剂量为0.008
‑
0.08mg/kg动物体重/天;较佳地,所述低剂量为0.01~0.05mg/kg动物体重/天;如0.015
‑
0.04mg/kg动物体重/天,或0.015~0.035mg/kg动物体重/天;更具体如0.02mg/kg动物体重/天,0.03mg/kg动物体重/天。
12.在本发明的另一优选例中,步骤(2)中,持续3~5天每天服用高剂量尼替西农。
13.在本发明的另一优选例中,步骤(2)中,所述高剂量为0.3~1.2mg/kg动物体重/天;较佳地,所述高剂量为0.35~1mg/kg动物体重/天;如0.35~0.85mg/kg动物体重/天;更具体如0.4、0.5、0.6、0.7、0.8mg/kg动物体重/天。
14.在本发明的另一优选例中,所述的动物为体型大于小鼠2倍(如2~2000倍,更具体如5、10、15、20、50、100、200、500倍)以上的哺乳动物;较佳地,所述动物包括选自下组的动物:大鼠,兔、猴、猪、豚鼠、狗;较佳地,所述的动物为白介素2受体γ基因和重组激活基因2被破坏的动物(rag2
‑
/
‑
il2rg
‑
/
‑
)。
15.在本发明的另一优选例中,所述的异源肝细胞包括(但不限于):与该动物模型属于不同物种的人源、小鼠源、猪源、猴源或狗源的肝细胞;较佳地,所述的异源细胞包括(但不限于):(a)原代肝细胞;(b)诱导多能性干细胞(ipsc)与胚胎干细胞(esc)诱导分化而来的肝干/祖细胞,肝细胞或肝样细胞,内胚层细胞等;(c)内胚层及其他胚层干细胞诱导分化而来的肝干/祖细胞,肝细胞或肝样细胞;(d)成体或胎儿干/祖细胞或肝细胞及其他体细胞直接转分化而来的肝干/祖细胞,肝细胞或肝样细胞;(f)(a)~(d)来源的细胞经体外诱导
扩增后的肝干/祖细胞,肝细胞或肝样细胞;(g)(a)~(f)来源的细胞构建的肝类器官。
16.在本发明的另一优选例中,(3)的循环进行至动物模型被应用或动物模型寿命结束。
17.在本发明的另一优选例中,所述的异源化肝脏为高异源化嵌合率的肝脏。
18.在本发明的另一优选例中,所述的高异源化嵌合率(异源化置换率)为异源化嵌合率高于25%,较佳地高于28%,更佳地高于30%。同时,随着受体动物模型的培养时间的延长,嵌合率不断上升。
19.在本发明的另一优选例中,所述异源肝细胞分离自器官供体的肝脏,分离自外科手术切除物或者源自诱导多能性干细胞、胚胎干细胞,胚胎组织及其细胞,羊膜上皮细胞,单核细胞或羊水细胞。
20.在本发明的另一优选例中,移植至所述动物中的异源肝细胞是分离的异源肝细胞。
21.在本发明的另一优选例中,所述尼替西农在饮用水中给药。
22.在本发明的另一优选例中,所述尼替西农在食物中给药。
23.在本发明的另一方面,提供一种用于培育fah基因缺失动物模型且维持其慢性肝损伤的系统,其包括:给药组件或模块1,其设置为持续3~12天、每天向动物给药低剂量尼替西农,所述低剂量为0.005~0.1mg/kg动物体重/天;和,给药组件或模块2,其设置为持续2~6天、每天向动物给药高剂量尼替西农,所述高剂量为0.25~1.5mg/kg动物体重/天。
24.在本发明的一个优选例中,所述的用于培育fah基因缺失动物模型且维持其慢性肝损伤的系统包括机械装置或计算机系统。
25.在本发明的另一优选例中,所述的装置还用于培育具有异源化肝脏的异源化肝移植动物模型。
26.在本发明的另一优选例中,所述的装置还包括:给药组件或模块3,其能向动物给药惹卓碱。
27.在本发明的另一优选例中,所述的装置设置为给予惹卓碱10~50mg/kg动物体重。
28.在本发明的另一优选例中,所述的装置通过计算机程序进行所述量的药物的输出,通过机械装置传递给动物。
29.在本发明的另一方面,提供一种用于培育fah基因缺失动物模型且维持其慢性肝损伤的试剂盒,其包括:容器组1,包括容器以及位于容器中的低剂量尼替西农,所述低剂量为0.005~0.1mg/kg动物体重/天;较佳地该容器组1中容器数量为3~12个;和,容器组2,包括容器以及位于其中的高剂量尼替西农,所述高剂量为0.25~1.5mg/kg动物体重/天;较佳地该容器组2中容器数量为2~6个。
30.在本发明的一个优选例中,所述的试剂盒中还包括:容器3,以及位于其中的惹卓碱;较佳地惹卓碱为1.2~10mg。
31.在本发明的一个优选例中,所述的容器组1和容器组2以及优选地还包括容器组3,被用于1只动物1个完整的给药循环(单次“低剂量
‑
高剂量”为一个循环)。
32.在本发明的另一优选例中,所述的容器组1和容器组2以及优选地还包括容器组3,被用于针对单只动物的2个或多个完整的给药循环,或被用于针对多只动物的1个、2个或多个给药循环。
33.在本发明的另一优选例中,在持续的动物培育中,运用试剂盒组,所述试剂盒组含有2~200个试剂盒,如5、10、15、20、30、40、50、60、80、100、150个试剂盒。
34.在本发明的另一方面,提供低剂量尼替西农、高剂量尼替西农以及惹卓碱的应用,用于:维持fah基因缺失动物模型的慢性肝损伤;或制备维持fah基因缺失动物模型的慢性肝损伤的给药组、试剂盒组;其中,所述低剂量为0.005~0.1mg/kg动物体重/天,所述高剂量为0.25~1.5mg/kg动物体重/天。
35.在本发明的另一方面,提供低剂量尼替西农、高剂量尼替西农以及惹卓碱的应用,用于:制备异源化肝移植动物模型,所述模型具有异源化肝脏;或制备用于进行异源化肝移植动物模型的制备的给药组、试剂盒组;其中,所述低剂量为0.005~0.1mg/kg动物体重/天,所述高剂量为0.25~1.5mg/kg动物体重/天。
36.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
37.图1、ntbc介导的frg大鼠肝损伤。
38.a.frg大鼠在ntbc供应(w/)与撤除(w/o)条件下的状态图。
39.b.ntbc供应下健康frg大鼠和撤除下濒死大鼠血清alt和ast水平。****p<0.0001。
40.c.frg大鼠在ntbc供应和撤除下肝脏组织的he和天狼猩红染色结果。标尺:100μm。
41.d.frg大鼠在ntbc供应和撤除下的生存曲线。
42.图2、大鼠慢性肝损伤模型建立。
43.a.frg大鼠在不同浓度ntbc条件下的生存曲线。***p<0.001,****p<0.0001;ns,无统计学差异。
44.b.4%和10%ntbc条件下大鼠的ast、alt水平和体重变化。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
45.c.循环周期固定化的ntbc程序化调控设计示意图。
46.d.frg大鼠在三种不同ntbc程序化调控(5+4,7+4和9+4)下的生存曲线。
47.e.5+4和7+4ntbc程序化调控下的大鼠的ast和alt水平。**p<0.01,****p<0.0001;ns,无统计学差异。
48.f.天狼猩红染色显示5+4和7+4ntbc程序化调控下的大鼠肝组织的纤维化程度。标尺:100μm。
49.g.5+4和7+4ntbc程序化调控下的大鼠肝组织afp基因表达水平。****p<0.0001;ns,无统计学差异。
50.图3、retrorsine(rs)预处理移植大鼠肝细胞修复性再生。
51.a.经rs预处理(w/)与未经处理(w/o)大鼠肝组织的ki67染色结果。标尺:100μm。
52.b.经rs预处理(w/)与未经处理(w/o)大鼠肝组织中增殖性细胞比例的统计分析。*p<0.05。
53.c.在phh移植后4周内,经rs预处理(w/)与未经处理(w/o)大鼠体内人白蛋白分泌水平。*p<0.05。
54.图4、大鼠慢性肝损伤模型建立。
controlling,ntbc
p
)方案。本发明的方案可实现动物在慢性肝损伤状态下长期生存,在进行异源化肝细胞移植后,可以实现高的异源化置换率。
81.如本发明所用,所述的“延胡索酰乙酰乙酸水解酶基因缺失(fah
‑
/
‑
)”、“重组激活基因2缺失(rag2
‑
/
‑
)”或“白介素2受体γ基因缺失(il2rg
‑
/
‑
)是指fah、rag2或il2rg被破坏,包括通过例如基因敲除、基因编辑、同源重组或定点突变等方式的破坏。在本发明一些方式中,所述的“缺失”也包括基因/蛋白表达的显著降低,例如基因/蛋白表达降低约80%、约90%、约95%或约99%。
82.如本发明所用,所述的动物为哺乳动物。较佳地,所述的动物为体型大于小鼠2倍(如2~2000倍)以上的哺乳动物动物;更佳地,所述动物包括选自下组的动物:大鼠,兔、猪、豚鼠、狗、非人灵长类动物如猴、猩猩;较佳地,所述的动物为fah
‑
/
‑
rag2
‑
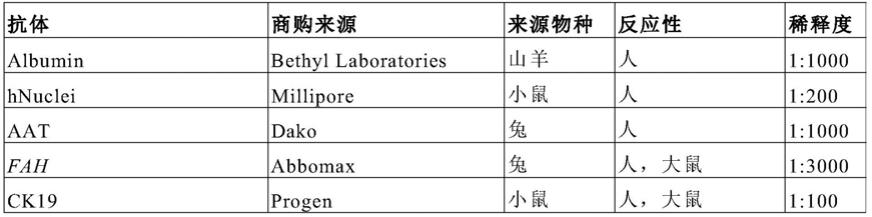
/
‑
il2rg
‑
/
‑
的动物。最为优选地,所述的动物是大鼠。
83.如本发明所用,所述的“异源”为“非内源”,指来自不同物种来源的两种肝细胞之间的关系,或指来自不同来源的细胞与动物受体之间的关系。例如,如果细胞与动物受体的组合通常不是天然存在的,则该细胞对于该动物受体来说是异源的。所述的“异源”也可被称为“外源”。所述的“异源化”是指使异源细胞在受体动物肝脏中定植、生长、扩增、并发挥功能的过程。
84.如本发明所用,所述的“异源化嵌合率”是指异源细胞在受体动物肝脏中定植、生长、扩增后,所占该受体动物总的肝细胞的比例。
85.动物模型的制备
86.fah酶是肝脏酪氨酸代谢途径中的一个关键酶。在动物模型中,fah基因缺失可造成酪氨酸代谢中间产物丁二酰的积累,在达到一定程度后可造成肝实质细胞的死亡。而在日常饮水中补给ntbc可通过抑制酪氨酸代谢途径,阻止毒性代谢中间产物的积累,起到挽救肝损伤的效果。本领域中,尽管通过阶梯式撤除或以体重变化为依据的ntbc撤除/回复循环调控策略已被应用于fah缺失小鼠的人源肝细胞移植。然而在本发明人前期测试中发现,该调控策略仅能支持fah缺失大鼠的低比例(比例低于10%)人源肝细胞嵌合,无法应用于高度人源化肝脏构建。本发明人发现,fah缺失大鼠与同基因缺失的小鼠相比对ntbc撤除导致的肝损伤更为敏感;且体重指标存在严重滞后,无法及时实施挽救,导致死亡率极高,成熟肝细胞移植后的可挽救窗口期过分短暂;因而无法获得稳定且高效的人源化置换率。为此,本发明人致力于找到解决这一问题的途径。
87.在深入研究分析基础上,本发明人揭示了一种操作性好、可控性高、非急性致死、可持续维持的慢性肝损伤的新型方法。本发明所述的方法可避免异源肝细胞移植后模型大鼠的早期死亡,创造有利于异源肝/肝样细胞在frg大鼠体内定植生存的肝内环境和足够的扩增窗口期,在高存活率下构建高置换率的异源化肝脏。该方法也可适用于除大鼠以外其他fah缺失大动物模型的异源化肝/肝样细胞移植,如兔、猪、豚鼠、狗、非人灵长类动物如猴等。
88.基于本发明人的新发现,提供了一种维持fah基因缺失动物模型的慢性肝损伤的方法(ntbc
p
),所述方法包括使fah基因缺失动物模型按照以下程序服用ntbc:(1)持续3~12天每天服用低剂量ntbc,所述低剂量为0.005~0.1mg/kg动物体重/天;(2)持续2~6天每天服用高剂量ntbc,所述高剂量为0.25~1.5mg/kg动物体重/天;(3)进行步骤(1)和(2)的
循环。根据实际需要,所述的程序进行至动物模型被应用或动物模型寿命结束。
89.鉴于动物的不同个体之间存在个体差异,在口服状况下,每天ntbc的摄入量存在一定的浮动,因此本发明的低剂量或高剂量以针对动物个体摄入量的平均值计。具体地,对于低剂量给药阶段,平均单日给予0.005~0.1mg/kg动物体重ntbc时,若以5mg/l ntbc设为100%ntbc,相应的ntbc用药浓度可以为0.665~13.33%。具体地,对于高剂量给药阶段,平均单日给予0.25~1.5mg/kg动物体重时,若以5mg/l ntbc设为100%ntbc,相应的ntbc用药浓度可以为33.33%~200%。
90.fah基因缺失动物可通过人为调控ntbc供给模式控制肝损伤,从而创建fah野生型同种肝细胞移植或异种肝细胞移植条件。因此,在上述维持fah基因缺失动物模型的慢性肝损伤的基础上,本发明进一步还提供了一种制备异源化肝移植动物模型方法,包括:以上述的(1)~(2)的步骤进行;并且,在上述程序起始后的第3~30天(如4、5、6、8、10、12、15、18、20、22、25、28天),对动物进行人原代肝细胞的移植。
91.在本发明的优选方式中,所述的fah基因缺失动物为fah
‑
/
‑
rag2
‑
/
‑
il2rg
‑
/
‑
的动物。fah是一条具有419个氨基酸的酶,其基因长度为22586bp,具有14个外显子和13个内含子;其genbank登录号为nm_017181.2。rag2是一条具有527个氨基酸的蛋白,其基因长度为8297bp,具有3个外显子和2个内含子;其genbank登录号为nm_001100528.1。il2rg是一条具有368个氨基酸的蛋白,其基因长度为7281bp,具有12个外显子和11个内含子;其genbank登录号为nm_080889.1。fah基因缺失可以导致动物发生可诱导肝脏损伤,rag2基因敲除可以导致动物的t、b细胞缺失,il2rg基因敲除可以导致动物的nk细胞缺失以及t、b细胞减少。rag2和il2rg各自敲除和共同敲除都可以获得免疫缺陷的动物,而rag2和il2rg同时敲除,免疫缺陷最严重,适合人肝细胞移植。
92.在本发明中,可以采用多种方式来给予动物ntbc。在一些优选方式中,采用口服给药的方式,包括将ntbc混合于饮用水中,或将ntbc混合于动物的食物中。
93.本发明中,所述的异源肝细胞可以包括:(a)原代肝细胞;(b)诱导多能性干细胞(ipsc)与胚胎干细胞(esc)诱导分化而来的肝干/祖细胞,肝细胞或肝样细胞,内胚层细胞等;(c)内胚层及其他胚层干细胞诱导分化而来的肝干/祖细胞,肝细胞或肝样细胞;(d)成体或胎儿干/祖细胞或肝细胞、体细胞直接转分化而来的肝干/祖细胞,肝细胞或肝样细胞;(f)(a)~(d)来源的细胞经体外诱导扩增后的肝干/祖细胞,肝细胞或肝样细胞;(g)(a)~(f)来源的细胞构建的肝类器官。异源的原代肝细胞可分离自动物器官供体的肝脏,分离自外科手术切除物或者源自诱导多能性干细胞、胚胎干细胞,胚胎组织及其细胞,羊膜上皮细胞,单核细胞或羊水细胞。
94.在本发明中,用于移植到受体动物中的异源肝细胞可通过本技术领域中任何已知的方法从肝组织分离。可以将肝脏组织以机械或酶法消化,以提供单细胞悬液,或可以使用完整肝脏组织块。例如,通过常规的胶原酶灌流,然后进行低速离心,将肝细胞从供体组织分离;然后可以通过筛网过滤,随后进行密度梯度离心,来纯化肝细胞。作为不同的选择方式,其他的用于富集肝细胞的方法也可以使用,例如流式细胞分选术、磁珠分离、密度梯度离心,或本技术领域中公知的任何其他方法。可以使用类似的肝细胞分离方法,从受体动物肝脏收集被扩增的人肝细胞。除了从器官供体或肝切除物获得异源肝细胞之外,用于移入的细胞也可以是在移植到受体动物中后定植并扩增的人肝细胞或经体外扩增的肝细胞前
体细胞、祖细胞及其他肝样细胞。
95.作为本发明的优选方式,在进行所述程序(ntbc
p
)之前,还包括:以惹卓碱(retrorsine,rs)预处理所述动物。在开发ntbc
p
程序之前,本发明人也尝试了联合使用惹卓碱和部分肝切除手术处理动物,然而因所用动物模型无法调控肝损伤的局限,检测到的人白蛋白分泌水平仅为90μg/ml。而在人源化动物中,只有超过30%人源化嵌合率或1mg/ml白蛋白分泌水平时,才能较为准确地模拟人类药物代谢过程。因此,本发明人以fah缺失且免疫缺陷的大鼠为模型,开发出优化的ntbc
p
程序,移植7个月时,能够将人源化嵌合率大大提高至30%以上,白蛋白分泌水平能达到高于2mg/ml。
96.作为本发明的优选方式,惹卓碱的用量为10~50mg/kg动物体重;更佳地,惹卓碱的用量为20~40mg/kg动物体重;进一步更佳地,惹卓碱的用量为25~35mg/kg动物体重。在本发明的具体实施例中,论证显示,经rs预处理的动物的肝组织中ki67阳性细胞比例显著更低。人白蛋白(halbumin,alb)分泌水平是评价异源肝细胞在体内嵌合、扩增水平的重要指标,经比较发现,rs预处理后的动物在移植异源肝细胞后的白蛋白分泌水平显著增长更快,表明rs的预处理与ntbc程序化调控的配合应用能更好地促进异源肝细胞在体内的嵌合和扩增。
97.在本发明的具体实施方式中,提供了一种优选的方案,包括:在人源肝/肝样细胞移植前2周,对fah缺失大鼠腹腔注射30mg/kg动物体重惹卓碱,并于移植前1周降低日常供水中ntbc浓度从正常维持浓度(5~8mg/l)至低浓度(0.2mg/l),开启ntbc程序化调控,按照0.2mg/l
×
7天+5mg/l
×
4天的方式(一个循环周期共11天)在日常饮水中添加ntbc。
98.利用本发明的方法,可以获得具有高异源化嵌合率的异源化肝脏,异源化嵌合率可高于25%,较佳地高于28%,更佳地高于32%;随着动物培养时间的增加,该嵌合率还会进一步提高。
99.本发明的技术方案,具有非常显著的技术效果,包括但不限于:(1)可维持fah缺失动物的长期慢性肝损伤状态,可实现非急性致死性可持续维持慢性肝损伤,避免异源肝/肝样细胞移植后动物模型的早期死亡,动物生存率高;(2)能创造有利于异源肝/肝样细胞在动物模型体内定植生存的肝内环境且提供足够长的体内扩增窗口期,能在高存活率下构建高置换率的异源化肝脏;(3)操作、管理方法便捷,可控性高,可开发自动化制备动物模型的装置或计算机系统,实现规模化的动物模型制备。
100.应用
101.本发明公开异源肝细胞移植动物模型可以用于多种多样的研究和治疗目的,包括但不限于以下应用:
102.动物慢性肝损伤模型:利用本发明能够稳定诱导fah缺失动物的慢性肝损伤,建立以肝纤维化和肝硬化为主要代表的慢性肝病模型,用于疾病机理和药物研究。
103.临床前药物体内测试:利用本发明构建的高度肝脏异源化动物模型,可望用于临床前药物代谢、毒性和药效测试,及体内人肝炎病毒感染实验,不仅生理上更接近人体,而且支持长期采样、检测和追踪,利于推进新药研发。本发明的动物模型可用于研究多种肝脏疾病,包括hcc、肝癌和肝硬化等。本发明的动物模型可用作由例如暴露于毒素、感染性疾病或恶性肿瘤或者由遗传缺陷引起的肝脏疾病的模型。适于应用本发明动物模型进行药物研究的遗传性肝脏疾病的实例包括但不限于高胆固醇血症、高甘油三酸酯血症、高草酸盐尿、
苯丙酮尿症、糖原贮积病和一些先天代谢缺陷等。本发明的模型系统可以用于更好地理解具体肝脏疾病,以及用于鉴定可以阻止、延缓或逆转疾病过程的试剂。在另一些可选方式中,本发明建立的动物模型可被用作因毒素引起的肝脏疾病的模型。本发明建立的动物模型还可被用于对候选疫苗进行筛查其防止或减轻嗜肝病原体引起的感染的能力。本发明中,用作药物测试的候选药物的类型没有特别的限制,可以获自多种来源,包括合成或天然化合物库。例如,有多种方式用于随机和定向合成多种有机化合物和生物分子,包括表达随机寡核苷酸和寡肽;或者,可获得或容易地产生细菌、真菌、植物和动物提取物形式的天然化合物库。另外,天然或合成方法产生的库和化合物可容易地通过常规化学、物理和生物化学方法修饰,并且可用于产生组合库。可以对已知药理学试剂进行定向或随机化学修饰(例如酰化、烷化、酯化、酰胺化等)以产生结构类似物。
104.异源(人源)肝细胞的扩增移植医疗:本发明的方法可在受体动物中扩增并从其中收集的异源(如人)肝细胞,可作为人肝细胞的来源,用于在需要肝脏重建疗法的受试者中进行肝脏重建的用途。本发明可支持异源肝/肝样细胞在fah缺失动物体内的大幅扩增,开发类器官的移植替代技术的开发,为未来临床再生移植治疗提供重要支撑。通过导入肝细胞在患者中重建肝组织,是患有急性肝衰竭患者的潜在的治疗性选择,也可以用作在肝移植前的暂时处理。肝细胞重建可以用于例如导入遗传修饰的肝细胞以进行基因疗法,或用于替换由于疾病、物理或化学损伤或肿瘤而引起的肝细胞损失。可以使用本技术领域在已知的许多技术从受体动物收集人肝细胞;可以使用本技术领域中任何公知的技术,将从受体动物收集的人肝细胞与非人细胞或其他杂质(例如组织或细胞碎片)分离开。本发明有望解决肝器官、肝细胞移植供体不足的严峻问题。
105.基因治疗研究:在本发明建立的动物模型中扩增并从其收集的肝细胞可用于评估任何药物化合物(例如小分子、生物制品、环境和生物毒素或基因送递系统)对人肝细胞基因表达的改变。也可将之应用于研究基因治疗方案和载体。例如,可以评估以下的参数:基因送递载体(包括病毒和非病毒载体)的转导效率;遗传物质的整合频率和定位(整合部位分析);遗传物质的功能性(基因表达水平、基因敲除效率);以及遗传物质的副作用(体内人肝细胞基因表达或蛋白组学的分析)。例如,已有报道称在对患有家族性高胆固醇血症的患者的基因治疗中使用转染的肝细胞。
106.个性化肝病模型与精准医疗:利用患者自身ipsc来源肝样细胞构建个性化肝病动物模型,从肝纤维化、肝硬化,hcc、icc、ccc到nash,hbv以及ht1、aat等病毒性和代谢性遗传缺陷的肝病基因编辑治疗,推动个性化靶向药物和前沿新型治疗策略的研发。
107.体外测试:异源肝/肝样细胞在动物体内扩增后,可通过肝脏灌流的方式回收获取。由于未经体外培养,体内扩增后的异源肝/肝样细胞在性状、功能上均能最大程度维持与植入原始细胞的一致性。用于药物测试、疾病模拟等相关体外测试时,能保证结果的稳定性和可重复性。
108.此外,采用与本发明类似方法确定适合特定种属动物的ntbc控制浓度和维持时间,建立循环周期固定化的ntbc程序化调控,可以创建针对性的慢性肝损伤调控,实现异源肝/肝样细胞移植后在体内持续、稳定地嵌合和扩增。
109.动物模型制备系统/试剂盒
110.基于所披露的新方法,本发明还提供了一种用于培育fah基因缺失动物模型且维
持其慢性肝损伤的系统。本发明中,所述的系统可以是机械装置,较佳地为自动化的机械装置;也可以是计算机系统,其包括多种模块,以便于本发明的方法的实施。
111.作为本发明的一种优选方式,提供一种机械装置,较佳地为自动化的机械装置,其包括:给药组件1,其设置为持续3~12天、每天向动物给药低剂量ntbc,所述低剂量为2~10%;以及,给药组件2,其设置为持续2~6天、每天向动物给药高剂量ntbc,所述低剂量为70~100%。较佳地,其还包括给药组件3,其能向动物给药(如注射)惹卓碱。上述三种给药组件可构成一个有机整体,与容纳动物的装置有机整合,从而提供一种便捷、自动化的动物制备系统。
112.作为本发明的一种优选方式,提供一种计算机控制系统,其包括给药模块1,其包括一种控制程序,该程序能够发出指令,使得与其操作性连接(由其操控)的下游系统(如机械嘴)能够持续3~12天、每天向动物给药低剂量ntbc,所述低剂量为2~10%;其还包括给药模块2,其包括一种控制程序,该程序能够发出指令,使得与其操作性连接(由其操控)的下游系统(如机械嘴)能够持续2~6天、每天向动物给药高剂量ntbc,所述低剂量为70~100%。较佳地,其还包括给药模块3,其包括一种控制程序,该程序能够发出指令,使得与其操作性连接(由其操控)的下游系统(如注射器)能够向动物给药惹卓碱。
113.基于所披露的新方法,本发明还提供了一种用于培育fah基因缺失动物模型且维持其慢性肝损伤的试剂盒(较佳地用于1次循环),其包括:容器组1,包括容器以及位于容器中的低剂量ntbc,所述低剂量为0.005~0.1mg/kg动物体重/天;较佳地该容器组1中容器数量为3~12个(较佳地用于1次循环);容器组2,包括容器以及位于其中的高剂量ntbc,所述高剂量为0.25~1.5mg/kg动物体重/天;较佳地该容器组2中容器数量为2~6个(较佳地用于1次循环)。优选地,所述的试剂盒中还包括:容器3,以及位于其中的惹卓碱。作为一种优选方式,所述的容器3可以为注射器。可以设置多组试剂盒以应用于多轮的ntbc循环。同时,实际运用中,根据动物的体重,本领域人员容易在容器中添加具体的ntbc的量。
114.根据本发明的整体披露以及实施例的举例,本领域技术人员可以方便地进行设计或组装。
115.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
116.材料和方法
117.1、动物
118.fah
‑
/
‑
rag2
‑
/
‑
il2rg
‑
/
‑
大鼠(frg大鼠)饲养于江苏大学实验动物中心。
119.2、细胞
120.实施例中所用于移植的原代肝细胞的来源信息如表1。
121.表1
122.批次号年龄性别供体死因细胞存活率qie7月男性缺氧;心血管86%xjl2年女性缺氧(溺水)84%jfc1年男性缺氧;钝器击伤94%
123.以上均购自bioreclamationivt,usa。
124.3、试剂
125.(1)rna反转录
126.使用试剂盒revert aid rt kit(thermo fisher scientific)。
127.(2)定量qpcr
128.使用试剂盒thunderbird sybr qpcr mix(toyobo,japan)。
129.(3)人白蛋白分泌测定
130.使用试剂盒human albumin elisa quantitation set(bethyl laboratory,usa)。
131.(4)he和免疫染色
132.4%多聚甲醛(wako);甲醇(wako);丙酮(wako);吐温
‑
20(wako);柠檬酸(wako);过氧化氢(wako);山羊血清(thermo fisher scientific);驴血清(jacksonlab,usa);苏木精(wako);伊红(wako);abc试剂盒(vector laboratories,usa);opal
tm 4
‑
color manual ihc kit(perkinelmer,usa);4’,6
‑
二脒基
‑2‑
苯基吲哚(dapi,thermo fisher scientific);fa封片剂(vmrd,usa)。
133.(5)periodic acid
‑
schiff(pas)染色
134.使用试剂盒periodic
‑
acid
‑
schiff(上海源叶生物科技有限公司)。
135.(6)ugt2b7代谢测试
136.参考物质:1.0mg/ml齐多夫定(zidovudine solution)(azt,sigma);3
’‑
叠氮基3
’‑
脱氧胸苷β
‑
d
‑
葡糖苷酸(azt
‑5’‑
葡糖醛酸,toronto research chemicals,canada)。
137.4、引物
138.实施例中所用引物如表2。
139.表2
140.基因正向(5
’‑3’
)反向(5
’‑3’
)albgcctttgctcagtatctt(seq id no:1)aggtttgggttgtcatct(seq id no:2)aattatgatgaagcgtttaggc(seq id no:3)cagtaatggacagtttgggt(seq id no:4)fahcctacggcgtcttctcgac(seq id no:5)ctgcaagaacactctcgcct(seq id no:6)g6pcctggagtcctgtcaggcattg(seq id no:7)cagtcccttgagcagcagataa(seq id no:8)cyp2a6cagcacttcctgaatgag(seq id no:9)aggtgactgggaggacttgaggc(seq id no:10)cyp2e1ccccagcggcaccatgtctg(seq id no:11)tgggccaaccgggtgaaggaa(seq id no:12)cyp3a4ttcagcaagaagaacaaggacaa(seq id no:13)ggttgaagaagtcctcctaagc(seq id no:14)cyp3a7tacacaccctttggaagtgg(seq id no:15)caaagcgtaatttcaggggg(seq id no:16)cyp7a1tgtccatttcatcacaaatcccttg(seq id no:17)gtggtatttccatccatcgggtc(seq id no:18)slco1b1ttggaggtgttttgactgctt(seq id no:19)acaagtggataaggtcgatgttg(seq id no:20)ugt2b7tcagccctggcccagatccc(seq id no:21)acagctgctcccctggcctt(seq id no:22)afpactgaatccagaacactgca(seq id no:23)tgcagtcaatgcatctttca(seq id no:24)actbtggcacccagcacaatgaa(seq id no:25)ctaagtcatagtccgcctagaagca(seq id no:26)rat afptgatttctctggcctcttgg(seq id no:27)ttgtcctttcttcctcctgg(seq id no:28)rat actbgagtacaaccttcttgcagctcc(seq id no:29)ccttctgacccatacccaccat(seq id no:30)
141.5、抗体
142.实施例中所用抗体如表3。
143.表3
[0144][0145][0146]
6、he染色
[0147]
大鼠肝脏用4%pfa固定过夜,脱水包埋,切成3um厚。
[0148]
(1)二甲苯脱蜡3次,每次5分钟。
[0149]
(2)梯度复水:100%乙醇,100%乙醇,90%乙醇,80%乙醇,70%乙醇,50%乙醇,各5分钟。去离子水,浸泡1分钟。
[0150]
(3)抗原修复(此步根据抗体特性可选):ph=6.0的柠檬酸钠抗原修复液95度加热半小时,然后自然冷却至室温。用去离子水洗15分钟。
[0151]
(4)苏木精复染20分钟。自来水冲洗半小时。
[0152]
(5)梯度脱水:50%乙醇,70%乙醇,80%乙醇,90%乙醇,100%乙醇,各2分钟。
[0153]
(6)二甲苯15
‑
30分钟后,中性树脂封片保存。
[0154]
7、免疫组化
[0155]
(1)脱蜡复水步骤同前述。
[0156]
(2)在样品周围用immunopen画圈,滴一滴3%h2o2,室温15分钟,用于封闭内源的过
氧化物酶。
[0157]
(3)pbs洗两次,每次5分钟。
[0158]
(4)用1:20的normal horse serum(溶于1%bsa
‑
pbs)封闭,室温孵育20分钟,用pbs洗3次。
[0159]
(5)加一抗,将切片放在湿盒内,封好,4度过夜。
[0160]
(6)pbs洗三次,每次5分钟。
[0161]
(7)加二抗,室温孵育30分钟。pbs洗三次,每次5分钟。
[0162]
(8)加入abc kit中的ab液(a、b液1:100稀释),室温孵育30分钟。pbs洗三次,每次5分钟。
[0163]
(9)dab显色,根据不同抗体调整显色时间。
[0164]
(10)苏木精复染20分钟。自来水冲洗半小时。
[0165]
(11)梯度脱水:50%乙醇,70%乙醇,80%乙醇,90%乙醇,100%乙醇,各2分钟。
[0166]
(12)二甲苯15
‑
30分钟后,中性树脂封片保存。
[0167]
8、免疫荧光染色
[0168]
(1)冰冻切片(7μm)于4%pfa中室温固定10分钟,或于甲醇:丙酮(1:1)中
‑
30℃固定30分钟。
[0169]
(2)0.1%tween
‑
pbs洗涤3遍,每次5分钟。
[0170]
(3)10%山羊或驴血清室温封闭60分钟。
[0171]
(4)一抗4℃下孵育过夜。
[0172]
(5)0.1%tween
‑
pbs洗涤3遍,每次5分钟。
[0173]
(6)结合荧光素的二抗室温孵育60分钟。
[0174]
(7)pbs洗涤3遍,每次5分钟。
[0175]
(8)加入dapi,封闭剂封片保存。
[0176]
9、定量qpcr
[0177]
根据revert aid rt kit试剂盒使用说明将1μg rna反转录为cdna。根据thunderbird sybr qpcr mix试剂盒使用说明,将cdna产物在定量pcr仪上扩增并定量分析。目标基因的相对表达量以actb为内参。所有数据至少重复两次。
[0178]
10、肝功检测
[0179]
大鼠血清中谷氨酸氨基转移酶(alt)和谷草转氨酶(ast)含量测定按生化分析仪fuji dri
‑
chem 7000v(fujifilm,japan)的操作说明进行。
[0180]
11、人白蛋白分泌测定
[0181]
通过尾静脉采集100μl大鼠外周血,室温凝固后400
×
g离心10分钟后,取上清获得血清。人白蛋白的分泌水平测试按照human albumin elisa quantitation set试剂盒使用说明。血清根据实际浓度稀释10
‑
100000倍,使计算数值落在标准曲线的线性范围内以获得准确值。
[0182]
12、原代肝细胞移植和程序化ntbc循环
[0183]
(1)移植前准备:7~8周龄雌性frg大鼠于移植前2周腹腔注射30mg/kg惹卓碱(retrorsine),并于移植前1周降低日常供水中ntbc浓度从正常维持浓度(5~8mg/l)至低浓度(0.2mg/l),开启程序化ntbc循环,按照0.2mg/l
×
7天+5mg/l
×
4天的方式(一个循环周
期共11天)提供日常ntbc饮水。
[0184]
以往饲养中,frg大鼠日常供应5~8mg/l,本发明中以该最低剂量5mg/l ntbc设为100%ntbc;依据大鼠体重(250
‑
300g)和饮水量(25
‑
50ml/天)的计算,可以得出:
[0185]
4%ntbc:相当于平均0.03mg/kg/天;
[0186]
100%ntbc:相当于平均0.75mg/kg/天。
[0187]
(2)移植过程在使用异氟烷的麻醉机下进行。大鼠腹部朝上固定,去毛后用碘酒和酒精清理、消毒。
[0188]
(3)剪开表皮和肌肉层,并找到肝门静脉。用26g针缓慢注射2
×
106人原代肝细胞(重悬于800μl dmem+10%fbs中)。注射完成后,停顿几秒后拔出针头,迅速用无菌棉棒按压进针口。
[0189]
(4)按压1分钟左右,观察无血液流出后缝合肌肉及表皮,用酒精棉消毒伤口。
[0190]
13、体内ugt2b7代谢测试
[0191]
肝脏人源化及未对照组frg大鼠经口灌胃给药15mg/kg zidovudine(wako),在0、0.5、1、2、4和8小时后采外周血。取30μl血浆用pbs稀释2倍后,用lc
‑
ms/ms(agilent 1200hplc和abi 4000mass
‑
spectrometer)检测底物和代谢产物的含量。
[0192]
实施例1、frg大鼠在ntbc撤除后产生致死性肝损伤
[0193]
本发明人长期跟踪观察,发现frg大鼠能够在100%ntbc(frg大鼠日常供应5
‑
8mg/l,本发明中以该最低剂量5mg/l设为100%)维持下健康存活至少1.5年,为人源化肝脏的构建提供了充足的时间窗口(图1a和d)。当ntbc撤除后,大鼠迅速出现肝损伤。伴随着显著升高的alt和ast值(图1b),肝组织出现坏死和纤维化病症(图1c)。所有大鼠均在ntbc撤除4周内死亡,其中位生存期为9.6天(图1d)。
[0194]
结果证明,ntbc撤除能引起frg大鼠产生严重肝损伤,并进而导致死亡。
[0195]
从大鼠中观测到的这一情形不同于小鼠等其它动物在ntbc撤除后还能维持较长存活时期,并维持较高的肝损伤。因此,对于大鼠而言,不适用本领域现有的一些ntbc应用方案。
[0196]
实施例2、建立诱导慢性肝损伤的ntbc程序化调控
[0197]
为提高frg大鼠在肝损伤条件下的生存率,保证长期人源化过程的稳定性,本发明人进行了深入的研究,多角度进行大鼠肝损伤及其生存情况分析,以探寻提高大鼠肝损伤条件下生存率的最佳条件。
[0198]
通过比较不同ntbc浓度(0%,1%,4%,10%,100%)下大鼠的生存率确定最佳ntbc维持浓度。结果显示,当ntbc浓度超过4%的维持剂量(5mg/l)时,中位生存期超过三周(22天),可有效预防大鼠出现猝死状况(图2a)。进一步比较4%和10%ntbc条件下大鼠肝功能和体重状态,发现4%条件下能够维持较高的alt和ast水平,并显著抑制大鼠体重的增长(图2b),达到既维持存活又诱导肝损伤的效果。
[0199]
由于人源化过程需要较长的周期,为进一步提高大鼠在肝损伤下的长期生存率,本发明人设计了一系列ntbc用药方案,称为循环周期固定化的ntbc程序化调控(programmed ntbc controlling,ntbc
p
),包括:分别在4%ntbc条件下维持5、7和9天后,恢复4天的100%ntbc,以缓解累积的肝损伤(图2c)。
[0200]
结果表明,frg大鼠在5+4的ntbc程序化(5天4%ntbc+4天100%ntbc循环)和7+4的
ntbc程序化(7天4%ntbc+4天100%ntbc循环)调控下均能在2个月内维持较高的生存率(图2d)。
[0201]
进一步比较5+4和7+4这两种模式,本发明人发现,7+4调控下具有显著更高的alt和ast水平(图2e),能更好地诱导肝脏的慢性损伤;观测肝组织纤维化程度(图2f),7+4调控下纤维化程度更为显著。
[0202]
同时,本发明人还观察到,ntbc程序化调控的长期作用不会导致大鼠肝组织特异性癌基因afp的异常上调(图2g),证明这一策略具有安全性。
[0203]
综合以上结果,本发明人确立了能够持续诱导慢性肝损伤的7+4ntbc
p
调控策略,并应用于后续肝脏人源化大鼠模型制作。
[0204]
实施例3、惹卓碱(retrorsine)预处理与ntbc程序化调控的配合应用
[0205]
本发明人发现,ntbc程序化调控过程(7+4:7天4%ntbc+4天100%ntbc循环)中,移植人原代肝细胞(phh)后,人源化大鼠模型体内的phh嵌合和扩增水平仍然不够理想。为了实现进一步的优化,本发明人针对多种多样的目标药物进行了广泛的分析和实验,发现利用retrorsine(rs)预处理具有促进作用。
[0206]
本发明人设置了retrorsine(rs)预处理(w/rs)与未经处理(w/o rs)frg大鼠肝细胞,观测大鼠模型体内的phh嵌合和扩增水平。
[0207]
如前述实施例2的ntbc程序化调控2个月后,可以发现经rs预处理的大鼠肝组织中ki67阳性细胞比例显著更低(图3a和b)。人白蛋白(halbumin,alb)分泌水平是评价人源肝细胞在体内嵌合、扩增水平的重要指标,经比较发现,rs预处理后的大鼠在移植人原代肝细胞(phh)后的白蛋白分泌水平显著增长更快(图3c),表明rs的预处理与ntbc程序化调控的配合应用能更好地促进phh在体内的嵌合和扩增。
[0208]
实施例4、慢性肝损伤下大鼠肝脏的人源化制作
[0209]
如前述对大鼠进行人原代肝细胞移植比较前述循环周期固定化的ntbc程序化调控ntbc
p
(7+4:7天4%ntbc+4天100%ntbc循环;以及以惹卓碱预处理)与以10%体重变化为指标的ntbc
δbw
条件下(撤除ntbc,当大鼠体重下降10%时给予100%ntbc,体重恢复至撤除前的时候再撤除ntbc,按此循环)(图4a),frg大鼠移植phh后的生存曲线。
[0210]
结果显示,移植后大鼠在ntbc
p
控制条件下具有更高的生存率,其中6/7的大鼠可以存活至少20周(图4b)。ntbc
p
控制条件下,随着时间延长,存活大鼠体内的人白蛋白分泌水平持续升高并在7个月后最高可达到2.2mg/ml(平均1.7
±
0.3mg/ml)(图4c)。
[0211]
通过人特异性标志物hnuclei的免疫染色,可以计算出大鼠肝脏人源化嵌合率。如图4d所示,ntbc
p
控制条件下,移植后人源细胞的嵌合率持续提高,并于7个月时嵌合率达到了31
±
4%(图4e)。
[0212]
实施例5、人源化肝脏的细胞构成鉴定
[0213]
前述ntbc程序化调控ntbc
p
(7+4:7天4%ntbc+4天100%ntbc循环;以及以惹卓碱预处理)方法下,frg大鼠移植phh后7个月后,获取和鉴定其中的嵌合的人源细胞性状。针对人肝实质细胞特有抗原,本发明人使用halb、haat与hnuclei抗体复染,并进行观察。结果显示,所有hnuclei阳性的人源细胞均表达halb和haat,表明这些细胞为成熟的肝实质细胞(图5a)。
[0214]
此外,以fah阳性代表的人肝实质细胞在he染色上表现为较周围大鼠肝细胞区域
更显白的颜色(图5b),可以明显区别两个不同物种来源。同时,人肝实质细胞也表现出更强的糖原储存能力(图5c)。从组织学上观察,可以确认人源肝实质细胞的嵌合未对大鼠原有肝脏结构产生影响(图5b)。这些结果与在人源化小鼠模型中的相关报道一致。同时,ck19和hnuclei抗体复染的结果显示不存在ck19阳性的人源细胞,表明移植的人原代肝细胞并未在大鼠体内转变为胆管上皮细胞(图5d)。此外,通过分析ki67阳性细胞在halb阳性肝实质细胞中的比例,发现随着时间的延长,人肝实质细胞的增殖性逐渐下降(图5e)。然而,在移植7个月后仍然维持了10%以上的比例(图5f),说明ntbc
p
可以诱导人原代肝细胞获得长期体内扩增潜能。
[0215]
实施例6、人源化肝脏的致瘤性检测
[0216]
前述ntbc程序化调控ntbc
p
(7+4:7天4%ntbc+4天100%ntbc循环;以及以惹卓碱预处理)方法下,frg大鼠移植phh后7个月,获取人源化肝脏计算肝体重比。
[0217]
结果显示,肝体重比数值与未移植的对照相比无显著提高(图6a)。组织学未发现肿瘤形成。进一步对肝癌主要标志物afp进行基因和蛋白水平的分析,结果显示人肝细胞嵌合到大鼠肝脏7个月后未发生afp的异常上调(图6b和c)。
[0218]
以上结果表明,ntbc
p
条件下不会诱导肝脏人源化过程发生恶性病变。
[0219]
实施例7、人源化肝脏显示与人体肝脏相近的代谢相关基因和蛋白表达
[0220]
前述ntbc程序化调控ntbc
p
(7+4:7天4%ntbc+4天100%ntbc循环;以及以惹卓碱预处理)方法下,frg大鼠移植phh后7个月,评估人源化肝脏在大鼠体内的功能。
[0221]
本发明人首先用特异性识别人基因的引物(表2)进行qpcr解析代谢相关基因的表达情况。结果显示,人源化肝脏不仅表达成熟肝实质细胞标志物相关基因(alb、aat、g6pc、fah),而且表达i相代谢酶(cyp2a6、cyp2e1、cyp3a4、cyp3a7和cyp7a1)、ii相代谢酶(ugt2b7)和转运体(slc22a1和slco1b1)相关基因(图7a)。更重要的是,其表达水平与移植前的phh接近。
[0222]
代谢酶类在肝组织中的有序分布是肝脏的重要结构特征。通过对随机选取的肝代谢酶进行免疫染色,可以发现谷氨酰胺合成酶(gs)特异性分布在中央静脉附近的肝实质细胞上(图7b),i相代谢酶细胞色素p450 3a4酶(cyp3a4)1a2酶(cyp1a2)也集中分布在中央静脉周边。相反地,精氨酸酶(arg1)主要集中在肝门静脉附近(图7b)。此外,ii相酶尿苷二磷酸葡萄糖醛酸转移酶2b79(ugt2b7)和转运体多药耐药相关蛋白2(mrp2)均匀地分布于整个肝小叶中(图7c)。重要的是,以上代谢酶在人源化肝脏中的分布情况均与人体中的分布规律一致。
[0223]
上述结果可见,无论在代谢相关基因和酶的表达特征上,人源化肝脏均表现出与人体肝脏极大的相似性。
[0224]
实施例8、人源化肝脏具有人类特异的药物代谢特征
[0225]
目前已知人ugt2b7酶参与约35%临床药物的代谢,具有重要的研究意义。本发明人利用ugt2b7代谢药物齐多夫定(azt)验证肝脏人源化大鼠能否表现出人类特异性的代谢特征。在人体中,75%的azt可代谢为azt
‑5’‑
葡萄糖醛酸(glucuronide),而在大鼠中,该代谢转化率仅为10%。图8a所示为测试流程。
[0226]
结果显示,经口服azt后,肝脏人源化大鼠(约30%嵌合率)中的azt
‑5’‑
葡萄糖醛酸明显高于对照组(图8b)。azt
‑5’‑
葡萄糖醛酸/azt的auc(areas under the curves)值在
肝脏人源化和对照大鼠中分别为39%
±
16%和6%
±
3%(图8c)。此外,人白蛋白分泌量与auc值(azt
‑5’‑
葡萄糖醛酸/azt)的相关性比较也表明肝脏人源化率与azt的人型代谢水平正相关(图8d)。
[0227]
以上结果表明,肝脏人源化大鼠表现出人特有的体内药物代谢特征,且其具备长期存活的能力。
[0228]
实施例9、用于动物人源化肝脏制备的试剂盒/套组
[0229]
本实施例中,提供一种用于大鼠人源化肝脏制备的试剂盒,其中包括:
[0230]
容器组1,包括容器以及位于容器中的低剂量尼替西农,所述低剂量为0.03mg;该容器组1中容器数量为7个;
[0231]
容器组2,包括容器以及位于其中的高剂量尼替西农,所述高剂量为0.75mg;该容器组2中容器数量为4个;
[0232]
容器组3,包括容器以及位于其中的惹卓碱,其为4mg;该容器组1中容器数量为1个;
[0233]
该试剂盒被用于1次(11天)的给药,以及大鼠的惹卓碱预处理。
[0234]
多个所述的试剂盒被整合后,可用于多个循环的大鼠用药,包括多只大鼠同时用药。在持续的动物培育中,运用试剂盒组,如所述试剂盒组含有2~200个试剂盒。多个试剂盒构成的试剂盒组中,惹卓碱仅需在1个试剂盒中提供。
[0235]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1