抗体偶联药物及其中间体和应用的制作方法
1.本发明属于生物技术和医药领域,特别涉及一种抗体偶联药物及其中间体和其应用。
背景技术:
2.抗体偶联药物(adc)是近年来制药行业关注的热点之一。由于许多抗体药物在临床中的疗效不尽如人意,许多行业巨头越来越多地把目光转向adc药物。目前国外已有七个adc药物获批上市销售。2000年5月17日fda批准辉瑞公司的gemtuzumab ozogamicin(商品名mylotarg)上市,用于治疗首次复发、60岁以上、cd33+、不适合细胞毒化疗的急性髓性白血病(aml)患者,虽然该药在2010年遭撤市,但又于2017年重新上市,同年辉瑞的inotuzumab ozogamicin(商品名besponsa)也被fda批准上市,用于治疗成人复发难治b细胞all。2011年8月19日,fda批准seattle genetics公司开发的brentuximab vedotin(商品名adcetris)上市,用于治疗cd30阳性的霍杰金淋巴瘤(hl)和罕见疾病系统性间变性大细胞淋巴瘤(salcl)。2013年2月22日,genentech公司开发的ado-trastuzumab emtansine(t-dm1,商品名kadcyla)获fda批准上市销售,主要用于治疗her2阳性晚期(转移性)乳腺癌。特别在2019年,polatuzumab vedotin(商品名polivy)、enfortumab vedotin(商品名padcev)和fam-trastuzumabderuxtecan(商品名enhertu)相继获批上市,更加激发了药物研发企业的热情,截至2020年第一季度末,全球处于活跃状态的adc药物共311个,临床二期和三期的研发管线有33个。
3.抗体偶联药物的基本模块包含抗体、连接子、效应分子,利用抗体将效应分子传输到肿瘤部分富集,从而杀死肿瘤细胞。传统的效应分子大都是高活性的微管蛋白抑制剂,通常有较大的毒副作用,限制了adc的应用。近来immunomedics公司发明了一种以喜树碱化合物作为效应分子的新型adc药物immu-132(zl200980156218),表现出了较好的抗肿瘤效果,第一三共发明了另一种喜树碱化合物作为效应分子的adc药物ds-8201a(zl201380053256),同样表现出来较好的抗肿瘤效果。现有的adc技术中,用于连接喜树碱化合物与抗体的连接子研究较少。一般来讲,adc中的理想连接子需满足以下要求:首先,血浆中保证小分子药物不与抗体脱离,进入细胞后,连接子在适当条件下断裂,迅速释放出活性小分子药物;其次,连接子还要具有较好的理化性质,以便能与抗体连接形成偶联物;再次,连接子要易于制备从而为adc规模化生产奠定基础。immu-132采用ph敏感型的连接子,稳定性较差。ds-8201a使用一种含有甘氨酸-甘氨酸-苯丙氨酸-甘氨酸(ggfg)的四肽结构,相比于一般的组织蛋白酶b底物序列(如缬氨酸-瓜氨酸)酶切反应慢,而且存在理化性质差,合成困难等问题。
技术实现要素:
4.本发明要解决的技术问题是克服现有抗体偶联药物种类单一的缺陷,提供了一种连接基药物偶联物,并在此基础上提供了一种抗体偶联药物及其中间体和应用。该抗体偶
联药物可以实现细胞毒性药物在adc领域的广泛应用,治疗对于微管类adc耐药的肿瘤病人。
5.本发明提供的具有特定结构连接基的抗体偶联药物能抑制哺乳动物肿瘤生长,可用于治疗多种癌症。所述抗体偶联药物具有很好的生物学活性、稳定性和均一性,且具有很好的安全性。
6.本发明通过以下技术方案解决上述技术问题。
7.本发明提供了一种连接基药物偶联物,其结构通式为:l
3-l
2-l
1-d;
8.d为细胞毒性药物;
[0009]-l
1-的结构如式i或ii所示,其a端与所述的细胞毒性药物相连,e端和与所述的-l
2-的c端相连;
[0010][0011]
其中,x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基、缬氨酸残基、谷氨酸残基、天冬氨酸残基、半胱氨酸残基、谷氨酸残基、组氨酸残基、异亮氨酸残基、亮氨酸残基、赖氨酸残基、甲硫氨酸残基、脯氨酸残基、丝氨酸残基、苏氨酸残基、色氨酸残基或酪氨酸残基;
[0012]
p和q各自独立地为2~4中任一整数;
[0013]
r1和r2各自独立地为c1~c6烷基或被1、2或3个r
1-a
取代的c1~c6烷基;
[0014]r1-a
各自独立地为r3r4n-或r5s(o)
2-;
[0015]
r3、r4和r5各自独立地为c1~c6烷基;
[0016]-l
2-为和中的一种或多种;
[0017]
其中,
[0018]
n为1~12中任一整数;
[0019]-l
2-的c端与所述的-l
1-的e端相连,-l
2-的f端与所述的l
3-的d端相连;
[0020]
l
3-为其中d端与所述的-l
2-的f端相连。
[0021]
在本发明一优选实施方案中,上述的连接基药物偶联物里,某些基团具有如下定
义,未提及的基团的定义如本发明中的任一方案所述(本段内容以下简称“在本发明一优选实施方案中”),
[0022]
所述细胞毒性药物为adc领域常规的细胞毒性药物,本发明特别优选为含羟基的拓扑异构酶抑制剂,进一步优选为含羟基的拓扑异构酶i抑制剂,更进一步优选为喜树碱类化合物,再进一步优选为
[0023]
在本发明一优选实施方案中,当所述的细胞毒性药物为含羟基的拓扑异构酶i抑制剂时,所述的-l
1-与所述的d中的羟基以醚键的形式连接,进一步优选更优选为
[0024]
以细胞毒性药物为为例,所述的-l
1-和细胞毒性药物连接后,保留在所述的连接基药物偶联物中的细胞毒性药物的片段优选为
[0025]
在本发明一优选实施方案中,当所述的r1和r2各自独立地为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,更进一步优选为甲基。
[0026]
在本发明一优选实施方案中,当所述的r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,更进一步优选为乙基。
[0027]
在本发明一优选实施方案中,当所述的r3和r4各自独立地为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,更进一步优选为甲基或乙基。
[0028]
在本发明一优选实施方案中,当所述的r5为c1~c6烷基时,所述的c1~c6烷基为c1~c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基,更进一步优选为甲基。
[0029]
在本发明一优选实施方案中,当所述的r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基时,所述的被1、2或3个r
1-a
取代的c1~c6烷基为或
[0030]
在本发明一优选实施方案中,当所述的-l
1-的结构为如式ii所示时,所述的-l
2-为或
[0031]
在本发明一优选实施方案中,所述的-(x)
p-为其氨基端和所述的式i中的羰基端相连。
[0032]
在本发明一优选实施方案中,所述的-(y)q-为为其氨基端和所述的式ii中的羰基端相连,优选
[0033]
在本发明一优选实施方案中,x各自独立地为缬氨酸残基或丙氨酸残基。
[0034]
在本发明一优选实施方案中,p为2。
[0035]
在本发明一优选实施方案中,所述的y各自独立地为甘氨酸残基或苯丙氨酸残基。
[0036]
在本发明一优选实施方案中,q为4。
[0037]
在本发明一优选实施方案中,所述的r1和r2各自独立地为1、2或3个r
1-a
取代的c1~c6烷基。
[0038]
在本发明一优选实施方案中,所述的r
1-a
为r5s(o)
2-。
[0039]
在本发明一优选实施方案中,所述的-l
2-为为优选
[0040]
在本发明一优选实施方案中,所述的n为6~9中任一整数。
[0041]
在本发明一优选实施方案中,-l
1-为为为
[0042]
在本发明一优选实施方案中,所述的-l
2-l
1-为
[0043]
[0044][0045]
在本发明一优选实施方案中,所述的-l
1-d为
[0046]
[0047][0048]
在本发明一优选实施方案中,所述的-l
2-l
1-d为
[0049]
[0050]
[0051][0052]
在本发明一优选实施方案中,d为
[0053]
x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基或缬氨酸残基;
[0054]-l
2-为为中的一种或多种。
[0055]
在本发明一优选实施方案中,d为
[0056]
x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基或缬氨酸残基;
[0057]
r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基;
[0058]-l
2-为为
[0059]
在本发明一优选实施方案中,d为
[0060]
x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基或缬氨酸残基;
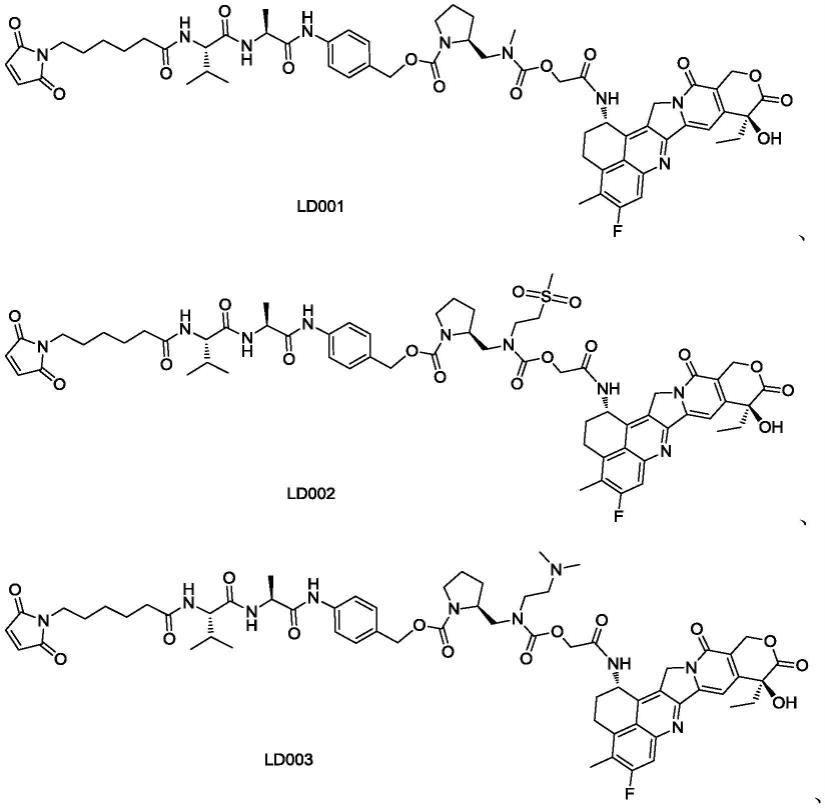
[0061]
r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基;
[0062]r1-a
为r5s(o)
2-;
[0063]-l
2-为为
[0064]
q为3或4。
[0065]
在本发明一优选实施方案中,d为
[0066]
x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基或缬氨酸残基;
[0067]
r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基;
[0068]r1-a
为r5s(o)
2-;
[0069]-l
2-为为
[0070]
q为2或4。
[0071]
在本发明一优选实施方案中,d为
[0072]
x和y各自独立地为苯丙氨酸残基、丙氨酸残基、甘氨酸残基或缬氨酸残基;
[0073]
r1和r2各自独立地为被1、2或3个r
1-a
取代的c1~c6烷基;
[0074]r1-a
为r5s(o)
2-;
[0075]-l
2-为
[0076]
q为4。
[0077]
在本发明一优选的实施方案中,所述的连接基药物偶联物为如下所示的任一化合物:
[0078]
[0079]
[0080][0081]
本发明还提供了一种如式iii所示的抗体偶联药物或其药学上可接受的盐:
[0082][0083]
其中,ab为抗体;
[0084]
m为2~8;
[0085]
d、-l
1-和-l
2-定义均同上任一实施方案所述。
[0086]
在本发明一优选实施方案中,所述的抗体为抗肿瘤的adc领域常规的抗体,本发明优选为抗her2抗体trastuzumab或其变体。所述的抗her2抗体trastuzumab中的轻链的氨基酸序列优选为如序列表中seq id no.1所示,重链的氨基酸序列优选为如序列表中seq id no.2所示。所述的抗her2抗体trastuzumab变体与所述的抗her2抗体trastuzumab序列相比
至少具有70%、75%、80%、85%、90%、95%、98%或99%以上的同源性。
[0087]
在本发明一优选实施方案中,所述的b端为和所述的抗体上巯基以硫醚键的形式相连。例如与所述的抗体中的半胱氨酸残基的连接形式为
[0088]
在本发明一优选实施方案中,所述的m为4~8,优选为7~8,更优选7、7.4、7.5、7.6、7.7、7.8、7.9或8,最优选7或8。
[0089]
在本发明一优选实施方案中,所述的如式iii所示的抗体偶联药物为如下所示的任一化合物:
[0090]
[0091]
[0092]
[0093][0094]
其中,m为7~8;ab为抗her2抗体trastuzumab,所述的抗her2抗体trastuzumab中的轻链的氨基酸序列为如序列表中seq id no.1所示,重链的氨基酸序列为如序列表中seq id no.2所示。
[0095]
在本发明一优选实施方案中,所述的如式iii所示的抗体偶联药物为如下任一化合物:
[0096]
[0097]
[0098][0099]
其中,ab为抗her2抗体trastuzumab,所述的抗her2抗体trastuzumab中的轻链的氨基酸序列为如序列表中seq id no.1所示,重链的氨基酸序列为如序列表中seq id no.2所示。
[0100]
本发明还提供了一种如式iv所示的化合物:
[0101]
[0102]
其中,r1的定义均同上任一方案所述。
[0103]
在本发明一优选实施方案中,所述的如式iv所示化合物为如下任一化合物:
[0104][0105]
本发明提供了一种所述的如式iii所示的抗体偶联药物或其药学上可接受的盐的制备方法,其包括将上述所述的连接基药物偶联物和上述所述的抗体偶联的步骤。
[0106]
本发明中,所述的偶联的条件和操作可为本领域该偶联常规的条件和操作。
[0107]
本发明还提供了一种药物组合物,其包括上述的如式iii所示的抗体偶联药物或其药学上可接受的盐、和、药用辅料。
[0108]
本发明还提供一种药物制剂,其包括上述的如式iii所示的抗体偶联药物、其药学上可接受的盐。
[0109]
在本发明一优选实施方案中,所述的药物制剂为注射剂。
[0110]
本发明还提供了一种物质m在制备用于预防或治疗癌症的药物中的应用;所述的物质m为上述的如式iii所示的抗体偶联药物、其药学上可接受的盐、上述的药物组合物或上述药物制剂在制备用于预防或治疗癌症的药物中的应用。
[0111]
在本发明一优选实施方案中,所述的癌症为胃癌、乳腺癌、非小细胞肺癌、尿路上皮癌或胰腺癌。
[0112]
本发明还提供了一种预防和/或治疗癌症的方法,其包括将受试者施用治疗有效量的上述的如式iii所示的抗体偶联药物、其药学上可接受的盐或上述的药物组合物。
[0113]
在本发明一优选实施方案中,所述的癌症优选为胃癌、乳腺癌、非小细胞肺癌、尿路上皮癌和胰腺癌中一种或多种,优选胃癌和/或乳腺癌。
[0114]
在本发明一优选实施方案中,所述的如式iii所示的抗体偶联药物、其药学上可接受的盐或所述的药物组合物的施用剂量可以根据受试者的体重来施用,优选2-5mg/kg(每次)。
[0115]
在本发明一优选实施方案中,所述的如式iii所示的抗体偶联药物、其药学上可接受的盐或所述的药物组合物的施用频率为每周1次。
[0116]
在本发明一优选实施方案中,所述的如式iii所示的抗体偶联药物、其药学上可接受的盐或所述的药物组合物的给药方式为静脉注射。
[0117]
除非另有说明,在本发明说明书和权利要求书中出现的以下术语具有下述含义:
[0118]
本发明中,m表示细胞毒性药物分子与ab的摩尔比(又称dar,即药物抗体偶联比率),优选地理解为是:单克隆抗体分子与细胞毒性药物偶联后得到的抗体偶联药物中的药物分子与单克隆抗体分子的摩尔比的平均值,一般可以采用疏水层析(hydrophobic-interaction chromatography,hic),聚丙烯酰胺-sds凝胶电泳(sds-page,electrophoresis),液相质谱(liquid chromatograph-mass spectrometer,lc-ms)等方式测定得到。比如,l-d是和抗体上的缀合点具反应性的基团,l是连接子,d是在连接l的抗体上进一步缀合的细胞毒剂,m表示的是每个抗体最终缀合d的数目,或者是单个抗体缀合d的数量。m可为整数或小数,在一些实施方式中,m实际上为介于2至8、4至8或6至8的平均值,或m为2、3、4、5、6、7或8中的某个整数;在一些实施方式中,m为2、4、6、或8的平均值;在其它实施方式中,m为2、3、4、5、6、7或8的平均值。
[0119]
术语“烷基”是指直连或支链饱和的烃基,例如c1~c4烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基。
[0120]
术语“抗体”在此取其最广义的解释,其可透过位于该免疫球蛋白分子的可变区的至少一个抗原辨认区特异性地与目标结合,诸如碳水化合物、多核苷酸、脂肪、多肽等。具体包括完整的单克隆抗体,多克隆抗体,双特异抗体以及抗体片段,只要他们具有所需的生物活性。本发明的抗体可利用该领域广为周知的技术制备,例如杂交瘤方法、重组dna技术、噬菌体展示技术、合成技术或该等技术的组合、或该领域己知的其它技术。
[0121]
术语“抗体的变体”指氨基酸序列突变体,以及天然多肽的共价衍生物,条件是保留了与天然多肽相当的生物活性。氨基酸序列突变体与天然氨基酸序列的差异一般在于天然氨基酸序列中的一个活多个氨基酸被取代或在多肽序列中缺失和/或插入一个或多个氨基酸。缺失突变体包括天然多肽的片段和n端和/或c端截短突变体。通常氨基酸序列突变体与天然序列相比至少具有70%(例如70%、75%、80%、85%、90%、95%、98%或99%)的同源性。
[0122]
单克隆抗体或单抗指的是该抗体来自一群基本均一抗体,即构成该集群的各抗体完全相同,除了可能存在的少量天然突变或在抗体表达制备过程中产生的异构体。单克隆抗体具有针对单一抗原的高度特异性。而多克隆抗体则包含了针对不同决定簇的不同抗体,每个单克隆抗体只针对抗原的一个决定簇。本发明中,单克隆抗体还特别包含嵌合抗体及其片段,即抗体的重链和/或轻链的一部分来自于某种、某类或某亚类,其余部分则与另一种、类或亚类。
[0123]
术语“连接子”是指抗体与药物间的直接或间接连接。将连接子连接至mab可经由许多方式完成,诸如经由表面赖氨酸、还原偶合至经氧化的碳水化合物、及经由还原链间二硫键所释放的半胱氨酸残基。多种adc连接系统是该领域所知,包括以腙、双硫及肽为基底的连接。
[0124]
术语“药用辅料”是指可为药物生产领域中广泛采用的辅料。辅料主要用于提供一个安全、稳定和功能性的药物组合物,还可以提供方法,使受试者接受给药后活性成分以所期望速率溶出,或促进受试者接受组合物给药后活性成分得到有效吸收。所述的药用辅料
可以是惰性填充剂,或者提供某种功能,例如稳定该组合物的整体ph值或防止组合物活性成分的降解。所述的药用辅料可包括下列辅料中的一种或多种:缓冲剂、螯合剂、防腐剂、助溶剂、稳定剂、赋形剂和表面活性剂着色剂、矫味剂和甜味剂。
[0125]
术语“药学上可接受的盐”是指本发明化合物与相对无毒的、药学上可接受的酸或碱制备得到的盐。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的碱与这类化合物的中性形式接触的方式获得碱加成盐。药学上可接受的碱加成盐包括但不限于:锂盐、钠盐、钾盐、钙盐、铝盐、镁盐、锌盐、铋盐、铵盐、二乙醇胺盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的药学上可接受的酸与这类化合物的中性形式接触的方式获得酸加成盐。所述的药学上可接受的酸包括无机酸,所述无机酸包括但不限于:盐酸、氢溴酸、氢碘酸、硝酸、碳酸、磷酸、亚磷酸、硫酸等。所述的药学上可接受的酸包括有机酸,所述有机酸包括但不限于:乙酸、丙酸、草酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、水杨酸、酒石酸、甲磺酸、异烟酸、酸式柠檬酸、油酸、单宁酸、泛酸、酒石酸氢、抗坏血酸、龙胆酸、富马酸、葡糖酸、糖酸、甲酸、乙磺酸、双羟萘酸(即4,4
’‑
亚甲基-双(3-羟基-2-萘甲酸))、氨基酸(例如谷氨酸、精氨酸)等。当本发明的化合物中含有相对酸性和相对碱性的官能团时,可以被转换成碱加成盐或酸加成盐。具体可参见berge et al.,"pharmaceutical salts",journal of pharmaceutical science 66:1-19(1977)、或、handbook of pharmaceutical salts:properties,selection,and use(p.heinrich stahl and camille g.wermuth,ed.,wiley-vch,2002)。
[0126]
术语“治疗”或它的同等表达当用于例如癌症时,指用来减少或消除患者体内癌细胞数目或减轻癌症的症状的程序或过程。癌症或另外的增生性障碍的“治疗”不一定指癌症细胞或其它障碍会实际上被消除,细胞或障碍的数目会实际上被减少或者癌症或其它障碍的症状会实际上被减轻。通常,即使只具有低的成功可能性也会进行治疗癌症的方法,但是考虑到患者的病史和估计的生存预期,其仍然被认为诱导总体有益的作用过程。
[0127]
术语“预防”是指获得或发生疾病或障碍的风险降低。
[0128]
一般而言,术语“取代的”表示所给结构中的1个或多个氢原子被具体取代基所取代。进一步地,当该基团被1个以上所述取代基取代时,所述取代基之间是相互独立,即,所述的1个以上的取代基可以是互不相同的,也可以是相同的。除非其他方面表明,一个取代基团可以在被取代基团的各个可取代的位置进行取代。当所给出的结构式中不只一个位置能被选自具体基团的一个或多个取代基所取代,那么取代基可以相同或不同地在各个位置取代。
[0129]
本发明中的取代基,若没有定义“被”某些取代基取代,均表示的该取代基是未取代的情况,例如“r1和r2各自独立地为c1~c6烷基、被1、2或3个r
1-a
取代的c1~c6烷基、c3~c
10
环烷基、c6~c
14
芳基或5~14元杂芳基”,其中的“c3~c
10
环烷基、c6~c
14
芳基和5~14元杂芳基”均理解为未被任何取代基取代。
[0130]
本领域技术人员可以理解,根据本领域中使用的惯例,本发明描述基团的结构式中所使用的是指,相应的基团通过该位点与化合物中的其它片段、基团进行连接。
[0131]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0132]
如无特殊说明,本发明中的室温是指20-30℃。本发明所用试剂和原料均市售可得。
[0133]
本发明的积极进步效果在于:
[0134]
1.本发明的连接基药物偶联可以和抗体偶联制备出具有很好靶向性的抗体偶联药物。
[0135]
2.本发明的抗体偶联药物具有很好的体外细胞活性和体内抗肿瘤活性。
[0136]
3.本发明的抗体偶联药物具有很好血浆稳定性和安全性。
具体实施方式
[0137]
表1.缩写词说明
[0138][0139][0140]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0141]
实施例1:连接基药物偶联物的合成
[0142]
实施例1-1:ld001的制备
[0143][0144]
化合物1的合成
[0145]
以l-脯氨酰胺为起始原料,按照文献(angew.chem.2020,132,4205
–
4210)报道的方法得到化合物1,esi-ms m/z:249.3(m+h)。
[0146]
化合物2的合成
[0147]
将2-羟基乙酸叔丁酯(2.5g,18.9mmol)与二(对硝基苯)碳酸酯(6.3g,20.8mmol)混合溶于200ml无水dmf中,加入25ml三乙胺,室温反应2小时。通过液质联用色谱监测原料反应完毕后,加入化合物1的三氟乙酸盐(3.4g,9.5mmol),继续反应1小时。反应完毕减压蒸馏去除大部分溶剂,然后加入150ml水,乙酸乙酯萃取三次(每次100ml),分液后合并有机相,饱和食盐水洗涤,无水硫酸钠干燥后并浓缩,所得粗品经过硅胶柱层析[二氯甲烷:乙酸乙酯=10:1(v/v)]纯化得到化合物2的叔丁酯(2.8g,收率81%),esi-ms m/z:363.5(m+h)。
[0148]
将化合物2的叔丁酯(2.5g,6.9mmol)溶于50ml二氯甲烷中,加入三氟乙酸4.5ml,室温反应0.5h。反应完毕,减压蒸馏去除溶剂,粗品经硅胶柱层析[二氯甲烷:甲醇=10:1(v/v)]纯化得到化合物2(1.6g,收率76%),esi-ms m/z:307.4(m+h)。
[0149]
化合物3的合成
[0150]
将化合物2(1.5g,4.9mmol)与市售的exatecan甲磺酸盐(2.8g,4.9mmol)混合于20ml无水dmf中,加入hatu(2.3g,6mmol),三乙胺1.2ml,室温反应2小时后,减压蒸馏去除大部分溶剂,然后加入50ml水,乙酸乙酯萃取三次(每次100ml),分液后合并有机相,饱和食盐
水洗涤,无水硫酸钠干燥后并浓缩。将所得粗品加入水和四氢呋喃的混合溶液(90ml,体积比为1:2)中,再加入乙酸(6ml)和10%pd/c(500mg)。所得混合物室温在h2(30psi)中搅拌4小时后,过滤除去pd/c,所得滤液减压蒸去大部分溶剂,然后加入饱和碳酸氢钠水溶液(50ml),乙酸乙酯萃取三次(每次100ml),分液后有机相合并后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,所得粗品经硅胶柱层析[二氯甲烷:甲醇=10:1(v/v)]纯化得到化合物3(2.0g,收率64%),esi-ms m/z:634.7(m+h)。
[0151]
化合物4的合成
[0152]
以市售的6-(n-马来酰亚胺基甲基)戊基-1-羧酸琥珀酰亚胺酯为起始原料,按照文献(int.j.mol.sci.2017,18,1860)报道的方法制备得到化合物4。
[0153]
ld001的合成
[0154]
向化合物3(95mg,0.15mmol)和4(148mg,0.22mmol)的dmf(5ml)溶液中加入hobt(20mg,0.15mmol)和dipea(55ul,0.30mmol),所得混合物室温下搅拌过夜后,加入水(15ml)后,用乙酸乙酯萃取三次(每次20ml),分液后有机相合并后用饱和食盐水洗涤,无水硫酸钠干燥后浓缩,所得粗品经硅胶柱层析[乙酸乙酯:石油醚=2:1(v/v)]纯化得到目标化合物ld001(120mg,收率70%),esi-ms m/z:1147.2(m+h)。
[0155]
实施例1-2:ld002的制备
[0156][0157]
化合物5的合成
[0158]
同样地,参照文献(angew.chem.2020,132,4205
–
4210)报道的方法,将倒数第2步的碘甲烷替换为1-溴-2-甲砜基乙烷,得到化合物5,esi-ms m/z:341.5(m+h)。
[0159]
化合物6的合成
[0160]
用化合物5替换化合物1为起始原料,参照化合物3的合成方法制备得到化合物6,esi-ms m/z:726.8(m+h)。
[0161]
ld002的合成
[0162]
参照连接基药物偶联物ld-001的合成方法,将化合物6和4偶联反应得到目标化合物ld002,esi-ms m/z:1239.4(m+h)。
[0163]
实施例1-3:ld003的制备
[0164][0165]
化合物7的合成
[0166]
同样地,参照文献(angew.chem.2020,132,4205
–
4210)报道的方法,将倒数第2步的碘甲烷替换为2-溴-n,n-二甲基乙基胺,得到化合物7,esi-ms m/z:306.4(m+h)。
[0167]
化合物8的合成
[0168]
用化合物7替换化合物1为起始原料,参照化合物3的合成方法制备得到化合物8,esi-ms m/z:691.8(m+h)。
[0169]
ld003的合成
[0170]
参照连接基药物偶联物ld-001的合成方法,将化合物8和4偶联反应得到目标化合物ld003,esi-ms m/z:1204.5(m+h)。
[0171]
实施例1-4:ld004-ld006的制备
[0172]
[0173][0174]
化合物9-11的合成
[0175]
以合适的马来酰亚胺为起始原料,参照化合物4的合成方法得到化合物9-11。化合物9-11及对应的起始原料结构见表2。
[0176]
表2.化合物9-11及相应的马来酰亚胺起始原料结构
[0177][0178]
ld004-ld006的合成
[0179]
参照化合物ld002的合成方法,将化合物6分别与化合物9、10和11缩合得到目标化合物ld004-ld006。ld004,esi-ms m/z:1241.3(m+h);ld005,esi-ms m/z:1265.4(m+h);ld006,esi-ms m/z:1319.4(m+h)。
[0180]
实施例1-5:ld007的制备
[0181][0182]
参照国际公开号为wo2020050406a1的专利申请第626至631页的方法,以市售化合物12(cas:13171-93-2)为起始原料合成化合物13,然后将化合物13和化合物6缩合得到目标化合物ld007,esi-ms m/z:1238.3(m+h)。
[0183]
实施例1-6:ld008的制备
[0184][0185]
参照化合物ld007的合成方法,将制备化合物13时所用的6-(n-马来酰亚胺基甲基)戊基-1-羧酸琥珀酰亚胺酯替换为市售的马来酰亚胺-八聚乙二醇-丙烯酸琥珀酰亚胺酯(cas:2055033-05-9),制备得到化合物14,再将化合物14与化合8缩合得到目标化合物ld008,esi-ms m/z:1203.3(m+h)。
[0186]
实施例1-7:ld009和ld010的制备
[0187][0188]
参照化合物ld007的合成方法,将制备化合物13时所用的替换氨基酸化合物12分别替换为市售的15和17,制备得到化合物16和18,再将化合物16和18分别与化合6缩合得到目标化合物ld009和ld010,ld009,esi-ms m/z:1181.3(m+h);ld010,esi-ms m/z:1124.2(m+h)。
[0189]
实施例1-8:ggfg-dxd的制备
[0190]
参照wo2015146132a1报道的已知的方法,制备得到ggfg-dxd,esi-ms m/z:1034.5(m+h)。
viability assay化学发光染色,读取荧光数据后计算ic
50
。从活性测试结果(见表4)看,所有的adc均表现出一定的抗肿瘤活性,部分adc活性超过fadc-8201。
[0198]
表4.不同adc的体外细胞毒活性
[0199][0200]
效果实施例2:体外血浆稳定性
[0201]
本实施例评价抗体偶联药物在人血浆中的稳定性。具体而言,在本实施例中,将实施例2的抗体偶联药物加入人血浆中,37℃水浴中放置1、3、7、14、21、28天加内标(依喜替康作为内标物质)并进行萃取然后通过高效液相色谱法检测游离药物的释放量,结果(如表5所示)表明本发明的抗体偶联药物具有很好的血浆稳定性,放置第1天的本发明的adc的血浆稳定性优于adc-8201;放置第3、7、14、21或者28天,本发明的部分adc的血浆稳定性优于adc-8201。
[0202]
表5.不同adc在人血浆中的稳定性评价
[0203]
[0204][0205]
效果实施例3:体内评估药效和安全评价
[0206]
6-8周大的雌性balb/c nude小鼠颈背部皮下注射溶于100ul pbs溶液的5
×
106人源胰腺癌细胞(capan-1)。待肿瘤平均体积约160mm3时,根据肿瘤大小随机分组,将所述裸鼠36只随机分成6组,每组6只动物,分组尾静脉注射给药:01为空白对照组,02为fadc-ld002(5mg/kg),03为fadc-ld002(2mg/kg),04为fadc-ld007(5mg/kg),05为fadc-ld007(2mg/kg),06为adc-8201(5mg/kg),每周给药1次。每周两次测量实验动物体重和肿瘤体积并观察实验过程中动物生存状态。实验结果(如表6所示)显示fadc
–
ld002和fadc-ld007具有较好的体内抗肿瘤活性,同时所有实验小鼠无死亡情况,无体重减轻情况,表明fadc
–
ld002和fadc-ld007具有很好的安全性。
[0207]
表6.adc体内药效评估实验结果
[0208][0209]
[0210]
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应当理解,这些仅是举例说明,在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改。因此,本发明的保护范围由所附权利要求书限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1