线粒体功能干预材料在制备改善线粒体功能的保健品或药品中的应用及其筛选方法与流程
1.本发明属于保健品或药品领域,具体涉及线粒体功能干预材料在制备改善线粒体功能的保健品或药品中的应用及其筛选方法。
背景技术:
2.线粒体是真核细胞的重要组成部分,一直以来线粒体都被认为是细胞内的能源工厂,负责为细胞提供必要能源,使其得以执行日常功能。而人体细胞所需的能量主要都是由线粒体提供的,值得注意的是但随着年龄的增长,线粒体功能每况愈下。然而越来越多的研究发现,线粒体不止"细胞能量站"的功能,它们参与了各种细胞功能调控,与许多人类疾病存在着莫大的联系,包括细胞信号传导、代谢、自噬、衰老和肿瘤发生都与线粒体的质量和活性相关。因此如何提升线粒体的功能和健康,被越来越多的研究人员所关注。
3.另外,尽管目前市面上存在大量宣称针对线粒体的营养补剂,但其中大多数补剂存在具体功效不明确,效果过分夸大,作用机制不清等问题。目前关于线粒体功能检测的相关技术种类繁多,且手段各异,较为通用的方法有相关基因蛋白检测技术,seahorse线粒体代谢能力检测技术,透射扫描电镜观测技术以及相关代谢产物鉴定技术。但关于线粒体相关营养补剂的功能测定存在检测指标不统一,检测技术落后,检测手段单一以及检测不全面等问题。这些问题造成了市面上相关产品品质参差不齐,真假产品鱼龙混杂的现象。
技术实现要素:
4.为解决上述技术问题,本发明的首要目的在于提供线粒体功能干预材料在制备改善线粒体功能的保健品或药品中的应用。
5.本发明的另一目的在于提供一种线粒体功能干预材料的筛选方法,相比较于现有的评价筛选体系,本发明提供的筛选方法更为科学、精准、高效。
6.本发明是通过以下技术方案实现:本发明提供线粒体功能干预材料在制备改善线粒体功能的保健品或药品中的应用,所述线粒体功能干预材料为烟酰胺单核苷酸(nmn)、海参肽、西兰花种子水提物、枸杞提取物、槲皮素、橘皮苷或积雪草提取物中一种或几种的混合,优选为nmn或海参肽。
7.本发明采用棕榈酸(pa)构建线粒体损伤模型,研究发现nmn、海参肽、西兰花种子水提物、枸杞提取物、槲皮素、橘皮苷或积雪草提取物都能显著逆转由pa造成的酰基肉碱的积累,特别是中长链酰基肉碱的含量,且对基础耗氧量、atp 生成和最大耗氧量都有显著增加。pcr结果表明,nmn和海参肽处理后的c2c12细胞中,大部分线粒体相关基因发生显著变化,尤其是ppard、sirt3、opa1、hsp60和cpt1b,mrna表达呈现上百倍地升高。nmn和海参肽还能提高c2c12细胞中cytc-1的蛋白水平,呼吸链复合体i也有增加的趋势。nmn和海参肽能降低由pa造成ros过量以及mda过表达,并激活sod的表达,同时,nmn能显著增加nad+/nad的比例。由线粒体形态学分析图像显示,pa处理会导致部分线粒体发生肿胀,体积变大,内部的
嵴结构被破坏,使线粒体结构发生紊乱;而nmn和海参肽处理则能够逆转pa对线粒体的破坏,会使线粒体体积变小,数量变多,嵴结构恢复正常且清晰可见,线粒体形态趋于正常。
8.经上述研究表明,nmn、海参肽、西兰花种子水提物、枸杞提取物、槲皮素、橘皮苷或积雪草提取物能够显著改善线粒体功能。本发明将有效量的nmn、海参肽、西兰花种子水提物、枸杞提取物、槲皮素、橘皮苷或积雪草提取物作为活性成分加入药学上或保健食品学上可接受的载体,按照本领域常规方法制成药物、食品或营养补充剂等,用于治疗或预防与线粒体功能有关的病症。
9.本发明还提供了一种线粒体功能干预材料的筛选方法,包括如下步骤:(1)采用棕榈酸构建线粒体损伤模型;(2)通过 lc-ms/ms法测定酰基肉碱;(3)运用seahorse细胞外通量分析仪检测呼吸功能;(4)定量pcr检测线粒体dna含量;(5)实时定量pcr检测主要与线粒体相关基因的mrna水平的表达;(6)采用western blot法检测骨骼肌中线粒体相关基因与氧化磷酸化复合体蛋白质;(7)采用试剂盒检测mda含量及nad+/nadh含量;(8)采用透射电镜观察细胞线粒体的超微结构并进行形态学分析。
10.本发明通过采用棕榈酸(pa)构建粒体损伤模型,采用seahorse线粒体实时代谢分析技术,酰基肉碱检测技术为主体,结合免疫印迹试验,实时定量pcr实验,试剂盒检测以及电镜观测技术,建立了一套完整的线粒体功能干预材料的初步筛选及功能评价系统,筛选出了具有干预线粒体功能的材料。
11.作为本发明进一步优选的技术方案,所述步骤(1)采用棕榈酸构建线粒体损伤模型具体包括如下步骤:a、 细胞培养选用c2c12成肌细胞,放入生长培养基中进行培养;b、细胞传代待细胞融合率达到80-85%时吸出生长培养基,用pbs冲洗细胞,加入胰酶消化细胞,当50~70%的细胞变亮变圆时,吸弃胰酶,加入生长培养基终止胰酶消化,脱落已消化的细胞,形成细胞悬液,离心,吸弃上清液,加入生长培养基,按特定的传代比例传至加有生长培养基的培养皿中进行培养;c、细胞分化待细胞生长融合率达到75-80%时吸出生长培养基,加入分化培养基进行分化;d、原料处理将分化好的c2c12成肌细胞中的分化培养基吸干,并用pbs润洗,然后加入棕榈酸溶液以及原料,将加好原料的细胞置于细胞培养箱中培养,然后吸取细胞培养液存放于-80℃,备用。
12.优选的,所述生长培养基含有10%fbs(胎牛血清)和1% p/s(双抗,100u/ml的青霉素和100 μg/ml的链霉素)。
13.优选的,所述分化培养基含有2%hs(马血清)和1% p/s(双抗,100u/ml的青霉素和100 μg/ml的链霉素)。
14.优选的,所述细胞培养的条件为37℃,5%co2。
15.优选的,所述棕榈酸溶液的配置方法为:称取棕榈酸溶解于无水乙醇中,得到棕榈酸乙醇溶液;称取bsa溶解于pbs中,得到pbs溶液;将棕榈酸乙醇溶液加到pbs溶液中,配制成终浓度为5 mm的棕榈酸溶液。
16.大量研究结果表明,衰老的发展过程与线粒体功能异常有密切关系。在衰老过程中,线粒体生物学发生变化,线粒体产生自由基和自由基对线粒体的损伤对衰老的发展起到促进作用;线粒体 dna 突变和线粒体对细胞死亡进程的调控与衰老的进程有密切关系。
17.根据本发明筛选方法,研究得到nmn、海参肽、西兰花种子水提物、枸杞提取物、槲皮素、橘皮苷或积雪草提取物可显著改善线粒体功能,进而具有抗衰老作用,可应用于抗衰老食品、保健食品、药品等领域。
18.本发明与现有技术相比,具有如下有益效果:本发明提供了线粒体功能干预材料在制备改善线粒体功能的保健品或药品中的应用。结果表明,线粒体功能干预材料能显著改善酰基肉碱的积累,且对基础耗氧量、atp 生成和最大耗氧量等都有显著增加,可应用于保健食品、药品等领域。
19.本发明提供的线粒体功能干预材料的筛选方法,相比较于现有的评价筛选体系,本发明提供的评价筛选系统更为科学、精准、高效。首先本发明采用棕榈酸(pa)构建粒体损伤模型,相比较于h2o2,胰岛素和地塞米松的建模,具有稳定性高,效果明显且构建成功率高的特点,同时能有效模拟由肥胖和脂代谢异常所造成的线粒体损伤。本发明方法采用了seahorse实时代谢监控结合三重四级杆复合线性离子阱液质联用技术,精准快速且直观的对线粒体呼吸代谢状况,以及代谢产物进行了检测和分析。该系统结合wb,qpcr,mtdna检测技术,针对体系筛选出的干预物质进行进一步的分析,从基因及蛋白水平对其可能的作用机制进行了探究,并通过对ros含量、sod含量、mda含量与nad+/nadh含量与比例的检测和扫面电镜技术进一步探究功能性成分的具体作用机制。整个系统形成从快速筛选到具体作用机制探究的完整体系,并实现从表观现象,代谢产物分析再到具体通路探究的科学化筛选。相比较于传统的体外筛选系统以及动物筛选实验系统,本系统具有更高效,更科学的特点,为后期的动物和人群实验能够提供更科学和充分的数据支持,也大大节约了时间和资金成本。
附图说明
20.图1为棕榈酸(pa)刺激后c2c12 细胞中酰基肉碱的相对含量图。
21.图2为nmn处理后酰基肉碱的相对含量图。
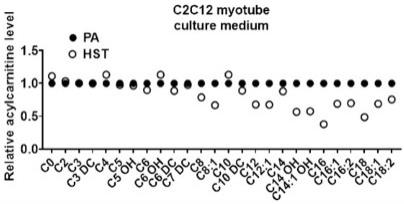
22.图3为海参肽(hst)处理后酰基肉碱的相对含量图。
23.图4为西兰花种子水提物处理后酰基肉碱的相对含量图。
24.图5为槲皮素处理后酰基肉碱的相对含量图。
25.图6为枸杞提取物处理后酰基肉碱的相对含量图。
26.图7为橘皮苷处理后酰基肉碱的相对含量图。
27.图8为nmn、海参肽(hst)组seahorse测定结果图。
28.图9为西兰花种子水提物、槲皮素、枸杞提取物组seahorse测定结果图。
29.图10为槲皮苷组seahorse测定结果图。
30.图11为mtdna测定结果图。
31.图12-14为实时定量pcr结果图。
32.图15为骨骼肌细胞增殖及氧化磷酸化复合体相关蛋白质western blot检测结果图。
33.图16为ros、sod、mda与nad+/nadh含量与比例检测结果图。
34.图17为线粒体形态学分析图像。
具体实施方式
35.下面通过具体实施方式来进一步说明本发明,以下实施例为本发明具体的实施方式,但本发明的实施方式并不受下述实施例的限制。
36.一、实验方法1、细胞培养细胞系选用c2c12细胞(小鼠成肌细胞);细胞生长培养液:dmem完全培养基含有10%fbs(胎牛血清),1% p/s(双抗,100u/ml的青霉素和100 μg/ml的链霉素);细胞分化培养液:dmem完全培养基含有2%hs(马血清),1% p/s;生长条件:37℃,5%co2。
37.2、细胞传代待细胞融合率达到80-85%时进行传代:(1)拿出培养箱中的细胞,在显微镜下观察是否需要传代,放入超净台随后吸弃培养皿中旧培液,并加入1-2 ml pbs冲洗细胞;(2)加1 ml胰酶消化细胞,同时轻微摇动培养皿使胰酶覆盖整个皿,用显微镜观察,当50-70%的细胞变亮变圆时,吸弃胰酶;(3)加2ml含有血清的dmem培液终止胰酶消化,用移液器吹打已消化的细胞从培养皿底脱落,形成细胞悬液;(4)将细胞悬液转移到15 ml离心管,700-1000 r/min,离心3 min;(5)吸弃上清液,加2-3 ml生长培养液,用移液器吹打混匀(在液面下吹打,幅度小,频率高);(6)1:5传代比例传至10 cm细胞培养皿(皿中预先加好8-9 ml的生长培养液)中进行培养;(7)盖上皿盖,按住皿的边缘,十字摇匀,程度适中(放显微镜下观察细胞分布是否均匀,不均匀会影响细胞生长状态)。
38.3、细胞分化c2c12成肌细胞进行后续实验,需要将其分化成肌管,细胞形态将成具有梭状结构的肌管;(1)细胞按照上述培养方法用6孔板进行培养,待细胞生长融合率接近80%时吸出含有10%fbs的生长培养基,改用含有2%hs的分化培养基,进行分化;(2)分化培基一般1到2天更换一次,分化时间根据细胞状态大约在3-4天左右便会形成较为明显的肌管。
39.4、原料处理(1)将烟酰胺单核苷酸(nmn)、海参肽(hst)、西兰花种子水提物、槲皮素、枸杞提取物、橘皮苷按照适宜的浓度进行配置,水溶性原料均用不含血清的培养基过夜溶解。而脂溶性原料均采用细胞级dmso进行溶解,且dmso在最终培养基中的浓度不得超过0.5%;(2)配置棕榈酸(pa)溶液:称取 pa 51.284 mg 溶解于1 ml的无水乙醇中,配制成浓度为 200 mm的溶液。称取 800 mg 的 bsa(不含脂肪酸)溶解于39 ml、0.01 m 的 pbs中。将1 ml200 mm的pa加到39 ml的pbs 中,配制成终浓度为5 mm的pa溶液,最后用0.22 μm的滤器过滤分装,-20 ℃保存备用。
40.(3)将分化4天后的c2c12细胞中的分化培养基吸干,并用2 ml pbs润洗,然后加入pa溶液以及之前配置好的原料。使pa的终浓度为1.6 mm。将加好原料的细胞置于细胞培养箱中培养24 h,然后吸取细胞培养液存放于-80℃用于酰基肉碱的测定。
41.5、酰基肉碱的测定酰基肉碱的测定采用 lc-ms/ms的方法。
42.将细胞培养液离心(10000 rpm, 15 min, 4℃)。然后取100
ꢀµ
l上清液于1.5 ml离心管中,于超纯氮气下吹干。然后加入100
ꢀµ
l的色谱级甲醇,并充分混匀然后离心(10000 rpm, 15 min, 4℃),吸取上清液待测。
43.将标准品按照500,1000,2000,4000,8000分别进行稀释,用于标准曲线的制作。
44.仪器为美国ab sciex公司的三重四级杆复合线性离子阱液质联用仪,型号:qtrap5500。色谱柱:kinetexc18 100
å
100*2.1mm, 2.6
µ
m。
45.确定目标测定物的离子对的信息,然后对样品进行测定。
46.流动相a:5mm乙酸铵水,b:乙腈,将数据带入标准曲线中计算浓度。
47.结果如图1所示,棕榈酸(pa)刺激会显著增加c2c12 细胞中部分酰基肉碱的释放,特别是如辛酰基肉碱(c8)、月桂酰肉碱(c12)、肉豆蔻酰肉碱(c14)以及棕榈酰肉碱(c16)等长链酰基肉碱的释放。肉碱是长链脂肪酸进入线粒体进行氧化供能的必要辅助因子,在此过程中肉碱与相应的脂肪酸在脂酰转移酶的作用下脱水酯化形成酰基肉碱。肉碱及酰基肉碱在细胞能量分布、脂肪酸在线粒体膜转运至代谢氧化部位的过程中均发挥重要作用。当线粒体受到损伤或线粒体过载时,则会导致长链酰基肉碱的累积。因此结果表明,pa构建的线粒体损伤模型是有效可行的。由图2-7所示,nmn、海参肽、西兰花种子水提物、槲皮素、枸杞提取物、橘皮苷都能显著逆转由pa造成的酰基肉碱的积累,特别是中长链酰基肉碱的含量。
48.6、seahorse测定mito stress test kit购置于seahorse biosciences。
49.配置检测培养基: 取100 ml xf base medium于洗净烘干的广口瓶中,加入 0.1g葡萄糖(d-glucose )以及1.1 ml 100 mm的丙酮酸钠(sodium pyruvate)。然后用1n 的naoh将ph调至 7.4,溶液过0.22
ꢀµ
m滤膜,保存至-4℃条件下备用。
50.实验前一天将c2c12细胞按照5000个/孔浓度接种到seahorse xf培养板中并加入生长培养基,待细胞贴壁后按照之前酰基肉碱实验中的浓度再加入pa以及原料刺激24h。pa以及原料均用无血清的dmem培养基配置。
51.将utility plate中加入seahorse xf校准1ml/孔,并至于无co2培养箱中过夜水化探针。
52.实验当天将刺激后的细胞培养板中的培养基吸干,加入525
ꢀµ
l的检测培养基,检测培养基需在37℃水浴锅中提前预热,然后讲细胞板放入37℃无co2培养箱中培养1 h。
53.分别配置好药物寡霉素a(oligomycin),碳酰氰-4-三氟甲氧基苯腙(fccp)以及鱼藤酮/抗霉素a(rotenone/antimycin a)加入测试板中,且依次加入a、b、c三个药物孔,每孔中三种药物的加入量均为75
ꢀµ
l,且三种药物在溶液中的终浓度分别为1
ꢀµ
m, 0.5
ꢀµ
m以及0.5
ꢀµ
m。
54.细胞板中共24个孔,其中a1 b4 c3 d6这四个孔为对照孔,不加入细胞。每次实验都设定pa组作为对照,用以最后数据的归一化。
55.将加原料后的测试板以及过夜水化后的utility plate仪器放置到仪器托板上,然后运行程序,约30分钟后换上细胞板。
56.结果如图8-10所示,nmn、海参肽、西兰花种子水提物、槲皮素、枸杞提取物、橘皮苷组相比较于pa组对线粒体功能ocr 曲线有明显提升作用,并且对基础耗氧量、atp 生成和最大耗氧量都有显著增加。
57.7. mtdna测定c2c12小鼠骨骼肌细胞培养分化4天后,根据所筛选出的受试物进行刺激处理,处理24小时后利用试剂盒分别提取肌肉细胞以及线粒体中dna,并合成所需测定的引物。线粒体dna含量的定量pcr检测:按以下组成配制pcr反应液。
58.dna模板0.5 μl;2x master mix 10 μl;灭菌蒸馏水8.5 μl;pcr正向和反向引物 共1 μl;total 20 μl/sample;进行pcr反应测定,反应后样品保存于4 ℃。每个样本均设置3个复孔,所有实验均重复6次。利用定量pcr得出拷贝数,计算细胞内线粒体dna含量相对值(线粒体dna/基因组dna)。结果如图11所示,pa会显著降低线粒体mtdna,这进一步证明pa会破坏线粒体dna,导致线粒体功能下降,而nmn和海参肽能够显著逆转这一情况。
59.8. 实时定量pcrc2c12小鼠骨骼肌细胞培养分化4天后,根据所筛选出的受试物进行刺激处理,处理24小时后,trizol收取细胞,并提取rna,反转录制备cdna后。照以下配制 pcr 反应体系:常规qpcr组成成分 10 μl体系;2 x powerup sybr green master mix(abi) 5μl;正向引物和反向引物 共0.6μl;cdna模板和ddh2o 4.4μl;总体积 10μl;检测27个主要与线粒体相关基因的mrna水平的表达,基因具体名录如下:
clpp、hsp60、ppard、cytc-1、cox1、mtatp8、mtcox2、sdha、sod1、sod2、pgc1a、sirt1、nrf1、nrf2、fis1、acox1、acadl、pgc1b、cpt1b、opa1、tfam、mfn1、mfn2、ndufs1、ucp2、atp5g1、cox4、36b4、b2m、erra、drp1。
60.如图12-14所示,与无血清dmem空白组相比,pa处理会在一定程度上影响c2c12细胞中线粒体相关基因的表达,但倍数变化均在5倍以内;nmn和海参肽处理后,大部分线粒体相关基因发生显著变化,尤其是ppard、sirt3、opa1、hsp60和cpt1b,mrna表达呈现上百倍地升高。
61.9. 骨骼肌中线粒体相关基因与氧化磷酸化复合体蛋白质western blot检测c2c12小鼠骨骼肌细胞培养分化4天后,根据所筛选出的受试物进行刺激处理,处理24小时后,用ripa裂解液收取细胞制作蛋白样,随后利用sds-page进行免疫印迹实验检测氧化磷酸化复合体(oxphos)、线粒体转录因子(mtfa)及细胞色素c,线粒体融合蛋白1(opa1), 动力相关蛋白 1 (drp1)等线粒体关键基因的蛋白质水平表达。
62.如图15所示,pa刺激会显著降低细胞cytc-1的蛋白表达水平,而nmn和海参肽处理提高了c2c12细胞中cytc-1的蛋白水平,呼吸链复合体i也有增加的趋势。
63.10. ros含量、sod含量、mda含量与nad+/nadh含量与比例检测c2c12小鼠骨骼肌细胞培养分化4天后,根据所筛选出的受试物进行刺激处理,处理24小时后,弃去培养液,向细胞中加入冷的磷酸盐缓冲液(pbs),利用细胞刮刀收取细胞,随后利用相关试剂盒进行裂解分析,最后读取相应吸光值,以细胞总蛋白质浓度为基准计算ros、sod、mda及nad+/nad相对含量。
64.如图16所示,nmn和海参肽都能降低由pa造成ros过量以及mda过表达,并激活sod的表达,同时,nmn能显著增加nad+/nad的比例。
65.11.线粒体形态学分析(透射电镜)c2c12小鼠骨骼肌细胞培养分化4天后,根据所筛选出的受试物进行刺激处理,处理24小时后,吸弃培养液,向细胞中加入冷的磷酸缓冲液(pbs),利用细胞刮刀收取细胞,随后700rpm 4℃离心5分钟获得细胞沉淀,加入新配制预冷25ml/l戊二醛固定细胞,1%(质量分数) oso4再固定,按常规方法乙醇梯度脱水、丙酮、环氧丙烷处理后,用环氧树脂812包埋,显微镜下定位取细胞集落较多的部位修块,参照pet聚酯薄膜校正平面,平行纵向超薄切片(70nm),醋酸双氧铀和柠檬酸铅染色,在80kv条件下,jem-1400透射电镜 (日本电子株式会社,日本)观察细胞线粒体的超微结构并照相。
66.线粒体形态学分析图像显示,如图17所示,pa处理会导致部分线粒体发生肿胀,体积变大,内部的嵴结构被破坏,使线粒体结构发生紊乱;而nmn和海参肽处理则能够逆转pa对线粒体的破坏,会使线粒体体积变小,数量变多,嵴结构恢复正常且清晰可见,线粒体形态趋于正常。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1