一种治疗丙肝的复方制剂及其制备方法与流程
本发明涉及药物
技术领域:
,具体涉及一种治疗丙肝的复方制剂及其制备方法。
背景技术:
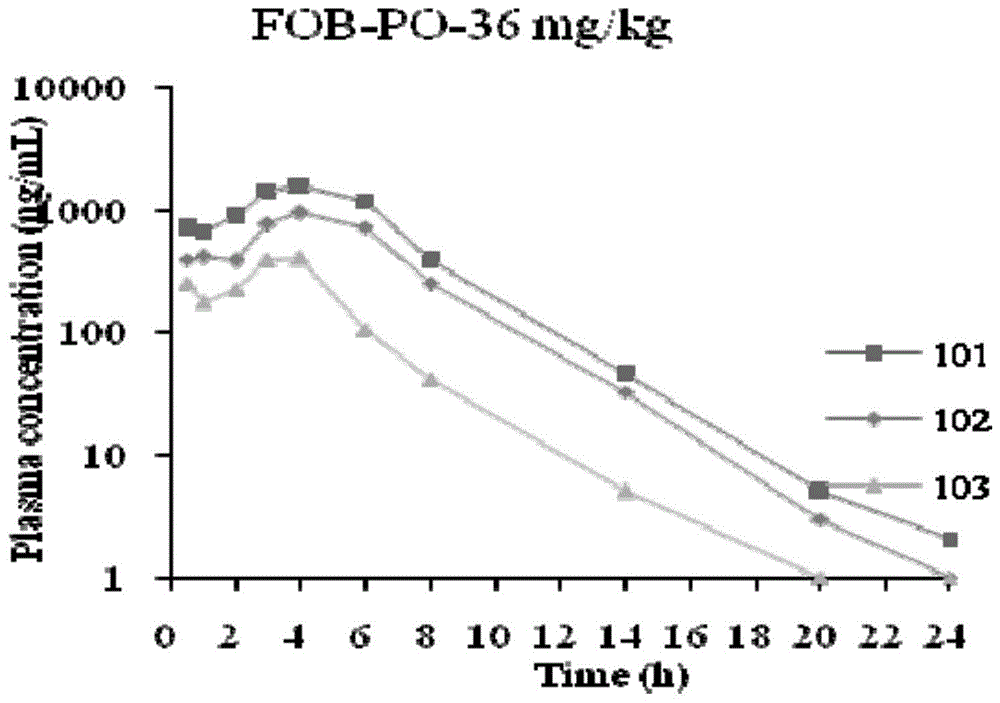
:丙型肝炎主要经输血、针刺和吸毒等传播,是由丙型肝炎病毒(hcv)感染引起的病毒性肝炎。hcv是主要的人类病原体,其在世界范围内感染约一亿七千万人,这大致是1型人类免疫缺陷病毒感染数量的5倍。一旦感染,大约20%的人员可以清除病毒,但其余人员在其余生中都携带hcv。10~20%的长期感染个体最后发展成损害肝脏的肝硬化或癌,对患者的健康和生命危害极大。目前治疗丙肝的药物主要为含有干扰素a的药物,这类药物在使用后的副作用较为严重,严重影响了患者的日常生活,因此,研发一种副作用小的药物显得尤为重要。技术实现要素:针对现有技术中的上述不足,本发明提供了一种治疗丙型肝炎的复方制剂及其制备方法,该制剂可有效解决现有的制剂存在的副作用大,治疗效果差的问题。为实现上述目的,本发明解决其技术问题所采用的技术方案是:一种治疗丙肝的复方制剂,包括以下组分sofosbuvir和fopitasvir,所述sofosbuvir和fopitasvir的质量比为6-7:0.5-1。进一步地,sofosbuvir的结构式为:进一步地,fopitasvir的结构式为:进一步地,还包括以下重量份的辅料:乳糖10-30份、微晶纤维素30-50份、交联羧甲基纤维素钠20-30份、聚维酮30-40份和硬脂酸镁5-10份,所述乳糖与所述sofosbuvir的质量比为0.25-0.75:1。进一步地,复方制剂的剂型为片剂。上述治疗丙肝的复方制剂的制备方法,包括以下步骤:(1)将fopitasvir和乳糖混合后进行超微粉碎,得混合粉;(2)将步骤(1)中的混合粉与sofosbuvir、微晶纤维素、交联羧甲基纤维素钠混匀,得混合物料;(3)将聚维酮溶解制得质量浓度为3-10%的聚维酮溶液,然后将其加入步骤(2)的混合物料中制软材,然后制粒并干燥、整粒;(4)向步骤(3)中的整粒后的颗粒中加入硬脂酸镁,总混后进行压片,制得。进一步地,步骤(1)中进行超微粉碎后的物料粒径≤25nm。进一步地,步骤(3)中的干燥温度为45-65℃。进一步地,步骤(3)中干燥温度为50℃。上述方案中,干燥温度过高,会造成有效成分损失。进一步地,步骤(3)中整粒所用的筛网目数为20目。本发明所产生的有益效果为:本发明中的制剂为二联复方制剂,其中sofosbuvir属于ns5b蛋白酶抑制剂,fopitasvir属于ns5a蛋白酶抑制剂,将两者合用,可从根源上治疗丙肝,其对丙肝的治愈率高达90%,具有极好的持续性病毒应答。且两者的副作用较小,可解决干扰素a带来的副作用大的问题。附图说明图1为单次灌胃口服给予fopitasvir后sd大鼠血浆中药物浓度图;图2为单次灌胃口服给予fopitasvir后sd大鼠血浆中药物浓度图均值图;图3为单次灌胃口服给予sofosbuvir后sd大鼠血浆中药物浓度图;图4为单次灌胃口服给予sofosbuvir后sd大鼠血浆中药物浓度图均值图;图5为单次灌胃口服给予实施例2中的复方制剂后sd大鼠血浆中fopitasvir药物浓度图;图6为单次灌胃口服给予实施例2中的复方制剂后sd大鼠血浆中fopitasvir药物浓度均值图;图7为单次灌胃口服给予实施例2中的复方制剂后sd大鼠血浆中psi-6206浓度图;图8为单次灌胃口服给予实施例2中的复方制剂后sd大鼠血浆中psi-6206浓度均值图;图9为单方和复方中fopitasvir均值对比图;图10为单方和复方中sofosbuvir均值对比图;图11为连续治疗9天后对丙型肝炎病毒复制子的抑制情况图。具体实施方式下面结合附图对本发明的具体实施方式做详细的说明。实施例1一种治疗丙肝的复方制剂,每1000片中包括sofosbuvir4kg,fopitasvir0.6kg,乳糖1kg,微晶纤维素0.44kg,交联羧甲基纤维素钠0.26kg,聚维酮0.33kg,硬脂酸镁0.07kg。上述治疗丙肝的复方制剂的制备方法如下:(1)将fopitasvir和乳糖混合后进行超微粉碎,控制粒径d90≤25nm,得混合有效成分,备用;(2)称取计算量的共微粉物和乳糖、配方量的sofosbuvir、微晶纤维素、交联羧甲基纤维素钠,聚维酮混合并搅拌均匀,得到混合物料,备用;(3)取适量的注射用水加入到步骤(2)所得混合物料中,加入适量的注射用水制软材,并将湿颗粒再55℃条件下烘干,整粒;(4)将硬脂酸镁加入步骤(3)整粒后的物料中,进行总混,压片,即得。实施例2一种治疗丙肝的复方制剂,每1000片中包括sofosbuvir4kg,fopitasvir0.5kg,乳糖1kg,微晶纤维素0.44kg,交联羧甲基纤维素钠0.26kg,聚维酮0.33kg,硬脂酸镁0.07kg。上述治疗丙肝的复方制剂的制备方法如下:(1)将fopitasvir和乳糖混合后进行超微粉碎,控制粒径d90≤25nm,得混合有效成分,备用;(2)称取计算量的共微粉物和乳糖、配方量的sofosbuvir、微晶纤维素、交联羧甲基纤维素钠混合并搅拌均匀,得到混合物料,备用;(3)将聚维酮溶于注射用水中,制成质量浓度为为5%的聚维酮溶液,然后将其加入步骤(2)的混合物料中,制软材,制粒并对颗粒进行干燥,然后过20目筛进行整粒;(4)将硬脂酸镁加入步骤(3)整粒后的物料中,进行总混,压片,即得。对比例1一种治疗丙肝的复方制剂,每1000片中包括sofosbuvir4kg乳糖1kg,微晶纤维素0.44kg,交联羧甲基纤维素钠0.26kg,聚维酮0.33kg,硬脂酸镁0.07kg。上述治疗丙肝的复方制剂的制备方法如下:(1)称取配方量的sofosbuvir、微晶纤维素、交联羧甲基纤维素钠,聚维酮混合并搅拌均匀,得到混合物料,备用;(2)取适量的注射用水加入到步骤(2)所得混合物料中,加入适量的注射用水制软材,并将湿颗粒再55℃条件下烘干,整粒;(3)将硬脂酸镁加入步骤(2)整粒后的物料中,进行总混,压片,即得。对比例2一种治疗丙肝的复方制剂,每1000片中包括fopitasvir0.6kg,乳糖1kg,微晶纤维素0.44kg,交联羧甲基纤维素钠0.26kg,聚维酮0.33kg,硬脂酸镁0.07kg。上述治疗丙肝的复方制剂的制备方法如下:(1)将fopitasvir和乳糖混合后进行超微粉碎,控制粒径d90≤25nm,得混合有效成分,备用;(2)称取计算量的共微粉物和乳糖微晶纤维素、交联羧甲基纤维素钠,聚维酮混合并搅拌均匀,得到混合物料,备用;(3)取适量的注射用水加入到步骤(2)所得混合物料中,加入适量的注射用水制软材,并将湿颗粒再55℃条件下烘干,整粒;(4)将硬脂酸镁加入步骤(3)整粒后的物料中,进行总混,压片,即得。试验例一、药代实验取9只sd大鼠(雄性、220-250g)由上海sipprbk实验动物有限公司动物中心提供,在标准实验室条件下将大鼠随机分为3组:fopitasvir片组、sofosbuvir片组和实施例2中制剂组,fopitasvir片服用剂量为5.4mg/kg,sofosbuvir片服用剂量为36mg/kg,实施例2中制剂服用剂量相当于fopitasvir5.4mg/kg,sofosbuvir36mg/kg,给药前将样品研磨成分散在蒸馏水中的粉末,于灌胃后0.2、1、2、3、4、5、6、7、8、14、20、24小时从大鼠颈静脉采集血样(0.2ml),加入肝素钠提前处理的试管中,样品在6800rpm下立即离心6分钟,分离的血浆储存于-80℃条件下进行分析,具体分析结果见表1-8和图1-10。表1:单次灌胃口服给予fopitasvir后sd大鼠血浆中药物浓度time(h)编号101编号102编号103meansd0.5708.283386.567254.444449.76233.431669.746412.535172.427418.24248.712882.500384.079224.561497.05343.2131450.640773.747388.638871.01537.6441579.290947.133397.310974.58591.4751204.670730.592106.702680.65550.686381.975255.57341.236226.26172.25745.47932.5615.00127.6820.6884.9972.962blq3.981.44142.072blqblqnana20708.283386.567254.444449.76233.4324669.746412.535172.427418.24248.71表2:单次灌胃口服给予sofosbuvir后sd大鼠血浆中代谢物psi-6206药物浓度time(h)编号201编号202编号203meansd0.5314.227297.742325.792312.5914.101473.994483.549566.827508.1251.062765.188855.900956.128859.0795.513779.2481023.7801109.700970.91171.454785.044764.601969.244839.63112.715359.694355.959461.351392.3359.806176.977179.539159.507172.0110.90727.23124.48938.67030.137.5287.14624.46110.80814.149.13143.1796.9026.0065.361.9420314.227297.742325.792312.5914.1024473.994483.549566.827508.1251.06表3:单次灌胃口服给予实施例2中药物后sd大鼠血浆中fopitasvir药物浓度time(h)编号301编号302编号303meansd0.5479.003558.254653.467563.5787.351395.766392.747764.187517.57213.582844.554489.319517.601617.16197.4431192.920948.227963.3211034.82137.1241093.7301391.7201313.6701266.37154.525585.692442.148304.514444.12140.606233.968209.465125.096189.5157.11732.77714.6408.44418.6212.6584.033blqblqnana14blqblqblqnana20479.003558.254653.467563.5787.3524395.766392.747764.187517.57213.58表4:单次灌胃口服给予实施例2中药物后sd大鼠血浆中代谢物psi-6206药物浓度time(h)编号201编号202编号203meansd0.5530.611359.081509.643466.493.61715.727557.964721.893665.1992.922970.569789.9241024.920928.47123.023985.4051028.480995.8861003.2622.464956.155844.282855.970885.4761.495463.512461.183371.459432.0552.496221.725221.279200.736214.5811.99771.15143.99952.54455.9013.88822.48211.17810.08714.586.861412.9026.9847.1309.013.3820530.611359.081509.643466.493.624715.727557.964721.893665.1992.92表5:单方fopitasvir参数表表6:单方sofosbuvir参数表表7:实施例2药物中fopitasvir参数表表8:实施例2药物中psi-6206参数表通过表1-8中的数据可以发现,所有大鼠耐受性良好,无异常表现,说明本申请中的复合制剂具有良好的安全性,与单方的药代动力学数据进行比较可以发现,单方组分的药代动力学表现出非劣效性。单方药物和申请中的复方药物在auc0last,cmax,t1/2,tmax的药代动力学特征的相似性意味着fopitasvir和sofosbuvir在复方中的吸收、分布、代谢和排泄相互之间不存在干扰。这一结果一定程度上说明fopitasvir和sofosbuvir之间发生相互作用的概率较低,说明本发明中的复方制剂具有与单方制剂相同的安全性。二、体外药效实验用单方fopitasvir、单方sofosbuvi和本申请中实施例2中的复方制剂处理丙型肝炎病毒gt1b复制子稳转细转9天。细胞每3天传代一次,用含有相应浓度化合物的新鲜培养基替换培养基。收集细胞进行细胞rna提取,然后用于确定化合物对丙型肝炎病毒复制子的抑制活性的考察,用qrt-pcr技术检测丙型肝炎病毒复制子rna水平。上述过程重复3次,以均值作为最终值,具体结果图11。通过图11可以明显看出,实施例2中的复方制剂对于复制子的抑制作用更明显,可以证明实施例2中的复方制剂对于丙型肝炎的治疗作用更强,治疗效果更好。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1