孕激素制剂及其用途的制作方法
1.本发明涉及孕激素制剂及其用途,具体涉及17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和双组分溶剂体系的组合物以及包含该组合物的软明胶胶囊、试剂盒及其用途,属于医药技术领域。
背景技术:
2.目前市场上可获得的孕激素制剂多为针剂,然而针剂存在一些缺点,例如注射时疼痛等。因此,有必要开发新的剂型。
3.为此,本技术的发明人在全球范围内首次创造了己酸羟孕酮口服剂。口服剂的优势在于使用方便,没有针剂使用的痛苦,患者接受度高。为此,本发明提供了新型口服剂及其用途。
技术实现要素:
4.在一些具体实施方案中,公开了含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的组合物。在一些实施方案中,该组合物包含一系列17
‑
α
‑
羟基孕酮乙酸盐(17
‑
hpc)和双组份溶剂系统。在某些实例中,双组份溶剂系统包含一系列增溶剂和一系列亲油性辅料。
5.在一些具体实施方案中,还公开了含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的溶液。在一些实施方案中,该溶液包含约120mg/ml~360mg/ml的17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和双组分溶剂系统,其包含可选的增溶剂和亲油性辅料。
6.在一些具体实施方案中,额外公开了含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的软明胶胶囊剂。在一些实施方案中,该软胶囊包扩含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和双组份溶剂系统的液体填充物;以及用于封装液体填充物的胶囊壳。
7.在一些具体实施方案中,还公开了包含17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和溶剂体系的组合物。在一些实施方案中,所述溶剂选自山梨醇、木糖醇、甘露醇、聚乙二醇蓖麻油酸酯、蓖麻油、聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。
8.在一些具体实施方案中,更进一步的公开了包括使用含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的组合物、溶液、软明胶胶囊其中的一种或多种的给药方案以及使用包含上述含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的组合物、溶液、软明胶胶囊的试剂盒的方法。在一些实施方案中,该方法包括向受试者提供含有17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的组合物、溶液、软明胶胶囊来治疗疾病或健康状况。在一些实施例中,该方法包括降低有需要的受试者中升高的il
‑
17、il
‑
2或il
‑
4表达或p38丝裂原活化蛋白激酶活性,包括向受试者施用含有17
‑
hpc的组合物、溶液或软明胶胶囊。在一些实施例中,该方法包含治疗被选中用该方法治疗的患者,包括:(a)检测受试者获得的样本中il
‑
17水平的升高;及(b)给予相对于il
‑
17水平处于预期的患者来说拥有il
‑
17水平升高的患者上述的组合物、溶液或软明胶胶囊。在一些实施方案中,给药方案包括在每个周期的第一天第一剂量给予有需要的受试者约120mg~720mg的17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)。
附图说明
9.本发明的创新特色将在附加声明中准确阐述。通过参考一下详细描述,读者将获得对本发明的特征和优点更好的理解,该描述中阐述利用了本发明原理的说明性实例以及其附图:
10.图1说明了含有17
‑
hpc的组合物、溶液或软明胶胶囊的制造工艺的示例性流程图。
11.图2说明了狗肌肉注射250mg后的pr2005浓度
‑
时间曲线。
12.图3说明了狗口服250mg(胶囊粉)后的pr2005浓度
‑
时间曲线。
13.图4说明了狗口服250mg(悬浮液#1)后的pr2005浓度
‑
时间曲线。
14.图5说明了狗口服250mg(溶液#3)后的pr2005浓度
‑
时间曲线。
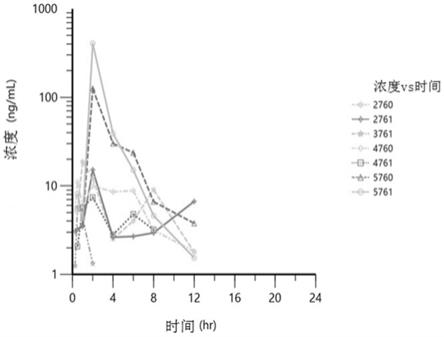
15.图6说明了狗口服750mg(溶液#3)后的pr2005浓度
‑
时间曲线。
16.图7说明了狗口服250mg(溶液#5)后的pr2005浓度
‑
时间曲线。
具体实施方式
17.定义
18.如规范和声明中使用的,单数形式"a","an"和"the"包括复数引用,除非上下文另有明确规定。例如,"细胞"一词包括多个细胞,包括其混合物。
19.如本文所用,术语“包括”意欲表达的意思是所述组合物或方法包括所述步骤或元素,但不排除其它步骤或元素。“基本上包含”是指使声明仅在包括步骤或元素时有效,这些步骤或元素不会实质性地影响声明的组合物和方法本身及其新颖特性。“包含”意思是排除声明中未提及的任何元素或步骤。由这些过渡术语所定义的实施例均处于本公开声明的范围内。
20.如本文所用,术语“关于”用于指示值,包括用于确定装置的标准差或用于确定值的方法。当在数字名称之前使用术语“大约”,例如温度、时间、数量和浓度(包括范围),表示近似值,其变化范围为(+)或(
–
)15%、10%、5%、3%、2%或1%。
21.如本文所用,术语“哺乳动物”包括人类和非人类哺乳动物。
22.术语“主体”、“宿主”、“个体”和“患者”在本文中可替换地用于指代动物,通常是哺乳动物动物。任何合适的哺乳动物都可以通过本文所述的方法、细胞或组合物来处理。哺乳动物的非限制性示例包括人类、非人灵长类动物(例如猿、长臂猿、黑猩猩、猩猩、猴子、猕猴等)、家畜(例如狗和猫)、耕畜(例如马、牛、山羊、绵羊、猪)和实验动物(例如,老鼠、老鼠、兔子、豚鼠)。在一些实施例中,哺乳动物是人类。哺乳动物可以是任何年龄或任何发育阶段(例如,成人、青少年、儿童、婴儿或子宫内的哺乳动物)。哺乳动物可以是雄性也可以是雌性。哺乳动物可以是怀孕的雌性。在一些实施例中,主体是人。
23.如本文所用,在年龄相当于18岁或以上的人类受试者的情况下,术语“年龄相等”是指非人类受试者,例如,非人类灵长类、家畜、耕畜,或者实验动物,其受试者的年龄等于或相当于18岁或以上的人类的年龄。
24.如本文所用,在年龄相当于17岁或以下的人类受试者的情况下,术语“年龄相等”是指非人类受试者,例如,非人灵长类动物、家畜、耕畜,或实验动物,其受试者的年龄等与或相当于17岁或以下的人类的年龄。
25.如本文所用,“处理”或“治疗”受试者的疾病指的是(1)防止症状或疾病发生在易
感或尚未出现疾病症状的个体中;(2)抑制疾病或阻止其发展;(3)改善疾病或使疾病(或疾病引起的症状)消退。如本领域中所理解的,“治疗”是一种用于获得有益的或期望的结果,包括临床结果的方法。就本技术而言,有益的或期望的结果可以包括一个或多个,但不限于,减轻或改善一个或多个症状、减轻病情(包括疾病)程度、稳定(即不恶化)病况(包括疾病),延迟或减缓病情(包括疾病)的进展、改善或减轻病症(包括疾病)、稳定和缓解(无论是部分或全部),无论是可检测的还是不可检测的。另一方面,“治疗”一词不包括预防。
[0026]“孕激素”一词是指孕激素,一种自然产生的激素,和孕酮,合成孕酮或孕酮类似物。孕酮或合成孕酮包括羟孕酮酯,如羟孕酮己酸酯(或17α
‑
羟基己酸孕酮)、醋酸羟孕酮或羟孕酮庚酸酯。
[0027]
17
‑
α
‑
羟基孕酮己酸酯(17
‑
ohpc或17
‑
hpc)或17
‑
[(1
‑
氧代己基)氧基]
‑
孕
‑4‑
烯
‑
3,20
‑
二酮,
[0028]
是一种合成孕激素,从17
‑
α
‑
羟基孕酮(17
‑
opc)和己酸中提取。17
‑
hpc的化学结构如下所示(分子量:428.6g/mol,熔点:119℃)。
[0029][0030]
如本文所用,术语“增溶剂”是提高药物在溶液中的溶解度的辅料。在一些实施例中,增溶剂包括表面活性剂,一种降低两种液体之间表面张力的化合物。在某些情况下,增溶剂包括非水溶性增溶剂。示例性增溶剂包括但不限于苯甲酸苄酯(cas号120
‑
51
‑
4)、二甘醇单乙醚、丙二醇单月桂酸酯、单己二酸甘油酯或油酸。在某些情况下,增溶剂溶解17
‑
hpc,其溶解度有约75mg/g、约150mg/g或约300mg/g。
[0031]
如本文所用,术语“亲脂剂”和“亲脂辅料”是可互换的,是指包括脂肪酸、蜡、甾醇、单甘油脂、甘油三酯、甘油三酯或磷脂的辅料。示例性亲油剂包括但不限于蓖麻油酸聚乙二醇甘油酯(macrogolglycerol ricinolate)、聚山梨酯80或辛基丙戊基聚氧基
‑
8甘油酯。
[0032]
蓖麻油酸聚乙二醇甘油酯(cas号61791
‑
12
‑
6)是乙氧基化甘油的三蓖麻油酸酯与少量聚乙二醇蓖麻醇酸酯及相应的游离二醇的混合物。蓖麻油酸聚乙二醇甘油酯的同义词包括多氧基
‑
35
‑
蓖麻油;乙氧基化蓖麻油,peg 35蓖麻油,和
[0033]
蓖麻油(cas号8001
‑
79
‑
4)是从蓖麻豆中提取的亲油性剂。
[0034]
如本文所用,一种或多种附加辅料包括调味辅料、防腐剂、稀释剂或其组合。
[0035]
一种调味辅料,包括天然香料、天然与其他天然香料的混合物、人工香料或天然与人工香料的混合物。示范性调味辅料包括但不限于乙基香兰素、薄荷、油、杏仁油、苯甲醛或苦味掩蔽剂。
[0036]
防腐剂包括能够减少或最小化降解的添加剂,所述组合物、溶液或软明胶胶囊的一个或多个组分。示范性防腐剂包括但不限于烷基或芳基醇,例如苄基醇或氯丁醇;氨基芳基酸酯,例如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯或对羟基苯甲酸丁酯;酚类,例如苯酚、间甲酚或氯甲酚;烷基或芳基酸,例如苯甲酸或山梨酸;有机汞,如硫柳汞或苯汞硝酸盐;二醇,如溴丙醇或丙二醇;或季铵化合物,如苄基氯化钾(bac)或苯乙氧铵氯化物。在某些情况下,防腐剂含有抗菌剂。抗菌剂包括但不限于尼泊金甲酯、尼泊金乙酯、
尼泊金丙酯、尼泊金丁酯、山梨酸、山梨酸钠、山梨酸钾、山梨酸钙、苯甲酸钠、苯甲酸钾或苯甲酸钙、焦亚硫酸钠、丙二醇、bht、bha、苯甲醛,苄基氯化钾(bac)或苄基氯化铵。
[0037]
稀释剂是用于改变重量和/或改善含量均匀性的填充物。示例性稀释剂包括淀粉、水解淀粉、部分预糊化淀粉、无水乳糖、乳糖一水合物或糖醇,如山梨醇、木糖醇或甘露醇。
[0038]
微粉化是一种减小固体材料颗粒直径以使材料具有溶解性的过程。制备微粉化材料的方法是本领域众所周知的。示例性方法包括“自下而上”的方法,例如结晶、喷雾干燥、离子络合和溶解活性药物的沉淀;“自上而下”方法涉及将先前形成的较大颗粒机械还原至所需尺寸。机械还原工艺依赖于铣削和/或研磨,并且包括诸如湿法铣削、干式铣削、球磨/珍珠铣削、螺旋介质铣削、喷射铣削、高压均匀化(hph)或本领域已知的任何其他形式的冲击铣削的技术。
[0039]
在某些情况下,17
‑
hpc通过使用多个高压均匀化循环研磨大块材料的方法进行微粉化,其中循环次数足以将大块材料减小为细颗粒,其中细颗粒具有至少小于57μm的dv50和小于6的跨距分布值。在某些情况下,高压均质是水射流铣削。在某些情况下,循环次数至少为25次。
[0040]
如本文所用,术语“预定水平”在与细胞因子相关的上下文中,指的是对照样品中细胞因子水平的范围。在某些情况下,对照样品取自健康的对象,例如,未患有一种或多种疾病或健康状况的受试者。在其他情况下,对照样品取自患有疾病或健康状况但尚未接受17
‑
hpc治疗的受试者。在这种情况下,对照样品的获取时间点包含在施用含17
‑
hpc的组合物之前或在治疗过程中的不同时间点。在一些实施例中,预定水平是指患有疾病或健康状况的动物模型。在进一步的实例中,对照样品是针对实验室设施的参考样品,并且其预定水平是由特定目的的实验室设施针对特定目标分析得到的。在某些情况下,预定水平是利用液体样品,例如,血液、唾液、血清、尿液、血浆、泪液、滑膜或脑脊髓液样本来测定的。在某些情况下,预定水平是指血清水平。而在某些情况下,预定水平是指表达水平。有经验的科研人员会理解细胞因子水平会受试验、受试者年龄和受试者健康状况所影响。测量细胞因子水平的方法在本领域是众所周知的。示范性方法包括酶联免疫吸附试验(elisa)、实时定量聚合酶链反应(pcr)、细胞因子珠阵列分析,例如bd
tm bd biosciences的细胞仪珠阵列(cba)试剂盒和eve technologies公司的人类细胞因子阵列,或免疫组织化学(ihc)。
[0041]
本文所述的细胞因子水平升高是指高于相同细胞因子的预定细胞因子水平。在一些实例中,细胞因子的升高水平至少为1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、100倍、200倍、500倍,或更高倍数于相同细胞因子的预定水平。在一些情况下,所述细胞因子的升高水平至少是相同细胞因子的预定水平的1倍或更高。在一些情况下,所述细胞因子的升高水平至少是相同细胞因子的预定水平的2倍或更高。在一些情况下,所述细胞因子的升高水平至少是相同细胞因子的预定水平的5倍或更高。在一些情况下,细胞因子的升高水平至少是相同细胞因子的预定水平的10倍或更高。在一些情况下,细胞因子的升高水平至少是相同细胞因子的预定水平的50倍或更高。在一些情况下,细胞因子的升高水平至少是相同细胞因子的预定水平的100倍或更高。
[0042]
il
‑
17包括一系列细胞因子,包括il
‑
17a、il
‑
17b、il
‑
17c、il
‑
17d、il
‑
17e(也称为il
‑
25)和il
‑
17f。il
‑
17a是t辅助细胞(th17细胞)在il
‑
23刺激下产生的促炎细胞因子。在某些情况下,il
‑
17(例如,il
‑
17a)的预定水平是基于液体样本来确定的。在某些情况下,液
体样本是血液、唾液、血清、尿液、血浆、滑膜液或脑脊髓液样本。在一些情况下,il
‑
17(例如,il
‑
17a)的预定水平是基于对照样品来确定的。在某些情况下,对照样品取自健康的对象,例如,未患有一种或多种疾病或健康状况的受试者。在其他情况下,对照样品取自患有疾病或健康状况但尚未接受17
‑
hpc治疗的受试者。在这种情况下,对照样品的获取时间点包含在施用含17
‑
hpc的组合物之前或在治疗过程中的不同时间点。在一些实施例中,预定水平是指患有疾病或健康状况的动物模型。在进一步的实例中,对照样品是针对实验室设施的参考样品,并且其预定水平是由特定目的的实验室设施针对特定目标分析得到的。
[0043]
测量il
‑
17(例如,il
‑
17a)水平的方法是本领域公知的。在某些情况下,这些方法包括quest diagnostics的il
‑
17血清分析(测试:36625);arup实验室的il
‑
17测定(测试:2013113),其预定水平为13pg/ml或更低或1.4pg/ml或更低(于2020年5月18日生效);或r&d systems提供的人类il
‑
17quantikine elisa试剂盒。其他测量il
‑
17(例如il
‑
17a)水平的方法包括实时定量聚合酶链反应(pcr)、细胞因子珠阵列分析,如bd
tm bd biosciences的细胞仪珠阵列(cba)试剂盒和eve technologies公司的人类细胞因子阵列,或免疫组织化学(ihc)。有经验的科研人员会理解il
‑
17(例如,il
‑
17a)水平会受试验、受试者年龄和受试者健康状况所影响。
[0044]
在一些情况下,il
‑
17(例如il
‑
17a)的升高水平是指高于il
‑
17的预定水平(例如,il
‑
17a)的水平。在某些情况下,il
‑
17(例如il
‑
17a)的升高水平至少为1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、100倍、200倍、500倍,或高于预定水平的il
‑
17(例如,il
‑
17a)。在某些情况下,il
‑
17(例如il
‑
17a)的升高水平至少是il
‑
17(例如il
‑
17a)的预定水平的1倍或更高。在某些情况下,il
‑
17(例如il
‑
17a)的升高水平至少是预定水平il
‑
17(例如il
‑
17a)的2倍或更高。在某些情况下,il
‑
17(例如il
‑
17a)的升高水平至少是预定水平il
‑
17(例如il
‑
17a)的5倍或更高。在某些情况下,il
‑
17(例如,il
‑
17a)的升高水平至少是预定水平il
‑
17(例如il
‑
17a)的10倍或更高。在某些情况下,il
‑
17(例如,il
‑
17a)的升高水平至少是预定水平il
‑
17(例如il
‑
17a)的50倍或更高。在某些情况下,il
‑
17(例如il
‑
17a)的升高水平至少是预定水平il
‑
17(例如il
‑
17a)的100倍或更高。
[0045]
17
‑
α
‑
羟基孕酮己酸配方
[0046]
在某些实施例中,本文公开了包含17
‑
hpc的组合物。在一些实施例中,该组合物还包括双组分溶剂系统。在某些情况下,双组分溶剂系统包括增溶剂和亲油性剂或辅料。在一些实例中,该组合物基本上包含或由一系列17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和一系列双组分溶剂系统组成。在一些实例中,该组合物基本上包含或由一系列17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)、一系列增溶剂和一系列亲脂辅料组成。
[0047]
在一些实施例中,17
‑
hpc的范围选自:以组合物的总质量计,约12%w/w至约75%w/w,约12%w/w至约74%w/w,约12%w/w至约63%w/w,约12%w/w至约36%w/w,约12%w/w至约30%w/w,约12%w/w至约25%w/w,约12%w/w至约24%w/w,约24%w/w至约75%w/w,约24%w/w至约74%w/w,约24%w/w至约63%w/w,约24%w/w至约36%w/w,约24%w/w至约30%w/w,约25%w/w至约75%w/w,约25%w/w至约74%w/w,约25%w/w至约63%w/w,约25%w/w至约36%w/w,约25%w/w至约30%w/w,约36%w/w至约75%w/w,约36%w/w至约74%w/w,或约36%w/w至约63%w/w。在某些情况下,17
‑
hpc的范围为约24%w/w至约75%w/w。在某些情况下,17
‑
hpc的范围从约24%w/w到约74%w/w。在某些情况下,17
‑
hpc的范围从约24%
w/w到约63%w/w。在某些情况下,17
‑
hpc的范围从约24%w/w到约36%w/w。在某些情况下,17
‑
hpc的范围从约36%w/w到约75%w/w。在某些情况下,17
‑
hpc的范围从约36%w/w到约74%w/w。在某些情况下,17
‑
hpc的范围从约36%w/w到约63%w/w。
[0048]
在某些情况下,17
‑
hpc的范围选自:以组合物的总质量计,约12%w/w至约36%w/w,约12%w/w至约25%w/w,约12%w/w至约24%w/w,约24%w/w至约36%w/w,或约25%w/w至约36%w/w。在某些实例中,17
‑
hpc的范围为约12%w/w至约36%w/w。在某些实例中,17
‑
hpc的范围从约12%w/w到约25%w/w。在某些情况下,17
‑
hpc的范围从约12%w/w到约24%w/w。在某些情况下,17
‑
hpc的范围从约24%w/w到约36%w/w。在某些情况下,17
‑
hpc的范围从约25%w/w到约36%w/w。
[0049]
在一些实施例中,以组合物的总质量计,组合物包含约12%w/w、约24%w/w、25%w/w、约30%w/w、约36%w/w、约60%w/w、约63%w/w、约74%w/w或约75%w/w。在某些情况下,含有约24%w/w的hpc,或约为24%w/w。在某些情况下,该组合物包含约12%w/w的17
‑
hpc。在某些情况下,该组合物包含约24%w/w的17
‑
hpc。在某些情况下,该组合物包含约25%w/w的17
‑
hpc。在某些情况下,该组合物包含约36%w/w的17
‑
hpc。在某些情况下,该组合物包含约74%w/w的17
‑
hpc。在某些情况下,该组合物包含约75%w/w的17
‑
hpc。
[0050]
在一些实施例中,17
‑
hpc的范围选自:以组合物的总质量计,约6%w/v至约36%w/v、约6%w/v至约24%w/v、约6%w/v至约18%w/v、约12%w/v至约36%w/v、约12%w/v至约18%w/v、约12%w/v至约24%w/v、约18%w/v至约36%w/v、或约24%w/v至约36%w/v。
[0051]
在一些实施例中,该组合物包含一系列双组分溶剂系统。在一些实例中,所述双组分溶剂系统的范围选自:以组合物的总质量计,约25%w/w至约88%w/w、约25%w/w至约76%w/w、约25%w/w至约75%w/w、约25%w/w至约36%w/w、约26%w/w至约88%w/w、约26%w/w至约76%w/w、约26%w/w至约75%w/w、约26%w/w至约64%w/w,约64%w/w至约88%w/w,约64%w/w至约76%w/w,约64%w/w至约75%w/w,或约75%w/w至约88%w/w。
[0052]
在某些情况下,以组合物的总质量计,该组合物包含约25%w/w、约26%w/w、约64%w/w、约75%w/w、约76%w/w或约88%w/w的双组分溶剂体系。
[0053]
在一些实施例中,双组分溶剂系统包括增溶剂和亲脂辅料。在某些情况下,增溶剂包括苯甲酸苄酯、二甘醇单乙醚、丙二醇单月桂酸酯、单磷酸甘油酯或油酸。在某些情况下,增溶剂包括苯甲酸苄酯。在某些情况下,亲脂辅料包括蓖麻酸大甘油酯、聚山梨酸80或辛基丙氧基聚氧乙烯
‑
8甘油酯。在某些情况下,亲脂辅料包括蓖麻酸大甘油酯。在某些情况下,增溶剂与亲脂剂的重量(mg)比为9:1。作为示例,在包含240mg 17
‑
hpc的组合物中,组合物中的增溶剂为684mg,组合物中的亲脂剂为76mg。增溶剂(684mg)与亲脂剂(76mg)的重量(mg)比为9:1。
[0054]
在一些实施例中,增溶剂的范围选自:以组合物的总质量计,约22%w/w至约80%w/w、约22%w/w至约68%w/w、约22%w/w至约67.5%w/w、约22%w/w至约67%w/w、约22%w/w至约63%w/w、约22%w/w至约60%w/w、约22%w/w至约50%w/w、约22%w/w至约40%w/w、约22%w/w至约40%w/w约36%w/w、约22%w/w至约30%w/w、约22%w/w至约25%w/w、约25%w/w至约80%w/w、约25%w/w至约68%w/w、约25%w/w至约67.5%w/w、约25%w/w至约67%w/w、约25%w/w至约63%w/w、约25%w/w至约60%w/w、约25%w/w至约50%w/w、约25%w/w至约40%,约25%w/w至约36%w/w、约25%w/w至约30%w/w、约30%w/w至约80%w/w、约
30%w/w至约68%w/w、约30%w/w至约67.5%w/w、约30%w/w至约63%w/w、约30%w/w至约60%w/w、约30%w/w至约50%w/w、约30%w/w至约40%w/w,或约30%w/w至约36%w/w。在某些情况下,增溶剂的范围为约25%w/w至约80%w/w。在某些情况下,增溶剂的范围为约25%w/w至约68%w/w。在某些情况下,增溶剂的范围为约25%w/w至约67.5%w/w。在某些情况下,增溶剂的范围为约25%w/w至约63%w/w。在某些情况下,增溶剂的范围为约25%w/w至约60%w/w。在某些情况下,增溶剂的范围为约30%w/w至约80%w/w。在某些情况下,增溶剂的范围为约30%w/w至约68%w/w。在某些情况下,增溶剂的范围为约30%w/w至约67.5%w/w。在某些情况下,增溶剂的范围为约30%w/w至约63%w/w。
[0055]
在某些情况下,以组合物的总质量计,该组合物包含约22%w/w、约25%w/w、约33%w/w、约33.8%w/w、约36%w/w、约57%w/w、约57.7%w/w、约63%w/w、约67%w/w、约67.5%w/w、约67.6%w/w、约68%w/w、约68.4%w/w、约79%w/w或约80%w/w的增溶剂。在某些情况下,该组合物包含约63%w/w的增溶剂。在某些情况下,该组合物包含约67.5%w/w的增溶剂。
[0056]
在某些情况下,增溶剂包含苯甲酸苄酯。在一些实施例中,苯甲酸苄酯的范围选自:以组合物的总质量计,约22%w/w至约80%w/w、约22%w/w至约68%w/w、约22%w/w至约67.5%w/w、约22%w/w至约67%w/w、约22%w/w至约63%w/w、约22%w/w至约60%w/w、约22%w/w至约50%w/w、约22%w/w至约40%w/w、约22%w/w至约约约40%w/w36%w/w、约22%w/w至约30%w/w、约22%w/w至约25%w/w、约25%w/w至约80%w/w、约25%w/w至约68%w/w、约25%w/w至约67.5%w/w、约25%w/w至约67%w/w、约25%w/w至约63%w/w、约25%w/w至约60%w/w、约25%w/w至约50%w/w、约25%w/w至约40%,约25%w/w至约36%w/w,约25%w/w至约30%w/w,约30%w/w至约80%w/w,约30%w/w至约68%w/w,约30%w/w至约67.5%w/w,约30%w/w至约67%w/w,约30%w/w至约63%w/w,约30%w/w至约60%w/w,约30%w/w至约50%w/w,约30%w/w至约40%w/w,或约30%w/w至约36%w/w。在某些情况下,苯甲酸苄酯的范围为约25%w/w至约80%w/w。在某些情况下,苯甲酸苄酯的范围为约25%w/w至约68%w/w。在某些情况下,苯甲酸苄酯的范围为约25%w/w至约67.5%w/w。在某些情况下,苯甲酸苄酯的范围为约25%w/w至约63%w/w。在某些情况下,苯甲酸苄酯的范围为约25%w/w至约60%w/w。在某些情况下,苯甲酸苄酯的范围为约30%w/w至约80%w/w。在某些情况下,苯甲酸苄酯的范围为约30%w/w至约68%w/w。在某些情况下,苯甲酸苄酯的范围为约30%w/w至约67.5%w/w。在某些情况下,苯甲酸苄酯的范围为约30%w/w至约63%w/w。
[0057]
在一些实例中,以组合物的总质量计,该组合物包含约22%w/w、约25%w/w、约33%w/w、约33.8%w/w、约36%w/w、约57%w/w、约57.7%w/w、约63%w/w、约67.5%w/w、约67.6%w/w、约68%w/w、约68.4%w/w、约79%w/w或约80%w/w苯甲酸苄酯。在某些情况下,该组合物包含约63%w/w的苯甲酸苄酯。在某些情况下,该组合物包含约67.5%w/w的苯甲酸苄酯。
[0058]
在一些实施方案中,亲脂性辅料的范围选自:以组合物的总质量计,约2.5%w/w至约8.7%w/w,约2.5%w/w至约7.6%w/w,约2.5%w/w至约2.5%w/w。7.4%w/w,约2.5%w/w至约7%w/w,约2.5%w/w至约6.3%w/w,约2.5%w/w至约4%w/w,约2.5%w/w至约3.7%w/w,约2.5%w/w至约2.8%w/w,约2.8%w/w至约9%w/w,约2.8%w/w至约8.7%w/w,约2.8%w/w至约7.6%w/w,约2.8%w/w至约7.4%w/w,约2.8%w/w至约7%w/w,约2.8%w/w至约
6.3%w/w,约2.8%w/w至约4%w/w,约2.8%w/w至约3.7%w/w,约3%w/w至约9%w/w,约3%w/w至约8.7%w/w,约3%w/w至约7.6%w/w,约3%w/w至约7.4%w/w,约3%w/w至约7%w/w,约3%w/w至约6.3%w/w,约3%w/w至约4%w/w,约6%w/w至约9%w/w,约6%w/w至约8.7%w/w,约6%w/w至约7.6%w/w,约6%w/w至约7.4%w/w,约6%w/w至约7%w/w,约7%w/w至约9%w/w,约7%w/w至约8.7%w/w,约7%w/w至约7.6%w/w或约7%w/w至约7.4%w/w。在一些情况下,亲脂性辅料的范围为约2.5%w/w至约7.6%w/w。在一些情况下,亲脂性辅料的范围为约2.5%w/w至约7.4%w/w。在一些情况下,亲脂性辅料的范围为约2.5%w/w至约7%w/w。在某些情况下,亲脂性辅料的范围为约2.5%w/w至约6.3%w/w。在一些情况下,亲脂性辅料的范围为约2.5%w/w至约4%w/w。在某些情况下,亲脂性辅料的范围为约2.5%w/w至约3.7%w/w。在一些情况下,亲脂性辅料的范围为约3%w/w至约7.4%w/w。在某些情况下,亲脂性辅料的范围为约3%w/w至约7%w/w。在一些情况下,亲脂性辅料的范围为约3%w/w至约6.3%w/w。在某些情况下,亲脂性辅料的范围为约3%w/w至约4%w/w。
[0059]
在一些实施例中,以组合物的总质量计,该组合物包含有约2.5%w/w、约2.8%w/w、约3.7%w/w、约4%w/w、约6.3%w/w、约7.4%w/w、约7.6%w/w、约8.7%w/w或约9%w/w的亲脂性辅料。
[0060]
在一些情况下,亲脂性试剂包括聚乙二醇蓖麻油酸酯。在一些情况下,聚乙二醇蓖麻油酸酯的范围选自:以组合物的总质量计,约2.5%w/w至约8.7%w/w,约2.5%w/w至约7.6%w/w,约2.5%w/w至约7.4%w/w,约2.5%w/w至约7%w/w,约2.5%w/w至约6.3%w/w,约2.5%w/w至约4%w/w,约2.5%w/w至约3.7%w/w,约2.5%w/w至约2.8%w/w,约2.8%w/w至约9%w/w,约2.8%w/w至约8.7%w/w,约2.8%w/w至约7.6%w/w,约2.8%w/w至约7.4%w/w,约2.8%w/w至约7%w/w,约2.8%w/w至约6.3%w/w,约2.8%w/w至约4%w/w,约2.8%w/w至约3.7%w/w,约3%w/w至约9%w/w约3%w/w至约8.7%w/w,约3%w/w至约7.6%w/w,约3%w/w至约7.4%w/w,约3%w/w约7%w/w,约3%w/w至约6.3%w/w,约3%w/w至约4%w/w,约6%w/w至约9%w/w,6%w/w至约8.7%w/w,约6%w/w至约7.6%w/w,约6%w/w至约7.4%w/w,约6%w/w至约7%w/w,约7%w/w至约9%w/w,约7%w/w至约8.7%w/w,约7%w/w至约7.6%w/w,或约7%w/w至约7.4%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约7.6%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约7.4%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约7%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约6.3%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约4%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约2.5%w/w至约3.7%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约3%w/w至约7.4%w/w。在某些情况下,聚乙二醇蓖麻油酸酯的范围为约3%w/w至约7%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约3%w/w至约6.3%w/w。在一些情况下,聚乙二醇蓖麻油酸酯的范围为约3%w/w至约4%w/w。
[0061]
在某些情况下,以组合物的总质量计,该组合物包含约2.5%w/w、约2.8%w/w、约3.7%w/w、约4%w/w、约6.3%w/w、约7%w/w、约7.4%w/w、约7.6%w/w、约8.7%w/w或约9%w/w的聚乙二醇蓖麻油酸酯。
[0062]
在一些实施方案中,组合物还包含一种或多种附加辅料。在一些情况下,一种或多种附加辅料包括调味辅料,防腐剂或稀释剂。在某些情况下,一种或多种附加辅料占组合物
总量的约50%w/w。
[0063]
在一些实施例中,在一种或多种辅料存在时,17
‑
hpc的范围选自:以组合物的总质量计,约3%w/w至约36%w/w、约3%w/w至约25%w/w、约3%w/w至约24%w/w、约3%w/w至约12%w/w、约6%w/w至约36%w/w、约6%w/w至约25%w/w、约6%w/w至约24%w/w、约6%w/w至约24%12%w/w,约12%w/w至约36%w/w,约12%w/w至约25%w/w,约12%w/w至约24%w/w,约24%w/w至约36%w/w,或约25%w/w至约36%w/w。
[0064]
在某些情况下,在存在一种或多种辅料时,以组合物的总质量计,组合物包含约3%w/w、6%w/w、12%w/w、24%w/w、25%w/w或36%w/w的17
‑
hpc。
[0065]
在一些实例中,在存在一种或多种辅料时,双组分溶剂系统的范围选自:以组合物的总质量计,约14%w/w至约57%w/w、约14%w/w至约44%w/w、约14%w/w至约38%w/w、约14%w/w至约26%w/w、约14%w/w至约25%w/w、约25%w/w至约57%w/w,约25%w/w至约44%w/w,约25%w/w至约38%w/w,约26%w/w至约57%w/w,约26%w/w至约44%w/w,约26%w/w至约38%w/w,或约38%w/w至约57%w/w。
[0066]
在一些实施例中,表1a、表1b、表1c和表1d示出了组合物中17
‑
hpc和双组分溶剂系统的量。在某些情况下,表2a和表2b示出了组合物中17
‑
hpc和双组分溶剂系统的量。
[0067]
表1a每1000mg配方的配料比例(按重量计)
–
无香料或防腐剂
[0068]
混合物数量(mg)%w/w数量(mg)%w/w数量(mg)%w/w17
‑
hpc120122402425025双组分溶剂系统880887607675075
[0069]
表1b每1000mg配方的配料比例(按重量计)
–
不含香料或防腐剂
[0070]
混合物数量(mg)%w/w数量(mg)%w/w数量(mg)%w/w17
‑
hpc360367407475075双组分溶剂系统640642602625025
[0071]
表1c每1000mg配方的配料比例(按重量计)
–
添加调味料、防腐剂或其他稀释剂
[0072][0073]
表1d每1000mg配方的配料比例(按重量计)
–
添加调味料、防腐剂或其他稀释剂
[0074][0075]
表2a每1000ml配方的配料比例(按体积计)
–
不含香料或防腐剂
[0076]
[0077]
表2b每1000ml配方的配料比例(按体积计)
–
添加调味料、防腐剂或其他稀释剂
[0078][0079]
在一些情况下,该组合物包含约24%w/w的17
‑
hpc和约76%w/w的包含增溶剂和亲脂辅料的双组分溶剂体系。
[0080]
在一些情况下,该组合物包含约24%w/w的17
‑
hpc和约76%w/w的包含苯甲酸苄酯和蓖麻油酸大甘油酯的双组分溶剂体系。
[0081]
在一些情况下,该组合物包含约25%w/w的17
‑
hpc和约75%w/w的包含增溶剂和亲脂辅料的双组分溶剂体系。
[0082]
在一些情况下,该组合物包含约25%w/w的17
‑
hpc和约75%w/w的包含苯甲酸苄酯和蓖麻油酸大甘油酯的双组分溶剂体系。
[0083]
在一些情况下,该组合物包含约36%w/w的17
‑
hpc和约64%w/w的包含增溶剂和亲脂辅料的双组分溶剂体系。
[0084]
在一些情况下,该组合物包含约36%w/w的17
‑
hpc和约64%w/w的包含苯甲酸苄酯和蓖麻油酸大甘油酯的双组分溶剂体系。
[0085]
在某些情况下,组合物是一种溶液。
[0086]
在一些情况下,组合物配制用于口服给药。
[0087]
在一些情况下,该组合物配制成口服胶囊,可选为软明胶胶囊。
[0088]
在一些情况下,组合物配制成注射剂。在一些情况下,表1a,表1b,表1c和表1d的组合物各自独立地配制成单一注射剂。
[0089]
在一些情况下,表2a和表2b的组合物共同配制成单一注射剂。
[0090]
在某些实施方案中,本文公开了包含17
‑
hpc的溶液。在一些实施方案中,该溶液基本包含由约120mg/ml至约360mg/ml的17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和双组分溶剂体系组成。
[0091]
在一些情况下,17
‑
hpc的范围选自:约120mg/ml至约240mg/ml,或约240mg/ml至约360mg/ml。
[0092]
在一些情况下,该溶液包含约120mg/ml,约240mg/ml或约360mg/ml的17
‑
hpc。
[0093]
在一些实施方案中,双组分溶剂体系包含增溶剂和亲脂性辅料,任选一系列增溶剂和一系列亲脂性辅料。在一些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚,丙二醇单月桂酸酯,单辛酸甘油酯或油酸。在一些情况下,增溶剂包含苯甲酸苄酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯。
[0094]
在一些实施方案中,该组合物包含17
‑
hpc,双组分溶剂体系和一种或多种额外的孕激素。在一些情况下,一种或多种额外的孕激素包含羟基孕酮酯。在一些情况下,该组合
物包含17
‑
hpc,一种或多种额外的羟基孕酮酯(例如,一种,两种或三种额外的羟基孕酮酯)和双组分溶剂体系。在一些情况下,双组分溶剂体系包含增溶剂和亲脂性辅料,任选一系列增溶剂和一系列亲脂性辅料。在一些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚,丙二醇单月桂酸酯,单辛酸甘油酯或油酸。在一些情况下,增溶剂包含苯甲酸苄酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯。
[0095]
在一些实施方案中,一种或多种额外的孕激素包含乙酸羟孕酮或庚酸羟孕酮。在一些情况下,该组合物包含17
‑
hpc,选自乙酸羟孕酮和庚酸羟孕酮的一种或多种额外的孕激素和双组分溶剂体系。在一些情况下,该组合物包含17
‑
hpc,乙酸羟孕酮和双组分溶剂体系。在一些情况下,该组合物包含17
‑
hpc,庚酸羟孕酮和双组分溶剂体系。在一些情况下,该组合物包含17
‑
hpc,乙酸羟孕酮,庚酸羟孕酮和双组分溶剂体系。在一些情况下,双组分溶剂体系包含增溶剂和亲脂性辅料,任选一系列增溶剂和一系列亲脂性辅料。在一些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚,丙二醇单月桂酸酯,单辛酸甘油酯或油酸。在一些情况下,增溶剂包含苯甲酸苄酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯。
[0096]
在一些实施方案中,亲脂性辅料的范围选自:约28mg/ml至约76mg/ml,约28mg/ml至约76mg/ml,约38mg/ml至约74mg/ml,或约74mg/ml至约87mg/ml。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰基聚氧乙烯
‑
8甘油酯
[0097]
在一些情况下,该溶液包含约25mg/ml,约28mg/ml,约63mg/ml,约74mg/ml,约76mg/ml或约87mg/ml的亲脂性辅料。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。
[0098]
在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯。在一些情况下,蓖麻油酸聚乙二醇甘油酯的范围选自:约28mg/ml至约76mg/ml,约28mg/ml至约76mg/ml,约38mg/ml至约74mg/ml,或约74mg/ml至约87mg/ml。
[0099]
在某些情况下,溶液包含约25mg/ml、约28mg/ml、约63mg/ml、约74mg/ml、约76mg/ml或约87mg/ml蓖麻油酸聚乙二醇甘油酯。
[0100]
在一些实施例中,增溶剂的范围选自:约225mg/ml至约793mg/ml、约252mg/ml至约684mg/ml、约252mg/ml至约676mg/ml、约577mg/ml至约793mg/ml或约577mg/ml至约684mg/ml。在某些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚、单月桂酸丙二醇酯、单己酸甘油酯或油酸。
[0101]
在一些情况下,该溶液包含约225mg/ml,约252mg/ml,约577mg/ml,约676mg/ml,约684mg/ml或约793mg/ml的增溶剂。在一些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚,丙二醇单月桂酸酯,单辛酸甘油酯或油酸。
[0102]
在一些情况下,增溶剂包含苯甲酸苄酯。在一些情况下,苯甲酸苄酯的范围选自:约225mg/ml至约793mg/ml,约252mg/ml至约684mg/ml,约252mg/ml至约676mg/ml,约577mg/ml至约793mg/ml,或约577mg/ml至约684mg/ml。
[0103]
在一些情况下,该溶液包含约225mg/ml,约252mg/ml,约577mg/ml,约676mg/ml,约684mg/ml或约793mg/ml苯甲酸苄酯。
[0104]
在某些情况下,该溶液配制用于口服给药。
[0105]
在某些情况下,溶液配制用于注射剂。
[0106]
在本文公开的某些实施方案中,包含17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和双组分溶剂体系的液体填充物和包封液体填充物的胶囊壳的软明胶胶囊。在一些实施方案中,液体填充物包含任选地选自:约12%w/w至约36%w/w,约12%w/w至约25%w/w,约12%w/w至约24%w/w,约24%w/w至约36%w/w或约25%w/w至约36%w/w。
[0107]
在一些情况下,液体填充物包含约12%w/w,约24%w/w,25%w/w,约30%w/w/或约36%w/w的17
‑
hpc。在一些情况下,液体填充物包含约24wt%的17
‑
hpc。在一些情况下,液体填充物包含约36wt%的17
‑
hpc。
[0108]
在一些实施方案中,液体填充物包括一系列双组分溶剂体系。在一些情况下,双组分溶剂体系的范围选自:约64%w/w至约88%w/w,约64%w/w至约76%w/w,约64%w/w至约75%w/w,或约75%w/w至约88%w/w。在一些情况下,液体填充物包含约64%w/w,约75%w/w,约76%w/w,或约88%w/w的双组分溶剂系统。
[0109]
在一些情况下,双组分溶剂体系包含增溶剂和亲脂性辅料。在一些情况下,增溶剂包含苯甲酸苄酯,二甘醇单乙醚,丙二醇单月桂酸酯,单辛酸甘油酯或油酸。在一些情况下,增溶剂包含苯甲酸苄酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯,聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。在一些情况下,亲脂性辅料包含蓖麻油酸大甘油酯。
[0110]
在某些情况下,软明胶胶囊配制成速释凝胶帽。如本文所用,在凝胶帽或凝胶胶囊的背景下术语“立即释放”是指在缩短的时间段内从胶囊快速释放17
‑
hpc。缩短的时间段包括超过1分钟,2分钟,3分钟,4分钟,5分钟,6分钟,7分钟,8分钟,9分钟,10分钟,15分钟,20分钟或30分钟。在一些情况下,缩短的时间段包括最多1分钟,2分钟,3分钟,4分钟,5分钟,6分钟,7分钟,8分钟,9分钟,10分钟,15分钟,20分钟或30分钟。
[0111]
在某些情况下,软明胶胶囊配制成改良释放液。在一些情况下,术语“修饰释放”是指在给药后的确定时间后或长时间后发生的药物释放(例如17
‑
hpc释放)或体内的特定靶标。在一些情况下,修改的释放包括延迟释放,延长释放或控制释放。如此处所使用的,术语延迟释放包括延迟约10分钟,15分钟,20分钟,30分钟,1小时,2小时,3小时,4小时,5小时,6小时的17
‑
hpc的释放。,8小时,10小时,12小时或更长时间。在一些情况下,17
‑
hpc的释放被延迟,直到药物进入受试者的小肠。
[0112]
在某些情况下,软明胶胶囊被配制成延长释放。在一些情况下,延长释放包括延长释放,例如在20分钟,30分钟,1小时,2小时,6小时,12小时或更长的过程中,以减少给药频率。
[0113]
在某些情况下,将明胶胶囊配制成控释剂。如本文所用,术语“控制释放”是指每次释放的药物浓度(例如17
‑
hpc)是相同的。
[0114]
在某些情况下,软明胶胶囊配制成缓释剂。如本文所用,术语“持续释放”是指以预定速率释放药物(例如17
‑
hpc)以在特定时间段内保持恒定的药物浓度。在一些情况下,实现持续释放速率以最小化副作用。
[0115]
在一些情况下,胶囊壳包含明胶和非明胶材料。示例性非明胶材料包括但不限于增塑剂如甘油或山梨糖醇,着色剂,防腐剂,崩解剂或润滑剂。
[0116]
在一些实施方案中,本文所述的组合物包含一系列17
‑
hpc,一系列苯甲酸苄酯和
一系列表面活性剂,其包含约12至约15的亲水
‑
亲油平衡(hlb)值。在一些情况下,表面活性剂包含辛基丙烯酰基聚氧乙烯
‑
8甘油酯(hlb值:约12),聚乙二醇甘油蓖麻油酸酯(hlb值:约12
‑
14)或聚山梨醇酯80(hlb值:约15)。在一些情况下,苯甲酸苄酯的范围为约10%w/w至约90%w/w。在一些情况下,表面活性剂的范围为约10%w/w至约90%w/w。在一些情况下,该组合物包含如表3所示的制剂。
[0117]
表3
[0118][0119]
在一些实施方案中,本文所述的组合物包含一系列17
‑
hpc和选自蓖麻油(cas 8001
‑
79
‑
4)和花生油的亲脂性辅料。在一些情况下,该组合物包含约30wt%的17
‑
hpc和约70wt%的蓖麻油或花生油。在一些情况下,组合物中的17
‑
hpc被微粉化。在一些情况下,微粉化17
‑
hpc的dv10,dv50和dv90值为约1.27μm,5.55μm和14μm。
[0120]
在一些实施方案中,组合物,溶液或软明胶胶囊通过图1所示的制造工艺制备。如图1所示,该方法包括在将api溶解在增溶剂和亲脂辅料中之前称量活性药物成分(api)17
‑
hpc,增溶剂和亲脂性辅料。随后将溶液填充到相应的载体中,例如填充到用于软明胶胶囊的胶囊或容器或小瓶中。
[0121]
在一些实施方案中,评估组合物,溶液或软明胶胶囊以确保组合物符合质量规格。在某些情况下,质量规格是美国食品和药物管理局(fda)的规格。在某些情况下,质量规格是来自美国食品和药物管理局的规格,该规格与美国fda相对应。在某些情况下,质量规格包括外观评估,鉴定,杂质评估,剂量均匀性,残留溶剂和微生物限制中的一种或多种。在某些情况下,质量规范包括外观评估,鉴定,杂质评估和微生物限制中的一个或多个。
[0122]
在一些实施方案中,软明胶胶囊的组成,溶液或液体填充的鉴定和杂质评估通过高效液相色谱(hplc)方法进行。示例性hplc方法包括正相,反相,尺寸排阻或离子交换色谱方法。
[0123]
在一些实施方案中,该组合物能保持约1,3,6,9,12,18,24,26个月或更长时间的稳定。如本文所用,术语“稳定”是指少于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的杂质。在一些情况下,组合物在指定的储存条件下能保持稳定约1,3,6,9,12,18,24,26个月或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0124]
在某些情况下,溶液稳定约1,3,6,9,12,18,24,26个月或更长时间。在某些情况下,溶液在指定的储存条件下稳定约1,3,6,9,12,18,24,26个月或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0125]
在一些实施方案中,软明胶胶囊的液体填充稳定约1,3,6,9,12,18,24,26个月或
更长时间。在一些情况下,软明胶胶囊的液体填充在特定的储存条件下稳定约1,3,6,9,12,18,24,26个月或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0126]
在一些实施方案中,该组合物在储存条件下具有小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的降解。在一些情况下,组合物在储存条件下具有小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的降解约1,3,6,9,12,18,24,26或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0127]
在一些情况下,溶液在储存条件下降解小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%。在一些情况下,该溶液在储存条件下具有小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的降解约1,3,6,9,12,18,24,26个月或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0128]
在一些实施方案中,软明胶胶囊的液体填充在储存条件下具有小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的降解。在一些情况下,软明胶胶囊的液体填充在储存条件下具有小于约10%,9%,8%,7%,6%,5%,4%,3%,2%或1%的降解约1个月,3个月,6个月,9个月,12个月,18个月,24个月,26个月或更长时间。在一些情况下,储存条件为约20℃至约28℃,约22℃至约26℃,或约23℃至约27℃。在一些情况下,储存条件包括约55%,约60%,约65%,约70%,约75%或约80%湿度。
[0129]
在一些实施方案中,软明胶胶囊具有剂量单位的均匀性。如本文所用,术语“剂量单位的均匀性”是指剂量单位之间药物量的均匀程度。在一些情况下,剂量单位的均匀性通过重量变化来测量。在其他情况下,剂量单位的均匀性通过含量均匀性来测量。在一些情况下,用于确定剂量单位重量变化的均匀性的测定符合美国药典(usp)<905>中详述的方法。在一个实例中,基于usp<905>的方法,该测定包括单独加重约10个胶囊以获得它们的总重量。然后打开每个胶囊以从每个胶囊中取出液体填充物。接下来,然后将每个壳干燥约30分钟,然后称重干燥的壳以计算内容物的净重量。从每个胶囊中取出的产品的净重量和上述标签声明的测定结果计算药物含量,以标签声明的百分比表示。
[0130]
在一些实施方案中,软明胶胶囊的组合物,溶液或液体填充物具有小于5000ppm的残余溶剂。如本文所用,术语“残余溶剂”是指在药物物质,辅料,药剂的制造或药物产品的制备中使用或生产的一种或多种有机挥发性化学品。如本文所用,术语“有机溶剂”是指碳基溶剂或在其结构中包含至少一个碳原子的溶剂。如本文所用,术语“挥发性”是指在约22℃至约27℃的温度和约1个标准气氛(atm)下蒸发的有机溶剂。在某些情况下,残留溶剂是根据usp<467>中详述的方法计算的。在某些情况下,残留溶剂小于4500ppm,小于4000ppm,小于3500ppm,小于3000ppm,小于2500ppm,小于2000ppm,小于1500ppm,小于1000ppm,小于500ppm,小于400ppm,小于300ppm,小于200ppm,小于100ppm或小于50ppm。在某些情况下,总残留溶剂小于5000ppm。
[0131]
在一些实施方案中,软明胶胶囊具有小于5000ppm的残余溶剂。
[0132]
在一些具体实施方案中,还公开了包含17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)和溶剂体
系的组合物,以所述组合物的总质量计,所述17
‑
hpc的范围选自:约12%w/w至约75%w/w,约12%w/w至约74%w/w,约12%w/w至约63%w/w,约12%w/w至约36%w/w,约12%w/w至约30%w/w,约12%w/w至约25%w/w,约12%w/w至约24%w/w,约24%w/w至约75%w/w,约24%w/w至约74%w/w,约24%w/w至约63%w/w,约24%w/w至约36%w/w,约24%w/w至约30%w/w,约25%w/w至约75%w/w,约25%w/w至约74%w/w,约25%w/w至约63%w/w,约25%w/w至约36%w/w,约25%w/w至约30%w/w,约36%w/w至约75%w/w,约36%w/w至约74%w/w,或约36%w/w至约63%w/w,所述溶剂体系的范围选自:约25%w/w至约88%w/w,约25%w/w至约76%w/w,约25%w/w至约75%w/w,约25%w/w至约36%w/w,约26%w/w至约88%w/w,约26%w/w至约76%w/w,约26%w/w至约75%w/w,约26%w/w至约64%w/w,约64%w/w至约88%w/w,约64%w/w至约76%w/w,约64%w/w至约75%w/w,或约75%w/w至约88%w/w。
[0133]
在一些实施方案中,所述17
‑
hpc的范围为约20%或约30%,所述溶剂体系的范围为约70%或80%。
[0134]
在一些实施方案中,所述溶剂选自山梨醇、木糖醇、甘露醇、聚乙二醇蓖麻油酸酯、蓖麻油、聚山梨醇酯80或辛基丙烯酰聚氧乙烯
‑
8甘油酯。
[0135]
在一些实施方案中,进行组合物或溶液的微生物含量的定量评估。这种定量评估有时可以称为微生物生物负载测试或微生物极限测试。在某些情况下,测试是根据usp<61>和/或usp<62>中详述的方法进行的。在某些情况下,usp<61>测试提供了在有氧条件下可能生长的嗜温细菌和真菌的计数。在一些情况下,好氧细菌是nmt(不超过)1000cfu/g(每克菌落形成单位)。在一些情况下,好氧细菌是nmt 900cfu/g,800cfu/g,700cfu/g,600cfu/g,500cfu/g,400cfu/g,300cfu/g,200cfu/g,或100cfu/g。在一些情况下,真菌(例如酵母和/或霉菌)是nmt 100cfu/g。在一些情况下,真菌是nmt 80cfu/g,50cfu/g,30cfu/g或10cfu/g。
[0136]
usp<62>测试确定是否存在以下微生物:大肠杆菌,沙门氏菌属,金黄色葡萄球菌,铜绿假单胞菌和胆汁耐受革兰氏阴性菌,如白色念珠菌,梭菌属和/或洋葱伯克霍尔德菌复合物(bcc)。在一些情况下,在组合物或溶液中未检测到一种或多种微生物。在一些情况下,在组合物中未检测到选自白色念珠菌,梭菌属物种或洋葱伯克霍尔德菌复合物(bcc)的一种或多种大肠杆菌,沙门氏菌属物种,金黄色葡萄球菌,铜绿假单胞菌或耐胆革兰氏阴性菌或其溶液。
[0137]
在一些实施方案中,进行软明胶胶囊的微生物含量的定量评估。在某些情况下,测试是根据usp<61>和/或usp<62>中详述的方法进行的。在一些情况下,好氧细菌是nmt(不超过)1000cfu/g(每克菌落形成单位)。在一些情况下,好氧细菌是nmt 900cfu/g,800cfu/g,700cfu/g,600cfu/g,500cfu/g,400cfu/g,300cfu/g,200cfu/g或100cfu/g。在一些情况下,真菌(例如酵母和/或霉菌)是nmt 100cfu/g。在一些情况下,真菌是nmt 80cfu/g,50cfu/g,30cfu/g或10cfu/g。在一些情况下,usp<62>测试确定存在或不存在以下微生物:大肠杆菌,沙门氏菌属,金黄色葡萄球菌,铜绿假单胞菌和耐受胆汁的革兰氏阴性菌,例如白色念珠菌,梭菌属和/或洋葱伯克霍尔德菌复合物(bcc)。在一些情况下,在软明胶胶囊中未检测到一种或多种微生物。在一些情况下,在软明胶中未检测到选自白色念珠菌,梭菌属物种或洋葱伯克霍尔德菌复合体(bcc)的一种或多种大肠杆菌,沙门氏菌属物种,金黄色葡萄球菌,铜绿假单胞菌或耐胆汁革兰氏阴性菌胶囊。
[0138]
使用方法
[0139]
在某些实施方案中,本文公开了向受试者施用17
‑
hpc或治疗需要其的受试者的疾病或病症的方法。在一些情况下,该方法包括向受试者施用上述组合物,溶液或软明胶胶囊。
[0140]
在某些实施方案中,本文还描述了在需要其的受试者中降低升高的il
‑
17表达,il
‑
2表达,il
‑
4表达或其组合和/或p38丝裂原活化蛋白激酶活性的方法。在一些情况下,该方法包括向受试者施用上述组合物,溶液或软明胶胶囊。在一些情况下,组合物,溶液或软明胶胶囊的施用降低了il
‑
17表达,il
‑
2表达,il
‑
4表达或其组合,和/或p38丝裂原活化蛋白激酶活性。主题。在一些情况下,组合物,溶液或软明胶胶囊在受试者中诱导il
‑
2表达,il
‑
4表达或其组合的降低。在一些情况下,组合物,溶液或软明胶胶囊诱导受试者中il
‑
17表达的降低。在一些情况下,组合物,溶液或软明胶胶囊诱导p38mapk磷酸化的降低。在一些情况下,组合物,溶液或软明胶胶囊降低了受试者的类固醇抗性。在一些情况下,组合物,溶液或软明胶胶囊逆转受试者中的糖皮质激素抗性。
[0141]
在某些实施方案中,本文还公开了治疗选择用于治疗的受试者的方法,包括(a)检测从受试者获得的样品中升高的il
‑
17水平和(b)与具有预定水平的受试者中的il
‑
17水平相比,给予具有升高水平的il
‑
17的受试者il
‑
17的范围是上述的组合物,溶液或软明胶胶囊。
[0142]
在一些情况下,疾病或病症包括糖皮质激素不敏感的疾病或病症。在一些情况下,疾病或病症与升高的il
‑
17表达相关或受试者表现出升高的il
‑
17水平。
[0143]
在一些情况下,疾病或病症与升高的p38丝裂原活化蛋白激酶活性相关或受试者表现出升高的p38丝裂原活性。
[0144]
在一些情况下,该疾病或病症是慢性阻塞性肺病,哮喘,闭塞性支气管炎,支气管扩张,囊性纤维化,结节病,嗜酸性肉芽肿,呼吸性细支气管炎间质性肺病或肺气肿。
[0145]
在一些实施方案中,疾病或病症是特发性间质性肺炎(iip)。特发性间质性肺炎是一组病因不明的间质性肺疾病,具有相似的临床和放射学特征,主要通过肺活检的组织病理学模式来区分。在某些情况下,iip进一步分为四组:慢性纤维化iip:特发性肺纤维化(ipf)和特发性非特异性间质性肺炎(nsip);吸烟相关iip:呼吸性细支气管炎相关性间质性肺病(rb
‑
ild))和脱屑性间质性肺炎(dip);急性和亚急性iip:急性间质性肺炎(aip)和隐源性机化性肺炎(cop);以及罕见的iip:特发性胸膜间质纤维弹力纤维增生症(ippfe)和淋巴样间质性肺炎(lip)。在某些情况下,iip包括特发性非特异性间质性肺炎(nsip),脱屑性间质性肺炎(dip),隐源性机化性肺炎(cop),淋巴样间质性肺炎(lip)或特发性胸膜间质纤维弹力纤维增生症(ippfe)。
[0146]
在一些实施方案中,疾病或病症是炎性肠病(ibd)。在一些情况下,ibd包括克罗恩病(例如回肠结肠炎/回盲部克罗恩病,回肠炎,胃十二指肠克罗恩病,空肠油膜炎或克罗恩肉芽肿性结肠炎),溃疡性结肠炎,不确定结肠炎,显微镜下结肠炎或转移性结肠炎。在某些情况下,疾病或病症是克罗恩病。在某些情况下,疾病或病症是溃疡性结肠炎。
[0147]
在一些实施方案中,每天向受试者施用约120mg,250mg,360mg,720mg,750mg,1000mg或1500mg的17
‑
hpc。在一些情况下,每天向受试者施用约120mg,360mg或720mg的17
‑
hpc。在一些情况下,每天向受试者施用约360mg的17
‑
hpc。在一些情况下,每天向受试者施
用约720mg的17
‑
hpc。
[0148]
在一些情况下,每天向受试者施用约6mg/kg至约12mg/kg的17
‑
hpc。在一些情况下,每天向受试者施用约6mg/kg的17
‑
hpc。在某些情况下,每天给受试者施用约12mg/kg的17
‑
hpc
[0149]
在一些情况下,将组合物,溶液或软明胶胶囊给予受试者至少1个月,2个月,3个月,4个月,5个月,6个月,1年,1.5年,2年,或更多。
[0150]
在一些情况下,施用组合物,溶液或软明胶胶囊后的受试者的血液水平(cmax)为约0ng/ml至约900ng/ml,约10ng/ml至约900ng/ml,约10ng/ml至约800ng/ml,约10ng/ml至约700ng/ml,约10ng/ml至约500ng/ml,从约50ng/ml至约900ng/ml,从约100ng/ml至约900ng/ml,或从约200ng/ml至约900ng/ml。在一些情况下,血液水平(c max)在单次施用高达或约750mg的17
‑
hpc后达到。
[0151]
在一些实施方案中,该方法还包括向受试者施用额外的治疗剂。在一些情况下,额外的治疗剂是糖皮质激素。在某些情况下,额外治疗剂选自氢化可的松,醋酸可的松,地塞米松,泼尼松,泼尼松龙,甲基强的松龙,倍他米松,曲安奈德,倍氯米松(也称为二丙酸倍氯米松),参数甲松,氟替卡松,醋酸氟可的松,醋酸脱氧皮质酮,氟泼尼松龙,丙酸氟替卡松,布地奈德,氟尼缩松,曲安奈德或其组合。在一些情况下,额外的治疗剂是地塞米松(dex)。在一些情况下,额外的治疗剂是布地奈德(bud)。在一些情况下额外的治疗剂是泼尼松。在一些情况下,额外的治疗剂不包含含有17
‑
hpc的组合物,溶液或软明胶胶囊。
[0152]
在一些情况下,将组合物,溶液或软明胶胶囊和额外的治疗剂同时给予受试者。
[0153]
在其他情况下,将组合物,溶液或软明胶胶囊和额外的治疗剂依次给予受试者。在一些情况下,在施用额外的治疗剂之前将组合物,溶液或软明胶胶囊施用于受试者。在一些情况下,在施用额外的治疗剂后将组合物,溶液或软明胶胶囊施用于受试者。
[0154]
在一些情况下,在施用组合物,溶液或软明胶胶囊之前受试者需禁食。
[0155]
在某些情况下,受试者是人类。
[0156]
给药方案
[0157]
在某些实施方案中,本文公开了一种给药方案,其包括在周期的第1天向受试者施用约15mg至约1500mg的17
‑
α
‑
羟基孕酮己酸酯(17
‑
hpc)的第一日剂量。在一些情况下,第一日剂量包括约15mg至约1000mg,约15mg至约740mg,约15mg至约720mg,约15mg至约360mg,约15mg至约240mg,约15mg至约120mg,约30mg至约1500mg,约30mg至约1000mg,约30mg至约740mg,约30mg至约720mg,约30mg至约360mg,约30mg至约240mg,约30mg至约120mg,约120mg至约1500mg,约120mg至约1000mg,约120mg至约740mg,约120mg至约720mg,约120mg至约360mg,约240mg至约1500mgmg,约240mg至约1000mg,约240mg至约740mg,约240mg至约720mg,约240mg至约360mg,约360mg至约1500mg,约360mg至约1000mg,约360mg至约740mg,或约360mg至约720mg的17
‑
hpc。在一些情况下,第一日剂量包括120mg17
‑
hpc。在一些情况下,第一日剂量包括360mg 17
‑
hpc。在一些情况下,第一日剂量包括720mg 17
‑
hpc。
[0158]
在一些情况下,第一日剂量包括约120mg至约1500mg,约120mg至约1000mg,约120mg至约360mg,约240mg至约720mg,约240mg至约1500mg,约240mg至约1000mg,约240mg至约720mg,约240mg至约360mg,约360mgmg至约1500mg,约360mg至约1000mg,或约360mg至约720mg的17
‑
hpc。在一些情况下,第一日剂量包括120mg 17
‑
hpc。在一些情况下,第一日剂量
包括360mg 17
‑
hpc。在一些情况下,第一日剂量包括720mg 17
‑
hpc。在一些情况下,向人类受试者施用约120mg至约1500mg的第一日剂量。在一些情况下,将约120mg至约1500mg的第一日剂量给予18岁或18岁以上的人受试者。在一些情况下,将约120mg至约1500mg的第一日剂量给予相当于18岁或18岁以上的人受试者的年龄的受试者。
[0159]
在一些情况下,第一日剂量包括约15mg至约740mg,约15mg至约720mg,约15mg至约360mg,约15mg至约240mg,约15mg至约120mg,约15mg至约100mg,约30mg至约740mg,约30mg至约720mg,从约30mg至约360mg,约30mg至约240mg,约30mg至约120mg,约30mg至约100mg,约60mg至约740mg,约60mg至约720mg,约60mg至约360mg,约60mg至约240mg,约60mg至约120mg,约120mg至约740mg,从约120mg至约720mg,约120mg至约360mg,约120mg至约240mg,约240mg至约740mg,约240mg至约720mg,约240mg至约360mg,约30m6g至约740mg,或约360mg至约720mg 17
‑
hpc。在一些情况下,第一日剂量包括15mg的17
‑
hpc。在一些情况下,第一日剂量包括30mg 17
‑
hpc。在一些情况下,第一日剂量包括120mg 17
‑
hpc。在一些情况下,第一日剂量包括240mg 17
‑
hpc。在一些情况下,第一日剂量包括360mg17
‑
hpc。在一些情况下,第一日剂量包括720mg 17
‑
hpc。在一些情况下,将约15mg至约740mg的第一日剂量给予人受试者。在一些情况下,将约15mg至约740mg的第一日剂量给予17岁或更小的人受试者。在一些情况下,将约15mg至约740mg的第一日剂量给予与17岁或更小的人受试者年龄相当的受试者。
[0160]
在一些实施方案中,给药方案还包括一个或多个额外的每日剂量的17
‑
hpc。在一些情况下,17
‑
hpc的一种或多种额外日剂量中的每一种包含约15mg至约1500mg,约15mg至约1000mg,约15mg至约740mg,约15mg至约15mg的范围。约720mg,约15mg至约360mg,约15mg至约240mg,约15mg至约120mg,从约30mg至约1500mg,约30mg至约1000mg,约30mg至约740mg,约30mg至约720mg,约30mg至约360mg,约30mg至约30mg至约240mg,约30mg至约120mg,约120mg至约1500mg,约120mg至约1000mg,约120mg至约740mg,从约120mg至约720mg,约120mg至约360mg,约240mg至约1500mg,约240mg至约1000mg,约240mg至约740mg,约240mg至约720mg,约240mg至约360mg,约360mg至约1500mg,约360mg至约1000mg,约360mg至约740mg,或约360mg至约720mg 17
‑
hpc。在一些情况下,17
‑
hpc的一种或多种额外日剂量中的每一种包括约120mg至约1500mg,约120mg至约1000mg,约120mg至约360mg的范围,约240mg至约720mg,约240mg至约1500mg,约240mg至约1000mg,约240mg至约720mg,从约240mg至约360mg,约360mg至约1500mg,约360mg至约1000mg,或约360mg至约720mg 17
‑
hpc。在一些情况下,17
‑
hpc的一个或多个额外日剂量中的每一个包括约15mg至约740mg,约15mg至约720mg,约15mg至约360mg,约15mg至约240mg,约15mg至约120mg,约15mg至约100mg,约30mg至约740mg,从约30mg至约720mg,约30mg至约360mg,约30mg至约240mg,约30mg至约120mg,约30mg至约100mg,约60mg至约60mg至约740mg,约60mg至约720mg,约60mg至约360mg,约60mg至约240mg,约60mg至约120mg,从约120mg至约740mg,约120mg至约720mg,约120mg至约360mg,约120mg至约240mg,约240mg至约740mg,约240mg至约720mg,约240mg至约360mg,约30m6g至约740mg,或约360mg至约720mg 17
‑
hpc。在一些情况下,17
‑
hpc的一个或多个额外日剂量中的每一个包括约120mg至约1500mg,约120mg至约1000mg,约120mg至约720mg,约120mg至约360mg,约240mg至约720mg,约240mg至约360mg,或约360mg至约720mg的17
‑
hpc。在一些情况下,一个或多个额外的每日剂量中的每一个包含120mg的17
‑
hpc。在一些情况
下,一个或多个额外的每日剂量中的每一个包含360mg的17
‑
hpc。在一些情况下,一个或多个额外的每日剂量中的每一个包含720mg的17
‑
hpc。
[0161]
在一些实施方案中,给药方案包括约6mg/kg至约12mg/kg的17
‑
hpc的第一日剂量。在某些情况下,第一次每日剂量约为6mg/kg的17
‑
hpc。在某些情况下,第一次每日剂量约为12mg/kg的17
‑
hpc。
[0162]
在一些实施方案中,给药方案还包括一个或多个额外的每日剂量的17
‑
hpc,其中一个或多个额外的每日剂量的17
‑
hpc为约6mg/kg至约12mg/kg。在一些情况下,17
‑
hpc的一个或多个额外日剂量为约6mg/kg。在某些情况下,17
‑
hpc的一个或多个额外日剂量约为12mg/kg。
[0163]
在一些实施方案中,给药方案的周期为约7至约30天,任选地为7,14,21,28或30天周期。在某些情况下,给药方案的周期约为7天。在一些情况下,给药方案的周期约为14天。在某些情况下,给药方案的周期约为21天。在一些情况下,给药方案的周期约为28天。在一些情况下,给药方案的周期约为30天。
[0164]
在一些实施方案中,给药方案的周期是7天周期,并且该方案包括在第1天施用的第一日剂量和在从周期的第5天至第7天选择的一天施用的第二日剂量。在某些情况下,第二天的剂量在第5天给药。在某些情况下,第二天的剂量是在第6天给药的。在某些情况下,第二天的剂量是在第7天给药的。在一些情况下,每个独立的第一日剂量和第二日剂量包含约120mg至约720mg,约120mg至约360mg,约240mg至约720mg,约240mg至约360mg或约360mg至约720mg的17
‑
hpc。在一些情况下,第一日剂量包括360mg或720mg的17
‑
hpc。在一些情况下,第一次每日剂量包括360mg 17
‑
hpc。在一些情况下,第一日剂量包括720mg 17
‑
hpc。在一些情况下,第二日剂量包括360mg或720mg的17
‑
hpc。在一些情况下,第二日剂量包括360mg 17
‑
hpc。在一些情况下,第二日剂量包括720mg 17
‑
hpc。
[0165]
在一些实施方案中,给药方案的周期是7天周期,并且该方案包括在该周期中给予受试者约5天的约120mg至约720mg的17
‑
hpc的日剂量。在一些情况下,从周期的第1天至第5天向受试者施用日剂量。在一些情况下,每种日剂量包含约120mg至约720mg,约120mg至约360mg,约240mg至约720mg,约240mg至约360mg,或约360mg至约720mg的17
‑
hpc。在一些情况下,每日剂量包括360mg的17
‑
hpc。在一些情况下,每日剂量包括720mg 17
‑
hpc。
[0166]
在一些实施方案中,给药方案的周期是7天周期,并且该方案包括在该周期中给予受试者约6天的约120mg至约720mg的17
‑
hpc的日剂量。在一些情况下,从周期的第1天至第6天向受试者施用日剂量。在一些情况下,每种日剂量包含约120mg至约720mg,约120mg至约360mg,约240mg至约720mg,约240mg至约360mg,或约360mg至约720mg的17
‑
hpc。在一些情况下,每日剂量包括360mg的17
‑
hpc。在一些情况下,每日剂量包括720mg 17
‑
hpc。
[0167]
在一些实施方案中,给药方案的周期是7天周期,并且该方案包括从第1天开始每12小时向受试者施用约120mg至约720mg的17
‑
hpc约5至约6天在周期中。在一些情况下,该方案包括每12小时向受试者施用约120mg的17
‑
hpc。在一些情况下,该方案包括每12小时向受试者施用约360mg的17
‑
hpc。在一些情况下,该方案包括每12小时向受试者施用约720mg的17
‑
hpc。在一些情况下,该方案包括在该周期中每12小时施用17
‑
hpc约5天。在一些情况下,该方案包括在该周期中每12小时施用17
‑
hpc约5.5天。在一些情况下,该方案包括在该周期中每12小时施用17
‑
hpc约6天。
[0168]
在一些实施方案中,给药方案还包括向受试者施用额外的治疗剂。在一些情况下,额外的治疗剂是糖皮质激素。在某些情况下,其他治疗剂选自氢化可的松,醋酸可的松,地塞米松,泼尼松,泼尼松龙,甲基强的松龙,倍他米松,曲安奈德,倍氯米松,参数松,氟替卡松,醋酸氟可的松,醋酸脱氧皮质酮,氟泼尼松龙,丙酸氟替卡松,布地奈德,二丙酸倍氯米松,氟尼缩松,曲安奈德或其组合。在一些情况下,额外的治疗剂是地塞米松(dex)。在一些情况下,地塞米松以每天约3mg或更高的剂量给予受试者。在一些情况下,地塞米松以每天约6mg的剂量给予受试者。在一些情况下,额外的治疗剂是布地奈德(bud)。在某些情况下,额外的治疗剂是泼尼松。
[0169]
生产工具及物品
[0170]
在某些实施例中,本文公开了一种试剂盒或制造物品,其包含含有17
‑
hpc的组合物或包含含有17
‑
hpc的液体填充物的软明胶胶囊。
[0171]
在一些实施方案中,试剂盒或产品还包括被分隔以接收一个或多个容器(例如小瓶,试管等)的载体,包装或容器,每个容器包含一个或多个单独的要用于本文所述方法的要素。合适的容器包括例如瓶子,小瓶,注射器和试管。在一个实施方案中,容器由各种材料如玻璃或塑料形成。
[0172]
本文提供的制造物品含有包装材料。药物包装材料的实例包括但不限于泡罩包装,瓶子,管子,袋子,容器,瓶子和适用于所选制剂和预期给药和处理模式的任何包装材料。
[0173]
套件通常包括列出内容和/或使用说明的标签,以及带有使用说明的包装插页。通常还会包含一组说明。
[0174]
实施例
[0175]
这些示例仅用于说明目的,而不是限制本文提供的权利要求的范围。
[0176]
实施例1
‑
17
‑
hpc在烟雾暴露诱导的copd大鼠中的药效学研究
[0177]
为了检测17
‑
hpc吸入在慢性阻塞性肺病(copd)大鼠中的体外和体内功效,通过将wistar大鼠每天暴露于cs 1小时建立copd大鼠模型,总共180天,用雾化吸入方式给药。将72只wistar大鼠随机分为空白对照组,模型组,17
‑
hpc(0.5mg/ml,0.25mg/ml和0.1mg/ml)组,bud(0.5mg/ml和0.1mg/ml)组,和联合治疗(0.5mg/ml bud+0.25mg/ml 17
‑
hpc和0.1mg/ml bud+0.25mg/ml 17
‑
hpc)组。药物浓度是雾化溶液浓度。使用小动物肺活量计测量大鼠的肺功能(用力肺活量),并在显微镜下测定balf中的差异计数。通过elisa测量血清和balf细胞因子(il
‑
6,il
‑
17,tnf
‑
α和il
‑
β)水平。he染色法测定大鼠肺组织炎性细胞浸润面积和mli。
[0178]
cs暴露24周后,使用小动物肺活量计测量大鼠的肺功能。cs暴露大鼠(67.4
±
4.20%)fev0.2/fvc(200ms)低于正常大鼠(79.2
±
1.79%)(p<0.01),表明该模型已成功构建。与模型组相比,17
‑
hpc以剂量依赖性方式改善fev0.2/fvc%。bud组fev0.2/fvc%高于模型组。17
‑
hpc+bud组的fev0.2/fvc%也高于模型组,但疗效并不优于单独的17
‑
hpc或单独的bud。
[0179]
长期定期cs暴露导致大鼠balf中炎性细胞数量增加。相比之下,17
‑
hpc,bud和17
‑
hpc+bud均降低了大鼠balf bud中嗜中性粒细胞的百分比,在降低等效剂量的balf嗜中性粒细胞比例方面优于17
‑
hpc。高剂量bud的功效相当于高剂量dbu+17
‑
hpc的功效。然而,低
剂量bud+17
‑
hpc的功效优于单独的低剂量bud或单独的17
‑
hpc。
[0180]
除低剂量(0.1mg/ml)17
‑
hpc组外,不同剂量的17
‑
hpc和bud可下调balf中tnf
‑
α,il
‑
1β,il
‑
6和il
‑
17的水平。治疗组血清tnf
‑
α,il
‑
1β,il
‑
6和il
‑
17水平也呈剂量依赖性下调。
[0181]
肺组织切片的he染色显示模型大鼠中的炎性细胞浸润,其在17
‑
hpc组中减弱。高剂量17
‑
hpc可拮抗copd大鼠肺组织炎性细胞浸润,病理特征与正常大鼠相似。17
‑
hpc的功效与等效剂量的bud和联合治疗的功效相似。除0.1mg/ml 17
‑
hpc组外,其他17
‑
hpc组和bud组的mli以剂量依赖性方式降低。高剂量bud的功效相当于高剂量bud+17
‑
hpc的功效。然而,低剂量bud+17
‑
hpc的功效优于单独的低剂量bud或单独的17
‑
hpc。
[0182]
在24周时,对照动物的体重继续增加,而5mg/ml bud抑制体重增加并且低于模型组。17
‑
hpc组的体重增加抑制率低于相同剂量的bud组。17
‑
hpc组和模型组之间的体重增加没有差异。联合治疗组的体重变化与单独bud组相似。
[0183]
实施例2
‑
大鼠七天雾化吸入毒性研究
[0184]
在glp条件下进行大鼠7天吸入毒性研究。在该研究中,连续7天以8,24和72mg/kg/天向sprague
‑
dawley大鼠(10/性别/组)施用气雾化的17
‑
hpc。对照组大鼠给予雾化载体。每天观察动物的临床体征。在预测试时记录体重和食物消耗,然后在第1,4和7天记录。为了评估17
‑
hpc治疗的可逆性,卫星大鼠组(5/性别/组)通过以72mg/kg/天吸入给药7天,然后在第14天处死。除卫星组中的大鼠外,所有动物在第8天处死。在研究结束时进行血液学和生物化学检查。进行器官重量,总体病理学和组织病理学评估。
[0185]
本实验的初步结果显示,8mg/kg/天组未观察到任何临床症状和体重变化。以8mg/kg/天的剂量,用溶媒和17
‑
hpc治疗的动物的血液学和生化参数具有可比性。器官重量、尸检和组织病理学均无明显变化。经过7天的恢复期,卫星组动物均未出现明显的病理改变。在提交本临床前文件之前,尚未完成24和72mg/kg/天组动物组织的组织病理学检查。
[0186]
根据本研究的初步结果,以8mg/kg/天(48mg/m2/天)的浓度吸入17
‑
hpc被确定为未观察到的不良反应水平(noael)。拟议的临床研究是单剂量吸入研究,起始剂量为300μg,根据50kg/人的体重,约为6μg/kg/天(222μg/m2/天)。因此,在这项吸入研究中产生的noael大约是基于体表面积的临床初始建议剂量的216倍。
[0187]
实施例3
‑
母狗口服pr2005配方的pk分析报告
[0188]
本研究测定了试验药物pr2005在犬体内口服后在不同配方中的药代动力学参数。这项研究进一步确定了试验药物pr2005在每种配方中的相对生物利用度,与肌肉注射溶液进行比较。
[0189]
pk分析方法:
[0190]
估计pk参数,包括最大血药浓度(cmax)、达到cmax的时间(tmax)、吸收过程的时间延迟(tlag)、从时间0到最后一个可量化数据点(auclast)的血药浓度
‑
时间曲线下的面积(aucinf),血浆半衰期(t1/2)、表观血浆清除率(cl/f)、表观分布体积(vz/f)。所有这些参数都是用标准的非隔离分析方法计算出来的。报告了大多数pk参数的几何平均值和cv%,并报告了tmax和tlag的中值和范围。对pheonix winnonlin 8.1(certara usa,inc.)的血浆pr2005 pk数据进行分析。
[0191]
利用线性混合效应模型分析aucinf的对数转换值。每个治疗组的最小二乘平均值
(lsm)和成对差异平均值的90%置信区间(ci)使用该模型进行估计。从对数标度反变换后,计算几何lsm和平均值比率的90%置信区间。相对生物利用度(fr%)计算为受试制剂和im溶液的剂量标准化几何最小二乘均值(lsm)之比:
[0192][0193]
配方:
[0194]
pr2005 250毫克肌肉注射剂:250毫克17
‑
hpc,28.6%v/v蓖麻油(cas 8001
‑
79
‑
4),46%v/v苯甲酸苄酯(cas 120
‑
51
‑
4)和2%v/v苯甲醇。
[0195]
pr2005 250mg口服(胶囊粉末):20%w/w 17
‑
hpc和80%w/w甘露醇。17
‑
hpc的粒径约为2~10μm。
[0196]
pr2005 250mg悬浮液1:
[0197]
30%w/w 17
‑
hpc和70%蓖麻油v/v(cas号8001
‑
79
‑
4)。17
‑
hpc的粒径约为5~30μm。
[0198]
pr2005 250mg和750mg溶液3:
[0199]
30%w/w 17
‑
hpc、63%w/w苯甲酸苄酯(cas号120
‑
51
‑
4)和7%w/w蓖麻油酸聚乙二醇甘油酯(cas号61791
‑
12
‑
6)。
[0200]
pr2005 250mg溶液5:
[0201]
30%w/w 17
‑
hpc、63%w/w苯甲酸苄酯(cas号120
‑
51
‑
4)和7%w/w聚山梨酯80(cas号9005
‑
65
‑
6)。
[0202]
结果:
[0203]
图2至图6显示了注射和口服各种制剂后的pr2005(羟孕酮)血浆浓度
‑
时间曲线。表4至表11汇总了每种配方中pr2005给药后的pk参数估计值。
[0204]
在给狗单次注射250mg im后,pr2005在所有计划采样点(直到168小时的最后一次采集时间点)的血浆中是可定量的(图2)。如表4所示,三只狗在给药后48小时出现tmax。半衰期(t1/2)为48.38小时。血浆表观清除率(cl/f,35.68l/hr)低至中等,表观分布容积(vz/f,2485l)较大。大多数pk参数(包括cmax和aucinf)的变异性很低(<10%)。这些羟孕酮的pk特征与im输注后人类的pk特征一致。
[0205]
施用单剂量250毫克pr2005口服胶囊粉、混悬液#1和溶液#5后,在pk曲线和大多数pk参数估计值中观察到很大的变异性。口服这些制剂后的吸收在接受相同口服制剂的动物中似乎不一致。tmax在给药后0.5至12小时范围内。末次半衰期(t1/2<5h)较im输注后短。与im输液相比,三种口服制剂的相对生物利用度的几何lsm均小于2%。
[0206]
口服250毫克pr2005口服溶液#3后,在pk曲线图和大多数pk参数估计值中观察到中度变异。cmax的几何平均值为69.21μg/l,与250mg静脉滴注后的几何平均值相当。tmax发生在0.5到4小时之间。tlag范围为0至0.25,表明给药后吸收延迟非常有限。与im输液相比,含有250mg pr2005的溶液#3的相对生物利用度的几何lsm估计约为3%。
[0207]
单次口服750毫克pr2005溶液#3后,在pk曲线图和大多数pk参数估计值中观察到中度到低变异性。tmax发生在1到4小时。在狗中没有观察到吸收延迟(tlag=0)。与平均给药剂量(16g/inf)相比,pr/inf的平均剂量为118.04μg/inf。表观cl/f的几何平均值为449.58l/hr,小于相同剂型pr2005给药后的几何平均值。结果表明,口服pr2005溶液#3后,
在吸收和/或消除过程中可能出现非线性。然而,由于观察到口服溶液#3的pk变异性,这一发现具有不确定性。文献研究表明,羟孕酮是abcb1外排转运体的底物(e.g.bloise,e.,et al.,“atp
‑
binding cassette transporters in reproduction:a new frontier,”hum repro update,22(2):164
‑
181,2016).因此,肠道和/或肝脏外排转运体的饱和可能导致口服pr2005后羟孕酮pk的复杂性。与im溶液相比,含750mg的#3溶液相对生物利用度的几何lsm为7.92%。该值大于含有250mg的溶液#3的数值,但无统计学意义。
[0208]
与im输液相比,250mg pr2005口服粉末胶囊、混悬液#1和溶液#5的相对生物利用度小于2%。溶液#3的相对生物利用度高于其他三种受试制剂。
[0209]
表4狗肌肉注射250mg后血浆pr2005的pk参数估计
[0210][0211]
*表示为中值和范围
[0212]
表5狗口服prmg粉末后血浆pr2005的pk参数估计值
[0213][0214]
*表示为中值和范围
[0215]
表6狗口服250mg(混悬液1)后血浆pr2005 pk参数估计
[0216][0217]
*表示为中值和范围
[0218]
由于所有浓度均为blq,因此排除了dog#4760和dog#4761。合格下限(lloq)为1.00ng/ml。
[0219]
表7狗口服250mg或250mg(溶液3)后血浆pr2005 pk参数估计
[0220][0221][0222]
*表示为中值和范围
[0223]
表8狗口服750mg(溶液3)后血浆pr2005 pk参数估计
[0224][0225]
*表示为中值和范围
[0226]
表9狗口服250mg(溶液5)后血浆pr2005 pk参数估计
[0227][0228][0229]
*表示为中值和范围
[0230]
表10不同pr2005制剂在犬体内的相对生物利用度
[0231][0232]
a表示几何lsm,b表示剂量标准化几何lsm比率(90%ci)
[0233]
表11a血液水平:不同pr2005配方的药峰浓度平均值和99%置信区间
[0234][0235]
表11b血液水平:不同pr2005配方的auc平均值和99%置信区间
[0236][0237]
99%置信区间是指99%置信区间。
[0238]
研究表明,17
‑
hpc作为口服制剂即使在大剂量环境下也能提供低生物利用度。为了达到发挥治疗效果的生物利用度水平,研究表明使用肌内注射。出乎意料的是,本发明人在表11a和11b中显示,与肌内注射和其他测试制剂相比,溶液#3(例如,750mg剂量)提供更高水平的生物利用度。如表11a所示,750mg剂量的溶液#3的血液水平(cmax,或药物给药后体内达到的药物的峰值血清浓度)约为353μg/l.这高于肌肉注射(~58.1μg/l)和其他测试制剂的血液水平(cmax值)。类似地,如表11b所示,与其他测试制剂相比,溶液#3的auc(或在施用一剂药物后实际暴露于药物)也更高。。
[0239]
实施例4 17
‑
hpc液体填充软胶囊的单剂量pk,1期研究
[0240]
题目:羟孕酮己酸酯液体填充软胶囊的单剂量药代动力学。第一阶段研究1
[0241]
目的:测试3个剂量水平的剂量比例
[0242]
配方:立即释放软胶囊120mg 17
‑
hpc/胶囊,其中装有实施例3中所述的溶液3
[0243]
研究设计:随机三向交叉
[0244]
表12说明了该研究的细节
[0245]
表12
[0246][0247][0248]
实施例5 17
‑
hpc液体填充软胶囊的多剂量pk,1期研究
[0249]
题目:羟孕酮己酸酯液体填充软胶囊的多剂量药代动力学。第一阶段研究2
[0250]
目的:确定可能剂量方案的多剂量动力学
[0251]
配方:立即释放软胶囊120mg 17
‑
hpc/软胶囊,其中装有实施例3中所述的溶液3
[0252]
研究设计:单臂,单一治疗
[0253]
表13说明了该研究的细节
[0254]
表13
[0255][0256]
[0257][0258]
实施例6 17
‑
hpc液体填充软胶囊的单剂量pk,1期研究
[0259]
题目:羟孕酮己酸酯液体填充胶囊的单剂量药代动力学。第一阶段研究3
[0260]
目的:确定17
‑
hpc液体填充软胶囊的食物效应
[0261]
配方:立即释放软胶囊120mg 17
‑
hpc/软胶囊,其中装有实施例3中所述的溶液3
[0262]
研究设计:随机三向交叉
[0263]
表14说明了该研究的细节
[0264]
表14
[0265]
[0266][0267]
实施例7
‑
用于治疗隐源性机化性肺炎的2期研究
[0268]
表15说明了该研究的细节
[0269]
表15
[0270]
[0271]
[0272][0273]
等价物
[0274]
除非另有定义,否则本文使用的所有技术和科学术语具有与本技术所属领域的普通技术人员通常理解的相同的含义。
[0275]
在不存在未在本文中具体披露的任何一个或多个元素、限制或限制的情况下,可适当地实施本文所说明的本技术。因此,例如,术语“包括”、“包括”、“包含”等应扩展阅读而不受限制。此外,本文所使用的术语和表达已被用作描述的术语,而非限制性术语和表达,且使用该等术语和表达无意排除所示和描述的特征或其部分的任何等价物,但公认在范围内可以进行各种修改所要求保护的现有技术。
[0276]
因此,应当理解,此处提供的材料、方法和示例代表优选方面,是示例性的,并非旨在限制本技术的范围。
[0277]
本文已经广泛且一般地描述了本技术。属于通用公开的每个较窄物种和亚通用群体也构成本技术的一部分。这包括对本技术的一般描述,附带或否定限制从该属中去除任何主题,而不管切除的材料是否在本文中具体列举。
[0278]
此外,如果根据markush群来描述本技术的特征或方面,则本领域技术人员将认识到,因此本技术也以markush组成员的任何单个成员或子组来描述。
[0279]
本文中提及的所有出版物、专利申请、专利和其他参考文献均以引用方式明确并
入整体,其程度与通过引用单独并入的程度相同。如有冲突,以本规范(包括定义)为准。
[0280]
其他方面在以下权利要求中陈述。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1