一种3D打印的人工骨膜、人工骨、人工骨骼及其制备方法与流程
一种3d打印的人工骨膜、人工骨、人工骨骼及其制备方法
技术领域
1.本发明属于医学材料技术领域,具体涉及一种3d打印人工骨和骨膜修复材料及其制备方法。
背景技术:
2.近年来,由于交通运输业、采矿业、建筑业的快速发展,造成的高能量骨骼损伤。临床上先天性疾病、感染疾病、肿瘤、外科手术等造成的骨骼异常和骨骼损伤也十分常见。骨骼主要由骨膜和骨两部分组成,估计我国每年有1200万骨科病例需要植骨或骨膜。在骨骼缺损填充医用材料领域,长期以来,自体骨、自体骨膜和异体骨是临床上治疗骨骼缺损的常用植骨材料。尽管自体骨移植存在来源有限和造成供骨区的多种并发症问题,但因其具有骨诱导又兼有骨遗传功能,一直以来被作为骨缺损治疗的“金标准”;异体骨片尚不能完全克服移植后的免疫排斥反应,有潜在的病源传播危险,同时存在医学伦理学方面的障碍。
3.为了克服其移植所带来的问题,人工骨材料的使用一直备受关注,欧美国家近年自体骨和异体骨相比于人工骨材料的使用正趋于明显的下降趋势,例如磷酸钙骨水泥、丙烯酸酯类骨水泥、羟基磷灰石、生物活性玻璃、生物陶瓷、组织工程骨和胶原纤维材料等作为骨缺损的主要治疗手段,已广泛的应用在骨缺损的治疗领域。其中羟基磷灰石(hydroxyapatite,ha)和动物胶原纤维是用于骨组织修复的最重要的一种生物陶瓷,羟基磷灰石(ha)的化学成分与人体硬组织的无机质成分极为相近,化学式为ca(po)(oh)。迄今来自动物解聚的胶原纤维,实际上是胶原蛋白,已失去了胶原纤维天然结构,与人体骨组织的胶原纤维束结构不同。将动物解聚的胶原纤维与ha制备成不同形状和尺寸的人工骨植入人体,可在较短时间内与人体组织形成紧密的生物结合,进而长成一个整体,但未有研究结果证实其生物相容性和生物活性。
4.然而,植入块状ha人工骨修复骨缺损,当其表面缺乏骨膜时,降解速度非常缓慢,并且力学性能不够理想,脆性大,塑形不佳,难以推广使用。其它人工骨及骨膜修复材料也都存在一定的缺陷和问题,如生物相容性、机械强度、生物降解性、骨诱导活性等方面仍然有待提高。
5.目前,引导性骨再生(guided bone regeneration,gbr)技术是将引导组织再生膜材料放置于骨缺损区和软组织之间,利用膜的屏障作用构建利于骨组织生成的相对封闭的环境[1.caball
é‑
serranoj,munar
‑
fraua,ortiz
‑
puigpelato,et al.on thesearch of the ideal barrier membrane for guided bone regeneration[j].j.clin expdent,2018,10(5):e477
‑
e483.2.elgalii,turria,xiaw,et al.guided boneregeneration using resorbable membrane and different bone substitutes:earlyhistological and molecular events[j].acta biomater,2016,29:409
‑
423.],以实现骨缺损区的骨再生,其广泛应用于颌面骨缺损的修复再生。改性的猪胶原蛋白膜因其较好的生物相容性、合适的降解速率等优势可以满足组织再生的要求而被广泛应用于临床。但猪胶原蛋白膜存在以下不足:此类材料植入宿主后吸收时间长,一般为5
‑
8个月,常导致周围纤维化、慢性炎性
反应,骨再生效果不佳。
[0006]
骨膜作为软组织薄膜覆盖在骨皮质表面,承担着皮质骨70
‑
80%的血供营养,在骨的形成和再生中扮演着关键性的作用。骨膜是被覆在除关节以外几乎所有骨表面上的致密结缔组织膜,由外部的纤维层和内部的形成层组成,在骨发育和骨折愈合中发挥着重要的作用.纤维层含有成纤维细胞、胶原纤维和弹性纤维,神经和微血管网络,提供骨膜的机械稳定性。形成层则储存大量不同类型的细胞,为骨形成和修复提供细胞来源。人工骨膜可为骨缺损修补部位提供有利于成纤维细胞长入,由此演生新骨膜组织的胶原纤维支架,具有很好的组织相容性和可降解性,能加快骨缺损修复,促进人工骨的降解和骨重建,同时也减少了邻近组织之间形成瘢痕组织。动物实验和临床实践均已证明去除骨膜将导致新骨形成和新血管生成减少,从而影响骨缺损的修复和重建。
[0007]
由于骨膜是机体成骨再生修复过程中极其关键的因素,因此人工骨膜材料的制备和应用逐渐受到许多外科医生和研究者的重视。但研发出完全模拟天然骨膜超微3d网状结构、生物组分及生物力学性能的人工骨膜材料仍未被攻克。猪胶原纤维蛋白作为骨膜材料,抗拉强度低,韧性差,生物相容性较差,难以直接用于人体。
[0008]
3d打印技术作为一种快速增材制造技术,能够减少资源的浪费,最大程度地满足个性化快速生产的需要,被广泛地应用在生物医疗、航空航天、教育教学、建筑生活等领域。fdm打印机具有操作简单、成本低廉、材料相容性广的特点具有可快速大面积推广应用的潜力。
[0009]
2013年初,欧洲的医生利用3d打印定制出一个人造下颚骨以替换病人的受损骨骼,使病人得以成功康复。与此同时,德国的研究人员正在采用3d打印技术制造具有生物相容性的人造血管。牛津性能材料公司制备的头骨植入物已经在 2013年2月18日获得美国食物和药物管理局(fda)的批准,并成功地帮助一位病人替换了75%的头骨,其所用原材料为不可降解的聚醚酮材料。
[0010]
上述案例所使用的原材料和天然骨存在区别,3d打印的产品仅从形状等宏观结构上与患者匹配,而成分和微结构上与人天然骨不同。近日韩国李红大学的研究团队研究出一种新的可生物降解材料用于3d打印面部植入物,并在植入之后促进组织再生,其采用的是聚己内酯制成的医疗聚合物,其生物相容性存在争议。目前,市场上人工骨骼主要以羟基磷灰石(ha)复合的生物材料多是以ha/ 胶原、ha/tcp(β
‑
tcp)、ha/pla、镁
‑
羟基磷灰石/聚乳酸等的以压缩成型或者冷冻干燥成型为主的方式,无人工骨膜结构,直接进行骨缺损的修复。各种骨骼缺损修复材料都因缺乏一种优良生物相容性的人工骨膜覆盖,使植入的人工骨在短时间内难以与肉芽组织和骨形成紧密的生物结合。
[0011]
一种公知的胶原蛋白/羟基磷灰石人工骨的制备方法和多孔胶原纤维复合纳米羟基磷灰石人工骨的制备方法中,采用冷冻干燥的方法进行骨修复材料成型的制备,此种方法不利于制备孔隙结构可控的植入体模型,不能够满足快速制备个性化骨植入体的特点。
[0012]
由化脓性中耳炎、外伤等原因导致的鼓膜穿孔临床常见,由于经久不愈可增加中耳反复感染的机会、导致传导性耳聋甚至胆脂瘤形成,给患者的工作和生活带来很多困扰,因此需要外科手术进行干预。术中鼓膜的修补通常由移植物完成,选择合适的移植材料对手术成功率及术后听力恢复起着至关重要的作用。理想的移植物要求鼓膜愈合后有接近正常鼓膜的三层组织结构,以确保良好的抗张性对抗中耳负压,防止新生鼓膜发生内陷和粘
连,同时要有良好的振动性和传声功能,但目前的自体材料和人工材料都很难达到上述要求。目前临床最常使用的鼓膜修补材料是自体颞肌筋膜,成功率较高,但有筋膜遇水或血液容易挛缩变形,术中铺放和固定存在一定难度;鼓室内需要使用明胶海绵支撑,术后容易发生内陷、粘连、再穿孔、继发胆脂瘤形成等并发症;仅提供上皮移行的支架,不能加厚鼓膜,无法对抗中耳负压;成形大的鼓膜穿孔时中央部位血运差,容易再穿孔,因此临床普遍认为颞肌筋膜是治疗鼓室粘膜正常、通气良好的鼓膜小穿孔或中等大小穿孔的最佳选择,而对于咽鼓管功能障碍、粘连性中耳炎、鼓室硬化、鼓膜大穿孔等患者时,术后鼓膜再穿孔、粘连、胆脂瘤形成等的发生率较高。目前已经报道的其他软性自体移植材料和组织工程材料也具有类似的缺陷,因此无法满足临床的全部需要。
[0013]
针对上述情况,1967年goodhill首次提出使用自体软骨
‑
软骨膜复合物作为鼓膜移植材料,经过50多年的临床应用,发现该复合物具有抗感染能力强、保留的软骨膜可以加速与鼓膜残缘的愈合、具有一定的硬度和弹性等特点,可以增加鼓膜修补手术的成功率,目前在临床上已经开始得到比较广泛的应用,但软骨
‑
软骨膜具有一些自身的缺陷,使其应用也受到一定的限制。首先是手术经常使用的耳屏软骨多不平整,铺放至移植床后容易发生边缘上翘或下陷,使其脱离外耳道鼓膜瓣,导致术后穿孔愈合不良,其次是研究发现薄层软骨比全厚软骨和颞肌筋膜具有更高的穿孔愈合率,厚度小于或等于0.5mm的软骨具有更好地维持机械稳定性和声音传导之间的平衡,中国人耳屏软骨的厚度男性和女性分别为0.8
‑
1.16mm、 0.85
‑
1.02mm,这就要求术中对取出的耳屏软骨进行修剪,但术中制备和铺放薄层软骨会延长手术时间,增加感染等并发症的风险,而且软骨切削越薄越卷曲,更增加了移植物移位和术后再穿孔的风险,如果能使用人工材料模拟软骨
‑
软骨膜移植物结构将有助于克服上述缺点,提高鼓膜修补手术成功率。
[0014]
综上所述,现有的人工骨技术不能完全满足骨材料的生物相容性和临床应用,采用的载体材料和人体自然骨的成分存在差异,并且人工骨表面缺乏相容性骨膜结构,而且多数材料不能用于3d打印,制作时间长,与患者病患部位不能完全匹配,存在力学强度不足等缺点。
技术实现要素:
[0015]
针对现有技术的上述问题,本发明提供一种3d打印的人工骨膜、人工骨及由两者组成的人工骨骼。人工骨膜和人工骨中均含有纳米级猪交联胶原纤维,经3d 打印的热融挤出过程,已有的胶原纤维结构形成有序的排列,模拟天然骨和骨膜中胶原纤维的结构,具有良好的机械强度、生物相容性和降解性能,可加速骨愈合。
[0016]
为实现上述目的,本发明包括如下技术方案:
[0017]
一种3d打印的人工骨膜,其是以海藻酸钙复合纳米级猪交联胶原纤维为材料,根据患者骨缺损部位所需骨膜的形状经3d打印制成;其中,海藻酸钙与纳米级猪交联胶原纤维的质量比为1∶(1~5)。
[0018]
如上所述的3d打印的人工骨膜,优选地,其是由以下成分制成:纳米级猪交联胶原纤维3~8wt%,乳酸1~3wt%,海藻酸钠1.5~3wt%,纳米级碳酸钙0.5~2 wt%和水余量。
[0019]
另一方面,本发明提供如上所述的3d打印的人工骨膜的制备方法,该方法包括以下步骤:
[0020]
i.按所述比例称取纳米级猪交联胶原纤维和乳酸,在2℃~8℃,将两种原料溶入水中制成溶质总质量浓度为3~10%的混合物a;
[0021]
ii.按所述比例称取海藻酸钠和纳米级碳酸钙,将两种原料溶入水中制成溶质总质量浓度为2.0~4.5%的混合物b;
[0022]
iii.利用3d打印
‑
同轴高压静电液滴发生装置,将混合物a注入芯液管,将混合物b注入壳液管,混合物a与混合物b按照1∶1流量比例,经3d打印
‑
同轴高压静电液滴发生装置喷嘴,在高压静电下形成直径在0.3mm~1.2mm的连续的液滴,液滴落入移动的收集台上,根据患者骨缺损部位所需骨膜的形状设置程序控制收集台和喷头的移动轨迹,液滴迅速凝固成细丝,细丝随收集台和喷头的移动编织成凝胶膜片,获得3d打印的人工骨膜。
[0023]
如上所述的3d打印的人工骨膜的制备方法,优选地,所述步骤iii的直流电压2000~6000v,制成的凝胶膜片厚度为0.2mm~0.8mm。
[0024]
再一方面,本发明提供一种3d打印的人工骨膜,其是采用如上所述的方法制备的。
[0025]
又一方面,本发明提供一种3d打印的人工骨,由以下成分制成:纳米级猪交联胶原纤维,1~6wt%;纳米级羟基磷灰石,3~4wt%和可降解生物级载体材料, 90~96wt%;
[0026]
优选地,所述可降解生物级载体材料选自以下材料:pla、pcl、pga或phb。
[0027]
又一方面,本发明提供如上所述的3d打印的人工骨的制备方法,该方法包括以下步骤:
[0028]
i.按所述比例称取纳米级猪交联胶原纤维、纳米级羟基磷灰石和可降解生物级载体,溶解于有机溶剂中,混合均匀后进行冻干,然后进行固体颗粒的破碎,形成≤2mm粒径的小颗粒,最后利用热熔挤出设备将这些小粒挤出成直径在 0.5mm~2mm的均匀的可供3d打印的线性材料,即为人工骨材料;
[0029]
ii.采用fdm三维打印机,以步骤i制备的人工骨材料为原料,依据患者骨缺损的形状进行打印获得3d打印的人工骨。
[0030]
如上所述的3d打印的人工骨的制备方法,优选地,所述步骤i中热熔挤出设备采用单/双螺杆挤出机,设置三区温度分别为150
‑
160℃,180
‑
200℃,150
‑
160℃进行线材挤出。
[0031]
又一方面,本发明提供一种3d打印的人工骨,其是采用如上所述的方法制备的。
[0032]
又一方面,本发明提供一种3d打印的人工骨骼,其是由如上所述的3d打印的人工骨膜,和权利要求6或9所述的3d打印的人工骨组成。
[0033]
胶原是一种韧性的纤维状大分子蛋白,一般的蛋白酶很难将其降解,其生理性转化也远远低于其它蛋白质,其降解时间约半年,符合骨骼的修复生长周期。未交联的胶原分子呈分散的液态,胶原分子交联后形成纳米级交联胶原纤维,其具有三维立体纤维状结构,类似于天然骨和骨膜中的胶原纤维结构,为骨细胞生长提供支撑和空间。因此,本发明采用纳米级猪交联胶原纤维作为人工骨和人工骨膜的基料。
[0034]
本发明使用的纳米级猪交联胶原纤维,通常是选取猪皮胶原,酸化后酶法切去猪胶原蛋白分子末端三个氨基酸残基,纯化后进行该胶原蛋白分子交联,形成纳米级猪交联胶原纤维。该物质可以商业途径购买。
[0035]
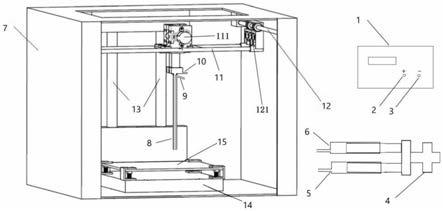
在本发明的优选实施方式中,3d打印
‑
同轴高压静电液滴发生装置包括高压静电发生器1、恒流泵4、同轴液滴喷嘴8和3d打印装置,如图1所示,3d打印装置包括支架7和设于支架上的三维移动组件。三维移动组件包括x轴移动组件11、y轴移动组件12和z轴移动组件
13。同轴液滴喷嘴8固定在x轴移动组件上。z轴移动组件上固定打印托盘15。同轴液滴喷嘴8和打印托盘15通过导线分别与高压静电发生器的阴极3和阳极2联接。同轴液滴喷嘴8由同轴套设的壳液管和芯液管组成。恒流泵4连接壳液注射器5和芯液注射器6。壳液管和芯液管分别与壳液注射器5和芯液注射器6连接。
[0036]
本发明用于3d打印人工骨的3d打印机可以使用各种已有的三维打印机,例如fdm三维打印机。
[0037]
本发明的有益效果在于以下几个方面:
[0038]
1.本发明采用纳米级猪交联胶原纤维为原料制备人工骨和人工骨膜。经交联的胶原纤维具有微观三维网络结构,经3d打印的热融挤出过程,已有的胶原纤维结构形成有序的排列,模拟天然骨和骨膜中的胶原纤维有序结构。猪交联胶原纤维与人骨组织中主要的关键组成部分胶原纤维最相似,聚合分子间具有供骨细胞生长的孔隙空间,能够促进早期矿化,支持新骨的形成,不引发排异反应,且可以生物降解最终被新骨组织替代。
[0039]
2.本发明的人工骨膜以纳米级猪交联胶原纤维、乳酸、海藻酸钠和纳米级碳酸钙为原材料,乳酸、海藻酸钠和纳米级碳酸钙反应生成海藻酸钙凝胶,干燥后形成微观三维网络结构,与交联猪胶原纤维的网络结构相复合,为骨缺损修补部位提供有利于成纤维细胞长入,由此衍生新骨膜组织的胶原纤维支架,具有很好的组织相容性和可降解性,能加快骨缺损修复,促进人工骨的降解和骨重建,减少了邻近组织之间形成瘢痕组织,并显著提高人工骨膜的机械强度和生物相容性。
[0040]
3.本发明的人工骨以纳米级交联胶原纤维为模板,钙磷盐在液相中沉积到交联胶原纤维上得到仿天然骨层片结构。该产品具有采用猪交联胶原纤维基质、大尺寸骨缺损修复、天然骨的微结构和成分三大特点,能够诱导自体骨生长,同时自身缓慢降解,达到骨组织再生,可广泛应用于骨科、口腔科、整形外科等各种骨性缺损。同时,纳米级猪交联胶原纤维与羟基磷灰石混合可显著提高人工骨的机械强度。
[0041]
4.本发明将人工骨及人工骨膜结合形成人工骨骼,用于修补骨缺损能够大大地缩短骨缺损修补愈合的时间。
[0042]
5.本发明采用3d打印的技术能够针对个性化实体进行快速制备,能够满足大批量快速制备的要求。本发明的人工骨和人工骨膜的拉伸模量、拉伸强度、断裂伸长率均符合国家标准。
附图说明
[0043]
图1为3d打印
‑
同轴高压静电液滴发生装置结构图。
[0044]
图2对照组和实验组术后不同时间植入材料病理组织切片图像,
[0045]
2a为对照组右股骨植入术后1月,回收睿膜
tm
材料病理组织切片图像,
[0046]
2b为对照组右股骨植入术后4月,回收睿膜
tm
材料病理组织切片图像,
[0047]
2c为对照组右股骨植入术后6
‑
8月,回收睿膜
tm
材料病理组织切片图像,
[0048]
2d为对照组右股骨植入术后10
‑
12月,回收睿膜
tm
材料病理组织切片图像,
[0049]
2e为实验组骨缺损植入术后12月,左股骨组织切片图像,
[0050]
2f为实验组右股骨植入实施例1的骨骼术后1月,回收骨膜材料病理组织切片图像,
[0051]
2g为实验组右股骨植入实施例1的骨骼术后2月,回收骨膜材料病理组织切片图像,
[0052]
2h为实验组右股骨植入实施例1的骨骼术后4月,回收骨膜材料病理组织切片图像,
[0053]
2i为实验组右股骨植入实施例1的骨骼术后6
‑
8月,回收骨膜材料病理组织切片图像,
[0054]
2j为实验组右股骨植入实施例1的骨骼术后10
‑
12月,回收骨膜材料病理组织切片图像。
[0055]
图3对照组和实验组术后不同时间骨修复组织切片图像,
[0056]
3a为对照组骨缺损植入术后1月,回收右股骨固邦
tm
骨填充修复材料组织切片图像,
[0057]
3b为对照组骨缺损植入术后1月,回收左股骨固邦
tm
骨填充修复材料组织切片图像,
[0058]
3c为对照组骨缺损植入术后4
‑
6月,回收右股骨固邦
tm
骨填充修复材料组织切片图像,
[0059]
3d为对照组骨缺损植入术后8
‑
10月,回收右股骨固邦
tm
骨填充修复材料组织切片图像,
[0060]
3e为实验组右股骨缺损植入实施例1的骨骼术后2月,回收右股骨骨填充修复材料病理组织切片图像,
[0061]
3f为实验组右股骨缺损植入实施例1的骨骼术后4月,回收右股骨骨填充修复材料病理组织切片图像,
[0062]
3g为实验组右股骨缺损植入实施例1的骨骼术后6
‑
8月,回收右股骨骨填充修复材料病理组织切片图像,
[0063]
3h为实验组右股骨缺损植入实施例1的骨骼术后12月,回收右股骨骨填充修复材料病理组织切片图像。
具体实施方式
[0064]
以下实施例中采用的部分原料来源如下∶
[0065]
纳米级猪交联胶原纤维,商标为sunmax
tm
双美,台湾双美生物技术公司生产(中国台湾地区企业);
[0066]
纳米级羟基磷灰石,南京埃普瑞纳米材料有限公司生产。
[0067]
以下各实施例和比较例中使用的3d打印
‑
同轴高压静电液滴发生装置结构如下:
[0068]
如图1所示,3d打印
‑
同轴高压静电液滴发生装置包括高压静电发生器1、恒流泵4、同轴液滴喷嘴8和3d打印装置,如图1所示,3d打印装置包括支架 7和设于支架上的三维移动组件。三维移动组件包括x轴移动组件11、y轴移动组件12和z轴移动组件13。y轴移动组件的轴部水平固定在支架7的侧壁上, x轴移动组件11的轴部两端固定在y轴移动组件的移动部121上。同轴液滴喷嘴8固定在x轴移动组件的移动部111上。z轴移动组件的轴部垂直固定在支架 7的侧壁上,z轴移动组件的移动部为升降平台14,升降平台上具有打印托盘15。同轴液滴喷嘴8和打印托盘15通过导线分别与高压静电发生器1的阴极3和阳极2联接。同轴液
滴喷嘴8由同轴套设的壳液管和芯液管组成。恒流泵4连接壳液注射器5和芯液注射器6。壳液管通过导管9与壳液注射器5连接,芯液管通过导管10与芯液注射器6连接。
[0069]
实施例1
[0070]
1.制备3d打印的人工骨
[0071]
分别采用2g的纳米级猪交联胶原纤维,4g的纳米级羟基磷灰石与94g pla (sigma公司,美国)进行超声分散,加入120ml氯仿,并通过机械搅拌进行混合,混合均匀后,真空冷冻干燥机进行干燥处理。然后采用碎料破碎机破碎,形成≤2mm粒径的小颗粒,最后采用单/双螺杆挤出机设置三区温度分别控为160℃, 190℃,160℃(挤出模具)进行线材的生产制作,挤出成直径在2mm的均匀的可供3d打印的线性材料。对所生产出线材进行性能检测,拉伸强度为29.7mpa,断裂伸长率为6.7%,拉伸模量为984mpa。
[0072]
在实施骨修补手术时,按照患者骨缺损的实际大小及形状,以人工骨线性材料为原料用3d打印机(创想三维cr
‑
3040,深圳市创想三维科技有限公司)打印出骨材。
[0073]
2.制备3d打印的人工骨膜
[0074]
i.按5∶2的质量比称取纳米级猪交联胶原纤维和乳酸,在4℃~8℃,将两种原料溶入水中制成溶质总质量浓度为7%的混合物a;
[0075]
ii.按2∶1的质量比称取海藻酸钠和纳米级碳酸钙,将两种原料溶入水中制成溶质总质量浓度为3%的混合物b;
[0076]
iii.利用3d打印
‑
同轴高压静电液滴发生装置,将混合物a注入芯液管,将混合物b注入壳液管,设定混合物a与混合物b的流量比为1∶1,电压3000v,在高压静电下形成直径在0.4mm的连续的液滴,在液滴收集台上迅速凝固,制成面积40mm
×
40mm、厚度0.4mm矩形凝胶膜片,即为3d打印的人工骨膜材料。
[0077]
获得的人工骨膜的机械性能用万能强力机(instron 4464)进行测试,上下夹距40mm,拉伸速度为6mm/min。人工骨膜断裂强度10.34n,断裂伸长率90.3%。
[0078]
3.人工骨骼
[0079]
在实施骨修补手术时,先将3d打印骨材填入患者骨缺损部位,再贴补适当大于骨缺损面积的3d打印人工骨膜,形成人工骨骼。
[0080]
实施例2
[0081]
1.制备3d打印的人工骨
[0082]
分别采用3g的纳米级猪交联胶原纤维,7g的纳米级羟基磷灰石与90g pla (sigma公司,美国)进行超声分散,加入110ml氯仿,并通过机械搅拌进行混合,混合均匀后,真空冷冻干燥机进行干燥处理。然后采用碎料破碎机破碎,形成≤2mm粒径的小颗粒,最后采用单/双螺杆挤出机设置三区温度分别控为150℃, 200℃,160℃(挤出模具)进行线材的生产制作,挤出成直径在2.0mm的均匀的可供3d打印的线性材料。对所生产出线材,对所生产出线材进行性能检测,拉伸强度为35.2mpa,断裂伸长率为6.9%,拉伸模量为1228mpa。
[0083]
在实施骨修补手术时,按照患者骨缺损的实际大小及形状,以人工骨线性材料为原料用3d打印机打印出骨材。
[0084]
2.制备3d打印的人工骨膜
[0085]
i.按2∶1的质量比称取纳米级猪交联胶原纤维和乳酸,在4℃~8℃,将两种原料溶入水中制成溶质总质量浓度为6%的混合物a;
[0086]
ii.按2∶1的质量比称取海藻酸钠和纳米级碳酸钙,将两种原料溶入水中制成溶质总质量浓度为3%的混合物b;
[0087]
iii.利用3d打印
‑
同轴高压静电液滴发生装置,将混合物a注入芯液管,将混合物b注入壳液管,设定混合物a与混合物b的流量比为1∶1,利用挤出设备经芯液管和壳液管注入同轴高压静电液滴发生装置,设定电压5000v,在高压静电下形成直径在0.5mm的连续的液滴,在液滴收集台上迅速凝固,形成面积 20mm
×
80mm、厚度0.5mm矩形凝胶人工骨膜片。人工骨膜的机械性能用万能强力机(instron 4464)进行测试,上下夹距40mm,拉伸速度为5mm/min。人工骨膜断裂强度11.24n,断裂伸长率91.3%。
[0088]
3.人工骨骼
[0089]
在实施骨修补手术时,先将3d打印骨材填入患者骨缺损部位,表面再贴补适当大于骨缺损面积的3d打印人工骨膜片,形成人工骨骼。简单固定,皮肤缝合,结束手术。
[0090]
实施例3
[0091]
1.制备3d打印的人工骨
[0092]
分别采用1g的纳米级猪交联胶原纤维,2g的纳米级羟基磷灰石与95g pla (sigma公司,美国)进行超声分散,加入110ml氯仿,并通过机械搅拌进行混合,混合均匀后,真空冷冻干燥机进行干燥处理。然后采用碎料破碎机破碎,形成≤2mm粒径的小颗粒,最后采用单/双螺杆挤出机设置三区温度分别控为150℃, 180℃,150℃(挤出模具)进行线材的生产制作,挤出成直径在2mm的均匀的可供3d打印的线性材料。对所生产出线材进行性能检测,拉伸强度为26.3mpa,断裂伸长率为6.6%,拉伸模量为870mpa。
[0093]
在实施骨修补手术时,按照患者骨缺损的实际大小及形状,以人工骨线性材料为原料用3d打印机打印出骨材。
[0094]
2.制备3d打印的人工骨膜
[0095]
i.按1∶1的质量比称取纳米级猪交联胶原纤维和乳酸,在4℃~8℃,将两种原料溶入水中制成溶质总质量浓度为4%的混合物a;
[0096]
ii.按3∶1的质量比称取海藻酸钠和纳米级碳酸钙,将两种原料溶入水中制成溶质总质量浓度为2%的混合物b;
[0097]
iii.利用3d打印
‑
同轴高压静电液滴发生装置,将混合物a注入芯液管,将混合物b注入壳液管,设定混合物a与混合物b的流量比为1∶1,电压3000v,在高压静电下形成直径在0.3mm的连续的液滴,在液滴收集台上迅速凝固,制成面积80mm
×
40mm、厚度0.4mm矩形凝胶膜片,即为用于3d打印的人工骨膜材料。
[0098]
人工骨膜的机械性能用万能强力机(instron 4464)进行测试,上下夹距 60mm,拉伸速度为6mm/min。人工骨膜断裂强度8.76n,断裂伸长率91.6%。
[0099]
3.人工骨骼
[0100]
在实施骨和骨膜修补手术时,先将3d打印人工骨材填入患者骨缺损部位,再贴补适当大于骨缺损面积的3d打印人工骨膜片,与人工骨贴合形成人工骨骼。实施例4耳鼓膜修补片的制作实例
[0101]
i.按5∶2的质量比称取纳米级猪交联胶原纤维和乳酸,在4℃~8℃,将两种原料溶入水中制成溶质总质量浓度为3.5%的混合物a;
[0102]
ii.按2∶1的质量比称取海藻酸钠和纳米级碳酸钙,将两种原料溶入水中制成溶质
总质量浓度为3%的混合物b;
[0103]
iii.利用3d打印
‑
同轴高压静电液滴发生装置,将混合物a注入芯液管,将混合物b注入壳液管,设定混合物a与混合物b的流量比为1∶1,利用挤出设备经芯液管和壳液管注入同轴高压静电液滴发生装置,设定电压4000v,在高压静电下形成直径在0.4mm的连续的液滴,作为3d打印的线性材料,在液滴收集台上迅速凝固,形成2个直径8mm厚度0.4mm圆形凝胶膜片。
[0104]
iv.分别采用3g纳米级猪交联胶原纤维,3g纳米级羟基磷灰石与94g pcl (武汉海山科技有限公司)进行超声分散,加入120ml氯仿,并通过机械搅拌进行混合,混合均匀后,真空冷冻干燥机进行干燥处理。然后采用碎料破碎机破碎,形成≤1mm粒径的小颗粒,最后采用单/双螺杆挤出机设置三区温度分别控为 160℃,190℃,160℃(挤出模具)进行线材的生产制作,挤出成直径1mm的均匀的可供3d打印的线性材料。使用3d打印机制作直径4mm、厚度1mm圆形人造骨薄片。
[0105]
在实施鼓膜修补手术时,制作好人工鼓膜移植床后,先根据患者鼓膜穿孔面积和形状,将上述3d打印人造骨薄片边缘进行相应修剪,使其大小与穿孔一致,并在其上缘雕刻出容纳锤骨柄的凹槽,然后将其夹入上述2张直径8mm的人工骨膜片之间,适当修剪使复位耳道鼓膜瓣后,人工鼓膜片边缘可与皮瓣重叠宽度不少于2mm,即形成耳鼓膜修补片,植入到外耳道鼓膜穿孔处,复位皮瓣,碘仿纱条固定,结束手术。
[0106]
实施例5
[0107]
采用质量分数分别为6%的纳米级猪交联胶原纤维,4%的纳米级羟基磷灰石与90%pcl进行超声分散,并通过机械搅拌进行混合,按照每单位质量2倍体积比例(g/ml)的三氯甲烷进行溶解,混合均匀后,采用真空冷冻干燥机进行干燥处理。然后采用碎料破碎机破碎,形成≤2mm粒径的小颗粒,最后采用单/ 双螺杆挤出机设置三区温度分别控为160℃,180℃,160℃(挤出模具)进行线材的生产制作,挤出成直径在2mm的均匀的可供3d打印的线性材料,对所生产出线材进行性能检测,拉伸强度为41.5mpa,断裂伸长率为7.2%,拉伸模量为 1340mpa。
[0108]
使用3d打印机制作直径40_mm、厚度0.5mm的圆形人造骨膜薄片。
[0109]
同时,经3d打印
‑
高压静电液滴发生装置制作直径8mm、厚度0.4mm圆形纳米级猪交联猪胶原
‑
海藻酸钠凝胶膜片2张。具体制作方案如下:
[0110]
将3质量份数纳米级猪交联猪胶原和4质量份数乳酸混合溶于水,制成总质量浓度为7%的混合物a;将1.5质量份数海藻酸钠和0.5份纳米级碳酸钙混合溶于水,制成溶质总质量浓度为2.0%的混合物b;将混合物a和b分别经芯液管和壳液管注入3d打印
‑
高压静电液滴发生装置的同轴喷嘴,混合物a与混合物b 的流量比为1∶1,设定电压6000v,在高压静电下形成直径在0.5mm的连续的液滴,在打印托盘上迅速凝固,形成直径8mm、厚度0.4mm圆形凝胶膜片。人工鼓膜片体积极小,人工鼓膜片的机械性能不能直接用万能强力机(instron 4464) 进行测试。通过对相同材料配方在同一工艺下生产面积80mm
×
40mm、厚度0.4 mm人工鼓膜片测试,人工骨膜断裂强度9.58n,断裂伸长率93.4%。
[0111]
在实施鼓膜修补手术时,制作好人工鼓膜移植床后,先根据患者鼓膜穿孔面积和形状,将上述3d打印人造骨薄片边缘进行相应修剪,使其大小与穿孔一致,并在其上缘雕刻出容纳锤骨柄的凹槽,然后将其夹入2张直径8mm的人工鼓膜片之间,适当修剪使复位耳道
鼓膜瓣后,人工鼓膜片边缘可与皮瓣重叠宽度不少于2mm,即形成耳鼓膜修补片,植入到外耳道鼓膜穿孔处,复位皮瓣,碘仿纱条固定,结束手术。
[0112]
比较例1
[0113]
含质量分数4%纳米级猪交联胶原纤维和4%乳酸的灭菌混合溶液a,分别与质量分数0%、1%、1.5%、2%或2.5%海藻酸钠(其中含质量分数0.3%纳米级碳酸钙)混合液b,作为3d打印
‑
高压静电液滴发生装置的芯液和壳液,混合液a 与混合液b的流量比为1∶1,设定电压6000v,经同轴喷嘴,在高压静电下形连续的液滴,在液滴收集台上凝固形成凝胶,80mm
×
80mm
×
0.4mm凝胶膜片。制备的人工骨膜的机械性能用万能强力机(instron 4464)进行测试,上下夹距 60mm,拉伸速度为6mm/min。制备的人工骨膜裁切成10mm
×
8mm小片,植入 sd大鼠背部皮下,定期取材。按照国标gb/t 16886系列标准要求,观察和评价人工骨膜降解和有无炎症反应。实验测试结果见表1。
[0114]
表1不同含量海藻酸钠对人工骨膜机械性能和生物反应性测试结果
[0115][0116]
由表1可以看出,含4%猪胶原纤维的人工骨膜中加入海藻酸钠,明显提高断裂强度和断裂伸长率,人工骨膜生物降解加快,炎症反应消失。
[0117]
实施例6
[0118]
1.动物分组和实验材料
[0119]
14只健康成年比格犬,体重10~13kg,雌雄不限,随机分为实验组和对照组,每组7只。按自身同期对照设计原则,每只动物左股骨钻孔用于人工骨修补实验,右股骨钻孔用于人工骨骼(包括人工骨和人工骨膜)修补实验。对照组每只动物左股骨干外侧钻1孔,直径8mm。植入固邦
tm
骨填充修复材料(主要由纳米级β
‑
磷酸三钙(β
‑
tcp)和缺钙型纳米羟基磷灰石(d
‑
hap)无机材料组成),作为骨填充修复材料实验对照。对照组右股骨干外侧钻1孔,直径8mm。植入固邦
tm
骨填充修复材料,外加睿膜
tm
骨膜修补材料。实验组犬左股骨钻孔,直径8mm,植入上述实施例1制备的人工骨材料。实验组犬右股骨干外侧钻1孔,直径8mm,分别植入上述实施例1制备的人工骨及骨膜修补材料。
[0120]
2.实验方法
[0121]
以2%戊巴比妥钠30mg/kg行静脉麻醉,常规消毒铺巾,股部切口,暴露股骨外侧。术中尽量减少对肌肉和骨膜的损伤。用直径8mm种植钻头在左右股骨外侧制备相应的种植孔,转速控制在800r/min以下,术中钻孔时用生理盐水降温和清洗骨屑。立即植入相应骨修复材料,实验组左股骨钻孔即刻植入上述实施例 1中制备的人工骨材料,实验组右股骨钻孔即刻植入上述实施例1中制备的人工骨材料,并在种植骨材料后其周边形成10mm
×
10mm
骨膜缺损区。适当修剪欲植入实施例1制备的人工骨膜材料,使之完全覆盖骨膜缺损区并超出骨膜缺损缘 2mm~3mm,严密缝合辅以固定。对照组按照上述相同方法,左股骨钻孔即刻植入固邦
tm
骨填充修复材料;右股骨钻孔即刻植入固邦
tm
骨填充修复材料和睿膜
tm
骨膜修复材料。术后肌注青霉素80万单位,3d,每日两次预防感染。分别于术后第1、2、4、6、8、10和12月各组麻醉处死一只动物,完整摘取股骨作大体观察,然后剥下植入区骨膜材料,截取骨修复材料填充区股骨,4%中性甲醛固定,组织脱钙,制备石蜡切片,h&e染色,基于国标gb/t 16886系列标准,参照无源医疗器械生物安全评价系统进行病理组织学分析。
[0122]
3.实验结果
[0123]
每只动物左股骨钻孔手术为人工骨修补实验,对照犬左股骨使用固邦
tm
骨填充修复材料;实验组左股骨使用上述实施例1制备的骨材料。每只动物右股骨钻孔手术为人工骨和人工骨膜修补实验,其中对照犬右股骨使用固邦
tm
骨填充外加睿膜
tm
骨膜修复材料;而实验组右股骨使用上述实施例1制备的骨及骨膜修复材料。实验期间所有犬的手术创口i期愈合,无1例发生术后感染反应。
[0124]
对照组犬术后不同时间病理组织切片图像分别如图2和图3中a、b、c、d 所示。
[0125]
对照组犬植入术后1月,回收右股骨植入的睿膜
tm
材料,其结构完整,外周包膜明显。图2a是回收睿膜
tm
材料病理组织切片图像,可见睿膜
tm
材料内有肉芽组织形成,少量炎性细胞浸润,出现少量异物巨噬细胞。另见大量折光性的合成纤维(聚乳酸纤维)。右股骨缺损区的固邦
tm
骨填充材料稍显内陷,少量新骨样组织形成,其内主要为纤维结缔组织填充(详见图3a)。固邦
tm
骨填充材料植入对照组左股骨缺损1月,从骨病理组织切片上观察,见较多成纤维增生,新骨样组织不明显,填充材料周围有肉芽组织形成(详见图3b)。
[0126]
术后4~6月,对照组右股骨缺损植入的睿膜
tm
修复膜内呈现大量肉芽组织和异物巨噬细胞,出现明显排异反应和炎性反应,外周可见较多纤维组织包裹,重度纤维化(详见图2b)。右股骨缺损区植入固邦
tm
骨填充部分为新生骨组织充填,出现新生的骨小梁结构(详见图3c)。对照组左股骨植入固邦
tm
骨填充修复材料周围有结缔组织包绕,内部出现明显炎性反应,新骨样组织部分填充,骨小梁结构不明显(详见图3b)。
[0127]
术后8~10个月,对照组右股骨睿膜
tm
材料内有大量肉芽组织和折光性的合成纤维(聚乳酸纤维),较多新生胶原束和炎性细胞,异物巨噬细胞较多,排异反应十分明显(详见图2c)。右股骨缺损区为新骨组织充填(详见图3d)。对照组左股骨植入固邦
tm
骨填充修复材料内部多处出现新骨样组织,偶见新生骨小梁。
[0128]
术后12个月,对照组右股骨睿膜
tm
材料内仍有大量肉芽组织和少量折光性的合成纤维(聚乳酸纤维),出现较多新生胶原束和炎性细胞,异物巨噬细胞减少,排异反应减弱(详见图2d)。
[0129]
实验犬术后病理组织切片图像如图2和图3中所示。第10个月对照组与实验组植入骨填充修复和人工骨膜材料病理学比较见表2。
[0130]
实验组犬植入术后1月,回收右股骨植入纳米级猪交联胶原
‑
海藻酸钙凝胶膜材料(实施例1制备的骨膜材料),膜材料结构较完整,外周包膜不明显。制作he染色切片,可显示纳米级猪交联胶原纤维(原图红色)和海藻酸钙(原图浅蓝色)组成的人工骨膜组织形态和结构(图2f)。图片中浅灰色区域是海藻酸钙凝胶材料,其余深色区是交联猪胶原纤维凝胶材料。染色切片上交联猪胶原纤维凝胶和海藻酸钙凝胶各自呈网状相互交织,周边有少量
肉芽组织长入,无明显炎症和排异反应(详见图2f)。
[0131]
实验组犬植入术2月后,交联猪胶原
‑
海藻酸钙凝胶膜材料包膜不明显,内部组织结构完全改变,大量成纤维细胞和胶原增生,海藻酸钙凝胶完全降解和吸收,逐渐为致密结缔组织所替代,无明显炎症反应,与天然骨膜结构较类似(详见图2g)。
[0132]
采用实施例1制备的骨材料植入实验组犬右股骨,2个月回收,可见骨膜下缺损区肉芽组织增生,形成结缔组织,包埋了部分种植体,新骨样组织形成(详见图3e)。
[0133]
而实验组犬左股骨植入实施例1的人工骨材料,2个月回收,骨缺损区人工骨浅层可见肉芽组织生长,缺损区有新骨样组织形成,多量成纤维细胞长入。可见植入人工骨材料部分转变为骨样结构。与同期右股骨缺损区相比,无明显差别。
[0134]
实验组犬植入术4月后,犬右股骨纳米级猪交联胶原
‑
海藻酸钙凝胶膜材料结构已完全改变,大量成纤维细胞和胶原增生,基本转变为致密结缔组织,与天然骨膜结构接近(详见图2h)。采用实施例1制备的骨材料植入实验组犬右股骨,4个月回收,可见骨膜下缺损区新骨样组织形成,出现较多新生骨小梁结构 (详见图3f)。无炎性反应,无排异反应,这与同时期对照犬骨膜下缺损区修复有明显不同,后者有较强的炎性反应。
[0135]
而实验组左股骨植入实施例1人工骨材料,4个月回收,骨缺损区多量成纤维细胞人工骨浅层可见多量成纤维细胞长入肉芽组织生长,有少量新骨样组织形成,少量新生骨小梁结构。可见植入人工骨材料大部分转变为骨样结构。与同期右股骨缺损区相比,左股骨植入人工骨材料的新生骨小梁结构出现略延迟。
[0136]
实验组犬植入术6~8个月,犬右股骨植入猪交联胶原
‑
海藻酸钙凝胶膜材料已完全转变为致密结缔组织,与天然骨膜结构相似(详见图2i)。此时回收的骨填充材料可见骨膜下缺损区胶原增生,组织染色加深,出现较多小血管和新生骨小梁结构,其中骨胶原成分明显多(详见图3g)。与同期对照犬右股骨缺损区 (图3c)相比,差异十分明显。
[0137]
而实验组犬左股骨植入实施例1人工骨材料,6个月回收,骨缺损区出现较多小血管和新生骨小梁结构,其中胶原成分明显多,与同期右股骨缺损区相比,左股骨植入人工骨材料的新生骨小梁结构欠广泛,其中骨胶原含量偏低。
[0138]
实验组犬植入术10~12个月,犬右股骨植入猪交联胶原
‑
海藻酸钙凝胶膜材料已转变为正常骨膜结构(详见图2j右侧),与骨皮质贴附。此时回收的骨填充材料可见骨膜下骨缺损区完全修复,具有基本正常的皮质结构(详见图2j左侧),其中有较多血管和骨小凹。与同期对照犬右股骨缺损区(图3d)相比,新生骨结构无明显差异。
[0139]
而实验组犬左股骨植入实施例1人工骨材料,12个月回收,骨缺损区已基本成为骨结构,其中有较多血管和骨小凹(图2e),骨胶原含量略低于对侧右股骨缺损修复水平。与同期对照和实验组右股骨缺损区(图3d和图2j左侧)相比,左股骨缺损修复后骨胶原含量偏低。
[0140]
表2犬股骨植入骨填充修复和人工骨膜材料病理学比较
[0141][0142]
由此可见,本发明的人工骨和骨膜修复材料相比上市的和修复材料,在动物实验中显示出了更好的生物相容性,无炎症和排异反应。同时揭示了人工骨膜促进骨修复的作用,实验修复材料植入10个月,实验组人工骨膜已降解并为新生致密结缔组织取代;骨缺损区完全为新生骨组织充填,形成了许多骨小梁结构。这表明骨愈合明显早于对照组。这种骨和骨膜修复材料在动物体内无炎症和排异反应,显示了很好的生物相容性和良好的临床应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1