AAV介导的基因疗法恢复耳畸蛋白基因的制作方法
aav介导的基因疗法恢复耳畸蛋白基因
背景技术:
1.超过一半的非综合征性重度先天性耳聋病例有遗传原因,大多数(~80%)是常染色体隐性(dfnb)形式(duman d.&tekin m,frontbiosci(landmark编)17:2213-2236(2012))。耳聋的基因诊断为耳蜗基因疗法提供必要信息,并且在过去几年中基因测试的准确性和可及性得到快速进展。可以在患者症状出现之前的很多年鉴定综合征耳聋基因中的突变,从而为计划疾病管理争取时间。
2.耳聋基因编码的蛋白具有对于耳蜗功能至关重要的大范围分子功能,例如感觉器官发育、毛细胞的静纤毛中的声音转导、维持耳蜗内电位(ep)和高浓度的细胞外钾、以及毛细胞和螺旋神经节神经元(sgn)之间的突触神经传递。耳聋基因产生的主要蛋白包括细胞骨架和分子马达中的离子通道和转运蛋白、间隙连接和紧密连接、蛋白亚基、以及在耳蜗发育中瞬时表达的转录因子。在确定“治疗时间窗”中的主要因素是突变是否会影响早期耳蜗发育以及导致显著的细胞变性,这是在该治疗领域中至关重要的问题。
3.虽然假体耳蜗植入物目前用于康复(kral a&o’donoghue gm n engl j med 363(15):1438-1450(2010)),但因为由通道间电干扰对其施加的频率分辨率的固有限制,听力恢复远非完美,特别是对于在嘈杂环境中语音的感知或对音乐的感知。
4.开发生物治疗的主要动机是在没有植入任何假体设备的情况下恢复听力,并且实现远远优于耳蜗植入物目前可实现的声音分辨率质量和单位成本。具体地,已经建议使用局部腺相关病毒(aav)介导的基因疗法的基因疗法用于治疗人的耳聋形式(zhang等人,frontiers in molecular neuroscience,第11卷,第221条,2018)。
5.使用研究usher型1c疾病的ush1c c.216g》a敲入小鼠模型,pan等人,nature biotechnology;35(3):264-272(2017)测试了耳蜗基因疗法是否可用于靶向毛细胞以修正耳聋表型。一种新的合成的aav(anc80l65)能够转导》90%的毛细胞。该治疗显示耳蜗中的形态保持,并且当在p0-p1天(即,小鼠出生当天或之后一天,称为“出生后0日或1日”)注射重组病毒载体时,与未治疗的耳朵相比听觉阈值改善60-70db。在p10-p12(即出生后的十或十二天,在听力出现之前(在该物种中约在p12发生))进行相同注射,没有产生任何治疗效果(pan等人,nature biotechnology;35(3):264-272(2017)。
6.akil等人,neuron 75:283-293(2012)使用aav2/1将囊泡谷氨酸转运蛋白3(vglut3)cdna递送到新生(即,出生后1至12天)ko小鼠耳蜗中,以治疗内毛细胞的突触传递的病症。基于听觉脑干反应(abr)和声惊吓反射的数据,他们证明经注射的耳朵中的听觉功能在2周内恢复。
7.这两项研究证明,当在出生后早期阶段(即在小鼠毛细胞成熟之前)注射重组病毒载体时,显著缓解耳蜗中的细胞变性。
8.迄今为止,所有评估小鼠内耳疗法的基因疗法研究都得出结论:这些疗法对成年动物无效。因此,人们一致认为,基因疗法在听力保存或恢复中的有效性存在关键时期,并且治疗的机会窗口只存在于处于胚胎中或出生后早期阶段的小鼠中,即在听力出现发生之前(ahmed等人,jaro 18:649-670(2017))。
9.众所周知,小鼠内耳在出生时在结构和功能上仍不成熟,并且在该动物物种中听力出现发生在出生后第12天(p12),至出生后约第20天(p20)结束(shnerson和willott,j.comp.physiol.psychol.94,36-40(1980))。然而,在人中听力出现和成熟发生在完全不同的时间。事实上,人的内耳在早在子宫内4.5个月时就能够进行听觉功能,并且在出生时结束(参见图6和hepper pg&shahidullah bs,arch dis child71(2):f81-87(1994))。
10.这意味着旨在于听力出现前或耳蜗成熟结束前恢复听觉功能的现有技术实验,当转移到人进行试验时应在子宫中进行(图6)。然而,因为在出生后阶段或儿童期(infancy)(即当听觉系统完全成熟和行使功能时)恢复听力被认为是不可能的,所以迄今为止还没有人接受过毛细胞基因疗法。
11.尽管如此,耳蜗基因疗法的最终目标是在可以检测出或诊断出潜在的遗传诱导的耳聋后(即,在其出生后的大多数时间中),治疗人常见的遗传性耳聋。
12.确实不可能开发出涉及在子宫中将治疗递送到耳蜗中的基因疗法操作方案,因为这种外科手术可能会引起许多副作用,其中包括确定性的听力丧失(zhang等人,frontiers in molecular neuroscience,卷11,第221条,2018)。此外,众所周知,在人中dfnb耳聋通常在新生儿阶段(即,在出生后在0到4个月之间)被诊断出来。
13.因此,为可转用于(transposable)人,基因疗法方法应经过测试并在逆转已经建立的影响成熟听觉系统的耳聋表型中有效,例如,当施用于出生后天数》p20的小鼠时(对应于年轻人或成年人)。
14.这将是符合人伦理和福利的鉴定治疗时间窗口的唯一方法,因为这些治疗可以施用在听觉系统完善的出生后(post-natal)、儿童(infant)和成人中。
15.发明详述
16.本发明人已经开发可选择的研究,以鉴定有实际机会有效预防或逆转受试者(特别是人)中的听力丧失的治疗,在所述受试者中听觉系统(特别是耳蜗)是成熟的,并且不涉及胚胎基因递送。在这种情况下,他们能够证明在内毛细胞中耳畸蛋白(otoferlin)的重组表达能够在出生后天数》p20时治疗的模型小鼠中(对应于年轻人或成人)恢复听觉。
17.耳畸蛋白在耳蜗的感觉内毛细胞(ihc)中大量表达。耳畸蛋白还在中枢神经系统的其他细胞中表达。它在耳蜗毛细胞突触与传入螺旋神经节神经元的突触囊泡融合的最后步骤中起着关键作用。更准确地说,耳畸蛋白对在听觉带状突触的细胞外泌很重要(roux等人,cell 127(2):277-89,2006)。
18.在人类中,影响耳畸蛋白基因(“otof基因”)的突变导致在出生后但在语言习得之前发生严重的非综合征双侧听觉丧失。其中一些还会导致当体温显著升高时触发的热敏非综合征性听觉神经病(例如,在发烧的情况下,参见marlin s.等人,biochemical and biophysical research communications,394(2010)737-742和varga r.等人,j.med.genet 2006;43:576-581)。目前已经鉴定至少60个突变(参见图7),其中已知5个是热敏的(p.q994vfsx6、p.i515t、p.g541s、pr1607w、p.e1804del,如pangrsic t.等人,trends in neurosciences,2012,第35栏,第11期所述)。
19.在全世界都发现这两个耳聋表型(组成型和诱导型)并且称为“耳聋、常染色体隐性9”或“dfnb9”耳聋。
20.dfnb9耳聋在一些西方人群中占常染色体隐性非综合征听力丧失的多达8%,因此
位于仍需要治疗干预的遗传性听力障碍的前五名。
21.本发明人在此报告了在dfnb9小鼠模型(otof敲除小鼠)中的首个理论验证:当在小鼠听觉系统已经成熟(p30)之后,将片段化的cdna通过双aav载体方法耳蜗递送可以有效且持久地修正这些小鼠中的重度耳聋表型。该结果表明,在具有由dfnb9导致的先天性耳聋的患者中,局部基因传递的治疗窗口实际上比最初怀疑的要长。
22.事实上,施用本发明的载体,每个载体提供一部分otof基因并能够在出生后晚期(p30)的otof敲除小鼠的转染的内毛细胞中表达全长otof蛋白,产生比治疗更年幼小鼠时更好的结果。
23.这是非常出人意料的,因为许多研究表明,患有遗传性耳聋的小鼠的局部基因传递的治疗窗口是胚胎期或出生后早期(ahmed等人,jaro 18:649-670(2017);zhang等人,frontiers in molecular neuroscience,第11卷,第221条,2018)。
24.众所周知,在小鼠中,可以在p14(即出生后的十四天)观察到全范围的反应频率。反应潜伏期和峰间间隔在生后第二周和第三周迅速成熟,并在p18达到成人特征(song l.等人,j acoust soc am 119(4):2242-2257(2006))。因此,小鼠的听觉系统在p30完全成熟。它对应于儿童或成人的听觉系统(见图6)。
25.因此,发明人获得的结果表明,本发明中使用的基因疗法不仅在出生前时间窗内对人有效,而且在被诊断患有先天性dfnb9耳聋的儿童患者中、或在稍晚诊断的成年患者(例如因为他们携带otof基因中的热敏突变)中有效。
26.在第一方面,本发明涉及允许全长耳畸蛋白多肽或其功能片段在内毛细胞中表达的载体系统,其用于在治疗患有dfnb9耳聋的患者,其中所述患者优选为幼儿(toddler)、儿童、青少年或成年人。
27.如本文所用,术语“耳畸蛋白”表示耳畸蛋白多肽。在此处缩写为“otof”。该多肽也称为“aunb1”;“dfnb6”;“dfnb9”;“nsrd9”和“fer1l2”。
28.在seq id no:1(对应于genbank号af183185.1)中显示野生型人耳畸蛋白多肽的同种型1的全长。该多肽是跨膜蛋白的ferlin家族的成员,它与突触结合蛋白、pkc和plc一样具有c2结构域。该长形式包含六个c2结构域。如上所述,它涉及耳蜗毛细胞和传入螺旋神经节神经元之间的突触囊泡融合(roux等人,cell 127(2):277-89,2006;michalski等人,elife,2017年11月,7;6e31013)。
29.术语“耳畸蛋白多肽”指seq id no:1的耳畸蛋白多肽及其同源序列,其保留了本文感兴趣的耳畸蛋白多肽的至少一种生物学功能。例如,该生物学功能与激活初级听觉神经元的耳蜗内毛细胞带状突触中的囊泡融合的调节有关(roux等人2006;michalski等人;elife,2017年11月7日;6e31013)。可以通过经典的离体电生理测量来评估该调节。
30.在优选的实施方案中,本发明的载体系统允许表达其氨基酸序列与seq id no:1具有至少70%的同一性和/或相似性的同源多肽。所述同源序列更优选地与seq id no:1具有至少75%、甚至更优选至少80%、或至少90%的同一性和/或相似性。当同源多肽比seq id no:1短得多时,可以考虑局部比对。
31.所述同源多肽可具有例如seq id no:5所示的氨基酸序列(对应于genbank号np_001274418)。所述序列表征野生型人耳畸蛋白多肽的同种型e(变体5)。该同种型e由具有序列seq id no:22的cdna变体编码。该变体与seq id no:1相比在3'编码区中缺少可选择的
框内(in-frame)外显子,并且使用下游终止密码子。与seq id no:1相比,其编码不同的c末端(但其n末端部分是相同的)。
32.所述同源多肽还可以具有seq id no:6所示的氨基酸序列(对应genbank号np_004793.2)或seq id no:24所示的氨基酸(对应于genbank号np_919303.1),其分别对应短的同种型b和c(变体2和3)。更准确地说,seq id no:6表示同种型b(变体2,也称为“短型1”),与seq id no:1相比其具有较短的n末端并且缺少一个区段。在另一方面,seq id no:24表示同种型c(变体3,也称为“短型2”),与变体1(seq id no:1)相比其区别在于5'utr和编码序列,因为其与seq id no:1相比,具有较短的和不同的c末端。
33.所述同源序列也可以是,例如另一种动物物种的耳畸蛋白多肽,例如,seq id no:7,其是小鼠耳畸蛋白多肽的全长同种型1(对应genbank号np_001093865.1)。该同种型由seq id no:16(nm_1100395)的cdna编码。
34.在本发明的上下文中,当所述两个同源序列之间的同一性百分比可以通过序列在其整体上的全局比对所鉴定时(例如,当序列大致尺寸相同时),可以通过本领域技术人员所公知的算法方式进行比对,例如在needleman和wunsch(1970)所公开。因此,两个氨基酸序列或两个核苷酸序列之间的序列比较可以通过以下进行,例如,通过使用本领域技术人员已知的任何软件,例如使用“needle”软件以及10的“空位打开”参数、0.5的“空位延伸”参数和“blosum62”矩阵来进行。
35.当要考虑序列的局部比对时(例如,在同源物具有比本发明的序列更小尺寸的情况下),那么所述比对可以通过常规算法的方式进行,例如,在smith和waterman(j.mol.evol.1981;18(1)38-46)中公开的算法。
36.本发明提供系统,其编码与seq id no:1或seq id no:5或seq id no:6或seq id no:24“相似”的同源氨基酸序列。两个靶氨基酸序列的“相似性”可以通过计算两个氨基酸序列的相似性评分来确定。如本文所用,“相似性评分”是指当两个序列最佳比对时,使用blosum62氨基酸取代矩阵、11的空位存在罚分、和1的空位延伸罚分对两个序列产生的评分。当两个序列在比对时以便为成对的序列产生最大可能的评分时是“最佳比对”,这可能需要在一个或两个序列中引入空位以实现最大评分。如果两个氨基酸序列的相似性评分超过某个阈值,则它们实质上是相似的。阈值可以是针对具体参考序列(例如,seq id no:1)的至少1190到最高可能评分的任何整数。例如,相似性评分阈值可以是1190、1200、1210、1220、1230、1240、1250、1260、1270、1280、1290、1300、1310、1320、1330、1340、1350、1360、1370、1380、1390、1400、1410、1420、1430、1440、1450、1460、1470、1480、1490、1500或更高。如果在本发明的具体实施方案中,评分阈值被设定为例如1300并且参考序列是seq id no:1,然后与seq id no:1可以经最佳比对以产生大于1300的相似性评分的任何氨基酸序列对于seq id no:1而言是相似的。氨基酸取代矩阵及其在量化两个序列之间的相似性中的用途是本领域公知的并且描述见于,例如dayhoff等人,(1978),“a model of evolutionary change in proteins”,“atlas of protein sequence and structure,”第5卷,3增刊(m.o.dayhoff编),345
–
352页,natl.biomed.res.found.,华盛顿d.c和henikoff等人(1992)proc.natl.acad.sci.usa 89:10915
–
10919。虽然可以手动完成最佳比对和评分,但通过使用计算机实现的比对算法可以促进该过程,例如,altschul等人(1997)nucleic acids res.25:3389
–
3402中所述的空位blast 2.0,并且公众可在国家生物技术信息网站
获得。为了使用ncbi blast生成准确的相似性分数,重要的是要关闭任何过滤(例如,低复杂度过滤),并禁用基于组成的统计数据。人们还应该确认使用正确的取代矩阵和空位罚分。最佳比对(包括多重比对)可以使用例如psi-blast来制备,psi-blast可通过ncbi网站获得,并且描述见于altschul等人,(1997)nucleic acids res.25:3389
–
3402。
37.在另一个实施方案中,本发明的载体系统可以允许表达耳畸蛋白多肽的功能片段。术语“功能片段”本文是指人耳畸蛋白多肽的任何片段或具有如上定义的同源序列的多肽的任何片段,其中所述片段保留本文中感兴趣的耳畸蛋白多肽的至少一种生物学功能。例如,该生物学功能与激活初级听觉神经元的耳蜗内毛细胞带状突触中的囊泡融合的调节有关(roux等人2006;michalski等人;elife,2017年11月7日;6e31013)。可以通过经典的离体电生理测量来评估该调节。
38.例如,所述功能片段可以具有seq id no:6所示的氨基酸序列(对应具有genbank号np_004793.2的同种型b)或seq id no:24所示的氨基酸序列(对应具有genbank号np_919303.1的同种型c)。所述序列表征野生型人耳畸蛋白多肽的短同种型,仅包含三个c2结构域。
39.在本发明的这个方面,本发明的载体系统施用于患有dfnb9耳聋的患者。通过“患有dfnb9耳聋的患者”,本文指患者、特别是人患者,其被认为具有(或已被诊断为具有)在组成型耳畸蛋白基因中的突变,所述突变触发耳畸蛋白蛋白的异常表达、异常功能或两者都有。在具体实施方案中,所述突变可以是热敏的。
40.迄今为止,在耳畸蛋白中报告多于60种致病性突变(参见图7)。其中包括在因发热引起的偶发性耳聋病状患者中鉴定出的至少五种热敏突变(p.q994vfsx6、p.i515t、p.g541s、pr1607w、p.e1804del)。
41.这些患者可由熟练的医师鉴定,例如使用听觉脑干反应(abr)的电生理学测试和/或基因测试的组合来鉴定otof基因中的突变。在一些实施方案中,患者在otof基因中具有以下无义或错义突变中的一种或多种:tyr730ter、gln829ter、pr01825ala、pro50arg、leu1011pro、ile515thr、arg1939gln、或gly541ser。在一些实施方案中,患者在内含子8/外显子9连接处具有a至g转换(ivs8-2a-g)、或在位置+1(外显子5的剪接供体位点中的第一个内含子核苷酸)处具有g至a转换、或在内含子39的供体剪接位点处具有g-c颠换。在一些实施方案中,患者在外显子16中具有一个碱基对缺失(1778g),导致产生终止密码子,以及6141g-a改变,产生外显子48中的arg到gln的取代。
42.施用本发明的载体系统的患者是听觉系统(特别是耳蜗)已经发育和成熟的患者,特别是人患者。因为施用不旨在于子宫内进行,因此这些患者,特别是人患者不是人胚胎或胎儿。根据图7,本发明靶向的患者优选为新生人婴儿,通常小于6月龄,甚至小于3月龄(如果他们在幼时被诊断出来患dfnb9耳聋)。这些人婴儿更优选在3月龄和1岁之间。
43.注意,人耳蜗在孕龄17至19周时整体达到成人尺寸,在30-36周内完全形态学成熟(对应于小鼠出生后12天)。通过监测abr记录的波i(在人孕龄约28周可以记录)可以评估内毛细胞带状突触的功能性成熟。abr波i的记录和分析(反映了与初级听觉神经元相关的内毛细胞突触的功能)显示人婴儿在出生时完全功能性成熟(对应于小鼠出生后20天)。这在本领域中是众所周知的(参见例如pujol et lavigne-rebillard,acta oto-laryngologica.增刊
·
1991年2月)。
44.因此,还可以将本发明的载体系统施用于较大的人患者,例如幼儿(2-6岁)、儿童(6-12岁)、青少年(12-18岁)或成人(18岁及以上)。
45.因此,优选将本发明的载体系统施用至年龄在3月龄至25岁之间的人患者中。
46.本发明的患者特别是在语言习得后诊断患有dfnb9耳聋的人儿童。
47.在另一个具体实施方案中,本发明的患者是6岁及以上的人类,即当其中枢神经系统完全成熟时发生治疗的施用(参见图7)。
48.在具体实施方案中,本发明的载体系统被施用于患有热敏突变诱导的dfnb9耳聋的人患者,优选施用于携带至少一个上述耳畸蛋白热敏突变的青少年或成人。
49.如本文所用,术语“治疗”旨在表示将治疗有效量的本发明的载体系统之一施用至患有dfnb9耳聋的患者,以便部分地或完全恢复所述患者的听力。通过使用电生理设备测试听觉脑干反应(abr)可以评估所述恢复。“治疗dfnb9耳聋”特别旨在指听力功能的完全恢复,而不考虑所涉及的细胞机制如何。
50.对于携带热敏突变的患者,也可以施用本发明的载体系统以预防体温调节诱导的听力丧失。在本发明的上下文中,术语“预防”指减少(impair)或延迟听觉频率范围内的听力丧失。
51.可以将本发明的载体系统施用在这些和其他dfnb9患者中,用于在听力丧失发生之前预防听力丧失,并且在听力丧失已经发生时恢复听力能力。
52.已经探索多个递送到内耳的途径。这些包括通过圆窗膜(round window membrane)(rwm)和通过卵圆窗注射到外淋巴空间,以及通过耳蜗造口术注射到鼓阶或前庭阶。已经证明所有这些递送途径分布在全部外淋巴空间。此外,已经证明流经耳蜗和前庭器官的平流可以促进治疗剂从注射部位分布到内耳更远区域。也已经探索通过耳蜗造口术进入蜗管(scala media)、通过小管造口术以及通过注射到内淋巴囊中来递送到内淋巴空间中。这些方法也产生了广泛的分布,但面临着破坏高钾内淋巴和外淋巴之间屏障的额外挑战。屏障的破坏会带来两个潜在问题。首先,高钾泄漏到外淋巴空间中,浸泡毛细胞和神经元的基底外侧表面,可使这些细胞慢性去极化并导致细胞死亡。其次,破坏内淋巴和外淋巴之间的紧密连接会导致耳蜗内电位下降,耳蜗内电位范围通常在+80和+120mv之间。耳蜗内电位的下降会降低毛细胞感觉转导的驱动力,从而导致耳蜗敏感性降低和听觉阈值升高。在成人耳蜗中避免这些并发症尤其具有挑战性。然而,通过靶向前庭系统中的内淋巴空间(其没有内淋巴电位但与耳蜗内淋巴空间连续),可以使混杂的问题最小化,同时仍然在耳蜗内提供足够的分布(ahmed等人,jaro 18:649-670(2017))。
53.耳蜗是高度分隔的并通过血-耳蜗屏障(bcb)与身体的其他部分隔开,从而最小化治疗注射体积以及使进入身体循环系统的泄漏最小化,从而保护耳蜗免疫赦免并减少全身不良免疫反应的机会。由于耳蜗中的毛细胞和支持细胞通常不会分裂,耳蜗中的细胞保持稳定,因此可以使用非整合病毒载体(例如aav)进行持续的转基因表达。
54.因为在人中,后半规管似乎也是人可及的,因此半规方法已被认为是未来人试验中耳蜗基因疗法的有前途的注射途径(suzuki等人,sci.rep.7:45524(2017);yoshimura等人,sci.rep.8:2980(2018)。
55.在本发明的一个优选实施方案中,本发明的载体系统通过临床耳科手术实践中常规使用的两种常见且成熟的技术之一在人耳中施用。更确切地说,将采用这些方法以靶向
外淋巴空间。为此,通过使用激光镫骨足板造孔术(经镫骨)通过卵圆窗或经乳突/经圆窗进行使用微导管的注射(dai c等人,jaro,18:601-617,2017)。
56.也可能通过静脉注射或输注全身施用。
57.本发明的载体系统包含至少一种多核苷酸载体,其可以触发在内毛细胞中全长耳畸蛋白多肽、或其功能片段的表达。优选地,所述多核苷酸载体包含编码所述多肽或其功能片段的编码序列,其可操作地连接至能够在所述细胞中特异性表达基因的启动子。
58.所述编码序列是例如seq id no:2的人耳畸蛋白基因,所述seq id no:2对应人野生型耳畸蛋白基因的同种型1的cdna序列(nm_194248.2=同种型a或变体1,其是最长的同种型)。
59.所述编码序列也可以是seq id no:22的较短的cdna序列nm_001287489.1(同种型e或变体5)、cdna序列nm_004802.3(同种型b或变体2)、cdna序列nm_194322.2(同种型c或变体3)、或cdna序列nm_194323.2(同种型d或变体4)。
60.已经开发了许多病毒和非病毒载体,用于在各种组织和器官中递送遗传物质。在大多数情况下,这些载体无复制能力,几乎没有病毒引起的疾病的威胁。相反,病毒基因组已经部分或完全缺失,从而扩大允许在病毒衣壳中包含治疗性dna货物(cargo)的能力。一些载体包括单链dna,而其他载体包括双链dna。在本发明的上下文中特别优选的载体是慢病毒载体、腺病毒载体、腺相关病毒(aav),如ahmed等人,jaro 18:649-670(2017)所公开。
61.具体来说,aav是来自细小病毒科的小复制缺陷的腺病毒依赖性病毒。其具有直径为20-25nm的二十面体(icosaedrical)衣壳,和侧翼有两个反向末端重复(itr)的4.8kb的基因组。在宿主细胞中脱壳后,aav基因组可以通过形成高分子量的头对尾环状多联体而保持稳定的附加体状态,或者可以整合到宿主细胞基因组中。这两种情况都提供长期和高水平的转基因表达。
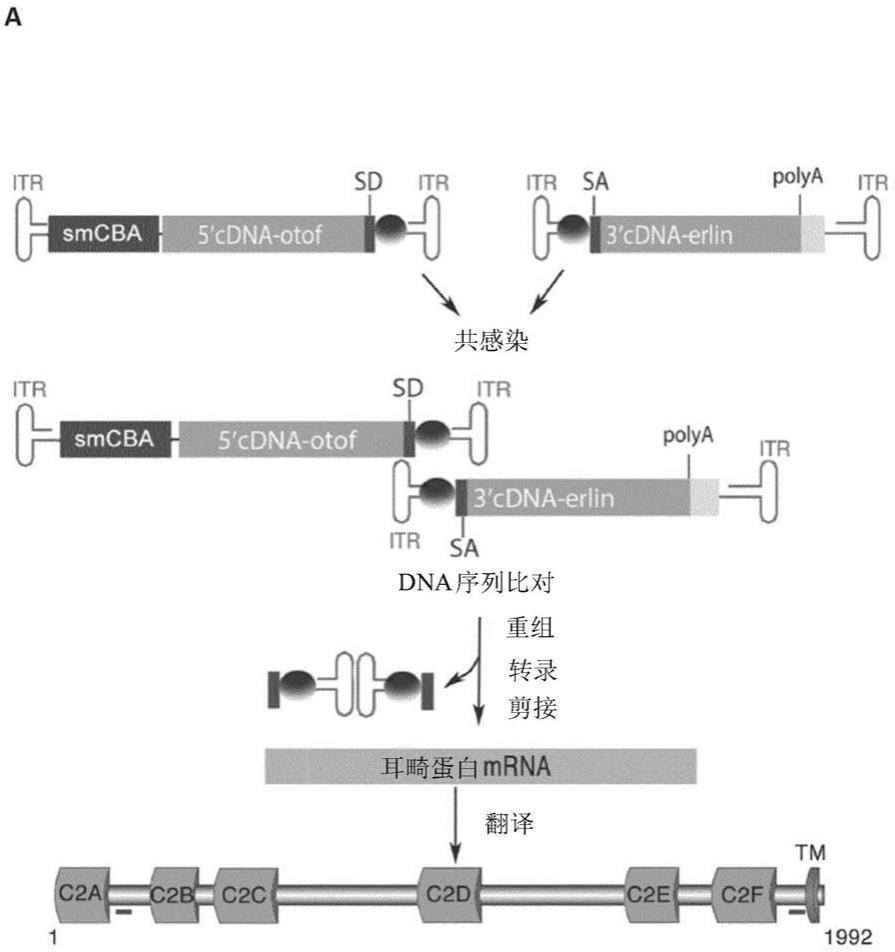
62.基于眼睛基因治疗的人试验所获得的结果,aav似乎是用于耳蜗基因治疗的有前途的病毒。aav在人眼睛基因治疗中取得成功的原因包括:(1)经证实的安全概况(大量人试验表明aav缺乏致病性并且具有非常低的免疫原性),(2)在非分裂细胞中持久的转基因表达,(3)aav的小尺寸(≈20nm,比腺病毒小五倍)有助于穿过细胞屏障扩散,到达所靶向的细胞(zhang等人,frontiers in molecular neuroscience,第11卷,第221条,2018)。
63.在优选的实施方案中,本发明的载体系统包含至少一种aav颗粒,其包含编码全长耳畸蛋白多肽或其功能片段的多核苷酸,如上所述。
64.在另一个优选的实施方案中,本发明的载体系统包含至少两种aav颗粒,它们中的每一种包含患有部分编码序列的多核苷酸,对于一种aav颗粒,所述部分编码序列编码:i)耳畸蛋白多肽或其功能片段的n末端部分,对于另一种aav颗粒,所述部分编码序列编码ii)耳畸蛋白多肽或其功能片段的c末端部分。
65.迄今为止,已对12种天然存在的人aav血清型进行表征。这些血清型在肌肉、肺、肝、脑、视网膜和血管系统中具有不同的固有趋向性和转导效率。在aav假型(pseudotyping)和衣壳工程化的多种尝试导致在转导的趋向性和效率上有显著改善。至于内耳细胞,已证明aav1-4、7和8在体内感染螺旋缘、螺旋韧带和螺旋神经节细胞。还证明aav1-3、5、6和8感染ihc。aav1是最有效的,偶尔会感染ohc和支持细胞。此外,证明aav5对克劳狄斯(claudius)细胞、螺旋神经节和内沟(sulcus)细胞有效。在假型载体中,发现在小鼠
耳蜗中aav2/1有效地转导产生ihc和ohc的祖细胞,而aav2/2对于豚鼠耳蜗的ihc是最佳的(ahmed等人,jaro 18:649-670(2017))。
66.因此,在优选的实施方案中,本发明的载体系统包含选自以下的aav载体:aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9和aav10。
67.在更优选的实施方案中,所述载体的血清型是aav2、aav8、aav5或aav1。在甚至更优选的实施方案中,所述载体的血清型是aav2或aav8。在本发明的上下文中,aav8是最优选的血清型,目前在体内进行测试。
68.为提高基因表达的效率,并防止病毒的意外扩散,可以进行aav的遗传修饰。这些遗传修饰包括删除e1区、删除e1区并删除e2或e4区,或删除整个腺病毒基因组,顺式作用反向末端重复和包装信号除外。此类载体有利地包括在本发明中。
69.此外,可以使用具有突变的衣壳蛋白的遗传修饰的aav以指导在特定的组织类型中基因表达,例如听觉细胞。为此,可以使用修饰的血清型2和8aav载体,其中病毒包膜中的酪氨酸残基被丙氨酸残基取代。在酪氨酸突变血清型2的情况下,酪氨酸444可以被丙氨酸(aav2-y444a)取代。在血清型8的情况下,酪氨酸733可以被丙氨酸残基(aav8-y733a)取代。通过使用aav2-y444a或aav8-y733a,可能将基因传递增加多达10,000倍,从而减少感染耳蜗感觉毛细胞所需的aav量。
70.在一个优选的实施方案中,表达耳畸蛋白多肽或其基因或其功能片段的本发明的多核苷酸包含在重组aav2颗粒中,在所述aav2颗粒中所有酪氨酸残基已被苯丙氨酸残基取代(aav2(y-》f)或quad y-f,如petrs-silva h等人,mol.ther.19,293-301(2011)和在以下的实施例中所公开的。衣壳蛋白外表面上的突变酪氨酸残基包括,例如但不限于以下的突变:tyr252至phe252(y252f)、tyr272至phe272(y272f)、tyr444至phe444(y444f)、tyr500至phe500(y500f)、tyr700至phe700(y700f)、tyr704至phe704(y704f)、tyr730至phe730(y730f)以及tyr733至phe733(y733f)。这些修饰的载体促进载体穿过圆窗膜,这允许载体非侵入性地递送至耳蜗的毛细胞/螺旋神经节神经元。这些突变的载体避免被蛋白酶体所降解,并且它们的转导效率显著增加。
71.其它源自天然血清型1-10的重组aav颗粒包括aav2-aav3杂合体、aavrh.10、aavhu.14、aav3a/3b、aavrh32.33、aav-hsc15、aav-hsc17、aavhu.37、aavrh.8、cht-p6、aav2.5、aav6.2、aav2i8、aav-hsc15/17、aavm41、aav9.45、aav6(y445f/y731f)、aav2.5t、aav-hae1/2、aav克隆32/83、aavshh10、aav8(y733f)、aav2.15、aav2.4、aavm41、和aavr3.45(asokan a等人,mol.therapy,第20卷,第4号,第699-708页,2012)。
72.也可以使用合成载体anc80l65,其已被证明具有迄今为止报道的内耳毛细胞的最高转导效率(suzuki等人,sci.rep.7:45524(2017))。也可能使用外来体相关的aav,如等人,ther.25(2):379-391,2017所建议的。
73.也可以使用超载的aav/php.b载体,其衣壳已被修饰以增强其包装能力。
74.制备包含异源多核苷酸或构建体的病毒和病毒粒子的方法是本领域已知的。在aav的情况下,细胞可以用腺病毒或包含适合aav辅助功能的腺病毒基因的多核苷酸构建体共感染或转染。材料和方法的示例在例如美国8,137,962和6,967,018中描述。
75.技术人员将容易地确定,在施用本发明的载体之前是否需要根据靶细胞来增强圆窗膜的渗透性,如wo 2011/075838中所建议。
76.即使使用aav,本发明的系统也可以是单载体系统。在这种情况下,可以使用修饰的衣壳(参见aav/php.b载体)。
77.如果所选择的aav衣壳具有5千碱基的有限包装容量,则最好使用双载体系统,例如在wo 2013/075008中公开的,其通过引用并入本文。
78.本发明人已使用所述双aav载体方法将耳畸蛋白基因分成两个部分提供至内毛细胞,在那里发生同源重组并表达全长蛋白。其结果表明,两种不同的aav载体能够有效地转导所靶向的内毛细胞,在内毛细胞中产生耳畸蛋白,并以持久的方式恢复因dfnb9失效而患先天性耳聋的小鼠otof ko的严重耳聋表型。
79.因此,本发明的载体系统优选包含至少两种aav颗粒,每种所述aav颗粒包含:
80.a)第一多核苷酸,其包含在所述多核苷酸的每个末端的反向末端重复,以及在所述反向末端重复之间从5'至3’的合适的启动子、之后是含有耳畸蛋白基因的n末端部分的部分编码序列、以及剪接供体位点,或
81.b)第二多核苷酸,其包含在所述多核苷酸的每个末端的反向末端重复,以及在所述反向末端重复之间从5'至3'的剪接接受位点、含有耳畸蛋白基因的c末端部分的部分编码序列,之后任选的多腺苷酸化序列,
82.其中所述第一和第二多核苷酸还含有引起重组的序列,其位于所述第一多核苷酸的剪接供体位点之后,所述第二多核苷酸的剪接受体位点之前,以及
83.其中当第一和第二多核苷酸结合时其中的编码序列编码全长耳畸蛋白多肽。
84.该优选的实施方案使用“第一”和“第二”多核苷酸。然而,除非另有明确说明,否则“第一”和“第二”并不意味着表示特定的顺序或重要性。
85.如图1和wo 2013/075008所阐述,在该具体实施方案中使用的第一和第二多核苷酸应含有特定的遗传组分,以诱导靶细胞中耳畸蛋白的适当重组和表达。
86.这些特定组分如下:
87.·
itr
88.在本发明的一些实施方案中,otof基因的部分或全长cdna插入到两个含itr的质粒中。
89.如果使用aav载体,则本文所述的多核苷酸的itr序列可源自任何aav血清型(例如,1、2、3、4、5、6、7、8、9或10)或可以源自一种以上血清型。在本文提供的多核苷酸的一些实施方案中,itr序列源自aav2。itr序列和含有itr序列的质粒在本领域中是已知的并且是商业上可获得的。
90.位于表达构建体的5'端侧翼的示例性aav2 itr序列包含序列seq id no:10。位于表达构建体的3'端侧翼的示例性aav2 itr序列包含序列seq id no:11。
91.如果本发明的多核苷酸是单载体系统,则可以有利地使用这种itr。
92.·
合适的启动子
93.预期用于本发明的载体系统的启动子包括、但不限于巨细胞病毒(cmv)启动子、sv40启动子、鲁斯氏肉瘤病毒(rsv)启动子、嵌合cmv/鸡-β肌动蛋白启动子(cba)和cba的截短形式(smcba)(美国专利号8,298,818)。在一个特定实施方案中,启动子是包含cmv和β-肌动蛋白启动子的嵌合启动子。
94.在优选的实施方案中,在本发明的载体系统中使用的启动子是seq id no:8的截
id no:13具有至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、或100%序列同一性的剪接位点。
109.包含在单或在双载体系统中的本发明的多核苷酸序列,可含有在待表达载体的内毛细胞中具有功能的其他调节组分。本领域普通技术人员可以选择用于人内毛细胞中的调节元件。调节元件包括例如内部核糖体进入位点(ires)、转录终止序列、翻译终止序列、增强子和聚腺苷酸化元件。
110.转录终止区通常可以从真核或病毒基因序列的3'非翻译区获得。转录终止序列可以定位在编码序列的下游以提供有效终止。信号肽序列是氨基末端序列,其编码的信息负责将可操作连接的多肽重新定位到广泛的翻译后细胞目的地,范围从特定的细胞器区室到蛋白质作用位点和细胞外环境。增强子是增加基因转录的顺式作用元件,也可以包含在载体中。增强子元件是本领域已知的,包括但不限于camv 35s增强子元件、巨细胞病毒(cmv)早期启动子增强子元件和sv40增强子元件。
111.在载体中还可以包括指导结构基因编码的mrna聚腺苷酸化的dna序列。
112.双载体方法有利地将otof基因的编码序列分成两部分,以便更容易地包装到具有有限包装能力的病毒粒子中。当使用aav衣壳时,优选使用包含otof编码序列的多核苷酸,所述otof编码序列不超过5千碱基、不超过4千碱基、甚至更优选不超过3千碱基。
113.人otof基因的编码序列优选在天然剪接位点切割。
114.例如,seq id no:2的人otof基因同种型1可以被分成n末端部分和c末端部分,所述的n末端部分具有如seq id no:3(seq id no:2的核苷酸1-2676)所示的核苷酸序列,所述c末端部分具有如seq id no:4(seq id no:2的核苷酸2677-5994)所示的核苷酸序列。具有seq id no:22的人otof基因同种型5可以被分成seq id no:3的n末端部分和seq id no:23的c末端部分。
115.可以作为在本发明的载体系统中的第一和第二多核苷酸的示例性多核苷酸分别例如seq id no:19和seq id no:20。这两种多核苷酸分别编码人耳畸蛋白蛋白的同种型1的n末端和c末端部分。
116.seq id no:19包含:
[0117]-具有序列seq id no:10(nt20-162)的aav2的5itr序列、
[0118]-cmv增强子(nt186-440)、鸡β-肌动蛋白启动子(nt441-835)、β-肌动蛋白蛋白的外显子1和嵌合内含子(nt836-1130),所有三个被称为“smcba”,对应序列seq id no:8、
[0119]-人耳畸蛋白同种型1编码序列的5’部分,其具有序列seq id no:3(nt1153-3558)、
[0120]-具有序列seq id no:12(nt3559-3642)的碱性磷酸酶的剪接供体位点、
[0121]-具有序列seq id no:9(nt3649-3935)的引起重组的序列,以及
[0122]-具有序列seq id no:11的aav2的3'itr序列。
[0123]
另一方面,seq id no:20包含:
[0124]-具有序列seq id no:10(nt20-162)的aav2的5'itr序列、
[0125]-具有序列seq id no:9(nt207-493)的引起重组的序列、
[0126]-具有序列seq id no:13(nt516-564)的碱性磷酸酶的剪接受体位点、
[0127]-人耳畸蛋白同种型1编码序列的3’部分,其具有序列seq id no:4(nt565-4152)、
[0128]
和
[0129]-牛生长激素聚腺苷酸化信号(nt4190-4411)、以及
[0130]-具有序列seq id no:11的aav2的3'itr序列。
[0131]
可以在本发明的载体系统中用作第一和第二多核苷酸的示例性多核苷酸分别为例如seq id no:19和seq id no:21。这两种多核苷酸分别编码seq id no:22的人耳畸蛋白基因的同种型5的n末端和c末端部分(因为同种型1&5的n末端部分相同,可以使用seq id no:19用于诱导两种同种型的表达)。
[0132]
seq id no:21包含:
[0133]-具有序列seq id no:10(nt20-162)的aav2的5'itr序列、
[0134]-具有序列seq id no:9(nt207-493)的引起重组的序列、
[0135]-具有序列seq id no:13(nt516-564)的碱性磷酸酶的剪接受体位点、
[0136]-人耳畸蛋白同种型5的编码序列的3'部分,其具有seq id no:23(nt565-4152)、
[0137]
和
[0138]-牛生长激素聚腺苷酸化信号(nt4190-4411)、以及
[0139]-aav2的3'itr序列,其具有序列seq id no:11。
[0140]
本发明的药物组合物
[0141]
在另一方面,本发明靶向包含本发明的载体系统的药物组合物,如上所述(即,多核苷酸或含有其的病毒粒子),用于治疗患有dfnb9耳聋的具有成熟听觉系统患者(特别是人患者),或用于预防具有dfnb9突变的患者中的dfnb9耳聋。
[0142]
更普遍的,该药物组合物可以施用于由于dfnb59基因表达的改变或缺陷而患有先天性听力丧失的人受试者。所述缺陷,例如,可以当耳畸蛋白以正常水平表达但没有功能时观察到。
[0143]
换句话说,如上所述,本发明涉及本发明的载体系统在制备用于预防和/或治疗具有成熟听觉系统的患者的药物组合物中的用途,所述患者(特别是人)患有与dfnb59基因表达的改变或缺陷相关的上述病症。
[0144]
如本文所用,“药学上可接受的载体”包括任何和所有生理相容的溶剂、分散介质、涂层、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等。药学上可接受的载体的实例包括水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等中的一种或多种,以及其组合。在许多情况下,可以优选在组合物中包括等渗剂,例如糖、多元醇如甘露醇、山梨糖醇或氯化钠。药学上可接受的载体可进一步包含少量辅助物质,例如润湿剂或乳化剂、防腐剂或缓冲剂,其提高抗氧化化合物或含有抗氧化化合物的药物组合物的保质期或有效性。
[0145]
本发明的药物组合物可以是多种形式。这些包括,例如,液体、半固体和固体剂型,例如液体溶液(例如,可注射和不熔化溶液)、分散剂或混悬剂、片剂、丸剂、粉剂、脂质体和栓剂。使用的形式取决于预期的施用方式和治疗应用。典型的组合物是可注射或不熔化溶液的形式。
[0146]
药物组合物通常在制造和储存条件下必须是无菌和稳定的。本发明的药物组合物优选配制成溶液、微乳液、分散剂、脂质体或其它适合高药物浓度的有序结构。根据需要,可以通过将所需量的本发明载体与一种以上列举的成分或以上列举的成分的组合,掺入适当的溶剂中,然后过滤除菌来制备无菌可注射溶液。通常,通过将本发明的载体掺入含有基本
分散介质和来自上面列举的那些所需的其他成分的无菌载剂中来制备分散剂。在用于制备无菌可注射溶液的无菌冻干粉剂的情况下,优选的制备方法是真空干燥和喷雾干燥,其从其之前无菌过滤的溶液产生活性成分加上任何额外的所需成分的粉剂。可以通过以下维持溶液的适当流动性,例如通过使用诸如卵磷脂的涂层、在分散剂的情况下通过维持所需的粒度以及通过使用表面活性剂。可以通过在组合物中包含延迟吸收的试剂(例如,单硬脂酸盐和明胶)来实现延长吸收可注射组合物。
[0147]
在本发明的上下文中,本发明组合物的典型施用模型是鼓室内(中耳)、耳蜗内、或肠胃外(例如,静脉内、皮下、腹膜内、肌肉内、鞘内(intrathecal))。在一个实例中,本发明的药物组合物通过静脉输注或注射施用。在另一个实例中,使用立体定位递送,特别是通过鼓膜或乳突递送进中耳,将本发明的药物组合物递送至特定位置。
[0148]
更准确地,可以通过使用微导管施用本发明的组合物,其通过使用激光镫骨足板造孔术(经镫骨)通过卵圆窗或经乳突/经圆窗进行(dai c等人,jaro,18:601-617,2017)。
[0149]
在本发明的一个优选实施方案中,本发明的药物组合物通过耳蜗内施用在人耳中施用,更准确地说是通过靶向上述的前庭系统中的内淋巴空间或通过半规方法。
[0150]
本发明的药物组合物通常包括“治疗有效量”或“预防有效量”的本发明载体。“治疗有效量”是指本发明的载体的量,其以必要的剂量和在必要的时间段内有效以实现期望的治疗结果,在这种情况下预防和治疗听力丧失而没有不可接受的毒性或不良副作用。
[0151]
本发明的载体的治疗有效量可根据以下因素而变化:诸如受试者的疾病状态、年龄、性别和体重以及所述化合物在受试者中引发所需反应的能力。治疗有效量也可以是其中要求保护的化合物的任何毒性或有害效果被治疗有益效果超过的量。“预防有效量”是指以必要的剂量和在必要的时间段内有效以实现期望的预防结果的本发明的载体的量。通常,由于可在疾病发生之前或早期阶段对受试者使用预防剂量,因此预防有效量通常小于治疗有效量。
[0152]
可以调整剂量方案以提供最佳的所需反应(例如,治疗或预防反应)。例如,根据治疗状况的迫切情况,可以施用单次大剂量、可以随时间施用数个分开的剂量,或可以成比例地减少或增加剂量。如本文所用的剂量单位形式是指适合作为待治疗哺乳动物受试者的单位剂量的物理离散单位;每个单位含有经计算的预定量的本发明载体化合物与所需的药物载体,以产生所期望的治疗或预防效果。剂量单位形式的规格(specification)可以由以下所决定并直接取决于以下:(a)载体的独特表征和待实现的具体治疗或预防效果,以及(b)在用于治疗或预防受试者听力丧失的此类载体的制剂领域的内在的限制。
[0153]
在使用第一和第二aav颗粒的一些实施方案中,第一和第二aav多核苷酸/颗粒可以包含在相同组合物或不同组合物中并且可以一起或分开施用。
[0154]
在某些实施方案中,本发明的组合物含有106至10
14
颗粒/ml或10
10
至10
15
颗粒/ml,或在任一范围之间的任何值,例如如,约106、107、108、109、10
10
、10
11
、10
12
、10
13
、或10
14
颗粒/ml。在一个实施方案中,本发明的组合物包含多于10
13
的aav颗粒/ml。
[0155]
在一些实施方案中,当施用包含第一多核苷酸的第一aav颗粒和包含第二多核苷酸的第二aav颗粒时,对两种颗粒而言施用量是相同的。
[0156]
本发明还涉及治疗方法,该方法包括将载体系统和含有该载体系统的药物组合物施用至患有dfnb9耳聋的患者,特别是具有成熟听觉系统的人患者。以上公开的所有实施方
案均适用于所述治疗方法。
附图说明
[0157]
图1显示双aav载体递送后hek293细胞中耳畸蛋白的表达。
[0158]
a)本研究中使用的重组aav载体对,以及在共感染细胞中产生全长蛋白耳畸蛋白的重组、转录、剪接和翻译过程的示意图。重组的aav-otof nt和aav-otof ct载体分别含有耳畸蛋白cdna的5'和3'部分。存在于两种重组载体中的引起重组的桥接序列由灰色球表示。蛋白图表下的红色棒表示两种肽,其用于产生针对耳畸蛋白的n末端和c末端部分的抗体。缩写:itr,反向末端重复;smcba,巨细胞病毒立即早期/鸡β-肌动蛋白嵌合启动子;sa,剪接受体位点;sd,剪接供体位点;polya,聚腺苷酸化信号;c2,c2结构域;tm,跨膜结构域。b)用aav-otof nt单独(上图)、aav-otof ct单独(中图)、或aav-otof nt与aav-otof ct一起(下图)感染hek293细胞。48小时之后,使用针对蛋白的c末端部分的多克隆抗体将耳畸蛋白染色(绿色),并用dapi标记细胞核(蓝色)。只有共感染的细胞产生耳畸蛋白。比例尺:15μm。
[0159]
图2显示在p10 otof-/-小鼠中进行双aav介导的基因疗法恢复耳畸蛋白表达并预防耳聋。
[0160]
(a)左图:在p70,注射耳蜗的中部和顶端转弯(turn)针对耳畸蛋白进行免疫染色的拼接共聚焦图像(绿色)。用dapi染色细胞核(蓝色)。大部分ihc表达耳畸蛋白,但没有外毛细胞(ohc)表达耳畸蛋白。箭头表示非转导的ihc。插图:更高放大倍数的盒型区域。比例尺:50μm和10μm(插图)。右图:耳畸蛋白(绿色)、带状蛋白(ribbon protein)ribeye(蓝色)和突触后谷氨酸受体的glua2亚基(红色)的ihc免疫共染色图像。突触活性区在表达耳畸蛋白的转导的ihc中具有正常分布,然而在非转导的ihc(由虚线表示)中倾向于形成簇(箭头)。比例尺:5μm。(b)左图:双aav注射后四周,otof-/-小鼠响应于短声或8khz、16khz和32khz频率的猝发音(绿点,n=8)显示的abr阈值接近野生型小鼠的abr阈值(黑点,n=8)。与之相反的,接受aav-otof nt的otof-/-小鼠(橙点,n=3)或未注射的otof-/-小鼠(蓝点,n=6)在高达86db spl的声音强度水平时没有可识别的abr波形。右图:在p10时治疗的otof-/-小鼠中(箭头),短声刺激的听力阈值在恢复后稳定至少六个月。(c)左图:在野生型小鼠、otof-/-小鼠(otof-/-)、以及拯救的otof-/-小鼠(注射的otof-/-)中在治疗性注射后三周记录的abr轨迹,显示在野生型和拯救的小鼠中相似的波形。右图:柱状图显示在拯救的otof-/-小鼠(灰色,n=8)和野生型小鼠(黑色,n=5)中abr波i的潜伏期和归一化振幅。
[0161]
图3显示对otof-/-小鼠在p17进行双aav介导的基因疗法持久恢复耳畸蛋白表达和听力。
[0162]
(a)左图:在p80,注射的耳蜗的中部和顶端转弯针对耳畸蛋白进行免疫染色的拼接共聚焦图像(绿色)。用dapi染色细胞核(蓝色)。大多数ihc表达耳畸蛋白,而外毛细胞(ohc)不表达。箭头表示未转导的ihc。插图:更高放大倍数的盒型区域。比例尺:50μm和10μm(插图)。右图:耳畸蛋白(绿色)、带状蛋白ribeye(蓝色)和突触后谷氨酸受体的glua2亚基(红色)的ihc免疫共染色图像。在表达耳畸蛋白的转导的ihc中突触活性区具有正常分布,然而在非转导的ihc(由虚线表示)中倾向于形成簇(箭头)。比例尺:5μm。(b)左图:在治疗的
小鼠中在耳蜗内注射重组载体对的四周后,未治疗的otof-/-小鼠(蓝色,n=5)、治疗的otof-/-小鼠(绿色,n=5)和野生型小鼠(黑色,n=5)响应于短声或8、16和32khz频率的猝发音刺激的abr阈值。右图:在p17接受注射的otof-/-小鼠(箭头)听力恢复的时间过程。接近野生型水平的听力恢复在注射后保持至少二十周。(c)左图:在野生型小鼠(黑色)、otof-/-小鼠(otof-/-)、以及拯救的otof-/-小鼠(注射的otof-/-)在治疗性注射后两周记录的abr轨迹,显示在野生型和拯救的小鼠中相似的波形。右图:柱状图表明,在拯救的otof-/-小鼠(n=5)中abr波形i的潜伏期(latency)与野生型小鼠(n=5)相似,而拯救的otof-/-小鼠的归一化振幅是在野生型小鼠中的约一半。
[0163]
图4显示对otof-/-小鼠在p30进行双aav介导的基因疗法以持续的方式恢复耳畸蛋白表达和听力。
[0164]
(a)左图:在p40,注射的耳蜗的中部和顶端转弯对耳畸蛋白进行免疫染色的拼接共聚焦图像(绿色)。用dapi染色细胞核(蓝色)。大多数ihc表达耳畸蛋白,而外毛细胞(ohc)不表达。箭头表示未转导的ihc。插图:更高放大倍数的盒型区域。比例尺:50μm和10μm(插图)。右图:耳畸蛋白(绿色)、带状蛋白ribeye(蓝色)和突触后谷氨酸受体的glua2亚基(红色)的ihc免疫共染色图像。突触活性区在表达耳畸蛋白的转导的ihc中具有正常分布,然而在非转导的ihc(由虚线表示)中倾向于形成簇(箭头)。比例尺:5μm。(b)在治疗的小鼠中在耳蜗内注射重组载体对后三周(左图)、十四周和二十周(右图),未治疗的otof-/-小鼠(蓝色,n=3)、治疗的otof-/-小鼠(绿色,n=3)和野生型小鼠(黑色,n=3)响应于短声或8、16和32khz频率的猝发音刺激的abr阈值。在这些小鼠中,接近野生型水平的听力恢复在注射后保持至少二十周。(c)左图:在野生型小鼠(黑色)、otof-/-小鼠(otof-/-)、以及拯救的otof-/-小鼠(注射的otof-/-)在治疗性注射后七周记录的abr轨迹,显示在野生型和拯救的小鼠中相似的波形。右图:柱状图表明,在拯救的otof-/-小鼠(n=3)中的abr波形i潜伏期与野生型小鼠(n=3)相似,而拯救的otof-/-小鼠的归一化振幅是在野生型小鼠中的约一半。
[0165]
图5显示在otof
ts/ts
小鼠中的双aav介导的基因疗法恢复耳畸蛋白正常表达和听力。a)对位于野生型(otof
+/+
)小鼠(左图)、otof
ts/ts
小鼠(中图)、以及治疗的otof
ts/ts
(右图)小鼠中的中部转弯耳蜗的ihc(用虚线勾勒)对耳畸蛋白进行免疫染色(绿色)的共聚焦图像。虽然耳畸蛋白在未治疗的otof
ts/ts
小鼠的ihc底部(base)显示异常聚集,但耳畸蛋白在治疗小鼠的ihc中的表达是接近正常的。b)在野生型小鼠(黑色)、otof
ts/ts
小鼠(蓝色)、以及拯救的otof
ts/ts
小鼠(绿色)中在治疗性注射后四周记录的abr波形,显示在野生型和拯救的小鼠中相似的波形,然而在未治疗的突变体中没有检测到abr波。
[0166]
图6中的图公开了人和小鼠中听力系统的成熟差异(shnerson和willott,j.comp.physiol.psychol.1980年2月;94(1):36-40)。
[0167]
图7描述到目前为止已识别的dfnb9基因的一些突变。这些突变构成了语言习得前耳聋dfnb9的隐性形式。
[0168]
图8显示(a)otof
ts/ts
小鼠的内毛细胞中耳畸蛋白的蛋白聚集和错误折叠,(b)otof
+/ts
和otof
ts/ts
小鼠的听觉脑干反应(abr)(也参见图5)。
[0169]
图9公开单侧注射aav-otof nt加aav-otof ct重组载体对对otof
ts/ts
小鼠的影响。注射后5周,对治疗的三只otof
ts/ts
小鼠的耳蜗感觉上皮进行显微解剖并对耳畸蛋白进行免
疫标记。已经测量治疗的耳蜗的ihc中的耳畸蛋白表达,并将其与在otof
ts/ts
未治疗的小鼠中的耳畸蛋白表达进行比较(也参见图5)。
[0170]
图10公开在野生型、otof
ts/ts
和otof
ts/ts
治疗的ihc中i
ca
的电压激活曲线(a)和相应的δcm反应(b)。细胞膜电容(δcm)的变化用于监测在胞外分泌期间的突触囊泡融合。
实施例
[0171]
i.材料和方法
[0172]
动物
[0173]
在c57bl/6种系中产生的耳畸蛋白敲除(otof-/-)小鼠(rouxi.等人,cell,127,277-289(2006)与fvb小鼠回交十代以上以获得同质fvb遗传背景,因为与c57bl/6背景不同,fvb遗传背景在生命的前十个月与稳定的听力阈值相关(kommareddi,p.等人,j assoc res otolaryngol 16,695-712(2015))。将重组aav2载体递送至fvb遗传背景中的otof-/-小鼠中。所有方法和动物治疗均符合国家医学研究所(institut national de la sant
é
et de la recherche m
é
dicale)、巴斯德研究所和nih的福利指南,以及加州大学旧金山分校批准的操作方案要求。手术前,通过腹膜内注射盐酸氯胺酮(ketaset,100mg/kg)、盐酸甲苯噻嗪(xyla-ject,10mg/kg)和乙酰丙嗪(2mg/kg)的混合物麻醉小鼠。通过监测深层组织对脚趾挤压的反应来检查麻醉深度。在手术前以及手术后一周每24小时,小鼠接受卡洛芬(2mg/kg)皮下注射以减轻炎症和疼痛。在手术后监测动物的痛苦迹象和异常体重减轻。
[0174]
产生在c2f结构域中携带热敏突变的小鼠模型(otof
ts/ts
)(p.e1804del)。otof
ts/ts
小鼠严重耳聋。图8中显示的结果突出显示,这些小鼠ihc中耳畸蛋白的分布异常/受到强烈干扰:蛋白在内毛细胞中聚集和错误折叠。此外,当在otof
+/ts
和otof
ts/ts
小鼠记录听觉脑干反应(abr)以监测对短声刺激的初级听觉神经元的电反应和中枢听觉通路的连续神经传递(relay)时,观察到在1个月龄时,otof
+/ts
小鼠在各种测试强度(40-86db)下获得abr特征波形,但在otof
ts/ts
小鼠中,即使在100db也没有引起反应。
[0175]
重组的aav2载体构建体和包装
[0176]
将鼠耳畸蛋白cdna的全长编码序列(otof1同种型1;nm_001100395.1)分为5'片段(核苷酸1-2448)和3'片段(核苷酸2449-5979),并合成这些片段(genscript,piscataway,nj)。5'构建体包含otof1 cdna的5'部分(编码氨基酸1-816,包括蛋白的c2a、c2b和c2c结构域)和剪接供体(sd)位点,3'构建体包含otof1 cdna的3'部分(编码氨基酸817-1992,包括蛋白的c2d、c2e、c2f和跨膜结构域)、剪接受体位点(sa)。此外,两种构建体都含有碱性磷酸酶引起重组的桥接序列[lay y等人,hum gene ther 17,1036-1042(2006);ghosh a.等人,hum gene ther 22,77-83(2011);dyka f.m.等人,hum gene ther methods 25,166-177(2014)]。将noti/nhei和mfei/kpni限制性内切核酸酶的识别位点添加到这些构建体中,然后如前所述将其插入到aav ptr22载体质粒中[lay y等人,hum gene ther 17,1036-1042(2006);ghosh a.等人,hum gene ther 22,77-83(2011);dyka f.m.等人,hum gene ther methods 25,166-177(2014)],产生了一对称为aav-otof nt和aav-otof ct的重组载体。另一个包含绿色荧光蛋白(gfp)cdna的重组载体经工程化用作细胞转导的阳性对照。重组载体包装在aav2 quady-f衣壳中(petrs-silvah等人,molecular therapy:the journal of the american society of gene therapy 19,293-301(2011),重组病毒在佛罗里达大学
眼睛基因治疗中心(university of florida ocular gene therapy core)得到纯化和滴定,如前所述[zolotukhin s.等人,methods 28,158-167(2002);jacobson sg等人,molecular therapy:the journal of the american society of gene therapy 13,1074-1084(2006)]。
[0177]
转染的hek293细胞中的转基因表达
[0178]
hek293细胞在6孔板中的聚赖氨酸包被的盖玻片上在dulbecco改良的eagle培养基中生长,该培养基中补充有1
×
非必需氨基酸和10%胎牛血清(gibco)、以及青霉素-链霉素(pen/strep,invitrogen)。第二天,如之前所述使细胞被感染(lopesv.s.等人,gene ther 20,824-833(2013))。简而言之,将具有75%汇合的细胞的盖玻片在37℃下、于5%二氧化碳中孵育在200μl的无血清培养基中,该培养基含有aav2-otof重组病毒中的一种或两种(对每个载体而言为含10 000个基因组的颗粒/细胞)。两小时后,加入1ml的完全培养基。第二天更换培养基,将细胞再孵育另外48小时。用4%多聚甲醛在0.1m磷酸盐缓冲盐水(pbs)中(ph7.4)在4℃下将细胞固定2小时,用pbs冲洗3次,然后与0.25%triton x-100和5%常规山羊血清在pbs中在室温下一起孵育一小时。然后,将细胞与之前表征的兔多克隆抗体14cc和c19在4℃孵育过夜,所述14cc和c19分别针对耳畸蛋白的n末端部分(氨基酸196-211)和c末端部分(氨基酸1848-1978)(roux i.等人,cell,127,277-289(2006)(1:200稀释))。将样品用pbs冲洗两次,并与cy3缀合的山羊抗兔igg二抗(life technologies,1:2000稀释)在pbs中在室温下孵育两小时。然后,将样品在pbs中冲洗两次,用4',6-二脒基-2-苯基吲哚(dapi)染色以使得细胞核可视化,用一滴fluorsave介质(biochem laboratories,法国)封在载玻片上,并用olympus共聚焦免疫荧光显微镜观察。
[0179]
向耳蜗的载体递送
[0180]
如前所述,将病毒递送至左耳蜗(akil o.等人,neuron 75,283-293(2012))。在p10、p17或p30天,麻醉的otof-/-小鼠接受aav2-otof载体对注射,所述注射通过圆窗膜进入耳蜗的鼓阶。通过背侧切口进入耳朵(duan m等人,gene ther11增刊1,s51-56(2004))。用18g针在大疱(bulla)上打一个小孔,用钳子扩大。用硼硅酸盐毛细玻璃移液管轻轻刺破圆窗膜,然后将移液管取出。当外淋巴外流停止时,将含有av2-otof nt(6.3x10
12 vg/ml)和aav2-otof ct(4.5x10
12 vg/ml)载体对的固定体积(2μl)通过细玻璃微量移液器(外尖端直径为10μm)在一分钟的时间段内注入鼓阶。拔出移液管,用筋膜和脂肪组织迅速封闭凹口(niche)。伤口用6-0可吸收铬缝线(ethicon)分层缝合。
[0181]
听觉测试
[0182]
如前所述,在隔音室中在不同时间点对麻醉的otof
+/+
小鼠、otof-/-小鼠和拯救的otof-/-小鼠进行听觉测试(akil o.等人,neuron 75,283-293(2012)。通过腹膜内注射盐酸氯胺酮(ketaset,100mg/ml)和盐酸甲苯噻嗪(xyla-ject,10mg/ml)的混合物麻醉小鼠,如果需要,随后注射初始剂量的五分之一。体温用加热垫保持,并在整个记录过程中用直肠探头监测。使用tdt biosig iii系统(tucker davis technologies)和位于小鼠头皮上的三个皮下针电极(一个在头顶、一个在左耳耳廓下方(参考电极)、一个在对侧耳朵下方(接地电极))记录听觉脑干反应(abr)。声音刺激是短声(5ms持续时间、31hz)和8、16和32khz的调值(tone pip)(10ms持续时间、余弦平方成形、21hz)。在自由场条件下递送声音,从左耳记录单声道反应(在记录过程中右耳被堵住)。对于每个声音刺激,以25khz的采样率以及过滤
(0.3-3khz)记录脑电图(eeg)活动20ms。分别平均短声和猝发音的512个刺激和1000个刺激的eeg波形。声音刺激强度从最大测试强度(86db spl)以5db声压级(spl)间隔递减。听力阈值被定义为在目视检查时abr的波i-v峰清晰且重复出现的最低刺激水平。通过对存储波形的离线分析确认这些阈值评估。abr波i的潜伏期作为短声刺激和波i的峰值振幅之间的时间间隔测量。此外,为了比较拯救的otof-/-小鼠和野生型小鼠,将在abr轨迹上的波i的峰值振幅的值相对于对照野生型小鼠的平均值(取为100%)进行归一化。
[0183]
内毛细胞和突触带计数
[0184]
用4%多聚甲醛的0.1m pbs溶液(ph7.4)灌注小鼠耳蜗,并于4℃在相同固定剂中孵育两小时。将耳蜗用pbs冲洗3次,并通过在4℃下与5%乙二胺四乙酸(edta)的0.1m pbs溶液孵育过夜来脱钙。将耳蜗感觉上皮(corti器官)显微切割成表面制备物,将其在0.25%triton x-100和含5%正常山羊血清的pbs溶液(封闭缓冲液)中在室温下预孵育1小时,然后与一抗在4℃孵育过夜。使用以下抗体:兔抗耳畸蛋白c末端部分(c19,1:250稀释)1、小鼠(igg1)抗-ctbp2/ribeye、小鼠(igg2a)抗-谷氨酸受体亚基a2(millipore,1:200稀释)和兔抗gfp(invitrogen,a11122;1:250稀释)。样品在pbs中冲洗3次,并与合适的二抗一起孵育:alexa fluor 488缀合的抗小鼠igg1、alexa fluor 568缀合的抗小鼠igg2a(life technologies,1:1000稀释)或atto fluor 647缀合的抗兔igg(sigma,1:200稀释)。样品在pbs中洗涤3次,并在一滴fluorsave中封在载玻片上,用dapi染色细胞核。用配备高分辨率物镜(数值孔径为1.4,60x油浸物镜)的lsm700共聚焦显微镜(zeiss,奥伯科亨,德国)获得corti器官的荧光共聚焦z堆栈(z-stack)。在512
×
512或1024
×
1024光栅(在x和y中的像素尺寸=0.036μm)以及0.2μm的z步长获取图像。通过多达20个共聚焦图像的z堆栈的3d渲染计数产生耳畸蛋白和突触带的内毛细胞(ihc)。为计算表达耳畸蛋白转基因的ihc的比例,我们将产生耳畸蛋白的ihc的总数除以dapi染色的细胞核鉴定的ihc总数(至少150个连续分析)。
[0185]
逆转录酶-聚合酶链式反应(rt-pcr)
[0186]
从六只otof+/+小鼠和六只在p10拯救的otof-/-小鼠的左耳蜗中提取总mrna(trizol,invitrogen)。使用寡dt引物和superscript ii rnaseh-(invitrogen)在42℃下进行逆转录(rt)50分钟。两微升rt反应产物用于聚合酶链反应(pcr;taqdna聚合酶,invitrogen)包括35轮循环(94℃持续30s、60℃持续45s、72℃持续60s),在72℃下进行最终延伸达10分钟。pcr引物对(正向引物tgtctcagagctccgaggca(seq id no:14)和反向引物(atcgtggaggaggaactgggca(seq id no:15)设计用于扩增耳畸蛋白cdna的2676bp中间片段(核苷酸27至2702)(genbank登录号nm_001100395.),包括在aav-otof nt和aav-otof ct插入之间的连接。通过在含有0.5mg/ml溴化乙锭的2%琼脂糖凝胶(qiaquick凝胶提取试剂盒,qiagen)上电泳纯化pcr产物、测序(elim biopharmaceuticals)、并检查与耳畸蛋白cdna序列的序列同一性。
[0187]
统计分析
[0188]
数据表示为平均值
±
标准差(sd)。所有统计分析均采用非参数mann-whitney u检验进行。统计显著性在图中表示如下:n.s.,不显著;*,p《0.05;**,p《0.01;***,p《0.001。
[0189]
ii.结果
[0190]
基于aav2的载体被工程化为在嵌合cmv-鸡β-肌动蛋白启动子的控制下表达绿色
荧光蛋白(gfp)基因。该表达盒被包装在aav2 quady-f衣壳中,其中aav2衣壳的四个表面酪氨酸(y)残基已被苯丙氨酸(f)残基取代,苯丙氨酸(f)残基显示出提高视网膜中基因传递的效率(petrs-silva h.等人,molecular therapy:the journal of the american society of gene therapy 19(2):293-301(2011))。在p2,将重组病毒通过圆窗膜注射到五只野生型小鼠的左耳蜗中。注射后三周的感觉上皮的gfp免疫染色显示包括ihc在内的各种类型细胞的转导。ihc的转导率为78
±
6%(平均值
±
sd),表示这种aav血清型适合将治疗基因递送给这些细胞(未显示)。将鼠耳畸蛋白cdna的编码序列分为5'片段(otof nt,核苷酸1-2448)和3'片段(otof ct,核苷酸2449-5979),每个片段插入携带引起重组的桥接序列的aav载体中(ghosh a.等人,hum gene ther 22(1):77-83(2011);dyka fm等人,hum gene ther methods 25(2):166-177(2014))。aav-otof nt重组载体携带cdna的5'部分,之后是剪接供体位点,以及aav-otof ct重组载体携带剪接受体位点,之后是cdna的3'部分(参见方法和图1)。这些重组载体中的每一个都被包装在aav2 quady-f衣壳中。使用aav-otof nt、aav otof ct或这两种重组病毒感染hek293细胞,48小时后对耳畸蛋白进行免疫染色。针对蛋白的c末端部分或n末端部分使用两种不同的抗体(roux i等人,cell 127:277-289(2006)),并获得了相同的结果。仅在同时感染两种病毒的细胞中检测到耳畸蛋白,因此表明这两种载体能够通过它们的反向末端重复进行重组并产生多联体,正确剪接所得的转录本以产生蛋白(图1)。
[0191]
在听力出现(在p10)之前或之后,单次单侧注射的aav-otof nt加aav-otof ct重组载体对通过圆窗膜进入左耳蜗施用至otof-/-小鼠。因为ihc带状突触的成熟在p17仍在进行(kros cj等人,nature 394(6690):281-284(1998);wong ab等人,embo j 33(3):247-264(2014)),而耳蜗在p30成熟(song l.等人,j acoust soc am 119(4):2242-2257(2006)),所以在两个不同时间点(p17和p30)之一进行听力出现后的注射。在p10注射重组载体对八周后,对三只otof-/-小鼠治疗耳蜗的感觉上皮进行显微解剖并对耳畸蛋白进行免疫标记(使用针对蛋白的c末端部分的抗体)以估计ihc转导率。在60%以上的ihc(64
±
6%,平均值
±
sd,n=3耳蜗)中检测到蛋白,但在其他细胞类型中没有检测到(图2a,左图)。该结果提供证据表明在体内局部递送重组aav载体对时,可以在耳蜗感觉细胞中有效地重构大cdna,其中通过大部分细胞持续、广泛地生产蛋白。通过对包括otof nt和otof ct cdna之间的连接的耳畸蛋白转录本的大片段进行rt-pcr和序列分析,检查转导细胞中的前mrna剪接过程的准确性(未显示)。
[0192]
在p10注射后4周,在小鼠中记录的听觉脑干反应(abr)证明在所有治疗的小鼠(n=8)中实质上恢复了响应于短声和猝发音刺激(8、16和32khz)的听力阈值,但在仅接受aav-otof nt或aav-otof ct单独(对于每种n=3)或没有注射的otof-/-小鼠(n=6)中没有恢复听力阈值(图2b、2c)。在治疗的小鼠中,短声和猝发音刺激两者的abr阈值与对照野生型小鼠的abr阈值相似(n=8;mann-whitney检验,对于所有比较p》0.15)。通过在1至30周之间的几个注射后时间点进行响应于短声的abr记录,以评估基因治疗的长期效果。从第四周开始,治疗小鼠的abr阈值与野生型小鼠的abr阈值没有显著差异(mann-whitney u检验,对所有阶段的比较而言p》0.05)(图2b)。然而,反映初级听觉神经元对声音刺激的电反应的abr波i的振幅是野生型小鼠平均值的39
±
7%(平均值
±
sd)(mann-whitney u检验,p=0.002),而波i潜伏期(1.15
±
0.09ms)与野生型小鼠的波i潜伏期相似(1.27
±
0.05ms;
mann-whitney u检验,p=0.06)(图2c)。
[0193]
在p10接受注射的8只小鼠中有6只在注射后30周仍具有野生型小鼠的10db以内的听力阈值。因此,在听力出现前进行基因治疗可预防otof-/-小鼠耳聋。发明人之前已经证明,在otof-/-小鼠中大约一半的ihc带变性(rou xi等人,cell 127:277-289(2006))。在p10注射后八周,通过免疫荧光和3d共聚焦显微镜成像在治疗的otof-/-耳蜗的转导的ihc和未转导的ihc中分析突触前带(连同突触后谷氨酸受体)的数量(图2a,右图)。转导细胞中每个ihc的带数目(12.5
±
1.8,平均值
±
sd,n=48个细胞,来自3只小鼠)几乎是未转导的细胞中的约两倍(6.9
±
1.3,n=48个细胞,来自3只小鼠;mann-whitney u检验,p《10-4
),但仍低于野生型ihc(16
±
1.3,n=48个细胞,来自3只小鼠;mann-whitney u检验,p《10-4
),这可能因为abr记录中波i振幅没有完全恢复。
[0194]
将重组载体对注射到p17或p30的otof-/-小鼠的耳蜗后,在整个治疗的耳蜗的ihc中检测到耳畸蛋白,但在对侧耳蜗的ihc中没有检测到耳畸蛋白(未显示)。两组小鼠的ihc转导率相似(在p17和p30治疗的n=5和n=3个耳蜗,分别为82
±
9%和85
±
7%),并且高于在p10接受注射的小鼠中的ihc转导率(mann-whitney u检验,对两种比较而言p《0.05)(图3a和图4a)。注射后4周的abr记录显示所有在p17接受注射的小鼠的听力恢复(n=5),响应于短声和猝发音刺激的abr阈值与野生型小鼠的abr阈值(n=5;mann-whitney u检验,对所有比较而言p》0.2)显著相似。注射后20周响应于短声的听力阈值保持不变,表明虽然这些小鼠的平均abr波i振幅约为野生型小鼠的一半(47
±
10%),但保持了听力恢复(图3b、图3c)。
[0195]
同样,在p30接受注射的otof-/-小鼠早在注射后三周就显示出类似的听力恢复,虽然平均abr波i振幅约为野生型小鼠的一半(55
±
10%),但响应于短声和猝发音刺激的abr阈值在注射后20周保持在野生型水平(n=3,mann-whitney u检验,在所有阶段进行比较时p》0.5)(图4b、图4c)。通过免疫荧光和3d共聚焦显微镜成像在p17和p30治疗的otof-/-耳蜗的转导的ihc和未转导的ihc中分析突触前带(连同突触后谷氨酸受体)的数量(图3a和图4a)。在转导细胞中每个ihc的带数目(10.0
±
1.3,平均值
±
sd,n=48个细胞,来自在p17治疗并在p80分析的3只小鼠,以及8.9
±
2.3,n=48个细胞,来自在p30治疗并在p40分析的3只小鼠)高于来自相同耳蜗的未转导细胞(分别为6.2
±
1.3,n=48个细胞和5.8
±
0.7,n=48个细胞;mann-whitney u检验,对于两种比较而言p《10-4),但低于10周龄野生型小鼠的ihc中的带数目(16
±
1.3,n=48个细胞,来自3只小鼠;mann-whitney u检验,对于两种比较而言p《10-4)。因为在p15分析的未治疗的otof-/-小鼠中每个ihc的带数目已经显著减少(8.2
±
1.0,n=48个细胞,来自3只小鼠),而治疗小鼠的非转导ihc在较晚阶段出人意料地保持稳定(见上文p40、p70和p80的值),可以推断出基因疗法在otof-/-小鼠的ihc中通过促进其生产而不是防止其变性(degeneration)来增加带的数目。
[0196]
使用上述公开的双aav基因疗法,在p30时施用至动物,也有可能在小鼠模型中恢复耳畸蛋白的正常分布以及将听力功能恢复到接近正常的abr阈值,所述小鼠模型在小鼠dfnb9基因中携带人热敏突变(otof
ts/ts
小鼠,图5)。
[0197]
更准确地说,已经表明,双病毒基因疗法改变了由在所述dfnb9小鼠模型中的人热敏突变导致的耳畸蛋白聚集(图9)。在该实验中,在听力出现之后,在p30,单次单侧注射的aav-otof nt加aav-otof ct重组载体对通过圆窗膜施用至otof
ts/ts
小鼠,进入左耳蜗。注射
后5周,对三只otof
ts/ts
小鼠的治疗的耳蜗的感觉上皮进行显微解剖并对耳畸蛋白进行免疫标记(图9)。发现当与未治疗的otof
ts/ts
小鼠耳蜗中的耳畸蛋白聚集相比(箭头)时,治疗耳蜗的ihc(虚线)中的耳畸蛋白表达几乎正常。
[0198]
最终发现,所述双病毒基因疗法在该动物模型中恢复ihc的钙流和细胞外泌,如图10所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1