抗claudin18抗体及其使用方法与流程
抗claudin 18抗体及其使用方法 相关申请
2.本技术要求于2019年2月1日提交的美国临时申请号62/800,359和 2019年8月26日提交的美国临时申请号62/891,925的权益。上述申请的全部教导通过引用纳入本文。
技术领域
3.本公开总体上涉及claudin 18.2(cldn18.2)特异性抗体及其抗体片段。该抗体可用于与cldn18.2异常表达相关的疾病(包括上皮细胞衍生的原发性和转移性癌症)的免疫疗法。
背景技术:
4.之前已经描述过两种选择性剪接的人claudin 18转录物变体,其编码以启动子依赖的方式表现出肺限制性(cldn18.1)和胃限制性 (cldn18.2)表达的不同亚型(niimi et al.,mol.cell.biol.21:7380
‑
90, 2001)。剪接变体的主要蛋白序列在n
‑
末端部分有所不同,该部分包括 n
‑
末端胞内区、第一跨膜区(tmd1)和胞外环区(ecl1)。cldn18.2 是严格限制于一种细胞谱系的人claudin家族中的少数成员之一(等人)。更具体地说,它提供了高度选择性的胃谱系(例如,胃细胞特异性)标记物,其表达模式限于短寿命分化的上皮细胞并且不存在于胃腺的干细胞区(sahin et al.,clin.cancer res.14(23)7624
‑
7634,2008)。
5.cldn18.2在恶性转化中保留,并在大部分原发肿瘤及其转移中表达。sahin等人还报告称,cldn18.2(而非cldn18.1)在几种不同类型的癌症中经常过表达,包括胰腺癌、胃癌、食道癌、肺癌和卵巢癌。因此,在癌症的情况下,cldn18.2并不局限于胃细胞谱系(sahin等人)。综合考虑,已发表报告的发现证实,cldn18.2为与上皮细胞衍生的肿瘤相关的疾病的癌症免疫治疗的开发提供了诊断工具和药物靶。
6.据报道,肿瘤组织中的紧密连接渗透性通常高于正常组织,这导致推测肿瘤细胞上的claudin蛋白可能比具有完整紧密连接的正常组织更易接近。这种可能性使得claudin蛋白成为治疗性癌症干预的有吸引力的靶标。此外,已发表的表达谱(expression profiling)结果表明,靶向cldn18.2 的癌症治疗将具有有利的全身毒性特征,因为正常的更换(turnover)和稳态过程每2至7天补充胃肠上皮细胞(sahin等人)。有限持续时间的短暂性胃肠道毒性是癌症免疫治疗中常见且可控的不良事件。
7.胰腺癌和胃食管癌属于医疗需求未得到满足程度最高的恶性肿瘤 (sahin等人)。尽管胃癌和胰腺癌导致显著的癌症相关发病率和死亡率,但治疗方案有限。因此,存在对抗cldn18.2特异性抗体和结合剂的需求,其用于与上皮细胞衍生的原发性和转移性实体瘤相关的癌症免疫治疗。
技术实现要素:
8.本公开通过提供特异性结合人紧密连接分子cldn18亚型2 (cldn18.2)并具有期
望功能特性的抗体和抗体片段来满足上述需要。抗cldn18.2抗体或其抗体片段、或包含cldn18.2抗体或抗体片段的双特异性分子或融合蛋白可用于与cldn18.2表达失调相关的疾病的基于抗体的疗法。例如,所述抗体可用于治疗与表达cldn18.2的细胞相关的实体瘤癌症疾病,例如胃癌、胰腺癌和食道癌、肺癌、卵巢癌、结肠癌和肝癌。
9.在一些实施方案中,本发明的抗体可以是单克隆的、嵌合的、人源化的或人抗体,双特异性或多特异性抗体的组分,或抗体的抗原结合部分,其结合cldn18.2的第一胞外结构域/环并表现出一种或多种以下特性: (a)对cldn18.2的特异性(例如与人cldn18.2结合但不与cldn18.1 结合);(b)介导表达cldn18.2的细胞的adcc杀伤能力;和(c) 在cldn18.2结合于表达cldn18.2的细胞上时有效内化,因此适合于 adc开发。
10.在一些实施方案中,抗cldn18.2特异性抗体或其抗体片段优先与人肿瘤细胞天然表达的cldn18.2(亚型2)结合,而不与cldn18亚型 1(cldn18.1)结合。由于与靶细胞表面上表达的cldn18.2结合,所公开的抗体可以通过一种或多种作用机制介导靶细胞杀伤,例如诱导细胞凋亡、抑制增殖、cdc裂解、adcc裂解或递送细胞毒性剂。在一个实施方案中,靶细胞是原发性或转移性癌细胞。
11.在一些实施方案中,抗cldn18.2抗体是全长抗体。
12.在一些实施方案中,抗cldn18.2抗体是抗体片段。在其他实施方案中,抗体片段选自:fab、fab’、f(ab)2、fd、fv、scfv和scfv
‑
fc片段、单链抗体、微抗体(minibody)和双抗体。
13.在一些实施方案中,抗cldn18.2抗体是单克隆抗体。
14.在一些实施方案中,抗cldn18.2抗体是鼠抗体。
15.在一些实施方案中,抗cldn18.2抗体是人抗体。在一些实施方案中,抗cldn18.2抗体是人源化抗体。
16.在一些实施方案中,抗cldn18.2抗体是嵌合抗体。
17.在一些实施方案中,抗cldn18.2抗体是双特异性抗体,其包含未修饰的(例如天然存在的)fc片段或修饰的fc片段,所述修饰的fc片段经设计以优化或替代性地消除特定的fc介导的功能。
18.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:47(hcdr1)、seq id no:48(hcdr2)和 seq id no:49(hcdr3);和/或轻链可变区,其具有seq id no:50 (lcdr1)、seq id no:51(lcdr2)和seq id no:52(lcdr3)。
19.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:53(hcdr1)、seq id no:54(hcdr2)和 seq id no:55(hcdr3);和/或轻链可变区,其具有seq id no:56 (lcdr1)、seq id no:57(lcdr2)和seq id no:58(lcdr3)。
20.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:59(hcdr1)、seq id no:60(hcdr2)和 seq id no:61(hcdr3);和/或轻链可变区,其具有seq id no:62 (lcdr1)、seq id no:63(lcdr2)和seq id no:64(lcdr3)。
21.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:65(hcdr1)、seq id no:66(hcdr2)和 seq id no:67(hcdr3);和/或轻链可变区,其具有seq id no:68 (lcdr1)、seq id no:69(lcdr2)和seq id no:70(lcdr3)。
22.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:71(hcdr1)、seq id no:72(hcdr2)和seq id no:73(hcdr3);和/或轻链可变区,其具
有seq id no:74 (lcdr1)、seq id no:75(lcdr2)和seq id no:76(lcdr3)。
23.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:77(hcdr1)、seq id no:78(hcdr2)和 seq id no:79(hcdr3);和/或轻链可变区,其具有seq id no:80 (lcdr1)、seq id no:81(lcdr2)和seq id no:82(lcdr3)。
24.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:83(hcdr1)、seq id no:84(hcdr2)和 seq id no:85(hcdr3);和/或轻链可变区,其具有seq id no:86 (lcdr1)、seq id no:87(lcdr2)和seq id no:88(lcdr3)。
25.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:89(hcdr1)、seq id no:90(hcdr2)和seq id no:91(hcdr3);和/或轻链可变区,其具有seq id no:92 (lcdr1)、seq id no:93(lcdr2)和seq id no:94(lcdr3)。
26.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:95(hcdr1)、seq id no:96(hcdr2)和 seq id no:97(hcdr3);和/或轻链可变区,其具有seq id no:98 (lcdr1)、seq id no:99(lcdr2)和seq id no:100(lcdr3)。
27.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:101(hcdr1)、seq id no:102(hcdr2) 和seq id no:103(hcdr3);和/或轻链可变区,其具有seq id no: 104(lcdr1)、seq id no:105(lcdr2)和seq id no:106(lcdr3)。
28.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:107(hcdr1)、seq id no:108(hcdr2) 和seq id no:109(hcdr3);和/或轻链可变区,其具有seq id no: 110(lcdr1)、seq id no:111(lcdr2)和seq id no:112(lcdr3)。
29.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:113(hcdr1)、seq id no:114(hcdr2) 和seq id no:115(hcdr3);和/或轻链可变区,其具有seq id no: 116(lcdr1)、seq id no:117(lcdr2)和seq id no:118(lcdr3)。
30.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:119(hcdr1)、seq id no:120(hcdr2) 和seq id no:121(hcdr3);和/或轻链可变区,其具有seq id no: 122(lcdr1)、seq id no:123(lcdr2)和seq id no:124(lcdr3)。
31.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:125(hcdr1)、seq id no:126(hcdr2) 和seq id no:127(hcdr3);和/或轻链可变区,其具有seq id no: 128(lcdr1)、seq id no:129(lcdr2)和seq id no:130(lcdr3)。
32.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:131(hcdr1)、seq id no:132(hcdr2) 和seq id no:133(hcdr3);和/或轻链可变区,其具有seq id no: 134(lcdr1)、seq id no:135(lcdr2)和seq id no:136(lcdr3)。
33.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:137(hcdr1)、seq id no:138(hcdr2) 和seq id no:139(hcdr3);和/或轻链可变区,其具有seq id no: 140(lcdr1)、seq id no:141(lcdr2)和seq id no:142(lcdr3)。
34.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:143(hcdr1)、seq id no:144(hcdr2) 和seq id no:145(hcdr3);和/或轻链可变区,其具有seq id no: 146(lcdr1)、seq id no:147(lcdr2)和seq id no:148(lcdr3)。
35.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:149(hcdr1)、seq id no:150(hcdr2) 和seq id no:151(hcdr3);和/或轻链可变区,
其具有seq id no: 152(lcdr1)、seq id no:153(lcdr2)和seq id no:154(lcdr3)。
36.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:155(hcdr1)、seq id no:156(hcdr2) 和seq id no:157(hcdr3);和/或轻链可变区,其具有seq id no: 158(lcdr1)、seq id no:159(lcdr2)和seq id no:160(lcdr3)。
37.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:161(hcdr1)、seq id no:162(hcdr2) 和seq id no:163(hcdr3);和/或轻链可变区,其具有seq id no: 164(lcdr1)、seq id no:165(lcdr2)和seq id no:166(lcdr3)。
38.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:167(hcdr1)、seq id no:168(hcdr2) 和seq id no:169(hcdr3);和/或轻链可变区,其具有seq id no: 170(lcdr1)、seq id no:171(lcdr2)和seq id no:172(lcdr3)。
39.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:173(hcdr1)、seq id no:174(hcdr2) 和seq id no:175(hcdr3);和/或轻链可变区,其具有seq id no: 176(lcdr1)、seq id no:177(lcdr2)和seq id no:178(lcdr3) 的。
40.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:179(hcdr1)、seq id no:180(hcdr2) 和seq id no:181(hcdr3);和/或轻链可变区,其具有seq id no: 182(lcdr1)、seq id no:183(lcdr2)和seq id no:184(lcdr3)。
41.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:221(hcdr1)、seq id no:222(hcdr2) 和seq id no:223(hcdr3);和/或轻链可变区,其具有seq id no: 224(lcdr1)、seq id no:225(lcdr2)和seq id no:226(lcdr3)。
42.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:227(hcdr1)、seq id no:228(hcdr2) 和seq id no:229(hcdr3);和/或轻链可变区,其具有seq id no: 230(lcdr1)、seq id no:231(lcdr2)和seq id no:232(lcdr3)。
43.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:233(hcdr1)、seq id no:234(hcdr2) 和seq id no:235(hcdr3);和/或轻链可变区,其具有seq id no: 236(lcdr1)、seq id no:237(lcdr2)和seq id no:238(lcdr3)。
44.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:239(hcdr1)、seq id no:240(hcdr2) 和seq id no:241(hcdr3);和/或轻链可变区,其具有seq id no: 242(lcdr1)、seq id no:243(lcdr2)和seq id no:244(lcdr3)。
45.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:245(hcdr1)、seq id no:246(hcdr2) 和seq id no:247(hcdr3);和/或轻链可变区,其具有seq id no: 248(lcdr1)、seq id no:249(lcdr2)和seq id no:250(lcdr3)。
46.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:251(hcdr1)、seq id no:252(hcdr2) 和seq id no:253(hcdr3);和/或轻链可变区,其具有seq id no: 254(lcdr1)、seq id no:255(lcdr2)和seq id no:256(lcdr3)。
47.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:257(hcdr1)、seq id no:258(hcdr2) 和seq id no:259(hcdr3);和/或轻链可变区,其具有seq id no: 260(lcdr1)、seq id no:261(lcdr2)和seq id no:262(lcdr3)。
48.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含重链可变区,其具有seq id no:263(hcdr1)、seq id no:264(hcdr2) 和seq id no:265(hcdr3);和/或轻链可变区,
nos:1、3、5、7、9、11、13、15、 17、19、21、23、25、27、29、31、33、35、37、39、41、43和45,所述可变重链序列与分别选自以下的可变轻链序列配对:seq id nos:2、 4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、 38、40、42、44和46。
62.在一个实施方案中,抗cldn18.2特异性抗体或其结合片段包含抗体或其cldn18.2结合片段,所述抗体或其cldn18.2结合片段包含分别选自以下的可变重链序列:seq id nos:185、187、189、191、193、 195、197、199、201、203、205、207、209、211、215、217和219,所述可变重链序列与分别选自以下的可变轻链序列配对:seq id nos: 186、188、190、192、194、196、198、200、202、204、206、208、210、 212、216、218和220。
63.在一个实施方案中,抗cldn18.2特异性抗体或其结合片段包含抗体或cldn18.2结合片段,其包含可变重链序列和可变轻链序列的特定组合或对。在一个替代的实施方案中,抗cldn18.2特异性抗体或其结合片段包含抗体或cldn18.2结合片段或结合剂,其包含衍生自本发明的抗cldn18.2抗体的vh和/或vl结构域区的cdr序列的确定集合或组合。
64.在一些实施方案中,抗cldn18.2抗体或其抗原结合片段包含选自以下组合的可变重链序列和可变轻链序列的特定对。
65.(a)包含seq id no:1的可变重链序列和包含seq id no:2的可变轻链序列;
66.(b)包含seq id no:3的可变重链序列和包含seq id no:4的可变轻链序列;
67.(c)包含seq id no:5的可变重链序列和包含seq id no:6的可变轻链序列;
68.(d)包含seq id no:7的可变重链序列和包含seq id no:8的可变轻链序列;
69.(e)包含seq id no:9的可变重链序列和包含seq id no:10的可变轻链序列;
70.(f)包含seq id no:11的可变重链序列和包含seq id no:12的可变轻链序列;
71.(g)包含seq id no:13的可变重链序列和包含seq id no:14的可变轻链序列;
72.(h)包含seq id no:15的可变重链序列和包含seq id no:16 的可变轻链序列;
73.(i)包含seq id no:17的可变重链序列和包含seq id no:18的可变轻链序列;
74.(j)包含seq id no:19的可变重链序列和包含seq id no:20的可变轻链序列;
75.(k)包含seq id no:21的可变重链序列和包含seq id no:22 的可变轻链序列;
76.(l)包含seq id no:23的可变重链序列和包含seq id no:24的可变轻链序列;
77.(m)包含seq id no:25的可变重链序列和包含seq id no:26 的可变轻链序列;
78.(n)包含seq id no:27的可变重链序列和包含seq id no:28 的可变轻链序列;
79.(o)包含seq id no:29的可变重链序列和包含seq id no:30的可变轻链序列;
80.(p)包含seq id no:31的可变重链序列和包含seq id no:32 的可变轻链序列;
81.(q)包含seq id no:33的可变重链序列和包含seq id no:34 的可变轻链序列;
82.(r)包含seq id no:35的可变重链序列和包含seq id no:36的可变轻链序列;
83.(s)包含seq id no:37的可变重链序列和包含seq id no:38的可变轻链序列;
84.(t)包含seq id no:39的可变重链序列和包含seq id no:40的可变轻链序列;
85.(u)包含seq id no:41的可变重链序列和包含seq id no:42 的可变轻链序列;
86.(v)包含seq id no:43的可变重链序列和包含seq id no:44的可变轻链序列;和
87.(w)包含seq id no:45的可变重链序列和包含seq id no:46 的可变轻链序列。
88.在一些实施方案中,所提供的抗体是全人抗cldn18.2抗体或其抗原结合片段,其包含选自以下组合的可变重链序列和可变轻链序列的特定对:
89.(aa)包含seq id no:185的可变重链序列和包含seq id no:186 的可变轻链序列;
90.(bb)包含seq id no:187的可变重链序列和包含seq id no:188 的可变轻链序列;
91.(cc)包含seq id no:189的可变重链序列和包含seq id no:190 的可变轻链序列;
92.(dd)包含seq id no:191的可变重链序列和包含seq id no:192 的可变轻链序列;
93.(ee)包含seq id no:193的可变重链序列和包含seq id no:194 的可变轻链序列;
94.(ff)包含seq id no:195的可变重链序列和包含seq id no:196 的可变轻链序列;
95.(gg)包含seq id no:197的可变重链序列和包含seq id no:198 的可变轻链序列;
96.(hh)包含seq id no:199的可变重链序列和包含seq id no:200 的可变轻链序列;
97.(ii)包含seq id no:201的可变重链序列和包含seq id no:202 的可变轻链序列;
98.(jj)包含seq id no:203的可变重链序列和包含seq id no:204 的可变轻链序列;
99.(kk)包含seq id no:205的可变重链序列和包含seq id no:206 的可变轻链序列;
100.(ll)包含seq id no:207的可变重链序列和包含seq id no:208 的可变轻链序列;
101.(mm)包含seq id no:209的可变重链序列和包含seq id no: 210的可变轻链序列;
102.(nn)包含seq id no:211的可变重链序列和包含seq id no:212 的可变轻链序列;
103.(oo)包含seq id no:215的可变重链序列和包含seq id no:216 的可变轻链序列;
104.(pp)包含seq id no:217的可变重链序列和包含seq id no:218 的可变轻链序列;和
105.(qq)包含seq id no:219的可变重链序列和包含seq id no:220 的可变轻链序列。
106.技术人员将进一步理解,可变轻链和可变重链可以独立地选自本文提供的抗体,或混合和进行配对。
107.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含cdr序列的组合,所述cdr序列衍生自选自以下的可变重链序列:seq id nos: 1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43和45以及选自以下的可变轻链序列:seq id nos: 2、4、
6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、 36、38、40、42、44和46。
108.在一些实施方案中,抗cldn18.2抗体或其抗体片段包含cdr序列的组合,所述cdr序列衍生自选自以下的可变重链序列:seq id nos: 185、187、189、191、193、195、197、199、201、203、205、207、209、 211、215、217和219以及选自以下的可变轻链序列:seq id nos:186、 188、190、192、194、196、198、200、202、204、206、208、210、212、 216、218和220。
109.在一些实施方案中,抗cldn18抗体及其抗体片段包含表1中公开的一种或多种重链可变区cdr和/或表3中公开的一种或多种轻链可变区 cdr。
110.在一些实施方案中,抗cldn18抗体及其抗体片段包含表2中公开的一种或多种重链可变区cdr和/或表4中公开的一种或多种轻链可变区 cdr。
111.在一些实施方案中,抗cldn18.2抗体或抗体片段是包含六(6)个 cdr的重组抗体(例如嵌合抗体、人源化抗体或双特异性抗体),所有 cdr均来源于本文公开的单一抗cldn18.2抗体的vh或vl结构域。例如,结合剂可包含被命名为hu
‑
1的抗cldn18.2抗体的所有六个cdr 区。在这种情况下,抗体或结合剂将包含seq id nos:221
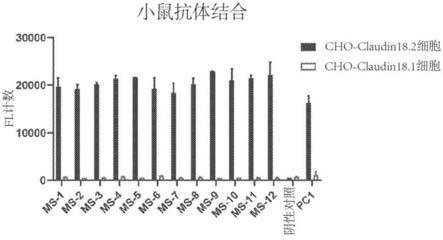
‑
223和seq idnos:224
‑
226的氨基酸序列,其分别表示hu
‑
1抗体的可变重链结构域的 cdr1、cdr2和cdr3以及可变轻链结构域的cdr1、cdr2和cdr3 序列。
112.在一些实施方案中,抗cldn18抗体或其抗体片段与cldn18.2的第一胞外结构域/环结合,并表现出一种或多种以下特性:优先结合由人肿瘤细胞天然表达的cldn18亚型2,不结合cldn18亚型1 (cldn18.1),在结合后从cldn18.2阳性细胞表面有效内化,能够通过诱导抗体依赖性细胞的细胞毒性(adcc)介导的裂解、补体依赖性细胞毒性(cdc)或抗体依赖性吞噬作用(adpc)来指导杀伤cldn18.2 阳性细胞。
113.本公开还提供了治疗上皮细胞衍生的原发性和转移性癌症的方法,所述方法包括给予包含抗cldn18.2抗体、包含抗cldn18.2特异性结合剂的双特异性抗体或其抗体片段的组合物或制剂以及任选的另一种基于免疫的疗法至需要其的受试者。在一些实施方案中,癌症选自实体瘤、胃癌、食道癌、胃食管连接部癌、胰腺癌、胆管癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌。在某些情况下,其他基于免疫的疗法是检查点抑制剂。
114.本公开的抗cldn18.2抗体还可用于开发基于抗体的免疫治疗,所述基于抗体的免疫治疗依赖cldn18.2特异性结合以将患者效应细胞(例如t细胞或nk细胞)引导至肿瘤,包括双特异性t细胞接合抗体,或重定向nk细胞的双特异性分子,或细胞疗法,例如car
‑
t疗法,或用于将毒性有效载荷(例如缀合的细胞毒性药物)递送至cldn18.2阳性实体瘤。
115.本公开的抗cldn18.2抗体还可用于胃癌、食管癌、胃食管连接部癌、胰腺癌、胆管癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌的诊断。
附图说明
116.当结合附图阅读时,将更好地理解本公开的前述概述以及以下详细描述。出于说明本公开的目的,图中示出了当前优选的实施方案。然而,应当理解,本公开不限于所示的精确布置、实施例和手段。
117.图1提供了鼠抗cldn18.2抗体的vh和vl结构域的氨基酸序列及其各自的cdr序列。提供了序列标识符,可变结构域序列中的cdr用下划线标出。
118.图2提供了人抗cldn18.2抗体的vh和vl结构域的氨基酸序列及其各自的cdr序列。
提供了序列标识符,可变结构域序列中的cdr用下划线标出。
119.图3a、3b和3c显示小鼠抗claudin 18.2抗体与cho
‑
claudin 18.2 细胞的结合。图3a显示鼠抗claudin 18.2抗体的结合强度计数。图3b 显示了鼠抗claudin 18.2抗体ms
‑
1、ms
‑
2和ms
‑
3与cho
‑
claudin 18.2 细胞的结合曲线。图3c显示claudin 18.2抗体ms
‑
4和hu
‑
3与 cho
‑
claudin 18.2细胞结合,但不与cho
‑
claudin 18.1结合。
120.图4a和4b是显示人抗claudin 18.2抗体与cho
‑
claudin 18.2和 cho
‑
claudin 18.1细胞的结合的图。图4a显示人抗claudin18.2抗体的结合。图4b显示人抗claudin 18.2抗体hu
‑
2、hu
‑
9和hu
‑
10与 cho
‑
claudin 18.2细胞的结合曲线。
121.图5是显示cho
‑
claudin 18.2和肿瘤细胞系patu8988s和nugc
‑
4 上表面claudin 18.2表达水平的比较的柱状图。
122.图6a和6b是显示抗claudin 18.2抗体与肿瘤细胞系patu8988s 结合的柱状图。图6a显示鼠抗claudin 18.2抗体的结合强度计数。图6b 显示人抗claudin 18.2抗体的结合。
123.图7是显示人抗claudin 18.2抗体与肿瘤细胞系nugc
‑
4的结合的柱状图。
124.图8是显示人抗claudin 18.2抗体与肿瘤细胞系katoiii结合的柱状图。
125.图9显示hu
‑
2、hu
‑
7和hu
‑
9介导的抗体依赖性细胞的细胞毒性 (adcc)。
126.图10显示由抗claudin 18.2抗体hu
‑
2、hu
‑
7、hu
‑
9和hu
‑
11诱导的抗体介导的内吞作用。
127.图11a和11b提供了四种人免疫球蛋白igg1 ch结构域(图11a) 和人免疫球蛋白κ轻链cl结构域(图11b)的氨基酸序列,所述氨基酸序列适用于与所公开的抗cldn18.2vh和vl结构域和/或cdr序列组合使用。提供了序列标识符。
128.图12提供了两个代表性的全长抗cldn18.2抗体的重组重链的氨基酸序列,所述重组重链包含seq id no:336或seq id no:338中提供的氨基酸序列,它们中的任一个可以与具有seq id no:337中提供的氨基酸序列的重组κ轻链配对,以提供全长人igg1抗cldn18.2抗体。
129.图13a和13b显示fc修饰的claudin 18.2抗体nbl
‑
014p和 nbl
‑
014g使用promega替代效应细胞(图13a)或过表达cd16a的 nk92mi细胞(图13b)诱导针对过表达人claudin 18.2的cho细胞的增强的adcc。
130.图14a和14b显示fc修饰的抗claudin 18.2抗体nbl
‑
014p和 nbl
‑
014g诱导针对nugc
‑
4细胞(图14a)和patu8988s细胞(图 14b)的增强的adcc。
131.图15显示,与pci的cdc活性相比,fc修饰的抗claudin 18.2抗体nbl
‑
014p和nbl
‑
014g诱导针对过表达人claudin 18.2的cho细胞的增强的cdc。
132.图16显示,与pc1的cdc活性相比,fc修饰的抗claudin 18.2抗体nbl
‑
014p和nbl
‑
014g诱导针对patu8988s细胞的增强的cdc活性。
133.图17a
‑
17b显示针对过表达人claudin 18.2的cho细胞(图17a) 和nugc
‑
4细胞(图17b)的抗claudin 18.2抗体的adcp活性。
134.图18a和图18b显示基于对肿瘤体积随时间的变化(图18a)和第 34天的肿瘤重量(图18b)的测定,过表达人claudin 18.2的皮下 patu8988s模型中抗claudin 18.2抗体nbl
‑
014和pc1的抗肿瘤功效。
135.图19是显示基于肿瘤体积随时间变化的皮下nugc
‑
4模型中抗claudin 18.2抗体
nbl
‑
014和pc1的抗肿瘤功效的图。
136.图20a和20b显示基于对肿瘤体积随时间的变化(图20a)和第28 天的肿瘤重量(图20b)的测定,在人pbmc移入的nogdko小鼠中植入的皮下nugc
‑
4模型中抗claudin 18.2抗体nbl
‑
014p的抗肿瘤功效。
137.图21提供了人claudin 18亚型2(claudin 18.2)的氨基酸序列(seqid no:329)和人claudin 18亚型1(claudin 18.1)的氨基酸序列(seqid no:330)。
具体实施方式
138.本公开总体上涉及claudin 18.2(cldn18.2)特异性抗体及其抗体片段。包含所公开的抗cldn18.2抗体的cdr或vh和vl序列的抗 cldn18.2抗体或其抗体片段、或双特异性分子、或融合蛋白可用于与 cldn18.2表达失调相关的疾病的基于抗体的疗法。更具体地,抗 cldn18.2抗体可用于上皮细胞衍生的原发性和转移性癌症的免疫疗法,所述癌症包括胃癌、胰腺癌和食管癌、肺癌、卵巢癌、结肠癌和肝癌。
139.为了更容易理解本发明,下面具体定义了某些技术和科学术语。除非在本文件的其他地方特别定义,本文使用的所有其他技术和科学术语具有本发明所属领域的普通技术人员通常理解的含义。
140.在本公开中,将使用以下缩写。
141.adc
‑
抗体药物缀合物。
142.adcc
‑
抗体依赖性细胞的细胞毒性。
143.cdc
‑
补体依赖性细胞毒性。
144.cdr
‑
免疫球蛋白可变区中的互补决定区。
145.ecd
‑
胞外结构域。
146.fr
‑
抗体框架区,不包括cdr区的免疫球蛋白可变区。
147.ec50
‑
产生半最大结合的抗体浓度或产生50%最大应答的抗体有效浓度。
148.ic50
‑
产生50%抑制的浓度。
149.mab或mab或mab
‑
单克隆抗体。
150.vh或v
h
‑
免疫球蛋白重链可变区。
151.vl或v
l
‑
免疫球蛋白轻链可变区。
152.eadcc
‑
增强的抗体依赖性细胞的细胞毒性。
153.adcp
‑
抗体依赖性细胞吞噬作用。
154.fc
‑
片段可结晶区。
155.fcrn
‑
新生fc受体。
156.本文使用的术语“cldn”是指claudin,包括cldn18.2和cldn18.1。优选地,claudin是人claudin 。
157.如本文所用,术语“claudin 18亚型2”(与cldn18.2可互换使用) 是指包含uni
‑
prot条目p56856(cld18人)中提供的氨基酸序列或由其组成的肽,所述肽被鉴定为p56856
‑
2亚型(剪接变体2),包括翻译后修饰的变体和物种同源物,所述变体和物种同源物存在于正常或转化的癌细胞表面上或在用cldn18.2基因转染的细胞上表达。claudin 18.2 优选具有seq id no:329的氨基酸序列。
158.如本文所用,术语“claudin 18亚型1”(与cldn18.1可互换使用) 是指包含uni
‑
prot条目p56856(cld18_人)中提供的氨基酸序列或由其组成的肽,所述肽被鉴定为p56856
‑
1亚型(剪接变体1),包括翻译后修饰的变体和物种同源物,所述变体和物种同源物存在于正常或转化的癌细胞表面上或在用cldn18.1基因转染的细胞上表达。claudin 18.1 优选具有seq id no:330的氨基酸序列。
159.本文所用的术语“胞外结构域”或“胞外部分”是指分子如蛋白质的一部分,其面向细胞的胞外空间,并且优选可从所述细胞的外部接近,例如通过位于细胞外部的抗原结合分子如抗体。优选地,该术语指一个或多个胞外环或结构域或其片段。
160.如本文所用,术语“cldn18相关疾病或病症”包括发现cldn18.2 的水平或活性或可及性改变的疾病状态和/或与疾病状态相关的症状。示例性的cldn18.2相关疾病或病症包括但不限于与表达cldn18.2的上皮肿瘤相关的癌症疾病,例如胰腺癌和胃食管癌。
161.本文所用的术语“抗体”是最广义的,包括各种抗体结构,包括但不限于单克隆抗体、多克隆抗体和多特异性抗体(例如双特异性抗体)。
162.示例性抗体如igg包含两条重链和两条轻链。每条重链由一个重链可变区(本文缩写为vh)和一个重链恒定区组成。每条轻链由一个轻链可变区(本文缩写为vl)和一个轻链恒定区组成。vh和vl区可进一步细分为高变区,称为互补决定区(cdr),其间散布有更保守的区,称为框架区(fr)。每个vh和vl由3个cdr和4个fr组成,按以下顺序从氨基末端到羧基末端排列:fri、cdr1、fr2、cdr2、fr3、 cdr3、fr4。
163.抗体的“类别(class)”或“同种型(isotype)”是指其重链所具有的恒定结构域或恒定区的类型。抗体主要有五类:iga、igd、ige、igg 和igm,其中一些可进一步分为亚类(同种型),如igg1、igg2、igg3、 igg4、iga1和iga2。对应于不同类别免疫球蛋白的重链恒定区分别称为α、δ、ε、γ和μ。
164.如本文所用,术语“igg”是指包含属于igg1、igg2、igg3和igg4 四个亚类的抗体的人免疫球蛋白的同种型。
165.高变区通常包含轻链可变区中的约氨基酸残基24
‑
34(lcdr1;“l”表示轻链)、50
‑
56(lcdr2)和89
‑
97(lcdr3)以及重链可变区中的约31
‑
35(hcdr1;“h”表示重链)、50
‑
65(hcdr2)和95
‑
102(hcdr3) 的氨基酸残基;kabat et al.,sequences of proteins ofimmunological interest,5th ed.public health service, national institutes of health,bethesda,md.(1991)和/或形成高变环的那些残基(例如,轻链可变区中的残基26
‑
32(lcdr1)、50
‑
52(lcdr2) 和91
‑
96(lcdr3),重链可变区中的26
‑
32(hcdr1)、53
‑
55(hcdr2) 和96
‑
101(hcdr3);chothia and lesk(1987)j.mol.biol.196:901
‑
917。
166.本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即包含该群体的单个抗体是相同的和/或结合相同的表位,除了可能的变体抗体,例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中产生的,这些变体通常以少量存在。与通常包括针对不同决定簇 (表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每个单克隆抗体针对抗原上的单一决定簇。因此,修饰词“单克隆”表示从基本上同质的抗体群体中获得的抗体的特性,不应被解释为需要通过任何方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤法、重组dna法、噬菌体展示法和利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,这些方法和本文描述的
制备单克隆抗体的其他示例性方法。
167.术语“嵌合”抗体是指重组抗体,其中重链和/或轻链的一部分源自特定来源或物种,而重链和/或轻链的其余部分源自不同来源或物种。
[0168]“人抗体”是具有与人产生的抗体的氨基酸序列相对应的氨基酸序列的抗体,和/或已经使用本领域技术人员已知的制备人抗体的任何技术制备的抗体。人抗体的该定义特异性地排除了包含非人抗原结合残基的人源化抗体。可以使用本领域已知的各种技术产生人抗体,包括在cole et al, monoclonal antibodies and cancer therapy,alan r.liss,p.77(1985); boerner et al,j.immunol,147(i):86
‑
95(1991)中描述的方法。还参见vandijk and van de winkel,curr.opin.pharmacol,5:368
‑
74(2001)。可通过将抗原给予转基因动物来制备人抗体,所述转基因动物已被修饰以应答抗原激发而产生此类抗体,但其内源性基因座已失效,例如,免疫的 humab小鼠(参见,例如关于humab小鼠的nils lonberg et al.,1994, nature368:856
‑
859、wo 98/24884、wo 94/25585、wo 93/1227、wo92/22645、wo 92/03918和wo 01/09187)、xenomice(参见,例如关于 xenomouse
tm
技术的美国专利号6,075,181和6,150,584)或trianni 小鼠(参见,例如关于trianni小鼠的wo 2013/063391、wo 2017/035252 和wo 2017/136734)。
[0169]
术语“人源化抗体”是指经工程化以包含可变区中的一个或多个人框架区以及重链和/或轻链的非人(例如小鼠、大鼠或仓鼠)互补决定区 (cdr)的抗体。在某些实施方案中,除cdr区外人源化抗体包含完全为人的序列。与非人源化抗体相比,人源化抗体对人的免疫原性通常较低,因此在某些情况下可提供治疗益处。本领域技术人员将了解人源化抗体,也将了解用于其产生的合适技术。参见例如hwang,w.y.k.,et al., methods 36:35,2005;queen et al.,proc.natl.acad.sci.usa, 86:10029
‑
10033,1989;jones et al.,nature,321:522
‑
25,1986;riechmannet al.,nature,332:323
‑
27,1988;verhoeyen et al.,science,239:1534
‑
36, 1988;orlandi et al.,proc.natl.acad.sci. usa,86:3833
‑
37,1989;美国专利号5,225,539;5,530,101;5,585,089;5,693,761;5,693,762;6,180,370;和selick et al.,wo 90/07861,其中的每一个都通过引用全文纳入本文。
[0170]
术语“多特异性抗体”在最广泛的意义上使用,并且具体地覆盖包含重链可变结构域(vh)和轻链可变结构域(vl)的抗体,其中vh
‑
vl 单元具有多表位特异性(即,能够结合一个生物分子上的两个不同表位或不同生物分子上的每个表位)。这种多特异性抗体包括但不限于全长抗体、具有两个或多个vl和vh结构域的抗体、双特异性双抗体和三抗体。“多表位特异性”是指特异性结合相同或不同靶上两个或多个不同表位的能力。
[0171]“双重特异性(dual specificity)”或“双特异性(bispecificity)”是指特异性结合相同或不同靶上两个不同表位的能力。然而,与双特异性抗体相反,双重特异性抗体具有氨基酸序列相同的两个抗原结合臂,并且每个fab臂能够识别两个抗原。双重特异性允许抗体作为单个fab 或igg分子与两种不同抗原以高亲和力相互作用。根据一个实施方案, igg1形式的多特异性抗体以5μm至0.001pm、3μm至0.001pm、1μm 至0.001pm、0.5μm至0.001pm或0.1μm至0.001pm的亲和力结合每个表位。“单特异性”是指仅结合一个表位的能力。多特异性抗体可以具有与完整免疫球蛋白分子相似的结构,并包括fc区,例如igg fc区。此类结构包括但不限于igg
‑
fv、igg
‑
(scfv)2、dvd
‑
ig、(scfv)2
‑
(scfv)2
‑
fc 和(scfv)2
‑
fc
‑
(scfv)。在igg
‑
(scfv)2的情况下,scfv可以连接到重链或轻链的n
‑
端或c
‑
端。
[0172]
如本文所用,术语“双特异性抗体”是指对至少两种不同抗原具有结合特异性的单克隆抗体,通常是人或人源化抗体。在本发明中,结合特异性中的一种可以针对cldn18.2,另一种可以针对任何其他抗原,例如,针对细胞表面蛋白、受体、受体亚基、组织特异性抗原、病毒衍生蛋白、病毒编码的包膜蛋白、细菌衍生蛋白或细菌表面蛋白等。
[0173]
如本文所用,术语“双抗体”指包含两条多肽链的二价抗体,其中每条多肽链包含通过太短的接头(例如,由五个氨基酸组成的接头)连接的vh和vl结构域,允许同一肽链上的vh和vl结构域的分子内关联。这种构型迫使每个结构域与另一条多肽链上的互补结构域配对,从而形成同型二聚体结构。因此,术语“三抗体”是指包含三条肽链的三价抗体,每条肽链包含一个vh结构域和一个vl结构域,它们通过非常短的接头(例如,由1
‑
2个氨基酸组成的接头)连接,以允许同一肽链内的 vh和vl结构域的分子内结合。
[0174]
术语“抗体片段”是指除完整抗体之外的分子,其包含与完整抗体结合的抗原结合的完整抗体的一部分。抗体片段的实例包括但不限于fv、 fab、fab’、fab
’‑
sh、f(ab)2;双抗体;线性抗体;单链抗体分子(例如 scfv)。木瓜蛋白酶消化抗体产生两个相同的抗原结合片段,称为“fab”片段和残留的“fc”片段,这一名称反映了易于结晶的能力。fab片段由一条完整的轻(l)链(vl)以及重(h)链的可变区结构域(vh)和一条重链的第一恒定结构域(ch1)组成。胃蛋白酶处理抗体产生单个大 f(ab)2片段,其大致对应于具有二价抗原结合活性的两个二硫键连接的 fab片段,且仍能够交联抗原。fab片段与f(ab)2片段的不同之处在于,在ch1结构域的羧基末端有额外的几个残基,包括来自抗体铰链区的一个或多个半胱氨酸。fab
’‑
sh是本文对fab’的名称,其中恒定结构域的半胱氨酸残基带有游离巯基(thiol group)。f(ab’)2抗体片段最初是作为其间有铰链的半胱氨酸fab’片段对产生的。还已知抗体片段的其他化学偶联。
[0175]
抗体的术语“抗原结合结构域”或“抗原结合部分”(或更简单地称为“结合结构域”或“结合部分”)或类似术语是指保留特异性结合抗原复合物的能力的抗体的一个或多个片段。包含在抗体的术语“抗原结合部分”中的结合片段的实例包括(i)fab片段,由vl、vh、cl和 ch结构域组成的单价片段;(ii)f(ab’)2片段,包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii)由vh和ch结构域组成的 fd片段;(iv)由抗体单臂的vl结构域和vh结构域组成的fv片段, (v)由vh结构域组成的dab片段(ward et al.,(1989)nature 341: 544
‑
546);(vi)分离的互补决定区(cdr),和(vii)两个或更多个分离的cdr的组合,它们可以任选地通过合成接头连接。
[0176]“fv”由紧密的非共价结合的一个重链可变区结构域和一个轻链可变区结构域的二聚体组成。从这两个结构域的折叠产生六个高变环(h 链和l链各有3个环),它们为抗原结合提供氨基酸残基并赋予抗体抗原结合特异性。
[0177]“单链fv”也缩写为“sfv”或“scfv”,是包含连接成单个多肽链的vh和vl抗体结构域的抗体片段。优选地,sfv多肽还包含vh和 vl结构域之间的多肽接头,其使sfv能够形成抗原结合所需的结构。有关sfv的综述,参见in the pharmacology of monoclonalantibodies,vol.113,rosenburg and moore eds.,springer
‑
verlag,newyork,pp.269
‑
315(1994)。
[0178]
本文所用术语“互补决定区”或“cdr”是指主要负责介导特异性抗原识别的重链和轻链多肽的可变区内的短多肽序列。每个v
l
和每个 v
h
中有三个cdr(称为cdr1、cdr2和
cdr3)。
[0179]
如本领域技术人员所理解的,cdr的确切编号和位置在不同编号系统之间可以不同。然而,应当理解可变重链序列和/或可变轻链序列的公开包括相关cdr的公开。因此,每个可变重区的公开是vhcdr(例如 vhcdr1、vhcdr2和vhcdr3)的公开,每个可变轻区的公开是vlcdr (例如vlcdr1、vlcdr2和vlcdr3)的公开。
[0180]
在某些实施方案中,抗体的cdr可根据lefranc m
‑
p,(1999)theimmunologist 7:132
‑
136和lefranc m
‑
p et al,(1999)nucleic acids res 27:209
‑
212中所述的imgt编号系统确定,其中每一项均通过引用全文纳入本文。除非本文另有说明,提及抗体可变结构域中的残基编号是指通过 imgt编号系统进行的残基编号。
[0181]
在其他实施方案中,抗体的cdr可根据maccallum rm et al,(1996) j mol biol262:732
‑
745确定,其通过引用全文纳入本文。另见,例如 martin a.
″
protein sequence and structure analysis of antibodyvariable domains,
″
in antibody engineering,kontermann and diibel, eds.,chapter 31,pp.422
‑
439,springer
‑
verlag,berlin(2001),其通过引用全文纳入本文。在其他实施方案中,抗体的cdr可根据abm编号方案确定,其是指abm高变区,其代表kabat cdr和chothia结构环之间的折中(compromise),并由oxford molecular的abm抗体建模软件 (oxford molecular group,inc.)使用,其通过引用全文纳入本文。
[0182]“框架”或“框架区”或“fr”是指除高变区(hvr)残基以外的可变结构域残基。可变结构域的fr通常由四个fr结构域:fr1、fr2、 fr3和fr4组成。
[0183]“人共有框架”是表示人免疫球蛋白vl或vh框架序列的选择中最常见的氨基酸残基的框架。通常,人免疫球蛋白vl或vh序列的选择来自可变结构域序列的亚组。通常,序列亚组是如kabat et al.,sequences of proteins of immunological interest,fifth edition,nih publication91
‑
3242,bethesda md.(1991),vols.1
‑
3中的亚组。在一个实施方案中,对于vl,亚组是如上文kabat等人所述的亚组κi。在一个实施方案中,对于vh,亚组是如上文kabat等人所述的亚组ill。
[0184]“铰链区”通常定义为从人igg1的216
‑
238(eu编号)或226
‑
251 (kabat编号)延伸的一段。铰链可以进一步分成三个不同的区域,上铰链、中(例如核心)铰链和下铰链。
[0185]
本文中术语“fc区”用于定义免疫球蛋白重链的c端区,其包含至少一部分恒定区并与免疫系统细胞表面上存在的内源性受体和补体系统的一些蛋白质相互作用。该术语包括天然序列fc区和变体fc区。在一个实施方案中,人igg重链fc区从cys226或从pro230延伸至重链的羧基端。但是,fc区的c端赖氨酸(lys447)可存在或不存在。除非本文另有说明,fc区或恒定区的氨基酸残基编号按照eu编号系统,也称为 eu指数,如kabat et al.,sequences of proteins of immunological interest, 5th ed.public health service,national institutes of health,bethesda,md. (1991)中所述。
[0186]
当用于描述本文公开的各种抗体时,术语“分离的抗体”是指已经从表达它的细胞或细胞培养物中鉴定和分离和/或回收的抗体。其天然环境中的污染物成分是通常会干扰多肽诊断或治疗用途的物质,可包括酶、激素和其他蛋白质溶质或非蛋白质溶质。在一些实施方案中,将抗体纯化至大于95%或99%的纯度,如通过例如电泳(例如sds
‑
page、等电聚焦(ief)、毛细管电泳)或色谱(例如离子交换或反相hplc)方法测定。关于抗体纯度评估方
法的综述,参见例如flatman et al.,j. chromatogr.b 848:79
‑
87(2007)。在优选的实施方案中,将抗体纯化至以下程度:(1)足以通过使用旋转杯测序仪获得至少15个n端或内部氨基酸序列残基的程度,或(2)在使用考马斯蓝或优选银染色的非还原或还原条件下通过sds
‑
page达到均质。分离的抗体包括重组细胞内的原位抗体,因为多肽天然环境的至少一种成分将不存在。
[0187]“表位”是表示抗体与其抗原之间相互作用的一个或多个位点的本领域术语。如(janeway,c,jr.,p.travers,et al.(2001).immunobiology:theimmune system in health and disease.part ii,section 3
‑
8.new york,garland publishing,inc.)所述:“抗体通常只识别大分子(如蛋白质) 表面的小区域
……
[某些表位]可能由[抗原]多肽链不同部分的氨基酸组成,这些氨基酸通过蛋白质折叠聚集在一起。这类抗原决定簇被称为构象表位或不连续表位,因为所识别的结构由在抗原氨基酸序列中不连续但在三维结构中聚集在一起的蛋白质区段组成。相反,由多肽链单个区段组成的表位被称为连续表位或线性表位”(janeway,c.,jr.,p.travers, et al.(2001).immunobiology:the immune system in health and disease. part ii,section 3
‑
8.new york,garland publishing,inc.)。
[0188]
作为参考抗体的“结合相同表位的抗体”是指与参考抗体相比接触抗原的一组重叠氨基酸残基或在竞争试验中阻断参考抗体与其抗原结合 50%或更多的抗体。可以例如通过测定与抗原复合的抗体的晶体结构或通过进行氢/氘交换来测定与抗原接触的抗体的氨基酸残基。在一些实施方案中,位于抗原以内的抗体残基被认为与抗原接触。在一些实施方案中,与参考抗体结合相同表位的抗体在竞争试验中阻断参考抗体与其抗原的结合达50%或更多,并且相反地,参考抗体在竞争试验中阻断抗体与其抗原的结合达50%或更多。
[0189]“阻断”抗体或“拮抗剂”抗体是抑制或降低其结合的抗原的生物活性的抗体。某些阻断抗体或拮抗剂抗体基本上或完全抑制抗原的生物活性。
[0190]
关于抗体与靶分子的结合,术语“特异性结合(specific binding)”或“特异性结合至(specifically binds to)”或“特异于(specific for)”特定多肽或特定多肽靶上的表位是指可测量地与非特异性相互作用不同的结合。例如,本文所用的术语“特异性结合(specific binding)”、“特异性结合(specifically binds)”和“选择性结合(selectively binds)”是指抗体与人cldn18.2表位的结合,其中所述结合可测量地与非特异性相互作用不同。例如,可以通过测定分子的结合与对照分子的结合相比来测量特异性结合。例如,可以通过与类似于靶的对照分子(例如过量的未标记靶)竞争来测定特异性结合。在这种情况下,如果标记靶与探针的结合被过量的未标记靶竞争性抑制,则表明特异性结合。如本文所用,术语“特异性结合(specific binding)”或“特异性结合(specificallybinds to)”或“特异于(specific for)”特定多肽或特定多肽靶上的表位可以例如通过针对靶的kd为10
‑
4m或更低、或者10
‑
5m或更低、或者10
‑
6m或更低、或者10
‑
7m或更低、或者10
‑
8m或更低、或者10
‑
9 m或更低、或者10
‑
10m或更低、或者10
‑
11m或更低,或者10
‑
12m 或更低,或kd在10
‑
4m至10
‑
6m或10
‑
6m至10
‑
10m或10
‑
7m至 10
‑
9m范围内的分子来表现。如本领域技术人员所知,亲和力和kd值呈负相关。通过低kd值测量对抗原的高亲和力。在一个实施方案中,术语“特异性结合(specific binding)”是指其中分子结合特定多肽或特定多肽上的表位而基本上
不结合任何其他多肽或多肽表位的结合。
[0191]
本文所用的术语“亲和力”是指抗体与表位的结合强度。抗体的亲和力由解离常数kd给出,定义为[ab]
×
[ag]/[ab
‑
ag],其中[ab
‑
ag]是抗体
‑ꢀ
抗原复合体的摩尔浓度,[ab]是未结合抗体的摩尔浓度,[ag]是未结合抗原的摩尔浓度。亲和常数ka由1/kd定义。可以在harlow,et al., antibodies:a laboratory manual,cold spring harbor laboratory press, cold spring harbor,n.y.,1988),coligan et al.,eds.,current protocols inimmunology,greene publishing assoc.and wiley interscience,n.y., (1992,1993)和muller,meth.enzymol.92:589
‑
601(1983)中找到测定 mab亲和力的方法,该参考文献通过引入全文纳入本文。本领域熟知的一种测定mab亲和力的标准方法是使用表面等离子体共振(spr)筛选 (例如通过使用biacore
tm spr分析设备进行分析)。
[0192]
关于试剂和特定活性(例如结合细胞、抑制酶活性、激活或抑制免疫细胞)的“ec50”,是指产生其关于这种活性的最大应答或效应的50%的试剂的有效浓度。关于试剂和特定活性的“ec100”是指产生其关于这种活性的基本上最大应答的试剂的有效浓度。
[0193]
术语“效应子功能”是指可归因于抗体fc区的那些生物活性,其随抗体同种型而变化。抗体效应子功能的实例包括c1q结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性 (adcc);吞噬作用;下调细胞表面受体(如b细胞受体);和b细胞激活。
[0194]
如本文所用,术语“fc γ受体”是指位于免疫细胞(包括b淋巴细胞、自然杀伤细胞、巨噬细胞、中性粒细胞和肥大细胞)膜中的内源性受体家族,其结合抗体的fc区并参与抗原识别。
[0195]
如本文所用,当提及结合对(例如抗体/细胞表面分子)时,术语“特异性结合(specifically binds)”表示决定蛋白质(例如cldn18.2)在蛋白质和/或其他生物制剂的异质群体中的存在的结合反应。因此,在指定的条件下,特定抗体结合特定的细胞表面标记物,而不与细胞表面或样品中存在的其他蛋白质大量结合。
[0196]
如本文所用,术语“特异性结合(specifically binds)cldn18.2”是指抗体或抗原结合片段在内源性claudin 18亚型2出现在正常或恶性细胞表面时识别和结合它,但不识别和结合claudin 18亚型1(cldn18.1) 或任何其他谱系特异性细胞表面标记物的能力。
[0197]
如本文所用,术语“内吞作用”是指真核细胞内化质膜片段、细胞表面受体和来自细胞外液的组分的过程。内吞作用机制包括受体介导的内吞作用。术语“受体介导的内吞作用”是指一种生物学机制,通过这种机制,配体在与其靶结合时触发膜内陷和收缩,被内化并递送到胞质中或转移到适当的胞内区室中。
[0198]
如本文所用,术语“基于抗体的免疫疗法”和“免疫疗法”用于泛指依赖于抗cldn18.2抗体、双特异性分子、抗原结合结构域或包含 cldn18.2抗体或其抗体片段或cdr的融合蛋白的靶向特异性以介导对特征在于cldn18.2异常表达的细胞的直接或间接作用的任何形式的疗法。该术语意指包括使用裸抗体、双特异性抗体(包括t细胞接合,nk 细胞接合和其他免疫细胞/效应细胞接合形式)抗体药物缀合物的治疗方法,使用经工程化以包含cldn18.2特异性嵌合抗原受体的t细胞 (car
‑
t)或nk细胞(car
‑
nk)和包含cldn18.2特异性结合剂的溶瘤病毒的细胞疗法,以及通过递送抗cldn18.2抗体的抗原结合序列并在体内表达相应抗体片段的基因疗法。
[0199]
本文要注意的是,如在本说明书和所附权利要求书中所使用的,单数形式“一(a)”、“一个(an)”和“所述”包括复数引用,除非上下文另有明确说明。
[0200]
claudin 18(cldn18)
[0201]
claudin蛋白家族于1998年首次被克隆并命名为紧密连接的关键结构和功能成分。作为一个家族,claudin是四跨膜蛋白的多基因家族,参与上皮细胞和内皮细胞的屏障功能以及细胞骨架的维持(furuse et al.,j. cell.biol.141(7):1539
‑
50,1998)。cldn18具有不同的变体或构象,包括cldn18亚型1(cldn18.1)和cldn18亚型2(cldn18.2)。
[0202]
claudin的第一胞外结构域(ecd)通常由约50个氨基酸组成,而第二胞外结构域较小,约有22个氨基酸(hashimoto,et al.drug discoverytoday 21(10):1711
‑
1718,2016)。n
‑
末端通常很短(例如,约4至10个氨基酸),而c
‑
末端的范围为21至约63个氨基酸,是蛋白质在紧密连接中定位所必需的。
[0203]
观察到肿瘤组织中紧密连接渗透性通常高于正常组织,这导致推测肿瘤细胞上的claudin可能比具有完整紧密连接的正常组织更易可及。这一观察结果也使claudin成为治疗性癌症干预的有吸引力的靶。此外,已发表的表达谱结果表明,靶向cldn18.2的癌症疗法将具有有利的全身毒性特征,因为正常的更换和稳态过程每隔2至7天会补充胃肠道上皮细胞 (sahin等人)。有限持续时间的短暂性胃肠道毒性是癌症免疫治疗学中常见且可控的不良事件。
[0204]
cldn18.2包含四个跨膜结构域,具有两个小的胞外环(环1由疏水区1和疏水区2包围;环2被疏水区3和4包围)。cldn18.2是一种跨膜蛋白,因此其胞外环内存在的或由其形成的表位代表了基于抗体的癌症免疫疗法的期望靶。然而,考虑到cldn18.1由正常肺组织(一种与毒性高度相关的组织)中的肺泡上皮细胞表达,专有的剪接变体特异性是使用cldn18.2特异性抗体进行基于抗体的癌症免疫疗法的公认先决条件。sahin等人首次报告概念验证(proof
‑
of
‑
concept)结果,证实了 cldn18.2作为药物靶用于癌症免疫疗法,该癌症免疫疗法基于只与 cldn18.2结合而不与cldn18.1结合的抗体(多克隆和单克隆)的分离 (sahin et al.,clin.cancer res.14(23)7624
‑
7634,2008)。
[0205]
cldn18.2在多种原发性肿瘤及其转移瘤中表达,包括胃癌、食道癌、胰腺癌、肺癌如非小细胞肺癌、卵巢癌、结肠癌、肝癌、头颈癌和胆囊癌。在许多癌症中检测到claudin表达失调,可能导致肿瘤发生和癌症侵袭(singh et al.,j oncology 2010;2010:541957)。cldn18.2的表达在胰腺导管腺癌(pdac)(tanaka et al.,j histochem cytochem.2011; 59:942
‑
952)、食道肿瘤、非小细胞肺癌(nsclc)、卵巢癌(sahin et al.,hu cancer biol.2008;14:7624
‑
7634)和胆管腺癌(keira et al.,virchowsarch.2015;466:265
‑
277)中显著升高。
[0206]
尽管胃癌导致显著的癌症相关发病率和死亡率,但胃癌的治疗选择有限。claudin存在于正常组织、良性肿瘤、增生性疾病和癌症中(ding et al.,cancer manag.res.5:367
‑
375(2013))。claudin的表达模式具有高度的组织特异性,大多数组织表达多种claudin。claudin可以与邻近细胞的 claudin以同型或异型方式相互作用,形成紧密连接(ding等人)。已知 claudin表达和信号通路的改变与癌症发展相关,已广泛报道了紧密连接功能受损与肿瘤进展之间的关联。
[0207]
抗cldn18.2抗体
[0208]
提供了特异性结合cldn18.2的第一胞外结构域/环的抗cldn18抗体,特别是人和鼠单克隆抗cldn18.2抗体。cldn18.2单克隆抗体或抗原结合片段与cldn18.2的结合可介导补体依赖性细胞毒性(cdc)、抗体依赖性吞噬作用(adpc)和/或抗体依赖性细胞的细胞毒性(adcc) 或导致靶癌细胞死亡的其他效应。或者,抗体或其抗原结合片段可例如用于递送缀合的细胞毒性药物,和/或可与另一种单克隆抗体形成双特异性抗体以介导靶癌细胞的死亡。
[0209]
在一个实施方案中,抗cldn18.2抗体或其抗体片段包含vh,其具有表1或表2中公开的一组cdr(hcdr1、hcdr2和hcdr3)。例如,抗cldn18抗体或其抗体片段可包含一组cdr,其对应于表2中描述的一条或多条抗cldn18.2抗体重链中的那些cdr(例如hu
‑
1抗体的cdr)。
[0210]
在另一个实施方案中,抗cldn18.2抗体包含vl,其具有表3或表 4中公开的一组cdr(lcdr1、lcdr2和lcdr3)。例如,抗cldn18 抗体或其抗体片段可包含一组cdr,其对应于表4中描述的一条或多条抗cldn18.2抗体轻链中的那些cdr(例如hu
‑
1抗体的cdr)。
[0211]
在一个替代的实施方案中,抗cldn18抗体或其抗体片段包含vh,其具有表1中公开的一组cdr(hcdr1、hcdr2和hcdr3),和vl,其具有表3中公开的一组cdr(lcdr1、lcdr2和lcdr3)。
[0212]
在一个替代的实施方案中,抗cldn18抗体或其抗体片段包含vh,其具有表2中公开的一组cdr(hcdr1、hcdr2和hcdr3),和vl,其具有表4中公开的一组cdr(lcdr1、lcdr2和lcdr3)。
[0213]
在一个特定的实施方案中,抗cldn18.2抗体可以包含一组六(6) 个cdr,其衍生自单一鼠抗体(表1中的vh cdr和表3中的vl cdr) 或全人抗体(表2中的vh cdr和表4中的vl cdr)。例如,抗体可包含一组六个cdr区,其衍生自全人抗cldn18.2抗体“hu
‑
1”。在这种情况下,结合剂将包含seq id no:221
‑
223和seq id no:224
‑
226 的氨基酸序列,分别代表hu
‑
1抗体的可变重结构域的cdr1、cdr2和 cdr3以及可变轻结构域的cdr1、cdr2和cdr3序列。
[0214]
表1:鼠可变重链结构域的cdr序列
[0215][0216]
表2:人可变重链结构域的cdr序列
[0217][0218][0219]
表3:鼠可变轻链结构域的cdr序列
[0220][0221]
表4:人可变轻链结构域的cdr序列
[0222][0223][0224]
在一个实施方案中,抗体可以是特异性结合人cldn18亚型2的单克隆的、嵌合的、人源化的或人抗体,或其抗原结合部分,或双特异性或多特异性结合剂。
[0225]
在另一个实施方案中,抗cldn18.2抗体或抗体片段包含衍生自所公开的抗cldn18.2抗体的vh和/或vl结构域的互补决定区(cdr) 序列的确定的集合/组合。
[0226]
在一个实施方案中,抗cldn8.2抗体或其抗体片段表现出一种或多种以下特性:优先结合人肿瘤细胞表达的cldn18亚型2,不结合 cldn18亚型1(cldn18.1),在结合后从cldn18.2阳性细胞表面有效内化,并且能够通过诱导抗体依赖性细胞的细胞毒性(adcc)介
导的裂解来指导杀伤cldn18.2阳性细胞。
[0227]
在一个实施方案中,抗cldn18.2特异性抗体或其结合片段包含vh,其包含一组选自以下的互补决定区cdr1、cdr2和cdr3:
[0228]
(i)cdr1:seq id no:47,cdr2:seq id no:48,cdr3:seq id no:49;
[0229]
(ii)cdr1:seq id no:53,cdr2:seq id no:54,cdr3:seq id no:55;
[0230]
(iii)cdr1:seq id no:59,cdr2:seq id no:60,cdr3: seq id no:61;
[0231]
(iv)cdr1:seq id no:65,cdr2:seq id no:66,cdr3: seq id no:67;
[0232]
(v)cdr1:seq id no:71,cdr2:seq id no:72,cdr3:seq id no:73;
[0233]
(vi)cdr1:seq id no:77,cdr2:seq id no:78,cdr3: seq id no:79;
[0234]
(vii)cdr1:seq id no:83,cdr2:seq id no:84,cdr3:seq id no:85;
[0235]
(viii)cdr1:seq id no:89,cdr2:seq id no:90,cdr3: seq id no:91;
[0236]
(ix)cdr1:seq id no:95,cdr2:seq id no:96,cdr3: seq id no:97;
[0237]
(x)cdr1:seq id no:101,cdr2:seq id no:102,cdr3: seq id no:103;
[0238]
(xi)cdr1:seq id no:107,cdr2:seq id no:108,cdr3: seq id no:109;
[0239]
(xii)cdr1:seq id no:113,cdr2:seq id no:114,cdr3: seq id no:115;
[0240]
(xiii)cdr1:seq id no:119,cdr2:seq id no:120,cdr3: seq id no:121;
[0241]
(xiv)cdr1:seq id no:125,cdr2:seq id no:126,cdr3: seq id no:127;
[0242]
(xv)cdr1:seq id no:131,cdr2:seq id no:132,cdr3: seq id no:133;
[0243]
(xvi)cdr1:seq id no:137,cdr2:seq id no:138,cdr3: seq id no:139;
[0244]
(xvii)cdr1:seq id no:143,cdr2:seq id no:144,cdr3: seq id no:145;
[0245]
(xviii)cdr1:seq id no:149,cdr2:seq id no:150,cdr3: seq id no:151;
[0246]
(xix)cdr1:seq id no:155,cdr2:seq id no:156,cdr3: seq id no:157;
[0247]
(xx)cdr1:seq id no:161,cdr2:seq id no:162,cdr3: seq id no:163;
[0248]
(xxi)cdr1:seq id no:167,cdr2:seq id no:168,cdr3: seq id no:169;
[0249]
(xxii)cdr1:seq id no:173,cdr2:seq id no:174,cdr3: seq id no:175;和
[0250]
(xxiii)cdr1:seq id no:179,cdr2:seq id no:180,cdr3: seq id no:181。
[0251]
在一个实施方案中,抗cldn18.2特异性抗体或其结合片段包含vl,其包含一组选自以下的互补决定区cdr1、cdr2和cdr3:
[0252]
(i)cdr1:seq id no:50,cdr2:seq id no:51,cdr3:seq id no:52;
[0253]
(ii)cdr1:seq id no:56,cdr2:seq id no:57,cdr3:seq id no:58;
[0254]
(iii)cdr1:seq id no:62,cdr2:seq id no:63,cdr3:seq id no:64;
[0255]
(iv)cdr1:seq id no:68,cdr2:seq id no:69,cdr3:seq id no:70;
[0256]
(v)cdr1:seq id no:74,cdr2:seq id no:75,cdr3:seq id no:76;
[0257]
(vi)cdr1:seq id no:80,cdr2:seq id no:81,cdr3:seq id no:82;
[0258]
(vii)cdr1:seq id no:86,cdr2:seq id no:87,cdr3:seq id no:88;
[0259]
(viii)cdr1:seq id no:92,cdr2:seq id no:93,cdr3:seqid no:94;
[0260]
(ix)cdr1:seq id no:98,cdr2:seq id no:99,cdr3:seq id no:100;
[0261]
(x)cdr1:seq id no:104,cdr2:seq id no:105,cdr3:seq id no:106;
[0262]
(xi)cdr1:seq id no:110,cdr2:seq id no:111,cdr3:seq id no:112;
[0263]
(xii)cdr1:seq id no:116,cdr2:seq id no:117,cdr3: seq id no:118;
[0264]
(xiii)cdr1:seq id no:122,cdr2:seq id no:123,cdr3: seq id no:124;
[0265]
(xiv)cdr1:seq id no:128,cdr2:seq id no:129,cdr3:seq id no:130;
[0266]
(xv)cdr1:seq id no:134,cdr2:seq id no:135,cdr3: seq id no:136;
[0267]
(xvi)cdr1:seq id no:140,cdr2:seq id no:141,cdr3: seq id no:142;
[0268]
(xvii)cdr1:seq id no:146,cdr2:seq id no:147,cdr3: seq id no:148;
[0269]
(xviii)cdr1:seq id no:152,cdr2:seq id no:153,cdr3: seq id no:154;
[0270]
(xix)cdr1:seq id no:158,cdr2:seq id no:159,cdr3: seq id no:160;
[0271]
(xx)cdr1:seq id no:164,cdr2:seq id no:165,cdr3: seq id no:166;
[0272]
(xxi)cdr1:seq id no:170,cdr2:seq id no:171,cdr3: seq id no:172;
[0273]
(xxii)cdr1:seq id no:176,cdr2:seq id no:177,cdr3: seq id no:178;和
[0274]
(xxiii)cdr1:seq id no:182,cdr2:seq id no:183,cdr3: seq id no:184。
[0275]
在一个实施方案中,具有结合cldn18.2的能力的抗体包含vh和 vl的组合,所述vh和vl各自包含一组选自以下的互补决定区cdr1、 cdr2和cdr3:
[0276]
(i)vh:cdr1:seq id no:47,cdr2:seq id no:48,cdr3: seq id no:49,vl:cdr1:seq id no:50,cdr2:seq id no:51, cdr3:seq id no:52;
[0277]
(ii)vh:cdr1:seq id no:53,cdr2:seq id no:54,cdr3: seq id no:55,vl:cdr1:seq id no:56,cdr2:seq id no:57, cdr3:seq id no:58;
[0278]
(iii)vh:cdr1:seq id no:59,cdr2:seq id no:60,cdr3: seq id no:61,vl:cdr1:seq id no:62,cdr2:seq id no:63, cdr3:seq id no:64;
[0279]
(iv)vh:cdr1:seq id no:65,cdr2:seq id no:66,cdr3: seq id no:67,vl:cdr1:seq id no:68,cdr2:seq id no:69, cdr3:seq id no:70;
[0280]
(v)vh:cdr1:seq id no:71,cdr2:seq id no:72,cdr3: seq id no:73,vl:cdr1:seq id no:74,cdr2:seq id no:75, cdr3:seq id no:76;
[0281]
(vi)vh:cdr1:seq id no:77,cdr2:seq id no:78,cdr3: seq id no:79,vl:cdr1:seq id no:80,cdr2:seq id no:81, cdr3:seq id no:82;
[0282]
(vii)vh:cdr1:seq id no:83,cdr2:seq id no:84,cdr3: seq id no:85,vl:cdr1:seq id no:86,cdr2:seq id no:87, cdr3:seq id no:88;
[0283]
(viii)vh:cdr1:seq id no:89,cdr2:seq id no:90,cdr3: seq id no:91,vl:cdr1:seq id no:92,cdr2:seq id no:93, cdr3:seq id no:94;
[0284]
(ix)vh:cdr1:seq id no:95,cdr2:seq id no:96,cdr3: seq id no:97,vl:cdr1:seq id no:98,cdr2:seq id no:99, cdr3:seq id no:100;
[0285]
(x)vh:cdr1:seq id no:101,cdr2:seq id no:102,cdr3: seq id no:103,vl:cdr1:seq id no:104,cdr2:seq id no:105, cdr3:seq id no:106;
[0286]
(xi)vh:cdr1:seq id no:107,cdr2:seq id no:108,cdr3: seq id no:109,vl:cdr1:seq id no:110,cdr2:seq id no:111, cdr3:seq id no:112;
[0287]
(xii)vh:cdr1:seq id no:113,cdr2:seq id no:114,cdr3: seq id no:115,vl:cdr1:seq id no:116,cdr2:seq id no:117, cdr3:seq id no:118;
[0288]
(xiii)vh:cdr1:seq id no:119,cdr2:seq id no:120,cdr3: seq id no:121,
vl:cdr1:seq id no:122,cdr2:seq id no:123, cdr3:seq id no:124;
[0289]
(xiv)vh:cdr1:seq id no:125,cdr2:seq id no:126,cdr3:seq id no:127,vl:cdr1:seq id no:128,cdr2:seq id no:129, cdr3:seq id no:130;
[0290]
(xv)vh:cdr1:seq id no:131,cdr2:seq id no:132,cdr3: seq id no:133,vl:cdr1:seq id no:134,cdr2:seq id no:135, cdr3:seq id no:136;
[0291]
(xvi)vh:cdr1:seq id no:137,cdr2:seq id no:138,cdr3: seq id no:139,vl:cdr1:seq id no:140,cdr2:seq id no:141, cdr3:seq id no:142;
[0292]
(xvii)vh:cdr1:seq id no:143,cdr2:seq id no:144, cdr3:seq id no:145,vl:cdr1:seq id no:146,cdr2:seq id no:147,cdr3:seq id no:148;
[0293]
(xviii)vh:cdr1:seq id no:149,cdr2:seq id no:150, cdr3:seq id no:151,vl:cdr1:seq id no:152,cdr2:seq id no:153,cdr3:seq id no:154;
[0294]
(xix)vh:cdr1:seq id no:155,cdr2:seq id no:156,cdr3: seq id no:157,vl:cdr1:seq id no:158,cdr2:seq id no:159, cdr3:seq id no:160;
[0295]
(xx)vh:cdr1:seq id no:161,cdr2:seq id no:162,cdr3: seq id no:163,vl:cdr1:seq id no:164,cdr2:seq id no:165, cdr3:seq id no:166;
[0296]
(xxi)vh:cdr1:seq id no:167,cdr2:seq id no:168,cdr3:seq id no:169,vl:cdr1:seq id no:170,cdr2:seq id no:171, cdr3:seq id no:172;
[0297]
(xxii)vh:cdr1:seq id no:173,cdr2:seq id no:174, cdr3:seq id no:175,vl:cdr1:seq id no:176,cdr2:seq id no:177,cdr3:seq id no:178;和
[0298]
(xxiii)vh:cdr1:seq id no:179,cdr2:seq id no:180, cdr3:seq id no:181,vl:cdr1:seq id no:182,cdr2:seq id no:183,cdr3:seq id no:184。
[0299]
在一个实施方案中,全人抗cldn18.2抗体或其抗原结合片段包含 vh,其包含一组选自以下的互补决定区cdr1、cdr2和cdr3:
[0300]
(i)cdr1:seq id no:221,cdr2:seq id no:222,cdr3:seq id no:223;
[0301]
(ii)cdr1:seq id no:227,cdr2:seq id no:228,cdr3:seq id no:229;
[0302]
(iii)cdr1:seq id no:233,cdr2:seq id no:234,cdr3:seq id no:235;
[0303]
(iv)cdr1:seq id no:239,cdr2:seq id no:240,cdr3:seq id no:241;
[0304]
(v)cdr1:seq id no:245,cdr2:seq id no:246,cdr3:seq id no:247;
[0305]
(vi)cdr1:seq id no:251,cdr2:seq id no:252,cdr3:seq id no:253;
[0306]
(vii)cdr1:seq id no:257,cdr2:seq id no:258,cdr3: seq id no:259;
[0307]
(viii)cdr1:seq id no:263,cdr2:seq id no:264,cdr3: seq id no:265;
[0308]
(ix)cdr1:seq id no:269,cdr2:seq id no:270,cdr3:seq id no:271;
[0309]
(x)cdr1:seq id no:275,cdr2:seq id no:276,cdr3:seq id no:277;
[0310]
(xi)cdr1:seq id no:281,cdr2:seq id no:282,cdr3:seq id no:283;
[0311]
(xii)cdr1:seq id no:287,cdr2:seq id no:288,cdr3: seq id no:289;
[0312]
(xiii)cdr1:seq id no:293,cdr2:seq id no:294,cdr3: seq id no:295;
[0313]
(xiv)cdr1:seq id no:299,cdr2:seq id no:300,cdr3: seq id no:301;
[0314]
(xv)cdr1:seq id no:311,cdr2:seq id no:312,cdr3: seq id no:313;
[0315]
(xvi)cdr1:seq id no:317,cdr2:seq id no:318,cdr3:seq id no:319;和
[0316]
(xvii)cdr1:seq id no:323,cdr2:seq id no:324,cdr3: seq id no:325。
[0317]
在一个实施方案中,全人抗cldn18.2抗体或其抗原结合片段包含 vl,其包含一组选自以下的互补决定区cdr1、cdr2和cdr3:
[0318]
(i)cdr1:seq id no:224,cdr2:seq id no:225,cdr3:seq id no:226;
[0319]
(ii)cdr1:seq id no:230,cdr2:seq id no:231,cdr3:seq id no:232;
[0320]
(iii)cdr1:seq id no:236,cdr2:seq id no:237,cdr3:seq id no:238;
[0321]
(iv)cdr1:seq id no:242,cdr2:seq id no:243,cdr3:seq id no:244;
[0322]
(v)cdr1:seq id no:248,cdr2:seq id no:249,cdr3:seq id no:250;
[0323]
(vi)cdr1:seq id no:254,cdr2:seq id no:255,cdr3:seqid no:256;
[0324]
(vii)cdr1:seq id no:260,cdr2:seq id no:261,cdr3: seq id no:262;
[0325]
(viii)cdr1:seq id no:266,cdr2:seq id no:267,cdr3: seq id no:268;
[0326]
(ix)cdr1:seq id no:272,cdr2:seq id no:273,cdr3:seq id no:274;
[0327]
(x)cdr1:seq id no:278,cdr2:seq id no:279,cdr3:seq id no:280;
[0328]
(xi)cdr1:seq id no:284,cdr2:seq id no:285,cdr3:seq id no:286;
[0329]
(xii)cdr1:seq id no:290,cdr2:seq id no:291,cdr3: seq id no:292;
[0330]
(xiii)cdr1:seq id no:296,cdr2:seq id no:297,cdr3: seq id no:298;
[0331]
(xiv)cdr1:seq id no:302,cdr2:seq id no:303,cdr3: seq id no:304;
[0332]
(xv)cdr1:seq id no:314,cdr2:seq id no:315,cdr3: seq id no:316;
[0333]
(xvi)cdr1:seq id no:320,cdr2:seq id no:321,cdr3: seq id no:322;和
[0334]
(xvii)cdr1:seq id no:326,cdr2:seq id no:327,cdr3: seq id no:328。
[0335]
图1中提供了鼠抗cldn18.2抗体的可变结构域(vh和vl)和cdr 的seq id nos和氨基酸序列。
[0336]
图2中提供了人抗cldn18.2抗体的可变结构域(vh和vl)和cdr 的seq id nos和氨基酸序列。
[0337]
在一个实施方案中,具有结合cldn18.2的能力的抗体包含vh和 vl的组合,所述vh和vl各自包含一组选自以下的互补决定区cdr1、 cdr2和cdr3:
[0338]
(i)vh:cdr1:seq id no:221,cdr2:seq id no:222,cdr3:seq id no:223,vl:cdr1:seq id no:224,cdr2:seq id no:225, cdr3:seq id no:226;
[0339]
(ii)vh:cdr1:seq id no:227,cdr2:seq id no:228,cdr3: seq id no:229,vl:cdr1:seq id no:230,cdr2:seq id no:231, cdr3:seq id no:232;
[0340]
(iii)vh:cdr1:seq id no:233,cdr2:seq id no:234,cdr3: seq id no:235,vl:cdr1:seq id no:236,cdr2:seq id no:237,cdr3:seq id no:238;
[0341]
(iv)vh:cdr1:seq id no:239,cdr2:seq id no:240,cdr3: seq id no:241,vl:cdr1:seq id no:242,cdr2:seq id no:243, cdr3:seq id no:244;
[0342]
(v)vh:cdr1:seq id no:245,cdr2:seq id no:246,cdr3: seq id no:247,vl:cdr1:seq id no:248,cdr2:seq id no:249, cdr3:seq id no:250;
[0343]
(vi)vh:cdr1:seq id no:251,cdr2:seq id no:252,cdr3:seq id no:253,vl:cdr1:seq id no:254,cdr2:seq id no:255, cdr3:seq id no:256;
[0344]
(vii)vh:cdr1:seq id no:257,cdr2:seq id no:258,cdr3: seq id no:259,vl:
no:19 90%、95%或99%相同的可变重链序列和与seq id no:20 90%、95%或99%相同的可变轻链序列;与seq id no:21 90%、95%或99%相同的可变重链序列和与seqid no:22 90%、95%或99%相同的可变轻链序列;与seq id no:2390%、95%或99%相同的可变重链序列和与seq id no:24 90%、95%或99%相同的可变轻链序列;与seq id no:25 90%、95%或99%相同的可变重链序列和与seq id no:26 90%、95%或99%相同的可变轻链序列;与seq id no:27 90%、95%或99%相同的可变重链序列和与seqid no:28 90%、95%或99%相同的可变轻链序列;与seq id no:2990%、95%或99%相同的可变重链序列和与seq id no:30 90%、95%或99%相同的可变轻链序列;与seq id no:31 90%、95%或99%相同的可变重链序列和与seq id no:32 90%、95%或99%相同的可变轻链序列;与seq id no:33 90%、95%或99%相同的可变重链序列和与seqid no:34 90%、95%或99%相同的可变轻链序列;与seq id no:3590%、95%或99%相同的可变重链序列和与seq id no:36 90%、95%或99%相同的可变轻链序列;与seq id no:37 90%、95%或99%相同的可变重链序列和与seq id no:38 90%、95%或99%相同的可变轻链序列;与seq id no:39 90%、95%或99%相同的可变重链序列和与seqid no:40 90%、95%或99%相同的可变轻链序列;与seq id no:4190%、95%或99%相同的可变重链序列和与seq id no:42 90%、95%或99%相同的可变轻链序列;与seq id no:43 90%、95%或99%相同的可变重链序列和与seq id no:44 90%、95%或99%相同的可变轻链序列;与seq id no:45 90%、95%或99%相同的可变重链序列和与seqid no:46 90%、95%或99%相同的可变轻链序列。
[0359]
在另一个替代的实施方案中,抗cldn18.2抗体或其抗体片段包含一对可变重链和可变轻链序列,其选自以下组合:与seq id no:18590%、95%或99%相同的可变重链序列和与seq id no:186 90%、95%或99%相同的可变轻链序列;与seq id no:187 90%、95%或99%相同的可变重链序列和与seq id no:188 90%、95%或99%相同的可变轻链序列;与seq id no:189 90%、95%或99%相同的可变重链序列和与 seq id no:190 90%、95%或99%相同的可变轻链序列;与seq id no: 191 90%、95%或99%相同的可变重链序列和与seq id no:192 90%、 95%或99%相同的可变轻链序列;与seq id no:193 90%、95%或99%相同的可变重链序列和与seq id no:194 90%、95%或99%相同的可变轻链序列;与seq id no:195 90%、95%或99%相同的可变重链序列和与seq id no:196 90%、95%或99%相同的可变轻链序列;与seq idno:197 90%、95%或99%相同的可变重链序列和与seq id no:19890%、95%或99%相同的可变轻链序列;与seq id no:199 90%、95%或99%相同的可变重链序列和与seq id no:200 90%、95%或99%相同的可变轻链序列;与seq id no:201 90%、95%或99%相同的可变重链序列和与seq id no:202 90%、95%或99%相同的可变轻链序列;与 seq id no:203 90%、95%或99%相同的可变重链序列和与seq id no: 204 90%、95%或99%相同的可变轻链序列;与seq id no:205 90%、 95%或99%相同的可变重链序列和与seq id no:206 90%、95%或99%相同的可变轻链序列;与seq id no:207 90%、95%或99%相同的可变重链序列和与seq id no:208 90%、95%或99%相同的可变轻链序列;与seq id no:209 90%、95%或99%相同的可变重链序列和与seq id no:210 90%、95%或99%相同的可变轻链序列;与seq id no:21190%、95%或99%相同的可变重链序列和与seq id no:212 90%、95%或99%相同的可变轻链序列;与seq id no:215 90%、95%或99%相同的可变重链序列和与seq id no:216 90%、95%或
99%相同的可变轻链序列;与seq id no:217 90%、95%或99%相同的可变重链序列和与 seq id no:218 90%、95%或99%相同的可变轻链序列;与seq id no: 219 90%、95%或99%相同的可变重链序列和与seq id no:220 90%、 95%或99%相同的可变轻链序列。
[0360]
在一些实施方案中,抗体是全长抗体。在其他实施方案中,抗体是抗体片段,包括,例如,选自以下的抗体片段:fab、fab’、f(ab)2、fv、结构域抗体(dab)和互补决定区(cdr)片段、单链抗体(scfv)、嵌合抗体、双抗体、三抗体、四抗体、小抗体、多特异性抗体、双特异性抗体和含有至少一部分足以赋予与多肽的cldnl8.2特异性结合的免疫球蛋白的多肽。
[0361]
因此,在一个实施方案中,抗体片段包含至少一个本文所述的cdr。抗体片段可包含本文所述的至少两个、三个、四个、五个或六个cdr。抗体片段还可包含本文所述抗体的至少一个可变区结构域。可变区结构域可以是任何大小或氨基酸组成,并且通常将包含至少一个负责特异性结合人cldn18.2的cdr序列,例如本文所述的cdr
‑
h1、cdr
‑
h2、 cdr
‑
h3、cdr
‑
l1、cdr
‑
l2和/或cdr
‑
l3,并且其与一个或多个框架序列相邻或在框架内。
[0362]
在一些实施方案中,抗cldn8.2抗体是单克隆抗体。在一些实施方案中,抗cldn8.2抗体是人抗体。在替代的实施方案中,抗cldn8.2 抗体是鼠抗体。在一些实施方案中,抗cldn8.2抗体是嵌合抗体、双特异性抗体或人源化抗体。
[0363]
在一些实施方案中,抗cldn8.2抗体或其抗体片段包含一个或多个保守氨基酸置换。本领域技术人员将认识到,保守氨基酸置换是一个氨基酸被具有类似结构或化学特性(例如,相似侧链)的另一个氨基酸替换。本领域中描述了示例性的保守置换,例如在watson et al.、molecular biology of the gene、the benjamin/cummings publication company、4th ed.(1987)中。
[0364]“保守修饰”是指不显著影响或改变含有氨基酸序列的抗体的结合特性的氨基酸修饰。保守修饰包括氨基酸置换、添加和缺失。保守置换是指氨基酸被具有相似侧链的氨基酸残基替换。具有相似侧链的氨基酸残基家族定义明确,包括具有以下侧链的氨基酸:酸性侧链(例如天冬氨酸、谷氨酸)、碱性侧链(例如赖氨酸、精氨酸、组氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸、色氨酸)、芳香族侧链(例如苯丙氨酸、色氨酸、组氨酸、酪氨酸)、脂肪族侧链(例如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸)、酰胺(例如,天冬酰胺、谷氨酰胺)、β
‑
支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和含硫侧链(半胱氨酸、蛋氨酸)。此外,多肽中的任何天然残基也可以被丙氨酸置换,如前面所述的丙氨酸扫描诱变(maclennan et al.(1998)actaphysiol scand suppl 643:55
‑
67;sasaki et al.(1998)adv biophys 35: 1
‑
24)。本发明抗体的氨基酸置换可以通过已知方法进行,例如通过pcr 诱变(美国专利号4,683,195)。
[0365]
在一个实施方案中,il
‑
cldn18.2抗体或其抗体片段包含被设计为嵌合抗体或人源化抗体的ms1、ms2、ms3、ms4、ms5、ms6、ms7、 ms8、ms9、ms10、ms11、ms12、ms13、ms14、ms15、ms16、ms17、 ms18、ms19、ms20、ms21、ms22或ms23抗体的所有六个cdr区。在其他实施方案中,cldn18.2抗体或其抗体片段包含所公开的全人抗体之一的所有六个cdr区。
[0366]
在一些实施方案中,本文公开的抗cldn18.2抗体的可变区结构域可以在c端氨基酸共价连接到至少一个其他抗体结构域或其片段。因此,例如,可变区结构域中存在的vh结构域可以与免疫球蛋白ch1结构域或其片段连接。类似地,vl结构域可以连接到ck结构域或
其片段。以这种方式,例如,抗体可以是fab片段,其中抗原结合结构域包含相关的vh和vl结构域,它们的c端分别共价连接到ch1和ck结构域。 ch1结构域可以用其他的氨基酸延伸,例如,以提供如fab片段中存在的铰链区或铰链区结构域的一部分,或提供其他的结构域,例如抗体ch2 和ch3结构域。
[0367]
抗原结合片段、单特异性或多特异性抗体可通过重组dna技术或通过酶或化学切割完整抗体产生。抗体片段的实例包括但不限于fv、fab、 fab’、fab
’‑
sh、f(ab)2;双抗体;线性抗体;单链抗体分子(例如scfv)。“单链fv”也缩写为“sfv”或“scfv”,是包含连接成单个多肽链的 vh和vl抗体结构域的抗体片段。一种或多种所公开的抗cldn18结合 cdr可以共价或非共价方式纳入重组分子中,以使其成为嵌合抗体、双抗体、三抗体、四抗体和多肽形式的抗原结合蛋白,所述多肽含有足以赋予与多肽的cldn18特异性结合的免疫球蛋白的至少一部分。
[0368]
因此,在一个实施方案中,结合剂包含至少一个本文所述的cdr。如本文所述,结合剂可以包含至少两个、三个、四个、五个或六个cdr。结合剂还可以包含本文所述抗体的至少一个可变区结构域。可变区结构域可以是任何大小或氨基酸组成,并且通常将包含至少一个负责结合人 cldn18.2的cdr序列,例如本文具体描述的cdr
‑
h1、cdr
‑
h2、 cdr
‑
h3和/或轻链cdr,并且其与一个或多个框架序列相邻或在框架内。
[0369]
一般而言,可变(v)区结构域可以是免疫球蛋白重链(vh)和/或轻链(vl)可变结构域的任何合适排列。因此,例如,v区结构域可以是单体的,并且可以是vh或vl结构域,其能够独立地结合人 cldn18.2,如下所述。或者,v区结构域可以是二聚体的,并含有vh
‑
vh、 vh
‑
vl或vl
‑
vl二聚体。v区二聚体包含至少一个vh和至少一个vl 链,其可以非共价结合(以下称为fv)。如果需要,链可以直接共价偶联,例如通过两个可变结构域之间的二硫键,或通过接头,例如肽接头,形成单链fv(scfv)。
[0370]
本领域技术人员将认识到,人igg免疫球蛋白分子(抗体)由四条多肽链组成,由两条相同的50kda γ重(h)链和两条相同的25kda κ或λ轻(l)链组成,其通过链间二硫键连接在一起。每条重链由一个n 端可变结构域(vh)和一个包含三个恒定结构域(ch1、ch2、ch3) 的fc区组成,ch1和ch2之间还有一个额外的“铰链区”。每条轻链由一个n端可变结构域(vl)和一个单一恒定结构域(cl)组成。两种类型的轻链,kappa(κ)和lambda(λ),最初也是在血清学上定义的,随后由蛋白质和基因序列定义。每个h2l2模块表达两条κ或两条λ轻链以形成h2κ2或h2λ2异二聚体。
[0371]
igg重链分子的fc区还含有一个新生fc受体(fcrn)结合表位,其位于fc ch2
‑
ch3结构域之间的连接处,所述新生fc受体负责胎盘转运和igg半衰期。一般而言,抗体的可变区(vh和vl结构域)参与靶上表位的识别,而fc片段的功能是赋予抗体生物学特性。更具体地说, fc区允许抗体被表达fcγ受体的免疫效应子(包括单核细胞、巨噬细胞、树突细胞和自然杀伤细胞或nk细胞)识别,以激活补体系统,并与fcrn (新生fc受体)结合。
[0372]
人igg包含四个高度保守的亚类:igg1、igg2、igg3和igg4,它们的氨基酸序列同源性超过90%,具有影响其与辅助分子和受体结合的亚型特异性差异。igg亚类在其恒定区序列上彼此不同,特别是在参与结合igg
‑
fc受体(fc γ受体)和补体成分c1q的铰链和上部ch2结构域上。因此,不同的igg亚类在激活免疫效应细胞和激活补体级联方面具有不同的效应子功能。fcγr介导的效应细胞应答的类型包括但不限于抗体依赖性细胞的细胞毒性
(adcc)、抗体依赖性细胞吞噬作用(adcp)、细胞因子的释放和用于呈递的抗原摄取。
[0373]
除了同种型变异外,在igg亚类中也发现了等位基因变异。这些在个体和种族之间可能存在差异的免疫球蛋白的多态性表位最初是根据血清学研究发现的,因为在一些个体的igg上发现了免疫原性决定簇,而其他个体没有。同种异型(allotype)以共显性孟德尔方式遗传,在非洲、白人和东方人群中发现了各种组合。
[0374]
治疗性抗体最常用的igg同种型亚类之一是igg1,它有四种特征明确的同种异型。据报道,使用包含替代性同种异型的igg1序列可改变(增加或降低)对fcrn受体的结合亲和力,和/或增加经修饰的抗体和fcrn 形成的复合体的稳定性,从而影响治疗性抗体的药代动力学 (us2018/0362624和j.immunol.196(2):607(2016),ternant,d et al)。目前,四种主要同种异型的igg1 mab治疗药物已获得许可并上市。注意,本领域普通技术人员可以容易地确定用于本发明的vh区的合适的 igg1 ch序列。
[0375]
在一个方面,本文提供的抗cldn18.2抗体包含与野生型人igg1重链恒定区(ch)和野生型人κ轻链(cl)区结合的可变重链和可变轻链序列的特定对。例如,而非出于限制的目的,本发明提供了抗cldn18.2 抗体,所述抗体包含本发明的重链可变区(vh),其与选自seq id no: 331
‑
334中列出的序列的野生型人igg1恒定重链(ch)免疫球蛋白序列结合,以及野生型人免疫球蛋白轻链,其具有与免疫球蛋白轻链恒定区 (cl)结合的本发明的轻链可变区(vl)。在一些方面,cl区包含人κ轻链区,所述人κ轻链区包含seq id no:335中列出的序列。图11a 和11b提供了适于与本发明的vh和vl序列组合使用的人igg1 ch结构域(图11a)和人κ链结构域(图11b)的序列信息。
[0376]
在另一个方面,本文提供的抗cldn18.2抗体包含含有修饰的ch 的人igg1 ch区,所述修饰的ch包含引入序列中的点突变以增强所需效应子功能(例如adcc或adcp活性)或延长抗体的半衰期或稳定性。在一个方面,本发明提供了抗cldn18.2抗体,以旨在使其由于增强的 adcc、adcp和/或cdc活性而作为癌症免疫疗法“适合于目的 (fit
‑
for
‑
purpose)”的方式对其进行工程化或制造。更具体地,本发明的一个方面的特征在于以低igg
‑
fc核心岩藻糖或无igg
‑
fc核心岩藻糖为特征的抗cldn18.2抗体。非岩藻糖基化抗cldn18.2治疗性抗体的潜在优势包括能够在较低剂量下达到治疗效果、诱导针对表达低水平 cldn18.2的肿瘤细胞的高细胞毒性以及在表达cd16a低亲和力fcγ受体的nk细胞中触发高效应子功能。
[0377]
在一个方面,并且不是出于限制的目的,本发明的特征在于以低igg 核心岩藻糖或无igg核心岩藻糖(非岩藻糖基化的或未岩藻糖基化的 (non
‑
or afucosylated))抗体为特征的抗cldn18.2抗体。本领域技术人员将容易理解,本发明的这一方面可以是嵌合的或人源化的抗 cldn18.2抗体,其包含选自图1中的抗体序列对(vh和vl)或vh 和vl cdr组的可变区(即vh和vl)区域。或者,以低igg核心岩藻糖或无igg核心岩藻糖为特征的抗cldn18.2抗体可以是包含选自图2 中的抗体序列对(vh和vl)或vh和vl cdr组的可变区的全人序列。
[0378]
在一个方面,本发明抗体的特征在于非岩藻糖基化的抗cldn18.2 抗体或以低核心igg岩藻糖水平为特征的抗cldn18.2抗体,其包含分别选自seq id no:1和seq id no:2、seq id no:3和seq id no:4、 seq id no:201和seq id no:202以及seq id no:203和seq id no: 204的一对vh和vl序列。在任何特定抗体中,抗cldn18.2特异性可变区可以是全长
igg的形式,其包含选自seq id no:331
‑
334的人igg1 恒定重链免疫球蛋白序列,和包含seq id no:335中所述序列的人ig κ轻链恒定区。
[0379]
在一个替代的方面,本发明的特征在于在fc区的靶向位点包含点突变的cldn18.2抗体,相对于包含野生型人igg1 ch序列的相同抗体(例如,相同的可变vh和vl区或6个cdr序列组)的活性,增强了adcc 和/或adcp和/或cdc活性。本领域技术人员将容易理解,本发明的这一方面可以是嵌合的或人源化的抗cldn18.2抗体,其包含选自图1中的抗体序列对(vh和vl)或vh和vl cdr组的可变区(即vh和 vl)区域。或者,包含点突变的fc工程化的抗cldn18.2抗体可以是包含选自图2中的抗体序列对(vh和vl)或vh和vl cdr组的可变区的全人序列。
[0380]
在一个方面,本发明提供了fc工程化的抗cldn18.2特异性抗体,其包含分别选自seq id no:1和seq id no:2、seq id no:3和seqid no:4、seq id no:201和seq id no:202以及seq id no:203和 seq id no:204的一对vh和vl序列。在任何特定抗体中,抗cldn18.2 特异性可变区可以是全长igg的形式,其包含选自seq id no:331
‑
334 的人igg1恒定重链免疫球蛋白序列,和包含seq id no:335中所述序列的人ig κ轻链恒定区。
[0381]
例如,但并非出于限制的目的,本发明提供了一种fc工程化的全人 igg1抗cldn18.2抗体,其包含与工程化的ch区组合的seq id no: 201中提供的vh序列,该ch区包括设计用于增强所需生物活性的ch1 和/或ch2和/或ch3区中的点突变;和与人κ轻链免疫球蛋白序列(例如seq id no:335中列出的序列)组合的seq id no:202中提供的vl 序列。在一个方面,并且不是出于限制的目的,本发明的特征在于在本文中称为mab nbl
‑
014的抗cldn18.2抗体,其包含具有氨基酸序列 seq id no:336的重组重链和包含seq id no:337中列出的序列的轻链(见图12)。在一个替代的实施方案中,本发明提供了抗cldn18.2 抗体,其包含具有氨基酸序列seq id no:338的重组重链和包含seq idno:337中列出的序列的轻链,本文称其为nbl
‑
014(见图12)。
[0382]
在一个替代的方面,本发明提供了一种fc工程化的全人igg1抗cldn18.2抗体,其包含与工程化的ch区组合的seq id no:203中提供的vh序列,所述工程化的ch区包含设计用于增强所需生物活性的 ch1和/或ch2和/或ch3区中的点突变;和与人κ轻链免疫球蛋白序列 (例如seq id no:335中列出的序列)结合的seq id no:204中提供的vl序列。
[0383]
在一个替代的方面,本发明提供了fc修饰的、糖工程化的或蛋白质工程化的(例如通过在ch fc区引入点突变)抗cldn18.2特异性抗体,其包含vh序列,所述vh序列包含选自图1和图2中提供的vh和vlcdr组的cdr1、cdr2和cdr3区。更具体地,本发明的特征在于包含vh结构域的工程化的抗cldn18.2抗体,所述vh结构域包含一组选自seq id no:47
‑
49、seq id no:53
‑
55、seq id no:269
‑
271和seqid no:275
‑
277的cdr1、cdr2和cdr3序列,所述vh结构域与工程化的ch区组合,所述工程化的ch区包含设计用于增强所需生物活性的 ch1和/或ch2和/或ch3区中的点突变,所述vh结构域与vl序列配对,所述vl序列包含一组分别选自seq id no:50
‑
52、seq id no: 56
‑
58、seq id no:272
‑
274和seq id no:278
‑
280的cdr1、cdr2 和cdr3序列,所述vl序列与人κ轻链免疫球蛋白序列组合。
[0384]
本公开的抗体的治疗价值可以通过与细胞毒性药物或试剂缀合而增强,所述细胞毒性药物或试剂改善其有效性和效价。在一些实施方案中,抗体是抗体药物缀合物(adc),其包含与细胞毒性效应剂如放射性同位素、药物或细胞毒素偶联的cldn18.2特异性抗体。
内吞作用的内化作用表明抗体适合于抗体药物偶联物(adc)的开发。具有这些特性的抗cldn18.2抗体也可用于但不限于治疗cldn18.2相关疾病或病症的双特异性、嵌合抗原受体t细胞或nk细胞、细胞疗法和组合疗法。
[0385]
本公开的抗cldn18.2抗体还可用于开发基于抗体的免疫疗法,其依赖于cldn18.2特异性结合以将患者效应细胞(例如,t细胞或nk细胞)引导至肿瘤,包括双特异性t细胞接合抗体,或重定向nk细胞的双特异性分子,或细胞疗法,例如car
‑
t疗法。
[0386]
产生抗体的方法
[0387]
许多合适的方法可用于抗体产生,并且是本领域技术人员已知的。例如,可以用表达claudin 18.2、可溶性重组claudin 18.2蛋白、或与其载体蛋白缀合的片段或肽的细胞来免疫受体。本领域技术人员已知的任何合适的方法可用于引发具有所需生物学特性的抗体以抑制claudin 18.2。此类方法可包括免疫方法,其包括使用佐剂、其他免疫刺激剂、重复加强免疫以及使用一种或多种免疫途径。
[0388]
任何合适的claudin 18.2来源都可用作产生本文公开的组合物和方法的对claudin 18.2具有特异性的非人抗体或人抗体的免疫原。此类形式包括但不限于通过本领域已知的重组、合成、化学或酶降解方法产生的表达claudin 18.2的细胞(内源性细胞或用claudin 18.2基因转染的内源性细胞细胞)全蛋白、肽和表位。
[0389]
不同形式的抗原可用于产生足以产生生物活性抗体的抗体。因此,引发抗原可以是单个表位、多个表位、或整个蛋白单独或与一种或多种免疫原性增强剂组合。在一些情况下,引发抗原是分离的全长蛋白、细胞表面蛋白(例如用至少一部分抗原转染的细胞免疫)或可溶性蛋白(例如仅用蛋白的胞外结构域部分免疫)。
[0390]
在一些实施方案中,在遗传修饰的细胞中产生抗原。编码抗原的dna 可以是基因组的或非基因组的(例如cdna),并且可以编码胞外结构域的至少一部分。如本文所用,术语“部分”指适于构成目的抗原的免疫原性表位的最少数量的氨基酸或核酸。可以使用适于转化目的细胞的任何遗传载体,包括但不限于腺病毒载体、质粒和非病毒载体,例如阳离子脂质。
[0391]
需要从各种哺乳动物宿主如小鼠、啮齿动物、灵长类动物、人等制备单克隆抗体(mab)。制备此类单克隆抗体的技术描述可在例如sties et al. (eds.)basic and clinical immunology(4th ed.)lance medicalpublication、los aitos、ca和其中引用的参考文献;harlow and lane (1988)antibodies:a laboratory manual csh press;goding (1986)monoclonal antibodies:principles and practice (2d ed)academic press、new york、ny中发现。通常,来自用所需抗原免疫的动物的脾细胞是永生化的,通常通过与骨髓瘤细胞融合。参见 kohler and milstein(196)eur.j.immunol.6:511
‑
519。永生化的替代方法包括用eb病毒、癌基因或逆转录病毒转化,或本领域已知的其他方法。参见例如doyle et al.(eds.1994和定期补充)cell and tissue culture:laboratory procedures、john wiley and sons、newyork、ny。筛选由单个永生化细胞产生的克隆以产生对抗原具有所需特异性和亲和力的抗体,且可通过各种技术(包括注射到脊椎动物宿主的腹膜腔中)提高由此类细胞产生的单克隆抗体的产量。或者,可以通过从人b细胞筛选dna文库来分离编码单克隆抗体或其抗原结合片段的 dna序列,根据例如huse et al.(1989)science 246:1275
‑
1281概述的一般方案。因此,单克隆抗体可以通过本领域技术人员熟悉
的多种技术获得。
[0392]
其他合适的技术包括选择噬菌体、酵母、病毒或相似载体中的抗体文库。参见例如上述huse等人;和ward et al.(1989)nature 341:544
‑
546。本发明的多肽和抗体可以在修饰或不修饰的情况下使用,包括嵌合或人源化抗体。通常,多肽和抗体通过共价或非共价连接提供可检测信号的物质来标记。已知有多种标记和缀合技术,在科学和专利文献中均有广泛报道。合适的标记物包括放射性核素、酶、底物、辅因子、抑制剂、荧光部分、化学发光部分、磁性颗粒等。教导使用此类标记物的专利包括美国专利号3,817,837;3,850,752;3,9396,345;4,277,437;4,275,149 和4,366,241。此外,可以产生重组免疫球蛋白,参见cabilly美国专利号 4,816,567;和queen et al.(1989)proc.nat’l acad.sci.usa 86: 10029
‑
10023;或在转基因小鼠中制备,参见niis lonberg et al.(1994)、 nature 368:856
‑
859;和mendez et al.(1997)nature genetics 15:146
‑
156; transgenic animals and methods of use (wo2012us62118a)、medarex、trianni、abgenix、ablexis、ominiab、 harbour和其他技术。
[0393]
在一些实施方案中,所产生的抗体结合抗原(例如cldn18)的能力可使用标准结合试验来评估,例如elisa、蛋白质印迹、免疫荧光和流式细胞分析。在一些方面,还可评估所产生的抗体介导对表达cldn18 的靶细胞(例如肿瘤细胞)的杀伤的能力(例如,抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(cdc)、抗体依赖性吞噬作用(adcp)和/或细胞增殖的抑制)。
[0394]
由细胞制备的抗体组合物可以使用例如羟基磷灰石色谱、凝胶电泳、透析和亲和色谱纯化,其中亲和色谱是典型的纯化技术。蛋白质a作为亲和配体的适用性取决于抗体中存在的任何免疫球蛋白fc结构域的种类和同种型。蛋白质a可用于纯化基于人γ1、γ2或γ4重链的抗体(参见,例如lindmark et al.、1983j.immunol.meth.62:1
‑
13)。建议将蛋白质 g用于所有小鼠同种型和人γ3(参见,例如guss et al.、1986embo j. 5:1567
‑
1575)。与亲和配体连接的基质通常是琼脂糖,但也可使用其他基质。机械稳定的基质,如可控孔玻璃或聚(苯乙烯二乙烯基)苯,可实现比琼脂糖更快的流速和更短的处理时间。当抗体包含ch3结构域时, bakerbond abx
tm
树脂(j.t.baker、phillipsburg、n.j.)可用于纯化。根据要回收的抗体,也可使用其他蛋白质纯化技术,如离子交换柱分馏、乙醇沉淀、反相hplc、硅胶色谱、肝素sepharose
tm
色谱、阴离子或阳离子交换树脂(如聚天冬氨酸柱)色谱、色谱聚焦、sds
‑
page和硫酸铵沉淀。
[0395]
在任何初步纯化步骤之后,可使用ph在约2.5
‑
4.5之间的洗脱缓冲液对包含目的抗体和污染物的混合物进行低ph疏水相互作用色谱,通常在低盐浓度(例如约0
‑
0.25m盐)下进行。
[0396]
还包括在本文定义的低、中和高严格条件下与由编码本公开的抗体或抗体片段的分离的多核苷酸序列表示的核苷酸序列的全部或一部分(例如,编码可变区的部分)杂交的核酸。杂交核酸的杂交部分的长度通常为至少15(例如20、25、30或50)个核苷酸。杂交核酸的杂交部分与编码抗cldn18多肽(例如重链或轻链可变区)的核酸的一部分或全部序列或其互补序列至少80%,例如至少90%,至少95%,或至少98%相同。本文所述类型的杂交核酸可用作例如克隆探针、引物(例如pcr引物) 或诊断探针。
[0397]
多核苷酸、载体和宿主细胞
[0398]
其他实施方案包括包含编码抗cldn18.2抗体或其抗体片段的序列的分离的多核苷酸,包含多核苷酸的载体和宿主细胞,以及用于产生抗体的重组技术。分离的多核苷酸可编码任何所需形式的抗cldn18.2抗体,包括例如全长单克隆抗体、fab、fab’、f(ab’)2和fv片段、双抗体、线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。
[0399]
一些实施方案包括分离的多核苷酸,其包含编码抗体或抗体片段的重链可变区的序列,所述重链可变区具有seq id no:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、 45、185、187、189、191、193、195、197、199、201、203、205、207、 209、211、215、217或219的氨基酸序列。一些实施方案包括分离的多核苷酸,其包含编码抗体或抗体片段的轻链可变区的序列,所述轻链可变区具有seq id no:2、4、6、8、10、12、14、16、18、20、22、24、 26、28、30、32、34、36、38、40、42、44、46、186、188、190、192、 194、196、198、200、202、204、206、208、210、212、216、218或220 中任一个的氨基酸序列。
[0400]
在一个实施方案中,分离的多核苷酸序列编码具有轻链和重链可变区的抗体或抗体片段,所述轻链和重链可变区包含以下氨基酸序列:
[0401]
(a)包含seq id no:1的可变重链序列和包含seq id no:2的可变轻链序列;
[0402]
(b)包含seq id no:3的可变重链序列和包含seq id no:4的可变轻链序列;
[0403]
(c)包含seq id no:5的可变重链序列和包含seq id no:6的可变轻链序列;
[0404]
(d)包含seq id no:7的可变重链序列和包含seq id no:8的可变轻链序列;
[0405]
(e)包含seq id no:9的可变重链序列和包含seq id no:10的可变轻链序列;
[0406]
(f)包含seq id no:11的可变重链序列和包含seq id no:12的可变轻链序列;
[0407]
(g)包含seq id no:13的可变重链序列和包含seq id no:14的可变轻链序列;
[0408]
(h)包含seq id no:15的可变重链序列和包含seq id no:16 的可变轻链序列;
[0409]
(i)包含seq id no:17的可变重链序列和包含seq id no:18的可变轻链序列;
[0410]
(j)包含seq id no:19的可变重链序列和包含seq id no:20的可变轻链序列;
[0411]
(k)包含seq id no:21的可变重链序列和包含seq id no:22 的可变轻链序列;
[0412]
(1)包含seq id no:23的可变重链序列和包含seq id no:24的可变轻链序列;
[0413]
(m)包含seq id no:25的可变重链序列和包含seq id no:26 的可变轻链序列;
[0414]
(n)包含seq id no:27的可变重链序列和包含seq id no:28 的可变轻链序列;
[0415]
(o)包含seq id no:29的可变重链序列和包含seq id no:30的可变轻链序列;
[0416]
(p)包含seq id no:31的可变重链序列和包含seq id no:32 的可变轻链序列;
[0417]
(q)包含seq id no:33的可变重链序列和包含seq id no:34 的可变轻链序列;
[0418]
(r)包含seq id no:35的可变重链序列和包含seq id no:36的可变轻链序列;
[0419]
(s)包含seq id no:37的可变重链序列和包含seq id no:38的可变轻链序列;
[0420]
(t)包含seq id no:39的可变重链序列和包含seq id no:40的可变轻链序列;
[0421]
(u)包含seq id no:41的可变重链序列和包含seq id no:42 的可变轻链序列;
[0422]
(v)包含seq id no:43的可变重链序列和包含seq id no:44的可变轻链序列;或
[0423]
(w)包含seq id no:45的可变重链序列和包含seq id no:46 的可变轻链序列。
[0424]
在另一个实施方案中,分离的多核苷酸序列编码具有轻链和重链可变区的抗体或抗体片段,所述轻链和重链可变区包含以下氨基酸序列:
[0425]
(aa)包含seq id no:185的可变重链序列和包含seq id no:186 的可变轻链序
列;
[0426]
(bb)包含seq id no:187的可变重链序列和包含seq id no:188 的可变轻链序列;
[0427]
(cc)包含seq id no:189的可变重链序列和包含seq id no:190 的可变轻链序列;
[0428]
(dd)包含seq id no:191的可变重链序列和包含seq id no:192 的可变轻链序列;
[0429]
(ee)包含seq id no:193的可变重链序列和包含seq id no:194 的可变轻链序列;
[0430]
(ff)包含seq id no:195的可变重链序列和包含seq id no:196 的可变轻链序列;
[0431]
(gg)包含seq id no:197的可变重链序列和包含seq id no:198 的可变轻链序列;
[0432]
(hh)包含seq id no:199的可变重链序列和包含seq id no:200 的可变轻链序列;
[0433]
(ii)包含seq id no:201的可变重链序列和包含seq id no:202 的可变轻链序列;
[0434]
(jj)包含seq id no:203的可变重链序列和包含seq id no:204 的可变轻链序列;
[0435]
(kk)包含seq id no:205的可变重链序列和包含seq id no:206 的可变轻链序列;
[0436]
(ll)包含seq id no:207的可变重链序列和包含seq id no:208 的可变轻链序列;
[0437]
(mm)包含seq id no:209的可变重链序列和包含seq id no: 210的可变轻链序列;
[0438]
(nn)包含seq id no:211的可变重链序列和包含seq id no:212 的可变轻链序列;
[0439]
(oo)包含seq id no:215的可变重链序列和包含seq id no:216 的可变轻链序列;
[0440]
(pp)包含seq id no:217的可变重链序列和包含seq id no:218 的可变轻链序列;或
[0441]
(qq)包含seq id no:219的可变重链序列和包含seq id no:220 的可变轻链序列。
[0442]
在另一个实施方案中,分离的多核苷酸序列编码具有轻链和重链可变区的抗体或抗体片段,所述轻链和重链可变区包含以下氨基酸序列:
[0443]
(aa)与seq id no:185 90%、95%或99%相同的可变重链序列和与seq id no:186 90%、95%或99%相同的可变轻链序列;
[0444]
(bb)与seq id no:187 90%、95%或99%相同的可变重链序列和与seq id no:188 90%、95%或99%相同的可变轻链序列;
90%、95%或99%相同的可变轻链序列;
[0465]
(e)与seq id no:9 90%、95%或99%相同的可变重链序列和与 seq id no:10 90%、95%或99%相同的可变轻链序列;
[0466]
(f)与seq id no:11 90%、95%或99%相同的可变重链序列和与seq id no:12 90%、95%或99%相同的可变轻链序列;
[0467]
(g)与seq id no:13 90%、95%或99%相同的可变重链序列和与 seq id no:14 90%、95%或99%相同的可变轻链序列;
[0468]
(h)与seq id no:15 90%、95%或99%相同的可变重链序列和与 seq id no:16 90%、95%或99%相同的可变轻链序列;
[0469]
(i)与seq id no:17 90%、95%或99%相同的可变重链序列和与seq id no:18 90%、95%或99%相同的可变轻链序列;
[0470]
(j)与seq id no:19 90%、95%或99%相同的可变重链序列和与 seq id no:20 90%、95%或99%相同的可变轻链序列;
[0471]
(k)与seq id no:21 90%、95%或99%相同的可变重链序列和与 seq id no:22 90%、95%或99%相同的可变轻链序列;
[0472]
(l)与seq id no:23 90%、95%或99%相同的可变重链序列和与seq id no:24 90%、95%或99%相同的可变轻链序列;
[0473]
(m)与seq id no:25 90%、95%或99%相同的可变重链序列和与seq id no:26 90%、95%或99%相同的可变轻链序列;
[0474]
(n)与seq id no:27 90%、95%或99%相同的可变重链序列和与 seq id no:28 90%、95%或99%相同的可变轻链序列;
[0475]
(o)与seq id no:29 90%、95%或99%相同的可变重链序列和与 seq id no:30 90%、95%或99%相同的可变轻链序列;
[0476]
(p)与seq id no:31 90%、95%或99%相同的可变重链序列和与 seq id no:32 90%、95%或99%相同的可变轻链序列;
[0477]
(q)与seq id no:33 90%、95%或99%相同的可变重链序列和与 seq id no:34 90%、95%或99%相同的可变轻链序列;
[0478]
(r)与seq id no:35 90%、95%或99%相同的可变重链序列和与 seq id no:36 90%、95%或99%相同的可变轻链序列;
[0479]
(s)与seq id no:37 90%、95%或99%相同的可变重链序列和与 seq id no:38 90%、95%或99%相同的可变轻链序列;
[0480]
(t)与seq id no:39 90%、95%或99%相同的可变重链序列和与 seq id no:40 90%、95%或99%相同的可变轻链序列;
[0481]
(u)与seq id no:41 90%、95%或99%相同的可变重链序列和与 seq id no:42 90%、95%或99%相同的可变轻链序列;
[0482]
(v)与seq id no:43 90%、95%或99%相同的可变重链序列和与 seq id no:44 90%、95%或99%相同的可变轻链序列;或
[0483]
(w)与seq id no:45 90%、95%或99%相同的可变重链序列和与seq id no:46 90%、95%或99%相同的可变轻链序列。
[0484]
包含编码抗cldn18.2抗体或其抗体片段的序列的多核苷酸可以与本领域已知的一个或多个调节或控制序列融合,并且可以包含在本领域已知的合适的表达载体或宿主细胞中。编码重链或轻链可变结构域的多核苷酸分子中的每一个可以独立地与编码恒定结构域如人恒定结构域的多核苷酸序列融合,从而能够产生完整的抗体。或者,可将多核苷酸或其部分融合在一起,从而提供生产单链抗体的模板。
[0485]
为了重组生产,将编码抗体的多核苷酸插入可复制的载体中以进行克隆(dna的扩增)或表达。可获得许多用于表达重组抗体的合适载体。载体组分通常包括但不限于以下的一种或多种:信号序列、复制起点、一种或多种标记基因、增强子元件、启动子和转录终止序列。
[0486]
抗cldn18.2抗体或其抗体片段也可以作为融合多肽产生,其中抗体或片段与异源多肽(如信号序列或在成熟蛋白或多肽的氨基端具有特异性切割位点的其他多肽)融合。所选择的异源信号序列通常是被宿主细胞识别和处理(即,被信号肽酶切割)的序列。对于不识别和处理抗 cldn18.2抗体信号序列的原核宿主细胞,信号序列可被原核信号序列替换。信号序列可以是例如碱性磷酸酶、青霉素酶、脂蛋白、热稳定肠毒素ii前导序列等。对于酵母分泌,天然信号序列可以被例如从酵母转化酶α
‑
因子(包括酵母属(saccharomyces)和克鲁维酵母属(kluyveromyces) α
‑
因子前导序列)、酸性磷酸酶、白色念珠菌(c.albicans)葡糖淀粉酶获得的前导序列或wo90/13646中描述的信号替换。在哺乳动物细胞中,可以使用哺乳动物信号序列以及病毒分泌前导序列,例如单纯疱疹gd信号。这种前体区域的dna在阅读框中与编码抗cldn18.2抗体的dna 连接。
[0487]
表达和克隆载体含有使载体能够在一种或多种选定的宿主细胞中复制的核酸序列。通常,在克隆载体中,该序列是使载体能够独立于宿主染色体dna复制的序列,包括复制起点或自主复制序列。多种细菌、酵母和病毒的此类序列是众所周知的。质粒pbr322的复制起点适用于大多数革兰氏阴性菌,2
‑
υ.质粒起点适用于酵母,各种病毒起点(sv40、多瘤病毒、腺病毒、vsv和bpv)可用于在哺乳动物细胞中克隆载体。一般而言,哺乳动物表达载体不需要复制起点组件(通常可以使用sv40起点,只是因为它含有早期启动子)。
[0488]
表达和克隆载体可含有编码选择性标记物的基因,以促进表达的识别。典型的选择性标记物基因编码赋予对抗生素或其他毒素(例如氨苄青霉素、新霉素、甲氨蝶呤或四环素)抗性的蛋白质,或者是补体营养缺陷型的蛋白质,或者在其他替代方案中提供复合培养基中不存在的特定营养物的蛋白质,例如编码杆菌(bacilli)的d
‑
丙氨酸消旋酶的基因。
[0489]
基于抗体的免疫治疗
[0490]
使用肿瘤抗原靶向抗体的基于抗体的免疫疗法的目标是消除癌细胞而不损害正常组织。因此,基于抗体的免疫治疗在肿瘤学中的疗效和安全性在很大程度上取决于预期的作用机制、免疫系统的相关效应子功能和肿瘤相关靶抗原的性质。最佳靶抗原应是可及的并在癌细胞表面均匀、专一地表达。如果预期的作用机制是抗体依赖性细胞介导的细胞毒性 (adcc)或补体介导的细胞毒性(cdc),那么为了使抗体fc区与补体系统组分或免疫效应细胞的相互作用最大化,抗原
‑
mab复合体不应被迅速内化。
[0491]
单克隆抗体的一个关键特征是它们的高特异性,以及它们直接降低靶肿瘤细胞的增殖和/或诱导其凋亡的能力,或标记肿瘤细胞以进行免疫效应子介导的细胞杀伤(补体依赖性细胞毒性(cdc),抗体依赖性细胞的细胞毒性(adcc))的能力(kubota,t.et al.(2009)
cancer sci.100 (9),1566
‑
1572)。与细胞毒性药物缀合可以扩大单克隆抗体的用途,提高其效力和有效性(goldmacher,v.s.et al.(2011)ther.deliv.2(3), 397
‑
416;sievers,e.l.(2013)annu.rev.med.64,15
‑
29)。
[0492]
抗体依赖性细胞介导的细胞毒性(adcc)描述了效应细胞的细胞杀伤能力,这优选需要靶细胞被抗体标记。效应细胞可包括b细胞、t细胞、杀伤细胞、nk细胞、巨噬细胞、单核细胞、嗜酸性粒细胞、中性粒细胞、多形核细胞、粒细胞、肥大细胞和/或嗜碱性粒细胞;更具体地,效应细胞是t细胞或nk细胞。在某些方面,当抗体与肿瘤细胞上的抗原结合,并且抗体fc结构域与免疫效应细胞表面的fc受体(fcr)结合时,就会发生adcc。已鉴定出几个fc受体家族,特定细胞群特征性地表达确定的fc受体。adcc可被视为一种直接诱导可变程度的即时肿瘤破坏(其导致抗原呈递和诱导肿瘤定向t细胞应答)的机制。优选地, adcc的体内诱导将导致肿瘤定向t细胞应答和宿主衍生的抗体应答。
[0493]
更具体地说,在髓系和淋巴系的白细胞上表达六种结构不同的人fcγ受体类型(fcγri或cd64、fcγriia/cd32a、fcγriib/cd32b、 fcγriic/cd32c、fcγriiia/cd16a和fcγriiib/cd16b)。fcγ受体分为两种类型:激活的受体(cd64、cd32a、cd32c、cd16a和cd16b),其通过胞质尾部或共受体分子上基于免疫受体酪氨酸的激活基序 (itam)导致免疫细胞激活;以及抑制性受体(cd32b),其通过基于免疫受体酪氨酸的抑制基序发出信号(itim)。
[0494]
fcgr2a(h13ir)和fcgr3a(v158f)中的单核苷酸多态性(snp) 与改善的结果相关,所述改善的结果归因于对人igg1和igg2治疗性抗体的较高抗体结合亲和力,这导致adcc活性增加(vargas,f.a.et al,cancer cell 33:649
‑
663(2018),musolino,a.et al.,j.clin.oncol.26: 1789
‑
1796(2008),zhang,w.et al,j.clin.oncol.25:3712
‑
3718(2007), nordstrom,j.l.et al,breast cancer res.13:r123(2011))。激活的 cd16a fcγr以两种变体或等位基因的形式存在,对igg1的fc结构域具有高(158v)或低(158f)亲和力。大多数(约85%)人群携带158f 基因型,其为纯合型或与158v形成杂合型。因此,最常与更大有益应答相关的fcgr基因型在少数人群中存在。这为工程化为治疗癌症而开发的治疗性抗体的fc结构域提供了强有力的理论基础,以更好地与激活的 fcγrs的低结合等位基因相互作用而扩展,而不考虑fcγr基因型,目标是开发能够赋予更大百分比的患者益处的治疗。
[0495]
激活细胞毒性细胞的一个关键步骤是mab与免疫效应细胞上的 fcγriiia(cd16a)结合,这种相互作用的强度由抗体同种型、抗体fc 区的糖基化模式和fcγriiia多态性决定。许多出版物已经报道了证明 fcγr介导的效应子功能在源自临床研究的基于抗体的癌症治疗中的作用的发现。研究结果表明临床应答(例如抗体功效)和激活的人fcγrs的特定同种异体(alloform)之间的关联。据报道,携带158f等位基因的患者对某些治疗性抗体的临床反应减弱,这些治疗性抗体包括曲妥珠单抗(trastuzumab)、利妥昔单抗(rituximab)、西妥昔单抗(cetuximab)、英夫利昔单抗(infliximab)和伊匹利单抗(ipilimumab)以及利用adcc 作为主要作用机制的其他治疗性抗体。据报道,经工程化以具有改善的 fcgr结合特征的抗体可产生更好的抗肿瘤应答,并赋予更大的临床益处。
[0496]
激活和抑制fcγr的发现导致了专注于设计治疗性抗体的转化研究努力,所述治疗性抗体基于具有以激活/抑制(a:i)比率为特征的fcγr结合活性而“适合目的”,所述激
活/抑制(a:i)比率被设计为激活免疫效应细胞以执行特定功能。使用单克隆抗体(mab)的癌症免疫疗法通过多种机制促进肿瘤细胞的清除,包括adcc、adcp和/或cdc活性。在实践中,几种经批准的mab的治疗活性取决于fcγ区域与效应细胞上表达的低亲和力fcγ受体的结合。
[0497]
一些出版物报道了成功使用蛋白质工程策略来设计变体人igg1 fc 结构域(ch区),其具有优化的fcgr结合特征和适合于优化细胞介导的效应子功能的激活/抑制(a:i)比率。特别是,努力集中于增加fc结构域对低亲和力受体fcγiiia的亲和力。已鉴定出fc结构域内的许多突变,这些突变直接或间接增强了fc受体的结合,因此显著增强了细胞毒性(lazar,g.a.pnas 103:4005
‑
4010(2006),shields,r.l.et al,j.biol. chem.276:6591
‑
6604(2001)stewart,r.et al.,protein engineeringdesign and selection 24:671
‑
678(2011))。genentech的研究人员鉴定了突变s239d/a330l/i332e,medimmune鉴定了突变f243l(stewart等人),xencor鉴定了g236a(richards,j.o.et al,mol.cancer ther. 7:2517
‑
2575(2008))。
[0498]
包括xencor、applied molecular evolution、medimmune、genentech 和macrogenics在内的几家不同公司已经描述了抗体变体,其包含相对于野生型fc区的至少一个氨基酸修饰,其中与包含野生型fc区的可比分子相比,变体fc区以更高的亲和力结合fcγriiia和/或fcγriia。xencor 开发了xmab平台技术,并公布了包含s239d/i332e点突变和 s239d/a330l/i332e的igg1 fc变体的结果,其作为具有期望a:i比率的优化fc变体。applied molecular evolution已鉴定出包含p247i和a339q 点突变的igg变体。macrogenics描述了变体人igg1 fc区,包含v305i、 f243l、r292p、y300l和p396l(变体18)处的突变(stavenhagen,j.b. et al,cancer res.67:8882
‑
8990(2007))或l235v、f243l、r292p、y300l 和p396l处的突变(nordstrom,j.l.et al,breast cancer res.13:r123 (2011))。
[0499]
nordstrom等人报道,转移性乳腺癌对曲妥珠单抗(herceptin
tm
) 的响应与激活fcγ受体cd16a的高结合变体(158v)的表达相关。使用嵌合抗her2单克隆抗体mgah22(具有与曲妥珠单抗相似的特异性和亲和力),其包含经工程化以增强与人cd16a的两个等位基因的结合的人igg1 fc结构域,nordstrom证明工程化的fc结构域赋予针对所有测试的her2阳性肿瘤细胞(包括对曲妥珠单抗的抗增殖活性有抗性或表达低her2水平的细胞)增强的adcc。从cd16a
‑
158f(低结合等位基因)纯合型或杂合型供体中分离出的效应细胞改善最大。
[0500]
将纳入mgha22的fc变异纳入临床阶段抗体候选产品 margetuximab中,其已被工程化以具有增加的结合激活fc
‑
γ受体 (cd16a)的能力和降低的结合免疫效应细胞上的fc
‑
γ抑制性受体cd32b的能力。macrogenics最近公布了首次随机3期研究的初步数据,该研究旨在检查fc修饰的潜在益处以及fc
‑
γ受体基因型对抗her2抗体功效的作用。sophia研究(nct02492711)是一项随机、开放标签的3期临床试验,评估margetuximab联合化疗与曲妥珠单抗联合化疗相比在her2阳性转移性乳腺癌患者中的疗效。该研究达到了无进展生存期(pfs)的第一个连续主要终点。用margetuximab和化疗治疗的患者的中位pfs为5.8个月,而用曲妥珠单抗和化疗治疗的患者的中位pfs 为4.9个月。进行主要pfs分析时,基于158个事件的总生存期(os) 数据不成熟。与用曲妥珠单抗和化疗治疗的患者相比,用margetuximab 和化疗治疗的患者当时的中位os延长了1.7个月。对于携带cd16a 158f 等
位基因的探索性患者亚群,与曲妥珠单抗组相比,margetuximab组的中位os延长了6.8个月(macrogenics新闻稿)。
[0501]
糖基工程化策略也已被用于开发具有根据癌症治疗进行调整的优化效应子功能的治疗性抗体。众所周知,fcγr与ch2结构域上的碳水化合物相互作用,并且这些聚糖的组成对效应子功能活性有显著影响。fc区第297位高度保守的聚糖表明结合fcγ受体所需的fc区的结构变化。该位点聚糖组成的细微差异会影响fc结构,也可能通过直接接触改变与fcγ r的相互作用。也许最好的实例是非岩藻糖基化抗体,其表现出与cd16a 的结合增加,并且表现出adcc活性显著增强(niwa,r et al,clin. cancer res.10:6248
‑
6255(2004),ferrara,c.et al,j.biol.chem281:5032
‑
5036(2006))。
[0502]
治疗性抗体的功效关键取决于适当的翻译后修饰。特别是,抗体fc 的糖基化对于fc受体介导的活性至关重要。在抗体治疗的效应子功能中, adcc已被临床确定为抗癌抗体的重要作用机制。本领域众所周知, igg
‑
fc核心岩藻糖的缺乏会极大地增加与fcγ riia(cd16a)的结合,并导致更高的adcc效力(例如更低的ec50),这一发现已被成功用于提高治疗性抗体的功效。糖基工程化策略包括在提供低岩藻糖基化或不提供岩藻糖基化的条件下(例如,非岩藻糖基化mab)产生抗体,以通过增加fcgriiia结合来增强adcc。
[0503]
本领域技术人员将认识到,biowa/kyowa hakko kirin和 glycart/roche已各自开发了产生去糖基化抗体的专有细胞系。为实现这一结果,biowa/kyowa kirin hakko建立了α
‑
1,6
‑
岩藻糖基转移酶 (fut8)酶敲除的中国仓鼠卵巢细胞系(技术),而 glycart/roche选择在产生抗体的细胞中过表达异源β
‑
1,4
‑
n
‑
乙酰氨基葡萄糖基转移酶iii(glycomab
tm
技术,美国专利号6,602,684)。
[0504]
具有改善的adcc活性的糖基工程化抗体已获食品药品监督管理局 (fda)批准,目前已在美国上市,包括mogamulizumab (poteligeo
tm
)、obinutuzumab(gazyva
tm
)和benralizumab (fasenra
tm
)。mogamulizumab是一种非岩藻糖基化的抗ccr4抗体,使用biowa开发的potelligent
tm
技术平台,在fut8(a
‑
1,6
‑ꢀ
岩藻糖基转移酶)基因突变的细胞系中产生。在哺乳动物中,n
‑
聚糖上的大多数核心岩藻糖基化是通过α
‑
1,6键形成的。fut8是唯一催化岩藻糖残基从gdp
‑
岩藻糖通过α
‑
1,6键转移至三甘露糖基核心结构的最内层 glcnac的α
‑
1,6岩藻糖基转移酶。benralizumab是一种抗il5受体抗体,其也是使用potelligent
tm
技术平台制造的,据报道能够诱导抗体依赖性细胞介导的adcc扩大>1000倍(pelaia,c et al,biomed researchint.,article id 4839230(2018))。
[0505]
obinutuzumab是一种ii型抗cd20mab,其特征在于由于在生产细胞系中添加了b
‑
1,4
‑
n
‑
乙酰葡糖氨基基转移酶(gniii)基因,岩藻糖含量较低(glycart glycomab
tm technology)。该修饰具有向n
‑
聚糖结构中添加二等分n
‑
乙酰葡糖胺(glcnac)的作用,其存在会干扰岩藻糖基化,从而产生高度富集的二等分非岩藻糖基化糖基化变体。用于制造 obinutuzumab的糖基工程化策略赋予了依赖于增强的adcc和adcp 的独特作用机制,降低了对其他两种抗cd20抗体(利妥昔单抗和奥法木单抗(ofatumumab))所使用的主要作用机制(主要依赖于cdc)的依赖(tobinai,k et al,adv.ther.34(2):324
‑
356(2017))。本领域技术人员还将认识到,通过使用糖基转移酶的诱饵底物(decoy substrate),例如2
‑
脱氧
‑2‑
氟
‑1‑
岩藻糖(2ff),或岩藻糖基转移酶抑制剂,例如2f
‑ꢀ
全乙酰
‑
岩藻糖,来减少在哺乳动物细胞中表达的抗体的聚糖中掺入岩藻糖,可以产生具有低岩藻糖含量的抗体
et al.(eds.),pp.303
‑
16(academic press 1985)和thorpe et al.,“the preparation and cytotoxic properties of antibody
‑
toxinconjugates”,immunol.rev.,62:119
‑
58(1982)。
[0512]
在一些实施方案中,adc被设计为以靶依赖性方式杀伤癌细胞。该过程的第一步是抗体与其抗原的结合。在adc结合时,整个抗原
‑
adc 复合体被内化,细胞毒性有效载荷被释放到肿瘤细胞中,导致细胞死亡。影响adc治疗指数的因素包括靶向抗体的肿瘤特异性、肿瘤靶抗原的表达水平、细胞毒性药物和接头(panowksi,s.et al.(2014)mabs 6(1), 34
‑
45)。如果治疗性抗体的预期作用机制是下调肿瘤相关抗原,或者如果抗体是设计用于将毒素递送至癌细胞的adc,那么内化是用于将毒性有效载荷递送至靶肿瘤细胞的抗体的期望特征。
[0513]
在一些方面,adc包括对癌细胞发挥治疗作用的任何试剂和本文所述的抗cldn18.2抗体或其衍生物。药物的缀合不会改变或显著改变结合特性,特别是抗体的特异性。在某些方面,药物是细胞毒性剂或细胞抑制剂(例如,对癌细胞有害和/或杀伤癌细胞的任何试剂)。此类细胞毒性剂类别的实例包括抗微管蛋白剂、dna小凹槽结合剂(例如烯二炔和lexitropsins)、dna复制抑制剂、烷化剂(例如铂络合物如顺铂、单 (铂)、双(铂)和三核铂络合物和卡铂)、蒽环类药物、抗生素、抗叶酸剂、抗代谢物、化疗增敏剂、倍癌霉素(duocarmycin)、依托泊苷、氟化嘧啶、离子载体、亚硝基脲、铂醇、预形成化合物、嘌呤抗代谢物、嘌呤霉素、辐射敏化剂、类固醇、紫杉烷(例如紫杉醇和多西紫杉醇)、拓扑异构酶抑制剂、长春花生物碱等。美国公开号2018/0117174中描述了此类细胞毒性剂的其他实例。
[0514]
抗体
‑
药物缀合物的产生可以通过本领域技术人员已知的任何技术完成。抗体
‑
药物缀合物可根据常规技术通过将药物与抗体结合来制备。抗体和药物可以通过它们自己的接头基团直接相互结合,或者通过接头或其他物质间接相互结合。美国公开号2018/0117174中描述了可用于形成 adc的接头实例。
[0515]
用于免疫治疗的抗cldn18.2抗体的一个实例是imab362,一种嵌合igg1单克隆抗体,其对cldn18.2的第一胞外结构域中的表位具有特异性。其鼠亲本抗体imab362和其他抗cldn18特异性抗体在属于 wo2007/059997、wo2014/075788和wo2016/166122专利家族的专利和专利申请中公开。
[0516]
在临床前,imab362通过间接(补体依赖性细胞毒性、抗体依赖性细胞的细胞毒性)和直接(抗增殖和促凋亡作用)作用机制显示出抑制肿瘤生长和杀伤癌细胞。astellas pharma已发表的报告表明,包含抗有丝分裂药物单甲基瑞奥西汀e(具有缬氨酸
‑
瓜氨酸接头) (imab
‑
vcmmae)的imab362抗体
‑
药物缀合物(adc)的临床前表征正在进行中(kreuzberg,m et al,annals of oncology 28(5)v122
‑
v141, abstract 377p,wo2016/165762)。
[0517]
iib期fast试验招募了晚期或复发性胃或胃食管连接部腺癌患者 (nct01630083)。入选资格要求患者具有cldn18.2阳性肿瘤(即免疫组织化学显示≥40%的肿瘤细胞中有2
+
/3
+
强度)。该试验评估了imab362联合化疗相对单独化疗在一线设置(first
‑
line setting)中的作用。根据最终结果,化疗(eox、表阿霉素、奥沙利铂和卡培他滨)中加入抗体imab362后,晚期胃、食管或胃食管连接部腺癌患者的中位总生存期增加了5个月(8.4vs 13.2个月,p=.0001)(schuler,m et al.,annalsof oncology,27(6):
release drug delivery systems,j.r.robinson, ed.,marcel dekker,inc.,new york,1978。
[0526]
药物组合物中活性成分的剂量水平可以变化,以获得有效实现特定受试者、组合物和给药方式的所需治疗响应而对受试者无毒性的活性成分的量。所选择的剂量水平将取决于各种药代动力学因素,包括所用本发明特定组合物的活性、给药途径、给药时间、所用特定化合物的排泄速率、治疗持续时间、与所用特定组合物组合使用的其他药物、化合物和/ 或材料、所治疗患者的年龄、性别、体重、病况、一般健康状况和既往病史,以及医学领域熟知的类似因素。
[0527]
本文所述的药物组合物可以有效量给药。“有效量”是指单独或与其他剂量一起实现所需反应或所需效果的量。在治疗特定疾病或特定病况的情况下,所需的反应优选涉及对疾病进程的抑制。这包括减缓疾病的进展,特别是中断或逆转疾病的进展。
[0528]
在一些方面,癌症的治疗代表了一个特别需要联合策略的领域,因为通常两种、三种、四种或甚至更多种癌症药物/治疗的联合作用产生比单一治疗方法的影响强得多的协同作用。本文提供的试剂和组合物(例如药物组合物)可单独使用或与常规治疗方案如手术、辐射、化疗和/或骨髓移植(自体、同系、同种异体或不相关)组合使用。试剂和组合物还可以与细胞因子、趋化因子、共刺激分子或融合蛋白、细菌治疗、激酶抑制剂、toll样受体、血管生成抑制剂、小分子靶向治疗药物、基于病毒的疫苗、多表位策略、过继性t细胞转移和基于肽的靶向疗法中的一种或多种组合使用。参见美国专利号10,093,736。因此,在本发明的另一个实施方案中,癌症治疗可以有效地与各种其他药物组合。
[0529]
在一些方面,将本文所述的试剂和组合物例如在体内给予患者,以治疗或预防多种病症,例如本文所述的那些病症。优选的患者包括具有可通过给予本文所述的试剂和组合物来纠正或改善的病症的人患者。这包括涉及以cldn18.2表达失调为特征的细胞的病症。
[0530]
例如,在一个实施方案中,本文所述的试剂和组合物可用于治疗患有癌症疾病的患者,所述癌症疾病例如本文所述的以表达cldn18.2的癌细胞的存在为特征的癌症疾病。在一些方面,癌症疾病是胃癌、食道癌、胰腺癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌或其转移。
[0531]
在所提供的治疗方法的一个实施方案中,还给予需要治疗的受试者选自以下的治疗剂:抗肿瘤剂、化疗剂、生长抑制剂、细胞毒性剂和免疫检查点抑制剂。
[0532]
在所提供的治疗方法的一个实施方案中,将包含本发明的抗 cldn18.2结合剂的抗体、抗体片段或双特异性抗体与化疗剂共同给药,所述化疗剂可以是细胞毒性剂。例如,可对接受抗claudin 18.2疗法的患者给予表阿霉素、奥沙利铂和/或5
‑
fu。
[0533]
本文所讨论的治疗剂的组合可以作为双特异性或多特异性结合剂或融合蛋白的组分或作为在药学上可接受的载体中的单一组合物同时给药。或者,治疗剂的组合可以作为单独的组合物与在药学上可接受的载体中的每种试剂同时给药。在另一个实施方案中,治疗剂的组合可以顺序给药。
[0534]
在一个实施方案中,本发明的治疗方法还包括给予能够稳定或增加 claudin 18.2在癌细胞的细胞表面的表达的试剂。例如,稳定或增加 claudin 18.2表达的药物可以是奥沙利铂和/或5
‑
fu。
biology,vol.3,john wileyand sons,inc.,ny,n.y.,pp.16.0.5
‑
16.22.17;sigma
‑
aldrich,co.(2001) products for life science research,st.louis,mo.;pp.45
‑
89;amershampharmacia biotech(2001)biodirectory,piscataway,n.j.,pp.384
‑
391。描述了多克隆抗体和单克隆抗体的生产、纯化和片段化。coligan et al.(2001) current protocols in immunology,vol.1,john wiley and sons,inc.,newyork;harlow and lane(1999)using antibodies,cold spring harborlaboratory press,cold spring harbor,n.y.;上述harlow and lane。
[0544]
根据制造商的步骤,通过hitrap蛋白g柱(ge,cat.no.17040401) 纯化杂交瘤上清液。简言之,将杂交瘤上清液用5cv的dpbs(gibco, cat.no.14190
‑
136)平衡,并在环境温度下通过注射器/输液泵(legato200,kds)加载,停留时间3分钟。使用5cv的dpbs洗涤柱,并使用4cv的ph 2.8洗脱缓冲液(fisher scientific,cat.no.pi21004)进行洗脱。分馏洗脱液,用1m tris
‑
hcl,ph 8.5(fisher scientific,cat.no. 50
‑
843
‑
270)中和馏分,并用a280(dropsense96,trinean)分析。合并峰馏分,并缓冲交换至dpbs。离心式过滤器(emd millipore,cat.no. ufc803024)在dpbs中以4,000x g平衡2分钟。加载纯化样本,加入 dpbs,以4,000x g旋转样本5
‑
10分钟,直至总dpbs体积达到≥6dv。通过a280分析最终混合物。
[0545]
描述了分子生物学中的标准方法。maniatis et al.(1982)molecularcloning,a laboratory manual,cold spring harbor laboratory press, cold spring harbor,n.y.;sambrook and russell(2001)molecularcloning,3rd ed.,cold spring harbor laboratory press,cold springharbor,n.y.;wu(1993)recombinant dna,vol.217,academic press, san diego,calif。ausbel et al.(2001)current protocols in molecularbiology,vols.1
‑
4,john wiley and sons,inc.new york,n.y.中也出现了标准方法,其中描述了细菌细胞中的克隆和dna诱变(第1卷)、哺乳动物细胞和酵母中的克隆(第2卷)、糖缀合物和蛋白质表达(第3 卷)和生物信息学(第4卷)。
[0546]
使用基于脂质的转染,使用lipofectamine 3000(invitrogen,cat# l3000015),通过用基于pcdna3.1的质粒转染选定的宿主细胞(即 cho
‑
k1、nih/3t3或hek293细胞,均购自atcc)来产生表达 cldn18.2或cldn18.1的稳定细胞系,所述质粒表达智人claudin 18、转录物变体2(cldn18.2)或智人claudin 18、转录物变体1(cldn18.1)。
[0547]
转染后24小时和48小时使用合适的抗体,使用流式细胞术分析表面表达来确认表达。抗生素选择用于选择整合细胞,遗传霉素选择7
‑
10天后,在96孔板中对存活的细胞进行限制性稀释,同时将转染子保持在选择压力下(遗传霉素)。
[0548]
10
‑
14天后,挑取单个克隆,使用流式细胞术筛选cldn18.2或 cldn18.1特异性抗体(阳性对照抗体的cldn18.2内部版本,使用us2018/0117174中报告的对cldn18.2具有特异性(且对cldn18.1不具有特异性)的单克隆抗体的公开可用序列信息合成)(本文称为“阳性对照”抗体);cldn18.1claudin 18多克隆抗体(invitrogen,cat #38
‑
8000))。选择前3
‑
5个高表达克隆进行进一步开发。传代几代后,通过流式细胞术和图像分析确证表达水平,确保其稳定。pcr也证实了特异性的基因表达。
[0549]
如下所述测定杂交瘤克隆的重链和轻链可变区的序列。使用来自qiagen(germantown,md,usa)的rneasy plus mini试剂盒从1
‑
2x106杂交瘤细胞中提取总rna。通
过使用来自takara(mountainview,ca, usa)的smarter race 5’/3’试剂盒进行5’race反应生成cdna。使用takara universal primer mix结合适当免疫球蛋白的3’小鼠恒定区的基因特异性引物,使用来自neb(ipswitch,ma,usa)的q5高保真 dna聚合酶进行pcr,以扩增重链和轻链的可变区。扩增的重链和轻链可变区在2%琼脂糖凝胶上运行,切除适当条带,然后使用来自qiagen 的mini elute gel extraction试剂盒进行凝胶纯化。使用来自invitrogen (carlsbad,ca,usa)的zero blunt pcr克隆试剂盒克隆纯化的pcr 产物,并将其转化到来自takara的stellar competent大肠杆菌细胞中,并铺板于lb琼脂+50ug/ml卡那霉素平板上。通过genewiz(southplainfield,nj,usa)进行直接克隆sanger测序。使用imgt v
‑
quest 分析得到的核苷酸序列,以鉴定生产性重排并分析翻译的蛋白质序列。 cdr测定基于imgt编号。
[0550]
可获得流式细胞术方法,包括荧光激活细胞分选检测系统参见例如owens et al.(1994)flow cytometry principles for clinicallaboratory practice,john wiley and sons,hoboken,n.j.;givan(2001) flow cytometry,2nd ed.;wiley
‑
liss,hoboken,n.j.;shapiro(2003) practical flow cytometry,john wiley and sons,hoboken,n.j。可获得适用于修饰核酸的荧光试剂,包括核酸引物和探针、多肽和抗体,用作例如诊断试剂。molecular probes(2003)catalogue,molecular probes,inc., eugene,oreg.;sigma
‑
aldrich(2003)catalogue,st.louis,mo。
[0551]
内部阳性对照cldn18.2
‑
特异性抗体唑贝妥昔单抗(zolbetuximab) (以前命名为克劳昔单抗(claudiximab))在本文称为“pc1”,由cro 基于其vh和vl序列(vh序列:us 2018/0117174的seq id no:32; vl序列:us 2018/0117174的seq id no:39)的公开信息制备。pc1 抗体用于确认实施例中使用的转染子和肿瘤细胞系的cldn18.2表达,并建立用于评估和表征本文公开的抗cldn18.2特异性抗体的结合和功能试验。
[0552]
简言之,根据制造商的方案,使用expicho
tm
表达系统(目录号: a29133,thermofisher scientific,usa)转染含有对照和基准抗体序列的质粒。第1天在37℃和8%co2下培养细胞,然后在试剂盒中提供的培养基中在32℃和5%co2下转染后培养细胞。通过以1,000g离心10分钟,然后以5,000g离心30分钟,澄清expicho
tm
培养基来纯化抗体。然后使用0.45μηι过滤器过滤上清液,然后使用0.22μι过滤器。随后,根据制造商的方案,使用蛋白a/g树脂(life technologies,carlsbad,ca;目录 #20424)对上清液进行亲和纯化。elisa纯化前,粗略测定培养基中的抗体效价,以确保加载的培养基量不超过树脂结合能力的80%。孵育后,用pbs洗涤树脂,并用洗脱缓冲液(life technologies,目录#21004)洗脱。通过加入tris缓冲液(ph 8.0),立即将洗脱级分调节至生理ph。随后使用amicon ultra
‑
15离心过滤装置(life technologies,目录# ufc900324)在pbs缓冲液中对纯化的抗体进行缓冲液交换和蛋白浓缩。抗体浓度采用bca蛋白法测定。采用sds
‑
page和考马斯染色检测抗体纯度。将纯化的蛋白等分并储存在
‑
80℃下,以便长期储存,或储存在 4℃下,以便立即使用。
[0553]
通过sds
‑
page验证抗体的完整性,然后在非还原和还原条件下进行考马斯染色;在非还原条件下,一条主带在150kda左右,而在还原条件下,观察到两条带,50kda和25kda。
[0554]
可获得表征配体/受体相互作用的标准技术。参见例如coligan et al. (2001)current protocols in immunology,vol.4,john wiley,inc.,newyork。本领域技术人员
还熟知适于表征具有特定作用机制的抗体的抗体功能表征的标准方法。
[0555]
可获得用于确定例如抗原片段、前导序列、蛋白质折叠、功能结构域、 cdr注释、糖基化位点和序列比对的软件包和数据库。
[0556]
实施例1:产生抗cldn18.2抗体
[0557]
通过用转染了人claudin 18.2基因的hek293细胞免疫balb/c小鼠来产生小鼠抗claudin 18.2抗体。
[0558]
通过用转染了人claudin 18.2基因的hek293细胞免疫人ig转基因小鼠——trianni小鼠株(wo2013/063391)来产生人抗claudin 18.2抗体。
[0559]
通过腹腔内(ip)或皮下(sc)免疫小鼠(balb/c或人ig转基因)。通过眶后出血监测免疫应答。通过facs或成像(如下所述)筛选血浆,并使用具有足够抗claudin 18.2效价的小鼠进行融合。用免疫原经腹腔内或静脉内对小鼠进行增强免疫,然后处死小鼠并切除脾脏和淋巴结。
[0560]
为了选择产生与claudin 18.2结合的抗体的balb/c或人ig转基因小鼠,通过流式细胞术(facs)筛选来自免疫小鼠的血清与表达claudin 18.2 的细胞系(cho、hek293或3t3
‑
claudin 18.2细胞系)的结合,而不与不表达claudin 18.2的对照细胞系的结合。简言之,将claudin 18.2
‑
cho (hek或3t3细胞)与来自免疫小鼠的稀释血清一起孵育。洗涤细胞,用pe标记的抗小鼠igg ab检测特异性抗体结合。在流式细胞仪 (intellicyte,ique plus,sartorius)上进行流式细胞分析。此外,通过成像测试小鼠血清。简言之,将claudin 18.2
‑
cho(hek或3t3细胞)与来自免疫小鼠的稀释血清一起孵育。洗涤细胞,用多聚甲醛固定,洗涤,用alexa488山羊抗小鼠二抗和hoechst(invitrogen,calsbad,ca)检测特定的抗体结合。在成像仪(cytation 5,biotek,winooski,vt)上扫描和分析平板。如上所述,通过facs和成像测试杂交瘤上清液的抗claudin18.2特异性结合。
[0561]
为了产生产生本发明的人和小鼠抗体的杂交瘤,从免疫的小鼠分离脾细胞和淋巴结细胞,并融合到合适的永生化细胞系,如小鼠骨髓瘤细胞系。筛选产生的杂交瘤以产生抗原特异性抗体。例如,将来自免疫小鼠的脾细胞、淋巴结细胞的单细胞悬液通过电融合与等数量的sp2/0非分泌小鼠igg骨髓瘤细胞(atcc,crl 1581)融合。将细胞置于平底96孔组织培养板中,然后在选择培养基(hat培养基)中孵育2周,然后切换至杂交瘤培养基。细胞平板培养约10
‑
14天后,如上所述通过facs 或成像筛选各孔上清液。将分泌抗体的杂交瘤转移至24孔板,再次筛选,如果仍呈抗claudin 18.2阳性,则使用单细胞分选器通过限制性稀释或分选亚克隆阳性杂交瘤。然后在体外培养稳定的亚克隆,以产生少量用于纯化和表征的抗体。
[0562]
实施例2:抗claudin 18.2抗体的特异性
[0563]
使用免疫荧光成像分析评估抗claudin抗体的结合特异性。
[0564]
在cho
‑
cldn18.2(表达重组人cldn18.2的转染cho细胞)和cho
‑
cldn18.1(表达重组人cldn18.1的转染cho细胞)细胞上测试了抗claudin 18.2抗体的特异性细胞结合亲和力。将细胞置于含f12和 10%fbs的完整培养基中,然后在37℃孵育过夜,将抗claudin 18.2抗体连续稀释并加入到试验板中,在4℃孵育2小时,然后固定细胞,并使用alexa488山羊抗人igg(h+l)二抗(invitrogen cat#a
‑
11013) 对细胞进一步染色30分钟,以进行检测。通过使用biotek cytation对细胞成像并定量荧光强度来评估结合。
[0565]
如图3a所示,当在研究中使用10μg/ml抗体时,纯化的鼠抗claudin18.2抗体组与cho
‑
cldn18.2细胞结合,但不与cho
‑
cldn18.1细胞结合,图3b显示ms
‑
1、ms
‑
2和ms
‑
3与cho
‑
cldn18.2细胞的剂量依赖性结合的代表性数据,ec50值分别为1.2nm、2.8nm和1.8nm。对照 ab pc1的ec50值为3.2nm,与文献报告一致。阴性对照抗体不与 cho
‑
cldn18.2细胞结合。
[0566]
还在稳定表达claudin 18.1的cho cldn18.1细胞系中测试了前导组抗体的结合亲和力。在133.4nm的最高测试浓度下,没有抗体显示出活性结合活性。图3c显示了代表性克隆的数据。克隆ms
‑
4和hu
‑
3均表现出与cho
‑
cldn18.2细胞的剂量依赖性结合,ec50值为0.75nm和 1.34nm,但不与cho
‑
cldn18.1细胞结合。
[0567]
表5中汇总了鼠抗claudin 18.2前导组的剂量依赖性结合数据的完整集合。纯化的鼠抗claudin 18.2抗体组与cho
‑
cldn18.2细胞结合,ec50 值范围为0.8
‑
3.3nm。
[0568]
表5鼠抗cldn18.2抗体的特异性
[0569][0570][0571]
类似地,如图4a所示,当在研究中使用10μg/ml的抗体时,代表性的纯化的人抗claudin 18.2抗体与cho
‑
cldn18.2细胞结合,但不与 cho
‑
cldn18.1细胞结合。
[0572]
表6汇总了人抗claudin 18.2前导组的剂量依赖性结合数据的完整集合。17种纯化的claudin 18.2抗体组与cho cldn18.2结合,ec50值范围在0.77nm至19nm之间。代表性克隆数据如图4b所示。克隆hu
‑
2、 hu
‑
9和hu
‑
10的结合ec50分别为1.5、1.1和1.5nm。
[0573]
表6人抗cldn18.2抗体的特异性
[0574][0575]
实施例3:claudin 18.2抗体对表达ciaudin 18.2的肿瘤细胞系的结合亲和力
[0576]
靶蛋白密度和糖基化状态因细胞类型而异。亲和力依赖机制(如adcc和cdc)的结合亲和力和活性受靶密度和糖基化状态的显著影响。使用内源性表达claudin 18.2的细胞系测定的效应与抗claudin 18.2抗体的功效具有更大的翻译相关性。
[0577]
将肿瘤细胞置于含有rpmi1640和+10%fbs的完整培养基中,然后在37℃孵育过夜,将claudin 18.2抗体连续稀释并添加到试验板上,在4℃孵育2小时,然后固定细胞,并使用alexa488山羊抗人igg (h+l)二抗(invitrogen cat#a
‑
11013)对细胞进一步染色30分钟,以进行检测。使用biotek cytation通过对细胞成像并定量荧光强度来评估结合。
[0578]
图5提供了不同类型细胞的相对表达水平。对与胃肿瘤细胞系 nugc
‑
4和胰腺肿瘤细胞系patu8988s并列的经工程化以过表达 claudin 18.2的重组cho
‑
claudin 18.2细胞中claudin 18.2表达水平的评估表明,cho
‑
claudin 18.2表达水平比nugc
‑
4和patu8988s细胞的内源性表达水平高100倍以上。
[0579]
所公开的抗cldn18.2抗体证明与胰腺肿瘤细胞系patu8988s的结合(见上文表5和表6),ec50值范围为小于2nm至约100nm。表5 和表6按四个类别报告了结合强度,ec50值小于2nm的最强结合定义为“++++”,2nm和20nm之间的结合ec50值定义为“+++”,20nm 和100nm之间的结合ec50值标记为“++”,约100nm的弱结合ec50 标示为“+”。
[0580]
如图6a和6b所示,与内部阳性对照pc1相比,抗claudin 18.2抗体组的结合表现出与patu8988s细胞更好的结合亲和力。当使用 20μg/ml抗体对细胞染色时,pc1的结合荧光强度显著低于ms1
‑
10和 hu1
‑
16抗体的荧光强度。
[0581]
类似地,如图7中的代表性数据所示,人抗体组中的抗体hu
‑
2、hu
‑
9 和hu
‑
10的结合亲和力表现出对人胃肿瘤细胞系nugc
‑
4更好的结合亲和力。
[0582]
为了进一步评估抗claudin 18.2ab对肿瘤细胞的结合亲和力,在流式细胞术结合试验中使用了另一种人胃肿瘤细胞系——内源性表达 claudin 18.2的katoiii(图8)。简言之,将katoiii细胞置于含有 rpmi1640和+10%fbs的完整培养基中,连续稀释claudin 18.2抗体并将其添加至试验板,在4℃孵育2小时,然后固定细胞,并使用alexa 488山羊抗人igg(h+l)二抗(invitrogen cat#a
‑
11013)对细胞进一步染色30分钟以进行检测。
[0583]
通过流式细胞仪ique plus(sartorius,germany)评估抗体结合。如图8所示,当使用6.67μg/mi抗体对细胞进行染色时,pci 抗体内部imab362的结合荧光强度显著低于hu
‑
2、hu
‑
9和hu
‑
10抗体的荧光强度。
[0584]
实施例4:抗体依赖性细胞的细胞毒性(adcc)
[0585]
通过生物发光试验测定了与claudin 18.2阳性细胞结合的claudin18.2抗体的抗体依赖性细胞的细胞毒性(adcc),以测定特异性结合并激活小鼠fcγriv的抗体的活性。将稳定表达cldn18.2的细胞,或由转染的cho细胞表达的重组蛋白或表达内源性cldn18.2的人细胞系,或阴性细胞置于含有f12+10%fbs的完全培养基中,将细胞在37℃下孵育过夜。然后连续稀释claudin 18.2抗体,并与效应细胞一起加入。按照制造商的说明,使用promega生物发光试验检测细胞活力(promega, cat#m1201)。
[0586]
如表7所示,代表性人claudin 18.2抗体(其具有人可变区以及小鼠 igg2a fc)诱导了adcc,ec50值在0.77nm至7.09nm范围内。代表性数据如图9所示。抗体hu
‑
2、hu
‑
7和hu
‑
9的adcc ec50分别为3.51、 3.52和1.10nm。一种对cldn18.2无特异性的不相关小鼠igg2a抗体在试验中无活性。在添加人效应细胞的类似试验中,经工程化以包含人igg1 fc的pc1抗体的ec50为0.66nm(数据未显示)。
[0587]
表7抗体依赖性细胞的细胞毒性(adcc)活性
[0588][0589]
[0590]
实施例5:内吞作用筛选
[0591]
通过基于细胞毒性的内吞试验测定了与claudin 18.2阳性细胞结合的所公开的cldn18.2特异性抗体的内吞作用,所述试验使用了靶结合抗体与抗人igg fc
‑
mmaf抗体的共内化。
[0592]
将稳定表达claudin 18.2的细胞或阴性细胞置于含有f12+10%fbs 的完整培养基中,将细胞在37℃孵育过夜。然后连续稀释claudin 18.2 抗体,并与抗人igg fc
‑
mmaf抗体一起添加到试验板上,并在37℃孵育72小时。按照制造商的说明,使用promega细胞效价glo生物发光试验(promega,cat#7570)检测细胞活力。
[0593]
如表8所示,纯化的鼠claudin 18.2抗体的前导组在cho cldn18.2 细胞中诱导了内吞作用衍生的细胞毒性,ec50值在0.71
‑
2.55nm范围内。
[0594]
类似地,如表9所示,纯化的人claudin 18.2抗体的trianni组在 cho cldn18.2中诱导了内吞作用衍生的细胞毒性,ec50值在0.85nm 至13.39nm之间。图10显示了代表性克隆数据。克隆hu
‑
2、hu
‑
7、hu
‑
9 和hu
‑
11表现出的内吞作用衍生的细胞毒性,ec50分别为1.43、1.65、 0.85和1.31nm。
[0595]
在内源性表达claudin 18.2的胰腺肿瘤细胞系patu8988s中,前导组抗体也表现出内吞作用衍生的细胞毒性,但在稳定表达claudin 18.1 的cho cldn18.1细胞系中,未表现出内吞作用衍生的细胞杀伤活性(数据未显示)。
[0596]
表8鼠抗claudin 18.2mab的内吞作用
[0597]
[0598][0599]
表9人抗claudin 18.2mab的内吞作用
[0600][0601]
实施例6:增强的抗体依赖性细胞的细胞毒性(adcc)
[0602]
通过生物发光试验测定了与claudin 18.2阳性细胞结合的claudin18.2抗体的adcc活性,以测定特异性结合并激活人fcγriiia的抗体的活性。将稳定表达cldn18.2的cho细胞或阴性细胞置于含有f12+ 10%fbs的完整培养基中,将细胞在37℃下孵育过夜。然后连续稀释 claudin 18.2抗体,并与效应细胞一起加入。按照制造商的说明,使用promega生物发光试验检测细胞活力(promega,cat#7010)。
[0603]
如图13a所示,未修饰的抗claudin 18.2抗体nbl
‑
014和fc修饰的抗体nbl
‑
014p(包含被引入以增强adcc活性的点突变)和nbl
‑
014g (在选择以表达特征在于低igg核心岩
藻糖或无igg核心岩藻糖(例如非岩藻糖基化的或未岩藻糖基化的)的抗体的条件下在hek细胞中产生的fc修饰的变体)在cho
‑
claudin 18.2细胞和patu8988s细胞中诱导了增强的adcc活性。
[0604]
在高靶密度cho
‑
claudin 18.2细胞中,nbl
‑
014p和nbl
‑
014g的 ec50值为0.06nm至0.02nm,比未修饰亲本nbl
‑
014抗体好10倍和35 倍,所述nbl
‑
014抗体的adcc ec50为0.73nm(图13a)。
[0605]
使用效应细胞系nk92mi
‑
cd16a,通过直接测量靶细胞裂解%,还使用了一种替代的adcc试验来评估抗claudin 18.2抗体的adcc活性。简言之,按照制造商的说明,用cfse对cho
‑
claudin 18.2靶细胞进行染色,然后将细胞以800k/ml接种到u形底部384孔板中,在rpmi培养基(无抗生素)中。向平板中加入系列稀释的ab和同种型对照。收获 nk92mi细胞并计数,稀释至指示浓度320k/ml,然后加入10ul/孔,使 nk92mi与肿瘤细胞的最终比例为1∶5,在37℃、5%co2下孵育4小时,然后在室温下取出10分钟。加入死细胞染料7
‑
aad(1∶100),并在孔中混合,静置10分钟,然后在facs上运行平板,以测定细胞死亡/杀伤能力(cfse阳性门控(gate),以定义死细胞7
‑
aad+)。
[0606]
如图13b所示,在该试验形式中,fc修饰的抗体nbl
‑
014p和 nbl
‑
014g诱导适度增强的adcc活性。
[0607]
实施例7:内源性表达claudin 18.2的肿瘤细胞中增强的adcc活性
[0608]
与过表达claudin 18.2的cho
‑
claudin 18.2细胞相比,人肿瘤细胞系patu8988s和nugc
‑
4内源性表达的claudin 18.2要少得多(图5)。使用人肿瘤细胞系作为靶细胞测试抗claudin 18.2抗体的adcc活性。通过生物发光试验测定claudin 18.2抗体的adcc活性,以测定特异性结合并激活人fcγriiia的抗体的活性。将表达内源性cldn18.2的人细胞系置于含有rpmi1640+10%fbs的完整培养基中,将细胞在37℃孵育过夜。
[0609]
然后连续稀释claudin 18.2抗体,并与效应细胞一起加入。按照制造商的说明,使用promega生物发光试验检测细胞活力(promega, cat#7010)。在patu8988s细胞系adcc试验中,nbl
‑
014p和nbl
‑
014g 分别显示0.06nm和0.04nm的adcc ec50值,这相对于亲本克隆 nbl
‑
014的adcc活性而言有所增强(ec50为0.12nm,见图13a)。此外,在该胰腺细胞模型中,adcc效应的最大值比亲本抗体nbl
‑
014 的最大adcc应答提高了约33倍(图14b)。
[0610]
在nugc
‑
4细胞系中,nbl
‑
014p和nbl
‑
014g分别显示0.04nm和 0.06nm的adcc ec50,也比亲本克隆nbl
‑
014(其adcc ec50为 0.40nm)增强。此外,在该胃细胞试验中,adcc效应的最大值比亲本抗体nbl
‑
014的最大adcc应答提高了约3倍(图14a)。
[0611]
实施例8:抗claudin 18.2抗体的补体依赖性细胞的细胞毒性(cdc)
[0612]
首先使用过表达claudin 18.2的cho细胞系评估抗claudin 18.2抗体诱导cdc活性的能力。这种基于流式细胞仪的cdc试验是使用来自 peprotech(rockyhill,nj)的混合人血清进行的。将cho
‑
claudin 18.2 细胞接种在384孔板中,每孔接种8,000个细胞。加入10ul选定的抗体,以10μg/ml浓度开始连续稀释。将平板置于37℃下孵育15分钟。孵育后,向孔中加入10ul人血清,最终稀释至每体积1/16。然后将平板置于37℃下孵育2.5小时。在ique plus(流式细胞仪)采集前10分钟加入7aad 活力染料。
[0613]
在高靶密度cho
‑
claudin 18.2细胞中,nbl
‑
014p和nbl
‑
014g表现出0.15nm至0.30nm的强效ec50值,与其未经工程化的形式nbl
‑
014 相似,nbl
‑
014的cdc ec50为0.22nm
(图15)。相对于pc1(内部 imab36)的cdc活性(ec50值为1.76),观察到的nbl
‑
014的ec50 活性大约提高了约10倍。
[0614]
在内源性表达claudin 18.2的人肿瘤细胞系patu8988s中进一步评估了抗claudin 18.2抗体的cdc活性。如图16所示,nbl
‑
014、nbl
‑
014p 和nbl
‑
014g均在patu8988s中诱导了强cdc活性,其中nbl
‑
014p 的cdc杀伤率%最高。
[0615]
实施例9:抗claudin 18.2抗体的抗体依赖性细胞吞噬作用(adcp)
[0616]
使用promega生物发光试验评估了抗claudin 18.2抗体诱导adcp 的能力。该试验使用过表达claudin 18.2的cho细胞或nugc细胞作为靶细胞。效应细胞与靶细胞在抗claudin 18.2抗体存在下共培养。抗体与靶细胞上的靶结合,进而激活效应细胞上的fcγriia,产生nfat
‑
re介导的荧光素酶活性,可使用bio
‑
glo荧光素酶试验系统对其进行定量。
[0617]
简言之,将cho
‑
claudin 18.2或nugc
‑
4细胞以12000/20ul/孔 (0.6m/ml)置于白色384孔板的试验缓冲液中。将效应细胞解冻并重新悬浮至1m/ml,向试验板中加入10ul(10000/孔)。在试验缓冲液中稀释抗体,并在靶细胞的顶部加入10μl/孔的抗体。将细胞平板孵育过夜。第二天,按照制造商的说明直接加入20ul的luc底物,将板旋下(spindown)并立即读数。
[0618]
图17a(cho
‑
claudin 18.2细胞)和图17b(nugc
‑
4细胞)显示了抗claudin 18.2抗体nbl
‑
014、nbl
‑
014g和nbl
‑
014p的adcp活性。当使用高密度cldn18.2靶细胞时,fc工程化abs的活性与其亲本抗体的活性相似,而内部pc1抗体(imab362)的adcp活性表现出高应答但效力活性较低。
[0619]
使用人肿瘤细胞系nugc
‑
4(内源性表达cldn18.2)评估adcp 活性得到的数据表明,内部pc1抗体的效力低100倍,但其最大活性高于nbl
‑
014、nbl
‑
014p和nbl
‑
014g。
[0620]
基于这些结果,无论claudin 18.2的表达水平如何,nbl
‑
014的 adcp活性似乎都是有效的,并且任一种fc修饰(蛋白质工程化或糖基工程化)均未改变观察到的活性的效力。nbl
‑
014g和nbl
‑
014p的ec50 值与其亲本克隆nbl
‑
014相似。在所测试的两种细胞系cho
‑
claudin18.2和nugc
‑
4中,nbl
‑
14、nbl
‑
14g和nbl
‑
14p在ec50值方面表现出比pc1更好的adcp活性。然而,在10μg/ml的pc1的高抗体浓度下的adcp效应具有比nbl
‑
014高两倍的应答。
[0621]
实施例10:抗claudin 18.2抗体在patu8988s——过表达claudin 18.2的胰腺癌皮下肿瘤模型中的抗肿瘤功效
[0622]
向6
‑
7周龄雌性balb/c裸鼠的右侧皮下注射于0.1ml pbs中的5x106活patu8988s细胞(过表达claudin 18.2)。3天后,将小鼠随机分组 (n=10),并开始腹膜内注射治疗(第0天)。第1组接受pbs对照;第2组接受200ug同种型抗体对照,第3组接受200ug nbl
‑
014,第4 组接受200ug pc1抗体。给药治疗为每周2次,持续4周。
[0623]
每周测量两次体重。使用公式v=1/2*l x w x w在不同时间点测定肿瘤体积,其中l为异种移植物的长尺寸,w为短尺寸。任何肿瘤超过 2500mm3的小鼠均被处死。
[0624]
如图18a所示,测试抗体nbl
‑
014和pc1抑制肿瘤大小生长。在研究的第34天,处死小鼠,取出肿瘤以测量重量。使用肿瘤重量作为指标, nbl
‑
014和内部pc1抗体(imab362)均显示出强效抗肿瘤功效(图18b)。
[0625]
实施例11:在胃癌的nugc
‑
4皮下模型中抗claudin 18.2抗体的抗肿瘤功效
[0626]
向6
‑
7周龄雌性balb/c裸鼠的右侧皮下注射于0.1ml pbs中的5x106活nugc
‑
4细胞。3天后,将小鼠随机分组(n=10),并开始腹膜内注射治疗(第0天)。第1组接受pbs对照;第2组接受200ug nbl
‑
014,第3组接受200ug pc1抗体。给药治疗每周两次,持续5周。
[0627]
每周测量两次体重。使用公式v=1/2*l x w x w在不同时间点测定肿瘤体积,其中l为异种移植物的长尺寸,w为短尺寸。任何肿瘤超过 2500mm3的小鼠均被处死。
[0628]
如图19所示,测试抗体nbl
‑
014抑制肿瘤生长。在研究的第35天, nbl
‑
014和pc1均显示出显著的抗肿瘤功效。nbl
‑
014表现出比内部 pc1抗体(imab362)更好的抗肿瘤活性。
[0629]
实施例12:fc工程化的抗claudin 18.2抗体在pbmc人源化 nugc
‑
4胃癌皮下模型中的抗肿瘤功效
[0630]
为了研究fc工程化的抗claudin 18.2抗体的治疗潜力,选择使用来自jackson实验室的nog
‑
mhc i/ii
‑
2ko (nod.cg
‑
b2m
em1tac
prkdc
scid h2
‑
ab1
tm1doi il2rg
tm1sug
/jictac)小鼠,因为治疗窗口期延长,而不发生gvhd。
[0631]
简言之,向6
‑
7周龄雌性nog dko小鼠的右侧皮下接种于0.1ml pbs 中的5x106活nugc
‑
4细胞。3天后,解冻外周血单核细胞(pbmc)并计数。将在300ul pbs中稀释的1x10
7 pbmc通过尾静脉移植入每只小鼠。将小鼠随机分组,并开始通过腹膜内注射抗体进行治疗(第0天)。第1 组接受含有pbmc的pbs;第2组接受200ug的nbl
‑
014,其具有工程化的人igg1 fc。
[0632]
给药治疗为每周2次,持续5周。pbmc植入每周重复4次。每周两次测量小鼠的体重。使用公式v=1/2*l xwxw在不同时间点测定肿瘤体积,其中l为异种移植物的长尺寸,w为短尺寸。任何肿瘤超过2500 mm3的小鼠均被处死。
[0633]
如图20a和20b所示,与对照组相比,接受nbl
‑
014的组显示出显著降低的肿瘤体积(图20a)和肿瘤重量(图20b)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1