使用不可交换性脂质探针评估心血管疾病或炎性疾病风险的方法与流程
使用不可交换性脂质探针评估心血管疾病或炎性疾病风险的方法
相关申请的交叉引用
1.本专利申请要求2019年3月8日提交的美国临时专利申请第62/815,604号和2019年5月8日提交的美国临时专利申请第62/844,957号的权益,所述美国临时专利申请中的每一个通过引用以其整体并入本文。关于联邦资助的研究或开发的声明
2.本发明是由国立卫生研究院国家心脏、肺和血液研究所在项目号为hl002058的政府资助下完成的。政府享有本发明的某些权利。发明背景
3.心血管疾病(cvd)是美国大多数种族/民族群体的主要死亡原因。可以通过对患者发生cvd的风险进行早期和可靠的评价来促进cvd的有效治疗和/或预防。因此,需要评估患者中发生cvd风险的改进的方法。发明简述
4.本发明的实施方案提供了评估患者中疾病发生的风险的方法,所述方法包括:(i)将来自所述患者的体液样品与供体颗粒一起孵育,其中在将所述供体颗粒与所述样品一起孵育之前,用脂质和第一量的可检测地标记的不可交换性脂质探针(nelp)包被所述供体颗粒,其中所述可检测地标记的nelp通过hdl流出,其中所述体液包含高密度脂蛋白(hdl)和载脂蛋白a-i(apoa-i),其中所述apoa-i将至少一部分可检测地标记的nelp从所述供体颗粒特异性地转移到所述hdl以产生具有第二量的可检测地标记的nelp的可检测地标记的nelp缔合的hdl;(ii)将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分;(iii)测量所述第一部分中可检测地标记的nelp的第二量;(iv)确定所述患者的可检测地标记的nelp流出值,其中所述患者的可检测地标记的nelp流出值等于所述可检测地标记的nelp的第二量除以所述可检测地标记的nelp的第一量;以及(v)将所述患者的可检测地标记的nelp流出值与参考标准进行比较,其中所述参考标准是通过使用对照人体液样品代替来自所述患者的体液样品进行(i)-(iv)所确定的所述对照人体液样品的可检测地标记的nelp流出值;其中所述患者的可检测地标记的nelp流出值等于或高于所述参考标准指示所述患者中疾病发生的风险较低,其中所述患者的可检测地标记的nelp流出值低于所述参考标准指示所述患者中疾病发生的风险较高,以及其中所述疾病是炎性疾病或cvd。
5.本发明的另一个实施方案提供了测量来自患者的体液样品中功能性hdl的量的方法,所述方法包括:(i)将来自所述患者的体液样品与供体颗粒一起孵育,其中在将所述供体颗粒与所述样品一起孵育之前,用脂质和第一量的可检测地标记的nelp包被所述供体颗粒,其中所述可检测地标记的nelp通过hdl流出,其中所述体液包含hdl和apoa-i,其中所述apoa-i将至少一部分可检测地标记的nelp从所述供体颗粒特异性地转移到所述hdl以产生具有第二量的可检测地标记的nelp的可检测地标记的nelp缔合的hdl;(ii)将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分;(iii)测量
所述第一部分中可检测地标记的nelp的第二量;以及(iv)确定所述患者的可检测地标记的nelp流出值,其中所述患者的可检测地标记的nelp流出值等于所述可检测地标记的nelp的第二量除以所述可检测地标记的nelp的第一量,其中所述可检测地标记的nelp流出值指示来自所述患者的体液样品中的功能性hdl的量,其中所述方法不包括将hdl与ldl或vldl分离。
6.本发明的另一个实施方案提供了降低患者中疾病发生风险的方法,所述方法包括:接收将所述患者鉴定为具有较高的发生所述疾病的风险的鉴定,其中发生所述疾病的风险已经通过本文所述的本发明方法中的任一种评估;以及(i)将脂蛋白修饰药物和抗炎药物中的一种或两种施用至被鉴定为具有较高的发生所述疾病的风险的所述患者和/或(ii)向被鉴定为具有较高的发生所述疾病的风险的所述患者推荐生活方式改变,其中所述疾病是cvd或炎性疾病。附图的若干视图的简要说明
7.图1a是显示将荧光pe和胆固醇掺入人血浆脂蛋白vldl的图。进行荧光pe和胆固醇双标记的分离的人脂蛋白vldl的fplc分析。黑色正方形:pe荧光;灰色圆圈:胆固醇(chol)荧光。
8.图1b是显示将荧光pe和胆固醇掺入人血浆脂蛋白ldl的图。进行荧光pe和胆固醇双标记的分离的人脂蛋白ldl的fplc分析。黑色正方形:pe荧光;灰色圆圈:胆固醇荧光。
9.图1c是显示将荧光pe和胆固醇掺入人血浆脂蛋白hdl的图。进行荧光pe和胆固醇双标记的分离的人脂蛋白hdl的fplc分析。黑色正方形:pe荧光;灰色圆圈:胆固醇荧光。
10.图1d是显示荧光pe和胆固醇在通过fplc分离的合并的人血清脂蛋白中的分布的图。黑线:pe荧光;灰线:胆固醇荧光。
11.图1e是显示pe荧光(黑线;%的总pe荧光)与磷脂质量(灰线;%的总磷脂质量)的比较的图。
12.图1f是显示胆固醇荧光(黑线;%的总胆固醇荧光)与胆固醇质量(灰线;%的总胆固醇质量)的比较的图。
13.图2a是显示合成的荧光pe-标记的lpx在与合并的人血浆孵育之前和之后的fplc分析的结果的图。
14.图2b是显示合成的荧光pe-标记的lpx在与合并的人血浆孵育之前和之后的fplc分析的结果的图。
15.图2c是显示合成的荧光胆固醇-标记的lpx在与合并的人血浆孵育之前和之后的fplc分析的结果的图。
16.图3是显示lra脂质颗粒pe和胆固醇荧光的校准的图。用tx-100去污剂提取对应于所示脂质质量的荧光脂质标记的lra脂质颗粒的体积,并测量pe和胆固醇荧光。
17.图4a是显示lpx lra衍生的荧光pe在合并的人血浆样品的fplc级分中的分布的图。ltg:低tg;htg:高tg;ll:低ldl;hh;高hdl。
18.图4b是显示lpx lra衍生的荧光胆固醇在合并的人血浆样品的fplc级分中的分布的图。ltg:低tg;htg:高tg;ll:低ldl;hh;高hdl。
19.图5是显示针对所有五十个样品定量的并相对于凝胶上的参考标准标准化的hdl pe和胆固醇条带的总像素强度的图(未知的hdl*pe/标准hdl*pe;未知的hdl*chol/标准
hdl*chol)。注意hdl*pe和*fc荧光是高度相关的。
20.图6是说明含有荧光胆固醇和pe的脂质包被的lra颗粒可用于监测荧光不可交换性pe的主动去除(hdl-apoa-i-介导的溶解)和荧光胆固醇至血浆脂蛋白以及在血浆脂蛋白之间的被动交换的示意图。
21.图7是显示通过实施例5的测定针对所示的合并的人血浆的样品体积测量的*pe流出率(%)、*chol流出率(%)的图。
22.图8是显示通过荧光测定法测量的标准化的*pe流出与通过电泳测量的标准化的*pe hdl像素强度的相关性的图。
23.图9是显示标准化的*pe hdl像素强度与标准化的*chol hdl像素强度的相关性的图。
24.图10是根据本发明实施方案的实施例5的*pe流出测定的示意图。
25.图11a是显示使用540nm/600nm(ex/em)的荧光测定法的图。flu=任意荧光单位。
26.图11b是显示使用485nm/520nm(ex/em)的荧光测定法的图。flu=任意荧光单位。
27.图11c是显示当监测*pe荧光时,在与*pe标记的或双*pe/*chol标记的lc-csh孵育的血浆(p)的上清液中仅检测到*pe荧光的图。
28.图11d是显示当监测*chol荧光时,在与*chol标记的或双*pe/*chol标记的lc-csh孵育的血浆的上清液中仅检测到*chol荧光的图。
29.图12a是显示合并的正常人血浆(hp)体积对荧光脂质流出的影响的图。所有数据均为一式三份测定中的平均值
±
sd。
30.图12b是显示hdl-spe的荧光和电泳凝胶分析高度相关的图。所有数据均为一式三份测定中的平均值
±
sd。
31.图12c呈现了在hp中,大量的*pe从供体颗粒转移到hdl,但在fld血浆中未发生大量的*pe从供体颗粒转移到hdl的图。
32.图12d是显示lc-csh*pe流出至分离的hdl但不流出至ldl或vldl的图。将各种量的hdl、ldl或vldl与盐水中的lc-csh一起孵育。
33.图13是显示hdl-spe是温度依赖性的图。使用标准hdl-spe测定条件将合并的人血浆或盐水与荧光脂质标记的lc-csh一起孵育。flu=荧光单位。注意,*pe流出至血浆在4℃至37℃是线性的。所有数据均为一式三份测定中的平均值
±
sd。
34.图14a是显示在37℃下孵育指定时间之后lc-csh*pe流出至hp对比流出至盐水的时间进程的图。
35.图14b是显示在洗涤和随后在37℃下与盐水孵育1小时之后,*pe从图18a中的lc-csh释放的图。
36.图14c-14e是显示基于强度的绝对定量(ibaq)分析揭示所鉴定的血浆蛋白的相对分布的图。hp蛋白(14c)、lc-csh结合蛋白(14d)和lc-csh释放蛋白(14e)。中间插图包括血浆和ls-csh结合蛋白中载脂蛋白的ibaq排名。hp或ls-csh结合级分中的载脂蛋白的%显示在括号中(14d插图)。14e插图包括在lc-csh结合的蛋白和lc-csh释放的蛋白中的载脂蛋白的ibaq排名。lccsh结合的蛋白和lc-csh释放的蛋白中的载脂蛋白的百分比显示在括号中。
37.图15a呈现了用于标准化凝胶之间的hdl像素强度的分离的*pe-标记的hdl标准曲线的图。
38.图15b是显示标准化的hdl-spe和标准化的*pe hdl像素强度高度地且显著地相关的图。上清液*pe代表*pe hdl。
39.图16a是显示84例cvd对象的群组中hdl-spe与c-cec测定之间的相关性的图。
40.图16b-16d呈现了显示hdl-c(16b)、hdl颗粒数目(hdl-p)(16c)和apoa-i(16d)与hdl-spe和c-cec的双变量相关性的图。hdl-spe和c-cec均与血浆hdl-c、hdl-p和apoa-i相关。
41.图16e呈现了显示在临床研究i中的84例对象中与hdl-spe和c-cec相关的hdl蛋白的蛋白质组评估的图。星号表示hdl-spe和c-cec中的相同蛋白。
42.图16f-16h呈现了显示hdl-spe和c-cec与(16f)tb、(16g)ncb和(16h)dcb的关联的图。hdl-spe和c-cec均与tcb和ncb呈负相关,但不与dcb呈负相关。
43.图16i是显示hdl-spe和c-cec与tb、ncb和dcb的关联的双变量和多变量回归分析的图。只有hdl-spe在变量调整之后与tb和ncb保持显著负相关。
44.图17a是显示hdl-spe和c-cec的接收器操作特性(roc)曲线的图。针对hdl-spe构建的接收器操作特性(roc)曲线的曲线下面积(auc)为0.67(p=0.007),c-cec为0.53(p=0.67)。
45.图17b是显示基于单变量(未调整的)回归分析以及针对如所示的风险因素和生物标志物调整的条件逻辑多变量回归分析针对hdl-spe和c-cec的每sd增量报告的优势比的图。
46.图18a是显示cad和无cad对象中hdl-spe值的等级和频率分布(插图)的图。
47.图18b呈现了显示hdl-c与hdl-spe显著相关的图。
48.图18c是显示hdl-spe和hdl-c的接收器操作特性(roc)曲线的图。
49.图18d是显示基于单变量(未调整的)回归分析以及针对如所示的风险因素和生物标志物调整的条件逻辑多变量回归分析针对hdl-spe和hdl-c的每sd增量报告的优势比的图。
50.图18e呈现了显示cad和无cad中hdl-c《60mg/dl与hdl-spe显著相关的图。
51.图18f是显示基于单变量(未调整的)回归分析以及针对如所示的风险因素和生物标志物调整的条件逻辑多变量回归分析针对hdl-spe和hdl-c《60mg/dl的每sd增量报告的优势比的图。
52.图18g呈现了显示在无cad中而不是cad中hdl-c》60mg/dl与hdl-spe显著相关的图。
53.图18h是显示基于双变量(未调整的)逻辑回归分析以及针对如所示的风险因素和生物标志物调整的多变量逻辑回归分析针对hdl-spe和hdl-c《60mg/dl的每sd增量报告的优势比的图。发明详述
54.本发明的实施方案提供了评估患者中发生疾病的风险的方法。本发明的方法可以提供多种优点中的任何一种或多种。例如,本发明的方法可以有利地通过评估apoa-i和其它hdl相关脂质从脂肪动脉病变中去除磷脂的能力来评估疾病风险。因此,本发明的方法基于人的全血浆中的hdl功能有利地评估疾病风险。不受特定理论或机制的束缚,认为通过功能性apoa-i(存在于hdl上的可转移蛋白)从心血管动脉粥样硬化病变中的膜结构中主动去
除不可交换性脂质(例如磷脂)在cvd的预防和消退中起作用。
55.hdl具有两个基本结构:前β盘状hdl和α球形hdl。前β盘状hdl含有两个apoa-i分子、磷脂和胆固醇。前β盘状hdl是当apoa-i溶解来自细胞膜的磷脂和胆固醇时形成的初生颗粒。前β盘状hdl从存在于动脉壁中的脂肪斑块中的载有脂质的巨噬细胞(lipid-laden macrophages)中去除胆固醇,这是逆向胆固醇转运途径中的初始步骤。
56.α球形hdl具有磷脂、胆固醇和其它脂质以及超过80种不同蛋白质的表面单层。每个单独的α球形hdl颗粒仅含有一些蛋白质的子集。α球形hdl颗粒在其核心中含有酯化的胆固醇和一些甘油三酯。这些α球形hdl颗粒将胆固醇酯和甘油三酯递送到肝脏以通过逆向胆固醇途径从体内消除。因为apoa-i是可交换蛋白,它可以从α球形hdl颗粒解离,然后与细胞膜结合以溶解脂质,形成新的前β盘状hdl颗粒。
57.逆向胆固醇转运途径是指从动脉壁中的脂肪病变中去除胆固醇并将该胆固醇递送至肝脏。酶lcat扩大最初在病变中形成的hdl颗粒,然后这些大的hdl颗粒将胆固醇酯和甘油三酯(hdl核心脂质)递送至肝脏,用于从体内去除递送至肠道的胆汁。apoa-i在肝脏中合成并快速转化为前β盘状hdl和小α4hdl。逆向胆固醇转运的第一步是通过前β盘状hdl和小α4hdl从动脉壁的脂肪病变中的巨噬细胞中去除胆固醇和磷脂。这是本发明方法有利地评估apoa-i和其它hdl相关脂质从脂肪动脉病变中去除磷脂的能力的步骤。
58.本发明的实施方案提供了评估患者中发生疾病的风险的方法。所述方法可以包括将来自患者的体液样品与供体颗粒一起孵育。体液可以是可以包含hdl的任何体液。体液的实例包括但不限于全血浆、血清、尿液和唾液。尿液和唾液是血浆的滤液,并且可以是更方便地从患者获得的hdl的可能来源。
59.全血浆是去除血小板和血细胞之后保留的全血的清澈的、淡黄色的液体部分。全血浆包括hdl和apoa-i(例如,功能性hdl和功能性apoa-i)等。全血浆还含有水,酶,抗体,葡萄糖,凝血因子,电解质(na
+
、ca
2+
、mg
2+
、hco
3-、cl-等),激素,二氧化碳和氧。全血浆包括其它脂蛋白(包括低密度脂蛋白(ldl)和极低密度脂蛋白(vldl))和其它载脂蛋白。全血浆是指未经处理以去除hdl、ldl或vldl的血浆。
60.在本发明的实施方案中,所述方法不包括将hdl与ldl或vldl分离。在这方面,所述方法不包括预处理体液以将hdl与ldl或vldl分离或者通过例如电泳或者通过聚乙二醇(peg)沉淀非hdl脂蛋白或任何其它处理将hdl与ldl或vldl分离。
61.供体颗粒可以包括由多种不同材料中的任一种组成的基材。在本发明的实施方案中,供体颗粒基材包括脂质结合微粒材料。合适的供体颗粒基材的实例包括但不限于水化硅酸钙、玻璃、塑料、乳胶和磁性材料。例如,供体颗粒可以包括水化硅酸钙晶体、玻璃珠、塑料珠、乳胶珠或磁珠。在本发明的实施方案中,供体颗粒是脂质去除剂(lra),它是由水化硅酸钙晶体的基质组成的可商购获得的试剂。如本文所述包被的lra颗粒可以有利地通过离心容易地与hdl分离。供体颗粒的尺寸(例如直径)不受限制,并且可以是例如小于约1微米、为约1微米、约10微米、约20微米、约40微米、约60微米、约80微米、约100微米或由前述值中的任两个限定的范围。
62.供体颗粒用脂质和可检测地标记的不可交换性脂质探针(nelp)包被。脂质可以是多种脂质中的任一种。在本发明的实施方案中,脂质是磷脂。磷脂可以是多种磷脂中的任一种。在本发明的实施方案中,磷脂是磷脂酰胆碱。磷脂酰胆碱包括多种化合物中的任一种,
包括与磷酸的胆碱酯连接的硬脂酸、棕榈酸和油酸甘油二酯的混合物。合适的磷脂的实例可以包括但不限于1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)或卵磷脂(例如蛋卵磷脂或大豆卵磷脂)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰乙醇胺(dppe)、二硬脂酰磷脂酰胆碱(dspc)、二棕榈酰磷脂酰甘油(dppg)或其任何组合。在优选的实施方案中,磷脂是dmpc。
63.在本发明的实施方案中,所述方法还包括在将供体颗粒与样品一起孵育之前将甾醇施加到供体颗粒上。尽管具有单独磷脂的供体颗粒使荧光pe流出到血浆hdl中,但添加甾醇可以增强流出。供体颗粒上包被的脂质与甾醇的摩尔比可以是约4:1至约2:1。例如,供体颗粒上包被的脂质与甾醇的摩尔比可以是约4:1、约3:1、约2:1或由前述值中的任两个限定的范围。
64.甾醇可以是多种甾醇中的任一种。合适的甾醇的实例包括但不限于胆固醇、lathosterol、羊毛脂甾醇、7-脱氢胆固醇、胆钙化醇、链甾醇(desmosterol)、lathosterol、胆甾烷醇、coprastanol、菜油甾醇、豆甾醇、谷甾醇(例如,β-谷甾醇)、燕麦甾醇、豆甾烯醇、菜子甾醇,4-去甲基甾醇(即在碳-4上没有取代基)、4α-单甲基甾醇和4,4-二甲基甾醇、植物甾烷醇(phytostanol)(完全饱和的)、麦角甾醇、香树脂醇、环阿屯醇(cylcoartenol)或其任何组合。在优选的实施方案中,甾醇是胆固醇。
65.可检测地标记的nelp可以是通过hdl流出的任何脂质。可检测地标记的nelp可以是将分配到脂质膜或表面中的脂质。在本发明的实施方案中,nelp可以是磷脂,例如本文关于本发明的其它方面描述的任何磷脂。合适的nelp的实例包括但不限于磷脂酰乙醇胺(pe)、磷脂酰胆碱、磷脂酰丝氨酸、鞘磷脂、糖脂或其任何组合。在优选的实施方案中,nelp是pe。
66.可以用任何可检测的标记来标记nelp。在本发明的实施方案中,nelp包含放射性标记、化学发光标记或荧光标记。可检测地标记可以置于nelp上的任何位置,前提是可检测地标记的位置不干扰nelp从供体颗粒到hdl的特异性转移。在本发明的实施方案中,nelp包含亲水部分、疏水部分和定位在亲水部分上的可检测地标记。
67.可以用第一量的可检测地标记的nelp包被供体颗粒。在供体颗粒与体液样品孵育期间和/或之后,一些或全部可检测地标记的nelp将从供体颗粒特异性地转移到hdl,如下面更详细解释的。供体颗粒上可检测地标记的nelp的第一量是指在供体颗粒与体液样品一起孵育之前供体颗粒上可检测地标记的nelp的量。
68.所述方法可以包括将体液与供体颗粒混合。在这方面,可以将体液置于与供体颗粒物理接触,使得可检测地标记的nelp可以从供体颗粒特异性地转移到来自体液中的hdl中。供体颗粒和体液可以在任何合适的容器,例如多孔板(例如96孔板)中混合。
69.所述方法可以包括将来自患者的体液样品与供体颗粒一起孵育。孵育可以在不破坏hdl或apoa-i的结构并且适于促进可检测地标记的nelp从供体颗粒到hdl的特异性转移的温度下进行。孵育可以在约10℃至约90℃、约20℃至约80℃、约30℃至约70℃或约35℃至约40℃的温度下进行。例如,孵育可以在约35℃、约36℃、约37℃、约38℃、约39℃、约40℃或由前述值中的任两个限定的范围的温度下进行。
70.可以在适于促进可检测地标记的nelp从供体颗粒特异性转移至受体脂蛋白,即hdl的时间段进行孵育。孵育可以进行约1分钟至约24小时、约20分钟至约18小时、约30分钟
至约10小时、约40分钟至约8小时、或约50分钟至约6小时的持续时间。例如,孵育可以进行约30分钟、1小时、2小时、3小时、4小时、6小时或由前述值中的任两个限定的范围的持续时间。
71.在孵育期间和/或之后,来自体液的apoa-i将至少一部分可检测地标记的nelp从供体颗粒特异性地转移到hdl,以产生具有第二量的可检测地标记的nelp的可检测地标记的nelp缔合的hdl。可检测地标记的nelp的第二量是在将体液与供体颗粒孵育之后与hdl缔合的可检测地标记的nelp的量,其已经通过apoa-i从供体颗粒特异性转移到hdl。可检测地标记的nelp仅以apoa-i依赖性方式转移到hdl。与可检测地标记的nelp相比,胆固醇转移到所有的hdl、ldl和vldl,如实施例所示。
72.所述方法还可以包括将可检测地标记的nelp缔合的hdl分离成第一部分以及将供体颗粒分离成第二部分。分离可以多种不同方式中的任一种进行。在本发明的实施方案中,分离包括对可检测地标记的nelp缔合的hdl和供体颗粒进行离心。当通过离心进行分离时,第一部分是上清液,并且第二部分是沉淀。上清液含有可检测地标记的nelp缔合的hdl,并且沉淀含有供体颗粒。离心可以以任何速度和任何不破坏nelp缔合的hdl结构的持续时间进行。在本发明的实施方案中,所述方法包括以约100至约15,000转/分钟(rpm)、约500至约1600rpm、或约1,000至约1,200rpm的速度对可检测地标记的nelp缔合的hdl和供体颗粒进行离心。例如,离心可以在约100;约500;约1,000;约1,500;约2,000;约3,000;约4,000;约5,000;约6,000;约7,000;约8,000;约9,000;约10,000;约11,000;约12,000;约13,000;约14,000;约15,000rpm或由前述值中的任两个限定的范围的速度下进行。在本发明的实施方案中,所述方法包括将可检测地标记的nelp缔合的hdl和供体颗粒离心约1分钟至约60分钟、约2分钟至约45分钟、约3分钟至约30分钟的持续时间。例如,离心可以进行约1分钟、约2分钟、约5分钟、约10分钟、约15分钟、约20分钟、约25分钟、约50分钟或约60分钟或由前述值中的任两个限定的范围。
73.在本发明的实施方案中,通过过滤进行可检测地标记的nelp缔合的hdl与供体颗粒的分离。在这方面,将可检测地标记的nelp缔合的hdl分离成第一部分以及将供体颗粒分离成第二部分包括从供体颗粒中过滤可检测地标记的nelp缔合的hdl。
74.在其中供体颗粒包含磁性材料的实施方案中,可以使用磁体进行可检测地标记的nelp缔合的hdl与供体颗粒的分离。磁体将供体颗粒吸引到第二部分中,将可检测地标记的nelp缔合的hdl留在第一部分中。
75.所述方法还可以包括测量第一部分中可检测地标记的nelp的第二量。可检测地标记的nelp的第二量是在体液与供体颗粒一起孵育之后与hdl缔合的可检测地标记的nelp的量,并且可检测地标记的nelp已经通过apoa-i从供体颗粒特异性地转移到hdl。第一部分中可检测地标记的nelp的量的测量值代表第一部分中可检测地标记的nelp缔合的hdl的量。
76.可检测地标记的nelp的第二量的测量可以以多种不同方式中的任一种来进行,并且可以由本领域技术人员基于针对nelp选择的可检测地标记的类型来选择。在本发明的实施方案中,当可检测地标记的pe是荧光标记的pe时,通过荧光测量进行第一部分中荧光标记的pe的量的测量。
77.所述方法还可以包括确定患者的可检测地标记的nelp流出值。患者的可检测地标记的nelp流出值等于可检测地标记的nelp的第二量除以可检测地标记的nelp的第一量。
78.所述方法还可以包括将患者的可检测地标记的nelp流出值与参考标准进行比较。参考标准可以是对照人体液样品的可检测地标记的nelp流出值,其通过进行与确定患者的可检测地标记的nelp流出值相同的方法来确定,但使用对照人体液样品代替来自患者的体液样品。对照人体体液样品可以是与患者相同类型的体液。用于参考标准的对照人体液样品可以获自单个健康供体或多个健康供体,其中健康供体被确定为处于发生cvd的低风险或平均风险,如通过例如用于基于包括测量总胆固醇、甘油三酯、hdl-c和ldl-c中的一种或多种的水平的脂质组评估cvd风险的2018美国心脏病学会/美国心脏协会(aha/acc)指南所确定的。来自单一健康供体的人体液的单一样品可以用作参考标准。用于参考标准的人体体液样品的汇集物可以获自单个健康供体或任何数目的不同健康供体,例如约10至约1,000个健康供体。
79.患者的可检测地标记的nelp流出值(相对于对照人体液样品的可检测地标记的nelp流出值)与患者发生疾病的风险呈负相关。患者中可检测地标记的nelp流出值等于或高于参考标准指示患者发生疾病的风险较低。患者中可检测地标记的nelp流出值低于参考标准指示患者发生疾病的风险较高。所述疾病可以是cvd或炎性疾病。cvd可以是影响心血管系统的多种病况中的任一种,包括但不限于中风、心肌梗塞、冠状动脉疾病(cad)、心脏病发作、心律失常、心力衰竭、先天性心脏缺陷、心肌病、外周动脉疾病、心绞痛、瓣膜疾病、高血压和遗传性心脏病况。
80.炎性疾病可以是任何炎性疾病,包括但不限于哮喘;肺纤维化;支气管炎;呼吸道感染;呼吸窘迫综合征;阻塞性肺病;变应性疾病;多发性硬化;脑或神经系统的感染;皮炎;银屑病;烧伤;皮肤感染;肠胃炎;结肠炎;克罗恩病;囊性纤维化;乳糜泻;炎性肠病;肠道感染;结膜炎;葡萄膜炎;眼睛感染;肾脏感染;自身免疫性肾病;糖尿病肾病;恶病质;冠状动脉再狭窄;鼻窦炎;膀胱炎;尿道炎;浆膜炎;尿毒症性心包炎;胆囊炎;阴道炎;药物反应;肝炎;骨盆炎性疾病;淋巴瘤;多发性骨髓瘤;白癜风;脱发;阿狄森氏病;桥本氏病;格雷夫斯病;萎缩性胃炎/恶性贫血;获得性性腺机能减退/不育症;甲状旁腺机能减退;多发性硬化;重症肌无力;coombs阳性溶血性贫血;系统性红斑狼疮;干燥综合征和免疫介导的(1型)糖尿病。
81.本发明的方法也可有利地指示cvd的其它临床生物标志物的相对水平。例如,患者的可检测地标记的nelp流出值(相对于对照人体液样品的可检测地标记的nelp流出值)可以与cvd的临床生物标志物显著负相关(p《0.0001)。这些生物标志物可以包括但不限于非钙化斑块负荷、总斑块负荷和纤维性脂肪负荷。
82.在本发明的实施方案中,患者的可检测地标记的nelp流出值等于或高于参考标准指示患者中较低的非钙化斑块负荷。患者的可检测地标记的nelp流出值低于参考标准指示患者中较高的非钙化斑块负荷。
83.在本发明的另一个实施方案中,患者的可检测地标记的nelp流出值等于或高于参考标准指示患者中较低的总斑块负荷。患者的可检测地标记的nelp流出值低于参考标准指示患者中较高的总斑块负荷。
84.在本发明的实施方案中,患者的可检测地标记的nelp流出值等于或高于参考标准指示患者中较低的纤维性脂肪负荷。患者的可检测地标记的nelp流出值低于参考标准指示患者中较高的纤维性脂肪负荷。
85.本发明的另一个实施方案提供了降低患者中发生疾病的风险的方法。所述方法可以包括接收所述患者被鉴定为具有较高的发生疾病的风险,其中所述发生疾病的风险已经通过本文关于本发明的其它方面所述的方法评估。所述方法还可以包括向被鉴定为具有较高的发生疾病风险的患者施用治疗,其中该治疗降低了患者发生疾病的风险。治疗可以包括但不限于施用脂蛋白修饰药物和抗炎药物中的一种或两种。在本发明的实施方案中,药物是他汀类。可选地或另外地,所述方法包括向被鉴定为具有较高的发生疾病的风险的患者推荐生活方式改变。这些生活方式改变可以包括但不限于增加运动、减少饱和脂肪的饮食摄入、减少反式脂肪的饮食摄入、增加ω-3脂肪酸的饮食摄入、增加可溶性纤维的饮食摄入和增加乳清蛋白的饮食摄入。
86.本发明的另一个实施方案提供了测量来自患者的体液样品中功能性hdl的量的方法。所述方法可以包括将来自患者的体液样品与供体颗粒一起孵育。体液、供体颗粒和孵育如本文关于本发明的其它方面所述。所述方法还可以包括将可检测地标记的nelp缔合的hdl分离成第一部分以及将供体颗粒分离成第二部分,并测量第一部分中可检测地标记的nelp的第二量,如本文关于本发明的其它方面所述的。
87.所述方法还可以包括确定患者的可检测地标记的nelp流出值,如本文关于本发明的其它方面所述的。患者的可检测地标记的nelp流出值等于可检测地标记的nelp的第二量除以可检测地标记的nelp的第一量。可检测地标记的nelp流出值指示来自患者的体液样品中的功能性hdl的量。
88.在本发明的实施方案中,所述方法不包括将hdl与ldl或vldl分离。在这方面,所述方法不包括预处理体液以将hdl与ldl或vldl分离或者通过例如电泳或者通过peg沉淀非hdl脂蛋白或任何其它处理将hdl与ldl或vldl分离。
89.本发明的方法可以提供优于常规的基于细胞的测定的多种优点中的任何一种或多种,所述常规的基于细胞的测定在cvd中评价hdl功能。这些常规的基于细胞的测定测量通过hdl从标记的细胞获得放射性标记的或荧光标记的胆固醇(“胆固醇流出能力测定”或“细胞cec测定”,例如,如khera等人,nejm,364:127-35(2011)中所述)。在细胞cec测定中,通过hdl获得细胞胆固醇主要通过被动交换发生,并反映hdl上的表面脂质单层保留胆固醇的能力。通过沉淀然后从体液中去除非hdl脂蛋白,从体液中分离用于细胞cec测定的hdl。细胞cec测定需要数天的准备和评估才能完成,并且读出中的变异系数(cv)相对较高(》10%)。
90.与细胞cec测定和其它常规测定相比,所述方法是无细胞的,快速的,并且需要最少的设备、试剂和劳动来进行。在本发明的实施方案中,所述方法在小于约2小时、小于约1小时、小于约半小时或由前述值中的任两个限定的范围内进行。此外,本发明的方法具有小于约3%的变异系数(cv)。本发明的方法也是可自动化的。
100.以下包括本发明的某些方面。
101.1.评估患者发生疾病的风险的方法,所述方法包括:(i)将来自所述患者的体液样品与供体颗粒一起孵育,其中在将所述供体颗粒与所述样品一起孵育之前,用脂质和第一量的可检测地标记的不可交换性脂质探针(nelp)包被所述供体颗粒,其中所述可检测地标记的nelp通过hdl流出,
其中所述体液包含高密度脂蛋白(hdl)和含有载脂蛋白a-i(apoa-i)的一种或多种hdl相关蛋白,其中所述apoa-i将至少一部分可检测地标记的nelp从所述供体颗粒特异性地转移到所述hdl以产生具有第二量的可检测地标记的nelp的可检测地标记的nelp缔合的hdl;(ii)将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分;(iii)测量所述第一部分中可检测地标记的nelp的第二量;(iv)确定所述患者的可检测地标记的nelp流出值,其中所述患者的可检测地标记的nelp流出值等于所述可检测地标记的nelp的第二量除以所述可检测地标记的nelp的第一量;以及(v)将所述患者的可检测地标记的nelp流出值与参考标准进行比较,其中所述参考标准是通过使用对照人体液样品代替来自所述患者的体液样品进行(i)-(iv)所确定的所述对照人体液样品的可检测地标记的nelp流出值;其中所述患者的可检测地标记的nelp流出值等于或高于所述参考标准指示所述患者发生疾病的风险较低,其中所述患者的可检测地标记的nelp流出值低于所述参考标准指示所述患者发生疾病的风险较高,以及其中所述疾病是炎性疾病或心血管疾病。
102.2.如方面1所述的方法,其中所述疾病是中风、心肌梗塞、冠状动脉疾病(cad)、心脏病发作、心律失常、心力衰竭、先天性心脏缺陷、心肌病、外周动脉疾病、心绞痛、瓣膜疾病、高血压、遗传性心脏病况或炎性疾病。
103.3.如方面1或2所述的方法,其中所述患者的可检测地标记的nelp流出值等于或高于所述参考标准指示所述患者中较低的非钙化斑块负荷,以及其中所述患者的可检测地标记的nelp流出值低于所述参考标准指示所述患者中较高的非钙化斑块负荷。
104.4.如方面1-3中任一项所述的方法,其中所述患者的可检测地标记的nelp流出值等于或高于所述参考标准指示所述患者中较低的总斑块负荷,以及其中所述患者的可检测地标记的nelp流出值低于所述参考标准指示所述患者中较高的总斑块负荷。
105.5.如方面1-4中任一项所述的方法,其中所述患者的可检测地标记的nelp流出值等于或高于所述参考标准指示所述患者中较低的纤维性脂肪负荷,以及其中所述患者的可检测地标记的nelp流出值低于所述参考标准指示所述患者中较高的纤维性脂肪负荷。
106.6.降低患者发生疾病的风险的方法,所述方法包括:接收所述患者具有较高的发生所述疾病的风险的鉴定,其中发生所述疾病的风险已经通过方面1-5中任一项所述的方法评估;以及
(i)将脂蛋白修饰药物和抗炎药物中的一种或两种施用至被鉴定为具有较高的发生所述疾病的风险的患者和/或(ii)向被鉴定为具有较高的发生所述疾病的风险的患者推荐生活方式改变,其中所述疾病是炎性疾病或心血管疾病。
107.7.如方面1-6中任一项所述的方法,其中所述方法不包括将hdl与低密度脂蛋白(ldl)或极低密度脂蛋白(vldl)分离。
108.8.测量来自患者的体液样品中功能性高密度脂蛋白(hdl)的量的方法,所述方法包括:(i)将来自所述患者的体液样品与供体颗粒一起孵育,其中在将所述供体颗粒与所述样品一起孵育之前,用脂质和第一量的可检测地标记的不可交换性脂质探针(nelp)包被所述供体颗粒,其中所述可检测地标记的nelp通过hdl流出,其中所述体液包含hdl和含有载脂蛋白a-i(apoa-i)的一种或多种hdl相关蛋白,其中所述apoa-i将至少一部分可检测地标记的nelp从所述供体颗粒特异性地转移到所述hdl以产生具有第二量的可检测地标记的nelp的可检测地标记的nelp缔合的hdl;(ii)将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分;(iii)测量所述第一部分中可检测地标记的nelp的第二量;以及(iv)确定所述患者的可检测地标记的nelp流出值,其中所述患者的可检测地标记的nelp流出值等于所述可检测地标记的nelp的第二量除以所述可检测地标记的nelp的第一量,其中所述可检测地标记的nelp流出值指示来自所述患者的体液样品中的功能性hdl的量,
109.其中所述方法不包括将hdl与ldl或vldl分离。
110.9.如方面1-8中任一项所述的方法,其中所述脂质是磷脂酰胆碱。
111.10.如方面1-9中任一项所述的方法,其中所述供体颗粒包括脂质结合微粒材料。
112.11.如方面1-10中任一项所述的方法,其还包括在将所述供体颗粒与所述样品一起孵育之前将甾醇施加到所述供体颗粒上。
113.12.如方面11所述的方法,其中所述供体颗粒上的所述脂质与所述甾醇的摩尔比为约4:1至约2:1。
114.13.如方面11或12所述的方法,其中所述甾醇是胆固醇。
115.14.如方面1-13中任一项所述的方法,其中所述可检测地标记的nelp包含亲水部分、疏水部分和定位在亲水部分上的可检测地标记。
116.15.如方面1-14中任一项所述的方法,其包括在约10℃至约90℃的温度下将来自所述患者的体液样品与所述供体颗粒一起孵育。
117.16.如方面1-15中任一项所述的方法,其包括将来自所述患者的体液样品与所述供体颗粒一起孵育约1分钟至约24小时的时间。
118.17.如方面1-16中任一项所述的方法,其中将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分包括将所述可检测地标记的nelp缔合的hdl和所述供体颗粒离心。
119.18.如方面17所述的方法,其包括以约100至约15,000转/分钟(rpm)的速度离心所述可检测地标记的nelp缔合的hdl和所述供体颗粒。
120.19.如方面17或18所述的方法,其中所述第一部分是上清液,并且所述第二部分是沉淀。
121.20.如方面1-16中任一项所述的方法,其中将所述可检测地标记的nelp缔合的hdl分离成第一部分以及将所述供体颗粒分离成第二部分包括从所述供体颗粒中过滤所述可检测地标记的nelp缔合的hdl。
122.21.如方面1-20中任一项所述的方法,其中所述方法在少于约2小时内进行。
123.22.如方面1-21中任一项所述的方法,其中所述方法是无细胞的。
124.23.如方面1-22中任一项所述的方法,其中所述可检测地标记的nelp包括放射性标记、化学发光标记或荧光标记。
125.24.如方面1-23中任一项所述的方法,其中所述脂质是1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)或卵磷脂。
126.25.如方面1-24中任一项所述的方法,其中所述不可交换性探针是磷脂酰乙醇胺(pe)。
127.应注意,前面仅仅是实施方案的实例。其它示例性实施方案从本文的整个描述中是显而易见的。本领域普通技术人员还将理解,这些实施方案中的每一个可以与本文提供的其它实施方案以各种组合使用。
128.以下实施例进一步说明本发明,但当然不应解释为以任何方式限制其范围。
实施例
129.在实施例1-4中描述的实验中采用以下材料和方法。试剂
130.磷脂酰胆碱、bodipy-胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇)、(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基))和卵磷脂获自avanti polar lipids,inc.(alabaster,al)。脂质去除吸附剂(lra)和胆固醇获自supelco(bellefonte,pa)。动物
131.如前所述(ossoli等人,plos one 11:e0150083(2016))从眼眶周窦收集的雄性小鼠血液中制备血浆以及如先前所述(rousset等人,j.pharmacol.exp.ther.,335:140-148)(2010))酶促测量脂质。包括野生型小鼠在内的所有小鼠均在c57bi/6n背景下。lcat-ko小鼠(sakai等人,j.biol.chem.,272:7506-7510)(1997)(mmrrc库存编号:11840-mu)获自jax以及如所述(vaisman等人,j.biol.chem.,270:12269-12275(1995))产生lcat转基因(tg)小鼠。apoa-i ko(畜号002055;b6.129p2-apoa1tm1unc/j)和apoa-i-tg小鼠(畜号1927c57bl/6-tg(apoa1)1rub/j)获自jax。将小鼠在具有12/12h的光/暗循环的受控条件下饲养,并随意饲喂含有4.0%脂肪的标准啮齿动物高压灭菌的食物饮食(nih31食物饮食;zeigler brothers inc.,gardners,pa)。所有动物实验由nhlbi的动物护理和使用委员会(nih协议#h-0050)批准。脂蛋白之间的荧光脂质交换
132.合并的和单独的人血浆样品获自健康供体和血脂异常供体。通过差速超速离心获
得vldl(极低密度脂蛋白)、ldl(低密度脂蛋白)和hdl(高密度脂蛋白)亚级分(brewer等人,methods in enzymolog.,128:223-246(1986))。通过将2μl荧光脂质储备溶液(1mg/ml乙醇)加入到200μl人血浆或分离的vldl、ldl或hdl中,用荧光pe和胆固醇单独或一起标记脂蛋白。将反应混合物轻轻混合,然后在使用eppendorf 5436thermomixer仪器混合(700rpm)下在37℃孵育过夜。如brewer等人,methods in enzymolog.,128:223-246(1986)中所述分离的人apoa-i用alexa fluor 647染料按照制造商的说明(invitrogen,carlsbad,ca)标记。为了监测脂蛋白之间的胆固醇交换,将从用荧光pe和胆固醇两者标记的人血浆中分离的20μl vldl、ldl或hdl与4μl alexa fluor 647染料标记的人apoa-1(1mg/ml)和16μl pbs(磷酸盐缓冲盐水)(60μl的总反应混合物)一起添加到1.5ml塑料锥形管中的20μl未标记的vldl、ldl或hdl中。通过将20μl标记的脂蛋白加入到40μl pbs中制备参考标准脂蛋白。参考标准alexa fluor 647染料标记的人apoa-i含有4μl荧光apoa-i和56μl pbs。将反应混合物轻轻混合,然后如上在37℃下孵育过夜。多层囊泡制备
133.通过将来自各自的在氯仿中的储备溶液的24.4mg l-α-卵磷脂(32微摩尔)与4.25mg胆固醇(10微摩尔)组合,形成含有24摩尔%胆固醇的多层囊泡(mlv)。荧光mlv包括在氯仿中添加171μg(130钠摩尔)荧光标记的pe(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基))和/或74μg(128钠摩尔)荧光bodipy胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇)。将脂质混合物在氮气下干燥。将2ml pbs加入到干燥的脂质中,然后将缓冲液中的脂质涡旋10分钟以重悬干燥的脂质。然后将溶液超声处理10分钟,使用由15秒休息间隔分开的1分钟脉冲串(burst)产生mlv。使用酶比色测定(waco)来确认mlv颗粒的胆固醇和磷脂组成(lambert等人,j.biol.chem.,276:15090-15098(2001))。rhdl制备
134.如前所述(lerch等人,vox sang 71:155-164(1996);thacker等人,immunology,149:306-319(2016))制备重构的hdl(rhdl),载脂蛋白a-1与大豆磷脂酰胆碱的最终摩尔比为1:150。apoa-i介导的mlv重塑
135.将用荧光pe和胆固醇单独或一起标记的mlv(20μl,含有288μg总脂质)与20μl合并的人血浆在37℃下孵育过夜。在其它实验中,将未标记的mlv或者用荧光pe和胆固醇单独或一起标记的mlv(20μl,含有288μg总脂质)与过量的alexa fluor647染料标记的apoa-1(含有6μg apoa-1的6μl)和足够的pbs(总反应混合物体积为70μl)在37℃下孵育过夜。如neufeld等人,j.biol.chem.,279:15571-15578(2004)中所述,将apoa-i用alexa fluor 647染料根据制造商的说明(invitrogen)标记。将反应混合物轻轻混合,然后如上在37℃下孵育过夜。脂质包被的lra制备
136.使用dmpc(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱)或卵磷脂(pc:胆固醇摩尔比4:1)如上所述与5x荧光pe和胆固醇混合合成的脂质,以将受体脂蛋白荧光信号增加到最佳水平。初步研究揭示了用dmpc代替卵磷脂改善了向脂蛋白的荧光pe转移。脂质去除吸收剂(lra)用作水化硅酸钙晶体的来源,平均直径为10μm。通过将14mg dmpc(21微摩尔)与2.12mg胆固醇(5.48微摩尔)组合并且添加来自其各自的在氯仿中的储备溶液的305μg(200
钠摩尔)荧光标记的pe(1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基))和/或27.5μg(50纳摩尔)荧光bodipy胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇),形成含有21摩尔%胆固醇的脂质包被颗粒。将脂质混合物在氮气下干燥。为了形成脂质包被的lra颗粒,将80mg的lra与2ml的pbs一起加入到干燥的脂质混合物中,然后涡旋10分钟。通过离心(1000rpm,1min)沉淀所得的脂质包被的lra颗粒,去除上清液并用2ml pbs替换。将该洗涤过程重复5次以确保去除任何不连接至lra的潜在脂质囊泡。对于利用比人血浆研究小得多的血浆体积的小鼠血浆研究,通过将dmpc:chol比率增加到2:1来优化lra颗粒脂质组成以增强荧光pe转移。通过将来自其各自的在氯仿中的储备溶液的11.8mg dmpc(17.7微摩尔)与3.39mg胆固醇(8.8微摩尔)、305μg(200钠摩尔)荧光标记的pe(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基))和/或27.5μg(50纳摩尔)荧光bodipy胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇组合,以及使用40mg lra形成这些脂质包被的颗粒。约4:1的最小脂质与lra比率(mg/mg)是基于先前测定的lra的脂质结合能力(gordon等人,j.proteome res.,9:5239-5249(2010))。这种脂质与lra的比率提供了足够的脂质以完全覆盖lra颗粒的表面,从而防止脂蛋白直接结合到非脂质包被的lra表面。在本文中,通过显示*pe-标记的血浆不将*pe转移到非荧光脂质包被的lra颗粒,通过实验确认了脂蛋白不与脂质包被的lra颗粒结合。从脂质包被的lra颗粒到脂蛋白的荧光脂质转移的体外研究
137.在国家心脏、肺和血液研究所机构审查委员会根据协议#93-cc-0094批准的研究下获得人样品,并且所有对象在登记时提供同意。将合并的或单独的人血浆样品(20μl)与荧光pe-和胆固醇-标记的脂质包被的lra(60μl)和pbs(20μl)在37℃下孵育4小时,同时混合。然后将样品以1000rpm离心1分钟以沉淀荧光脂质包被的lra颗粒。通过琼脂糖电泳和fplc分析上清液样品。通过针对总胆固醇(tc)、胆固醇和甘油三酯(tg)(waco)的比色测定来测定合并的人血浆样品的脂质和脂蛋白组成。基于它们的组成,将样品命名为:低tg(ltg)、高tg(htg)、低ldl(ll)和高hdl(hh)。总胆固醇:160.3、227.5、120.2和201.6,g/dl);hdl:分别为66.9、39.2、43.7和84.1,g/dl;甘油三酯:分别为37.9、412.9、114.7和60.9g/dl。将小鼠血浆(10、15、20或25μl)的一式三份样品与荧光pe和胆固醇标记的脂质包被的lra(50μl)和足够的pbs(总体积为200μl)一起在96孔板中在37℃下孵育1小时,同时混合(1200rpm)。孵育后,向每个孔中加入另外的100μl pbs,然后将板以2000rpm离心2分钟。将来自每个一式三份样品的10μl上清液合并用于琼脂糖凝胶电泳分析。荧光脂质琼脂糖凝胶电泳
138.通过使用sebia hydragel脂蛋白(e)15/30琼脂糖凝胶对10μl反应混合物或血浆样品进行电泳(其运行45、60或90分钟)来监测荧光脂蛋白。使用typhoon 9400variable mode imager(ge)对凝胶上的荧光条带进行成像。分别使用532/560nm、488/520nm和633/670nm的激发/发射波长检测荧光pe、胆固醇和apoa-i。荧光脂质和蛋白质成像后,用苏丹黑(sudan black)染料染色凝胶并重新扫描。使用imagequant 5.1软件进行荧光条带强度的定量分析。fplc分析
139.将370μl血浆应用于akta快速蛋白质液相色谱(fplc(amersham biosciences)上的superose 6 10/300gl柱,并收集0.5ml级分。
上清液pe和胆固醇荧光测量
140.对于体外研究,用200μl的1%triton x-100表面活性剂稀释40μl的反应混合物上清液以溶解脂质。用perkin elmer victor31420多通道计数器分别使用540/600和485/520激发/发射过滤器测量pe丽丝胺罗丹明和bodipy-胆固醇荧光。通过在tx-100去污剂中提取各种体积的荧光pe和胆固醇标记的脂质包被的lra以及测量丽丝胺罗丹明和bodipy荧光来确定脂质包被的lra颗粒的荧光发射/ng荧光脂质的量。然后使用每单位体积脂质lra的荧光pe和胆固醇的质量计算荧光发射/ng脂质lra。蛋白质组分析
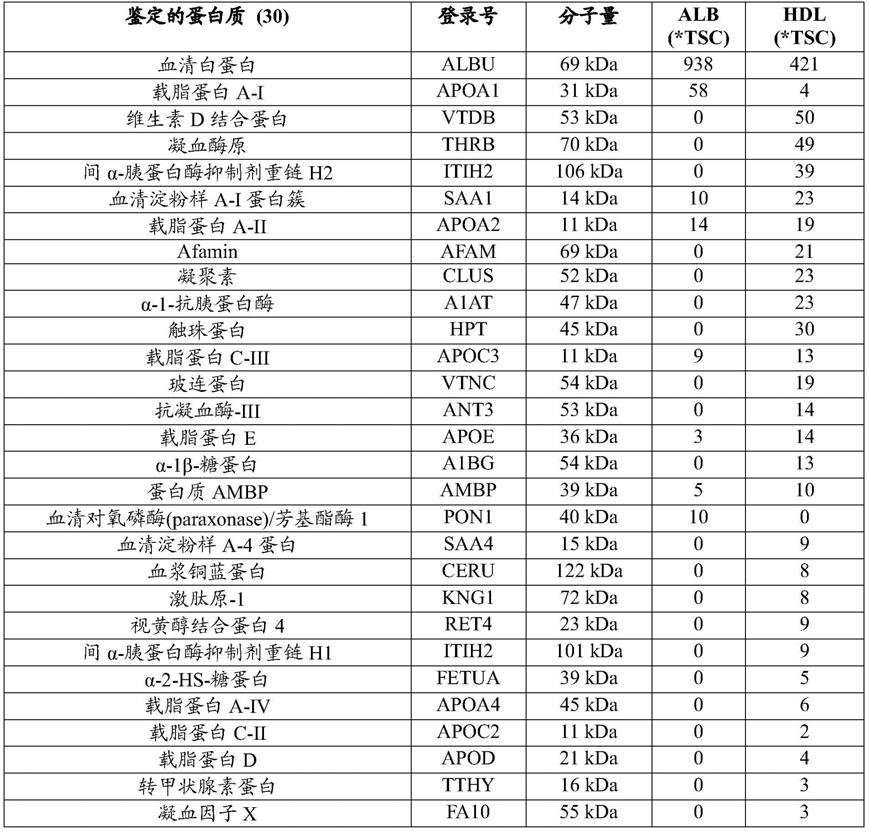
141.将代表hdl的琼脂糖凝胶条带或hdl上方的条带(15个泳道)从凝胶塑料背衬上刮下并转移到塑料eppendorf管中。通过二硫苏糖醇对样品进行凝胶内还原,通过碘乙酰胺进行氨基甲酰甲基化(carbamidomethylation),然后用测序级胰蛋白酶消化过夜。过滤蛋白质消化物以从凝胶片段中分离肽,并使用ziptip c18柱(millipore)进行脱盐。将样品重悬于0.1%甲酸中,并在orbitrap elite质谱仪(thermo scientific)上通过nanolc-esi-ms/ms分析。使用mascot搜索引擎和proteome discover软件(thermo)针对swiss-prot数据库搜索大量数据。使用scaffold软件(proteome software)验证鉴定,其中肽和蛋白质阈值都设定为95%置信度,最少2个肽用于蛋白质鉴定。实施例1
142.本实施例显示了荧光pe和胆固醇掺入脂蛋白中。
143.首先通过fplc脂蛋白分析评估用痕量的荧光pe(*pe(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基)))和胆固醇(*chol(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇))标记分离的脂蛋白亚级分的效果,发现vldl、ldl和hdl的洗脱曲线未被标记过程改变(图1a-c)。*chol和*pe在通过琼脂糖凝胶电泳检测的脂蛋白中的分布与通过fplc分析观察到的类似(图1a-c)。vldl和hdl级分在琼脂糖凝胶上的电泳迁移率通过双*pe和*chol标记增加,最可能是由于在脂蛋白颗粒上存在带正电荷的荧光团pe。
144.然后测试用*pe和*chol标记人全血浆是否会改变血浆脂蛋白的fplc洗脱曲线,并且,如果荧光脂质掺入脂蛋白中将与脂质质量成比例。如上,血浆脂蛋白磷脂和胆固醇fplc洗脱曲线不受用*pe或*chol标记的影响,但将*pe和*chol掺入血浆脂蛋白中的模式不同(图1d)。然而,将*pe和*chol掺入脂蛋白中分别与脂蛋白磷脂和胆固醇质量成比例(图1e,f)。因此,将*pe和*chol掺入脂蛋白中的不同模式反映了vldl、ldl和hdl颗粒的不同磷脂和胆固醇组成。实施例2
145.本实施例显示了掺入脂蛋白中的荧光胆固醇是可交换的,而荧光pe不是可交换的。
146.然后评估当与人血浆孵育时*pe是否保持与标记的分离脂蛋白缔合。当将双*pe和*chol标记的hdl、vldl或ldl与合并的人血浆一起孵育时,*pe确实在所有情况下都保持与原始荧光标记的脂蛋白缔合,证实了不可交换性*pe作为脂蛋白标志物的效用。与此形成鲜明对比的是,荧光胆固醇容易在双*pe和*chol标记的脂蛋白与未标记的血浆脂蛋白之间交换。
147.然后确定alexa647-标记的apoa-i是否特异性结合hdl。先前显示,当用alexa荧光
团标记apoa-i时,apoa-i介导的细胞胆固醇流出不会改变(neufeld等人,j.biol.chem.,279:15571-15578(2004))。在本研究中,将alexa647标记的apoa-i(*apoa-i)与从全血浆中分离的双*pe和*chol标记的hdl、vldl或ldl以及未标记的分离的脂蛋白共孵育不同的时间量。*apoa-i、*pe和*chol荧光通过琼脂糖凝胶电泳监测。*apoa-i与hdl特异性结合,证实了荧光标签不改变apoa-i与hdl的结合,也不诱导与其它脂蛋白的非特异性结合。在这些实验中,琼脂糖凝胶运行45分钟以避免*apoa-i条带在凝胶上拖尾。与本实施例中的以上观察一致,在荧光脂蛋白与未标记的合并的人血浆一起孵育时,*pe保持与原始荧光标记的脂蛋白缔合,而*chol在荧光脂质标记的脂蛋白与未标记的脂蛋白之间快速交换(在5分钟内)。为了更好地评估vldl与ldl之间的*chol交换,琼脂糖凝胶运行90分钟以增强vldl和ldl条带的分辨率。*chol在vldl与hdl之间以及ldl与hdl之间快速平衡,而*chol在vldl与ldl之间的交换显著较慢。剂量反应实验显示,4小时后*chol在vldl或ldl之间的净转移(此时供体和受体胆固醇汇集物处于平衡状态)随着反应混合物中未标记脂蛋白的量的增加而增加。这些发现显示脂蛋白之间的*chol交换是时间依赖性的和剂量依赖性的。实施例3
148.本实施例显示了不可交换性的荧光pe可用于监测脂蛋白重塑。
149.然后将研究扩展到apoa-i介导的mlv的重塑,所述mlv具有与脂蛋白-x类似的脂质组成。典型的脂蛋白含有单层表面磷脂以及胆固醇酯和甘油三酯的疏水核心,与典型的脂蛋白不同,lpx(脂蛋白-x)是包含围绕水核心的多个磷脂/胆固醇双层的多层囊泡。此外,与典型的脂蛋白不同,lpx在琼脂糖凝胶电泳过程中向阴极迁移(o and frohlich,j.lipid res.,36:2344-2354(1995)),因此可以容易地检测到。先前显示,合成的lpx通过存在于血浆中的apoa-i和lcat的组合作用被重塑成hdl(ossoli等人,plos one 11:e0150083(2016))。对于本研究,合成含有痕量的*pe、*chol或两者的多层合成lpx样颗粒(ossoli等人,plos one 11:e0150083(2016)),然后将荧光mlv与人血浆一起孵育(图2a-2c)。与人血浆孵育后消耗了几乎所有的荧光mlv。mlv衍生的*pe与hdl特异性缔合(图2a-2c)。未标记的、双荧光脂质标记的和单荧光脂质标记的mlv经历与hdl类似的重塑,表明pe和胆固醇上的荧光团既不单独也不一起扰乱mlv重塑。mlv衍生的*chol在脂蛋白上的分配(图2a-2c)类似于上文看到的(实施例2),表明mlv缔合的*chol可能基于它们的胆固醇含量在脂蛋白之间平衡。将单或双荧光脂质标记的mlv与过量的荧光标记或未标记的apoa-i一起孵育,以测试apoa-i是否会从mlv中去除脂质,以及荧光标签是否会干扰该过程。结果显示*apoa-i确实重塑了mlv以形成含有*pe、*chol和*apoa-i的新脂蛋白颗粒。mlv的重塑似乎不会被存在于脂质或apoa-i上的荧光团的存在所扰乱。实施例4
150.本实施例显示了荧光脂质从底物结合的脂质供体膜转移到脂蛋白。
151.在实施例1-3中,脂蛋白直接用荧光脂质和apoa-i标记,以监测脂蛋白之间的胆固醇交换和脂蛋白的重塑。考虑到对细胞胆固醇交换作为hdl功能标志物的兴趣(rosenson等人,circulation,125:1905-1919(2012)),模拟脂蛋白或细胞膜脂质表面结构或脂质组成并且容易与受体膜分离的荧光脂质标记的供体膜,可以用作研究脂质表面之间的脂质转移的另外有用的模型系统。
152.为此,开发了简单的方法来评估从底物结合的供体膜到脂蛋白的荧光pe和胆固醇
转移。作为原理论证,dmpc:胆固醇脂质供体膜与如实施例3所示的类似于合成lpx的组合物一起使用,lpx通过交换将(i)*pe和*chol以apoa-i依赖性方式转移到hdl,以及将(ii)*chol转移到vldl和ldl。用dmpc、胆固醇和痕量的*pe和*chol包被容易吸附脂质的水化硅酸钙晶体(10μm大小)(脂质去除吸附剂(lra))。供体脂质膜制剂容易通过简单的低速离心步骤与脂蛋白受体颗粒分离,该步骤使供体颗粒沉淀,但不使受体颗粒沉淀。
153.为了评估通过hdl获得脂质包被的lra*pe的潜在特异性以及丽丝胺罗丹明与bodipy荧光团之间可能的相互作用,将单标记或双标记的荧光*pe和*chol脂质包被的lra与人血浆一起孵育。lra衍生的*pe稳健地转移到血浆hdl中,而相对少地转移到vldl或ldl中,这与先前观察到的lpx衍生的*pe在人全血浆中的hdl特异性摄取一致(实施例3;图6)。如先前使用单独的lpx所看到的(实施例3;图6),脂质包被的lra*chol转移到所有脂蛋白。脂质包被的lra*pe或*chol向脂蛋白的转移以剂量依赖性方式发生。从单标记或双标记的*pe和/或*chol脂质包被的lra转移到血浆脂质的*pe和*chol的分布几乎相同,表明当两个荧光团一起存在于脂蛋白颗粒上时,丽丝胺和bodipy荧光没有改变。
154.为了进一步评估通过血浆hdl获得荧光脂质包被的lra衍生的*pe的潜在特异性,将重构的hdl(rhdl)以及分离的血浆hdl和ldl作为受体进行比较。rhdl(一种avid胆固醇受体)是合成的前β样hdl颗粒,其通过用磷脂酰胆碱重构无脂质的apoa-i来制备(chen等人,j.cardiovasc.pharmacol.ther.,17:315-323(2012))。供体颗粒衍生的*pe稳健地转移到分离的hdl和重构的hdl,但不转移到ldl,这与先前观察到的lpx衍生的*pe(实施例3)和脂质包被的lra供体颗粒衍生的*pe在人全血浆中的hdl特异性摄取一致。供体脂质颗粒*pe和*chol向脂蛋白的转移以剂量依赖性方式发生。有趣的是,重构的hdl用作avid胆固醇受体。荧光琼脂糖凝胶电泳揭示了重构的hdl形成两个条带:(1)从脂质供体lra颗粒获得*chol和*pe的较慢迁移条带,以及(2)仅获得*pe的较快迁移条带。因此,后一条带仅通过其对*pe的摄取来揭示。基于总的*pe和*chol荧光强度,以及它们各自的荧光/质量比(图3),计算出每摩尔*pe有3摩尔*chol从脂质lra颗粒转移到重构的hdl。
155.检查了lra供体颗粒的磷脂组成和胆固醇含量的改变对荧光pe和胆固醇向人血浆脂蛋白的转移的影响。在没有胆固醇的情况下,apoa-i介导的*pe的转移显著减少,与磷脂组成(dmpc对比蛋卵磷脂)无关。然而,随着胆固醇添加到磷脂供体颗粒中,向血浆hdl的特异性*pe转移显著增加,并且依赖于磷脂组成(dmpc》蛋卵磷脂)。该发现表明胆固醇改变了脂质包被的lra颗粒表面上磷脂的组织结构,使得*pe更可用于apoa-i介导的去除。另一方面,*chol通过被动交换从供体lra颗粒转移到所有血浆脂蛋白仅依赖于供体lra磷脂组成。
156.为了直接证实hdl和apoa-i在介导*pe从供体lra颗粒到血浆hdl的转移中的作用,将来自荧光脂质包被的lra颗粒的*pe转移与来自野生型和基因工程化敲除及转基因的lcat和apoa-i小鼠的血浆脂蛋白进行比较。先前显示lcat-tg小鼠血浆中的血浆hdl浓度增加(vaisman等人,j.biol.chem.,270:12269-12275(1995)),并且在apoa-i tg小鼠中增加到甚至更大的程度(rubin等人,pnas,88,434-438(1991))。与野生型小鼠血浆相比,*pe向hdl的转移以血浆剂量依赖性方式增加至lcat-tg小鼠血浆hdl,并且在缺乏hdl的lcat-ko小鼠中不存在。这些发现显示脂质供体颗粒*pe血浆摄取是hdl依赖性的,并且与血浆hdl浓度成比例。apoa-i tg小鼠具有显著增加的血浆hdl水平。因此,与野生型和lcat-tg小鼠血浆相比,lra供体颗粒*pe向apoa-i tg小鼠血浆hdl的转移显著增加。*pe向血浆hdl的转移
也是血浆剂量依赖性的,并且在缺乏hdl的apoa-iko小鼠中不存在。这些发现显示lra供体颗粒*pe向小鼠血浆的转移是apoa-i依赖性的。
157.然后评估脂质包被的lra在评价荧光pe和胆固醇向含有不同量ldl、hdl和甘油三酯的合并的人血浆脂蛋白样品的转移中的效用(图4a-4b)。如通过琼脂糖凝胶分析和fplc所评估的,*pe从供体颗粒转移到hdl,但是如果有的话,*pe很少转移到vldl或ldl(图14a,b)。这一发现与先前的观察一致(ossoli等人,plos one11:e0150083(2016)):即供体lra颗粒*pe主动掺入血浆hdl中(参见实施例4)。相比之下,*chol以与实施例4中的研究类似的方式从脂质包被的lra转移到所有脂蛋白(图4a,b)。fplc分析揭示了不同的合并人血浆样品显示出对*pe和*chol的独特摄取模式(图4a,b)。
158.该方法还允许在获得*pe和*chol的琼脂糖凝胶上鉴定hdl条带上方的条带(图4a,b)。hdl条带中鉴定的蛋白质对比已建立的hdl蛋白质组(//homepages.uc.edu/~davidswm/hdlproteome.html)的蛋白质组分析揭示了除一种蛋白质(凝血因子10(fa10))以外的所有蛋白质都是真正的hdl结合蛋白质,从而验证了凝胶内质谱蛋白质组分析(表1)。质谱蛋白质组分析揭示了htg样品中最上面的条带明显富含apoa-i和apoa-ii,但不富含其它hdl相关蛋白(表1)。由于显示了rhdl从供体颗粒对*pe和*chol的稳健摄取,该发现表明存在于最上面条带中的其它hdl种类(可能是前α-hdl(asztalos等人,curr.opin.lipidol.,22:176-185(2011))可能从供体颗粒获得荧光pe和胆固醇。表1htg合并的人血浆alb和hdl条带的蛋白质组分析
159.最后,评估*pe和*chol从lra脂质供体颗粒到来自50个个体的一组人血浆样品的转移(图5)。琼脂糖凝胶电泳再现所观察到的结果,即*pe仅转移到hdl(并且可变地转移到白蛋白条带)并且*chol转移到vldl、ldl和hdl。在这50个样品中hdl*pe和*chol荧光的强度是高度相关的(图5;r2=0.8534;p《0.0001),表明磷脂和胆固醇apoa-i介导的从lra到hdl供体脂质颗粒的转移的摩尔比是高度保守的。实施例5
160.本实施例显示了高通量无细胞的hdl脂质流出测定。
161.图14中示出了测定的示意图。将来自84个供体的人全血浆的合并样品与标称直径为10微米的供体颗粒混合。供体颗粒是用dmpc、未标记的胆固醇、*chol和*pe包被的水化硅酸钙晶体(lra)。在进行测定之前,供体颗粒上的*chol和*pe的量分别是总lra*chol和总lra*pe。颗粒上的dmpc与胆固醇的摩尔比为2:1。将混合物在96孔板中在37℃下孵育1小时,同时以1200rpm(每分钟转数)摇动。
162.通过以2,000rpm快速离心2分钟将供体颗粒与脂蛋白分离。取出一部分上清液(50μl),与另外的50μl盐水和100μl 1%tx-100混合,以溶解荧光脂蛋白颗粒。然后通过荧光测量来测量上清液中*pe和*chol的量。
163.在全血浆中的apoa-i将至少一部分*pe从供体颗粒特异性地转移到hdl。因此,不
可交换性的*pe以依赖于apoa-i功能性的方式特异性地标记hdl。
164.另一方面,*chol通过来自供体颗粒的被动交换来标记所有脂蛋白受体颗粒(vldl、ldl和hdl)。
165.作为阴性对照,仅将供体颗粒单独与盐水孵育。盐水对照上清液中的荧光极低(《0.1%)。
166.如下计算*pe流出的百分比(%*pe流出):%*pe流出=上清液*pe/总lra*pe(50μl)。
167.如下计算*chol流出的百分比(%*chol流出):%*chol流出=上清液*chol/总lra*chol(50μl)。
168.84个供体的临床特征显示在表2中。表2
实施例6
169.本实施例显示了实施例5的测定的血浆剂量依赖性和线性度。
170.验证测定实施例5的分析性能。
171.使用实施例5中所述的测定在范围为15-50μl的不同体积的人合并血浆样品中测量%*pe流出和%*chol流出。结果显示在图7和表3中。表3
172.如图7所示,*pe流出值和*胆固醇流出值显示15μl至50μl的血浆剂量依赖性和线性度。此外,如表3所示,变异系数(cv)完全低于4%的平均值,尽管它依赖于血浆体积。因此,考虑到khera等人,nejm,364:127-35(2011)中所述的常规细胞胆固醇流出能力(cec)测
定(“细胞cec测定”)的值常具有较大的cv(》10%),实施例5的测定完全是可重复的。因此,这种测定既是定量的又是可重复的,并且适用于临床测试。
173.对于随后的临床研究,选择25μl的血浆体积。通常,在约10分钟内使用约10μl血浆进行临床测定。实施例7
174.本实施例显示了pe从供体颗粒特异性地转移到血浆hdl。
175.使用84个临床样品进行实施例5的测定,不同之处在于通过在电泳凝胶上分离上清液中的hdl和ldl/vldl来测量荧光。电泳凝胶将hdl和ldl/vldl分离成单独的荧光条带。电泳凝胶显示*pe仅存在于hdl条带中,而*chol同时存在于hdl和ldl/vldl条带中。这些数据证实了*pe从lra供体颗粒特异性地转移到血浆hdl。相比之下,*胆固醇不仅转移到hdl,而且还转移到ldl/vldl。实施例8
176.本实施例显示了通过荧光和凝胶分析获得的结果是高度相关的。
177.分析实施例6中进行的上清液的荧光分析与实施例7中进行的上清液的电泳分析之间的相关性。将标准化的*pe流出(荧光测定法)和标准化的*pe hdl像素强度(电泳)绘制在图上(图8)。将标准化的*pe hdl像素强度和标准化的*chol hdl像素强度绘制在图上(图9)。
178.如图8所示,通过荧光测定法得到的*pe流出值与通过电泳得到的hdl条带的*pe像素强度高度相关(皮尔逊相关系数r=0.7251,p《0.0001)。因此,对hdl的*pe特异性允许直接使用人全血浆,而不需要对血浆进行任何另外的处理。
179.然而,通常用于其它方法(包括细胞cec测定)中的*胆固醇通常需要预处理以在流出测定之前从人全血浆中分离hdl。hdl的分离涉及通过聚乙二醇沉淀从全血浆中耗尽apob相关脂蛋白如ldl和vldl,因此细胞cec测定在上清液中得到分离的hdl。据报道,apob耗尽后的上清液仍然包括高浓度的聚乙二醇(peg)。通过细胞cec测定获得的流出数据可能受到残留peg的影响。
180.相比之下,实施例5的测定有利地反映了排除诸如peg的人为因素的绝对生理条件。
181.此外,hdl条带的*pe像素强度和hdl条带的*胆固醇像素强度也是高度相关的(图9),这与图5所示的数据一致。因此,*pe可以是hdl功能的可选择的标志物。实施例9
182.本实施例显示了无细胞磷脂转移和细胞胆固醇流出是相关的。
183.使用25微升的人血浆进行实施例5的测定和khera等人,nejm,364:127-35(2011)所述的细胞胆固醇流出能力(cec)测定(“细胞cec测定”)。绘制通过实施例5的测定测量的标准化的*pe流出和通过细胞cec测定测量的标准化的细胞cec值。这些测定的结果是适度相关的(皮尔逊相关系数r=0.3457,p=0.0013)。实施例10
184.本实施例显示了无细胞磷脂转移与血浆apoa-i水平和hdl颗粒数目高度相关。
185.进行通过实施例5的测定测量的标准化的*pe流出或通过细胞cec测定测量的标准化的细胞cec值与apo-ai和hdl颗粒数目的相关分析。*pe转移与apoa-i血浆水平高度相关。
令人惊讶的是,与细胞cec测定相比,实施例5的*pe测定的皮尔逊相关系数r高得多。这表明*pe流出值对apoa-i的特异性高于细胞cec值。*pe转移与hdl颗粒数目高度相关,尽管细胞cec测定值也与hdl颗粒数目适度相关。
186.由于apoa-i是hdl的主要成分,因此apoa-i水平和hdl颗粒数目与*pe流出相关的发现是完全一致的。实施例11
187.本实施例显示了*pe流出与非钙化斑块负荷呈负相关。
188.进行来自84个临床样品的223条动脉的非钙化斑块负荷(ncb)与通过实施例5的测定测量的标准化的pe流出或通过细胞cec测定测量的标准化的细胞cec值的相关性分析。通过gordon等人,atherosclerosis,278:278-85(2018)所述的方法测定ncb的测量。
189.这些结果显示*pe流出与ncb呈负相关。而且,这种相关性高于细胞cec测定的相关性。实施例12
190.本实施例显示了*pe流出与非钙化斑块负荷呈负相关。
191.通过另一种统计分析方法证实实施例11的结果。将*pe流出和细胞cec测定值分为三组,即low、med和high。与散点图分析一致,本实施例的分析表明ncb与*pe流出水平相关。细胞cec测定流出与ncb的关联不如用实施例5的测定强。实施例13
192.本实施例显示了*pe与总负荷、非钙化负荷和纤维性脂肪负荷显著相关。
193.通过gordon等人,atherosclerosis,278:278-85(2018)所述的方法测定总负荷、非钙化负荷和纤维性脂肪负荷的测量。也证实了通过实施例5的测定测量的*pe流出与冠状动脉计算机断层血管造影术(ccta)所有斑块参数的关联。结果显示在表4中。表4线性回归模型。结果报告为标准化的β系数(p值)。tb:总负荷,ncb:非钙化负荷,dcb:致密钙化负荷,ffb:纤维性脂肪负荷,nb:坏死负荷。cb(aga):agastone钙评分。dcb值经log10转换。
194.*pe与总负荷、非钙化负荷和纤维性脂肪负荷显著相关。与细胞cec测定相比,用实施例5的*pe测定的这些关联中的每一个都更好。实施例14
195.本实施例显示了*pe不依赖于评估非钙化斑块负荷的风险的各种临床标志物。
196.进行多变量调整的线性回归分析以确定实施例5的*pe流出测定(或细胞cec测定)与非钙化斑块负荷之间的关联。结果显示在表5中。表5
197.这些分析揭示了细胞cec测定受体重指数(bmi)、hdl-c和他汀类处理的影响。实施例5的*pe测定不受任何临床生物标志物的影响。甚至当调整了apoa-i时,pe流出仍与ncb显著相关。该发现表明除apoa-i血浆浓度水平之外,*pe流出与ncb的关联还包括其它因素。实施例15
198.本实施例显示了实施例5的测定的优点。
199.实施例5的测定是独特的,因为它使用*pe作为hdl功能的标志物。因为*pe对hdl具有特异性,所以与其它胆固醇流出方法不同,可以使用无需任何预处理的人全血浆。此外,常规细胞cec测定需要放射性标记的胆固醇、细胞培养和abca1表达的诱导,这是耗时的,而且提供了高度可变的数据。细胞cec测定不适于用作临床测定。
200.sysmex corp.方法(描述于harada等人,j.applied labor.med.,jalm.2016.022913;doi:10.1373/jalm.2016.022913(2017)中)测量hdl的胆固醇摄取能力(cuc)(“sysmex方法”)。这些研究者发现与非abca1 c-cec流出的高度相关性。因此,所述方法基于供体脂质体与hdl之间胆固醇的被动交换。sysmex方法的主要局限性是它仅在ldl-c《100mg/dl的患者(即其进行了他汀类治疗用于ldl-c控制)中得到验证,由于它们的测定似乎受ldl-c水平的影响。相反,实施例5的*pe测定不受任何临床标志物的影响(实施例14),并且与常规细胞cec测定相比更好地与ncb相关。
201.实施例5的测定是独特的,因为它使用不可交换性的荧光磷脂测量apoa-i功能,而不是hdl的胆固醇摄取能力。
202.实施例5的测定的特征和优点显示在表6中。表6
实施例16方法
203.脂质包被的csh(lc-csh制备。如前所述,经过小的修改制备脂质包被的水化硅酸钙晶体(lc-csh)(neufeld,e.b.等人,biology(basel),8,doi:10.3390/biology8030053(2019),通过引用以其整体并入)。简而言之,脂质去除吸附剂(lra;supelco#13358-u,merck kgaa,darmstadt,germany)用作csh颗粒的来源。通过将来自其各自的在氯仿中的储备溶液的11.8mg(17.7μmol)dmpc(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱)(avanti polar lipids#850345c,alabaster,al,usa)与3.39mg(8.8μmol)胆固醇(sigma#c8667,merck kgaa,darmstadt,germany)、305μg(200纳摩尔)不可交换性的头基标记的带荧光标签的磷脂酰乙醇胺(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-(丽丝胺罗丹明b磺酰基));avanti polar lipids#810150c),和/或55.0μg(100纳摩尔)荧光bodipy胆固醇(23-(二吡咯亚甲基二氟化硼)-24-降胆甾醇);avanti polar lipids#810255)合并而形成lc-csh。lc-csh脂质摩尔比是dmpc:胆固醇:*pe:*chol=2:1:0.02:0.01。将脂质混合物在氮气下干燥。为了形成lc-csh,将80mg lra与2ml盐水一起加入到干燥的脂质混合物中,然后涡旋10分钟。这种脂质与lra的比率提供了足够的脂质以完全覆盖lra颗粒的表面,从而防止脂蛋白直接结合到非脂质包被的lra表面。通过离心(2000rpm,2min)沉淀所得的lc-csh,去除上清液并用5ml盐水替换。将该洗涤过程重复5次以确保去除不连接至lra的任何潜在脂质囊泡。在最后一次洗涤之后,使lc-csh溶液体积在盐水中达到2.5ml。共聚焦显微镜和透射电子显微镜揭示了lc-csh颗粒的板状和针状晶体结构。
204.血浆和血清样品。为了分析验证研究,分别从健康供体和家族性卵磷脂胆固醇酰基转移酶缺乏症(fld)患者获得合并的人血浆和单独的hdl缺乏血浆样品。在使用前,fld血浆储存在冰上或在4℃下。诊断fld的脂蛋白-x(lpx)是富含磷脂和游离胆固醇的异常多层脂蛋白。因为血浆lpx对冷冻和解冻循环不稳定,所以在这些研究中使用新鲜的从未冷冻的fld血浆。通过差速超速离心获得来自正常人血浆的vldl、ldl和hdl亚级分。对于临床验证研究,从在nih(临床研究i和ii)的临床试验中登记的cvd患者以及从日本cad和无cad对象(临床研究iii)获得单独的人血清样品。按照1975年“赫尔辛基宣言”(2013年修订)的规定,进行血液收集。nih研究得到了国家心脏、肺和血液研究所机构审查委员会的批准。日本研
究得到了自治医科大学(jichi medical university)的伦理委员会的批准。所有对象在参加这些研究之前提供了知情同意书。如下进行全部合并的人血浆中所有脂蛋白的直接标记:将2μl含*pe的乙醇,然后将2μl含*chol的乙醇注入200μl合并的人血浆中,同时剧烈混合,如先前所述的(neufeld,e.b.等人,biology(basel),8,doi:10.3390/biology8030053(2019),通过引用以其整体并入)。
205.hdl-spe和ns-cec测定。标准测定反应混合物(总体积150μl):将25μl人血浆或血清(或25μl盐水作为阴性对照)与50μllc-csh和75μl盐水在96孔板中在37℃下孵育1小时,同时摇动(1200rpm)。当将血浆体积从10μl增加至50μl时,添加90-50μl盐水和50μl lc-csh以维持150μl的总反应体积。孵育之后,经由离心(2000rpm,2分钟)沉淀供体颗粒。将50μl上清液与50μl盐水和100μl 1%triton-x100水溶液(1%tx)(thermo scientific#28314)一起转移到黑色96孔板中的孔中。在充分混合之后,通过荧光测定法(*pe;540nm/600nm ex/em,*chol;485nm/520nm ex/em)测量hdl-spe的荧光标记的pe(*pe)和/或ns-cec的荧光标记的胆固醇(*chol)。对于分析验证研究,所有测定以一式三份进行,或者对于临床验证研究,所有测定以一式两份进行。
206.hdl-spe和ns-cec的*pe和*chol标准曲线。首先,如下制备在15ml管中的lc-csh的10倍稀释液和lc-csh的100倍稀释液:10倍稀释液:100μl的lc-csh和900μl的1%triton-x100的水溶液(1%tx);100倍稀释液:100μl的10倍稀释的lc-csh和900μl的1%tx。其次,使用10倍稀释液和100倍稀释液还制备了如下的在96孔板中的六个连续稀释液:100μl的10倍稀释液+100μl的1%tx(相当于每孔10μl的lc-csh)、50μl的10倍稀释液+150μl的1%tx(相当于每孔5μl的lc-csh)。25μl的10倍稀释液+175μl的1%tx(相当于每孔2.5μl的lc-csh)、100μl的100倍稀释液+100μl的1%tx(相当于每孔1μl的lc-csh)、50μl的100倍稀释液+150μl的1%tx(相当于每孔0.5μl的lc-csh)、25μl的100倍稀释液+175μl的1%tx(相当于每孔0.25μl的lc-csh)。第三,为了完全溶解lc-csh结合的脂质,将样品在24℃下孵育1小时,同时摇动(1200rpm)。在该孵育之后,将100μl的全部悬浮液(包括脱脂的csh颗粒)与100μl的盐水一起转移到黑色96孔板孔中。在充分混合之后,如上所述测量荧光标记的pe(*pe)和/或荧光标记的胆固醇(*chol)的荧光。所有测定以一式三份进行。注意,该方案可以提供*pe(r2=0.9999)和*chol(r2=0.9997)的精确标准曲线,如图11a和11b所示(注意,lc-csh(a)*pe荧光发射在*chol存在下不改变,相反,(b)*cho荧光发射在*pe存在下不改变。此外,(a)*pe标记的lc-csh没有*chol发射,相反,(b)*chol标记的lc-csh没有*pe发射。使用*pe单标记的lc-csh和*chol单标记的lc-csh证实了*pe荧光与*chol荧光之间没有串扰(图11c和11d)。此外,当在测定中使用双*pe-和*chol-标记的lc-csh供体颗粒时,在hdl-spe或ns-cec的测量中没有检测到干扰。
207.hdl-spe(*pe)和ns-cec(*chol)的%流出计算。%*pe或*chol流出值由((上清液样品flu-上清液盐水flu)/总lc-csh flu)
×
100给出。如上所述,使用标准曲线计算总lc-csh flu。标准化的流出值被定义为临床样品%流出值除以参考对照%流出值。将来自具有正常脂质分布的健康供体的相同合并的人血浆用作参考对照。进行临床研究中流出值的标准化以校正试剂制剂和实验中的每日变化。hdl-spe和ns-cec测定方案以及%流出计算方法显示出高再现性,其中对于hdl-spe和ns-cec分别为r2=0.9984和r2=0.9969。使用包括lc-csh的相同批次的材料进行这些再现性分析。
208.使用分离的脂蛋白(hdl、ldl和vldl)的hdl-spe测定。用盐水将分离的hdl磷脂浓度调整至80mg/dl,其是先前报道的人血浆中的hdl磷脂浓度。为了比较脂蛋白之间hdl-spe的特异性,还在与hdl磷脂相同的磷脂浓度下使用分离的ldl和vldl,具体地,10μl(8μg)、20μl(16μg)或40μl(32μg)。
209.荧光脂质琼脂糖凝胶电泳。如先前报道的(neufeld,e.b.等人,biology(basel),8,doi:10.3390/biology8030053(2019),通过引用以其整体并入)进行该测定。简而言之,通过使用sebia hydragel lipoprotein(e)15/30琼脂糖凝胶(sebia#4134,france)对10μl反应混合物进行电泳来监测荧光脂蛋白,所述凝胶在室温下在100v下运行60分钟。使用typhoon 9400可变模式成像仪(ge)对凝胶上的荧光条带进行成像。分别使用532/560nm和488/520nm的激发/发射波长检测用*pe和/或*chol标记的脂蛋白。在荧光脂质和蛋白质成像后,根据制造商的说明用苏丹黑染色对凝胶进行染色并重新扫描。使用imagequant 5.1软件进行荧光条带强度的定量分析。将各个像素强度标准化为每个样品的总hdl像素强度。
210.细胞-胆固醇流出能力测定(c-cec)。如先前报道的(gordon,s.m.等人,atherosclerosis,278,278-285,doi:10.1016/j.atherosclerosis.2018.09.032(2018),通过引用以其整体并入本文)进行c-cec测定。简而言之,将j774细胞铺板,用2μci的3h-胆固醇/ml进行放射性标记,并与camp一起孵育以上调abca1。将peg沉淀的血浆加入流出培养基(终浓度2.8%)中4小时。通过使用下式(μci3h-胆固醇)计算流出:((对象血浆中的3h-胆固醇)-(无血浆培养基中的3h-胆固醇)/含有参考血浆汇集物的培养基中的3h-胆固醇)-(无血浆培养基中的3h-胆固醇))。合并的人血浆获自健康志愿者。所有测定以一式两份进行。
211.lc-csh结合和释放的血浆蛋白的评估。为了允许血浆蛋白与lc-csh颗粒的结合,将25μl合并的人血浆(或盐水)、50μl lc-csh和75μl盐水在37℃下孵育30分钟,同时以1200rpm摇动。去除120μl上清液并用120μl新的冷盐水代替。在剧烈移液5次之后,通过离心(2000rpm,2分钟)沉淀lc-csh,去除120μl上清液并用120μl新的冷盐水代替。重复该程序总共5次洗涤。所有洗涤程序在4℃下进行。确定5次洗涤足以消除未结合的血浆蛋白(参见下文)。去除最终的盐水上清液洗涤液,并将120μl盐水加入到洗涤的lc-csh沉淀(30μl体积)中,使得总的最终反应混合物体积为150μl。然后通过在37℃下孵育混合物1小时,同时以1200rpm摇动,使与lc-csh结合的血浆蛋白释放到盐水中。对于溶液内消化(图14c-14e),经由speed-vac浓缩上清液中的蛋白质以获得用于lc-ms/ms分析的足够的蛋白质质量。对于荧光脂质凝胶电泳,通过使用3k过滤器(millipore#ufc500324)离心(10,000rpm,45min)来浓缩上清液中的*pe标记的-hdl,以便增强*pe强度以允许凝胶分析。
212.通过荧光测定法和sds-page电泳评估从lc-csh去除未结合的血浆蛋白的功效。将25μl合并的人血浆、50μl lc-csh和75μl盐水在37℃下孵育30分钟,同时以1200rpm摇动。去除120μl上清液并用120μl新的冷盐水代替。在剧烈移液5次之后,通过离心(2000rpm,2分钟)沉淀lc-csh,去除120μl上清液,并再次用120μl新的冷盐水代替。该洗涤过程重复多达10次。所有洗涤程序在4℃下进行。在5次洗涤之后,甚至在lc-csh与人血浆预孵育240min之后,上清液中的*pe荧光(未结合lc-csh的*pe)降低至与盐水背景水平相同的水平。为了证实与合并的人血浆预孵育30分钟之后血浆蛋白与lc-csh结合的稳定性,如下制备用于sds-page电泳的样品:将50μl裂解缓冲液(2%sds,10mm dtt在50mm三乙基碳酸氢铵缓冲液(ph8.5)中)加入到洗涤(1-10次)和未洗涤的lc-csh以及1μl合并的人血浆中(作为参考对
照)。提取样品,并在95℃下在裂解缓冲液中变性5min,同时以600rpm摇动。从上清液获得30μl的裂解物,并与10μl的4x nupage样品缓冲液(invitrogen#np0007,carlsbad,ca,usa)在95℃下孵育5分钟。将40μl的每个样品上样到novex nupage 4-12%bis-tris gel 1.5mm(invitrogen#np0335)上,并在室温下用nupage mops运行缓冲液(invitrogen#np0001)在200v下运行50分钟。seeblue plus2预染色的标准品(invitrogen#lc5925)用作蛋白质大小标志物。在凝胶电泳之后,蛋白质条带用考马斯亮蓝(cbb:1g r-250,400ml甲醇,100ml乙酸和500ml双蒸水)染色30分钟,然后脱色过夜(200ml甲醇,100ml乙酸和700ml双蒸水)。在5次或更多次盐水洗涤之后,凝胶上的apoa-i条带保持不变,而白蛋白和其它蛋白条带与未洗涤的对照相比降低至最小。通过凝胶内蛋白质组分析鉴定了apoa-i和白蛋白(未显示)。这些发现表明5次洗涤最佳地去除污染的上清液蛋白和*pe,从而允许与*pe流出相关的lc-csh结合和释放的血浆蛋白的蛋白质组分析。
213.凝胶内蛋白质组分析。与lc-csh结合的洗脱的血浆蛋白进行sds-page,并且用cbb对凝胶进行染色。切下蛋白质条带,然后脱色、还原、烷基化并用胰蛋白酶(promega,v511a测序级;madison,wi,usa)消化过夜。使用c18 ziptips,根据制造商的方案(ztc18s096,millipore sigma,merck kgaa,darmstadt,germany),将消化的肽脱盐、浓缩和纯化,并转移到样品小瓶中(c4011-13,thermo scientific,waltham,ma,usa)用于质谱分析。
214.溶液内蛋白质组分析。将全血浆蛋白、lc-csh结合蛋白和浓缩的lc-csh释放蛋白溶解在100μl裂解缓冲液(在50mm teab中的7m尿素/2m硫脲)中。bradford蛋白质测定(23200,thermo scientific pierce)用于测量每个样品的蛋白质浓度。将来自每个样品的40μg总蛋白脱脂并使用从先前报道(wessel,d.&flugge,u.i.,anal biochem,138,141-143,doi:10.1016/0003-2697(84)90782-6(1984),通过引用以其整体并入本文)修改的氯仿/甲醇程序浓缩。将脱脂的蛋白质沉淀重悬于100μl的100mm三乙基碳酸氢铵(teab)中,然后还原、烷基化并用胰蛋白酶消化过夜。使用高容量c18 tips,根据制造商的方案(87784,thermo scientific pierce),将消化的肽脱盐、浓缩和纯化,并转移到样品小瓶中用于质谱分析。
215.质谱分析。所有质谱分析实验在与ultimate 3000-nlc(thermo fisher scientific)偶联的orbitrap lumos tribrid上重复进行。在easy-spray c
18
柱(thermo scientific;75μm x 50cm内径,2μm粒度和孔径)上分离肽。通过乙腈+0.1%甲酸的4-35%线性梯度历经125min实现分离。经由easy-spray柱电极向洗脱液施加1.9kv的电喷雾电压。orbitrap lumos以阳离子数据依赖模式操作。在orbitrap中以380-1,500m/z的正常前体质量范围以120k的分辨率进行全扫描ms1。自动增益控制(agc)目标和最大累积时间设置分别被设置为4
×
105和50ms。通过选择强度阈值高于2.5
×
104的最强前体离子用于碰撞诱导解离(cid)-ms2碎裂来触发ms2,其中agc目标和最大累积时间设置分别为5
×
104和50ms。通过具有0.7m/z传输窗的四极,然后在轨道阱中cid碎裂,以及在15k的分辨率下35%的标准化碰撞能量(nce)进行质量过滤。为了提高光谱采集速率,激活了可并行时间。在全扫描之间获得的ms2光谱的数目被限制为3s的占空比。
216.数据处理。使用整合在maxquant(v1.6.2.10,max planck institute of biochemistry)中的andromeda处理原始数据文件。所有峰列表在具有智人分类法的2019年4月发布的uniprotkb/swiss-prot蛋白数据库(20,316个序列)中进行检索,并且用所有序
列的反向拷贝多行索引。以下检索参数是针对10ppm的ms1容差设置的;轨道阱检测到的ms/ms质量容差为20ppm;将酶特异性设置为胰蛋白酶,最多有两个缺失的裂解;最小肽长度为7个氨基酸;半胱氨酸的脲甲基化(carbamidomethylation)设置为固定修饰;并且将甲硫氨酸的氧化设置为可变修饰。在使用诱饵命中分布估计的psm上将数据过滤至1%的错误发现率(fdr)。为了计算每种蛋白质的近似丰度,使用maxquant中提供的基于强度的绝对定量或ibaq算法。ibaq是每种蛋白质的所有鉴定的肽的提取离子强度的总和,通过蛋白质的理论上可观察到的肽的数目标准化。将这些标准化的蛋白质强度转化为基于分析样品中总蛋白质量的蛋白质拷贝数估计。
217.非变性凝胶分析。将等体积的novex tris-甘氨酸非变性样品缓冲液(2x)(thermo fisher scientific)加入到每个样品中,并立即将20.0μl上样到1.0mm厚的novex非变性10-20%tris-甘氨酸wedgewell微型凝胶(thermo fisher scientific)上。非变性凝胶电泳的amersham hmw校准试剂盒(目录号17-0445-01ge healthcare piscataway,nj,usa)用于hdl大小标志物(8.16nm、9.7nm、12.2nm和17nm)。凝胶在35v下运行17小时,使用typhoon 9400可变模式成像仪(ge)对荧光条带进行成像,并使用532/560nm的激发/发射波长检测*pe。
218.共聚焦显微镜。使用来自visitech international(sunderland,uk)的vt-isim成像系统扫描仪在olympus ix 81显微镜上使用olympus uplsapo 100
×
1.49na油物镜和双hamamatsu cmos orca-flash 4照相机获得结构照明显微镜(sim)图像。使用metamorph软件(molecular devices,llc,san jose,ca,usa)控制总采集系统。*pe和*chol荧光分别用561nm和488nm激光激发,并且发射光分别使用长传590nm和500-550nm发射过滤器在照相机之前过滤。对于总共30-36个单独的平面,在100nm的切片间距处拍摄3d体积。每个平面的曝光时间为250ms。
219.电子显微镜。薄切片tem:将lc-csh颗粒与10%液化低熔点琼脂糖混合,然后在冰上固化。将包埋的lc-csh保持在4℃过夜,然后在4℃下固定在含2.5%戊二醛/1%多聚甲醛的0.12m二甲胂酸钠缓冲液(ph7.4)中过夜。将固定的样品在二甲胂酸盐缓冲液中洗涤,在二甲胂酸盐缓冲液中的1%oso4中后固定,洗涤,用乙酸铀酰整体染色,乙醇脱水,以及embed-812包埋(electron microscopy sciences,hatfield,pa,usa)。在用配备有amt xr-111数码相机(advanced microscopy techniques corp,woburn,ma,usa)的jem1400电子显微镜(jeol usa,peabody,pa,usa)成像之前,用乙酸铀酰和柠檬酸铅对薄切片进行染色。阴性染色:用pbs样品缓冲液将lc-csh颗粒稀释至0.6mg/ml。将3μl样品溶液置于每个fcf300h-cu(electron microscopy sciences,pa,usa)网格上,并在室温下放置1分钟。随后使用滤纸将网格吸干,用过滤的蒸馏水洗涤三次,然后用2%乙酸铀酰(electron microscopy sciences)染色20秒。然后用滤纸吸干网格以去除过量的染色剂,并在室温下放置干燥15分钟。通过fei tecnai t12120kv tem&2k tvips照相机评价样品。
220.动脉粥样硬化负荷评估。使用320-detector row aquilion one vision system(toshiba)进行冠状动脉ct扫描。使用专用软件qangio ct(medis)通过如先前报道的单盲读取器(gordon,s.m.等人,atherosclerosis 278,278-285,doi:10.1016/j.atherosclerosis.2018.09.032(2018))分别评估每个主冠状动脉(左前降支,左回旋支和右冠状动脉)中的冠状动脉斑块负荷。通过将总血管斑块体积除以总血管长度来计算斑
块体积指数(mm2),并针对管腔衰减进行调整。总斑块负荷定义为钙化斑块负荷和非钙化斑块负荷的总和。
221.临床研究群体。临床研究i、ii和iii分别包括84名、76名和217名对象。对于临床研究i,在us群组研究中使用的血清包括84名心血管疾病(cvd)患者,其是作为先前报道的正在进行的群组研究(#12-h-0141)的一部分招募的(gordon,s.m.等人,atherosclerosis 278,278-285,doi:10.1016/j.atherosclerosis.2018.09.032(2018))。对于临床研究ii,包括来自方案#12-h-0141的另外76名cvd对象。招募了严重的cad病例(n=40)和良好匹配的无cad病例(n=36)。严重的cad被定义为基于血管造影结果(cad-rads 5)具有完全冠状动脉闭塞的患者,并且无cad被定义为无显著狭窄或最小狭窄的人(cad-rads 0或cad-rads 1)。这些对象(临床研究i和ii)包括至少18岁,具有冠状动脉ct血管造影(ccta)检查的临床适应症,并且没有另外的纳入标准的男性和女性。这些研究方案得到了国家心脏、肺和血液研究所机构审查委员会的批准,并且所有对象在登记时提供了知情同意。clinicaltrials.gov标识符:nct01621594。对于临床研究iii,作为另外的族群研究,包括由cad病例(n=63)和无cad(n=154)组成的217名日本群组的对象。这些对象包括至少20岁,患有生活方式相关的疾病或处于生活方式相关的疾病的风险中,没有另外的纳入标准的男性和女性。基于冠状动脉造影评价cad。这项研究方案(c17-r007、122、142和158)得到了自治医科大学的伦理委员会的批准,并且所有对象在登记时提供了知情同意书。
222.统计分析。使用偏度和峰度测量来评估正态性。数据分别表示为参数变量和非参数变量的平均值
±
标准偏差或中值(四分位距),以及分类变量的n(%)。p值源自用于参数变量的单个未配对双尾t检验和用于非参数变量的曼-惠特尼(mann-whitney)检验。fisher精确检验用于分类变量。使用皮尔逊相关系数与95%置信区间和p值通过散点图评价两个变量之间的关系。进行双变量或多变量线性回归分析以评估hdl流出值(c-cec或hdl-spe)与临床和实验室参数(包括ccta斑块参数)之间的关系。对非正态分布的数据进行对数变换。传统的风险因素如年龄、性别、bmi、收缩压、脂质参数、hs-crp、降脂治疗、高血压和糖尿病根据它们在每个临床研究中的可用性被包括用于多变量线性回归分析。结果报告为标准化的β系数与95%置信区间和p值。为了评价hdl-蛋白与hdl-spe或c-cec的关联,如先前报道的(gordon,s.m.等人,atherosclerosis 278,278-285,doi:10.1016/j.atherosclerosis.2018.09.032(2018))使用r中的pls进行偏最小二乘回归(plsr)分析。根据其变量投影重要性(vip)评分对蛋白质进行排名,最强的关系被定义为vip≥1.3。在临床研究ii中,对照在种族,性别,体重指数,2型糖尿病,当前吸烟者,甘油三酯,hdl-相关参数(血浆hdl胆固醇、hdl颗粒数目、hdl大小和apoa-i),nmr参数(ldl颗粒数目、ldl大小、vldl颗粒数目和vldl大小),血浆apo-b,hs-crp水平和冠状动脉旁路移植术(cabg)方面良好匹配,但在年龄、agatston评分、降脂治疗和ldl胆固醇方面并不是良好匹配的。进行接受者操作特性(roc)曲线分析以评价hdl-c或c-cec或hdl-spe对cad患者辨别能力的贡献。数据表示为具有95%置信区间的曲线下面积(auc)。通过至roc曲线左上角的最小距离计算提供最佳灵敏度和特异性对的最佳截止点。双变量或多变量逻辑回归分析用于评估每个hdl-c、c-cec或hdl-spe中的标准偏差增量的cad的粗略优势比或经调整的优势比。包括传统的风险因素用于如上所述的调整。在所有分析中,p值《0.05被认为是统计学显著的。使用stata/ic 12.0(statacorp lp,college station,tx,usa)和ezr1.40版(自治医科大学,
tochigi,japan)进行统计分析。ezr是r命令实用程序的改进版本,并且包括在具有“100%clean”软件奖的softpedia软件数据库中(softpedia.com/get/science-cad/ezr.shtml)。结果
223.无细胞磷脂流出测定的开发。先前显示了apoa-i溶解来自不可交换性带头基标签的丽丝胺罗丹明磷脂酰乙醇胺(*pe)和bodipy-胆固醇(*chol)标记的脂质囊泡的脂质以形成含有*pe、*chol和apoa-i的前β-hdl样颗粒,以及囊泡衍生的*pe在体外和体内均特异性地掺入血浆hdl中。基于这些发现,开发了hdl-spe测定,其中脂质包被的水化硅酸钙晶体(lc-csh)用作荧光*pe至血浆hdl的供体,并且可以在反应结束时通过离心容易地与血浆分离。除了带荧光标签的脂质外,还用比例为2:1的二肉豆蔻酰磷脂酰胆碱和胆固醇包被lc-csh,发现这促进了脂质流出过程。
224.在本文中,提供了使用高通量hdl-spe测定从lc-csh到人全血浆中脂蛋白的磷脂流出的apoa-i/hdl特异性。hdl-spe(i)依赖于血浆体积(图12a),(ii)与琼脂糖凝胶上的hdl*pe像素强度高度相关(图12b),(iii)在其中几乎不存在hdl的家族性卵磷脂胆固醇酰基转移酶缺乏症(fld)患者的血浆中显著降低(图12c),以及(iv)主要对分离的hdl具有特异性,而对分离的ldl或vldl不具有特异性(图12d)。在低血浆样品体积下,hdl-spe依赖性是线性的,但在较高浓度下显示饱和。hdl-spe饱和可能是由于lc-csh表面上hdl蛋白的结合位点的饱和,如下所示。hdl-spe是温度依赖性的,因此是能量依赖性的过程(图13),与hdl组分的结合和释放一致。相比之下,非特异性胆固醇流出能力(ns-cec)更线性,并且在测试剂量下确实显示出显著的饱和(图12a)。此外,与hdl-spe不同,正常和fld血浆中的ns-cec几乎相同(图12c)。这些发现表明不同的机制构成hdl-spe和ns-cec的基础,即分别为apoa-i/hdl介导的供体颗粒*pe的结合和去除相对供体颗粒*chol向所有血浆脂蛋白的扩散。
225.可交换hdl载脂蛋白介导hdl-spe。对hdl-spe期间形成的颗粒进行了进一步的表征,并鉴定了从lc-csh流出*pe的hdl相关蛋白。在以下实验中选择25μl血浆样品,因为它提供了次于最大但稳健的荧光pe信号。如图14a所示,血浆介导的*pe从lc-csh流出的量随时间增加,但仅在最初45分钟内是线性的。lc-csh首先与人血浆(但不是盐水)预孵育,随后在37℃下1小时之后使*pe流出至盐水(图14b)。这些发现与模型一致,其中在该过程中,最初结合lc-csh的血浆蛋白随后被释放并去除*pe。在与人血浆预孵育30分钟(其是使lc-csh结合位点饱和的足够时间)(图14b)后,琼脂糖凝胶电泳显示从lc-csh释放的*pe仅与hdl缔合并含有极少的中性核心脂质(甘油三酯和胆固醇酯),如弱的苏丹黑染色所示。此外,非变性凝胶脂蛋白电泳显示大部分小的*pe标记的hdl样颗粒(≤9.7nm)从lc-csh释放。粒径分布在上清液和释放的汇集物中是类似的。值得注意的是,与原始血浆相比,在上清液和释放的汇集物中都有较大尺寸hdl的伴随损失。如果apoa-i和可能的其它hdl相关的可交换载脂蛋白(已知其从hdl中连续释放)与lc-csh结合,溶解lc-csh脂质,随后作为小的*pe标记的载脂蛋白从lc-csh中释放,则这些发现是容易解释的。蛋白质组分析确实证实了可交换的hdl相关蛋白,主要是apoa-i,还有apoa-ii和apoc-iii,以及apoa-iv均与lc-csh结合,然后从lc-csh释放(图14c-14e)。值得注意的是,apoa-iv是lc-csh释放的汇集物中最高度富集的一种,与先前报道的一致:血浆apoa-iv容易从hdl中置换,增强c-cec,而且与cad呈负相关。相比之下,apoe是一种尺寸较大的可交换蛋白,并且更牢固地结合脂蛋白,在与lc-csh结合
的蛋白中富集,但在随后从lc-csh释放的蛋白中未检测到。白蛋白(最丰富的血浆蛋白)在结合的和释放的蛋白中的丰度几乎比apoa-i少20倍,显示了hdl相关蛋白与lc-csh结合和释放的特异性。极少的血浆apob与lc-sch结合,并且在释放的级分中几乎没有发现,这与通过琼脂糖凝胶分析观察到的ldl的*pe标记的缺乏和该蛋白质的相对不可交换性一致。apoa-i和其它可交换的载脂蛋白必须首先从hdl解离,结合lc-csh颗粒的表面,然后与lc-csh衍生的脂质(包括小的脂化载脂蛋白颗粒形式的*pe和*chol)一起释放到上清液中。
226.通过ccta将hdl-spe与cad关联。检查hdl-spe和c-cec测定与cad,即已经经历冠状动脉计算机断层血管造影术(ccta)(临床研究i)的84名已知心血管疾病(cvd)对象的群组的关联。该群组有43%的男性,平均年龄为60.4岁,并且通常是血脂正常的。琼脂糖凝胶电泳显示lc-csh*pe特异性地掺入所有84名对象的血清hdl,这与*pe掺入血浆hdl的特异性一致。与使用合并的人血浆的研究一致(图12b),hdl-spe也与hdl*pe凝胶像素强度高度相关(r=0.68)和显著相关(p=7.3
×
10-13
)(图15a和15b)。因此,验证了人血清和血浆中lc-csh*pe向hdl流出的特异性。
227.hdl-spe和c-cec(图16a)彼此之间仅适度相关(r=0.33),这可能是由于它们各自流出过程的不同机制。然而,hdl-spe和c-cec均与hdl-c(图16b)、hdl颗粒数目(图16c)和apoa-i(图16d)相关。甚至在针对年龄、性别、bmi和降脂治疗调整之后,hdl-spe与hdl-c、hdl-p和apoa-i保持高度显著的相关性。相比之下,这些参数仅与c-cec适度相关(图16b-16d)。在c-cec与这些hdl参数之间观察到的更适度的相关性与在jupiter试验中针对巢式病例(cvd)对照研究所报道的那些非常类似。
228.临床研究i中84名对象的hdl蛋白质组分析揭示了apoa-i与hdl-spe和c-cec的关联最强(图16e);然而,与图16d一致,与c-cec相比,在hdl-spe的情况下,相关性强度高约2倍。此外,与介导hdl-spe的血浆蛋白的蛋白质组分析一致,apoa-i、apoc-iii和apoa-iv均与临床研究i中84名对象的血清中的hdl-spe强相关。这些发现也与先前观察一致,即这些可交换载脂蛋白在体外介导表达abca1的细胞的磷脂流出。
229.然后比较hdl-spe和c-cec测定预测该群组中冠状动脉斑块负荷的能力(图16f-16i)。先前已显示c-cec与银屑病患者的动脉粥样硬化非钙化斑块负荷呈负相关。在冠状血管中,测量非钙化、致密钙化和总斑块负荷(分别为ncb、dcb和tb)。双变量分析揭示了hdl-spe和c-cec与总斑块负荷(图16f)和非钙化斑块负荷(图16g)呈负相关,但与dcb不呈负相关(图16h)。与c-cec相比,在hdl-spe的情况下,tb与ncb之间的相关性显示出显著更大的统计显著性。多变量回归分析揭示了在针对年龄、性别、收缩压、ldl-c、tg、高敏(hs)crp和降脂治疗调整之后,hdl-spe与tb和ncb保持显著负相关,而在该群组中,c-cec则没有。双变量分析揭示了针对bmi和hdl-c的调整消除了c-cec与tb和ncb的关联。相比之下,hdl-spe与tb和ncb的关联不依赖于bmi和hdl-c。由于ncb反映斑块脂质负荷,因此hdl-spe与ncb的负相关可反映apoa-i在体内去除动脉斑块脂质的能力。
230.hdl-spe可以检测功能障碍的hdl,并预测严重的cad。在该研究(临床研究ii)中包括另外76个严重的cad病例(n=40)和良好匹配的无cad对象(n=36)。严重的cad被定义为cad-rads 5(完全冠状动脉闭塞),并且无cad被定义为cad-rads 0/1(无明显狭窄/最小狭窄)。无cad和cad对象在性别、bmi、hdl临床参数(apoa-i、hdl-c和hdl颗粒数目和大小)方面良好匹配,但在年龄、降脂治疗或ldl-c方面则不是。hdl-spe和cad呈显著负相关(p=
0.004),roc分析显示与无cad相比,hdl-spe预测严重cad的最佳临界点为0.99。auc为0.66,灵敏度为65%,以及特异性为64%(图17a)。多因素逻辑回归分析揭示了hdl-spe,而不是c-cec,可以预测该群组中的cad,甚至在针对年龄和降脂治疗、ldl-c和降脂治疗、或hdl-c和apoa-i调整之后亦如此(图17b)。hdl-spe在针对hdl-c和apoa-i调整之后也可预测cad,表明hdl-spe的负关联不依赖于这些参数。该发现表明hdl-spe可以检测功能障碍的apoa-i/hdl。
231.hdl-spe,而不是hdl-c,可以预测日本人群组中的cad。在本研究中使用的日本人群组(n=217)包括cad(n=63)和无cad对象(n=154),并且基于标准冠状动脉血管造影术(临床研究iii)评价cad。cad和无cad对象在年龄、性别、高血压、降脂治疗、糖尿病和lcl-c方面有显著差异。在cad对象相对无cad对象中没有观察到hdl-c的显著差异。然而,在cad对象中hdl-spe显著降低。hdl-spe值呈正态分布,并且范围为0.65-1.49相对单位(图18a)。感兴趣的是,23.8%的cad/0%的无cad对象具有hdl-spe≤0.87,而15.7%的无cad/0%的cad对象具有hdl-spe≥1.19。hdl-spe测定的潜在临床适用性通过以下观察结果而被突出:流出值没有在较低范围内下降或在最高值达到饱和(图18a)。
232.hdl-c与hdl-spe强相关(图18b)。然而,hdl-spe,而不是hdl-c,在该群组中与cad呈显著负相关。roc分析显示,与无cad相比,hdl-spe预测严重cad的截止点为1.03,auc为0.82,灵敏度为70.3%,以及特异性为73.4%(图18c)。hdl-spe与cad的负关联仅略有降低,并且在针对年龄、性别和ldl-c以及降脂疗法(模型1)、或高血压和糖尿病(模型2)调整之后保持高度统计学显著性(图18d)。
233.然后通过将hdl-c《60mg/dl的对象与hdl-c≥60mg/dl的对象进行比较,评价cad相对无cad对象中的hdl-c与hdl-spe的关联。基于在亚洲cad群组中的先前观察选择该截止值,即hdl-c》60mg/dl与cvd死亡率的风险增加以及c-cec降低有关。在日本人群组中,hdl-c《60mg/dl和hdl-spe在两种病例和对照中均显著相关(图18e)。hdl-spe与cad的负关联是高度显著的(图18f),甚至在针对传统风险因素进行调整之后亦如此。在hdl-c《60mg/dl对象中,hdl-c也以临界统计显著性与cad呈负相关(图18f)。相比之下,尽管hdl-c≥60mg/dl和hdl-spe在无cad对象中相关,但在cad病例中hdl-spe与hdl-c之间完全没有相关性(图18g),甚至在针对传统风险因素和生物标志物进行调整之后亦如此。
234.hdl-spe与cad(图18h)的负关联即使在进行与图18f中相同的调整之后也是高度显著的。值得注意的是,在hdl-c≥60mg/dl对象中hdl-c与cad没有关联(图18h)。因此,hdl-spe可以在hdl-c≥60的病例中预测cad,不依赖于hdl-c,这再次与hdl-spe测定检测功能障碍hdl的能力一致。讨论
235.hdl-c目前被用于评估cad风险,但其局限性在于在hdl-c与心血管事件之间存在复杂的抛物线(parabolic)关系,并且已知其作为基于功能的hdl测定(如c-cec)的风险标志物是较差的。本文描述了能够容易自动化地基于全血浆中的apoa-i/hdl功能性来评估cad风险的无细胞的hdl特异性磷脂流出测定(hdl-spe)。证实了hdl-spe确实由apo-ai和其它可交换载脂蛋白(a-ii、a-iv、c-iii)介导。载脂蛋白a-i和其它载脂蛋白介导hdl-spe所必需的步骤包括它们(i)从血浆hdl中解离,(ii)与lc-csh结合,以及(iii)lc-csh脂质的溶解和随后作为*pe标记的载脂蛋白颗粒释放。载脂蛋白从hdl中解离是hdl-spe测定中必不
可少的允许步骤,先前已显示其与动脉粥样硬化和cad相关。从lc-csh释放的*pe-载脂蛋白颗粒可能类似于在体内通过apoa-i与abca1产生的细胞膜脂质结构域的相互作用生成的前β-hdl颗粒的类型。胆固醇和可能的磷脂酰乙醇胺可以在供体颗粒脂质膜表面产生包装缺陷,这使得载脂蛋白结合和随后的供体颗粒脂质的溶解成为可能。此外,csh晶体具有高曲率区域,这也可能有助于产生这些潜在的包装缺陷。
236.在三个临床群组中对hdl-spe测定的评价表明,它不仅相对于c-cec测定,而且相对于更常规的hdl测量增加了cad预测的值,如apoa-i、hdl-c和hdl颗粒数目和大小。在临床研究i中,与c-cec相比,apoa-i血浆浓度、hdl-c和hdl颗粒数目与hdl-spe的相关性更高且更显著。相反,ldl相关的临床参数与hdl-spe不相关。此外,在临床研究ii中,hdl-spe是不依赖于apoa-i血浆浓度、hdl-c和hdl颗粒数目的cad的强逆预测物。hdl-spe,而不是hdl-c,预测日本人群组中的cad。总之,这些发现强烈地表明hdl-spe与cad风险的负关联是基于其检测hdl功能的能力。hdl-spe,而不是c-cec,与总斑块负荷和非钙化斑块负荷(ncb)显著成反比,甚至在针对传统风险因素进行调整之后亦如此。已经显示c-cec测定在预测意外的cvd事件方面优于hdl-c,并且类似地,hdl-spe也可以用于该目的,但与c-cec测定不同,它可以发展成常规测试。
237.本文引用的所有参考文献,包括出版物、专利申请和专利,均通过引用并入本文,其程度如同每篇参考文献均被单独且具体地指示为通过引入并入本文并在本文整体阐述。
238.在描述本发明的上下文中(尤其是在所附权利要求的上下文中)术语“一个”和“一种”和“该”和“至少一种”以及类似指代物的使用应被解释为涵盖了单数和复数两种,除非本文另有说明或与上下文明显矛盾。术语“至少一种”之后是一项或多项的列表(例如,“a和b中的至少一种”)的使用应理解为意指选自所列项(a或b)的一项或所列项(a和b)的两种或多种的任何组合,除非本文另有说明或与上下文明显矛盾。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应被解释为开放式术语(即,意指“包括但不限于”)。除非在本文中另外指出,否则本文中数值范围的叙述仅旨在用作分别指代落入该范围内的每个单独值的简写方法,并且每个单独值都被并入说明书中,就好像它在本文中被单独叙述一样。除非本文另外指出或另外与上下文明显矛盾,否则本文描述的所有方法可以以任何适合的顺序执行。除非另外要求保护,否则本文提供的任何和所有示例或示例性语言(如,“诸如”)的使用仅旨在更好地阐明本发明,并且不对本发明的范围构成限制。说明书中的任何语言都不应解释为指示任何未要求保护的要素对于实施本发明必不可少。
239.本文描述了本发明的优选实施方案,包括发明人已知的用于实施本发明的最佳模式。在阅读前述说明书之后,那些优选实施方案的变型对于本领域普通技术人员而言将变得显而易见。本发明人期望熟练的技术人员适当地采用这样的变型,并且本发明人有意以不同于本文具体描述的方式来实践本发明。因此,本发明包括适用法律所允许的所附权利要求书中记载的主题的所有修改和等同物。此外,除非本文另外指出或另外与上下文明显矛盾,否则本发明涵盖上述要素在其所有可能的变型中的任何组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1