用于治疗副蛋白血症性神经病的方法的补体系统的拮抗剂与流程
1.本发明涉及使用补体系统的拮抗剂来治疗副蛋白血症性神经病的方法。所述拮抗剂阻断或抑制补体因子c5上游的补体系统。可被治疗的副蛋白血症性神经病特别地包括多灶性运动神经病(multifocal motor neuropathy,mmn)、慢性炎性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy,cidp)和吉兰-巴雷综合征(guillain-barr
éꢀ
syndrome,gbs)。
背景技术:
2.补体系统是固有免疫系统的重要方面,其增强(补充)抗体和吞噬细胞从生物体中清除微生物入侵者和受损细胞的能力。因此,补体形成了抵御感染的重要防线。
3.对感染的响应必须足够快速和全面以防止对宿主造成风险,但要有足够的选择性以避免损害健康细胞。补体通常通过采用多于30种可溶性并且在表面表达的蛋白的分层式和紧密调节的级联系统来实现这种微妙的平衡。补体因子作为无活性的前体蛋白在血液中循环。对系统的激活导致激活级联,其中一个因子通过特异性蛋白水解级联中更下游的补体蛋白来激活后续的一个因子。这种级联最终可导致:产生吸引和激活巨噬细胞和白细胞的过敏毒素;形成裂解性攻膜复合物(membrane attack complex,mac);和调理靶标以进行吞噬作用和破坏。
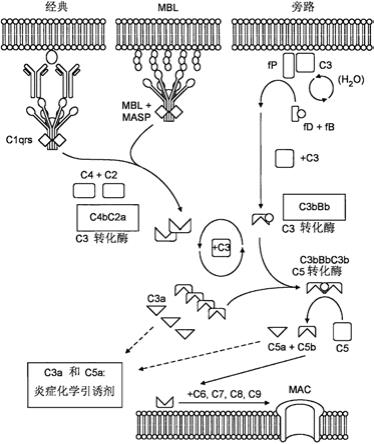
4.补体系统的激活可通过三种途径发生:经典途径;凝集素途径;和旁路途径(参见图1)。每种途径均激活中心组分c3,导致激活共同终止途径,进而导致形成mac(muller-eberhrd,annu rev biochem 1988,57:321)。经典途径通常被称为抗体依赖性途径,因为它由igm或igg簇有力地启动。该途径通常当六聚体c1q与抗体/抗原复合物中存在的igg或igm分子的fc区结合时被激活。在结合之后,c1s切割c4以产生c4a和c4b。接下来,c2与表面结合的c4b结合(在存在下mg
2+
的情况下)以形成c4bc2复合物,所述c4bc2复合物然后被活化的c1s切割成两个片段:较小的30kda片段c2b和较大的70kda片段c2a,片段c2a保持与c4b连接以形成c4bc2a经典途径c3转化酶。c3转化酶能够将c3切割成c3a(过敏毒素;增强炎症)和c3b,从而启动扩增和下游效应物功能。
5.凝集素途径的激活是由甘露糖结合凝集素(mannose-binding lectin,mbl)或纤胶凝蛋白与在病原体或微生物表面上表达的细菌性碳水化合物基序的结合来介导的。mbl结合随后刺激mbl相关丝氨酸蛋白酶-1(mbl-associated serine proteinase-1,masp-1)和masp-2的激活,导致c4和c2的切割,从而导致产生c4bc2a凝集素途径c3转化酶。
6.可认为旁路途径是无论初始触发如何都会被接合的扩增环路。c3b与受损组织、外来物质或微生物的细胞表面上的靶标直接结合。然后表面结合的c3b可结合因子b形成c3bb。这种复合物在存在因子d的情况下被切割成ba和bb。bb保持与c3b缔合以形成c3bbb,其是旁路途径c3转化酶。
7.因此,这三种途径在中央c3转化酶处汇合。c3转化酶c4bc2a或c3bbb与另外的c3b分子形成多聚体复合物,分别产生c5转化酶c4bc2ac3b和c3bbbc3b。这些酶优先切割补体因
子c5,释放c5a(过敏毒素,增强炎症)和片段c5b。c5b募集c6和c7并与之缔合;复合物插入到细胞膜中并与c8相互作用;这诱导c9分子的多个单元的结合以形成c5b-9攻膜复合物(mac)或可溶性末端补体复合物(terminal complement complex,tcc)。mac通过将自身插入到细胞膜中而形成孔,主要导致无核细胞(例如老化的红细胞和某些革兰氏阴性菌)的细胞裂解。然而,在有核细胞上,mac形成受到严格调节,并且其裂解作用可被离子泵抵消。此外,mac的亚裂解水平可诱导宿主细胞的损伤或活化并用作促炎介质。除mac介导的级联作用之外,过敏毒素c3a和c5a还可用作强效免疫调节剂,将免疫细胞募集到激活部位。调理素c3b和c4b还可与多种补体受体结合并介导免疫复合物去除、吞噬作用或刺激b细胞响应。
8.补体系统还受许多补体调节蛋白的控制。这些包括抑制经典和凝集素途径的起始步骤的c1抑制剂;解离c3转化酶的因子h;降解c4b和c3b的因子i;以及抑制mac形成的血浆蛋白玻连蛋白(vitronectin)和簇集蛋白(clusterin)以及膜蛋白cd59(sahu et al.,immunol res 1998,17:109;campbell at al.,annu rev immunol 1988,6:161)。
9.虽然补体形成了抵御病原生物体的重要防线,但是如果控制不当,这些抵御功能可能转而针对宿主细胞并诱导或加剧免疫性、炎性和退行性病症。当补体过度激活(如发生在自身免疫病或具有功能失调的调节蛋白的对象中)时,它在许多器官中引起严重的炎性响应(noris and remuzzi,semin nephrol 2013,33(6):479-492)。鉴于补体蛋白在整个身体中的普遍表达,认为补体系统可以在具有免疫组分的许多疾病,例如炎性疾病、退行性疾病、癌症和移植排斥中发挥作用。补体系统也越来越多地与中枢神经系统疾病例如阿尔茨海默病相关(carpanini et al.,front immunol 2019,10:362)。
10.补体作为外来或受损物质的初始检测器和免疫应答的下游协调者二者的独特地位使补体成为具有吸引力的治疗性靶标。事实上,目前报道了针对多于十多种不同补体靶标的抑制剂的临床开发计划。
11.已产生了数种可溶性补体抑制剂。c1-inh(多个制造商)目前被批准用于治疗遗传性血管性水肿,并且正在其他病症例如脓毒症和缺血-再灌注损伤中进行评估。然而,c1-inh是广泛的丝氨酸蛋白酶抑制剂,其阻断经典和凝集素途径二者的初始蛋白酶以及凝结和接触系统的非补体蛋白酶。相比之下,苏替莫单抗(sutimlimab,也称为bivv009,以前称为tnt009)是被设计成通过靶向c1s选择性地抑制经典补体途径的人源化单克隆抗体,并且在溶血性贫血和冷凝集素病的治疗中显示出前景。还开发了抑制级联中的关键蛋白质的其他抗体。annexon开发了作用于c1q水平用于神经退行性病症和自身免疫病的单克隆抗体(anx005),而omeros开发了针对masp-2的单克隆抗体(oms721),作为用于治疗非典型溶血性尿毒综合征(atypical haemolytic uremic syndrome,ahus)的临床候选物。
12.在补体级联的另一端起作用的是依库丽单抗(eculizumab)其是抗c5抗体,目前被批准用于治疗阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,pnh)和ahus。该抗体结合c5上的位点,阻止其被c5转化酶激活,从而削弱c5a的释放和mac的形成。还评价了抗c5a抗体(ifx-1)以及已显示出作为多种病症的潜在治疗的前景的许多小分子c5ar1拮抗剂(pmx53;pmx205;ccx186)。
13.还开发了靶向补体级联的c2蛋白的抗体。国际专利申请号wo2014/189378描述了具有特定的c2活性抑制特性的结合分子,例如抗体。这样的结合分子被描述为可用于治疗多种人疾病,例如炎性疾病或缺血-再灌注损伤的症状。
14.尽管为开发靶向补体级联的治疗剂做出了显著努力,但补体抑制剂的临床成功仍然有限。这很可能是由于补体级联的复杂性。仍需要更好地了解过度活跃的补体活性在多种病症中的作用,以开发基于补体抑制的有效治疗。
技术实现要素:
15.本发明人已发现,靶向补体因子c5上游的补体级联很可能是治疗副蛋白血症性神经病,特别是神经病例如多灶性运动神经病(mmn)、慢性炎性脱髓鞘性多发性神经病(cidp)和吉兰-巴雷综合征(gbs)的有效策略。副蛋白血症性神经病是特征为血清中存在“副蛋白”的周围神经病。副蛋白是由b淋巴细胞或浆细胞的异常克隆增殖相对过量产生的特定类型的单克隆抗体或免疫球蛋白。与正常免疫球蛋白抗体不同,副蛋白通常不能抵抗感染。
16.如本文中报道和示例的,补体系统在副蛋白血症性神经病的病理学中发挥重要作用。特别是,发现来自患有mmn、cidp和gbs的患者的血清通过施万细胞(schwann cell)和运动神经元二者的在体外的调理作用激活补体。重要的是,本文中呈现的结果进一步证明施万细胞和运动神经元表达高水平的补体调节蛋白cd59,其是阻止攻膜复合物(mac)末端聚合的因子。结果还显示施万细胞对补体介导的裂解具有抗性。总之,这表明在副蛋白血症性神经病中,存在针对补体介导的裂解的保护作用,并且观察到的病理状况很可能是mac独立性的,即由mac上游的补体蛋白引起。因此,本发明涉及通过靶向补体因子c5上游的补体系统来治疗副蛋白血症性神经病。
17.在第一方面中,本发明提供了在对象中治疗副蛋白血症性神经病的方法,该方法包括向对象施用补体系统的拮抗剂,其中该拮抗剂抑制补体因子c5上游的补体系统。本发明还提供了用于在对象中治疗副蛋白血症性神经病的补体系统的拮抗剂,其中该拮抗剂抑制补体因子c5上游的补体系统。
18.在某些实施方案中,拮抗剂抑制经典补体途径和/或凝集素补体途径。
19.在某些实施方案中,副蛋白血症性神经病是脱髓鞘性神经病。
20.在某些实施方案中,副蛋白血症性神经病的特征在于存在igm、iga或igg免疫球蛋白。
21.在某些实施方案中,副蛋白血症性神经病的特征在于存在自身抗体。自身抗体可以是igm、iga或igg类的免疫球蛋白。
22.在某些实施方案中,副蛋白血症性神经病的特征在于存在针对神经抗原的自身抗体。神经抗原可以是神经节苷脂或者神经抗原可以是髓鞘相关糖蛋白(myelin-associated glycoprotein,mag)。对于其中神经抗原是神经节苷脂的一些实施方案,神经节苷脂可选自gm1、gm1b、gm2、gm3、gd1a、gd1b、gd2、gd3、gt1a、gt1b、gt3和gq1b。在某些优选实施方案中,神经节苷脂是gm1。
23.在某些实施方案中,副蛋白血症性神经病选自:多灶性运动神经病(mmn)、慢性炎性脱髓鞘性多发性神经病(cidp)、吉兰-巴雷综合征(gbs)、米勒费希尔综合征(miller fisher syndrome)、急性运动轴突性神经病(acute motor axonal neuropathy,aman)、急性运动和感觉轴突性神经病(acute motor and sensory axonal neuropathy,amsan)、慢性共济失调性神经病-眼肌麻痹-igm副蛋白-冷凝集素-二唾液酸抗体(canomad)综合征、远端获得性脱髓鞘性对称性(distal acquired demyelinating symmetric,dads)神经病、单
克隆丙种球蛋白病相关周围神经病、抗mag周围神经病和poems综合征。在某些优选实施方案中,副蛋白血症性神经病是多灶性运动神经病(mmn)、慢性炎性脱髓鞘性多发性神经病(cidp)或吉兰-巴雷综合征(gbs)。副蛋白血症性神经病优选地为多灶性运动神经病(mmn)。
24.在某些实施方案中,拮抗剂抑制补体因子c3上游的补体系统。在某些实施方案中,拮抗剂抑制c1、c1q、c1r或c1s。在某些实施方案中,拮抗剂抑制补体因子c2、c2a或c2b。在某些实施方案中,拮抗剂抑制补体因子c3、c3a或c3b。在某些实施方案中,拮抗剂抑制补体因子c4、c4a或c4b。
25.在某些实施方案中,拮抗剂选自:抑制性rna物质,例如sirna或shrna;小分子抑制剂;生物拮抗剂,例如抑制性肽或抗体模拟物例如亲和体(affibody)、affilin、affitin、adnectin、atrimer、evasin、darpin、抗运载蛋白(anticalin)、高亲合性多聚体(avimer)、fynomer、versabody或duocalin;或者抗体或其抗原结合片段。
26.在某些实施方案中,拮抗剂选自:坎普他汀cp40(amyndas);peg-cp40(amyndas);amy-101(amyndas);amy-201(amyndas);apl-1和apl-2(apellis);cinryze(shire);cdx-1135(celldex);apt070米考西普(mrc);hc3-1496(incode);萘莫司他(torii pharmaceutical);和痘苗病毒补体控制蛋白(vcp)。
27.在一些优选实施方案中,拮抗剂是抗体或其抗原结合片段,优选igg抗体或其抗原结合片段。
28.在某些实施方案中,抗原结合片段选自:抗体轻链可变结构域(vl)、抗体重链可变结构域(vh)、单链抗体(scfv)、f(ab’)2片段、fab片段、fd片段、fv片段、单臂(单价)抗体、双抗体、三抗体、四抗体、单价体(unibody)、结构域抗体和纳米抗体(nanobody)。
29.在某些实施方案中,抗体或其抗原结合片段与补体因子c1、c1q、c1s、c2、c2a、c2b、c3、c3a、c3b、c4、c4a或c4b结合。
30.在某些实施方案中,抗体或抗原结合片段选自:苏替莫单抗(bioverativ);anx005(annexon);mab h17(elusys therapeutics);和tnt003(true north)。
31.在某些实施方案中,抗体或抗原结合片段与补体因子c2结合。在某些实施方案中,抗体或抗原结合片段与补体因子c2的c2b结构域结合。
32.在某些实施方案中,抗体或抗原结合片段包含可变重链结构域(vh)和可变轻链结构域(vl),其中vh和vl结构域包含以下cdr序列:
33.包含seq id no:2[eddhdafay]或由其组成的hcdr3;
[0034]
包含seq id no:3[dinpnyestgynqkfkg]或由其组成的hcdr2;
[0035]
包含seq id no:4[dynmd]或由其组成的hcdrl;
[0036]
包含seq id no:5[qhsrelpyt]或由其组成的lcdr3;
[0037]
包含seq id no:6[lasnlks]或由其组成的lcdr2;以及
[0038]
包含seq id no:7[rasksvrtsgynymh]或由其组成的lcdr1。
[0039]
在某些实施方案中,抗体或抗原结合片段包含vh结构域和vl结构域,所述vh结构域包含以下或由以下组成:seq id no:8的氨基酸序列或与其具有至少70%同一性的氨基酸序列,并且所述vl结构域包含以下或由以下组成:seq id no:9的氨基酸序列或与其具有至少70%同一性的氨基酸序列。在某些实施方案中,抗体或抗原结合片段包含含有seq id no:8的氨基酸序列或由其组成的vh结构域和含有seq id no:9的氨基酸序列或由其组成的
vl结构域。
[0040]
在某些实施方案中,抗体或其抗原结合片段包含人igg重链恒定结构域。
[0041]
在某些实施方案中,抗体或其抗原结合片段包含含有seq id no:16的氨基酸序列的重链和含有seq id no:20的氨基酸序列的轻链。
[0042]
在某些实施方案中,所述方法还包括向对象施用ivig。
[0043]
在某些实施方案中,所述方法还包括向对象施用利妥昔单抗。
附图说明
[0044]
图1是示出在补体系统的经典、凝集素和旁路途径中涉及的细胞信号传导级联的示意图。
[0045]
图2示出了多种膜蛋白在活的施万细胞(snf02.2)上的表达谱。使用流式细胞术分析针对不同膜蛋白,特别是与补体级联相关的蛋白对施万细胞进行染色。七幅图示出以下内容:(a)cd46、(b)cd55、(c)cd59、(d)cd64、(e)cd88、(f)gm1和(g)mag。
[0046]
图3示出了crp在用或不用磷脂酶-c(phospholipase-c,pl-c)处理的snf02.2施万细胞上的表达谱。snf02.2施万细胞用不同浓度的pl-c(1-0.5-0.25u/ml)处理并在37℃下孵育1小时,然后分别用检测cd46(a)、cd55(b)和cd59(c)的抗体染色。
[0047]
图4示出了施万细胞(snf96.2)对补体介导的裂解的抗性。图4中的每幅图均在该图的左半部分示出
‘
无pl-c处理’并在该图的右半部分示出
‘
pl-c处理’。
[0048]
(a)pl-c处理通过切割gpi锚降低了cd59和cd55表达二者的表达。cd46(其是跨膜蛋白)的表达不受影响(右侧y轴)。pl-c对gm1的表达也没有影响(左侧y轴,图a)。
[0049]
(b)细胞本质上受到保护免受c3固定的影响。c3固定是在不存在用mmn患者血清进行调理作用的情况下观察到的,并且c3固定在用mmn患者血清进行调理作用之后略微提高。经pl-c处理的细胞更易受c3固定的影响,尤其是在调理作用之后。argx-117抑制c3固定,但是在调理作用和pl-c处理之后仅看到部分抑制。这大概是由于抗gm1抗体和针对其他表位的血清抗体的组合调理作用密度引起的。
[0050]
(c)当对mac固定进行量化时,观察到与图b中所见类似的结果。
[0051]
(d)施万细胞受到保护免受补体介导的细胞裂解-归因于高水平的cd59表达。未用pl-c处理的细胞在调理作用和与补体活性血清孵育之后保持有生存力。在pl-c处理之后,当将施万细胞用患者来源的抗gm1抗体调理时观察到细胞裂解。这被argx-117抑制到基线。
[0052]
图5示出了抗hla mab对snf02.2施万细胞的补体c3固定。用提高浓度的w6/32(抗hla抗体)调理细胞,然后添加hps(human pooled serum,人混合血清)以激活补体途径。添加edta和tnt009(480μg/ml)二者以评估补体特异性。
[0053]
图6示出了施万细胞上的gm1表达和igm结合。(a)snf02.2施万细胞用ctb染色以使用流式细胞术检测gm1表达。(b)在用mmn患者血清(阴影条)进行调理作用之后或在没有补体激活的情况下(白色条),与培养的snf02.2施万细胞结合的igm的流式细胞术检测。
[0054]
图7示出了mmn患者血清中的igm与snf02.2施万细胞的结合。施万细胞用不同患者样品(包含不同gm1滴度)进行调理,并且在与snf02.2细胞孵育之后均显示出igm结合。(a)经igm染色的mfi;(b)igm阳性施万细胞的百分比。
[0055]
图8示出了在用mmn患者血清进行调理作用之后对snf02.2施万细胞上c3固定的优
化。将50,000个施万细胞接种到96孔板中,并用mmn患者血清调理(1小时,rt)。图8中的每幅图均在该图的左半部分示出
‘
无调理作用’并在该图的右半部分示出
‘
调理作用’。(a)使用不同百分比的补体活性血清:10%(左图)、5%(中间图)或2.5%(右图)激活补体。研究了补体活性血清(黑色条)与经清除血清(=先前与施万细胞一起孵育的补体活性血清)(灰色条)。(b)(a)中所示结果的总结,将血清(黑色条)与经清除血清(浅灰色条)进行比较。(c)使用不同c3检测抗体:c3fitc(lsbio,克隆6c9)(左图)、c3-bio(lsbio,克隆6c9)+链霉抗生物素蛋白apc(中间图)或c3-bio(多克隆绵羊抗人c3)+链霉抗生物素蛋白apc(右图)的施万细胞上的c3固定。细胞用10%(黑色条)或5%(灰色条)血清激活。白色条代表edta对照并且全部符合预期。
[0056]
图9示出了施万细胞中补体激活的c2依赖性。将施万细胞接种到96孔板中,并用mmn患者血清(mmn-005)调理(1小时,rt),随后与补充有提高浓度的rhc2(以1.11μg/ml开始直至30μg/ml(生理浓度))的c2耗竭的血清一起孵育。在1小时(37℃)之后,在用c3-bio(lsbio,克隆6c9)染色之后,使用流式细胞术测量c3固定。
[0057]
图10示出了argx-117对用mmn患者血清调理的snf02.2施万细胞上的c3固定的剂量依赖性抑制。将施万细胞转移至96孔板(50,000个细胞/孔),用mmn患者血清进行调理(1小时,rt),并随后与5%补体活性血清(其用补体阻断抗体或edta预孵育(20分钟,rt))一起孵育。通过用c3-bio(lsbio,克隆6c9)和链霉抗生物素蛋白-apc对施万细胞染色进行c3固定的检测。(a)通过apc的mfi值的施万细胞上的c3固定。(b)在将5%血清设定为0%抑制并且edta 10mm设定为100%抑制的情况下计算的施万细胞上c3固定的抑制百分比。
[0058]
图11示出了在mmn血清诱导的补体激活之后snf02.2施万细胞的细胞因子分泌。将施万细胞接种到24孔板中,用mmn患者血清进行调理(1小时,rt),并在存在或不存在补体阻断抗体的情况下添加补体活性血清。在48小时之后收集上清液并使用luminex平台测量细胞因子分泌。三幅图示出以下内容:(a)il-6、(b)il-8和(c)mcp-1。图11中的每幅图均按以下顺序(从左到右)示出条:无刺激、il-1b 10ng/ml、il-1b 5ng/ml、il-1b 2.5ng/ml、tnf-a 50ng/ml、tnf-a 25ng/ml、tnf-a 12.5ng/ml,仅血清、仅mmn-05、mmn-05+血清、mmn-05+血清mgegta、mmn-05+血清argx-117、mmn-05+血清tnt009、mmn-05+血清依库丽单抗、mmn-05+血清hi、仅mmn-73、mmn-73+血清、mmn-73+血清mgegta、mmn-73+血清argx-117、mmn-73+血清+tnt009、mmn-73+血清依库丽单抗、mmn-73+血清hi。
[0059]
图12示出了针对由mmn患者中存在的抗gm1自身抗体触发的补体事件所提出的机制。
[0060]
图13示出了膜补体蛋白包括补体调节蛋白(complement regulatory protein,crp)在固定的ipsc-mn上的表达。培养诱导型多能干细胞来源的运动神经元(induced pluripotent stem cell-derived motor neuron,ipsc-mn)并使用4%pfa固定在盖玻片上,然后针对表达标志物进行染色。mgv=平均灰度值(mean gray value)。
[0061]
图14示出了c3固定的c2依赖性。将ipsc来源的运动神经元用c2耗竭的血清进行调理,并用提高浓度的经纯化人c2(human c2,hc2)重构,以通过测量c3固定来评价补体激活。将ipsc-mn培养3天,然后固定并随后染色以检测gm1表达和c3沉积。在40
×
放大率下分析图像,并计算单独的gm1、单独的c3的平均灰度值(mgv)或这二者之间的比值。
[0062]
图15示出了argx-117在另一些免疫介导的神经病中阻断补体。在存在或不存在
argx-117(200μg/ml)的情况下使用gbs或cipd患者血清调理运动神经元。将ipsc来源的运动神经元培养12至14天,然后固定并染色以检测gm1表达和c3沉积。在40
×
放大率下分析图像,并计算单独的gm1、单独的c3的平均灰度值(mgv)或这二者之间的比值(c3/gm1)。图15中的每幅图均比较了
‘
仅血清’(左侧条)、
‘
血清+edta’(中间条)和
‘
argx-117 200μg/ml’(右侧条)。
[0063]
图16示出了ivig对使用用mmn患者样品调理的ipsc-mn的c3固定的作用。将ipsc来源的运动神经元培养12至14天,然后固定并随后针对gm-1表达和c3沉积染色。测试了两个不同的ivig批次:gammaquin和nanogam,二者均以50mg/ml使用。在40
×
放大率下分析图像,并计算单独的gm1、单独的c3的平均灰度值(mgv)或这二者之间的比值(c3/gm1)。图16中的每幅图均按以下顺序(从左到右)示出条:仅血清、血清+edta、gammaquin ops、gammaquin ops+comp、gammaquin comp、nanogram ops、nanogram ops+comp、nanogram comp。
[0064]
图17示出了ivig对通过mmn患者血清的gm1结合的抗独特型作用。用mmn患者血清、mmn005和mmn073进行elisa。将gm1包被在96孔板上,与添加或不添加50μg/ml ivig(2个批次:gammaquin和nanogam)的mmn患者血清一起孵育,然后使用抗人igm抗体检测igm。
具体实施方式
[0065]
a.定义
[0066]
除非另外定义,否则本文中使用的所有技术和科学术语均具有与本发明所属领域中普通技术人员通常理解的相同含义。在不限制任何术语的情况下,下面提供对本文中使用的一些术语的进一步说明。
[0067]“副蛋白血症性神经病
”‑
本文中使用的术语“副蛋白血症性神经病”或“ppn”描述了一组特征为血清中存在均质免疫球蛋白的周围神经病。均质免疫球蛋白被称为“副蛋白”。b淋巴细胞或浆细胞的异常克隆增殖(其在恶性血液病的情况下可能发生或可能不发生)产生过量的免疫球蛋白。数种周围神经系统病症与血液中存在过多量的异常免疫球蛋白密切相关。ppn可由抗体与周围神经上特定抗原靶标的相互作用或由免疫球蛋白的沉积引起。可根据本发明进行治疗的一些示例性副蛋白血症性神经病包括mmn、cidp和gbs。
[0068]“多灶性运动神经病
”‑
多灶性运动神经病或mmn是罕见的病症,患病率为每100,000名个体约0.6名,并且男性比女性更常受到影响(比例为2.7∶1)(harschnitz et al.,j clin immunol 2014,34:112-119)。mmn是慢性、免疫介导的神经病,其特征为非对称性(主要是远端)肢体无力。该疾病的标志是存在多灶性运动传导阻滞,并且患者通常显示出针对鞘糖脂gm1的igm抗体的血清水平高,所述鞘糖脂gm1在周围神经的周围结区(peri-nodal region)中大量表达。这些自身gm1 igm抗体具有补体激活特性,并且是疾病严重程度的决定性因素(vlam et al.,neurol neuroimmunol neuroinflamm 2015,25;2(4))。gm1在周围运动神经中大量表达并定位于周围神经的轴膜(axolemma)和髓鞘二者。gm1具有动作电位传播和维持传导速度所必需的数个重要功能。在郎飞结(node of ranvier)处和相邻副结(paranode)上发现了最高的gm1表达,在那里gm1锚定钾通道并聚集钠通道,以通过副结稳定来维持紧密连接。此外,gm1作为控制神经发生和凋亡的神经营养因子的受体调节剂并且作为膜信号传导和运输中脂筏中的多分子组合体的一部分二者发挥作用。这些功能的破坏导致跨副结区域的传导失败。mmn患者中存在的抗gm1 igm抗体由活化的b细胞(浆细胞)产
生;然而,这种b细胞激活的机制尚未确定。
[0069]“吉兰-巴雷综合征
”‑
吉兰-巴雷综合征或gbs的发病率为每100,000名个体0.81至1.89例,并且男性比女性更常受到影响(比例为3∶2)(kieseier et al.,nature reviews,2018,4:31)。在60%至70%的病例中,gbs的最初症状出现在急性感染(通常是上呼吸道感染或胃肠感染)之后1至3周之间。gbs的最初症状通常是感觉或疼痛的变化,以及开始于足和手的肌无力。这通常扩散至臂和上半身。存在于轴突中的多种神经节苷脂的自身抗体用于帮助诊断某些gbs亚型。例如,在患有急性运动轴突性神经病(aman)和急性运动和感觉轴突性神经病(amsan)的患者的血清中发现了抗gm1和抗gd1a igg抗体。这些抗体与郎飞结结合,在那里它们破坏负责钠通道聚集的精细结构布置,导致轴突传导减慢和功能丧失。或者,抗体与运动神经末梢结合,导致突触前神经末梢退化。
[0070]“慢性炎性脱髓鞘性多发性神经病
”‑
慢性炎性脱髓鞘性多发性神经病或cidp是最常见的免疫介导的神经病,报道的患病率为每100,000名个体0.8至8.9例(kieseier et al.,nature reviews,2018,4:31)。男性比女性更常受到影响(比例为2∶1)。cidp与gbs密切相关并被认为是急性疾病的慢性对应物。最常见的cidp症状是腿、臂、手指和手的无力、麻木和刺痛。另一些症状包括疲劳、疼痛、平衡问题和行走能力受损。cidp的一些变体在郎飞结处存在针对蛋白质的自身免疫。这些变体包含具有针对副结蛋白神经束蛋白-186、神经束蛋白-155、接触蛋白-1和caspr-1的igg4自身抗体的炎性神经病亚组(querol et al.,nat rev neurol.2017,13(9):533-547)。这些蛋白质在有髓轴突区室化为结、副结和结间体中发挥关键作用。跳跃式传导需要区室化,因为它维持参与动作电位传递的电压门控钠和钾通道的分离。这些区域的破坏会导致神经传导减慢或受阻。
[0071]“补体系统的拮抗剂
”‑
本文中使用的短语“补体系统的拮抗剂”或“补体拮抗剂”是指能够阻断或抑制补体因子或补体级联组分的功能,从而抑制或降低补体活性的任何药剂。补体系统的拮抗剂可阻断或抑制经典补体途径、凝集素补体途径、旁路补体途径,或其任意组合。优选地,补体系统的拮抗剂通过靶向这些途径中的两种所共有的补体因子来抑制经典补体途径和凝集素补体途径。根据本文中所述方法使用的补体拮抗剂抑制补体因子c5上游的补体系统。这意味着拮抗剂通过抑制补体级联中c5之前的补体途径的任何组分或因子来抑制或降低补体活性,即拮抗剂不直接抑制c5或c5下游的任何补体因子。例如,拮抗剂可抑制补体因子c1、c2、c3或c4或者其任意组合的功能。抑制补体因子的功能意味着即使在存在补体因子上游激活信号的情况下,补体因子也被阻止执行其在整个补体激活级联中的作用。
[0072]
用于本发明的拮抗剂可采用任何合适的药剂形式并且可直接或间接地阻断或抑制补体因子或组分的功能。拮抗剂可通过下调靶标的表达例如通过sirna技术来抑制其靶标的功能。在该方面中,合适的拮抗剂包括抑制性rna物质,例如sirna或shrna。拮抗剂可通过与靶标直接结合来抑制其靶标的功能;例如,拮抗剂可与其靶标直接结合并阻止其激活级联中的下一个补体因子。在一些优选实施方案中,拮抗剂对其靶标具有特异性。例如,c2的拮抗剂与其他分子靶标相比将优先抑制c2的功能。拮抗剂通常将通过与其靶标直接相互作用,例如通过与补体蛋白选择性地结合来实现所需的特异性水平。可用作用于本文中所述方法的拮抗剂的合适药剂包括但不限于:小分子抑制剂;和生物拮抗剂包括抑制性肽、抗体模拟物例如亲和体、affilin、affitin、adnectin、atrimer、evasin、darpin、抗运载蛋白、
高亲合性多聚体、fynomer、versabody和duocalin。在一些优选实施方案中,用于本发明的拮抗剂是抗体或其抗原结合片段。
[0073]“抗体”或“免疫球蛋白
”‑
本文中使用的术语“免疫球蛋白”包括具有两条重链和两条轻链的组合的多肽,无论其是否具有任何相关的特异性免疫反应性。“抗体”是指对目的抗原具有显著已知的特异性免疫反应活性的这样的组合体。抗体和免疫球蛋白包含轻链和重链,在它们之间具有或不具有链间共价键。脊椎动物系统中的基本免疫球蛋白结构已被相对充分地了解。
[0074]
通用术语“免疫球蛋白”包含可在生物化学上区分的五种不同类别的抗体。关于igg,免疫球蛋白包含两条相同的分子量为约23,000道尔顿的轻多肽链和两条相同的分子量为53,000至70,000的重链。四条链在“y”构型中通过二硫键连接,其中轻链从“y”的口起始并继续通过可变区而括住重链。抗体的轻链被分类为kappa或lambda(κ,λ)。每个重链类别可与κ或λ轻链结合。一般而言,轻链和重链彼此共价结合,并且当通过杂交瘤、b细胞或经遗传改造的宿主细胞产生免疫球蛋白时,两条重链的“尾”部通过共价二硫键或非共价键彼此键合。在重链中,氨基酸序列从y构型的叉形末端的n端延伸至每条链底部的c端。本领域技术人员将理解,重链被分类为gamma、mu、alpha、delta或epsilon(γ、μ、α、δ、ε),其中还有一些亚类(例如,γ1-γ4)。该链的性质将抗体的“类别”分别确定为igg、igm、iga、igd或ige。免疫球蛋白亚类(同种型)例如igg1、igg2、igg3、igg4、iga1等已被充分表征并且已知赋予功能特化。鉴于本公开内容,技术人员容易辨别这些类别和同种型中每一种的经修饰形式,并且因此其在本发明的范围内。
[0075]
如上所述,抗体的可变区允许抗体选择性地识别并且特异性地结合抗原上的表位。也就是说,抗体的vl结构域和vh结构域组合形成限定三维抗原结合位点的可变区。该四级抗体结构形成了存在于y的每个臂末端的抗原结合位点。更特别地,抗原结合位点由vh和vl链中每一个上的三个互补决定区(complementary determining region,cdr)限定。
[0076]
本文中使用的术语“抗体”也旨在涵盖“vhh抗体”或“仅重链抗体”。
[0077]“vhh抗体
”‑
本文中使用的术语“vhh抗体”或“仅重链抗体”是指仅由骆驼科(camelidae family)物种(其包括骆驼、美洲驼(llama)和羊驼)产生的抗体类型。仅重链抗体或vhh抗体由两条重链构成并且没有轻链。每条重链在n端均有可变结构域,并且这些可变结构域被称为“vhh”结构域,以将它们与传统的异源四聚体抗体重链的可变结构域,即上述vh结构域区分开。
[0078]“可变区”或“可变结构域
”‑
术语“可变区”和“可变结构域”在本文中可互换使用并且旨在具有等同含义。术语“可变”是指以下事实:可变结构域vh和vl的某些部分在抗体之间在序列上广泛不同,并且用于每种特定抗体对其靶抗原的结合和特异性。然而,变异性并非均匀地分布在抗体的整个可变结构域中。其集中在vl结构域和vh结构域中每一个中形成抗原结合位点的一部分的称为“超变环”的三个区段中。vλ轻链结构域的第一、第二和第三超变环在本文中称为l1(λ)、l2(λ)和l3(λ),并且可定义为包含vl结构域中的残基24至33(l1(λ),由9、10或11个氨基酸残基组成)、49至53(l2(λ),由3个残基组成)和90至96(l3(λ),由5个残基组成)(morea et al.,methods 20:267-279(2000))。vκ轻链结构域的第一、第二和第三超变环在本文中称为l1(κ)、l2(κ)和l3(κ),并且可定义为包含vl结构域中的残基25至33(l1(κ),由6、7、8、11、12或13个残基组成)、49至53(l2(κ),由3个残基组成)和90至97
(l3(κ),由6个残基组成)(morea et al.,methods 20:267-279(2000))。vh结构域的第一、第二和第三超变环在本文中称为h1、h2和h3,并且可定义为包含vh结构域中的残基25至33(h1,由7、8或9个残基组成)、52至56(h2,由3或4个残基组成)和91至105(h3,长度高度可变)(morea et al.,methods 20:267-279(2000))。
[0079]
除非另有说明,否则术语l1、l2和l3分别是指vl结构域的第一、第二和第三超变环,并且涵盖从vκ和vλ同种型二者获得的超变环。术语h1、h2和h3分别是指vh结构域的第一、第二和第三超变环,并且涵盖从任何已知的重链同种型获得的超变环,包括γ、ε、δ、α或μ。
[0080]
超变环l1、l2、l3、h1、h2和h3可各自包含“互补决定区”或“cdr”的一部分,如下文所限定。术语“超变环”和“互补决定区”不是严格同义的,因为超变环(hv)是基于结构定义的,而互补决定区(cdr)是基于序列变异性定义的(kabat et al.,sequences of proteins of immunological interest,第5版.public health service,national institutes of health,bethesda,md.,1983)并且hv和cdr的限制在一些vh和vl结构域中可不同。
[0081]
vl和vh结构域的cdr通常可定义为包含以下氨基酸:轻链可变结构域中的残基24至34(lcdr1)、50至56(lcdr2)和89至97(lcdr3),以及重链可变结构域中的残基31至35或31至35b(hcdr1)、50至65(hcdr2)和95至102(hcdr3);(kabat et al.,sequences of proteins of immunological interest,第5版.public health service,national institutes of health,bethesda,md.(1991))。因此,hv可包含在对应的cdr内,并且本文中对vh和vl结构域的“超变环”的提及应被解释为也涵盖对应的cdr,并且反之亦然,除非另有说明。
[0082]
可变结构域的更高度保守部分称为框架区(framework region,fr),如下文所定义。天然重链和轻链的可变结构域各自包含四个fr(分别为fr1、fr2、fr3和fr4),主要采用β折叠构型,其通过三个超变环连接。每条链中的超变环通过fr紧密地保持在一起,并且与来自另一条链的超变环一起有助于形成抗体的抗原结合位点。抗体的结构分析揭示了序列与由互补决定区形成的结合位点的形状之间的关系(chothia et al.,j.mol.biol.227:799-817(1992));tramontano et al.,j.mol.biol,215:175-182(1990))。尽管其具有高的序列变异性,但六个环中的五个仅采用主链构象中的一小部分,称为“规范结构”。这些构象首先由环的长度决定,并且其次由环中和框架区中某些位置处的关键残基的存在决定,这些残基通过其堆积、氢键键合或呈现不寻常主链构象的能力来决定构象。
[0083]“cdr
”‑
本文中使用的术语“cdr”或“互补决定区”意指存在于重链和轻链多肽二者的可变区内的非连续抗原结合位点。这些特定区域已由以下描述:kabat et al.,j.biol.chem.252,6609-6616(1977)和kabat et al.,sequences of protein of immunological interest.(1991),以及chothia et al.,j.mol.biol.196:901-917(1987)和maccallum et al.,j.mol.biol.262:732-745(1996),其中定义包括氨基酸残基在彼此比较时的重叠或子集。示出了涵盖如上文引用的每篇参考文献所定义的cdr的氨基酸残基以用于比较。优选地,术语“cdr”是kabat基于序列比较所定义的cdr。
[0084]
表1:cdr定义
[0085][0086][0087]1残基编号遵循kabat et al.(同上)的命名法
[0088]2残基编号遵循chothia et al.(同上)的命名法
[0089]3残基编号遵循maccallum et al.(同上)的命名法
[0090]“框架区
”‑
本文中使用的术语“框架区”或“fr区”包括作为可变区的一部分但不是cdr的一部分的氨基酸残基(例如,使用cdr的kabat定义)。因此,可变区框架的长度为约100至120个氨基酸,但仅包含在cdr之外的那些氨基酸。对于重链可变结构域的具体实例和由kabat et al.定义的cdr,框架区1对应于涵盖氨基酸1至30的可变区结构域;框架区2对应于涵盖氨基酸36至49的可变区结构域;框架区3对应于涵盖氨基酸66至94的可变区结构域;并且框架区4对应于从氨基酸103到可变区末端的可变区结构域。轻链的框架区类似地由每一个轻链可变区cdr分开。类似地,使用chothia et al.或mccallum et al.的cdr定义,框架区边界由如上所述的相应cdr末端分开。在一些优选实施方案中,cdr如kabat所定义。
[0091]
在天然存在的抗体中,存在于每个单体抗体上的六个cdr是短的、非连续的氨基酸序列,其在抗体在水性环境中呈现其三维构型时特别地定位以形成抗原结合位点。重链和轻链可变结构域的其余部分在氨基酸序列中显示出较小的分子间变异性,并且被称为框架区。框架区主要采用β折叠构型,并且cdr形成连接β折叠结构的环且在一些情况下形成β折叠结构的一部分。因此,这些框架区起到形成支架的作用,该支架通过链间非共价相互作用将六个cdr定位在正确的方向上。由定位的cdr形成的抗原结合位点限定了与免疫反应性抗原上的表位互补的表面。该互补表面促进抗体与免疫反应性抗原表位的非共价结合。本领域普通技术人员可容易地鉴定cdr的位置。
[0092]“恒定区
”‑
本文中使用的术语“恒定区”是指可变结构域或可变区之外的抗体的一部分。免疫球蛋白轻链具有单结构域“恒定区”,其通常称为“cl或cl1结构域”。该结构域位于vl结构域的c端。免疫球蛋白重链的恒定区根据免疫球蛋白类别而不同(γ、μ、α、δ、ε)。重链γ、α和δ具有由三个免疫球蛋白结构域(称为ch1、ch2和ch3)组成的恒定区以及将ch1和ch2结构域分开的柔性铰链区。重链μ和ε具有由四个结构域(ch1至ch4)组成的恒定区。重链的恒定结构域位于vh结构域的c端。
[0093]
免疫球蛋白重链和轻链中氨基酸的编号从y构型的叉形末端的n端延伸至每条链底部的c端。不同的编号方案用于限定免疫球蛋白重链和轻链的恒定结构域。根据eu编号方案,igg分子的重链恒定结构域标识如下:ch1-氨基酸残基118至215;ch2-氨基酸残基231至340;ch3-氨基酸残基341至446。根据kabat编号方案,igg分子的重链恒定结构域标识如下:ch1-氨基酸残基114至223;ch2-氨基酸残基244至360;ch3-氨基酸残基361至477。“fc结构
域”或“fc区”通常定义重链恒定区的一部分,包括ch2和ch3结构域。fc区还可包括来自铰链区的一些残基。“铰链区”包含将ch1结构域与ch2结构域连接的重链分子部分。该铰链区包含约25个残基并且是柔性的,因此允许两个n端抗原结合区独立移动。铰链区可细分为三个不同的结构域:上游、中部和下游铰链结构域(roux k.h.et al.j.immunol.161:4083-901998)。包含“全人”铰链区的本发明抗体可包含下表2中所示的铰链区序列之一。
[0094]
表2:人铰链序列
[0095][0096]“片段
”‑
术语“片段”或“抗原结合片段”是指抗体或抗体链的区段或部分,其包含的氨基酸残基少于完整或完全抗体或抗体链。术语“抗原结合片段”是指免疫球蛋白或抗体的多肽片段,其结合抗原或与完整抗体(即,与其所来源于的完整抗体)竞争与抗原结合。本文中使用的术语抗体分子的“片段”包括抗体的抗原结合片段,例如,抗体轻链可变结构域(vl)、抗体重链可变结构域(vh)、单链抗体(scfv)、f(ab’)2片段、fab片段、fd片段、fv片段、单臂(单价)抗体、双抗体、三抗体、四抗体或通过组合、组装或缀合这样的抗原结合片段形成的任何抗原结合分子。本文中使用的术语“抗原结合片段”还旨在涵盖选自单价体、结构域抗体和纳米抗体的抗体片段。片段可例如通过化学或酶处理完整或完全抗体或抗体链或者通过重组手段获得。
[0097]“特异性”和“多特异性抗体
”‑
用于本文中所述方法的抗体与补体系统内的靶抗原结合。优选的是抗体与其靶抗原“特异性结合”,其中术语“特异性结合”是指任何抗体优先与给定靶标例如c1、c2、c3或c4进行免疫反应的能力。抗体可以是单特异性的,并且包含特异性结合特定靶标的一个或更多个结合位点。抗体可并入到“多特异性抗体”形式,例如双特异性抗体中,其中多特异性抗体与两种或更多种靶抗原结合。为了实现多重特异性,通常将“多特异性抗体”改造成包含具有不同vh-vl对的重链和轻链多肽的不同组合或配对。可改造多特异性抗体,特别是双特异性抗体,以采用天然抗体的整体构象,例如,具有与fc区缀合的不同特异性的fab臂的y形抗体。或者,可改造多特异性抗体,例如双特异性抗体,以采用非天然构象,例如其中具有不同特异性的可变结构域或可变结构域对被定位于fc区的相对端。
[0098]“经修饰的抗体
”‑
本文中使用的术语“经修饰的抗体”包括合成形式的抗体,其被改变使得其不是天然存在的,例如,包含至少两个重链部分但不包含两个完全重链的抗体(例如,结构域缺失的抗体或微抗体(minibody));被改变以与两种或更多种不同的抗原结合或与单一抗原上的不同表位结合的多特异性形式的抗体(例如,双特异性抗体、三特异性抗体等);与scfv分子结合的重链分子等。scfv分子是本领域中已知的并且描述于例如美国
专利5,892,019中。另外,术语“经修饰的抗体”包括多价形式的抗体(例如,三价、四价等,与同一抗原的三个或更多个拷贝结合的抗体)。在另一个实施方案中,本发明的经修饰的抗体是融合蛋白,其包含至少一个缺少ch2结构域的重链部分,并且包含含有受体配体对中一个成员的结合部分的多肽结合结构域。
[0099]“人源化替换
”‑
本文中使用的术语“人源化替换”是指这样的氨基酸替换:其中存在于抗体的vh或vl结构域中特定位置处的氨基酸残基被参考人vh或vl结构域中等效位置处存在的氨基酸残基替代。所述参考人vh或vl结构域可以是由人种系编码的vh或vl结构域。可在本文中限定的抗体的框架区和/或cdr中进行人源化替换。
[0100]“人源化变体
”‑
本文中使用的术语“人源化变体”或“人源化抗体”是指与参考抗体相比包含一个或更多个“人源化替换”的变体抗体,其中参考抗体的部分(例如vh结构域和/或vl结构域或者其包含至少一个cdr的部分)具有来源于非人物种的氨基酸,并且“人源化替换”存在于来源于非人物种的氨基酸序列内。
[0101]“种系变体
”‑
术语“种系变体”或“种系抗体”在本文中用于特别地指“人源化变体”,在所述人源化变体中“人源化替换”导致存在于抗体的vh或vl结构域中特定位置处的一个或更多个氨基酸残基被由人种系编码的参考人vh或vl结构域中等效位置处存在的氨基酸残基替代。通常来说,对于任何给定的“种系变体”,被替换成种系变体的替代氨基酸残基是从单一人种系编码的vh或vl结构域唯一地或主要地取得的。术语“人源化变体”和“种系变体”通常可互换使用。将一个或更多个“人源化替换”引入到骆驼科来源(例如美洲驼来源)的vh或vl结构域导致骆驼科(美洲驼)来源的vh或vl结构域的“人源化变体”的产生。如果被替换的氨基酸残基主要地或唯一地来源于单一人种系编码的vh或vl结构域序列,则结果可以是骆驼科(美洲驼)来源的vh或vl结构域的“人种系变体”。
[0102]“亲和变体
”‑
本文中使用的术语“亲和变体”是指与参考抗体相比在氨基酸序列中表现出一个或更多个变化的变体抗体,其中所述亲和变体与参考抗体相比表现出对靶抗原的改变的亲和力。例如,与参考抗体相比,亲和变体将表现出对靶标的改变的亲和力。优选地,与参考抗体相比,亲和变体将表现出对靶抗原的改善的亲和力。与参考抗体相比,亲和变体通常表现出cdr的氨基酸序列中的一个或更多个变化。这样的替换可导致用不同氨基酸残基取代cdr中给定位置处存在的原始氨基酸,所述不同氨基酸残基可以是天然存在的氨基酸残基或非天然存在的氨基酸残基。氨基酸替换可以是保守的或非保守的。
[0103]“对象
”‑
本文中使用的术语“对象”是指哺乳动物,优选人。对象可以是雄性或雌性。对象可表现出与副蛋白血症性神经病一致的一种或更多种症状。在某些实施方案中,对象可以是患者,其中患者是接受医学护理和/或积极寻求医学护理以治疗副蛋白血症性神经病的个体。
[0104]
b.治疗方法
[0105]
本发明提供了治疗副蛋白血症性神经病的方法。该方法包括向对象施用补体系统的拮抗剂,其中该拮抗剂抑制补体因子c5上游的补体系统。本发明还提供了用于治疗副蛋白血症性神经病的补体系统的拮抗剂,其中该拮抗剂抑制补体因子c5上游的补体系统。
[0106]
副蛋白血症性神经病在本文其他地方定义并且包含一类特征在于血清中存在均质免疫球蛋白或“副蛋白”的周围神经病。周围神经病是其中运动、感觉或血管舒缩神经纤维受到影响的周围神经的疾病或退化状态。特别感兴趣的是免疫介导的神经病,其代表了
一类由免疫介导的对周围神经的损伤引起的周围神经病症。一般而言,免疫介导的周围神经病的特征在于进行性肌无力,并且通常伴随感觉缺陷,如疼痛和麻木。推测这些病症是由血清中与髓鞘组分结合或与位于郎飞结处的蛋白质结合的自身反应性抗体引起的。这些病症的共同特征是血神经屏障(blood-nerve-barrier,bnb)受损,使自身抗体、补体组分和炎性细胞进入神经内膜。bnb的这种破坏被认为是由循环细胞因子例如vegf、tnfα和il1-β以及由t细胞分泌的金属蛋白酶触发的。在进入神经之后,自身抗体可与神经抗原结合,所述神经抗原例如分别存在于髓鞘上或在轴突之间的连接处的髓鞘相关糖蛋白(mag)或神经节苷脂。如本文其他地方所说明的,抗体/抗原免疫复合物的形成可通过募集c1q来启动补体系统的经典途径。
[0107]
副蛋白血症性神经病是一组特征在于血清中免疫球蛋白过量的免疫介导的神经病。ppn通常与自身抗体的存在相关。目前针对这类神经病的现有治疗策略包括静脉内注射免疫球蛋白(intravenous immune globulin,ivig)、血浆去除术(血浆置换)、皮质类固醇、硫唑嘌呤、利妥昔单抗、苯丁酸氮芥、氟达拉滨(fludarabine)、美法仑(melphalan)等(参见rison和beydoun.bmc neurology.(2016)16:13)。
[0108]
如本文中报道的,存在于患有不同副蛋白血症性神经病的患者的血清中的免疫球蛋白可激活补体,并且这支持补体介导的组织损伤在ppn患者中所见病理状况中的作用。然而,测试依库丽单抗(soliris
tm-抗c5抗体)在治疗多灶性运动神经病(mmn)的先前临床研究并未表现出效力(fitzpatrick et al.,j peripher nerv syst,2011,16(2):84-91)。
[0109]
重要的是,本发明人已表明施万细胞和运动神经元二者均上调补体调节蛋白cd59,即保护细胞免受mac介导的裂解的蛋白质。该观察表明c5上游补体级联的元件在ppn病理状况中发挥更重要的作用。这可很好地解释之前在依库丽单抗的情况下所见的效力的缺乏。不希望受到理论的束缚,认为副蛋白血症性神经病中的补体激活通过激活c3ar来诱导细胞因子和/或趋化因子的释放,所述c3ar被发现在施万细胞和运动神经元上表达。趋化因子,例如mcp-1,可在吸引炎性细胞从而促进神经损伤中发挥作用。
[0110]
本发明寻求通过靶向补体因子c5上游的补体活性来改善ppn的治疗。
[0111]
根据本文中所述方法待治疗的神经病包括归类为“副蛋白血症性神经病”的所有周围神经病。这包括急性病症和慢性病症二者。副蛋白血症性神经病可分类为脱髓鞘性或轴突性的,或其组合,这取决于髓鞘和/或轴突是否受损。在某些实施方案中,待治疗的神经病是轴突性神经病。在某些实施方案中,待治疗的神经病是脱髓鞘性神经病,例如慢性脱髓鞘性神经病。
[0112]
副蛋白血症性神经病的特征通常为存在自身抗体。因此,在某些实施方案中,根据本文中所述方法待治疗的神经病的特征在于存在自身抗体。识别神经抗原的高滴度的血清自身抗体存在于数种形式的周围感觉、运动和感觉运动神经病中。抗体通常与糖基化的细胞表面分子(包括糖脂、糖蛋白和糖胺聚糖)反应,但也描述了针对胞内蛋白质的抗体。抗体特异性与临床症状之间存在数种相关性,表明神经病可以是由抗体引起的。自身抗体,通常为igm或igg同种型,能够激活在周围神经上的补体系统的经典途径,如本文其他地方所述。在血神经屏障(bnb)破坏之后,可发生自身抗体和补体进入周围神经。在某些实施方案中,副蛋白血症性神经病的特征在于高滴度的自身抗体。在某些实施方案中,副蛋白血症性神经病的特征在于存在igg、igm或iga自身抗体。
[0113]
在某些实施方案中,副蛋白血症性神经病的特征在于存在针对神经抗原的自身抗体。在某些实施方案中,神经抗原是位于郎飞结处的蛋白质。在另一些实施方案中,神经抗原是位于髓鞘上的蛋白质。髓鞘相关糖蛋白(mag)是周围和中枢神经系统髓鞘的组分。针对mag的高滴度igm抗体与感觉运动脱髓鞘性周围神经病相关。mag抗体通常与igm单克隆蛋白的存在相关。在某些实施方案中,神经抗原是髓鞘相关糖蛋白(mag)。
[0114]
神经节苷脂是一组广泛分布于神经系统膜组分中的鞘糖脂。在某些实施方案中,神经抗原是神经节苷脂。神经病相关自身抗体最常识别的神经节苷脂是gm1、gd1a、gd1b和gq1b。在某些实施方案中,神经节苷脂选自gm1、gm1b、gm2、gm3、gd1a、gd1b、gd2、gd3、gt1a、gt1b、gt3和gq1b。在一个优选实施方案中,神经节苷脂是gm1。单独患者可具有针对单一神经节苷脂或针对多种神经节苷脂的抗体。因此,在某些实施方案中,副蛋白血症性神经病的特征在于存在针对一种或更多种神经抗原的自身抗体。在某些实施方案中,周围神经病的特征在于存在针对一种或更多种神经节苷脂的自身抗体。在某些实施方案中,神经抗原是副结节蛋白。在某些实施方案中,神经抗原可以是选自接触蛋白1、nf155、nf186和nf140的副结节蛋白。已知与多种周围神经病相关的自身抗体描述于下表3中。例如,已在患有cidp的患者中鉴定了针对副结节蛋白的igg4自身抗体。对gm1抗体(通常是igm同种型)的检测与多灶性运动神经病和下运动神经病相关,所述神经病特征在于肌无力和萎缩。gm1 igm可作为单克隆igm副蛋白或作为多克隆igm存在。
[0115]
表3.周围神经病中的自身抗体
[0116][0117]
根据本文中所述方法待治疗的特定的副蛋白血症性神经病可选自多灶性运动神经病(mmn)、慢性炎性脱髓鞘性多发性神经病(cidp)、吉兰-巴雷综合征(gbs)、米勒费希尔综合征、急性运动轴突性神经病(aman)、急性运动和感觉轴突性神经病(amsan)、慢性共济失调性神经病-眼肌麻痹-igm副蛋白-冷凝集素-二唾液酸抗体(canomad)综合征、远端获得性脱髓鞘性对称性(dads)神经病、单克隆丙种球蛋白病相关周围神经病、抗mag周围神经病和poems综合征。在某些优选实施方案中,副蛋白血症性神经病选自多灶性运动神经病(mmn)、慢性炎性脱髓鞘性多发性神经病(cidp)、吉兰-巴雷综合征(gbs)。本文中所述方法特别优选地用于治疗多灶性运动神经病(mmn)。
[0118]
本文中所述的方法用于在有此需要的对象中治疗副蛋白血症性神经病。对象优选
地是人对象。对象可以是患者,其中患者是正在接受医学护理和/或积极寻求医学护理以治疗副蛋白血症性神经病的个体。待治疗的对象通常表现出与副蛋白血症性神经病一致的一种或更多种症状,包括但不限于:徐发麻木;足或手的刺痒感(prickling)或刺痛(tingling),其可向上扩散至腿和臂;锐痛、刺痛、搏动痛、冻痛或灼痛;对触摸极度敏感;缺乏协调和跌倒;抽搐和肌痉挛;肌肉变薄(消瘦);肌无力或麻痹。待治疗的对象可能之前已通过任何标准评估标准被诊断为患有副蛋白血症性神经病。对象可基于血清中过量的免疫球蛋白来确定或者所述对象之前已基于血清中过量的免疫球蛋白被诊断。作为替代或补充,对象可具有针对一种或更多种神经抗原的自身抗体
[0119]
待治疗的对象可能已接受了针对副蛋白血症性神经病的治疗,或者可能之前已接受了针对副蛋白血症性神经病的治疗。在一些实施方案中,对象之前已接受或者正在接受ivig。在另一些实施方案中,对象之前已接受或者正在接受利妥昔单抗。在一些实施方案中,对象已接受或者正在接受血浆置换。对象可能对之前的治疗无响应,或者可能对之前的治疗产生抗性使得他们的症状恶化。
[0120]
本文中所述的治疗方法可导致与ppn相关的一种或更多种症状的完全或部分逆转。可使用适用于评价ppn治疗的任何标准评估标准来测量性能的改善。
[0121]
本发明的方法可包括施用用于治疗副蛋白血症性神经病的一种或更多种另外的治疗剂。所述一种或更多种另外的治疗剂可与补体拮抗剂作为组合治疗同时施用。或者,所述一种或更多种另外的药剂可在施用补体拮抗剂之前或之后施用,即依次施用药剂。可根据本发明方法施用的另外的治疗剂包括但不限于ivig、利妥昔单抗、皮质类固醇、硫唑嘌呤、苯丁酸氮芥、氟达拉滨、美法仑、环磷酰胺/泼尼松、美法仑、加巴喷丁(gabapentin)、普瑞巴林(pregabalin)、丙戊酸盐、右美沙芬(dextromethorphan)、曲马多(tramadol)、度洛西汀(duloxetine)、阿米替林(amitriptyline)和文拉法辛(venlafaxine)。
[0122]
c.补体拮抗剂
[0123]
本文中呈现的结果表明补体级联的终末阶段,特别是mac介导的裂解,可能不在ppn的病理状况中发挥重要作用。这是因为施万细胞和运动神经元表达高水平的补体调节蛋白cd59,其保护免受mac介导的裂解。因此,推断出与本文中所述副蛋白血症性神经病相关的补体相关病理状况可能由c5上游的因子例如通过c3ar来介导。因此,本发明提供了通过抑制c5上游的补体途径来治疗副蛋白血症性神经病的方法。
[0124]
该方法包括向对象施用补体系统的拮抗剂,其中该拮抗剂抑制补体因子c5上游的补体系统。抑制补体因子c5上游的补体系统的拮抗剂不直接抑制补体因子c5本身或组合以形成膜攻击复合物的任何下游因子(c6、c7、c8、c9)。相反,抑制补体因子c5上游的补体系统的拮抗剂靶向补体因子c5之前的补体级联的因子或组分。c5上游的补体因子包括c1、c2、c4和c3。因此,在某些实施方案中,拮抗剂通过抑制c1、c2、c4和c3中任一个的功能来抑制补体系统。在某些实施方案中,拮抗剂通过抑制c1、c1q、c1r、c1s、c2、c2a、c2b、c3、c3a、c3b、c4、c4a或c4b中任一个的功能来抑制补体系统。
[0125]
在某些实施方案中,拮抗剂抑制补体因子c3上游的补体系统。c3上游的补体因子包括c1、c4和c2。因此,在某些实施方案中,拮抗剂通过抑制c1、c2和c4中任一个的功能来抑制补体系统。在某些实施方案中,拮抗剂通过抑制c1、c1q、c1r、c1s、c2、c2a、c2b、c4、c4a或c4b中任一个的功能来抑制补体系统。
[0126]
经典补体途径的起始因子是补体因子c1。因此,在一些实施方案中,拮抗剂抑制补体因子c1。在另一些实施方案中,拮抗剂抑制补体因子c1qc1r或c1s。通过抑制补体因子c1处的补体级联,可防止或降低c1特异性靶标c4和c2的切割,并通过补体系统的经典途径特异性地抑制补体激活。抑制c1可降低调理素c4b的沉积,从而降低对细胞的靶向以进行吞噬和破坏。另外,抑制c1可防止或降低c3转化酶c4bc2a的形成。c4和c2也可通过凝集素途径被masp酶切割;然而,通过靶向补体因子c1仍可显著地抑制c3转化酶的总水平。
[0127]
在某些实施方案中,拮抗剂抑制补体因子c4。在另一些实施方案中,拮抗剂抑制补体因子c4a或c4b。通过靶向补体因子c4,可阻止c3转化酶c4bc2a的形成,并通过补体系统的经典途径和凝集素途径二者抑制补体激活。
[0128]
在某些实施方案中,拮抗剂抑制补体因子c2。在另一些实施方案中,拮抗剂抑制补体因子c2a或c2b。抑制c2也将阻止或降低c3转化酶的形成,从而降低过敏毒素c3a和调理素c3b以及c2下游的其他补体激活产物的沉积。c2拮抗剂可直接抑制c2a,从而阻止c3转化酶的形成。或者,拮抗剂可抑制c2b,从而阻止c2与表面结合的c4b的初始结合。c2b拮抗剂可使c2a与c4b的结合保持完整。然而,c2活性可被c2b拮抗剂显著抑制。
[0129]
在某些实施方案中,拮抗剂抑制补体因子c3。在另一些实施方案中,拮抗剂抑制补体因子c3a或c3b。抑制c3可阻止或降低c5转化酶c3bbbc3b的形成,从而降低过敏毒素c5a和mac生成物c5b的沉积。
[0130]
根据补体级联中拮抗剂抑制补体系统的点,拮抗剂可抑制经典补体途径、凝集素补体途径、旁路补体途径或这些途径的组合。在某些实施方案中,拮抗剂抑制经典补体途径和凝集素补体途径但不影响旁路补体途径。靶向c2和c4的拮抗剂能够抑制经典补体途径和凝集素补体途径,同时使旁路途径保持完整。在一些情况下,使补体途径之一保持完整使得固有免疫系统的这一重要武器不完全失效可以是有益的。作为替代或补充,拮抗剂可能仅需要引起补体活性的部分抑制以实现治疗作用。
[0131]
用于本文中所述治疗方法的拮抗剂抑制补体因子c5上游的补体系统的因子或组分以便抑制或降低补体活性。如本文中报道的,靶向c5上游的补体级联以抑制mac复合物形成之前的补体因子的活性是有益的。根据本文中所述方法应用的拮抗剂可通过抑制生物活性补体来源肽例如c4a、c4b、c3a、c3b和c5a的产生来降低或抑制补体活性。拮抗剂可至少部分地阻止补体来源肽对细胞和组织的损伤作用。补体系统的拮抗剂可通过降低过敏毒素的沉积、通过降低调理素的沉积、通过降低细胞因子和/或趋化因子的产生或分泌、通过降低吞噬作用、通过降低免疫细胞的募集,及其任意组合来抑制或降低补体活性。在某些实施方案中,补体系统的拮抗剂抑制过敏毒素的沉积。在某些实施方案中,拮抗剂抑制c3a或c5a的沉积。在某些实施方案中,拮抗剂抑制调理素的沉积。在某些实施方案中,拮抗剂抑制c3b或c4b的沉积。在某些实施方案中,拮抗剂抑制炎性细胞因子和/或趋化因子的产生和/或分泌。在一些实施方案中,拮抗剂抑制mcp-1的产生和/或分泌。
[0132]
用于本发明的拮抗剂可以是能够抑制补体因子的功能从而抑制或降低补体活性的任何药剂。如本文其他地方所述,优选地,用于所述方法的拮抗剂对其靶标表现出特异性。这种特异性通常通过使拮抗剂与其靶标直接结合并抑制靶标功能来实现。
[0133]
在一些实施方案中,拮抗剂选自:抑制性rna物质,例如sirna或shrna;小分子抑制剂;生物拮抗剂包括抑制性肽、抗体模拟物例如亲和体、affilin、affitin、adnectin、
atrimer、evasin、darpin、抗运载蛋白、亲和体、fynomer、versabody和duocalin;抗体及其抗原结合片段。
[0134]
在一些优选实施方案中,拮抗剂是抗体或其抗原结合片段。在某些实施方案中,抗体或其抗原结合片段与补体因子c1、c1q、c1s、c1r、c2、c2a、c2b、c3、c3a、c3b、c4、c4a或c4b结合。在某些实施方案中,抗体或抗原结合片段与补体因子c1、c1q、c1s、c1r、c2、c2a、c2b、c4、c4a或c4b结合。在一些优选实施方案中,抗体或抗原结合片段与c2,优选c2b结合。
[0135]
用于本文中所述方法的抗体和抗原结合片段旨在用于人治疗用途,并因此通常为iga、igd、ige、igg、igm类型,通常为igg类型,在这种情况下,它们可属于四个亚类igg1、igg2a和b、igg3或igg4中的任一个。在一些优选实施方案中,抗体是igg抗体,任选地是igg1抗体。抗体可以是单克隆、多克隆、多特异性(例如双特异性抗体)抗体,前提是其对其靶标表现出适当的免疫特异性。单克隆抗体是优选的,因为它们是高度特异性的,是针对单一抗原位点的。
[0136]
本文中所述的抗原结合片段通常将包含全长抗体的一部分,通常是其抗原结合或可变结构域。抗体片段的一些实例包括fab、fab’、f(ab’)2、双特异性fab’s和fv片段、线性抗体、单链抗体分子、单链可变片段(scfv)和由抗体片段形成的多特异性抗体(参见holliger和hudson(2005)nature biotechnol.23:1126-36,通过引用并入本文)。
[0137]
根据本文中所述方法应用的抗体或抗原结合片段可表现出高的人同源性。具有高的人同源性的这样的抗体分子可包含含有天然非人抗体的vh和vl结构域的抗体,其表现出与人种系序列足够高%的序列同一性。在某些实施方案中,抗体分子是非人抗体的人源化或种系变体。
[0138]
在一些非限制性实施方案中,抗体可包含ch1结构域和/或cl结构域(分别来自重链和轻链),其氨基酸序列完全或基本上是人的。对于旨在用于人治疗用途的抗体分子,抗体的整个恒定区或其至少一部分通常具有完全或基本上人的氨基酸序列。因此,ch1结构域、铰链区、ch2结构域、ch3结构域和cl结构域(以及ch4结构域,如果存在的话)中的一个或更多个或任意组合对于其氨基酸序列可以完全或基本上是人的。ch1结构域、铰链区、ch2结构域、ch3结构域和/或cl结构域(和/或ch4结构域,如果存在的话)可来源于人抗体,优选人igg抗体,更优选人igg1抗体亚型igg1、igg2、igg3或igg4。
[0139]
有利地,ch1结构域、铰链区、ch2结构域、ch3结构域和cl结构域(以及ch4结构域,如果存在的话)可全部具有完全或基本上人的氨基酸序列。在人源化或嵌合抗体或者抗体片段的恒定区的情况下,术语“基本上人的”是指与人恒定区具有至少90%、或至少92%、或至少95%、或至少97%、或至少99%的氨基酸序列同一性。在本上下文中术语“人氨基酸序列”是指由人免疫球蛋白基因,包括种系、重排和体细胞突变的基因编码的氨基酸序列。
[0140]
在一个实施方案中,抗体或抗体片段包含人fc结构域,其包含设计成提高抗体或抗体分子的血清半衰期的一个或更多个突变。这样的优化努力旨在改善体内抗体循环。人igg fc结构域中影响半衰期的突变的一些实例包括his433lys+asn434phe(nhance);arg435his;asn434ala;met252tyr+ser254thr+thr256glu(yte);met428leu+asn434ser(ls);thr252leu+thr253ser+thr254phe(lsf);glu294delta+thr307pro+asn434tyr(c6a-66);thr256asn+ala378val+ser383asn+asn434tyr(c6a-78)和glu294delta(del)。根据补体抑制剂的血清半衰期,其可作为单剂量施用,或者其可以以多剂量以后续剂量之间1天至
1个月的间隔施用。
[0141]
在另一个实施方案中,fc结构域可包含设计成损害fc结构域的效应物功能的一个或更多个突变。这样的突变是本领域技术人员公知的。在人igg1的情况下,抗体可包含已被修饰以消除或损害其效应物功能的人fc结构域。这样的fc结构域突变通常包含从重链恒定区第234、235、236、237、297、318、320或322位改变至少1个氨基酸,从而引起效应物功能的改变,同时保持与抗原结合。人igg fc结构域中的效应物损害突变的一些实例包括leu234ala+leu235ala(称为lala);leu234ala+leu235ala+pro329gly(称为lala-pg);igg4中的ser228pro+leu235glu;pro331ser+leu234glu+leu235phe;和pro331ser+leu234ala+leu235ala。
[0142]
适用于本发明的抑制补体因子c1的拮抗剂的一些实例包括cinryze(shire)、苏替莫单抗-也称为tnt009和biv009(bioverativ)、tnt003(true north)、anx005(annexon)和萘莫司他(torii pharmaceutical)。
[0143]
适用于本发明的抑制补体因子c3的拮抗剂的一些实例包括坎普他汀cp40(amyndas)、peg-cp40(amyndas)、amy-101(amyndas)、amy-201(amyndas)、apl-1和apl-2(apellis)、cdx-1135(celldex)、apt070mirococept(mrc)、hc3-1496(incode)、人源化单克隆抗体h17(elusys therapeutics)或痘苗病毒补体控制蛋白(vcp)。
[0144]
d.抗c2抗体和抗原结合片段
[0145]
用于本文中所述治疗方法的特别优选的补体拮抗剂是抑制补体因子c2的那些。在一些优选实施方案中,用于治疗的补体拮抗剂是与c2结合的抗体或其抗原结合片段。用于本文中所述方法的合适的抗c2抗体和抗原结合片段包括在国际专利申请号wo2014/189378中鉴定的抗体和抗原结合片段,其内容以整体并入本文。
[0146]
c2是90至100kda的糖蛋白,其参与补体激活的经典途径和凝集素途径。如上所述,c2可被经典途径的c1s激活或被凝集素途径的masp2激活。c2与表面结合的c4b结合(在存在mg
2+
的情况下)以形成c4bc2复合物,其然后被激活的c1s或masp2切割成两个片段:较大的70kda片段c2a,其保持与c4b连接以形成c3转化酶c4bc2a和较小的30kda n端片段c2b,其被释放到流体相中。一旦被激活并与c4b结合,c2a就构成了能够分别切割c3和c5的c3和c5转化酶的催化亚基。
[0147]
人c2的氨基酸序列是已知的(genbank登录号nm_000063)并且如以以下seq id no:1所示。
[0148]
人c2的氨基酸序列(seq id no:1):
[0149][0150]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域和可变轻链(vl)结构域,其中vh和vl结构域包含以下cdr序列:
[0151]-包含seq id no:2[eddhdafay]或由其组成的hcdr3;
[0152]-包含seq id no:3[dinpnyestgynqkfkg]或由其组成的hcdr2;
[0153]-包含seq id no:4[dynmd]或由其组成的hcdr1;
[0154]-包含seq id no:5[qhsrelpyt]或由其组成的lcdr3;
[0155]-包含seq id no:6[lasnlks]或由其组成的lcdr2;以及
[0156]-包含seq id no:7[rasksvrtsgynymh]或由其组成的lcdr1。
[0157]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域和可变轻链(vl)结构域,所述可变重链(vh)结构域包含以下或由以下组成:与seq id no:8具有至少70%、至少80%、至少90%或至少95%同一性的序列,所述可变轻链(vl)结构域包含以下或由以下组成:与seq id no:9具有至少70%、至少80%、至少90%或至少95%同一性的序列。在某些实施方案中,与c2b结合的抗体或抗原结合片段包含含有seq id no:8或由其组成的可变重链结构域(vh结构域)和含有seq id no:9或由其组成的可变轻链结构域(vl结构域)。
[0158]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域和可变轻链(vl)结构域,其中vh结构域包含以下或由以下组成:与seq id no:8具有至少70%、至少80%、至少90%或至少95%同一性的序列,并且vl结构域包含以下cdr序列:
[0159]
包含seq id no:5[qhsrelpyt]或由其组成的lcdr3;
[0160]
包含seq id no:6[lasnlks]或由其组成的lcdr2;以及
[0161]
包含seq id no:7[rasksvrtsgynymh]或由其组成的lcdr1。
[0162]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域和可变轻链(vl)结构域,其中vh结构域包含seq id no:8的氨基酸序列或由其组成,并且vl结构域包含以下cdr序列:
[0163]
包含seq id no:5[qhsrelpyt]或由其组成的lcdr3;
[0164]
包含seq id no:6[lasnlks]或由其组成的lcdr2;以及
[0165]
包含seq id no:7[rasksvrtsgynymh]或由其组成的lcdr1。
[0166]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域
和可变轻链(vl)结构域,其中vh结构域包含以下cdr序列:
[0167]
包含seq id no:2[eddhdafay]或由其组成的hcdr3;
[0168]
包含seq id no:3[dinpnyestgynqkfkg]或由其组成的hcdr2;
[0169]
包含seq id no:4[dynmd]或由其组成的hcdr1;并且
[0170]
vl结构域包含以下或由以下组成:与seq id no:9具有至少70%、至少80%、至少90%或至少95%同一性的序列。
[0171]
在某些实施方案中,抗体或抗原结合片段与c2b结合并包含可变重链(vh)结构域和可变轻链(vl)结构域,其中vh结构域包含以下cdr序列:
[0172]
包含seq id no:2[eddhdafay]或由其组成的hcdr3;
[0173]
包含seq id no:3[dinpnyestgynqkfkg]或由其组成的hcdr2;
[0174]
包含seq id no:4[dynmd]或由其组成的hcdr1,并且
[0175]
vl结构域包含seq id no:9的氨基酸序列或由其组成。
[0176]
对于其中抗体或抗原结合片段的结构域由与参考序列具有特定百分比序列同一性所限定的一些实施方案,vh和/或vl结构域可保留与参考序列中存在的那些相同的cdr序列,以使得变异仅存在于框架区内。
[0177]
表4 vh和vl结构域序列
[0178][0179]
在某些实施方案中,抗c2b抗体包含人抗体,特别是人igg1、igg2、igg3或igg4的ch1结构域、铰链结构域、ch2结构域和/或ch3结构域。在某些实施方案中,抗c2b抗体包含人igg1的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含ch2结构域中的替换l234a和l235a,其中位置根据eu编号进行限定。作为替代或补充,抗c2b抗体包含人igg1的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含ch3结构域中的替换h433k和n434f,其中位置根据eu编号进行限定。eu编号是指在edelman,g.m.et al.,proc.natl.acad.sci.usa,63:78-85(1969);和kabat et al.在
″
sequences of proteins of immunological interest
″
,u.s.dept.health and human services,5th edition,1991中描述的对fc区的共同约定。
[0180]
在某些实施方案中,抗c2b抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域和ch3结构域。在某些实施方案中,抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含铰链结构域中的替换s228p。
[0181]
在某些实施方案中,抗c2b抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含ch3结构域中的替换l445p。
[0182]
在某些实施方案中,抗c2b抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域
和ch3结构域并且包含铰链结构域中的替换s228p和ch3结构域中的替换l445p二者。
[0183]
在某些实施方案中,抗c2b抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含ch3结构域中的替换h433k和n434f。
[0184]
在某些实施方案中,抗c2b抗体包含人igg4的ch1结构域、铰链结构域、ch2结构域和ch3结构域并且包含铰链结构域中的替换s228p和ch3结构域中的替换h433k和n434f。
[0185]
在某些实施方案中,抗c2b抗体包含人igg重链恒定结构域。在某些实施方案中,重链恒定结构域包含人igg1重链恒定结构域。在某些实施方案中,重链恒定结构域由人igg1重链恒定结构域组成。在某些实施方案中,重链恒定结构域包含含有如seq id no:10或11所示的氨基酸序列或由其组成的人igg1重链恒定结构域。
[0186]
在某些实施方案中,重链恒定结构域包含人igg4重链恒定结构域。在某些实施方案中,重链恒定结构域由人igg4重链恒定结构域组成。在某些实施方案中,重链恒定结构域包含含有seq id no:12、13或14中任一个所示的氨基酸序列或由其组成的人igg4重链恒定结构域。
[0187]
重链恒定结构域示于下表5中。
[0188]
表5重链恒定结构域
[0189][0190]
在某些实施方案中,抗c2b抗体包含以下或由以下组成:与如seq id no:20所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%或至少99%序列同一性的轻链和选自以下的重链:
[0191]
(i)与如seq id no:15所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%或至少99%序列同一性的重链;
[0192]
(ii)与如seq id no:16所示的氨基酸序列具有至少90%、至少95%、至少97%、至
少98%或至少99%序列同一性的重链;
[0193]
(iii)与如seq id no:17所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%或至少99%序列同一性的重链;
[0194]
(iv)与如seq id no:18所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%或至少99%序列同一性的重链;以及
[0195]
(v)与如seq id no:19所示的氨基酸序列具有至少90%、至少95%、至少97%、至少98%或至少99%序列同一性的重链。
[0196]
在某些实施方案中,抗c2b抗体包含具有seq id no:20的氨基酸序列的轻链和具有选自seq id no:15至19的氨基酸序列的重链。
[0197]
在一个优选实施方案中,抗c2b抗体包含具有seq id no:20的氨基酸序列的轻链和具有seq id no:16的氨基酸序列的重链。
[0198]
重链和轻链序列示于下表6中。
[0199]
表6重链和轻链
[0200]
[0201][0202]
在一个优选实施方案中,抗c2b抗体是单克隆igg抗体。
[0203]
对于其中抗体的重链和/或轻链由与参考序列具有特定百分比序列同一性所限定的一些实施方案,重链和/或轻链可保留与参考序列中存在的那些相同的cdr序列,以使得变异仅存在于cdr区域之外。
[0204]
除非在本技术中另外说明,否则两个氨基酸序列之间的%序列同一性可通过比较以最佳方式排列的这两个序列而确定,并且其中待比较的氨基酸序列可相对于参考序列包含添加或缺失以用于这两个序列之间的最佳比对。同一性百分比通过以下来计算:确定两个序列之间氨基酸残基相同的相同位置的数目,将该相同位置的数目除以比较窗口中的位置总数并将得到的结果乘以100以获得这两个序列之间的同一性百分比。例如,可使用blast程序“blast 2 sequences”(tatusova et al,“blast 2 sequences-a new tool for comparing protein and nucleotide sequences”,fems microbiol lett.174:247-250),使用的参数是默认给出的那些(特别是参数“开放空位罚分”:5,和“延伸空位罚分”:2;所选矩阵是例如由程序提出的矩阵“blosum 62”),待比较的两个序列之间的同一性百分比由程序直接计算。
[0205]
抗c2抗体可在fc区内被修饰以提高对新生儿受体fcrn,优选人fcrn的结合亲和力。提高的结合亲和力可在酸性ph(例如从约ph 5.5至约ph 6.0)下是可测量的。提高的结
合亲和力还可在中性ph(例如从约ph 6.9至约ph 7.4)下是可测量的。“提高的结合亲和力”意指相对于未经修饰的fc区的结合亲和力对fcrn的结合亲和力提高。通常来说,未经修饰的fc区将具有人igg1、igg2、igg3或igg4的野生型氨基酸序列。在一些这样的实施方案中,具有经修饰fc区的抗体分子对fcrn的结合亲和力提高将相对于野生型igg1、igg2、igg3或igg4对fcrn,优选对人fcrn的结合亲和力进行测量。
[0206]
e.药物组合物
[0207]
用于本文中所述治疗方法的拮抗剂,特别是抗体和抗原结合片段,可配制成药物组合物用于施用于对象。
[0208]
药物组合物可与可药用载体或稀释剂以及任何其他已知的辅料和赋形剂一起根据常规技术例如(remington:the science and practice of pharmacy,19th edition,gennaro,ed.,mack publishing co.,easton,pa.,1995)中公开的那些进行配制。术语“可药用载体”涉及固有地无毒性的载体或赋形剂。这样的赋形剂的一些实例是但不限于:盐水、林格液(ringer’s solution)、右旋糖溶液和汉克斯液(hanks’solution)。也可使用非水性赋形剂,例如不挥发性油和油酸乙酯。
[0209]
药物组合物通常在制造和储存条件下必须是无菌和稳定的。该组合物可被配制成溶液剂、微乳剂、脂质体或适于高药物浓度的其他有序结构。可用于所述药物组合物的合适的水性和非水性载体的一些实例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等),及其合适的混合物;植物油(例如橄榄油);以及可注射有机酯(例如油酸乙酯)。可例如通过使用包衣材料(例如卵磷脂)、通过在分散体的情况下保持所需粒度、以及通过使用表面活性剂来保持适当的流动性。
[0210]
药物组合物可还包含辅料,例如防腐剂、润湿剂、乳化剂和分散剂。可通过灭菌程序和通过包含多种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、酚、山梨酸等来确保防止存在微生物。还可期望在组合物中包含等张剂,例如糖、多元醇例如甘露糖醇、山梨糖醇、甘油或氯化钠。还可包含可药用的抗氧化剂,例如:(1)水溶性抗氧化剂,例如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠等;(2)油溶性抗氧化剂,例如抗坏血酸棕榈酸酯、丁基羟基茴香醚(butylated hydroxyanisole,bha)、丁基羟基甲苯(butylated hydroxytoluene,bht)、卵磷脂、没食子酸丙酯、α-生育酚等;和(3)金属螯合剂,例如柠檬酸、乙二胺四乙酸(edta)、山梨糖醇、酒石酸、磷酸等。
[0211]
药物组合物可通过任何合适的施用方式来施用。例如,施用可以是肠胃外的,优选地通过静脉内(intravenous,i.v.)或皮下(subcutaneous,s.c.)注射或输注来施用。本文中使用的短语“肠胃外施用”和“肠胃外地施用”意指除了肠内和表面施用之外的施用方式,通常通过注射,并且包括但不限于静脉内、腹膜内、皮下、肌内、动脉内、鞘内、囊内、眶内、心内、皮内、经气管、表皮下、关节内、被膜下、蛛网膜下、椎管内、硬膜外和胸骨内注射和输注。
[0212]
通过引用并入
[0213]
在前面的描述和以下实施例通篇中引用了多种出版物,其各自通过引用整体并入本文。
[0214]
实施例
[0215]
参考以下非限制性实施例将进一步理解本发明。
[0216]
实施例1使用活的施万细胞在多灶性运动神经病(mmn)体外模型中的补体抑制
[0217]
施万细胞是分泌髓磷脂的胶质细胞,其螺旋状地缠绕在周围神经系统的轴突周围以形成髓鞘。这些细胞通过蛋白质gm1附着在轴突上。其最重要的功能是轴突的髓鞘形成以提高神经元的跳跃传导,但其也有助于神经元存活和信号传导。这些细胞的功能障碍导致脱髓鞘,从而导致信号转导减弱。因此,施万细胞与数种脱髓鞘病症如mmn相关。存在一种人施万细胞系-snf02.2-并且其来源于患者中诊断为恶性外周神经鞘瘤的肺转移。这些细胞是从培养的原发肿瘤材料的多次传代中建立起来的,直到其形成均质施万细胞样群,其显示出施万细胞标志物s100和p75阳性的克隆形态。这种从购买的细胞系用于本文所述的实验。
[0218]
a.方法
[0219]
1.1施万细胞培养方案
[0220]
将snf02.2(crl-2885
tm
)或snf96.2(crl-2884)施万细胞在含有100u/ml青霉素、100μg/ml链霉素并且补充有10%fcs的dmem培养基中在37℃、5%co2下培养。每周两次,当汇合度达到>80%时,将细胞传代或用于实验。弃去培养基并用10ml pbs洗涤细胞。为了解离细胞,添加3ml(t75)或5ml(t175)accutase细胞脱离溶液(ebioscience
tm
,thermo fischer scientific;cat.n
°
00-455-56),并将细胞在37℃下孵育5分钟,或直到细胞完全脱离。然后,添加培养基(7ml至t75以及10ml至t175)并将细胞转移至15ml管中,然后离心(125x g,10分钟)。将沉淀物重悬在5ml培养基中并使用台盼蓝区分活细胞与死细胞来计数。接下来,将细胞调整到所期望浓度并接种至培养瓶中(t75中10ml,t175中20ml)或用于facs实验。
[0221]
1.2施万细胞染色方案
[0222]
将细胞如上所述培养,并且在计数之后,将50,000个细胞转移至v型底板。将细胞在facs缓冲液(pbs 1%bsa 0.01%叠氮化钠)中洗涤一次,并用在facs缓冲液中稀释的各自抗体在暗处在冰上染色45分钟(facs染色抗体见表7)。如果需要,将细胞通过添加100μl facs缓冲液并随后以125x g离心5分钟洗涤一次。接下来,将细胞与第二抗体在暗处在冰上孵育45分钟。在孵育之后,添加100μl facs缓冲液并离心细胞(5分钟,125x g)。最后,将细胞沉淀重悬在100μl facs缓冲液中,并使用facs canto ii和随附软件进行分析。
[0223]
表7 facs染色抗体
[0224][0225]
1.3活的施万细胞上的补体激活测定
[0226]
当评估补体激活时,将50,000个细胞转移至96孔v型底板,然后用20μl在vb++中稀释(1小时,室温)的各自的调理剂进行调理。接下来,添加100μl vb++并离心样品(125x g,5分钟)。接下来,弃去上清液,并将细胞与100μl补体活性血清(用edta、mgedta或ab预孵育,15分钟,室温)在37℃下孵育1小时。接下来,将细胞以125x g离心5分钟并弃去上清液。随后,根据上述染色方案进行补体激活染色。
[0227]
1.4细胞因子分泌测定
[0228]
如上所述培养snf02.2细胞。在accutase处理和计数之后,将细胞以10,000个细胞/孔的密度转移至24孔板中的1ml snf02.2培养基中。2天之后,弃去培养基并将细胞用100μl热灭活mmn患者血清在vb++中以1∶50稀释度在室温下调理1小时。接下来,将100μl 15%补体活性血清(在室温下与mgegta或抗体预孵育15分钟)添加至经调理的细胞中,然后在37℃下孵育1小时。随后,将300μl培养基添加至细胞,得到500μl最终体积/孔。在24小时和48小时之后,收集200μl上清液用于通过乌得勒支大学医学中心(university medical centre in utrecht,mc utrecht)的多重核心设施进行内部分析。
[0229]
b.结果
[0230]
1.5活的施万细胞的补体受体表达
[0231]
为了使用施万细胞研究mmn生物学,评估了补体调节因子的表达。因此,培养snf02.2施万细胞并进行针对表达标志物的facs染色。结果显示在图2中并总结在下表8中。
[0232]
表8:补体调节蛋白在snf02.2施万细胞上的表达
[0233]
名称标志物施万细胞mcpcd46++
dafcd55++保护素cd59+++cr1cd35-c5arcd88-c3ar +gm1 ++mag +fcγricd64++
[0234]
这些结果表明补体调节蛋白(cd46、cd55和cd59)在施万细胞上表达,且末端途径的关键调节因子cd59具有高表达。施万细胞上的高cd59表达表明补体介导的裂解在这些细胞中受到限制,因为mac的形成受到抑制。相反,炎症是通过细胞信号传导在神经隔室中被诱导的。此外,施万细胞表现出负责吞噬清除的fcγ受体1(cd64)的表达。没有观察到cr1(cd35)的检出,因为cr1在施万细胞上的表达伴随髓鞘化开始而发生而这些培养的snf02.2施万细胞缺乏髓磷脂(terenghi f et al.,neurology,2004,62:666-668)。c3ar仅显示低表达而c5ar不存在。总而言之,施万细胞高度表达cd59,表明mac的亚裂解形成引发神经隔室中的炎症。
[0235]
为了研究施万细胞上的补体调节蛋白(crp)对补体介导的裂解的敏感性,将snf02.2细胞用不同浓度的裂解糖基磷脂酰肌醇锚定蛋白(包括cd59)的磷脂酶-c(phospholipase-c,pl-c)处理(fitzpatrick a,mann c et al.,j peripher nerv syst,2011,16(2):84-91)。结果如图3所示并且表明cd55和cd59都对补体介导的裂解敏感,因为在pl-c处理之后这两种crp的表达水平都降低了。
[0236]
1.6施万细胞对补体介导的细胞裂解的抗性
[0237]
先前的实验表明cd59和cd55在施万细胞(snf92.2和snf02.2)上高度表达。为了研究这种表达的功能性影响,评估了在有或没有cd59和cd55的情况下snf96.2施万细胞上的抗gm1介导的c3和mac固定。此外,还研究了补体激活对细胞生存力的作用。为此,将施万细胞培养并转移至v型底板上进行进一步的实验分析。用磷脂酶c(pl-c)处理通常用于从细胞表面去除gpi连接的蛋白质,例如cd59和cd55。事实上,pl-c处理导致cd59和cd55的去除,而cd46和gm1的表面表达保持不受影响(图4a)。为了评估pl-c处理对针对c3和mac固定的敏感性的作用,将施万细胞用含有抗gm1抗体的mmn患者血清(1小时,室温)或作为对照的弗洛拿缓冲液(veronal buffer,vb)进行调理。接下来,将细胞与5%补体活性血清孵育,或与经与480μg/ml argx-117在37℃下预孵育1小时的5%补体活性血清孵育。最后,分别使用针对c3和mac的经生物素标记的抗体检测c3和mac固定,并且通过apc缀合的链霉抗生物素蛋白染色。结果如图4a所示,并且揭示在未经pl-c处理的施万细胞中,与仅用vb调理相比,在用mmn-05血清调理之后c3固定略有提高。然而,argx-117在两种情况下都完全抑制了c3固定。vb对照中的经典途径介导的补体激活可能是由补体活性血清中存在的抗体(例如抗hla抗体)引起的。在pl-c处理之后,观察到c3固定提高,并且argx-117确实抑制了由mmn-005血清在经pl-c处理的细胞上诱导的c3固定,尽管不完全(图4b)。在这种情况下,针对gm1的igm抗体预期并达到高调理密度,并且针对非gm1的igm/igg抗体由于缺乏mcrp而靶向调节强补体激活。在mac固定中发现了类似的观察结果,其中未经处理的细胞显示出低水平的mac固定,
这在用mmn-005血清调理之后也略有提高。pl-c处理导致在用mmn-005血清调理之后mac固定提高,而这被argx-117抑制(图4c)。最后,为了评估补体介导的细胞毒性(complement-mediated cytotoxicity,cdc)的诱导,通过用7aad结合膜联蛋白v染色来测量生存力,并且双阳性细胞被认为是晚期凋亡/死亡。即使在用mmn-005血清调理之后,使用表达正常水平补体调节蛋白的细胞也未检测到cdc。然而,pl-c处理提高了经mmn-05调理的细胞的凋亡,并且添加argx-117导致对补体介导的细胞裂解的完全保护(图4d)。总而言之,由于cd59和cd55的高表达水平,施万细胞固有地受到保护免受补体介导的裂解。在不存在mcrp的情况下,检测到cdc,这可以(部分)被argx-117阻止。
[0238]
1.7使用施万细胞的补体激活的检测
[0239]
为了研究活的施万细胞上的补体激活,将细胞转移至96孔v型底板(50,000个细胞/孔)并用抗hla抗体(w6/32-biolegend;cat n
°
311402)在室温下调理30分钟。接下来,将补体活性血清(用edta、mgegta或tnt009预孵育,15分钟,室温)添加至细胞中,最终浓度为5%血清。在孵育1小时(37℃)之后,将细胞转移至96孔v型底板中,并在染色(45分钟,冰)之后测量c3固定。结果如图5所示。
[0240]
这些结果显示在用5%hps(人混合血清)激活补体之后的c3固定。此外,c3固定是补体特异性的,因为在添加edta(10mm)或tnt009(480mg/ml)之后,c3固定降低到基础水平。此外,c3在mgedta存在的情况下也被阻断,排除其主要通过旁路补体途径出现。值得注意的是,c3固定与用w6/32进行调理无关。
[0241]
1.8 mmn-患者来源的自身抗体与经培养的施万细胞的结合
[0242]
在确定igm抗gm1抗体的致病性之前,研究了在体外这些抗体与人施万细胞的结合。为此,将snf02.2施万细胞培养并转移至96孔圆底板(50,000个细胞/孔)在50μl snf02.2培养基中。接下来,将细胞用霍乱毒素b-af488染色以检测gm1表达。图6a中描述的结果显示体外培养的人snf0.2.2施万细胞表达gm1。此外,与mmn患者血清(含有针对gm1的自身抗体)孵育导致更高的抗gm1表达,并且更重要的是,在用mmn患者血清调理之后检测到igm与施万细胞结合(图6b)。用多种igm抗gm1抗体滴度研究了mmn患者的不同血清,并且所有都表明了igm与施万细胞结合。此外,对于所有研究的患者血清,均检测到igm与施万细胞结合的滴定效应(图7)。
[0243]
接下来,评价了患者igm抗gm1抗体在施万细胞上的补体激活潜力。为此,将人snf02.2施万细胞转移至96孔v型底板(50,000个细胞/孔)并用mmn患者血清(1小时,室温)调理。接下来,添加补体活性血清(1小时,37℃),然后使用fitc缀合抗体检测c3。
[0244]
起初,由于所用抗体的c3检测不足,仅观察到有限的c3固定。因此,使用不同方法来提高c3检测并降低背景补体激活。首先,测试了不同百分比的补体活性血清(10%、5%和2.5%)并与200μg/ml抗c5 mab(1小时,37℃)预孵育以阻止末端补体途径激活,并从而阻止snf02.2施万细胞的裂解。为了降低补体背景,还测试了具有经清除血清的条件(=补体活性血清在施万细胞上在4℃下孵育4x 10分钟以去除血清中的抗体)。
[0245]
图8a和8b中描述的结果显示补体活性血清(黑色条)与经清除血清(灰色条)之间没有差异,这表明血清中仍然存在的抗体对补体激活没有贡献并因此对c3固定没有贡献。将edta(白色条)用作对照。然而,使用5%补体活性血清显示是最佳的,因为无调理与调理之间的窗口最大。其次,测试了不同的抗c3抗体以提高检测窗。结果显示在图8c中,并且显
示使用生物素化抗c3(lsbio,克隆6c9)检测施万细胞上的c3固定,窗口从10%提高到25%。
[0246]
因此,当以最终浓度为5%且与来自lsbio(克隆6c9)的生物素化抗c3检测抗体一起使用补体活性血清时,观察到施万细胞上c3固定的最佳检测。总而言之,在用mmn患者血清调理之后在施万细胞上检测到c3固定。这表明mmn患者血清中存在的igm抗gm1抗体可以激活经典补体途径。
[0247]
1.9 c2依赖性
[0248]
评价c2依赖性以验证补体因子c2在mmn发病机制中的重要性。将snf02.2施万细胞用mmn患者血清调理,并经受用浓度递增的重组人c2(rhc2)(u蛋白表达;cat n
°
:c001,1987)重构的c2耗竭的血清(补体技术;cat n
°
a312)来评价c3固定。结果如图9所示,并且揭示单独的c2耗竭的血清导致相对较高的平均荧光强度(mean fluorescence intensity,mfi)值-与edta对照相比,mfi信号更高,导致实验窗小。无论如何,用30μg/ml rhc2重构的血清将施万细胞上的c3固定恢复到正常水平。此外,c3固定在5至10μg/ml rhc2左右恢复,其相当于生理c2水平的20至40%。这些结果表明低水平的c2不会导致c3固定或补体激活。
[0249]
1.10 argx-117抑制snf02.2施万细胞上c3固定的效力
[0250]
已经产生了多种针对补体因子的抑制性单克隆抗体,并且其中一些已被批准用于临床应用。例如,tnt009(bivv009)是抗c1s人源化抗体,其特异性地阻断经典补体途径(u,d
′
sa et al.,blood,2019,133(9):893-901),而oms646靶向masp-2从而阻断凝集素途径。依库丽单抗抑制c5,并且从而阻断由所有三种途径诱导的mac沉积(brodsky r,young n et al.,blood,2018,111:1840-1847)。
[0251]
argx-117是靶向c2的单克隆抗体,并且其独特之处在于其抑制经典和凝集素途径而保持旁路途径完整。以上结果表明,来自mmn患者的血清中的igm抗gm1自身抗体可以与snf02.2施万细胞特异性结合。此外,自身抗体能够激活补体级联,导致施万细胞上的c3固定。研究了argx-117对由mmn血清介导的c3固定的作用以评估该抗体的治疗潜力。为此,将施万细胞培养并转移至v型底板(50,000个细胞/孔),用mmn患者血清调理(1小时,室温),并随后与已与补体阻断抗体或edta预孵育(20分钟,室温)的5%补体活性血清孵育。c3固定的检测通过用c3-bio(lsbio,克隆6c9)和链霉抗生物素蛋白-apc染色施万细胞来进行。结果如图10所示。
[0252]
结果显示,argx-117和tnt009均以剂量依赖性方式抑制c3固定。然而,两种抗体的抑制均未达到edta对照。多至53μg/ml的tnt009可以阻断c3固定,而需要更高浓度的argx-117才能相同程度地阻断(160μg/ml)。重要的是,没有将抗c5添加至细胞中,之前这样做是为了阻断末端补体途径以便能够检测c3固定。令人惊讶的是,细胞未被裂解,这意味着其固有地受到保护免受补体介导的裂解,这可能是由于施万细胞上cd59的高表达。总而言之,argx-117能够以剂量依赖性方式阻断施万细胞上的c3固定,并且这些细胞固有地受到保护免受补体介导的裂解。
[0253]
1.11细胞因子分泌测定
[0254]
为了阐明mmn患者中神经损伤起源的病理生理学,测量了补体介导的细胞因子产生。将施万细胞接种至24孔板(10,000个细胞/孔)中,用mmn患者血清(1小时,室温)调理,并在存在或不存在补体阻断抗体的情况下添加补体活性血清。在48小时之后,收集上清液并使用luminex平台测量细胞因子分泌。结果显示在图11中并且表明用il1-β或tnf-α刺激施
万细胞导致il-6、il-8和mcp-1的分泌提高。在mmn患者血清中未观察到il-6或il-8升高。尽管如此,与对照相比,与mmn患者血清孵育的细胞中的mcp-1水平提高了2倍(图11c)。这种提高可以在添加argx-117或tnt009之后被阻断,而依库丽单抗只能部分阻断mcp-1分泌。
[0255]
mcp-1在向感染部位募集炎性免疫细胞、单核细胞和巨噬细胞中发挥作用,并且还参与多种疾病(包括以神经变性为特征的神经炎症过程)的发病机制。例如,随着gbs进展,mcp-1的循环水平提高(orlikowski et al,j of neuroimmunol,2003,134(118-27))。总而言之,mcp-1是由snf02.2施万细胞在用mmn患者血清调理并进行随后的补体激活之后产生的。argx-117能够阻断mcp-1的产生。
[0256]
c.结论
[0257]
使用snf02.2施万细胞评价补体系统的调节。数据表明施万细胞表达高水平的补体调节蛋白cd46、cd55和cd59。此外,在所研究的mmn模型系统中,显示来自mmn患者的igm抗gm1抗体激活经典补体途径,并且c3固定取决于c2的存在。argx-117有效地阻断了用抗gm1抗体致敏的snf02.2细胞上的补体激活。
[0258]
这些结果表明了新机制,通过该机制由抗gm1自身抗体触发的补体事件有助于mmn患者的病理学。这在图12中示意性描述。igm抗gm1自身抗体激活经典补体途径,但由于cd59在施万细胞上的高表达,不形成裂解mac。因此,直接补体依赖性细胞毒性(cdc)不太可能是导致这种情况下神经损伤的机制。然而,亚裂解mac复合物形成已被描述为引起细胞活化,这可能会诱导炎性介质的产生和分泌。在本研究中,观察到snf02.2细胞以补体依赖性产生趋化因子mcp-1。依库丽单抗、抗c5不能抑制二分之一受试mmn血清中的mcp-1分泌,这表明snf02.2细胞的mcp-1分泌是由亚裂解mac形成上游的机制触发的。
[0259]
抗gm1抗体的补体激活很可能通过c3ar诱导细胞因子和/或趋化因子的释放,c3ar被发现在这些细胞上表达。这些趋化因子(例如mcp-1)可能在吸引炎性细胞从而导致进一步的神经元功能障碍和损伤中发挥作用。在这里,施万细胞上通过抗gm1抗体的补体激活导致被argx-117抑制的mcp-1分泌,表明该抗体的可能治疗机制。总而言之,mmn患者中神经破坏和脱髓鞘的病理生理学显示发生在mac形成的上游,这使得mac上游的补体级联组分成为治疗这种疾病的更令人感兴趣的治疗靶标。argx-117靶向c2补体蛋白并因此是治疗该适应症的合适分子的一个实例。
[0260]
实施例2使用经固定的施万细胞在多灶性运动神经病(mmn)体外模型中的补体抑制
[0261]
a.方法
[0262]
2.1培养和在盖片上固定施万细胞的方案
[0263]
将施万细胞在含有100u/ml青霉素、100μg/ml链霉素并补充有10%fcs的dmem培养基中在37℃和5%co2下培养。每周两次,当汇合度达到>80%时,将细胞传代或用于实验。弃去培养基并用10ml pbs洗涤细胞。为了解离细胞,添加3ml(t75)或5ml(t175)accutase细胞脱离溶液,并将细胞在37℃下孵育5分钟,或直至细胞完全脱离。然后,添加培养基(7ml至t75,10ml至t175)并将细胞转移至15ml管中,然后离心(125x g,10分钟)。将沉淀物重悬在5ml培养基中并使用台盼蓝区分活细胞与死细胞来计数。接下来,将细胞调节至所期望浓度并接种至培养瓶中(t75中10ml,t175中20ml)或接种至置于24孔板中的盖片上。
[0264]
2.2 argx-117的体外评价方案
[0265]
将snf02.2施万细胞在盖片上在37℃、5%co2下培养3天。将细胞用4%pfa固定(4℃下10分钟),用500μl pbs洗涤一次,并从24孔板中取出盖片。为了尽量减少非特异性染色,将细胞在室温下使用100μl nh4cl淬灭5分钟,用100μl pbs洗涤一次,然后在室温下用100μl pbs+2%bsa封闭2小时。用100μl pbs洗涤之后,将细胞与热灭活的mmn患者血清(在pbs+2%bsa中按1∶50稀释)自顶向下孵育60分钟。接下来,将细胞洗涤一次(500μl pbs+2%bsa),在室温下与15%补体活性血清(-/+与补体阻断抗体预孵育)自顶向上孵育30分钟并洗涤一次(100μl pbs+2%bsa)。随后,将细胞用100μl第一抗体(在pbs+2%bsa中稀释)染色,并且自顶向下孵育(1小时,室温,暗处),然后用100μl pbs+2%bsa洗涤。接下来,将细胞与100μl链霉抗生物素蛋白-apc(在pbs+2%bsa中1∶100稀释)在室温下在暗处自顶向下孵育1小时,然后用100μl pbs洗涤一次并用100μl milliq水洗涤一次。在干燥组织上盖片之后,将7μl含有dapi的prolong
tm diamond抗淬灭封固剂移液至盖片上,在4℃下干燥过夜,然后用指甲油固定。使用带有colibri led的zeiss z1显微镜分析细胞,设置如下:40x放大倍数,25%led,alexa fluor
tm 488通道为400毫秒,apc通道为100毫秒以及dapi通道为50毫秒。用于染色的抗体显示在下表9中。
[0266]
表9染色抗体
[0267][0268]
(1)与人c3a和c3b均发生反应。
[0269]
(2)在掺入到tcc中时抗c5b-9克隆ae11针对c9上暴露的新表位。
[0270]
b.结果
[0271]
对于使用经固定的施万细胞进行的实验,观察到如上文实施例1中使用活的施万细胞所报道的非常类似的结果。
[0272]
2.3补体受体的表达
[0273]
将snf02.2施万细胞培养并固定在盖片上,然后针对表达标志物染色。结果显示在下表10中并且揭示所有补体调节蛋白都在施万细胞上表达。cd59高度表达,表明运动神经元受到保护免受mac介导的裂解,因为cd59是末端途径的关键调节因子。cd46、cd55和c3ar显示在施万细胞上中等表达,而c5ar在施万细胞的胞体上高度表达。cd35、cd11b和cd11c在施万细胞上均不存在。
[0274]
表10补体调节蛋白在经固定的施万细胞上的表达
[0275][0276]
2.4 mmn患者来源的自身抗体与经固定的施万细胞的结合
[0277]
研究了mmn患者来源的自身抗体与经固定的施万细胞的结合,并且看到了与上述实施例1.8中所报道的结果类似的结果。
[0278]
将snf02.2施万细胞在盖片上(50,000个细胞/盖片)在1ml snf02.2培养基中培养3天,然后用4%pfa固定。接下来,将盖片在pbs中洗涤并用nh4cl4(5分钟,室温)淬灭,然后用pbs-2%bsa封闭2小时。用霍乱毒素b-alexa488进行染色以检测gm1表达。结果表明,体外培养的人snf0.2.2施万细胞表达gm1以及神经母细胞瘤来源的小鼠n2a细胞。
[0279]
与mmn患者血清孵育导致显著的与igm染色共定位的抗gm1染色。用多种igm抗gm1抗体滴度研究了mmn患者的不同血清,并且所有都表明了igm与施万细胞结合。此外,igm抗体与人施万细胞结合是gm-1特异性的,因为与过量的可溶性未经标记的霍乱毒素孵育会干扰来自mmn血清的igm抗体的结合。用100μg/ml未经标记的霍乱毒素预孵育有效阻止抗gm1抗体与施万细胞结合,因为霍乱毒素和抗gm1抗体之间竞争与gm1神经节苷脂结合。
[0280]
评价了患者igm抗gm1抗体在施万细胞上的补体激活潜力。为此,将人施万细胞与来自mmn患者的热灭活血清(含有自体反应性igm抗gm1抗体)和hps(人混合血清)一起孵育,hps作为外部补体来源。补体因子的沉积(例如c4和c3的形成)是使用特异性抗体确定的。结果表明,在施万细胞上可以检测到c4固定,这与抗gm1滴度相关。然而,高igm抗gm1滴度并不总是与高c4沉积相关。
[0281]
评价c3的检测并且用不同的抗c3抗体染色盖片。随后,用不同mmn患者血清调理的施万细胞在这些细胞上显示出c3固定。然而,高抗igm gm1滴度并不总是与高c3沉积相关。所有edta对照均为阴性。
[0282]
下面的表11总结了不同mmn患者样品的不同补体因子表达水平。
[0283]
表11:不同mmn患者样品的c3和c4固定
[0284]
患者抗igm gm1滴度*c3固定c4固定mmn-0051∶800高高mmn-0141∶0低低mmn-0171∶800低低
mmn-0241∶6400中/高高mmn-0351∶100低/中低mmn-0421∶1600中高mmn-0521∶25600低低/中mmn-0731∶25600中/高高
[0285]
*根据gm1 elisa确定。
[0286]
总而言之,在用mmn患者血清调理之后在经固定的施万细胞上检测到c4和c3固定。这表明来自mmn患者的igm抗gm1抗体可以激活经典补体途径。
[0287]
2.5 c2依赖性
[0288]
评价c2依赖性以验证补体因子c2在mmn发病机制中的重要性。因此,将施万细胞用c2耗竭的血清调理,并用浓度递增的经纯化的人c2(hc2)重构以评价c3的形成。结果揭示,用c2耗竭的血清的情况下没有c3固定。然而,添加c2以浓度依赖性方式恢复了c3固定。令人感兴趣的是,不需要完全阻断c2来阻断c3固定;4.58μg/ml hc2(生理水平的约20%)几乎没有显示c3形成。
[0289]
总而言之,c3固定取决于c2的存在。不需要完全抑制c2来阻断经典补体途径并从而阻止施万细胞上c3形成。
[0290]
2.6 argx-117对经固定的施万细胞的效力
[0291]
将施万细胞在盖片上培养3天,然后固定。随后,将细胞洗涤,淬灭并封闭,然后用患者血清调理。此后,在存在或不存在不同补体阻断抗体或ivig的情况下,将细胞与补体活性血清在室温下孵育20分钟。最后,将细胞染色并用40x放大倍数成像。
[0292]
施万细胞上的c4固定被tnt009(200μg/ml)和12.5mg/ml ivig处理抑制。
[0293]
argx-117和tnt009均以200μg/ml使用时观察到c3抑制,而使用依库丽单抗或oms646如预期的那样没有观察到作用。浓度为12.5mg/ml的ivig仅显示对施万细胞上c3固定的部分抑制。因此,在该mmn体外疾病模型系统中,高浓度(200μg/ml)的补体抑制性抗体能够阻断c4和c3固定。
[0294]
为了确定抗补体抗体的不同作用,进行了滴定并分析了下游补体事件。将经固定的施万细胞用mmn患者血清调理,在存在浓度递增的补体阻断抗体(tnt009、依库丽单抗和argx-117)(从15μg/ml开始升高到480μg/ml)的情况下激活补体。结果显示依库丽单抗对c3固定没有抑制作用,因为其抑制c3的下游。argx-117显示出对c3固定的完全抑制,直到浓度为约30μg/ml。
[0295]
c.结论
[0296]
靶向人c2b的argx-117的补体抑制作用在体外模型中使用经固定的施万细胞进行评价,从而模拟mmn的病理生理学。数据表明施万细胞表达高水平的补体调节蛋白cd46、cd55和cd59。此外,在mmn模型系统中,显示来自mmn患者的igm抗gm1抗体激活经典补体途径,并且c3固定取决于c2的存在。argx-117有效地阻断了补体激活并优于依库丽单抗和tnt009二者。
[0297]
实施例3使用诱导多能干细胞(induced pluripotent stem cell,ipsc)在多灶性运动神经病(mmn)体外模型中的补体抑制
[0298]
a.方法
[0299]
3.1来自ipsc的脊髓运动神经元分化的方案
[0300]
将来自诱导多能干细胞(ipsc)的运动神经元样细胞(mn)按照文献(harschnitz o et al.j clin immunol.2014,jul;34 suppl 1:s112-9)中所述,并与dr l van der pol及其同事(department of neurology,umcu,the netherlands)合作制备。简而言之,根据机构审查委员会批准的方案从健康个体的皮肤活检物获得人成纤维细胞。将这些细胞在含有dmem glutamax并补充有10%胎牛血清和1%青霉素/链霉素的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,mef)培养基中在37℃5%co2下培养。根据以下方案在前5代内对细胞进行重编程。将人成纤维细胞以每孔10,000个细胞的密度接种在6孔皿中,并在mef培养基中培养24小时。随后,用含有mef培养基、4mg/ml溴化己二甲铵和表达oct4、klf4、sox2和c-myc的慢病毒载体的混合物进行病毒转导。在孵育24小时之后,将细胞用ph 7.4的pbs洗涤3次,并在mef培养基中另外培养5天。此后,将细胞与胰蛋白酶-edta孵育并转移至10厘米的皿中,该皿预先涂布有0.1%的明胶并在mef培养基中含有经辐照mef的汇合层。将培养基替换为含有dmem-f12、敲除血清替代品、1%青霉素/链霉素、l-谷氨酰胺、非必需氨基酸、β-巯基乙醇和20ng/ml重组人成纤维细胞生长因子-基本的人胚胎干细胞(hues)培养基。在3至6周之后人工挑选ipsc的集落以进行进一步的扩增和表征。将ipsc维持在hues培养基中,4至6代之后冷冻保存,并储存在液氮中。将ipsc在hues培养基中在经辐照的mef上培养并人工传代。ipsc的无饲养层培养在geltrex上进行并在mtesr1培养基中维持。使用accutase酶促传代经无饲养层培养的ipsc。
[0301]
3.2 argx-117的体外评价方案
[0302]
将ipsc在盖片上在37℃5%co2下朝向mn培养12至14天。接下来,将ipsc-mn用4%pfa固定(4℃下10分钟),用500μl pbs洗涤3次,并从24孔板中取出盖片。为了尽量减少非特异性染色并中和固定剂,将细胞用100μl 50mm nh4cl在室温下淬灭5分钟,在pbs中洗涤一次(所有洗涤步骤都通过浸没盖片),然后用100μl pbs+2%bsa在室温下封闭2小时。用pbs洗涤之后,将细胞与热灭活的mmn患者血清(在pbs+2%bsa中以1∶50稀释)自顶向下孵育60分钟。接下来,将细胞在pbs中洗涤一次,与15%补体活性血清(-/+与补体阻断抗体预孵育)自顶向上在室温下孵育30分钟,然后在pbs中洗涤一次。随后,将细胞用100μl第一抗体(在pbs+2%bsa中稀释)染色并自顶向下孵育(1小时,室温,暗处),然后在pbs中洗涤。接下来,将细胞与100μl链霉抗生物素蛋白-apc(在pbs+2%bsa中1∶100稀释)在暗处在室温下自顶向下孵育1小时,然后用pbs洗涤一次并用milliq水洗涤一次(也浸没盖片)。在干燥组织上盖片之后,将含有dapi的7μl prolong
tm
diamond抗淬灭封固剂移液至载玻片上,并将盖片自顶向下放置在液滴上并在室温下干燥过夜,然后用指甲油固定。使用带有colibri led的zeiss z1显微镜分析细胞,设置如下:40x或20x放大倍数(取决于实验),25%led,alexa fluor
tm 488通道为400毫秒,apc通道为100毫秒,并且dapi通道为50毫秒(除非另有说明)。在整个盖片中,每种条件拍摄四张照片。将所有照片都基于阳性和阴性对照归一化,并使用zen 2012软件在单个合并通道中导出为非压缩的8位tiff格式。使用imagej(fiji)计算每个单通道的平均灰度值。在microsoft excel 2010中计算比率并使用graphpad prism 7可视化。用于染色的抗体显示在下表12中。
[0303]
表12染色抗体
[0304][0305]
(1)与人c3a和c3b均发生反应。
[0306]
(2)在掺入tcc中时,抗c5b-9克隆ae11针对c9上暴露的新表位。
[0307]
3.3使用elisa确定gm1的方案
[0308]
nunc maxisorp板涂布有在甲醇中的gm1(5μg/ml)。将甲醇在层流柜中蒸发+/-2.5小时。随后,将孔用200μl 1%bsa-pbs在室温下封闭2小时。将mmn患者血清在1%bsa-pbs中稀释(任意与ivig预孵育),并向每孔添加100μl,然后在4℃下o/n孵育。接下来,将板用pbs洗涤6次,然后与检测人igm的第一抗体在1%bsa-pbs中孵育(室温下1小时)。在用pbs进行六个洗涤步骤之后,将孔与100μl hrp缀合的第二抗体在室温下孵育1小时。在用pbs进行六个洗涤步骤之后,添加tmb并用盐酸使反应停止。使用biorad elisa阅读器在415nm处分析板。
[0309]
b.结果
[0310]
为了研究mmn患者的抗gm1 igm抗体的致病性,开发了mmn体外模型,因为目前没有mmn的动物模型可用。简而言之,人诱导多能干细胞由成纤维细胞产生并如上所述分化为运动神经元。接下来,将这些运动神经元使用多聚甲醛(paraformaldehyde,pfa)固定在盖片上并用nh4cl淬灭。随后,将细胞用含有抗gm1 igm自身抗体的mmn患者血清调理1小时,使这些自身抗体与gm1结合。洗涤之后,在存在或不存在补体阻断抗体的情况下,使用人混合血清(hps)激活补体30分钟。最后,将细胞用针对补体因子的抗体染色以评价补体活性。这些研究的结果描述如下。
[0311]
3.4 ipsc来源的运动神经元上补体受体的表达
[0312]
为了更好地了解补体在mmn病理生理学中的作用,在ipsc-mn上评估了补体调节蛋白和补体受体的表达。因此,将ipsc-mn在盖片上培养并用4%pfa固定,然后针对表达标志
物染色。结果如表13和图13所示。
[0313]
表13补体调节蛋白在ipsc-mn上的表达
[0314]
标志物名称ipsc来源的运动神经元cd46mcp++cd55daf++cd59保护素+++cd35cr1+cd88c5ar++c3ar ++gm1 +++cd11b
ꢀ‑
cd11c
ꢀ‑
[0315]
这些结果揭示所有补体调节蛋白(cd46、cd55和cd59)都在经固定的运动神经元上表达。cd59高度表达,表明运动神经元受到保护免受mac介导的裂解。cd46和cd55显示出定位于胞体的中等表达。c3r和c5r都在运动神经元上表达,而c5ar仅在胞体上表达,不在神经突上表达。cd11b和cd11c均不存在,而cd35表达较低。
[0316]
3.5 mmn患者来源的自身抗体与ipsc-mn的结合
[0317]
在体外研究了igm抗gm1抗体与ipsc-mn的结合。为此,将ipsc-mn在盖片(80,000至150,000个细胞/13mm盖片)上在1200μl培养hmn培养基中培养12至14天,然后用4%pfa固定。接下来,将盖片在pbs中洗涤并用nh4cl4(5分钟,室温)淬灭,然后用pbs-2%bsa封闭2小时。用霍乱毒素b-alexa 488进行染色以检测gm1表达。结果表明,来源于ipsc的运动神经元表达gm1,并且与mmn患者血清孵育导致显著的与igm染色共定位的抗gm1染色。
[0318]
还评价了患者igm抗gm1抗体在ipsc来源的运动神经元上的补体激活潜力。为此,将人ipsc来源的运动神经元与来自mmn患者的热灭活血清(含有自体反应性igm抗gm1抗体)和hps一起孵育,hps作为外部补体来源。补体因子(例如c4和c3)的沉积用特异性抗体确定。结果表明,在ipsc-mn上可以检测到c4和c3固定。然而,高抗igm gm1滴度并不总是与高c3沉积相关。总而言之,在用mmn患者血清调理之后,在经固定的ipsc-mn上检测到c4和c3固定。这表明来自mmn患者的igm抗gm1抗体可以激活经典补体途径。
[0319]
3.6 c2依赖性
[0320]
评估c2依赖性以验证补体因子c2在mmn发病机制中的重要性。将ipsc来源的运动神经元用c2耗竭的血清调理,并用浓度递增的经纯化的人c2(hc2)重构,以通过测量c3固定来评价补体激活。结果显示在图14中并且揭示用c2耗竭的血清没有c3固定。然而,添加c2以浓度依赖性方式恢复了c3固定。此外,在用生理量的hc2重构的c2耗竭的血清中argx-117完全抑制c3固定。
[0321]
总而言之,c3固定取决于c2的存在。argx-117在hc2存在的情况下抑制c3固定的能力证明了这一点。显示不需要完全抑制c2来阻断经典补体途径并阻止c3形成。
[0322]
3.7 argx-117在经固定的ipsc-mn上阻止补体固定的效力
[0323]
如上文1.9节所述,已经产生了多种针对补体因子的抑制性单克隆抗体,并且其中一些已获准用于临床应用。研究了这些抑制性抗体对经固定的ipsc-mn的作用。为此,将
ipsc-mn在盖片上培养12至14天,然后固定。随后,将细胞洗涤,淬灭和封闭,然后用患者血清调理。此后,在存在或不存在不同补体阻断抗体的情况下,将细胞与补体活性血清在室温下孵育20分钟。最后,将细胞染色并用40x或20x放大倍数成像。
[0324]
运动神经元上的c4固定被tnt009(200μg/ml)抑制,而不是被其他mab抑制,像预期的那样。
[0325]
argx-117和tnt009二者以200μg/ml使用时观察到c3抑制,而使用相同浓度的依库丽单抗、oms646和利妥昔单抗未观察到作用。因此,在该mmn体外疾病模型系统中,阻断c2的高浓度(200μg/ml)argx-117能够阻断下游c3固定。
[0326]
为了确定抗补体抗体的不同作用,进行了滴定并分析了下游补体事件。将经固定的ipsc来源的运动神经元用mmn患者血清调理。将补体活性血清与浓度递增的补体阻断抗体(tnt009、oms646和argx-117)(从3μg/ml开始升高至200μg/ml)预孵育,然后添加至ipsc-mn。结果显示oms646对c3固定没有抑制作用,因为其抑制了凝集素途径。argx-117显示出对c3固定的完全抑制,直到浓度为约12μg/ml。使用tnt009获得了相同的结果,其中c3沉积也被阻断直到12μg/ml。因此,argx-117和tnt009在抑制用mmn患者血清调理的ipsc来源的运动神经元上的c3固定方面表现同样出色。
[0327]
3.8 argx-117在其他免疫介导的神经病中的补体抑制
[0328]
自身免疫性周围神经病代表了一组临床异质性的罕见且致残性疾病,其特征在于疾病严重性的运动和/或感觉症状。在mmn中,这些是自身免疫反应性的直接证据,由靶向gm1的特异性igm抗体介导。已经确定了其他免疫介导的神经病,包括最常见的慢性炎性脱髓鞘性多发性神经根神经病(cidp)和为最急性病症的吉兰-巴雷综合征(gbs)。为了评价argx-117对其他免疫介导的神经病的治疗效果,使用了上述体外模型。然而,作为用mmn患者血清调理ipsc来源的运动神经元的替代,分别使用了来自gbs和cidp患者的血清。结果如图15所示,并且揭示两种患者血清中存在的自身抗体可以激活补体,作为运动神经元上c3固定测定的,并且这通过添加200μg/ml argx-117而被阻断。因此,除了mmn,argx-117还在其他免疫介导的神经病的疾病模型中阻断了补体。
[0329]
3.9使用体外mmn测定的ivig对补体抑制的作用
[0330]
ivig是常用于治疗多种自身免疫性疾病的生物制剂。在mmn中,ivig是经fda批准的并且是一线治疗。数种机制负责使用ivig进行免疫调节,包括直接中和病原性免疫球蛋白、fcr阻断和数种免疫细胞的调节。ivig还作用于补体激活的抑制,因为ivig中存在的igg可以与c3结合,从而从血清中耗竭c3并阻止末端补体途径(terenghi f et al.,neurology,2004,62:666-668;fitzpatrick a,mann c et al.,j peripher nerv syst,2011,16(2):84-91)。在mmn中,已经表明ivig减少了抗gm1-gm1复合物的病理沉积(bhatheja k,field j.int j biochem cell biol.2006;38(12):1995)。mmn的标准治疗是ivig;然而,这种治疗在长期施用时是无效的。因此,使用ipsc来源的运动神经元使用体外mmn模型研究了ivig的补体抑制作用。为此,将ipsc来源的运动神经元在盖片上培养,固定并用mmn患者血清调理,然后添加补体活性血清以激活补体级联。测试了两个品牌的ivig(gammaquin和nanogam),并且还评价了不同的ivig治疗方法。首先,在调理步骤期间添加50mg/ml ivig,其中ivig无法阻断运动神经元上的c3固定。其次,分别在调理和补体激活期间或仅在补体激活期间施用ivig。二者都导致c3固定降低,并且与nanogam相比,gammaquin
显示出对补体抑制的最强作用(见图16)。
[0331]
为了评价ivig的抗独特型作用,使用mmn患者血清进行了gm1的竞争elisa。图17中显示的结果揭示了,在该测定中ivig对gm1结合没有竞争效应。总而言之,当在补体激活步骤期间添加时,ivig处理阻断了c3固定,表明ivig从血清中耗竭了c3。然而,ivig对独特型抗体没有作用。
[0332]
c.结论
[0333]
使用ipsc来源的运动神经元在体外模型中评价靶向人c2b的argx-117的补体抑制作用,从而模拟mmn的可能病理生理学。数据表明,该系统中的运动神经元表达补体调节蛋白,其中cd59的表达最高。此外,表明来自mmn患者的igm抗gm1抗体激活了经典补体途径,并且c3沉积取决于c2的存在。argx-117不仅在mmn患者中有效地阻断了补体激活,而且还在cidp和gbs患者样品中阻断了补体激活。此外,ivig仅在补体激活步骤期间阻断补体,并且对抗独特型抗体没有作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1