靶向活性基因编辑剂和使用方法与流程
靶向活性基因编辑剂和使用方法
1.相关申请
2.本技术要求于2019年3月22日提交的美国临时申请号62/822,529的优先权。优先权申请的内容通过引用并入本文。
技术领域
3.本发明整体涉及使用与抗原结合多肽缀合的定点修饰多肽编辑细胞内的核酸的方法和组合物。
背景技术:
4.crispr相关的rna引导的内切核酸酶诸如cas9已经成为在各种细胞类型和生物体中进行基因组工程化的通用工具(参见例如us8,697,359)。在引导rna(诸如双rna复合物或嵌合单引导rna)的引导下,rna引导的内切核酸酶(例如cas9)可以在靶核酸(例如双链dna(dsdna)、单链dna(ssdna)或rna)内产生位点特异性双链断裂(dsb)或单链断裂(ssb)。当靶核酸的切割在细胞(例如真核细胞)内发生时,可以通过非同源末端连接(nhej)或同源介导的修复(hdr)来修复靶核酸中的断裂。另外,可以使用单独的或与转录激活物或阻遏物结构域融合的催化失活的rna引导的内切核酸酶(例如cas9),通过与靶位点结合而不发生切割来改变靶核酸内位点处的转录水平。
5.然而,将rna引导的内切核酸酶递送和靶向特定细胞或组织的能力仍然存在挑战。已经使用了多种用于递送rna引导的内切核酸酶的方法或媒介物,诸如电穿孔、核转染、显微注射、腺相关载体(aav)、慢病毒和脂质纳米颗粒(参见例如lino,c.a.等人,2018.drug delivery,25(1),第1234-1257页)。如lino等人所述,某些方法诸如显微注射或电穿孔主要限于体外应用。其他递送模式诸如aav或脂质纳米颗粒已经用于体内递送rna引导的内切核酸酶,但是这些递送方法在体内环境中面临挑战。例如,基于aav的递送媒介物存在免疫屏障、包装大小限制和基因毒性基因组整合事件的风险(参见例如lino等人,2018;以及wang,d等人,2019.nature reviews drug discovery,18(5),第358-378页)。此外,通过脂质纳米颗粒递送rna引导的内切核酸酶具有若干缺点,包括货物的内体降解、特定的细胞趋向性和肝脏中的生物积累(参见例如lino等人,2018;以及finn,j.d.等人,2018.cell reports,22(9),第2227-2235页)。
6.已经尝试了通过用受体修饰rna引导的内切核酸酶本身来改进rna引导的内切核酸酶的靶向递送的替代方法。然而,此类受体介导的rna引导的内切核酸酶的实例在体外显示出有限的编辑,并且没有实现体内编辑(参见例如rouet,r.等人,2018.receptor-mediated delivery of crispr-cas9 endonuclease for cell-type-specific gene editing.j am chem,140(21),第6596-6603页)。
技术实现要素:
7.对具有靶向所需细胞或组织能力的rna引导的内切核酸酶、尤其是对于体内编辑
存在未满足的需求。本领域需要利用具有靶向所需细胞或组织能力的rna引导的内切核酸酶有效递送基因编辑疗法。此外,对提供体内靶向基因编辑的组合物和方法存在未满足的需求。
8.本文提供了包含抗原结合多肽的靶向活性基因编辑(tage)剂,其能够在体内和离体编辑特定细胞类型。tage剂的模块化和可编程设计能够实现快速再靶向和多功能性,从而能够灵活靶向多种细胞类型。此外,通过编辑靶细胞中的特定核酸序列(例如基因和调控元件),与基于dna的递送方法相比,tage剂具有双重特异性并且具有更少的脱靶效应(cameron等人nature methods.14.6(2017):600;kim等人genome research.24.6(2014):1012-1019)。tage剂包括一种或多种促进tage剂在靶细胞中进行细胞结合和/或细胞内化的抗原结合多肽。此外,在一些情况下,抗原结合多肽不仅允许受体介导的tage剂进入,而且在某些情况下,抗原结合多肽还介导细胞的生物学(例如通过改变细胞内信号转导途径)。
9.因此,本文提供了涉及基因编辑细胞内化剂(tage剂)的方法和组合物,该tage剂包含与细胞外细胞膜结合分子(例如细胞表面分子)特异性结合的抗原结合多肽以及识别核酸序列的定点修饰多肽,其中抗原结合多肽和定点修饰多肽稳定缔合,使得定点修饰多肽可以内化到展示细胞外细胞膜结合分子(例如细胞表面分子)的细胞中。
10.在一些实施方案中,抗原结合多肽是抗体、抗体的抗原结合部分或抗体模拟物。
11.在一些实施方案中,定点修饰多肽包含核酸酶或切口酶。在某些实施方案中,核酸酶是dna内切核酸酶,诸如cas9或cas12。
12.在一些实施方案中,tage剂还包含与细胞基因组的靶区域特异性杂交的引导rna,其中该引导rna和定点修饰多肽形成核糖核蛋白。
13.在另一个方面,本发明提供了一种靶向活性基因编辑(tage)剂,其包含与细胞外细胞膜结合分子特异性结合的抗原结合多肽以及包含识别crispr序列的rna引导的dna内切核酸酶的定点修饰多肽,其中抗原结合多肽和定点修饰多肽稳定缔合,使得定点修饰多肽可以内化到展示细胞外细胞膜结合分子的细胞中,并且其中抗原结合多肽是抗体、抗体的抗原结合部分或抗体模拟物。
14.在一些实施方案中,tage剂包含与细胞基因组的靶区域特异性杂交的引导rna,其中该引导rna和定点修饰多肽形成核糖核蛋白。
15.在一些实施方案中,rna引导的dna内切核酸酶是cas9核酸酶。在一些实施方案中,cas9核酸酶是野生型cas9核酸酶(例如酿脓链球菌(streptococcus pyogenes)cas9,seq id no:119)。在一些实施方案中,cas9核酸酶包含与seq id no:119具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。在某些实施方案中,cas9核酸酶包含氨基酸取代c80a(例如seq id no:1)。在另一个实施方案中,cas9核酸酶包含与seq id no:1具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。
16.在一些实施方案中,rna引导的dna内切核酸酶是cas9以外的核酸酶(例如,诸如部分iii中所述的核酸酶)。在某些实施方案中,rna引导的dna内切核酸酶是crispr v型核酸酶。在具体实施方案中,rna引导的dna内切核酸酶是cas12核酸酶。在一些实施方案中,cas12核酸酶是野生型cas12核酸酶(例如氨基酸球菌属某种(acidaminococcus sp.)cas12a,seq id no:120)。在一些实施方案中,cas12核酸酶包含与seq id no:120具有至少
85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。可用于本文的tage剂中的cas12a变体的示例包括但不限于cas12a(cpf1)ultra(例如idt目录号10001272)或kleinstiver等人nature biotechnology 37.3(2019):276-282中所述的cas12a,该文献据此通过引用并入。
17.在一些实施方案中,定点修饰多肽还包含至少一个核定位信号(nls)。
18.在一些实施方案中,定点修饰多肽还包含与抗原结合多肽结合的缀合部分。在某些实施方案中,
19.缀合部分是蛋白质。在某些实施方案中,蛋白质是蛋白质a、spycatcher或halo-tag。
20.在一些实施方案中,定点修饰多肽和抗原结合多肽经由接头缀合。在某些实施方案中,接头是可切割的。
21.在一些实施方案中,抗体模拟物是adnectin(即,基于纤连蛋白的结合分子)、affilin、affimer、affitin、alphabody、affibody、darpin、anticalin、avimer、fynomer、kunitz结构域肽、单抗体、nanoclamp、unibody、versabody、适体或肽分子。
22.在一些实施方案中,抗体的抗原结合部分是纳米抗体、结构域抗体、scfv、fab、双抗体、bite、双抗体、dart、微抗体、f(ab')2或内抗体。
23.在一些实施方案中,抗体是完整抗体或双特异性抗体。
24.在一些方面,本发明提供了一种靶向活性基因编辑(tage)剂,其包含与细胞外细胞膜结合蛋白特异性结合的抗体或其抗原结合部分以及包含cas9核酸酶的定点修饰多肽,其中抗体或其抗原结合部分和定点修饰多肽经由缀合部分稳定缔合,使得定点修饰多肽可以经由抗体或其抗原结合部分内化到表达细胞外细胞膜结合蛋白的细胞中。
25.在一些实施方案中,定点修饰多肽还包含至少一个核定位信号(nls)。在某些实施方案中,至少一个nls包含sv40 nls。在某些实施方案中,sv40 nls包含氨基酸序列pkkkrkv(seq id no:8)。在某些实施方案中,至少一个nls位于定点修饰多肽的c-末端、n-末端或两者处。在某些实施方案中,tage剂包含至少两个nls。
26.在某些实施方案中,tage剂还包含与表达细胞外细胞膜结合蛋白的细胞基因组的靶区域特异性杂交的引导rna,其中该引导rna和定点修饰多肽形成核蛋白。
27.在某些实施方案中,定点修饰多肽还包含可以与抗体或其抗原结合部分结合的缀合部分。在某些实施方案中,缀合部分是蛋白质。在一些实施方案中,蛋白质是蛋白质a、spycatcher或halo-tag。
28.在一些实施方案中,cas9核酸酶是野生型cas9核酸酶(例如酿脓链球菌cas9,seq id no:119)。在一些实施方案中,cas9核酸酶包含与seq id no:119具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。
29.在某些实施方案中,cas9核酸酶包含氨基酸取代c80a(例如seq id no:1)。在某些实施方案中,cas9核酸酶具有与seq id no:1至少85%、90%、95%、97%、98%、99%或100%同一的氨基酸序列。
30.在某些实施方案中,抗体的抗原结合部分是纳米抗体、
31.结构域抗体、scfv、fab、双抗体、bite、双抗体、dart、微抗体、f(ab')2或内抗体。
32.在某些实施方案中,抗体是完整抗体或双特异性抗体。
33.在某些实施方案中,细胞外细胞膜结合分子或蛋白质(例如细胞表面分子或蛋白质)是hla-dr、cd44、cd11a、cd22、cd3、cd20、cd33、cd32、cd44、cd47、cd59、cd54、cd25、achr、cd70、cd74、ctla4、egfr、her2、epcam、ox40、pd-1、pd-l1、gitr、cd52、cd34、cd27、cd30、icos或rsv。
34.在一些实施方案中,细胞外细胞膜结合分子或蛋白质是cd11a。在一些实施方案中,抗原结合多肽是抗cd11a抗体或其抗原结合片段。在某些实施方案中,抗cd11a抗体是依法珠单抗(efalizumab)。
35.在一些实施方案中,细胞外细胞膜结合分子或蛋白质是cd25。在一些实施方案中,抗原结合多肽是抗cd25抗体或其抗原结合片段。在某些实施方案中,抗cd25抗体是达利珠单抗(daclizumab)。
36.在另一个方面,本发明提供了一种定点修饰多肽,其包含识别crispr序列的rna引导的dna内切核酸酶以及结合到与细胞外细胞膜结合分子(例如细胞表面分子)特异性结合的抗体、抗体的抗原结合部分或抗体模拟物的缀合部分。
37.在某些实施方案中,定点修饰多肽还包含与细胞基因组的靶区域特异性杂交的引导rna。在某些实施方案中,rna引导的dna内切核酸酶是cas9核酸酶。在一些实施方案中,cas9核酸酶是野生型cas9核酸酶(例如酿脓链球菌cas9,seq id no:119)。在一些实施方案中,cas9核酸酶包含与seq id no:119具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。在某些实施方案中,cas9核酸酶包含氨基酸取代c80a (例如seq id no:1)。在另一个实施方案中,cas9核酸酶包含与seq id no:1具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。
38.在某些实施方案中,rna引导的dna内切核酸酶是crispr v型核酸酶。在具体实施方案中,rna引导的dna内切核酸酶是cas12核酸酶。在一些实施方案中,cas12核酸酶是野生型cas12核酸酶(例如氨基酸球菌属cas12a,seq id no:120)。在一些实施方案中,cas12核酸酶包含与seq id no:120具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。可用于本文的tage剂中的cas12a变体的示例包括但不限于cas12a(cpf1)ultra(例如idt目录号10001272)或kleinstiver等人nature biotechnology 37.3(2019):276-282中所述的cas12a,该文献据此通过引用并入。
39.在某些实施方案中,定点修饰多肽还包含至少一个核定位信号(nls)。在某些实施方案中,至少一个nls包含sv40 nls。在某些实施方案中,sv40 nls包含pkkkrkv(seq id no:8)。在某些实施方案中,定点修饰多肽包含至少两个nls。在某些实施方案中,至少一个nls位于定点修饰多肽的c-末端、n-末端或两者处。
40.在某些实施方案中,定点修饰多肽还包含可以与抗体、其抗原结合部分或抗体模拟物结合的缀合部分。在某些实施方案中,缀合部分是蛋白质。在某些实施方案中,蛋白质是蛋白质a、spycatcher或halo-tag。
41.在某些实施方案中,细胞外细胞膜结合分子是选自由以下项组成的组的蛋白质:hla-dr、cd44、cd11a、cd22、cd3、cd20、cd33、cd32、cd44、cd47、cd59、cd54、cd25、achr、cd70、cd74、ctla4、egfr、her2或epcam、ox40、pd-1、pd-l1、gitr、cd52、cd34、cd27、cd30、icos或rsv。
42.在一些实施方案中,细胞外细胞膜结合分子或蛋白质是cd11a。在一些实施方案
中,抗原结合多肽是抗cd11a抗体或其抗原结合片段。在某些实施方案中,抗cd11a抗体是依法珠单抗(efalizumab)。
43.在一些实施方案中,细胞外细胞膜结合分子或蛋白质是cd25。在一些实施方案中,抗原结合多肽是抗cd25抗体或其抗原结合片段。在某些实施方案中,抗cd25抗体是达利珠单抗。
44.在另一个方面,本发明提供了一种包含定点修饰多肽和引导rna的核蛋白,其中引导rna与展示细胞外细胞膜结合蛋白的细胞基因组的靶区域特异性杂交。
45.在另一个方面,本发明提供了一种编码本文所述的定点修饰多肽的分离核酸。在一个实施方案中,载体包含该核酸。在另一个实施方案中,细胞包含该定点修饰多肽。
46.在另一个方面,本发明提供了一种修饰靶细胞的基因组的方法,该方法包括使靶细胞与本文所述的靶向活性基因编辑(tage)剂接触。在某些实施方案中,靶细胞是真核细胞。在某些实施方案中,真核细胞是哺乳动物细胞。在某些实施方案中,哺乳动物细胞是小鼠细胞、非人类灵长类动物细胞或人类细胞。在某些实施方案中,定点修饰多肽在基因组的靶区域产生切割位点,从而修饰基因组。在某些实施方案中,基因组的靶区域是靶基因。
47.在某些实施方案中,包括使用本文所述的tage剂的方法有效地修饰靶基因的表达。在某些实施方案中,该方法相对于参考水平有效增加靶基因的表达。在某些实施方案中,该方法相对于参考水平有效降低靶基因的表达。
48.在另一个方面,本文提供了一种修饰哺乳动物受试者中的靶细胞内的核酸序列的方法,该方法包括使受试者中的靶细胞与靶向活性基因编辑(tage)剂接触,该tage剂包含与细胞外细胞膜结合分子特异性结合的抗原结合多肽以及识别靶细胞内的核酸序列的定点修饰多肽,使得靶细胞的核酸序列被修饰。
49.在另一个方面,本文提供了一种修饰哺乳动物受试者中的靶细胞内的核酸序列的方法,该方法包括向受试者局部施用靶向活性基因编辑(tage)剂接触,该tage剂包含与细胞外细胞膜结合分子特异性结合的抗原结合多肽以及识别靶细胞内的核酸序列的定点修饰多肽,使得靶细胞的核酸序列被修饰。
50.在一些实施方案中,该方法包括通过肌内注射、骨内注射、眼内注射、瘤内注射或真皮内注射向受试者局部施用tage剂。
51.在一些实施方案中,该方法相对于通过用缺乏抗原结合多肽的定点修饰多肽处理实现的水平有效增加受试者中遗传修饰的靶细胞的水平。
52.在一些实施方案中,哺乳动物受试者是人类受试者。
53.在一些实施方案中,受试者患有选自眼病、干细胞病症和癌症的疾病,并且其中该方法有效治疗该疾病。
54.在另一个方面,本文提供了一种修饰靶哺乳动物细胞内的核酸序列的方法,该方法包括使靶哺乳动物细胞与靶向活性基因编辑(tage)剂在tage剂内化到靶细胞中的条件下接触,使得核酸序列被修饰,其中tage剂包含与细胞外细胞膜结合分子特异性结合的抗原结合多肽以及识别靶细胞内的核酸序列的定点修饰多肽,其中tage剂的内化不依赖于电穿孔。
55.在一些实施方案中,靶哺乳动物细胞是造血细胞(hsc)、嗜中性粒细胞、t细胞、b细胞、树突状细胞、巨噬细胞或成纤维细胞。在某些实施方案中,靶哺乳动物细胞是造血干细
胞(hsc)。在某些实施方案中,靶哺乳动物细胞是骨髓中并非造血干细胞的细胞(例如成纤维细胞、巨噬细胞、成骨细胞、破骨细胞或内皮细胞)。
56.在一些实施方案中,抗原结合多肽特异性结合人hsc上的细胞外细胞膜结合分子。在某些实施方案中,hsc上的细胞外细胞膜结合分子是cd34、emcn、cd59、cd90、ckit、cd45或cd49f。
57.在一些实施方案中,通过离体共孵育使靶哺乳动物细胞与tage剂接触。
58.在一些实施方案中,该方法提供了被施用给有需要的受试者的遗传修饰的靶细胞。
59.在一些实施方案中,通过注射到受试者的组织中使靶哺乳动物细胞与tage剂原位接触。
60.在一些实施方案中,通过肌内注射、骨内注射、眼内注射、瘤内注射或真皮内注射向受试者施用tage剂。
61.在一些实施方案中,核酸是靶细胞基因组中的基因,其中所述基因的表达在所述修饰后被改变。
62.在一些实施方案中,靶哺乳动物细胞是小鼠细胞、非人类灵长类动物细胞或人类细胞。
63.在一些实施方案中,抗原结合多肽是抗体、抗体的抗原结合部分或抗体模拟物。
64.在某些实施方案中,抗体模拟物是adnectin(即,基于纤连蛋白的结合分子)、affilin、affimer、affitin、alphabody、适体、affibody、darpin、anticalin、avimer、fynomer、kunitz结构域肽、单抗体、nanoclamp、unibody、versabody、适体或肽分子。
65.在一些实施方案中,抗体的抗原结合部分是纳米抗体、结构域抗体、scfv、fab、双抗体、bite、双抗体、dart、微抗体、f(ab')2或内抗体。
66.在一些实施方案中,抗体是完整抗体或双特异性抗体。
67.在一些实施方案中,抗原结合多肽结合的细胞外细胞膜结合分子是hla-dr、cd44、cd11a、cd22、cd3、cd20、cd33、cd32、cd44、cd47、cd59、cd54、cd25、achr、cd70、cd74、ctla4、egfr、her2、epcam、ox40、pd-1、pd-l1、gitr、cd52、cd34、cd27、cd30、icos或rsv。
68.在某些实施方案中,细胞外细胞膜结合分子或蛋白质是cd11a。在一些实施方案中,抗原结合多肽是抗cd11a抗体或其抗原结合片段。在某些实施方案中,抗cd11a抗体是依法珠单抗或其抗原结合片段。
69.在一些实施方案中,细胞外细胞膜结合分子或蛋白质是cd25。在一些实施方案中,抗原结合多肽是抗cd25抗体或其抗原结合片段。在某些实施方案中,抗cd25抗体是达利珠单抗。
70.在一些实施方案中,tage剂还包含至少一个核定位信号(nls)。在一些实施方案中,tage剂包含至少两个核定位信号(nls)。在某些实施方案中,tage剂包含四个核定位信号(nls)。在某些实施方案中,tage剂包含六个核定位信号(nls)。在一些实施方案中,tage剂包含七个核定位信号(nls)。在一些实施方案中,tage剂包含八个核定位信号(nls)。
71.在一些实施方案中,nls包含sv40 nls。在某些实施方案中,sv40 nls包含氨基酸序列pkkkrkv(seq id no:8)。
72.在一些实施方案中,靶哺乳动物细胞是靶哺乳动物细胞群体。在一些实施方案中,
该方法有效增加群体中遗传修饰的靶哺乳动物细胞的水平(数量)。在某些实施方案中,增加通过哺乳动物细胞中的应答(例如表型)来证明。在某些实施方案中,tage剂修饰的哺乳动物细胞的增加数量可以通过将哺乳动物细胞群体中的水平相对于用缺乏抗原结合多肽的定点修饰多肽处理实现的水平进行比较来确定。
73.在一些实施方案中,tage剂的定点修饰多肽增加了靶哺乳动物细胞中的细胞内化。在某些实施方案中,内化的增加通过哺乳动物细胞中的应答(例如表型)来证明。在某些实施方案中,tage剂内化到哺乳动物细胞中的增加可以通过将哺乳动物细胞群体中tage剂的内化相对于用缺乏抗原结合多肽的定点修饰多肽实现的细胞内化进行比较来确定。
74.在一些实施方案中,tage剂的定点修饰多肽相对于用缺乏抗原结合多肽的定点修饰多肽实现的核内化增加了靶哺乳动物细胞中的核内化。
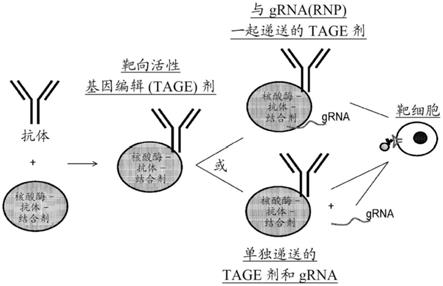
75.在一些实施方案中,定点修饰多肽包含核酸酶或切口酶。
76.在一些实施方案中,定点修饰多肽是核酸引导的核酸酶,并且tage剂还包含与靶哺乳动物细胞的核酸序列的靶区域特异性杂交的引导核酸,其中引导核酸和核酸引导的核酸酶形成核蛋白。
77.在某些实施方案中,定点修饰多肽是rna引导的核酸酶,并且tage剂还包含与靶哺乳动物细胞的核酸序列的靶区域特异性杂交的引导rna,其中引导rna和rna引导的核酸酶形成核糖核蛋白。在一些实施方案中,引导rna是单引导rna(sgrna)或cr:trrna。
78.在一些实施方案中,rna引导的核酸酶是2类cas多肽。
79.在一些实施方案中,2类cas多肽是ii型cas多肽。在一些实施方案中,ii型cas多肽是cas9。在一些实施方案中,cas9核酸酶是野生型cas9核酸酶(例如酿脓链球菌cas9,seq id no:119)。在一些实施方案中,cas9核酸酶包含与seq id no:119具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。在某些实施方案中,cas9核酸酶包含氨基酸取代c80a(例如seq id no:1)。在另一个实施方案中,cas9核酸酶包含与seq id no:1具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。
80.在一些实施方案中,2类cas多肽是v型cas多肽。在某些实施方案中,v型cas多肽是cas12。在一些实施方案中,cas12核酸酶是野生型cas12核酸酶(例如氨基酸球菌属cas12a,seq id no:120)。在一些实施方案中,cas12核酸酶包含与seq id no:120具有至少85%、90%、95%、97%、98%、99%或100%同一性的氨基酸序列。可用于本文的tage剂中的cas12a变体的示例包括但不限于cas12a(cpf1)ultra(例如idt目录号10001272)或kleinstiver等人nature biotechnology 37.3(2019):276-282中所述的cas12a,该文献据此通过引用并入。
81.在一些实施方案中,定点修饰多肽还包含与抗原结合多肽结合的缀合部分或与其附接的互补结合部分。在某些实施方案中,缀合部分是蛋白质。在一些实施方案中,蛋白质是spycatcher或halo-tag。
82.在一些实施方案中,定点修饰多肽和抗原结合多肽经由接头缀合。在一些实施方案中,接头是可切割接头。
83.在一些实施方案中,tage剂还包含内体逃逸剂。在某些实施方案中,内体逃逸剂是tdp或tdp-kdel。
附图说明
84.图1是本文所述的核酸酶抗体结合剂与抗体、抗原结合剂或抗体样分子复合形成靶向活性基因编辑(tage)剂的示意图。在图1中,术语“核酸酶抗体结合剂”是指包括核酸酶的定点修饰多肽。
85.图2图示了评估单独的cas9-2xnls-蛋白质a(“cas9-pa”)或与抗cd3抗体复合的cas9-2xnls-蛋白质a (“cas9-pa:α-cd3”)或cas9(c80a)-2xnls(“c80a”)的体外dna切割测定的结果,其中将活性相对于cas9(c80a)-2xnls活性作图。
86.图3图示了评估cas9-2xnls-蛋白质a(“cas9-pa”)或cas9(c80a)-2xnls(“c80a”)在核转染到刺激的人t细胞中后的编辑活性的离体编辑测定的结果。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白核转染到t细胞中以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。将编辑活性相对于cas9(c80a)-2xnls活性作图。
87.图4图示了评估cas9-2xnls-蛋白质a(“cas9-pa”)与抗cd3抗体结合的体外结合测定的结果。还示出了单独的cas9-pa和单独的抗cd3抗体的结果。
88.图5a和5b图示了测量cd8 t细胞(图5a)和cd19 b细胞(图5b)中抗cd3(18nm)或抗cd22(100nm)抗体的pbmc内化速率的基于facs的内化测定的结果。
89.图6a至6c示出了与cas9-2xnls-蛋白质a (“cas9-pa”)复合形成tage剂的抗体(huigg1、cd22)的结合和内化研究的结果。图6a图示了其中将10nm每种指定蛋白添加到pbmc中并染色30分钟的基于facs的细胞结合测定的结果。图6b图示了其中针对指定温度和时间将10nm每种指定蛋白添加到pbmc中的基于facs的内化测定的结果。通过facs分析评估用和未用抗a488抗体猝灭的每种条件的样品。图6c进一步说明了pbmc池中t细胞与b细胞的内化。
90.图7a至7d图示了利用各种猝灭方法(肝素洗涤、酸洗涤、抗a488抗体、未猝灭)的基于facs的内化测定的结果,在所述测定中,在t细胞(图7a和7b)或骨髓细胞(图7c)中评估包含cas9-2xnls-蛋白质a (“cas9-pa”)、抗cd3抗体或与抗cd3抗体复合的cas9-pa(“cas9pa:cd3”)的tage剂的内化。图7a图示了利用用a488标记的抗cd3抗体或具有用a488标记的引导rna的cas9-pa:抗cd3rnp进行内化测定的结果。图7b图示了利用cas9-pa:抗cd3 rnp或具有用atto550标记的引导rna的cas9-pa在t细胞中进行内化测定的结果。图7c图示了利用cas9-pa:抗cd3 rnp或具有用atto550标记的引导rna的cas9-pa在骨髓细胞中进行内化测定的结果。图7d图示了评价每种猝灭方法的毒性效果的基于活死facs的测定的结果。
91.图8图示了评估通过tage剂cas9-2xnls-darpin(ec1)(“cas9-darpin(ec1)”)(也称为cas9-darpin(epcam))或cas9(c80a)-2xnls(“c80a”)进行dna切割的体外dna切割测定的结果,其中将活性相对于cas9(c80a)-2xnls活性作图。
92.图9图示了评估tage剂cas9-2xnls-蛋白质a(cas9-pa)或cas9(c80a)在核转染到刺激的人t细胞中后的编辑的离体编辑测定的结果。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白核转染到t细胞中以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。将编辑活性相对于c80a活性作图。
93.图10a至10d图示了评估tage剂cas9-2xnls-darpin(epcam)(“darpin”)或cas9(c80a)-2xnls(“c80a”)在上皮细胞系bt474或skbr3的细胞表面上的结合的基于facs的结
合测定的结果。图10a和10b图示了10、25、50、100或300nm的cas9(c80a)-2xnls或cas9-2xnls-darpin(epcam)在bt474细胞(图10a)或skbr3细胞(图10b)上的基于facs的结合测定的结果。图11c图示了epcam抗体在skbr3细胞或bt474细胞上结合的结果,表明两种细胞系都表达epcam。图10d图示了25、100或300nm的cas9(c80a)-2xnls或cas9-2xnls-darpin(epcam)在bt474细胞或skbr3细胞上的基于facs的结合测定的结果。
94.图11图示了其中将100nm或300nm tage剂cas9-darpin(epcam)与bt474细胞或skbr3细胞在37℃或4℃下孵育指定时间(60分钟或30分钟),然后在进行或不进行预先猝灭的情况下用facs进行测定的基于facs的内化测定的结果。
95.图12图示了评估通过将tage剂cas9-2xnls-darpin(epcam)rnp与hucd47引导rna在bt474细胞或skbr3细胞中共孵育指定时间(4天或7天)后实现的编辑的离体编辑测定的结果。还示出了从未暴露于rnp的对照细胞获得的结果。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。通过流式细胞术测定的编辑细胞的百分比在每个图上指示。
96.图13图示了在人t细胞中用hucd47引导rna对tage剂cas9-2xnls-darpin(epcam)rnp进行核转染指定时间(4天或7天)后通过流式细胞术评估的离体编辑测定的结果。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。
97.图14a和14b图示了cas9-2xnls-halo:抗cd22 tage剂(“cas9-halo=mcd22”)的分析。图14a图示了来自cas9-halo:抗cd22抗体tage剂的尺寸交换色谱法(s200 10/300increase分级柱)的色谱图,其中8.5-11ml之间的峰代表抗体-cas9缀合材料。图14b是用于鉴定cas9-抗体缀合物的比例的sds-page图像。标记含有来自尺寸交换分析的峰1至峰3的材料的泳道。“ab-2xcas9”是指每个抗体具有两个cas9分子的缀合物。
98.图15a和15b图示了其中将20nm具有a488引导rna的指定tage剂rnp(cas9-2xnls-halo:抗cd22抗体(“cas9-halo:mcd22”)、cas9-2xnls-halo:igg1(“cas9-halo-igg1”)或cas9-2xnls-halo(“cas9-halo”))与总脾细胞(图15a)或肿瘤浸润淋巴细胞(图15b)在37℃或4℃下孵育指定时间(15分钟或60分钟)的基于facs的内化测定的结果。通过对cd19+b细胞进行门控的facs分析评估来自具有和不具有猝灭的每种条件的样品。
99.图16a和16b图示了人t细胞中评估单独的cas9-2xnls-halo(“cas9-halo”)的dna切割或者包含与抗cd22抗体(“cas9-halo:mcd22”)、抗ctla4抗体(“cas9-halo:mctla4”)、igg1(“cas9-halo:igg1”)复合的cas9-2xnls-halo的tage剂的dna切割的体外dna切割测定(图16a)和离体核转染编辑测定(图16b)的结果,其中将活性相对于cas9(c80a)-2xnls活性作图。为了评估离体编辑,将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白核转染到t细胞中以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。图16b另外示出了通过halo-30a.a.-cas9、halo-3a.a.-cas9和higg1:halo-3a.a.-cas9进行的编辑,其中30a.a.和3a.a.是指构建体中肽接头的氨基酸(“a.a.”)长度。
100.图17图示了其中评估指定tage剂rnp(cas9(c80a)-2xnls(“c80a”)、单独的cas9
–
2xnls-halo(“cas9-halo”)或者与抗cd22抗体(“halo-mcd22”)、抗ctla4抗体(“halo-mctla4”)、mhcii-nb(“mhcii-nb”)或igg1(“halo-igg1”)复合的cas9-2xnls-halo)内化到从b16f10肿瘤分离的混合细胞群体中的基于facs的内化测定的结果。示出了门控dc细胞、
非dc骨髓细胞、b细胞、t细胞、非t/b细胞和cd45-pdpn+细胞的结果。
101.图18a-18c图示了利用包括与抗cd22抗体缀合的cas9-2xnls-halo(“cas9-halo”)(图18a;与小鼠脾细胞结合)、抗fap抗体(图18b;与人成纤维细胞结合)或抗ctla-4抗体(图18c;与t细胞结合)的tage剂进行体外结合测定的结果。图18a:将20nm带有a488标记的引导物或a488标记的抗体的rnp与总小鼠脾细胞在冰上孵育30分钟。图18b:将人成纤维细胞与20nm蛋白质在冰上孵育30分钟。将抗体用a488(1:1染料:抗体)标记,并且每个rnp含有a488标记的引导物。图18c:将刺激的小鼠t细胞与20或100nm蛋白质在37℃下孵育15分钟。将抗体用a488(1:1染料:抗体)标记,并且每个rnp含有a488标记的引导物。
102.图18d图示了利用包括与cas9-2xnls-halo缀合并与人皮肤成纤维细胞共孵育的人抗fap抗体的tage剂的离体编辑测定的结果。将人皮肤成纤维细胞铺板过夜。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白与成纤维细胞共孵育以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。将37.5um rnp与细胞在2.5%fbs中孵育1小时。然后添加完全培养基,将rnp稀释至300nm。在孵育后第6天分析样品的cd47表达。
103.图18e和18f图示了利用包括与cas9-halo-2xnls缀合并与调节性t细胞(图18e)或总刺激的t细胞(图18f)共孵育的小鼠抗ctla-4抗体的tage剂进行离体编辑测定的结果。使用tdtomato荧光报告系统测量基因编辑。将诱导的treg或总脾细胞刺激3天。将250,000个细胞与75pmol的rnp(3.75um)和2.5%血清一起孵育一小时。一小时后,添加完全培养基,以将rnp稀释至300nm。在孵育后第6天通过facs分析细胞,以测量tdtomato信号。
104.图19a至19f图示了利用包括与cas9缀合的人抗fap抗体的tage剂进行离体编辑和结合测定的结果。抗体经由spytag(st)部分与spycatcher-cas9(wt)-2xnls缀合(“fap=sc-cas9”)。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白与成纤维细胞共孵育以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。图19a图示了人皮肤成纤维细胞中fap=sc-cas9编辑测定的结果(“c80a”是指cas9(c80a)-2xnls;“fap-ll”是指fap-st-长接头;“fap-sl”是指fap-st-短接头)。图19b和19c图示了人真皮成纤维细胞中以3750nm(图19b)或5850nm(图19c)进行fap=(4x-sc-2x)2编辑测定的结果(“c800a+fap”是指在编辑过程中反式添加的fap-st抗体,以排除未缀合抗体的影响,“2x”是指2xnls,“4x”是指4xnls)。图19d图示了比较人真皮成纤维细胞中hctla4=cas9(“ipi”)与fap=cas9编辑的结果(“无rnp”是指未添加cas9的条件;“c80a:bfp”是指添加有非靶向引导物的cas9(c80a)-2xnls:所有其他条件使用sgcd47作为靶向grna;fap=(sc-cas9)2是指将cas9靶向fap+成纤维细胞的阳性对照;ipi=(sc-cas9)2是指ab-cas9的阴性对照;不应结合成纤维细胞)。图19e示出了利用指定分子进行成纤维细胞结合测定的结果。图19f示出了利用过量fc=sc-cas9和指定分子对人皮肤成纤维细胞进行竞争测定的结果。“pali”是指帕利珠单抗(palivizumab),一种抗呼吸道合胞病毒(rsv)抗体,用作阴性对照;“ipi”是指伊匹木单抗(ipilimumab),一种抗ctla-4抗体,阴性对照;“fc=(sc-cas9)
2”是指连接在一起的抗体的fc部分和2个cas9的阴性对照,“fap=(sc-cas9)
2”是指全长抗体,阳性对照;“fap-f(ab’)2=(sc-cas9)
2”是指仅f(ab’)2,无fc结构域;阳性对照;“fap-fab=(sc-cas9)
2”是指仅fab,单结合域且无fc结构域;阳性对照;“fap=(sc-cas9)2+过量fap”是指添加过量fap抗体以阻断fap=cas9缀合物的结合的附加对照(证明fap介导
的特异性)。
105.图20a至20c图示了对包括结合t细胞的抗体-cas9缀合物(“ab=cas9”)的tage剂进行体外筛选的结果。每种抗体经由spytag(“st)与cas9(wt)-2xnls-spycatcher-htn(“ac28”)缀合。图20a图示了指定rnp结合cd4+t细胞的水平。将总pbmc活化2天,然后用7nm或70nm的ab=cas9缀合物染色。a550信号来自a550标记的引导物。pali=帕利珠单抗,阴性对照。进行具有多重比较的anova,以将每种抗体与帕利珠单抗(“pali”)进行比较;如果抗体比pali显著染色更多,则将其移至下一步骤。图20b和20c图示了在cd8+t细胞(图20b)或cd4+t细胞(图20c)中评估指定抗体=cas9tage剂的t细胞结合是否被未缀合(“冷”)抗体阻断的阻断测定的结果。将tage剂与a550标记的引导物复合,该引导物产生在y轴上标记的a550信号。图20d和20e图示了cd4+t细胞(图20d)和cd8+t细胞(图20e)中被未缀合抗体阻断的ab=cas9结合的百分比。
106.图21a和21b图示了在人cd4+t细胞(图21a)和cd8+t细胞(图21b)中用实施例19中鉴定的包含与cas9缀合的抗体(ab=cas9)的tage剂进行离体编辑测定的结果。抗cd11a和抗cd25a抗体(如实施例21所述的t细胞筛选中鉴定的)与cas9缀合(cd11a=cas9和cd25a=cas9)。每种抗体经由spytag(“st)与cas9(wt)-2xnls-spycatcher-htn(“ac28”)或cas9(wt)-2xnls-spycatcher-4xnls(“ac26”)缀合,以形成基于抗体的tage剂。将靶向cd47的引导rna与相应的tage剂缔合,并将tage剂与t细胞共孵育以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。“2步”表示添加3750nm rnp保持1小时,然后稀释直至300nm,并孵育直至读数。抗体=ac26(或ac28)是指包含全长抗体的测试品;pali=ac26或pali=ac28用作阴性对照,因为它不结合t细胞。f(ab')2是指没有fc结构域的抗体片段。
107.图22a和22b图示了比较用于检测t细胞或成纤维细胞的离体编辑的两种不同方法的测定结果:(1)通过流式细胞术获得的编辑测量结果(例如以检测表型读数,即cd47或cd44的细胞表面表达的损失),或(2)通过下一代测序(ngs)获得的编辑测量结果,以检测编码cd47或cd44的基因的编辑。通过每种方法分析相同的样品并比较测量结果。图22a图示了通过流式细胞术(y轴)与ngs(x轴)获得的具有0%至50%编辑的样品的编辑测量结果之间的比较。图22a图示了通过流式细胞术(y轴)与ngs(x轴)获得的具有0%至2%编辑的样品的编辑测量结果之间的比较(相同样品如图22b,但具有不同的x轴标度)。
具体实施方式
108.本文提供了涉及靶向活性基因编辑(tage)剂的组合物和方法,该tage剂可以在体内和离体编辑特定细胞类型内的核酸。此外,本文提供了用于在体内和离体促进细胞内定点修饰多肽的细胞内化的组合物和方法。tage剂的模块化和可编程设计能够实现快速再靶向和多功能性,从而能够灵活靶向多种所需细胞类型。此外,通过编辑特定靶细胞中的特定核酸,与基于dna的递送方法相比,tage剂具有双重特异性并且具有更少的脱靶效应。为了实现这一点,tage剂包括一种或多种促进细胞结合和/或细胞内化的抗原结合多肽。本组合物和方法的tage剂由此可以促进定点修饰多肽(例如基因编辑多肽)诸如cas9递送和内化到靶细胞类型中。此外,抗原结合多肽不仅允许受体介导的tage剂进入,而且在某些情况下,抗原结合多肽还介导细胞的生物学(例如通过改变细胞内信号转导途径)。本文所述的
tage剂特别适于全身递送。
109.因此,本文提供了涉及tage剂的方法和组合物,该tage剂包含抗原结合多肽以及识别细胞内的核酸序列的定点修饰多肽,其中抗原结合多肽和定点修饰多肽稳定缔合,使得定点修饰多肽可以内化到细胞中。
110.在一个方面,本文提供了一种靶向活性基因编辑(tage)剂,其包含与细胞外细胞膜结合分子(例如细胞表面分子)特异性结合的抗原结合多肽以及识别靶细胞内的核酸序列的定点修饰多肽。抗原结合多肽和定点修饰多肽稳定缔合,使得定点修饰多肽可以内化到展示细胞外细胞膜结合分子的靶细胞中。
111.此外,本文提供了离体或体内修饰细胞基因组的方法,以及经由tage剂向受试者递送定点修饰多肽的方法。通过tage剂进行靶向离体编辑使得能够对细胞(例如造血干细胞)进行遗传修饰以用于多种细胞疗法。另外,向受试者施用tage剂能够在体内靶向编辑所需细胞类型。
112.i.定义
113.术语“靶向活性基因编辑”或“tage”剂是指包括以下项的分子的复合物:与细胞膜上展示的细胞外靶分子(例如细胞外蛋白或聚糖,诸如细胞表面上的细胞外蛋白)特异性结合的抗原结合多肽(例如抗体或其抗原结合部分)以及识别核酸序列的定点修饰多肽(诸如但不限于内切核酸酶)。tage剂的抗原结合多肽与定点修饰多肽缔合,使得至少定点修饰多肽被靶细胞(即表达抗原结合多肽结合的细胞外分子的细胞)内化。tage剂的示例是活性crispr靶向(tage)剂,其中定点多肽是核酸引导的dna内切核酸酶(例如rna引导的内切核酸酶或dna引导的内切核酸酶),诸如cas9或cas12。在一些实施方案中,tage剂包括至少一个nls。值得注意的是,tage剂可以靶向细胞内的任何核酸,包括但不限于基因。
114.本文所用的术语“抗原结合多肽”是指与特定靶抗原结合的蛋白质,诸如细胞外细胞膜结合蛋白质(例如细胞表面蛋白)。抗原结合多肽的示例包括抗体、抗体的抗原结合片段和抗体模拟物。在某些实施方案中,抗原结合多肽是抗原结合肽。
115.如本文所用,“定点修饰多肽”是指通过修饰多肽本身或相关分子(例如rna)识别特定序列而靶向多核苷酸链的特定核酸序列或一组相似序列的蛋白质,其中多肽可以修饰多核苷酸链。
116.本文可互换使用的术语“多肽”或“蛋白质”是指氨基酸的任何聚合链。术语“多肽”涵盖天然或人工蛋白质、蛋白质片段和蛋白质序列的多肽类似物。
117.本文所用的术语“缀合部分”是指能够缀合两个或更多个分子的部分,诸如抗原结合蛋白和定点修饰多肽。本文所用的术语“缀合”是指在分子(例如抗体)与第二分子(例如定点修饰多肽、治疗剂、药物或靶向分子)之间形成的物理或化学络合。化学络合具体地构成在第一分子(例如抗体)的官能团与第二分子(例如定点修饰多肽、治疗剂或药物)的官能团之间形成的键或化学部分。此类键包括但不限于共价键和非共价键,而此类化学部分包括但不限于酯、碳酸酯、亚胺磷酸酯、腙、缩醛、原酸酯、肽键和寡核苷酸键。在一个实施方案中,缀合经由物理缔合或非共价络合实现。
118.如本文所用,术语“靶细胞”是指包括需要在其中对核酸进行定点修饰(例如,以在体内或离体产生遗传修饰的细胞)的核酸序列的细胞或细胞群体,诸如哺乳动物细胞(例如人类细胞)。在一些情况下,靶细胞在其细胞膜上展示tage剂的抗原结合多肽特异性结合的
细胞外分子(例如细胞外蛋白,诸如受体或配体或聚糖)。
119.如本文所用,术语“遗传修饰的细胞”是指其中dna序列已被定点修饰多肽有意修饰的细胞或其祖先。
120.如本文所用,术语“核酸”是指包含核苷酸的分子,包括多核苷酸、寡核苷酸或其他dna或rna。在一个实施方案中,核酸存在于细胞中并且可以经由细胞分裂传递给细胞的后代。在一些情况下,核酸是在其染色体内的细胞基因组中发现的基因(例如内源基因)。在其他情况下,核酸是已转染到细胞中的哺乳动物表达载体。使用例如转染方法掺入细胞基因组中的dna也被认为在本文所用的“核酸”的范围内,即使所掺入的dna不意味着传递给后代细胞。
121.如本文所用,术语“内体逃逸剂”或“内体释放剂”是指在与分子(例如多肽,诸如定点修饰多肽)缀合时能够促进分子从细胞内的内体释放的试剂(例如肽)。保留在内体内的多肽最终可以被靶向降解或回收利用,而不是释放到细胞质中或运输到所需的亚细胞目的地。因此,在一些实施方案中,tage剂包含内体逃逸剂。
122.如本文所用,术语“稳定缔合”在用于tage剂的上下文中时是指抗原结合多肽和定点修饰多肽以如下方式复合的能力:复合物可以内化到靶细胞中,使得核酸编辑可以在细胞内发生。确定tage剂是否稳定缔合的方式的示例包括体外分析,由此在细胞暴露于tage剂后确定复合物的缔合,例如通过使用标准基因编辑系统确定是否发生基因编辑。此类分析的示例是本领域已知的,诸如sds-page、蛋白质印迹分析、尺寸排阻色谱法和确定蛋白质复合物和pcr扩增的电泳迁移率变动分析、直接测序(例如下一代测序或sanger测序)、用核酸酶(例如celery)酶促切割基因座以确认编辑;以及间接表型分析,其测量编辑特定基因的下游效应,诸如如通过蛋白质印迹或流式细胞术测量的蛋白质损失或者如通过功能分析测量的功能蛋白质产生。
123.如本文所用,术语“修饰核酸”是指对定点修饰多肽靶向的核酸的任何修饰。此类修饰的示例包括氨基酸序列的任何改变,包括但不限于相对于参考序列(例如野生型或天然序列)核酸序列中氨基酸残基的任何插入、缺失或取代。此类氨基酸改变可例如导致基因表达的改变(例如表达的增加或减少)或核酸序列的替换。核酸的修饰可以进一步包括双链切割、单链切割或本文公开的任何rna引导的内切核酸酶与靶位点的结合。rna引导的内切核酸酶的结合可以抑制核酸的表达或可以增加与包含靶位点的核酸可操作连接的任何核酸的表达。
124.术语“细胞穿透肽”(cpp)是指长度通常为约5-60个氨基酸残基(例如5-10、10-15、15-20、20-25、25-30、30-35、35-40、40-45、45-50、50-55或55-60个氨基酸残基)的肽,其可以促进细胞摄取缀合分子,特别是一种或多种位点特异性修饰多肽。在某些实施方案中,cpp还可以被表征为能够促进分子缀合物移动或穿过/通过脂双层、胶束、细胞膜、细胞器膜(例如核膜)、囊泡膜或细胞壁中的一种或多种。在某些实施方案中,本文的cpp可以是阳离子的、两亲性的或疏水性的。本文可用的cpp的示例以及一般对cpp的进一步描述在borrelli,antonella等人molecules 23.2(2018):295;milletti,francesca.drug discovery today 17.15-16(2012):850-860中公开,这些文献通过引用并入本文。此外,存在经实验验证的cpp的数据库(cppsite,gautam等人,2012)。tage剂的cpp可以是任何已知的cpp,诸如cppsite数据库中显示的cpp。
125.如本文所用,术语“核定位信号”或“nls”是指在与分子(例如多肽,诸如定点修饰多肽)缀合时能够通过核转运促进分子进入细胞核中的肽。例如,nls可以指导与其缔合的蛋白质从细胞的细胞质转运穿过核被膜屏障。nls旨在不仅包括特定肽的核定位序列,而且包括能够指导细胞质多肽易位穿过核被膜屏障的衍生物。在一些实施方案中,一个或多个nls(例如1、2、3、4、5、6、7、8、2-6、3-7、4-8、5-9、6-10、7-10、8-10个nls)可以附接到本文的tage剂的多肽的n-末端、c-末端或n-末端和c-末端两者。
126.本文所用的术语“tat-相关肽”是指衍生自人免疫缺陷病毒的转录反式激活因子(tat)的cpp。tat肽的氨基酸序列包含rkkrrqrrr(seq id no:9)。因此,tat-相关肽包括包含rkkrrqrrr(seq id no:9)的氨基酸序列或具有保守氨基酸取代的氨基酸序列的任何肽,其中该肽仍然能够内化到细胞中。在某些实施方案中,tat-相关肽包括1、2或3个氨基酸取代,其中tat-相关肽能够内化到靶细胞中。
127.如本文所用,术语“特异性结合”是指识别并结合样品中存在的抗原的抗原结合多肽,但该抗原结合多肽基本上不识别或结合样品中的其他分子。在一个实施方案中,与抗原特异性结合的抗原结合多肽以至少约1
×
10-4
、1
×
10-5
、1
×
10-6
m、1
×
10-7
m、1
×
10-8
m、1
×
10-9
m、1
×
10-10
m、1
×
10-11
m、1
×
10-12
m或更大的kd(如通过表面等离子体共振或本领域已知的其他方法(例如过滤结合分析、荧光偏振、等温滴定量热法)测定,包括本文进一步描述的那些)与抗原结合。在一个实施方案中,如果抗原结合多肽以比其对非特异性抗原的亲和力大至少两倍的亲和力(如通过表面等离子体共振测定)与抗原结合,则抗原结合多肽与抗原特异性结合。当在配体的上下文中使用时,术语“特异性结合”是指配体能够识别并结合其相应受体。当在cpp的上下文中使用时,术语“特异性结合”是指cpp能够使细胞膜易位。在一些情况下,当将cpp和抗体或配体组合为tage剂时,tage剂可显示抗体或配体和cpp的特异性结合特性。例如,在此类情况下,tage剂的抗体或配体可赋予与细胞外细胞表面分子诸如细胞表面蛋白的特异性结合,而cpp赋予tage剂增强的易位穿过细胞膜的能力。
128.术语“抗体”在本文中以最广泛的意义使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)、纳米抗体、单抗体和抗体片段,只要它们表现出所需的抗原结合活性即可。
129.术语“抗体”包括包含通过二硫键互相连接的四条多肽链、两条重(h)链和两条轻(l)链的免疫球蛋白分子及其多聚体(例如igm)。每条重链(hc)包含重链可变区(或结构域)(本文缩写为hcvr或vh)和重链恒定区(或结构域)。重链恒定区包含三个结构域ch1、ch2和ch3。每条轻链(lc)包含轻链可变区(本文缩写为lcvr或vl)和轻链恒定区。轻链恒定区包含一个结构域(cl1)。每个vh和vl由三个互补决定区(cdr)和四个框架区(fr)组成,它们从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、1-r3、cdr3、fr4。免疫球蛋白分子可以是任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或亚类。因此,vh和vl区可以进一步细分为高变区,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,它们从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
130.如本文所用,术语“cdr”或“互补决定区”是指在重链和轻链多肽的可变区内发现的非连续抗原结合位点。这些特定区域已经由kabat等人,j.biol.chem.252,6609-6616(1977)和kabat等人,sequences of protein of immunological interest.(1991)以及由
chothia等人,j.mol.biol.196:901-917(1987)和maccallum等人,j.mol.biol.262:732-745(1996)描述,其中当相互比较时,定义包括氨基酸残基的重叠或子集。列出了包括上面引用的每一篇考文献所定义的cdr的氨基酸残基以用于比较。优选地,术语“cdr”是基于序列比较由kabat定义的cdr。
131.术语“fc结构域”用于定义免疫球蛋白重链的c-末端区,其可通过完整抗体的木瓜蛋白酶消化产生。fc结构域可以是天然序列fc结构域或变体fc结构域。免疫球蛋白的fc结构域通常包含两个恒定结构域ch2结构域和ch3结构域,并且任选地包含ch4结构域。在fc部分中替换氨基酸残基以改变抗体效应子功能是本领域已知的(winter等人美国专利号5,648,260、5,624,821)。抗体的fc结构域介导几种重要的效应子功能,例如细胞因子诱导、adcc、吞噬作用、补体依赖性细胞毒性(cdc)和抗体和抗原-抗体复合物的半衰期/清除率。在某些实施方案中,在含有fc结构域的结合蛋白的fc结构域中改变(例如缺失、插入或替换)至少一个氨基酸残基,使得结合蛋白的效应子功能被改变。
132.本文所用的“完整”或“全长”抗体是指包含四条多肽链、两条重(h)链和两条轻(l)链的抗体。在一个实施方案中,完整抗体是完整igg抗体。
133.如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即构成该群体的个体抗体是相同的和/或结合相同的表位,除了可能的变体抗体,例如含有天然存在的突变或在单克隆抗体制剂的产生过程中产生,此类变体通常少量存在。与多克隆抗体制剂(通常包括针对不同决定子(表位)的不同抗体)相比,单克隆抗体制剂的每个单克隆抗体针对抗原上的单个决定子。因此,修饰语“单克隆”表示从基本上同质的抗体群体获得的抗体的特征,并且不应被解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可通过多种技术制备,包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法以及利用包含人免疫球蛋白基因座的全部或一部分的转基因动物的方法,此类方法和其他制备单克隆抗体的示例性方法如本文所述。
134.本文所用的术语“人抗体”是指具有其中框架区和cdr区都源自人种系免疫球蛋白序列的可变区的抗体。此外,如果抗体含有恒定区,则恒定区也源自人种系免疫球蛋白序列。本发明的人抗体可包括并非由人种系免疫球蛋白序列编码的氨基酸残基(例如通过体外随机或位点特异性诱变或者通过体内体细胞突变引入的突变)。然而,本文所用的术语“人抗体”并非旨在包括其中源自另一哺乳动物物种诸如小鼠的种系的cdr序列已被移植到人框架序列上的抗体。
135.术语“人源化抗体”旨在是指其中源自一种哺乳动物物种诸如小鼠的种系的cdr序列已被移植到人框架序列上的抗体。可在人框架序列中进行其他框架区修饰。抗体(例如非人抗体)的“人源化形式”是指已经历人源化的抗体。
136.术语“嵌合抗体”旨在是指其中可变区序列源自一种物种而恒定区序列源自另一种物种的抗体,诸如其中可变区序列源自小鼠抗体而恒定区序列源自人抗体的抗体。
137.抗体的“抗体片段”、“抗原结合片段”或“抗原结合部分”是指除完整抗体以外的包含完整抗体的一部分并结合完整抗体所结合的抗原的分子。抗体片段的示例包括但不限fv、fab、fab'、fab'-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(例如scfv);以及由抗体片段形成的多特异性抗体。
[0138]“多特异性抗原结合多肽”或“多特异性抗体”是靶向并结合一种以上抗原或表位
的抗原结合多肽。“双特异性”、“双重特异性”或“双功能性”抗原结合多肽或抗体是分别具有两个不同抗原结合位点的杂合抗原结合多肽或抗体。双特异性抗原结合多肽和抗体是多特异性抗原结合多肽或多特异性抗体的示例,并且可通过多种方法产生,包括但不限于杂交瘤的融合或fab'片段的连接。参见例如songsivilai和lachmann,1990,clin.exp.immunol.79:315-321;kostelny等人,1992,j.immunol.148:1547-1553,brinkmann and kontermann.2017.mabs.9(2):182-212。例如,双特异性抗原结合多肽或抗体的两个结合位点将与两个不同的表位结合,这两个表位可位于相同或不同的蛋白靶标上。
[0139]
术语“抗体模拟物”或“抗体模仿物”是指在结构上与抗体无关但能够与抗原特异性结合的分子。抗体模拟物的示例包括但不限于adnectin(即,基于纤连蛋白的结合分子)、affilin、affimer、affitin、alphabody、affibody、darpin、anticalin、avimer、fynomer、kunitz结构域肽、单抗体、nanoclamp、纳米抗体、unibody、versabody、适体和肽分子,所有这些均采用结合结构,虽然这些结合结构模拟传统的抗体结合,但经由不同的机制产生和起作用。
[0140]
本文所述的氨基酸序列可包括“保守突变”,包括改变、添加或缺失编码序列中单个氨基酸或少量氨基酸的核酸取代、缺失或添加,其中核酸改变导致化学上相似的氨基酸的取代。保守氨基酸取代是指第一氨基酸被具有与第一氨基酸相似的化学和/或物理性质(例如电荷、结构、极性、疏水性/亲水性)的第二氨基酸替换。保守取代包括以下组内的一个氨基酸被另一个替换:赖氨酸(k)、精氨酸(r)和组氨酸(h);天冬氨酸(d)和谷氨酸(e);天冬酰胺(n)和谷氨酰胺(q);n、q、丝氨酸(s)、苏氨酸(t)和酪氨酸(y);k、r、h、d和e;d、e、n和q;丙氨酸(a)、缬氨酸(v)、亮氨酸(l)、异亮氨酸(i)、脯氨酸(p)、苯丙氨酸(f)、色氨酸(w)、甲硫氨酸(m)、半胱氨酸(c)和甘氨酸(g);f、w和y;h、f、w和y;c、s和t;c和a;s和t;c和s;s、t和y;v、i和l;v、i和t。其他保守氨基酸取代也被认为是有效的,这取决于所讨论的氨基酸的上下文。例如,在一些情况下,甲硫氨酸(m)可以取代赖氨酸(k)。另外,因保守变异而不同的序列通常是同源的。
[0141]
术语“分离的”是指基本上不含其他细胞物质的化合物,其可以是例如抗体或抗体片段。因此,在一些方面,提供的抗体是已经从具有不同特异性的抗体中分离出来的分离抗体。
[0142]
其他定义在以下部分中描述。
[0143]
本发明的各个方面在以下小节中进一步详细地描述。
[0144]
ii.靶向活性基因编辑(tage)剂
[0145]
本发明包括可用于将基因编辑多肽(即,定点修饰多肽)递送到靶细胞的靶向活性基因编辑(tage)剂。在一些实施方案中,tage剂可以是生物制剂。在特定的实施方案中,定点修饰多肽含有允许蛋白质与抗原结合蛋白缀合的缀合部分,该抗原结合蛋白结合与细胞膜的细胞外区域相关的抗原。这种靶标特异性允许将定点修饰多肽仅递送到展示抗原的细胞(例如造血干细胞(hsc)、造血祖干细胞(hpsc)、自然杀伤细胞、巨噬细胞、dc细胞、非dc骨髓细胞、b细胞、t细胞(例如活化的t细胞)、成纤维细胞或其他细胞)。此类细胞可与某种组织或与疾病相关的细胞类型相关。因此,tage剂提供了一种可以修饰靶细胞基因组的方式。
[0146]
在一个实施方案中,tage剂包含识别crispr序列的核酸引导的内切核酸酶(例如
rna引导的内切核酸酶或dna引导的内切核酸酶)(诸如cas9)以及与位于靶细胞膜上的细胞外分子(例如蛋白质、聚糖、脂质)特异性结合的抗原结合蛋白。可以用于本发明的tage剂中的抗原结合蛋白的示例包括但不限于抗体、抗体的抗原结合部分或抗体模拟物。可以用于本文所述的组合物和方法中的抗原结合蛋白的类型在部分iv中更详细地描述。
[0147]
tage剂内的蛋白质(即至少定点修饰多肽和抗原结合多肽)稳定缔合,使得抗原结合蛋白将定点修饰多肽导向细胞表面,并且定点修饰多肽内化到靶细胞中。在某些实施方案中,抗原结合蛋白与细胞表面上的抗原结合,使得定点修饰多肽被靶细胞内化,但抗原结合蛋白不被内化。在一些实施方案中,定点修饰多肽和抗原结合蛋白都内化到靶细胞中。
[0148]
如在部分iii中更详细地描述,在某些实施方案中,当定点修饰多肽是核酸引导的内切核酸酶诸如cas9时,核酸引导的内切核酸酶与引导核酸缔合以形成核蛋白。例如,引导rna(grna)与rna引导的核酸酶结合以形成核糖核蛋白(rnp),或引导dna与dna引导的核酸酶结合以形成脱氧核糖核酸(dnp)。在其他实施方案中,核酸引导的内切核酸酶与包含dna:rna杂合体的引导核酸缔合。在此类情况下,核糖核蛋白(即rna引导的内切核酸酶和引导rna)、脱氧核糖核酸(即dna引导的内切核酸酶和引导dna)或与dna:rna杂合体结合的核酸引导的内切核酸酶内化到靶细胞中。在单独的实施方案中,引导核酸(例如rna、dna或dna:rna杂合体)与核酸引导的内切核酸酶分开递送到靶细胞中。引导核酸(例如rna、dna或dna:rna杂合体)可能在核酸引导的内切核酸酶与tage剂接触后内化时已经存在于靶细胞中。
[0149]
tage剂与位于靶细胞膜上的细胞外分子(例如蛋白质、聚糖、脂质)特异性结合。靶分子可以是例如细胞外膜结合蛋白,但也可以是非蛋白分子诸如聚糖或脂质。在一个实施方案中,细胞外分子是由靶细胞表达的细胞外蛋白,诸如配体或受体。细胞外靶分子可与生物体内的特定疾病病症或特定组织相关。与细胞膜相关的细胞外分子靶标的示例在以下部分中描述。
[0150]
定点修饰多肽包含缀合部分,使得抗原结合蛋白可以稳定地与定点修饰多肽缔合(从而形成tage剂)。缀合部分提供抗原结合蛋白与定点修饰多肽之间的共价或非共价连接。
[0151]
在某些实施方案中,可用于本发明的tage剂的缀合部分在细胞外是稳定的,防止tage剂的聚集,并且/或者保持tage剂在水性介质中自由溶解并处于单体状态。在转运或递送到细胞中之前,tage剂是稳定的并且保持完整,例如抗体或其抗原结合蛋白保持与核酸引导的内切核酸酶连接。
[0152]
在一个实施方案中,缀合部分是蛋白质a,其中定点修饰多肽包含蛋白质a,并且抗原结合蛋白包含可以被蛋白质a结合的fc区,例如包含fc结构域的抗体。在一个实施方案中,定点修饰多肽包含seq id no:2或其fc结合部分(seq id no:2对应于蛋白质a的氨基酸序列)。
[0153]
在另一个实施方案中,缀合部分是spycatcher/spytag肽系统。例如,在某些实施方案中,定点修饰多肽包含spycatcher(例如在n-末端或c-末端),并且抗原结合多肽包含spytag。例如,在定点修饰多肽包含cas9的情况下,cas9可与spycatcher缀合以形成spycatcher-cas9(seq id no:6)或cas9-spycatcher(seq id no:7)。在一个实施方案中,spytag肽序列是vptivmvdaykryk(seq id no:116)。
[0154]
可用于本文提供的tage剂的其他缀合部分包括但不限于spycatcher标签、snoop
标签、卤代烷脱卤素酶(halo-tag)、sortase、单亲和素、acp标签、snap标签或本领域已知的任何其他缀合部分。在一个实施方案中,抗体结合部分选自蛋白质a、cbp、mbp、gst、poly(his)、生物素/链霉亲和素、v5-tag、myc-tag、ha-tag、ne-tag、his-tag、flag标签、halo-tag、snap-tag、fc-tag、nus-tag、bccp、硫氧还蛋白、snooprtag、spytag、spycatcher、isopeptag、sbp-tag、s-tag、avitag和钙调蛋白。
[0155]
在一些实施方案中,抗体结合部分是化学标签。例如,化学标签可以是snap标签、clip标签、halotag或tmp-tag。在一个示例中,化学标签是snap标签或clip标签。snap和clip融合蛋白使得几乎任何分子能够特异性共价附接到目的蛋白。在另一个示例中,化学标签是halotag。halotag涉及模块化蛋白标记系统,其允许不同分子在溶液中、在活细胞中或在化学固定的细胞中连接到单个遗传融合体上。在另一个示例中,化学标签是tmp-tag。
[0156]
在一些实施方案中,抗体结合部分是表位标签。例如,表位标签可以是多组氨酸标签,诸如六组氨酸标签(seq id no:25)或十二组氨酸(seq id no:126)、flag标签、myc标签、ha标签、gst标签或v5标签。
[0157]
根据缀合方法,定点修饰多肽和抗原结合蛋白可各自经工程化以包含互补结合对,所述互补结合对使得抗体结合剂与相应的抗体、其抗原结合片段或抗体模拟物接触时能够稳定缔合。示例性结合部分配对包括(i)链霉亲和素结合肽(sbp)和链霉亲和素(stv),(ii)生物素和ema(增强的单体亲和素),(iii)spytag(st)和spycatcher(sc),(iv)halo-tag和halo-tag配体,(v)和snap-tag,(vi)myc标签和抗myc免疫球蛋白,(vii)flag标签和抗flag免疫球蛋白,以及(ix)ybbr标签和辅酶a基团。在一些实施方案中,抗体结合单位选自sbp、生物素、spytag、spycatcher、halo-tag、snap-tag、myc标签或flag标签。
[0158]
在某些实施方案中,定点修饰多肽可以另选地经由本文所述的一个或多个接头与抗原结合蛋白缔合,其中接头是缀合部分。
[0159]
本文所用的术语“接头”意指包含共价键或原子链的二价化学部分,其将抗原结合蛋白共价附接到定点修饰多肽以形成tage剂。肽或大分子缀合的任何已知方法可以用于本公开的上下文中。通常,抗原结合蛋白和定点修饰多肽的共价附接需要接头具有两个反应性官能团,即反应意义上的二价。可用于附接两个或更多个功能性或生物活性部分(诸如肽、核酸、药物、毒素、抗体、半抗原和报告基团)的二价接头试剂是已知的,并且用于这种缀合的方法已经在例如hermanson,g.t.(1996)bioconjugate techniques;academic press:new york,第234-242页中描述,该文献的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。其他接头在例如tsuchikama,k.和zhiqiang,a.protein and cell,9(1),第33-46页,(2018)中公开,该文献的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。
[0160]
通常,适用于所公开的组合物和方法中的接头在循环中是稳定的,但允许抗原结合蛋白和/或定点修饰多肽在靶细胞中或另选地在靶细胞附近释放。适于本公开的接头可广泛地分类为不可切割的或可切割的,以及细胞内的或细胞外的,它们各自在下文进一步描述。
[0161]
不可切割接头
[0162]
在一些实施方案中,缀合抗原结合蛋白和定点修饰多肽的接头是不可切割的。不可切割接头包含抗降解(例如,蛋白水解)的稳定化学键。通常,不可切割接头需要在靶细胞
immunoconjugates:antibody conjugates in radioimagery and therapy of cancer(c.w.vogel ed.,oxford u.press,1987。还可参见美国专利号4,880,935,这些文献中的每一篇的公开内容全文通过引用并入本文,因为其涉及适于共价缀合的接头)。基于二硫化物的接头在血浆循环中往往相对不稳定,然而,这种较低的稳定性在需要细胞外切割的情况下可能是有利的。也可通过例如在二硫化物部分附近引入空间位阻以阻碍还原切割来调节对切割的敏感性。
[0168]
对酶促水解敏感的接头可以是例如被细胞内肽酶或蛋白酶(包括但不限于溶酶体或内体蛋白酶)切割的含肽接头。在一些实施方案中,肽基接头的长度为至少两个氨基酸或至少三个氨基酸。示例性氨基酸接头包括二肽、三肽、四肽或五肽。合适的肽的示例包括含有氨基酸诸如缬氨酸、丙氨酸、瓜氨酸(cit)、苯丙氨酸、赖氨酸、亮氨酸和甘氨酸的那些。包含氨基酸接头组分的氨基酸残基包括天然存在的那些,以及次要氨基酸和非天然存在的氨基酸类似物,诸如瓜氨酸。示例性二肽包括缬氨酸-瓜氨酸(vc或val-cit)和丙氨酸-苯丙氨酸(af或ala-phe)。示例性三肽包括甘氨酸-缬氨酸-瓜氨酸(gly-val-cit)和甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)。在一些实施方案中,接头包括二肽,诸如val-cit、ala-val或phe-lys、val-lys、ala-lys、phe-cit、leu-cit、ile-cit、phe-arg或trp-cit。含有二肽诸如val-cit或phe-lys的接头在例如美国专利号6,214,345中公开,该文献的公开内容全文通过引用并入本文,因为其涉及适于共价缀合的接头。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在某些实施方案中,包含肽部分的接头可能对细胞内和细胞外的不同程度的切割敏感。因此,在一些实施方案中,接头包含二肽,并且tage剂在细胞外被切割。因此,在一些实施方案中,接头包含二肽,并且tage剂在细胞外是稳定的,在细胞内被切割。
[0169]
适于将本文公开的抗原结合蛋白与本文公开的定点修饰多肽缀合的接头包括能够通过1,6-消除过程释放抗原结合蛋白或定点修饰多肽的那些。能够进行该消除过程的化学部分包括对氨基苄基(pab)基团、6-马来酰亚胺基己酸、ph-敏感性碳酸酯和其他试剂,如jain等人,pharm.res.32:3526-3540,2015中所述,该文献的公开内容全文通过引用并入本文,因为其涉及适于共价缀合的接头。
[0170]
在一些实施方案中,接头包括“自消”基团,诸如上述pab或pabc(对氨基苄氧基羰基),这些基团在例如carl等人,j.med.chem.(1981)24:479-480、chakravarty等人(1983)j.med.chem.26:638-644、us6214345、us20030130189、us20030096743、us6759509、us20040052793、us6218519、us6835807、us6268488、us20040018194、w098/13059、us20040052793、us6677435、us5621002、us20040121940、w02004/032828中公开。能够进行该过程的其他此类化学部分(“自消接头”)包括氨基甲酸亚甲酯和杂芳基基团,诸如氨基噻唑、氨基咪唑、氨基嘧啶等。含有此类杂环自消耗基团的接头在例如美国专利公开20160303254和20150079114以及美国专利号7,754,681、hay等人(1999)bioorg.med.chem.lett.9:2237、us 2005/0256030、de groot等人(2001)j.org.chem.66:8815-8830以及us 7223837中公开。在一些实施方案中,二肽与自消接头组合使用。
[0171]
适用于本文的接头还可包括选自以下项的一个或多个基团:c
1-c6亚烷基、c
1-c6杂亚烷基、c
2-c6亚烯基、c
2-c6杂亚烯基、c
2-c6亚炔基、c
2-c6杂亚炔基、c
3-c6亚环烷基、杂亚环烷基、亚芳基、杂亚芳基以及它们的组合,这些基团中的每一者可任选地被取代。此类基团的非限制性示例包括(ch2)
p
、(ch2ch2o)
p
和
–
(c=o)(ch2)
p-单元,其中p为针对每种情况独立
选择的1-6的整数。
[0172]
在一些实施方案中,接头可包括以下项中的一个或多个:肼、二硫化物、硫醚、二肽、对氨基苄基(pab)基团、杂环自消基团、任选取代的c
1-c6烷基、任选取代的c
1-c6杂烷基、任选取代的c
2-c6烯基、任选取代的c
2-c6杂烯基、任选取代的c
2-c6炔基、任选取代的c
2-c6杂炔基、任选取代的c
3-c6环烷基、任选取代的杂环烷基、任选取代的芳基、任选取代的杂芳基、溶解度增强基团、酰基、-(c=o)-或-(ch2ch2o)
p-基团,其中p为1-6的整数。本领域技术人员将认识到,所列基团中的一个或多个可以二价(双自由基)物质(例如c
1-c6亚烷基等)的形式存在。
[0173]
在一些实施方案中,接头包括对氨基苄基基团(pab)。在一个实施方案中,对氨基苄基基团设置在接头中的细胞毒性药物与蛋白酶切割位点之间。在一个实施方案中,对氨基苄基基团是对氨基苄氧基羰基单元的一部分。在一个实施方案中,对氨基苄基基团是对氨基苄基酰氨基单元的一部分。
[0174]
在一些实施方案中,接头包含pab、val-cit-pab、val-ala-、pab、val-lys(ac)-pab、phe-lys-pab、phe-lys(ac)-pab、d-val-leu-lys、gly-gly-arg、ala-ala-asn-pab或ala-pab。在一些实施方案中,接头包含以下项中的一个或多个的组合:肽、寡糖、-(ch2)
p-、-(ch2ch2o)
p-、pab、val-cit-pab、val-ala-pab、val-lys(ac)-pab、phe-lys-pab、phe-lys(ac)-pab、d-val-leu-lys、gly-gly-arg、ala-ala-asn-pab或ala-pab。
[0175]
合适的接头可被调节溶解度或反应性的基团取代。合适的接头可含有具有溶解度增强特性的基团。包括(ch2ch2o)
p
单元(聚乙二醇,peg)的接头例如可以增强溶解度,正如可以被氨基、磺酸、膦酸或磷酸残基取代的烷基链一样。包括此类部分的接头在例如美国专利号8,236,319和9,504,756中公开,这些文献中的每一篇的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。含有此类基团的接头在例如美国专利号9,636,421和美国专利申请公开号2017/0298145中描述,这些文献的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。
[0176]
用于共价缀合本文公开的抗原结合蛋白和定点修饰多肽的合适接头可以具有两个反应性官能团(即两个反应性末端),一个用于与抗原结合蛋白缀合,另一个用于与定点修饰多肽缀合。在某些实施方案中,抗原结合蛋白上用于缀合的合适位点是亲核性的,诸如硫醇、氨基基团或羟基基团。可存在于本文公开的抗原结合蛋白内的反应性(例如亲核性)位点包括但不限于氨基酸残基上的亲核取代基,诸如(i)n-末端胺基团,(ii)侧链胺基团,例如赖氨酸,(iii)侧链硫醇基团,例如半胱氨酸,(iv)侧链羟基基团,例如丝氨酸;或者(iv)糖羟基或氨基基团,其中抗体是糖基化的。抗原结合蛋白上用于缀合的合适位点包括但不限于丝氨酸、苏氨酸和酪氨酸残基的羟基部分;赖氨酸残基的氨基部分;天冬氨酸和谷氨酸残基的羧基部分;以及半胱氨酸残基的硫醇部分,以及非天然存在的氨基酸的炔丙基、叠氮基、卤代芳基(例如氟代芳基)、卤代杂芳基(例如氟代杂芳基)、卤代烷基和卤代杂烷基部分。因此,在某些实施方案中,接头上的抗体缀合反应性末端是硫醇反应性基团(诸如双键,如在马来酰亚胺中)、离去基团(诸如氯、溴、碘)或r-硫基基团或羧基基团。
[0177]
在某些实施方案中,定点修饰多肽上用于缀合的合适位点也可以是亲核性的。可存在于本文公开的定点修饰多肽内的反应性(例如亲核性)位点包括但不限于氨基酸残基上的亲核取代基,诸如(i)n-末端胺基团,(ii)侧链胺基团,例如赖氨酸,(iii)侧链硫醇基
团,例如半胱氨酸,(iv)侧链羟基基团,例如丝氨酸;或者(iv)糖羟基或氨基基团,其中抗体是糖基化的。定点修饰多肽上用于缀合的合适位点包括但不限于丝氨酸、苏氨酸和酪氨酸残基的羟基部分;赖氨酸残基的氨基部分;天冬氨酸和谷氨酸残基的羧基部分;以及半胱氨酸残基的硫醇部分,以及非天然存在的氨基酸的炔丙基、叠氮基、卤代芳基(例如氟代芳基)、卤代杂芳基(例如氟代杂芳基)、卤代烷基和卤代杂烷基部分。因此,在某些实施方案中,接头上的定点修饰多肽缀合反应性末端是硫醇反应性基团(诸如双键,如在马来酰亚胺中)、离去基团(诸如氯、溴、碘)或r-硫基基团或羧基基团。
[0178]
在一些实施方案中,附接到接头的反应性官能团是与抗原结合蛋白、定点修饰多肽或两者上存在的亲电子基团反应的亲核基团。抗原结合蛋白或定点修饰多肽上有用的亲电子基团包括但不限于醛和酮羰基基团。亲核基团的杂原子可以与抗原结合蛋白或定点修饰多肽上的亲电子基团反应,并与抗原结合蛋白或定点修饰多肽形成共价键。有用的亲核基团包括但不限于酰肼、肟、氨基、羟基、肼、缩氨基硫脲、羧酸肼和芳酰肼。
[0179]
在一些实施方案中,本文公开的tage剂包含核苷或核苷酸。此类核苷或核苷酸上用于缀合的合适位点分别包括-oh或磷酸基团。适用于此类实施方案的接头和缀合方法在例如wang,t.p.等人,bioconj.chem.21(9),1642-55,2010以及bernardinelli,g.和hogberg,b.nucleic acids research,45(18),第e160页(2017年8月16日在线公布)中公开,这些文献中的每一篇的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。
[0180]
当术语“接头”用于描述缀合形式的接头时,由于在接头与抗原结合蛋白之间和/或在接头与定点修饰多肽之间形成键,一个或两个反应性末端将不存在(已转化为化学部分)或不完全(诸如仅为羧酸的羰基)。因此,可用于本文的接头包括但不限于含有以下项的接头:通过接头上的反应性官能团与抗原结合蛋白上的亲核基团或其他反应性取代基之间的偶联反应形成的化学部分,以及通过接头上的反应性官能团与定点修饰多肽上的亲核基团之间的偶联反应形成的化学部分。
[0181]
通过这些偶联反应形成的化学部分的示例由化学反应性官能团(包括亲核体/亲电体对(例如硫醇/卤代烷基对、胺/羰基对,或者硫醇/α,β-不饱和羰基对等)、二烯/亲二烯体对(例如叠氮化物/炔烃对,或者二烯/α,β不饱和羰基对等)等)之间的反应产生。反应性官能团之间形成化学部分的偶联反应包括但不限于硫醇烷基化、羟基烷基化、胺烷基化、胺或羟胺缩合、肼形成、酰胺化、酯化、二硫化物形成、环加成(例,[4+2]diels-alder环加成、[3+2]huisgen环加成等)、亲核芳族取代、亲电芳族取代以及本领域已知或本文所述的其他反应性形式。合适的接头可含有用于与抗原结合蛋白、定点修饰多肽或两者上的亲核官能团反应的亲电官能团。
[0182]
在一些实施方案中,存在于本文公开的抗原结合蛋白、定点修饰多肽或两者内的反应性官能团是胺或硫醇部分。某些抗原结合蛋白具有可还原的链间二硫化物,即半胱氨酸桥。通过用还原剂诸如dtt(二硫苏糖醇)处理,可使抗原结合蛋白对于与接头试剂缀合具有反应性。因此,理论上每个半胱氨酸桥将形成两个反应性硫醇亲核体。可以通过赖氨酸与2-亚氨基硫杂环戊烷(traut试剂)反应,使胺转化为硫醇,将另外的亲核基团引入抗原结合蛋白中。可通过引入一个、两个、三个、四个或更多个半胱氨酸残基(例如制备包含一个或多个非天然半胱氨酸氨基酸残基的突变抗体),将反应性硫醇基团引入抗原结合蛋白中。美国专利号7,521,541提出了通过引入反应性半胱氨酸氨基酸来工程化抗体。
[0183]
适于合成本文公开的共价缀合物的接头包括但不限于反应性官能团,诸如马来酰亚胺或卤代烷基。这些基团可存在于接头或交联试剂中,诸如4-(n-马来酰亚胺基甲基)-环己烷-l-羧酸琥珀酰亚胺酯(smcc)、n-琥珀酰亚胺基碘乙酸酯(sia)、磺基-smcc、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、磺基-mbs和琥珀酰亚胺基碘乙酸酯,以及例如liu等人,18:690-697,1979中描述的那些,该文献的公开内容通过引用并入本文,因为其涉及用于化学缀合的接头。
[0184]
在一些实施方案中,附接到接头的反应性官能团中的一个或两个是马来酰亚胺、叠氮化物或炔烃。含马来酰亚胺的接头的示例是不可切割的基于马来酰亚胺基己酰基的接头。doronina等人,bioconjugate chem.17:14-24,2006描述了此类接头,该文献的公开内容通过引用并入本文,因为其涉及用于化学缀合的接头。
[0185]
在一些实施方案中,反应性官能团是
–
(c=o)-或-nh(c=o)-,使得接头可分别通过酰胺或脲部分与抗原结合蛋白或定点修饰多肽结合,所述酰胺或脲部分由
–
(c=o)-或-nh(c=o)-基团与抗原结合蛋白或定点修饰多肽或两者的氨基基团反应产生。
[0186]
在一些实施方案中,反应性官能团是n-马来酰亚胺基基团、卤代n-烷基酰胺基基团、磺酰氧基n-烷基酰胺基基团、碳酸酯基团、磺酰卤基团、硫醇基团或其衍生物、包含内部碳-碳三键的炔基基团、(杂)环炔基基团、双环[6.1.0]壬-4-炔-9-基基团、包含内部碳-碳双键的烯基基团、环烯基基团、四嗪基基团、叠氮基基团、膦基团、氧化腈基团、硝酮基团、腈亚胺基团、重氮基基团、酮基团、(o-烷基)羟基氨基基团、肼基团、卤代n-马来酰亚胺基基团、1,1-双(磺酰甲基)甲基羰基基团或其消除衍生物、碳酰卤基团或丙二烯酰胺基团,这些基团中的每一者可任选地被取代。在一些实施方案中,反应性官能团包含环烯烃基团、环炔烃基团或任选取代的(杂)环炔基基团。
[0187]
适于制备本文所公开的缀合物的合适的二价接头试剂的示例包括但不限于n-琥珀酰亚胺基4-(马来酰亚胺基甲基)环己烷羧酸酯(smcc)、n-琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)-环己烷-1-羧基-(6-胺基己酸酯)(其为smcc的“长链”类似物(lc-smcc))、κ-马来酰亚胺基十一烷酸n-琥珀酰亚胺酯(kmua)、γ-马来酰亚胺基丁酸n-琥珀酰亚胺酯(gmbs)、ε-马来酰亚胺基己酸n-羟基琥珀酰亚胺酯(emcs)、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、n-(α-马来酰亚胺基乙酰氧基)-琥珀酰亚胺酯(amas)、琥珀酰亚胺基-6-(β-马来酰亚胺基丙酰胺基)己酸酯(smph)、n-琥珀酰亚胺基4-(对马来酰亚胺苯基)-丁酸酯(smpb)和n-(对马来酰亚胺苯基)异氰酸酯(pmpi)。包含基于卤代乙酰基的部分的交联试剂包括n-琥珀酰亚胺基-4-(碘乙酰基)-氨基苯甲酸酯(siab)、n-琥珀酰亚胺基碘乙酸酯(sia)、n-琥珀酰亚胺基溴乙酸酯(sba)和n-琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)。
[0188]
本领域技术人员将认识到,本文公开的化学基团、部分和特征中任何一个或多个可以多种方式组合,以形成可用于将本文公开的抗原结合蛋白与本文公开的定点修饰多肽缀合的接头。可用于与本文所述的组合物和方法结合的其他接头在例如美国专利申请公开号2015/0218220中描述,该文献的公开内容通过引用并入本文,因为其涉及适于共价缀合的接头。
[0189]
iii.tage剂的定点修饰多肽
[0190]
tage剂包含定点修饰多肽,诸如识别靶细胞中的核酸序列的核酸引导的内切核酸
酶(例如rna引导的内切核酸酶(例如cas9)或dna指导的内切核酸酶)。
[0191]
本文公开的组合物和方法中使用的定点修饰多肽是位点特异性的,因为多肽本身或相关分子识别并靶向特定核酸序列或一组相似序列(即靶序列)。在一些实施方案中,定点修饰多肽(或其相关分子)识别在序列上相似且包含在一个或多个位置可以简并的保守碱基或基序的序列。
[0192]
在特定的实施方案中,定点修饰多肽在其靶序列外的特定位置(即修饰位点)修饰多核苷酸。被特定定点修饰多肽修饰的修饰位点通常也对特定序列或一组相似序列具有特异性。在这些实施方案中的一些中,定点修饰多肽修饰在序列上相似且包含在一个或多个位置可以简并的保守碱基或基序的序列。在其他实施方案中,定点修饰多肽修饰在相对于靶序列的特定位置内的序列。例如,定点修饰多肽可修饰在靶序列上游或下游特定数量的核酸内的序列。
[0193]
如本文所用,关于定点修饰多肽,术语“修饰”意指修饰位点中至少一个核苷酸的任何插入、缺失、取代或化学修饰,或者另选地与靶位点相邻的基因的表达变化。修饰位点中至少一个核苷酸的取代可以是碱基编辑结构域(诸如胞苷脱氨酶或腺嘌呤脱氨酶结构域)的募集的结果(参见例如eid等人(2018)biochem j 475(11):1955-1964,该文献全文并入本文)。
[0194]
与靶位点相邻的基因的表达变化可能由转录激活结构域或转录抑制结构域向基因的启动子区域的募集或表观遗传修饰结构域的募集引起,该表观遗传修饰结构域共价修饰dna或组蛋白以改变组蛋白结构和/或染色体结构而不改变dna序列,从而导致相邻基因的基因表达变化。术语“修饰”还涵盖可检测标记向靶位点的募集,所述可检测标记可以与定点修饰多肽或允许检测特定核酸序列(例如疾病相关序列)的相关分子(例如grna)缀合。
[0195]
在一些实施方案中,定点修饰多肽是核酸酶或其变体,因此包含核酸酶或其变体的试剂在本文中称为基因编辑细胞靶向(tage)剂。如本文所用,“核酸酶”是指切割多核苷酸链主链中的磷酸二酯键的酶。用于本文公开的组合物和方法的合适核酸酶可以具有内切核酸酶和/或外切核酸酶活性。外切核酸酶从多核苷酸链的末端一次切割一个核苷酸。内切核酸酶通过切割多核苷酸链内的磷酸二酯键而不是切割多核苷酸链两端的磷酸二酯键来切割多核苷酸链。核酸酶可以切割rna多核苷酸链(即核糖核酸酶)和/或dna多核苷酸链(即脱氧核糖核酸酶)。
[0196]
核酸酶切割多核苷酸链,从而产生切割位点。如本文所用,术语“切割”是指多核苷酸链主链内的磷酸二酯键的水解。通过本文公开的tage剂的核酸酶进行的切割可以是单链或双链的。在一些实施方案中,经由用两种核酸酶切割来实现dna的双链切割,其中每种核酸酶切割dna的单链。通过核酸酶切割可以产生平末端或交错末端。
[0197]
适于本文公开的组合物和方法的核酸酶的非限制性示例包括大范围核酸酶,诸如归巢内切核酸酶;限制性内切核酸酶,诸如iis型内切核酸酶(例如foki);锌指核酸酶;转录激活因子样效应物核酸酶(talen)和核酸引导的核酸酶(例如rna引导的内切核酸酶、dna引导的内切核酸酶或dna/rna引导的内切核酸酶)。
[0198]
如本文所用,“大范围核酸酶”是指在长度大于12个碱基对的靶序列处结合dna的内切核酸酶。大范围核酸酶与双链dna结合为异源二聚体。用于本文公开的组合物和方法的合适大范围核酸酶包括归巢内切核酸酶,诸如包含laglidadg(seq id no:127)氨基酸基序
或其变体的该家族的那些。
[0199]
如本文所用,“锌指核酸酶”或“zfn”是指包含与来自外切核酸酶或内切核酸酶(诸如限制性内切核酸酶或大范围核酸酶)的核酸酶结构域融合的锌指dna结合结构域的嵌合蛋白。锌指dna结合结构域由用于稳定独特结构的锌离子结合。
[0200]
如本文所用,“转录激活因子样效应物核酸酶”或“talen”是指包含dna结合结构域的嵌合蛋白,所述dna结合结构域包含与来自外切核酸酶或内切核酸酶(诸如限制性内切核酸酶或大范围核酸酶)的核酸酶结构域融合的多个tal结构域重复。tal结构域重复可以来源于来自变形菌门(proteobacteria)的黄单胞菌属(xanthomonas)的tale蛋白家族。tal结构域重复是具有高变的第12和13个氨基酸(称为重复可变双残基(rvd))的33-34个氨基酸序列。rvd赋予靶序列结合特异性。可以通过合理的或实验的方式对tal结构域重复进行工程化,以产生具有特定靶序列特异性的变体talen(参见例如boch等人(2009)science 326(5959):1509-1512以及moscou和bogdanove(2009)science 326(5959):1501,这些文献中的每一篇全文通过引用并入)。通过talen进行dna切割需要两个dna靶序列侧接非特异性间隔区,其中每个dna靶序列被talen单体结合。在一些实施方案中,talen包括紧凑型talen,其是指包含具有以任何取向与归巢内切核酸酶的任何部分(例如i-tevi、mmei、enda、end1、i-basi、i-tevii、i-teviii、i-twoi、mspi、mvai、nuca和nucm)融合的一个或多个tal结构域重复的dna结合结构域的内切核酸酶。紧凑型talen是有利的,因为它们不需要二聚化来获得dna加工活性,因此只需要单个靶位点。
[0201]
如本文所用,“核酸引导的核酸酶”是指基于与核酸酶相关的引导核酸(即引导rna或grna、引导dna或gdna或者引导dna/rna杂合体)与靶序列之间的互补性(全部或部分)而被导向特定靶序列的核酸酶。引导rna与靶序列之间的结合用于将核酸酶募集到靶序列附近。适于本文公开的组合物和方法的核酸引导的核酸酶的非限制性示例包括来自原核生物体(例如细菌、古细菌)或其变体的天然存在的规律成簇的间隔短回文重复序列(crispr)相关(cas)多肽。在原核生物体内发现的crispr序列是源自来自入侵病毒的多核苷酸的片段的序列,在随后的感染过程中用于识别相似的病毒,并且经由用作rna引导的核酸酶以切割病毒多核苷酸的crispr相关(cas)多肽切割病毒多核苷酸。如本文所用,“crispr相关多肽”或“cas多肽”是指在天然存在的crispr系统内在crispr序列附近发现的天然存在的多肽。某些cas多肽用作rna引导的核酸酶。
[0202]
存在至少两类天然存在的crispr系统即1类和2类。一般来讲,鉴于2类crispr系统包含具有核酸引导的核酸酶活性的单一多肽,而1类crispr系统需要蛋白复合物来获得核酸酶活性,本文公开的组合物和方法的核酸引导的核酸酶是2类cas多肽或其变体。存在至少三种已知类型的2类crispr系统,即ii型、v型和vi型,其中存在多种亚型(亚型ii-a、ii-b、ii-c、v-a、v-b、v-c、vi-a、vi-b和vi-c,以及其他未定义或推定的亚型)。一般来讲,ii型和v-b型系统除了crrna之外还需要tracrrna来获得活性。相比之下,v-a型和vi型仅需要crrna来获得活性。所有已知的ii型和v型rna引导的核酸酶靶向双链dna,而所有已知的vi型rna引导的核酸酶靶向单链rna。ii型crispr系统的rna引导的核酸酶在本文和文献中被称为cas9。在一些实施方案中,本文公开的组合物和方法的核酸指导的核酸酶是ii型cas9蛋白或其变体。用作rna引导的核酸酶的v型cas多肽不需要tracrrna来靶向和切割靶序列。va型crispr系统的rna引导的核酸酶在本文和文献中被称为cpf1;vb型crispr系统的rna引
导的核酸酶被称为c2c1;vc型crispr系统的rna引导的核酸酶被称为cas12c或c2c3;via型crispr系统的rna引导的核酸酶被称为c2c2或cas13a1;vib型crispr系统的rna引导的核酸酶被称为cas13b;并且vic型crispr系统的rna引导的核酸酶被称为cas13a2。在某些实施方案中,本文公开的组合物和方法的核酸指导的核酸酶是va型cpf1蛋白或其变体。用作核酸引导的核酸酶的天然存在的cas多肽及其变体是本领域已知的,包括但不限于酿脓链球菌cas9、金黄色葡萄球菌(staphylococcus aureus)cas9、嗜热链球菌(streptococcus thermophilus)cas9、新凶手弗朗西丝氏菌(francisella novicida)cpf1或shmakov等人(2017)nat rev microbiol 15(3):169-182;makarova等人(2015)nat rev microbiol 13(11):722-736;以及美国专利号9790490中描述的那些,这些文献中的每一篇全文并入本文。2类v型crispr核酸酶包括cas12和cas12的任何亚型,诸如cas12a、cas12b、cas12c、cas12d、cas12e、cas12f、cas12g、cas12h和cas12i。包括cas13在内的2类vi型crispr核酸酶可以包括在tage剂中,以便切割rna靶序列。
[0203]
本文公开的组合物和方法的核酸引导的核酸酶可以是天然存在的核酸引导的核酸酶(例如酿脓链球菌cas9)或其变体。变体核酸引导的核酸酶可以是工程化的或天然存在的变体,其含有氨基酸的取代、缺失或添加,它们例如改变核酸酶结构域中的一个或多个的活性、将核酸引导的核酸酶与赋予修饰特性的异源结构域(例如转录激活结构域、表观遗传修饰结构域、可检测标记)融合、修饰核酸酶的稳定性或修饰核酸酶的特异性。
[0204]
在一些实施方案中,核酸引导的核酸酶包括一个或多个突变以改善对靶位点的特异性和/或细胞内微环境中的稳定性。例如,在蛋白质是cas9(例如spcas9)或修饰的cas9的情况下,缺失rec2结构域的n175至r307(包括端点)的任何或所有残基可能是有益的。可以发现,较小或较低分子量形式的核酸酶更有效。在一些实施方案中,核酸酶相对于核酸酶的天然存在形式包含至少一个取代。例如,当蛋白质是cas9或修饰的cas9时,突变c80或c574(或在具有indel的修饰蛋白质中为其同源物)可能是有益的。在cas9中,期望的取代可包括c80a、c80l、c80i、c80v、c80k、c574e、c574d、c574n、c574q(任何组合)中的任一种,特别是c80a。可包括取代以减少核酸酶的细胞内蛋白结合和/或增加靶位点特异性。另选地或任选地,可包括取代以降低组合物的脱靶毒性。
[0205]
核酸指导的核酸酶通过其与引导核酸(例如引导rna(grna)、引导dna(gdna))的缔合而被导向特定靶序列。核酸引导的核酸酶经由非共价相互作用与引导核酸结合,从而形成复合物。多核苷酸靶向核酸通过包含与靶序列的序列互补的核苷酸序列而提供对复合物的靶特异性。复合物或者与其融合或以其他方式缀合的结构域或标记的核酸引导的核酸酶提供位点特异性活性。换言之,核酸引导的核酸酶借助于其与多核苷酸靶向引导核酸的蛋白质结合片段的缔合而被引导到靶多核苷酸序列(例如染色体核酸中的靶序列;染色体外核酸中的靶序列,例如游离核酸、微环;线粒体核酸中的靶序列;叶绿体核酸中的靶序列;质粒中的靶序列)。
[0206]
因此,引导核酸包含两个片段,即“多核苷酸靶向片段”和“多肽结合片段”。所谓“片段”意指指分子的片段/区段/区域(例如rna中的一段连续核苷酸)。片段还可以指复合物的区域/区段,使得片段可包含多于一个分子的区域。例如,在一些情况下,多核苷酸靶向核酸的多肽结合片段(下文描述)仅包含一个核酸分子,因此多肽结合片段包含该核酸分子的区域。在其他情况下,dna靶向核酸的多肽结合片段(下文描述)包含沿互补性区域杂交的
两个单独分子。
[0207]
多核苷酸靶向片段(或“多核苷酸靶向序列”或“引导序列”)包含与靶序列内的特定序列互补(完全或部分)的核苷酸序列(例如靶dna序列的互补链)。多肽结合片段(或“多肽结合序列”)与核酸引导的核酸酶相互作用。一般来讲,通过核酸引导的核酸酶对靶dna的位点特异性切割或修饰发生在由以下两者确定的位置:(i)核酸的多核苷酸靶向序列与靶dna之间的碱基配对互补性;以及(ii)靶dna中的短基序(称为原间隔子相邻基序(pam))。
[0208]
原间隔子相邻基序可以具有不同的长度,并且与目标序列的距离可以可变,但是pam通常在距靶序列约1至约10个核苷酸内,包括在距靶序列约1、约2、约3、约4、约5、约6、约7、约8、约9或约10个核苷酸内。pam可以是靶序列的5'或3'。通常,pam是约3-4个核苷酸的共有序列,但在特定的实施方案中,长度可以为2、3、4、5、6、7、8、9或更多个核苷酸。用于鉴定给定rna引导的核酸酶的优选pam序列或共有序列的方法是本领域已知的,包括但不限于karvelis等人(2015)genome biol 16:253中描述的pam消耗测定,或者pattanayak等人(2013)nat biotechnol 31(9):839-43中公开的测定,这些文献中的每一篇全文通过引用并入。
[0209]
多核苷酸靶向序列(即,引导序列)是与目的靶序列直接杂交的核苷酸序列。引导序列被工程化成与目的靶序列完全或部分互补。在各种实施方案中,引导序列可以包含约8个核苷酸至约30个核苷酸或更多。例如,引导序列的长度可以为约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29、约30或更多个核苷酸。在一些实施方案中,引导序列的长度为约10至约26个核苷酸,或约12至约30个核苷酸。在特定的实施方案中,引导序列的长度为约30个核苷酸。在一些实施方案中,当使用合适的比对算法进行最佳比对时,引导序列与其相应靶序列之间的互补性程度为约或大于约50%、约60%、约70%、约75%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高。在特定的实施方案中,引导序列不含二级结构,其可以使用本领域已知的任何合适的多核苷酸折叠算法来预测,包括但不限于mfold(参见例如zuker和stiegler(1981)nucleic acids res.9:133-148)和rnafold(参见例如gruber等人(2008)cell 106(1):23-24)。
[0210]
在一些实施方案中,引导核酸包含两个单独的核酸分子(“激活剂-核酸”和“靶向剂-核酸”,参见下文),并且在本文中被称为“双分子引导核酸”或“两分子引导核酸”。在其他实施方案中,主题引导核酸是单核酸分子(单多核苷酸),并且在本文中被称为“单分子引导核酸”、“单引导核酸”或“sgna”。术语“引导核酸”或“gna”是包含性的,是指双分子引导核酸和单分子引导核酸(即sgna)两者。在其中引导核酸是rna的那些实施方案中,grna可以是双分子引导rna或单引导rna。同样,在其中引导核酸是dna的那些实施方案中,gdna可以是双分子引导dna或单引导dna。
[0211]
示例性两分子引导核酸包含crrna样(“crispr rna”或“靶向剂-rna”或“crrna”或“crrna重复序列”)分子和相应的tracrrna样(“反式作用crispr rna”或“激活剂-rna”或“tracrrna”)分子。crrna样分子(靶向剂-rna)包含引导rna的多核苷酸靶向片段(单链)和形成引导rna的多肽结合片段的dsrna双链体的一半的一段核苷酸(“双链体形成片段”)(在本文中也被称为crispr重复序列)。
[0212]
术语“激活剂-核酸”或“激活剂-na”在本文中用于意指双分子引导核酸的tracrrna样分子。术语“靶向剂-核酸”或“靶向剂-na”在本文中用于意指双分子引导核酸的crrna样分子。术语“双链体形成片段”在本文中用于意指激活剂-na或靶向剂-na中通过与相应的激活剂-na或靶向剂-na分子的一段核苷酸杂交而有助于dsrna双链体形成的核苷酸段。换言之,激活剂-na包含与相应的靶向剂-na的双链体形成片段互补的双链体形成片段。因此,激活剂-na包含双链体形成片段,而靶向剂-na包含引导核酸的双链体形成片段和dna靶向片段两者。因此,主题双分子引导核酸可以由任何相应的激活剂-na和靶向剂-na对组成。
[0213]
激活剂-na包含crispr重复序列,该重复序列包含核苷酸序列,该核苷酸序列包含具有足够互补性以与激活剂-na(引导核酸的多肽结合片段的另一部分)杂交的区域。在各种实施方案中,crispr重复序列可以包含约8个核苷酸至约30个核苷酸或更多。例如,crispr重复序列的长度可以为约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29、约30或更多个核苷酸。在一些实施方案中,当使用合适的比对算法进行最佳比对时,crispr重复序列与其相应tracr序列的抗重复区域之间的互补性程度为约或大于约50%、约60%、约70%、约75%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高。
[0214]
相应的tracrrna样分子(即激活剂-na)包含形成引导核酸的多肽结合片段的双链双链体的另一部分的一段核苷酸(双链体形成片段)。换言之,crrna样分子的一段核苷酸(即crispr重复序列)与tracrrna样分子的一段核苷酸(即抗重复序列)互补并杂交,以形成引导核酸的多肽结合结构域的双链双链体。crrna样分子另外提供单链dna靶向片段。因此,crrna样和tracrrna样分子(作为相应对)杂交形成引导核酸。给定crrna或tracrrna分子的确切序列是crispr系统和发现rna分子的物种的特征。主题双分子引导rna可以包含任何相应的crrna和tracrrna对。
[0215]
反式激活样crispr rna或tracrrna样分子(在本文中也被称为“激活剂-na”)包含核苷酸序列,该核苷酸序列包含具有足够互补性以与crrna的crispr重复序列杂交的区域,该区域在本文中被称为抗重复区域。在一些实施方案中,tracrrna样分子进一步包含具有二级结构(例如茎环)的区域或在与其相应crrna杂交时形成二级结构。在特定的实施方案中,与crispr重复序列完全或部分互补的tracrrna样分子的区域在该分子的5'端,并且tracrrna样分子的3'端包含二级结构。二级结构的该区域通常包含几个发夹结构,包括邻近抗重复序列发现的连结(nexus)发夹。连结发夹通常在发夹茎的碱基中具有保守的核苷酸序列,其中在tracrrna的许多连结发夹中发现基序unannc。tracrrna的3'端通常有末端发夹,其结构和数量可能会有所不同,但通常包含富含gc的rho独立转录终止子发夹,然后在3'端有一串u。参见例如briner等人(2014)molecular cell 56:333-339、briner和barrangou(2016)cold spring harb protoc;doi:10.1101/pdb.top090902以及美国公开号2017/0275648,这些文献中的每一篇全文通过引用并入本文。
[0216]
在各种实施方案中,与crispr重复序列完全或部分互补的tracrrna样分子的抗重复区包含约8个核苷酸至约30个核苷酸或更多。例如,tracrrna样抗重复序列与crispr重复序列之间的碱基配对区域的长度可以为约8、约9、约10、约11、约12、约13、约14、约15、约16、
约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29、约30或更多个核苷酸。在一些实施方案中,当使用合适的比对算法进行最佳比对时,crispr重复序列与其相应tracrrna样抗重复序列之间的互补性程度为约或大于约50%、约60%、约70%、约75%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高。
[0217]
在各种实施方案中,整个tracrrna样分子可以包含约60个核苷酸至多于约140个核苷酸。例如,tracrrna样分子的长度可以为约60、约65、约70、约75、约80、约85、约90、约95、约100、约105、约110、约115、约120、约125、约130、约135、约140或更多个核苷酸。在特定的实施方案中,tracrrna样分子的长度为约80至约100个核苷酸,包括约80、约81、约82、约83、约84、约85、约86、约87、约88、约89、约90、约91、约92、约93、约94、约95、约96、约97、约98、约99和约100个核苷酸。
[0218]
主题单分子引导核酸(即sgna)包含两段核苷酸(靶向剂-na和激活剂-na),它们彼此互补,通过间插核苷酸(“接头”或“接头核苷酸”)共价连接,并且杂交以形成蛋白质结合片段的双链核酸双链体,从而产生茎环结构。靶向剂-na和激活剂-na可以经由靶向剂-na的3'端和激活剂-na的5'端共价连接。另选地,靶向剂-na和激活剂-na可以经由靶向剂-na的5'端和激活剂-na的3'端共价连接。
[0219]
单分子dna靶向核酸的接头可以具有约3个核苷酸至约100个核苷酸的长度。例如,接头可以具有约3个核苷酸(nt)至约90nt、约3nt至约80nt、约3nt至约70nt、约3nt至约60nt、约3nt至约50nt、约3nt至约40nt、约3nt至约30nt、约3nt至约20nt或约3nt至约10nt的长度,包括但不限于约3、约4、约5、约6、约7、约8、约9、约10、约11、约12、约13、约14、约15、约16、约17、约18、约19、约20或更多个核苷酸。在一些实施方案中,单分子dna靶向核酸的接头为4nt。
[0220]
示例性单分子dna靶向核酸包含杂交以形成双链双链体的两段互补核苷酸,以及与特定靶序列杂交的引导序列。
[0221]
对于大多数cas蛋白,crrna(以及在一些实施方案中为tracrrna)的合适的天然存在的同源对是已知的,它们作为已经发现的核酸引导的核酸酶起作用,或者可以通过测序和分析cas核酸引导的核酸酶蛋白的侧接序列以鉴定tracrrna编码序列、并因此通过搜索已知的抗重复编码序列或其变体以鉴定tracrrna序列来确定具有核酸引导的核酸酶活性的特定天然存在的cas蛋白。tracrrna的抗重复区域包含ds蛋白结合双链体的一半。包含ds蛋白结合双链体的一半的互补重复序列被称为crispr重复。已知的crispr核酸引导的核酸酶所利用的crispr重复和抗重复序列是本领域已知的,并且可以在例如万维网上的crispr数据库crispr.i2bc.paris-saclay.fr/crispr/中找到。
[0222]
单引导核酸或双引导核酸可以化学合成或经由体外转录合成。用于确定核酸引导的核酸酶与引导核酸之间的序列特异性结合的测定是本领域已知的,包括但不限于表达的核酸引导的核酸酶与引导核酸之间的体外结合测定,其可以用可检测标记(例如生物素)标记并用于融合物沉降(pull-down)检测测定,其中经由可检测标记(例如用链霉亲和素珠)捕获核蛋白复合物。具有与引导核酸无关的序列或结构的对照引导核酸可以用作核酸引导的核酸酶与核酸非特异性结合的阴性对照。
[0223]
在一些实施方案中,dna靶向rna、grna或sgrna或者编码dna靶向rna、grna或sgrna
的核苷酸序列包含核苷酸序列的修饰。在一些情况下,sgrna(例如截短的sgrna)包含与靶核酸互补的第一核苷酸序列和与cas多肽相互作用的第二核苷酸序列。在其他情况下,sgrna包含一个或多个修饰的核苷酸。在一些情况下,第一核苷酸序列和/或第二核苷酸序列中的一个或多个核苷酸是修饰的核苷酸。
[0224]
在一些实施方案中,修饰的核苷酸包含核糖基团、磷酸基团、核碱基或它们的组合中的修饰。在一些情况下,核糖基团中的修饰包括核糖基团的2'位置处的修饰。在一些情况下,核糖基团的2'位置处的修饰选自由2'-o-甲基、2'-氟、2'-脱氧、2'-o-(2-甲氧基乙基)和它们的组合组成的组。在其他情况下,磷酸基团中的修饰包括硫代磷酸酯修饰。在其他实施方案中,修饰的核苷酸选自由2'-核糖3'-硫代磷酸酯(s)、2'-o-甲基(m)核苷酸、2'-o-甲基3'-硫代磷酸酯(ms)核苷酸、2'-o-甲基3'-硫代pace(msp)核苷酸和它们的组合组成的组。
[0225]
在某些实施方案中,本文公开的组合物和方法的定点修饰多肽包含用作切口酶的核酸酶变体,其中该核酸酶与野生型核酸酶相比包含导致该核酸酶仅能够切割双链核酸分子的单链或完全缺乏核酸酶活性(即核酸酶死亡)的突变。
[0226]
用作切口酶的核酸酶(诸如核酸引导的核酸酶)仅包含单个起作用的核酸酶结构域。在这些实施方案的一些中,另外的核酸酶结构域已经突变,使得该特定结构域的核酸酶活性被降低或消除。
[0227]
在其他实施方案中,核酸酶(例如rna引导的核酸酶)完全缺乏核酸酶活性并且在本文中被称为核酸酶死亡。在这些实施方案的一些中,核酸酶内的所有核酸酶结构域已经突变,使得多肽的所有核酸酶活性被消除。本领域已知的任何方法可以用于将突变引入定点核酸酶的一个或多个核酸酶结构域,包括美国公开号2014/0068797和美国专利号9,790,490中阐述的那些,这些文献中的每一篇全文通过引用并入。
[0228]
降低或消除核酸酶活性的核酸酶结构域内的任何突变可以用于产生具有切口酶活性的核酸引导的核酸酶或核酸酶死亡的核酸引导的核酸酶。此类突变是本领域已知的,包括但不限于ruvc结构域内的d10a突变或者酿脓链球菌cas9的hnh结构域内或另一种核酸引导的核酸酶内在与酿脓链球菌cas9进行最大同源性比对时相似位置处的h840a突变。酿脓链球菌cas9的核酸酶结构域内可以突变以产生切口酶或核酸酶死亡蛋白的其他位置包括g12、g17、e762、n854、n863、h982、h983和d986。核酸引导的核酸酶的核酸酶结构域内可以产生切口酶或核酸酶死亡蛋白的其他突变包括新凶手弗朗西丝氏菌cpf1蛋白或另一种核酸引导的核酸酶内在与新凶手弗朗西丝氏菌cpf1蛋白进行最大同源性比对时相似位置处的d917a、e1006a、e1028a、d1227a、d1255a、n1257a、d917a、e1006a、e1028a、d1227a、d1255a和n1257a(美国专利号9,790,490,该文献全文通过引用并入)。
[0229]
包含核酸酶死亡结构域的定点修饰多肽还可以包含能够修饰多核苷酸的结构域。可与核酸酶死亡结构域融合的修饰结构域的非限制性示例包括但不限于转录激活或抑制结构域、碱基编辑结构域和表观遗传修饰结构域。在其他实施方案中,包含核酸酶死亡结构域的定点修饰多肽还包含可以有助于检测靶序列存在的可检测标记。
[0230]
可以与核酸酶死亡结构域融合的表观遗传修饰结构域用于共价修饰dna或组蛋白,以改变组蛋白结构和/或染色体结构,而不改变dna序列本身,从而导致基因表达的改变(上调或下调)。可以通过定点修饰多肽诱导的表观遗传修饰的非限制性示例包括以下组蛋
白残基的改变及其逆反应:sumo化(sumoylation)、精氨酸或赖氨酸残基的甲基化、赖氨酸残基的乙酰化或泛素化、丝氨酸和/或苏氨酸残基的磷酸化;以及以下dna的改变及其逆反应:胞嘧啶残基的甲基化或羟甲基化。因此,表观遗传修饰结构域的非限制性示例包括组蛋白乙酰转移酶结构域、组蛋白脱乙酰化结构域、组蛋白甲基转移酶结构域、组蛋白脱甲基酶结构域、dna甲基转移酶结构域和dna脱甲基酶结构域。
[0231]
在一些实施方案中,定点多肽包含转录激活结构域,其通过与转录控制元件和/或转录调节蛋白(诸如转录因子或rna聚合酶)相互作用来激活至少一个相邻基因的转录。合适的转录孵育结构域是本领域已知的,并且包括但不限于vp16激活结构域。
[0232]
在其他实施方案中,定点多肽包含转录阻遏物结构域,其也可以与转录控制元件和/或转录调节蛋白(诸如转录因子或rna聚合酶)相互作用,以减少或终止至少一个相邻基因的转录。合适的转录抑制结构域是本领域已知的,并且包括但不限于iκb和krab结构域。
[0233]
在其他实施方案中,包含核酸酶死亡结构域的定点修饰多肽还包含可以有助于检测靶序列(其可以是疾病相关序列)存在的可检测标记。可检测标记是可以被可视化或以其他方式观察到的分子。可检测标记可与核酸引导的核酸酶融合为融合蛋白(例如荧光蛋白),或者可以是与核酸酶多肽缀合的小分子,其可以通过视觉或其他方式检测到。可以与本文公开的核酸引导的核酸酶融合为融合蛋白的可检测标记包括任何可检测蛋白结构域,包括但不限于荧光蛋白或可以用特异性抗体检测的蛋白结构域。荧光蛋白的非限制性示例包括绿色荧光蛋白(例如gfp、egfp、zsgreen1)和黄色荧光蛋白(例如yfp、eyfp、zsyellow1)。小分子可检测标记的非限制性示例包括放射性标记,诸如3h和
35
s。
[0234]
可以将核酸引导的核酸酶作为tage剂的一部分且作为包含结合到其引导核酸的核酸引导的核酸酶的核蛋白复合物递送到细胞中。另选地,将核酸引导的核酸酶作为tage剂递送,而单独提供引导核酸。在某些实施方案中,可以将引导rna作为rna分子引入靶细胞中。引导rna可以在体外转录或化学合成。在其他实施方案中,将编码引导rna的核苷酸序列引入细胞中。在这些实施方案中的一些中,编码引导rna的核苷酸序列与启动子(例如rna聚合酶iii启动子)可操作地连接,该启动子可以是天然启动子或与引导rna编码核苷酸序列异源的。
[0235]
在某些实施方案中,定点多肽可以包含另外的氨基酸序列,诸如至少一个核定位序列(nls)。核定位序列增强定点多肽向细胞核的转运。输入细胞核的蛋白与核孔复合物中的一种或多种蛋白(诸如输入蛋白/核周蛋白,它们通常与赖氨酸和精氨酸残基结合最好)结合。用于核定位的最佳表征途径涉及与输入蛋白-α蛋白结合的短肽序列。这些核定位序列通常包含碱性氨基酸段,并且假定在输入蛋白-α上存在两个此类结合位点,则由至少10个氨基酸分隔的两个碱性序列可以构成二分nls。核输入的第二最佳表征途径涉及与输入蛋白-β1蛋白结合的蛋白,诸如hiv-tat和hiv-rev蛋白,它们分别使用序列rkkrrqrrr(seq id no:9)和rqarrnrrrrwr(seq id no:13)与输入蛋白-β1结合。其他核定位序列是本领域已知的(参见例如lange等人,j.biol.chem.(2007)282:5101-5105)。nls可以是定点多肽的天然存在的nls或异源nls。如本文所用,关于序列的“异源”是源自外来物种的序列,或者如果来自相同物种,则通过有意的人为干预在组成和/或基因组位点上从其天然形式显著修饰的序列。可以用于增强定点多肽的核定位的nls序列的非限制性示例包括sv40大t抗原和c-myc的nls。在某些实施方案中,nls包含氨基酸序列pkkkrkv(seq id no:8)。
[0236]
定点多肽可以包含多于一个nls,诸如两个、三个、四个、五个、六个或更多个nls序列。多个nls中的每一个在序列上可以是唯一的,或者可以使用多于一个的相同nls序列。nls可以位于定点多肽的氨基末端(n-末端)、羧基末端(c-末端)或多肽的n-末端和c-末端。在某些实施方案中,定点多肽在其n-末端包含四个nls序列。在其他实施方案中,定点多肽在定点多肽的c-末端包含两个nls序列。在其他实施方案中,定点多肽在其n-末端包含四个nls序列,并且在其c-末端包含两个nls序列。
[0237]
在某些实施方案中,定点多肽还包含细胞穿透肽(cpp),其诱导连接的蛋白或肽通过细胞的质膜吸收。通常,cpp诱导进入细胞,因为它们的大致形状和倾向可自组装成跨膜孔或具有几个带正电荷的残基,这些残基与带负电荷的磷脂外膜相互作用,从而诱导膜的弯曲,继而激活内化。示例性可穿透肽包括但不限于转运肽(transportan)、pep1、mpg、p-vec、map、cady、polyr(例如seq id no:128)、hiv-tat(seq id no:9)、hiv-rev(seq id no:13)、穿透肽(penetratin)、r6w3、p22n、dpv3、dpv6、k-fgf和c105y,并且在van den berg和dowdy(2011)current opinion in biotechnology 22:888-893以及farkhani等人(2014)peptides 57:78-94中综述,这些文献中的每一篇全文通过引用并入本文。
[0238]
与nls一起或作为nls的替代物,定点多肽可以包含另外的异源氨基酸序列,诸如本文其他地方所述的可检测标记(例如荧光蛋白)或纯化标签,以形成融合蛋白。纯化标签是可以用于从混合物(例如生物样品、培养基)中分离蛋白质或融合蛋白质的任何分子。纯化标签的非限制性示例包括生物素、myc、麦芽糖结合蛋白(mbp)和谷胱甘肽-s-转移酶(gst)。
[0239]
本文公开的组合物和方法可以用于通过引入被修复(经由例如易错非同源末端连接(nhej)、微同源介导的末端连接(mmej)或替代性末端连接(alt-ej)途径)以在特定基因组位置处引入突变的序列特异性双链断裂来编辑基因组。由于修复过程具有易错性质,双链断裂的修复可能产生对靶序列的修饰。另选地,供体模板多核苷酸可在修复引入的双链断裂的过程中整合到靶序列中或与靶序列交换,从而产生外源供体序列的引入。因此,组合物和方法还可以包括供体模板多核苷酸,其可包括侧接同源末端。在这些实施方案中的一些中,供体模板多核苷酸经由本文其他地方所述的接头拴接到tage剂(例如供体模板多核苷酸经由可切割接头结合到定点多肽)。
[0240]
在一些实施方案中,供体序列改变原始靶序列,使得新整合的供体序列不会被核酸引导的核酸酶识别和切割。供体序列可包含侧接序列,其与侧接靶序列的序列具有大量序列同一性,以经由同源介导的修复增强供体序列的整合。在核酸引导的核酸酶产生双链交错断裂的特定实施方案中,供体多核苷酸的两侧可以是相容的突出端,从而允许在修复双链断裂的过程中经由非同源修复过程掺入供体序列。
[0241]
iv.tage剂的抗原结合多肽
[0242]
抗原结合多肽靶向与细胞膜相关的细胞外抗原并提供递送定点修饰多肽的特异性。可包括在本文所述的tage剂中的抗原结合多肽的示例包括但不限于抗体、抗体的抗原结合片段或抗体模拟物。
[0243]
抗体和抗原结合片段
[0244]
在某些实施方案中,本文提供的tage剂包含抗原结合多肽,所述抗原结合多肽是与位于靶细胞膜上或与特定组织缔合的细胞外分子(例如蛋白质、聚糖、脂质)特异性结合
的抗体或其抗原结合片段。抗体或其抗原结合片段特异性结合的细胞外分子可以是抗原,诸如但不限于hla-dr、cd3、cd11a、cd20、cd22、cd25、cd32、cd33、cd44、cd47、cd54、cd59、cd70、cd74、achr、ctla4、cxcr4、egfr、her2、epcam、pd-1或fap1。在某些实施方案中,抗原是cd22。在一个实施方案中,抗体或其抗原结合部分与cd3特异性结合。本发明的tage剂中的抗体、其抗原结合片段的其他示例性靶标包括:(i)肿瘤相关抗原;(ii)细胞表面受体,(iii)cd蛋白及其配体,诸如cd3、cd4、cd8、cd11a、cd19、cd20、cd22、cd25、cd32、cd33、cd34、cd40、cd44、cd47、cd54、cd59、cd70、cd74、cd79a(cd79a)和cd79p(cd79b);(iv)erbb受体家族的成员,诸如egf受体、her2、her3或her4受体;(v)细胞粘附分子,诸如lfa-1、mac1、p150,95、vla-4、icam-1、vcam和包括其α或β亚基的αv/β3整联蛋白(例如抗cd11a、抗cd18或抗cd11b抗体);以及(vi)生长因子,诸如vegf;ige;血型抗原;flk2/flt3受体;肥胖症(ob)受体;mpl受体;ctla4;蛋白c、br3、c-met、组织因子、β7等。抗体或其抗原结合片段可以靶向的抗原的其他示例包括细胞表面受体,诸如chen和flies.nature reviews immunology.13.4(2013):227中所述的那些,该文献通过引用并入本文。
[0245]
用于本文所述的tage剂中的抗原结合多肽也可对某种细胞类型具有特异性。例如,抗原结合多肽诸如抗体或其抗原结合部分可与造血细胞(hsc)的细胞表面上存在的抗原结合。在hsc上发现的抗原的示例包括但不限于cd34、emcn、cd59、cd90、c-kit、cd45或cd49f。抗原结合多肽经由在细胞的细胞外表面上表达或展示的抗原(因此经由tage剂所编辑的基因)所结合的其他细胞类型包括嗜中性粒细胞、t细胞、b细胞、树突状细胞、巨噬细胞和成纤维细胞。
[0246]
示例性抗体(或其抗原结合片段)包括选自但不限于以下项的那些:抗hla-dr抗体、抗cd3抗体、抗cd20抗体、抗cd22抗体、抗cd11a抗体、抗cd25抗体、抗cd32抗体、抗cd33抗体、抗cd44抗体、抗cd47抗体、抗cd54抗体、抗cd59抗体、抗cd70抗体、抗cd74抗体、抗achr抗体、抗ctla4抗体、抗cxcr4抗体、抗egfr抗体、抗her2抗体、抗epcam抗体、抗pd-1抗体或抗fap1抗体。这些不同靶标的示例性抗体在以下序列表中描述为seq id no:14至115。
[0247]
在一个实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd22抗体或其抗原结合片段。在某些实施方案中,抗cd22抗体选自依帕珠单抗(epratuzumab)(也称为hl22,参见例如美国专利号5789554、美国申请号20120302739;由novus biologicals销售,目录号nbp2-75189(日期为2019年3月3日))、贝妥莫单抗(bectumomab)(参见例如美国专利号us8420086)、rfb4(参见例如美国专利号us7355012)、sm03(参见例如zhao等人,clin drug investig(2016)36:889-902)、nci m972(参见例如us8591889、us9279019、us9598492)或nci m971(参见例如us7456260、us8591889、us9279019、us9598492)。
[0248]
在一个实施方案中,tage剂包含抗cd22抗体或其抗原结合部分。在一些实施方案中,抗cd22抗体或其抗原结合部分包含含有seq id no:108中所示的氨基酸残基的可变重链区以及含有seq id no:109中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd22抗体或其抗原结合片段包含含有seq id no:108中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:109中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0249]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd11a抗体或其抗原结合片段。cd11a(也称为整联蛋白,αl;淋巴细胞功能相关抗原1;α多肽;或itgal;
uniprot登录号p20701)是参与细胞粘附和淋巴细胞共刺激信号传导的整联蛋白。cd11a是与cd18一起形成淋巴细胞功能相关抗原-1的两种成分中的一种,后者在白细胞上表达。在某些实施方案中,抗cd11a抗体是依法珠单抗(在例如wo1998023761或美国专利号6,652,855中描述,这些文献中的每一篇据此通过引用并入)。
[0250]
在一个实施方案中,抗cd11a抗体包含含有抗cd11a抗体依法珠单抗的cdr1、cdr2和cdr3的重链可变区以及含有抗cd11a抗体依法珠单抗的cdr1、cdr2和cdr3的轻链可变区。在一个实施方案中,抗cd11a抗体包含抗cd11a抗体依法珠单抗的重链可变区以及抗cd11a抗体依法珠单抗的轻链可变区。
[0251]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd25抗体或其抗原结合片段。cd25(也称为白介素-2受体α链,il2ra;uniprot登录号p01589)是存在于活化的t细胞、活化的b细胞、一些胸腺细胞、骨髓前体和寡突胶质细胞上的i型跨膜蛋白。白细胞介素2(il2)受体α(il2ra)和β(il2rb)链与共同的γ链(il2rg)一起形成高亲和力il2受体。在某些实施方案中,抗cd25抗体是达利珠单抗(例如在美国专利号7,361,740中描述,该文献据此通过引用并入)。
[0252]
在一个实施方案中,抗cd25抗体包含含有抗cd25抗体达利珠单抗的cdr1、cdr2和cdr3的重链可变区以及包含抗cd25抗体达利珠单抗的cdr1、cdr2和cdr3的轻链可变区。在一个实施方案中,抗cd25抗体包含抗cd25抗体达利珠单抗的重链可变区以及抗cd11a抗体达利珠单抗的轻链可变区。
[0253]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗fap抗体或其片段。成纤维细胞活化蛋白(fap)也称为seprase,是脯氨酰寡肽酶家族的膜结合丝氨酸蛋白酶,具有后脯氨酰内肽酶活性。fap对肿瘤微环境(例如肿瘤基质)的限制性表达使其成为靶向治疗各种肿瘤的有吸引力的治疗候选物。在某些实施方案中,抗fap抗体选自西罗珠单抗(sibrotuzumab)/bibh1(在wo 99/57151;mersmann等人,int j cancer 92,240-248(2001);schmidt等人,eur j biochem 268,1730-1738(2001);wo 01/68708;wo 2007/077173中描述)、f19、(在wo 93/05804中描述,atcc编号hb 8269,由r&d systems销售,目录号:mab3715)、os4(在w
ü
est等人,j biotech 92,159-168(2001)中描述)。其他抗fap抗体在例如美国专利号8568727、美国专利号8999342、美国申请号20160060356、美国申请号20160060357和美国专利号us9011847中描述,这些文献中的每一篇通过引用并入本文。
[0254]
在一个实施方案中,tage剂包含抗fap抗体或其抗原结合部分。在一些实施方案中,抗fap抗体或其抗原结合部分包含含有seq id no:100中所示的氨基酸残基的可变重链区以及含有seq id no:101中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗fap抗体或其抗原结合片段包含含有seq id no:100中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:101中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0255]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗ctla4抗体或其片段。ctla-4(细胞毒性t-淋巴细胞相关蛋白4)也称为cd152(分化簇152),是蛋白受体的免疫球蛋白超家族的成员,用作免疫检查点以下调免疫反应。ctla4在t淋巴细胞的表面上表达,在早期活化的cd8t细胞的表面上瞬时表达;在调节性t细胞上组成型表达。在某些实施方案中,抗ctla4抗体选自伊匹木单抗(商品名:在美国专利号6984720、
美国专利号605238、美国专利号8017114、美国专利号8318916和美国专利号8784815中描述)。其他抗ctla4抗体例如在美国专利号9714290、美国专利号10202453和美国公开号20170216433中描述,这些文献中的每一篇通过引用并入本文。
[0256]
在一个实施方案中,抗ctla4抗体或其抗原结合部分包含含有seq id no:102中所示的氨基酸残基的可变重链区以及含有seq id no:103中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ctla4抗体或其抗原结合片段包含含有seq id no:102中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:103中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。前述序列对应于抗ctla4抗体伊匹鲁密单抗(ipilumimab)。
[0257]
在一个实施方案中,抗ctla4抗体或其抗原结合部分包含含有seq id no:104中所示的氨基酸残基的可变重链区以及含有seq id no:105中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ctla4抗体或其抗原结合片段包含含有seq id no:104中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:105中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。前述序列对应于抗ctla4抗体替西木单抗(tremelimumab)。
[0258]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd44抗体或其片段。cd44是一种普遍存在的细胞表面糖蛋白,其在许多癌症中高度表达,并经由将cd44募集到细胞表面来调节转移。在某些实施方案中,抗cd44抗体选自rg7356(在pct公开wo2013063498a1中描述)。其他抗ctla4抗体例如在美国公开号20170216433、美国公开号20070237761a1和美国公开号us20100092484中描述,这些文献中的每一篇通过引用并入本文。
[0259]
在一个实施方案中,tage剂包含抗cd44抗体或其抗原结合部分。在一些实施方案中,抗cd44抗体或其抗原结合部分包含含有seq id no:30中所示的氨基酸残基的可变重链区以及含有seq id no:31中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd44抗体或其抗原结合片段包含含有seq id no:30中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:31中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0260]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd54抗体或其片段。cd54是与白细胞功能相关抗原-1(cd11a/cd18[lfa-1])结合的细胞表面糖蛋白。cd54调节白细胞与内皮细胞的lfa-1依赖性粘附和涉及细胞与细胞接触的免疫功能。抗cd54抗体例如在美国专利号7943744、美国专利号5773293、美国专利号8623369、pct公开号w091/16928和美国公开号us20100092484中描述,这些文献中的每一篇通过引用并入本文。
[0261]
在一个实施方案中,tage剂包含抗cd54抗体或其抗原结合部分。在一些实施方案中,抗cd54抗体或其抗原结合部分包含含有seq id no:86中所示的氨基酸残基的可变重链区以及含有seq id no:87中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd54抗体或其抗原结合片段包含含有seq id no:86中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:87中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0262]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd33抗体
或其片段。cd33或siglec-3(唾液酸结合ig样凝集素3、siglec3、siglec-3、gp67、p67)是唾液酸结合受体家族的骨髓特异性成员,在骨髓祖细胞上高度表达,但在分化细胞中的水平低得多。在某些实施方案中,抗cd33抗体选自林妥珠单抗(lintuzumab)(也称为克隆hum195,在美国专利号9079958中描述)、2h12(在美国专利号9587019中描述)。其他cd33抗体已经在例如美国专利号7,342,110、美国专利号7,557,189、美国专利号8,119,787、美国专利号8,337,855、美国专利号8,124,069、美国专利号5,730,982、美国专利号7,695,71、wo2012074097、wo2004043344、wo1993020848、wo2012045752、wo2007014743、wo2003093298、wo2011036183、wo1991009058、wo2008058021、wo2011038301、hoyer等人,(2008)am.j.clin.pathol.129,316-323、rollins-raval和roth,(2012)histopathology 60,933-942)、p
é
rez-oliva等人,(2011)glycobiol.21,757-770)、ferlazzo等人(2000)eur j immunol.30:827-833、vitale等人,(2001)proc natl acad sci usa.98:5764-5769、jandus等人,(2011)biochem.pharmacol.82,323-332、o'reilly和paulson,(2009)trends pharmacol.sci.30,240-248,jurcic,(2012)curr hematol malig rep 7,65-73以及ricart,(2011)clin.cancer res.17,6417-6427中描述,这些文献中的每一篇通过引用并入本文。
[0263]
在某些实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd22抗体或其片段。在某些实施方案中,抗cd22抗体是抗cd22抗体依帕珠单抗(也称为hl22,参见例如美国专利号5789554、美国申请号20120302739;由novus biologicals销售,目录号nbp2-75189(日期为2019年3月3日))或包含对应于依帕珠单抗抗体的抗原结合区的抗cd22抗体。依帕珠单抗抗体是源自抗体ll2(epb-2)的人源化抗体,这是一种针对raji burkitt淋巴瘤细胞产生的鼠抗cd22 igg2a。
[0264]
在一个实施方案中,抗cd22抗体包含含有抗cd22抗体依帕珠单抗的cdr1、cdr2和cdr3的重链以及含有抗cd22抗体依帕珠单抗的cdr1、cdr2和cdr3的轻链。
[0265]
在一个实施方案中,tage剂包括抗原结合多肽,所述抗原结合多肽是抗cd3抗体或其抗原结合片段。在某些实施方案中,抗cd3抗体是莫罗单抗(muromonab)(也称为okt3;由biolegend销售,目录号317301或317302(日期为2019年3月3日))、维西珠单抗(visilizumab)(参见例如美国专利号5834597、美国专利号7381803、美国申请号20080025975)、奥替利珠单抗(otelixizumab)(参见例如wo2007145941)或dow2(参见例如wo2014129270)。
[0266]
在某些实施方案中,tage剂包括抗cd3抗体,其中抗cd3抗体是抗cd3抗体莫罗单抗(也称为okt3;由biolegend销售,目录号317301或317302(日期为2019年3月3日))或包含对应于莫罗单抗的抗原结合区的抗cd3抗体。
[0267]
在一个实施方案中,抗cd3抗体包含含有抗cd3抗体莫罗单抗的cdr1、cdr2和cdr3的重链以及含有抗cd3抗体莫罗单抗的cdr1、cdr2和cdr3的轻链可变区。
[0268]
在一个实施方案中,tage剂包含抗cd3抗体或其抗原结合部分。在一些实施方案中,抗cd3抗体或其抗原结合部分包含含有seq id no:76中所示的氨基酸残基的可变重链区以及含有seq id no:77中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd3抗体或其抗原结合片段包含含有seq id no:76中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:77中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据
kabat编号确定。
[0269]
在一个实施方案中,tage剂包含抗cd45抗体或其抗原结合部分。在一些实施方案中,抗cd45抗体或其抗原结合部分包含含有seq id no:14中所示的氨基酸残基的可变重链区以及含有seq id no:15中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd45抗体或其抗原结合片段包含含有seq id no:14中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:15中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0270]
在一个实施方案中,tage剂包含抗cd48抗体或其抗原结合部分。在一些实施方案中,抗cd48抗体或其抗原结合部分包含含有seq id no:16中所示的氨基酸残基的可变重链区以及含有seq id no:17中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd45抗体或其抗原结合片段包含含有seq id no:16中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:17中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0271]
在一个实施方案中,tage剂包含抗tim3抗体或其抗原结合部分。在一些实施方案中,抗tim3抗体或其抗原结合部分包含含有seq id no:18中所示的氨基酸残基的可变重链区以及含有seq id no:193中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗tim3抗体或其抗原结合片段包含含有seq id no:18中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:19中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0272]
在一个实施方案中,tage剂包含抗cd73抗体或其抗原结合部分。在一些实施方案中,抗cd73抗体或其抗原结合部分包含含有seq id no:20中所示的氨基酸残基的可变重链区以及含有seq id no:21中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd73抗体或其抗原结合片段包含含有seq id no:20中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:21中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0273]
在一个实施方案中,tage剂包含抗tigit抗体或其抗原结合部分。在一些实施方案中,抗tigit抗体或其抗原结合部分包含含有seq id no:22中所示的氨基酸残基的可变重链区以及含有seq id no:23中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗tigit抗体或其抗原结合片段包含含有seq id no:22中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:23中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0274]
在一个实施方案中,tage剂包含抗ccr4抗体或其抗原结合部分。在一些实施方案中,抗ccr4抗体或其抗原结合部分包含含有seq id no:24中所示的氨基酸残基的可变重链区以及含有seq id no:25中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ccr4抗体或其抗原结合片段包含含有seq id no:24中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:25中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0275]
在一个实施方案中,tage剂包含抗il-4r抗体或其抗原结合部分。在一些实施方案中,抗il-4r抗体或其抗原结合部分包含含有seq id no:26中所示的氨基酸残基的可变重
链区以及含有seq id no:27中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗il-4r抗体或其抗原结合片段包含含有seq id no:26中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:27中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0276]
在一个实施方案中,tage剂包含抗ccr2抗体或其抗原结合部分。在一些实施方案中,抗ccr2抗体或其抗原结合部分包含含有seq id no:28中所示的氨基酸残基的可变重链区以及含有seq id no:29中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ccr2抗体或其抗原结合片段包含含有seq id no:28中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:29中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0277]
在一个实施方案中,tage剂包含抗ccr5抗体或其抗原结合部分。在一些实施方案中,抗ccr5抗体或其抗原结合部分包含含有seq id no:32中所示的氨基酸残基的可变重链区以及含有seq id no:33中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ccr5抗体或其抗原结合片段包含含有seq id no:32中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:33中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0278]
在一个实施方案中,tage剂包含抗cxcr4抗体或其抗原结合部分。在一些实施方案中,抗cxcr4抗体或其抗原结合部分包含含有seq id no:34中所示的氨基酸残基的可变重链区以及含有seq id no:35中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cxcr4抗体或其抗原结合片段包含含有seq id no:34中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:35中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0279]
在一个实施方案中,tage剂包含抗slamf7抗体或其抗原结合部分。在一些实施方案中,抗slamf7抗体或其抗原结合部分包含含有seq id no:36中所示的氨基酸残基的可变重链区以及含有seq id no:37中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗slamf7抗体或其抗原结合片段包含含有seq id no:36中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:37中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0280]
在一个实施方案中,tage剂包含抗icos抗体或其抗原结合部分。在一些实施方案中,抗icos抗体或其抗原结合部分包含含有seq id no:38中所示的氨基酸残基的可变重链区以及含有seq id no:39中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗icos抗体或其抗原结合片段包含含有seq id no:38中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:39中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0281]
在一个实施方案中,tage剂包含抗pd-l1抗体或其抗原结合部分。在一些实施方案中,抗pd-l1抗体或其抗原结合部分包含含有seq id no:40中所示的氨基酸残基的可变重链区以及含有seq id no:41中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗pd-l1抗体或其抗原结合片段包含含有seq id no:40中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:41中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根
据kabat编号确定。
[0282]
在一个实施方案中,tage剂包含抗ox40抗体或其抗原结合部分。在一些实施方案中,抗ox40抗体或其抗原结合部分包含含有seq id no:42中所示的氨基酸残基的可变重链区以及含有seq id no:43中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ox40抗体或其抗原结合片段包含含有seq id no:42中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:43中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0283]
在一个实施方案中,tage剂包含抗cd11a抗体或其抗原结合部分。在一些实施方案中,抗cd11a抗体或其抗原结合部分包含含有seq id no:44中所示的氨基酸残基的可变重链区以及含有seq id no:45中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd11a抗体或其抗原结合片段包含含有seq id no:44中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:45中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0284]
在一个实施方案中,tage剂包含抗cd40l抗体或其抗原结合部分。在一些实施方案中,抗cd40l抗体或其抗原结合部分包含含有seq id no:46中所示的氨基酸残基的可变重链区以及含有seq id no:47中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd40l抗体或其抗原结合片段包含含有seq id no:46中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:47中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0285]
在一个实施方案中,tage剂包含抗ifnar1抗体或其抗原结合部分。在一些实施方案中,抗ifnar1抗体或其抗原结合部分包含含有seq id no:48中所示的氨基酸残基的可变重链区以及含有seq id no:49中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗ifnar1抗体或其抗原结合片段包含含有seq id no:48中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:49中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0286]
在一个实施方案中,tage剂包含抗转铁蛋白抗体或其抗原结合部分。在一些实施方案中,抗转铁蛋白抗体或其抗原结合部分包含含有seq id no:50中所示的氨基酸残基的可变重链区以及含有seq id no:51中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗转铁蛋白抗体或其抗原结合片段包含含有seq id no:50中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:51中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0287]
在一个实施方案中,tage剂包含抗cd80抗体或其抗原结合部分。在一些实施方案中,抗cd80抗体或其抗原结合部分包含含有seq id no:52中所示的氨基酸残基的可变重链区以及含有seq id no:53中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd80抗体或其抗原结合片段包含含有seq id no:52中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:53中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0288]
在一个实施方案中,tage剂包含抗il6-r抗体或其抗原结合部分。在一些实施方案中,抗il6-r抗体或其抗原结合部分包含含有seq id no:54中所示的氨基酸残基的可变重
链区以及含有seq id no:55中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗il6-r抗体或其抗原结合片段包含含有seq id no:54中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:55中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0289]
在一个实施方案中,tage剂包含抗tcrb抗体或其抗原结合部分。在一些实施方案中,抗tcrb抗体或其抗原结合部分包含含有seq id no:56中所示的氨基酸残基的可变重链区以及含有seq id no:57中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗tcrb抗体或其抗原结合片段包含含有seq id no:56中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:57中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0290]
在一个实施方案中,tage剂包含抗cd59抗体或其抗原结合部分。在一些实施方案中,抗cd59抗体或其抗原结合部分包含含有seq id no:58中所示的氨基酸残基的可变重链区以及含有seq id no:59中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd59抗体或其抗原结合片段包含含有seq id no:58中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:59中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0291]
在一个实施方案中,tage剂包含抗cd4抗体或其抗原结合部分。在一些实施方案中,抗cd4抗体或其抗原结合部分包含含有seq id no:60中所示的氨基酸残基的可变重链区以及含有seq id no:61中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd4抗体或其抗原结合片段包含含有seq id no:60中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:61中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0292]
在一个实施方案中,tage剂包含抗hla-dr抗体或其抗原结合部分。在一些实施方案中,抗hla-dr抗体或其抗原结合部分包含含有seq id no:62中所示的氨基酸残基的可变重链区以及含有seq id no:63中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗hla-dr抗体或其抗原结合片段包含含有seq id no:62中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:63中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0293]
在一个实施方案中,tage剂包含抗lag3抗体或其抗原结合部分。在一些实施方案中,抗lag3抗体或其抗原结合部分包含含有seq id no:64中所示的氨基酸残基的可变重链区以及含有seq id no:65中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗lag3抗体或其抗原结合片段包含含有seq id no:64中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:65中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0294]
在一个实施方案中,tage剂包含抗4-1bb抗体或其抗原结合部分。在一些实施方案中,抗4-1bb抗体或其抗原结合部分包含含有seq id no:66中所示的氨基酸残基的可变重链区以及含有seq id no:67中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗4-1bb抗体或其抗原结合片段包含含有seq id no:66中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:67中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以
根据kabat编号确定。
[0295]
在一个实施方案中,tage剂包含抗gitr抗体或其抗原结合部分。在一些实施方案中,抗gitr抗体或其抗原结合部分包含含有seq id no:68中所示的氨基酸残基的可变重链区以及含有seq id no:69中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗gitr抗体或其抗原结合片段包含含有seq id no:68中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:69中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0296]
在一个实施方案中,tage剂包含抗cd27抗体或其抗原结合部分。在一些实施方案中,抗cd27抗体或其抗原结合部分包含含有seq id no:70中所示的氨基酸残基的可变重链区以及含有seq id no:71中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd27抗体或其抗原结合片段包含含有seq id no:70中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:71中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0297]
在一个实施方案中,tage剂包含抗nkg2a抗体或其抗原结合部分。在一些实施方案中,抗nkg2a抗体或其抗原结合部分包含含有seq id no:72中所示的氨基酸残基的可变重链区以及含有seq id no:73中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗nkg2a抗体或其抗原结合片段包含含有seq id no:72中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:73中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0298]
在一个实施方案中,tage剂包含抗cd25抗体或其抗原结合部分。在一些实施方案中,抗cd25抗体或其抗原结合部分包含含有seq id no:74中所示的氨基酸残基的可变重链区以及含有seq id no:75中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd25抗体或其抗原结合片段包含含有seq id no:74中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:75中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0299]
在一个实施方案中,tage剂包含抗tlr2抗体或其抗原结合部分。在一些实施方案中,抗tlr2抗体或其抗原结合部分包含含有seq id no:78中所示的氨基酸残基的可变重链区以及含有seq id no:79中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗tlr2抗体或其抗原结合片段包含含有seq id no:78中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:79中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0300]
在一个实施方案中,tage剂包含抗pd1抗体或其抗原结合部分。在一些实施方案中,抗pd1抗体或其抗原结合部分包含含有seq id no:80中所示的氨基酸残基的可变重链区以及含有seq id no:81中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗pd1抗体或其抗原结合片段包含含有seq id no:80中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:81中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0301]
在一个实施方案中,tage剂包含抗cd2抗体或其抗原结合部分。在一些实施方案中,抗cd2抗体或其抗原结合部分包含含有seq id no:82中所示的氨基酸残基的可变重链
区以及含有seq id no:83中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd2抗体或其抗原结合片段包含含有seq id no:82中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:83中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0302]
在一个实施方案中,tage剂包含抗cd52抗体或其抗原结合部分。在一些实施方案中,抗cd52抗体或其抗原结合部分包含含有seq id no:84中所示的氨基酸残基的可变重链区以及含有seq id no:85中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd52抗体或其抗原结合片段包含含有seq id no:84中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:85中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0303]
在一个实施方案中,tage剂包含抗egfr抗体或其抗原结合部分。在一些实施方案中,抗egfr抗体或其抗原结合部分包含含有seq id no:88中所示的氨基酸残基的可变重链区以及含有seq id no:89中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗egfr抗体或其抗原结合片段包含含有seq id no:88中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:89中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0304]
在一个实施方案中,tage剂包含抗igf-1r抗体或其抗原结合部分。在一些实施方案中,抗igf-1r抗体或其抗原结合部分包含含有seq id no:90中所示的氨基酸残基的可变重链区以及含有seq id no:91中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗igf-1r抗体或其抗原结合片段包含含有seq id no:90中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:91中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0305]
在一个实施方案中,tage剂包含抗cd30抗体或其抗原结合部分。在一些实施方案中,抗cd30抗体或其抗原结合部分包含含有seq id no:92中所示的氨基酸残基的可变重链区以及含有seq id no:93中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd30抗体或其抗原结合片段包含含有seq id no:92中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:93中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0306]
在一个实施方案中,tage剂包含抗cd19抗体或其抗原结合部分。在一些实施方案中,抗cd19抗体或其抗原结合部分包含含有seq id no:94中所示的氨基酸残基的可变重链区以及含有seq id no:95中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd19抗体或其抗原结合片段包含含有seq id no:94中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:95中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0307]
在一个实施方案中,tage剂包含抗cd34抗体或其抗原结合部分。在一些实施方案中,抗cd34抗体或其抗原结合部分包含含有seq id no:96中所示的氨基酸残基的可变重链区以及含有seq id no:97中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd34抗体或其抗原结合片段包含含有seq id no:96中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:97中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据
kabat编号确定。
[0308]
在一个实施方案中,tage剂包含抗cd59抗体或其抗原结合部分。在一些实施方案中,抗cd59抗体或其抗原结合部分包含含有seq id no:98中所示的氨基酸残基的可变重链区以及含有seq id no:99中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd59抗体或其抗原结合片段包含含有seq id no:98中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:99中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0309]
在一个实施方案中,tage剂包含抗cd47抗体或其抗原结合部分。在一些实施方案中,抗cd47抗体或其抗原结合部分包含含有seq id no:114中所示的氨基酸残基的可变重链区以及含有seq id no:115中所示的氨基酸残基的轻链可变区。在一个实施方案中,抗cd47抗体或其抗原结合片段包含含有seq id no:114中所示的cdr1、cdr2和cdr3结构域的重链可变区以及含有seq id no:115中所示的cdr1、cdr2和cdr3结构域的轻链可变区。cdr可以根据kabat编号确定。
[0310]
在一些实施方案中,抗体、其抗原结合片段包含具有与本文公开的抗体至少95%、96%、97%或99%同一的氨基酸序列(包括引用的参考文献中的序列)的可变区。另选地,抗体或其抗原结合片段包含本文公开的抗体的cdr,其中本文所述的可变区的框架区具有与本文公开的抗体至少95%、96%、97%或99%同一的氨基酸序列(包括引用的参考文献中的序列)的可变区。本文具体列举的序列和公开内容明确地通过引用并入。
[0311]
在一些实施方案中,tage剂包含与在选自以下项的细胞的表面上表达的蛋白质结合的抗原结合多肽:造血干细胞(hsc)、造血祖干细胞(hpsc)、天然杀伤细胞、巨噬细胞、dc细胞、非dc骨髓细胞、b细胞、t细胞(例如活化的t细胞)、成纤维细胞或其他细胞。在一些实施方案中,t细胞是cd4或cd8t细胞。在某些实施方案中,t细胞是调节性t细胞(t treg)或效应t细胞。在一些实施方案中,t细胞是肿瘤浸润t细胞。在一些实施方案中,细胞是造血干细胞(hsco)或造血祖细胞(hpsc)。在一些实施方案中,巨噬细胞是m1或m2巨噬细胞。
[0312]
在某些实施方案中,tage剂的抗原结合蛋白是抗原结合片段。此类片段的示例包括但不限于结构域抗体、纳米抗体、单抗体、scfv、fab、bite、双抗体、dart、微抗体、f(ab’)2或胞内抗体。
[0313]
在一个实施方案中,tage剂的抗原结合多肽是纳米抗体。
[0314]
在一个实施方案中,纳米抗体是抗mhcii纳米抗体。在一个实施方案中,抗mhcii纳米抗体包含seq id no:110的氨基酸序列。
[0315]
在一个实施方案中,纳米抗体是抗egfr纳米抗体。在一个实施方案中,抗egfr纳米抗体包含seq id no:111的氨基酸序列。
[0316]
在一个实施方案中,纳米抗体是抗her2纳米抗体。在一个实施方案中,抗her2纳米抗体包含seq id no:112的氨基酸序列。
[0317]
在一个实施方案中,tage剂包含结构域抗体和定点修饰多肽。结构域抗体(dab)是抗体的小功能结合单位,对应于人抗体的重链(vh)或轻链(vl)的可变区。结构域抗体具有大约13kda的分子量。domantis已经开发了一系列大型且功能强大的全人vh和vl dab文库(每个文库中有超过一百亿个不同的序列),并使用这些文库来选择对治疗靶标具有特异性的dab。与许多常规抗体相比,结构域抗体在细菌、酵母和哺乳动物细胞系统中良好表达。结
构域抗体及其生产方法的更多细节可通过参考美国专利号6,291,158、6,582,915、6,593,081、6,172,197、6,696,245、美国序列号2004/0110941、欧洲专利申请号1433846和欧洲专利0368684&0616640、wo05/035572、wo04/101790、wo04/081026、wo04/058821、wo04/003019和wo03/002609获得,这些文献中的每一篇全文通过引用并入本文。
[0318]
在一个实施方案中,tage剂包含纳米抗体和定点修饰多肽。纳米抗体是抗体衍生的治疗性蛋白质,其含有天然存在的重链抗体的独特结构和功能特性。这些重链抗体含有单个可变区(vhh)和两个恒定区(ch2和ch3)。重要的是,克隆和分离的vhh结构域是一种非常稳定的多肽,具有原始重链抗体的全部抗原结合能力。纳米抗体与人抗体的vh结构域具有高度同源性,并且可以进一步人源化而没有任何活性损失。重要的是,纳米抗体具有低免疫原性潜力,这已在用纳米抗体先导化合物的灵长类研究中得到证实。
[0319]
纳米抗体结合了常规抗体的优点和小分子药物的重要特征。与常规抗体一样,纳米抗体显示出高靶标特异性、对其靶标的高亲和力和低固有毒性。然而,与小分子药物一样,它们可以抑制酶并容易进入受体裂隙。此外,纳米抗体极其稳定,可以通过注射以外的方式施用(参见例如wo 04/041867,该文献全文通过引用并入本文)并且易于制造。纳米抗体的其他优点包括由于其尺寸较小可识别不常见或隐藏的表位,由于其三维药物形式灵活性独特可以高亲和力和选择性结合到蛋白质靶标的腔或活性位点中,可定制半衰期以及药物发现的容易性和速度。
[0320]
纳米抗体由单个基因编码,并且可在原核或真核宿主中产生,例如大肠杆菌(e.coli)(参见例如美国专利号6,765,087,该文献全文通过引用并入本文)、霉菌(例如曲霉属(aspergillus)或木霉属(trichoderma))和酵母(例如酵母属(saccharomyces)、克鲁维酵母菌属(kluyveromyces)、汉逊酵母属(hansenula)或毕赤酵母属(pichia))(参见例如美国专利号6,838,254,该文献全文通过引用并入本文)。生产过程是可扩展的,已经生产了几千克量的纳米抗体。因为纳米抗体与常规抗体相比表现出优异的稳定性,所以可以将它们配制成保质期长的即用型溶液。
[0321]
纳米克隆方法(参见例如wo 06/079372,该文献全文通过引用并入本文)是基于b细胞的自动高通量选择产生抗所需靶标的纳米抗体的专有方法,可以用于本发明的上下文中。
[0322]
在一个实施方案中,tage剂包含单抗体和定点修饰多肽。unibody是另一种抗体片段技术,然而该技术基于igg4抗体的铰链区的去除。铰链区的缺失导致分子基本上为传统igg4抗体大小的一半,并且具有单价结合区而不是igg4抗体的二价结合区。还众所周知的是,igg4抗体是惰性的,因此不与免疫系统相互作用,这对于治疗不需要免疫应答的疾病可能是有利的,并且这种优势被传递给unibody。例如,unibody可用于抑制或沉默,但不杀死与其结合的细胞。另外,与癌细胞结合的unibody不刺激它们增殖。此外,因为unibody为传统igg4抗体大小的约一半,因此它们可在较大的实体瘤中表现出更好的分布,并具有潜在的优势功效。unibody以与完整igg4抗体相似的速率从体内清除,并且能够以与完整抗体相似的亲和力结合其抗原。unibody的更多细节可通过参考专利申请wo2007/059782获得,该文献全文通过引用并入本文。
[0323]
在一个实施方案中,tage剂包含亲和体和定点修饰多肽。亲和体分子代表一类基于58个氨基酸残基的蛋白质结构域的亲和蛋白,其源自葡萄球菌蛋白a的igg结合结构域中
的一个。该三螺旋束结构域已被用作构建组合噬菌粒文库的支架,可以使用噬菌体展示技术从所述组合噬菌粒文库中选择靶向所需分子的亲和体变体(nord k,gunneriusson e,ringdahl j,stahl s,uhlen m,nygren p a,binding proteins selected from combinatorial libraries of an α-helical bacterial receptor domain,nat biotechnol 1997;15:772-7;ronmark j,gronlund h,uhlen m,nygren p a,human immunoglobulin a(iga)-specific ligands from combinatorial engineering of protein a,eur j biochem 2002;269:2647-55)。亲和体分子的简单坚固的结构与其低分子量(6kda)相结合,使它们适用于各种应用,例如作为检测试剂(ronmark j,harmon m,nguyen t等人,construction and characterization of affibody-fc chimeras produced in escherichia coli,j immunol methods 2002;261:199-211)和抑制受体相互作用(sandstorm k,xu z,forsberg g,nygren p a,inhibition of the cd28-cd80 co-stimulation signal by a cd28-binding affibody ligand developed by combinatorial protein engineering,protein eng 2003;16:691-7)。亲和体及其生产方法的更多细节可通过参考美国专利号5,831,012获得,该文献全文通过引用并入本文。
[0324]
在一些实施方案中,抗体、其抗原结合片段或抗体模拟物可以至少约1
×
10-4
、1
×
10-5
、1
×
10-6
m、1
×
10-7
m、1
×
10-8
m、1
×
10-9
m、1
×
10-10
m、1
×
10-11
m、1
×
10-12
m或更大的kd与位于靶细胞膜上或与特定组织缔合的细胞外分子(例如蛋白质、聚糖、脂质)特异性结合,和/或以比其对非特异性抗原的亲和力大至少两倍的亲和力与抗原结合。这种结合可产生抗原介导的表面相互作用。然而,应当理解,结合蛋白能够与两个或更多个序列相关的抗原特异性结合。例如,本发明的结合多肽可以与抗原的人类和非人类(例如小鼠或非人类灵长类)直向同源物特异性结合。
[0325]
在一些实施方案中,抗体、其抗原结合片段或抗体模拟物与半抗原结合,该半抗原又与细胞外细胞表面蛋白(例如靶向细胞受体的cas9-抗体-半抗原)特异性结合。
[0326]
抗原与抗体之间的结合或亲和力可以使用本领域已知的多种技术测定,例如但不限于平衡方法(例如酶联免疫吸附测定(elisa);kinexa,rathanaswami等人analytical biochemistry,第373卷:52-60,2008;或放射免疫测定(ria)),或通过表面等离子体共振测定或基于动力学的其他测定机制(例如biacore.rtm.分析或octet.rtm.分析(fortebio))和其他方法,诸如间接结合测定、竞争性结合测定、荧光共振能量转移(fret)、凝胶电泳和色谱法(例如凝胶过滤)。这些和其他方法可利用被检测的一种或多种组分上的标记和/或采用多种检测方法,包括但不限于显色、荧光、发光或同位素标记。结合亲和力和动力学的详细描述可见于paul,w.e.编,fundamental immunology,第4版,lippincott-raven,philadelphia(1999),该文献主要讲述抗体-免疫原相互作用。竞争性结合测定的一个示例是放射免疫测定,其包括在存在增加量的未标记抗原的情况下将标记抗原与目的抗体一起孵育,并检测与标记抗原结合的抗体。目的抗体对特定抗原的亲和力和结合解离速率可以根据数据通过斯卡恰特(scatchard)作图分析来确定。与第二抗体的竞争也可以使用放射免疫测定法来确定。在这种情况下,在存在增加量的未标记第二抗体的情况下,将抗原与缀合至标记化合物的目的抗体一起孵育。
[0327]
本文所述的抗体或其抗原结合片段可以是全长抗体、双特异性抗体、双可变结构域抗体、多链或单链抗体以及/或者特异性结合细胞外分子的结合片段(包括但不限于fab、
fab'、(fab')2、fv、scfv(单链fv)、替代体(surrobody)(包括替代轻链构建体)、单结构域抗体、骆驼化抗体等)的形式。它们也可以是或源自任何同种型,包括例如iga(例如iga1或iga2)、igd、ige、igg(例如igg1、igg2、igg3或igg4)或igm。在一些实施方案中,抗体是igg(例如igg1、igg2、igg3或igg4)。
[0328]
在一个实施方案中,所述抗体是阿昔单抗(abciximab)(reopro;cd41)、阿仑单抗(alemtuzumab)(lemtrada、campath;cd52)、阿利鲁单抗(abrilumab)(整联蛋白α4β7)、阿拉赛珠单抗聚乙二醇(alacizumab pegol)(vegfr2)、阿仑单抗(lemtrada、campath;cd52)、阿尼福鲁单抗(anifrolumab)(干扰素α/β受体)、阿泊珠单抗(apolizumab)(hla-dr)、阿普卢妥单抗(aprutumab)(fgfr2);阿塞珠单抗(aselizumab)(l-选择素或cd62l)、阿特珠单抗(atezolizumab)(tecentriq;pd-l1)、阿维鲁单抗(avelumab)(bavencio;pd-l1)、阿妥昔珠单抗(azintuxizumab)(cd319);巴利昔单抗(basiliximab)(simulect;cd25)、bcd-100(pd-1)、贝妥莫单抗(bectummomab)(lymphoscan;cd22)、贝兰他单抗(belantamab)(bcma)、贝利木单抗(belimumab)(benlysta;baff)、贝马妥珠单抗(bemarituzumab)(fgfr2)、贝那利珠单抗(benralizumab)(fasenra;cd125)、贝尔桑利单抗(bersanlimab)(icam-1)、比马鲁单抗(bimagrumab)(acvr2b)、比伐珠单抗(bivatuzumab)(cd44 v6)、布来鲁单抗(bleselumab)(cd40)、博纳吐单抗(blinatumomab)(blincyto;cd19)、布洛珠单抗(blosozumab)(sost);本妥昔单抗(brentuximab)(adcentris;cd30)、布朗妥珠单抗(brontictuzumab)(notch 1)、卡比拉单抗(cabiralizumab)(csf1r)、卡米丹单抗(camidanlumab)(cd25)、卡瑞利珠单抗(camrelizumab)(pd-1)、卡罗妥昔单抗(carotuximab)(endoglin)、卡妥索单抗(catumaxomab)(removab;epcam、cd3)、塞得珠单抗(cedelizumab)(cd4);西米普利单抗(cemipilimab)(libtayo;pcdc1)、西曲利单抗(cetrelimab)(pd-1)、西妥昔单抗(cetuximab)(erbitux;egfr)、赛必妥单抗(cibisatamab)(ceacam5)、西姆图珠单抗(cirmtuzumab)(ror1)、西妥木单抗(cixutumumab)(igf-1受体、cd221)、克立昔单抗(clenoliximab)(cd4)、考妥昔单抗(coltuximab)(cd19)、可那木单抗(conatumumab)(trail-r2)、达西组单抗(dacetuzumab)(cd40)、达利珠单抗(daclizumab)(zenapax;cd25)、达罗妥珠单抗(dalotuzumab)(igf-1受体、cd221)、达匹利珠单抗聚乙二醇(dapirolizumab pegol)(cd154、cd40l)、达雷木单抗(daratumumab)(darzalex;cd38)、登西珠单抗(demcizumab)(dll4)、地宁妥珠单抗(denintuzumab)(cd19)、迪妥昔珠单抗(depatuxizumab)(egfr)、曲齐妥单抗(drozitumab)(dr5);ds-8201(her2)、杜力格单抗(deligotuzumab)(erbb3、her3)、度普利尤单抗(dupilumab)(il-4rα)、度伐利尤单抗(durvalumab)(imfinzi;pd-l1)、度妥昔珠单抗(duvortuxizumab)(cd19、cd3e)、依法利珠单抗(efalizumab)(cd11a)、依更妥单抗(elgemtumab)(erbb3、her3);埃洛妥珠单抗(elotuzumab)(slamf7)、艾马妥珠单抗(emactuzumab)(csf1r)、恩泊妥单抗(enapotamab)(axl)、依那妥组单抗(enavatuzumab)(tweak受体)、恩莫单抗聚乙二醇(enlimonomab pegol)(icam-1、cd54)、依诺妥珠单抗(enoblituzumab)(cd276)、依诺苏单抗(enoticumab)(dll4)、依帕珠单抗(epratuzumab)(cd22)、厄利珠单抗(erlizumab)(itgb2、cd18)、厄妥昔单抗(ertumaxomab)(rexomun;her2/neu、cd3)、依他西单抗(etaracizumab)(abergin;整联蛋白αvβ3)、厄替吉利单抗(etigilimab)(tigit)、依托利珠单抗(etrolizumab)(整联蛋白β7)、艾韦单抗
(exbivirumab)(乙型肝炎表面抗原)、法索单抗(fanolesomab)(neutrospec;cd15)、法拉莫单抗(faralimomab)(干扰素受体)、法妥珠单抗(farletuzumab)(叶酸受体1)、fbta05(lymphomun、cd20)、菲巴妥珠单抗(fibatuzumab)(肝配蛋白受体a3)、菲吉妥木单抗(figitumumab)(igf-1受体、cd221)、氟替妥珠单抗(flotetuzumab)(il3受体);福拉木单抗(foralumab)(cd3ε);伏妥昔单抗(futuximab)(egfr)、加利昔单抗(galiximab)(cd80)、甘妥单抗(gancotamab)(her2/neu)、加尼妥单抗(ganitumab)(igf-1受体、cd221)、加维莫单抗(gavilimomab)(cd147、basigin)、吉妥单抗(gemtuzumab)(mylotarg;cd33)、戈米昔单抗(gomiliximab)(cd23、ige受体)、伊利尤单抗(ianalumab)(baff-r)、依巴利珠单抗(ibalizumab)(trogarzo;cd4)、ibi308(pd-1)、替伊莫单抗(ibritumomab tiuxetan)(cd20)、艾芦库单抗(icrucumab)(vegfr-1)、伊法博图单抗(ifabotuzumab)(epha3)、伊达珠单抗(iladatuzumab)(cd97b)、英加妥珠单抗(imgatuzumab)(egfr)、英度妥单抗(indusatumab)(gucy2c)、英比利珠单抗(inebilizumab)(cd19)、英妥木单抗(intetumumab)(cd51)、伊诺莫单抗(inolimomab)(cd25)、奥英妥珠单抗(inotuzumab)(besponsa;cd22)、伊匹木单抗(ipilimumab)(yervoy;cd152)、iomab-b(cd45)、伊妥木单抗(iratumumab)(cd30)、伊沙妥昔单抗(isatuximab)(cd38)、伊斯卡利单抗(iscalimab)(cd40)、艾司妥单抗(istiratumab)(igf1r、cd221)、伊托利珠单抗(itolizumab)(alzumab、cd6)、凯利昔单抗(keliximab)(cd4)、拉妥昔单抗(laprituximab)(egfr)、来马索单抗(lemalesomab)(nca-90、粒细胞抗原)、冷维单抗(lenvervimab)(乙型肝炎表面抗原)、来龙利单抗(leronlimab)(ccr5)、来沙木单抗(lexatumumab)(trail-r2)、利韦单抗(libivirumab)(乙型肝炎表面抗原)、罗妥昔珠单抗(losatuxizumab)(egfr、erbb1、her1)、利洛他单抗(lilotomab)(cd37)、林妥珠单抗(lintuzumab)(cd33)、利鲁单抗(lirilumab)(kir2d)、洛沃妥珠单抗(lorvotuzumab)(cd56)、卢卡木单抗(lucatumumab)(cd40)、鲁利珠单抗聚乙二醇(lulizumab pegol)(cd28)、鲁米单抗(lumiliximab)(cd23、ige受体)、鲁妥珠单抗(lumretuzumab)(erbb3、her3)、鲁帕妥单抗(lupartumab)(lypd3)、马帕木单抗(mapatumumab)(trail-r1)、马吉妥昔单抗(margetuximab)(her2)、马司莫单抗(maslimomab)(t细胞受体)、玛弗利木单抗(mavrilimumab)(gmcsf受体α-链)、马妥珠单抗(matuzumab)(egfr)、米妥昔单抗(mirvetuximab)(叶酸受体α)、莫多妥昔单抗(modotuximab)(egfr细胞外结构域iii)、莫格利珠单抗(mogamulizumab)(ccr4)、莫那利珠单抗(monalizumab)(nkg2a)、莫苏奈妥珠单抗(mosunetuzumab)(cd3e、ms4a1、cd20)、莫塞妥莫单抗(moxetumomab pasudotox)(cd22)、莫罗单抗(muromonab)-cd3(cd3)、纳可洛单抗(nacolomab)(c242抗原)、那妥昔单抗(naratuximab)(cd37)、那呐妥单抗(narnatumab)(mst1r)、那他利珠单抗(natalizumab)(tysabri、整联蛋白α4)、那昔妥单抗(naxitamab)(c-met)、耐昔妥珠单抗(necitumumab)(egfr)、奈莫利珠单抗(nemolizumab)(il31ra)、尼妥珠单抗(nimotuzumab)(theracim、theraloc;egfr)、尼塞韦单抗(nirsevimab)(rsvfr)、纳武利尤单抗(nivolumab)(pd-1)、奥滨尤妥珠单抗(obinutuzumab)(cd20)、奥卡妥珠单抗(ocaratuzumab)(cd20)、奥瑞利珠单抗(ocrelizumab)(cd20)、奥度莫单抗(odulimomab)(lfa-1、cd11a)、奥法木单抗(ofatumumab)(cd20)、奥拉单抗(olaratumab)(pdgf-rα)、奥姆布他单抗(omburtamab)(cd276)、奥纳妥珠单抗(onartuzumab)(人扩散因子受体激酶)、昂妥昔珠单抗(ontuxizumab)(tem1)、奥瓦利单抗(onvatilimab)(vsir)、奥匹单抗
egfr;egfr)、扎木单抗(zanolimumab)(humax-cd4;cd4)、扎妥昔单抗(zatuximab)(her1)、泽妥珠单抗(zenocutuzumab)(erbb3、her3)、齐拉木单抗(ziralimumab)(cd147、basigin);佐洛贝昔单抗(zolbetuximab)(claudin 18同种型2)、佐莫单抗(zolimomab)(cd5)、3f8(gd2神经节苷脂)、阿德木单抗(adecatumumab)(epcam)、阿妥莫单抗(altumomab)(hybri-ceaker;cea)、阿莫昔单抗(amatuximab)(间皮素)、马安那莫单抗(anatumomab mafenatox)(tag-72)、阿奈妥单抗(anetumab)(msln)、阿西莫单抗(arcitumomab)(cea)、阿托木单抗(atorolimumab)(rhesus因子);巴维昔单抗(bavituximab)(磷脂酰丝氨酸)、贝西洛索单抗(besilesomab)(scintimun;cea相关抗原)、坎妥珠单抗(cantuzumab)(muc1)、卡普赛珠单抗(caplacizumab)(cablivi;vwf)、泰坦-克利妥珠单抗(clivatuzumab tetraxetan)(hpam4-cide;muc1)、考曲妥珠单抗(codrituzumab)(磷脂酰肌醇聚糖3)、克赞利珠单抗(crizanlizumab)(选择素p)、克罗特度单抗(crotedumab)(gcgr)、地努图希单抗(dinutuximab)(unituxin;gd2神经节苷脂)、依美昔单抗(ecromeximab)(gd3神经节苷脂);依决洛单抗(edrecolomab)(epcam);依赞珠单抗(elezanumab)(rgma)、弗格替妥珠单抗(fgatipotuzumab)(muc1)、格伦巴单抗(glembatumumab)(gpnmb)、伊戈伏(igovomab)(indimacis-125;ca-125)、imab362(cldn18.2)、依玛利单抗(imaprelimab)(mcam)、英克勒库单抗(inclacumab)(选择素p)、英达妥昔单抗(indatuximab)(sdc1)、拉贝珠单抗(labetuzumab)(cea-cide、cea)、利法妥珠单抗(lifastuzumab)(磷酸钠共转运蛋白)、明瑞莫单抗(minretumomab)(tag-72)、米妥莫单抗(mitumomab)(gd3神经节苷脂)、莫罗木单抗(morolimumab)(rhesus因子)、埃托-那普妥莫单抗(naptumomab estafenatox)(5t4)、莫妥珠单抗(oportuzumab monatox)(epcam)、奥戈伏单抗(oregovomab)(ca-125)、潘科曼单抗(pankomab)(muc1的肿瘤特异性糖基化)、帕妥莫单抗(pemtumomab)(theragyn、muc1)、雷妥莫单抗(racotumomab)(vaxira、ngna神经节苷脂)、雷曲妥单抗(radretumab)(纤连蛋白额外结构域b)、瑞法奈珠单抗(refanezumab)(髓磷脂相关糖蛋白)、松妥珠单抗(sontuzumab)(episialin);trbs07(gd2神经节苷脂)、西莫白介素单抗(tucotuzumab celmoleukin)(epcam)、隆卡昔单抗(loncastuximab)(cd19)、米拉妥珠单抗(milatuzumab)(cd74)、沙妥莫单抗喷地肽(satumomab pendetide)(tag-72)、索非妥珠单抗(sofituzumab)(ca-125)、索利妥单抗(solitomab)(epcam)、阿比妥珠单抗(abituzumab)(cd51)、阿达木单抗(adalimumab)(humira;tnf-α)、柏达鲁单抗(brodalumab)(siliq;il-17受体)、瑟妥珠单抗阿姆白介素(cergutuzumab amunaleukin)(cea)、戈利木单抗(golimumab)(simponi;tnf-α)、英夫利昔单抗(infliximab)(remicade;tnf-α)、伐利苏单抗(varisacumab)(vegfr2)、沙瑞鲁单抗(sarilumab)(kevzara,il-6r)、司妥昔单抗(siltuximab)(sylvant;可溶性il-6,il-6r)或那赛昔珠单抗(avicixizumab)(dll4,vegfa)。还将前一句中关于特定抗体公开的细胞表面靶标的抗体或抗原结合蛋白设想为细胞表面上的靶标,例如her2。
[0329]
在其他实施方案中,可以用于本文公开的组合物和方法中的抗体是已知内化并有效作为抗体药物缀合物(adc)的抗体。可以用于本文所述的tage剂中的此类抗体的示例包括但不限于阿奈妥单抗(anetumab)(间皮素)、奥拉单抗(aorutumab)(fgfr2)、阿妥昔珠单抗(azintuxizumab)(slamf7)、贝兰他单抗(belantamab)(tnfrsf17)、比伐珠单抗(bivatuzumab)(cd44v6)、本妥昔单抗(brentuximab)(cd30)、卡米丹单抗(camidanlumab)(cd25)、坎妥珠单抗(cantuzumab)(canag)、坎妥珠单抗(cantuzumab)(canag)、克利伐妥珠
单抗(clivatuzumab)(muc1)、考非妥珠单抗(cofetuzumab)(ptk7)、考妥昔单抗(coltuximab)(cd19)、地宁妥珠单抗(denintuzumab)(cd19)、迪妥昔珠单抗(depatuxizumab)(egfr)、恩泊妥单抗(enapotamab)(axl)、恩诺单抗(enfortumab)(nectin-4)、依帕珠单抗(epratuzumab)(cd22)、吉妥单抗(gemtuzumab)(cd33)、格伦巴单抗(glembatumumab)(gpnmb)、赫妥珠单抗(hertuzumab)(her2)、伊达珠单抗(iladatuzumab)(cd79b)、英达妥昔单抗(indatuximab)(cd138)、英度珠单抗(industuzumab)(gcc)、奥英妥珠单抗(inotuzumab)(cd22)、拉贝珠单抗(labetuzumab)(cea-cam4)、拉迪拉妥珠单抗(ladiratuzumab)(liv-1)、拉妥昔单抗(laprituximab)(egfr)、利法妥珠单抗(lifastuzumab)(slc34a2)、隆卡昔单抗(loncastuximab)(cd19)、洛沃妥珠单抗(lorvotuzumab)(cd56)、洛沙妥昔单抗(losatuximab)(egfr)、鲁帕妥单抗(lupartumab)(lypd3)、伊妥木单抗(iratumumab)(cd30)、米拉妥珠单抗(milatuzumab)(cd74)、米妥昔单抗(mirvetuximab)(psma)、那妥昔单抗(naratuximab)(cd37)、品妥珠单抗(pinatuzumab)(cd22)、泊洛妥珠单抗(polatuzumab)(cd79b)、罗伐比妥单抗(rovalpituzumab)(dll3)、戈沙妥组单抗(sacituzumab)(tacstd2)、沙马妥单抗(samrotamab)(lrrc15)、斯妥尤单抗(sirtratumab)(sltrk6)、索非妥珠单抗(sofituzumab)(粘蛋白16)、特立妥珠单抗(telisotuzumab)(c-met)、替索珠单抗(tisotumab)(tf)、曲妥珠单抗(trastuzumab)(erbb2)、伐达妥昔单抗(vadastuximab)(cd33)、万多妥珠单抗(vandortuzumab)(steap1)或沃瑟妥珠单抗(vorsetuzumab)(cd70)。本文还设想了针对前一句中引用的靶标的抗体。已显示为有效adc靶标的另外的细胞表面靶标包括但不限于kaag-1、prlr、dlk1、enpp3、flt3、adam-9、cd248、内皮素受体etb、her3、tm4sf1、slc44a4、5t4、axl、ror2、ca9、cfc1b、mt1-mmp、hgfr、cxcr4、tim-1、cd166、cd163、gpc2、金黄色葡萄球菌(s.aureus)、叶酸受体、fxyd5、cd20、ca125、amhrii、bcma、cdh-6、cd98、sail、cldn6、cldn18.2、egfrviii、α-v整联蛋白、cd123、hla-dr、cd117、fgfr、epha、cd205、cd276、cd99、globo h、mtx3、mtx5、p-钙粘蛋白、sstr2、efna4、notch3、trop2、神经节苷脂gd3、folh1、ly6e、cea-cam5、lamp1、le(y)、cd352、er-α36、stn、叶酸受体α、铜绿假单胞菌(p.aeruginosa)抗原、cd38、h-铁蛋白、slea、nka、cd147、ofp、slitrk5、ephrina4、vegfr2、gcl、ceacam1、ceacam6或napi2b。
[0330]
本文所述的抗体或其抗原结合片段可以是全长抗体、双特异性抗体、双可变结构域抗体、多链或单链抗体以及/或者特异性结合细胞外分子的结合片段(包括但不限于fab、fab'、(fab')2、fv、scfv(单链fv)、替代体(surrobody)(包括替代轻链构建体)、单结构域抗体、骆驼化抗体等)的形式。它们也可以是或源自任何同种型,包括例如iga(例如iga1或iga2)、igd、ige、igg(例如igg1、igg2、igg3或igg4)或igm。在一些实施方案中,抗体是igg(例如igg1、igg2、igg3或igg4)。在某些实施方案中,抗原结合多肽是多特异性蛋白质,诸如多特异性(例如双特异性)抗体。
[0331]
在一个实施方案中,抗原结合蛋白是双特异性分子,其包含来自与细胞的细胞外细胞膜上的靶标结合的第一抗体的第一抗原结合位点以及具有不同结合特异性(诸如对细胞的细胞外细胞膜上的第二靶标具有结合特异性)的第二抗原结合位点,即其中第一抗原结合位点和第二抗原结合位点不彼此交叉阻断与第一抗原或第二抗原结合的双特异性抗体。上文提供了靶抗原的示例。因此,可以设想,tage剂包括与两个抗原(包括本文所述的那
些,例如ctla4和cd44)结合的双特异性分子。
[0332]
示例性双特异性抗体分子包含(i)缀合在一起的两个抗体,一个对第一抗原具有特异性,而另一种对第二靶标具有特异性,(ii)单个抗体,其具有对第一抗原具有特异性的一条链或臂以及对第二抗原具有特异性的第二条链或臂,(iii)单链抗体,其例如经由通过额外肽接头串联连接的两个scfv对第一抗原和第二抗原具有特异性;(iv)双可变结构域抗体(dvd-ig),其中每条轻链和重链含有通过短肽键串联的两个可变结构域(wu等人,generation and characterization of a dual variable domain immunoglobulin(dvd-igtm)molecule,in:antibody engineering,springer berlin heidelberg(2010));(v)化学连接的双特异性(fab')2片段;(vi)tandab,其是两个单链双抗体的融合体,产生针对每个靶抗原具有两个结合位点的四价双特异性抗体;(vii)柔性体(flexibody),其是scfv与双抗体的组合,产生多价分子;(viii)所谓的“停靠-和-加锁(dock and lock)”分子,其基于蛋白激酶a中的“二聚化和停靠结构域”,当应用于fab时,其可以产生由与不同fab片段连接的两个相同fab片段组成的三价双特异性结合蛋白;(ix)所谓的scorpion分子,其包含例如与人fc区的两个末端融合的两个scfv;以及(x)双抗体。
[0333]
可用于制备双特异性抗体的平台的示例包括但不限于bite(micromet)、dart(macrogenics)、fcab和mab.sup.2(f-star)、fc工程化的igg1(xencor)或duobody(基于fab臂交换,genmab)。
[0334]
不同类别的双特异性抗体的示例包括但不限于不对称igg样分子,其中该分子的一侧含有至少一种抗体的fab区或fab区的一部分,而该分子的另一侧含有至少一种其他抗体的fab区或fab区的一部分;在该类别中,fc区中的不对称性也可以存在,并且用于该分子的两个部分的特异性连接;对称igg样分子,其中该分子的两侧各自含有至少两种不同抗体的fab区或fab区的一部分;igg融合分子,其中全长igg抗体与额外的fab区或fab区的部分融合;fc融合分子,其中单链fv分子或稳定的双抗体与fcγ区或其部分融合;fab融合分子,其中不同的fab片段融合在一起;基于scfv和双抗体的分子,其中不同的单链fv分子或不同的双抗体彼此融合或者与另一种蛋白或载剂分子融合。
[0335]
不对称igg样分子的示例包括但不限于triomab/quadroma(trion pharma/fresenius biotech)、knobs-into-holes(genentech)、crossmabs(roche)和静电匹配(amgen)、luz-y(genentech)、链交换工程化的结构域体(emd serono)、biclonic(merus)和duobody(genmab a/s)。
[0336]
对称igg样分子的示例包括但不限于双重靶向(dt)-ig(gsk/domantis)、two-in-one antibody(genentech)、cross-linked mabs(karmanos cancer center)、mab2(f-star)和covx-body(covx/pfizer)。
[0337]
igg融合分子的示例包括但不限于双重可变结构域(dvd)-ig(abbott)、igg样bispecific(imclone/eli lilly)、ts2ab(medimmune/az)和bsab(zymogenetics)、hercules(biogen idec)和tvab(roche)。
[0338]
fc融合分子的示例包括但不限于scfv/fc融合体(academic institution)、scorpion(emergent biosolutions/trubion,zymogenetics/bms)、双亲和重新靶向技术(fc-dart)(macrogenics)和dual(scfv)
2-fab(national research center for antibody medicine
‑‑
china)。
[0339]
v类双特异性抗体的示例包括但不限于f(ab)2(medarex/amgen)、dual-action或bis-fab(genentech)、dock-and-lock(dnl)(immunomedics)、bivalent bispecific(biotecnol)和fab-fv(ucb-celltech)。基于scfv和双抗体的分子的示例包括但不限于双特异性t细胞接合物(bite)(micromet)、串联双抗体(tandab)(affimed)、双亲和重新靶向技术(dart)(macrogenics)、单链双抗体(academic)、tcr样抗体(ait,receptorlogics)、人血清白蛋白scfv fusion(merrimack)和com body(epigen biotech)。
[0340]
可与本文所述的组合物和方法结合使用的抗体、抗原结合片段或抗体模拟物包括上述抗体及其抗原结合片段,以及上述那些非人类抗体和抗原结合片段的人源化变体以及结合与上述那些相同的表位的抗体或抗原结合片段,如例如通过竞争性抗原结合测定所评估。
[0341]
本文所述的抗体或结合片段还可包括改变抗体和/或片段的特性的修饰和/或突变。工程化抗体以包括任何修饰的方法是本领域熟知的。这些方法包括但不限于通过对制备的编码抗体或抗体的至少恒定区的dna分子进行定点(或寡核苷酸介导的)诱变、pcr诱变和盒式诱变来进行制备。定点诱变是本领域熟知的(参见例如carter等人,nucleic acids res.,13:4431-4443(1985)以及kunkel等人,proc.natl.acad.sci.usa,82:488(1987))。pcr诱变也适于制备起始多肽的氨基酸序列变体。参见higuchi,pcr protocols,第177-183页(academic press,1990);以及vallette等人,nuc.acids res.17:723-733(1989)。用于制备序列变体的另一种方法盒式诱变基于wells等人,gene,34:315-323(1985)描述的技术。
[0342]
抗体或其片段可使用重组方法和组合物产生,例如如美国专利号4,816,567中所述。在一个实施方案中,提供了编码本文所述抗体的分离核酸。这种核酸可编码包含抗体的vl的氨基酸序列和/或包含抗体的vh的氨基酸序列(例如抗体的轻链和/或重链)。在另一个实施方案中,提供了包含这种核酸的一种或多种载体(例如表达载体)。在另一个实施方案中,提供了包含这种核酸的宿主细胞。在一个这种实施方案中,宿主细胞包含以下项(例如已经用以下项转化):(1)包含编码包含抗体vl的氨基酸序列和包含抗体vh的氨基酸序列的核酸的载体,或(2)包含编码包含抗体vl的氨基酸序列的核酸的第一载体以及包含编码包含抗体vh的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞是真核细胞,例如中国仓鼠卵巢(cho)细胞或淋巴样细胞(例如y0、ns0、sp20细胞)。在一个实施方案中,提供了制备抗cll-1抗体的方法,其中该方法包括在适于抗体表达的条件下培养包含编码如上提供的抗体的核酸的宿主细胞,以及任选地从宿主细胞(或宿主细胞培养基)中回收抗体。
[0343]
为了重组产生抗体(或抗体片段),分离编码例如如上所述的抗体的核酸,并将其插入一种或多种载体中,用于在宿主细胞中进一步克隆和/或表达。可使用常规程序(例如,通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离这种核酸并对其进行测序。
[0344]
用于克隆或表达抗体编码载体的合适宿主细胞包括本文所述的原核或真核细胞。例如,抗体可在细菌中制备,特别是在不需要糖基化和fc效应子功能时。关于抗体片段和多肽在细菌中的表达,参见例如美国专利号5,648,237、5,789,199和5,840,523。(还可参见charlton,methods in molecular biology,第248卷(b.k.c.lo编,humana press,totowa,n.j.,2003),第245-254页,其描述了抗体片段在大肠杆菌中的表达。)表达后,可以可溶性
级分从细菌细胞糊中分离抗体,并可以对其进行进一步纯化。
[0345]
脊椎动物细胞也可用作宿主。例如,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他示例是sv40转化的猴肾cv1系(cos-7);人胚肾系(293或293细胞,如例如graham等人,j.gen virol.36:59(1977)中所述);幼仓鼠肾细胞(bhk);小鼠塞尔托利氏(sertoli)细胞(tm4细胞,如例如mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck);水牛鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);tri细胞(如例如mather等人,annals n.y.acad.sci.383:44-68(1982)中所述);mrc 5细胞;以及fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa 77:4216(1980));以及骨髓瘤细胞系,诸如y0、ns0和sp2/0。关于适于抗体生产的某些哺乳动物宿主细胞系的综述,参见例如yazaki和wu,methods in molecular biology,第248卷(b.k.c.lo编,humana press,totowa,n.j.),第255-268页(2003)。
[0346]
抗体模拟物
[0347]
tage试可包括能够结合目的抗原的抗体模拟物。如下详述,已经开发了多种抗体片段和抗体模拟物技术,这些技术是本领域广为人知的。通常,本文所述的抗体模拟物在结构上与抗体无关,并且包括adnectin、亲和体、darpin、anticalin、avimer、versabody、适体和smips。抗体模拟物使用在模拟传统抗体结合的同时由不同机制产生并经由不同机制起作用的结合结构。这些替代结构中的一些在gill和damle(2006)17:653-658中综述。
[0348]
在一个实施方案中,tage剂包含adnectin分子和定点修饰多肽。adnectin分子是源自纤连蛋白的一个或多个结构域的工程化的结合蛋白。纤连蛋白天然存在于人体内。它作为不溶性糖蛋白二聚体存在于细胞外基质中,并且还用作接头蛋白。它也作为二硫化物连接的二聚体以可溶形式存在于血浆中。纤连蛋白的血浆形式由肝脏细胞(肝细胞)合成,并且ecm形式由软骨细胞、巨噬细胞、内皮细胞、成纤维细胞和上皮的一些细胞制成。如前所述,纤连蛋白可天然地作为细胞粘附分子起作用,或者它可通过在细胞外基质中进行接触来介导细胞的相互作用。通常,纤连蛋白由三种不同的蛋白质模块即i型、ii型和iii型模块组成。关于纤连蛋白功能结构的综述,参见pankov和yamada(2002)j cell sci.;115(pt 20):3861-3、hohenester和engel(2002)21:115-128以及lucena等人(2007)invest clin.48:249-262。
[0349]
在一个实施方案中,adnectin分子通过改变由分布在两个β片层之间的多条β链组成的天然蛋白质而源自纤连蛋白iii型结构域。根据起源组织,纤连蛋白可含有多个iii型结构域,这些结构域可表示为例如1fn3、2fn3、3fn3等。10fn3结构域含有整联蛋白结合基序并且还含有连接β链的三个环。这些环可被认为对应于igg重链的抗原结合环,并且它们可通过下面讨论的方法改变以特异性结合目的靶标。优选地,可用于本发明目的的纤连蛋白iii型结构域是表现出与编码纤连蛋白iii型分子的结构的序列(可以从protein data bank(pdb,rcsb.org/pdb/home/home.do)获得,登录号:1ttg)至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%的序列同一性的序列。adnectin分子还可源自10fn3相关分子的聚合物而不是简单的单体10fn3结构。
[0350]
尽管天然10fn3结构域通常与整联蛋白结合,但适于变成adnectin分子的10fn3蛋
白被改变以结合目的抗原。在一个实施方案中,10fn3分子的改变包括β链的至少一个突变。在优选的实施方案中,连接10fn3分子的β链的环区被改变以与目的抗原结合。
[0351]
10fn3中的改变可通过本领域已知的任何方法进行,包括但不限于易错pcr、定点诱变、dna改组或本文提及的其他类型的重组诱变。在一个示例中,编码10fn3序列的dna的变体可在体外直接合成,随后在体外或体内转录和翻译。另选地,天然10fn3序列可使用标准方法(如例如在美国专利申请号20070082365中执行的)从基因组中分离或克隆,然后使用本领域已知的诱变方法进行突变。
[0352]
在一个实施方案中,可将靶抗原固定在固体支持物(诸如柱树脂或微量滴定板中的孔)上。然后使靶标与潜在结合蛋白文库接触。文库可包含通过10fn3序列的诱变/随机化或通过10fn3环区(不是β链)的诱变/随机化而源自野生型10fn3的10fn3克隆或adnectin分子。在优选的实施方案中,文库可以是通过以下文献中描述的技术产生的rna-蛋白质融合文库:szostak等人,美国专利号6,258,558和6,261,804;szostak等人,wo989/31700;以及roberts&szostak(1997)94:12297-12302。文库也可以是dna-蛋白质文库(例如,如lohse,美国专利号6,416,950和wo 00/32823中所述)。然后将融合文库与固定的靶抗原一起孵育,并洗涤固体支持物以除去非特异性结合部分。然后在严格条件下洗脱紧密结合物,并使用pcr扩增遗传信息或产生新的结合分子文库以重复该过程(进行或不进行另外的诱变)。可重复选择/诱变过程直到获得对靶标具有足够亲和力的结合物。用于本发明的adnectin分子可使用adnexus(briston-myers squibb公司)采用的profusion
tm
技术进行工程化。profusion技术是基于上文提及的技术创建的(例如,roberts&szostak(1997)94:12297-12302)。产生改变的10fn3结构域的文库并选择可与本发明一起使用的合适结合物的方法在以下美国专利和专利申请文件中充分描述并通过引用并入本文:美国专利号7,115,396、6,818,418、6,537,749、6,660,473、7,195,880、6,416,950、6,214,553、6623926、6,312,927、6,602,685、6,518,018、6,207,446、6,258,558、6,436,665、6,281,344、7,270,950、6,951,725、6,846,655、7,078,197、6,429,300、7,125,669、6,537,749、6,660,473;以及美国专利申请号20070082365、20050255548、20050038229、20030143616、20020182597、20020177158、20040086980、20040253612、20030022236、20030013160、20030027194、20030013110、20040259155、20020182687、20060270604、20060246059、20030100004、20030143616和20020182597。在纤连蛋白iii型结构域诸如10fn3中产生多样性随后进行选择步骤可使用本领域已知的其他方法(诸如噬菌体展示、核糖体展示或酵母表面展示)来完成,例如lipovsek等人(2007)journal of molecular biology 368:1024-1041;sergeeva等人(2006)adv drug deliv rev.58:1622-1654;petty等人(2007)trends biotechnol.25:7-15;rothe等人(2006)expert opin biol ther.6:177-187;以及hoogenboom(2005)nat biotechnol.23:1105-1116。
[0353]
本领域技术人员应当理解,上文引用的方法参考文献可用于从除优选的10fn3结构域之外的蛋白质衍生抗体模拟物。可以用于经由上文提及的方法产生抗体模拟物的另外的分子包括但不限于人纤连蛋白模块1fn3-9fn3和11fn3-17fn3以及来自非人类动物和原核生物的相关fn3模块。另外,也可使用来自与10fn3具有序列同源性的其他蛋白质(诸如腱生蛋白(tenascin)和粗纤维调节素(undulin))的fn3模块。具有免疫球蛋白样折叠(但具有与vh结构域无关的序列)的其他示例性蛋白质包括n-钙粘蛋白、icam-2、肌联蛋白、gcsf受
体、细胞因子受体、糖苷酶抑制剂、e-钙粘蛋白和抗生素色蛋白。具有相关结构的其他结构域可源自髓磷脂膜粘附分子p0、cd8、cd4、cd2、i类mhc、t细胞抗原受体、vcam-1的cd1、c2和i-set结构域、肌球蛋白结合蛋白c的i-set免疫球蛋白折叠、肌球蛋白结合蛋白h的i-set免疫球蛋白折叠、端素蛋白(telokin)、telikin、ncam、颤搐蛋白(twitchin)、神经胶质蛋白(neuroglian)、生长激素受体、红细胞生成素受体、催乳素受体、gc-sf受体、干扰素-γ受体、β-半乳糖苷酶/葡萄糖醛酸酶、β-葡萄糖醛酸酶和转谷氨酰胺酶的i-set免疫球蛋白折叠。另选地,包括一个或多个免疫球蛋白样折叠的任何其他蛋白质可用于产生adnectin样结合部分。例如,可使用程序scop(murzin等人,j.mol.biol.247:536(1995);lo conte等人,nucleic acids res.25:257(2000))鉴定此类蛋白质。
[0354]
在一个实施方案中,tage剂包含适体和定点修饰多肽。本文公开的组合物和方法中使用的“适体”包括由肽或核苷酸制成的适体分子。肽适体与核苷酸适体共享许多特性(例如尺寸小并能够以高亲和力结合靶分子),并且它们可通过具有与用于产生核苷酸适体的那些方法类似的原理的选择方法产生,例如baines和colas.2006.drug discov today.11(7-8):334-41;以及bickle等人2006.nat protoc.1(3):1066-91,这些文献通过引用并入本文。
[0355]
在某些实施方案中,适体是与特定分子靶标结合的小核苷酸聚合物。适体可以是单链或双链核酸分子(dna或rna),但基于dna的适体最常见是双链的。适体核酸没有限定的长度;然而,适体分子最常见的长度介于15与40个核苷酸之间。
[0356]
适体通常形成复杂的三维结构,这些结构决定它们对靶分子的亲和力。与简单抗体相比,适体可以提供许多优势,主要是因为它们几乎可以完全在体外进行工程化和扩增。此外,适体通常诱导很少或不诱导免疫应答。
[0357]
适体可使用多种技术产生,但最初使用体外选择(ellington和szostak.(1990)nature.346(6287):818-22)和selex方法(指数富集配体的系统进化)(schneider等人1992.j mol biol.228(3):862-9)开发,这些文献的内容通过引用并入本文。已经公开了制备和使用适体的其他方法,包括klussmann.the aptamer handbook functional oligonucleotides and their applications.isbn:978-3-527-31059-3;ulrich等人2006.comb chem high throughput screen 9(8):619-32;cerchia和de franciscis.2007.methods mol biol.361:187-200;ireson和kelland.2006.mol cancer ther.2006 5(12):2957-62;美国专利号5,582,981、5,840,867、5,756,291、6,261,783、6,458,559、5,792,613、6,111,095;以及美国专利申请美国公开号us20070009476a1;美国公开号us20050260164a1;美国专利号7,960,102;以及美国公开号us20040110235a1,这些文献全部通过引用并入本文。
[0358]
selex方法显然是最受欢迎的,分三个基本步骤进行。首先,选择候选核酸分子文库用于与特定分子靶标结合。其次,将对靶标具有足够亲和力的核酸与非结合剂分离。第三,扩增结合的核酸,形成第二文库,并重复该过程。在每次重复时,选择对靶分子具有越来越高的亲和力的适体。selex方法在以下公开中更全面地描述,这些文献通过引用并入本文:bugaut等人2006.4(22):4082-8;stoltenburg等人2007 biomol eng.2007 24(4):381-403;以及gopinath.2007.anal bioanal chem.2007.387(1):171-82。
[0359]
在一个实施方案中,tage剂包含darpin和定点修饰多肽。darpin(设计的锚蛋白重
复蛋白)是抗体模拟物drp(设计的重复蛋白)技术的一个示例,该技术已被开发以利用非抗体多肽的结合能力。重复蛋白(诸如锚蛋白或富含亮氨酸的重复蛋白)是普遍存在的结合分子,与抗体不同,它们存在于细胞内和细胞外。它们独特的模块化结构以重复结构单元(重复)为特征,这些重复结构单元堆叠在一起形成展示可变和模块化靶结合表面的细长重复结构域。基于这种模块性,可以产生具有高度多样化结合特异性的多肽组合文库。该策略包括展示可变表面残基的自相容重复以及它们随机组装成重复结构域的共有设计。
[0360]
darpin可以在细菌表达系统中以非常高的产量生产,并且它们属于已知的最稳定的蛋白质。已经选择了对广泛的靶蛋白(包括人受体、细胞因子、激酶、人蛋白酶、病毒和膜蛋白)具有高度特异性、高亲和力的darpin。可以获得具有在个位数纳摩尔至皮摩尔范围内的亲和力的darpin。
[0361]
darpin已经用于广泛的应用中,包括elisa、夹心elisa、流式细胞分析(facs)、免疫组织化学(ihc)、芯片应用、亲和纯化或蛋白质印迹。还证明darpin在细胞内区室中具有高度活性,例如作为与绿色荧光蛋白(gfp)融合的细胞内标记蛋白。darpin进一步用于抑制病毒进入,ic50在pm范围内。darpin不仅理想地阻断蛋白质-蛋白质相互作用,而且抑制酶。蛋白酶、激酶和转运蛋白已被成功抑制,最常见的是变构抑制模式。肿瘤上非常快速和特异性的富集以及非常有利的肿瘤与血液比率使得darpin非常适合于体内诊断或治疗方法。
[0362]
关于darpin和其他drp技术的附加信息可以在美国专利申请公开号2004/0132028和国际专利申请公开号wo 02/20565中找到,这两篇文献全文据此通过引用并入。
[0363]
在一个实施方案中,tage剂包含anticalin和定点修饰多肽。anticalin是一种另外的抗体模拟技术,然而在这种情况下,结合特异性来源于脂质运载蛋白(在人组织和体液中天然和丰富表达的低分子量蛋白家族)。脂质运载蛋白已经进化为在体内执行一系列与化学敏感或不溶性化合物的生理运输和储存相关的功能。脂质运载蛋白具有稳健的内在结构,包括高度保守的β-桶,该β-桶在蛋白质的一个末端支撑四个环。这些环形成结合口袋的入口,并且分子的该部分的构象差异解释了各个脂质运载蛋白之间结合特异性的变化。
[0364]
虽然由保守的β-片层框架支撑的高变环的整体结构使人联想到免疫球蛋白,但脂质运载蛋白在大小方面与抗体显著不同,其由160-180个氨基酸的单条多肽链组成,该多肽链略大于单个免疫球蛋白结构域。
[0365]
在一个实施方案中,tage剂包含脂质运载蛋白和定点修饰多肽。克隆脂质运载蛋白并对其环进行工程化以产生anticalin。已经产生了结构不同的anticalin文库,并且anticalin展示允许选择和筛选结合功能,随后表达和产生可溶性蛋白,用于在原核或真核系统中进一步分析。研究已经成功证明了可以开发对几乎任何人类靶蛋白都具有特异性的anticalin,并且可以分离和获得纳摩尔或更高范围内的结合亲和力。
[0366]
anticalin也可以被形成为双重靶向蛋白,所谓的duocalin。duocalin使用标准制造方法在一个易于产生的单体蛋白中结合两个单独的治疗靶标,同时保持靶标特异性和亲和力,而与其两个结合结构域的结构取向无关。
[0367]
通过单个分子调节多个靶标在已知涉及多于单个致病因素的疾病中是特别有利的。此外,双价或多价结合形式(诸如duocalin)在靶向疾病中的细胞表面分子、介导对信号转导途径的激动作用或经由细胞表面受体的结合和成簇诱导增强的内化作用方面具有显著潜力。此外,duocalin的高内在稳定性与单体anticalin相当,为duocalin提供灵活的制
剂和递送潜力。
[0368]
关于anticalin的附加信息可以在美国专利号7,250,297和国际专利申请公开号wo 99/16873中找到,这两篇文献全文据此通过引用并入。
[0369]
可用于本发明的上下文中的另一种抗体模拟物技术是avimer。avimer通过体外外显子改组和噬菌体展示由人细胞外受体结构域的大家族进化而来,从而生成具有结合和抑制特性的多结构域蛋白。连接多个独立的结合结构域已被证明可以产生亲合力并且使得亲和力和特异性与常规单表位结合蛋白相比得以提高。其他潜在的优点包括在大肠杆菌中简单有效地生产多靶标特异性分子、提高热稳定性和对蛋白酶的抗性。已获得针对多种靶标的具有亚纳摩尔亲和力的avimer。
[0370]
关于avimer的附加信息可以在美国专利申请公开号2006/0286603、2006/0234299、2006/0223114、2006/0177831、2006/0008844、2005/0221384、2005/0164301、2005/0089932、2005/0053973、2005/0048512、2004/0175756中找到,所有这些文献全文据此通过引用并入。
[0371]
在一个实施方案中,tage剂包含versabody和定点修饰多肽。versabody是可以用于本发明的上下文中的另一种抗体模拟技术。versabody是具有》15%半胱氨酸的3-5kda的小蛋白,其形成高二硫化物密度支架,替代典型蛋白具有的疏水核心。用少量二硫化物替换大量包含疏水核心的疏水氨基酸使得蛋白质更小、更亲水(更少聚集和非特异性结合)、更抗蛋白酶和热,并且具有更低密度的t细胞表位,因为对mhc呈递贡献最大的残基是疏水的。众所周知,所有这四种特性都会影响免疫原性,预计它们一起会使得免疫原性大幅下降。
[0372]
versabody的灵感来自于水蛭、蛇、蜘蛛、蝎子、蜗牛和海葵产生的天然可注射生物药物,已知这些药物表现出出乎意料的低免疫原性。从所选择的天然蛋白质家族开始,通过设计并通过筛选,将大小、疏水性、蛋白水解抗原加工和表位密度最小化至远低于天然可注射蛋白质的平均水平。
[0373]
考虑到versabody的结构,这些抗体模拟物提供了包括多价、多特异性、多种半衰期机制、组织靶向模块和缺乏抗体fc区的通用形式。此外,versabody在大肠杆菌中以高产量生产,并且由于其具有亲水性和小尺寸,versabody具有高溶解性,并且可以被配制成高浓度。versabody具有出色的热稳定性(它们可以被煮沸)和延长的保质期。
[0374]
关于versabody的附加信息可以在美国专利申请公开号2007/0191272中找到,该文献全文据此通过引用并入。
[0375]
在一个实施方案中,tage剂包含smip和定点修饰多肽。对smips
tm
(小模块化免疫药物-trubion药物)进行工程化以维持和优化靶结合、效应子功能、体内半衰期和表达水平。smips由三个不同的模块化结构域组成。首先,它们含有结合结构域,其可由赋予特异性的任何蛋白质(例如细胞表面受体、单链抗体、可溶性蛋白质等)组成。其次,它们含有铰链结合结构域,其用作结合结构域与效应结构域之间的柔性接头,并且还有助于控制smip药物的多聚化。最后,smips含有效应结构域,其可源自多种分子,包括fc结构域或其他特别设计的蛋白质。设计的模块性(其允许简单构建具有各种不同结合、铰链和效应结构域的smip)提供了快速且可定制的药物设计。
[0376]
关于smip的更多信息(包括如何设计它们的示例)可在zhao等人(2007)blood 110:2569-77和以下美国专利申请号中找到:20050238646、20050202534、20050202028、
20050202023、20050202012、20050186216、20050180970和20050175614。
[0377]
上文提供的对抗体片段和抗体模拟物技术的详细描述并非旨在是可以在本说明书的上下文中使用的所有技术的全面列表。例如,但也不通过限制的方式,多种另外的技术(包括替代的基于多肽的技术,诸如qui等人,nature biotechnology,25(8)921-929(2007)中概述的互补决定区的融合体,该文献全文据此通过引用并入;以及基于核酸的技术,诸如美国专利号5,789,157、5,864,026、5,712,375、5,763,566、6,013,443、6,376,474、6,613,526、6,114,120、6,261,774和6,387,620中所述的rna适体技术,所有这些文献据此通过引用并入)可以用于本发明的上下文中。
[0378]
tage剂构建体
[0379]
在一些实施方案中,tage剂按从n-末端到c-末端的顺序包含抗原结合多肽和定点修饰多肽(例如cas9)。
[0380]
在一些实施方案中,tage剂按从n-末端到c-末端的顺序包含定点修饰多肽(例如cas9)和抗原结合多肽。
[0381]
在一些实施方案中,tage剂按从n-末端到c-末端的顺序包含定点修饰多肽(例如cas9)、两个核定位信号(例如2x sv40 nls)和spycatcher。例如,tage剂可包含cas9-2xnls-spycatcher构建体,其又可与连接到spytag的抗原结合多肽缀合。
[0382]
在一些实施方案中,tage剂按从n-末端到c-末端的顺序包含spycatcher、定点修饰多肽(例如cas9)和两个核定位信号(例如2x sv40 nls)。例如,tage剂可包含spycatcher-cas9-2xnls构建体,其又可与连接到spytag的抗原结合多肽缀合。
[0383]
在一些实施方案中,tage剂按从n-末端到c-末端的顺序包含一系列通过肽接头(例如遗传融合体)或选自表1的化学接头连接在一起的多肽。在一些实施方案中,表1所示的构建体进一步包括所示多肽之间的一个或多个肽接头。在某些实施方案中,表1所示的构建体进一步包括对应于hrv 3c蛋白酶切割位点的肽序列。
[0384]
表1:tage剂或其片段的示例
[0385]
[0386][0387]
在一些实施方案中,tage剂包含第一系列多肽(例如第一遗传融合体,诸如选自表1的融合体)和第二系列多肽(例如第二遗传融合体,诸如选自表1的融合体),其中第一遗传融合体和第二遗传融合体以非共价方式或共价方式(例如经由互补缀合部分,诸如spycatcher/spytag或halo/halo-tag或配体)稳定缔合。
[0388]
在一些实施方案中,tage包含与spycatcher-cas9(wt)-2xnls(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0389]
在一些实施方案中,tage包含与(spycatcher-cas9(wt)-2xnls)2(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0390]
在一些实施方案中,tage包含与cas9(wt)-2xnls-spycatcher-4xnls(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0391]
在一些实施方案中,tage包含与cas9(wt)-2xnls-spycatcher-htn(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0392]
在一些实施方案中,tage包含与4xnls-spycatcher-cas9(wt)-2xnls(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0393]
在一些实施方案中,tage包含与htn-spycatcher-cas9(wt)-2xnls(按从n-末端到c-末端的顺序)缀合的抗体-spytag融合体(按从n-末端到c-末端的顺序)。
[0394]
iii.使用方法
[0395]
本文所述的tage剂可以用于修饰靶细胞的基因组。该方法包括使靶细胞与本文公开的tage剂接触,使得至少定点修饰多肽内化到细胞中,随后修饰靶细胞的基因组(或靶核酸)。此类方法可用于体外、离体或体内环境,包括用于其中对有需要的受试者的基因组进行修饰使得疾病或障碍得以治疗的治疗用途。
[0396]
本文所述的tage剂可以用于将定点修饰多肽靶向任何展示目的抗原的细胞。细胞可以是真核细胞,包括但不限于哺乳动物细胞。可以被本发明的tage剂靶向(并且使其基因组被修饰)的哺乳动物细胞的示例包括但不限于小鼠细胞、非人类灵长类动物细胞或人类细胞。
[0397]
在某些情况下,tage剂可以用于离体或体内编辑特定细胞类型,诸如造血干细胞(hsc)、造血祖干细胞(hpsc)、自然杀伤细胞、巨噬细胞、dc细胞、非dc骨髓细胞、b细胞、t细胞(例如活化的t细胞)、成纤维细胞或其他细胞。在一些实施方案中,t细胞是cd4或cd8t细胞。在某些实施方案中,t细胞是调节性t细胞(treg)或效应t细胞。在一些实施方案中,t细胞是肿瘤浸润t细胞。在一些实施方案中,细胞是造血干细胞(hsc)或造血祖细胞(hpsc)。在一些实施方案中,巨噬细胞是m0、m1或m2巨噬细胞。在一些实施方案中,tage剂用于编辑选自以下项的多种(例如两种或更多种)细胞类型:造血干细胞、造血祖干细胞(hpsc)、自然杀伤细胞、巨噬细胞、dc细胞、非dc骨髓细胞、b细胞、t细胞(例如活化的t细胞)和成纤维细胞。
[0398]
在一些实施方案中,tage剂还包含cpp,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0399]
在一些实施方案中,tage剂还包含cpp,并且该方法包括使巨噬细胞(例如人类巨噬细胞)与tage剂接触。
[0400]
在一些实施方案中,tage剂还包含cpp,并且该方法包括使hsc(例如人类hsc)与tage剂接触。在一些实施方案中,tage剂包含cpp,并且该方法包括使受试者骨髓中的细胞与tage剂接触。在一些实施方案中,细胞不是造血干细胞(例如成纤维细胞、巨噬细胞、成骨细胞、破骨细胞或内皮细胞)。
[0401]
在一些实施方案中,tage剂还包含至少四个nls,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0402]
在一些实施方案中,tage剂还包含至少四个nls,并且该方法包括使巨噬细胞(例如人类巨噬细胞)与tage剂接触。
[0403]
在一些实施方案中,tage剂还包含cpp,并且该方法包括使hsc(例如人类hsc)与tage剂接触。
[0404]
在一些实施方案中,tage剂还包含至少六个nls,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0405]
在一些实施方案中,tage剂还包含至少四个nls,并且该方法包括使巨噬细胞(例如人类巨噬细胞)与tage剂接触。
[0406]
在一些实施方案中,tage剂还包含至少六个nls,并且该方法包括使hsc(例如人类hsc)与tage剂接触。
[0407]
在一些实施方案中,tage剂包含至少六个nls,并且该方法还包括使成纤维细胞(例如人类成纤维细胞)与tage剂接触。
[0408]
在一些实施方案中,tage剂还包含his-tat-nls(htn)肽,并且该方法包括使t细胞与tage剂(例如人类t细胞)接触。
[0409]
在一些实施方案中,tage剂还包含htn肽,并且该方法包括使巨噬细胞(例如人类巨噬细胞)与tage剂接触。
[0410]
在一些实施方案中,tage剂还包含htn肽,并且该方法包括使hsc(例如人类hsc)与tage剂接触。在一些实施方案中,tage剂包含htn肽,并且该方法包括使受试者骨髓中的细胞与tage剂接触。在一些实施方案中,细胞不是造血干细胞(例如成纤维细胞、巨噬细胞、成骨细胞、破骨细胞或内皮细胞)。
[0411]
在一些实施方案中,tage剂还包含htn肽,并且该方法包括使成纤维细胞(例如人
类成纤维细胞)与tage剂接触。
[0412]
在一些实施方案中,tage剂还包含抗体,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0413]
在一些实施方案中,tage剂包含抗体,并且该方法还包括使巨噬细胞(例如人类巨噬细胞)与tage剂接触。
[0414]
在一些实施方案中,tage剂包含抗体,并且该方法还包括使hsc(例如人类hsc)与tage剂接触。
[0415]
在一些实施方案中,tage剂还包含抗体,并且该方法包括使成纤维细胞(例如人类成纤维细胞)与tage剂接触。
[0416]
在一些实施方案中,tage剂还包含抗fap抗体,并且该方法包括使成纤维细胞(例如人类成纤维细胞)与tage剂接触。
[0417]
在一些实施方案中,tage剂还包含抗ctla-4抗体,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0418]
在一些实施方案中,tage剂还包含抗cd25抗体,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0419]
在一些实施方案中,tage剂还包含抗cd11a抗体,并且该方法包括使t细胞(例如人类t细胞)与tage剂接触。
[0420]
在某些实施方案中,tage剂的定点修饰多肽在靶细胞基因组的靶区域产生切割位点,随后修饰细胞的基因组并影响基因表达。因此,在一个实施方案中,基因组的靶区域是靶基因。在某些实施方案中,定点修饰多肽修饰靶细胞基因组的能力提供了一种修饰靶基因表达的方式。靶核酸(例如基因)的表达水平可以根据标准方法确定,其中在某些情况下,本文公开的方法相对于参考水平有效增加靶基因的表达。另选地,在其他情况下,本文公开的方法能够相对于参考水平降低靶基因的表达。参考水平可以使用非特异性引导rna/定点修饰多肽在标准测定中确定,其中靶核酸例如基因的增加或减少可相对于对照测量。
[0421]
定点修饰多肽的内化可以根据标准内化测定以及下文实施例中所述的那些测定来确定。在一个实施方案中,至少1%、至少2%、至少3%、至少4%、至少5%、至少8%、至少9%、至少10%或至少15%的定点修饰多肽在tage剂与细胞外细胞结合抗原接触给定时间(例如一小时、两小时、三小时或超过三小时)内被细胞内化。例如,在某些实施方案中,与对照试剂(例如未缀合(即没有抗原结合多肽)的定点修饰多肽)相比,定点修饰多肽以更高的效率在tage剂与细胞外细胞结合抗原接触一小时内被靶细胞内化。
[0422]
可以使用本领域已知的任何内化测定来评估tage剂或其组分的内化。例如,可以通过将可检测的标记(例如荧光染料)附接到肽(和/或待转染的货物)或通过将肽与报告分子融合从而使得一旦发生细胞摄取就能够例如通过facs分析或经由特异性抗体进行检测来评估tage剂或其组分的内化。在一些实施方案中,tage剂的一种或多种组分与具有可猝灭信号的报告分子缀合。例如,如实施例5中所述,可以基于在将标记组分与细胞孵育给定时间段后检测alexa-488标记的tage组分(例如,蛋白质组分或核酸引导物),之后比较用抗a488抗体猝灭或未猝灭所获得的结果,来利用基于facs的内化测定。被靶细胞内化的标记分子被抗a488抗体保护免于猝灭,因此在猝灭后相对于对照保留更强的alexa488信号。相比之下,未内化因此保留在细胞表面上的标记分子易于被抗a488抗体猝灭,因此相对于未
猝灭的对照显示出降低的alexa488信号。
[0423]
本文所述的tage剂可以用于将定点修饰多肽靶向可以被给定细胞外细胞膜结合蛋白(例如抗原结合蛋白、配体或cpp)靶向的任何细胞。细胞可以是真核细胞,包括但不限于哺乳动物细胞。可以被本发明的tage剂靶向(并且使其基因组被修饰)的哺乳动物细胞的示例包括但不限于小鼠细胞、非人类灵长类动物细胞或人类细胞。真核细胞可以是(i)体内存在于生物体/组织中、(ii)离体存在于组织或细胞群中或(iii)体外状态存在的细胞。在某些情况下,本文的真核细胞可以以分离状态(例如体外细胞、培养的细胞)或非分离状态(例如在受试者中,例如哺乳动物,诸如人类、非人类灵长类动物或小鼠)存在。在某些实施方案中,真核细胞是哺乳动物细胞,诸如人类细胞。
[0424]
可以根据本领域已知的方法(包括例如表型分析或测序分析)来确定tage剂在靶细胞中编辑靶核酸(例如基因)的能力。此类测定可确定与被tage剂编辑的靶细胞的基因或核酸相关的标记的存在或不存在。例如,如下文实施例中所述,cd47流式细胞术测定可以用于确定用于基因编辑的tage剂的功效。在cd47流式细胞术测定中,靶细胞中的内源性cd47基因序列被tage剂靶向,其中编辑通过靶细胞的细胞表面上缺乏cd47表达来证明。可以以细胞群体测量cd47的水平,并将其与对照tage剂进行比较,其中使用非靶向引导rna作为同一类型的靶细胞中的阴性对照。cd47的水平例如相对于对照降低表明tage剂的基因编辑。在某些情况下,在测试测定中相对于对照降低至少1%、至少2%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%等表明核酸(例如基因)被tage剂编辑。本文还设想了前述百分比的范围。可以确定tage剂的核酸(例如基因)编辑活性的其他方法包括本领域已知的基于序列的测定,例如扩增子测序。
[0425]
在另选的实施方案中,靶细胞中的内源序列被tage剂靶向,其中编辑通过靶细胞的细胞表面上或细胞内(例如,考虑细胞内tdtomato或荧光(例如gfp)等、报告基因)的标记的表达增加来证明。在此类实施方案中,如通过例如流式细胞术检测到标记的水平相对于对照增加表明tage剂的基因编辑。在某些情况下,在测试测定中细胞表面标记相对于对照增加至少1%、至少2%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%等表明核酸(例如基因)被tage剂编辑。在某些情况下,在测试测定中细胞表面标记的表达相对于对照增加至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多等表明核酸(例如基因)被tage剂编辑。例如,荧光标记(例如tdtomato荧光系统)的表达增加可以用于测量被tage剂编辑的增加。本文还设想了前述百分比的范围。可以确定tage剂的核酸(例如基因)编辑活性的其他方法包括本领域已知的基于序列的测定,例如扩增子测序。
[0426]
在一些实施方案中,tage剂靶向靶细胞中编码细胞表面蛋白的内源基因序列(例如cd47),并且编辑通过靶细胞的细胞表面上缺乏细胞表面蛋白表达的靶细胞的百分比来证明。在一些实施方案中,如通过例如流式细胞术检测到相对于对照缺乏细胞表面蛋白表达的靶细胞的百分比表明tage剂的基因编辑。在某些情况下,如通过测试测定检测到靶细胞群体中至少0.05%、至少0.1%、至少0.2%、至少0.3%、至少0.4%、至少0.5%、至少0.6%、至少0.7%、至少0.8%、至少0.9%、至少1%、至少2%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%等的靶细胞中缺乏细胞表面蛋白(例如cd47)表明核酸(例如基因)被tage剂编辑。本文还设想了前述百分比的范围。在一些情况下,在测试测定中相对于对照缺乏细胞表面蛋白(例如cd47)的靶细胞的百分比增加至少2
倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多表明核酸(例如基因)被tage剂编辑。可以确定tage剂的核酸(例如基因)编辑活性的其他方法包括本领域已知的基于序列的测定,例如扩增子测序。
[0427]
在另选的实施方案中,靶细胞中的内源序列被tage剂靶向,其中编辑通过基因编辑的水平相对于对照(例如未编辑的靶细胞)的倍数变化来证明。在一个实施方案中,通过流式细胞术检测到细胞表面标记增加或降低一定倍数将表明相对于对照(例如具有非靶向引导rna的tage剂,或作为阴性对照的缺乏抗原结合多肽的tage剂)的核酸(例如基因)编辑。在某些情况下,细胞表面标记相对于对照的增加倍数在水平上高至少1倍、至少2倍、至少3倍、至少4倍、至少5倍、至少1-5倍、至少1-4倍、至少2-5倍等。在某些情况下,在测试测定中细胞表面标记的表达相对于对照增加至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多等表明核酸(例如基因)被tage剂编辑。在某些情况下,在测试测定中细胞表面标记的表达相对于对照降低至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多等表明核酸(例如基因)被tage剂编辑。这种倍数增加或降低(取决于由tage剂促进的核酸编辑的结果)将表明核酸(例如基因)被tage剂编辑。在某些情况下,在测试测定中细胞表面标记的表达相对于对照增加至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多等表明核酸(例如基因)被tage剂编辑。本文还设想了前述倍数变化的范围。可以确定tage剂的核酸(例如基因)编辑活性的其他方法包括本领域已知的基于序列的测定,例如扩增子测序。
[0428]
对于将蛋白质(例如抗体结合多肽)递送到细胞的方法,可以使用本领域已知的任何方法来产生蛋白质,例如通过共价或非共价键,或在合适的宿主细胞中从编码变体蛋白质的核酸表达。本领域已知许多产生蛋白质的方法。例如,蛋白质可以在酵母、细菌、昆虫细胞系、植物、转基因动物或培养的哺乳动物细胞中产生和纯化;参见例如palomares等人,"production of recombinant proteins:challenges and solutions,"methods mol biol.2004;267:15-52。另外,抗原结合多肽可以连接到促进转移到细胞中的部分,例如脂质纳米颗粒,任选地具有一旦蛋白质在细胞内就被切割的接头。
[0429]
在一些实施方案中,抗原结合多肽可经由内吞过程将位点特异性修饰多肽递送到细胞中。这种过程的示例可包括大胞饮作用、网格蛋白介导的内吞作用、胞膜穴样/脂质筏介导的内吞作用和/或受体介导的内吞作用机制(例如清道夫受体介导的摄取、蛋白聚糖介导的摄取)。
[0430]
一旦位点特异性修饰多肽在细胞内,它就可穿过细胞器膜,诸如核膜或线粒体膜。在某些实施方案中,位点特异性修饰多肽包括至少一个(例如至少1、2、3、4或更多个)核靶向序列(例如nls)。在其他实施方案中,穿过细胞器膜(诸如核膜或线粒体膜)的能力不依赖于核靶向序列的存在。因此,在一些实施方案中,位点特异性修饰多肽不包括nls。
[0431]
在一些实施方案中,将tage剂离体施用给细胞,诸如造血干细胞(hsc)或造血祖干细胞(hspc)。例如,在将本文提供的tage剂(例如抗cd34 tage剂或tage-cpp剂)离体施用给hsc后,可将tage-编辑的hsc移植到需要造血干细胞移植的受试者中。
[0432]
在某些实施方案中,可例如通过局部施用将本文所述的tage剂施用给受试者。在一些实施方案中,可经皮、皮下、静脉内、肌内、眼内、骨内或瘤内将tage剂施用给受试者。
[0433]
可以治疗有效量(例如以达到治疗或预防受试者疾病的基因组编辑水平的量)将tage剂施用给受试者。例如,可将治疗有效量的tage剂施用给患有癌症(例如结肠癌或黑素
瘤)、眼病或干细胞病症的受试者。治疗有效量可取决于递送模式,例如是局部(例如通过真皮内(例如就小鼠而言,经由侧腹或耳朵)、瘤内、骨内、眼内或肌内注射)还是全身施用tage剂。
[0434]
可将本文所述的tage剂配制成与预期的施用途径(诸如通过真皮内、瘤内、骨内、眼内或肌内注射)相容。溶液、悬浮液、分散液或乳液可用于此类施用,并且可包括无菌稀释剂,诸如注射用水、盐水溶液、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或硫酸氢钠;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节张力的试剂,诸如氯化钠或右旋糖。可用酸或碱(诸如盐酸或氢氧化钠)调节ph。可将制剂封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。在某些实施方案中,药物组合物包含tage剂和药学上可接受的载剂。
[0435]
tage剂可以与适于将组合物递送给受试者的医疗装置(诸如通过真皮内、瘤内、骨内、眼内或肌内注射)一起包含在试剂盒、容器、包装或分配器中。包含在试剂盒中的组合物可在任何种类的容器中供应,使得不同组分的寿命可被保持并且不会被容器的材料吸附或改变。例如,密封的玻璃安瓿或小瓶可含有已在中性非反应性气体(诸如氮气)下包装的本文所述的组合物。安瓿可由任何合适的材料组成,诸如玻璃、有机聚合物(诸如聚碳酸酯、聚苯乙烯等)、陶瓷、金属或通常用于容纳试剂的任何其他材料。合适容器的其他示例包括由与安瓿类似的物质制成的瓶子,以及由衬箔内部(诸如铝或合金)构成的包膜。其他容器包括试管、小瓶、烧瓶、瓶子、注射器等。一些容器可具有无菌的可重新密封进入端口,诸如具有可被皮下注射针头反复刺穿的塞子的瓶子。
[0436]
可通过根据治疗目标的途径将tage剂施用给受试者。多种途径可用于将tage剂递送到所需细胞或组织,包括全身或局部递送。
[0437]
在某些实施方案中,可将tage剂施用给患有癌症(诸如结肠癌或黑素瘤)的受试者。在一些实施方案中,癌症是例如黑素瘤、泌尿生殖道癌、非小细胞肺癌、小细胞肺癌、肺癌、白血病、肝癌、视网膜母细胞瘤、星形细胞瘤、胶质母细胞瘤、牙龈癌、舌癌、成神经细胞瘤、头癌、颈癌、乳腺癌、胰腺癌、前列腺癌、肾癌、骨癌、睾丸癌、卵巢癌、间皮瘤、宫颈癌、胃肠癌、淋巴瘤、骨髓瘤、脑癌、结肠癌、肉瘤或膀胱癌。癌症可以是原发性癌症或转移性癌症。在某些实施方案中,可例如以有效编辑肿瘤中的一种或多种细胞类型(例如巨噬细胞、cd4+t细胞、cd8+t细胞或成纤维细胞)的量将tage剂直接注射到受试者的肿瘤中(即通过瘤内注射)。例如,本公开的tage剂可用于通过瘤内施用tage剂来治疗受试者(例如人)的实体瘤。
[0438]
在一些实施方案中,可用针(诸如特纳活组织检查针(turner biopsy needle)或千叶活组织检查针(chiba biopsy needle))将tage剂直接注射到实体瘤中。例如,当治疗肺中的实体瘤时,可使用支气管镜或其他能够对支气管进行插管的装置在胸腔内施用tage剂。可通过使用广泛可用的经支气管抽吸针直接注射经由支气管树可到达的肿块。也可以使用穿透肿瘤组织领域的技术人员已知的任何合适的方法将tage剂植入实体瘤内。此类技术可包括在肿瘤中形成开口并将tage剂定位在肿瘤中。
[0439]
在其他实施方案中,可将tage剂注射到受试者的骨髓中(即骨内注射)。骨内递送可用于编辑受试者的骨髓细胞(例如造血干细胞(hsc))。当骨内递送时,本公开的tage剂可用于治疗受试者(例如人)的干细胞病症,其中骨髓细胞(例如hscs)以提供对干细胞病症进行治疗的方式被修饰。
[0440]
在另外的实施方案中,可以有效编辑视网膜下细胞(例如视网膜色素上皮(rpe)或光感受器)的量将tage剂直接注射到受试者(例如人)的眼室中。例如,本公开的tage剂可用于通过眼内施用tage剂(例如通过视网膜下注射)来治疗受试者(例如人)的眼病。
[0441]
在一个实施方案中,包含抗原结合多肽(例如抗体)的tage剂可经由局部递送施用给人类受试者。局部递送是指递送到身体的特定位置,在该位置处,tage剂将在其被递送到的区域内起作用,而不是全身起作用。包括抗原结合多肽的tage剂的局部递送的示例包括局部施用、眼部递送、关节内递送、心脏内递送、真皮内递送、皮内递送、骨内递送、鞘内递送或吸入。
[0442]
在一个实施方案中,包含抗原结合多肽(例如抗体或其抗原结合片段)的tage剂经由全身施用施用给人类受试者。含有抗原结合多肽(例如抗体或其抗原结合片段)的tage剂的全身递送的示例包括静脉内注射或腹膜内注射。
[0443]
实施例
[0444]
通过参考以下实施例将更充分地理解本发明。然而,它们不应被解释为限制本发明的范围。所有文献和专利引用通过引入并入本文。
[0445]
如整个实施例中所用,除非另有说明,否则构建体(例如cas9-2xnls)名称中的符号
“‑”
是指遗传融合体。构建体(例如cas9-蛋白质a:抗体;抗体-spytag=spycatcher-cas9)名称中的符号“=”或“:”是指通过两个缀合部分(例如蛋白质a和抗体的fc区、spycatcher和spytag;或halo和halo-tag)之间的相互作用介导的缀合。
[0446]
实施例1.cas9-2xnls-蛋白质a的设计和产生
[0447]
包括2x核定位信号和蛋白质a的cas9融合体(cas9(c80a)-2xnls-蛋白质a,除非另有说明,否则在下文中也称为“cas9-2xnls-蛋白质a”或“cas9-pa”;seq id no:3;图2a)是根据以下步骤从大肠杆菌构建和纯化的。
[0448]
将含有表达cas9-2xnls-蛋白质a的载体的大肠杆菌在选择性tb培养基中在37℃以》200rpm振荡培养。在od600为0.6-0.8时,用1mm iptg在16℃下诱导cas9-2xnls-蛋白质a的表达过夜或在37℃下诱导3小时。随后通过在4℃下以4000xg离心20分钟收获培养物。将每升细胞用20ml冷裂解缓冲液(50mm tris ph 8,500mm nacl,10mm咪唑,1x蛋白酶抑制剂,0.025%tx-100)重悬并通过超声裂解细胞。碎片在4℃下以15000xg沉淀40分钟。
[0449]
将裂解物施加到5ml ninta fastflow预填充柱。用至少5倍体积的ninta洗涤缓冲液(50mm tris ph 8,500mm nacl,10mm咪唑)洗涤柱。然后用至少5体积的tx-100缓冲液(50mm tris ph 8,500mm nacl,10mm咪唑,0.025%tx-100)洗涤柱。随后用ninta洗涤缓冲液洗涤柱,直至完成。通过bradford试剂监测洗涤。在ninta洗脱缓冲液(50mm tris ph 8,500mm nacl,300mm咪唑)中洗脱样品,并通过bradford试剂监测。通常,用4柱体积的ninta洗脱缓冲液洗脱所有蛋白质。
[0450]
测量洗脱液中的蛋白质浓度,并以1:90w/w蛋白酶:洗脱液添加hrv 3c蛋白酶。将洗脱液转移到透析盒,并在4℃下在1l透析缓冲液(50mm tris ph 8,300mm nacl)中透析过夜。将透析液施加到在过夜透析缓冲液中平衡的5ml ninta柱,并收集流过物。再次重复该步骤。用约5ml过夜透析缓冲液洗涤柱,以确保收集所有流过物蛋白质。然后用1:1v/v无盐缓冲液(20mm hepes ph 7.5,10%甘油)稀释样品,以使盐浓度降至约150mm,并以4000rpm离心10分钟以沉淀任何沉淀的蛋白质。
[0451]
将可溶性蛋白质施加到在离子交换(iex)缓冲液a (20mm hepes ph 7.5,15 0mm kcl,10%甘油)中平衡的hitrap sp柱,并以5ml/min的速率从iex缓冲液a到b(20mm hepes ph 7.5,1.5m kcl,10%甘油)以20cv的线性梯度洗脱(akta pure)。在0.5m naoh中洗涤sp柱,以确保没有来自其他纯化的内毒素残留。
[0452]
以约33ms/cm处的峰或约22%iex缓冲液b从sp柱上洗脱出cas9-2xnls-蛋白质a。汇集级分并用30kda旋转浓缩器浓缩至约0.5ml。
[0453]
在尺寸排阻缓冲液(20mm hepes ph 7.5,200mm kcl,10%甘油)中平衡的s200 increase 10/300柱上分离蛋白质。在0.5m naoh中洗涤s200柱,以确保没有来自其他纯化的内毒素残留。以约12ml的峰洗脱出cas9-蛋白质a。将蛋白质浓缩并储存在-80℃。
[0454]
纯化后,将样品与选择性内毒素去除树脂一起孵育,直到内毒素水平适当低(例如通常为0.1eu/剂)。
[0455]
以大约1mg/l的终浓度纯化cas9-2xnls-蛋白质a融合体。
[0456]
实施例2.由cas9-2xnls-蛋白质a进行的体外dna切割
[0457]
通过体外dna切割测定评估单独的cas9-2xnls-蛋白质a(cas9-pa)或与抗cd3抗体结合的cas9-2xnls-蛋白质a(“cas9-pa-α-cd3”)的dna切割。
[0458]
通过合并1ul 5x缓冲液(100mm hepes ph 7.5,1m kcl,25%甘油,25mm mgcl2)、2.5ul 1um cas9、0.6ul 5um重折叠引导rna(grna;0.6nm终浓度)和0.9ul水来复溶500nm cas9-pa:α-cd3。将复溶的cas9 rnp在37℃下孵育10分钟,以使cas9 grna结合。为了评估dna切割,将100nm每种cas9 rnp与100nm dsdna靶在37℃下孵育30分钟。作为对照评估cas9(c80a)-2xnls(“c80a”)。
[0459]
将1ul 20mg/ml蛋白酶k添加到反应并在50℃下孵育15分钟。将猝灭反应保持在4℃,然后在片段分析仪毛细管电泳(ce)仪器上进行分离。根据制造商的建议,用22ul te缓冲液稀释2ul反应物并通过毛细管电泳分析。切割反应一式三份运行,并从条带强度中减去背景。用以下等式量化切割百分比:切割%=(切割产物的总摩尔数)/(底物的总摩尔数)。结果表示为相对于cas9(c80a)内部对照的切割%。
[0460]
如图2所示,cas9-pa:α-cd3实现了与cas9(c80a)-2xnls相似水平的dna切割。
[0461]
实施例3.核酸转染后cas9-2xnls-蛋白质a的离体dna编辑
[0462]
为了评估cas9-2xnls-蛋白质a(“cas9-pa”)离体编辑dna的能力,通过核转染将25pm cas9-2xnls-蛋白质a或cas9(c80a)-2xnls(“c80a”)引入刺激的人t细胞中。
[0463]
为了分离刺激的人t细胞,首先从血沉棕黄层分离pbmc(来自stemcell的sepmate分离方案)。然后将t细胞从pbmc中分离(来自stemcell的easysep分离方案)到t细胞培养基(x-vivo-15培养基,5%fbs,50um 2-巯基乙醇,10um n-乙酰基l-半胱氨酸和1%青霉素-链霉素)中。为了刺激t细胞,将t细胞以t细胞培养基中1x106个细胞/ml的浓度转移到烧瓶,并向t细胞中添加刺激试剂(200uml-1
il-2、5ng ml-1
il-7、5ng ml-1
il-15和每毫升25ul immunocult可溶性cd3/cd28)。刺激72小时后,制备t细胞用于核转染。
[0464]
接着,通过将50um cas9-2xnls-蛋白质a与25um靶向cd47基因的重折叠单引导rna(cd47sg2)在cas9缓冲液中在37℃下孵育10分钟,使cas9-2xnls-蛋白质a与引导rna复合,以制备cas9-2xnls-蛋白质a:grna rnp。
[0465]
为了评估cas9-2xnls-蛋白质a(cas9-pa)rnp离体编辑dna的能力,通过核转染将
25pm cas9-2xnls-蛋白质a rnp或cas9(c80a)rnp引入刺激的人t细胞中。在核转染后,使用测量表面cd47损失(使用流式细胞术)的表型读数来评估cd47下调。最后,从细胞中分离dna并通过扩增子测序进行分析。如图3所示,cas9-2xnls-蛋白质a rnp在刺激的人类t细胞中显示出离体编辑。
[0466]
实施例4.评估cas9-pa:抗体剂的形成的体外结合测定
[0467]
为了评估cas9-2xnls-蛋白质a(“cas9-pa”)与抗体复合的能力,将cas9-蛋白质a(pa)与抗cd3抗体以2:1的抗体:cas9比率混合。通过尺寸排阻色谱法在s200尺寸排阻柱上分析单独的cas9pa、单独的抗cd3抗体或cas9-pa和抗cd3抗体的混合物。
[0468]
如图4所示,cas9-pa可以结合抗cd3抗体,从而形成cas9pa:抗体剂。
[0469]
实施例5.抗体和cas9-pa:抗体内化测定
[0470]
通过基于facs的内化测定评估抗体和tage剂内化。
[0471]
基于facs的内化测定
[0472]
基于facs的内化测定基于在将标记的分子与细胞孵育给定时间段后检测alexa-488标记的分子(例如蛋白质或rna引导物),并比较用抗a488抗体猝灭或未猝灭所获得的结果。被细胞内化的标记分子被抗a488抗体保护免于猝灭,因此在猝灭后相对于对照保留更强的alexa488信号。相比之下,未内化并因此保留在细胞表面上的标记分子易于被抗a488抗体猝灭,并因此相对于未猝灭的对照显示出降低的alexa488信号。
[0473]
使用由thermofisher销售的nhs酯-alexa488(商品号a37563)与蛋白质上的可到达赖氨酸缀合来制备本文所述的alexa-488标记的蛋白质(例如cas9或抗体)。为了制备alexa-488标记的蛋白质,在室温下将16000pmol nhs酯-alexa488与1000pmol蛋白质在补充有10%碳酸氢钠ph8.5的尺寸排阻缓冲液(20mm hepes ph 7.5,200mm kcl和10%甘油)中孵育1小时。用10mm tris ph 8猝灭过量的未缀合的nhs酯,并使用hitrap脱盐柱除去过量的染料。
[0474]
通过从idt购买带有5'标记的alexa488的定制tracrrna来制备alexa-488标记的引导rna。使tracrrna与crisprrna复合。首先,通过合并1x重折叠缓冲液、25um crisprrna和25um alexa-488-tracrrna来制备重折叠引导rna。将重折叠反应物加热至70℃保持5分钟,然后平衡至室温。随后,将20mm mgcl2添加到反应中,并在50℃下加热5分钟,然后平衡至室温。然后将标记的引导rna与cas9复合(1.3:1cr/trrna:cas9比率)。
[0475]
一旦标记的分子制备好,就用目的分子绘制滴定曲线,以找到在不相关细胞上实现良好染色而无背景的最佳量。然后根据以下方法制备细胞。收集细胞并重悬,使得它们为500,000-100万个细胞/100ul(500万-1000万个/ml)。将fc阻断物添加到细胞中(小鼠为1:100,人为5ul/样品)并在冰上孵育15分钟。将100ul细胞添加到每个孔中,以300xg离心3分钟,并将细胞重悬于80ul 10%rpmi中。如果需要,刺激细胞以引起表面标记的上调。然后根据以下洗掉方法或下一部分中的连续标记方法将细胞暴露于标记的分子。
[0476]“洗掉”方法包括首先将所有样品与488-标记的分子在4℃下孵育,以允许表面结合。然后在将细胞移至37℃之前洗掉分子。这样,只有最初结合到表面的分子被内化。对于洗掉方法,将20ul a488分子添加到80ul rpmi/fbs中的细胞中,并在冰上孵育30分钟。然后,在孔的顶部添加100ul pbs,并将细胞以300xg旋转3分钟。将细胞重悬于100ul rpmi+10%fbs中。将4℃样品和对照保持在冰上,同时将37℃样品移至单独的板并孵育设定的时
间量(例如15分钟、60分钟或更长(例如3小时))。在完成第一时间点(即15分钟)后,将板或细胞取出并保持在冰上。
[0477]
相比之下,连续方法包括将细胞移至37℃(或保持在4℃),并从开始就添加488标记的分子。这允许在整个37℃孵育期间持续摄取分子。将4℃样品保持在冰上,同时将37℃样品在37℃下孵育。然后在适当的时间将a488标记的分子添加到样品中,从最长的时间点样品开始(即首先将488标记的分子添加到3小时样品中;2小时后(剩余1小时),将488分子添加到60分钟样品中,然后2.75小时后(剩余0.25小时),将488分子添加15分钟样品中。在最后的时间点后,将所有样品移回到冰中。在以下实验中使用连续方法。
[0478]
最后,用抗a488抗体猝灭样品,并将其染色用于facs分析。在离心之前,将每个样品分成两半,每个时间点提供两个50ul样品。将板以300xg离心3分钟。然后,将50ul macs缓冲液(pbs,2%fbs,2mm edta)添加到所有未猝灭的孔中。接着,将50ul抗a488猝灭主混合物添加到所有猝灭的孔中。最后,将50ul facs混合物添加到所有样品中。然后将样品在冰上孵育30分钟。然后将100ul macs缓冲液添加到每个孔中,之后将细胞在4℃下以300xg离心3分钟。将细胞重悬于170ul macs缓冲液和10ul 7aad中。孵育5分钟后,在attune nxt流式细胞仪上运行样品。另选地,可以通过以下方式在分析之前固定细胞:将细胞重悬于100ul 4%pfa的pbs溶液中,在室温下孵育10分钟,在顶部添加100ul pbs,离心,并将细胞重悬于180ul pbs中。此后,可以在第二天分析细胞。
[0479]
抗体内化
[0480]
为了鉴定可在cas9-2xnls-蛋白质a(“cas9-pa”):抗体剂中起作用的候选抗体,首先在没有cas9-pa的情况下评估抗体的内化能力。在小鼠和人细胞群体(例如b细胞、骨髓细胞、t细胞、活化的t细胞、上皮细胞)中评估具有不同靶标(即cd22、cd33、cd3、cxcr4、cd25、cd54、cd44和egfr)的多种抗体的内化。如表2所示,抗cd22、抗cd33、抗cd3、抗cxcr4、抗cd54和抗cd44抗体被鉴定为被多种人小鼠免疫细胞内化。
[0481]
表2.抗体内化
[0482]
抗体靶标靶向群体是否内化?cd22b细胞是cd33骨髓细胞是cd3t细胞是,缓慢(7-24小时)cxcr4前体、t细胞、骨髓是cd25活化t细胞未测试cd54(icam1)许多细胞是cd44许多细胞是
[0483]
具体地,通过将每种抗体添加到pbmc来评估抗cd3(18nm)或抗cd22(100nm)抗体的内化速率。在指定温度下指定时间后,用抗a488抗体猝灭外部a488信号。通过facs鉴定特定细胞群体。如图5a和5b所示,识别cd3和cd22的抗体以不同的速率内化。
[0484]
tage剂内化
[0485]
接着,在基于facs的内化测定中评估与cas9-2xnls-蛋白质a(cas9-pa)复合的候选抗体的内化。用cas9-pa上或抗体上的a488标记评估与人igg1或抗cd22抗体复合的cas9-pa。评估单独的抗cd22抗体作为对照。
[0486]
首先,通过将10nm每种蛋白质添加到pbmc并在冰上染色30分钟来评估细胞结合。如图6a所示,cas9-pa与抗cd22复合增加了对b细胞的结合,但不增加对t细胞的结合。
[0487]
接着,在将10nm每种蛋白质添加到pbmc并猝灭后,对细胞进行针对cd45、cd3和cd19的染色。如图6b所示,cas9-pa在与抗cd22复合时可以被内化,而cas9-pa不被内化。如图6c所示,cas9-pa:抗cd22仅结合b细胞并在b细胞上被内化,而不结合同一细胞池中的t细胞并不在t细胞上被内化。因此,cas9-pa:抗体剂在被递送到大量pbmc时显示出被b细胞有效内化。
[0488]
实施例6.抗体和cas9-pa:抗体内化测定
[0489]
为了评估不同猝灭方法在实施例5中描述的基于facs的内化测定中的功效,通过基于facs的内化测定评估抗体(抗cd3抗体)、cas9-2xnls-蛋白质a(“cas9-pa”)rnp或tage剂(cas9-pa:抗cd3抗体rnp)(“cas9pa:cd3”)内化,其中通过肝素洗液(2000u/ml)、酸洗涤(ph 3.5)或抗a488抗体猝灭报告信号(a488或atto550)。对于每种rnp,使报告信号(a488或atto500)与引导rna缀合。通过基于facs的活/死测定进一步评估每种猝灭方法对cd45+细胞的毒性,其中通过facs确定fvde506+细胞(死细胞)的水平(图7d)。如图7d所示,酸猝灭和肝素猝灭具有比常规猝灭更大的毒性。
[0490]
在t细胞(图7a和7b)或骨髓细胞(图7c)中评估cas9-pa、抗cd3抗体或与抗cd3抗体复合的cas9-pa的内化。如图7a和7b所示,酸洗液在内化测定中与抗a488抗体一样有效地猝灭。对于骨髓群体,酸洗液对于cas9-pa染色比抗a488抗体更有效地猝灭(图7c)。
[0491]
实施例7.由cas9-2xnls-蛋白质a进行的体外dna切割
[0492]
如实施例2所述,通过体外dna切割测定评估由tage剂cas9-darpin(ec1)进行的dna切割。如图8所示,cas9-2xnls-darpin(ec1)实现了与cas9(c80a)-2xnls相似水平的dna切割。
[0493]
实施例8.核转染后cas9-darpin(ec1)的离体dna编辑
[0494]
为了评估tage剂cas9-2xnls-darpin(ec1)(“cas9-darpin(ec1)”)离体编辑dna的能力,用25pm cas9-darpin(ec1)rnp或cas9(c80a)rnp核转染刺激的人t细胞(参见实施例3)。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白核转染到t细胞中以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。在核转染后,使用测量表面cd47损失(使用流式细胞术)的表型读数来评估cd47下调。最后,从细胞中分离dna并通过扩增子测序进行分析。如图9所示,cas9-darpin(ec1)rnp在刺激的人类t细胞中显示出离体编辑。
[0495]
实施例9.cas9-darpin(epcam)在epcam+细胞上的结合
[0496]
为了评估tage剂cas9-2xnls-darpin(epcam)(“cas9-darpin(epcam)”)结合epcam+细胞的能力,将10、25、50、100或300nm的在pbs中的cas9-darpin(epcam)rnp或cas9(c80a)2xnls对照与两种不同的人上皮乳腺癌细胞系skbr-3和bt474一起孵育。如图10c所示,skbr-3和bt474细胞表达epcam,如通过epcam抗体染色检测到。将指定rnp与用a488标记的hbb cr/tr引导物复合,并与skbr-3或bt474细胞系在冰上孵育30分钟。然后洗涤细胞并通过facs分析。
[0497]
如图10a和10b所示,靶向epcam的cas9-darpin结合epcam+细胞。特别是当将细胞与高浓度的cas9-darpin(epcam)孵育时,检测到结合,如图10d所示。
[0498]
实施例10.cas9-darpin(epcam)的内化
[0499]
使用基于facs的内化测定评估tage剂cas9-2xnls-darpin(epcam)(“cas9-darpin(epcam)”)在epcam+bt-474细胞或skbr3细胞中的内化,其方案在实施例5中进一步描述。将100nm或300nm cas9-darpin(epcam)与bt474细胞或skbr3细胞在37℃或4℃下一起孵育指定时间(60分钟或30分钟),然后猝灭。
[0500]
如图11所示,cas9-darpin(epcam)在bt474细胞中被内化。
[0501]
实施例11.共孵育或核转染后由cas9-darpin(epcam)进行的离体编辑
[0502]
通过将在bt474细胞中共孵育所实现的编辑水平与在skbr3细胞中所实现的编辑水平进行比较的离体编辑测定来评估tage剂cas9-2xnls-darpin(epcam)(“cas9-darpin(epcam)”)。
[0503]
通过共孵育离体编辑粘附细胞—当细胞在悬浮液中时编辑
[0504]
通过合并cas9-darpin(epcam)和靶向cd47的hucd47g2引导rna来制备rnp复合物。通过简单的胰蛋白酶化剥离在组织培养板上生长的细胞。通过添加至少5倍过量的完全细胞培养基来猝灭胰蛋白酶化。然后对细胞进行计数并用细胞培养基洗涤。细胞培养基含有0-10%胎牛血清,适合于所需的编辑条件。然后通过离心沉淀细胞,并将其以高密度重悬于细胞培养基中。将浓缩的细胞(约500,000个细胞)与3.75um rnp在eppendorf管中混合。然后将细胞置于37℃孵育箱中1小时。1小时后,将具有rnp的细胞转移到预先加载有完全细胞培养基的组织培养板。
[0505]
第二天,当细胞达到80-100%汇合度时分裂细胞(最佳细胞密度取决于使用的细胞类型)。共孵育后第4天和第7天,收获细胞以使用流式细胞术测量基因编辑的程度。
[0506]
结果
[0507]
如图12所示,cas9-darpin(epcam)在bt474细胞中共孵育后表现出大约1.34%的编辑,并在skbr3细胞中共孵育后表现出约0.7%的编辑。示出了在无rnp条件下获得的结果用于比较。作为对照,在人t细胞中证实了通过核转染引入的cas9-darpin(epcam)的编辑(图13)。
[0508]
实施例12.cas9-halo:抗体缀合物的产生
[0509]
根据用于产生cas9-2xnls-蛋白质a的类似方案构建包括与halo标签连接的cas9(cas9-2xnls-halo)(“cas9-halo”)的tage剂并从大肠杆菌中纯化,如实施例1所概述。可以使用与halo配体连接的琥珀酰亚胺酯(promega p6751)将cas9-halo与任何同种型的抗体(或任何其他蛋白质)缀合。在该实施例中,将抗cd22抗体与cas9-halo复合。
[0510]
首先,经由至抗体上赖氨酸的胺反应性基团将抗cd22抗体与卤代琥珀酰亚胺酯连接,如下。将100mm碳酸氢钠ph8.5添加到抗体。然后,将8mol过量的nhs酯-halo配体添加到抗体。用10mm tris ph7.5猝灭缀合。相对于抗体增加或减少摩尔过量的卤代配体可以用于改变cas9:抗体缀合比率。接着,在脱盐柱上运行抗体缀合反应,并将抗体浓缩至》50um。
[0511]
为了将与halo配体连接的抗cd22抗体与cas9-halo缀合,将抗体和cas9-halo以1:1.5的摩尔比合并,并在室温下孵育1小时。使用sec缓冲液(20mm hepes(ph 7.5)、200mm kcl和10%甘油)中的s200 10/300increase分级柱将抗体-cas9缀合物与未缀合物质分离(图14a)。8.5-11ml之间的峰含有缀合物质。sds-page用于鉴定cas9-抗体缀合的比率(图14b)。
[0512]
实施例13.cas9-halo:抗cd22抗体的内化
[0513]
使用基于facs的内化测定(使用洗掉方法)评估包括cas9-2xnls-halo(“cas9-halo”):抗cd22抗体的tage剂在来自健康脾或b16肿瘤的小鼠b细胞中的内化,其方案在实施例5中进一步描述。将20nm带有a488引导rna的指定rnp(cas9-halo:抗cd22抗体、cas9-halo:igg1或cas9-halo)与总脾细胞或肿瘤浸润性淋巴细胞在37℃或4℃下孵育指定时间(15分钟或60分钟)。通过对cd19+b细胞进行门控的facs分析评估来自具有和不具有猝灭的每种条件的样品。
[0514]
如图15a和15b所示,将cas9-halo:抗cd22内化到来自健康脾和b16肿瘤的小鼠b细胞中。
[0515]
实施例14.由cas9-halo:抗cd22抗体进行的体外dna切割和离体编辑
[0516]
在体外dna切割中评估包括cas9-2xnls-halo(“cas9-halo”)的tage剂,并且评估离体核转染编辑活性,分别如实施例2和3所概述。具体地,通过与dsdna孵育来评估cas9-halo(20181209)、cas9-halo:抗mctla4、cas9-halo:igg1、cas9-halo:抗cd22、halo-30aa-cas9、halo-3aa-cas9的体外活性。每个构建体在体外显示出dna切割活性(图16a)。
[0517]
接着,通过核转染将25pm每种rnp引入刺激的人t细胞。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白核转染到t细胞中以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。图16b示出了halo复合抗体与cas9(c80a)-2xnls相比的相对编辑效率。
[0518]
实施例15.混合细胞群体中的cas9-halo:抗体rnp差异内化
[0519]
在混合细胞群体中评估包括与抗体复合的cas9-2xnls-halo(“cas9-halo”)(“cas9-halo:抗体”)的tage剂的内化,tage剂rnp内化。将从汇集的b16f10肿瘤分离的活细胞与与不同抗体(抗ctla4抗体、抗cd22抗体、igg1、mhcii-nb)复合的cas9-halo tage剂rnp混合。还评估了单独的cas9(c80a)rnp和cas9-halo rnp作为对照。将具有a488标记的引导rna的每种rnp与肿瘤细胞在4℃和37℃下孵育1小时,之后在猝灭或不猝灭的情况下通过facs分析评估样品。在门控dc细胞、非dc骨髓细胞、b细胞、t细胞、非t/b细胞或cd45-pdpn+细胞中评估每种rnp的内化。
[0520]
如图17所示,cas9-halo:抗体rnp在dc细胞、非dc骨髓细胞、b细胞、t细胞、非t/b细胞和cd45-pdpn+细胞中显示出差异内化模式。
[0521]
实施例16.具有蛋白质a缀合的抗体tage剂—内化和编辑测定
[0522]
在不同细胞类型中测试含有与五种不同抗体(抗cd33抗体、抗egfr抗体、抗cd25抗体、抗fap抗体或抗ctla-4抗体)中的一种连接的cas9-2xnls-蛋白质a(“cas9-pa”)的tage剂的内化和编辑。
[0523]
首先,进行基于facs的内化测定以评估包括抗cd33抗体、抗egfr抗体或抗fap抗体的cas9-pa:抗体复合物的细胞内化(数据未示出;还可参见实施例4)。含有与抗cd33抗体复合的cas9-pa的tage剂与cas9pa:huigg1相比增加了cas9-pa在us937细胞中的内化,但未增加至单独的抗体的内化水平。与抗egfr抗体复合的cas9-pa与pa:huigg1相比介导了a431上皮细胞中的结合和内化。类似地,在人成纤维细胞中,cas9-pa:fap比pa:huigg1(同种型对照)结合更多,并且可以驱动cas9-pa在人成纤维细胞上内化。
[0524]
cas9-pa编辑(没有抗体)始终显示出比单独的cas9(c80a)更少的编辑(数据未示
出)。此外,当将cas9-pa与所测试的五种不同细胞类型和抗体中的抗体缀合时,没有观察到可检测的编辑(表3)。表3的结果表明,尽管cas9-pa构建体具有在细胞内结合和内化的能力,但无论tage剂靶向的抗原如何,该构建体相对于对照具有降低的编辑。因此,评估了除蛋白a以外的另选缀合部分,如实施例17-21所述。
[0525]
表3.
[0526][0527]
实施例17.具有halo缀合的抗体tage剂—结合和离体编辑测定
[0528]
在一些抗体/细胞类型对中,抗体经由halo/halo标签与cas9缀合似乎影响cas9 tage剂情况下的抗体结合,如以下实施例所示。
[0529]
将本实施例中描述的抗体连接至halo tag(ht)用于与cas9-halo缀合,以形成cas9-halo:ht抗体缀合物(另选地被称为cas9-halo:抗体缀合物)。
[0530]
用小鼠抗cd22抗体进行的初始试验证明,包括与抗cd22抗体缀合的cas9-halo的tage剂与单独的抗cd22抗体相比具有等同的b细胞结合(图18a)。随后用与cas9-halo缀合的抗fap抗体进行的成纤维细胞结合测定或者用与cas9-halo缀合的抗小鼠ctla-4抗体进行的t细胞结合测定(测试3个不同克隆)显示,cas9-halo:抗体缀合物与单独的抗体相比具有较少细胞结合,但比阴性对照具有增加的结合(图18b和18c)。进一步的测试表明,halo tag从cas9的n-末端到c-末端的位置不影响结合,halo tag的数量也不影响结合。
[0531]
包括cas9-halo的tage剂也显示出可变的编辑,取决于cas9-halo被内化到其中的细胞类型。离体编辑测定证明,与抗fap抗体缀合的cas9-halo(cd47引导rna;使用测量表面cd47损失(使用流式细胞术)的表型读数来评估编辑)能够经由以与cas9(c80a)-2xnls(用作阳性对照的基于cpp的tage剂)相似的水平共孵育来编辑人成纤维细胞(图18d)。然而,与cas9(c80a)-2xnls相比,包括与抗ctla-4抗体缀合的halo-cas9并与小鼠t细胞共孵育的tage剂显示出较低的编辑水平(如通过tdtomato荧光报告系统所测量)(在cas9(c80a)-2xnls中观察到约20%的编辑;图18e和18f)。
[0532]
上述实施例的结果证明使用靶向这些细胞的tage剂(即抗fap tage剂)对成纤维细胞进行了结合和编辑,并且表明t细胞中的此类编辑结果可能取决于靶标或抗体。
[0533]
实施例18.抗fap抗体tage剂内化和离体编辑测定
[0534]
在本实施例中评估了包括与cas9缀合的人抗成纤维细胞活化蛋白(fap)抗体的tage剂的内化和离体编辑。
[0535]
使用用于在哺乳动物细胞中表达抗体的标准方法来表达与spytag(st)连接的抗fap抗体和与spycatcher(sc)部分连接的cas9(参见vazquez-lombardi等人,(2018).nature protocols,13(1),99)。将spytag与抗体轻链的c-末端遗传融合,同时将spycatcher与cas9-2xnls的n-末端遗传融合以形成spycatcher-cas9(wt)-2xnls。将抗fap-spytag与spycatcher-cas9缀合以形成抗fap抗体/cas9缀合物(“fap=sc-cas9”)。复合物的一部分包括一个spycatcher-cas9/抗体(fap-spytag=spycatcher-cas9),而复合物的另一部分包括两个spycatcher-cas9部分/抗体(fap-spytag=(spycatcher-cas9)2)。单个抗体上具有两个cas9分子的复合物是由于每个抗体存在两个轻链和两个spytag而形成的。
[0536]
为了评估缀合物的结合,将粘附的人真皮成纤维细胞与270nm蛋白质在4℃或37℃下孵育1小时,然后通过facs分析。a488信号来自标记的抗体或a488标记的引导物(其中存在cas9)。fap=sc-cas9与单独的抗fap抗体相当地结合。此外,使用本文所述的基于facs的内化测定在多种细胞类型中评价fap=sc-cas9缀合物的内化。fap抗体和sc-cas9缀合物在人成纤维细胞中快速内化。
[0537]
随后,评估抗fap抗体对成纤维细胞的离体编辑。将靶向cd47的引导rna与相应的tage剂缔合以形成核糖核蛋白,并将核糖核蛋白与成纤维细胞共孵育以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。将编辑与具有和不具有spycatcher(sc)的cas9(c80a)-2xnls进行比较。此外,评估了用长接头(ll)或短接头(sl)连接至spy标签(st)的抗fap抗体。将人真皮成纤维细胞与3750nm指定分子孵育1小时,然后在375nm rnp中再保持5天。通过cd47表面蛋白的损失检测编辑的细胞。将编辑值确定为每组技术重复三次的平均值。
[0538]
如图19a所示,与sc-cas9(裸对照)相比,fap-st抗体与sc-cas9的缀合显示出更高水平的编辑。为了排除未缀合抗体的影响,在编辑cas9(c80a)-2xnls(c80a +fap)期间反式添加抗fap-st抗体。尽管与每个抗体具有单个cas9部分的缀合物类似地结合和内化,但只有2:1cas9:ab缀合物(每1个ab 2个cas9)的编辑效果比对照更好。具体地,fap=(4xnls-sc-cas9-2xnls)2在高浓度下显示出比单独的4xnls-sc-cas9-2xnls增强的编辑(图19b和19c)。此外,2:1cas9:ab缀合物的编辑效果比抗fap抗体与未缀合cas9反式递送的条件更好。
[0539]
评估用抗ctla4抗体(伊匹木单抗,ipi=(sc-cas9)2)编辑成纤维细胞作为fap=(sc-cas9)2的阴性(同种型)对照,因为成纤维细胞不表达ctla-4。此外,多种抗体=sc-cas9缀合物类似地结合成纤维细胞(图19e)。所有构建体都在人真皮成纤维细胞(供体8194)上以50nm的浓度进行测试。抗ctla4对照构建体与fap=cas9缀合物类似地编辑并且与成纤维细胞结合,表明存在能够在成纤维细胞中摄取和编辑的另外机制。例如,虽然sc-cas9和cas9(c80a)没有表现出实质性的细胞结合,但包括各种非特异性(对成纤维细胞)抗体(例如伊匹木单抗、帕利珠单抗或具有连接在一起的两个cas9的抗体的fc部分)的cas9缀合物表现出与成纤维细胞结合(图19e)。过量的fap阻断了抗fap抗体=sc-cas9缀合物与成纤维细胞的结合,表明抗fap抗体=sc-cas9 tage剂对在成纤维细胞的细胞表面上表达的fap具有特异性(图19e)。
[0540]
接着,用过量的fc=sc-cas9(与sc-cas9缀合的抗体fc结构域)进行竞争测定,以
确定包括抗fap抗体和sc-cas9的tage剂的结合是否由抗fap抗体的fc区介导。添加fc阻断了抗fap抗体=(sc-cas9)2tage剂以及伊匹木单抗和帕利珠单抗与成纤维细胞的结合。这表明抗fap抗体=(sc-cas9)2缀合物与成纤维细胞的结合可由抗fap抗体的fc结构域或由cas9本身介导。然而,如图19f所示,存在不能被fc=sc-cas9阻断的残余抗fap抗体=(sc-cas9)2结合,这与fap介导的结合一致(参见图19f中的方框)。
[0541]
实施例19.人t细胞中的抗体tage剂筛选
[0542]
本研究的目的是鉴定用于工程化t细胞靶向tage剂的抗体。在该筛选中,收集针对经临床验证的人t细胞上的靶标的抗体。产生在人igg1主链上具有spytag的抗体,使得它们可以与spycatcher(sc)-cas9缀合,并验证它们的结合和编辑。
[0543]
抗体筛选
[0544]
对于该筛选测定,在expi293细胞中克隆并表达带spytag的人t细胞结合抗体。使expi293细胞培养物在24孔板格式中在4ml培养基中生长。在第0天,用0.5ug/细胞ml的表达抗体重链的载体和0.5ug/细胞ml的表达抗体轻链的载体转染3x106/ml和至少95%存活率的细胞。在第4天或当存活率降至85%以下时收获细胞,以先到者为准。将细胞以3000xg沉淀10分钟,将上清液用pbs按1:1体积:体积稀释,并用0.44um过滤器过滤。如果当天不使用,将上清液在4℃保持过夜。
[0545]
为了纯化抗体,在25ml如上所述制备的expi293细胞中表达每种抗体。然后将来自抗体表达细胞的细胞裂解物施加到5ml mabselect sure 5ml hitrap柱上并用pbs洗涤。用50mm柠檬酸盐缓冲液洗脱抗体,并汇集峰级分。将汇集的洗脱液的ph用1m hepes ph8调节至ph 7.5。使用30kd浓缩器浓缩最终的抗体溶液。
[0546]
为了产生f(ab')2片段,将genovis fragit midi-spin树脂在消化缓冲液(150mm nacl和10mm na3po4,ph7.5)中平衡。以最终f(ab')2所需量的两倍添加抗体以考虑任何损失,并在室温下振荡消化2小时。通过sds-page分析证实消化。
[0547]
将纯化的带spytag的抗体(ab-st)与cas9(wt)-2xnls-spycatcher-htn(“ac28”)(另选地被称为“sc-cas9”)在expi293培养基中混合,以形成ab-st=sc-cas9缀合物。用spytag(5x spytag溶液,在室温下1-2小时)
‘
猝灭’未缀合的过量cas9,以实现阻断而不会使过量的cas9产生噪声。通过用高达10%的expi293培养养基处理pbmc进行pbmc实验。因此,在expi293培养基中缀合ab-st=sc-cas9避免了完全缀合物纯化的需要。
[0548]
对于该测定,鉴定了与人t细胞上的受体结合的45种抗体,并选择其用于克隆。表达31种带spytag的抗体用于进一步测试。
[0549]
抗体的t细胞结合
[0550]
测试31种带spytag的t细胞结合抗体与人t细胞的结合。评估帕利珠单抗(“pali”)和具有未染色细胞的无rnp条件作为阴性对照。将活化零天、两天或七天的总pbmc用70nm的抗指定靶标的抗体在4℃下染色1小时。使用a488标记的抗人二抗来检测结合。进行具有多重比较的anova,以将每种抗体与pali进行比较;如果抗体比pali显著染色更多,则将其移至下一步骤。
[0551]
31种测试抗体中有14种结合人t细胞明显高于背景。所鉴定的抗体靶向以下抗原:cd11a、cd25、cd27、cd44、cd52、cd54(icam)、cd59、gitr、hla-dr、icos、ox40、pd-l1和pd-1。预先在脾细胞和刺激的pbmc上测试使用spycatcher缀合系统的含有抗ctla-4小鼠和人抗
体(包括伊匹木单抗和替西木单抗)的tage剂。虽然这些tage剂能够内化,但没有观察到编辑。除了在t细胞抗体筛选中鉴定的新抗原之外,下面描述了对伊匹木单抗和替西木单抗的进一步研究。
[0552]
ab=cas9缀合物的t细胞结合
[0553]
然后选择在上一步中鉴定的14种抗体以及伊匹木单抗(“ipi”)和替西木单抗(“trem”)(总共16种抗体)与cas9缀合。将总pbmc活化两天,然后用7nm或70nm的ab=cas9缀合物染色。基于a550标记的grna的存在检测结合。帕利珠单抗(pali)用作阴性对照。进行具有多重比较的anova,以将每种抗体与pali进行比较,并且如果抗体比pali显著染色更多,则将其移至下一步骤。
[0554]
如图20a所示,14种测试的ab=cas9缀合物(抗体=cas9(wt)-2xnls-spycatcher-htn(“ac28”))比阴性对照(pali)显著更多地结合t细胞。
[0555]
在用5x“冷”抗体进行的70nm阻断测定中进一步评估ab=cas9缀合物与人t细胞的结合,以评估过量的未缀合抗体是否阻断ab=cas9缀合物的结合。将总pbmc活化2天,并先用350nm未缀合的带spytag的抗体阻断30分钟。然后将细胞用70nm的ab=cas9缀合物染色。a550信号来自a550标记的引导物。基于a550信号,通过将具有和不具有阻断的抗体缀合物的结合量进行比较来确定阻断百分比。
[0556]
如图20b-20e所示,15种测试的tage剂(ab=cas9)中有14种结合人t细胞,并在阻断测定中被未缀合抗体阻断。这些结果表明,包括靶向cd11a、cd25、cd27、cd44、cd52、cd54(icam)、gitr、hla-dr、icos、ox40、pd-l1或pd-1的抗体的tage剂(ab=cas9)可以特异性结合人t细胞。
[0557]
实施例20.抗cd11a和抗cd25抗体tage剂离体编辑人t细胞
[0558]
将抗cd11a和抗cd25a抗体(如在实施例19所述的t细胞筛选中鉴定的)或其抗原结合片段与cas9缀合,以形成基于抗体的tage剂(cd11a=cas9和cd25a=cas9)。具体地,将抗cd11a和抗cd25a抗体与cas9(wt)-2xnls-spycatcher-4xnls(“ac26”)或cas9(wt)-2xnls-spycatcher-htn(“ac28”)缀合。纯化缀合物并通过共孵育测试其对人t细胞的编辑。将靶向cd47的引导rna与相应的tage剂缔合,并将tage剂与t细胞共孵育以测试编辑。使用测量表面cd47损失(使用流式细胞术)的表型读数来测量编辑。评估来自两个不同供体的人t细胞的编辑。测试全长抗体和没有fc结构域的抗体片段以确定较小的分子是否具有较高的编辑。帕利珠单抗用作阴性对照。
[0559]
如图21a和21b所示,与抗cd11a抗体或抗cd25抗体或它们的抗原结合片段缀合的cas9(例如ac26或ac28)相对于同种型对照抗体对人t细胞显示出增加的编辑。在从第二供体获得的人t细胞中实现类似的编辑。
[0560]
实施例21.通过流式细胞术对比扩增子测序的离体编辑测量结果的比较
[0561]
在先前的实施例中,在一些情况下,使用流式细胞术通过表型读数评估离体编辑(参见例如实施例3、8、14、17、18、20、23、27、28、39、45或47)。与标准扩增子测序方法相比,流式细胞术提供了一种检测编辑的快速方法。为了确定通过流式细胞术获得的编辑测量结果与通过测序获得的编辑测量结果相关的程度,通过流式细胞术和下一代测序(ngs)两者评估由tage剂编辑的t细胞或成纤维细胞(经由共同孵育或核转染)。
[0562]
将包含cas9(c80a)-2xnls或4xnls-cas9(c80a)-2xnls的tage剂与靶向cd47或
cd44的sgrna复合以形成核糖核蛋白(rnp)。非靶向sgrna用作阴性对照(sgbfp;bfp是人类基因组中不存在的基因)。
[0563]
通过与每种tage剂共孵育或核转染来评估tage剂对成纤维细胞的编辑。
[0564]
为了评估通过共孵育对成纤维细胞的编辑,使人真皮成纤维细胞在组织培养板上生长。将rnp添加到96孔圆底超低附着组织培养板的孔中。添加30ul适当的rnp以达到5um的rnp浓度。从组织培养板收获人真皮成纤维细胞,并以20x106个细胞/ml将其重悬于成纤维细胞生长培养基中。将10ul成纤维细胞添加到含有rnp的孔中。每个孔中的最终条件为:40ul体积;3.75um rnp;200,000个细胞/孔,5x106个细胞/ml。将板在37摄氏度下孵育1小时。孵育后,将每个样品转移到含有960ul成纤维细胞生长培养基的12孔组织培养板的一个孔中,最终体积为每孔1ml。三天后,将细胞从板中剥离并转移到6孔组织培养板的孔中。再过三天后(共孵育六天后),收获细胞并分成两半。一半细胞用于基因组dna分离并进行处理用于下一基因测序(ngs),并且一半细胞经处理用于流式细胞术,如下所概述。
[0565]
为了评估通过核转染对成纤维细胞的编辑,使人真皮成纤维细胞在组织培养板上生长。将rnp添加到96孔圆底超低附着组织培养板的孔中。向每个孔添加5ul适当的rnp以达到5um的rnp浓度。从组织培养板收获人真皮成纤维细胞,并以10x106个细胞/ml将其重悬于lonza核转染缓冲液p4中。将20ul成纤维细胞添加到含有rnp的孔中。每个孔中的最终条件为:25ul体积;1um rnp;200,000个细胞/孔,8x106个细胞/ml。将与rnp混合的细胞转移到lonza 4dnucleofector的核转染盒的孔中。使用lonza 4d nucleofector并使用仪器代码ds-137对细胞进行核转染。核转染后,将每个样品转移到含有975ul成纤维细胞生长培养基的12孔组织培养板的一个孔中,最终体积为每孔1ml。三天后,将细胞从板中剥离并转移到6孔组织培养板的孔中。再过三天后(共孵育六天后),收获细胞并分成两半。一半细胞用于基因组dna分离并进行处理用于下一基因测序(ngs),并且一半细胞经处理用于流式细胞术,如下所述。
[0566]
通过与每种tage剂共孵育来评估tage剂对t细胞的编辑。将人t细胞在含有cd3和cd28交联抗体的t细胞培养基中培养4天,用于刺激t细胞。刺激4天后,收获细胞,并以20x106个细胞/ml将其重悬于t细胞生长培养基中。将rnp添加到96孔圆底超低附着组织培养板的孔中。向每个孔添加30ul适当的rnp以达到5um的rnp浓度。将10ul t细胞添加到含有rnp的孔。每个孔中的最终条件为:40ul体积;3.75um rnp;200,000个细胞/孔,5x106个细胞/ml。将板在37摄氏度下孵育1小时。孵育后,将每个样品用160ul t细胞生长培养基稀释。在接下来的六天,将细胞用新鲜培养基喂饲,并按需要针对标准t细胞生长条件扩大到更大的孔体积。共孵育后再过六天,收获细胞并分成两半。一半细胞用于基因组dna分离并进行处理用于下一基因测序(ngs),并且一半细胞经处理用于流式细胞术。
[0567]
首先,使用测量表面cd47或cd44损失(使用流式细胞术)的表型读数来测量编辑。通过标准流式细胞术方法处理细胞并用抗人cd44和cd47蛋白的抗体染色。在流式细胞仪上分析样品。通过分析cd44或cd47染色减少的细胞的频率来测量基因编辑。与用非靶向(sgbfp)rnp处理的细胞相比,分析用cd44靶向rnp编辑的细胞的cd44染色。与用非靶向(sgbfp)rnp处理的细胞相比,分析用cd47靶向rnp编辑的细胞的cd47染色。
[0568]
接着,使用下一代测序来测量编辑。通过pcr扩增从至少10,000个细胞/样品分离的基因组dna。pcr引物含有基因特异性区域和含有衔接子的区域,以实现基于illumina的
测序。使用illumina测序仪器对每个样品进行测序。将每个样品的测序读数与人基因组靶区域的基因组dna序列进行比对。对每个样品的未修饰序列和含有插入和缺失突变(indel)的序列进行计数。将基因编辑测量为每个样品的相应rnp靶位点处indel突变的频率。
[0569]
对于每个样品,将如通过流式细胞术测量的基因编辑与如通过ngs测量的基因编辑进行比较。
[0570]
如图22a所示,如通过流式细胞术测量的编辑百分比与对基因和细胞类型进行扩增子测序相关。通过流式细胞术和测序获得的编辑测量结果在细胞中也与较低程度的编辑相关(图22b)。
[0571]
这些结果表明,表型流式细胞仪读数是扩增子测序测定的代表,其中任何一种都可以用于确定tage剂用于基因编辑的功效。图22a和22b中提供的结果还表明,与通过对不同细胞类型、sgrna和编辑效率进行测序获得的编辑测量结果相比,流式细胞术测定可将基因编辑水平低估2至4倍。
[0572]
表4.序列表
[0573]
[0574]
[0575]
[0576]
[0577]
[0578]
[0579]
[0580]
[0581]
[0582]
[0583]
[0584]
[0585]
[0586]
[0587]
[0588]
[0589]
[0590]
[0591]
[0592]
[0593]
[0594]
[0595]
[0596]
[0597]
[0598]
[0599]
[0600][0601]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1