产生调节性B细胞的方法及其用途
产生调节性b细胞的方法及其用途
1.本技术要求于2019年4月12日提交的美国临时专利申请系列号62/833,174的优先权,该美国临时专利申请通过引用完全结合在本文中。
2.背景
1.技术领域
3.本发明整体上涉及医药和免疫学领域。更具体地,本发明涉及调节性b细胞群体及其用途。
4.2.相关技术说明
5.调节性b细胞(regulatory b cell,breg)能够抑制免疫应答,起抗自身免疫性疾病的重要作用并且提供移植耐受性。由于外周血仅包含少量百分比的这些抑制性免疫细胞,因此利用离体扩增方法来产生数量充足的抑制性细胞用于免疫相关疾病的体内治疗或预防。目前用于扩增breg的方法包括bcr连接和cd40配体(taitano等人,2016)。
6.然而,免疫疗法,如用于炎性病症的免疫疗法,通常需要大量的细胞,并且因此优化体外诱导b细胞增殖的方法以使产生的breg数目最大化并使产生数量充足的抑制性细胞所需的时间最小化是至关重要的。因此,对于有效扩增以产生用于治疗多种免疫疾病(包括自身免疫性、感染、癌症和cgvhd)的breg的方法存在尚未满足的需求。
技术实现要素:
7.因此,本公开内容的某些实施方案提供关于breg扩增的方法和组合物以及使用这些抑制性breg细胞治疗和/或预防任意免疫相关的疾病的方法。在一个实施方案中,提供用于产生抑制性调节性b细胞(breg)的体外方法,所述方法包括获得b细胞群体;改造b细胞以表达cd40配体(cd40l);以及扩增所述改造的b细胞以产生所述breg。
8.在一些方面中,cd40l是可溶性cd40l(scd40l)。在某些方面中,获得b细胞群体包括从血液样品和/或骨髓分离b细胞。在一些方面中,获得b细胞群体包括从cd34
+
造血干细胞和/或诱导性多能干细胞(ipsc)分化b细胞。在某些方面中,分离包括进行抗体珠粒选择或荧光相关细胞分选(facs)。在一些方面中,所述血液样品是外周血或脐带血。在具体的方面中,所述血液样品是脐带血(cb)。在某些方面中,所述脐带血是从2个以上单个脐带血单位汇集的。在一些方面中,所述脐带血是从3个、4个或5个单个脐带血单位汇集的。
9.在某些方面中,所述b细胞群体是cb单核细胞(cbmc)。在一些方面中,所述b细胞群体是cd5
+
cd1d
hi b细胞。在具体的方面中,所述b细胞群体是全部b细胞。在特定方面中,多于90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的b细胞群体包含b细胞。
10.在一些方面中,所述方法还包括在改造b细胞之前活化b细胞。在某些方面中,活化包括在il
‑
2、cpg寡脱氧核苷酸(odn)、cd40l、抗
‑
igm和/或抗
‑
igg的存在下培养b细胞。在一些方面中,活化包括在cpg odn和cd40l的存在下培养b细胞。
11.在一些方面中,活化包括在il
‑
2、cpg odn、抗
‑
igm和抗
‑
igg的存在下培养b细胞。在某些方面中,cpg odn以1
‑
5μg/ml的浓度存在,诸如1、2、3或3μg/ml,特别是3μg/ml。在一
些方面中,il
‑
2以50
‑
200iu/ml的浓度存在,诸如50、100、150或200iu/ml,特别是约100iu/ml。在某些方面中,抗
‑
igm和抗
‑
igg以5
‑
20μg/ml的浓度存在,诸如5、6、7、8、9、10、11、12、13、14、15或20μg/ml,诸如10μg/ml。在具体的方面中,活化持续40
‑
48小时,诸如约41、42、43、44、45、46、47或48小时。
12.在特定方面中,改造包括向所述b细胞中引入编码cd40l的表达载体。在一些方面中,所述载体是病毒载体。例如,所述病毒载体是逆转录病毒载体。在具体的方面中,所述逆转录病毒载体是基于mmlv的逆转录病毒载体。在一些方面中,所述表达载体还编码il
‑
21和/或baff。在某些方面中,所述表达载体还编码il
‑
21。在一些方面中,基于mmlv的逆转录病毒载体编码通过2a裂解肽连接的人cd40l和人il
‑
21、通过2a裂解肽连接的cd40l和人baff、通过2a裂解肽连接的baff和人il
‑
21或通过2a裂解肽连接的cd40l、baff和人il
‑
21。在特定方面中,所述载体包含seq id no:1、2或3。
13.在一些方面中,在il
‑
12和/或il
‑
4的存在下进行扩增。在特定方面中,在il
‑
12和il
‑
4的存在下进行扩增。在一些方面中,il
‑
12以10
‑
100iu/ml的浓度存在,诸如20、30、40、50、60、70、80、90或100iu/ml,特别是约50iu/ml。在某些方面中,il
‑
4以1
‑
10ng/ml的浓度存在,诸如1、2、3、4、5、6、7、8、9或10ng/ml,特别是4ng/ml。在特定方面中,扩增持续12
‑
16天,诸如12、13、14、15或16天。在具体的方面中,活化、改造或扩增进一步包括在一种或多种另外的细胞因子的存在下进行培养。在一些方面中,所述另外的细胞因子是il
‑
33。在一些方面中,活化、改造和/或扩增进一步包括一种或多种foxo1抑制剂、一种或多种mtor抑制剂和/或一种或多种stat6抑制剂的存在。在具体的方面中,foxo1抑制剂是as1842856和/或as1708727。在一些方面中,foxo1抑制剂是as1842856。在特定方面中,mtor抑制剂是torkinib、雷帕霉素(rapamycin)、依维莫司(everolimus)、替西罗莫司(temsirolimus)、deforolimus、bgt226、sf1126、bez235、gedatolisib和/或sf1101。在具体的方面中,mtor抑制剂是torkinib。在一些方面中,stat6抑制剂是as1517499和/或来氟米特(leflunomide)。在特定方面中,stat6抑制剂是as1517499。
14.在另外的方面中,所述方法还包括使breg与抗
‑
mir
‑
155接触。在一些方面中,所述breg具有抑制cd4
+
t细胞增殖的能力。在某些方面中,所述breg是人breg。
15.在另一个实施方案中,提供根据本发明的方法(例如,用于产生抑制性调节性b细胞(breg)的体外方法,所述方法包括:获得b细胞群体;改造b细胞以表达cd40配体(cd40l);以及扩增所述改造的b细胞以产生所述breg)产生的调节性b细胞群体。另一个实施方案提供一种药物组合物,其包含所述实施方案的调节性b细胞群体和药用承载体。
16.在另一实施方案中,提供治疗受试者中的免疫病症的方法,所述方法包括向所述受试者施用治疗有效量的实施方案所述的抑制性breg。在一些方面中,所述受试者已经施用或目前正在施用至少一种糖皮质激素疗法。在某些方面中,所述免疫病症是炎症、移植物抗宿主病、移植排斥和/或自身免疫性病症。在具体的方面中,所述breg针对所述接受者受试者是同种异体的。在其他方面中,所述breg针对所述接受者受试者是自体的。在具体的方面中,所述受试者是人。
17.在一些方面中,所述免疫病症是移植物抗宿主病(gvhd)。在特定方面中,所述gvhd是慢性gvhd(cgvhd)。
18.在某些方面中,所述受试者之前已经施用脐带血移植(cbt)。在一些方面中,所述
breg与所述cbt同时施用。在其他方面中,所述breg在所述cbt之前或之后施用。相继施用breg和cbt之间的时间间隔可以是任意适当的时间间隔,诸如1
‑
24小时、1
‑
7天、1
‑
4周、1
‑
12月或更久,以及其间任意的亚范围。
19.在具体的方面中,所述免疫病症是移植物排斥,并且所述移植物是器官移植物、骨髓或其他细胞移植物、复合组织移植物和/或皮肤移植物。在一些方面中,所述免疫病症是多发性硬化、炎性肠病、类风湿性关节炎、i型糖尿病、系统性红斑狼疮、接触性超敏反应、哮喘和/或干燥综合征。
20.在另外的方面中,所述方法还包括施用至少一种第二治疗剂。在一些方面中,所述至少第二治疗剂是治疗有效量的免疫调节剂或免疫抑制剂。在具体的方面中,所述免疫抑制剂是钙依赖磷酸酶抑制剂、mtor抑制剂、抗体、化疗剂、辐照、趋化因子、白介素或趋化因子和/或白介素的抑制剂。在某些方面中,所述breg和/或所述至少第二治疗剂经静脉内、腹膜内、气管内、肿瘤内、肌内、经内窥镜、病灶内、经皮、皮下、局部施用或通过直接注射或输注施用。
21.本发明的其他目的、特征和优点将通过下文的详细描述而变得显而易见。然而,应该理解,所述详细描述和具体的实施例尽管表示本发明的优选实施方案,但是仅通过举例说明的方式给出,因为本领域技术人员根据该详细描述将清楚在本发明的精神和范围内的多种改变和改进。
附图说明
22.下述附图形成本说明书的一部分,并且包括附图以进一步证明本公开内容的某些方面。通过参考这些附图中的一幅或多幅,并结合其中显示的具体实施方案的详细描述,可以更好地理解本公开内容。
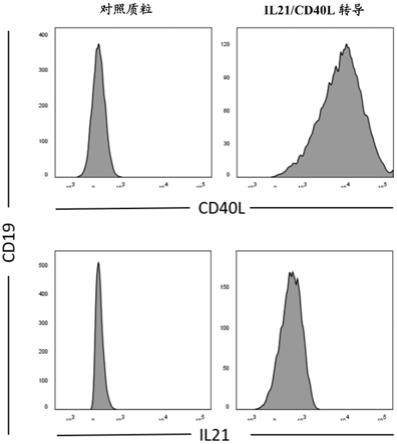
23.图1a
‑
1b:使用阴性分离试剂盒(miltenyi biotec)从pbmc分离b细胞,并将b细胞用cpg odn 2006(cpg)(3μg/ml,hycultbiotech)和cd40l(200ng/ml,adipogen)活化48小时,然后用mmlv逆转录病毒(ltr
‑
hcd40l
‑
2a
‑
hil21
‑
ltr)转导,以及进一步用il2(50iu/ml)和il4(4ng/ml)外源支持。(1a)48小时后的转导效率是极好的(右上和右下图)。(1b)2周扩增后的绝对b细胞扩增。
24.图2a
‑
2c:将磁力分离的cd4
+
t细胞以105个细胞/孔铺板在96孔平底板上,并用或不用抗
‑
cd3/cd28 dynabeads(分别是阳性和阴性对照)刺激;将105个hcd40l/hil21
‑
转导的b细胞以1:1或1:2比率添加;invitrogen。将cd4
+
t细胞在培养之前用2μm羧基荧光素琥珀酰亚胺酯(cfse)(ebioscience)染色。(2a)将b细胞和cfse
‑
标记的cd4
+
t细胞共培养48小时。添加乙酸肉豆蔻佛波醇(50ng/ml)/离子霉素(500ng/ml)(pma/iono)和布雷非德菌素a(brefeldin a,bfa)(10μg/ml)(均购自sigma
‑
aldrich,st louis,mo,usa)持续最后4小时。收集细胞,并用抗
‑
ifn
‑
γ(b27;bd)、tnf
‑
α(mab11;invitrogen)细胞内染色。在hcd40l/hil21
‑
转导的b细胞存在下培养的cd4+t细胞以不同的t:b细胞比率抑制cd4 t细胞的ifn
‑
γ和tnfα产生(a
‑
左上图和左下图)。(2b)来自2次独立实验的在cd40l/hil21
‑
转导的b细胞存在下的cd4+t
‑
细胞细胞因子抑制的结果。(2c)通过计算分裂指数分析cd4
+
t细胞增殖。在cd40l/hil21
‑
转导的b细胞存在下的培养物抑制cd4+t细胞增殖,通过在不同t:b细胞比率以cfse稀释进行评估(下面两个图)。
25.图3:用于转导b细胞的hbaff
‑
hcd40l
‑
hil21质粒图谱。
26.图4a
‑
4b:使用阴性分离试剂盒(miltenyi biotec)从pbmc分离b细胞,将b细胞用cpg odn 2006(cpg)(3μg/ml,hycultbiotech)和cd40l(200ng/ml,adipogen)活化48小时,然后用可以过表达cd40l和il21的病毒上清液转导,并进一步用il2(50iu/ml)和il4(4ng/ml)支持。(4a)48小时后的转导效率。(4b)随时间变化的绝对b细胞数目。
27.图5a
‑
5c:将磁力分离的cd4
+
t细胞以105个细胞/孔与105个活化的或静息b细胞和抗
‑
cd3/cd28 dynabeads(1:1和1:2比率;invitrogen)一起铺板在96孔平底板上。将cd4
+
t细胞在培养前用2μm羧基荧光素琥珀酰亚胺酯(cfse)(ebioscience)染色。(5a)按共培养实验部分所述,将b细胞和cfse
‑
标记的cd4
+
t细胞共培养48小时。添加乙酸肉豆蔻佛波醇(50ng/ml)/离子霉素(500ng/ml)(pma/iono)和布雷非德菌素a(bfa)(10μg/ml)(均购自sigma
‑
aldrich,st louis,mo,usa)持续最后4小时。收集细胞,并用抗
‑
ifn
‑
γ(b27;bd)、tnf
‑
α(mab11;invitrogen)细胞内染色。(5b)通过计算分裂指数分析cd4
+
t细胞增殖。(5c)组合2个不同实验的结果用于细胞毒性测定。从左至右的柱状图是阴性对照、阳性对照、b+t
‑
1:2比率和b+t
‑
1:1比率。
具体实施方案
28.本公开内容的某些实施方案提供产生高度抑制性调节性b细胞(breg)的有效方法。具体地,通过本发明方法产生的breg可以是高度抑制性的并且数量充足,足以用于治疗一种或多种炎性病况。本发明的方法可以包括使用编码人il21和人cd40l(ltr
‑
hcd40l
‑
2a
‑
hil21
‑
ltr)的基于mmlv的逆转录病毒载体进行b细胞的离体转导、活化和扩增。本研究证明用该构建体实例转导和扩增的b细胞具有高度抑制性能力,包括抑制cd4
+
t细胞的ifnγ和tnfα产生。
29.可以通过在il
‑
2、cpg寡脱氧核苷酸(odn)、cd40l、抗
‑
igm和/或抗
‑
igg存在下培养b细胞(例如,全部b细胞或纯化的cd5
+
cd1d
high b细胞群体)活化breg。b细胞起始群体可以分离自外周血和/或脐带血。初始活化培养可以持续约1
‑
2天、1
‑
3天或2
‑
3天(包括1、2或3天),例如,40
‑
48小时、40
‑
47小时、40
‑
46小时、40
‑
45小时、40
‑
44小时、40
‑
43小时、40
‑
42小时、40
‑
41小时、41
‑
48小时、41
‑
47小时、41
‑
46小时、41
‑
45小时、41
‑
44小时、41
‑
43小时、41
‑
42小时、42
‑
48小时、42
‑
47小时、42
‑
46小时、42
‑
45小时、42
‑
44小时、42
‑
43小时、43
‑
48小时、43
‑
47小时、43
‑
46小时、43
‑
45小时、43
‑
44小时、44
‑
48小时、44
‑
47小时、44
‑
46小时、44
‑
45小时、45
‑
48小时、45
‑
47小时、45
‑
46小时、46
‑
48小时、46
‑
47小时或47
‑
48小时。
30.然后,可以改造b细胞以表达cd40l、和/或baff、和/或il
‑
12。改造可以包括表达载体,诸如逆转录病毒载体,特别是基于mmlv的逆转录病毒载体。然后,可以在il
‑
12和/或il
‑
4的存在下扩增b细胞。扩增培养物可以进一步包括一种或多种信号传导抑制剂,诸如一种或多种foxo1抑制剂、一种或多种mtor抑制剂和/或一种或多种stat6抑制剂。另外,本发明人已经发现将b细胞暴露于抗
‑
mir155(例如,药理学抑制或遗传操作)进一步增加其抑制功能。因此,在一些实施方案中,将b细胞或扩增的breg与抗
‑
mir155接触以进一步增强其抑制活性。
31.可以进一步改造breg以表达一种或多种嵌合抗原受体(car)。进一步的修饰可以包括自杀开关,所述自杀开关允许细胞缺失以防止任何不适当的毒性。
32.因此,本技术还提供利用该调节性细胞亚组操作免疫和炎性反应的方法,用于治疗人和其他哺乳动物(狗、猫、马等)中的免疫相关疾病、病症和病况(包括炎性疾病和自身免疫性疾病)以及免疫抑制和癌症的方法。例如,这些刺激的breg可以用于治疗自身免疫性病症或同种异体免疫性病症,诸如移植物抗宿主病症(gvhd)。因此,本公开内容提供扩增的breg的组合物,其可以用于多种免疫相关病症的免疫调节。
33.i.定义
34.如本文所用,关于指定组分“基本上不含”在本文中用于意指没有任一种指定组分被有意配制在组合物中和/或仅作为污染物或以痕量存在。由组合物的任何非预期污染产生的指定组分的总量因此远低于0.05%,优选地低于0.01%。更优选的是这样的组合物,其中指定组分的量用标准分析方法检测不到。
35.当在本说明书中使用时,“一种”或“一个”可意指一种或多种或者一个或多个。当在权利要求书中与词语“包含”结合使用时,词语“一种”或“一个”可以意指一种或多于一种或者一个或多于一个。
36.尽管本技术支持“或”的定义仅指备选物和“和/或”,但在权利要求书中使用时,术语“或”用来意指“和/或”,除非明确指示仅指备选物或备选物是相互排斥的。如本文中所用,“另一种”可意指至少第二种或更多种。术语“约”、“基本上”和“大约”通常意指指定值加或减5%。
[0037]“调节性b细胞”(breg)是抑制免疫应答的b细胞。调节性b细胞可以直接或间接抑制t细胞活化,并且还可以抑制抗原呈递细胞、其他先天免疫细胞或其他b细胞。调节性b细胞可以是cd19
+
或表达多种其他b细胞标记物和/或属于其他b细胞亚组。这些细胞还可以分泌il
‑
10,通过本发明提供的刺激方法增加il
‑
10的分泌。
[0038]“b细胞抗原受体”或“bcr”是指b细胞抗原受体,其包括膜免疫球蛋白抗原结合成分或其生物活性部分(即,能够结合配体和/或能够与转导剂成分缔合的部分)。b细胞受体通常由与ig
‑
α和ig
‑
β异二聚体缔合的表面结合的igm或igd抗体组成,所述ig
‑
α和ig
‑
β异二聚体能够信号转导。术语“b细胞受体的跨膜结构域”优选指b细胞受体的抗体部分的跨膜结构域,即,igm或igd重链的跨膜结构域。在一些实施方案中,“b细胞抗原受体”或“bcr”优选指成熟bcr,并且有效地排除包含替代轻链的前b细胞受体(pre
‑
bcr)。
[0039]“cpg寡脱氧核苷酸”或“cpg寡脱氧核苷酸(odn)”是包含至少一个未甲基化cpg二核苷酸的寡核苷酸。含有至少一个未甲基化cpg二核苷酸的寡核苷酸是含有未甲基化胞嘧啶
‑
鸟嘌呤二核苷酸序列(即,“cpg dna”或含有5'胞嘧啶接着3'鸟嘌呤(通过磷酸酯键连接)的dna)并活化免疫系统的核酸分子。cpg寡核苷酸可以是双链的或单链的。通常,双链分子在体内更稳定,而单链分子具有增加的免疫活性。
[0040]
术语“核酸”和“寡核苷酸”可互换使用,意指连接至磷酸酯基团和可交换的有机碱基的多核苷酸(即,包含糖(例如,核糖或脱氧核糖)的分子),所述有机碱基是取代的嘧啶(例如,胞嘧啶(c)、胸腺嘧啶(t)或尿嘧啶(u))或取代的嘌呤(例如,腺嘌呤(a)或鸟嘌呤(g))。用于本文时,该术语是指寡核糖核苷酸以及寡脱氧核糖核苷酸。该术语还应该包括多核苷(即,多核苷酸减去磷酸酯)和含有任意其他有机碱基的聚合物。核酸分子可以从已有的核酸来源(例如,基因组或cdna)获得,但优选是合成的(例如,通过寡核苷酸合成产生)。
[0041]“免疫病症”、“免疫相关病症”或“免疫介导的病症”是指其中免疫反应在疾病的发
展或进展中起关键作用的病症。免疫介导的病症包括自身免疫性病症、同种异体移植排斥、移植物抗宿主病和炎性病况以及过敏性病况。
[0042]“免疫反应”为免疫系统的细胞(诸如b细胞或t细胞或先天性免疫细胞)对刺激物的反应。在一个实施方案中,该反应特异性针对特定的抗原(“抗原特异性反应”)。
[0043]“自身免疫性病症”是指这样的疾病,其中免疫系统对作为正常宿主的一部分的抗原(即,自体抗原)产生免疫反应(例如,b
‑
细胞或t
‑
细胞反应),随后产生组织损伤。自体抗原可以源自宿主细胞或可以源自共生生物体,诸如正常定殖在粘膜表面的微生物(称作共生生物体)。
[0044]“治疗”疾病或病况是指执行方案,其可包括向有需要的个体施用一种或多种药物(或任意治疗组合物),以努力减轻疾病的征兆或症状。所需的治疗效果包括降低疾病进展速率、改善或减轻疾病状态和缓解或改良预后。减轻可在疾病或病况的征兆或症状出现之前以及在它们出现之后发生。因此,“治疗”可以包括“预防”或“防止”疾病或非所需的病况。另外,“治疗”不需要完全减轻征兆或症状,不需要治愈,且特别包括对患者仅具有边际效应的方案。
[0045]
如在整个申请中使用的术语“治疗效益”或“治疗有效的”是指相对于此病况的医学治疗促进或增强受试者的健康的任何事物。这包括但不限于疾病征兆或症状的频率或严重性的降低。例如,癌症治疗可涉及例如肿瘤尺寸减小、肿瘤侵袭性降低、癌症生长速率降低或预防转移。癌症治疗还可指延长癌症患者的生存期。
[0046]“受试者”和“患者”是指人类或非人类(诸如灵长类动物、哺乳动物和脊椎动物)。在具体的实施方案中,受试者是人类。
[0047]
术语“抗体”在本文中以最广意义使用,并且具体涵盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出需要的生物活性即可。
[0048]
短语“药学上或药理学上可接受的”是指在按需要向动物(诸如人类)施用时不产生不良、过敏或其他不适当反应的分子实体和组合物。依据本发明,包含抗体或额外活性成分的药物组合物的制剂将是本领域技术人员所知的。此外,对于动物(例如人类)施用,应理解,制剂应该满足fda生物标准办公室(fda office of biological standards)所要求的无菌性、致热原性、一般安全性和纯度标准。
[0049]
如本文所用,“药学上可接受的承载体”包括任何以及所有水性溶剂(例如,水,醇/水溶液,盐水溶液,肠胃外媒介物,诸如氯化钠、林格氏右旋糖(ringer's dextrose)等)、非水溶剂(例如,丙二醇、聚乙二醇、植物油和可注射有机酯,诸如油酸乙酯)、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如,抗细菌剂或抗真菌剂、抗氧化剂、螯合剂和惰性气体)、等渗剂、吸收延迟剂、盐、药物、药物稳定剂、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、流体和营养补充剂,类似物质以及它们的组合,这些是本领域普通技术人员已知的。根据熟知的参数调整药物组合物中的各种组分的ph和准确浓度。
[0050]“分离的”生物成分(如血液学物质的一部分,诸如血液成分)是指基本上与该成分天然存在的生物体中其他生物成分分开或纯化的成分。分离的细胞是已经基本上与该细胞天然存在的生物体的其他生物成分分开或纯化的细胞。
[0051]
当用于本文时,术语“基本上”用来表示包含至少80%所需成分、更优选地90%所
需成分、或最优选95%所需成分的组合物。在一些实施方案中,所述组合物包含至少80%、82%、84%、86%、88%、90%、91%、92%、93%、94%、95%、96%、97%或98%所需成分。
[0052]
ii.调节性b细胞
[0053]
本公开内容的一些实施方案涉及调节性b细胞(breg)的分离和扩增。因此,本技术公开了高度抑制性的breg群体。breg可以通过下述能力表征:例如,抑制效应t细胞(诸如cd4
+
t细胞)的增殖、抑制效应t细胞的炎性细胞因子(ifnγ和tnfα)产生和产生白介素
‑
10(il
‑
10)。
[0054]
a.分离b细胞群体
[0055]
分离的b细胞群体可以获自受试者,特别是人受试者。b细胞可以获自感兴趣的受试者,诸如疑似患有特定疾病或病况的受试者、疑似具有患特定疾病或病况倾向的受试者或正在经历针对特定疾病或病况的疗法的受试者。b细胞可以从其在受试者中驻留的位置采集,所述位置包括,但不限于,血液、脐带血、脾、胸腺、淋巴结和/或骨髓。分离的b细胞可以直接进行分析,或者其可以储存直到进行测定时,诸如通过冷冻储存。
[0056]
在具体的实施方案中,b细胞分离自血液,诸如外周血、骨髓和/或脐带血,和/或源自干细胞和/或ipsc。在一些方面中,分离自脐带血的b细胞具有增强的免疫调节能力,诸如通过cd4
‑
或cd8
‑
阳性t细胞抑制测定的。在特定方面中,b细胞分离自汇集的血液,特别是汇集的脐带血,用于增强的免疫调节能力。汇集的血液可以来自2个以上的来源,诸如3、4、5、6、7、8、9、10或更多的来源(例如,供体受试者)。
[0057]
b细胞群体可以获自需要治疗或患有与减少的调节性b细胞活性相关的疾病的受试者。因此,对于需要治疗的受试者而言,细胞可以是自体的。备选地,b细胞群体可以获自供体,优选组织相容性匹配的供体,并且,对于需要治疗的受试者而言,细胞可以是同种异体的。
[0058]
当调节性b细胞群体获自与受试者不同的供体时,所述供体优选是同种异体的,条件是所获得的细胞是受试者相容的,因为所述细胞可以被引入到所述受试者中。同种异体供体细胞可以是或可以不是人类白细胞抗原(hla)
‑
相容的。为了成为受试者相容的,可以处理同种异体细胞以减少免疫原性(fast等人,2004)。
[0059]
用于分离和定量细胞群体的方法在本领域中是公知的,并且可以通过本领域技术人员已知的任何方式实现调节性b细胞(诸如cd19
+
细胞)的分离和定量。可以使用针对cd19的磁珠、或荧光活化细胞分选(facs)、或其他细胞分离方法来分离cd19
+
并且特别还产生il
‑
10的细胞。还可以分离这样的调节性b细胞:所述细胞表达cd19并且是cd38
hi
cd24
hi
、igm
hi
igd
+
cd10
+
cd27
‑
、cd38
int
cd24
int
或igm
int
igd
+
cd10
‑
cd27
‑
或属于任意其他b细胞亚群。在具体的方面中,b细胞是cd5
+
cd1d
hi b细胞。在一个实施方案中,使用特异性针对一种或多种细胞表面标记物的标记的抗体来鉴定和定量调节性b细胞,诸如cd19
+
细胞。抗体可以缀合到其他化合物上,所述其他化合物包括,但不限于:酶,磁珠,胶体磁珠,半抗原,荧光色素,金属化合物,放射性化合物和/或药物。可以缀合到抗体上的酶包括,但不限于:碱性磷酸酶,过氧化物酶,脲酶和b半乳糖苷酶。可以缀合到抗体上的荧光色素包括,但不限于:异硫氰酸荧光素,异硫氰酸四甲基若丹明,藻红蛋白,别藻蓝蛋白和texas red。
[0060]
可以通过选择具有cd19
+
表面标记物的细胞并使用自动细胞分选(诸如荧光活化细胞分选(facs))分离来富集调节性b细胞。为了增强富集,阳性选择可以与阴性选择组合;
即,通过去除具有非b细胞特有的表面标记物和/或非调节性b细胞特有的表面标记物的细胞,非调节性b细胞特有的示例性表面标记物包括cd3、cd4、cd7、cd8、cd15、cd16、cd34、cd56、cd57、cd64、cd94、cd116、cd134、cd157、cd163、cd208、f4/80、gr
‑
1和/或tcr。
[0061]
在一些实例中,通过使细胞与适当标记的抗体接触以鉴定感兴趣的细胞、然后通过分离技术(如facs或结合抗体的珠粒)来分离调节性b细胞(诸如cd19
+
细胞)。然而,可以使用不同效力的其他技术来纯化和分离需要的细胞群体。所用的分离技术应该最大程度保留要收集的细胞级分的存活力。所用的具体技术当然依赖分离效率、方法的细胞毒性、分离的容易性和速度以及所需要的器材和/或技术能力。
[0062]
另外的分离程序可以包括磁性分离、使用抗体包被的磁珠、亲和层析、细胞毒性剂(连接到单克隆抗体上或与补体联合使用)和“淘选”(其利用连接到固体基质上的单克隆抗体)、或另一种便利的技术。连接到磁珠和其他固体基质(诸如琼脂糖珠粒、聚苯乙烯珠粒、中空纤维膜和塑料皮氏培养皿)上的抗体允许直接的分离。与抗体结合的细胞可以通过从细胞悬液中简单物理分离固体支持物而从所述细胞悬液中分离出来。细胞与固相连接的抗体温育的精确条件和持续时间将依赖所用系统特有的一些因素。然而,适当条件的选择在本领域中是公知的。
[0063]
然后,在允许表达目的标记物的细胞(例如,cd19
+
)与固相连接的抗体结合充分的时间后,可以用生理缓冲液将未结合的细胞洗脱下来或冲洗掉。然后,通过任意适当的方法(主要取决于所用固相和抗体的性质)将结合的细胞与固相分离,并且通过本领域公知的方法定量。在一个具体的非限制性的实例中,与固相分离的结合的细胞通过流式细胞术定量。
[0064]
调节性b细胞(诸如cd19
+
b细胞)还可以通过阴性选择不是调节性b细胞的细胞而分离。这可以通过进行谱系消耗实现,其中细胞用关于特定谱系(诸如t谱系、巨噬细胞/单核细胞谱系、树突状细胞谱系、粒细胞谱系、红细胞谱系、巨核细胞谱系等)的抗体标记。然后,可以通过亲和柱处理(其中谱系标记物阳性的细胞保留在柱上)、通过亲和磁珠或颗粒(其中谱系标记物阳性的细胞被吸引到分离磁铁上)、通过“淘选”(其中谱系标记物阳性的细胞保持连接到第二抗体包被的表面上)、或通过补体介导的裂解(其中谱系标记物阳性的细胞在补体存在下利用结合到期细胞表面上的抗体而裂解),去除用一种或多种谱系特异性抗体标记的细胞。另一种谱系消耗策略涉及四聚体复合物形成。使用四聚体抗人抗体复合物(例如,特异性针对多种细胞类型上多种标记物(不是调节性b细胞的标记物)的复合物)和与stemstep
tm
柱联合的磁性胶体(stem cell technologies,vancouver,canada)分离细胞。然后,任选地使细胞进行离心,以将其上结合了四聚体复合物的细胞与所有其他细胞分离。
[0065]
在某一实施方案中,来自单个供体或汇集的供体的分离的b细胞可以储存用于将来的应用。在该方面,分离的b细胞群体可以冷冻保存。冷冻保存是通过在冷冻保护剂存在下冷却至低的零下温度(如77k或
‑
196℃)保存细胞或全组织的方法。通过冷冻保存的储存包括,但不限于:在液氮中储存,在保持在约0℃的恒定温度的冰箱中储存,在保持在约
‑
20℃的恒定温度的冰箱中储存,在保持在约
‑
80℃的恒定温度的冰箱中储存,和在保持在低于约
‑
80℃的恒定温度的冰箱中储存。在该实施方案的一方面中,细胞可以是“快速冷冻的”,诸如在储存前通过使用乙醇/干冰或液氮。在该实施方案的另一方面中,细胞可以保存在包含冷冻保护剂的介质中,所述冷冻保护剂包括,但不限于:二甲亚砜(dmso)、甘油、乙二醇、
丙二醇、蔗糖和海藻糖。储存生物物质的其他方法是本领域技术人员公知的,例如参见美国专利公开号2007/0078113,其通过引用结合在本文中。
[0066]
b.调节性b细胞的活化和扩增
[0067]
然后,分离的b细胞群体可以进行活化、改造、然后扩增以增加细胞数目和/或增加调节性b细胞的抑制能力。调节性b细胞群体的活化和扩增可以通过使调节性b细胞群体与足以引起调节性b细胞数目增加的刺激性组合物接触而实现。这可以通过使分离的cd19
+
b细胞与有丝分裂原、细胞因子、生长因子或抗体(如特异性结合b细胞受体的抗体)或饲养细胞接触而实现。调节性b细胞可以扩增至少2倍、5倍、10倍,诸如至少50倍、100倍、200倍、300倍、500倍、800倍、1000倍、10,000倍或100,000倍。
[0068]
本公开内容提供用于活化和扩增分离的b细胞的方法,其通过用一种或多种扩增剂处理细胞以增强其抑制能力而进行。扩增的调节性b细胞群体可以包括至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少99%或100%产生il
‑
10或通过其他机制发挥其抑制功能的调节性b细胞。
[0069]
扩增剂可以包括一种或多种cd40激动剂,诸如cd40配体(cd40l),特别是可溶性cd40和/或cpg核苷酸。其他扩增剂可以包括细胞因子,如il
‑
4、il
‑
21、il
‑
33或它们的组合。培养物还可以包含il
‑
2。
[0070]
在一些方面中,首先将分离的b细胞群体在il
‑
2、cpg寡脱氧核苷酸(odn)、cd40l、抗
‑
igm和/或抗
‑
igg存在下活化,诸如持续约1
‑
3天,特别是约40
‑
48小时。培养基可以进一步包含一种或多种信号传导抑制剂。例如,可以在il
‑
4、cpg、cd40l和信号传导抑制剂(诸如一种或多种foxo1抑制剂、一种或多种stat6抑制剂和/或一种或多种mtor抑制剂)存在下培养b细胞。
[0071]
然后,可以改造活化的b细胞以表达cd40l和/或baff和/或il
‑
21,特别是cd40l和il
‑
21。可以通过本领域公知的方法将细胞遗传工程改造成表达一种或多种因子,所述方法诸如编码一种或多种因子的表达载体,如下文所述。示例性的载体序列提供在下文中。可以使用与seq id no:1
‑
6具有至少80%、85%、90%、95%、99%或100%序列同一性的载体改造b细胞以表达baff和/或cd40l和/或il
‑
21。
[0072]
hbaff(seq id no:1)
[0073]
atggatgactccacagaaagggagcagtcacgccttacttcttgccttaagaaaagagaagaaatgaaactgaaggagtgtgtttccatcctcccacggaaggaaagcccctctgtccgatcctccaaagacggaaagctgctggctgcaaccttgctgctggcactgctgtcttgctgcctcacggtggtgtctttctaccaggtggccgccctgcaaggggacctggccagcctccgggcagagctgcagggccaccacgcggagaagctgccagcaggagcaggagcccccaaggccggcctggaggaagctccagctgtcaccgcgggactgaaaatctttgaaccaccagctccaggagaaggcaactccagtcagaacagcagaaataagcgtgccgttcagggtccagaagaaacagtcactcaagactgcttgcaactgattgcagacagtgaaacaccaactatacaaaaaggatcttacacatttgttccatggcttctcagctttaaaaggggaagtgccctagaagaaaaagagaataaaatattggtcaaagaaactggttacttttttatatatggtcaggttttatatactgataagacctacgccatgggacatctaattcagaggaagaaggtccatgtctttggggatgaattgagtctggtgactttgtttcgatgtattcaaaatatgcctgaaacactacccaataattcctgctattcagctggcattgcaaaactggaagaaggagatgaactccaacttgcaataccaagagaaaatgcacaaatatcactggatggagatgtcacattttttgg
tgcattgaaactgctgc
[0074]
hcd40l(seq id no:2)
[0075]
atgatcgaaacatacaaccaaacttctccccgatctgcggccactggactgcccatcagcatgaaaatttttatgtatttacttactgtttttcttatcacccagatgattgggtcagcactttttgctgtgtatcttcatagaaggctggacaagatagaagatgaaaggaatcttcatgaagattttgtattcatgaaaacgatacagagatgcaacacaggagaaagatccttatccttactgaactgtgaggagattaaaagccagtttgaaggctttgtgaaggatataatgttaaacaaagaggaaacgaagaaagaaaacagctttgaaatgcaaaaaggtgatcagaatcctcaaattgcggcacatgtcataagtgaggccagcagtaaaacaacatctgtgttacagtgggctgaaaaaggatactacaccatgagcaacaacttggtaaccctggaaaatgggaaacagctgaccgttaaaagacaaggactctattatatctatgcccaagtcaccttctgttccaatcgggaagcttcgagtcaagctccatttatagccagcctctgcctaaagtcccccggtagattcgagagaatcttactcagagctgcaaatacccacagttccgccaaaccttgcgggcaacaatccattcacttgggaggagtatttgaattgcaaccaggtgcttcggtgtttgtcaatgtgactgatccaagccaagtgagccatggcactggcttcacgtcctttggcttactcaaactcggac
[0076]
hil21(seq id no:3)
[0077]
gcatgagatccagtcctggcaacatggagaggattgtcatttgtctgatggtcattttcttggggacactggtccacaaatcaagctcccaaggtcaagatcgccacatgattaggatgcgtcaacttatagatattgttgatcagctgaaaaattatgtgaatgacttggtccctgaatttctgccagctccagaagatgtagagacaaactgtgagtggtcagctttttcctgttttcagaaggcccaactaaagtcagcaaatacaggaaacaatgaaaggataatcaatgtatcaattaaaaagctgaagaggaaaccaccttccacaaatgcagggagaagacagaaacacagactaacatgcccttcatgtgattcttatgagaaaaaaccacccaaagaattcctagaaaggttcaaatcacttctccaaaagatgattcatcagcatctgtcctctagaacacacggaagtgaagattcctgagatgatcatcaacaccagctg
[0078]
hbaff(seq id no:4)
[0079]
mddstereqsrltsclkkreemklkecvsilprkespsvrsskdgkllaatlllallsccltvvsfyqvaalqgdlaslraelqghhaeklpagagapkagleeapavtaglkifeppapgegnssqnsrnkravqgpeetvtqdclqliadsetptiqkgsytfvpwllsfkrgsaleekenkilvketgyffiygqvlytdktyamghliqrkkvhvfgdelslvtlfrciqnmpetlpnnscysagiakleegdelqlaiprenaqisldgdvtffgalkll
[0080]
hcd40l(seq id no:5)
[0081]
lkmietynqtsprsaatglpismkifmylltvflitqmigsalfavylhrrldkiedernlhedfvfmktiqrcntgerslsllnceeiksqfegfvkdimlnkeetkkensfemqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllk
[0082]
hil21(seq id no:6)
[0083]
rmrsspgnmeriviclmviflgtlvhksssqgqdrhmirmrqlidivdqlknyvndlvpeflpapedvetncewsafscfqkaqlksantgnneriinvsikklkrkppstnagrrqkhrltcpscdsyekkppkeflerfksllqkmihqhlssrthgseds*
[0084]
然后,将改造的b细胞在il
‑
12和/或il
‑
14存在下扩增。扩增培养物可以进一步包含一种或多种另外的细胞因子,诸如il
‑
33。总扩增培养可以进行约8
‑
15天、8
‑
14天、8
‑
13天、8
‑
12天、8
‑
11天、8
‑
10天、8
‑
9天、9
‑
15天、9
‑
14天、9
‑
13天、9
‑
12天、9
‑
11天、9
‑
10天、10
‑
15天、10
‑
14天、10
‑
13天、10
‑
12天、10
‑
11天、11
‑
15天、11
‑
14天、11
‑
13天、11
‑
12天、12
‑
15天、
12
‑
14天、12
‑
13天、13
‑
15天、13
‑
14天、或14
‑
15天,特别是10
‑
14天。
[0085]
breg的抑制功能可以通过加入抗
‑
mir
‑
155而增强。抗
‑
mir
‑
155可以在过程的任意步骤添加到扩增培养物中。然而,在具体的方面中,在扩增后将抗
‑
mir
‑
155添加到breg培养物中,以进一步增强breg的抑制活性。例如,抗
‑
mir
‑
155可以在扩增培养第12
‑
20天(诸如第13、14、15或16天)添加到breg培养物中。
[0086]
1.cd40配体
[0087]
在某些实施方案中,将分离的b细胞用cd40激动剂(诸如可溶性cd40l)在单独使用或与其他扩增激动剂组合使用的条件下培养。术语“cd40”是指任意、优选天然存在的cd40蛋白。cd40是一种跨膜糖蛋白细胞表面受体,其与肿瘤坏死因子α(tnf
‑
α)受体家族共有序列同源性,并且最初被鉴定为在与单克隆抗体连接后诱导b细胞生长的b细胞表面分子。
[0088]
其配体cd40l,也称为cd 154,是一种34
‑
39kda的属于tnf基因超家族的ii型整合膜蛋白,并且主要在活化的t细胞上表达。cd40与其配体的结合导致cd40的三聚体簇集和称为tnf受体相关因子(traf)的衔接蛋白被招募到cd40的胞质尾部。cd40l也称为cd154、tnfsf5、trap和gp39,是一种可能三聚体化以结合并活化cd40以及αilb
‑
β3整联蛋白的tnf超家族成员。cd40l为约30
‑
kda,全长版本具有261个氨基酸,其中细胞外结构域(ecd)是氨基酸45
‑
261。其为ii型膜糖蛋白。在一些生理情形中,cd40l被加工产生包含氨基酸113
‑
261的可溶性形式。
[0089]
当用于本文时,术语“cd40
‑
l”包括缺少跨膜和细胞内区域的可溶性cd40
‑
l多肽、人cd40
‑
l的哺乳动物同源物、人或鼠cd40
‑
l的类似物或者人或鼠cd40
‑
l的衍生物。本文中所称的cd40
‑
l类似物是基本上与人或鼠cd40
‑
l序列同源的多肽,但是其具有与天然序列的cd40
‑
l(人或鼠物种)多肽因一个或多个缺失、插入或取代而不同的氨基酸序列。cd40
‑
l的类似物可以从通过寡核苷酸合成和连接或通过位点特异性诱变技术制备的dna构建体合成。
[0090]
在一些实施方案中,一种或多种cd40激动剂,诸如cd40配体和/或激动性抗
‑
cd40抗体,可以与一种或多种其他扩增剂组合使用,以增强breg的扩增。例如,cd40激动剂是激动性抗
‑
cd40抗体或其抗原结合片段,包括但不限于:抗
‑
cd40抗体的至少第一scfv、fv、fab'、fab或f(ab')2抗原结合区。在某些方面中,cd40激动剂是人、人源化或部分人嵌合抗
‑
cd40抗体、或其抗原结合片段。在其他方面中,cd40激动剂是抗
‑
cd40单克隆抗体,包括但不限于:g28
‑
5、mab89、ea
‑
5或s2c6单克隆抗体或其抗原结合片段。
[0091]
在具体的实施方案中,cd40激动剂是可溶性cd40l(scd40l)。可溶性cd40
‑
l包含cd40
‑
l的细胞外区域或其片段。例如,可溶性单体cd40l记述在美国专利号6,264,951中,变体记述在国际公开号wo 2005/035570中。cd40
‑
l还可以通过诱变编码cd40
‑
l多肽的核苷酸序列而获得。可以使b细胞与浓度为约10
‑
500ng/ml(诸如约20
‑
200ng/ml,诸如约30
‑
150ng/ml,诸如约50、75、80、90、95、100、110或120ng/ml,特别约100ng/ml)的可溶性cd40l接触。在一些方面中,在浓度为100
‑
500ng/ml(诸如150、200、250、300、350、400或450ng/ml)的cd40l的存在下培养b细胞。
[0092]
2.细胞因子
[0093]
将分离的b细胞扩增为高度抑制性的breg还可以包括使b细胞与一种或多种细胞因子(诸如但不限于:il
‑
4、il
‑
21、il
‑
33、il
‑
2、il
‑
7、il
‑
10、il
‑
21、il
‑
35和baff)接触。在
一些方面中,b细胞首先与il
‑
4接触,然后在il
‑
21存在下培养。细胞因子可以以约10
‑
500iu/ml的浓度存在,诸如约50
‑
200iu/ml,诸如约75
‑
150iu/ml,特别是约100iu/ml。在一些方面中,il
‑
4以约0.1
‑
10ng/ml的浓度存在于扩增培养物中,诸如约1
‑
5ng/ml,例如2、2.5、3、3.5、4或4.5ng/ml或可以是其间衍生的任意范围。在特定方面中,il
‑
21以约10
‑
250ng/ml的浓度存在于扩增培养物中,诸如25
‑
50、50
‑
75、75
‑
125、125
‑
150、150
‑
175、175
‑
225或225
‑
250ng/ml。
[0094]
3.mtor抑制剂
[0095]
mtor抑制剂是一类抑制雷帕霉素的机制靶标(mtor)的药物,其为一种属于磷脂酰肌醇
‑
3激酶(pi3k)相关激酶(pikk)家族的丝氨酸/苏氨酸
‑
特异性蛋白激酶。可以用于本发明方法的示例性mtor抑制剂包括,但不限于:雷帕霉素、依维莫司、替西罗莫司(temsirolimus)、deforolimus、bgt226、sf1126、bez235、gedatolisib和sf1101。在一些方面中,mtor抑制剂是pp42(也称为torkinib)。mtor抑制剂可以以约50
‑
500nm的浓度存在,诸如100
‑
400nm,特别是150、200、250、300或350nm。
[0096]
4.foxo1抑制剂
[0097]
叉头蛋白o1(forkhead box protein o1,foxo1)也称为横纹肌肉瘤中的叉头蛋白,其是人类中由foxo1基因编码的蛋白。foxo1是一种转录因子,在通过胰岛素信号转导进行的糖异生和糖原分解调节中起重要作用,并且对于前成脂肪细胞决定进行脂肪生成也是至关重要的。可以用在本发明的方法中的示例性foxo1抑制剂包括,但不限于,as1842856和as1708727。foxo1抑制剂可以以约50
‑
500ng/ml的浓度存在,诸如100
‑
200、200
‑
300、300
‑
400或400
‑
500ng/ml。
[0098]
5.stat6抑制剂
[0099]
可以用于本发明方法的stat6抑制剂包括,但不限于:as1517499和来氟米特(leflunomide,alx
‑
430
‑
095)。靶向stat6的sh2结构域的小分子肽模拟物在美国专利号6,426,331和pct专利公开号wo2001/083517中公开;二者通过引用结合在本文中。stat6抑制剂可以以约10
‑
250ng/ml的浓度存在,诸如20
‑
50、50
‑
75、75
‑
100、100
‑
150、150
‑
200或200
‑
250ng/ml。
[0100]
6.cpg寡脱氧核苷酸
[0101]
在某些实施方案中,b细胞用cpg核苷酸扩增。cpg寡脱氧核苷酸(odn)是短的单链合成的dna分子,其含有胞嘧啶三磷酸脱氧核苷酸接着是鸟嘌呤三磷酸脱氧核苷酸,其可以作为免疫刺激剂。cpg基序被认为是病原体相关的分子模式(pathogen
‑
associated molecular patterns,pamp),其被在b细胞和树突状细胞上表达的模式识别受体(prr)toll样受体9(tlr9)所识别。
[0102]
为了促进摄入到细胞中,含有cpg的寡核苷酸优选在8
‑
100个碱基的长度范围内。然而,由于较长的核酸在细胞内部降解成寡核苷酸,如果存在充足的免疫刺激性基序,则大于8个核苷酸的任意尺寸(甚至长度为数个kb)的核酸能够诱导本发明所述的免疫反应。优选地,cpg寡核苷酸的尺寸在8
‑
100个核苷酸的范围内,在一些实施方案中,尺寸在8
‑
30个核苷酸的范围内。cpg核酸序列可以如在国际公开号wo2000/06588和wo2000/06588以及美国专利号7,488,490中所公开的;所有这些通过引用结合在本文中。完整的cpg寡核苷酸可以是未甲基化的,或部分可以是未甲基化的但至少5
′
cg 3
′
的c必须是未甲基化的。一个示例
性的cpg寡核苷酸由至少下式所示:5
′
n1x1cgx2n23
′
,其中至少一个核苷酸分开连续的cpg;x1是腺嘌呤、鸟嘌呤或胸腺嘧啶;x2是胞嘧啶、腺嘌呤或胸腺嘧啶;n是任意核苷酸,n1和n2各自是由约0
‑
25个n组成的核酸序列。一种示例性的cpg odn具有序列5'tccat
‑
gacgttcctgatgct 3'(seq id no:1)。另一种示例性的cpg odn是24
‑
mer odn 2006,其能够调节人和小鼠中的免疫反应,并且具有序列:5'
‑
tcgtcgttttgtcgttttgtcgtt
‑
3'(seq id no:2),其中常规字母表示ps连接,粗体字母表示cpg二核苷酸。
[0103]
扩增培养物可以包含一种或多种浓度为0.1
‑
10μg/ml的不同的cpg odn序列,诸如约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、4.5、6、7、8、9或10μg/ml的cpg odn,诸如0.1
‑
2、1
‑
3、2
‑
4、3
‑
6、4
‑
7、5
‑
8、7
‑
9或8
‑
10μg/ml的cpg odn。在具体的方面中,用约3μg/ml的cpg odn处理b细胞。
[0104]
c.遗传工程改造的b细胞
[0105]
本领域技术人员将充分知晓通过标准重组技术构建载体(例如,参见sambrook等人,2001和ausubel等人,1996,二者通过引用结合在本文中)以用于表达本公开内容的抗原受体。载体包括但不限于:质粒、黏粒、病毒(噬菌体、动物病毒和植物病毒)和人工染色体(例如,yac),诸如逆转录病毒载体(例如,衍生自莫洛尼氏鼠白血病病毒载体(momlv)、mscv、sffv、mpsv、snv等),慢病毒载体(例如,衍生自hiv
‑
1、hiv
‑
2、siv、biv、fiv等),腺病毒(ad)载体(包括其能复制型、复制缺陷型和无肠形式),腺相关病毒(aav)载体,猿猴病毒40(sv
‑
40)载体,牛乳头状瘤病毒载体,埃巴病毒载体,疱疹病毒载体,牛痘病毒载体,哈维鼠肉瘤病毒载体,鼠乳房肿瘤病毒载体,劳斯肉瘤病毒载体,细小病毒载体,脊髓灰质炎病毒载体,水疱性口炎病毒载体,maraba病毒载体和b组腺病毒enadenotucirev载体。
[0106]
a.病毒载体
[0107]
本公开内容的某些方面可以提供编码抗原受体的病毒载体。在生成重组病毒载体时,通常用异源(或非天然)蛋白的基因或编码序列替换非必需基因。病毒载体是一类利用病毒序列将核酸且有可能将蛋白引入到细胞中的表达构建体。某些病毒通过受体介导的胞吞作用感染细胞或进入细胞并整合到宿主基因组中并稳定且有效地表达病毒基因的能力已经使得它们成为将外源核酸递送到细胞中(例如,哺乳动物细胞中)的有吸引力的候选物。可以用于递送本发明的某些方面的核酸的病毒载体的非限制性实例记载在下文中。
[0108]
慢病毒是复合逆转录病毒,其除了常见的逆转录病毒基因gag、pol和env之外还含有其他具有调节或结构功能的基因。慢病毒载体在本领域中是公知的(例如,参见美国专利6,013,516和5,994,136)。
[0109]
重组慢病毒载体能够感染未分裂的细胞并且可以用于体内和离体基因转移和核酸序列的表达。例如,美国专利5,994,136记载了能够感染未分裂细胞的重组慢病毒,其中适当的宿主细胞用两个或更多个携带包装功能(即,gag、pol和env,以及rev和tat)的载体转染,该美国专利通过引用结合在本文中。
[0110]
b.调节元件
[0111]
包括在可用于本公开内容的载体中的表达盒尤其含有(以5’至3'方向)可操作地连接至蛋白质编码序列的真核转录启动子、包括间隔序列的剪接信号和转录终止/聚腺苷酸化序列。控制在真核细胞中蛋白质编码基因的转录的启动子和增强子由多个遗传元件组成。细胞机构能够聚集和整合由各元件传达的调节信息,从而允许不同基因演变出不同的、
通常是复合的转录调节模式。例如,在本公开内容的情形中所使用的启动子包括组成型、诱导型和组织特异型启动子。
[0112]
(i)启动子/增强子
[0113]
本文所提供的表达构建体包含驱动抗原受体表达的启动子。启动子一般包含起定位rna合成的起始位点作用的序列。其最佳已知实例为tata盒,但在不具有tata盒的一些启动子(诸如例如哺乳动物末端脱氧核苷酸转移酶基因的启动子和sv40晚期基因的启动子)中,叠加起始位点本身的离散元件有助于固定起始的位置。另外的启动子元件调节转录起始频率。通常,这些位于起始位点上游30110bp的区域中,尽管已显示多个启动子也含有起始位点下游的功能元件。为了使编码序列“处在启动子控制下”,将转录阅读框的转录起始位点的5’端置于所选择的启动子的“下游”(即3’)。“上游”启动子刺激dna的转录并且促进所编码的rna的表达。
[0114]
启动子元件之间的间距通常是灵活的,使得当元件相对于彼此倒置或移动时保留启动子功能。在tk启动子中,启动子元件之间的间距可在活性开始下降之前增加至相距50bp。视启动子而定,个别元件似乎可以合作地或独立地起作用以活化转录。启动子可以或可以不与“增强子”(其是指参与核酸序列的转录活化的顺式作用调节序列)结合使用。
[0115]
启动子可为天然地与核酸序列缔合的一种启动子,如可通过分离位于编码区段和/或外显子上游的5’非编码序列获得。此类启动子可以称为“内源的”。相似地,增强子可为天然地与核酸序列缔合、位于该序列下游或上游的一种增强子。备选地,某些优势将通过将编码核酸区段置于重组或异源启动子(其是指在其天然环境中通常不与核酸序列缔合的启动子)控制下来获得。重组或异源增强子还指在其天然环境中通常不与核酸序列缔合的增强子。此类启动子或增强子可包括其他基因的启动子或增强子,和从任何其他病毒或原核或真核细胞分离的启动子或增强子,和不“天然存在”的启动子或增强子,即含有不同转录调节区的不同元件和/或改变表达的突变。例如,最常用于重组dna构建的启动子包括β
‑
内酰胺酶(青霉素酶)、乳糖和色氨酸(trp
‑
)启动子系统。除了合成地产生启动子和增强子的核酸序列以外,还可结合本文所公开的组合物使用重组克隆和/或核酸扩增技术(包括pcr
tm
)产生序列。此外,预期还可使用引导序列在非核细胞器(例如线粒体、叶绿体等)内的转录和/或表达的控制序列。
[0116]
自然地,使用有效引导dna区段在选择用于表达的细胞器、细胞类型、组织、器官或生物体中的表达的启动子和/或增强子很重要。分子生物学领域的技术人员一般知晓使用启动子、增强子和细胞类型组合用于蛋白质表达(参见例如sambrook等人1989,其通过引用结合在本文中)。所用启动子可以是组成型的、组织特异型的、诱导型的和/或可用于在合适条件下引导所引入的dna区段的高水平表达,例如有利于大规模产生重组蛋白质和/或肽。启动子可为异源性或内源性的。
[0117]
另外,任何启动子/增强子组合(按照例如真核启动子数据库(eukaryotic promoter data base,epdb),通过万维网epd.isb
‑
sib.ch/访问)也可用于驱动表达。另一个可能实施方案为使用t3、t7或sp6细胞质表达系统。若提供适当的细菌聚合酶(作为递送复合物的一部分或作为另外的基因表达构建体),则真核细胞可支持从某些细菌启动子的细胞质转录。
[0118]
启动子的非限制性实例包括早期或晚期病毒启动子,诸如sv40早期或晚期启动
子、巨细胞病毒(cmv)即时早期启动子、劳斯肉瘤病毒(rsv)早期启动子;真核细胞启动子,诸如β肌动蛋白启动子、gadph启动子、金属硫蛋白启动子;和串联的反应元件启动子,诸如环状amp反应元件启动子(cre)、血清反应元件启动子(sre)、佛波醇酯启动子(tpa)和靠近最小tata盒的反应元件启动子(tre)。也有可能使用人类生长激素启动子序列(例如genbank登录号x05244,核苷酸283
‑
341所描述的人类生长激素最小启动子)或小鼠乳房肿瘤启动子(可购自atcc,目录号atcc 45007)。在某些实施方案中,启动子为cmv ie、dectin
‑
1、dectin
‑
2、人类cd11c、f4/80、sm22、rsv、sv40、ad mlp、β
‑
肌动蛋白、mhc i类或mhc ii类启动子,然而适用于驱动治疗性基因表达的任何其他启动子可以适用于实施本发明。
[0119]
在某些方面中,本公开内容的方法还涉及增强子序列,即增加启动子活性且具有以顺式方式起作用的潜能的核酸序列,且不考虑核酸序列的方向,甚至跨越相对较长距离(与靶启动子相距多达几千个碱基)。然而,增强子功能不一定受限于这样长的距离,因为其也可非常接近所给定的启动子起作用。
[0120]
(ii)起始信号和连接表达
[0121]
特定起始信号也可用于本公开内容中所提供的表达构建体中用以编码序列的有效翻译。这些信号包括atg起始密码子或相邻序列。可能需要提供包括atg起始密码子的外源性翻译控制信号。本领域普通技术人员将容易地能够判定此情形且提供必需的信号。熟知起始密码子必须在所要编码序列的阅读框的“框内”,以确保整个插入物的翻译。外源性翻译控制信号和起始密码子可为天然或合成的。表达效率可通过包括适当转录增强子元件来增强。
[0122]
在某些实施方案中,使用内部核糖体进入位点(ires)元件的用途产生多基因或多顺反子信息。ires元件能够绕过5’甲基化封端(cap)依赖性翻译的核糖体扫描模型且在内部位点开始翻译。已描述来自小核糖核酸病毒家族的两个成员(脊髓灰质炎和脑心肌炎)的ires元件以及来自哺乳动物信息的ires。ires元件可连接至异源开放阅读框。多个开放阅读框可转录在一起,各自通过ires分隔,产生多顺反子信息。借助于ires元件,各开放阅读框可接近核糖体以便有效翻译。可以使用单一启动子/增强子转录单一信息来有效表达多个基因。
[0123]
另外,某些2a序列元件可用于在本公开内容中所提供的构建体中产生基因的连接表达或共表达。例如,裂解序列可用于通过连接开放阅读框以形成单一顺反子来共表达基因。示例性裂解序列为f2a(口蹄疫病毒2a)或“2a样”序列(例如,thosea asigna病毒2a;t2a)。
[0124]
(iii)复制起点
[0125]
为了在宿主细胞中繁殖载体,其可含有一个或多个复制位点起点(常常称为“ori”),例如,对应于如上文所描述的ebv的orip、或在程序化中具有类似或提高功能的经基因工程改造的orip的核酸序列,其为复制起始的特定核酸序列。备选地,可以采用如上文所述的其他染色体外复制病毒或自主复制序列(ars)的复制起点。
[0126]
c.选择和可筛选标记物
[0127]
在一些实施方案中,含有本公开内容的构建体的细胞可通过在表达载体中包括标记物进行体外或体内鉴别。此类标记物将赋予细胞可鉴别的变化,允许容易地鉴别含有所述表达载体的细胞。一般而言,选择标记物是赋予允许选择的特性的一种标记物。阳性选择
标记物是该标记物的存在允许其选择的一种标记物,而阴性选择标记物是其存在阻止其选择的一种标记物。阳性选择标记物的实例为抗药性标记物。
[0128]
通常包含药物选择标记物有助于克隆和鉴定转化体,例如,赋予对新霉素、嘌呤霉素、潮霉素、dhfr、gpt、博来霉素(zeocin)和组氨醇的抗性的基因是有用的选择标记物。除了赋予允许基于条件的实施区分转化体的表型的标记物之外,还考虑了其他类型的标记物,包括可筛选标记物,例如以比色分析为基础的gfp。备选地,可以使用可筛选的酶作为阴性选择标记物,例如单纯疱疹病毒胸苷激酶(tk)或氯霉素乙酰转移酶(cat)。本领域技术人员还知晓如何使用免疫标记物,可能与facs分析结合使用。所使用的标记物被认为并不重要,只要它能够与编码基因产物的核酸同时表达即可。选择和可筛选标记物的其他例子是本领域技术人员公知的。
[0129]
d.核酸递送的其他方法
[0130]
除病毒递送编码抗原受体的核酸以外,以下为将重组基因递送至给定宿主细胞的其他方法,且由此被视为在本公开内容中。
[0131]
如本文所描述或如本领域普通技术人所知晓的,可使用任何适合的用于转化细胞的核酸递送方法来将诸如dna或rna的核酸引入本公开内容的免疫细胞中。此类方法包括但不限于:直接递送dna,诸如通过离体转染、通过注射,包括显微注射;通过电穿孔;通过磷酸钙沉淀;通过使用deae
‑
葡聚糖接着使用聚乙二醇;通过直接声波加载;通过脂质体介导的转染和受体介导的转染;通过微弹轰击;通过与碳化硅纤维一起进行搅拌;通过农杆菌介导的转化;通过干化/抑制介导的dna摄取;以及这些方法的任何组合。经由应用诸如这些方法的技术,可以稳定或暂时地转化一个或多个细胞器、一个或多个细胞、一个或多个组织或一个或多个生物体。
[0132]
d.嵌合抗原受体(car)和改造的tcr
[0133]
可以基因工程改造breg以表达抗原受体,诸如改造的tcr和/或嵌合抗原受体(car)。例如,可以修饰b细胞以表达具有针对癌症抗原的抗原特异性的细胞受体。可以向b细胞中加入多个car和/或多个改造的tcr,诸如针对不同的抗原。
[0134]
在一些实施方案中,car包含特异性结合抗原的细胞外抗原识别结构域。在一些实施方案中,抗原是在细胞表面上表达的蛋白质。在一些实施方案中,car是tcr样car,抗原是加工的肽抗原,诸如细胞内蛋白质的肽抗原,其如同tcr一样在主要组织相容性复合物(mhc)分子的情形中在细胞表面上被识别。
[0135]
在一些实施方案中,嵌合抗原受体包含:a)细胞内信号传导结构域,b)跨膜结构域,和c)包含抗原结合区的细胞外结构域。
[0136]
在一些实施方案中,经改造的抗原受体包括car,所述car包括活化或刺激性car、共刺激性car(参见wo2014/055668)和/或抑制性car(icar,参见fedorov等人,2013)。car通常包括连接至(在一些方面中经由接头和/或一个或多个跨膜结构域)一种或多种细胞内信号传导成分的细胞外抗原(或配体)结合结构域。此类分子通常模仿或近似通过天然抗原受体的信号、通过此类受体与共刺激性受体的组合的信号和/或通过单独的共刺激性受体的信号。
[0137]
本公开内容的某些实施方案涉及核酸的用途,包括编码抗原特异性嵌合抗原受体(car)多肽的核酸,包括已经人源化以降低免疫原性的car(hcar),所述car包含细胞内信号
传导结构域、跨膜结构域和包含一个或多个信号传导基序的细胞外结构域。在某些实施方案中,car可识别包含一种或多种抗原之间的共享空间的表位。在某些实施方案中,结合区可包含单克隆抗体的互补决定区、单克隆抗体的可变区和/或其抗原结合片段。在另一实施方案中,该特异性来源于结合至受体的肽(例如细胞因子)。
[0138]
预期人类car核酸可以是用于增强用于人类患者的细胞免疫疗法的人类基因。在一个特定实施方案中,本发明包括全长car cdna或编码区。抗原结合区或抗原结合结构域可以包含源于特定人类单克隆抗体的单链可变片段(scfv)的v
h
和v
l
链的片段,诸如美国专利7,109,304中记载的那些,该专利通过引用并入本文中。该片段也可以是人类抗原特异性抗体的任何数目的不同抗原结合结构域。在更特定的实施方案中,该片段是由针对用于在人类细胞中表达的人类密码子应用而优化的序列编码的抗原特异性scfv。
[0139]
重排可以是多聚的,诸如双抗体或多聚体。多聚体最可能由轻链和重链的可变部分交叉配对为双抗体而形成。构建体的铰链部分可具有多种选择,从完全缺失至保留第一半胱氨酸、至脯氨酸取代而非丝氨酸取代、至截断至第一半胱氨酸。fc部分可缺失。稳定和/或二聚化的任何蛋白质均可供用于此目的。人们可以仅使用fc结构域中的一种,例如来自人类免疫球蛋白的ch2或ch3结构域。还可以使用已经修饰的人类免疫球蛋白的铰链区、ch2区和ch3区以改良二聚化。人们还可以仅使用免疫球蛋白的铰链部分。人们还可使用cd8α的部分。
[0140]
在一些实施方案中,car核酸包含编码其他共刺激性受体的序列,所述共刺激性受体诸如跨膜结构域和经修饰的cd28细胞内信号传导结构域。其他共刺激性受体包括(但不限于)cd28、cd27、ox
‑
40(cd134)、dap10、dap12和4
‑
1bb(cd137)中的一种或多种。除了通过cd3ζ引发的初级信号以外,通过插入到人类car中的人类共刺激性受体提供的额外信号对于nk细胞的完全活化具有重要性且可以帮助改良过继免疫疗法的体内持久性和治疗成功性。
[0141]
在一些实施方案中,car经构建具有针对特定抗原(或标记物或配体)的特异性,所述特定抗原诸如在待由过继疗法靶向的特定细胞类型中表达的抗原,例如癌症标记物,和/或意欲诱导抑制反应的抗原,诸如在正常或非病变细胞类型上表达的抗原。因此,car在其细胞外部分中通常包含一种或多种抗原结合分子,诸如一种或多种抗原结合片段、结构域或部分,或一种或多种抗体可变结构域和/或抗体分子。在一些实施方案中,car包括抗体分子的一个或多个抗原结合部分,诸如来源于单克隆抗体(mab)的可变重链(vh)和可变轻链(vl)的单链抗体片段(scfv)。
[0142]
在嵌合抗原受体的某些实施方案中,受体的抗原特异性部分(其可称为包含抗原结合区的细胞外结构域)包含肿瘤相关抗原或病原体特异性抗原结合结构域。抗原包括通过模式识别受体(诸如dectin
‑
1)识别的碳水化合物抗原。肿瘤相关抗原可以是任何种类的,只要其在肿瘤细胞的细胞表面上表达即可。肿瘤相关抗原的示例性实施方案包括cd19、cd20、癌胚抗原、甲胎蛋白、ca
‑
125、muc
‑
1、cd56、egfr、c
‑
met、akt、her2、her3、上皮肿瘤抗原、黑素瘤相关抗原、突变的p53、突变的ras等。在某些实施方案中,当存在低量的肿瘤相关抗原时,car可以与细胞因子共表达以改良持久性。例如,car可与il
‑
15共表达。
[0143]
编码嵌合受体的开放阅读框的序列可以获自基因组dna来源、cdna来源,或可以经合成(例如经由pcr合成),或其组合。取决于基因组dna的尺寸和内含子的数目,可能需要使
用cdna或其组合,原因在于:发现内含子使mrna稳定。此外,可进一步有利地使用内源性或外源性非编码区来使mrna稳定。
[0144]
预期嵌合构建体可以作为裸dna或在合适的载体中引入至免疫细胞中。通过电穿孔使用裸dna稳定转染细胞的方法为本领域中已知的。参见例如美国专利号6,410,319。裸dna一般指编码嵌合受体的dna,该dna以对于表达适当的定向包含在质粒表达载体中。
[0145]
备选地,病毒载体(例如逆转录病毒载体、腺病毒载体、腺相关病毒载体或慢病毒载体)可以用于将嵌合构建体引入至免疫细胞中。根据本发明方法使用的适合的载体在免疫细胞中是非复制的。已知大量载体是基于病毒的,其中维持在细胞中的病毒的拷贝数足够低以维持细胞存活力,诸如例如基于hiv、sv40、ebv、hsv或bpv的载体。
[0146]
在一些方面中,抗原特异性结合或识别成分连接至一个或多个跨膜和细胞内信号传导结构域。在一些实施方案中,car包括融合至car的细胞外结构域的跨膜结构域。在一个实施方案中,使用与car中的结构域之一天然缔合的跨膜结构域。在一些情况下,跨膜结构域经选择或由氨基酸取代修饰以避免此类结构域结合至相同或不同表面膜蛋白质的跨膜结构域,以使与受体复合物的其他成员的相互作用降至最低。
[0147]
在一些实施方案中,跨膜结构域来源于天然或合成来源。在天然来源的情况下,在一些方面中,结构域来源于任何膜结合的蛋白或跨膜蛋白。跨膜区包括来源于以下(即,至少包含以下的一个或多个跨膜区)的那些:t细胞受体的α、β或ζ链,cd28,cd3ζ,cd3ε,cd3γ,cd3δ,cd45,cd4,cd5,cd8,cd9,cd 16,cd22,cd33,cd37,cd64,cd80,cd86,cd 134,cd137,cd154,icos/cd278,gitr/cd357,nkg2d和dap分子。备选地,在一些实施方案中,跨膜结构域为合成的。在一些方面中,合成的跨膜结构域主要包含疏水性残基,诸如亮氨酸和缬氨酸。在一些方面中,将在合成的跨膜结构域的各末端处发现苯丙氨酸、色氨酸和缬氨酸的三联体。
[0148]
在某些实施方案中,本文所公开的用于遗传修饰免疫细胞的平台技术包括:(i)使用电穿孔装置(例如核转染仪)的非病毒基因转移,(ii)经由胞内结构域(例如cd28/cd3
‑
ζ、cd137/cd3
‑
ζ或其他组合)传导信号的car,(iii)具有可变长度的胞外结构域的car,所述胞外结构域将抗原识别结构域连接至细胞表面,以及在一些情况下,(iv)能够稳健地且在数值上扩增car
+
免疫细胞的衍生自k562的人工抗原呈递细胞(aapc)。
[0149]
2.自杀基因
[0150]
本公开内容的t细胞的car和/或tcr可包含一种或多种自杀基因。本文所用的术语“自杀基因”定义为可以用来选择性靶向细胞进行杀死的基因。例如,在施用前药后,自杀基因实现基因产物向杀死其宿主细胞的化合物的转变。可使用的自杀基因/前药组合的实例为单纯疱疹病毒
‑
胸苷激酶(hsv
‑
tk)和更昔洛韦、阿昔洛韦或fiau;氧化还原酶和环己酰亚胺;胞嘧啶脱氨酶和5
‑
氟胞嘧啶;胸苷激酶胸苷酸激酶(tdk::tmk)和azt;和脱氧胞苷激酶和胞嘧啶阿拉伯糖苷。
[0151]
可使用大肠杆菌(e.coli)嘌呤核苷磷酸化酶,一种所谓的自杀基因,其将前药6
‑
甲基嘌呤脱氧核苷转化为有毒的嘌呤6
‑
甲基嘌呤。与前药疗法一起使用的自杀基因的其他实例是大肠杆菌胞嘧啶脱氨酶基因和hsv胸苷激酶基因。
[0152]
示例性自杀基因包括cd20、cd52、egfrv3或诱导型胱天蛋白酶9。在一个实施方案中,egfr变体iii(egfrv3)的截短形式可用作可通过西妥昔单抗(cetuximab)消除的自杀抗
原。可用于本公开内容中的本领域已知的其他自杀基因包括:嘌呤核苷磷酸化酶(pnp)、细胞色素p450酶(cyp)、羧肽酶(cp)、羧酸酯酶(ce)、硝基还原酶(ntr)、鸟嘌呤核糖基转移酶(xgrtp)、糖苷酶、甲硫氨酸
‑
α,γ
‑
裂解酶(met)和胸苷磷酸化酶(tp)。
[0153]
3.基因表达的修饰
[0154]
在一些实施方案中,本公开内容的细胞经修饰以具有某些基因(诸如糖皮质激素受体、tgfβ受体(例如,tgfβ
‑
rii)和/或cish)的改变的表达。在一个实施方案中,所述细胞可经修饰以表达显性阴性tgfβ受体ii(tgfβriidn),其可作为细胞因子贮库起作用以消耗内源tgfβ。
[0155]
在一些实施方案中,改变的基因表达通过实现基因的破坏,诸如敲除、插入、错义或移码突变(诸如双等位基因移码突变)、所有或部分基因(例如,一个或多个外显子或其部分)的缺失、和/或敲入进行。例如,改变的基因表达可通过序列特异性或靶向性核酸酶,包括dna结合靶向性核酸酶(诸如锌指核酸酶(zfn)和转录活化子样效应子核酸酶(talen)),和专门设计以靶向基因或其部分的序列的rna指导的核酸酶(诸如crispr相关核酸酶(cas))实现。
[0156]
iii.使用方法
[0157]
本公开内容的某些实施方案涉及使用本文提供的breg群体治疗或预防炎性或免疫介导的病症的方法。所述方法包括向受试者施用治疗有效量的breg,由此治疗或预防所述受试者中的炎性或免疫介导的病症。
[0158]
根据本发明方法所述的breg具有多种潜在用途,包括实验和治疗用途。具体而言,考虑所述细胞群体特别有效地用于抑制不需要的或不适当的免疫反应。在此类方法中,从患者取出少量b细胞,然后在将其重新输注回有需要的个体之前进行离体操作和扩增。可以以这种方式治疗的疾病的实例是其中需要抑制的免疫活性的自身免疫性疾病和病况,例如,用于同种异体移植耐受性。治疗方法可以包括提供哺乳动物,从所述哺乳动物获得b细胞;按照上文所述的本发明方法离体扩增b细胞;并且将扩增的breg施用给待治疗的哺乳动物。
[0159]
在一个实施方案中,给患有自身免疫性疾病或炎性疾病(例如,与减少的il
‑
10水平相关的)的受试者施用breg群体。在该实施方案的一个方面中,b细胞和/或t细胞群体分离自患者本身,即,受试者即为供体。在该实施方案的另一方面中,b细胞群体分离自不是受试者的供体。在该实施方案的一个方面中,b细胞群体从几个供体汇集,诸如从几个供体的脐带血汇集。按照该实施方案,给有需要的受试者施用调节性b细胞群体导致患者中增加的il
‑
10产生水平,足以控制、减少或消除被治疗的疾病的症状。
[0160]
在一些实施方案中,在将breg群体引入到受试者中之前,使breg群体与对病症(诸如自身免疫性病症)特异性的抗原接触。例如,在施用至受试者之前,可以使调节性细胞暴露于自身抗原,诸如胰岛素或gad
‑
65,从而预防或治疗糖尿病。
[0161]
在一个实施方案中,受试者患有自身免疫性疾病。自身免疫性疾病的非限制性实例包括:斑秃,强直性脊柱炎,抗磷脂综合征,自身免疫性艾迪生病,肾上腺的自身免疫性疾病,自身免疫性溶血性贫血,自身免疫性肝炎,自身免疫性卵巢炎和睾丸炎,自身免疫性血小板减少症,白塞氏病,大疱性类天疱疮,心肌病,乳糜泻性皮炎(celiac spate
‑
dermatitis),慢性疲劳免疫功能障碍综合症(cfids),慢性炎症性脱髓鞘性多发性神经病,
churg
‑
strauss综合征,瘢痕性类天疱疮,crest综合征,冷凝集素病,克罗恩病,盘状狼疮,原发性混合性冷球蛋白血症,纤维肌痛
‑
纤维肌炎,肾小球肾炎,格雷夫斯病,格林
‑
巴利病,桥本氏甲状腺炎,特发性肺纤维化,特发性血小板减少性紫癜(itp),iga神经病,青少年关节炎,扁平苔藓,红斑性狼疮,美尼尔病,混合性结缔组织病,多发性硬化,1型或免疫介导的糖尿病,重症肌无力,肾病综合征(例如微小病变,局灶性肾小球硬化或膜性肾病),寻常型天疱疮,恶性贫血,结节性多动脉炎,多发性软骨炎,多腺综合征,风湿性多发性肌痛,多发性肌炎和皮肌炎,原发性无丙种球蛋白血症,原发性胆汁性肝硬化,银屑病,银屑病关节炎,雷诺现象,雷特综合征,类风湿性关节炎,结节病,硬皮病,干燥综合征,僵人综合征,系统性红斑狼疮,红斑狼疮,溃疡性结肠炎,葡萄膜炎,血管炎(例如结节性多动脉炎,大动脉炎,颞动脉炎/巨细胞性动脉炎或疱疹样皮炎性血管炎),白癜风和韦格纳肉芽肿病。因此,可以使用本文公开的方法治疗的自身免疫性疾病的一些实例包括但不限于多发性硬化症、类风湿性关节炎、系统性红斑狼疮、i型糖尿病、克罗恩病、溃疡性结肠炎、重症肌无力、肾小球肾炎、强直性脊柱炎、血管炎和/或银屑病。受试者还可以患有过敏性病症,例如哮喘。
[0162]
在另一个实施方案中,受试者是移植的器官或干细胞的接受者,并且扩增的调节性细胞(例如,breg)用于预防和/或治疗排斥。在具体的实施方案中,受试者患有移植物抗宿主病或有发展该疾病的风险。gvhd是使用或含有来自相关或不相关供体的干细胞的任何移植的可能并发症。存在两种gvhd:急性的和慢性的。急性gvhd出现在移植后的前三个月内。急性gvhd的征兆包括手和脚上出现可能扩散并变得更严重的微红色的皮疹,并且具有皮肤剥落或起泡。急性gvhd还可能影响胃和肠,在这种情况下会出现痉挛、恶心和腹泻。皮肤和眼睛发黄(黄疸)表明急性gvhd已经影响肝脏。慢性gvhd根据其严重程度进行分级:阶段/等级1是轻微的;阶段/等级4是严重的。慢性gvhd在移植后三个月或之后发展。慢性gvhd的症状与急性gvhd的症状相似,但此外,慢性gvhd还可能影响眼睛中的粘液腺、口腔中的唾液腺以及润滑胃粘膜和肠道的腺体。可以利用本文公开的任何调节性b细胞群体。移植器官的实例包括实体器官移植物,例如肾脏、肝脏、皮肤、胰腺、肺和/或心脏,或细胞移植物,例如胰岛、肝细胞、成肌细胞、骨髓或造血或其他干细胞。移植物可以是复合移植物,例如面部的组织。调节性b细胞(诸如免疫抑制性cd19
+
细胞)可以在移植之前、与移植同时或在移植之后施用。在一些实施方案中,调节性b细胞在移植前施用,例如在移植前至少1小时、至少12小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少1周、至少2周、至少3周、至少4周或至少1个月施用。在一个具体的非限制性实例中,治疗有效量的调节性b细胞的施用在移植前3
‑
5天进行。
[0163]
在施用之前,可以用对所移植的材料特异性的抗原致敏施用给接收移植物的患者的调节性细胞亚组。按照该实施方案,移植物接受者将具有降低的针对所移植的材料的免疫/炎性反应,并且因此使排斥所移植的组织的可能性降至最低。类似地,关于移植物抗宿主病的治疗,可以用对宿主特异性的抗原致敏调节性细胞亚组。按照该实施方案,接受者将具有降低的针对自身抗原的免疫/炎性反应。
[0164]
在另一个实施方案中,给受试者施用治疗有效量的调剂性b细胞(例如,breg)治疗或抑制所述受试者中的炎症。因此,所述方法包括向受试者施用治疗有效量的调节性细胞,以抑制炎性过程。炎性病症的实例包括,但不限于:哮喘,脑炎,炎性肠病,慢性阻塞性肺病(copd),过敏性病症,感染性休克,肺纤维化,未分化型脊椎关节病变,未分化型关节病变,
关节炎,炎性骨质溶解,和由慢性病毒或细菌感染导致的慢性炎症。本文公开的方法还可以用于治疗过敏性病症。
[0165]
在需要炎症的免疫抑制或抑制时,例如,在疾病或炎症的第一征兆或症状时,可以利用调节性细胞的施用。这些可以是一般征兆或症状,诸如疼痛、水肿、体温升高,或可以是与受影响的一个或多个器官的功能失调相关的特异性的征兆或症状。例如,在肾移植排斥中,可能存在升高的血清肌酸酐,而在gvhd中,可能存在皮疹,在哮喘中,可能存在呼吸短促和喘息。
[0166]
施用调节性细胞还可以用于预防感兴趣受试者中的免疫相关的疾病。例如,可以在移植之前对将成为移植接受者的受试者施用调节性细胞。在另一个实例中,将调节性细胞施用给接受同种异体骨髓移植而没有进行细胞耗竭的受试者。在另一个实例中,可以给具有糖尿病家族史的受试者施用调节性细胞。在其他实例中,给哮喘患者施用调节性细胞,以预防哮喘发作。在一些实施方案中,在出现症状之前给受试者施用治疗有效量的调节性细胞。与接受不包括调节性细胞的其他疗法的患者相比,调节性细胞的施用导致后续免疫事件或症状(诸如哮喘发作)减少的发生率或降低的严重性,或改善的患者生存期。
[0167]
治疗的有效性可以通过本领域技术人员已知的多种方法测量。在一个实施方案中,利用白细胞计数(wbc)来确定受试者免疫系统的反应性。wbc测量受试者中白细胞的数量。利用本领域公知的方法,将受试者血液样品中的白细胞与其他血液细胞分离并进行计数。白细胞的正常值为约4,500至约10,000个白细胞/μl。较低数量的白细胞可能指示受试者中免疫抑制的状态。
[0168]
在另一个实施方案中,受试者中的免疫抑制可以使用t淋巴细胞计数来测定。使用本领域公知的方法,将受试者血液样品中的白细胞与其他血液细胞分离。使用本领域的标准方法,诸如例如免疫荧光或facs,将t淋巴细胞与其他白细胞区分开。减少数量的t细胞或特定t细胞群体可以用作免疫抑制的量度。与治疗前t细胞数量(或特定群体中的细胞数量)相比,t细胞数量的减少或在特定t细胞群体中的减少可以用于指示已经诱导了免疫抑制。
[0169]
在另外的实施方案中,进行测试以测量t细胞活化、增殖或细胞因子反应,包括针对特定抗原的细胞因子反应。在一些实例中,可以测量来自受试者的样品中的treg或breg细胞的数量。在另外的实例中,测量来自受试者的样品中的细胞因子,诸如il
‑
10。
[0170]
在其他实例中,为了评估炎症,可以测量炎症状态的中性粒细胞浸润。为了评估中性粒细胞浸润,可以测量髓过氧化物酶活性。髓过氧化物酶是存在于多形核白细胞和单核细胞的嗜天青颗粒中的血红素蛋白。其催卤化物离子氧化成其各自的次卤酸,吞噬细胞利用次卤酸进行微生物杀伤。因此,组织中髓过氧化物酶活性的减少反映减少的中性粒细胞浸润,并且可以作为炎症抑制的量度。
[0171]
在另一个实例中,对受试者的有效治疗可以通过测量受试者中的细胞因子水平进行评估。体液或细胞样品中的细胞因子水平通过常规方法测定。例如,可以使用免疫斑点测定,诸如酶联免疫斑点或“elispot”测定。免疫斑点测定是在单细胞水平上检测细胞因子分泌的高度灵敏的定量测定。免疫斑点法和应用在本领域中是公知的,并且例如记述在ep 957359中。标准免疫斑点测定的变化在本领域中是公知的,并且可以用于检测本公开内容的方法中细胞因子产生的改变(例如,参见美国专利号5,939,281和美国专利号6,218,132)。
[0172]
在另一个实施方案中,给受试者施用治疗有效量的刺激的调节性b细胞诱导调节性t细胞(诸如cd4
+
cd25
+
或cd4+foxp3+抑制性t细胞)的产生或活性。在另一些实施方案中,施用治疗有效量的刺激的调节性b细胞减少cd4
+
和/或cd8
+
t细胞的增殖。在另一些实施方案中,施用治疗有效量的刺激的调节性b细胞减少受试者非调节性b细胞产生的抗体的产量,所述非调节性b细胞参与免疫介导的疾病。在另一些实施方案中,调节性b细胞可以抑制炎性细胞的流入或先天性免疫细胞介导的损伤。因此,可以测量所有这些细胞类型。在另一个实施方案中,可以测量细胞因子产生。
[0173]
可以使用本领域公知的多种方法评价对增殖的抑制。在一个实施方案中,通过测量[3h]
‑
胸苷掺入定量细胞增殖。增殖的细胞将标记的dna前体掺入到新合成的dna中,使得通过液闪计数测得的掺入量成为细胞增殖的相对量度。在另一个实施方案中,在增殖测定中使用胸苷类似物5
‑
溴
‑2′‑
脱氧尿苷(brdu)定量细胞增殖。brdu以与胸苷相似的方式掺入细胞dna中,并且通过流式细胞术使用抗
‑
brdu mab定量。
[0174]
治疗有效量的调节性b细胞可以通过多种途径施用,包括肠胃外施用,例如静脉内、腹膜内、肌内、胸骨内或关节内注射或输注。
[0175]
用于诱导免疫抑制或治疗或抑制炎症的调节性细胞的治疗有效量是在被治疗的受试者中达到期望效果的量。例如,这可以是抑制进展或引起自身免疫或同种免疫疾病的消退所必需的或能够缓解由自身免疫疾病引起的症状(例如疼痛和炎症)的调节性细胞的量。它可能是缓解与炎症相关的症状(例如疼痛、水肿和体温升高)所必需的量。它也可以是减少或防止移植的器官的排斥所必需的量。
[0176]
可以以与疾病相一致的治疗方案施用调节性细胞群体,例如在一到几天内单次或几次剂量以改善疾病状态或在延长的时间内的定期剂量以抑制疾病进展并预防疾病复发。制剂中使用的精确剂量还取决于施用途径以及疾病或病症的严重性,并且应根据从业者的判断和每个患者的情况来决定。调节性细胞的治疗有效量将取决于所治疗的受试者、病痛的严重程度和类型以及施用方式。在一些实施方案中,可用于治疗人受试者的剂量范围为至少3.8
×
104、至少3.8
×
105、至少3.8
×
106、至少3.8
×
107、至少3.8
×
108、至少3.8
×
109、或至少3.8
×
10
10
个调节性细胞/m2。在某些实施方案中,用于治疗人受试者的剂量范围为约3.8
×
109至约3.8
×
10
10
个调节性细胞/m2。在另外的实施方案中,调节性细胞的治疗有效量可以为约5
×
106个细胞/kg体重至约7.5
×
108个细胞/kg体重,例如约2
×
107个细胞至约5
×
108个细胞/kg体重,或约5
×
107个细胞至约2
×
108个细胞/kg体重。调节性细胞的确切数量由本领域技术人员根据受试者的年龄、体重、性别和生理状况来容易地确定。可以从由体外或动物模型测试系统得出的剂量反应曲线外推得出有效剂量。
[0177]
扩增的调节性细胞可以与一种或多种其他治疗剂组合施用以治疗免疫介导的病症。组合疗法可包括但不限于一种或多种抗微生物剂(例如,抗生素、抗病毒剂和抗真菌剂),抗肿瘤剂(例如,氟尿嘧啶,甲氨蝶呤,紫杉醇,氟达拉滨,依托泊苷,阿霉素或长春新碱),免疫消耗剂(例如氟达拉滨,依托泊苷,阿霉素或长春新碱),免疫抑制剂(例如,硫唑嘌呤或糖皮质激素,例如地塞米松或泼尼松),抗炎剂(例如,糖皮质激素,例如氢化可的松、地塞米松或泼尼松,或非甾体抗炎剂,例如乙酰水杨酸、布洛芬或萘普生钠),细胞因子(例如白介素10或转化生长因子
‑
β),激素(例如雌激素)或疫苗。另外,可以施用免疫抑制剂或致耐受剂,包括但不限于钙依赖磷酸酶抑制剂(例如,环孢菌素和他克莫司);mtor抑制剂(例
如,雷帕霉素);霉酚酸酯,抗体(例如识别cd3、cd4、cd40、cd154、cd45、ivig或b细胞);化疗剂(例如,甲氨蝶呤,苏消安,白消安);辐照;或趋化因子,白介素或其抑制剂(例如baff,il
‑
2,抗il
‑
2r,il
‑
4,jak激酶抑制剂)。取决于所需的效果,可以在施用调节性b细胞之前、期间或之后施用此类另外的药剂。细胞和试剂的这种施用可以通过相同的途径或通过不同的途径,并且可以在相同的部位或在不同的部位施用。
[0178]
iv.试剂盒
[0179]
在一些实施方案中,提供可以包括例如一种或多种用于产生调节性免疫细胞的介质和成分的试剂盒。所述制剂可以包含因子混合物,其采用适于与b细胞组合的形式。适当地,试剂系统可以包装在水性介质中或采用冻干形式。试剂盒的容器装置通常包括至少一个小瓶、测试管、烧瓶、瓶子、注射器或其他容器装置,在其中可以放置成分,优选地,适当地等分所述成分。在试剂盒中存在多于一种成分时,试剂盒还通常包含第二、第三或其他额外的容器,在所述容器中可以分开放置额外的成分。然而,成分的多种组合可以包含在一个小瓶中。试剂盒的成分可以作为干粉提供。当试剂和/或成分作为干粉提供时,粉剂可以通过添加适当的溶剂进行重建。考虑所述溶剂也可以提供在另一个容器装置中。试剂盒还通常包括用于容纳一种或多种试剂盒成分的装置,采用封闭限制以用于商业销售。此类容器可以包括注塑或吹塑塑料容器,在所述塑料容器中保留需要的小瓶。试剂盒还可以包括使用说明书,诸如打印的或电子形式,诸如数字化形式。
[0180]
v.实施例
[0181]
包括以下实施例以证明本发明的具体实施方案。本领域技术人员应该理解,以下实施例中公开的技术代表本发明人发现的在本发明方法的实践中发挥良好作用的技术,因此可以认为构成本发明实践的优选方式。然而,根据本公开内容,本领域技术人员应当理解,可以在不背离本发明的精神和范围的情况下在所公开的特定实施方案中进行许多改变,并且仍可获得类似或相似的结果。
[0182]
实施例1
–
扩增调节性b细胞
[0183]
关于扩增,使用来自miltenyi的b细胞分离试剂盒(130
‑
091
‑
151)从脐带血或外周血分离b细胞。通过流式细胞术分析b细胞的纯度,以证实多于90%的b细胞。将b细胞用cpg odn 2006(cpg)(3μg/ml,hycult biotech)、抗
‑
igm+igg(10μg/ml,jackson immunoresearch)和il
‑
2(100iu/ml,peprotech)活化40
‑
48小时。然后,在伴有il2(50iu/ml)和il4(4ng/ml)的其他外源支持下用mmlv逆转录病毒(ltr
‑
hcd40l
‑
2a
‑
hil21
‑
ltr)转导b细胞(图1)。在转导后第2
‑
3天表征转导效率。
[0184]
根据细胞数量和存活力,在第7
‑
14天进行功能研究。在培养之前,将磁力分离的cd4
+
t细胞用2μm羧基荧光素琥珀酰亚胺酯(cfse)(ebioscience)染色。将磁力分离的cd4
+
t细胞以105个细胞/孔铺板在96孔平底板上并用或不用抗
‑
cd3/cd28 dynabeads(分别为阳性对照和阴性对照)刺激。以1:1或1:2比率加入约105个hcd40l/hil21
‑
转导的b细胞。将b细胞和cfse
‑
标记的cd4
+
t细胞共培养48小时。添加乙酸肉豆蔻佛波醇(50ng/ml)/离子霉素(500ng/ml)(pma/iono)和布雷非德菌素a(bfa)(10μg/ml)(均购自sigma
‑
aldrich,st louis,mo,usa)持续最后4小时。收集细胞,并用抗
‑
ifn
‑
γ(b27;bd)和tnf
‑
α(mab11;invitrogen)细胞内染色。通过计算分裂指数分析cd4
+
t细胞增殖。在cd40l/hil21
‑
转导的b细胞存在下的培养物抑制cd4
+
t细胞增殖,通过在不同t:b细胞比率以cfse稀释进行评估
(图2)。
[0185]
b细胞分离自pbmc,用cpg odn 2006(cpg)和cd40l活化48小时,然后用可以过表达cd40l和il21的病毒上清液转导。图4a证明转导效率。绝对b细胞数量随时间增加(图4b)。
[0186]
分离cd4+t细胞并与105个活化或静息b细胞和抗
‑
cd3/cd28dynabeads一起铺板到96孔平底板上(图5a)。b细胞和cfse
‑
标记的cd4+t细胞共培养48小时,并且在培养物中加入某些因子(乙酸肉豆蔻佛波醇;离子霉素;和布雷非德菌素a)持续最后4小时。收集细胞,用抗
‑
ifn
‑
γ(b27;bd)、tnf
‑
α(mab11;invitrogen)细胞内染色(参见图5b)。图5c显示细胞毒性测定的结果。
[0187]
可根据本公开内容在无不适当实验下进行和执行本文中所公开和要求的所有方法。虽然已根据优选实施方案描述了本发明的组合物和方法,对本领域技术人员显而易见的是,可在不背离本发明的观念、精神和范围下,在方法和步骤中或本文中所述方法的步骤的顺序中进行变化。更具体而言,显然在化学和生理上均相关的某些药剂可替代本文所述的药剂,同时将达成相同或相似的结果。对本领域技术人员显而易见的所有这些相似替代和修改被视为在如由随附权利要求书所定义的本发明的精神、范围和观念内。
[0188]
参考文献
[0189]
以下参考文献特别地通过引用并入本文中至其对本文所述内容提供示例性程序或其他细节补充的程度。
[0190]
cohen等人,j immunol.175:5799
‑
5808,2005.
[0191]
current protocols in immunology,ed coligan等人,wiley,1994.
[0192]
czerkinsky等人,j.immunol.methods,110:29
‑
36,1988.
[0193]
ep 957359
[0194]
fast等人,transfusion 44:282
‑
5,2004.
[0195]
fedorov等人,sci.transl.medicine,5(215),2013.
[0196]
he y,等人journal of immunology research,7,2014.
[0197]
heemskerk等人hum gene ther.19:496
‑
510,2008.
[0198]
国际专利公开号wo2000/06588
[0199]
国际专利公开号wo2000/06588
[0200]
国际专利公开号pct/us95/01570
[0201]
国际专利公开号wo2000/06588
[0202]
国际专利公开号wo2005/035570
[0203]
janeway等人,immunobiology:the immune system in health and disease,3rd ed.,current biology publications,p.433,1997.
[0204]
johnson等人blood 114:535
‑
46,2009.
[0205]
lefranc等人,dev.comp.immunol.27:55,2003.
[0206]
li,nat biotechnol.23:349
‑
354,2005.
[0207]
olsson等人j.clin.invest.86:981
‑
985,1990.
[0208]
parkhurst等人,clin cancer res.15:169
‑
180,2009.
[0209]
pct专利公开号wo2001/083517
[0210]
taitano等人,the journal of immunology,196,2016.
[0211]
美国专利7,109,304
[0212]
美国专利号5,939,281
[0213]
美国专利号5,939,281
[0214]
美国专利号6,218,132
[0215]
美国专利号6,218,132
[0216]
美国专利号6,264,951
[0217]
美国专利号6,426,331
[0218]
美国专利号7,488,490
[0219]
美国专利号7,488,490
[0220]
美国专利公开号2007/0078113
[0221]
varela
‑
rohena等人,nat med.14:1390
‑
1395,2008.
[0222]
wo2014/055668
[0223]
wong等人,cytotherapy,4:65
‑
76,2002。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1