通过抑制15-羟基前列腺素脱氢酶(15-PGDH)使老化组织复壮的方法
通过抑制15-羟基前列腺素脱氢酶(15-pgdh)使老化组织复壮的方法
交叉引用
1.本技术要求2019年6月11日提交的美国临时专利申请第62/860,180号;2019年7月18日提交的美国临时专利申请第62/875,915号;2019年8月5日提交的美国临时专利申请第62/882,981号;以及2019年8月5日提交的美国临时专利申请第62/883,025号的权益;所述美国临时专利申请中的每一个通过引用以其整体并入本文。在联邦资助的研发下作出的发明权利的声明
2.本发明是在国立卫生研究院(the national institutes of health)授予的合约ag020961下在政府支持下进行的。政府享有本发明的某些权利。背景
3.在肌肉消瘦(muscle wasting)疾病中,肌肉质量和力量的快速损失主要是由于过度的蛋白质降解而出现,这经常伴随着蛋白质合成的减少。由于肌肉功能的这种丧失,生活质量降低,并且发病率和死亡率增加。尽管已知有很多关于肌肉萎缩如何发生,但有效预防或减缓萎缩的当前治疗策略仅限于锻炼。增加肌肉质量和力量的似乎合理的策略是改变蛋白质平衡,例如通过调节tgf-β家族或胰岛素受体信号传导途径。
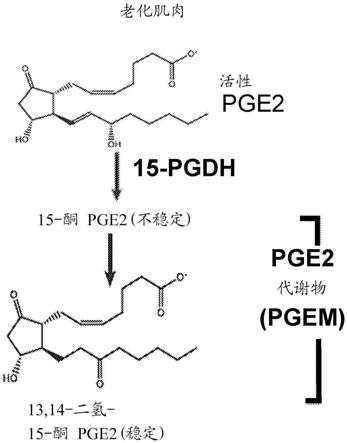
4.前列腺素e2(pge2),也称为地诺前列酮(dinoprostone),已被用于不同的临床环境中,包括诱导女人分娩和增强造血干细胞移植。pge2可用作抗凝剂和抗血栓形成剂。pge2作为脂质介质可以缓解炎症的作用也广为人知。cox-1和/或cox-2的抑制剂——非甾体抗炎药(nsaid),主要是经由pge2生物合成通过抑制前列腺素而抑制炎症。pge2通过环氧合酶(cox)和前列腺素e合成酶由花生四烯酸合成。pge2的水平受pge2降解酶——15-羟基前列腺素脱氢酶(15-pgdh)的生理调控。15-pgdh催化pge2 15-oh失活转化为15-酮基。
5.本领域仍然需要有效的治疗以预防或逆转有需要的对象中的衰老和/或萎缩肌肉中蛋白质的损失,以及由此导致的肌纤维和/或肌管大小的损失,以及随之发生的萎缩肌肉的力量、耐力或质量的损失。本领域还需要有效的治疗以预防或逆转患有年龄相关疾病和病症的对象的组织(例如非骨骼肌组织)中的功能丧失。本公开内容满足这些需求并且还提供其它优点。简要概述
6.在一个方面,提供了增强对象中老化骨骼肌功能的方法,所述方法包括:向所述老化骨骼肌施用有效抑制所述老化骨骼肌中的一种或多种衰老细胞中的15-pgdh活性和/或降低所述老化骨骼肌中的一种或多种衰老细胞中的15-pgdh水平的量的15-pgdh抑制剂,从而增强所述老化骨骼肌的功能。
7.在另一个方面,提供了增加对象中老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力的方法,所述方法包括:向所述老化骨骼肌施用有效抑制所述老化骨骼肌中的一种或多种衰老细胞中的15-pgdh活性和/或降低所述老化骨骼肌中的一种或多种衰老细胞中的15-pgdh水平的量的15-pgdh抑制剂,从而增加所述老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力。
8.在另一个方面,提供了提高对象的老化骨骼肌中pge2水平的方法,所述方法包括:向所述老化骨骼肌施用有效增加所述老化骨骼肌中pge2水平的量的15-pgdh抑制剂,从而提高所述老化骨骼肌中的pge2水平。
9.在前述方法中的任一种中,所述对象具有一种或多种衰老生物标志物。
10.在又一方面,提供了在具有一种或多种衰老生物标志物的对象中使老化骨骼肌复壮的方法,所述方法包括:向所述具有一种或多种衰老生物标志物的对象施用有效抑制所述对象中的15-pgdh活性和/或降低所述对象中的15-pgdh水平的量的15-pgdh抑制剂,从而使所述老化骨骼肌复壮。
11.在前述方法中的任一种中,所述一种或多种衰老生物标志物选自:相对于年轻骨骼肌中存在的水平15-pgdh水平的升高,相对于年轻骨骼肌中存在的水平pge2水平的降低,相对于年轻骨骼肌中存在的水平pge2代谢物的增加,相对于年轻骨骼肌中存在的水平衰老细胞积累的增加或更多,相对于年轻骨骼肌中存在的水平一种或多种萎缩基因表达的增加,相对于年轻骨骼肌中存在的水平线粒体生物发生和/或功能的降低以及相对于年轻骨骼肌中存在的水平转化生长因子途径信号传导的增加。在一些情况下,所述一种或多种萎缩基因选自:atrogin1(mafbx1)、musa(fbxo30)和trim63(murf1)。在一些情况下,所述转化生长因子途径信号传导的增加包括选自以下的一种或多种基因表达的增加:活化素受体、肌肉生长抑制素、smad蛋白和骨形态发生蛋白。在前述方法中的任一种中,相对于年轻骨骼肌,所述老化骨骼肌具有增加的衰老细胞积累。在一些情况下,所述衰老细胞表达一种或多种衰老标志物。在一些情况下,相对于非衰老细胞,所述衰老细胞具有增加的一种或多种衰老标志物水平。在一些情况下,所述一种或多种衰老标志物选自:p15ink4b、p16ink4a、p19arf、p21、mmp13、il1a、il1b和il6。在一些情况下,衰老细胞为巨噬细胞。在前述方法中的任一种中,所述老化骨骼肌是未受损伤的和/或未经历运动和/或未经历再生。在前述方法中的任一种中,所述方法还包括向所述老化骨骼肌施用溶解性药剂(senolytic agent)。在一些情况下,所述溶解性药剂选自:bcl2抑制剂、泛酪氨酸激酶抑制剂、达沙替尼和槲皮素的组合疗法、类黄酮、干扰foxo4-p53相互作用的肽、使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统、hsp90抑制剂及以上的组合。在前述方法中的任一种中,所述15-pgdh抑制剂选自:小分子化合物、封闭抗体、纳米抗体和肽。在前述方法中的任一种中,所述15-pgdh抑制剂为sw033291。在前述方法中的任一种中,所述15-pgdh抑制剂选自:反义寡核苷酸、微rna、sirna和shrna。在前述方法中的任一种中,所述对象为人类。在前述方法中的任一种中,所述对象为至少30岁。在前述方法中的任一种中,施用包括全身施用或局部施用。在前述方法中的任一种中,相对于在施用所述15-pgdh抑制剂之前老化骨骼肌中存在的pge2水平,所述老化骨骼肌中的pge2水平升高。在前述方法中的任一种中,相对于在施用所述15-pgdh抑制剂之前老化骨骼肌中存在的pge2水平,pge2水平升高至少10%。在前述方法中的任一种中,pge2水平升高至与年轻骨骼肌中存在的水平基本上类似的水平。在前述方法中的任一种中,pge2的水平升高至年轻骨骼肌中存在的水平的约50%内或更低的水平。在前述方法中的任一种中,所述方法导致肌纤维和/或肌管横截面积和/或直径的增加。在前述方法中的任一种中,所述方法导致氧化(iia型)和/或糖酵解(iib型)纤维的横截面积和/或直径的增加。在前述方法中的任一种中,所述15-pgdh抑制剂降低或阻断15-pgdh表达。在前述方法中的任一种中,所述15-pgdh抑制剂降低或阻断15-pgdh的酶活性。在前述方
法中的任一种中,所述方法导致所述老化骨骼肌的肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合。在前述方法中的任一种中,所述方法导致所述老化骨骼肌相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌的肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合。在前述方法中的任一种中,所述方法导致所述老化骨骼肌的肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合达到与年轻骨骼肌中存在的水平基本上类似的水平。在前述方法中的任一种中,所述方法导致所述老化骨骼肌的肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合达到年轻骨骼肌中存在的水平的约50%内或更低的水平。在前述方法中的任一种中,所述方法导致所述老化骨骼肌的功能增强。在前述方法中的任一种中,所述方法导致所述老化骨骼肌相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌的功能增强。在前述方法中的任一种中,所述方法导致所述老化骨骼肌的功能增强至与年轻骨骼肌中存在的水平基本上类似的水平。在前述方法中的任一种中,所述方法导致所述老化骨骼肌的功能增强至年轻骨骼肌中存在的水平的约50%内或更低的水平。在前述方法中的任一种中,所述功能为蛋白质合成的增加、细胞增殖的增加、细胞存活的增加、蛋白质降解的降低或以上的任何组合。在前述方法中的任一种中,所述方法导致所述老化骨骼肌相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌中的pge2代谢物的水平降低,和/或降低至与年轻骨骼肌中存在的水平基本上类似的水平。在一些情况下,所述pge2代谢物选自:15-酮pge2和13,14-二氢-15-酮pge2。在前述方法中的任一种中,所述对象患有由于衰老引起的肌肉减少症。在前述方法中的任一种中,相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌,一种或多种萎缩基因的表达水平降低和/或降低至与年轻骨骼肌中存在的水平基本上类似的水平。在前述方法中的任一种中相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌,线粒体复合物的一种或多种组分的表达水平升高和/或升高至与年轻骨骼肌中存在的水平基本上类似的水平。在一些情况下,所述线粒体复合物的一种或多种组分选自:ndufa11、ndufa12、ndufa13、ndufa2、ndufa3、ndufa4、ndufa5、ndufa10、ndufb5、ndufc1、ndufs4、ndufs8、ndufv1、ndufv2、uqcrb、uqcrc1、uqcrh、uqcrq、ucqr10、cox8b、cox7a1、cox7a2、cox7b、cox6c、cox5a、cox5b、atp5f1、atp5g1、atp5h、atp5j2、atp5o、atp5e和atp5k。在前述方法中的任一种中,相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌,过氧化物酶体增殖物激活受体γ辅激活物1-α(pgc1α)的表达水平升高和/或升高至与年轻骨骼肌中存在的水平基本上类似的水平。在前述方法中的任一种中,相对于在施用所述15-pgdh抑制剂之前的老化骨骼肌,一种或多种基因的表达水平降低和/或降低至与年轻骨骼肌中存在的水平基本上类似的水平,所述一种或多种基因选自:tnfaip1、klhdc8a、fbxw11、tnfaip3、herc3、herc2、hdac4、traf6、ankib1、mib1、pja2、ubr3、thbs1、smad3、acvr2a、rgmb、tgfb2和mstn。在前述方法中的任一种中,所述方法不依赖于所述对象中肌肉干细胞(musc)增殖的增加。在前述方法中的任一种中,所述施用包括一天一次施用、一天两次施用、一周一次施用或一个月一次施用。
12.在另一个方面,使对象的老化非骨骼肌组织复壮的方法,所述方法包括:向所述对象施用有效抑制所述对象中的15-pgdh活性和/或降低所述对象中的15-pgdh水平的量的15-pgdh抑制剂,从而使所述老化非骨骼肌组织复壮。在一些情况下,所述施用提高所述对象的老化非骨骼肌组织中pge2的水平。在一些情况下,相对于在施用所述15-pgdh抑制剂之前的老化非骨骼肌组织,所述老化非骨骼肌组织中的pge2水平升高。在一些情况下,相对于
在施用所述15-pgdh抑制剂之前的老化非骨骼肌组织,所述老化非骨骼肌组织中的pge2水平升高至少10%。在一些情况下,所述老化非骨骼肌组织中的pge2水平升高至与年轻非骨骼肌组织中存在的水平基本上类似的水平。在一些情况下,所述老化非骨骼肌组织中的pge2水平升高至年轻非骨骼肌组织中存在的水平的约50%内或更低的水平。在一些情况下,所述老化非骨骼肌组织选自:表皮组织、上皮组织、血管组织、心肌、脑、骨、软骨、感觉器官、肾、甲状腺、肺、平滑肌、棕色脂肪、脾脏、肝脏、心脏、小肠、结肠、皮肤、卵巢和其它生殖组织、毛发、牙组织、血液、耳蜗及其任意组合。在一些情况下,所述对象具有一种或多种衰老生物标志物。在一些情况下,所述一种或多种衰老生物标志物选自:15-pgdh水平相对于年轻非骨骼肌组织的增加,pge2水平相对于年轻非骨骼肌组织的降低,pge2代谢物相对于年轻非骨骼肌组织的增加,衰老细胞相对于年轻非骨骼肌组织的增加或更大的积累,一种或多种萎缩基因的表达相对于年轻非骨骼肌组织的增加,线粒体生物发生和/或功能相对于年轻非骨骼肌组织的降低,以及转化生长因子途径信号传导相对于年轻非骨骼肌组织的增加。在一些情况下,相对于年轻非骨骼肌组织,所述老化非骨骼肌组织具有增加的衰老细胞积累。在一些情况下,所述衰老细胞表达一种或多种衰老标志物。在一些情况下,相对于非衰老细胞,所述衰老细胞具有增加的一种或多种衰老标志物水平。在一些情况下,所述一种或多种衰老标志物选自:p15ink4b、p16ink4a、p19arf、p21、mmp13、il1a、il1b和il6。在一些情况下,所述衰老细胞为巨噬细胞。在一些情况下,所述方法还包括所述老化非骨骼肌组织施用溶解性药剂。在一些情况下,所述溶解性药剂选自:bcl2抑制剂、泛酪氨酸激酶抑制剂、达沙替尼和槲皮素的组合疗法、类黄酮、干扰foxo4-p53相互作用的肽、使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统、hsp90抑制剂及以上的组合。在一些情况下,所述15-pgdh抑制剂选自:小分子化合物、封闭抗体、纳米抗体和肽。在一些情况下,所述15-pgdh抑制剂为sw033291。在一些情况下,所述15-pgdh抑制剂选自:反义寡核苷酸、微rna、sirna和shrna。在一些情况下,所述对象为人类。在一些情况下,所述对象为至少30岁。在一些情况下,所述15-pgdh抑制剂降低或阻断15-pgdh表达。在一些情况下,所述15-pgdh抑制剂降低或阻断15-pgdh的酶活性。在一些情况下,相对于在施用所述15-pgdh抑制剂之前的老化非骨骼肌的功能,所述老化非骨骼肌的功能增强。在一些情况下,相对于在施用所述15-pgdh抑制剂之前的老化非骨骼肌的功能,所述老化非骨骼肌组织的功能增强至少10%。在一些情况下,所述老化非骨骼肌组织的功能增强至与年轻非骨骼肌组织中存在的水平基本上类似的水平。在一些情况下,所述老化非骨骼肌组织的功能增强至在年轻非骨骼肌组织中存在的水平的约50%内或更低的水平。在一些情况下,所述功能包括增加的蛋白质合成、增加的细胞增殖、增加的细胞存活、降低的蛋白质降解或以上的任何组合。在一些情况下,所述方法导致所述老化非骨骼肌组织相对于在施用所述15-pgdh抑制剂之前的老化非骨骼肌组织的pge2代谢物水平的降低和/或降低至与年轻非骨骼肌中存在的水平基本上类似的水平。在一些情况下,所述pge2代谢物选自:15-酮pge2和13,14-二氢-15-酮pge2。
13.在另一方面,提供了增强对象中骨骼肌功能的方法,所述方法包括:向所述对象施用有效抑制所述骨骼肌中的15-pgdh活性和/或降低所述骨骼肌中的15-pgdh水平的量的15-pgdh抑制剂,从而增强所述对象中骨骼肌的功能,其中所述骨骼肌是健康的,以及其中
所述方法不依赖于所述对象中肌肉干细胞(musc)增殖的增加。在一些情况下,所述骨骼肌是未受损伤的。在一些情况下,所述骨骼肌没有经历再生。在一些情况下,所述骨骼肌没有经历显著或实质的运动。在一些情况下,相对于在施用所述15-pgdh抑制剂之前的骨骼肌,所述功能增强。在一些情况下,所述功能为蛋白质合成的增加、细胞增殖的增加、细胞存活的增加、蛋白质降解的降低或以上的任何组合。在一些情况下,所述方法导致相对于在施用所述15-pgdh抑制剂之前的骨骼肌的肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合。在一些情况下,所述骨骼肌为年轻骨骼肌。在一些情况下,所述对象小于30岁。在一些情况下,所述骨骼肌为老化骨骼肌。在一些情况下,所述对象大于30岁。
14.在另一个方面,本公开内容提供了用于增加对象中的老化和/或萎缩肌肉的质量、力量和/或耐力的方法,所述方法包括向所述对象施用治疗有效量的15-羟基前列腺素脱氢酶(15-pgdh)抑制剂,其中所述15-pgdh抑制剂的施用增加所述对象的老化和/或萎缩肌肉中的肌纤维和/或肌管大小。
15.在一些实施方案中,所述对象患有与肌肉萎缩相关的病况或疾病,其选自肌肉减少症、糖尿病、肌营养不良、少肌性肥胖、神经病、癌症恶病质、hiv恶病质、肌肉固定(muscle immobilization)、肌肉废用、虚弱及以上的组合。在一些实施方案中,所述对象为人类。在一些实施方案中,所述人超过30岁(例如,患有年龄相关的肌肉减少症的成人)。在一些实施方案中,所述人类是儿童(例如,患有肌营养不良,例如杜氏肌营养不良的儿童)。在一些实施方案中,所述方法还包括基于他或她的年龄选择用15-pgdh抑制剂治疗的人类的步骤。
16.在一些实施方案中,所述方法还包括基于糖尿病、虚弱、肌营养不良、少肌性肥胖、神经病、癌症恶病质或hiv恶病质或由固定或废用导致的肌肉萎缩的诊断,选择用15-pgdh抑制剂治疗的人类的步骤。在一些实施方案中,所述肌营养不良选自:杜氏肌营养不良、贝克肌营养不良、先天性肌营养不良、远端肌营养不良、emery-dreifuss肌营养不良、面肩肱型肌营养不良、肢带肌营养不良、强直性肌营养不良和眼咽肌营养不良。在一些实施方案中,所述肌营养不良为杜氏肌营养不良。
17.在一些实施方案中,15-pgdh抑制剂使15-pgdh失活或阻断15-pgdh活性(例如,酶活性)。在一些实施方案中,15-pgdh抑制剂降低15-pgdh的稳定性。在一些实施方案中,15-pgdh抑制剂是小分子化合物、阻断抗体、纳米抗体或肽。在一些实施方案中,小分子化合物为sw033291。在一些实施方案中,15-pgdh抑制剂降低或阻断15-pgdh表达。在一些实施方案中,15-pgdh抑制剂为反义寡核苷酸、微rna、sirna或shrna。在一些实施方案中,15-pgdh抑制剂为修饰的rna,例如修饰的mrna(mmrna)。
18.在一些实施方案中,肌肉为骨骼肌。在一些实施方案中,肌肉是未受损伤的和/或未经历运动和/或再生。在一些实施方案中,抑制剂增加对象的老化和/或萎缩肌肉中的肌纤维和/或肌管大小,而与肌肉损伤、运动或再生无关。在一些实施方案中,治疗有效量的15-pgdh抑制剂增加对象的老化和/或萎缩肌肉中的肌肉质量或肌纤维和/或肌管横截面积或直径。在一些实施方案中,治疗有效量的15-pgdh抑制剂增加肌肉力量、肌肉功能、肌肉质量和/或肌肉耐力,而不依赖于或不需要对象中肌肉干细胞(musc)增殖的增加。在一些实施方案中,治疗有效量的15-pgdh抑制剂增加、升高或恢复对象的老年和/或萎缩肌肉中的前列腺素e2(pge2)水平。在一些实施方案中,治疗有效量的15-pgdh抑制剂降低对象的老化和/或萎缩肌肉中的pge2代谢物水平。
19.在一些实施方案中,pge2代谢物是15-酮-pge2或13,14-二氢-15-酮-pge2(pgem)。在一些实施方案中,施用15-pgdh抑制剂包括全身或局部施用。在一些实施方案中,老化和/或萎缩肌肉具有增加的衰老细胞的积累(例如,相对于年轻肌肉)。
20.在一些实施方案中,所述方法还包括向对象施用溶解性药剂。在一些实施方案中,所述溶解性药剂选自:bcl2抑制剂(例如,纳维托克(navitoclax)(abt-263)、abt-737)、泛酪氨酸激酶抑制剂(例如,达沙替尼)、类黄酮(例如,槲皮素)、干扰foxo4-p53相互作用的肽(例如,foxo4-dri),使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统,hsp90抑制剂(例如,17-dmag)及以上的组合。
21.在一些实施方案中,15-pgdh抑制剂的施用导致对象的老化和/或萎缩性肌肉中的atrogin1水平或活性降低。在一些实施方案中,15-pgdh抑制剂的施用导致对象的老化和/或萎缩性肌肉中的ep4活性增加。在一些实施方案中,15-pgdh抑制剂的施用导致针对肌细胞(特别是成熟肌细胞)死亡的保护。
22.本公开内容提供了用于改善患有年龄相关病况或疾病的对象中的非骨骼肌组织的健康、功能和/或表现的组合物和方法,特别是通过抑制对象中的15-pgdh。
23.在一个方面,本公开内容提供了用于增加患有年龄相关病症的对象中非骨骼肌组织的功能的方法,所述方法包括向所述对象施用治疗有效量的15-羟基前列腺素脱氢酶(15-pgdh)抑制剂,其中所述15-pgdh抑制剂的施用增加或恢复所述对象的非骨骼肌组织中的pge2和/或pgd2的水平。
24.在所述方法的一些实施方案中,所述年龄相关病症选自:心血管疾病、慢性呼吸道疾病、营养性疾病、肾脏疾病、胃肠或消化疾病、神经病症、感觉障碍、听力障碍、皮肤或皮下疾病、脑血管疾病、骨质疏松症、骨关节炎、早衰疾病及以上的组合。在一些实施方案中,心血管疾病为心房纤颤、中风、缺血性心脏病、心肌病、心内膜炎、脑内出血、高血压或其组合。在一些实施方案中,慢性呼吸道疾病为慢性阻塞性肺病、石棉肺、矽肺或其组合。在一些实施方案中,营养性疾病为沙眼、腹泻疾病、脑炎或其组合。在一些实施方案中,肾脏疾病为慢性肾脏疾病。在一些实施方案中,胃肠或消化疾病为nash、胰腺炎、溃疡、肠梗阻或其组合。在一些实施方案中,神经病症为阿尔茨海默病、痴呆、帕金森病或其组合。在一些实施方案中,感觉障碍为听力损失、视力损失、嗅觉或味觉损失、黄斑变性、视网膜色素变性(retinosa pigmentosa)、青光眼或其组合。在一些实施方案中,皮肤或皮下疾病为蜂窝织炎、溃疡、真菌皮肤病、脓皮病或其组合。在一些实施方案中,早衰疾病为成骨不全症、布卢姆综合症(bloom syndrome)、科克因综合症(cockayne syndrome)、hutchinson-gilford progeria综合征、下颌骨发育不良(mandibuloacral dysplasia)、早衰(progeria)、早衰样综合征(progeroid syndrome)、rothmund-thomson综合征、seip综合征、werner综合征、唐氏综合征、肢端早老症、rothmund-thomson综合征、导致早衰综合征的免疫缺陷(例如共济失调毛细血管扩张)或导致早衰的感染性疾病(例如hiv)。
25.在所述方法的一些实施方案中,所述对象为人类。在一些实施方案中,所述方法还包括基于年龄相关病症的诊断选择用15-pgdh抑制剂治疗的人类的步骤。在一些实施方案中,非骨骼肌组织选自:表皮、上皮、血管、心肌、脑、骨、软骨、感觉器官、肾、甲状腺、肺、平滑肌、棕色脂肪、脾脏、肝脏、心脏、脑、小肠、结肠、皮肤、卵巢和其它生殖组织、毛发、牙组织、耳蜗、少突胶质细胞及以上的组合。
26.在所述方法的一些实施方案中,15-pgdh抑制剂使15-pgdh失活或阻断15-pgdh活性。在一些实施方案中,15-pgdh抑制剂降低或阻断15-pgdh的酶活性。在一些实施方案中,15-pgdh抑制剂为小分子化合物、阻断抗体、纳米抗体或肽。在一些实施方案中,所述小分子化合物为sw033291。在一些实施方案中,15-pgdh抑制剂降低或阻断15-pgdh表达。在一些实施方案中,15-pgdh抑制剂为反义寡核苷酸、微rna、sirna或shrna。
27.在所述方法的一些实施方案中,15-pgdh抑制剂的施用增加或恢复对象的非骨骼肌组织中的pge2水平。在一些实施方案中,治疗有效量的15-pgdh抑制剂降低对象的非骨骼肌组织中的pge2和/或pgd2代谢物水平。在一些实施方案中,pge2代谢物为15-酮-pge2或13,14-二氢-15-酮-pge2(pgem)。在一些实施方案中,pgd2代谢物为15-酮-pgd2或13,14-二氢-15-酮-pgd2。在一些实施方案中,治疗有效量的15-pgdh抑制剂在对象的非骨骼肌组织中增加蛋白质合成、增加细胞增殖、增加细胞存活、延长端粒和/或减少蛋白质降解。在一些实施方案中,施用15-pgdh抑制剂包括全身施用。在一些实施方案中,施用15-pgdh抑制剂包括局部施用。在一些实施方案中,非骨骼肌组织具有增加的衰老细胞的积累(例如,相对于年轻非骨骼肌组织)。在一些实施方案中,所述方法还包括向对象施用溶解性药剂。在一些实施方案中,所述溶解性药剂选自bcl2抑制剂、泛酪氨酸激酶抑制剂、类黄酮、干扰foxo4-p53相互作用的肽、使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统、hsp90抑制剂及以上的组合。
28.从以下详述和附图中,本公开内容的其它目的、特征和优点对于本领域技术人员将是显而易见的。附图简述
29.图1a-1d:老化肌肉中力量和pge2水平的下降。(图1a)青年(2个月,n=9)、中年(18个月,n=)和老年(25个月,n=5)的雄性小鼠的跖屈肌强直性扭矩。(图1b)pge2分解代谢方案。13,14-二氢-15-酮pge2(pgem)。(图1c)在青年(2个月)和老年(25个月)小鼠(每个年龄组n=4只小鼠)的肌肉组织中测定15-pgdh酶比活性。(图1d)通过质谱分析法定量肌肉组织裂解物中的pge2和pgem水平(对于青年的,n=14只小鼠,对于老年的,n=8只小鼠)。*p《0.05,**p《0.001,****p《0.0001。用于多重比较的邦费罗尼校正的anova检验(图1a和图1d);曼-惠特尼检验(图1c)。平均值
±
s.e.m。
30.图2:15-pgdh,老化组织中衰老细胞的组分。15-pgdh(hpgd)在20个月c57b1/6野生型小鼠的肌肉组织中的表达,所述小鼠在4周交替方案中用媒介物(veh)或abt-263(abt)处理并在2个月后分析(在2月龄小鼠中每种情况n=3,在23月龄小鼠中每种情况n=4)。*p《0.05。用于多重比较的邦费罗尼校正的anova检验;平均值+s.e.m。缩写:mo,月。
31.图3a-3e:15-pgdh抑制通过增加内源性pge2水平而导致老年小鼠中改善的肌肉功能。(图3a)每天用15-pgdh抑制剂,即sw033291(sw)或媒介物(veh)处理老年小鼠,并且在1个月时测量肌肉功能。实验方案(顶部)。从左到右:质量被评估为解剖的腓肠肌(ga)和胫前肌(ta)的重量。力量被评估为跖屈强直性力(绝对值)。跖屈强直性力(归一化至基线的值)。耐力被评估为筋疲力尽的时间和距离。(图3b)1个月的媒介物(veh)处理的或sw处理的老化肌肉的代表性ta横截面。dapi,蓝色;laminin,绿色。比例尺(bar)=50μm。(图3c)媒介物和sw处理的老化ga中的肌纤维横截面积(csa)(每组n=4)。(图3d)平均csa(每组n=4)。(图3e)通过质谱分析法定量的肌肉组织裂解物中的pge2和pgem水平(每组n=3)。*p《0.05,**p
《0.001,****p《0.0001。曼-惠特尼检验(图3a和3d)。用于多重比较的邦费罗尼校正的anova检验(图3c和3e);平均值
±
s.e.m。缩写:mo,月;i.p.腹膜内。
32.图4a-4d:通过aav9递送的shrna敲低15-pgdh导致老年小鼠中改善的肌肉功能。将携带针对15-pgdh的shrna(sh15pgdh)或加扰(scr)对照的构建体的aav9肌内(i.m.)注射到ga中。(图4a)实验方案。(图4b)在scr和sh15pgdh感染的肌肉和年轻对照(每组n=5)中15-pgdh的表达水平。(图4c)解剖的腓肠肌(ga)的重量。(图4d)跖屈强直性力(绝对值)。*p《0.05。用于多重比较的邦费罗尼校正的anova检验(图4b);曼-惠特尼检验(图4c和4d)。平均值
±
s.e.m。缩写:mo,月;i.m.肌内。
33.图5a和5b:15-pgdh抑制在杜氏肌营养不良小鼠模型中导致改善的肌肉功能。(图5a)衰老标志物和15-pgdh(hpgd)在杜氏肌营养不良(dmd)小鼠(mdx4cv/mtrko(g2))和对照(mtrko(g2))(每个基因型n=4)的ga肌肉中的表达。(图5b)每天用15-pgdh抑制剂,即sw033291(sw)或媒介物处理dmd小鼠和对照小鼠,并且在1个月时测量肌肉功能。实验方案(顶部)。跖屈强直性力(对于每种基因型(底部),归一化至媒介物处理的值)。*p《0.05,****p《0.0001。曼-惠特尼检验(图5a和5b)。平均值
±
s.e.m。缩写:mo,月;i.p.腹膜内。
34.图6a-6f。培养的肌管的pge2处理导致肌肉萎缩途径的抑制。(图6a)在(左)媒介物和sw处理的老化肌肉(每种情况n=3);(右)shscr和sh15pgdh处理的老化肌肉(每种情况n=5)中atrogin1的表达水平。(图6b)在分化的时间过程中pge2受体ep1-4(ptger1-4)的表达水平。(图6c)在分化的时间过程中pax7和myh的表达水平。(图6d)在ep4拮抗剂ono-ae3-208存在下,在饥饿24小时并伴有用媒介物、pge2或sw处理的分化肌管中,萎缩标志物atrogin1(左)和肌管直径(中)的表达水平。分化后暴露于pge2或媒介物的肌管的代表性图像(右)。比例尺=50μm。(图6e)ep4fl/fl或ep4/肌管的直径和myh染色的阳性面积。(图6f)老年和营养不良小鼠中15-pgdh调节的图形描述。通过使用15-pgdh抑制剂或溶解性药剂恢复pge2的水平,导致处理的dmd或老年小鼠中降低水平的下游萎缩介质atrogin1、肌肉肥大和增加的力量,可以实现对老化或dmd肌肉中肌肉质量和力量损失的挽救。*p《0.05,**p《0.001,***p《0.0005****p《0.0001。曼-惠特尼检验(图6a,6d-左和6e);用于多重比较的邦费罗尼校正的anova检验(图6d-右);平均值
±
s.e.m。
35.图7a-7c:年轻和老化肌肉的质谱分析以检测前列腺素和pge2代谢物。(图7a)所分析的前列腺素(pge2、pgf2α和pgd2)和pge2代谢物(15-酮pge2和13,14-二氢-15-酮pge2)的化学结构、化学式、确切质量和分子量。将内部标准pgf2α-d9和pge2-d9加入到所有复合标准中。(图7b)通过将储备溶液稀释至0.1ng/ml至500ng/ml的最终浓度来制备用于液相色谱-电喷雾离子化-串联质谱(lc-esi-ms/ms)分析的校准线。示出了每个标准的标准曲线方程和相关系数。(图7c)代表性色谱图。分离的峰显示出分析的前列腺素及其代谢物的优异色谱分离度。cps:每秒计数。
36.图8a-8p:衰老过程中类花生酸水平的分析揭示了pge2降解酶15-pgdh的增加。(图8a)pge2和pgd2分解代谢方案。(图8b)通过质谱分析法定量肌肉组织裂解物中pge2、pgd2、pgf2a和13,14-二氢-15-酮pge2(pgem)水平(对于年轻的,n=12只小鼠,以及对于老年的,n=8只小鼠)。(图8c)通过质谱分析法分析来自年轻(2个月,左)和老化(25个月,右)肌肉组织的pge2、pgd2水平的代表性色谱图。(图8d)在青年(2个月)和老年(25个月)小鼠的组织中测定15-pgdh酶比活性。活性表示为相对于年轻的变化百分比。(图8e)来自青年(3mo.)和老
年小鼠(》24mo.)的15-pgdh(hpgd)rnaseq表达数据。(分别为n=4,6)。tpm,每百万的转录物。(图8f)来自青年(3个月)和老年(25个月)的肌肉裂解物的15-pgdh免疫印迹(每个n=4)。(图8g-8p)将携带针对15-pgdh的shrna(sh15pgdh)或加扰(scr)对照的构建体的aav9肌内(i.m.)注射到青年(3个月)和老年(24个月)c57bl/6的腓肠肌(ga)中。(图8g)实验方案。(图8h)scr和sh15pgdh感染的肌肉和年轻对照(每组n=5)中15-pgdh的表达水平。(图8i)在scr和sh15pgdh感染的老化肌肉的肌肉组织中测定的归一化至scr处理的15-pgdh酶比活性(每个年龄组n=5只小鼠)。(图8j)通过质谱分析法定量的肌肉组织裂解物中的pge2、pgd2、pgf2a水平(每组n=4)。(图8k)scr和sh15pgdh感染的老化肌肉的代表性ta横截面。dapi,蓝色;laminin,绿色。比例尺=50μm。(图8l)scr和sh15pgdh感染的老化ga中的肌纤维横截面积(csa)(每组n=7)。(图8m)平均csa。(图8n)解剖的ta的重量(图8o)解剖的ga的重量。(图8p)跖屈强直性力(绝对值)。*p《0.05,**p《0.01,****p《0.0001。用于多重比较的邦费罗尼校正的anova检验(图8h和8l-8p);多重t检验(图8b、8d和8j),曼-惠特尼检验(图8e、8f和8i)。平均值
±
s.e.m。缩写:spl.,脾脏;mus,肌肉;mo,月;i.m.,肌内。
37.图9a-9c:年轻和老化肌肉的质谱分析检测前列腺素和pge2代谢物。(图9a)所分析的前列腺素(pge2、pgf2α和pgd2),pge2代谢产物(15-酮pge2和13,14-二氢-15-酮pge2),pga2及其代谢产物13,14-二氢-15-酮pga2,以及内标pgf2α-d9和pge2-d4和pgd2-d4的化学结构、化学式、精确质量和分子量。(图9b)pge2校准曲线在0.05-500ng/ml范围内是线性的。示出了标准曲线方程和相关系数。(图9c)标准混合物的代表性色谱图,其显示了所分析的前列腺素及其代谢物的色谱分离。分析物峰强度表示为cps(每秒计数)。
38.图10:年轻和老化肌肉的质谱分析。代表性色谱图指示通过质谱分析法分析来自青年(2个月,左)和老年(25个月,右)肌肉组织的代谢物pge2水平的过渡状态。
39.图11:在年轻和老化组织中的15-pgdh比活性测定。从年轻(灰色)和老化(黑色)组织制备的裂解物中15-pgdh比活性的动力学测量。
40.图12a-12d:青年对比老年c57bl/6中四头肌的转录组学分析。(图12a-12d)在青年(3mo.)和老年小鼠(》24mo.)(分别为n=4,6)上进行rna测序。(图12a)在rlog转换后年轻和老化样品的欧几里得样品距离的热图。(图12b)年轻对比老化样品的差异表达基因的火山图(volcano plot)。(图12c)前列腺素e2受体(ptger 1-4)的tpm值的盒须图(box and whiskers plot)。(图12d)来自(图12b)的差异上调和下调基因的go术语和kegg分析(12b)。缩写:mo,月;n.s.,不显著;tpm,每百万的转录物。
41.图13:15-pgdh水平在老化肌肉中升高。与从公开获得的数据gse25941(raue等人,2012)中分析的年轻人(25
±
3岁)相比,来自老年人(78
±
6岁)活检的股外侧肌的15-pgdh(hpgd)微阵列表达数据(分别为n=15,21)。*p《0.0001。曼-惠特尼检验。
42.图14a-14c:aav9介导的15-pgdh的敲低。(图14a)相对于shscr,对年轻sh15pgdh的肌肉组织中pge2、pgd2、pgf2a水平的质谱定量(每组n=4)。(图14b)scr和sh15pgdh感染的老化肌肉的ta横截面的代表性图像,dapi,蓝色;gfp,绿色;laminin,白色。(图14c)跖屈强直性力(相对于基线)。*p《0.05。多重t检验(图14a),用于多重比较的邦费罗尼校正的anova检验(图14c)。平均值+s.e.m。缩写:ta:胫前肌;scr,加扰的;n.s.,不显著的。
43.图15a-15m:小分子对15-pgdh的抑制通过增加内源性pge2水平而导致老年小鼠的肌肉功能改善。(图15a)实验方案。每天用15-pgdh抑制剂,即sw033291(sw)或媒介物处理青
年(3个月)和老年(》24个月)小鼠,并且在1个月时测量肌肉功能。(图15b)在媒介物和sw处理的老化肌肉的肌肉组织中测定的归一化至媒介物处理的15-pgdh酶促比活性(n=4只小鼠/年龄组)。(图15c)通过质谱分析法定量肌肉组织裂解物中的类花生酸水平(对于青年的n=10,对于老年的,veh,n=5,对于老年的,sw,n=7)。(图15d)1个月媒介物处理的或sw处理的老化肌肉的代表性ta横截面。dapi,蓝色;laminin,绿色。比例尺=50μm。(图15e)媒介物和sw处理的老化ga中的肌纤维横截面积(csa)(每组n=4)。(图15f)平均csa。(图15g)针对氧化性(mhc2a)和糖酵解纤维(mhc2b)染色的1个月媒介物处理的或sw处理的老化肌肉的代表性ta横截面,laminin,蓝色;mhc2a,绿色以及mhc2b,红色;比例尺=50μm。(图15h)平均csa。(图15i)mhc2a的横截面积。每组n=4。(图15j)mhc2b的横截面积。每组n=4。(图15k)解剖的腓肠肌(ga)、胫前肌(ta)和比目鱼肌的重量。(图15l)跖屈强直性力(绝对值)。(图15m)筋疲力尽的时间。*p《0.05,**p《0.01,****p《0.0001。曼-惠特尼检验(图15b和15h);用于多重比较的邦费罗尼校正的anova检验(图15c、15e、15f和15j-15m)。平均值
±
s.e.m。缩写:mo,月;i.p.,腹膜内。
44.图16a-16c:媒介物和sw处理的老化肌肉的分析。(图16a)代表性色谱图表示通过质谱分析来自媒介物处理的老化(左)和sw处理的老化(右)肌肉组织的代谢物pge2水平的过渡状态。(图16b)对于媒介物处理的,sw处理的肌肉组织中pge2、pgd2、pgf2a水平的质谱定量(每组n=4)。(图16c)跖屈强直性力(相对于基线)。**p《0.01。多重t检验(图16b),用于多重比较的具有邦费罗尼校正的anova检验(图16c)。缩写:n.s.,不显著。
45.图17a-17g:15-pgdh由老化肌肉微环境中的细胞表达。(图17a)15-pgdh(hpgd)在来自青年(2个月)和老年(25个月)的后肢肌的分选的巨噬细胞(cd11b+/cd11c-/f4/80+/cd31-)、内皮细胞(cd31+/cd11b-/cd11c-/f4/80-)以及肌原性和干细胞(α7+/cd11b-/cd45-/cd31-/sca1-)中的表达。(图17b)p16ink4a和p21在facs分离的青年(2个月)和老年巨噬细胞(25个月)中的表达(分别为n=3和5)。(图17c-17g)用媒介物或ap20187(ap)以每周两次处理ink-attac 12月龄小鼠持续16个月以消除衰老细胞,并在28个月时分析骨骼肌组织。(图17c)实验方案。(图17d)用媒介物(veh)或ap处理的青年(2个月)和老年(28个月)ink-attac小鼠的四头肌中15-pgdh酶(hpgd)的表达。对于2mo,n=5,对于28个月,n=6(用veh或ap处理)。(图17e)通过质谱分析法定量的肌肉组织裂解物中的类花生酸水平(对于青年的,n=10;对于媒介物处理的,n=3只小鼠以及对于ap处理的,n=3)。(图17f)15-pgdh(hpgd)在来自成年(12个月)和用媒介物(veh)或ap(28个月)处理的老年ink-attac的后肢肌的分选的巨噬细胞和内皮细胞中的表达。(图17g)成年(12个月)和用媒介物(veh)或ap(28个月)处理的老年ink-attac的解剖的腓肠肌(ga)、胫前肌(ta)(左)的重量、握力和跑步机耐力(右)。分别为n=6、7和15。*p《0.05,***p《0.001,****p《0.0001。多重t检验(a),用于多重比较的具有邦费罗尼校正的anova检验(图17e-17g)。平均值
±
s.e.m。
46.图18a和18b:来自青年和老年小鼠的分选细胞的老化标志物的表达。(图18a)从青年(3mo.)和老年小鼠(24mo.)中分选巨噬细胞(cd11b+/cd11c-/f4/80+/cd31-)。(图18b)p16和p21在青年(2mo.)和老年(24mo)的分选的内皮细胞(cd31+/cd11b-/cd11c-/f4/80-)中的表达。(每种情况n=5只小鼠)。*p《0.05,****p《0.0001。曼-惠特尼检验(图18b)。平均值+s.e.m。缩写:mo,月。
47.图19a-19g:ink-attac和溶解性药剂处理的老年小鼠的表征。(图19a)在青年(2个
月)和用媒介物(veh)或ap处理的老年(28个月)ink-attac小鼠的四头肌中指定衰老标志物的表达。对于青年的,n=5,对于用veh或ap处理的老年的,n=6。(图19b)代表性色谱图指示通过质谱分析法分析来自老年ink-attac的媒介物处理(左)和老年ink-attac的ap处理(右)的肌肉组织的代谢物pge2水平的过渡状态。(图19c)在成年(12mo.)ink-attac、用媒介物(veh)或ap处理的老年(28mo.)ink-attac小鼠的分选的巨噬细胞和内皮细胞中p21的表达。(每种情况n=4)。(图19d-19g)历经4周的交替方案将20个月的c57b1/6野生型小鼠用媒介物(veh)或abt-263(abt)处理,并在2个月后分析。(图19d)方案(顶部)。用媒介物或abt263(abt)以及在4周的交替方案期间处理的青年或老年的c57b1/6野生型(wt)小鼠的衰老标志物的表达(在青年小鼠中,每种情况n=3以及在老年小鼠中,每种情况n=4)(底部)。(图19e)青年的(2个月)、abt处理的老年的和媒介物处理的老年的肌肉(23个月)的代表性ta横截面。dapi,蓝色;15-pgdh,绿色;wga,红色。(比例尺=20μm)。(图19f)肌肉组织切片中15-pgdh+免疫染色细胞的定量。(对于用abt处理的n=4的老年小鼠以及用媒介物对照处理的n=4只小鼠的肌肉横截面(每个切片约5,000-8,000个dapi阳性细胞)。(图19g)15-pgdh(hpgd)的表达(在青年的2月龄的小鼠中,n=3以及在23月龄的老年小鼠中,n=4)*p《0.05,**p《0.01,***p《0.001。用于多重比较的邦费罗尼校正的anova检验(图19a、19c、19d-左和19g)。曼-惠特尼检验(图19f和19d-右)。平均值+s.e.m。缩写:mo,月。
48.图20a-20k:15-pgdh的过表达诱导肌肉萎缩,通过用sw033291治疗而被拯救。(图20a-20h)将携带cmv驱动15-pgdh表达或对照的构建体的aav9肌内(i.m.)注射到青年c57bl/6(4个月)小鼠的胫前肌(ta)中。(图20a)实验方案。(图20b)15-pgdh(hpgd)在scr和15-pgdh o.e.感染的年轻肌肉中的表达(每组n=5)。(图20c)通过质谱分析法定量肌肉组织裂解物中pge2、pgd2、pgf2a和pgem水平(每组n=4)。(图20d)i.m.注射后1个月的代表性ta横截面。dapi,蓝色;laminin,绿色。比例尺=50μm。(图20e)注射15-pgdh过表达载体和对照(每组n=3)的肌肉的肌纤维横截面积。(图20f)解剖的胫前肌(ta)的重量。(图20g)跖屈强直性力(绝对值)。(图20h)通过qpcr测量murf1(trim63)、atrogin-1(fbxo32)、p62、lc3b、atg4和atg6的表达水平(n=3)。(图20i-20k)将携带cmv驱动15-pgdh表达或对照的构建体的aav9肌内(i.m.)注射到青年c57bl/6(3个月)小鼠的胫前肌(ta)中以及每日用15-pgdh抑制剂,即sw033291(sw)或媒介物(每组n=4只小鼠)腹膜内(i.p.)处理。(图20i)实验方案。(图20j)解剖的ta肌肉的重量。(图20k)跖屈强直性力(绝对值)。*p《0.05,**p《0.01,***p《0.001****p《0.0001。用于多重比较的邦费罗尼校正的anova检验(图20j和20k);多重t检验(图20c),曼-惠特尼检验(图20b和20e-20h)。平均值
±
s.e.m。
49.图21a-21k:pge2介导15-pgdh抑制的有益作用。(图21a-21g)将携带针对前列腺素d2合酶ptgds的shrna(shptgds)或加扰(scr)对照的构建体的aav9肌内(i.m.)注射到老年(》24个月)c57bl/6小鼠的腓肠肌(ga)中。(图21a)实验方案。(图21b)通过qpcr测量的ptgds的表达(每组n=4)。(图21c)通过质谱分析法定量的肌肉组织裂解物中的pgd2水平(每组n=4)。(图21d)解剖的ga的重量。(图21e)跖屈强直性力(归一化至基线的值)。(图21f)跖屈强直性力(绝对值)。(图21g)跑步机上筋疲力尽的距离。(图21h-21k)将携带驱动cre表达的mck启动子的构建体的aav9肌内(i.m.)注射到ep4f/f小鼠或同窝出生仔畜(littermate)对照(ep4+/+)的ga中。然后每天用15-pgdh抑制剂,即sw033291(sw)或媒介物处理小鼠,并在1个月时测量肌肉功能。(图21h)实验方案。(图21i)解剖的ga的重量(图21j)跖屈强直性力
(归一化至基线的值)。(图21k)跖屈强直性力(绝对值)。*p《0.05,**p《0.01,***p《0.001****p《0.0001。用于多重比较的邦费罗尼校正的anova检验(图21b、21d-21g和21i-21k);曼-惠特尼检验(图21c)。平均值
±
s.e.m。缩写:mo.,月;i.p.,腹膜内;i.m.,肌内。
50.图22.前列腺素受体在肌管中的表达。肌管(第4天分化肌管)的pge2受体ep1-4(ptger1-4)、pgd2受体(ptgdr1-2)和pgf2a受体(ptgfr)的表达水平。
51.图23a和23b。pge2处理导致肌肉中creb的活化。(a)来自i.m.注射pge2 0分钟、30分钟或60分钟后的青年(3mo.)c57bl/6小鼠的肌肉裂解物的免疫印迹。(b)(a)中免疫印迹的定量。**p《0.01。用于多重比较的邦费罗尼校正的anova检验(b)。平均值+s.e.m。
52.图24a-24i:15-pgdh抑制影响多种途径以改善肌肉功能。(图24a-24c)用15-pgdh抑制剂,即sw033291(sw)或媒介物每天处理老化肌肉小鼠的rna测序分析,并在1个月时测量肌肉功能(各自为n=3)。(图24a)上调(左)和下调(右)基因的kegg和go术语分析。(图24b)在(图24a)中鉴定的线粒体基因的热图。(图24c)通过qpcr的pgc1a的表达水平(每组n=4)。(图24d)线粒体dna与核dna的相对定量(每组n=4)。(图24e)在(图24a)中鉴定的蛋白质泛素相关基因(顶部)和tgf-β信号传导途径(底部)的热图。(图24f)从来源于用pge2(10ng/ml)处理0、15或30分钟的人肌肉活检的肌原性前体分化的肌管(mt)的免疫印迹。(图24g)来自媒介物和sw处理的老年小鼠的肌肉裂解物的免疫印迹(顶部)和定量(底部)(每个n=4)。(图24h)通过qpcr测量媒介物和sw处理中murf1(trim63)、atrogin-1(fbxo32)和肌肉生长抑制素(mstn)的表达水平(对于年的媒介物处理,n=12,以及对于老年的sw处理,n=8)。(图24i)通过qpcr测量在scr和sh15pgdh处理中murf1(trim63)、atrogin-1(fbxo32)和肌肉生长抑制素(mstn)的表达水平(对于老年的shscr处理,n=5,对于老年的sh15pgdh处理,n=4)。*p《0.05,**p《0.01,***p《0.001****p《0.0001。用于多重比较的邦费罗尼校正的anova检验(图24c);曼-惠特尼检验(图24d和24g-1)。平均值
±
s.e.m。缩写:kegg:京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes);go:基因本体;bp:生物过程;mf:分子功能;cc:细胞组分。
53.图25a-25d:pge2处理导致肌管中蛋白质合成增加。(图25a)饥饿24小时,并用媒介物、用在ep4拮抗剂ono-ae3-208(1μm)存在下的pge2(10ng/ml)或sw(1μm)同时处理的分化后肌管的直径。(每种情况,n=4)。(图25b)如(图25a)中处理的饥饿肌管的代表性图像。dapi,蓝色;myh,红色。比例尺=50μm。(图25c)左:用媒介物或pge2处理4天的分化后肌管的直径。右:用媒介物或pge2处理4天的分化后肌管的代表性图像。dapi,蓝色;肌球蛋白重链(myh),红色。比例尺=50μm。dm,分化培养基。(图25d)左:嘌呤霉素掺入每天用pge2(10ng/ml)或媒介物处理(4d)的分化鼠肌管的免疫印迹。在嘌呤霉素添加期间加入环己酰亚胺作为对照。右:上样对照呈现为丽春红s染色。用于多重比较的邦费罗尼校正的anova检验(图25a),曼-惠特尼检验(图25b)。***p《0.001,****p《0.0001。平均值+s.e.m。
54.图26a-26d:老化肌肉中15-pgdh抑制或敲低的表征。(图26a)媒介物和sw处理的老化肌肉中萎缩标志物的表达水平(分别为n=8和5)。(图26b)在媒介物处理的青年(3mo.)肌肉和sw处理的老化肌肉中自噬标志物的表达水平(对于青年的,n=4,对于媒介物处理的老化的,n=12,以及对于sw处理的老化的,n=8)。(图26c)在媒介物和sw处理的老化肌肉中炎性和衰老标志物的表达水平(每种情况n=3)。(图26d)在shscr和sh15pgdh aav9处理的老化肌肉中炎性和衰老标志物的表达水平,(每种情况n=5)。曼-惠特尼检验(图26a、26c和
26d),用于多重比较的邦费罗尼校正的anova检验(图26b),*p《0.05,**p《0.01。平均值+s.e.m。缩写:n.s.,不显著。
55.图27a和27b:pge2降解酶15-pgdh在衰老组织中增加。(图27a)pge2和pgd2分解代谢方案。(图27b)在青年(2个月)和老年(25个月)小鼠的组织中测定15-pgdh酶促比活性。活性表示为相对于青年的变化百分比。*p《0.05,**p《0.001,***p《0.0005。多重t检验(图27b)。平均值
±
s.e.m。缩写:spl.脾脏;mus.肌肉。
56.图28:年轻和老化组织的15-pgdh比活性测定。从年轻(灰色)和老化(黑色)组织制备的裂解物中15-pgdh比活性的动力学测量。详述1.引言
57.本公开内容部分地基于以下发现:pge2信号传导的丧失导致在衰老和肌营养不良期间骨骼肌的消瘦并且与肌肉萎缩相关,以及pge2分解代谢失调,导致对衰老的、营养不良的或萎缩性肌肉组织的有害影响。在老化的肌肉组织中,以较低的水平检测到pge2,这是先前与衰老无关的现象。此外,在老化或营养不良肌肉中升高的pge2降解酶15-pgdh的水平(部分由于衰老细胞的积累)导致肌肉组织pge2水平的降低。因此,本公开内容提供了基于使用15-pgdh活性作为老化和/或营养不良肌肉中的治疗靶标以改善例如肌肉萎缩,增加肌肉质量、功能和力量的组合物和方法。特别地,15-pgdh(例如,活性或水平,例如,mrna和/或蛋白)的降低或抑制可导致在衰老和肌营养不良中骨骼肌功能的改善。在一个实施方案中,本文提供的方法包括施用15-pgdh抑制剂以治疗老化和/或营养不良肌肉。在一些情况下,所述方法包括增加老化的、萎缩的或营养不良的肌肉中pge2的水平(例如,通过抑制pge2降解酶15-pgdh)。
58.例如,在不存在损伤、运动或再生的情况下,老化的、萎缩的或营养不良的肌肉中pge2水平的升高、增加或恢复可以改善肌肉消瘦,揭示了pge2降解酶15-pgdh在肌肉消瘦疾病如肌营养不良和衰老中的先前未认识到的作用。特别地,pge2可以在不存在损伤的情况下在体内平衡中作用于成熟的肌纤维。因此,15-pgdh抑制剂(例如,sw033291)可以恢复衰老的、萎缩的和/或营养不良的骨骼肌中pge2的水平,以及降低无活性的pge2代谢物(例如,pgem)的水平。在一些情况下,本文所述的15-pgdh抑制剂的使用可以增加或增强肌肉质量、力量、运动性能和/或功能。pge2信号传导的途径可以通过分化的肌细胞和肌纤维中的ep4受体发生,并且可以通过抑制atrogin1表达(肌肉萎缩的关键介质)直接调节肌肉质量。15-pgdh抑制可以通过局部或全身策略来实现,克服了老化的、萎缩的和营养不良的肌肉微环境的有害影响,并导致老化的和营养不良的肌肉中肌肉质量、力量和耐力的稳健增加。
59.本公开内容还部分地基于以下发现:pge2降解酶15-pgdh或其转录物在一系列衰老组织,特别是非骨骼肌组织中升高。因此,15-pgdh蛋白或转录物可以用作非骨骼肌组织中,例如患有年龄相关病症或疾病的对象中的衰老的生物标志物。另外,可以抑制15-pgdh以逆转或减缓非骨骼肌组织中的衰老和衰老相关过程,从而改善其功能。不受以下理论的束缚,认为在患有年龄相关病症或疾病的对象的非骨骼肌组织中,例如在结肠、脑、皮肤、脾脏或肝脏中,升高的15-pgdh水平导致这些组织中的pge2和/或pgd2降解,因此导致较低水平的pge2和/或pgd2以及pge2和/或pgd2信号传导,其对衰老中表现出的组织功能具有有害影响。因此,本公开内容提供了基于使用15-pgdh活性作为患有年龄相关疾病或病症的对象
的非骨骼肌组织中的治疗靶标的组合物和方法。抑制这些组织中的15-pgdh可以恢复或增加组织中的pge2和/或pgd2水平,并且可以改善它们的功能、健康和/或生理活性。因此,降低15-pgdh可以导致改善的生活质量和年龄相关疾病的结果。
60.可以使用本发明的方法和组合物治疗的非骨骼肌组织的非限制性列表包括,例如,表皮、血管、心肌、脑、骨、软骨、平滑肌、棕色脂肪、脾脏、肝脏等。15-pgdh升高可以发生在老化组织的疾病中,包括心血管疾病(例如,心房纤颤、中风、缺血性心脏病、心肌病、心内膜炎、脑内出血),慢性呼吸道疾病(例如,慢性阻塞性肺病、石棉肺、矽肺)、营养性疾病(沙眼、腹泻疾病、脑炎)、肾脏疾病(例如,慢性肾脏疾病),胃肠和消化疾病(例如nash、胰腺炎、溃疡、肠梗阻),神经病症(例如阿尔茨海默病、痴呆、帕金森病),感觉障碍(例如听力损失、黄斑变性、青光眼),皮肤和皮下疾病(例如蜂窝织炎、溃疡、真菌皮肤病、脓皮病),骨质疏松症,骨关节炎,类风湿性关节炎等。另外,导致早衰综合征的这些组织的遗传病症,如布卢姆综合症、科克因综合症、hutchinson-gilford progeria综合征、下颌骨发育不良、早衰、早衰样综合征、rothmund-thomson综合征、seip综合征、werner综合征、唐氏综合征、肢端早老症、rothmund-thomson综合征,以及导致早衰综合征的这些组织的免疫缺陷,如共济失调毛细血管扩张,以及导致早衰综合征的这些组织的感染性疾病,如人免疫缺陷病毒(hiv),也可受益于15-pgdh抑制。
61.用15-pgdh抑制剂治疗非骨骼肌组织可以提供许多优点,如治疗可定位于表达升高水平的酶的特定细胞类型(例如,患病或老化非骨骼肌组织);它提供恢复pge2和/或pgd2的内源性水平以达到pge2和/或pgd2的生理学“年轻”水平的能力;它可以靶向具有高衰老细胞浸润的非骨骼肌组织(例如,结肠、皮肤、脾脏),其被认为在衰老和衰老相关病况中具有有害作用;以及它提供了用具有相对长半衰期的分子或通过使用基因治疗靶向15-pgdh的可能性,以便提供持续的、全身性pge2和/或pgd2益处。2.概述
62.实施本文公开的方法利用分子生物学领域中的常规技术。公开本文所述的一般使用方法的基本文本包括sambrook和russell,molecular cloning,a laboratory manual(第3版,2001);kriegler,gene transfer and expression:a laboratory manual(1990);以及current protocols in molecular biology(ausubel等人编,1994))。
63.对于核酸,大小以千碱基(kb)、碱基对(bp)或核苷酸(nt)给出。单链dna和/或rna的大小可以以核苷酸给出。这些为来自琼脂糖或丙烯酰胺凝胶电泳、来自测序的核酸或来自发表的dna序列的估算值。对于蛋白质,大小以千道尔顿(kda)或氨基酸残基数量给出。蛋白质大小为来自凝胶电泳、来自测序的蛋白质、来自推导的氨基酸序列或来自发表的蛋白质序列的估算值。
64.不可商购获得的寡核苷酸可以,例如,根据由beaucage和caruthers,tetrahedron lett.22:1859-1862(1981)首次描述的固相亚磷酰胺三酯方法,使用如van devanter等人,nucleic acids res.12:6159-6168(1984)中所描述的自动化合成仪化学合成。寡核苷酸的纯化使用任何本领域认可的策略进行,例如如pearson和reanier,j.chrom.255:137-149(1983)中所述的非变性丙烯酰胺凝胶电泳或阴离子交换高效液相色谱(hplc)。3.定义
65.如本文所用,除非另有说明,否则以下术语具有赋予它们的含义。
66.本文所用的术语“一个/一种(a)”、“一个/一种(an)”或“所述”不仅包括具有一个/种成员的方面,还包括具有多于一个/种成员的方面。例如,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物,除非上下文另有明确规定。因此,例如,提及“一个细胞”包括多个这样的细胞,且提及“所述试剂”包括提及本领域技术人员已知的一种或多种试剂,等等。
67.本文所用的术语“约”和“大约”通常意指给定测量的性质或精度所测量的量的可接受的误差程度。通常,示例性误差程度在给定值或值范围的20%(%)内,优选在10%内,更优选在5%内。任何提及的“约x”特别地表示至少值x、0.8x、0.81x、0.82x、0.83x、0.84x、0.85x、0.86x、0.87x、0.88x、0.89x、0.9x、0.91x、0.92x、0.93x、0.94x、0.95x、0.96x、0.97x、0.98x、0.99x、1.01x、1.02x、1.03x、1.04x、1.05x、1.06x、1.07x、1.08x、1.09x、1.1x、1.11x、1.12x、1.13x、1.14x、1.15x、1.16x、1.17x、1.18x、1.19x和1.2x。因此,“约x”旨在教导和提供对例如“0.98x”的要求限制的书面描述支持。
[0068]“年龄相关的病况”或“年龄相关的疾病”是指在非骨骼肌组织中显示或可能显示与年龄增加或时间流逝相关的任何体征或特征的任何疾病、病况或病症,包括例如组织功能的丧失或降低、组织健康的丧失或降低、组织的一种或多种生理活动的丧失或降低、组织细胞中蛋白质合成降低、组织细胞中蛋白质降解增加、组织的存活或活力降低、组织内细胞增殖降低、组织细胞中端粒缩短、组织细胞中线粒体功能障碍、组织中衰老细胞的存在增加、组织中pge2和/或pgd2水平降低等。病况或疾病可以是由于时间流逝而引起的自然衰老过程的结果;其它因素如生活方式因素或疾病,例如感染性疾病的结果;或者引起早衰的遗传病况的结果。
[0069]
本文所用的“非骨骼肌”组织可以指身体中除了骨骼肌以外的任何组织(例如,除了胸肌复合体、背阔肌、大圆肌和肩胛下肌、肱桡肌、二头肌、肱肌、旋前方肌、旋前圆肌、桡侧屈腕肌、尺侧屈腕肌、屈指浅肌、屈指深肌、拇短屈肌、拇指对掌肌、拇收肌、拇短屈肌、髂腰肌、腰肌、腹直肌、股直肌、臀大肌、臀中肌、内侧腘绳肌(medial hamstrings)、腓肠肌、外侧腘绳肌、四头肌机制、长收肌、短收肌、大收肌、腓肠肌内侧、腓肠肌外侧、比目鱼肌、胫后肌、胫前肌、屈趾长肌、屈趾短肌、屈姆长肌、伸姆长肌、眼肌、咽肌、括约肌、手肌、臂肌、脚肌、腿肌、胸肌、胃肌、背肌、臀肌、肩肌、头和颈肌以外),并且可以涵盖包括多种组织类型的器官,以及器官或组织内的特定细胞类型。例如,“非骨骼肌组织”可以包括以下中的任一种:上皮组织、神经组织、结缔组织、平滑肌、心肌、表皮组织、血管组织、心脏、肾脏、脑、骨、软骨、棕色脂肪、脾脏、肝脏、结肠、感觉器官、甲状腺、肺、血液、小肠、牙组织、卵巢或其它生殖组织或器官、毛发、耳蜗、少突胶质细胞及以上的组合。
[0070]“肌肉减少症”是指与年龄相关的肌肉质量、力量和/或身体表现的损失。肌肉减少症是一个进行性过程,其可以在不同个体中以不同比率发生,并且没有诊断的最小年龄。例如,对于本文提供的方法的目的,如果人至少是例如20岁、25岁、30岁、35岁、40岁、45岁、50岁、55岁、60岁、65岁、70岁、75岁或以上,则可以认为人患有肌肉减少症。
[0071]“老化肌肉”或“衰老肌肉”是指在发育的肌肉中显示或可能显示与年龄增加或时间流逝相关的任何体征或特征的任何肌肉(例如骨骼肌),包括例如肌肉质量或力量的损失、蛋白质合成降低、肌细胞内外脂质的积累、线粒体功能障碍、萎缩基因(例如,atrogin1、murf和musa)的表达、存在的衰老细胞增加、pge2代谢物(例如,pgem)的水平升高等。在一些
实施方案中,老化或衰老的肌肉是指患有肌肉减少症的对象的肌肉。
[0072]“肌肉萎缩”或“萎缩性肌肉”是指肌肉组织的任何损失或消瘦,例如,由于任何原因,例如,与诸如肌肉减少症、糖尿病、肌营养不良、肌肉减少性肥胖、神经病、癌症恶病质或hiv恶病质、虚弱或者由固定或废用引起的肌肉萎缩的病况相关的肌肉大小、质量或功能的任何量的降低。
[0073]
术语“前列腺素e2”、“pge2”和“地诺前列酮”是指可以从花生四烯酸经由环氧合酶(cox)和最终的前列腺素e合酶(pge5)合成的前列腺素。pge2在包括血管舒张、炎症和调节睡/醒循环在内的多种生物功能中起作用。关于pge2的结构和功能信息可以见于例如pubchem:pubchem.ncbi.nlm.nih.gov/compound/dinoprostone的“地诺前列酮”的条目中,其内容通过引用以其整体并入本文。
[0074]
术语“前列腺素d2”或“pgd2”是指可以从花生四烯酸经由环氧合酶(cox)和pgd2合酶(ptds)合成的前列腺素。pgd2是pge2的结构异构体,其中pge2上的9-酮基和11-羟基在pgd2上颠倒。pgd2在包括血管收缩、炎症、睡眠期间体温的调节、趋化性和男性性发育在内的多种生物功能中起作用。关于pgd2的结构和功能信息可以见于例如pubchem:pubchem.ncbi.nlm.nih.gov/compound/448457的“前列腺素d2”的条目中,其内容通过引用以其整体并入本文。
[0075]“15-pgdh”(15-羟基前列腺素脱氢酶)是参与多种活性前列腺素失活的酶,例如,通过催化pge2氧化成15-酮-前列腺素e2(15-酮-pge2),或催化pgd2氧化成15-酮-前列腺素d2(15-酮-pgd2)。人类酶由hpgd基因(gene id:3248)编码。该酶是短链非金属酶醇脱氢酶蛋白家族的成员。存在酶的多种同种型,例如,在人类中,可以使用本发明的方法靶向其中的任一种。例如,可以靶向人类同种型1-6中的任一种(例如genbank登录号np_000851.2、np_001139288.1、np_001243236.1、np_001243234.1、np_001243235.1、np_001350503.1、np_001243230.1),也可以是与任何genbank登录号np_000851.2、np_001139288.1、np_001243236.1、np_001243234.1、np_001243235.1、np_001350503.1、np_001243230.1或任何其它15-pgdh酶的氨基酸序列具有50%、60%、70%、80%、85%、90%、95%或更高同一性的任何同种型。
[0076]“15-pgdh抑制剂”是指能够以任何方式抑制、减少、降低、减弱、取消、消除、减慢或抵消15-pgdh的表达、稳定性或活性的任何方面的任何试剂。与对照(例如,在不存在抑制剂的情况下)相比,15-pgdh抑制剂可以在体外或体内例如将编码15-pgdh的基因(例如人hpgd基因)的表达,例如转录、rna加工、rna稳定性或翻译的任何方面降低例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多。类似地,与对照(例如,在不存在抑制剂的情况下)相比,15-pgdh抑制剂可以在体外或体内例如将15-pgdh酶的活性(例如酶活性)降低例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多。此外,与对照(例如,在不存在抑制剂的情况下)相比,15-pgdh抑制剂可以在体外或体内例如将15-pgdh酶的稳定性降低例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多。“15-pgdh抑制剂”,在本文中也称为“试剂”或“化合物”,可以是天然存在的或合成的任何分子,例如肽,蛋白质,寡肽(例如,长度为约5至约25个氨基酸,例如,长度为约5、10、15、20或25个氨基酸),小分子(例如,具有小于约
2500道尔顿,例如小于2000、小于1000或小于500道尔顿的分子量的有机分子),抗体,纳米抗体,多糖,脂质,脂肪酸,抑制性rna(例如sirna、shrna、微rna),修饰的rna,多核苷酸,寡核苷酸,例如反义寡核苷酸,适配子,affimer,药物化合物或其它化合物。
[0077]“溶解性药剂”是指能够在体外或体内诱导衰老细胞死亡,例如诱导至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的衰老细胞群体死亡的任何试剂。可以用于本发明方法的溶解性药剂的非限制性列表包括bcl2抑制剂(例如,纳维托克(abt-263)、abt-737)、泛酪氨酸激酶抑制剂(例如,达沙替尼)、类黄酮(例如,槲皮素)、干扰foxo4-p53相互作用的肽(例如,foxo4-dri),使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统,hsp90抑制剂(例如,17-dmag)及以上的组合。在特定实施方案中,溶解性药剂能够诱导例如老化和/或萎缩性肌肉中的巨噬细胞和/或纤维脂肪生成祖(fap)细胞和/或非骨骼肌组织中的巨噬细胞和/或纤维脂肪细胞的例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多衰老细胞的死亡。
[0078]
术语“表达”和“表达的”是指转录和/或翻译产物的产生,例如编码蛋白质(例如15-pgdh)的核酸序列的产生。在一些实施方案中,该术语是指由基因(例如,人类hpgd基因)或其部分编码的转录和/或翻译产物的产生。dna分子在细胞中的表达水平可以基于细胞内存在的相应mrna的量或由细胞产生的dna编码的蛋白质的量来评估。
[0079]
术语“抗体”是指由特异性结合和识别抗原的免疫球蛋白基因或其功能片段编码的多肽。识别的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数的免疫球蛋白可变区基因。轻链被分类为κ或λ。重链被分类为γ、μ、α、δ或ε,其依次分别定义免疫球蛋白类别igg、igm、iga、igd和ige。该术语包括具有相同抗原特异性的抗体片段及其融合产物。
[0080]
示例性免疫球蛋白(抗体)结构单位包含四聚体。每个四聚体由两对相同的多肽链组成,每对具有一条“轻”链(约25kda)和一条“重”链(约50-70kda)。每条链的n-末端限定了主要负责抗原识别的约100-110个或更多氨基酸的可变区。因此,术语“可变重链”、“v
h”或“vh”是指免疫球蛋白重链的可变区,包括fv、scfv、dsfv或fab;而术语“可变轻链”、“v
l”或“vl”是指免疫球蛋白轻链的可变区,包括fv、scfv、dsfv或fab。等效分子包括例如通过修饰抗体片段或通过从噬菌体展示文库中选择而获得的具有期望抗原特异性的抗原结合蛋白。
[0081]
术语“抗原结合部分”和“抗原结合片段”在本文中可互换使用,并且是指保留特异性结合抗原(例如,15-pgdh蛋白)的能力的抗体的一个或多个片段。抗体结合片段的实例包括但不限于fab片段(由vl、vh、cl和ch1结构域组成的单价片段),f(ab’)2片段(包含在铰链区通过二硫化物桥连接的两个fab片段的二价片段),单链fv(scfv),二硫化物连接的fv(dsfv),互补决定区(cdr),vl(轻链可变区,vh(重链可变区),纳米抗体,以及那些的任何组合或能够结合靶抗原的免疫球蛋白肽的任何其它功能部分(参见,例如,fundamental immunology(paul ed.,4th ed.2001))。
[0082]
短语“特异性结合”是指与靶标结合的分子(例如,15-pgdh抑制剂,如小分子或抗体),所述分子以比其与非靶标化合物的结合更高的亲和力、亲合力、更容易地和/或以更大的持续时间结合靶标。在一些实施方案中,特异性结合靶标(例如,15-pgdh)的分子以比非靶标化合物高至少2倍的亲和力,例如,高至少3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、25倍、50倍或更高的亲和力结合靶标。例如,在一些实施方案中,特异性结合15-pgdh的分子
通常以比非15-pgdh靶标高至少2倍的亲和力结合15-pgdh。
[0083]
在化合物的上下文中,术语“衍生物”包括但不限于给定化合物的酰胺、醚、酯、氨基、羧基、乙酰基和/或醇衍生物。
[0084]
术语“治疗”或“处理”是指以下中的任一种:改善疾病或病况的一种或多种症状;在其出现前阻止此类症状的显现;减慢或完全阻止疾病或病况的进展(其可以通过复发期之间较长的时间段、减慢或阻止症状恶化等显示);增强缓解期的开始;减慢疾病或病况的进行性-慢性期造成的不可逆损伤(第一阶段和第二阶段);延迟所述进行性阶段的开始;或以上的任意组合。
[0085]
术语“施用(administer)”、“施用(administering)”或“施用(administration)”是指可用于使递送诸如本文中描述的化合物的试剂或组合物至生物作用的期望位点成为可能的方法。这些方法包括但不限于,肠胃外施用(例如,静脉内、皮下、腹膜内、肌内、动脉内、血管内、心内、鞘内、鼻内、皮内、玻璃体内等)、透粘膜注射、口服施用、以栓剂施用以及局部施用。本领域技术人员会知道用于施用治疗有效量的本文所述的化合物来预防或减轻一种或多种与疾病或病况相关的症状的另外方法。
[0086]
术语“治疗有效量”或“治疗有效剂量”或“有效量”是指足以产生有益的或期望的临床效果的化合物(例如15-pgdh抑制剂)的量。治疗有效量或剂量可以基于每名患者独特的因素,包括但不限于患者年龄、体型、疾病或病况的类型或程度、疾病或病况的阶段、施用途径、所使用的补充疗法的类型或范围、进行中的疾病过程以及期望的治疗类型(例如,侵入性的对比常规的治疗)。可以由细胞培养和动物模型初步估计本文所述的药物化合物或组合物的治疗有效量。例如,细胞培养方法中测定的ic
50
值可以用作动物模型的起始点,而动物模型中测定的ic
50
值可以用于探寻人体中的治疗有效剂量。
[0087]
术语“药学上可接受的载体”是指不对有机体造成显著刺激且不消除所施用化合物的生物活性和特性的载体或稀释剂。
[0088]
术语“对象”、“个体”和“患者”在本文中可互换使用,是指脊椎动物,优选哺乳动物,更优选人。哺乳动物包括但不限于小鼠、大鼠、猿、人类、农场动物或用于人类食用的牲畜,如猪、牛和绵羊,以及运动动物和宠物。对象还包括脊椎动物,如鱼和家禽。
[0089]
在施用化合物的上下文中,术语“急性方案”是指将化合物暂时或短暂应用至对象,例如人类对象,或者是指将化合物重复应用至对象,例如人类对象,其中应用之间间隔期望的时间段(例如,1天)。在一些实施方案中,急性方案包括在治疗过程中或在延长的时间段内将化合物急性暴露(例如,单剂量)于对象。在其它实施方案中,急性方案包括将化合物间歇暴露(例如,重复的剂量)于对象,其中每次暴露之间间隔期望的时间段。
[0090]
在施用化合物的上下文中,术语“慢性方案”是指将化合物在延长的时间段内重复地、长期地应用至对象,例如人类对象,使得化合物的量或水平在选定的时间段内基本恒定。在一些实施方案中,慢性方案包括将对象在延长的时间段内连续暴露于化合物。
[0091]“表达盒”是重组或合成产生的核酸构建体,其具有允许特定多核苷酸序列在宿主细胞中转录的一系列特定核酸元件。表达盒可以是质粒、病毒基因组或核酸片段的一部分。通常,表达盒包含与启动子可操作地连接的待转录的多核苷酸。启动子可以是异源启动子。在与多核苷酸可操作地连接的启动子的上下文中,“异源启动子”是指不会如此可操作连接到与天然产物(例如在野生型有机体中)中发现的多核苷酸相同的多核苷酸的启动子。
[0092]
术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非特别限定,否则该术语涵盖含有天然核苷酸的已知类似物的核酸,其具有与参考核酸类似的结合特性,并且以与天然存在的核苷酸类似的方式被代谢。除非另有说明,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(例如简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。在特定实施方案中,使用修饰的rna分子,例如,具有某些化学修饰的mrna,以在导入细胞时允许增加稳定性和/或翻译,如下文更详细描述的。应理解,本发明方法中使用的任何rna(包括核酸抑制剂如sirna或shrna)可以与化学修饰一起使用以增强例如稳定性和/或效力,例如,如dar等人,(2016)scientific reports 6:article no.20031(2016)所述以及如在crdd.osdd.net/servers/sirnamod/处可访问的数据库中所呈现的。
[0093]“多肽”、“肽”和“蛋白质”在本文中可互换使用,是指氨基酸残基的聚合物。所有三个术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是相应的天然存在的氨基酸的人工化学模拟物;以及适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。如本文所用,该术语涵盖任何长度的氨基酸链,包括全长蛋白质,其中氨基酸残基通过共价肽键连接。
[0094]
如本文所用,在描述两个或更多个多核苷酸或氨基酸序列的上下文中,术语“相同的”或“同一性百分比”是指相同的两个或更多个序列或者指定的子序列。当在比较窗口或指定区域上比较和比对最大对应性时,“基本上相同”的两个序列具有至少60%同一性,优选65%、70%、75%、80%、85%、90%、91%、92%、93、94%、95%、96%、97%、98%、99%或100%同一性,如使用序列比较算法或通过手动比对和目视检查未指定特定区域所测量的。关于多核苷酸序列,该定义还指测试序列的互补物。关于氨基酸序列,在一些情况下,同一性存在于长度为至少约50个氨基酸或核苷酸的区域上,或更优选存在于长度为75-100个氨基酸或核苷酸的区域上。
[0095]
对于序列比较,通常一个序列用作与测试序列比较的参考序列。当使用序列比较算法时,将测试序列和参考序列输入到计算机中,如果需要,指定子序列坐标,并且指定序列算法程序参数。可以使用默认的程序参数,或者可以指定替代参数。序列比较算法然后基于程序参数计算测试序列相对于参考序列的序列同一性百分比。为了核酸和蛋白质的序列比较,使用blast 2.0算法和默认参数。4.增强萎缩和/或老化肌肉的肌肉质量、耐力、力量或功能的方法
[0096]
在一个实施方案中,本文提供了增强对象中老化骨骼肌的肌肉功能的方法,所述方法包括:向所述老化骨骼肌施用有效抑制衰老细胞(例如,老化骨骼肌附近或内部存在的,例如老化骨骼肌微环境中存在的)中的15-pgdh活性和/或降低衰老细胞中的15-pgdh水平(例如,mrna和/或蛋白水平)的量的15-pgdh抑制剂,从而增强老化骨骼肌的肌肉功能。
[0097]
在另一个实施方案中,本文提供了增加对象中老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力的方法,所述方法包括:向所述老化骨骼肌施用有效抑制衰老细胞(例如,老化骨骼肌附近或内部存在的,例如老化骨骼肌微环境中存在的)中的15-pgdh活性和/或降低衰老细胞中的15-pgdh水平(例如,mrna和/或蛋白水平)的量的15-pgdh抑制剂,从而增加老年骨骼肌的肌肉质量,肌肉力量和/或肌肉耐力。
[0098]
在另一个实施方案中,提供了提高对象的老化骨骼肌中pge2水平的方法,所述方
法包括:向所述骨骼肌施用有效增加所述老化骨骼肌中pge2水平的量的15-pgdh抑制剂(例如,通过抑制15-pgdh活性或降低15-pgdh表达水平),从而提高所述老化骨骼肌中的pge2水平。
[0099]
在另一个实施方案中,提供了在具有一种或多种衰老生物标志物的对象中使老化骨骼肌复壮的方法,所述方法包括:向所述具有一种或多种衰老生物标志物的对象施用有效抑制所述对象中的15-pgdh活性和/或降低所述对象中的15-pgdh水平(例如,mrna和/或蛋白水平)的量的15-pgdh抑制剂,从而使所述老化骨骼肌复壮。
[0100]
本文提供的方法可以用于增强老化骨骼肌的功能。本文提供的方法可以用于使老化骨骼肌复壮。本文提供的方法可以用于增加老化骨骼肌的肌肉质量、肌肉力量、肌力和/或肌肉耐力。
[0101]
在各个方面,老化骨骼肌可以具有一种或多种衰老细胞(例如,存在于骨骼肌组织内或附近)。在一些情况下,老化骨骼肌可以具有多种衰老细胞(例如,存在于骨骼肌组织内或附近)。在一些情况下,老化骨骼肌可以具有增加的衰老细胞的积累(例如,在骨骼肌组织内或附近)(例如,相对于年轻骨骼肌)。在一些情况下,老化骨骼肌可以具有比年轻骨骼肌中通常发现的数量更高(例如,显著更高)的多种衰老细胞。衰老细胞可以表达一种或多种衰老标志物。相对于非衰老细胞,衰老细胞可以具有增加的一种或多种衰老标志物水平。一种或多种衰老标志物可以是但不限于p15ink4b、p16ink4a、p19arf、p21、mmp13、il1a、il1b和il6。在各个方面,可以基于骨骼肌内存在的衰老细胞的水平和/或基于一种或多种衰老标志物的存在或水平来选择对象用于治疗(例如,通过本文公开的任何方法)。在一些情况下,骨骼肌内衰老细胞的存在(例如,数量高于在年轻肌肉中通常发现的数量)和/或一种或多种衰老标志物的存在和/或水平可以指示治疗(例如,本文公开的任一种)可能提供治疗益处。在一些情况下,衰老细胞可以表达15-pgdh(例如,以有效降低老化骨骼肌内pge2水平的水平)。在一些情况下,衰老细胞可以是巨噬细胞。
[0102]
在各个方面,对象可以表达一种或多种衰老生物标志物。衰老生物标志物可以包括但不限于15-pgdh水平的增加(例如,相对于年轻骨骼肌中存在的水平)、pge2水平的降低(例如,相对于年轻骨骼肌中存在的水平)、pge2代谢物的增加(例如,相对于年轻骨骼肌中存在的水平)、衰老细胞积累的增加或更多(例如,相对于年轻骨骼肌中存在的水平)、一种或多种萎缩基因(例如,atrogin1(mafbx1)、musa(fbxo30)和trim63(murf1))的表达增加(例如,相对于年轻骨骼肌中存在的水平)、线粒体生物发生和/或功能的降低(相对于年轻骨骼肌中存在的水平)和转化生长因子途径信号传导的增加(例如,涉及转化生长因子信号传导途径的一种或多种基因表达的增加,例如,活化素受体、肌肉生长抑制素、smad蛋白和骨形态发生蛋白中的一种或多种)(例如,相对于年轻骨骼肌中存在的水平)。在一些情况下,老化生物标志物可以包括15-pgdh水平或活性增加(例如,在老化骨骼肌内)(例如,相对于年轻骨骼肌中存在的水平)。在一些情况下,老化生物标志物可以包括pge2水平降低(例如,在老化骨骼肌内)(例如,相对于年轻骨骼肌中存在的水平)。在一些情况下,老化生物标志物可以包括pge2代谢物(例如,15-酮pge2和13,14-二氢-15-酮pge2)的水平升高(例如,相对于年轻骨骼肌中存在的水平)。在一些情况下,老化生物标志物的存在可以指示对象可以受益于根据本文公开的任何方法的治疗。在一些情况下,基于一种或多种衰老生物标志物的存在,选择对象用于通过本文公开的方法(例如,用15-pgdh抑制剂)进行治疗。
[0103]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前老化骨骼肌中存在的水平,老化骨骼肌中存在的pge2水平可以增加(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前老化骨骼肌中存在的水平,老化骨骼肌中的pge2水平可以增加(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化骨骼肌中存在的pge2的水平可以增加(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻骨骼肌中存在的水平基本上类似的水平。老化骨骼肌中的pge2水平可以增加(例如,通过本文公开的任何方法)至年轻骨骼肌中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。
[0104]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前老化骨骼肌中存在的水平,老化骨骼肌中存在的pge2代谢物水平可以降低(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前老化骨骼肌中存在的水平,老化骨骼肌中的pge2代谢物水平可以降低(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化骨骼肌中存在的pge2代谢物的水平可以降低(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻骨骼肌中存在的水平基本上类似的水平。老化骨骼肌中的pge2代谢物水平可以降低(例如,通过本文公开的任何方法)至年轻骨骼肌中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。pge2代谢物可以是15-酮pge2、13,14-二氢-15-酮pge2或两者。
[0105]
在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致肌纤维和/或肌管横截面积和/或直径增加(例如,相对于治疗之前的老化骨骼肌,和/或增加至与在年轻骨骼肌中的水平基本上类似的水平(或50%内或更低)。在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致氧化(iia型)和/或糖酵解(iib型)纤维的横截面积和/或直径增加(例如,相对于治疗之前的老化骨骼肌,和/或增加至与在年轻骨骼肌中的水平基本上类似的水平(或约50%内或更低)。
[0106]
在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致选自以下的一种或多种萎缩基因的表达水平(例如,在老化骨骼肌中)降低:atrogin1(mafbx1)、musa(fbxo30)和trim63(murf1)(例如,相对于治疗之前的老化骨骼肌,和/或增加至与在年轻骨骼肌中的水平基本上类似的水平(或约50%内或更低)。在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致线粒体复合物的一种或多种组分的表达水平(例如,在老化骨骼肌中)增加(例如,相对于治疗之前的老化骨骼肌,和/或增加至与年轻骨骼肌中的水平基本上类似的水平(或约50%内或更低))。线粒体复合物的一种或多种组分可以选自:ndufa11、ndufa12、ndufa13、ndufa2、ndufa3、ndufa4、ndufa5、ndufa10、ndufb5、ndufc1、ndufs4、ndufs8、ndufv1、ndufv2、uqcrb、uqcrc1、uqcrh、uqcrq、ucqr10、cox8b、cox7a1、cox7a2、cox7b、cox6c、cox5a、cox5b、atp5f1、atp5g1、atp5h、atp5j2、atp5o、atp5e和atp5k。在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致过氧化物酶体增殖物激活受体γ辅激活物1-α(pgc1α)的表达水平
增加(例如,相对于治疗之前的老化骨骼,和/或增加至与年轻骨骼肌中的水平基本上类似的水平(或约50%内或更低)。在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致选自以下的一种或多种基因的表达水平降低:tnfaip1、klhdc8a、fbxw11、tnfaip3、herc3、herc2、hdac4、traf6、ankib1、mib1、pja2、ubr3、thbs1、smad3、acvr2a、rgmb、tgfb2和mstn(例如,相对于治疗之前的老化骨骼肌,和/或增加至与年轻骨骼肌中的水平基本上类似的水平(或约50%内或更低)。
[0107]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前的老化骨骼肌,老化骨骼肌的肌肉功能可以增强(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于治疗之前的老化骨骼肌,老化骨骼肌的肌肉功能可以增强(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化骨骼肌的肌肉功能可以增强(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻骨骼肌中存在的水平基本上类似的水平。老化骨骼肌的肌肉功能可以增强(例如,通过本文公开的任何方法)至年轻骨骼肌中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。肌肉功能可以包括增加的蛋白质合成、增加的细胞增殖、增加的细胞存活、降低的蛋白质降解或以上的任何组合。
[0108]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前的老化骨骼肌,老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力可以增加(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前的老化骨骼肌,老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力可以增加(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力可以增加(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻骨骼肌基本上类似的水平。老化骨骼肌的肌肉质量、肌肉力量和/或肌肉耐力可以增加(例如,通过本文公开的任何方法)至年轻骨骼肌的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。
[0109]
在进一步的实施方案中,本公开内容提供了增强对象中骨骼肌功能的方法,所述方法包括:向所述对象施用有效抑制骨骼肌中15-pgdh活性和/或降低骨骼肌中15-pgdh水平的量的15-pgdh抑制剂,从而增强对象中骨骼肌的功能。在一些情况下,骨骼肌为健康的骨骼肌。在一些情况下,骨骼肌是未受损伤的,尚未经历或没有经历再生,和/或尚未经历或没有经历显著或大量运动。在一些情况下,骨骼肌不是营养不良的、萎缩的或老化的。在一些情况下,所述方法不依赖于对象中肌肉干细胞增殖的增加。在一些情况下,骨骼肌为年轻骨骼肌。在一些情况下,对象小于30岁(例如是29岁、28岁、27岁、26岁、25岁、24岁、23岁、22岁、21岁、20岁、19岁、18岁、17岁、16岁、15岁、14岁、13岁、12岁、11岁、10岁、9岁、8岁、7岁、6岁、5岁、4岁、3岁、2岁或1岁)。在各个方面,所述方法导致肌肉质量增加、肌肉力量增加、肌肉耐力增加或以上的任何组合(例如,相对于例如,用15-pgdh抑制剂治疗之前的骨骼肌)。在各个方面,所述方法导致蛋白质合成的增加、细胞增殖的增加、细胞存活的增加、蛋白质降解的降低或以上的任何组合(例如,相对于例如,用15-pgdh抑制剂治疗之前的骨骼肌)。
[0110]
本公开内容还提供了增加对象(例如人类对象)中老化和/或萎缩肌肉的功能的方
法,其包括向所述对象施用15-pgdh抑制剂。15-pgdh抑制剂的施用可以是全身性的或局部的,例如通过肌内注射,并且可以增强老化和/或萎缩肌肉的许多方面中的任一种,包括增强质量、功能、力量、耐力、运动表现或对象的肌肉功能的任何其它测量。在特定实施方案中,15-pgdh抑制剂的施用导致对象中老化和/或萎缩肌肉中肌纤维和/或肌管的大小增加,例如,它们的直径或横截面增加。在其它实施方案中,15-pgdh抑制剂的施用导致对对象中肌细胞死亡,特别是成熟肌细胞死亡的保护。
[0111]
在特定实施方案中,对象中15-pgdh的抑制导致对象肌肉中pge2的增加,例如pge2水平的升高、增加或恢复,以及pge2代谢物如15-酮基-pge2或13,14-二氢-15-酮基-pge2(pgem)的降低。在一些实施方案中,所述抑制还导致对象的萎缩和/或老化肌肉中ep4活性的增加。在一些实施方案中,所述抑制还导致对象的萎缩和/或老化肌肉中atrogin1水平或活性的降低。
[0112]
在特定实施方案中,本文所述的15-pgdh抑制剂施用的益处,例如增强的肌肉力量、质量、运动性能、耐力、肌纤维或肌管大小等,不依赖于对象的萎缩和/或老化肌肉中的肌肉干细胞(musc)的数量或增殖的任何增加而发生。换句话说,虽然对象中musc的数量或增殖可能增加,但本文所述的效果不需要musc,甚至在musc的数量或增殖没有增加的情况下也会发生。在特定实施方案中,老化和/或萎缩肌肉不受损伤,也没有经历运动或再生。
[0113]
在一些实施方案中,15-pgdh抑制剂的施用抑制老化和/或萎缩肌肉内的衰老细胞,例如巨噬细胞和/或纤维脂肪生成祖(fap)细胞中的15-pgdh活性或降低所述细胞中的15-pgdh水平。在一些实施方案中,所述方法还包括向对象施用溶解性药剂。可以使用的溶解性药剂的实例尤其包括bcl2抑制剂如纳维托克(也称为abt-263)和abt-737,泛酪氨酸激酶抑制剂如达沙替尼以及类黄酮如槲皮素,干扰foxo4-p53相互作用的肽如foxo4-dri,使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统,包含达沙替尼和槲皮素的组合疗法以及hsp90抑制剂如17-dmag。应理解,所述溶解性药剂可以与15-pgdh抑制剂例如在单一药物制剂内一起施用,或分开施用。对象
[0114]
对象可以是具有老化和/或萎缩骨骼肌,或处于具有老化和/或萎缩骨骼肌的风险中的任何对象,例如人类或其它哺乳动物。在一些实施方案中,对象为人类。在一些实施方案中,对象为成人(例如,患有年龄相关肌肉减少症的成人)。在一些实施方案中,对象为儿童(例如,患有肌营养不良的儿童,如杜氏肌营养不良)。在一些实施方案中,对象为女性(例如,成年女性)。在一些实施方案中,对象为男性(例如成年男性)。
[0115]
在一些实施方案中,对象为人类,并且所述方法还包括基于他的或她的年龄选择用15-pgdh抑制剂治疗的人类的步骤。例如,可以基于超过20岁、25岁、30岁、35岁、40岁、45岁、50岁、55岁、60岁、65岁、70岁、75岁、80岁、85岁、90岁、95岁或100岁以上的年龄,或者人类患有或可能患有肌肉减少症或老化肌肉的任何年龄,来选择用于治疗的人类。在一些实施方案中,使用评估肌肉力量或功能的任何方法,例如握力测试、行走速度、肌肉力量测试、功能测试、阻力测试或跑步机,通过基于成像的测试,通过肌肉质量的评估,和/或通过分子或细胞分析,例如由医师或其它合格的医学专业人员从对象获取的肌肉活检,来确定对象具有老化和/或萎缩肌肉。
[0116]
在一些实施方案中,对象患有与肌肉萎缩相关的病况或疾病,如糖尿病、虚弱、肌
营养不良、少肌性肥胖、神经病、恶病质如癌症恶病质或hiv恶病质,或者患有由于固定或肌肉废用引起的肌肉萎缩。在一些实施方案中,对象患有选自以下的肌营养不良:杜氏肌营养不良(dmd)、贝克肌营养不良、先天性肌营养不良、远端肌营养不良、emery-dreifuss肌营养不良、面肩肱型肌营养不良、肢带肌营养不良、强直性肌营养不良(mdd)和眼咽肌营养不良。在特定实施方案中,所述肌营养不良为杜氏肌营养不良。
[0117]
在特定实施方案中,所述肌肉为骨骼肌。在一些实施方案中,所述肌肉是未受损伤的和/或未经历运动或再生。所述肌肉可以是身体的任何肌肉,包括但不限于胸肌复合体、背阔肌、大圆肌和肩胛下肌、肱桡肌、二头肌、肱肌、旋前方肌、旋前圆肌、桡侧屈腕肌、尺侧屈腕肌、屈指浅肌、屈指深肌、拇短屈肌、拇指对掌肌、拇收肌、拇短屈肌、髂腰肌、腰肌、腹直肌、股直肌、臀大肌、臀中肌、内侧腘绳肌(medial hamstrings)、腓肠肌、外侧腘绳肌、四头肌机制、长收肌、短收肌、大收肌、腓肠肌内侧、腓肠肌外侧、比目鱼肌、胫后肌、胫前肌、屈趾长肌、屈趾短肌、屈姆长肌、伸姆长肌、眼肌、咽肌、括约肌、手肌、臂肌、脚肌、腿肌、胸肌、胃肌、背肌、臀肌、肩肌、头和颈肌等。
[0118]
在一些实施方案中,基于对与肌肉萎缩相关的病况或疾病的诊断;基于肌肉萎缩的存在或潜在的确定;基于对象的年龄,例如与肌肉减少症或潜在肌肉减少症相关的年龄;或者基于对老化和/或萎缩肌肉的本文所述特征中任一种的检测来鉴定用于治疗的对象。例如,在肌肉中检测到pge2代谢物(例如,15-酮-pge2或pgem)的水平升高,在肌肉中检测到蛋白质合成的降低,检测到肌纤维和/或肌管大小的降低,检测到肌肉质量的降低,检测到肌肉力量、功能或耐力的降低,检测到atrogin1的水平或活性的提高、检测到ep4活性的降低,检测到与衰老表型相关的基因(例如ptges、cox2)表达的升高,检测到衰老细胞的数量增加,检测到一种或多种衰老标志物的存在,检测到15-pgdh水平或活性的升高(特别是在衰老细胞,例如巨噬细胞和/或纤维脂肪生成祖细胞中),可以指示对象是用15-pgdh抑制剂进行治疗的候选者。在特定实施方案中,进行这样的检测,其中肌肉既没有损伤,也没有经历运动或再生。
[0119]
可以使用本领域技术人员已知的多种方法中的任一种,例如,通过诸如通过握力测试、行走速度、肌肉力量测试、功能测试、阻力测试或跑步机的肌肉性能的分析,通过基于成像的测试,通过评估肌肉质量,和/或分子或细胞分析例如从对象获取的肌肉活检,来评估对象中的肌肉功能、力量、耐力、质量或本文所述的特征中的任一种的评估。
[0120]
在一些实施方案中,对象为农场动物,例如用于人类食用的牲畜,如猪、牛、绵羊、家禽或鱼,并且所述方法用于例如增强衰老动物,例如具有老化和/或萎缩肌肉的动物的肌肉质量、功能或力量。在一些这样的实施方案中,向动物施用15-pgdh的小分子抑制剂。在一些实施方案中,将包含15-pgdh的核酸抑制剂(例如shrna)的载体或表达盒导入动物中,使得核酸抑制剂在动物的细胞(例如肌细胞)中表达。在一些实施方案中,将包含编码15-pgdh的多肽抑制剂(例如抗体或肽)的多核苷酸的载体或表达盒导入动物,使得多肽抑制剂在动物的细胞(例如肌细胞)中表达。在一些实施方案中,使用基因疗法,例如,使得内源性15-pgdh编码基因的全部或部分被在动物的细胞(例如,肌细胞)中活性较低、稳定性较低或高度表达较低的基因形式替代。在一些实施方案中,将修饰的rna,例如化学修饰的rna抑制剂如shrna或编码多肽15-pgdh抑制剂的化学修饰的mrna导入动物,使得rna抑制剂或表达的蛋白质抑制剂存在于动物的肌细胞中。
5.增强患有年龄相关病况的对象中组织功能的方法
[0121]
在另一个实施方案中,提供了使对象中老化非骨骼肌组织复壮的方法,所述方法包括:向所述对象施用有效抑制15-pgdh的量的15-pgdh抑制剂,从而使老化非骨骼肌组织复壮。
[0122]
在各个方面,老化非骨骼肌组织可以具有一种或多种衰老细胞(例如,存在于老化组织内或附近)。在一些情况下,老化非骨骼肌组织可以具有多种衰老细胞(例如,存在于老化组织内或附近)。在一些情况下,老化非骨骼肌组织可以具有增加的衰老细胞的积累(例如,在老化非骨骼肌组织内或附近)(例如,相对于年轻非骨骼肌组织)。在一些情况下,老化非骨骼肌组织可以具有比年轻非骨骼肌组织中通常发现的数量更高(例如,显著更高)的多种衰老细胞。衰老细胞可以表达一种或多种衰老标志物。相对于非衰老细胞,衰老细胞可以具有增加的一种或多种衰老标志物水平。一种或多种衰老标志物可以是但不限于p15ink4b、p16ink4a、p19arf、p21、mmp13、il1a、il1b和il6。在各个方面,可以基于老化非骨骼肌组织内存在的衰老细胞的水平和/或基于一种或多种衰老标志物的存在或水平来选择对象用于治疗(例如,通过本文公开的任何方法)。在一些情况下,衰老非骨骼肌组织内衰老细胞的存在(例如,数量高于在年轻非骨骼肌组织中通常发现的数量)和/或一种或多种衰老标志物的存在和/或水平可以指示治疗(例如,本文公开的任一种)可能提供治疗益处。在一些情况下,衰老细胞可以表达15-pgdh(例如,以有效降低老化非骨骼肌组织内pge2水平的水平)。在一些情况下,衰老细胞可以是巨噬细胞。
[0123]
在各个方面,对象可以表达一种或多种衰老生物标志物。衰老生物标志物可以包括但不限于15-pgdh水平的增加(例如,相对于年轻非骨骼肌组织中存在的水平)、pge2水平的降低(例如,相对于年轻非骨骼肌组织中存在的水平)、pge2代谢物的增加(例如,相对于年轻非骨骼肌组织中存在的水平)、衰老细胞积累的增加或更多(例如,相对于年轻非骨骼肌组织中存在的水平)、一种或多种萎缩基因(例如,atrogin1(mafbx1)、musa(fbxo30)和trim63(murf1))的表达增加(例如,相对于年轻非骨骼肌组织中存在的水平)、线粒体生物发生和/或功能的降低(相对于年轻非骨骼肌组织中存在的水平)和转化生长因子途径信号传导的增加(例如,涉及转化生长因子信号传导途径的一种或多种基因表达的增加,例如,活化素受体、肌肉生长抑制素、smad蛋白和骨形态发生蛋白中的一种或多种)(例如,相对于年轻非骨骼肌组织中存在的水平)。在一些情况下,老化生物标志物可以包括15-pgdh水平或活性增加(例如,在老化非骨骼肌组织内)(例如,相对于年轻非骨骼肌组织中存在的水平)。在一些情况下,老化生物标志物可以包括pge2水平降低(例如,在老化非骨骼肌组织内)(例如,相对于年轻非骨骼肌组织中存在的水平)。在一些情况下,老化生物标志物可以包括pge2代谢物(例如,在老化非骨骼肌组织内的例如15-酮pge2和13,14-二氢-15-酮pge2)的水平升高(例如,相对于年轻非骨骼肌组织中存在的水平)。在一些情况下,老化生物标志物的存在可以指示对象可以受益于根据本文公开的任何方法的治疗。年轻非骨骼肌可以包括来自30岁以下(例如,29岁、28岁、27岁、26岁、25岁、24岁、23岁、22岁、21岁、20岁、19岁、18岁、17岁、16岁、15岁、14岁、13岁、12岁、11岁、10岁、9岁、8岁、7岁、6岁、5岁、4岁、3岁、2岁或1岁)的对象的非骨骼肌。
[0124]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前老化非骨骼肌组织中存在的水平,老化非骨骼肌组织中存在的pge2水平可以增加(例如,根据本文提供的方法,例如,
在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前老化非骨骼肌组织中存在的水平,老化非骨骼肌组织中的pge2水平可以增加(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化非骨骼肌组织中存在的pge2的水平可以增加(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻非骨骼肌组织中存在的水平基本上类似的水平。老化非骨骼肌组织中的pge2水平可以增加(例如,通过本文公开的任何方法)至年轻非骨骼肌组织中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。
[0125]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前老化非骨骼肌组织中存在的水平,老化非骨骼肌组织中存在的pge2代谢物水平可以降低(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前老化非骨骼肌组织中存在的水平,老化非骨骼肌组织中的pge2代谢物水平可以降低(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化非骨骼肌组织中存在的pge2代谢物的水平可以降低(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻非骨骼肌组织中存在的水平基本上类似的水平。老化非骨骼肌组织中的pge2代谢物水平可以降低(例如,通过本文公开的任何方法)至年轻非骨骼肌组织中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内或约1%内)。pge2代谢物可以是15-酮pge2、13,14-二氢-15-酮pge2或两者。pge2代谢物可以是15-酮pge2、13,14-二氢-15-酮pge2或两者。
[0126]
在各个方面,相对于(例如,用15-pgdh抑制剂)治疗之前的老化非骨骼肌组织,可以增强老化非骨骼肌组织的功能(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)。相对于(例如,用15-pgdh抑制剂)治疗之前老化非骨骼肌组织中存在的水平,老化非骨骼肌组织的功能可以增强(例如,通过本文公开的任何方法)至少10%(例如,至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%或更高)。在各个方面,老化非骨骼肌组织的功能可以增强(例如,根据本文提供的方法,例如,在用15-pgdh抑制剂治疗之后)至与年轻非骨骼肌组织中存在的水平基本上类似的水平。老化非骨骼肌组织的功能可以增强(例如,通过本文公开的任何方法)至年轻非骨骼肌组织中存在的水平的约50%内或更低的水平(例如,约40%内、约35%内、约30%内、约25%内、约20%内、约15%内、约10%内、约5%内、约1%内)。功能可以包括增加的蛋白质合成、增加的细胞增殖、增加的细胞存活、降低的蛋白质降解或以上的任何组合。
[0127]
在一些情况下,治疗(例如,根据本文提供的方法,例如,用15-pgdh抑制剂)可导致老化非骨骼肌组织的复壮(例如,老化非骨骼肌组织的一种或多种功能的增加)。
[0128]
本公开内容提供了增加患有年龄相关病况或疾病的对象(例如人类对象)中非骨骼肌组织的功能、健康和其它特性的方法,所述方法包括向所述对象施用15-pgdh抑制剂。15-pgdh抑制剂的施用可以是全身性的或局部的,并且可以增强组织的许多方面中的任一个,包括增强功能,生理活性,耐力,在用于评估组织功能的任何测定中的性能或者对象中的组织功能或健康的任何其它测量。在一些实施方案中,15-pgdh抑制剂的施用导致对在对象的非骨骼肌组织的细胞死亡的保护。在一些实施方案中,15-pgdh抑制剂的施用导致对象
的非骨骼肌组织中的蛋白质降解减少。在一些实施方案中,15-pgdh抑制剂的施用导致对象的非骨骼肌组织中的蛋白质合成增加。在一些实施方案中,15-pgdh抑制剂的施用可导致增加的耐力(例如,在运动期间,例如,如在跑步机上测量的)。在一些情况下,对象的耐力增加(例如,在运动期间)可能是由于老化非骨骼肌组织(例如,心脏、肺、骨等)的功能增加和/或复壮。
[0129]
本公开内容还提供了测量患有年龄相关病况的对象的非骨骼肌组织中的15-pgdh水平的方法。这种方法可用于例如使用15-pgdh作为衰老或衰老非骨骼肌组织的生物标志物和/或用于非骨骼肌组织的功能丧失或降低,例如其中升高的15-pdgh水平或活性水平,例如相对于没有年龄相关病况的对象中的对照水平,增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多指示衰老或者组织中功能的丧失或降低。在这种方法中,可以以多种方式中的任一种,例如,通过检测编码15-pgdh蛋白的转录物的水平,通过检测15-pgdh多肽的水平或者通过检测15-pgdh酶活性来评估15-pgdh。
[0130]
在特定实施方案中,对象中15-pgdh的抑制导致对象的非骨骼肌组织中pge2和/或pgd2的增加,例如pge2和/或pgd2水平的升高、增加或恢复,以及pge2和/或pgd2代谢物如15-酮-pge2、13,14-二氢-15-酮-pge2(pgem)、15-酮基-pgd2和13,14-二氢-15-酮基-pgd2的降低。在一些实施方案中,抑制还导致非骨骼肌组织中通过pge2受体(例如ep1、ep2、ep3和/或ep4(也称为ptger1、ptger2、ptger3、ptger4))的信号传导增加。在一些实施方案中,抑制还导致通过pgd2受体,例如dp1和/或dp2(也称为ptgdr1、ptgdr2/crth2)的信号传导增加。
[0131]
在特定实施方案中,在非骨骼肌组织中施用15-pgdh抑制剂的本文所述益处,例如增强的组织健康、功能、生理活性等,不依赖于对象组织的任何再生而发生。换句话说,虽然在对象中可能存在组织的再生,例如,如果组织已经被损伤或损坏,但本文所述的效果不需要再生,甚至在没有再生的情况下也会发生。在特定实施方案中,非骨骼肌组织未受损伤或损坏,并且尚未经历或没有经历再生。
[0132]
在一些实施方案中,15-pgdh抑制剂的施用抑制对象的非骨骼肌组织内衰老细胞(例如巨噬细胞,纤维脂肪细胞,其它单核间质组织驻留细胞,包括其它免疫细胞、成纤维细胞、内皮细胞、前脂肪细胞和/或脂肪细胞)中的15-pgdh活性或降低所述细胞中的15-pgdh水平。在一些实施方案中,所述方法还包括向所述对象施用溶解性药剂。可以使用的溶解性药剂的实例尤其包括bcl2抑制剂如纳维托克(也称为abt-263)和abt-737,泛酪氨酸激酶抑制剂如达沙替尼以及类黄酮如槲皮素,干扰foxo4-p53相互作用的肽如foxo4-dri,使用低聚半乳糖包被的纳米颗粒的衰老细胞的选择性靶向系统,包含达沙替尼和槲皮素的组合药物疗法以及hsp90抑制剂如17-dmag。应理解,所述溶解性药剂可以与15-pgdh抑制剂例如在单一药物制剂内一起施用,或分开施用。对象
[0133]
对象可以是患有年龄相关病况或处于患有年龄相关病况的风险中的任何对象,例如人类或其它哺乳动物。在一些实施方案中,对象为人类。在一些实施方案中,对象为成人。在一些实施方案中,对象为儿童(例如,患有早老症的儿童)。在一些实施方案中,对象为女性(例如,成年女性)。在一些实施方案中,对象为男性(例如成年男性)。
[0134]
在一些实施方案中,所述对象为人类,并且所述方法还包括以下步骤:其中基于对
年龄相关病况或疾病的诊断,或者基于发展为年龄相关病况或疾病的可能性或风险,选择用15-pgdh抑制剂治疗的人类。在一些这样的实施方案中,基于他的或她的年龄选择人。例如,可以基于超过20岁、25岁、30岁、35岁、40岁、45岁、50岁、55岁、60岁、65岁、70岁、75岁、80岁、85岁、90岁、95岁或100岁以上的年龄,或者人类患有或可能患有年龄相关病况或疾病的任何年龄,选择用于治疗的人类。在一些实施方案中,基于年龄相关病况或疾病的可能性,基于与一种或多种非骨骼肌组织的早衰相关的环境、生活方式或医学因素的存在或潜在存在,如吸烟、饮酒、饮食、缺乏体育活动、睡眠不足、药物使用、暴露于uv射线、暴露于极端温度、压力、超重或健康相关因素,如感染,精神疾病,癌症,糖尿病等选择人类。在一些实施方案中,对象患有由一种或多种组织的早衰引起的年龄相关病况,例如遗传病症,如成骨不全症、布卢姆综合症、科克因综合症、hutchinson-gilford progeria综合征、下颌骨发育不良、早衰、早衰样综合征、rothmund-thomson综合征、seip综合征、werner综合征、唐氏综合征、肢端早老症、rothmund-thomson综合征、导致早衰综合征的这些组织的免疫缺陷(如共济失调毛细血管扩张)或导致早衰综合征的这些组织的感染性疾病(如人类免疫缺陷病毒(hiv))。
[0135]
在一些实施方案中,对象被确定为具有老化组织或具有年龄相关的病况或疾病,如使用评估非骨骼肌组织的功能、性能、健康、力量、耐力、生理活性或任何其它特性的任何测量的任何方法(例如,基于性能的、基于成像的、生理的、分子的、细胞的或功能的测定)所确定的。例如,可以使用评估心脏功能或健康的任何方法,如血管造影、心电图、平板运动试验、超声心动图等来评估心脏。在一些实施方案中,基于非骨骼肌相关组织中15-pgdh转录物、蛋白质或酶活性的水平升高的检测,或基于组织中pge2和/或pgd2的降低水平的检测,选择用于治疗的对象。
[0136]
在一些实施方案中,所述方法包括在施用15-pgdh抑制剂之后的另外步骤,其包括评估对象中非骨骼肌组织的健康、功能、性能或任何其它特性,或者包括评估对象中非骨骼肌组织中15-pgdh(例如,15-pgdh蛋白、转录物或活性)和/或pge2和/或pgd2的水平,例如,以确定先前施用15-pgdh抑制剂对组织的潜在作用。在一些这样的实施方案中,检测或检查组织的健康、功能、性能、15-pgdh水平、pge2水平、pgd2水平或其它特性,并与施用15-pgdh抑制剂之前的组织的健康、功能、性能、15-pgdh水平、pge2水平、pgd2水平或其它特性进行比较或者与对照值进行比较,其中与在施用15-pgdh抑制剂之前获得的值相比或相对于对照值,在施用抑制剂之后的组织中,组织的健康、功能或性能已经改善,15-pgdh水平已经降低,pge2水平和/或pgd2水平已经增加的确定,表明15-pgdh抑制剂在对象的非骨骼肌组织中具有有益效果。
[0137]
在一些实施方案中,对象患有年龄相关的病况、病症或疾病,如心血管疾病或病况(例如,心房纤颤、中风、缺血性心脏病、心肌病、心内膜炎、脑内出血、高血压)、慢性呼吸道疾病或病况(例如,慢性阻塞性肺病、石棉肺、矽肺)、营养性疾病或病况(例如,沙眼、腹泻疾病、脑炎),肾脏疾病或病况(例如慢性肾脏疾病),胃肠或消化疾病或病况(例如nash、胰腺炎、溃疡、肠梗阻),神经病症(例如阿尔茨海默病、痴呆、帕金森病、认知衰退),感觉障碍(例如听力损失、视力损失、嗅觉损失或味觉损失、黄斑变性、视网膜色素变性、青光眼),皮肤或皮下疾病或病况(例如蜂窝织炎、溃疡、真菌皮肤病、脓皮病),骨质疏松症,骨关节炎,类风湿性关节炎,在一种或多种非骨骼肌组织中导致早衰的基因疾病(例如早衰,成骨不全症、
布卢姆综合症、科克因综合症、hutchinson-gilford progeria综合征、下颌骨发育不良、早衰样综合征、rothmund-thomson综合征、seip综合征、werner综合征、唐氏综合征、肢端早老症、rothmund-thomson综合征、导致早衰综合征的这些组织的免疫缺陷(例如共济失调毛细血管扩张)或导致早衰综合征的这些组织的感染性疾病(例如人类免疫缺陷病毒(hiv))等。
[0138]
15-pgdh抑制剂的施用可以在这些病况中的任一种中提供改善,并且可以帮助改善,例如,骨质疏松症、脱发、老化皮肤、认知障碍、感觉障碍、老化造血干细胞功能和胃肠功能。
[0139]
本发明的方法和组合物可以用于治疗任何非骨骼肌组织或器官,包括此类组织或此类组织内的细胞,包括上皮组织、神经组织、结缔组织、平滑肌、心肌、表皮组织、血管组织、心脏、肾脏、脑、骨、软骨、棕色脂肪、脾脏、肝脏、结肠、感觉器官、甲状腺、肺、血液、小肠、牙组织、卵巢或其它生殖组织、毛发、耳蜗、少突胶质细胞等。
[0140]
在一些实施方案中,基于年龄相关病况、病症或疾病的诊断;基于非骨骼肌组织功能、健康或性能的年龄相关损失的存在或潜在的确定;基于对象的年龄,例如,年龄相关病况或疾病相关的年龄;或者基于对老化非骨骼肌组织的任何本文所述的特征的检测,例如pge2和/或pgd2代谢物,如15-酮-pge2、pgem、15-酮-pgd2或13,14-二氢-15-pgd2的水平升高的检测,pge2和/或pgd2的水平降低的检测,蛋白质合成降低的检测,线粒体活性降低的检测,通过ep1、ep2、ep3、ep4、dp1和/或dp2受体的信号传导降低的检测,与衰老表型相关的基因如p16(ink4a)或p21(cdkn1a)的表达升高的检测,组织细胞中端粒长度缩短的检测,非骨骼肌组织中衰老细胞数量增加的检测或者15-pgdh的水平或活性升高的检测,特别是在衰老细胞,例如巨噬细胞、纤维脂肪细胞、成纤维细胞、内皮细胞等中,鉴定用于治疗的对象。
[0141]
在一些实施方案中,对象为宠物或农场动物,如猪、牛、绵羊、家禽或鱼,并且所述方法用于例如增强衰老动物的非骨骼肌组织功能或健康。在一些这样的实施方案中,向动物施用15-pgdh的小分子抑制剂。在一些实施方案中,将包含15-pgdh的核酸抑制剂(例如shrna)的载体或表达盒导入动物中,使得核酸抑制剂在动物的细胞(例如非骨骼肌组织的细胞)中表达。在一些实施方案中,将包含编码15-pgdh的多肽抑制剂(例如抗体或肽)的多核苷酸的载体或表达盒导入动物中,使得多肽抑制剂在动物的细胞(例如非骨骼肌组织的细胞)中表达。在一些实施方案中,使用基因疗法,例如,使得内源性15-pgdh编码基因的全部或一部分被在动物的细胞(例如,非骨骼肌组织细胞)中活性较低、稳定性较低或高度表达较低的基因形式替代。在一些实施方案中,将修饰的rna,例如化学修饰的rna抑制剂如shrna或编码多肽15-pgdh抑制剂的化学修饰的mrna导入动物中,使得rna抑制剂或表达的蛋白质抑制剂存在于动物的细胞中。6.评估15-pgdh水平
[0142]
例如,当使用15-pgdh作为生物标志物时或当评估15-pgdh抑制剂的功效时,可以使用多种方法中的任一种来评估非骨骼肌组织或骨骼肌组织中的15-pgdh水平。例如,可以通过检查编码15-pgdh的基因(例如hpgd基因)的转录,通过检测组织(例如骨骼肌或非骨骼肌组织)中15-pgdh蛋白的水平,或者通过测量组织(例如骨骼肌或非骨骼肌组织)中15-pgdh酶活性来评估15-pgdh的水平。此类方法可以在整个组织上或在组织内的细胞亚群(例如衰老细胞)上进行。
[0143]
在一些实施方案中,所述方法包括,例如,使用标准方法,如在15-pgdh酶、nad(+)和pge2存在下,在适当的反应缓冲液中孵育候选化合物,以及监测nadh的产生(参见,例如zhang等人,(2015)science348:1224),或者通过使用多种可用试剂盒中的任一种,如荧光picoprobe15-pgdh活性测定试剂盒(biovision),或者通过使用例如出版物ep2838533中描述的方法和/或指标中的任一种,测量15-pgdh酶活性。
[0144]
在一些实施方案中,所述方法包括编码15-pgdh的多核苷酸(例如mrna)表达的检测,其可以使用常规技术,如rt-pcr、实时rt-pcr、半定量rt-pcr、定量聚合酶链式反应(qpcr)、定量rt-pcr(qrt-pcr)、多重分支dna(bdna)测定、微阵列杂交或序列分析(例如,rna测序(“rna-seq”))进行分析。定量多核苷酸表达的方法描述于例如fassbinder-orth,integrative and comparative biology,2014,54:396-406;thellin等人,biotechnology advances,2009,27:323-333;以及zheng等人,clinical chemistry,2006,52:7(doi:10/1373/clinchem.2005.065078)中。在一些实施方案中,实时或定量pcr或rt-pcr用于测量生物样品中多核苷酸(例如mrna)的水平。参见例如nolan等人,nat.protoc,2006,1:1559-1582;wong et al.,biotechniques,2005,39:75-75。用于测量基因表达的定量pcr和rt-pcr测定也可商购获得(例如,基因表达测定,thermofisher scientific)。
[0145]
在一些实施方案中,所述方法包括例如使用本领域技术人员已知的常规技术如免疫测定、二维凝胶电泳和定量质谱来检测15-pgdh蛋白表达或稳定性。蛋白质定量技术一般描述于“strategies for protein quantitation,”principles of proteomics,2nd edition,r.twyman,ed.,garland science,2013。在一些实施方案中,蛋白表达或稳定性通过免疫测定检测,如但不限于酶免疫测定(eia),如酶倍增免疫测定技术(emit)、酶联免疫吸附测定(elisa)、igm抗体捕获elisa(mac elisa)和微粒酶免疫测定(meia);毛细管电泳免疫测定(ceia);放射免疫测定(ria);免疫放射测定(irma);免疫荧光(if);荧光偏振免疫测定(fpia);和化学发光测定(cl)。如果需要,此类免疫测定可以是自动化的。免疫测定也可以与激光诱导的荧光结合使用(参见例如schmalzing等人,electrophoresis,18:2184-93(1997);bao,j.chromatogr.b.biomed.sci.,699:463-80(1997))。7.15-pgdh作为生物标志物
[0146]
在一些实施方案中,15-pgdh可以用作老化骨骼肌和/或非骨骼肌组织的生物标志物,或者用作年龄相关病况或疾病的存在或潜在的生物标志物。例如,检测骨骼肌和/或非骨骼肌组织,例如总体组织或组织内的特定细胞如衰老细胞中的15-pgdh水平的增加,指示组织老化,与衰老相关的组织的功能或健康的损失或降低,或者年龄相关病况或疾病的存在。例如,与来自没有年龄相关病况或疾病的对象的对照组织中的相比,在骨骼肌和/或非骨骼肌组织中检测到的10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更多的15-pgdh增加,可指示组织衰老,与衰老相关的组织的功能或健康的损失或降低,或者年龄相关病况或疾病的存在。8.15-pgdh抑制剂
[0147]
在本发明的方法中可以使用以任何方式减少、降低、抵消、减弱、抑制、阻断、下调或消除15-pgdh的表达、稳定性或活性(例如酶活性)的任何试剂。抑制剂可以是小分子化合物、肽、多肽、核酸、抗体(例如阻断抗体或纳米抗体),或者以任何方式减少、降低、抵消、减弱、抑制、阻断、下调或消除15-pgdh的表达、稳定性和/或活性(例如15-pgdh的酶活性)的任
何其它分子。
[0148]
在一些实施方案中,相对于对照水平,例如,在不存在抑制剂的情况下,15-pgdh抑制剂在体内或体外将15-pgdh的活性、稳定性或表达降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或更多。
[0149]
抑制剂的功效可以,例如,使用标准方法,如在15-pgdh酶、nad(+)和pge2存在下,在适当的反应缓冲液中孵育候选化合物,以及监测nadh的产生(参见,例如zhang等人,(2015)science 348:1224),或者通过使用多种可用试剂盒中的任一种,如荧光picoprobe 15-pgdh活性测定试剂盒(biovision),或者通过使用例如出版物ep2838533中描述的方法和/或指标中的任一种,例如通过测量15-pgdh酶活性来评估。
[0150]
抑制剂的功效也可以例如通过检测降低的多核苷酸(例如,mrna)表达来评估,其可以使用常规技术,如rt-pcr、实时rt-pcr、半定量rt-pcr、定量聚合酶链式反应(qpcr)、定量rt-pcr(qrt-pcr)、多重分支dna(bdna)测定、微阵列杂交或序列分析(例如,rna测序(“rna-seq”))进行分析。定量多核苷酸表达的方法描述于例如fassbinder-orth,integrative and comparative biology,2014,54:396-406;thellin等人,biotechnology advances,2009,27:323-333;以及zheng等人,clinical chemistry,2006,52:7(doi:10/1373/clinchem.2005.065078)。在一些实施方案中,实时或定量pcr或rt-pcr用于测量生物样品中多核苷酸(例如mrna)的水平。参见例如nolan等人,nat.protoc,2006,1:1559-1582;wong et al.,biotechniques,2005,39:75-75。用于测量基因表达的定量pcr和rt-pcr测定也可商购获得(例如,基因表达测定,thermofisher scientific)。
[0151]
在一些实施方案中,如果编码15-pgdh的多核苷酸的表达水平与参考值,例如,在不存在抑制剂的情况下的值相比在体外或体内降低至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或更多,则认为15-pgdh抑制剂是有效的。在一些实施方案中,如果编码15-pgdh的多核苷酸的表达水平与参考值相比降低至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或更多,则认为15-pgdh抑制剂是有效的。
[0152]
15-pgdh抑制剂的有效性也可以例如使用本领域技术人员已知的常规技术如免疫测定、二维凝胶电泳和定量质谱来检测蛋白表达或稳定性。蛋白质定量技术一般描述于“strategies for protein quantitation,”principles of proteomics,2nd edition,r.twyman,ed.,garland science,2013。在一些实施方案中,蛋白表达或稳定性通过免疫测定检测,如但不限于酶免疫测定(eia),如酶倍增免疫测定技术(emit)、酶联免疫吸附测定(elisa)、igm抗体捕获elisa(mac elisa)和微粒酶免疫测定(meia);毛细管电泳免疫测定(ceia);放射免疫测定(ria);免疫放射测定(irma);免疫荧光(if);荧光偏振免疫测定(fpia);和化学发光测定(cl)。如果需要,此类免疫测定可以是自动化的。免疫测定也可以与激光诱导的荧光结合使用(参见例如schmalzing等人,electrophoresis,18:2184-93(1997);bao,j.chromatogr.b.biomed.sci.,699:463-80(1997))。
[0153]
为了确定在15-pgdh抑制剂存在下15-pgdh蛋白水平是否降低,所述方法包括将在抑制剂存在下的蛋白(例如15-pgdh蛋白)水平与参考值,例如在不存在抑制剂情况下的水平进行比较。在一些实施方案中,如果15-pgdh蛋白的水平与参考值相比降低至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或更多,
则15-pgdh蛋白在抑制剂存在下降低。在一些实施方案中,如果15-pgdh蛋白的水平与参考值相比降低至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或更多,则15-pgdh蛋白在抑制剂存在下降低。小分子
[0154]
在特定实施方案中,通过施用小分子抑制剂而抑制15-pgdh。可以使用任何小分子抑制剂,相对于对照,例如在不存在抑制剂的情况下的表达、稳定性或活性,其将15-pgdh的表达、稳定性或活性降低例如10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或更多。在特定实施方案中,可以使用能够在体外或体内降低15-pgdh的酶活性的小分子抑制剂。可以用于本发明方法的小分子化合物的非限制性实例包括公开于出版物ep2838533中的小分子,其全部公开内容通过引用并入本文中。小分子尤其可以包括公开于出版物ep2838533的表2中的小分子,即sw033291、sw033291异构体b、sw033291异构体a、sw033292、413423、980653、405320、sw208078、sw208079、sw033290、sw208080、sw208081、sw206976、sw206977、sw206978、sw206979、sw206980、sw206992、sw208064、sw208065、sw208066、sw208067、sw208068、sw208069、sw208070及以上的组合、衍生物、异构体或互变异构体。在特定实施方案中,使用的15-pgdh抑制剂为sw033291(2-(丁基亚磺酰基)-4-苯基-6-(噻吩-2-基)噻吩并[2,3-b]吡啶-3-胺;pubchem cid:3337839)。
[0155]
在一些实施方案中,15-pgdh抑制剂是噻唑烷二酮衍生物(例如,苯亚甲基噻唑烷-2,4-二酮衍生物),如(5-(4-(2-(噻吩-2-基)乙氧基)苯亚甲基)噻唑烷-2,4-二酮)、5-(3-氯-4-苯基乙氧基苯亚甲基)噻唑烷-2,4-二酮、5-(4-(2-环己基乙氧基)苯亚甲基)噻唑烷-2,4-二酮、5-(3-氯-4-(2-环己基乙氧基)苄基)噻唑烷-2,4-二酮、(z)-n-苄基-4-((2,4-二氧代噻唑烷-5-亚基)甲基)苯甲酰胺,或者choi等人,(2013)bioorganic&medicinal chemistry21:4477-4484;wu等人,(2010)bioorg.med.chem.18(2010)1428-1433;wu等人,(2011)j.med.chem.54:5260-5264;或者yu等人,(2019)biotechnology and bioprocess engineering 24:464-475(其全部公开内容通过引用并入本文)中公开的任何化合物。在一些实施方案中,15-pgdh抑制剂为cox抑制剂或化学预防剂,如环格列酮(cid:2750)或者cho等人,(2002)prostaglandins,leukotrienes and essential fatty acids 67(6):461-465(其全部公开内容通过引用并入本文)中公开的任何化合物。
[0156]
在一些实施方案中,15-pgdh抑制剂为含有苯并咪唑基团的化合物,如(1-(4-甲氧基苯基)-1h-苯并[d]咪唑-5-基)(哌啶-1-基)甲酮(cid:3474778),或者含有三唑基团的化合物,如3-(2,5-二甲基-1-(对甲苯基)-1h-吡咯-3-基)-6,7,8,9-四氢-5h-[1,2,4]三唑并[4,3-a]氮杂卓(cid:71307851),或者duveau等人,(2015)(“discovery of two small molecule inhibitors,ml387 and ml388,of human nad+-dependent 15-hydroxyprostaglandin dehydrogenase,”出版于probe reports from the nih molecular libraries program[internet])(其全部公开内容通过引用并入本文)中公开的任何化合物。在一些实施方案中,15-pgdh抑制剂为1-(3-甲基苯基)-1h-苯并咪唑-5-基)(哌啶-1-基)甲酮(cid:4249877)或niesen等人,(2010)plos one 5(11):e13719(其全部公开内容通过引用并入本文)中公开的任何化合物。在一些实施方案中,15-pgdh抑制剂为2-((6-溴-4h-咪唑并[4,5-b]吡啶-2-基硫基)甲基)苄腈(cid:3245059)、哌啶-1-基(1-间甲
苯基-1h-苯并[d]咪唑-5-基)甲酮(cid:3243760)或者3-(2,5-二甲基-1-苯基-1h-吡咯-3-基)-6,7,8,9-四氢-5h-[1,2,4]三唑并[4,3-a]氮杂卓(cid:2331284)者jadhav等人,(2011)(“potent and selective inhibitors of nad+-dependent 15-hydroxyprostaglandin dehydrogenase(hpgd),”出版于probe reports from the nih molecular libraries program[internet])(其全部公开内容通过引用并入本文)中公开的任何化合物。
[0157]
在一些实施方案中,15-pgdh抑制剂为td88或者seo等人,(2015)prostaglandins,leukotrienes and essential fatty acids 97:35-41或者shao等人,(2015)genes&diseases 2(4):295-298(其全部公开内容通过引用并入本文)中公开的任何化合物。在一些实施方案中,15-pgdh抑制剂为eeah(波罗蜜(artocarpus heterophyllus)的乙醇提取物)或karna(2017)pharmacogn mag.2017jan;13(suppl 1):s122
–
s126(其全部公开内容通过引用并入本文)中公开的任何化合物。抑制性核酸
[0158]
在一些实施方案中,试剂包含抑制性核酸,例如反义dna或rna、小干扰rna(sirna)、微rna(mirna)或短发夹rna(shrna)。在一些实施方案中,抑制性rna靶向与15-pgdh多核苷酸中的靶序列(例如包含至少20个、至少30个、至少40个、至少50个、至少60个、至少70个、至少80个、至少90个、或至少100个连续核苷酸的部分,例如,来自编码15-pgdh的多核苷酸序列(例如,人hpgd基因,gene id:3248,包括其转录物变体中的任一个,例如,如genbank登录号nm_000860.6、nm_001145816.2、nm_001256301.1、nm_001256305.1、nm_001256306.1、nm_001256307.1或nm_001363574.1中所示的)的20-500、20-250、20-100、50-500或50-250个连续核苷酸))相同或基本上相同(例如,至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同)的序列。
[0159]
在一些实施方案中,本文所述的方法包括使用shrna或sirna治疗对象,例如患有肌肉减少症或衰老或萎缩性肌肉的对象;或者患有年龄相关病况、病症或疾病的对象。shrna是具有发夹转角的人工rna分子,其可以用于通过其在细胞中产生的sirna来沉默靶基因表达。参见例如fire等人,nature 391:806-811,1998;elbashir等人,nature 411:494-498,2001;chakraborty等人,mol ther nucleic acids 8:132-143,2017;以及bouard等人,br.j.pharmacol.157:153-165,2009。在一些实施方案中,提供了治疗例如患有衰老和/或萎缩性肌肉的对象;或者患有年龄相关病况、病症或疾病的对象的方法,其包括向所述对象施用治疗有效量的修饰的rna或载体,所述修饰的rna或载体包含编码能够与15-pgdh mrna的一部分(例如,如genbank登录号nm_000860.6,nm_001145816.2,nm_001256301.1,nm_001256305.1,nm_001256306.1,nm_001256307.1或nm_001363574.1中任一个示出的编码人15-pgdh的多核苷酸序列的一部分)杂交的shrna或sirna的多核苷酸。在一些实施方案中,载体还包含本领域已知的适当的表达控制元件,包括例如启动子(例如诱导型启动子或组织特异性启动子)、增强子和转录终止子。
[0160]
在一些实施方案中,试剂为15-pgdh特异性微rna(mirna或mir)。微rna是一种小的非编码rna分子,其在rna沉默和基因表达的转录后调节中起作用。mirna与在mrna转录物内的互补序列碱基配对。结果,mrna转录物可以通过一种或多种机制沉默,如mrna链的切割,
pgdh抗体的一个或多个互补决定区(cdr)。在一些实施方案中,抗15-pgdh抗体为纳米抗体或单域抗体(sdab),其包含单个单体可变抗体结构域,例如单个vhh结构域。
[0167]
为了制备结合15-pgdh的抗体,可以使用本领域已知的许多技术。参见,例如,kohler&milstein,nature 256:495-497(1975);kozbor等人,immunology today 4:72(1983);cole等人,pp.77-96in monoclonal antibodies and cancer therapy,alan r.liss,inc.(1985);coligan,current protocols in immunology(1991);harlow&lane,antibodies,a laboratory manual(1988);以及goding,monoclonal antibodies:principles and practice(2nd ed.1986))。在一些实施方案中,通过用抗原免疫动物(如小鼠、兔或大鼠)以诱导抗体应答来制备抗体。在一些实施方案中,抗原与佐剂(例如弗氏佐剂)结合施用。在一些实施方案中,在初次免疫之后,可以施用一次或多次随后加强注射抗原以改善抗体产生。免疫后,例如从脾脏和/或淋巴组织收获抗原特异性b细胞。为了产生单克隆抗体,将b细胞与骨髓瘤细胞融合,随后对其进行抗原特异性筛选。
[0168]
编码目的抗体的重链和轻链的基因可以从细胞中克隆,例如,编码单克隆抗体的基因可以从杂交瘤中克隆并用于产生重组单克隆抗体。编码单克隆抗体的重链和轻链的基因文库也可以由杂交瘤或浆细胞制备。另外,噬菌体或酵母展示技术可以用于鉴定特异性结合所选抗原的抗体和异聚fab片段(参见,例如,mccafferty等人,nature 348:552-554(1990);marks等人,biotechnology 10:779-783(1992);lou等人,m peds 23:311(2010);以及chao等人,nature protocols,1:755-768(2006))。可选地,可以使用基于酵母的抗体呈递系统,例如xu等人,protein eng des sel,2013,26:663-670;wo 2009/036379;wo 2010/105256;和wo 2012/009568中公开的那些分离和/或鉴定抗体和抗体序列。重链和轻链基因产物的随机组合产生具有不同抗原特异性的大量抗体库(参见,例如kuby,immunology(3rd ed.1997))。用于产生单链抗体或重组抗体的技术(美国专利4,946,778,美国专利第4,816,567号)也可适于产生抗体。
[0169]
抗体可以使用任何数量的表达系统产生,包括原核和真核表达系统。在一些实施方案中,表达系统为哺乳动物细胞,如杂交瘤或cho细胞。许多这样的系统可广泛地从商业供应商获得。在抗体包含vh和vl区的实施方案中,vh和vl区可以使用单一载体,例如在双顺反子表达单元中表达,或者在不同启动子的控制下。在其它实施方案中,vh和vl区可以使用分开的载体表达。
[0170]
在一些实施方案中,抗15-pgdh抗体包含一个或多个亲和力成熟的cdr、重链和/或轻链序列。对于嵌合抗体,制备嵌合抗体的方法是本领域已知的。例如,可以制备嵌合抗体,其中来自一种物种如小鼠的抗原结合区(重链可变区和轻链可变区)与另一种物种如人的效应区(恒定结构域)融合。作为另一个实例,可以制备“类别转换的”嵌合抗体,其中抗体的效应区被不同免疫球蛋白类别或亚类的效应区取代。
[0171]
在一些实施方案中,抗15-pgdh抗体包含一个或多个人源化的cdr、重链和/或轻链序列。对于人源化抗体,制备人源化抗体的方法是本领域已知的。参见例如us8,095,890。通常,人源化抗体具有一个或多个从非人来源导入其中的氨基酸残基。作为人源化的替代物,可以产生人抗体。作为非限制性实例,可以产生转基因动物(例如小鼠),其在免疫后能够在不存在内源性免疫球蛋白产生的情况下产生人抗体的全部库(repertoire)。例如,已经描述了嵌合和种系突变小鼠中抗体重链连接区(jh)基因的纯合缺失导致内源抗体产生的完
全抑制。在这样的种系突变小鼠中转移人种系免疫球蛋白基因阵列将导致抗原攻击后产生人抗体。参见,例如,jakobovits等人,proc.natl.acad.sci.usa,90:2551(1993);jakobovits等人,nature,362:255-258(1993);bruggermann等人,year in immun.,7:33(1993);以及美国专利第5,591,669号、第5,589,369号和第5,545,807号。
[0172]
在一些实施方案中,产生抗体片段(如fab、fab’、f(ab’)2、scfv、纳米抗体或双价抗体)。已经开发了各种技术用于生产抗体片段,如完整抗体的蛋白水解消化(参见,例如,morimoto等人,j.biochem.biophys.meth.,24:107-117(1992);以及brennan等人,science,229:81(1985))和使用重组宿主细胞以产生片段。例如,可以从抗体噬菌体文库中分离抗体片段。可选地,可以直接从大肠杆菌细胞中回收fab
’‑
sh片段,并化学偶联以形成f(ab’)2片段(参见,例如carter等人,biotechnology,10:163-167(1992))。根据另一种方法,f(ab’)2片段可以直接从重组宿主细胞培养物中分离。用于产生抗体片段的其它技术对于本领域技术人员是显而易见的。
[0173]
用于测量结合亲和力和结合动力学的方法是本领域已知的。这些方法包括但不限于固相结合测定(例如elisa测定)、免疫沉淀、表面等离子共振(例如biacore
tm
(ge healthcare,piscataway,nj))、动力学排除测定(例如)、流式细胞术、荧光激活细胞分选(facs)、生物膜层干涉(例如,octet
tm
(fort
é
bio,inc.,menlo park,ca))和蛋白质印迹分析。肽
[0174]
在一些实施方案中,所述试剂为肽,例如,结合和/或抑制15-pgdh的酶活性或稳定性的肽。在一些实施方案中,所述试剂为肽适配子。肽适配子为被选择或工程化以结合特定靶分子的人工蛋白。通常,肽包括由蛋白质支架展示的可变序列的一个或多个肽环。肽适配子选择可以使用不同的系统进行,包括酵母双杂交系统。肽适配子也可以选自通过噬菌体展示和其它表面展示技术如mrna展示、核糖体展示、细菌展示和酵母展示构建的组合肽文库。参见,例如,reverdatto等人,2015,curr.top.med.chem.15:1082-1101。
[0175]
在一些实施方案中,所述试剂为affimer。affimer是小的高度稳定的蛋白质,通常具有约12-14kda的分子量,其以与抗体类似的特异性和亲和力结合它们的靶分子。通常,affimer展示两个肽环和一个n末端序列,它们可以以与单克隆抗体类似的方式以高亲和力和特异性结合不同的靶蛋白。通过蛋白质支架稳定两个肽环限制了肽可以采用的可能构象,与游离肽的文库相比,这增加了结合亲和力和特异性。在本领域中描述了affimer和制备affimer的方法。参见,例如,tiede等人,elife,2017,6:e24903。affimer也是可商购获得的,例如来自avacta life sciences。载体和修饰的rna
[0176]
在一些实施方案中,使用适当的载体将提供15-pgdh抑制活性的多核苷酸,例如核酸抑制剂如sirna或shrna,或者编码抑制15-pgdh的多肽的多核苷酸导入细胞,例如肌细胞、非骨骼肌组织细胞。可用于本公开内容的递送载体的实例为病毒载体、质粒、外来体、脂质体、细菌载体或纳米颗粒。在一些实施方案中,使用载体如病毒载体将本文所述的15-pgdh抑制剂,例如核酸抑制剂或者编码多肽抑制剂的多核苷酸中的任一种导入细胞,例如肌细胞、非骨骼肌组织细胞。合适的病毒载体包括但不限于腺相关病毒(aav)、腺病毒和慢病毒。在一些实施方案中,15-pgdh抑制剂,例如核酸抑制剂或编码多肽抑制剂的多核苷酸,
以表达盒的形式提供,通常重组产生,具有与编码抑制剂的多核苷酸序列可操作地连接的启动子。在一些情况下,启动子是在所有或大多数组织类型中指导基因表达的通用启动子;在其它情况下,启动子是在被靶向的组织的细胞中特异性地指导基因表达的启动子。
[0177]
在一些实施方案中,使用修饰的rna将15-pgdh的核酸或蛋白质抑制剂导入对象,例如导入对象的骨骼肌或非骨骼肌组织中。本领域已知rna的各种修饰在导入对象的细胞时增强例如rna(例如编码15-pgdh多肽抑制剂的shrna或mrna)的翻译、效力和/或稳定性。在特定实施方案中,使用修饰的mrna(mmrna),例如编码15-pgdh的多肽抑制剂的mmrna。在其它实施方案中,使用包含15-pgdh表达的rna抑制剂的修饰的rna,例如sirna、shrna或mirna。可以使用的rna修饰的非限制性实例包括抗反向帽类似物(arca),例如长度为100-250个核苷酸的polya尾,用来自已知的稳定mrna的序列替代3’utr中的富含au的序列以及包括修饰的核苷和结构,如假尿苷,例如n1-甲基假尿苷、2-硫代尿苷,4
’‑
硫代rna、5-甲基胞苷、6-甲基腺苷、酰胺3连键、硫酸酯键(thioate linkages)、肌苷、2
’‑
脱氧核糖核苷酸、5-溴-尿苷和2
’‑
o-甲基化核苷。可以使用的化学修饰的非限制性列表可以见于例如在线数据库crdd.osdd.net/servers/sirnamod/。可以使用任何已知的方法将rna导入体内细胞,所述方法尤其包括物理干扰、通过阳离子载体产生rna胞吞作用、电穿孔、基因枪、超声、纳米颗粒、缀合物或高压注射。修饰的rna也可以通过直接注射导入,例如在柠檬酸盐缓冲盐水中。还可以使用自组装的lipoplex或polyplex递送rna,所述lipoplex或polyplex是通过带负电荷的rna与阳离子脂质或聚合物(如lipoplex、polyplex、聚阳离子和树状物)之间的电荷-电荷相互作用自发产生的。也可以使用聚合物,如聚-l-赖氨酸、聚酰胺胺和聚乙烯亚胺、壳聚糖和聚(β-氨基酯)。参见,例如,youn等人,(2015)expert opin biol ther,sep 2;15(9):1337
–
1348;kaczmarek等人,(2017)genome medicine 9:60;gan等人,(2019)nature comm.10:871;chien等人,(2015)cold spring harb perspect med.2015;5:a014035;其中每一个的全部公开内容通过引用并入本文。9.施用方法
[0178]
本文所述的化合物可以在对象中局部施用或全身施用。在一些实施方案中,化合物可以例如经腹膜内、肌内、动脉内、口服、静脉内、颅内、鞘内、脊柱内、病变内、鼻内、皮下、脑室内、局部和/或通过吸入施用。在一个实例中,化合物例如通过肌内注射肌内施用。
[0179]
在一些实施方案中,根据急性方案施用所述化合物。在某些情况下,将所述化合物施用至对象一次。在其它情况下,将化合物在一个时间点施用,并在第二个时间点再次施用。在其它情况下,在短时间内(例如,2天、3天、4天、5天、6天、1周、2周、3周、4周、1个月或更长),以间歇剂量将所述化合物重复(例如,每天一次或两次)施用至对象。在一些情况下,化合物施用之间的时间为约1天、2天、3天、4天、5天、6天、1周、2周、3周、4周、一个月或更长。在其它实施方案中,在期望的时间段内根据长期方案连续或长期施用所述化合物。例如,可以施用所述化合物,使得所述化合物的量或水平在选定的时间段内基本上恒定。
[0180]
可以通过本领域中通常使用的方法将化合物施用至对象。导入的化合物的量可以考虑诸如性别、年龄、体重、疾病或病症的类型、病症的阶段和产生期望结果所需的量的因素。通常,为了治疗目的施用化合物,以药理学有效剂量给予细胞。“药理学有效量”或“药理学有效剂量”为足以产生期望的生理效果的量或能够实现期望结果的量,特别是用于治疗病况或疾病,包括减轻或消除病况或疾病的一种或多种症状或表现。
[0181]
身体的任何数量的肌肉可以直接注射或以其它方式施用本文所述的化合物,所述肌肉诸如例如,二头肌;三头肌;肱桡肌;肱肌(brachialis muscle)(肱肌(brachialis anticus));浅室腕屈肌;三角肌;腘绳肌的股二头肌、股薄肌、半腱肌和半膜肌;四头肌的股直肌、股外侧肌、股内侧肌和股中间肌;小腿的腓肠肌(侧面和中间)、胫前肌和比目鱼肌;胸部的胸大肌和胸小肌;上背的背阔肌;菱形肌(主要和次要);跨越颈部、肩部和背部的斜方肌;腹部的腹直肌;臀部的臀大肌、臀中肌和臀小肌;手部肌肉;括约肌;眼肌;咽肌。
[0182]
本文所述的化合物可以通过注射到被靶向的非骨骼肌组织中或者通过在被靶向的组织附近施用而局部施用。10.药物组合物
[0183]
本文所述的化合物的药物组合物可以包含药学上可接受的载体。在某些方面,药学上可接受的载体部分由所施用的具体组合物以及由用于施用所述组合物的具体方法确定。相应地,存在多种适合的本文所述的药物组合物制剂(参见,例如,remington’s pharmaceutical sciences,18th ed.,mack publishing co.,easton,pa(1990))。
[0184]
如本文所用,“药学上可接受的载体”包括本领域普通技术人员在配制药物组合物中已知的任何标准的药学上可接受的载体。因此,化合物本身,如作为药学可接受的盐或作为缀合物存在,可以制备成药学上可接受的稀释剂,例如,盐水,磷酸盐缓冲盐水(pbs),乙醇水溶液或者葡萄糖、甘露醇、葡聚糖、丙二醇、油(例如,植物油、动物油、合成油等)、微晶纤维素、羧甲基纤维素、羟丙基甲基纤维素、硬脂酸镁、磷酸钙、明胶、聚山梨酯80等的溶液中的制剂;或者制备成适当赋形剂中的固体制剂。
[0185]
药物组合物通常还包含一种或多种缓冲液(例如,中性缓冲盐水或磷酸盐缓冲盐水),碳水化合物(例如,葡萄糖、甘露糖、蔗糖或葡聚糖),甘露醇,蛋白质,多肽或氨基酸如甘氨酸,抗氧化剂(例如,抗坏血酸、偏亚硫酸氢钠、丁基化羟基甲苯、丁基化羟基苯甲醚等),抑菌剂,螯合剂如edta或谷胱甘肽、使得制剂与接受者血液等渗、低渗或弱高渗的溶质,混悬剂,增稠剂,防腐剂,调味剂,甜味剂和着色化合物,视情况而定。
[0186]
本文所述的药物组合物以与剂量制剂相容的方式施用,并且以治疗有效的量施用。施用的量取决于多种因素,包括例如,个体的年龄、体重、身体活动和饮食,待治疗的病况或疾病,以及病况或疾病的阶段或严重程度。在某些实施方案中,剂量的大小还可以通过伴随在特定个体中施用治疗剂的任何不良副作用的存在、性质和程度来确定。
[0187]
然而,应理解,任何特定患者的具体剂量水平和给药频率可以变化,并且可以取决于多种因素,包括所使用的具体化合物的活性、该化合物的代谢稳定性和作用时间长度、年龄、体重、遗传特征、总体健康状况、性别、饮食、施用模式和时间、排泄率、药物组合、特定病况的严重程度以及宿主正在接受的治疗。
[0188]
在某些实施方案中,所述化合物的剂量可以采用固体、半固体、冻干粉形式或液体剂量的形式,诸如,例如,片剂、丸剂、小球、胶囊、散剂、溶液、混悬剂、乳剂、栓剂、保留灌肠剂、霜剂、软膏剂、洗剂、凝胶剂、气雾剂、泡沫剂等,优选以适于简单施用精确剂量的单位剂型。
[0189]
如本文所用,术语“单位剂型”是指适合作为人类和其它哺乳动物的单一剂量的物理上离散的单位,每个单位含有与合适的药物赋形剂(例如,安瓿)联合使用的经计算以产生期望的起效、耐受性和/或治疗效果的预定量的治疗剂。另外,可以制备更为浓缩的剂型,
然后可以由其制备更多的稀释单位剂型。因此,更为浓缩的剂型包含基本上超过,例如至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多倍的治疗化合物的量。
[0190]
制备此类剂型的方法是本领域技术人员已知的(参见,例如,remington’s pharmaceutical sciences,同上)。所述剂型通常包含常规药物载体或赋形剂,并且可以另外包含其它药剂、载体、佐剂、稀释剂、组织渗透增强剂、增溶剂等。可以通过本领域熟知的方法(参见,例如remington’s pharmaceutical sciences,同上)针对特定的剂型和施用途径调整适当的赋形剂。
[0191]
合适的赋形剂的实例包括但不限于乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、盐水、糖浆、甲基纤维素、乙基纤维素、羟丙基甲基纤维素和聚丙烯酸如卡波姆(carbopols),例如,卡波姆941、卡波姆980、卡波姆981等。剂型可另外包含润滑剂如滑石、硬脂酸镁和矿物油;湿润剂;乳化剂;混悬剂;防腐剂如甲基-羟基-苯甲酸盐、乙基-羟基-苯甲酸盐和丙基-羟基-苯甲酸盐(即,对羟基苯甲酸盐);ph调节剂如无机和有机酸及碱;甜味剂和调味剂。所述剂型还可包含可生物降解的聚合物珠粒、葡聚糖和环糊精包合物。
[0192]
对于口服施用,所述治疗有效剂量可以为以下形式:片剂、胶囊、乳剂、混悬剂、溶液、糖浆、喷雾剂、锭剂、散剂和缓释制剂。用于口服施用的合适赋形剂包括药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、明胶、蔗糖、碳酸镁等。
[0193]
治疗有效剂量还可以以冻干形式提供。此类剂型可以包含缓冲液,例如,碳酸氢盐,用于在施用前复溶,或者缓冲液可以包含在冻干剂型中,用于与例如水复溶。所述冻干剂型还可包含合适的血管收缩剂,例如肾上腺素。所述冻干剂型可以在注射器内提供,任选地与用于复溶的缓冲液组合包装,使得所复溶的剂型可以立即施用至个体。
[0194]
在一些实施方案中,可以向对象共施用另外的化合物或药物。为了减轻所治疗疾病的体征或症状,减少由诱导免疫应答引起的副作用等目的,可以共施用此类化合物或药物。在一些实施方案中,例如,本文所述的15-pgdh抑制剂与溶解性药剂,增强pge2水平或pgd2水平的化合物,降低atrogin1水平或活性的化合物,增强通过ep1、ep2、ep3、ep4、dp1和/或dp2受体的信号传导的化合物和/或旨在增强肌肉质量、力量或功能;或所靶向的非骨骼肌组织的功能、健康或任何其它期望特性的任何其它化合物一起施用。11.试剂盒
[0195]
本文所述的组合物的其它实施方案为包含15-pgdh抑制剂的试剂盒。试剂盒通常包含容器,其可以由多种材料如玻璃或塑料形成,并且可以包括例如瓶、小瓶、注射器和试管。标签通常伴随试剂盒,并且包含任何书写或记录的材料,其可以是电子或计算机可读形式,提供使用试剂盒内容物的说明或其它信息。
[0196]
在一些实施方案中,所述试剂盒包含一种或多种用于治疗衰老和/或萎缩肌肉的试剂。在一些实施方案中,所述试剂盒包含用于治疗患有年龄相关病况、病症或疾病的对象的非骨骼肌组织的一种或多种试剂。在一些实施方案中,所述试剂盒包含拮抗15-pgdh的表达或活性的试剂。在一些实施方案中,所述试剂盒包含抑制性核酸(例如,反义rna、小干扰rna(sirna)、微rna(mirna)、短发夹rna(shrna))或编码15-pgdh抑制多肽的多核苷酸,其抑制或阻抑15-pgdh mrna或蛋白表达或活性,例如酶活性。在一些实施方案中,所述试剂盒包含修饰的rna,例如修饰的shrna或sirna,或者编码多肽15-pgdh抑制剂的修饰的mrna。在一
些实施方案中,所述试剂盒还包含用于表达抑制性核酸或编码15-pgdh抑制多肽的多核苷酸的一种或多种质粒、细菌或病毒载体。在一些实施方案中,所述试剂盒包含能够与编码15-pgdh的mrna的一部分杂交的反义寡核苷酸。在一些实施方案中,所述试剂盒包含特异性结合并抑制15-pgdh蛋白的抗体(例如单克隆抗体、多克隆抗体、人源化抗体、双特异性抗体、嵌合抗体、封闭抗体或中和抗体)或其抗体结合片段。在一些实施方案中,所述试剂盒包含封闭肽。在一些实施方案中,所述试剂盒包含适配子(例如肽或核酸适配子)。在一些实施方案中,所述试剂盒包含affimer。在一些实施方案中,所述试剂盒包含修饰的rna。在特定实施方案中,所述试剂盒包含小分子抑制剂,例如sw033291,其结合15-pgdh或抑制其酶活性。在一些实施方案中,所述试剂盒还包含一种或多种另外的治疗剂,例如,用于与拮抗15-pgdh的表达或活性的试剂组合治疗施用的试剂。
[0197]
在一些实施方案中,所述试剂盒还可以包含含有实施本文所述方法的说明(例如,方案)的指导材料(例如,使用所述试剂盒以增强老化和/或萎缩肌肉的质量、力量或功能;和/或使用所述试剂盒以增强非骨骼肌组织的功能、健康或其它特性的说明)。虽然指导材料通常包括书面或印刷材料,但它们不限于此。本公开内容考虑了能够存储此类指令并将它们传送给最终用户的任何介质。此类介质包括但不限于电子存储介质(例如,磁盘、磁带、盒式磁带、芯片),光学介质(例如,cd rom)等。此类介质可以包括提供此类指导材料的互联网网站的地址。
实施例
[0198]
将通过具体实施例更详细地描述本公开内容。提供以下实施例仅用于说明目的,而不旨在以任何方式限制本公开内容。本领域技术人员将容易地认识到可以改变或修改各种非关键参数以产生基本上相同的结果。实施例1:靶向前列腺素e2降解酶改善肌肉减少症和肌营养不良摘要
[0199]
肌肉减少症是迄今为止缺乏有效治疗方法的与衰老相关的肌肉消瘦综合征。在本文中,我们已经鉴定了pge2水平的损失带来老化骨骼肌中的肌肉萎缩。我们揭示了衰老细胞在老化肌肉中的积累有助于提高pge2降解酶(15-pgdh)水平。使用药理学试剂sw033291来抑制15-pgdh酶或基因治疗以敲低15-pgdh,我们已经观察到老年小鼠的肌肉质量、力量和运动性能的增加。我们已经在患有杜氏肌营养不良(mdxcv4/mtrko(g2))的小鼠中观察到15-pgdh的类似降低和力量的增加。使用全身性溶解性药剂治疗(abt-263),我们已经显示15-pgdh水平在肌肉组织中降低。使用遗传和细胞培养模型,我们已经揭示了前列腺素e2(pge2)信号传导通过ep4受体在分化细胞和肌纤维中作为肌肉质量调节剂的作用。pged信号传导抑制肌肉萎缩的关键介质atrogin1表达。在本文中,我们已经揭示了15-pgdh抑制前列腺素e2降解酶作为逆转肌肉质量和力量损失以及对抗衰老和肌营养不良的有效靶标。引言
[0200]
萎缩主要是由于过度的蛋白质分解导致的肌肉质量和力量的快速损失引起的,这通常伴随着蛋白质合成的减少。由于肌肉功能的这种损失,生活质量降低并且发病率和死亡率增加。尽管人们对肌肉萎缩是如何产生的了解很多,但有效预防或减缓萎缩的当前治疗策略限于锻炼。目前正在研究的实验方法主要针对通过改变蛋白质平衡(例如通过肌肉
生长抑制素抑制剂)来增加肌肉质量(1)。
[0201]
在本文中,我们测试了pge2途径的调节是否可以增加老年小鼠的萎缩肌肉的功能。我们出乎意料的发现是pge2分解代谢失调,导致对老化鼠肌肉组织的有害作用。我们揭示了在老化的肌肉组织中,以比年轻低的水平检测到pge2,这一发现以前与老化肌肉无关。我们揭示了老化肌肉中pge2合成、分解代谢和信号传导失调的细胞和分子基础。我们设计了通过抑制15-pgdh来增加pge2水平的策略,所述15-pgdh是使pge2失活(可作为pge2代谢物(pgem)在老化肌肉组织中检测到)的分解代谢酶。15-pgdh抑制克服了老化肌肉微环境的有害影响,导致老年小鼠中力量、肌肉质量和耐力的稳健增加。发现老化肌肉组织中pge2水平降低
[0202]
肌肉力量的进行性下降伴随着衰老,如本文对于通过跖屈扭矩评估不同年龄小鼠的腓肠肌(ga)所示(图1a)。pge2通过2步过程分解代谢,其中第一步是由限速酶15-羟基前列腺素脱氢酶(15-pgdh)介导的,并且包括pge2转化为不稳定的15-酮-pge2,第二步是由前列腺素还原酶2介导的,并且包括15-酮-pge2转化为更稳定的13,14-二氢-15-酮-pge2代谢物(3,4)(图1b)。根据pge2的降低,15-pgdh活性在老化肌肉组织中显著增加(图1c)。如通过质谱分析所示的,进一步分析衰老期间pge2信号传导途径揭示了老化肌肉中pge2的水平较低(图1d)。总之,这表明pge2在老化肌肉微环境或小生境中被分解代谢。pge2的分解代谢是通过老化组织的衰老细胞中的15-pgdh上调
[0203]
已经报道随着衰老,衰老细胞积累并不利地影响组织功能。已经假定pge2是衰老相关分泌表型(sasp)的组成部分(5,6)。我们假设15-pgdh表达和pge2失活是由于老化肌肉中的衰老细胞。为了解决这种可能性,我们用也被称为纳维托克的溶解性药剂abt-263处理老年小鼠(20个月),其通过抑制bcl-2、bcl-w和bcl-xl起作用,以诱导衰老细胞的凋亡(7)(图2a)。abt-263处理两个月后,pge2降解酶(15-pgdh)mrna的水平显著降低(图2a),表明老化肌肉中的主要细胞源是衰老细胞,其通过溶解性药剂处理从组织中消除。这些结果表明pge2失活部分由老化肌肉组织中的衰老细胞介导,所述衰老细胞带来与衰老相关的肌肉消瘦表型。15-pgdh抑制导致老年小鼠的肌肉功能改善
[0204]
我们试图确定pge2失活是否是老年小鼠肌肉消瘦和肌肉功能降低的主要成分。我们每天用15-pgdh抑制剂sw033291(sw)处理老年小鼠持续1个月,并且发现15-pgdh抑制导致老年小鼠的肌肉质量、力量和耐力的显著增加(图3a)。我们进行了组织学分析,并且发现sw处理的老年小鼠的肌纤维横截面积较大(图3b-d)。为了证实该表型是由于pge2水平升高,我们对肌肉样品进行了质谱分析,并且发现sw处理提高了肌肉中的pge2水平,与年轻肌肉中的水平相当(图3e)。为了确定效果是通过抑制15-pgdh,我们使用了通过使用shrna(sh15pgdh)敲低酶的独立方法,所述shrna通过腺相关病毒aav9递送至老化肌肉(图4a)。我们证实了与aav9介导的shrna scramble(shscr)对照相比,aav9介导的sh15pgdh敲低中hpgd(15-pgdh)的水平通过qpcr在mrna水平降低(图4b)。我们发现与感染aav(shscr)的对照肌肉相比,肌肉质量和肌力增加(图4c,d)。15-pgdh抑制导致杜氏营养不良症小鼠中肌肉功能的改善
[0205]
为了将我们的发现扩展到以肌肉萎缩和高的衰老细胞浸润为特征的其它肌肉消瘦疾病,我们分析了具有“人源化”端粒长度的mdx4cv/mtrko(g2)杜氏肌营养不良(dmd)小
鼠模型,其概括了骨骼肌和心脏dmd表型(8,9)。通过qpcr,我们分析了衰老和衰老相关分泌表型(sasp)标志物的水平,并且发现它们在mdx4cv/mtrko(g2)小鼠中极大地升高(10)(图5a)。重要的是,我们发现与mtrko(g2)对照相比,mdx4cv/mtrko(g2)中的降解酶15-pgdh显著增加(图5a)。为了阐明pge2失活是否带来dmd中所见的肌肉消瘦,我们用sw处理8月龄的mdx4cv/mtrko(g2)和mtrko(g2)对照,并且在处理4周后观察到与媒介物处理的对照相比,这些小鼠中的肌肉力量增加22%(图5b)。pge2通过肌纤维中的ep4受体防止萎缩
[0206]
为了了解15-pgdh抑制导致肌肉萎缩改善的下游机制,我们对用sw或aav-sh15pgdh处理的老化肌肉进行qpcr分析。我们假设ep4受体的pge2刺激可能是通过抑制atrogin1来改善萎缩表型的原因(11-14)。我们的数据证实,通过aav9 sh15pgdh递送的sw处理和15-pgdh敲低导致在mrna水平上fbxo32(atrogin1)的表达降低(图6a)。
[0207]
为了进一步描述pge2在肌肉中的作用机制,我们测试了pge2是否通过分化肌管中的ep4受体发信号。我们分析了所有pge2受体ep1-ep4(ptger1-4)的水平,并且如先前所述,我们发现ep4在肌肉干细胞(musc)中高度表达(15)。然而,我们还发现ep4在分化的成肌细胞和肌管中表达,尽管其水平低于在musc中的水平(图6b,c)。为了在体外模拟萎缩并阐明pge2信号传导的作用,我们用媒介物、pge2或ep4拮抗剂(ono-ae3-208)存在下的pge2处理饥饿的肌管。我们发现pge2在饥饿的肌管中极大地降低了atrogin1的表达(图6d)。另外,我们发现pge2在饥饿或非饥饿培养的肌管中增加了肌管直径(图6d)。在ep4拮抗剂(ono-ae3-208)存在下,这种作用被消除,提供了pge2通过ep4受体促进肌管肥大的证据(图6d)。为了确定sw是否可以介导与pge2无关的对肌管的作用,我们评估了其对培养的肌管的作用。在不存在表达15-pgdh的衰老细胞或其它细胞的情况下,我们发现sw处理的饥饿肌纤维没有表现出肌管直径增加(图6d),这与体内sw处理后观察到的肌纤维横截面积的增加形成对比(图3b-d)。为了证实ep4受体在肌管中的作用,我们使用ep4flox/flox成肌细胞,其中在用具有用作对照的空载体的表达cre的慢病毒感染后对受体进行基因消融(genetically ablated)。在不存在ep4受体的情况下,观察到较小的肌管,表明ep4受体在肌管分化中起关键作用(图6e)。这些结果揭示了pge2信号传导通过ep4受体在肌肉萎缩中的作用。此外,我们证明了,与肌肉组织一样,培养的肌管的pge处理抑制萎缩相关的泛素连接酶atrogin1(图6f)。讨论
[0208]
我们揭示了15-pgdh作为衰老和营养不良肌肉中的治疗靶标,当减少时,其改善肌肉萎缩。我们先前显示了在年轻肌肉再生的情况下pge2信号传导在肌肉干细胞(musc)功能中的重要性(15)。这需要将pge2处理的musc移植到受损肌肉中,或者将pge2局部肌内递送至受损肌肉中。先前的工作已经表明在年轻小鼠再生中的15-pgdh抑制,并且显示15-pgdh的小分子抑制剂sw033291的全身递送是内源性pge2的有效诱导剂,其改善造血、肝脏和结肠组织再生(16)。在本文中,我们显示15-pgdh在肌肉衰老中具有先前未认识到的作用。仅在年轻肌肉组织中以低水平表达,随着衰老细胞的积累,15-pgdh水平升高。此外,我们显示抑制15-pgdh可改善老年小鼠的骨骼肌功能。通过防止内源性pge2水平在肌肉中的降解而进行的内源性pge2水平的全身重建改善了肌肉萎缩,导致增加的质量和力量。我们的发现提供了pge2降解酶在肌肉消瘦疾病如dmd和衰老中的作用的出乎意料的证据,并显示其构
natl acad sci u s a 114,6675-6684(2017).16.y.zhang et al.,tissue regeneration.inhibition of the prostaglandin-degrading enzyme 15-pgdh potentiates tissue regeneration.science 348,aaa2340(2015).材料和方法小鼠
[0209]
我们按照斯坦福大学和实验动物护理管理小组(aplac)的机构指南进行了所有实验和方案。中年(18mo.)和老年(》24mo.)小鼠c57bl/6获自美国国家老龄化研究所(nia)用于老化肌肉研究,以及青年(2-4mo.)野生型c57bl/6小鼠来自jackson laboratory。在研究期间,将小鼠保持在12小时黑暗/光照循环的无特异性病原体的住房(housing)中。
[0210]
对于abt-263处理,将20月龄的c57/b16小鼠通过口服管饲法(oral gavage)用媒介物(乙醇:聚乙二醇400:phosal 50pg)或abt-263(在乙醇:聚乙二醇400:phosal 50pg中)处理1周的2个周期,在周期之间有2周的休息期,如前所述(1)。对于杜氏肌营养不良(dmd)小鼠模型,我们使用如前所述(2)产生的8-10月龄mdx4cv/mtrko(g2)。
[0211]
如前所述(3),用sw033291(sw)(cayman chemicals)或媒介物处理小鼠1个月。对sw处理的小鼠及其对照如前所述进行筋疲力尽的时间和距离(图3a)。
[0212]
小鼠转基因品系购自the jackson laboratory(ep4flox/flox)no.028102。我们通过适当的基于pcr的策略验证了这些基因型。除非说明,否则用雌性和雄性小鼠进行研究。免疫荧光染色和成像
[0213]
如前所述(5),我们收集并准备接受者的胫前肌(ta)或腓肠肌(ga)肌肉组织用于组织学。我们使用4%pfa固定肌肉的横截面,使用pbs/1%bsa/0.1%triton x-100进行封闭和透化,并与抗laminin(millipore,克隆a5,目录#05-206,1:200),然后alexafluor二抗(jackson immunoresearch laboratories,1:200)或小麦胚芽凝集素-alexa 647缀合物(wga,thermo fisher scientific)一起孵育。我们用dapi(invitrogen)复染细胞核。
[0214]
对于肌管,我们使用4%pfa进行固定,使用pbs/1%bsa/0.1%triton x-100进行封闭和透化,并用一抗抗myhc(thermo fisher scientific,目录#14-6503-82,克隆mf-20,1:500),然后用alexafluor二抗(jackson immunoresearch laboratories,1:500)染色。我们用dapi(invitrogen)复染细胞核。
[0215]
我们在zeiss 510激光扫描共聚焦显微镜(carl zeiss microimaging)上用40x/0.9n.a.物镜捕获多个连续的焦平面,或者使用keyence bz-x700一体化荧光显微镜(keyence),利用20
×
/0.75n.a.物镜获得图像。我们使用keyence高级分析软件对肌纤维区域进行分析。对于横截面积,对肌肉的最大横截面积进行定量,或者如上所述对每只小鼠捕获涵盖超过400个肌纤维的至少10个视野的laminin染色的肌纤维横截面积。数据分析是盲目的。进行成像采集和评分的研究人员不知道所分析的样品组给出的处理条件。细胞培养
[0216]
原代成肌细胞在含有dmem/f10(50:50)、15%fbs、2.5ng ml-1成纤维细胞生长因子-2和1%青霉素-链霉素的肌原性细胞培养基中生长。对于分化实验,汇合的成肌细胞在含有5%马血清,dmem的培养基中生长。我们将10ng/ml前列腺素e2(cayman chemicals)、1μ
m sw033291(apexbio)或1μm ono-ae3-208(cayman chemicals)添加至第4天分化的肌管中。从ep4
fl/fl
小鼠中分离成肌细胞,并接受mcherry/cre慢病毒或模拟感染,如前所述(5)。定量rt-pcr
[0217]
我们使用rneasy micro kit(qiagen)从musc中分离rna。对于肌肉样品,我们在液氮中快速冷冻组织,在trizol(invitrogen)中使用fastprep fp120匀浆器(mp biomedicals)使肌肉均质化,然后分离rna。我们使用sensifast
tm cdna合成试剂盒(bioline)从来自每个样品的总mrna逆转录cdna。我们在abi 7900ht实时pcr系统(applied biosystems)中使用sybr green pcr预混合物(applied biosystems)或taqman测定(applied biosystems)对cdna进行rt-pcr。我们在95℃下保持10分钟,然后40个循环的在95℃下保持15s和60℃下保持1分钟而使样品循环。为了定量相对转录物水平,我们使用2-δδct来比较处理的样品和未经处理的样品,并相对于gapdh表达结果。
[0218]
对于sybr green qrt-pcr,我们使用以下引物序列:gapdh,正向5
’‑
ttcaccaccatggagaaggc-3
′
,反向5
’‑
cccttttggctccaccct-3
′
;hpgd,正向5
’‑
tccagtgtgatgtggctgac-3
′
,反向5
’‑
attgttcacgcctgcattgt-3
′
;ptger1,正向5’gtggtgtcgtgcatctgct-3
′
,反向5
’‑
ccgctgcagggagttagagt-3
′
,ptger2,正向5
’‑
accttcgccatatgctcctt-3
′
,反向5
’‑
ggaccggtggcctaagtatg-3
′
,cox2,正向,5
’‑
aacccaggggatcgagtgt-3’,反向5
’‑
cgcagctcagtgtttgggat-3’;fbxo32,正向5
’‑
tagtaaggctgttggagctgatag-3’,反向5
’‑
ctgcaccagtgtgcataagg-3’。对于鼠衰老标志物和衰老相关标志物,我们使用前述引物(6)。
[0219]
利用taqman通用pcr预混合试剂试剂盒(applied biosystems),根据制造商的说明书,使用taqman测定(applied biosystems)定量样品中的pax7、myh、p21、ptger3和ptger4。转录水平以相对于gapdh水平来表示。对于sybr green qpcr,使用gapdh qpcr来归一化输入的cdna样品。对于taqman qpcr,多重qpcr使得靶标信号(fam)能够通过其内部的gapdh信号(vic)单独地被归一化。15-pgdh动力学测定
[0220]
使用biovision picoprobe 15-pgdh活性测定试剂盒(目录#k562)根据制造商的方案分析肌肉裂解物中的15-pgdh活性。质谱分析分析物:
[0221]
所有前列腺素标准品—pgf2α;pge2;pgd2;15-酮pge2;13,14-二氢15-酮pge2;pge2-d4;和pgf2α-d9——均购自caymanchemical。对于pge2-d4内标,3和4位置以总共4个氘原子进行标记。对于pgf2α-d9,17、18、19和20位置以总共9个氘原子进行标记。
[0222]
校准曲线准备:
[0223]
分析物储备液(5mg/ml)用dmso制备。用乙腈/水(1:1v/v)连续稀释这些储备液来获得一系列的标准工作溶液,用于绘制校准曲线。通过以下方式准备校准曲线:将10μl的每种标准工作溶液加入到200μl的均质化缓冲液(丙酮/水1:1v/v;0.005%bht来防止氧化)中,然后加入10μl内标溶液(pgf2α-d9和pge2-d4每种3000ng/ml)。用每组样品新鲜准备校准曲线。校准曲线范围:对于pge2和13,14-二氢15-酮pge2为0.05ng/ml至500ng/ml;对于pgd2和pgf2α为0.1ng/ml至500ng/ml;以及对于15-酮pge2为0.025ng/ml至500ng/ml。
提取程序:
[0224]
提取程序从prasain等人(7)的程序进行了修改,并包括丙酮蛋白质沉淀,然后进行2步液液萃取;后一步提高了lc-ms/ms的灵敏度。使用丁羟甲苯(bht)和氮气(n2)下的蒸发来防止氧化。
[0225]
收获固体组织,称重,并使用液氮速冻。将肌肉组织与均质化珠粒和200μl均质化缓冲液组合在聚丙烯管中,并在fastprep 24匀浆器(mp biomedicals)中以6m/s的速度处理40秒。均质化后,将10μl内标溶液(3000ng/ml)加入到组织匀浆中,然后超声处理并振荡10分钟。离心样品并将上清液转移至干净的eppendorf管中。向样品中加入200μl己烷,然后振荡15分钟,接着离心。将样品在-80℃下冷冻40分钟。从冷冻的下面水层倒出己烷层并丢弃。融化后,向底部水层加入25μl 1n的甲酸,并将样品涡旋。对于第二次提取,向水相中加入200μl氯仿。将样品振荡15分钟以确保完全提取。进行离心以分离各层。将下面的氯仿层转移至新的eppendorf管中,并在氮气下,于40℃蒸发至干燥。将干燥的残留物在100μl乙腈/10mm乙酸铵中复溶(2:8v/v),并通过lc-ms/ms进行分析。lc-ms/ms:
[0226]
由于许多前列腺素是具有相同质量的位置异构体且具有类似的片段化模式,因此色谱分离至关重要。针对每种分析物仔细选择了两个srm离子峰(transition)——一个是定量离子峰(quantifier)和另一个是定性离子峰(qualifier)。独特的定性物离子强度比率和保留时间对于鉴定靶标分析物至关重要。所有分析均通过负电喷射lc-ms/ms,使用lc-20adxr prominence液相色谱仪和8030三重四极杆质谱仪(shimadzu)进行。hplc条件:acquity uplc beh c18 2.1x100mm,1.7um粒径柱,在50℃下操作,流速为0.25ml/min。流动相由以下物质组成:a:0.1%乙酸水溶液以及b:0.1%乙酸乙腈溶液。洗脱概况:最初采用35%b保持5分钟,然后采用35%-40%的梯度3分钟,接着40%-95%3分钟;总运行时间为14分钟。注射体积为20μl。使用这些hplc条件,我们实现了目的分析物的基线分离。
[0227]
选定的反应监测(srm)用于定量。质量离子峰如下:pgd2:m/z 351.10
→
m/z 315.15(定量离子峰)和m/z 351.10
→
m/z 233.05(定性离子峰);pge2:m/z 351.10
→
m/z 271.25(定量离子峰)和m/z 351.10
→
m/z 315.20(定性离子峰);pgf2α:m/z 353.10
→
m/z 309.20(定量离子峰)和m/z 353.10
→
m/z 193.20(定性离子峰);15酮-pge2:m/z 349.30
→
m/z 331.20(定量离子峰)和m/z 349.30
→
m/z 113.00(定性离子峰);13,14-二氢15-酮pge2:m/z 351.20
→
m/z 333.30(定量离子峰)和m/z 351.20
→
m/z 113.05(定性离子峰);pge2-d4:m/z 355.40
→
m/z 275.20;和pgf2α-d9:m/z 362.20
→
m/z 318.30。停留时间为20-30ms。
[0228]
使用labsolutions lcms(shimadzu)进行定量分析。内标法用于定量:将pge2-d4用作pge2、15-酮pge2和13,14-二氢15-酮pge2定量的内标。pgf2α-d9为pgd2和pgf2α定量的内标。使用1/x2的权重因子,校准曲线在浓度范围内为线性的(r》0.99),其中x为浓度。反算的标准浓度为标称值的
±
15%,以及在定量下限(lloq)的
±
20%。体内和原位肌力测量
[0229]
如前所述(8,9)评估脚踝跖屈肌的峰值等轴扭矩(n
·
mm)。简而言之,将麻醉的小鼠的脚放置在连接到伺服电机(型号300c-lr;aurora scientific)的踏板上。将两个pt-ir电极针(aurora scientific)经皮和皮下插入胫神经上方,恰好在膝盖的后部/后中。踝关
节以90
°
角固定。通过以200hz的频率和0.1-ms的方波脉冲改变传递到胫神经的电流来实现峰值等轴扭矩。我们对每个肌肉进行三次强直性测量,每次测量之间恢复1分钟。用aurora科学动态肌肉数据采集和分析软件(aurora scientific dynamic muscle data acquisition and analysis software)收集数据。统计分析
[0230]
我们在至少3个独立的实验中进行了细胞培养实验,其中在每个独立实验中汇集了3个生物学重复。我们使用配对t检验用于实验,其中对照样品来自相同的体外实验或来自体内对侧肢体肌肉。非参数曼-惠特尼检验用于确定未处理的对比经处理的组之间的显著性差异(使用α=0.05)。进行anova或多重t检验用于多重比较,使用邦费罗尼校正校正来确定显著性水平,如附图图例中所示。除非另有说明,否则数据显示为平均值
±
s.e.m。参考文献1.chang j,et al.(2016)clearance of senescent cells by abt263 rejuvenates aged hematopoietic stem cells in mice.nature medicine 22(1):78-83).2.a.sacco et al.,(2010)short telomeres and stem cell exhaustion model duchenne muscular dystrophy in mdx/mtr mice.cell 143,1059-1071.3.y.zhang et al.,tissue regeneration.inhibition of the prostaglandin-degrading enzyme 15-pgdh potentiates tissue regeneration.science 348,aaa2340(2015).4.c.vinel et al.,the exerkine apelin reverses age-associated sarcopenia.nat med 24,1360-1371(2018).5.a.t.v.ho et al.,prostaglandin e2 is essential for efficacious skeletal muscle stem-cell function,augmenting regeneration and strength.proc natl acad sci u s a 114,6675-6684(2017).6.d.j.baker et al.,naturally occurring p16(ink4a)-positive cells shorten healthy lifespan.nature 530,184-189(2016).7.j.k.prasain,h.d.hoang,j.w.edmonds,m.a.miller,prostaglandin extraction and analysis in caenorhabditis elegans.j vis exp,(2013).8.e.l.mintz,j.a.passipieri,d.y.lovell,g.j.christ,applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair.j vis exp,(2016).9.k.a.sheth et al.,muscle strength and size are associated with motor unit connectivity in aged mice.neurobiol aging 67,128-136(2018).实施例2:抑制前列腺素降解酶15-pgdh增加老年小鼠中的肌肉力量引言
[0231]
随着衰老,肌肉功能的身体广泛损失降低了生活质量并增加了发病率和死亡率(1,2)。这种弥散性肌肉萎缩和力量损失或肌肉减少症仅在美国就导致180亿美元的每年保健费用(2)。用于肌肉减少症的治疗剂的鉴定将具有重大的临床益处(1,2)。
[0232]
在衰老期间,骨骼肌经历结构和功能变化。最明显的是肌肉力量的损失,其在老年
人的下半身肌肉中可下降50-80%,并且伴随着肌纤维的横截面积、肌肉质量和力量的减少(3)。这种功能的损失是由于细胞-细胞相互作用的破坏和异常的细胞信号传导途径,特别是与炎症、蛋白质转换和线粒体功能相关的那些引起的(1,4-6)。由于这种多因素病因,为了鉴定预防、延迟或逆转肌肉减少症的治疗靶标而解开的因果分子途径已被证明具有挑战性。
[0233]
之前,我们确定在年轻小鼠中pge2刺激肌肉干细胞(musc)并且对于受损肌肉的再生是必不可少的(7),这与关于其在骨、结肠、肝脏和血液的再生中的功能的发现(8-10)很好地一致。我们推断,在衰老中,前列腺素信号传导可能会出错。使用与大气压电离串联质谱(lc-ms/ms)偶联的液相色谱来区分密切相关的前列腺素家族成员(11),我们发现在老化骨骼肌中pge2和pgd2水平降低。
[0234]
我们假设老化肌肉中前列腺素的减少可能是由于15-羟基前列腺素脱氢酶(15-pgdh)增加的前列腺素分解代谢。在本文中,我们揭示了升高的15-pgdh是老化肌肉和某些其它衰老组织的标志。此外,我们显示在老年小鼠中,15-pgdh的抑制增加了肌肉质量和力量。遗传实验证明,15-pgdh抑制的有益作用对增加的pge2信号传导具有特异性。我们的发现为肌肉减少症提供了新的见解,并提出了创新的治疗策略。老化组织中前列腺素降解酶(15-pgdh)升高
[0235]
我们先前证明了pge2信号传导在刺激干细胞再生年轻小鼠的受损组织中的重要性(7)。我们推断pge2也可能作用于成熟的肌肉肌纤维,并在维持肌肉组织内稳态中起至关重要的作用。我们假设在衰老中,pge2和其它内源性类花生酸(由膜脂肪酸产生的脂质代谢物)的降低可能发生并且对肌肉组织功能具有有害影响。为了分析老化骨骼肌中类花生酸组成,我们使用lc-ms/ms。该方法克服了基于抗体的测定(如elisa)的交叉反应性,并且在其相同质量的相关类花生酸pge2和pgd2以及pgf2α的分辨率方面超过了其它质谱分析方法(图8a-c,9a-c和10a)。这是通过从青年和老年小鼠中分离和均质化后肢肌肉,然后进行丙酮沉淀以排除蛋白质来实现的。然后进行2步液-液萃取以增强lc-ms/ms灵敏度。我们观察到老化肌肉中pge2和pgd2水平显著下降(图8a-c、9a-c和10a)。pge2和pgd2通过由限速酶15-pgdh引发的多步过程降解以产生不稳定的15-酮-pge2和15-酮-pgd2代谢物,然后将其转化成多个下游代谢物,包括13,14-二氢-15-酮-pge2代谢物(pgem)(12,13)。由于它们的不稳定性,lc-ms/ms根本没有检测到或仅在低水平上检测到这些中间体(图8c和9c)。ms光谱图证明了该方法易于区分密切相关的类花生酸。
[0236]
我们假设降解酶15-pgdh的增加可以解释观察到的pge2和pgd2在肌肉中的减少,并且可能构成老化组织的一般特征。一致地,我们发现该酶的比活性不仅在老化骨骼肌中升高,而且在老化的心脏、皮肤、脾脏和结肠组织中升高(图8d和11)。因此,15-pgdh mrna和蛋白在老化肌肉中显著增加(图8e、8f、12a和12b)。为了确定这一发现与人类衰老的相关性,我们重新分析了年轻和老化人肌肉样品的可公开获得的微阵列数据(14),并且发现与来自年轻群体(25
±
3年)的那些相比,老年人(78
±
6年)的股外侧肌的活检中15-pgdh的表达显著增加(图13a)。总之,这些数据鉴定了15-pgdh作为在老化肌肉中所见的前列腺素水平下降的潜在驱动。在抑制15-pgdh后老化的肌肉质量和力量的增加
[0237]
我们假定抑制15-pgdh可导致pge2和pgd2水平升高,这继而可以改善老年小鼠的
肌肉消瘦。与人类一样,老年小鼠表现出肌肉减少症,即肌肉力量的一般损失(1)。我们首先使用基因方法来降低酶水平,其需要在普遍存在的启动子(u6)的控制下gfp和15-pgdh的shrna的腺相关病毒(aav9)肌内(i.m.)递送或者在普遍存在的启动子(u6)的控制下编码gfp和加扰(scr)shrna的对照aav9肌内(i.m.)递送(图8g)。所得的局部肌内基因疗法递送策略导致15-pgdh mrna水平和比活性的显著降低以及pge2和pgd2水平的增加(通过质谱分析法评估的)(图8h-j和14a)。通过转导的胫前肌(ta)和腓肠肌(ga)中gfp报道子的免疫荧光分析证实了这些靶向肌肉的载体(图14b)。15-pgdh在老化的而非年轻肌肉中的基因敲低伴随着15-pgdh shrna处理的老化肌肉中的横截面肌纤维面积与对照相比的显著增加(图8k-m)。此外,与年轻的相比,老化肌肉中15-pgdh的敲低导致治疗后一个月肌肉质量和肌力的显著增加(图8n-p和14c)。
[0238]
为了测试在肌肉减少症中所见的弥散性肌肉消瘦是否可以通过15-pgdh的小分子抑制剂的全身递送来克服,我们用sw033291(sw)或媒介物(10)腹膜内处理老年小鼠和年轻对照小鼠(图15a)。sw先前被广泛地表征为15-pgdh的特异性抑制剂,其与pge2无竞争性,表观ki为0.1nm(10)。在体内,sw先前显示将骨髓、结肠、肺和肝脏中的pge2水平增加2倍,并且在较小程度上增加pgd2水平,这增强了年轻小鼠在这些组织损伤后的再生(10)。我们发现,在每天腹膜内sw处理一个月后,老化肌肉中15-pgdh比活性显著降低,并且通过lc-ms/ms检测到pge2和pgd2水平的伴随增加,其与年轻肌肉相当(图15b、15c、16a和16b)。组织学分析揭示了在sw处理的老年小鼠中而非在年轻小鼠中,肌纤维横截面积显著增加,表明老年小鼠中肌肉萎缩减弱(图15d-f)。纤维类型分析揭示了sw处理促进氧化(iia型)和糖酵解(iib型)纤维的横截面积增加(图15g-j)。sw处理的年轻小鼠表现出肌肉质量和绝对力量增加的趋势,其在统计学上不显著(图15k、15l和16c)。相比之下,sw处理的老年小鼠表现出ta、ga和比目鱼肌的质量显著增加(图15k)和跖屈肌力的显著增加(图15l和16c)。此外,耐力(在跑步机上筋疲力尽的时间)增加,表明除了肌肉力量之外还有整体的全身有益效果(图15m)。总之,我们使用小分子抑制剂sw的研究证实了我们通过局部shrna导致的基因功能缺失的发现,并且显示在一个月的时间内全身性降低15-pgdh活性足以在老年小鼠中减弱骨骼肌萎缩和增强肌肉功能。老化肌肉微环境中衰老间质细胞的15-pgdh表达
[0239]
我们试图鉴定老化肌肉组织中15-pgdh的细胞来源。为此,我们分析了通过荧光激活细胞分选从解离的年轻和老化肌肉组织中分离的细胞中的hpgd(15-pgdh)mrna水平。在facs纯化的巨噬细胞(cd11b+/cd11c-/f4/80+/cd31-)中检测到15-pgdh转录物水平的显著增加,但在从老化肌肉分离的内皮细胞(cd31+/cd11b-/cd11c-/f4/80-)或肌原性干细胞和祖细胞(α7+/cd11b-/cd45-/cd31-/sca1-)中没有检测到(图17a、18a和18b)。此外,老化的巨噬细胞和内皮细胞表达高水平的细胞周期调节物p16(ink4a,cdkn2a)和p21(cdkn1a)(图17b和19c),它们是已经报道随着衰老积累并且不利地影响组织功能,包括肌肉的衰老细胞的标志物(15)。为了确定衰老细胞是否是老化肌肉中15-pgdh的来源,我们使用了两种策略来消融这些细胞,即基因模型和溶解性药物治疗。首先,我们分析了来自ink-attac转基因小鼠的肌肉,其中响应于ap20187(ap)的处理,通过在最小ink4a启动子(p16)的控制下表达fk506-结合蛋白-半胱天冬酶8融合蛋白来清除衰老细胞,所述ap20187(ap)是活化导致细胞死亡的融合蛋白的二聚体(16)(图17c和19a)。对老年ink-attac小鼠进行16个月的ap处
理后,15-pgdh转录物水平显著降低(图17d),这导致通过lc-ms/ms分析的pge2水平增加(图17e和19b)。为了在该小鼠模型中确定15-pgdh的细胞来源,我们从对照和ap处理的ink-attac肌肉中通过facs分离了巨噬细胞,并且发现在衰老细胞清除后这些细胞中的15-pgdh水平降低(图17f),这与p16和p21的表达降低一致(图19c)。相比之下,facs分离的衰老内皮细胞不表达显著的15-pgdh水平(图17f和19c)。值得注意的是,肌纤维不会死亡并且它们的功能得到改善。老年小鼠中衰老细胞的消除导致后肢肌肉质量(ta和ga)、力量(以握力评估的)、耐力(以在跑步机上跑步直到筋疲力尽的距离和体重的综合测量评估的)的增加(图17g)。这些衰老细胞已经被消融的老年小鼠跑了更长的距离并具有增加的体重,表明较高的工作能力(图17g)。
[0240]
作为第二种方法,我们通过用溶解性药剂abt-263(也称为纳维托克,一种泛bcl抑制剂(17))处理老年小鼠来诱导老化衰老细胞中的凋亡(图19d)。在处理2个月后,在肌肉组织中通过免疫组织化学检测到的表达15-pgdh的细胞的百分比以及通过qrt-pcr检测到的总体15-pgdh基因表达水平显著降低(图19d-g)。通过这种溶解性处理消融了表现出最高15-pgdh染色的肌肉组织驻留间质细胞(图19e和19f),而肌纤维未被消融。这些结果表明pge2部分地通过旁分泌机制降解,由此在肌纤维附近的衰老的表达15-pgdh的间质细胞,如巨噬细胞降解pge2并有助于衰老的肌原性小生境或微环境的功能障碍。年轻肌肉异常表达15-pgdh后肌肉力量降低
[0241]
我们推断,如果15-pgdh在随着衰老所见的肌肉功能损失中起主要作用,则pge2降解酶在年轻小鼠的肌肉中的异常表达将对肌肉功能具有有害影响。为了检验这一假设,我们使用aav9来递送和过表达在普遍存在的巨细胞病毒(cmv)启动子控制下的15-pgdh基因(hpgd)(图20a)。我们证实了在肌内注射aav9-cmv-15-pgdh后,15-pgdh的表达通过qrt-pcr增加(图20b)。另外,通过lc-ms/ms分析揭示了在表达15-pgdh的年轻肌肉中前列腺素pge2和pgd2的显著降低,类似于在老年肌肉中所见的这些前列腺素的下降(图20c)。在仅一个月的时间内这些前列腺素的减少导致单独肌纤维的平均横截面积的显著降低(图20d和20e)和在年轻成年小鼠中测定为肌肉质量和肌力(图20f和20g)的肌肉功能的急性损失。我们通过qrt-pcr分析肌肉萎缩的标志物,并且发现在过表达15-pgdh的肌肉中,萎缩基因trim63(murf1)和fbxo32(atrogin-1)以及自噬基因p62、lc3b、atg4和atg6上调(图20h),这与其他人在急性萎缩模型中的发现(18-21)一致。这些数据提供了强有力的证据,即15-pgdh过表达在降低肌肉中pge2和pgd2水平中起因果作用,这继而导致肌肉质量和力量的降低。此外,它们显示15-pgdh活性对肌肉内稳态具有深远的影响并诱导萎缩表型。
[0242]
为了确定sw对其靶标15-pgdh的特异性,我们在肌内aav9介导的基因递送后过表达该酶的年轻小鼠中进行了拯救实验。我们推断sw抑制过表达的酶应克服15-pgdh过表达时所见的有害作用。因此,我们用媒介物或sw全身处理对照和过表达15-pgdh的年轻小鼠(图20i)。我们发现用sw处理增加了过表达15-pgdh的年轻肌肉的质量(图20j)和力量(图20k)。这些数据表明使用小分子sw的15-pgdh抑制特异性地靶向15-pgdh,导致改善的肌肉功能。由pge2而不是pgd2介导的老年小鼠的力量增加
[0243]
15-pgdh降解老化肌肉中的pge2和pgd2。值得注意的是,这两种前列腺素在其受体和其下游信号级联方面不同(22)。为了确定哪种前列腺素负责驱动老化肌肉功能的改善,
我们通过使用sw抑制15-pgdh来增加它们的水平并且抑制pgd2合成酶ptgds的表达。这是通过向老化肌肉肌内注射编码靶向ptgds的shrna或加扰的对照shrna的aav9病毒并用15-pgdh抑制剂sw或媒介物处理小鼠一个月来实现的(图21a)。我们通过qrt-pcr证实降低的ptgds mrna水平以及通过质谱分析法证实降低的pgd2水平来验证转导的老化肌肉中ptgds的敲低(图21b和21c)。在敲低ptgds时,在sw处理后所见的肌肉质量、肌力和肌肉耐力的增加(图21d-g)。这些结果表明pge2,而不是pgd2,是15-pgdh抑制后老化肌肉中所见的肌肉功能增加的介质。
[0244]
我们进行了另外的实验以证实pge2在减弱老年小鼠的肌肉萎缩中的特定作用。由于三种酶负责pge2合成,即cpges、pges1和pges2(22),靶向pge2合成途径将需要三重敲低,这在技术上是具有挑战性的。作为替代方法,我们关注肌肉中的pge2受体。qrt-pcr揭示了pge2受体ep4(ptger4)是分化肌管中表达最高的类花生酸受体(图22a)。为了最终确定所观察到的肌肉肥大是否是由于体内成熟肌肉肌纤维中pge2介导的ep4信号传导,我们创建了小鼠模型,其中受体仅在ga肌肉的肌纤维中被基因消融。这通过肌内aav9介导的肌肉肌酸激酶(mck)启动子驱动的cre递送至老年ep4f/f小鼠(mck-ep4
δ/δ
)的ga肌纤维中来实现。令人惊奇的是,老年小鼠肌纤维中ep4表达的丧失消除了sw介导的15-pgdh抑制处理一个月所诱导的对肌肉质量和力量的有益作用(图21h-k)。这些数据表明,观察到的sw治疗效果主要由老化肌纤维上通过ep4受体的pge2信号传导介导的。15-pgdh抑制后线粒体功能和生物发生的增加
[0245]
已知通过g偶联蛋白受体ep4的pge2信号传导由环amp(camp)介导(12,22,23)。我们证实了pge2活化骨骼肌中的环amp反应元件结合蛋白(creb)(图23a和23b)。为了鉴定pge2对老化肌肉发挥作用的下游信号传导途径,我们对媒介物和sw处理的老化肌肉进行了无偏差转录组学分析。最引人注目的是线粒体途径的强烈富集,包括线粒体氧化磷酸化、atp合成以及其它代谢和能量产生过程(图24a)。在sw处理的老化肌肉中,电子传输链的线粒体复合物i、ii、iv和v的许多组分显著增加(图24b)。当我们测定在其启动子中具有creb结合基序的线粒体生物发生的关键辅因子,即过氧化物酶体增殖物激活受体γ辅激活物1-α(pgc1α)的mrna水平时(24),我们发现其水平恢复到在年轻肌肉中所见的水平(图24c)。总线粒体含量增加,这反映在sw处理老化肌肉后线粒体与核dna的比率增加(图24d)。总之,这些数据提供了pge2触发线粒体数量的稳健增加以满足肌肉生长的能量需求的强有力证据。
[0246]
基因表达分析还揭示了与年龄相关的肌肉萎缩有关的信号传导途径的下降。在老化肌肉的sw处理后的最高下调基因中,有泛素信号传导途径的成员(图24a和24e)。pge2信号传导先前与非肌细胞中akt/foxo途径的活化有关(12,25,26)。因此,我们试图确定该途径是否可能在肌肉中起作用以调节已知在肌肉萎缩中起作用的e3泛素连接酶的表达(27-29)。为此,在不存在其它细胞类型的情况下,将肌细胞进行急性暴露于pge2。如蛋白质印迹分析所示,衍生自用pge2处理15分钟或30分钟的人类供体肌细胞的分化肌管表现出增加的pakt水平,所述pakt使foxo(pfoxo3a)失活(图24f)。另外,pge2处理的肌管活化下游靶标磷酸化-s6核糖体蛋白(ps6rp),表明蛋白质合成增加(图24f)并且表现出直径的显著增加,这在加入pge2拮抗剂(ono-ae3-208)时未见到(图25a-c)。在证实中,我们观察到在pge2处理肌管后通过嘌呤霉素掺入定量的蛋白质合成增加(图25d)。用sw处理对培养的肌管的直径没有影响(图25a和25b),这与通过老化肌肉组织中驻留的间质细胞抑制15-pgdh表达的间
接机制一致。这些体外数据显示pge2可以直接作用于肌管以活化akt信号传导并增强肌管生长和蛋白质合成,为pge2在对抗肌肉萎缩中的先前未研究的作用提供证据。老化肌肉中15-pgdh抑制后的蛋白质水解和tgf-β信号传导降低
[0247]
我们试图在体内测定在老化的肌肉组织中,pge2由于15-pgdh抑制导致的升高是否导致通过akt/foxo途径的信号传导,如在体外肌管中所见的。我们发现,与媒介物处理的对照相比,sw处理的老化肌肉中的pfoxo增加(图24g)。foxo先前已被其他人证明在降低肌肉特异性萎缩相关e3泛素连接酶atrogin-1(fbxo32)、murf1(trim63)、musa1和smart的表达中起作用(30-32)。rt-qpcr分析揭示了与媒介物处理的对照相比,sw处理的老化肌肉中所有这些萎缩基因以及e3泛素连接酶traf6(33)的表达均减少(图24e、24h和26a),表明蛋白质水解的调节有助于肌肉萎缩的减弱。这一发现与我们对老化肌肉与年轻肌肉相比的转录组分析非常吻合,所述转录组分析显示泛素连接酶途径中的基因是老化肌肉中最高富集的上调基因之一(图12a-d)并且与其他人的发现很好地一致,所述发现是,随着衰老,萎缩基因表达增加(34-36)。我们观察到与scr shrna对照相比,在通过肌内递送15-pgdh的shrna介导的老化肌肉中,在15-pgdh酶的基因抑制之后,e3泛素连接酶表达的类似降低(图24i)。有趣的是,组蛋白脱乙酰酶hdac4(肌肉萎缩的另一介质)在sw处理的肌肉中减少(图24e),所述组蛋白脱乙酰酶hdac4使蛋白质如myhc和pgc1α去乙酰化,导致它们的泛素化以及增加萎缩基因atrogin-1和murf1的表达(37,38)。这些结果表明,pge2导致了对萎缩基因表达的调节,其缓和了老化肌肉中所见的增加的蛋白质降解,并有助于观察到的老化肌肉中肌肉萎缩的改善。
[0248]
我们的转录组分析揭示了在sw处理一个月后第二信号传导途径tgf-β途径的减少,这提供了15-pgdh抑制对老化肌肉的另一种协同有益效果的证据。已知对肌肉功能有害且与衰老中的老化肌肉萎缩相关的关键tgf-β途径基因(如肌肉生长抑制素)的表达降低(mstn、tgfb2、acrv2a、smad3)(27),这可能有助于观察到肌肉萎缩的减弱(图24e)。值得注意的是,在sw处理的老年小鼠的肌肉中测定的其它衰老、炎性和自噬标志物没有观察到显著变化(图26b-d)。总之,这些结果显示,老化肌肉中1个月的15-pgdh抑制和随后的pge2升高刺激了几种协同的信号传导途径,导致老年小鼠中肌肉功能的改善和萎缩的减弱。讨论
[0249]
骨骼肌占身体质量的40%。在50岁之后,人类每十年平均损失其肌肉质量的15%(39),最终导致肌肉减少症的肌肉力量特征的大幅损失。目前没有治疗肌肉减少症的疗法,并且其医疗负担高(2)。在本文中,我们发现前列腺素降解酶15-pgdh的表达升高是小鼠和人类中老化肌肉的新标志物。我们发现增加的15-pgdh活性不限于肌肉,而是许多老化组织(例如老化心脏、皮肤、结肠和脾脏)的特征。15-pgdh在衰老中的深刻作用由这种酶的过表达引起年轻小鼠肌肉消瘦的发现而突出。在老年小鼠中,通过基因敲低或小分子抑制15-pgdh对抗肌肉萎缩并显著增加肌肉质量、力量和耐力。使用质谱分析法和靶向功能缺失实验,我们显示肌肉功能的改善是由于升高的pge2水平。我们和其他人先前证明了pge2信号传导在刺激干细胞以在年轻小鼠中再生受损组织中的重要性(7-10)。在本文中,我们证明了pge2也作用于成熟的肌纤维,并在维持肌肉组织内稳态中起关键作用。重要的是,我们的数据表明15-pgdh构成了对抗肌肉减少症的衰弱性肌肉萎缩特征的治疗靶标。
[0250]
据我们所知,以前没有报道增加15-pgdh活性导致老化组织中pge2水平降低。我们
的研究受益于lc-ms/ms方法,其能够明确分辨和定量骨骼肌中高度类似的前列腺素家族成员。因此,我们能够揭示老化肌肉中pge2下降的幅度,并将15-pgdh与这种下降联系起来。这种酶在萎缩表型中的重要性通过在年轻肌肉中所述酶的过表达导致一个月内肌肉质量和力量的显著损失这一发现得到了强调。总之,我们的数据突出了15-pgdh在降低肌肉质量和功能中的因果作用。考虑到我们在许多其它老化组织中检测到增加的15-pgdh,这一发现可能对年龄相关的病理学具有广泛的影响。
[0251]
我们的数据表明细胞间信号传导机制在老化肌肉中pge2的减少中起作用。在老化肌肉中衰老细胞的溶解性处理或基因消融后,15-pgdh水平降低,并且观察到pge2伴随增加。这些结果暗示老化的肌肉环境中的衰老的间质细胞作为pge2分解代谢的主要部位。在衰老的肌肉小生境中存在的衰老的炎性细胞类型中,巨噬细胞似乎是表达15-pgdh并降解pge2的主要细胞类型。这些细胞似乎通过旁分泌机制间接起作用以带来肌肉消瘦表型,称为“炎性衰老(inflammaging)”(43)。这种有害的微环境可以通过用溶解性处理消除衰老的间质细胞或者通过抑制老化肌肉中的15-pgdh表达来克服,这两者都足以提高内源性pge2水平以减弱肌肉萎缩。未来的研究有必要详细研究这种旁分泌机制。我们假定类似的组织驻留的衰老间质细胞是我们在其它老化组织中检测到的升高的15-pgdh的原因。
[0252]
先前对pge2在肌肉蛋白质内稳态中的作用的研究表明pge2诱导蛋白质降解,然而,这些研究是对经历通过从身体取出肌肉而沉淀的快速肌肉蛋白质分解代谢的去神经离体肌肉进行的(44,45)。相比之下,在本文中我们提供了在活的小鼠中抑制15-pgdh阻碍pge2降解并导致足以改善肌肉萎缩的生理范围内的内源性pge2水平的调节的证据。我们的数据与先前的研究很好地吻合,其中cox酶水平的扰动揭示了前列腺素在肌肉肥大和从肌肉萎缩中恢复的作用(22,46,47)。然而,由于cox2对于具有拮抗作用的前列腺素的合成是关键的,因此它不是理想的治疗靶标。在本文中,我们通过协同增强肌肉功能并减弱肌肉萎缩的多种信号传导途径——tgf-β、camp/creb、akt/foxo和线粒体功能——揭示了pge2信号传导与肌肉萎缩之间的先前未认识到的联系。
[0253]
肌肉减少症是一种多因素疾病,其是在慢性炎症、肌肉去神经支配、有缺陷的线粒体和破坏的蛋白质稳态中达到顶峰的失调的信号传导途径的概要(4,48,49)。特别地,线粒体功能受损(50)。为了解决15-pgdh抑制对肌肉功能的有益作用的机制,我们采用了无偏差方法。将用15-pgdh的小分子抑制剂处理1个月后的老化肌肉与媒介物处理的对照进行比较的转录组分析揭示了线粒体功能是最高的上调途径之一。经由camp/creb通过ep4受体的pge2信号传导可以解释所观察到的线粒体数量和功能的增加,这与先前的报道一致(12,22,23)。与先前对于其它camp诱导剂(如β-肾上腺素能受体(β-ar)激动剂或促肾上腺皮质激素释放因子受体2(crfr2)激动剂)所显示的对骨骼肌的有益效果类似,camp的pge2诱导可能通过用促进线粒体生物发生的camp响应元件(creb结合基序)(包括主要线粒体调节物pgc1α和其它氧化基因(51-53))活化下游转录调节物来增强线粒体功能。这种信号级联最终导致线粒体质量增加和肌肉萎缩的显著改善。
[0254]
我们的转录组分析还揭示了在15-pgdh抑制一个月之后下调的关键信号传导途径,包括泛素-蛋白酶体途径基因。在证实中,这种途径在我们相对于年轻肌肉的老化的转录组分析中得到富集。一致地,其他人已经报道了老年大鼠(34,35)和人肌肉(36)中e3泛素连接酶atrogin-1和murf1的水平升高。泛素连接酶表达是否在肌肉减少症中起因果作用仍
然是争论的问题。某些e3泛素连接酶(包括atrogin-1和murf1)的敲除模型导致肌肉功能的有害作用(54,55),但在急性去神经萎缩的情况下具有有益作用(27)。值得注意的是,在衰老的情况下中没有研究这些遗传模型。实际上,诸如rapalogs、sestrin和apelin的干预导致老化肌肉中的萎缩基因表达(atrogin-1和murf1)降低(21,56,57),改进了肌肉质量和功能并改善了肌肉减少症。一致地,我们观察到在老化肌肉中15-pgdh抑制后,多种e3-泛素连接酶的表达降低。总之,这些数据表明,萎缩基因表达的调节对老化肌肉功能是有益的。除了萎缩基因之外,我们观察到hdac4和traf6的下调,所述hdac4通过调节e3泛素连接酶(murf1和atrogin-1)、myhc和pgc1a水平来促进萎缩(37,38,48),所述traf6是先前参与肌肉萎缩的适配子蛋白和非常规e3泛素连接酶(33)。除了调节萎缩基因表达之外,自噬的增强已经涉及akt/foxo信号传导下游的衰老表型的逆转(21,30),这在我们的转录组分析中并不明显。在本文中,我们显示了在老年小鼠中15-pgdh的部分抑制导致许多这些萎缩标志物的减少,导致肌肉质量和功能的改善。
[0255]
我们还观察到在sw处理的老化肌肉的转录组中的第二途径(即tgf-β信号传导途径)的显著下调。该家族的一个重要成员,即肌肉生长抑制素,对肌肉生长具有显著的抑制作用,并且其在敲除动物中的丧失与显著的肥大相关(58)。肌肉生长抑制素通过活化素受体和下游smad转录因子发信号,关闭akt途径和蛋白质合成,同时触发泛素连接酶的表达,所述泛素连接酶协调(orchestrate)肌肉蛋白质的降解(59)。tgf-β途径中的几个基因(包括肌肉生长抑制素、转化生长因子β-2(tgf-β-2)和活化素受体2a型)在sw处理的老化肌肉的转录组中显著减少。
[0256]
总之,在本文中,我们揭示了15-pgdh作为用于旨在改善与衰老和肌肉减少症相关的肌肉消瘦的策略的先前未认识到的标志物和治疗靶标。我们的干预是有利的,因为它需要老年小鼠中pge2的稳态水平生理恢复到年轻小鼠中发现的水平。所得的pge2水平的适度增加调节几种信号传导途径以促进线粒体生物发生和功能,同时抑制tgf-β和泛素蛋白酶体途径,导致肌肉功能的增加。由于15-pgdh活性在一系列组织中升高,我们推测其部分抑制可能具有在衰老期间延伸超过骨骼肌的有益效果。
[0257]
参考文献1.s.cohen,j.a.nathan,a.l.goldberg,muscle wasting in disease:molecular mechanisms and promising therapies.nat rev drug discov 14,58-74(2015).2.y.rolland et al.,sarcopenia:its assessment,etiology,pathogenesis,consequences and future perspectives.j nutr health aging 12,433-450(2008).3.r.a.fielding et al.,sarcopenia:an undiagnosed condition in older adults.current consensus definition:prevalence,etiology,and consequences.international working group on sarcopenia.j am med dir assoc 12,249-256(2011).4.l.larsson et al.,sarcopenia:aging-related loss of muscle mass and function.physiol rev 99,427-511(2019).5.c.e.lee,a.mcardle,r.d.griffiths,the role of hormones,cytokines and heat shock proteins during age-related muscle loss.clin nutr 26,524-534(2007).
6.k.lenk,g.schuler,v.adams,skeletal muscle wasting in cachexia and sarcopenia:molecular pathophysiology and impact of exercise training.j cachexia sarcopenia muscle 1,9-21(2010).7.a.t.v.ho et al.,prostaglandin e2 is essential for efficacious skeletal muscle stem-cell function,augmenting regeneration and strength.proc natl acad sci u s a 114,6675-6684(2017).8.h.chen et al.,prostaglandin e2 mediates sensory nerve regulation of bone homeostasis.nat commun 10,181(2019).9.t.e.north et al.,prostaglandin e2 regulates vertebrate haematopoietic stem cell homeostasis.nature 447,1007-1011(2007).10.y.zhang et al.,tissue regeneration.inhibition of the prostaglandin-degrading enzyme 15-pgdh potentiates tissue regeneration.science 348,aaa2340(2015).11.j.k.prasain,h.d.hoang,j.w.edmonds,m.a.miller,prostaglandin extraction and analysis in caenorhabditis elegans.j vis exp,(2013).12.d.wang,r.n.dubois,eicosanoids and cancer.nat rev cancer 10,181-193(2010).13.y.h.wu et al.,structural basis for catalytic and inhibitory mechanisms of human prostaglandin reductase ptgr2.structure 16,1714-1723(2008).14.u.raue et al.,transcriptome signature of resistance exercise adaptations:mixed muscle and fiber type specific profiles in young and old adults.j appl physiol(1985)112,1625-1636(2012).15.b.g.childs,m.durik,d.j.baker,j.m.van deursen,cellular senescence in aging and age-related disease:from mechanisms to therapy.nat med 21,1424-1435(2015).16.d.j.baker et al.,naturally occurring p16(ink4a)-positive cells shorten healthy lifespan.nature 530,184-189(2016).17.j.chang et al.,clearance of senescent cells by abt263 rejuvenates aged hematopoietic stem cells in mice.nature medicine 22,78-83(2016).18.l.brocca et al.,foxo-dependent atrogenes vary among catabolic conditions and play a key role in muscle atrophy induced by hindlimb suspension.j physiol 595,1143-1158(2017).19.j.m.sacheck et al.,rapid disuse and denervation atrophy involve transcriptional changes similar to those of muscle wasting during systemic diseases.faseb j 21,140-155(2007).20.m.f.o'leary,a.vainshtein,s.iqbal,o.ostojic,d.a.hood,adaptive plasticity of autophagic proteins to denervation in aging skeletal muscle.am j physiol cell physiol 304,c422-430(2013).
21.j.segales et al.,sestrin prevents atrophy of disused and aging muscles by integrating anabolic and catabolic signals.nat commun 11,189(2020).22.m.korotkova,i.e.lundberg,the skeletal muscle arachidonic acid cascade in health and inflammatory disease.nat rev rheumatol 10,295-303(2014).23.e.ricciotti,g.a.fitzgerald,prostaglandins and inflammation.arterioscler thromb vasc biol 31,986-1000(2011).24.p.j.fernandez-marcos,j.auwerx,regulation of pgc-1alpha,a nodal regulator of mitochondrial biogenesis.am j clin nutr 93,884s-890(2011).25.h.fujino,j.w.regan,ep(4)prostanoid receptor coupling to a pertussis toxin-sensitive inhibitory g protein.mol pharmacol 69,5-10(2006).26.v.konya,g.marsche,r.schuligoi,a.heinemann,e-type prostanoid receptor 4(ep4)in disease and therapy.pharmacol ther 138,485-502(2013).27.p.bonaldo,m.sandri,cellular and molecular mechanisms of muscle atrophy.dis model mech 6,25-39(2013).28.m.d.gomes,s.h.lecker,r.t.jagoe,a.navon,a.l.goldberg,atrogin-1,a muscle-specific f-box protein highly expressed during muscle atrophy.proc natl acad sci u s a 98,14440-14445(2001).29.s.c.bodine et al.,akt/mtor pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo.nat cell biol 3,1014-1019(2001).30.g.milan et al.,regulation of autophagy and the ubiquitin-proteasome system by the foxo transcriptional network during muscle atrophy.nat commun 6,6670(2015).31.m.sandri et al.,foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy.cell 117,399-412(2004).32.t.n.stitt et al.,the igf-1/pi3k/akt pathway prevents expression of muscle atrophy-induced ubiquitin ligases by inhibiting foxo transcription factors.mol cell 14,395-403(2004).33.p.k.paul et al.,targeted ablation of traf6 inhibits skeletal muscle wasting in mice.j cell biol 191,1395-1411(2010).34.m.altun et al.,muscle wasting in aged,sarcopenic rats is associated with enhanced activity of the ubiquitin proteasome pathway.j biol chem 285,39597-39608(2010).35.s.clavel et al.,atrophy-related ubiquitin ligases,atrogin-1 and murf1 are up-regulated in aged rat tibialis anterior muscle.mech ageing dev 127,794-801(2006).
skeletal muscle finds change in spliceosome,immunity,proteostasis and mitochondria.elife 8,(2019).50.r.calvani et al.,mitochondrial pathways in sarcopenia of aging and disuse muscle atrophy.biol chem 394,393-414(2013).51.r.berdeaux,r.stewart,camp signaling in skeletal muscle adaptation:hypertrophy,metabolism,and regeneration.am j physiol endocrinol metab 303,e1-17(2012).52.s.herzig et al.,creb regulates hepatic gluconeogenesis through the coactivator pgc-1.nature 413,179-183(2001).53.s.austin,j.st-pierre,pgc1alpha and mitochondrial metabolism
‑‑
emerging concepts and relevance in ageing and neurodegenerative disorders.j cell sci 125,4963-4971(2012).54.m.sandri et al.,signalling pathways regulating muscle mass in ageing skeletal muscle:the role of the igf1-akt-mtor-foxo pathway.biogerontology 14,303-323(2013).55.t.zaglia et al.,atrogin-1deficiency promotes cardiomyopathy and premature death via impaired autophagy.j clin invest 124,2410-2424(2014).56.g.a.joseph et al.,partial inhibition of mtorc1 in aged rats counteracts the decline in muscle mass and reverses molecular signaling associated with sarcopenia.mol cell biol 39,(2019).57.c.vinel et al.,the exerkine apelin reverses age-associated sarcopenia.nat med 24,1360-1371(2018).58.a.c.mcpherron,a.m.lawler,s.j.lee,regulation of skeletal muscle mass in mice by a new tgf-beta superfamily member.nature 387,83-90(1997).59.y.elkina,s.von haehling,s.d.anker,j.springer,the role of myostatin in muscle wasting:an overview.j cachexia sarcopenia muscle 2,143-151(2011).材料和方法小鼠
[0258]
我们按照斯坦福大学和实验动物护理管理小组(aplac)的机构指南进行了所有实验和方案。中年(18-20mo.)和老年(》24mo.)小鼠c57bl/6获自美国国家老龄化研究所(nia)用于老化肌肉研究,以及青年(2-4mo.)野生型c57bl/6小鼠来自jackson laboratory。如前所述(1)产生ink-attac小鼠。ink-attac健康寿命评估。将ink-attac小鼠杂交到c57bl6/j遗传背景上,并在研究期间,将其保持在12小时黑暗/光照循环的无特异性病原体的住房中。在12月龄时,将雄性小鼠用于基线健康寿命评估和末端肌肉收获或随机化以接受每周两次的媒介物或ap20187(2mg/kg腹膜内注射;b/b同型二聚体,clontech)直到在28月龄时评估并处死(2)。如前所述(3),通过腹膜内注射5mg/kg的sw033291(sw)(cayman chemicals)或媒介物(10%乙醇,5%聚氧乙烯蓖麻油,85%d5w(5%的葡萄糖水)),每天一次处理小鼠,持续1个月。如前所述(4)对sw处理的小鼠和它们的对照进行筋疲力尽的时间和距离。
[0259]
对于abt-263处理,将20月龄的c57/b16小鼠通过口服管饲法用媒介物(乙醇:聚乙二醇400:phosal 50pg)或50mg/kg/天abt-263(在乙醇:聚乙二醇400:phosal 50pg中)处理1周的2个周期,在周期之间有2周的休息期,如前所述(5)。用13nmol pge2(cayman chemicals)或媒介物对照(pbs)在年轻小鼠的ta肌肉中进行pge2的肌肉注射。小鼠转基因品系购自the jackson laboratory(ep4flox/flox;ep4f/f)no.028102(6)。我们通过适当的基于pcr的策略验证了这些基因型。用雄性小鼠进行研究。使用facs进行原代细胞分离
[0260]
如前所述(6-9),我们分离和富集了肌原性细胞。简而言之,通过macs解离器(miltenyi)使用胶原酶和分散酶溶液切碎和消化后肢肌肉。使用facs,对于肌原性干细胞和祖细胞,我们分离了造血谱系和非肌细胞(cd45-/cd11b-/cd31-/sca1-)阴性的细胞,并针对α7-整联蛋白
+
细胞标志物进行分选。对于巨噬细胞分离,我们分选了a7-/cd11b
+
/cd11c-/f4/80+群体。对于内皮细胞,我们分选了a7-/cd11b-/cd11c-/cd31
+
。我们使用flowjo v10.0产生并分析流式细胞术散点图。shrna和mck-cre的肌内aav9递送
[0261]
将针对hpgd(15-pgdh)(nm_008278)的shrna在u6启动子依赖性和egfp下整合到aav9(aav9-egfp-u6-sh15pgdh)(vector biolabs)中。将对照小鼠用含有加扰肽序列而非sh15pgdh的类似构建体(aav9-egfp-u6-shscr)处理。将cre在肌肉特异性tmck启动子和egfp下整合到aav9(aav9-tmck-egfp-wpre)(vector biolabs)中。hpgd(15-pgdh)的过表达通过在cmv启动子下和ires下的egfp整合到aav9(aa9-cmv-m-hpgd-ires-egfp)(vector biolabs)中来实现。对照病毒为aav9-tmck-egfp-wpre。使用在u6启动子依赖性下整合的aav9(aav9-gfp-u6-m-ptgds-shrna)实现ptdgs的敲低,并以2
×
10
11
gc/ga的最终浓度向对照小鼠注射加扰的(aav9-gfp-u6-scrmb-shrna)(vector biolabs)。将3-4或》24月龄的c57b1/6小鼠用20μl上述aav9颗粒在pbs中的稀释液(终浓度为2
×
10
11
个颗粒/ga)进行两次肌内注射到腓肠肌(ga)中,和/或一次肌内注射到胫前肌(ta)中(终浓度为2
×
10
11
gc/ta)。免疫荧光染色和成像
[0262]
如前所述(6),我们收集并准备接受者的胫前肌(ta)或腓肠肌(ga)肌肉组织用于组织学。我们使用4%pfa固定肌肉的横截面或从肌肉中分离肌纤维,使用pbs/1%bsa/0.1%triton x-100进行封闭和透化,并与生物素-抗cd11b(bd biosciences,目录#553309,1:100)、抗15-pgdh(novus biologicals,目录#nb200-179ss,1:100)、抗laminin(millipore,clone a5,目录#05-206,1:200),然后与alexafluor二抗(jackson immunoresearch laboratories,1:200)、链霉亲和素-cy3(biolegend,1:500)或小麦胚芽凝集素-alexa 647缀合物(wga,thermo fisher scientific)一起孵育。我们用dapi(invitrogen)复染细胞核。
[0263]
通过冷冻的10μm切片的免疫组织化学进行纤维分型,并安装在载玻片上。在室温下,将风干的切片立即在pbs/1%山羊血清中封闭1小时,并在4℃下使用针对在pbs/1%山羊血清中稀释过夜的mhc2a(来自dshb的sc71,1:1000)、mhc2b(来自dshb的bf-f3,1:100)(10,11)和层粘连蛋白(laminin)(millipore,克隆a5,目录号#05-206,1:200)的抗体进行免疫组织染色。在室温下,将针对在pbs/1%bsa中稀释的igg1alexa488、igm alexa 405和igg2b alexa647(jackson immunoreserch laboratories,1:500)的二抗应用1小时,然后
用dapi(invitrogen)复染细胞核。使用keyence bz-x700一体化荧光显微镜,利用20x/0.75n.a.物镜获得图像,以及使用keyence高级分析软件合并和分析单独的视野。
[0264]
对于培养的肌管,我们使用4%pfa进行固定,使用pbs/1%bsa/0.1%triton x-100进行封闭和透化,并用一抗抗myh(thermo fisher scientific,目录#14-6503-82,克隆mf-20,1:500),然后用alexafluor二抗(jackson immunoresearch laboratories,1:500)染色。我们用dapi(invitrogen)复染细胞核。我们使用keyence bz-x700一体化荧光显微镜(keyence),利用20
×
/0.75n.a.物镜获得图像。我们使用keyence高级分析软件对纤维区域进行分析。对于纤维区域,对肌肉的整个最大横截面积进行定量,或者如上所述对每只小鼠捕获涵盖超过400个肌纤维的至少10个视野的laminin或wga染色的肌纤维横截面积。对于纤维分型分析,如先前所述(12)使用matlab应用smash-使用组织学分割的半自动肌肉分析(semi-automatic muscle analysis using segmentation of histology)。数据分析是盲目的。进行成像采集和评分的研究人员不知道所分析的样品组给出的处理条件。细胞培养
[0265]
鼠原代成肌细胞在含有dmem/f10(50:50)、15%fbs、2.5ng ml-1
成纤维细胞生长因子-2和1%青霉素-链霉素的肌原性细胞培养基中生长。来自两名59岁女性的胸肌的原代人类祖细胞,如前所述(13),使用skgm-2骨骼肌生长培养基(lonza,cc-3245)生长。对于分化实验,汇合的成肌细胞在含有5%马血清,dmem的培养基中生长。我们将10ng/ml前列腺素e2(cayman chemicals)、1μm sw033291(apexbio)或1μm ono-ae3-208(cayman chemicals)添加至第4天分化的鼠肌管中或第7天分化的人肌管中。通过体外sunset进行蛋白质合成
[0266]
如前所述(4),使用sunset测定来监测蛋白质合成的速率。简而言之,在收获细胞前10分钟,将嘌呤霉素以1μg/ml加入到培养基中。作为对照,加入环己酰亚胺以阻断蛋白质翻译。然后使用抗嘌呤霉素12d10抗体(millipore)处理细胞提取物用于蛋白质印迹。定量rt-pcr
[0267]
我们使用rneasy试剂盒(qiagen)从musc、成肌细胞和肌管分离rna。将肌肉样品在液氮中速冻,然后使用fastprep fp120匀浆器(mp biomedicals)在trizol(invitrogen)中均质化,然后分离rna。我们使用sensifast
tm cdna合成试剂盒(bioline)从来自每个样品的总mrna逆转录cdna。我们在abi 7900ht实时pcr系统(applied biosystems)中使用sybr green pcr预混合物(applied biosystems)或taqman测定(applied biosystems)对cdna进行rt-pcr。我们在95℃下保持10分钟,然后40个循环的在95℃下保持15s和60℃下保持1分钟而使样品循环。为了定量相对转录物水平,我们使用2-δδct来比较处理的样品和未经处理的样品,并相对于gapdh表达结果。
[0268]
对于sybr green qrt-pcr,我们使用以下引物序列:gapdh,正向5
’‑
ttcaccaccatggagaaggc-3’,反向5
’‑
cccttttggctccaccct-3’;hpgd,正向5
’‑
tccagtgtgatgtggctgac-3’,反向5
’‑
attgttcacgcctgcattgt-3’;ptger1,正向5’gtggtgtcgtgcatctgct-3’,反向5
’‑
ccgctgcagggagttagagt-3’;
ptger2,正向5
’‑
accttcgccatatgctcctt-3’,反向5
’‑
ggaccggtggcctaagtatg-3’;fbxo32(atrogin1),正向5
’‑
tagtaaggctgttggagctgatag-3’,反向5
’‑
ctgcaccagtgtgcataagg-3’;trim63正向5
’‑
catcttccaggctgcgaatc-3’,反向5
’‑
actggagcactcctgcttgt-3’;atg4,正向5
’‑
atggagtcagttatgtccaa-3’,反向5
’‑
caatcggggaaaacttcctt-3’;atg6正向5
’‑
ggaactcacagctccattactta-3’,反向5
’‑
catcctggcgagtttcaataa-3’;pgc1a,正向5
’‑
agacaaatgtgcttcgaaaaagaa-3’,反向5
’‑
gaagagataaagttgttggtttggc-3’;ptgdr1正向5
’‑
cccagtcaggctcagactaca-3’,反向5
’‑
aagtttaaaggctccatagtacgc-3’;ptgdr2正向5
’‑
agcacacccgatcagtcac-3’,反向-5
’‑
gtcacccaggaaccagaaga-3’;ptgfr正向5
’‑
tcatgaaggcctaccagagatt-3’,反向5
’‑
ctgtgatcaccaggccacta-3’musa1正向5
’‑
cttcagtctcgtggaatggtaatctt-3’,反向5
’‑
tgcagtactgaatcgccatac-3’smart正向5
’‑
tttttgaggatgagctggtgtgt-3’,反向5
’‑
aggaacgccttgaggttattgag-3’traf6正向5
’‑
tgcaaaagatggaactgagacatc-3’,反向5
’‑
tgggacaatcctcaataatgtgtg-3’atf7正向5
’‑
tctgggaagccataaagtcagg-3’,反向5
’‑
gcgaaggtcaggagcagaa-3’bnip3正向5
’‑
tgacagcccacctcgc-3’,反向5
’‑
tcgacttgaccaatcccata-3’ulk2正向5
’‑
gcaccgccagaaaactgat-3’,反向5
’‑
gttgggcaattcctgaacat-3’[0269]
对于鼠衰老标志物和衰老相关标志物,我们使用先前所述的引物(2)。利用taqman通用pcr预混合试剂试剂盒(applied biosystems),根据制造商的说明书,使用taqman测定(applied biosystems)定量样品中的p21、mstn、ptger3和ptger4。转录水平以相对于gapdh水平来表示。对于sybr green qpcr,使用gapdh qpcr来归一化输入的cdna样品。对于taqman qpcr,多重qpcr使得靶标信号(fam)能够通过其内部的gapdh信号(vic)单独地被归一化。线粒体拷贝数通过使用前述方法和引物定量(14)。微阵列数据
[0270]
从可公开获得的储存库gene expression omnibus(ncbi.nlm.nih.gov/geo/)收集微阵列基因表达谱。我们分析了来自hpgd表达的gse25941(15)的微阵列数据。
酮pge2为0.25ng/ml至500ng/ml。样品制备程序
[0277]
提取程序从prasain等人(20)的程序进行了修改,并包括丙酮蛋白质沉淀,然后进行2步液液萃取;后一步提高了lc-ms/ms的灵敏度。使用丁羟甲苯(bht)和氮气(n2)下的蒸发来防止氧化。收获固体组织,称重,并使用液氮速冻。将肌肉组织与均质化珠粒和200μl均质化缓冲液组合在聚丙烯管中,并在fastprep 24匀浆器(mp biomedicals)中以6m/s的速度处理40秒。均质化后,将10μl内标溶液(3000ng/ml)加入到组织匀浆中,然后振荡2分钟(multi-tube vortexer,thermo scientific)。离心样品并将上清液转移至干净的eppendorf管中。向样品中加入200μl己烷,然后振荡15分钟(vortex mixer,thermo scientific),接着离心。将样品在-80℃下冷冻40分钟。从冷冻的下面水层倒出己烷层并丢弃。融化后,向底部水层加入25μl 1n的甲酸,并将样品涡旋。对于第二次提取,向水相中加入200μl氯仿。将样品振荡15分钟以确保完全提取。进行离心以分离各层。将下面的氯仿层转移至新的eppendorf管中,并在氮气下,于40℃蒸发至干燥。将干燥的残留物在100μl乙腈/10mm乙酸铵中复溶(2:8v/v),并通过lc-ms/ms进行分析。lc-ms/ms
[0278]
由于许多前列腺素是具有相同质量的位置异构体且具有类似的片段化模式,因此色谱分离至关重要。针对每种分析物仔细选择了至少两个srm离子峰——一个是定量离子峰和另一个是定性离子峰。独特的定性物与定量物离子强度比率和保留时间对于鉴定靶标分析物至关重要。所有分析均通过负电喷射lc-ms/ms,使用lc-20adxr prominence液相色谱仪和8030三重四极杆质谱仪(shimadzu)进行。hplc条件:acquity uplc beh c18 2.1x100 mm,1.7um粒径柱,在50℃下操作,流速为0.25ml/min。流动相由以下物质组成:a:0.1%乙酸水溶液以及b:0.1%乙酸乙腈溶液。洗脱概况:最初采用35%b保持5分钟,然后采用35%-40%的梯度3分钟,接着40%-95%3分钟;总运行时间为14分钟。注射体积为20μl。使用这些hplc条件,我们实现了目的分析物的基线分离。选定的反应监测(srm)用于定量。质量离子峰如下:pgd2:m/z 351.10
→
m/z 271.3(定量离子峰);m/z 351.10
→
m/z 233.05(定性离子峰)和m/z 351.10
→
m/z 189.15(定性离子峰);pge2:m/z 351.20
→
m/z 271.10(定量离子峰);m/z 351.20
→
m/z 333.15(定性离子峰)和m/z 351.20
→
m/z 315.20(定性离子峰);pgf2α:m/z 353.10
→
m/z 3193.3(定量离子峰)和m/z 353.10
→
m/z 309.20(定性离子峰);15酮-pge2:m/z 349.30
→
m/z 331.20(定量离子峰)和m/z 349.30
→
m/z 113.00(定性离子峰);13,14-二氢15-酮pge2:m/z 351.20
→
m/z 333.30(定量离子峰)和m/z 351.20
→
m/z 113.05(定性离子峰);pge2-d4:m/z 355.40
→
m/z 275.20(定量离子峰);pgf2α-d9:m/z 362.20
→
m/z 318.30;pgd2-d4:m/z 355.10
→
m/z 275.40;pga2:m/z 332.90
→
m/z 271.25(定量离子峰)和m/z 332.90
→
m/z 189.10(定性离子峰);以及13,14-二氢15-酮pga2:m/z 332.90
→
m/z 235.15(定量离子峰)m/z 332.90
→
m/z 113.00(定性离子峰)。停留时间为20-30ms。
[0279]
使用labsolutions lcms(shimadzu)进行定量数据分析。内标法用于定量:pge2-d4为pge2、15-酮pge2和13,14-二氢15-酮pge2,pga2;13,14-二氢15-酮pga2定量的内标。pgf2α-d9为pgf2α定量的内标;以及pd2-d4为pgd2定量的内标。使用1/x2的权重因子,校准曲线在浓度范围内为线性的(r》0.99),其中x为浓度。反算的标准浓度为标称值的
±
15%,
以及在定量下限(lloq)的
±
20%。体内肌力测量
[0280]
如前所述(21,22)评估脚踝跖屈肌的峰值等轴扭矩(n
·
mm)。简而言之,将麻醉的小鼠的脚放置在连接到伺服电机(型号300c-lr;aurora scientific)的踏板上。将两个pt-ir电极针(aurora scientific)经皮和皮下插入胫神经上方,恰好在膝盖的后部/后中。踝关节以90
°
角固定。通过以200hz的频率和0.1-ms的方波脉冲改变传递到胫神经的电流来实现峰值等轴扭矩。我们对每个肌肉进行三次强直性测量,每次测量之间恢复1分钟。用aurora科学动态肌肉数据采集和分析软件(aurora scientific dynamic muscle data acquisition and analysis software)收集数据。统计分析
[0281]
非参数曼-惠特尼检验用于确定未处理的对比经处理的组之间的显著性差异(使用α=0.05)。进行anova或多重t检验用于多重比较,使用邦费罗尼校正校正或费希尔检验来确定显著性水平,如附图图例中所示。除非另有说明,否则数据显示为平均值
±
s.e.m。参考文献1.d.j.baker et al.,clearance of p16ink4a-positive senescent cells delays ageing-associated disorders.nature 479,232-236(2011).2.d.j.baker et al.,naturally occurring p16(ink4a)-positive cells shorten healthy lifespan.nature 530,184-189(2016).3.y.zhang et al.,tissue regeneration.inhibition of the prostaglandin-degrading enzyme 15-pgdh potentiates tissue regeneration.science 348,aaa2340(2015).4.c.vinel et al.,the exerkine apelin reverses age-associated sarcopenia.nat med 24,1360-1371(2018).5.j.chang et al.,clearance of senescent cells by abt263 rejuvenates aged hematopoietic stem cells in mice.nature medicine 22,78-83(2016).6.a.t.v.ho et al.,prostaglandin e2 is essential for efficacious skeletal muscle stem-cell function,augmenting regeneration and strength.proc natl acad sci u s a 114,6675-6684(2017).7.b.d.cosgrove et al.,rejuvenation of the muscle stem cell population restores strength to injured aged muscles.nat med 20,255-264(2014).8.a.sacco,r.doyonnas,p.kraft,s.vitorovic,h.m.blau,self-renewal and expansion of single transplanted muscle stem cells.nature 456,502-506(2008).9.p.m.gilbert et al.,substrate elasticity regulates skeletal muscle stem cell self-renewal in culture.science 329,1078-1081(2010).10.g.azzarello et al.,myosin isoform expression in rat rhabdomyosarcoma induced by moloney murine sarcoma virus.j cancer res clin oncol 113,417-429(1987).11.s.schiaffino et al.,three myosin heavy chain isoforms in type 2 skeletal muscle fibres.j muscle res cell motil 10,197-205(1989).
12.l.r.smith,e.r.barton,smash-semi-automatic muscle analysis using segmentation of histology:a matlab application.skelet muscle 4,21(2014).13.x.xu et al.,human satellite cell transplantation and regeneration from diverse skeletal muscles.stem cell reports 5,419-434(2015).14.p.m.quiros,a.goyal,p.jha,j.auwerx,analysis of mtdna/ndna ratio in mice.curr protoc mouse biol 7,47-54(2017).15.u.raue et al.,transcriptome signature of resistance exercise adaptations:mixed muscle and fiber type specific profiles in young and old adults.j appl physiol(1985)112,1625-1636(2012).16.a.dobin et al.,star:ultrafast universal rna-seq aligner.bioinformatics 29,15-21(2013).17.b.li,c.n.dewey,rsem:accurate transcript quantification from rna-seq data with or without a reference genome.bmc bioinformatics 12,323(2011).18.m.i.love,w.huber,s.anders,moderated estimation of fold change and dispersion for rna-seq data with deseq2.genome biol 15,550(2014).19.w.huang da,b.t.sherman,r.a.lempicki,systematic and integrative analysis of large gene lists using david bioinformatics resources.nat protoc 4,44-57(2009).20.j.k.prasain,h.d.hoang,j.w.edmonds,m.a.miller,prostaglandin extraction and analysis in caenorhabditis elegans.j vis exp,(2013).21.e.l.mintz,j.a.passipieri,d.y.lovell,g.j.christ,applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair.j vis exp,(2016).22.k.a.sheth et al.,muscle strength and size are associated with motor unit connectivity in aged mice.neurobiol aging 67,128-136(2018).实施例3:靶向前列腺素e2降解酶以改善年龄相关的疾病和病况中的非骨骼肌组织功能
[0282]
随着年龄的增长,生活质量降低并且死亡率增加。年龄相关的疾病是一组随着年龄增长而在人群中更频繁发生的疾病,其与寿命降低直接相关(1)。这些年龄相关的疾病包括心血管疾病(心房纤颤、中风、缺血性心脏病、心肌病、心内膜炎、脑内出血),慢性呼吸道疾病(慢性阻塞性肺病、石棉肺、矽肺)、营养性疾病(沙眼、腹泻疾病、脑炎)、肾脏疾病(慢性肾脏疾病),胃肠和消化疾病(nash、胰腺炎、溃疡、肠梗阻),神经病症(阿尔茨海默病、痴呆、帕金森病),感觉障碍(听力损失、黄斑变性、青光眼),皮肤和皮下疾病(蜂窝织炎、溃疡、真菌皮肤病、脓皮病),骨质疏松症,骨关节炎,类风湿性关节炎等(2)。
[0283]
我们先前确定了pge2刺激肌肉干细胞(musc)以在年轻小鼠中再生受损肌肉(3),这与关于其在其它组织(包括骨、结肠、肝脏和血液)中再生功能的发现(4-6)很好地一致。我们推断pge2信号传导可能在衰老中出错。在本文中,我们证明了pge2降解酶15-羟基前列腺素脱氢酶(15-pgdh)在老化组织中的先前未认识到的作用。15-pgdh的部分抑制使pge2和/或pgd2恢复至年轻水平,从而可以复壮组织功能。我们的发现为衰老提供了新的见解,
并揭示了创新的治疗策略。
[0284]
我们假设pge2的降低是由于老化组织中15-pgdh的降解增加导致的(图27a)。我们发现,在包括心脏、皮肤、脾脏和结肠的衰老组织中,酶的比活性确实增加(图27b和28)。因此,抑制15-pgdh可以通过恢复或增加老化组织中pge2和/或pgd2水平来帮助改善年龄相关的疾病和病况。
[0285]
我们揭示了15-pgdh作为衰老的新标志物,在许多组织(如心脏、皮肤、结肠和脾脏)中在升高的活性下可检测到。因此,将pge2和/或pgd2恢复到年轻水平可以提供多效改善作用,因为15-pgdh在一系列组织中随着衰老而上调。参考文献1.d.s.kehler,age-related disease burden as a measure of population ageing.lancet public health 4,e123-e124(2019).2.a.y.chang,v.f.skirbekk,s.tyrovolas,n.j.kassebaum,j.l.dieleman,measuring population ageing:an analysis of the global burden of disease study 2017.lancet public health 4,e159-e167(2019).3.a.t.v.ho et al.,prostaglandin e2 is essential for efficacious skeletal muscle stem-cell function,augmenting regeneration and strength.proc natl acad sci u s a114,6675-6684(2017).4.h.chen et al.,prostaglandin e2 mediates sensory nerve regulation of bone homeostasis.nat commun 10,181(2019).5.t.e.north et al.,prostaglandin e2 regulates vertebrate haematopoietic stem cell homeostasis.nature 447,1007-1011(2007).6.y.zhang et al.,inhibition of the prostaglandin-degrading enzyme 15-pgdh potentiates tissue regeneration.science 348,aaa2340(2015).材料和方法小鼠
[0286]
按照斯坦福大学和实验动物护理管理小组(aplac)的机构指南进行了所有实验和方案。老年(》24mo.)小鼠c57bl/6获自美国国家老龄化研究所(nia)用于老化肌肉研究,以及青年(2-4mo.)野生型c57bl/6小鼠来自jackson laboratory。15-pgdh动力学测定
[0287]
使用biovision picoprobe 15-pgdh活性测定试剂盒(目录#k562)根据制造商的方案分析组织裂解物中的15-pgdh活性。简而言之,分离组织,并在液氮中速冻。使用裂解缓冲液(50mm tris-hcl ph 7.5,150mm nacl,4mm cacl,1.5%triton x-100,蛋白酶抑制剂和微球菌核酸酶)制备总裂解物,并使用fastprep 24匀浆器(mp biomedicals)以6m/s的速度均质化40秒。
[0288]
尽管为了清楚理解的目的,已经通过示例和实施例的方式详细描述了上述公开内容,但本领域技术人员将理解,可以在所附权利要求的范围内实践某些改变和修改。另外,本文提供的每篇参考文献通过引用以其整体并入,其程度如同每篇参考文献单独地通过引用并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1