基于放射学的活检得分风险评估的制作方法
1.本文所述的实施例整体涉及用于确定肿瘤异质性的方法、系统和计算机程序产品。在特定方面,本发明涉及用于确定从处理肿瘤组织的活检样本获得的病理学得分(例如指示程序性死亡1受体及其配体(pd-1/pd-l1)的表达的得分)的代表性的计算机实现的方法。方法特别适用于确定从潜在异质肿瘤获得的病理学得分是否可能不准确。这样的方法的输出在临床决策中是有用的,例如,用于确定癌症治疗中的进一步诊断和/或疗法步骤。
背景技术:
2.随着检查点抑制免疫疗法(cit)的引入,调节免疫系统的治疗已成为癌症疗法的重要类别,即使在一线治疗中,fda也批准了许多癌症类型。这些疗法可以在晚期患者中实现持久的响应。然而,根据癌症类型,单一疗法的响应者百分比仅为15%至30%。cit的基本机制是激活细胞毒性t细胞,这些t细胞能够将肿瘤识别为外来者。通过阻断靶细胞上的检查点分子,可以使用效应物功能,并且可以通过渗透的t细胞杀死肿瘤细胞。
3.临床上最重要的检查点是程序性死亡1受体和配体(pd-1/pd-l1)。pd-l1分子在肿瘤细胞上的过量表达被用作生物标志物,用于在各种癌症(诸如非小细胞肺癌(nsclc))的一线治疗中选择患者。
4.大多数肺癌患者被诊断为晚期,并且诊断基于小活检或细胞学标本。在晚期癌症环境中,手术通常不适用。存在几种技术可用于获取肺癌活检样本,包括支气管镜检查、超声引导支气管镜检查、纵隔镜检查、经胸针吸、胸腔穿刺术和内科胸腔镜检查。所有这些在组织产量方面都有局限性,并且它们的使用在很大程度上取决于病变的位置及其可及性。对于肺癌来说,这是一个重大挑战。在最好的情况下,使用20号到22号的芯针进行经胸穿刺抽吸,每个芯活检通常包含大约500个细胞。该材料然后被石蜡包埋并切成薄片用于显微镜分析。
5.cit中的治疗选择通常涉及使用此类技术确定从患者获得的活检样本中肿瘤细胞上的pd-l1表达。然而,很明显,pd-l1表达并不是患者响应的良好预测指标。一个原因是该生物标志物表达的强烈空间异质性限制了在单个时间点对小活检进行测定的有效性。
6.肿瘤由不同的细胞和组织类型组成。肿瘤内不同位置处的癌细胞在其基因组成、活性和环境相关信号传导行为方面可能有所不同。已注意到,特别是相关的pd-l1表达可以在单个病变内以及同一患者的病变之间有很大差异。对于通过免疫组织化学确定pd-l1表达,通常只有活检可用。从活检获得的得分可能无法反映肿瘤的平均特性。这样,活检的阴性结果可能会变成假阴性,因为肿瘤的其他部分可能是阳性的。
7.目前,无法估计进行非代表性活检但病理评估可能不正确的可能性。pd-l1得分是治疗决策中的重要因素。因此,需要确定肿瘤异质性的方法,方法可以被用于预测获得肿瘤的活检样本的代表性可能有多大。具体地,需要能够预测获得关于例如pd-l1表达来代表肿瘤的用于病理评估的活检标本的似然值的方法。
技术实现要素:
8.本发明的目的通过独立权利要求的主题来解决,其中进一步的实施例被并入从属权利要求中。应当注意,本发明的以下描述的各方面同样适用于用于确定肿瘤异质性的方法、系统和计算机程序产品。
9.在本发明的实施例中,肿瘤异质性得分基于放射学图像分析,例如使用正电子发射断层扫描(pet)来计算。放射学图像分析可以被用于指示从活检样本的病理分析中获得非代表性结果的风险。具体地,使用本方法,从放射学图像分析获得的异质性得分可以与从分析活检样本获得的病理学得分进行比较。通过将异质性得分与病理学得分进行比较,可以预测病理学得分对整个肿瘤的代表性。例如,在一些实施例中,方法可以预测基于活检的(病理学)得分是不具代表性的和/或不准确的,因为活检位点的肿瘤局部变化。这例如通过标识病理学得分中的假阴性结果并指示需要进一步的样本/测试,可以对疗法产生重要影响。
10.例如,在一个实施例中,fdg-pet/ct图像分析被用于指示活检样本中pd-l1表达的潜在异质性,以及因此在活检中获得不正确/不具有代表性的pd-l1得分的概率。在另一实施例中,放射图像分析可以被用于指导活检样本的采集。
11.因此,在一个实施例中,本发明提供了用于确定肿瘤异质性的计算机实现的方法,方法包括:分析肿瘤的放射图像来计算肿瘤中多个位置中的每个位置处的指示肿瘤活性的值;确定每个计算值是否高于预定阈值;以及计算肿瘤的异质性得分;其中异质性得分基于具有高于预定阈值的指示肿瘤活性的值的肿瘤的体积分数来计算。
12.在一个实施例中,方法还包括计算从肿瘤获得的活检样本具有高于预定阈值的肿瘤活性值的概率,其中概率基于异质性得分和活检样本的体积来计算。
13.在另一实施例中,方法还包括:分析肿瘤活检样本的显微图像来确定与肿瘤相关联的生物学参数的值;以及确定生物学参数的值代表肿瘤的似然值,其中似然值基于异质性得分和/或概率来计算。
14.在一些实施例中,放射图像通过正电子发射断层扫描(pet)、磁共振成像(mri)、计算机断层扫描(ct)和/或单光子发射计算机断层扫描(spect)来获得。
15.在一个实施例中,组织中指示肿瘤活性的值是例如由pet获得的标准摄取值(suv)。例如,指示肿瘤活性的值(例如suv)可以通过使用(18-f)氟脱氧葡萄糖(fdg)的pet成像来获得。
16.在一个实施例中,生物学参数包括肿瘤细胞上程序性死亡配体1(pd-l1)的表达水平。
17.在一个实施例中,方法还包括计算轮廓线图,轮廓线图示出了具有相等肿瘤活性值的肿瘤区域。优选地,轮廓线图中的至少一个轮廓线对应于预定的肿瘤活性阈值。在一些实施例中,轮廓线图可以包括多个轮廓线,每个轮廓线对应于不同的预定肿瘤活性阈值。在一些实施例中,每个轮廓线(和每个预定的肿瘤活性阈值)可以与生物学参数的临床相关阈值(例如pd-l1表达阳性的肿瘤细胞的不同百分比(肿瘤比例得分或tps),诸如1%或50%)相关。
18.在一个实施例中,方法还包括向用户指示具有高于预定阈值的肿瘤活性的肿瘤区域,活检样本要从该肿瘤区域中提取。
19.在一个实施例中,肿瘤的体积分数基于具有高于预定阈值的值的最小连接体积来确定。
20.在一个实施例中,指示肿瘤活性的值指示肿瘤中的代谢活性、缺氧和/或增殖。
21.在一个实施例中,每个指示肿瘤活性的值针对肿瘤内的体积元素来确定,并且体积元素的平均值与预定阈值进行比较。在另一实施例中,每个指示肿瘤活性的值针对肿瘤内的体积元素来确定,并且体积元素的最大值与预定阈值进行比较。
22.在一个实施例中,肿瘤活性的值(例如,从放射图像获得)与生物学参数的值(例如,从显微图像获得)相关。优选地,肿瘤活性的预定阈值与和肿瘤相关联的生物学参数的临床相关阈值相关。例如,在一个实施例中,生物学参数是对pd-l1表达呈阳性的肿瘤细胞的百分比(肿瘤比例得分或tps)。临床相关阈值可以是例如tps值,tps值指示是否适合检查点抑制剂治疗(或例如其特定方式,诸如检查点抑制剂治疗与化学疗法的组合)。
23.在一个实施例中,异质性得分与生物学参数的值进行比较。例如,异质性得分和生物学参数的值之间的不一致可以指示生物学参数的值不具有代表性。具体地,如果生物学参数的值低于临床相关阈值,则异质性得分可以指示肿瘤的显著体积分数具有高于对应预定阈值的活性。在这样的实施例中,可以推荐采取进一步的活检样本。
24.在另一方面,本发明提供用于确定肿瘤异质性的系统,系统包括:用于接收肿瘤的放射图像的接口;存储器;以及处理器,其被配置为执行存储器上存储的指令,以:(a)分析肿瘤的放射图像来计算肿瘤中多个位置中的每个位置处的指示肿瘤活性的值;(b)确定每个计算值是否高于预定阈值;以及(c)计算肿瘤的异质性得分;其中异质性得分基于肿瘤的体积分数来计算,体积分数具有指示肿瘤活性高于预定阈值的值。
25.在另一方面,本发明提供了包括非暂态计算机可读介质的计算机程序产品,计算机可读介质具有其中体现的计算机可读代码,计算机可读代码被配置为使得在由合适的计算机或处理器执行时,使得计算机或处理器执行如上所述的方法。
附图说明
26.现在将参考以下附图来描述本发明的示例性实施例,其中:
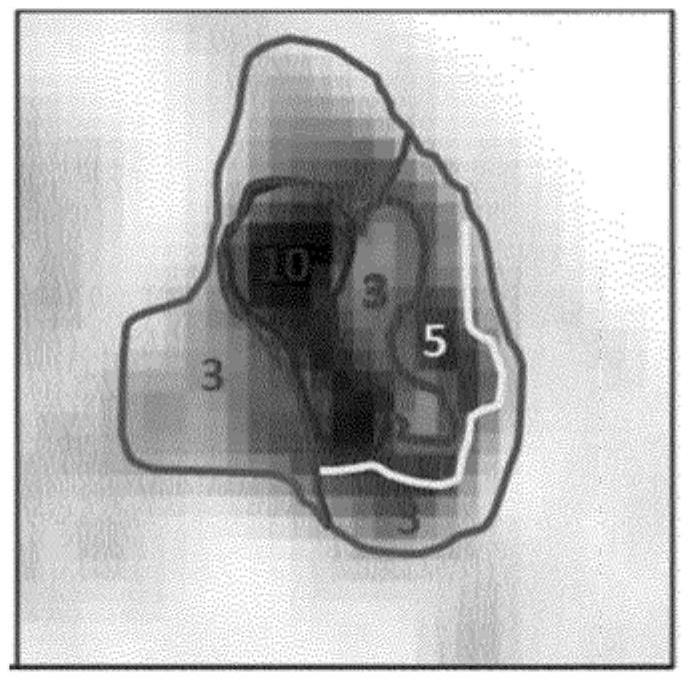
27.图1示出了用于确定肿瘤异质性的计算机化系统的系统框图。
28.图2示出了根据本发明的用于确定肿瘤异质性的方法的流程图。
29.图3示出了来自对pd-l1表达染色的肿瘤的活检样本的病理学图像。(a)示出染色样本的低分辨率图像,指示区域b和c。(b)示出区域b的高分辨率图像,区域b为pd-l1阳性(即,示出pd-l1表达升高)。(c)示出区域c的高分辨率图像,区域c为pd-l1阴性。
30.图4示出了肿瘤的pet图像,该图像具有轮廓线图,其中实线指示具有相等代谢活性(suv)值的肿瘤区域。suv高于10、suv介于5和10之间以及suv介于3和5之间的肿瘤体积区域因此被指示。
31.图5示出了来自感兴趣区域的体积元素的suv直方图。每个体素的实线,每个分析体积的虚线(对应于活检体积)。竖直线指示对应病理解释的预选阈值。切割点指示suv低于阈值的体积元素分数。对于较大体积元素(即,活检体积),如虚线所示,分数更小。
具体实施方式
32.病理学信息对于癌症的诊断、分期和分型至关重要。通常只有小的芯或针活检样本可用。由于肿瘤特性显示出空间异质性,因此存在非代表性诊断结果的显著风险。本文在一个实施例中描述的是使用放射学图像分析来指示具有来自活检病理分析的非代表性结果的风险的方法。作为一个实施例,我们描述了使用fdg-pet/ct图像分析来指示pd-l1表达的潜在异质性以及在活检中获得不正确pd-l1得分的机会。另一实施例描述了使用这样的分析来指导活检。
33.以下参考附图来更全面地描述各种实施例,附图形成了其一部分并且示出了特定的示例性实施例。然而,本公开的概念可以以许多不同的形式来实现并且不应被解释为限于本文所阐述的实施例;相反,这些实施例被提供作为彻底和完整公开内容的一部分,以向本领域技术人员充分传达本公开的概念、技术和实现方式的范围。实施例可以作为方法、系统或设备来实践。因此,实施例可以采取硬件实现方式、完全软件实现方式或组合软件和硬件方面的实现方式的形式。因此,以下的详细描述不应被理解为限制性的。
34.在说明书中对“一个实施例”或“实施例”的引用意味着结合实施例描述的特定特征、结构或特性被包括在根据本公开的至少一个示例实现方式或技术中。在说明书的各个地方出现的短语“在一个实施例中”不一定指代同一实施例。
35.除非从以下讨论中明确另外明确说明,否则应理解,在整个描述中,使用诸如“处理”或“运算”或“计算”或“确定”或“显示”等术语的讨论指代计算机系统或类似的电子运算设备的动作和过程,它在计算机系统存储器或寄存器或其他此类信息存储、传输或显示设备中操纵和转换被表示为物理(电子)量的数据。本公开的各部分包括可以体现在软件、固件或硬件中的过程和指令,并且当体现在软件中时,可以被下载,以驻留在各种操作系统使用的不同平台上并从其操作。本发明可以在各种组件和组件布置中,以及在各种过程操作和过程操作布置中形成。
36.本公开还涉及用于执行本文中的操作的装置。该装置可以为所需目的专门构造,或者它可以包括由计算机中存储的计算机程序选择性地激活或重新配置的通用计算机。这样的计算机程序可以被存储在计算机可读存储介质中,诸如但不限于任何类型的磁盘,包括软盘、光盘、cd-rom、磁光盘、只读存储器(rom)、随机存取存储器(ram)、eprom、eeprom、磁卡或光卡、专用集成电路(asic)或适合存储电子指令的任何类型的介质,并且每个可以耦合到计算机系统总线。此外,本说明书中提及的计算机可以包括单个处理器或者可以是采用多个处理器设计以增加运算能力的架构。
37.本文中呈现的过程和显示与任何特定的计算机或其他装置没有内在的关联。各种通用系统也可以与根据本文的教导的程序一起使用,或者可以证明构造更专业的装置来执行一个或多个方法步骤是方便的。各种这些系统的结构将在以下的描述中讨论。附加地,可以使用足以实现本公开的技术和实现方式的任何特定编程语言。可以使用多种编程语言来实现如本文所讨论的本公开。
38.附加地,本说明书中使用的语言主要是为了可读性和指导目的而选择,可能不是为了描述或限制所公开的主题而选择。因此,本公开旨在例示而非限制本文讨论的概念的范围。在阅读以下详细描述之后,对于本领域普通技术人员来说,许多附加优点和益处将变得显而易见。
39.图1图示了根据一个实施例的用于确定肿瘤异质性的系统100。
40.系统100可以包括用户输入/输出(i/o)设备102和执行在存储器106上存储的指令的处理器104。处理器104可以与用于从图像数据源112和114接收成像数据的接口110通信或以其他方式包括接口110。例如,图像数据源112可以包括诸如pet扫描仪的放射成像系统,而图像数据源114可以包括诸如数字显微镜的显微成像系统。
41.i/o设备102可以是可以从操作员接收命令并输出放射和成像数据以及其中相关联得分的任何合适的设备。i/o设备102可以被配置为例如但不限于个人计算机、平板计算机、膝上型计算机、移动设备等。
42.处理器104可以是任何具体配置的处理器或硬件设备,其能够执行在存储器106上存储的指令来处理放射学和可选地显微成像数据,以从中确定定量值。处理器104可以包括微处理器、现场可编程门阵列(fpga)、专用集成电路(asic)或其他类似设备。在一些实施例(诸如依赖于一个或多个asic的实施例)中,被描述为部分地经由软件提供的功能可以替代地硬连线到asic的操作中,并且因此,可以省略任何相关联的软件。
43.存储器106可以是l1、l2、l3高速缓存或ram存储器配置。如上所述,存储器106可以包括诸如闪存、eprom、eeprom、rom和prom的非易失性存储器,或者诸如静态或动态ram的易失性存储器。存储器106的确切配置/类型当然可以改变,只要用于分析放射学和可选地显微成像数据的指令可以由处理器104执行。
44.接口110可以从数据源112接收放射成像数据并且可选地从数据源114接收显微成像数据。接口110然后可以将所接收的数据通信到处理器104用于分析。放射学和显微成像数据通常是对象内感兴趣组织的数字图像的形式。放射图像通常示出肿瘤内不同位置处的肿瘤活性。放射图像可以例如通过pet分析来获得并且标准数据处理技术可以被用于将原始数据转换为指示肿瘤活性的图像。附加地,可以采用校正来考虑例如造影剂浓度和示踪剂衰减。显微成像数据可以例如显示肿瘤内其他感兴趣蛋白质的肿瘤标志物的表达。
45.处理器104被配置为计算放射图像中多个位置中的每个位置处的指示肿瘤活性的值并且确定每个计算的值是否高于预定阈值。通常,预定阈值根据肿瘤活性与感兴趣的生物学参数的相关性来导出。例如,预定阈值(用于肿瘤活性)可以对应于指示诊断或治疗决策的生物学参数的特定临床阈值。处理器104然后基于具有高于预定阈值的肿瘤活性值的肿瘤体积分数来计算肿瘤的异质性得分。
46.在一些实施例中,处理器104可以进一步被配置为计算从肿瘤获得的活检样本的代表性得分。代表性得分可以对应于从肿瘤获得的活检样本具有高于预定阈值的肿瘤活性值(例如,均值或平均值)的概率。由于肿瘤活性可能与感兴趣的生物学参数相关,因此代表性得分也可以对应于从肿瘤获得的活检样本具有高于临床相关阈值的生物学参数的值的概率。处理器可以被配置为基于异质性得分和活检样本的体积来计算该概率。
47.在一些实施例中,处理器104可以分析显微图像来确定与肿瘤相关联的生物学参数,例如,组织中感兴趣蛋白质的表达水平。处理器然后可以基于异质性得分、预定阈值和/或概率来确定生物学参数的值代表肿瘤的似然值或概率。在备选实施例中,显微图像的分析可以例如由病理学家或其他临床医生手动执行。临床医生还可以手动确定生物学参数的值代表肿瘤的概率。
48.在分析所接收的数据之后,处理器104可以向i/o设备102或另一显示单元输出例
如异质性得分、代表性得分和/或概率。在一些实施例中,输出可以包括诊断和/或治疗建议,例如应采集和分析进一步的活检样本的指示。
49.图2描绘了根据一个实施例的用于使用图1的系统来确定肿瘤异质性的方法200的流程图。步骤202涉及分析肿瘤的放射图像来计算肿瘤中多个位置中的每个位置处的指示肿瘤活性的值。如本文所用的“图像”应被广义地解释为不仅包括图像信号的整个阵列,而且在极端情况下,包括用于单个体素位置的单个图像信号或者用于整个视场中的体素位置子集的此类图像信号的选择。
50.指示肿瘤活性的值可以是例如标准摄取值(suv)。例如,suv可以通过使用(18-f)氟脱氧葡萄糖(fdg)的pet成像来获得。在一些实施例中,suv可以被计算为在组织中的多个位置中的每个位置处的限定体积上的平均值或均值。在这样的实施例中,样本中每个限定的组织体积由指示代谢活性的单个值表示。在备选实施例中,可以分析放射图像来计算组织中每个单个体素位置处的suv值。在这些实施例中,组织中不同位置处的suv值可以通过示出值(例如suv)在整个组织中的分布的图像在视觉上表示。
51.放射图像可以通过接口110从放射成像系统112接收。诸如图1的处理器104的处理器可以从图1的接口110接收这些图像。在备选实施例中,放射图像可以由i/o设备102传输到接口110和/或处理器104,例如,在成像系统获取图像后,图像被存储在另一位置中。
52.步骤204涉及确定每个计算值(例如每个位置处的suv)是否高于预定阈值。
53.步骤206涉及计算肿瘤的异质性得分。异质性得分通常对应于具有高于预定阈值的肿瘤活性值的肿瘤体积分数。异质性得分因此可以例如通过将确定为高于阈值的(suv)计算值的数量除以计算值的总数来获得。在针对每个体素计算suv的情况下,这对应于高于阈值的体素数量除以所描绘的病变体积内的体素总数。
54.在一些实施例中,附加步骤208可以包括计算待从肿瘤中取出的活检样本的代表性得分。代表性得分可以对应于活检样本具有高于预定阈值的肿瘤活性值(例如均值)的概率和/或活检样本具有高于临床相关阈值的生物学参数的值的概率。该概率可以基于异质性得分和活检样本的已知体积来计算。例如,如果与整个肿瘤相比,活检样本的体积相对较小,则代表性得分将类似于异质性得分。随着活检样本体积的增加,代表性得分降低,因为包括低于阈值的体积元素的风险增加,这将使得肿瘤活性的平均值降低到阈值以下。
55.方法还可以可选地包括步骤210,其中分析活检样本的显微图像来确定与肿瘤相关联的生物学参数的值。例如,处理器104可以使用适合于分析数字显微图像的算法来标识染色对象和/或组织内的整体染色水平,例如,通过活检样本的免疫组织化学处理来标识已在图像中染色的蛋白质的表达水平。在一个实施例中,处理器分析图像来确定组织中肿瘤细胞上pd-l1表达水平。该分析的输出可以是连续变量(例如,pd-l1阳性肿瘤细胞的百分比)或二元结果(例如,基于表达高于或低于所限定的临界水平,pd-l1的阳性/阴性得分)。
56.方法还可以可选地包括步骤212,其中处理器确定生物学参数的值代表肿瘤的似然值或概率。该似然值可以例如由代表性得分来确定,因为从具有高于阈值的肿瘤活性的肿瘤区域获得活检样本的概率与生物学参数的值代表整个肿瘤的似然值直接相关。备选地,似然值可以从异质性得分来确定,因为这与活检样本体积相关的代表性得分相关联。
57.方法的输出可以是例如异质性得分、代表性得分和/或生物学参数的值代表肿瘤的似然值的指示。这些结果中的一个或多个可以经由i/o设备102或显示器输出。
58.在一个实施例中,一个或多个放射学衍生特征可以与一个或多个病理学衍生特征进行比较来检查一致性。例如,生物学参数的值(从显微图像的分析中获得)可以与异质性得分(从放射图像的分析中获得)进行比较。如果发现肿瘤的显著体积部分具有高于阈值的肿瘤活性(如异质性得分所示),则可能预期获得高于临床相关阈值的生物学参数的值(例如pd-l1表达)。如果不是这种情况,则可以将其标记为意外(或不一致)结果并向临床医生指示。
59.本方法整体针对确定肿瘤异质性并且涉及计算肿瘤的异质性得分。例如就一个或多个肿瘤标志物的功能活性和/或表达而言,“异质性得分”是指得分与肿瘤特性的空间变异性相关。在本发明的实施例中,异质性得分由具有高于预定阈值的指示肿瘤活性的值的肿瘤的体积分数表示。因此,得分的高值可以指示异质性相对较低(即,肿瘤活性在整个肿瘤体积中相对较高且均匀)。相反,得分的低值可以指示异质性相对较高(即,与其他高活性区域相比,肿瘤体积的显著部分示出相对低的活性)。因此,异质性得分可能例如与肿瘤活性的变异性成反比。在一些实施例中,异质性得分因此可以备选地被称为例如肿瘤活性得分、肿瘤活性一致性得分或者高于阈值的体积分数肿瘤活性得分。
60.放射图像(例如,图2中所示的步骤202中所分析的)可以通过任何合适的放射成像方法,例如,通过正电子发射断层扫描(pet)、计算机断层扫描(ct)、磁共振成像(mri)和/或单光子发射计算机断层扫描(spect)来获得。通常,图像是pet图像。
61.组织中指示肿瘤活性的值(例如通过pet成像确定)例如可以是衡量肿瘤代谢活性的指标。如本文所使用的“代谢活性”包括人体或动物体的细胞化学转化(或加工)某些化合物(“代谢物”)。一个重要但非限制性的示例是用于获得能量的葡萄糖转化。
62.tca循环是允许哺乳动物细胞利用葡萄糖、氨基酸和脂肪酸的关键代谢途径。对这些燃料进入循环进行仔细调节,以有效满足细胞的生物能量学、生物合成和氧化还原平衡要求。与正常细胞相比,癌细胞表现出独特的病理生理学,包括:(a)细胞生长的自主机制,(b)与生长抑制相关因素的分歧,(c)逃避失巢凋亡、免疫监视和细胞凋亡,(d)生长的进化调控,(e)侵袭性和转移性定植。
63.为了进行复制分裂,细胞必须复制其基因组、蛋白质和脂质,并将这些元素组装成子细胞。癌症中细胞分裂率的增加需要重新设计代谢途径,从而导致肿瘤细胞代谢。葡萄糖代谢的重编程是肿瘤发生的关键事件。肿瘤细胞经历从氧化磷酸化(oxphos)到糖酵解的代谢转变,其中葡萄糖分子被降解为两个丙酮酸分子。根据细胞的氧气供应情况,丙酮酸或者在没有氧气的情况下经由厌氧糖酵解途径被还原成乳酸,或者在氧气存在的情况下被氧化产生乙酰辅酶a,然后经由柠檬酸循环完全氧化成co2和h2o。大多数肿瘤细胞的生长和存活都依赖于高速率的糖酵解,即使有足够的氧气也是如此。这种有氧糖酵解被称为warburg效应。
64.为了支持这种持续的细胞增殖,增加了肿瘤细胞的生物合成能力,包括脂肪酸和核苷酸的合成。相反,脂肪酸的β-氧化被抑制并且无效循环被最小化。这些变化增加了转化细胞的代谢自主性,使它们能够获得增强的合成代谢表型。因此,组织中的代谢活性可以用作肿瘤活性的标志物。
65.使用示踪剂氟-18(18-f)氟脱氧葡萄糖(fdg)进行pet扫描(被称为fdg-pet)被广泛用于临床肿瘤学。这种示踪剂是葡萄糖类似物,它被使用葡萄糖的细胞吸收并被己糖激
酶磷酸化(其线粒体形式在快速生长的恶性肿瘤中大大升高)。肿瘤扫描中使用的典型
18
f-fdg活性在200-450mbq范围内。因为被f-18取代以生成fdg的氧原子是所有细胞中葡萄糖代谢的下一步所必需的,因此fdg中不会发生进一步的响应。此外,大多数组织(肝脏和肾脏除外)不能去除己糖激酶添加的磷酸盐。这意味着fdg被困在吸收它的任何细胞中,直到它衰变,因为磷酸化糖由于它们的电荷而不能从细胞中排出。这导致对葡萄糖摄取量高的组织(诸如大脑、心肌、肝脏和大多数癌症)进行强烈的放射性标记。因此,fdg-pet可以被用于癌症(特别是霍奇金淋巴瘤、非霍奇金淋巴瘤、乳腺癌、黑色素瘤和肺癌)的诊断、分期、治疗计划和监测治疗。pet图像的分析已得到很好的建立,并且信号强度(如标准摄取值(suv、suvmax)所示)被用于分期和预后。
66.因此,在一个实施例中,指示肿瘤活性的值是suv,例如,放射图像通过使用18f-fdg的pet成像而获得。从pet图像导出的可用于指示肿瘤活性的其他合适度量包括例如suvmax、suvmean、代谢肿瘤体积(mtv)、总病变糖酵解(tlg)或其他高阶所谓的放射组学特征。参见例如paul e kinahan et al in“pet/ct standardized uptake values(suvs)in clinical practice and assessing response to therapy”,semin ultrasound ct mr,december 2010december,vol 31(6),pp496
–
505。
67.在其他实施例中,另外的生物学参数可以被用来指示肿瘤活性,作为指示代谢活性的参数的备选方案。通常,各种功能和/或解剖参数可以使用放射成像方法来评估,以确定肿瘤活性。例如,特定pet示踪剂可以被用于确定肿瘤增殖和/或缺氧作为肿瘤活性的标志物。在一个实施例中,指示组织中肿瘤细胞增殖的值可以从使用18f-flt pet成像获得的图像中确定。在另一实施例中,指示肿瘤细胞缺氧的值可以从使用适当示踪剂(例如,使用18f-fmiso pet成像)获得的图像来计算。
68.在进一步的实施例中,指示肿瘤活性的标志物可以是例如使用放射成像在肿瘤中确定的pd-l1表达。例如,组织中的pd-l1表达可以根据使用抗pd-l1抗体pet示踪剂(例如,89zr-atezolizumab、18f-bms-986192)获得的pet图像来确定。在一些这样的实施例中,异质性得分可以附加地与在来自肿瘤的活检样品中测量的生物学参数(诸如pd-l1)的表达的病理学得分相比。换言之,pd-l1表达的放射学(例如,pet)得分与pd-l1表达的病理学得分进行比较。两个值之间的显著差异指示病理衍生值可能不正确/不具代表性,应进行进一步活检并进行分析。
69.在一个实施例中,指示肿瘤活性的值可以通过分析由pet(例如提供代谢活性)和对比增强灌注ct(例如,提供关于肿瘤中的血管生成和血流特征的信息)获得的图像组合来计算。在具体实施例中,ct灌注数据(例如,血流(bf)、血容量(bv)和平均通过时间(mtt))通过时间对比度增强曲线的分析来获得。在一个实施例中,组织的灌注状态也可以从mr图像导出。
70.本文所述的方法在一些实施例中(例如,在图2中所示的步骤210中)涉及分析组织的显微图像的步骤。显微图像通常是例如通过数码显微镜获得的数字光学显微图像。显微图像通常示出作为放射图像对象的同一组织的一部分,例如,显微图像是从活检或已使用例如pet取自受试者的肿瘤的切除组织样本中获得的组织标本。
71.组织标本(例如,通过活检或从受试者切除获得)可以使用用于光学显微分析和成像的已知技术来制备。例如,石蜡包埋切片的苏木精和伊红(h&e)染色是在载玻片上可视化
组织以进行病理学分析的默认技术。免疫组织化学(ihc)染色是用于标识病理组织切片中细胞上蛋白质的过度表达的众所周知的方法。染色导致组织呈现典型的棕色外观,其中与正常相比,靶蛋白过度表达。例如,通过使用针对程序性死亡配体1(pd-l1)的抗体,可以检测到其过表达。结果通常被表示为所谓的比例得分,即,被指定为阳性(高于阈值)的肿瘤细胞的百分比。
72.3d图像可以从活检或切除组织材料中获得,具有或没有染色,以在用石蜡处理和显微切片成用于病理图像采集的薄显微镜切片之前提供活检形态的中间3d表示。这可以例如在利用折射率匹配物质清除组织后通过光学相干断层扫描、x射线和/或多焦点显微镜来完成。
73.病理学切片中特征的检测可以使用可以分析切片的数字图像的已知计算机算法来执行。例如,卷积神经网络可以通过提供病理学图像的注释数据集来训练,在注释数据集中,感兴趣的对象已由病理学家手动注释。这样的对象可以是例如细胞核。也可以成功地训练将细胞核分类为例如肿瘤细胞或免疫细胞。因此,在特定实施例中,深度学习计算机算法可以被训练和/或用于检测组织数字图像上的细胞核,甚至区分肿瘤和非肿瘤组织。
74.基于计算机的检测算法也可以与ihc结合使用,以自动检测感兴趣的细胞(例如过度表达特定蛋白质)。例如,可以确定在ihc图像中被分类为对pd-l1过度表达呈阳性的细胞的存在和丰度。使用基于计算机的检测使得能够真正量化感兴趣区域(例如肿瘤病变)中对象的数量和密度。
75.在一个优选的实施例中,在活检样本中检测的生物学参数是pd-l1表达。pd-l1是细胞膜蛋白,是所谓的检查点分子之一,对肿瘤和免疫细胞之间的通信很重要。它也可以被认为是肿瘤细胞代谢活性增加的标志。肿瘤细胞上的pd-l1表达可以是组成型(突变驱动)或诱导型(经由免疫攻击)。pd-l1表达通常利用组织切片上的免疫组织化学染色测定来确定。存在几种商业化验可供使用(参见例如f.r.hirsch et al.,j.thorac.onc.,12,208)。肿瘤和某些情况下免疫细胞上的pd-l1过度表达被用作诊断测试来指导疗法选择。例如,pd-l1阳性肿瘤细胞得分超过50%的晚期肺癌患者有资格接受检查点抑制单药治疗,而得分较低的患者将有资格接受检查点抑制和化疗的联合治疗。已知pd-l1的表达在患者的病变内和病变之间可能是异质的。图3示出了肿瘤活检组织切片的pd-l1染色示例,指示pd-l1表达差异很大的区域。
76.在一个实施例中,本文描述的是基于放射学图像,特别是fdg-pet/ct的分析,获得肿瘤的活检的代表性得分的方法。方法可以包括以下步骤:
77.1.获取肿瘤病变的(fdg-)pet/ct图像;
78.2.分析pet图像:
79.a.限定感兴趣区域(选择病变的轮廓线);
80.b.确定与感兴趣区域的代谢活性(例如suv)有关的参数;
81.c.计算等参数体积的轮廓线图;
82.d.计算参数高于阈值的病变体积百分比;
83.3.计算反映获得活检的概率的得分,活检将代表高于阈值的病变部分;
84.4.将得分报告给放射科医师和/或病理学家和/或治疗医师;
85.5.可选地指示得分是否低于预定义值。
86.在一个实施例中,体积百分比(步骤2.d)可以基于具有高于阈值的值的最小连接体积来计算。体积可以相对于芯活检样本的体积来限定。阈值可以与体积平均值或特定体积元素中的最大值相关。
87.在另一实施例中,在步骤(2.d)中不使用阈值,而是计算参数得分等于或高于总病变的体积平均值的活检体积被移除的概率(步骤3)。
88.在另一实施例中,从局部pet suv值导出的局部活性参数可以通过从将反映组织密度的相同位置的ct图像获得的局部参数来校正。该校正可以通过例如将suv值除以密度参数来执行。在另一实施例中,反映组织密度的局部参数可以通过适当的mr序列来确定。
89.如果活检位置已知并且可以配准到放射图像,则活检具有代表性的概率可以通过计算具有与局部活检体积元素的平均值相同或更高的值的体积分数来以更高的精度计算。如果活检位置可以完美地配准到放射影像,假设生物学参数和肿瘤活性示出已知的相关性,则从活检获得的生物学参数的值应对应于该位置处的肿瘤活性值。通常,活检体积与放射学(例如pet)图像的分辨率具有相同的数量级。因此,如果异质性得分指示肿瘤的高体积分数超过了肿瘤活性的预定阈值,则预期取自肿瘤内大多数位置的活检样本示出生物学参数的值高于其对应的临床相关阈值。然而,如果从活检获得的生物学参数的值为负(即,低于临床相关阈值),尽管肿瘤的高体积分数高于通过放射学获得的预定肿瘤活性阈值,则这种不一致指示生物学参数可能无法代表肿瘤。
90.轮廓线图以及活检具有代表性的概率可以例如在显示器上提供给放射科医师或核医学医师。同样的信息也可以报告给病理学家,以在进行病理学得分时考虑,也可以报告给治疗医师。例如,从概率导出的风险得分可以向放射科医师和/或病理学家和/或治疗医师显示。
91.在优选实施例中,轮廓线图可以被用于将活检引导到具有大于阈值的参数值的最大连接体积的位置。
92.在另一实施例中,参数的局部异质性可以针对病变来计算,并且可选地显示在增强的放射学图像中。局部异质性可以与组织病理学参数相关联。这可以针对具有多个病变的患者的所有病变来执行。以这种方式,可以定义病变间异质性参数。
93.阈值(2.d)可以例如根据队列研究来预先确定,并且被可选地调整到特定患者图像采集条件。
94.在一个实施例中,fdg-pet和suv被用于与病理学中的pd-l1表达相关。一个这样的非限制性实施例的步骤如下所述。
95.fdg-pet/ct图像根据众所周知的临床程序和仪器来获取。在图像采集和标准图像校正和后处理之后的第一步骤中,病变体积被定义为3d图像中的轮廓线。suv针对病变图像中的每个体素来计算。针对预定(合并)suv值,相等suv值的体积元素由图像中的iso-suv轮廓线确定和指示。示出相等suv值的体积元素的轮廓线图在例如图4中示出。可以将限制应用于指示此类创建的子体积(最小岛尺寸、粒度)的体积元素的最小尺寸。附加地,可以生成suv分布的直方图,并例如如图5所示从中计算异质性得分。
96.与病理学参数(例如肿瘤细胞上的pd-l1表达)的相关性相关的suv预定阈值可以在直方图中选择和指示,并且可选地,suv等于或高于阈值的所有体积元素可以在图像中突出显示。具有高于阈值的suv值的总病变的体积分数可以被表示为得分。该得分与通过活检
程序提取其特征在于suv值高于阈值的样本的无偏概率有关。
97.高于阈值的病变体积分数以及高于阈值的体积元素位置被报告。
98.该信息可以被用于指示临床医生将活检针引导至具有最高suv值且连接体积显著大于待移除的活检体积的区域(如果该区域可达)。如果否,可以选择引导活检的最佳备选区域。同时,计算活检样本中预期高于阈值的体积分数。
99.在不知情的活检情况下,与高于阈值的体积分数(即,异质性得分)有关的信息被报告给病理学家。病理学家(可选地使用自动图像分析系统)可能已将肿瘤细胞上pd-l1表达的得分确定为阳性肿瘤细胞的百分比(肿瘤比例得分或tps)。如果该得分为负或低于50%,则会对为患者选择的护理路径产生影响。如果tps低于阈值并且pet图像中高于suv阈值的体积分数相对较高(例如,高于20%,tps和suv之间的不一致指示存在非代表性结果的风险),则tps得分可以被标记为潜在的假阴性(或低于50%阈值为假)。重新活检可以基于这样的结果来建议。如果这是不可接受的,假阴性pd-l1得分的风险可以被报告给临床医生并在选择疗法时将其考虑在内。
100.本方法使用从放射图像获得的肿瘤活性值的预定阈值来确定异质性得分。由于肿瘤活性参数(例如基于suv)与生物学参数(例如pd-l1得分)相关,因此生物学参数的临床相关阈值可以被用于计算肿瘤活性的预定阈值。只要生物学参数的临床相关阈值和肿瘤活性的预定阈值之间的关系已知(例如,不管相关性是线性的还是非线性的),就可以例如通过可以从一次性实验相关曲线获得的简单相关方程,将例如1%和50%tps的阈值转换为对应suv阈值。例如通过fdg-pet和pd-l1表达获得的suv之间的关系已知(参见例如zhou et al.(2018),eur j nucl med mol imaging 45(suppl 1):s441,ep-0367)。
101.在优选实施例中,相关性函数被用于将用于异质性确定的预定阈值与生物学参数的临床相关阈值相关联。换言之,相关性函数允许基于提供诊断或临床指示的生物学参数的已知截止值(例如,指示适合检查点抑制剂疗法的tps),选择肿瘤活性值(例如,suv)的合适预定阈值。
102.相关性函数将来自病理学的局部生物学参数与计算的局部放射学信号相关。在一个示例中,生物学参数是组织区域中pd-l1阳性肿瘤细胞的百分比,并且肿瘤活性被确定为来自fdg-pet图像的局部suv。对于临床问题,特定pd-l1阳性肿瘤细胞百分比(所谓的肿瘤比例得分tps)是相关的。根据相关性函数,对应的suv值可以在选择临床截止值时导出。
103.对于晚期肺癌患者使用具有50%tps截止值的pembrolizumab检查点免疫治疗。因此50%tps对应的suv值被选择作为计算肿瘤异质性的阈值。对于pembrolizumab与化疗的联合治疗,使用1%tps的截止值。在这种情况下,为suv选择不同的阈值来计算肿瘤异质性。因此,所报告的肿瘤异质性和具有不相关活检结果的对应风险取决于所涉及的生物学参数的临床阈值。对于同一患者,1%tps和50%tps的异质性得分不同。一般而言,tps阈值越高,对应的suv预定阈值越高,因此suv值等于或高于预定阈值的肿瘤病变体积分数越小。使用两个不同阈值确定的异质性得分将相应变化。
104.以上讨论的方法、系统和设备是示例。各种配置可以适当地省略、替换或添加各种程序或组件。例如,在备选配置中,可以以不同于所描述的顺序来执行方法,并且可以添加、省略或组合各种步骤。此外,关于某些配置所描述的特征可以被组合在各种其他配置中。配置的不同方面和元素可以以类似方式组合。此外,技术不断发展,因此,许多元素是示例,并
不限制本公开或权利要求的范围。
105.例如,以上参考根据本公开实施例的方法、系统和计算机程序产品的框图和/或操作说明描述了本公开的实施例。框中注明的功能/动作可以以不同顺序出现在任何流程图中。例如,根据所涉及的功能/动作,连续示出的两个框实际上可以基本上同时执行,或者这些框有时可以以相反的顺序执行。附加地或备选地,并非任何流程图中所示的所有框都需要被执行和/或施行。例如,如果给定流程图具有包含功能/动作的五个框,则可能是五个框中只有三个被执行和/或施行的情况。在该示例中,可以执行和/或施行五个框中的三个框中的任一个。
106.描述中给出了具体细节,以提供对示例配置(包括实现方式)的透彻理解。然而,配置可以在没有这些具体细节的情况下实现。例如,众所周知的电路、过程、算法、结构和技术已在没有不必要的细节的情况下示出,以避免混淆配置。该描述仅提供示例配置,并且不限制权利要求的范围、适用性或配置。相反,配置的前述描述将为本领域技术人员提供用于实现所描述的技术的使能描述。在不脱离本公开的精神或范围的情况下,可以对元素的功能和布置进行各种改变。
107.已描述了若干示例配置,在不脱离本公开的精神的情况下,可以使用各种修改、备选构造和等价物。例如,上述元素可以是更大系统的组件,其中其他规则可以优先于或以其他方式修改本公开的各种实现方式或技术的应用。此外,可以在考虑上述元素之前、期间或之后进行多个步骤。
108.已提供了本技术的描述和图示,本领域技术人员可以设想不脱离所附权利要求的范围的、落入本技术中讨论的总体发明构思的变化、修改和备选实施例。
109.一些布置的特征在以下编号的段落中阐述:
110.1.一种用于确定肿瘤异质性的计算机实现的方法(200),方法包括:
111.分析(202)肿瘤的放射图像来计算肿瘤中多个位置中的每个位置处的指示肿瘤活性的值;
112.确定(204)每个计算值是否高于预定阈值;以及
113.计算(206)肿瘤的异质性得分;其中异质性得分基于具有高于预定阈值的指示肿瘤活性的值的肿瘤的体积分数来计算。
114.2.根据段落1所述的方法,还包括:计算(208)从肿瘤获得的活检样本具有高于预定阈值的肿瘤活性值的概率,其中概率基于异质性得分和活检样本体积来计算。
115.3.根据前述段落中任一项所述的方法,其中肿瘤活性的预定阈值与和肿瘤相关联的生物学参数的临床相关阈值有关。
116.4.根据段落3所述的方法,其中生物学参数包括程序性死亡配体1(pd-l1)在肿瘤细胞上的表达水平。
117.5.根据段落3或段落4所述的方法,其中生物学参数的临床相关阈值是指示适合检查点抑制疗法的pd-l1表达(tps)阳性的肿瘤细胞百分比。
118.6.根据前述段落中任一项所述的方法,还包括将异质性得分与根据从肿瘤获得的活检样本确定的生物学参数的值进行比较;其中异质性得分和生物学参数的值之间的不一致指示生物学参数的值不能代表肿瘤。
119.7.根据段落6所述的方法,其中如果异质性得分指示肿瘤的显著体积分数具有高
于预定阈值的指示肿瘤活性的值,并且生物学参数的值低于临床相关阈值,则方法进一步包括将生物学参数的值指示为潜在的假阴性结果。
120.8.根据前述段落中任一项所述的方法,其中放射图像通过正电子发射断层扫描(pet)、磁共振成像(mri)、计算机断层扫描(ct)和/或单光子发射计算机断层扫描(spect)或其任何组合来获得。
121.9.根据段落8所述的方法,其中组织中指示肿瘤活性的值是从pet成像获得的标准摄取值(suv)。
122.10.根据段落9所述的方法,其中指示肿瘤活性的值通过使用(18-f)氟脱氧葡萄糖(fdg)的pet成像来获得。
123.11.根据前述段落中任一项所述的方法,还包括计算轮廓线图,轮廓线图示出具有相等的肿瘤活性值的肿瘤区域,其中轮廓线图中的轮廓线对应于预定的肿瘤活性阈值。
124.12.根据前述段落中任一项所述的方法,还包括向用户指示要从中提取活检样本的、肿瘤活性高于预定阈值的肿瘤区域。
125.13.根据前述段落中任一项所述的方法,其中肿瘤的体积分数基于具有高于预定阈值的值的最小连接体积来确定。
126.14.根据前述段落中任一项所述的方法,其中指示肿瘤活性的值指示代谢活性、缺氧、信号通路的肿瘤活化和/或肿瘤中的增殖。
127.15.一种用于确定肿瘤异质性的系统(100),系统包括:
128.用于接收肿瘤放射图像的接口(110);
129.存储器(106);以及
130.处理器(104),被配置为执行存储器上存储的指令,以:
131.分析肿瘤的放射图像来计算肿瘤中多个位置中的每个位置处的指示肿瘤活性的值;
132.确定每个计算值是否高于预定阈值;以及
133.计算肿瘤的异质性得分;其中异质性得分基于具有高于预定阈值的指示肿瘤活性的值的肿瘤的体积分数来计算。
134.16.一种包括非暂态计算机可读介质的计算机程序产品,计算机可读介质具有在其中体现的计算机可读代码,计算机可读代码被配置为使得在由合适的计算机或处理器执行时,使计算机或处理器执行根据段落1至14中任一项所述的方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1