醋酸西曲瑞克的稳定的肠胃外剂型的制作方法
1.本发明涉及一种稳定的肠胃外剂型,其具有醋酸西曲瑞克的即时注射型的(ready-to-inject)、无菌的、稳定的水溶液。本发明还涉及预填充有醋酸西曲瑞克的即时注射型的、无菌的、稳定的水溶液的注射装置。本发明涉及一种抑制经历受控卵巢刺激的妇女中的过早黄体化激素激增的方法,包含稳定的肠胃外剂型,所述稳定的肠胃外剂型具有醋酸西曲瑞克的即时注射型的、无菌的、稳定的水溶液。
背景技术:
2.西曲瑞克是具有下式的促性腺激素释放激素拮抗剂(gnrh拮抗剂)乙酰-d-3-(2
′‑
萘基)-丙氨酸-d-4-氯苯丙氨酸-d-3-(3
′‑
吡啶基)-丙氨酸-l-丝氨酸-l-酪氨酸-d-瓜氨酸-l-亮氨酸-l-精氨酸-l-脯氨酸-d-丙氨酸-酰胺(c70h92cln17o14)。它是一种具有末端酸酰胺基团的十肽。它通过阻断gnrh对垂体的作用来起作用,因此快速抑制黄体化激素和促泡激素的产生和作用。
[0003][0004]
对于肠胃外施用需要肽的水溶液。然而,肽如西曲瑞克的水溶液易受化学降解的影响。它们还易于聚集,由此在储存时溶液的浊度或混浊度增加。
[0005]
市场上的第一个产品是它在含有0.25mg或3mg的西曲瑞克的玻璃小瓶中可作为冻干粉末获得。分别提供具有1ml或3ml的无菌注射用水的预填充式玻璃注射器,并且仅在注射之前制备溶液。因此,第一个产品简单地通过避免制备含有需要随时间推移存储的水溶液的剂型解决了水溶液中的降解问题。相反,去除水并且制备冷冻干产物以避免不稳定性问题。然而,这种问题的解决方案具有明显的缺点-(1)昂贵且耗时的过程;(2)产品不是即时注射型的,并且需要在施用前重构;以及(3)重构的溶液仅在短的时间段内是稳定的。因此,并不满足对即时注射型的水溶液的需求。
[0006]
us 7,718,599公开了西曲瑞克的水溶液易于聚集。在偏振光显微镜下,观察到液体结晶结构。向醋酸西曲瑞克溶液(2.5mg/ml)中添加葡萄糖酸,由此在小于0.07%的葡萄糖酸的浓度,导致ph为3.7时,在2天内观察到聚集。当ph大于3.7时,报告类似的失败。当葡萄糖酸的浓度增加至0.71%,导致ph为3.1时,在12天内观察到聚集,表明较高浓度的葡萄糖酸且因此较低的ph导致改善。该方法的缺点是聚集问题的解决程度取决于葡萄糖酸浓度,并且在更多的葡萄糖酸的情况下,ph降低。然而,us 7,718,599未报告ph对西曲瑞克的化学稳定性的影响。此外,不存在在长期储存稳定性研究期间未观察到聚集的制剂。
us2013/0303464公开了西曲瑞克的即用型水性制剂,其包含醋酸西曲瑞克、冰醋酸、张度调整剂和注射用水。通过其中ph为约3的工作实例示出了合适的ph。根据该发明的优选的ph为ph 2.8至3.5。
[0007]
us 7,214,662公开了包括醋酸西曲瑞克的肽的水溶液和针对聚集问题的建议的解决方案。它教导了羧酸(并且特别是羟基羧酸,优选地葡萄糖酸)与表面活性剂的组合减少了聚集。根据us7,214,662使用羧酸导致低ph,例如ph 2.5至3。
具体实施方式
[0008]
本发明的目的是提供一种肠胃外剂型,所述肠胃外剂型包含醋酸西曲瑞克的即时注射型的、无菌的稳定的水溶液。本发明的另一目的是提供一种预填充有醋酸西曲瑞克的无菌的稳定的水溶液的注射装置。如本文所施用的,术语“即时注射型”是指醋酸西曲瑞克的即时注射型的、无菌的、稳定的水溶液,其适合于直接皮下或肌内施用,即它为即时注射型,并且在注射之前不需要重构或稀释。更具体地,另一个目的是,在注射装置中分配的醋酸西曲瑞克的无菌的稳定的水溶液是即时注射型的,不仅在对聚集或浊度发展的控制方面在物理上是稳定的,而且还在化学上是稳定的,使得当肠胃外剂型储存在货架上并且直到它被皮下或肌肉内注射到患者体内时杂质保持低。
[0009]
肽的降解可以导致其他肽和/或肽衍生物的生成,所述肽和/或肽衍生物本身可能具有药理学活性。因此,更具体而言,目的是开发一种适当的方法来分离单独的杂质并对其进行定量。目的是限制此类杂质的浓度。本发明人发现了一种高效液相色谱(“hplc”)方法,该方法给出了以前在现有技术中没有报道的几种杂质的单独的峰。尽管现有技术主张低ph值降低聚集的趋势,但本发明人在使用其hplc方法时发现,在本发明的肠胃外剂型中,在一段时间内的杂质水平增加方面,3至5的ph对于化学稳定性是最佳的,并且醋酸西曲瑞克的水溶液可以在这种较高的ph下制备,而没有聚集问题。
[0010]
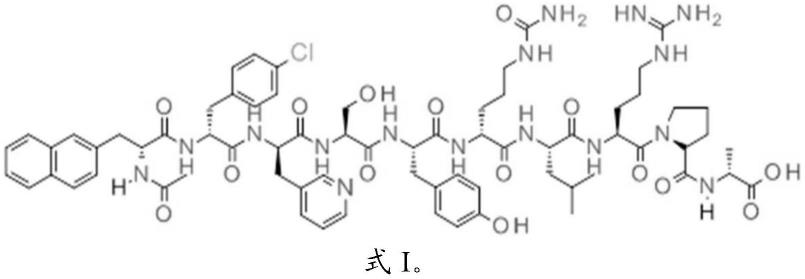
发明人发现的一种新型杂质是由以下给出的式i的化合物表示的杂质a:
[0011][0012]
杂质b的特征在于具有由以下给出的式ii的化合物表示的结构:
[0013][0014]
杂质d的特征在于具有由以下给出的式iii的化合物表示的结构:
[0015][0016]
杂质f的特征在于具有由以下给出的式iv的化合物表示的结构:
[0017][0018]
现有技术认为,3.0的低ph是稳定性的最佳ph;然而,本发明发现,在现有技术提倡的2.5至3.0的ph值下,当溶液在25℃/60%相对湿度下储存时,杂质a的水平显著增加。
[0019]
现有技术均未鉴定出式i、ii、iii和iv的化合物,即分别为杂质a、b、d和f。
[0020]
本发明发现,不仅可以在ph 3-5下制备醋酸西曲瑞克的稳定的水溶液而没有凝聚问题,而且杂质a和总杂质的水平还被很好地控制,并且在25℃/60%rh下将该肠胃外剂型储存至少1个月、至少2个月、至少3个月或至少6个月时仍保持低浓度。肠胃外剂型也可以以良好的稳定性存储在2℃至8℃下持续至少24个月。
[0021]
在一个方面中,本发明提供了一种包含稳定的水溶液的肠胃外剂型,其包含:
[0022]
(i)西曲瑞克或其药学上可接受的盐;和
[0023]
(ii)小于5%w/v的西曲瑞克碱的量的式i的杂质,
[0024][0025]
优选地,肠胃外剂型包含小于4%w/v的西曲瑞克碱的量的式i的杂质。更优选地,肠胃外剂型包含小于3%w/v的西曲瑞克碱的量的式i的杂质。更优选地,肠胃外剂型包含小于2%w/v的西曲瑞克碱的量的式i的杂质。更优选地,肠胃外剂型包含小于1%w/v的西曲瑞克碱的量的式i的杂质。
[0026]
肠胃外剂型进一步包含渗透剂和注射用水。
[0027]
在优选的方面中,本发明提供了一种包含稳定的水溶液的肠胃外剂型,其包含:
[0028]
(i)西曲瑞克或其药学上可接受的盐;和
[0029]
(ii)小于1%w/v的西曲瑞克碱的量的式i的杂质,
[0030][0031]
在另一个方面中,本发明提供了一种包含稳定的水溶液的肠胃外剂型,其包含:
[0032]
(i)西曲瑞克或其药学上可接受的盐;和
[0033]
(ii)小于1%w/v的西曲瑞克碱的量的式i的杂质,
[0034][0035]
在另一个方面中,本发明提供了一种肠胃外剂型,其包含即时注射型的、无菌的、稳定的水溶液,其包含:
[0036]
(i)西曲瑞克或其药学上可接受的盐,
[0037]
(ii)将ph调节在3至5的范围内的有机酸,
[0038]
(iii)小于1%w/v的西曲瑞克碱的量的杂质a,一种式i的十肽
[0039][0040]
(iv)渗透剂;以及
[0041]
(v)注射用水。
[0042]
在一个实施例中,本发明提供了一种肠胃外剂型,其包含即时注射型的、无菌的、稳定的水溶液,其由以下组成:
[0043]
(i)西曲瑞克或其药学上可接受的盐,
[0044]
(ii)将ph调节在3至5的范围内的有机酸,
[0045]
(iii)小于1%w/v的西曲瑞克碱的量的杂质a,一种式i的十肽
[0046][0047]
(iv)渗透剂,以及
[0048]
(v)注射用水。
[0049]
当在2℃至8℃下储存至少1个月、至少3个月、至少6个月、至少12个月、至少18个月或至少24个月;或在室温(25℃/60%rh)下储存至少1个月、至少3个月或至少6个月时,包含根据本发明的西曲瑞克的即时注射型的、无菌的、稳定的水溶液的肠胃外剂型在物理上和化学上保持稳定。
[0050]
稳定的肠胃外剂型的优选的实施例可以在2℃至8℃下用至少24个月或24个月的保质期来标记。肠胃外剂型的更优选的实施例可以在室温(25℃/60%rh)储存条件下用至少6个月或6个月的保质期来标记。
[0051]
式i的十肽(杂质a)的浓度保持在西曲瑞克碱的0.001重量%至1.0重量%,优选地0.05重量%至0.5重量%的范围内,单一的最大未知杂质保持小于西曲瑞克碱的0.5重量%,并且在2℃至8℃下储存至少1个月、至少2个月、至少3个月、至少6个月、至少12个月、至少18个月或至少24个月和/或在室温(25℃/60%rh)下储存至少1个月、至少2个月、至少3个月或至少6个月时,总杂质保持不超过西曲瑞克碱的3.5重量%。
[0052]
包含根据本发明的西曲瑞克的即时注射型的无菌的水溶液的肠胃外剂型在物理上是稳定的,在保质期期间水溶液没有聚集、凝胶形成或沉淀。聚集或凝胶形成可以通过测
量溶液的混浊度或浊度来确定。它以ftu单位(formazin浊度单位)或ntu单位(比浊法浊度单位(nephelometric turbidity unit))来测量。
[0053]
根据欧洲药典9.0中描述的方案进行测试。如果混浊度/浊度值小于或等于8ftu/ntu,则溶液被认为没有任何聚集或凝胶形成。ftu/ntu值越高,溶液中的混浊度或浊度越高,并且反之亦然。根据本发明的即时注射型的肠胃外剂型的ntu值在初始时和在2℃至8℃下长期储存该剂型至少1个月、至少2个月、至少3个月、至少6个月、至少12个月、至少18个月或至少24个月和/或在室温(25℃/60%rh)下储存至少6个月时保持小于2ntu,优选地小于1ntu,更优选地小于0.5ntu。因此,在保质期期间不存在水溶液的聚集、凝胶形成或沉淀。另外,在储存时,溶液的粘度没有显著增加。
[0054]
包含根据本发明的西曲瑞克的即时注射型的、无菌的、稳定的水溶液的肠胃外剂型包含浓度范围为0.26mg/ml至0.28mg/ml的醋酸西曲瑞克,该量相当于0.25mg/ml的西曲瑞克碱。优选地,醋酸西曲瑞克以相当于0.25mg/ml的西曲瑞克碱的浓度存在于即时注射型的、无菌的、稳定的水溶液中。
[0055]
在一个实施例中,包含根据本发明的西曲瑞克的即时注射型的、无菌的、稳定的水溶液的肠胃外剂型包含浓度足以将ph调节在3至6的范围内的ph调节剂。
[0056]
在优选的实施例中,包含根据本发明的西曲瑞克的即时注射型、无菌的、稳定的水溶液的肠胃外剂型包含作为ph调节剂的有机酸,其浓度足以将ph调节在3至5的范围内,更优选地在4至4.5的范围内。根据本发明的即时注射型的、无菌的、稳定的水溶液的ph可以为例如3、3.05、3.10、3.15、3.20、3.25、3.30、3.35、3.40、3.45、3.5、3.55、3.60、3.65、3.70、3.75、3.80、3.85、3.90、3.95、4.00、4.05、4.10、4.15、4.20、4.25、4.30、4.35、4.40、4.45、4.50、4.55、4.60、4.65、4.70、4.75、4.80、4.85、4.90、4.95、5.00、5.05、5.10、5.15、5.20、5.25、5.30、5.35、5.40、5.45、5.50、5.55和6或其中间范围。
[0057]
有机酸可以选自任何可溶于水的肠胃外可接受的有机酸,但优选地乙酸,更优选地乳酸。例如,乳酸可以以范围为约0.013mg/ml至0.53mg/ml,优选地以范围为约0.033mg/ml至约0.53mg/ml的量;及其中间范围的浓度用于根据本发明的即时注射型的无菌的水溶液中。
[0058]
优选地,根据本发明,西曲瑞克的即时注射型的无菌的、稳定的水溶液包含重量比范围为5 0.47∶1至19.23∶1,优选地重量比范围为约0.47∶1至7.57∶1,更优选地重量比范围为约1.56∶1至7.57∶1及其中间范围的西曲瑞克(碱)和有机酸。
[0059]
包含根据本发明的西曲瑞克的即时注射型的无菌的、稳定的水溶液的肠胃外剂型包含渗透剂或张力调节剂,其量适于将溶液的渗透压浓度调节在约250-375mosm/kg,优选地270-330mosm/kg的范围内。可以用于根据本发明的水溶液的渗透剂选自但不限于甘露醇、甘油、山梨醇、氯化钠、氯化钾、右旋糖、蔗糖等及其混合物。
[0060]
根据一个优选的实施例,渗透剂是甘露醇,并且它可以以范围为约40.0mg/ml至60.0mg/ml的量,优选地范围为约50.0mg/ml至58.0mg/ml的量用于水溶液中。在一个优选的实施例中,渗透剂是甘露醇,并且它以约55.0mg/ml的量用于即时注射型的无菌的水溶液中。
[0061]
本发明的肠胃外剂型的即时注射型的、无菌的水溶液不包含其衍生物、聚合物或共聚物形式的乳酸,例如聚乳酸或聚乳酸-共-乙醇酸。优选地,乳酸用作唯一ph调节剂。在
优选的实施例中,即时注射型的无菌的水溶液不含任何表面活性剂,例如吐温80、聚山梨醇酯、泊洛沙姆、司盘等。肠胃外剂型的即时注射型的无菌的水溶液避免使用表面活性剂、络合剂、防腐剂或抗氧化剂进行溶解或稳定。在某些实施例中,溶液不含络合剂如环糊精,不含共溶剂如醇或二醇,并且也不含防腐剂和抗氧化剂。
[0062]
在另一个方面中,本发明提供了如上所述的醋酸西曲瑞克的无菌的水溶液,其在25℃温度和60%相对湿度下保持稳定持续至少1个月,优选地至少3个月,并且更优选地至少6个月。
[0063]
在又一个方面中,本发明提供了如上所述的醋酸西曲瑞克的无菌的水溶液,其在2-8℃下保持稳定持续至少1个月,优选地至少3个月,更优选地至少6个月,甚至更优选地至少12个月或18个月,并且最优选地至少24个月。
[0064]
包含根据本发明的西曲瑞克的即时注射型的、无菌的、稳定的水溶液的稳定的肠胃外剂型适合于通过皮下途径或肌内途径施用。即时注射型、无菌的、稳定的水溶液适合于直接皮下施用,即它是即时注射型或即时自我施用型,并且在使用前不需要重构或稀释。根据本发明的即时注射型的、无菌的、稳定的水溶液不涉及冻干。
[0065]
本发明的稳定的肠胃外剂型适合于自我施用,并且使得患者能够皮下自我施用少量的水溶液。填充在注射装置的储器中的西曲瑞克的即时注射型的无菌的水溶液的体积在约0.5ml至10.0ml的范围内,优选地1.0ml至2.0ml,更优选地1.0ml。根据优选的实施例之一,西曲瑞克的即时注射型的、无菌的、稳定的水溶液以1.0ml的体积被填充在注射装置的储器中。优选地,根据本发明的肠胃外剂型适合于施用单剂量的醋酸西曲瑞克。在一个实施例中,肠胃外剂型包含适合作为单剂量自我施用的约1.0ml的填充体积的醋酸西曲瑞克的水溶液。在一些实施例中,肠胃外剂型可以包含约10.0ml的填充体积的西曲瑞克的水溶液,其适合于多剂量施用。
[0066]
根据本发明的稳定的肠胃外剂型的注射装置可以选自但不限于预填充式注射器、自动注射器等。在一个优选的实施例中,注射装置是预填充式注射器。在另一个优选的实施例中,注射装置是自动注射器,例如笔式自动注射器。这些预填充式注射器或自动注射器适合用于由需要其的患者自我施用或自动注射药物溶液,因此提供用户友好的方法。
[0067]
在一个优选的实施例中,注射装置是预填充式注射器。预填充式注射器包含以下部件:储存水溶液的储器,诸如例如桶或筒;附接在储器的一端的带柄针;覆盖针并密封针尖开口的针护罩或针尖帽,任选地,覆盖针护罩或针尖帽的刚性护罩;位于储器的另一端的柱塞塞子(plunger stopper),其塞住并密封填充在储器中的水溶液;柱塞杆,所述柱塞杆装配到柱塞塞子中并且用于在施用所述药物的同时将所述柱塞塞子连同所述溶液一起推向针端。
[0068]
在另一个优选的实施例中,注射装置是自动注射器。所述自动注射器可以具有变化的设计。在一个优选的设计中,自动注射器包含以下部件:适于保持预填充式注射器的中央组件或主体部分,所述注射器包含储存水溶液的储器,例如桶或筒,所述储器在一端具有带柄针,并且在另一端具有柱塞塞子中央主体部分可以具有透明检查窗,储器中的溶液通过所述透明检查窗可见。所述自动注射器进一步包含前部组件,所述前部组件具有容纳针护罩或针尖帽的帽部分,并且其可附接到覆盖所述带柄针并密封所述针尖开口的中央组件。所述自动注射器进一步包含后部组件,所述后部组件包含具有弹簧组件的塑料杆和启
动按钮。在水溶液的自我施用期间,首先,将帽连同针头护罩一起从主体部分上取下,露出针头,并且随后,在将自动注射器的主体部分放置在施用部位后,按压启动按钮,这将带有弹簧组件的塑料杆推向柱塞塞子,这导致水溶液通过针递送至患者。
[0069]
储器可以是桶或筒,诸如例如预填充式注射器的桶或自动注射器的筒。它可以由选自玻璃、塑料或聚合材料的材料构成。在一些优选的实施例中,储器由玻璃构成,例如usp i型硅化玻璃或非化脓性玻璃材料。在其他实施例中,储器由选自环烯烃聚合物、环烯烃共聚物、聚烯烃聚碳酸酯、基于苯乙烯-聚烯烃的聚合物和嵌段共聚物、聚碳酸酯等的非玻璃塑料或聚合物材料构成。在一个优选的实施例中,储器是预填充式注射器的非化脓性玻璃桶或自动注射器的非化脓性玻璃筒。
[0070]
在一个或多个实施例中,储器可以在一端处具有堆叠针。在一些其它实施例中,储器是无针的,并且在一端具有鲁尔尖端锁,该鲁尔尖端锁具有用于在使用之前将针附接在鲁尔尖端的装置。带柄针可以由不锈钢构成。针尖被针护罩或针尖帽屏蔽或覆盖。含有药物的无菌水溶液的储器在另一端处进一步用塞子例如柱塞塞子密封。这些塞子、针头护罩或针尖帽为外部环境提供了物理和无菌屏障。
[0071]
优选地,柱塞塞子、针头护罩/针尖帽或鲁尔锁的帽由非玻璃组分构成。非玻璃组分可以是橡胶或弹性体材料,诸如例如溴丁基橡胶、氯丁基橡胶、usp ii型橡胶、由聚-顺式-1,4-异戊二烯、苯乙烯丁二烯橡胶等构成的天然橡胶。其它合适的材料包括高密度聚乙烯或低密度聚乙烯或其它塑料材料。在优选的实施例中,柱塞塞子由溴丁基橡胶构成,并且针护罩或针尖帽由天然橡胶构成。针护罩可以进一步被由聚丙烯制成的刚性护罩覆盖在外侧。它可以保护针护罩免受损坏,并增强注射前针护罩的移除。注射装置组件可以具有柱塞杆,所述柱塞杆连接到柱塞塞子上,并且用于在施用药物时将柱塞塞子连同溶液一起推向针端。
[0072]
优选地,将西曲瑞克的即时注射型的、无菌的、稳定的水溶液填充在注射装置的储器中,并且以基本上没有留在储器内部的顶部空间空气的方式加塞。在储存期间,储器中的水溶液始终保持与由弹性体材料或橡胶材料构成的柱塞塞子接触。在预填充式注射器具有由不锈钢构成的带柄针的情况下,针被针护罩或针尖帽覆盖,在储存期间,水溶液保持与针和针护罩或针尖帽接触。
[0073]
注射装置可以任选地被包装或封闭在二次包装中。二次包装可以是泡罩包装或铝袋和/或不透明纸盒。在二次包装内部可以任选地放置合适的除氧剂。
[0074]
通过将剂型储存在2-8℃和室温(25℃/60%相对湿度)下,完成肠胃外剂型的稳定性测试。在稳定性测试期间,西曲瑞克的即时注射型的无菌溶液保持与由弹性体橡胶材料构成的柱塞塞子和针护罩接触以及与由不锈钢构成的堆叠针接触。在优选的实施例中,包含根据本发明的西曲瑞克的即时注射型的无菌的水溶液的肠胃外剂型当在2-8℃下储存时在1年,优选地2年的时间段内在物理上和化学上保持稳定并且在室温(25℃,60%相对湿度)下储存时在至少6个月内在物理上和化学上保持稳定。当填充的注射装置在室温(25℃/60%相对湿度)下储存至少6个月和在2-8℃下储存至少24个月时,杂质a的浓度保持小于1.0重量%的西曲瑞克碱。发现通过minitab计算确定的杂质a水平不超过1%的西曲瑞克的水溶液的外推保质期为122个月。
[0075]
在一个方面中,本发明涉及一种抑制经历受控卵巢刺激的妇女中的过早黄体化激
素激增的方法,其包含:
[0076]
肠胃外剂型,所述肠胃外剂型包含:即时注射型的无菌的稳定的水溶液,其包含:
[0077]
(i)西曲瑞克或其药学上可接受的盐;和
[0078]
(ii)小于5%w/v的西曲瑞克碱的量的式i的杂质,
[0079][0080]
优选地,稳定的水溶液包含小于4%w/v的西曲瑞克碱的量的式i的杂质。更优选地,稳定的水溶液包含小于3%w/v的西曲瑞克碱的量的式i的杂质。更优选地,稳定的水溶液包含小于2%w/v的西曲瑞克碱的量的式i的杂质。更优选地,稳定的水溶液包含小于1%w/v的西曲瑞克碱的量的式i的杂质。
[0081]
稳定的水溶液进一步包含渗透剂和注射用水。
[0082]
在一个方面中,本发明涉及一种抑制经历受控卵巢刺激的妇女中的过早黄体化激素激增的方法,其包含:
[0083]
肠胃外剂型,所述肠胃外剂型包含:即时注射型的无菌的稳定的水溶液,其包含:
[0084]
(i)西曲瑞克或其药学上可接受的盐;
[0085]
(ii)小于1%w/v的西曲瑞克碱的量的杂质a,一种式i的十肽,
[0086][0087]
在一个方面中,本发明涉及一种抑制经历受控卵巢刺激的妇女中的过早黄体化激素激增的方法,其包含:肠胃外剂型,所述肠胃外剂型包含:即时注射型的无菌的稳定的水溶液,其包含:
[0088]
(i)西曲瑞克或其药学上可接受的盐;
[0089]
(ii)小于1%w/v的西曲瑞克碱的量的杂质a,一种式i的十肽,
[0090][0091]
在一个优选的方面中,本发明涉及一种抑制经历受控卵巢刺激的妇女中的过早黄体化激素激增的方法,其包含:肠胃外剂型,所述肠胃外剂型包含:即时注射型的、无菌的、稳定的水溶液,其包含:
[0092]
(i)西曲瑞克或其药学上可接受的盐,
[0093]
(ii)将ph调节在3至5的范围内的有机酸,
[0094]
(iii)小于1%w/v的西曲瑞克碱的量的杂质a,一种式i的十肽,
[0095][0096]
(iv)渗透剂,和
[0097]
(v)注射用水。
[0098]
在另一个方面中,本公开提供了一种式i的十肽
[0099][0100]
该化合物在本文中被称为“杂质a”,因为它是西曲瑞克溶液的杂质。
[0101]
本公开还提供了一种包含式i的十肽的组合物:
[0102][0103]
在另一个方面中,本公开提供了一种通过hplc分析鉴定式i的十肽的工艺,所述工艺包含:
[0104]
a)将包含水、乙腈和甲酸的稀释剂注射到色谱系统中,
[0105]
b)注射包含醋酸西曲瑞克、稀释剂和杂质储备溶液的系统适用性溶液,并记录色谱图,
[0106]
c)将包含醋酸西曲瑞克和稀释剂的标准溶液注射到所述色谱系统中,
[0107]
d)将包含醋酸西曲瑞克的水溶液和安慰剂制剂的样品注射到所述色谱系统中,以及
[0108]
e)确定杂质和醋酸西曲瑞克相对于醋酸西曲瑞克的相对保留时间和相对响应因子。
[0109]
本公开还提供了一种通过hplc分析鉴定的式i的十肽,所述工艺包含:
[0110]
1.将包含水、乙腈和甲酸的稀释剂注射到色谱系统中,
[0111]
2.注射包含醋酸西曲瑞克、稀释剂和杂质储备溶液的系统适用性溶液,并记录色谱图,
[0112]
3.将包含醋酸西曲瑞克和稀释剂的标准溶液注射到所述色谱系统中,
[0113]
4.将包含醋酸西曲瑞克的水溶液和安慰剂制剂的样品注射到所述色谱系统中,以及
[0114]
5.确定杂质和醋酸西曲瑞克相对于醋酸西曲瑞克的相对保留时间和相对响应因子,
[0115]
在下文中,本发明将借助于实例更具体地描述。所述实例并非旨在限制本发明的范围,并且仅用作说明。
[0116]
实例1a降解产物的鉴定
[0117]
为了研究西曲瑞克的降解,通过固相肽合成的已知技术来制备西曲瑞克的肽相关物质。合成涉及从树脂上的c-末端氨基酸开始,一次偶联一个氨基酸。肽链的合成使用氟烯基甲基氧基羧基(fmoc)/叔丁基(fmoc/tbu)以n,n
′‑
二异丙基碳二亚胺(dipc)作为偶联试剂进行。通过用在二甲基甲酰胺中的20%哌啶处理来去除fmoc基团。使用三氟乙酸最终切割在树脂上形成的肽,以获得通过反相高效液相色谱法(rp-hplc)在c18二氧化硅柱上使用含有0.1%三氟乙酸的乙腈/水的梯度进一步纯化的相关物质。将纯化的肽相关物质冻干以获得纯固体形式。这些相关物质的结构通过质子nmr、碳nmr、质谱和元素分析来表征,并且它们被称为杂质a、b、d和f。
[0118]
杂质a:
[0119]
ac-2-d-nal-4-c1-d-phe-3
‑‑
d-pal-ser-tyr-d-cit-leu-arg-pro-d-ala-oh(描绘为式i的化合物的详细结构),
[0120]
杂质b:
[0121]
2-d-nal-4-c1-d-phe-3-d-pal-ser-tyr-d-cit-leu-arg-pro-d-ala-nh2(描绘为式ii的化合物的详细结构),
[0122]
杂质d:ac-2-d-nal-4-cl-d-phe-3-d-pal-ser-tyr-d-cit-leu-oh(描绘为式iii的化合物的详细结构),和
[0123]
杂质f:
[0124]
ac-2-d-nal-4-cl-d-phe-3-d-pal-ser-tyr-d-cit-leu-arg-pro-oh(描绘为式iv的化合物的详细结构)。
[0125]
基于这些化合物的相对保留时间,在hplc柱上分离的降解峰被鉴定为这些化合物。hplc方法的细节在下面的实例1b中提供:
[0126]
实例1b
[0127]
使用梯度技术(柱:x-select c18,(150x4.6)mm,2.5u(由waters,爱尔兰,部件编号:186006729))在反相(c-18)柱上分离西曲瑞克和从水溶液样品中鉴定的杂质,即杂质a、杂质b、杂质d和杂质f,通过紫外光谱法在225nm波长下检测和定量。以0.7ml/min和1.0ml/min的流速运行流动相。色谱图的运行时间为150分钟。
[0128]
流动相细节:
[0129]
流动相a:如下缓冲溶液的混合物,其中乙腈和四氢呋喃的比率为(700∶280∶20),通过声处理来脱气。
[0130]
流动相b:如下缓冲溶液的混合物,其中乙腈和四氢呋喃的比率为(500∶480∶20),通过声处理来脱气。
[0131]
缓冲液:在1000ml水中的2.5g的正磷酸二氢铵和0.75g的1-辛烷磺酸钠盐,其中使用三乙胺将ph调节至8.0
±
0.05。
[0132]
稀释剂:水、乙腈和甲酸的混合物,其比率为(700∶300∶1)。
[0133]
表1:梯度洗脱的细节
[0134][0135]
杂质的储备溶液的制备:
[0136]
将各3.125mg的杂质a;杂质b、杂质d和杂质f置于50ml容量瓶中,并且通过声处理溶解在约5ml的稀释剂中,然后使用稀释剂补足至体积。
[0137]
系统适用性溶液的制备:
[0138]
这通过称重并将约12.5mg的醋酸西曲瑞克工作标准品转移到100ml容量瓶中,并通过声处理将其溶解在约50ml的稀释剂中,然后添加约2ml的杂质储备溶液并使用稀释剂
补足体积来制备。
[0139]
醋酸西曲瑞克的标准溶液的制备:
[0140]
醋酸西曲瑞克的标准溶液通过称重并将20mg的醋酸西曲瑞克工作标准品转移到250ml容量瓶中,并通过声处理将其溶解在约50ml的稀释剂中并用稀释剂补充体积来制备。将两ml的该溶液转移到250ml容量瓶中,并且在混合的情况下使用稀释剂补足至标记。
[0141]
测试溶液的制备:
[0142]
将来自约10个预填充式注射器的待测试的样品(根据上述实例制备)的醋酸西曲瑞克的水溶液在容器中混合。溶液包含醋酸西曲瑞克、有机酸、渗透剂和注射用水。将约5.0ml的该溶液精确地转移到10ml容量瓶中,并加入约3ml的稀释剂,并且在中间振荡的情况下对溶液进行声处理持续5分钟。在混合的情况下使用稀释剂补足体积。
[0143]
通过将约5.0ml的安慰剂溶液精确地转移到10ml容量瓶中,加入约3ml稀释剂,并在中间振荡的情况下声处理5分钟来制备安慰剂。在混合的情况下使用稀释剂补充体积。将50微升作为空白的稀释剂的一式两份的注射剂注射到色谱系统中。随后,注射系统适用性溶液并记录色谱图。杂质d与杂质f之间的分离度不低于2.0。在此之后,注射六个重复的标准溶液。随后,将样品和安慰剂制剂注射到色谱系统中。
[0144]
在表2中呈现了醋酸西曲瑞克以及杂质a、b、d和f相对于醋酸西曲瑞克的相对保留时间和相对响应因子。
[0145]
表2:
[0146][0147]
计算杂质a、b、d、f和未知杂质的百分比,排除来自稀释剂和安慰剂的峰。所有已知杂质和未知杂质的总和提供总杂质%。
[0148]
通过以下公式来计算鉴定的杂质(a、b、d、f)%:
[0149][0150]
其中,
[0151]
a1=测试制剂的色谱图中每种已知杂质的峰响应,as=标准制剂的色谱图中西曲瑞克的平均峰响应,ws=以mg计的醋酸西曲瑞克工作标准品的重量
[0152]
v=以ml计获取的样品的体积
[0153]
p=西曲瑞克工作标准品的效价%(以原样计),lc=以mg/ml计的西曲瑞克的标签要求(0.25mg/ml),rrf=每种杂质的相对响应因子
[0154]
通过以下公式来计算未知杂质%
[0155]
[0156]
其中,
[0157]
a1=测试制剂的色谱图中每种未知杂质的峰响应,as=标准制剂的色谱图中西曲瑞克的平均峰响应,ws=以mg计的醋酸西曲瑞克工作标准品的重量
[0158]
v=以ml计获取的样品的体积
[0159]
p=西曲瑞克工作标准品的效价%(以原样计),lc=以mg/ml计的西曲瑞克的标签要求(0.25mg/ml),
[0160]
总杂质(%)=已知杂质%和未知杂质%的总和。
[0161]
表3:组成
[0162][0163]
制备的方法:
[0164]
在容器中在2℃至8℃的温度下获取注射用水。添加甘露醇,并且在搅拌的情况下逐渐溶解在注射用水中,直到获得透明溶液。向其中添加醋酸西曲瑞克,并且在搅拌的情况下逐渐溶解。检查溶液的ph,并且使用指定量(体积)的0.1%w/v乳酸溶液将其调节到如表3中针对本发明的每个实例和比较例所述的ph。用注射用水补足体积。将溶液搅拌10-15分钟。将实例的溶液无菌地过滤通过0.2微米膜过滤器的床。将溶液无菌地填充在注射装置的储器中,即,无菌地填充在1ml玻璃注射器的桶中,其中填充体积为1.1ml。桶中的堆叠针被弹性体针护罩塞住,在填充之前被刚性帽覆盖。在填充后,玻璃注射器(桶)通过真空加塞用柱塞塞子塞住,使得在注射器内基本上没有残留的顶部空间空气。在储存时,水溶液保持与由橡胶构成的柱塞塞子、由不锈钢构成的堆叠针和由天然橡胶构成的针护罩接触。
[0165]
工作实例1至9和比较例10至14的即时注射型的水溶液在不同阶段经受化学分析。最初,通过上述hplc方法分析在过滤之前和之后的溶液中西曲瑞克的测定%。确定在过滤之前和过滤之后的化学测定%的变化。
[0166]
然后使玻璃注射器中所包含的实例的溶液经受储存稳定性测试。使用上述高效液相色谱法确定测定%、降解产物(如式i、ii、iii和iv的化合物)的水平以及在初始时间点和在室温(25℃/60%相对湿度)下和在2至8℃下的不同时间点储存时填充在肠胃外剂型的注射装置中的过滤溶液中未知杂质和总杂质的水平。
[0167]
发现在室温下储存6个月后,杂质a、b的水平、单个最大未知杂质和总杂质保持不变或变化较小。基于该数据,预期本发明的肠胃外剂型在长时间段内在化学上是稳定的。发现溶液在制备时和在填充到注射装置中并储存时没有显示出聚集或粘度增加的任何问题。数据还证实,在储存的时间段期间,西曲瑞克没有吸收或吸附到装置的部件上或部件中,例
如与溶液接触的橡胶塞子。
[0168]
在下表4和表5中提供了在25℃/60%rh和2-8℃下根据本发明的稳定的肠胃外剂型的稳定性结果:
[0169]
表4:
[0170][0171]
nd:未检测到;rh-相对湿度;bql:低于可量化限值
[0172][0173]
表6:
[0174][0175]
在25℃/60%rh和2-8℃下储存时,在不同的时间点研究了额外中间ph范围的稳定性结果,在下表7中给出:
[0176][0177]
表8:
[0178][0179]
表9:
[0180]
在ph 5时,醋酸西曲瑞克注射液0.25mg/ml、1ml pfs的稳定性数据
[0181]
每ml包含相当于西曲瑞克0.25mg的醋酸西曲瑞克、54.8mg的甘露醇、适量的以将ph调整为5.0的乳酸和适量至1ml的注射用水
[0182][0183]
nd:未检测到;rh-相对湿度;bql:低于可量化限值;
[0184]
*填充在1ml的pfs中的透明无色溶液
[0185]
[0186][0187]
比较例2
[0188]
根据us 2013/0303464(patel等人)的公开来制备醋酸西曲瑞克的水溶液。在下表
12中示出了组成:
[0189]
表12:
[0190]
成分量(mg/ml)醋酸西曲瑞克0.25甘露醇42.0冰醋酸适量至ph 3.0注射用水1ml
[0191]
制备的方法在容器中在2℃至8℃的温度下获取注射用水。添加甘露醇,并且在搅拌的情况下逐渐溶解在注射用水中,直到获得透明溶液。向其中添加醋酸西曲瑞克,并且在搅拌的情况下逐渐溶解。然后添加冰醋酸,并将溶液的ph调节至约3.0。用注射用水补足体积。将溶液搅拌10-15分钟,并且随后通过0.2μm膜过滤器的床(optiscale 47胶囊,通过millipore的聚醚砜膜过滤器)无菌过滤。将溶液无菌地填充在注射装置的储器中,即无菌地填充在在1ml玻璃注射器的桶中,其中填充体积为1.1ml。桶中的堆叠针被弹性体针护罩塞住,在填充之前被刚性帽覆盖。在填充后,玻璃注射器(桶)通过真空加塞用柱塞塞子塞住,使得在注射器内基本上没有残留的顶部空间空气。在储存时,水溶液保持与由橡胶构成的柱塞塞子、由不锈钢构成的堆叠针和由天然橡胶构成的针护罩接触。
[0192]
使填充在玻璃注射器中的该比较例(比较例2)的溶液经受储存稳定性测试。通过高效液相色谱技术,在初始以及在室温(25℃/60%相对湿度)下储存时,分析了溶液中杂质a、杂质b和总杂质的水平。在下表13中提供了结果。
[0193]
表13:比较例2的稳定性结果
[0194][0195]
nd:未检测到;rh-相对湿度
[0196]
观察到us 2013/0303464(比较物)的醋酸西曲瑞克的溶液在室温下储存时,显示出杂质a和总杂质的水平的显著增加。特别地,作为降解杂质的杂质a的水平显著增加并且在6个月内增加到西曲瑞克的1.77重量%。总杂质的水平在6个月内也增加到西曲瑞克的2.83重量%。
[0197]
相比之下,包含本发明的醋酸西曲瑞克的即时注射型的水溶液的肠胃外剂型在室温下在延长的时间段内保持稳定,由此在储存时基本上不发生杂质a、其它杂质或总杂质的水平的降解或增加,并且该溶液具有超过24个月的外推保质期。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1