包含钠通道阻滞剂的缓释热固性凝胶及其制备方法与流程
包含钠通道阻滞剂的缓释热固性凝胶及其制备方法
相关申请的交叉引用
1.本技术要求2020年5月18日提交的美国临时申请号63/026,369;2020年1月7日提交的美国临时申请号62/958,212;2019年11月7日提交的美国临时申请号62/932,076;和2019年9月9日提交的美国临时申请号62/897,555的权益,将其内容通过引用以其整体特此并入。
技术领域
2.本公开文本描述了涉及治疗或控制疼痛的组合物和方法,其中所述组合物包含配制在三嵌段共聚物中的福奈派德(funapide)。本公开文本还提供了制造如本文所述的组合物的方法。
背景技术:
3.估计每年在美国完成7千万例手术(owings 1998)。超过80%的经历手术的患者出现急性术后疼痛,并且这些患者中有约75%报告其疼痛严重程度为中度、重度或极度(chou 2016)。在超过50%的病例中,患者报告术后没有得到足够的疼痛缓解(chou 2016)。控制不当的术后疼痛可能具有短期和长期影响,包括对生活质量、功能和功能恢复、术后并发症的风险和持续性术后疼痛的风险的负面影响。
4.在术后疼痛控制中,对于具有不实质损害运动功能的延长的区域镇痛作用的非阿片类感觉阻滞存在显著未满足的需求。骨科手术在成人中产生第二高比率的阿片类药物处方,许多患者在手术前后都使用阿片类药物(smith 2018),从而促进潜在成瘾的途径。提供延长的疼痛缓解而不实质损害运动功能的治疗可以减少对阿片类药物的需要,允许更早的步行和物理治疗,并且使患者能够在术后更快出院。
5.福奈派德是一种优先拮抗nav1.7的小分子电压门控钠通道(nav)抑制剂。nav1.7参与基于由scn9a基因突变引起的人表型的疼痛信号传导,其中功能丧失导致先天性对疼痛不敏感(cip),并且功能获得导致对疼痛超敏感(yang 2004,fertleman 2006,goldberg 2007)。对nav1.7的拮抗足以提供术后疼痛的镇痛而不实质损害运动功能。对于通过单次注射递送持久的疼痛缓解的药物组合物存在未满足的需求。本文公开了包含福奈派德的热敏性水凝胶配制品,其在靶向注射部位(外周神经)保持局部物理接近和高局部药物浓度持续至少3-5天,并且可以提供至少3-5天的术后疼痛缓解而不实质损害运动功能。
技术实现要素:
6.本公开文本提供了一种配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.2%至2%w/w的福奈派德;b)浓度为5%至35%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个聚乳酸-共-乙醇酸(plga)聚合物嵌段具有400至2550da的分子量(mw),并且其中聚乙二醇(peg)聚合物嵌段具有1000-3000da的mw;并且(ii)其中所述plga包含40%至100%乳酸和60%至0%乙醇酸;c)浓度为1%-20%w/w的极
性有机溶剂;和d)浓度为1%至20%w/w的溶解度增强剂。
7.本公开文本提供了一种配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中plga聚合物和peg聚合物的分子量值使用凝胶渗透色谱(gpc)方法在数均分子量(mn)基础上报告。
8.所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1000-2450da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1400-2450da。
9.所述组合物可以包含plga-peg-plga三嵌段共聚物,其中peg聚合物嵌段的mw为1000-1600da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中peg聚合物嵌段的mw为1400-1600da。
10.所述组合物可以包含浓度为0.2%至1.8%w/w的福奈派德。所述组合物可以包含浓度为0.2%至1.5%w/w的福奈派德。所述组合物可以包含浓度为0.2%至1%w/w的福奈派德。所述组合物可以包含浓度为1%至2%w/w的福奈派德。所述组合物可以包含浓度为1%至1.5%w/w的福奈派德。所述组合物可以包含浓度为1.5%至2%w/w的福奈派德。所述组合物可以包含浓度为0.65%w/w的福奈派德。所述组合物可以包含浓度为1.3%w/w的福奈派德。
11.所述组合物可以包含浓度为1%至5%w/w的极性有机溶剂。所述组合物可以包含浓度为5%至10%w/w的极性有机溶剂。所述组合物可以包含浓度为10%至20%w/w的极性有机溶剂。所述组合物可以包含浓度为1.5%-20%w/w的极性有机溶剂。所述组合物可以包含浓度为1%至10.5%w/w的极性有机溶剂。所述组合物可以包含浓度为1.5%至2%w/w的极性有机溶剂。所述组合物可以包含浓度为1.5%w/w的极性有机溶剂。所述组合物可以包含浓度为1.7%w/w的极性有机溶剂。所述极性有机溶剂可以是二甲基乙酰胺(dma)、二甲基亚砜(dmso)、四氢呋喃聚乙二醇醚(glycofurol)和n-甲基-2-吡咯烷酮(nmp)或其任何组合中的任一种。所述极性有机溶剂可以是dma。
12.所述组合物可以包含浓度为5%-20%w/w的溶解度增强剂。所述组合物可以包含浓度为10%-11%w/w的溶解度增强剂。所述溶解度增强剂可以是丙二醇(pg)、聚氧乙烯蓖麻油(cremophor el)、聚氧乙烯60氢化蓖麻油(cremophor rh 60)、乙醇、甘油、peg 300、peg 400、聚山梨醇酯、维生素e-tpgs、plga-peg二嵌段共聚物、羟丙基-β-环糊精、磺丁基醚-β-环糊精、泊洛沙姆188、泊洛沙姆407、聚乙烯吡咯烷酮(pvp)、甘油缩甲醛和solutol hs或其任何组合中的任一种。优选的溶解度增强剂包括聚山梨醇酯、plga-peg二嵌段共聚物、聚氧乙烯蓖麻油、peg 300、peg 400和solutol hs。在一个优选的方面,所述溶解度增强剂可以是peg 400。
13.所述组合物可以包含具有40%乳酸和60%乙醇酸的plga(la:ga比率为40:60)。所述组合物可以包含具有50%乳酸和50%乙醇酸的plga(la:ga比率为50:50)。所述组合物可以包含具有100%乳酸和0%乙醇酸的plga(la:ga比率为100:0)。
14.所述组合物可以包含浓度为8%至25%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19%至20%w/w的plga-peg-plga三嵌段共聚物。
15.如本文所公开的组合物的总三嵌段聚合物体系的总分子量可以在2500-7000da之间。总三嵌段聚合物体系的总分子量可以在4000-7000da之间。总三嵌段聚合物体系的总分
子量可以在6000-7000da之间。总三嵌段聚合物体系的总分子量不超过大于6600-7000da。总三嵌段聚合物体系的总分子量可以是6000da。
16.如本文所公开的组合物可以包含plga-peg-plga三嵌段共聚物,其可以是400da-3000da-400da的plga-peg-plga。所述组合物可以包含plga-peg-plga三嵌段共聚物,其可以是1000da-1000da-1000da的plga-peg-plga。所述组合物可以包含plga-peg-plga三嵌段共聚物,其可以是1500da-1500da-1500da的plga-peg-plga。所述组合物可以包含plga-peg-plga三嵌段共聚物,其可以是2000da-2000a-2000da的plga-peg-plga。所述组合物可以包含plga-peg-plga三嵌段共聚物,其可以是2450da-1500da-2450da的plga-peg-plga。
17.所述组合物可以包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%至19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中plga乳酸:乙醇酸比率(la:ga比率)为50:50;c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
18.所述组合物可以包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19%至19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中plga乳酸:乙醇酸比率(la:ga比率)为50:50;c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
19.所述组合物可以具有5ml至40ml的总剂量体积。所述组合物可以具有5ml的总剂量体积。所述组合物可以具有10ml的总剂量体积。所述组合物可以具有15ml的总剂量体积。所述组合物的总剂量体积可以是20ml。所述组合物可以具有25ml的总剂量体积。所述组合物可以具有30ml的总剂量体积。所述组合物可以具有40ml的总剂量体积。
20.本公开文本提供了一种治疗有需要的受试者的术后疼痛的方法,其中所述方法包括向所述受试者施用有效量的本文公开的任何组合物。所述方法包括在手术之前向所述受试者施用有效量的任何所述组合物。治疗术后疼痛的所述方法可以包括在手术过程中向所述受试者施用有效量的所述组合物。治疗术后疼痛的所述方法可以包括在手术之后向所述受试者施用有效量的所述组合物。治疗术后疼痛的所述方法可以包括在手术之前向所述受试者施用有效量的所述组合物。
21.本公开文本提供了一种预防或治疗有需要的受试者的疼痛的方法,其中所述方法包括施用有效量的本文公开的组合物。所述疼痛可以是急性疼痛。所述急性疼痛可以是由于损伤、牙科治疗、分娩、手术或其任何组合中的任一种。
22.所述有效量诱导镇痛神经阻滞。所述镇痛神经阻滞可以是上肢神经阻滞、下肢神经阻滞、面神经阻滞、颈背神经阻滞、胸腹阻滞或其任何组合中的任一种。所述上肢神经阻滞可以是肌间沟神经阻滞、锁骨上神经阻滞、臂丛神经阻滞、锁骨下神经阻滞或其任何组合中的任一种或多种。所述下肢神经阻滞可以是腹下丛神经阻滞、腰丛神经阻滞、股神经阻滞、收肌管神经阻滞、隐神经阻滞、腘窝神经阻滞和坐骨神经阻滞或其任何组合中的任一种或多种。所述面神经阻滞可以是三叉神经阻滞、眼神经阻滞、眶上神经阻滞、上颌神经阻滞、蝶腭神经阻滞或其任何组合中的任一种或多种。所述颈背神经阻滞可以是颈椎硬膜外神经阻滞、胸椎硬膜外神经阻滞、腰椎硬膜外神经阻滞、骶管阻滞或其任何组合中的任一种或多种。所述胸腹阻滞可以是椎旁阻滞、肋间阻滞、腹横肌平面阻滞、腹直肌鞘阻滞或其任何组合中的任一种或多种。
23.所述手术可以是诊断性手术、消融性手术、姑息性手术、重建性手术、移植手术、建设性手术或其任何组合中的任一种。
24.所述手术可以是上肢手术、下肢手术、腹部手术、心胸手术、头颈手术、背部手术、肌肉骨骼手术、骨科手术、眼科手术、耳鼻喉手术、血管手术、牙科手术或其任何组合中的任一种。
25.所述上肢手术可以是手臂、前臂、手部、腕部、肘部、肩部或其任何组合的手术中的任一种。所述上肢手术可以是所述手臂、前臂、手部、腕部、肘部、肩部或其任何组合的一根或多根骨的手术。所述一根或多根骨可以包括桡骨、尺骨、肱骨、腕骨、掌骨或指骨或其组合中的任一种。
26.所述下肢手术是髋部、大腿、膝盖、脚踝、脚部或其任何组合的手术中的任一种。所述下肢手术可以是所述髋部、大腿、膝盖、脚踝、脚部或其任何组合的一根或多根骨的手术。所述一根或多根骨可以包括髋臼、股骨、胫骨、腓骨、髌骨、跗骨、跖骨、足弓或其组合中的任一种。
27.所述手术可以属于腹壁、胸壁或其组合中的任一种。所述手术可以是器官的手术。所述器官可以是心脏、肺、肝、脾、脑、胃、小肠、大肠、胆囊、胆管、淋巴管、膀胱、前列腺、胰腺、肾上腺、甲状腺、皮肤、子宫、输卵管、卵巢、精小管、睾丸或其任何组合。所述手术可以用于所述器官的修复、切除或移植中的任一种。所述器官手术可以用于从所述器官内或附近切除肿瘤或癌组织。
28.所述有需要的受试者可以是哺乳动物。所述受试者可以是人、鼠科动物、马科动物、犬科动物、猫科动物、兔、猪、仓鼠、牛科动物或骆驼科动物。所述受试者可以是人。
29.神经周、硬膜外、皮下、皮内、口服、肌内或静脉内施用所述有效量的所述组合物。优先神经周施用所述有效量的所述组合物。通过直接滴注到一处或多处损伤或手术部位的伤口中来施用所述有效量的所述组合物。通过在一处或多处损伤或手术部位渗透来施用所述有效量的所述配制品。
30.本公开文本提供了一种制造本文公开的任何组合物的方法,所述方法包括:i)合并并溶解:a)一定量的plga-peg-plga三嵌段聚合物;b)一定量的水;c)一定量的福奈派德;d)一定量的极性有机溶剂;和e)一定量的溶解度增强剂;以形成混合物;ii)在1℃-30℃下搅拌(i)的混合物;iii)通过无菌过滤器过滤(ii)的澄清溶液;以及iv)收集并在≤-20℃下冷冻(iii)的过滤溶液。
31.制造本文公开的任何组合物的所述方法可以包括在步骤i)中:1)在1℃-30℃下将(a)的所述量的plga-peg-plga三嵌段聚合物配混并溶解在(b)的所述量的水中,以形成聚合物溶液;2)在单独的容器中将(c)的所述量的福奈派德溶解在(d)的所述量的极性有机溶剂和(e)的所述量的溶解度增强剂中,以形成福奈派德溶液;以及3)将(2)的福奈派德溶解溶液与(1)的聚合物溶液合并以形成混合物。在制造本文公开的任何组合物的所述方法中,搅拌所述混合物的温度可以是1℃-30℃。优选的温度范围包括5℃-25℃、5℃-20℃和5℃-15℃。在一个优选的方面,所述温度的范围从8℃-12℃。
32.任何上述方面都可以与任何其他方面组合。
33.除非另外定义,否则本文使用的所有技术和科学术语都具有与本公开文本所属领域的普通技术人员通常所理解的相同的含义。在本说明书中,除非上下文另外明确规定,否
则单数形式也包括复数形式;作为例子,术语“一种/一个(a)”、“一种/一个(an)”和“所述”应理解为单数或复数,并且术语“或”应理解为包含性的。举例来说,“一种/一个要素”是指一种或多种/一个或多个要素。在整个说明书中,词语“包含(comprising)”或变体(如“包含(comprises)”或“包含(comprising)”)应理解为意指包括所述的要素、整体或步骤,或要素、整体或步骤的组,但是不排除任何其他要素、整体或步骤,或要素、整体或步骤的组。约可以理解为在所述的值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非根据上下文另外清楚,否则本文提供的所有数值都被术语“约”修饰。
34.尽管与本文所述的方法和材料类似或等同的方法和材料可以用于本公开文本的实践或测试,但以下描述了合适的方法和材料。将本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用以其整体而并入。本文引用的参考文献不被承认是所要求保护的本发明的现有技术。在冲突的情况下,应以本说明书(包括定义)为准。此外,材料、方法和实施例仅仅是说明性的,并不旨在是限制性的。根据以下具体实施方式和权利要求,本公开文本的其他特征和优点应变得清楚。
附图说明
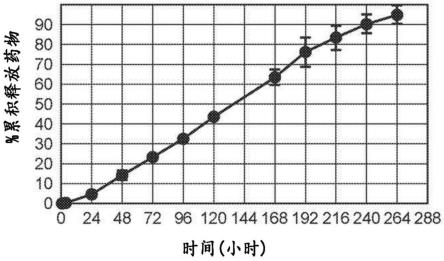
35.图1a-图1b.福奈派德-三嵌段聚合物配制品的体外和体内释放。图1a描绘了本公开文本的福奈派德-三嵌段聚合物配制品(fx301)的体外释放曲线。随时间(小时)(x轴)的变化测量累积释放药物百分比(y轴)。结果来自包括对一式三份分析ivr的一种配制品的分析的一个实验。统计显著性用sd误差条指示。图1b描绘了在术后猪模型中施加fx301的坐骨神经阻滞后获得的福奈派德的血浆pk曲线。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。虚线指示福奈派德抑制nav1.7的体外ic
50
值。结果代表3只动物。统计显著性用均数标准误(sem)误差条指示。
36.图2初始配制品的体外释放曲线。图2描绘了如表2所指示的六种不同配制品的体外释放曲线,测量为随时间(小时)(x轴)变化的%释放api(y轴)。对于如所指示的每种配制品,结果代表使用单个重复的体外释放分析的单个实验。
37.图3.使用初始配制品进行的大鼠pk研究。图3描绘了用如表2所指示的六种不同配制品处理的大鼠中福奈派德的血浆药代动力学。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。结果代表每组3只动物。统计显著性用sem误差条指示。
38.图4.含有较高聚合物浓度的配制品的体外释放曲线。图4描绘了含有较高聚合物浓度的不同配制品的体外释放曲线,对于如表3所指示的每种配制品,测量为随时间(小时)(x轴)变化的%释放api(y轴)。结果代表所分析的每种配制品的单个实验。
39.图5使用含有较高聚合物浓度的配制品进行的大鼠pk研究。图5描绘了用如表3所指示的不同配制品处理的大鼠中福奈派德的血浆药代动力学。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。结果代表3只动物。统计显著性用sem误差条指示。
40.图6.比较具有和不具有聚山梨醇酯80的配制品的体外释放(%api释放)曲线。图6描绘了如表4所指示的具有或不具有聚山梨醇酯80的不同配制品的体外释放曲线,测量为随时间(小时)(x轴)变化的%释放api(y轴)。结果代表所分析的每种配制品的单个实验。
41.图7.比较具有和不具有聚山梨醇酯80的配制品的体外释放(释放质量)曲线。图7
描绘了如表4所指示的具有或不具有聚山梨醇酯80的不同聚合物配制品的体外释放曲线,测量为随时间(小时)(x轴)变化的释放api的总质量(μg)(y轴)。结果代表所分析的每种配制品的单个实验。
42.图8.使用nb0032-021-01(9.6%peg 400+16.4%plga-peg-plga(1500-1500-1500,la:ga 50:50))进行的猪pk研究。图8描绘了在猪中进行的pk研究的血浆药代动力学曲线,所述猪使用5ml给药体积体内暴露于通过神经周注射施用的不具有聚山梨醇酯80的配制品。虚线指示福奈派德抑制nav1.7的体外ic
50
值(50nm)。
43.图9.比较具有和不具有dma的配制品的体外释放(%释放api)曲线。图9描绘了如表6所指示的具有或不具有dma的不同配制品的体外释放曲线,测量为随时间(小时)(x轴)变化的%释放api(y轴)。结果代表所分析的每种配制品的单个实验。
44.图10.具有和不具有dma的配制品的大鼠pk研究。图10描绘了用剂量为300μl的如表6所指示的不同配制品处理的大鼠中福奈派德的血浆药代动力学。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。体外ic
50
值用虚线指示。结果代表每组3只动物。统计显著性用sem误差条指示。
45.图11.福奈派德-三嵌段聚合物配制品(fx301)在猪中的全身pk曲线。图11描绘了用剂量为10ml的fx301配制品处理的猪中福奈派德的血浆药代动力学曲线。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。虚线指示福奈派德抑制nav1.7的体外ic
50
值。结果代表3只动物。统计显著性用sem误差条指示。
46.图12.用低和高mw聚合物制备的福奈派德-三嵌段聚合物配制品(fx301)的体外释放曲线。图12描绘了如表7所指示的19.2%低分子量(低mw)(3600da)聚合物配制品和19.2%高分子量(高mw)(5400da)聚合物配制品的体外释放曲线,测量为随时间(小时)(x轴)变化的%释放api(y轴)。结果代表高mw组的单个实验和低mw组的单个实验。
47.图13.使用用低和高mw聚合物制备的配制品进行的大鼠pk研究。图13描绘了用如表7所指示的19.2%低分子量(低mw)(3600da)聚合物配制品或19.2%高分子量(高mw)(5400da)聚合物配制品处理的大鼠中福奈派德的血浆药代动力学。随时间(小时)(x轴)的变化测量福奈派德的血浆浓度(nm)(y轴)。虚线指示福奈派德抑制nav1.7的体外ic
50
值。结果代表每组3只动物。统计显著性用sem误差条指示。
48.图14.用mw在5600至6400da范围内的plga-peg-plga聚合物(所有聚合物的la:ga都为50:50)制备的fx301的体外释放曲线。图14描绘了用mw在5600至6400da范围内的plga-peg-plga聚合物制备的fx301的体外药物释放曲线,其中peg聚合物嵌段mw为约1500da,并且总mw的变化由plga嵌段mw的变化引起(所有聚合物都具有50%乳酸和50%乙醇酸(la:ga 50:50)),如表8所指示,测量为随时间(小时)(x轴)变化的%释放api(y轴)。对于如所指示的每种配制品,结果代表一式三份进行的体外释放分析的单个实验。统计显著性用sd误差条指示。
49.图15a-图15c.fx301在猪的术后疼痛模型中的周围神经阻滞的功效和药代动力学。在适应5天后,将总共18只猪麻醉,然后在超声引导下非常靠近坐骨神经注射10ml媒介物(n=6)、fx301(13mg/ml;总剂量130mg)(n=6)或脂质体布比卡因(13.3mg/ml;总剂量133mg)(n=6)。然后在注射后立即在同侧后肢的背侧区通过5cm长的切口来诱导手术疼痛。图15a描绘了通过von frey测试得到的平均
±
sem回缩力。图15b描绘了平均
±
sem gbs得
分。图15c描绘了在旷场测试中经5分钟的平均
±
sem总步行距离。条表示如所指示的每个处理组,并且误差条指示sem。使用单因素方差分析,然后使用tukey检验进行处理组和媒介物组之间的比较;*p《0.05相比于媒介物;**p《0.01相比于媒介物;布比卡因;##p《0.01相比于脂质体布比卡因;####p《0.001相比于脂质体布比卡因(单因素方差分析,然后是tukey检验)。+p《0.05相比于基线(重复测量方差分析)。***p《0.005;****p《0.001相比于媒介物;#p《0.05相比于脂质体。
50.图16.血浆福奈派德浓度与时间的关系曲线。图16描绘了使用具有串联质谱检测的高效液相色谱法在用fx301处理的猪的血浆中定量的福奈派德。随时间(小时)(x轴)的变化测量血浆福奈派德浓度(ng/ml)(y轴)。数据代表n=3只动物,并且误差条指示sem。
51.图17a-图17b.fx301局部递送福奈派德持续至少3天。图17a描绘了全身福奈派德浓度曲线,测量为随时间(小时)(x轴)变化的血浆浓度(ng/ml)(y轴)。图17b描绘了局部肌肉福奈派德浓度,测量为随时间(天)(x轴)变化的总浓度(ng/g)(y轴)。
具体实施方式
52.nav1.7是一种电压门控钠通道,其在动作电位的产生和沿着感觉神经元的传导中起关键作用(dib-flajj sd等人nat rev neurosci.2013;14:49-62)。来自遗传性疼痛综合征的遗传证据已经确认nav1.7是治疗疼痛的治疗靶标(cox jj等人nature.2006;444:894-98;fertleman cr等人neuron.2006;52:767-74;yang y等人j med genet.2004;41:171-74;cummins tr等人j neurosci.2004;24:8232-36)。由于nav1.7优先由感觉神经元而非运动神经元表达(dib-hajj sd等人nat rev neurosci.2013;14:49-62),因此靶向nav1.7具有提供有效疼痛缓解而不实质损害运动功能的潜力。因此,本领域需要靶向nav1.7以用于疼痛控制的组合物和方法。本公开文本解决了这些需求。
53.本文公开了用于递送优先的nav1.7拮抗剂(福奈派德)以用于术后疼痛控制的热敏性水凝胶技术。水凝胶主要由plga-peg-plga三嵌段共聚物构成。三嵌段聚合物在溶解于水中时自组装成纳米尺寸的胶束。在环境温度下,配制品存在于由可以负载药物的聚合物胶束组成的溶液相中。在升温至体温时,胶束的疏水结构域之间的相互作用在热力学上变得有利,并且胶束形成网络,导致从胶束溶液相转变为稠度类似于凡士林的粘性凝胶。此过程在冷却后完全可逆。这种溶液到凝胶相的转变便于作为溶液注射,一旦施用,快速转变为粘性凝胶相,允许物理贮库驻留和通过简单的药物扩散控制药物释放。在配制品仍为液体的同时(低于临界胶凝温度),疏水药物可以被包封在胶束的疏水核内。然后包封的药物经几天从配制品的凝胶贮库中释放。
54.福奈派德的结构是本领域公知的,例如在美国专利号8,450,358、9,480,677、10,118,932和10,513,526(通过引用并入本文)中。
55.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)福奈派德;b)plga-peg-plga三嵌段共聚物;c)极性有机溶剂;和d)溶解度增强剂。在本公开文本的组合物中,组成质量的余量包含水。
56.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为约0.1%至5%w/w的福奈派德;b)浓度为5%至35%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有约300至3000da的mw,并且
其中peg聚合物嵌段具有约700-3500da的mw;并且(ii)其中所述plga包含40%至100%乳酸和60%至0%乙醇酸;c)浓度为约1%-20%w/w的极性有机溶剂;和d)浓度为1%至20%w/w的溶解度增强剂。
57.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.2%至2%w/w的福奈派德;b)浓度为5%至35%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有400至2550da的mw,并且其中peg聚合物嵌段具有1000-3000da的mw;并且(ii)其中所述plga包含40%至100%乳酸和60%至0%乙醇酸;c)浓度为1%-20%w/w的极性有机溶剂;和d)浓度为1%至20%w/w的溶解度增强剂。
58.所述组合物可以包含浓度为0.1%至2%w/w的福奈派德。所述组合物可以包含浓度为0.2%至2%w/w的福奈派德。所述组合物可以包含浓度为0.2%至1.8%w/w的福奈派德。所述组合物可以包含浓度为0.2%至1.5%w/w的福奈派德。所述组合物可以包含浓度为0.65%至1.3%w/w的福奈派德。所述组合物可以包含浓度为0.5%至1.0%w/w的福奈派德。所述组合物可以包含浓度为0.65%w/w的福奈派德。所述组合物可以包含浓度为1.3%w/w的福奈派德。
59.所述组合物可以包含浓度为5%-30%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为5%-25%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为5%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为5%-15%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为5%-10%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-35%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-30%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-25%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-15%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-10%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为5%-8%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为8%-10%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为10%-15%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为15%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为20%-25%w/w的plga-peg-plga三嵌段共聚物。
60.所述组合物可以包含浓度为15%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.1%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.2%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.5%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.8%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.0%-19.5%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.0%-19.2%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.2%-19.5%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.5%-20%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为25%-30%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为
30%-35%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为25%-35%w/w的plga-peg-plga三嵌段共聚物。
61.所述组合物可以包含浓度为19.0%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.1%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.2%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.25%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.3%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.4%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.5%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.6%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.7%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.8%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为19.9%w/w的plga-peg-plga三嵌段共聚物。所述组合物可以包含浓度为20%w/w的plga-peg-plga三嵌段共聚物。
62.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中plga聚合物和peg聚合物的分子量使用凝胶渗透色谱(gpc)方法测量,其中值报告为数均分子量(mn)。
63.所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为400至2550da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为400至750da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为750至1000da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1000至1250da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1250至1500da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1500至1750da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1750至2000da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2000至2250da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2250至2500da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2500至2550da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为400至1000da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1000至2450da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1400至2450da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1500至2250da。
64.所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为400da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为750da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1000da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为1500da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2000da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2450da。所述组合物可以包含plga-peg-plga三嵌段共聚物,其中每个plga聚合物嵌段的mw为2550da。
10.5%w/w的极性有机溶剂。所述组合物可以包含10%-20%w/w的极性有机溶剂。所述组合物可以包含1%-5%w/w的极性有机溶剂。所述组合物可以包含1%-3%w/w的极性有机溶剂。所述组合物可以包含1%-2%w/w的极性有机溶剂。所述组合物可以包含1.5%-3%w/w的极性有机溶剂。所述组合物可以包含1.5%-2%w/w的极性有机溶剂。
70.所述组合物可以包含3%w/w的极性有机溶剂。所述组合物可以包含2.5%w/w的极性有机溶剂。所述组合物可以包含2.4%w/w的极性有机溶剂。所述组合物可以包含2.3%w/w的极性有机溶剂。所述组合物可以包含1.8%w/w的极性有机溶剂。所述组合物可以包含1.7%w/w的极性有机溶剂。
71.所述组合物可以包含极性有机溶剂,其为二甲基乙酰胺(dma)、二甲基亚砜(dmso)、四氢呋喃聚乙二醇醚和n-甲基-2-吡咯烷酮(nmp)中的任一种。所述组合物可以包含极性有机溶剂,其为dma。
72.所述组合物可以包含1%-7.5%w/w的溶解度增强剂。所述组合物可以包含1%-10.5%w/w的溶解度增强剂。所述组合物可以包含1%-12.5%w/w的溶解度增强剂。所述组合物可以包含1%-15%w/w的溶解度增强剂。所述组合物可以包含1%-17.5%w/w的溶解度增强剂。所述组合物可以包含1%-20%w/w的溶解度增强剂。所述组合物可以包含1.5%-20%w/w的溶解度增强剂。所述组合物可以包含2%-20%w/w的溶解度增强剂。所述组合物可以包含2.5%-20%w/w的溶解度增强剂。所述组合物可以包含3%-20%w/w的溶解度增强剂。所述组合物可以包含5%-20%w/w的溶解度增强剂。所述组合物可以包含1%-5%w/w的溶解度增强剂。所述组合物可以包含1%-3%w/w的溶解度增强剂。所述组合物可以包含1%-2%w/w的溶解度增强剂。所述组合物可以包含1%-1.5%w/w的溶解度增强剂。所述组合物可以包含1.5%-2%w/w的溶解度增强剂。所述组合物可以包含1.7%-2%w/w的溶解度增强剂。所述组合物可以包含2%-2.5%w/w的溶解度增强剂。所述组合物可以包含2%-3%w/w的溶解度增强剂。所述组合物可以包含2%-5%w/w的溶解度增强剂。所述组合物可以包含3%-5%w/w的溶解度增强剂。所述组合物可以包含5%-10%w/w的溶解度增强剂。所述组合物可以包含10%-15%w/w的溶解度增强剂。所述组合物可以包含15%-20%w/w的溶解度增强剂。所述组合物可以包含15%-17%w/w的溶解度增强剂。所述组合物可以包含17%-20%w/w的溶解度增强剂。所述组合物可以包含5%-11%w/w的溶解度增强剂。所述组合物可以包含6%-11%w/w的溶解度增强剂。所述组合物可以包含5%-7%w/w的溶解度增强剂。所述组合物可以包含7%-11%w/w的溶解度增强剂。所述组合物可以包含7%-9%w/w的溶解度增强剂。所述组合物可以包含8%-11%w/w的溶解度增强剂。所述组合物可以包含9%-11%w/w的溶解度增强剂。所述组合物可以包含10%-11%w/w的溶解度增强剂。所述组合物可以包含11%-15%w/w的溶解度增强剂。所述组合物可以包含11%-13%w/w的溶解度增强剂。所述组合物可以包含13%-16%w/w的溶解度增强剂。所述组合物可以包含16%-19%w/w的溶解度增强剂。所述组合物可以包含19%-20%w/w的溶解度增强剂。
73.所述组合物可以包含1.7%w/w的溶解度增强剂。所述组合物可以包含5%w/w的溶解度增强剂。所述组合物可以包含6%w/w的溶解度增强剂。所述组合物可以包含6.2%w/w的溶解度增强剂。所述组合物可以包含6.4%w/w的溶解度增强剂。所述组合物可以包含6.5%w/w的溶解度增强剂。所述组合物可以包含8.3%w/w的溶解度增强剂。所述组合物可以包含8.4%w/w的溶解度增强剂。所述组合物可以包含8.6%w/w的溶解度增强剂。所述组
合物可以包含8.7%w/w的溶解度增强剂。所述组合物可以包含8.8%w/w的溶解度增强剂。所述组合物可以包含8.9%w/w的溶解度增强剂。所述组合物可以包含9.1%w/w的溶解度增强剂。所述组合物可以包含9.2%w/w的溶解度增强剂。所述组合物可以包含9.4%w/w的溶解度增强剂。所述组合物可以包含9.6%w/w的溶解度增强剂。所述组合物可以包含10%w/w的溶解度增强剂。所述组合物可以包含10.3%w/w的溶解度增强剂。所述组合物可以包含10.4%w/w的溶解度增强剂。所述组合物可以包含10.5%w/w的溶解度增强剂。所述组合物可以包含10.6%w/w的溶解度增强剂。所述组合物可以包含11%w/w的溶解度增强剂。
74.所述组合物可以包含溶解度增强剂,其为丙二醇(pg)、聚氧乙烯蓖麻油、聚氧乙烯60氢化蓖麻油、乙醇、甘油、peg 300、peg 400、聚山梨醇酯、维生素e-tpgs、plga-peg二嵌段共聚物、羟丙基-β-环糊精、磺丁基醚-β-环糊精、泊洛沙姆188、泊洛沙姆407、聚乙烯吡咯烷酮(pvp)、甘油缩甲醛和solutol hs中的任一种。所述组合物可以包含溶解度增强剂,其为peg 400。所述组合物可以包含溶解度增强剂,其为聚山梨醇酯80。
75.所述组合物可以包含在2000-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在2500-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在3000-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在3500-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在4000-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在4000-5000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在5000-6000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在6000-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在5000-7000da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在2600-6400da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含在4300-6400da之间的总三嵌段聚合物体系的总分子量。所述组合物可以包含不超过大于6600-7000da的总三嵌段聚合物体系的总分子量。所述组合物可以包含6000da的总三嵌段聚合物体系的总分子量。所述组合物可以包含小于6000da的总三嵌段聚合物体系的总分子量。
76.所述组合物可以包含400da-3000da-400da的plga-peg-plga。所述组合物可以包含400da-3050da-400da的plga-peg-plga。所述组合物可以包含750da-1850da-750da的plga-peg-plga。所述组合物可以包含750da-2500da-750da的plga-peg-plga。所述组合物可以包含1000da-1000da的plga-peg-plga。所述组合物可以包含1500da-1500da的plga-peg-plga。所述组合物可以包含2000da-2000da的plga-peg-plga。所述组合物可以包含2550da-1550da-2550da的plga-peg-plga。
77.所述组合物可以包含2450da-1500da-2450da的plga-peg-plga。所述组合物可以包含1700da-1500da-1700da的plga-peg-plga。所述组合物可以包含1600da-1500da-1600da的plga-peg-plga。所述组合物可以包含1600da-1000da-1600da的plga-peg-plga。
78.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%-19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
79.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19%-19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
80.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
81.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
82.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
83.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg 400。
84.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg-400。
85.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg 400。
86.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19.0%至19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)
(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
87.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%至19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
88.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%至19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
89.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
90.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
91.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
92.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
93.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
94.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da的mw,并且其中peg聚合物具
有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
95.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg 400。
96.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.2%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg 400。
97.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为0.65%w/w的福奈派德;b)浓度为19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为50:50);c)浓度为1.7%w/w的dma;和d)浓度为10%w/w的peg 400。
98.本公开文本提供了配制在plga-peg-plga三嵌段共聚物中的福奈派德的组合物,其中所述组合物包含:a)浓度为1.3%w/w的福奈派德;b)浓度为19%-19.5%w/w的plga-peg-plga三嵌段共聚物:(i)其中每个plga聚合物嵌段具有1500da-2250da的mw,并且其中peg聚合物嵌段具有1500da的mw;并且(ii)其中所述plga包含50%乳酸(la)和50%乙醇酸(ga)(la:ga比率为43:57);c)浓度为1.7%w/w的dma;和d)浓度为10.5%w/w的peg 400。
99.如本文所公开的组合物的三嵌段聚合物的聚合物组分plga和peg的分子量可以报告为重均分子量(mw)和数均分子量(mn)。为了一致性和清晰性,本文报告的分子量报告为如通过凝胶渗透色谱法(gpc)测量的mn。当通过gpc测量时,聚合物分子量可能基于方法和系统差异而显著变化,所述方法和系统差异包括仪器制造商、柱类型和制造商、试剂、实验室环境和所使用的标准。
100.所述组合物可以具有0.5ml至50ml(或其中的任何整数)的剂量体积。所述组合物可以具有1ml至50ml(或其中的任何整数)的剂量体积。所述组合物可以具有5ml至40ml(或其中的任何整数)的剂量体积。所述组合物可以具有5ml至10ml(或其中的任何整数)的剂量体积。所述组合物可以具有10ml至20ml(或其中的任何整数)的剂量体积。所述组合物可以具有20ml至30ml(或其中的任何整数)的剂量体积。所述组合物可以具有30ml至40ml(或其中的任何整数)的剂量体积。所述组合物的总剂量体积可以是0.5ml。所述组合物的总剂量体积可以是1ml。所述组合物的总剂量体积可以是5ml。所述组合物的总剂量体积可以是10ml。所述组合物的总剂量体积可以是15ml。所述组合物的总剂量体积可以是20ml。所述组合物的总剂量体积可以是25ml。所述组合物的总剂量体积可以是30ml。所述组合物的总剂量体积可以是35ml。所述组合物的总剂量体积可以是40ml。
101.本公开文本提供了配制在pcl-peg-pcl三嵌段共聚物中的福奈派德的组合物。本公开文本提供了配制在pdlla-peg-pdlla三嵌段共聚物中的福奈派德的组合物,所述三嵌
段共聚物与plga-peg-plga相同,其中plga包含100%乳酸(la)和0%乙醇酸(ga)(la:ga比率为100:0)。
102.本公开文本提供了治疗有需要的受试者的术后疼痛的方法,其中所述方法包括在手术之前、过程中或之后向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
103.所述治疗方法可以包括在手术之前向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1分钟至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前15分钟至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前30分钟至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至3小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至2小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前2至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前4至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前6至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1分钟、15分钟、30分钟或者1、2、3、4、5、6、7或8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
104.所述治疗方法可以包括在手术过程中向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
105.所述治疗方法可以包括在手术之后向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1分钟-240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后15分钟-240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后30分钟-240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1-240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1至3小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1至2小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后2至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后4至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后6至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合
物。所述治疗方法可以包括在手术之后8至10小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后10至12小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后12至24小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后24至48小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后48至72小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后72至96小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后96至120小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后120至144小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后144至168小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后168至192小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后192至216小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后216至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之后1分钟、15分钟、30分钟或者1、2、3、4、5、6、7、8、9、10、12、24、48、72、96、120、144、168、192、216或240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
106.所述治疗方法可以包括在手术之前向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1分钟至1小时或1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1分钟至1小时或1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
107.所述治疗方法可以包括在手术之前1至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至3小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至2小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前2至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前4至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前6至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至240小时向所述受试者施用有效量的本公开文本的任何福奈
派德组合物。所述治疗方法可以包括在手术之前1分钟、15分钟、30分钟或者1、3、3、4、5、6、7或8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1分钟、15分钟、30分钟或1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
108.所述治疗方法可以包括在手术之前1分钟至1小时或1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1分钟至1小时或1至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在所述手术之后1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1至3小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1至2小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
109.所述治疗方法可以包括在手术之前1分钟至1小时或1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1分钟至2小时或2至4小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后4至6小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后6至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后8至10小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后10至12小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后12至24小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
110.所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后24至48小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后48至72小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述
治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后71至96小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后96至120小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后122至144小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后144至168小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后168至192小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后192至216小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后216至240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。所述治疗方法可以包括在手术之前1至8小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物,以及在手术之后在所述手术之后1分钟、15分钟、30分钟或者1、2、3、4、5、6、7、8、9、10、12、24、48、72、96、120、144、168、192、216或240小时向所述受试者施用有效量的本公开文本的任何福奈派德组合物。
111.本公开文本提供了治疗有需要的受试者的疼痛的方法,其中所述方法包括向所述受试者施用有效量的本文公开的任何组合物。所述疼痛可以是急性疼痛。所述急性疼痛可以是由于损伤、牙科治疗或分娩或其任何组合中的任一种。术语“急性疼痛”在本文中以其最广泛的含义用于指代持续时间少于6个月、优选少于3个月的疼痛。如熟练技术人员应理解的,急性疼痛可以归因于特定原因(例如损伤、牙科治疗、分娩等),并且通常在特定原因得到治疗后消退。
112.所述治疗方法可以包括向所述受试者施用有效量的本公开文本的任何福奈派德组合物,其中所述有效量诱导镇痛神经阻滞。所述有效量在手术之前诱导镇痛神经阻滞。所述有效量在手术过程中诱导镇痛神经阻滞。所述有效量在手术之后诱导镇痛神经阻滞。所述有效量在损伤之后诱导镇痛神经阻滞。所述有效量在手术之后诱导镇痛神经阻滞。所述有效量在牙科治疗之前诱导镇痛神经阻滞。所述有效量在牙科治疗过程中诱导镇痛神经阻滞。所述有效量在分娩(包括剖腹产,如果需要的话)过程中诱导镇痛神经阻滞。
113.所述镇痛神经阻滞可以是上肢神经阻滞、下肢神经阻滞、面神经阻滞、颈背神经阻滞、胸腹阻滞或其任何组合中的任一种。所述上肢神经阻滞可以是肌间沟神经阻滞、锁骨上神经阻滞、臂丛神经阻滞和锁骨下神经阻滞或其任何组合中的任一种。所述下肢神经阻滞可以是腹下丛神经阻滞、腰丛神经阻滞、股神经阻滞、收肌管神经阻滞、腘窝阻滞和坐骨神经阻滞或其任何组合中的任一种。所述面神经阻滞可以是三叉神经阻滞、眼神经阻滞、眶上神经阻滞、上颌神经阻滞、蝶腭神经阻滞或其任何组合中的任一种。所述颈背神经阻滞可以
是颈椎硬膜外神经阻滞、胸椎硬膜外神经阻滞、腰椎硬膜外神经阻滞、骶管阻滞或其任何组合中的任一种。所述胸腹阻滞可以是椎旁阻滞、肋间和腹横肌平面阻滞、腹直肌鞘阻滞或其任何组合中的任一种。
114.所述手术可以是诊断性手术、消融性手术、姑息性手术、重建性手术、移植手术、建设性手术或其任何组合中的任一种。
115.所述手术可以是上肢手术、下肢手术、腹部手术、心胸手术、头颈手术、背部手术、肌肉骨骼手术、骨科手术、眼科手术、耳鼻喉手术、血管手术、牙科手术或其任何组合中的任一种。
116.所述手术可以是上肢手术和下肢手术或其任何组合中的任一种。所述上肢手术可以是手臂、前臂、手部、腕部、肘部、肩部或其任何组合的手术中的任一种。所述上肢手术可以是所述手臂、前臂、手部、腕部、肘部、肩部或其任何组合的一根或多根骨的手术。所述一根或多根骨可以包括桡骨、尺骨、肱骨、腕骨、掌骨或指骨或其组合中的任一种。
117.所述肘部和肩部手术可以是骨折手术、全肩置换术、反肩置换术、肩关节镜检查、肘关节镜检查、肩袖修复术、网球和高尔夫球肘手术或其任何组合中的任一种。所述手部和腕部手术可以是骨折手术、腕管松解术、腕关节镜检查、腕关节置换术、腕部融合术或其任何组合中的任一种。
118.所述下肢手术是髋部、大腿、膝盖、脚踝、脚部或其任何组合的手术中的任一种。所述下肢手术可以是所述髋部、大腿、膝盖、脚踝、脚部或其任何组合的一根或多根骨的手术。所述一根或多根骨可以包括髋臼、股骨、胫骨、腓骨、髌骨、跗骨、跖骨、足弓或其组合中的任一种。
119.所述下肢手术可以是关节镜检查(观察关节内部的诊断工具和治疗方法)、骨融合术、切开复位骨折固定术、手术切除(即拇囊炎、囊肿、趾甲等)、肌腱和韧带修复术或其任何组合中的任一种。
120.所述腹部手术可以是胃、小肠、脾、阑尾和结肠(或直肠)的手术中的任一种。所述腹部手术可以是阑尾切除术、胆囊切除术、结肠/肛门直肠手术、结肠/大肠切除术、疝气手术、小肠切除术或其任何组合中的任一种。
121.所述心胸手术可以是肺或心脏的手术中的任一种。所述心胸手术可以是呼吸系统、心血管系统或其任何组合的手术中的任一种。所述心胸手术可以是开胸术、叶切除术、肺切除术、肺移植、防止胸膜粘连的手术、防止脓胸的手术、去除胸腔中的血液的手术(特别是在创伤心脏移植之后)、切除引起肺萎缩(气胸)的小气球样组织(气泡)的手术、楔形切除术、主动脉手术、心房颤动手术(混合迷宫手术)、颈动脉内膜切除术、冠状动脉搭桥手术(cabg)、心脏瓣膜修复/置换手术、无需手术的心脏瓣膜置换术、二尖瓣修复术、微创心脏手术、机器人胸科手术或其任何组合中的任一种。
122.所述头颈手术可以是用于神经受压、强烈眩晕和晕动病、脊髓压力、上脊柱问题、头颈损伤、窦痛、慢性耳感染、打鼾和睡眠呼吸暂停、扁桃体问题、颌问题和畸形、甲状腺病症或其任何组合的手术中的任一种。
123.所述背部手术可以是用于矫正或修复脊柱缺陷或损伤的手术。所述背部手术可以是用于矫正或修复椎间盘突出或破裂、椎管狭窄、脊椎前移、椎骨骨折、椎间盘退行性疾病或其任何组合的手术中的任一种。
124.所述骨科手术可以是关节镜检查、软组织修复术、关节置换术、关节翻修手术、骨折修复术、清创术、骨融合术、脊柱融合术、截骨术或其任何组合中的任一种。所述骨科手术可以是膝关节镜检查和半月板切除术、肩关节镜检查和减压术、腕管松解术、膝关节镜检查和软骨成形术、取出支撑植入物、膝关节镜检查和前交叉韧带重建术、膝置换术、股骨颈骨折修复术、转子骨折修复术、髋置换术或其任何组合中的任一种。
125.所述眼部手术可以是眼整形手术、角膜、视网膜和眼肌的手术、屈光手术、青光眼手术或其任何组合中的任一种。
126.所述血管手术可以是主动脉瘤修复术、主动脉腔静脉瘘修复术、主动脉肠道瘘修复术、动静脉瘘手术、动静脉畸形手术、搭桥手术、颈动脉血管成形术和支架置入术、颈动脉支架置入术、颈动脉内膜切除术、腹腔动脉搭桥术、冠状动脉血管成形术和支架置入术、血管内重建术、静脉内激光治疗、离体肾动脉重建术、下腔静脉(ivc)滤器取出术、下腔静脉(ivc)置入术、激光消融、肠系膜动脉搭桥术、开放血管重建术、射频消融、肾动脉血管成形术、肾动脉搭桥术、肾动脉内膜切除术、修复动脉瘤的支架置入术、内镜筋膜下交通支静脉离断手术、胸导管栓塞、胸廓出口减压术、血栓切除术、血管支架置入术、静脉切除、腔静脉重建术、椎动脉重建术或其任何组合中的任一种。
127.所述牙科手术可以是牙髓学、根管手术、根尖切除术、口腔修复手术、正畸手术、牙周手术、口腔和颌面手术或其任何组合中的任一种。
128.所述手术可以属于腹壁、胸壁或其组合中的任一种。所述腹壁的手术可以是用于腹壁重建和修复的手术。所述腹壁的手术可以是用于腹壁疝的手术。
129.所述手术可以是器官的手术。所述器官可以是心脏、肺、肝、脾、脑、胃、小肠、大肠、胆囊、胆管、淋巴管、膀胱、前列腺、胰腺、肾上腺、甲状腺、皮肤、子宫、输卵管、卵巢、精小管、睾丸或其任何组合中的任一种。所述手术可以用于所述器官的修复、切除或移植中的任一种。所述器官手术可以用于从所述器官内或附近切除肿瘤或癌组织。
130.所述手术可以是上肢手术和下肢手术中的任一种。所述手术可以是拇囊炎切除术、全膝关节成形术、前交叉韧带重建术、肩关节成形术(全肩或反肩)、肩袖修复术或其组合中的任一种。
131.所述有需要的受试者可以是将要经历、正在经历或已经经历手术的受试者,可以是人。所述受试者可以是哺乳动物。所述受试者可以是人、鼠科动物、马科动物、犬科动物、猫科动物、兔、猪、仓鼠、牛科动物或骆驼科动物。所述受试者可以是人。
132.可以神经周、硬膜外、皮下、皮内、口服、肌内或静脉内施用所述有效量的所述组合物。可以神经周施用所述有效量的所述配制品。通过直接滴注到手术部位附近的伤口中来施用所述有效量的所述配制品。通过在手术部位渗透来施用所述有效量的所述配制品来施用所述有效量的所述配制品。
133.剂量
134.本公开文本提供了有效量的本公开文本的组合物,其用于控制有需要的受试者的由损伤、伤口或手术引起的疼痛而不实质损害运动功能的方法。控制疼痛可以被定义为以下中的任一种或全部:a)降低疼痛强度,和b)在施用组合物后防止需要施用援救抗疼痛药物或增加到施用援救抗疼痛药物的时间。
135.控制疼痛可以被定义为降低已经经历损伤、伤口或手术的受试者的疼痛强度,如
在数值评定量表(nrs)量表上测量的。用于评估有需要的受试者的疼痛强度的nrs量表是根据定义的11点(0-10)、21点(0-20)和101点(0-100)量表(jensen&karoly2001),其中0分意指“无疼痛”,10、20和100分意指“可想象的最严重的疼痛”,并且在量表上0和最高点之间的得分按升序为轻度至中度疼痛。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在nrs量表上测量的,从在手术/损伤后第0天意指“可想象的最严重的疼痛”的得分降低至在手术/损伤后24小时至7天之间的某个时间意指“无疼痛”的得分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在nrs量表上测量的,从在手术/损伤后第0天意指“可想象的最严重的疼痛”的得分降低至在手术/损伤后24小时至7天之间的某个时间意指“轻度疼痛”的得分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在nrs量表上测量的,从在手术/损伤后第0天意指“可想象的最严重的疼痛”的得分降低至在手术/损伤后24小时至7天之间的某个时间意指“中度疼痛”的得分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在nrs量表上测量的,从在手术/损伤后第0天意指“中度疼痛”的得分降低至在手术/损伤后24小时至7天之间的某个时间意指“轻度疼痛”的得分。
136.如本文所公开的组合物的“有效量”或“治疗有效量”是在向有需要的受试者施用后在所述受试者中减轻或抑制疼痛或者使疼痛可控制的组合物量。如本文所公开的组合物的“有效量”或“治疗有效量”是引起所述有需要的受试者的疼痛强度降低的组合物量,如在11点nrs量表上测量的,从手术/损伤后第0天的10分降低至在手术/损伤后24小时至7天之间的某个时间的0分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在11点nrs量表上测量的,从手术/损伤后第0天的10分降低至在手术/损伤后24小时至7天之间的某个时间的0-5分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在11点nrs量表上测量的,从手术/损伤后第0天的8-10分降低至在手术/损伤后24小时至7天之间的某个时间的5-7分。所述有效量是引起所述有需要的受试者的疼痛强度降低的量,如在11点nrs量表上测量的,从手术/损伤后第0天的6-10分降低至在手术/损伤后24小时至7天之间的某个时间的0-5分。
137.可以通过评估运动强度,特别是膝盖伸展和屈曲、踝背屈和踝跖屈的强度来测量已经经历损伤、伤口或手术的受试者的运动功能的丧失。
138.可以通过确定手术/损伤后所述受试者可以保持不伴随使用抗疼痛药物的时间来评估在施用组合物后防止需要向已经经历损伤、伤口或手术的受试者施用援救抗疼痛药物或增加到向已经经历损伤、伤口或手术的受试者施用援救抗疼痛药物的时间。所述抗疼痛药物可以是阿片类药物。所述阿片类药物可以是羟考酮、吗啡、可待因、芬太尼、氢可酮、哌替啶和美沙酮中的任一种或其组合。如本文所公开的所述组合物的有效量可以是防止在手术/损伤后少于1周需要施用阿片类药物的量。如本文所公开的所述组合物的有效量可以是防止在手术/损伤后少于4周需要施用阿片类药物的量。如本文所公开的组合物的有效量可以是防止在手术/损伤后少于8周需要施用阿片类药物的量。
139.所述治疗方法可以包括向所述有需要的受试者施用有效量的本公开文本的任何福奈派德组合物,其中所述组合物的有效量可以是1-20mg/ml。所述治疗方法可以包括向所述有需要的受试者施用有效量的本公开文本的任何福奈派德组合物,其中所述组合物的有效量可以是1.5-20mg/ml。所述治疗方法可以包括向所述有需要的受试者施用有效量的本
公开文本的任何福奈派德组合物,其中所述福奈派德组合物的有效量可以是2-20mg/ml。所述福奈派德组合物的有效量可以是6-13mg/ml。所述组合物的有效量可以是2-5mg/ml。所述福奈派德组合物的有效量可以是5-10mg/ml。所述福奈派德组合物的有效量可以是10-15mg/ml。所述福奈派德组合物的有效量可以是15-20mg/ml。所述福奈派德组合物的有效量可以是3-6mg/ml。所述福奈派德组合物的有效量可以是6-13mg/ml。所述福奈派德组合物的有效量可以是6.5-13mg/ml。所述福奈派德组合物的有效量可以是10-13mg/ml。所述福奈派德组合物的有效量可以是13-16mg/ml。所述福奈派德组合物的有效量可以是16-19mg/ml。所述福奈派德组合物的有效量可以是19-20mg/ml。所述福奈派德组合物的有效量可以是6.5mg/ml。所述福奈派德组合物的有效量可以是13mg/ml。
140.所述治疗方法可以包括向所述有需要的受试者施用有效量的本公开文本的任何福奈派德组合物,其中所述福奈派德组合物的有效量可以是5-40ml的剂量体积。所述福奈派德组合物的有效量可以是5-10ml的剂量体积。所述福奈派德组合物的有效量可以是10-15ml的剂量体积。所述福奈派德组合物的有效量可以是15-20ml的剂量体积。所述福奈派德组合物的有效量可以是20-25ml的剂量体积。所述福奈派德组合物的有效量可以是25-30ml的剂量体积。所述福奈派德组合物的有效量可以是30-35ml的剂量体积。所述福奈派德组合物的有效量可以是35-40ml的剂量体积。所述福奈派德组合物的有效量可以是10-20ml的剂量体积。所述福奈派德组合物的有效量可以是20-30ml的剂量体积。所述福奈派德组合物的有效量可以是30-40ml的剂量体积。所述福奈派德组合物的有效量可以是5ml的剂量体积。所述福奈派德组合物的有效量可以是10ml的剂量体积。所述福奈派德组合物的有效量可以是20ml的剂量体积。所述福奈派德组合物的有效量可以是30ml的剂量体积。所述福奈派德组合物的有效量可以是40ml的剂量体积。所述福奈派德组合物的有效量可以是6.5mg/ml,10ml剂量体积。所述福奈派德组合物的有效量可以是13mg/ml,20ml剂量体积。
141.本公开文本提供了治疗有需要的受试者的术后疼痛的方法,其中所述受试者可以是哺乳动物。本公开文本提供了治疗有需要的受试者的疼痛的方法,其中所述受试者可以是哺乳动物。所述受试者可以是人、鼠科动物、马科动物、犬科动物、猫科动物、兔、猪、仓鼠、牛科动物或骆驼科动物。所述受试者可以是人。所述人类受试者可以是男性。所述人类受试者可以是女性。
142.可以神经周、硬膜外、皮下、皮内、口服、肌内或静脉内施用所述有效量的福奈派德组合物。可以神经周施用所述有效量的所述配制品。通过直接滴注到手术部位附近的伤口中来施用所述有效量的所述配制品。通过在手术部位渗透来施用所述有效量的所述配制品。
143.超声探头可以用于将所述有效量的福奈派德组合物施用到所述有需要的受试者的手术或损伤部位远端的神经附近的部位,其中靶向神经在超声引导探头的帮助下对手术或损伤部位提供神经支配。
144.本公开文本中提供的结果证明了福奈派德从本文公开的组合物中的一致且延长的释放动力学(图1a)。本公开文本中提供的结果证明,用如本文所公开的组合物处理导致在已经经历手术的受试者中以相对较长的活动持续时间显著增加回缩力(图15a)。在猪中单次神经周注射之后:全身pk曲线证实了福奈派德从所述组合物中的延长的释放(图17a)。
在神经周围的注射部位保持高局部浓度,与镇痛曲线一致(图17b)。本公开文本中提供的结果证明,如本文所公开的组合物局部递送福奈派德(一种优先的nav1.7拮抗剂)持续长达7天。
145.本公开文本中提供的结果证明,本文公开的组合物到注射后36小时提高了手术切口后的回缩阈值,并且到注射后12小时改善了行为得分,与较少疼痛相关行为一致。在施用如本文所公开的组合物的受试者中没有观察到运动活动的损害,在注射后2和24小时总步行距离没有显著变化。在单次施用如本文所公开的组合物之后,在72小时时存在高局部福奈派德浓度。在整个研究中,福奈派德的血浆曲线与缓慢持续释放一致。本文公开的这些结果支持在治疗和控制有需要的受试者的术后疼痛而不实质损害运动功能的方法中使用本文公开的组合物。
146.本公开文本提供了制造本文公开的任何组合物的方法。制造本文公开的任何组合物的所述方法包括:i)合并并溶解:a)一定量的plga-peg-plga三嵌段聚合物;b)一定量的水;c)一定量的福奈派德;d)一定量的极性有机溶剂;和e)一定量的溶解度增强剂,以形成混合物;ii)在1℃-30℃下搅拌(i)的混合物;iii)通过无菌过滤器过滤(ii)的澄清溶液;以及iv)收集并在≤-20℃下冷冻(iii)的过滤溶液。
147.在制造本文公开的任何组合物的所述方法中,然后将福奈派德溶解溶液与所述聚合物溶液合并以在8℃-12℃下搅拌。
148.制造本文公开的任何组合物的所述方法可以包括在步骤i)中:1)在1℃-30℃下将(a)的所述量的plga-peg-plga三嵌段聚合物配混并溶解在(b)的所述量的水中,以形成聚合物溶液;2)在单独的容器中将(c)的所述量的福奈派德溶解在(d)的所述量的极性有机溶剂和(e)的所述量的溶解度增强剂中,以形成福奈派德溶液;以及3)将(2)的福奈派德溶解溶液与(1)的聚合物溶液合并以形成混合物。在制造本文公开的任何组合物的所述方法中,搅拌所述混合物的温度可以是8℃-12℃。
149.在制造本文公开的任何组合物的所述方法中,在与并入无菌填充整理(fill-finish)工艺相容的受控环境条件下进行福奈派德、plga-peg-plga三嵌段聚合物、极性有机溶剂、溶解度增强剂和水的配混和溶解。在制造本文公开的任何组合物的所述方法中,所述无菌过滤器是0.5/0.2μm无菌过滤器。
150.通过以下实施例进一步说明本公开文本,所述实施例不应当被解释为是限制性的。将贯穿本技术引用的所有参考文献、专利和公开的专利申请以及附图的内容出于所有目的都通过引用以其整体并入本文。将在以下实施例中进一步说明本说明书。实施例
151.实施例1:福奈派德-plga-peg-plga三嵌段聚合物配制品(fx301)。
152.配制在plga-peg-plga三嵌段聚合物中的福奈派德的一种配制品(在下文中称为fx301)由1.7%二甲基乙酰胺(dma)+10.5%聚乙二醇400(peg 400)+19.2%聚合物+水构成。在先导配制品中使用的聚合物是1500-1500-1500plga-peg-plga(la:ga 50:50)。在热敏性水凝胶配制品中,福奈派德可以负载高达20mg/ml药物浓度。本文描述了最终fx301配制品的体外释放曲线和在术后猪模型中在施加神经阻滞后获得的api的全身pk曲线(图1)。本文公开的结果表明释放曲线与nav1.7拮抗剂从水凝胶配制品中的受控持续释放一致。这允许高浓度的药物在神经处局部释放,以在比用简单的药物溶液所能达到的更长的时间段
内保持目标覆盖。
153.实施例2:fx301配制品开发和优化概述
154.本文描述了产生指名的配制品的配制品开发和筛选,其集中于聚合物特征、药物负载和加工条件,其中制备和评价了超过100种独特的配制品(表1)。表1:使用福奈派德制备的所有新型凝胶配制品的主表
155.最初的配制工作集中于使用分子量范围为约6kda的三嵌段plga-peg-plga聚合物。由于聚合物的分子量高,因此这些聚合物中的一些仅可溶至多12%-15%。用这些聚合物制备的配制品(如在表2中所总结)导致药物负载不足。其次,如使用体外释放测定表征的这些配制品的药物释放(图2所示)是快速的,并且从配制品获得的体内药物暴露(图3)也是低且短寿命的。表2.初始侦察配制品总结
156.本文公开的来自初始配制品的体外和体内数据的结果表明,增加药物负载量对于实现较高剂量以用于体内研究是必需的。增加配制品中的聚合物浓度以实现较高的药物包封。疏水性稍差的聚合物(如plga-peg-plga(1500-1500-1500,la:ga 50:50),关于聚合物组成和mw详情,参见表3)能够以16%至20%溶解。由于用plga-peg-plga(1500-1500-1500,la:ga 50:50)实现了如此高的聚合物浓度,因此选择plga-peg-plga(1500-1500-1500,la:ga 50:50)作为先导聚合物。为了进一步增加api在配制品内的溶解度,peg 400百分比也增加至约10%。如在表3中所见,使用较高的聚合物浓度和较高的peg 400导致配制品内的药物负载量更高。然而,即使用这些配制品,体外释放曲线(图4)仍然是次优的,并且体内药物
暴露(图5)仍然远低于ic
50
浓度。表3.增加的聚合物浓度导致药物负载量更高
157.为了进一步减缓药物的释放,从配制品中去除聚山梨醇酯80。由于聚山梨醇酯80是表面活性剂和亲水性分子,因此它可能干扰配制品的胶凝过程,从而潜在地引起更快的药物释放。用和不用聚山梨醇酯80制备的配制品总结于表4中。本文公开的体外释放数据的结果表明,不具有聚山梨醇酯80的配制品显示出比含有聚山梨醇酯80的配制品慢得多的体外释放曲线(图6和图7)。虽然来自不具有聚山梨醇酯80的配制品的api的体内暴露显示持续3天的药物暴露,但api的全身水平仍然低于ic
50
浓度(50nm)(图8)。表4.比较具有和不具有聚山梨醇酯80的配制品中的药物负载量
表5.猪pk研究中评价的配制品总结
158.为了进一步增加药物暴露,通过向配制品中添加1.7%dma(二甲基乙酰胺)来增加配制品中的药物负载。dma用实验方法被鉴定为此api的良好药物增溶剂。通过向配制品中添加1.7%dma,药物负载量增加至约1.5%药物负载量。用1.7%dma和10.5%peg 400制备的配制品的药物负载信息示于表6中。本文所述的结果表明,虽然添加dma增加了药物负载量,但它不影响配制品的体外释放(图9所示)。在大鼠pk模型(图10所示)和猪pk模型(图11所示)中评价这些配制品的体内暴露。本文公开的结果表明,对于具有较高药物负载量的配制品,两种pk研究都显示出显著更高的药物暴露。表6.比较具有和不具有dma的配制品中的药物负载量
159.此时,1.7%dma+10.5%peg 400+19.3%聚合物被鉴定为先导配制品。然而,在此配制品中使用的先导聚合物(即plga-peg-plga(1500-1500-1500,la:ga50:50),取决于聚合物的批次)的plga分子量可以变化。这些变化意味着实际mw可能不一定是准确的标称目标分子量。具有稍长plga链的聚合物批次可以具有较高的mw(约5400da),并且具有稍短plga链的聚合物批次将具有稍低的mw(约3600da)。为了理解聚合物mw的正常变化对配制品性能的影响,制备具有高和低mw聚合物的配制品。如在图12中所见,两种mw配制品的体外释
放曲线是相似的。其次,其他产品属性(表7所示)(如药物负载量、胶凝开始和胶凝温度)在配制品之间是相当的。最后,还在大鼠pk研究中筛选配制品的药物暴露和持续时间(图13所示)。本文所述的结果表明,所选择的标称聚合物plga-peg-plga(1500-1500-1500,la:ga 50:50)产生mw分子量范围在3600-5400da内的一致配制品。表7.用低和高mw聚合物制备的配制品的配制品特性总结(*胶凝特性可以取决于流变测量的设置而变化)
160.随着聚合物按比例放大,本文所述的研究表明,存在发现甚至更高mw分子量聚合物适用于fx301的情况。peg嵌段一致地为约1500da,因为这是通过peg起始材料建立的,但是plga侧链长度范围从2050-2450da,这基于用于制备plga-peg-plga三嵌段聚合物的合成途径中的工艺变化。制备聚合物以覆盖此扩展范围,并且制备和评价配制品。这些配制品的特性对于产品性能是可接受的,并且详述于表8中。这些配制品的释放曲线提供于图14中。表8.用较高分子量的聚合物制备的配制品的配制品特性总结(*胶凝特性可以取决于流变测量的设置而变化)
161.在配制品开发过程中也筛选其他聚合物体系,并且将其列于表9中。表9.所评价的所有聚合物的总结
162.本公开文本的结果表明,三嵌段聚合物体系的溶解度以及药物(福奈派德)在聚合物溶液中的溶解度和溶出速率(在配混过程中)取决于以下参数的组合:三嵌段聚合物的每个聚合物嵌段的分子量,三嵌段聚合物的总分子量,以及三嵌段聚合物、药物、溶剂和溶解度增强剂在组合物中的相对最终浓度。本文所述的研究表明了如本文所公开的组合物的具体参数的改变如何影响聚合物溶解度、胶凝温度、药物负载量和药物从如本文所述的组合
物中的体外释放速率。
163.实施例3:fx301在猪的术后疼痛模型中的周围神经阻滞的功效和药代动力学
164.简介
165.将fx301以液体状态注射到周围神经部位附近,并且其在体温下形成包被神经外部以阻滞感觉神经信号的传播的粘性柔软凝胶。本文描述了评价作为坐骨神经阻滞递送的fx301在经验证的猪术后疼痛模型中的功效和药代动力学概况的研究。
166.猪研究产生的数据总结(在手术之前以13mg/ml、10ml总剂量向猪给药)
167.经由超声引导的坐骨神经阻滞递送的fx301在经验证的猪术后疼痛模型中的功效和pk概况的评价
168.将总共18只青年公猪分配到3个研究组中的1个中:媒介物(n=6),fx301(n=6)和脂质体布比卡因(n=6)。用fx301处理另外3只猪,以评价福奈派德的局部和全身暴露。在适应5天后,在超声引导下向猪的坐骨神经附近注射10ml媒介物、fx301(13mg/ml;总剂量130mg)或脂质体布比卡因(13.3mg/ml;总剂量133mg)。在后肢的背侧区通过5cm长的手术切口来诱导术后疼痛。使用在基线以及注射后1、4、8、12、24、36、48和72小时进行的von frey测试和一般行为评分(gbs)评价疼痛。在基线以及注射后2和24小时进行用于自主活动(5min内的总步行距离)的旷场测试。使用单因素方差分析,然后使用tukey检验进行处理组和媒介物组之间的比较;p值《0.05被认为是统计学上显著的。在基线以及注射后1、4、8、12、24、36、48和72小时收集血浆样品以用于pk分析。在基线以及注射后72小时收集注射部位的局部肌肉样品。使用具有串联质谱检测的高效液相色谱法定量血浆和肌肉匀浆样品中的福奈派德。
169.本文所述的来自von frey测试的结果表明,在用具有相对较长的活性持续时间的fx301处理后回缩力增加。与媒介物相比,到注射后8小时,在用fx301或脂质体布比卡因处理的动物中回缩力显著更高(图15a)。本文所述的结果显示了持续到注射后36小时fx301和媒介物处理的动物之间的显著差异;在36小时时,fx301处理的动物的平均
±
sem回缩力显著高于用媒介物或脂质体布比卡因处理的动物(媒介物:0.76
±
0.08g;fx301:7.33
±
1.33g;脂质体布比卡因:2.73
±
1.16g;fx301相比于媒介物p《0.001,并且fx301相比于脂质体布比卡因p《0.01)。本文所述的结果表明,在媒介物处理的动物中gbs得分最高,表明在此组中疼痛和痛苦相关的行为更大。本文所述的结果表明,与媒介物相比,用fx301或脂质体布比卡因处理导致gbs得分到注射后前12小时显著降低(图15b)。本文所述的来自注射后2小时和24小时的用于自主活动的旷场测试的结果表明,用媒介物处理没有导致自主活动的任何改变,如通过5min内的总步行距离所评估的(图15c)。本文所述的结果表明,用fx301处理不显著影响总步行距离;尽管在注射后2小时观察到总步行距离的减少,但与基线或媒介物相比,这在统计学上是不显著的。在注射后24小时,在fx301处理的动物中总步行距离的减少不明显。相比之下,在注射后2小时和24小时,与基线相比,用脂质体布比卡因处理的动物经历了总步行距离的显著减少。
170.本文所述的结果表明,平均血浆c
max
为68.58ng/ml,并且相应的平均t
max
为28.00小时(表10)。平均auc
last
(从时间零到最后可定量浓度的平均auc)和auc
inf
(从时间零到无穷大的auc)分别为2462h
·
ng/ml和2634h
·
ng/ml。到注射后72小时保持高血浆浓度(图16)。在注射后72小时,在每只动物的肌肉中测量到的fx301浓度为606,629.60ng/g、1176.99ng/
g和5001.73ng/g。在注射后72小时,在肌肉中测量到的福奈派德平均浓度为204,269.4ng/g。表10.福奈派德血浆pk参数总结[临时申请的表7]auc
inf
,从时间零到无穷大的浓度时间曲线下面积;auc
last
,从时间零到最后可定量浓度的浓度时间曲线下面积;c
max
,最大血浆浓度;na,不适用;sd,标准差;t
1/2
,终末半衰期;t
max
,达到最大血浆浓度的时间。
[0171]
本文所述的结果表明,fx301到注射后36小时提高了手术切口后的回缩阈值,并且到注射后12小时改善了行为得分,与较少疼痛相关行为一致。在fx301的情况下没有观察到运动活动的损害,在注射后2和24小时总步行距离没有显著变化。在单次施用fx301之后,在72小时时存在高局部福奈派德浓度。在整个研究中,福奈派德的血浆曲线与药物的受控且持续的释放保持一致。这些结果支持fx301的开发以及将其用于术后疼痛。
[0172]
实施例4:用fx301处理的动物中全身和局部福奈派德浓度
[0173]
体外药物释放曲线表明了福奈派德从水凝胶配制品中的一致且延长的释放动力学(图1a)。本文所述的结果表明,在猪中单次神经周注射之后,全身pk曲线证实了从新型配制品中的延长释放(图17a)。在神经周围的注射部位保持高局部浓度,与镇痛曲线一致(图17b)。这些数据表明,fx301局部递送福奈派德(一种优先的nav1.7拮抗剂)持续长达7天。
[0174]
本文所述的结果表明,如本文所公开的三嵌段plga-peg-plga聚合物中的福奈派德的组合物提供了福奈派德的一致且延长的释放,这导致福奈派德的高局部浓度持续延长的时间段。本文所述的结果表明,如本文所公开的三嵌段plga-peg-plga聚合物中的福奈派德的组合物的处理导致回缩力的显著改善、指示疼痛和紧张行为减少的gbs得分的降低以及运动功能的保留。本文公开的这些结果支持在治疗和控制有需要的受试者的术后疼痛的方法中使用本公开文本的组合物。
[0175]
实施例5:fx301药品(dp)制造工艺
[0176]
本文描述了用于制造本公开文本的配制在plga-peg-plga三嵌段聚合物中的福奈派德的组合物的方法。fx301dp是一种无菌可注射溶液,其由配制在19%-25%(w/w)plga-peg-plga(1500-1500-1500da,la:ga 50:50)中的0.5%至1.5%(w/v)福奈派德、1%-2%(w/w)dma、10%-11%(w/w)peg 400和水组成。dma和peg 400用作药物增溶剂,它们将ds(福奈派德)从其结晶形式溶解。plga-peg-plga是一种功能性赋形剂,同原料药的胶束包封和热敏性水凝胶的形成相比,其在注射部位赋予延长的释放和物理持续时间。描绘配制过程的流程图提供于图18中。这允许注射低粘度溶液,类似于当前的周围神经阻滞施用程序,其然后在注射到体内后快速转变为凝胶贮库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1