用于治疗干性年龄相关性黄斑变性(AMD)或继发于干性AMD的地图样萎缩的抗C5剂的制作方法
用于治疗干性年龄相关性黄斑变性(amd)或继发于干性amd的地图样萎缩的抗c5剂
技术领域
1.本发明涉及适用于患有干性年龄相关性黄斑变性或继发于干性年龄相关性黄斑变性的地图样萎缩的对象的方法和组合物。所述方法涉及施用有效量的抗c5剂。
背景技术:
2.年龄相关性黄斑变性(“amd”)是一种以黄斑(视网膜中央部分的小区域)中的进行性变性异常为特征的疾病。amd典型地为老年人的疾病并且为发达国家中年龄》50岁的个体失明的主要原因。在美国,据估计约6%的年龄为65-74岁的个体和20%的年龄大于75岁的个体患有amd。由于在发达国家和发展中国家中预期寿命增加,在未来几十年中总人口中老年人部分预期以最大速率增加。在不存在充足的预防或治疗手段的情况下,具有视觉损失的amd病例的数目预期与老年人口并行增长。
3.amd被归类到两个一般亚组之一;非新生血管(“干性”)形式的疾病(“干性amd”)和新生血管形式的疾病(“湿性amd”)。干性amd更为普遍,占所有amd病例的约90%。其特征为黄斑的变性,并且在经多年持续进展的情况下,可能最终导致与中央视觉损失相关的中央视网膜萎缩。相比之下,湿性amd虽然不太普遍,但更可能引起突然的(常常为相当大的)中央视觉损失。
4.干性amd为中度和重度中央视觉损失的重要原因并且在大多数患者中为双侧的。在干性amd中,黄斑中的视网膜色素上皮细胞(rpe)变薄与相邻视网膜组织层的其他年龄相关性变化一起发展。干性amd的特征为存在位于rpe下的脉络膜小疣(黄斑内发展的黄色结晶沉淀)。当疾患严重时,干性amd使得黄斑明显变薄和/或萎缩,这是由于rpe和相关毛细管(脉络膜毛细血管)的损失。这种形式的晚期干性amd与位于患病rpe上的神经视网膜的变薄和功能损失相关。晚期干性amd中的这种集合表型称为地图样萎缩(“ga”)。ga中的光敏感光细胞的进行性变性导致患病眼睛的严重视觉损失。此外,干性amd可进展为疾病的湿性形式。
5.虽然干性amd为疾病的最常见形式,但目前不存在被批准的疗法。不存在针对干性amd的治疗选择代表一个急迫的未满足的医学需要的领域,以及关于快速增加的老年人口的主要公众健康担忧。
技术实现要素:
6.本发明的方面涉及治疗患有干性amd的对象或治疗患有继发于干性amd的ga的对象的方法。本发明的方面还涉及治疗患有继发于amd的ga的对象的方法。
7.本发明的方面涉及降低患有继发于干性amd的ga的对象中ga生长的速率或降低患有继发于干性amd的ga的对象中的ga面积变化率的方法。
8.本发明的方面还涉及减慢或抑制有需要的对象的干性amd的进展的方法,或减慢或抑制有需要的对象的ga的进展的方法。
9.另外,本发明的方面涉及减慢或抑制患有干性amd的对象或患有继发于干性amd的ga的对象的视敏度损失的方法,或逆转患有干性amd的对象或患有继发于干性amd的ga的对象的视敏度损失的方法。
10.此外,本发明的方面涉及减慢或抑制患有干性amd的对象或患有继发于干性amd的ga的对象的低亮度视敏度损失的方法,或逆转患有干性amd的对象或患有继发于干性amd的ga的对象的低亮度视敏度损失的方法。
11.本发明的方面涉及减少对象中脉络膜小疣的形成或降低对象中脉络膜小疣的形成速率或逆转对象中脉络膜小疣的形成的方法。本发明的其他方面涉及降低对象中脉络膜小疣的量的方法。对象可患有干性amd。
12.本发明的方法包括向对象施用包含c5特异性适体的抗c5剂,其中适体具有fcmgfcfcgfcmgmgfufcfufcmamgmgfcgfcfumgmamgfufcfumgmamgfufufuafcfcfumgfcmg-3t(seq id no:1)的序列,其中fc和fu=2’氟核苷酸、mg和ma=2
’‑
ome核苷酸,所有其他核苷酸为2
’‑
oh,并且3t指示反向脱氧胸苷。
附图说明
13.参见以下具体实施方式,具体实施方式阐述了说明性实施方案和附图,其中:
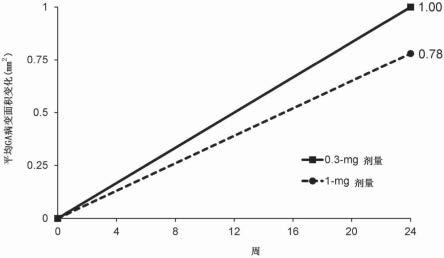
14.图1示出了展示如实施例1中所阐述在24周时测量并且从第0周至第24周每月用0.3-mg或1-mg剂量的arc1905处理的干性amd患者中的平均ga病变面积变化的图。
15.图2示出了展示如实施例1中所阐述在24周和48周时测量并且从第0周至第48周每月用0.3-mg或1-mg剂量的arc1905处理的干性amd患者中的平均ga病变面积变化的图。
16.图3示出了展示如实施例2中所阐述,在6个月和12个月时测量并且用2-mg剂量的arc1905或假治疗处理的干性amd患者中,基于mrm模型,平方根ga病变面积相较于基线的最小二乘均值变化的图。
17.图4示出了展示如实施例2中所阐述,在6个月和12个月时测量并且用4-mg剂量的arc1905或假治疗处理的干性amd患者中,基于mrm模型,平方根ga病变面积相较于基线的最小二乘均值变化的图。
18.图5示出了展示如实施例2中所阐述,在6个月和12个月时测量并且用2-mg剂量的arc1905或假治疗处理的干性amd患者中,基于mrm模型,非平方根ga病变面积相较于基线的最小二乘均值变化的图。
19.图6示出了展示如实施例2中所阐述,在6个月和12个月时测量并且用4-mg剂量的arc1905或假治疗处理的干性amd患者中,基于mrm模型,非平方根ga病变面积相较于基线的最小二乘均值变化的图。
具体实施方式
20.本发明涉及适用于患有干性amd的对象以及患有继发于干性amd的ga的对象以及患有继发于amd的ga的对象的方法和组合物。所述方法包括向有需要的对象施用抗c5剂。
21.抗c5剂
22.术语“抗c5剂”是指降低、或部分或完全抑制c5补体蛋白或其变体的活性或产生的药剂。抗c5剂可直接或间接降低或抑制c5补体蛋白或其变体的活性或产生。抗c5剂可降低
或抑制c5补体蛋白转化为其组分多肽c5a和c5b。抗c5剂还可降低或抑制c5a和/或c5b的活性或产生。
23.在本发明的实施方案中,抗c5剂包含c5特异性适体,其中适体包含fcmgfcfcgfcmgmgfufcfufcmamgmgfcgfcfumgmamgfufcfumgmamgfufufuafcfcfumgfcmg-3t(seq id no:1)的核苷酸序列,其中fc和fu=2’氟核苷酸,mg和ma=2
’‑
ome核苷酸,所有其他核苷酸为2
’‑
oh,并且3t指示反向脱氧胸苷。
24.在一些实施方案中,适体可经由接头缀合至聚乙二醇部分(peg)。peg部分可具有大于约10kda的分子量,诸如约20kda、或约30kda、或约40kda、或约50kda、或约60kda的分子量。在一些实施方案中,peg部分经由接头结合至适体的5’端。在某些实施方案中,缀合至5’端的peg部分为约40kda分子量的peg部分。在特定实施方案中,约40kda peg部分为支链peg部分。支链约40kda peg部分可为例如1,3-双(mpeg-[约20kda])-丙基-2-(4
’‑
丁酰胺),或2,3-双(mpeg-[约20kda])-丙基-1-氨甲酰基。
[0025]
在某些实施方案中,适体为具有以下结构的化合物arc187或其药学上可接受的盐:
[0026][0027]
其中适体=fcmgfcfcgfcmgmgfufcfufcmamgmgfcgfcfumgmamgfufcfumgmamgfufufuafcfcfumgfcmg-3t(seq id no:1),其中fc和fu=2
’‑
氟核苷酸,mg和ma=2
’‑
ome核苷酸,所有其他核苷酸为2
’‑
oh,并且其中3t指示反向脱氧胸苷。在一些实施方案中,以上结构的各个20kda mpeg具有约20kda的分子量。
[0028]
在某些实施方案中,适体为具有以下所阐述的结构的化合物arc1905或其药学上可接受的盐:
[0029][0030]
其中适体=fcmgfcfcgfcmgmgfufcfufcmamgmgfcgfcfumgmamgfufcfumgmamgfufufuafcfcfumgfcmg-3t(seq id no:1),其中fc和fu=2
’‑
氟核苷酸,mg和ma=2
’‑
ome核苷酸,所有其他核苷酸为2
’‑
oh,并且其中3t指示反向脱氧胸苷。在一些实施方案中,以上结构的各个20kda mpeg具有约20kda的分子量。
[0031]
药学上可接受的盐的实例包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、丹宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、蔗糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲烷磺酸盐、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐、樟脑磺酸盐、双羟萘酸盐、苯基乙酸盐、三氟乙酸盐、丙烯酸盐、氯苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、甲基苯甲酸盐、邻乙酰氧基苯甲酸盐、萘-2-苯甲酸盐、异丁酸盐、苯基丁酸盐、α-羟基丁酸盐、丁炔-1,4-二甲酸盐、己炔-1,4-二甲酸盐、癸酸盐、辛酸盐、肉桂酸盐、乙醇酸盐、庚酸盐、马尿酸盐、苹果酸盐、羟基马来酸盐、丙二酸盐、苦杏仁酸盐、甲磺酸盐、烟酸盐、邻苯二
甲酸盐、对苯二酸盐、丙炔酸盐、丙酸盐、苯基丙酸盐、癸二酸盐、辛二酸盐、对溴苯磺酸盐、氯苯磺酸盐、乙磺酸盐、2-羟基乙磺酸盐、甲磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、萘-1,5-磺酸盐、二甲苯磺酸盐以及酒石酸盐。术语“药学上可接受的盐”包括但不限于本发明的化合物的水合物,并且还可指本发明的拮抗剂的盐,其具有酸性官能团(诸如但不限于羧酸官能团或磷酸氢盐官能团),以及碱。合适的碱包括但不限于诸如钠、钾以及锂等碱金属的氢氧化物;诸如钙和镁等碱土金属的氢氧化物;诸如铝和锌等其他金属的氢氧化物;氨和有机胺,诸如未取代或羟基取代的单烷基、二烷基或三烷基胺、双环己胺;三丁胺;吡啶;n-甲基、n-乙胺;二乙胺;三乙胺;单(2-oh-低级烷基胺)、双(2-oh-低级烷基胺)或三(2-oh-低级烷基胺),诸如单(2-羟乙基)胺、双(2-羟乙基)胺或三(2-羟乙基)胺、2-羟基-叔丁胺或三(羟甲基)甲胺;n,n-二-低级烷基-n-(羟基-低级烷基)-胺,诸如n,n-二甲基-n-(2-羟乙基)胺或三-(2-羟乙基)胺;n-甲基-d-葡糖胺;以及氨基酸,诸如精氨酸、赖氨酸等。
[0032]
使用抗c5剂的方法
[0033]
在一个方面中,本发明涉及治疗患有干性amd的对象的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转干性amd的进展。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转干性amd的一种或多种症状,包括但不限于视物扭曲、中央视觉降低、需要更大的亮度、难以适应低亮度、模糊增加以及色彩强度或亮度降低。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转与干性amd相关的组织水平或细胞水平改变中的一者或多者,包括但不限于黄斑中的rpe细胞变薄、rpe下形成脉络膜小疣以及黄斑变薄和/或萎缩。
[0034]
在一个方面中,本发明涉及治疗患有继发于干性amd的ga的对象的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转ga的进展。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转继发于干性amd的ga的一种或多种症状,包括但不限于中央视觉降低或损失、视敏度损失以及阅读能力降低或不能阅读。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转与继发于干性amd的ga相关的组织水平或细胞水平改变中的一者或多者,包括但不限于ga病变的生长、ga病变生长或改变的速率以及rpe下脉络膜小疣的形成。
[0035]
在一个方面中,本发明涉及治疗患有继发于amd的ga的对象的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转ga的进展。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转继发于amd的ga的一种或多种症状,包括但不限于中央视觉降低或损失、视敏度损失以及阅读能力降低或不能阅读。在一些实施方案中,施用抗c5剂可降低、抑制、减慢和/或逆转与继发于amd的ga相关的组织水平或细胞水平改变中的一者或多者,包括但不限于ga病变的生长、ga病变生长或改变的速率以及rpe下脉络膜小疣的形成。
[0036]
在一个方面中,本发明涉及降低患有继发于干性amd的ga的对象中ga生长的速率的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使ga生长的速率降低至少或约5%、至少或约10%、至少或约15%、至少或约20%、至少或约25%、至少或约30%、至少或约35%、至少或约40%、至少或约45%或至少或约50%。此类ga生长速率降低可以是在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7
个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月的时间段之后。
[0037]
在一个方面中,本发明涉及降低患有继发于amd的ga的对象中ga生长的速率的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使ga生长的速率降低至少或约5%、至少或约10%、至少或约15%、至少或约20%、至少或约25%、至少或约30%、至少或约35%、至少或约40%、至少或约45%或至少或约50%。此类ga生长速率降低可以是在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月的时间段之后。
[0038]
在一个方面中,本发明涉及降低患有继发于干性amd的ga的对象中的ga面积变化率的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使ga面积变化率降低至少或约5%、至少或约10%、至少或约15%、至少或约20%、至少或约25%、至少或约30%、至少或约35%、至少或约40%、至少或约45%或至少或约50%。此类ga面积变化率降低可以是在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月的时间段之后。
[0039]
在一个方面中,本发明涉及降低患有继发于amd的ga的对象中的ga面积变化率的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使ga面积变化率降低至少或约5%、至少或约10%、至少或约15%、至少或约20%、至少或约25%、至少或约30%、至少或约35%、至少或约40%、至少或约45%或至少或约50%。此类ga面积变化率降低可以是在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月的时间段之后。
[0040]
在一个方面中,本发明涉及减慢或抑制对象中干性amd的进展的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,施用抗c5剂可减慢或抑制干性amd的一种或多种症状的进展,包括但不限于视物扭曲、中央视觉降低、需要更大的亮度、难以适应低亮度、模糊增加以及色彩强度或亮度降低。在一些实施方案中,施用抗c5剂可减慢或抑制与干性amd相关的组织水平或细胞水平改变中的一者或多者的进展,包括但不限于黄斑中的rpe细胞变薄、rpe下形成脉络膜小疣以及黄斑变薄和/或萎缩。
[0041]
在一个方面中,本发明涉及减慢或抑制对象中ga的进展的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,施用抗c5剂可减慢或抑制继发于干性amd或amd的ga的一种或多种症状的进展,包括但不限于中央视觉降低或损失、视敏度损失以及阅读能力降低或不能阅读。在一些实施方案中,施用抗c5剂可减慢或抑制与继发于干性amd或amd的ga相关的组织水平或细胞水平改变中的一者或多者的进展,包括但不限于ga病变的生长、ga病变生长或改变的速率以及rpe下脉络膜小疣的形成。
[0042]
在一个方面中,本发明涉及减慢或抑制患有干性amd对象的视敏度损失的方法,所
述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制最佳矫正视敏度(使用糖尿病性视网膜病变早期治疗研究(early treatment of diabetic retinopathy study,etdrs)字母测量)的降低。此类降低可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0043]
在一个方面中,本发明涉及减慢或抑制患有继发于干性amd的ga的对象的视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制最佳矫正视敏度(使用etdrs字母测量)的降低。此类改变可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0044]
在一个方面中,本发明涉及减慢或抑制患有继发于amd的ga的对象的视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制最佳矫正视敏度(使用etdrs字母测量)的降低。此类改变可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0045]
在一个方面中,本发明涉及逆转患有干性amd的对象的视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0046]
在一个方面中,本发明涉及逆转患有继发于干性amd的ga的对象的视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0047]
在一个方面中,本发明涉及逆转患有继发于amd的ga的对象的视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至
少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0048]
在一个方面中,本发明涉及减慢或抑制患有干性amd的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制低亮度最佳矫正视敏度(使用etdrs字母测量)的降低。此类降低可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0049]
在一个方面中,本发明涉及减慢或抑制患有继发于干性amd的ga的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制低亮度最佳矫正视敏度(使用etdrs字母测量)的降低。此类降低可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0050]
在一个方面中,本发明涉及减慢或抑制患有继发于amd的ga的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减慢或抑制低亮度最佳矫正视敏度(使用etdrs字母测量)的降低。此类降低可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0051]
在一个方面中,本发明涉及逆转患有干性amd的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使低亮度最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0052]
在一个方面中,本发明涉及逆转患有继发于干性amd的ga的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可使低亮度最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0053]
在一个方面中,本发明涉及逆转患有继发于amd的ga的对象的低亮度视敏度损失的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗
c5剂的对象中相比,向对象施用抗c5剂可使低亮度最佳矫正视敏度(使用etdrs字母测量)增加。此类增加可在基线与至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之间测量。
[0054]
在一个方面中,本发明涉及减少对象中脉络膜小疣的形成的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可减少脉络膜小疣的形成。脉络膜小疣的形成的减少可通过测量在一段时间之后,诸如在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之后视网膜下形成多少脉络膜小疣来确定。
[0055]
在一个方面中,本发明涉及降低对象中脉络膜小疣的形成速率的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可降低脉络膜小疣的形成速率。脉络膜小疣的形成速率的降低可通过测量历经一段时间,诸如在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之后视网膜下形成多少脉络膜小疣来确定。
[0056]
在一个方面中,本发明涉及逆转对象中脉络膜小疣的形成的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可逆转脉络膜小疣的形成。脉络膜小疣的形成的逆转可通过测量在一段时间之后,诸如在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之后视网膜下形成多少脉络膜小疣来确定。
[0057]
在一个方面中,本发明涉及降低对象中脉络膜小疣的量的方法,所述方法包括向对象施用如本文所描述的抗c5剂。在一些实施方案中,与未施用抗c5剂的对象中相比,向对象施用抗c5剂可降低脉络膜小疣的量。脉络膜小疣的形成的逆转可通过测量在一段时间之后,诸如在至少或约1个月、至少或约2个月、至少或约3个月、至少或约4个月、至少或约5个月、至少或约6个月、至少或约7个月、至少或约8个月、至少或约9个月、至少或约10个月、至少或约11个月、至少或约12个月、至少或约15个月、至少或约18个月或至少或约24个月之后视网膜下存在多少脉络膜小疣来确定。
[0058]
在一些实施方案中,使用etdrs字母的测量可如糖尿病性视网膜病变早期治疗研究组(etdrs),操作手册(manual of operations),baltimore:etdrs coordinating center,university of maryland中所描述。可获自:national technical information service,5285port royal road,springfield,va 22161;登录号pb8s 223006/as;ferris等,am j ophthalmol 94:91-96,1982;或如本文所描述的实施例4。在一些实施方案中,视觉测试使用从http://www.nei.nih.gov/photo/keyword.asp?conditions=eye+charts&
matc h=all可获得的一种或多种图表,例如etdrs视敏度图表1、2和/或r。
[0059]
在一些实施方案中,本文所描述的方法可还包括诸如通过确定对象是否患有干性amd、患有继发于干性amd的ga或患有继发于amd的ga来鉴定要治疗的对象。
[0060]
在一些实施方案中,对象可为哺乳动物,所述哺乳动物包括但不限于人、猴、奶牛、猪、绵羊、马、狗、猫、兔、大鼠以及小鼠。在某些实施方案中,对象为人。
[0061]
在一些实施方案中,对象可为未进行治疗的,例如先前未针对干性amd、继发于干性amd的ga或继发于amd的ga进行治疗。
[0062]
用于治疗性或预防性施用的组合物
[0063]
抗c5剂可作为还包含药学上可接受的载体或媒介物的组合物(例如药物组合物)的组分施用。举例来说,抗c5剂可与合适的载体物质混合,并且通常以按重量计占组合物总重量1-95%的量存在。可以适合于注射,特别是适合于直接注射于眼睛中(例如玻璃体内注射)的剂型提供组合物。组合物可呈例如悬浮液、乳液或溶液的形式。
[0064]
用于注射的制剂包括无菌水溶液或非水溶液、悬浮液或乳液。可使用多种水性载体,例如水、缓冲水、盐水等。此类制剂还可含有赋形剂,诸如防腐剂、润湿剂、缓冲剂、乳化剂、分散剂以及悬浮剂。
[0065]
在一些实施方案中,用于包含抗c5剂的组合物的赋形剂包括但不限于缓冲剂、非离子表面活性剂、防腐剂、张力剂、糖、氨基酸以及ph调节剂。合适的缓冲剂包括但不限于磷酸二氢钠、磷酸氢二钠以及乙酸钠。合适的非离子表面活性剂包括但不限于聚氧乙烯脱水山梨醇脂肪酸酯,诸如聚山梨醇酯20和聚山梨醇酯80。合适的防腐剂包括但不限于苯甲醇。合适的张力剂包括但不限于氯化钠、甘露糖醇以及山梨糖醇。合适的糖包括但不限于α,α-海藻糖。合适的氨基酸包括但不限于甘氨酸和组氨酸。合适的ph调节剂包括但不限于盐酸、乙酸以及氢氧化钠。在一些实施方案中,一种或多种ph调节剂以有效提供约3至约8、约6至约8、约6.5至约8、约4至约7、约5至约6、约6至约7或约7至约7.5的ph值的量存在。在某些实施方案中,所述一种或多种ph调节剂以有效提供约6.8至约7.8的ph值的量存在。在一些实施方案中,组合物不包含防腐剂。在一些实施方案中,组合物不包含抗微生物剂。在一些实施方案中,组合物不包含抑菌剂。
[0066]
在某些实施方案中,组合物包含氯化钠、磷酸二氢钠(单水合物)以及磷酸氢二钠(七水合物),其中组合物的ph值为约6.8至约7.8。
[0067]
在一些实施方案中,组合物中抗c5剂的浓度为约0.5mg/ml至约100mg/ml。在一些实施方案中,组合物中抗c5剂的浓度为小于或约100mg/ml、小于约50mg/ml、小于约40mg/ml、小于约30mg/ml、小于约25mg/ml、小于约20mg/ml、小于约15mg/ml、小于约10mg/ml或小于约5mg/ml。在某些实施方案中,组合物中抗c5剂的浓度为约0.3mg/ml至约100mg/ml、约0.3mg/ml至约50mg/ml、约1mg/ml至约50mg/ml、约5mg/ml至约40mg/ml、约10至约30mg/ml、约15mg/ml至约25mg/ml、约1mg/ml、约5mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约30mg/ml、约35mg/ml、约40mg/ml、约45mg/ml或约50mg/ml。在特定实施方案中,组合物中抗c5剂的浓度为约20mg/ml。
[0068]
施用和剂量
[0069]
用于向眼睛施用的抗c5剂的剂量可为每只眼睛约0.5mg至每只眼睛约5mg,或每只眼睛约1mg至约4mg,或每只眼睛约2mg至每只眼睛约4mg、每只眼睛约1mg,或每只眼睛约
2mg,或每只眼睛约3mg,或每只眼睛约4mg。抗c5剂可经眼施用,例如通过玻璃体内注射来施用。抗c5剂可每周一次、每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每10周一次、每11周一次或每12周一次进行施用。剂量可每月一次、每两个月一次(即,每隔一个月一次)、每三个月一次、每四个月一次、每五个月一次或每六个月一次进行施用。在某些实施方案中,剂量每月一次进行施用。
[0070]
在本发明的实施方案中,可按包括加载阶段和维护阶段的给药方案施用抗c5剂。在一些实施方案中,与维护阶段相比,加载阶段可包括以不同剂量、以不同频率或它们的组合施用抗c5剂。举例来说,加载阶段可包括以每只眼睛约0.5mg或每只眼睛约1mg或每只眼睛约2mg或每只眼睛约3mg或每只眼睛约4mg的剂量施用抗c5剂;而维护阶段可包括以等于或大于加载阶段的抗c5剂的剂量的一定百分比的剂量施用抗c5剂,诸如加载阶段的抗c5剂的剂量的约10%,或约20%,或约25%,或约30%,或约33%,或约40%,或约50%,或约60%,或约67%,或约70%,或约75%,或约80%,或约90%,或约100%,或约125%,或约150%,或约175%,或约200%,或约225%,或约250%,或约275%,或约300%,或约325%,或约350%,或约375%,或约400%。或者或此外,加载阶段可包括以剂量之间的持续时间为一周、两周、三周、四周、一个月、五周、六周、七周、八周、两个月、九周、10周、11周、12周、三个月、四个月、五个月或六个月的频率施用抗c5剂;而维护阶段可包括以剂量之间的持续时间为等于或大于加载阶段的剂量之间的持续时间的一定百分比的频率施用抗c5剂,诸如加载阶段的剂量之间的持续时间的约10%,或约20%,或约25%,或约30%,或约33%,或约40%,或约50%,或约60%,或约67%,或约70%,或约75%,或约80%,或约90%,或约100%,或约125%,或约150%,或约175%,或约200%,或约225%,或约250%,或约275%,或约300%,或约325%,或约350%,或约375%,或约400%。在一些实施方案中,加载阶段可持续约1周、约2周、约3周、约4周、约1个月、约五周、约六周、约七周、约八周、约2个月、约九周、约10周、约11周、约12周、约3个月、约4个月、约6个月、约8个月、约9个月、约12个月、约15个月、约18个月、约21个月或约24个月的持续时间;而维护阶段可在加载阶段结束时开始。
[0071]
在某些实施方案中,可按依次包括加载阶段和维护阶段的给药方案施用抗c5剂,加载阶段包括每只眼睛约2mg的剂量,每月施用一次,持续一年的持续时间,维护阶段包括每只眼睛约2mg的剂量,每两个月施用一次。在某些实施方案中,可按依次包括加载阶段和维护阶段的给药方案施用抗c5剂,加载阶段包括每只眼睛约4mg的剂量,每月施用一次,持续一年的持续时间,维护阶段包括每只眼睛约2mg的剂量,每月施用一次。在某些实施方案中,可按依次包括加载阶段和维护阶段的给药方案施用抗c5剂,给药方案包括每只眼睛约2mg的剂量,每月施用一次,持续约6个月的持续时间,维护阶段包括每只眼睛约2mg的剂量,每两个月施用一次。
[0072]
向对象施用的包含抗c5剂的组合物的量可在每只眼睛施用约0.01ml至约0.2ml、或每只眼睛施用约0.03ml至约0.15ml、或每只眼睛施用约0.05ml至约0.10ml范围内。
[0073]
在一些实施方案中,对象可每只眼睛接受较低剂量的超过一次注射。举例来说,对象可接受2-mg剂量的两次注射,而不是单个4-mg剂量。
[0074]
本发明的其他方面
[0075]
在一些实施方案中,本发明涉及用于以下用途的如本文所描述的抗c5剂:治疗患有干性amd的对象;治疗患有继发于干性amd的ga的对象;治疗患有继发于amd的ga的对象;
降低患有继发于干性amd的ga的对象中ga生长的速率;降低患有继发于amd的ga的对象中ga生长的速率;降低患有继发于干性amd的ga的对象中的ga面积变化率;降低患有继发于amd的ga的对象中的ga面积变化率;减慢或抑制有需要的对象中干性amd的进展;减慢或抑制有需要的对象中ga的进展;减慢或抑制患有干性amd的对象的视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的视敏度损失;减慢或抑制患有继发于amd的ga的对象的视敏度损失;逆转患有干性amd的对象的视敏度损失;逆转患有继发于干性amd的ga的对象的视敏度损失;逆转患有继发于amd的ga的对象的视敏度损失;减慢或抑制患有干性amd的对象的低亮度视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的低亮度视敏度损失;减慢或抑制患有继发于amd的ga的对象的低亮度视敏度损失;逆转患有干性amd的对象的低亮度视敏度损失;逆转患有继发于干性amd的ga的对象的低亮度视敏度损失;逆转患有继发于amd的ga的对象的低亮度视敏度损失;减少对象中脉络膜小疣的形成;降低对象中脉络膜小疣的形成速率;逆转对象中脉络膜小疣的形成;或降低对象中脉络膜小疣的量。此类用途根据本文所描述的本发明方法来执行。
[0076]
在一些实施方案中,本发明涉及如本文所描述的抗c5剂用于以下的用途:治疗患有干性amd的对象;治疗患有继发于干性amd的ga的对象;治疗患有继发于amd的ga的对象;降低患有继发于干性amd的ga的对象中ga生长的速率;降低患有继发于amd的ga的对象中ga生长的速率;降低患有继发于干性amd的ga的对象中的ga面积变化率;降低患有继发于amd的ga的对象中的ga面积变化率;减慢或抑制有需要的对象中干性amd的进展;减慢或抑制有需要的对象中ga的进展;减慢或抑制患有干性amd的对象的视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的视敏度损失;减慢或抑制患有继发于amd的ga的对象的视敏度损失;逆转患有干性amd的对象的视敏度损失;逆转患有继发于干性amd的ga的对象的视敏度损失;逆转患有继发于amd的ga的对象的视敏度损失;减慢或抑制患有干性amd的对象的低亮度视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的低亮度视敏度损失;减慢或抑制患有继发于amd的ga的对象的低亮度视敏度损失;逆转患有干性amd的对象的低亮度视敏度损失;逆转患有继发于干性amd的ga的对象的低亮度视敏度损失;逆转患有继发于amd的ga的对象的低亮度视敏度损失;减少对象中脉络膜小疣的形成;降低对象中脉络膜小疣的形成速率;逆转对象中脉络膜小疣的形成;或降低对象中脉络膜小疣的量。此类用途根据本文所描述的本发明方法来执行。
[0077]
在一些实施方案中,本发明涉及抗c5剂在药物制造中的用途,所述药物用于:治疗患有干性amd的对象;治疗患有继发于干性amd的ga的对象;治疗患有继发于amd的ga的对象;降低患有继发于干性amd的ga的对象中ga生长的速率;降低患有继发于amd的ga的对象中ga生长的速率;降低患有继发于干性amd的ga的对象中的ga面积变化率;降低患有继发于amd的ga的对象中的ga面积变化率;减慢或抑制有需要的对象中干性amd的进展;减慢或抑制有需要的对象中ga的进展;减慢或抑制患有干性amd的对象的视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的视敏度损失;减慢或抑制患有继发于amd的ga的对象的视敏度损失;逆转患有干性amd的对象的视敏度损失;逆转患有继发于干性amd的ga的对象的视敏度损失;逆转患有继发于amd的ga的对象的视敏度损失;减慢或抑制患有干性amd的对象的低亮度视敏度损失;减慢或抑制患有继发于干性amd的ga的对象的低亮度视敏度损失;减慢或抑制患有继发于amd的ga的对象的低亮度视敏度损失;逆转患有干性amd的对象的低亮
度视敏度损失;逆转患有继发于干性amd的ga的对象的低亮度视敏度损失;逆转患有继发于amd的ga的对象的低亮度视敏度损失;减少对象中脉络膜小疣的形成;降低对象中脉络膜小疣的形成速率;逆转对象中脉络膜小疣的形成;或降低对象中脉络膜小疣的量。药物的这些用途根据本文所描述的本发明方法来执行。
[0078]
实施例
[0079]
实施例1
[0080]
进行以下研究,其中47个被诊断为患有ga的患者接受治疗,其中在第0天、第4周以及第8周施以剂量为每只眼睛0.3mg(24个患者)或每只眼睛1mg(23个患者)的三次初始玻璃体内arc1905注射,并且在第16周进行跟踪访视。患者在第24周和第36周接受两次后续注射,随后在第48周进行最终跟踪访视。
[0081]
从基线到第24周,在药物暴露频率增加(即从第0天到第8周每月给药)期间ga的生长速率减慢。这些结果为剂量相关的,因为在第24周时相较于筛查时的ga病变面积变化在0.3mg组中为1.00mm2并且在1.0mg组中为0.78mm2(参见图1)。当在后续24周内药物暴露降低时,与基线相比生长速率发生会聚,因为在第48周时相较于筛查时的ga病变面积变化在0.3mg组中为1.73mm2并且在1.0mg组中为1.71mm2(参见图2)。
[0082]
在两种剂量水平下,arc1905均为良好耐受的并且在剂量组之间不存在明显差异。不存在被认为与arc1905有关的不良事件。
[0083]
概括地说,结果显示由arc1905的施用引起的ga病变生长的剂量依赖性降低,表明arc 1905可减慢干性amd患者中ga的进展。
[0084]
实施例2
[0085]
进行研究以评估当在患有继发于干性amd的ga的对象中施用时arc1905玻璃体内施用的安全性和功效。
[0086]
研究由两个部分组成。在第1部分中,对26个患者进行随机化以接受每月玻璃体内注射1mg arc1905;对25个患者进行随机化以接受每月玻璃体内注射2mg arc1905;并且对26个患者进行随机化以接受每月假治疗处理注射。在研究的第2部分中,对83个患者进行随机化以接受每月玻璃体内注射4mg arc 1905,以两次注射2mg arc1905进行施用;对42个患者进行随机化以接受每月玻璃体内注射2mg arc1905加上假治疗处理注射;并且对84个患者进行随机化以接受每月假治疗处理注射,以两次分开的假治疗处理注射进行施用。
[0087]
在研究中,将arc1905在ph 6.8-7.8的磷酸盐缓冲盐水中以20mg/ml(寡核苷酸质量)的浓度调配成无菌水溶液,并且提供于用卤丁基橡胶塞密封的usp i型0.5ml玻璃小瓶中。为施用1-mg和2-mg arc1905剂量,分别制备具有0.05ml和0.1ml的总注射体积的制剂。为施用4-mg arc1905剂量,施以2-mg arc1905制剂的两次注射。
[0088]
研究数据的统计分析使用混合效应重复测量模型(mrm模型)将arc1905 2-mg和arc1905 4-mg组的数据与对应的假治疗处理组进行比较。与假治疗处理组相比的arc 1905 2-mg组的统计分析包括根据部分试验的回归因子。
[0089]
研究的主要功效终点为基于在三个时间点进行的读数(基线、第6个月以及第12个月)通过眼底自发荧光(faf)测量的历时12个月的平均ga变化率,并且使用ga面积的平方根变换来进行计算。由独立的设盲读数中心对faf图像进行评估。结果在下表1中示出。
[0090]
表1.在接受玻璃体内arc1905注射与假治疗处理注射的患者之间使用平方根变换
计算的到第12个月时相较于基线的平均ga面积变化率的比较
[0091][0092][0093]a基于来自mrm模型的最小二乘均值,这些最小二乘均值来自在第18个月时间点基于所有可获得的数据绘制的mrm模型,包括来自用于zimura 2-mg比较的在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据。
[0094]b反映了统计显著性p值;使用霍赫伯格程序(hochberg procedure)进行显著性检验
[0095]
如表1中所示,与对应的假治疗处理对照组相比,arc1905 2-mg组历时12个月平均ga生长速率的降低为27.38%(p值=0.0072)(还参见图3),并且与对应假对照组相比arc1905 4-mg组为27.81%(p值=0.0051)(还参见图4)。两个剂量组的这些数据均为统计显著性的。
[0096]
基于在四个时间点(基线、第6个月、第12个月以及第18个月)进行的读数通过faf测量历时18个月的平均ga生长变化率,并且使用ga面积的平方根变换进行计算。由独立的设盲读数中心对faf图像进行评估。预定的统计分析计划使用混合效应重复测量模型(mrm模型)将zimura 2mg和zimura 4mg组的数据与对应的假治疗处理组进行比较。结果在下表2中示出:
[0097]
表2.在接受玻璃体内arc1905注射与假治疗处理注射的患者之间使用平方根变换计算的到第18个月时相较于基线的平均ga面积变化率的比较
[0098][0099][0100]a基于来自mrm模型的最小二乘均值,这些最小二乘均值来自在第18个月时间点基于所有可获得的数据绘制的mrm模型,包括来自在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据。
[0101]b这些最小二乘均值为在第18个月时间点基于所有可获得的数据绘制的mrm模型的估计值。
[0102]
由于在具有不同随机化比率的两个研究部分中对2-mg剂量的arc1905进行测试的事实,对相较于假治疗处理2-mg组的arc19052-mg组的平均ga变化的分析进行调整。第1部分和第2部分中ga的最小二乘均值变化在表3中单独示出。
[0103]
表3.在接受玻璃体内arc 1905 2-mg注射和假治疗处理注射的患者之间使用研究的第1部分和第2部分的平方根变换计算的到第12个月时相较于基线的平均ga面积变化率的比较
[0104][0105]a基于来自mrm模型的最小二乘均值
[0106]
与在12个月时进行的分析一致,由于在各自具有不同随机化比率的两个试验部分中对2mg剂量的zimura进行测试的事实,对历时18个月与对应的假治疗处理对照组相比的zimura 2mg的平均ga生长变化的分析进行调整。在第18个月时第1部分和第2部分中ga的最小二乘均值变化在表4中单独示出:
[0107]
表4.在接受玻璃体内arc1905 2-mg注射和假治疗处理注射的患者之间使用研究的第1部分和第2部分的平方根变换计算的到第18个月时相较于基线的平均ga面积变化率的比较
[0108][0109][0110]
(a)
基于来自mrm模型的最小二乘均值
[0111]
此外,初步描述性分析表明当与对应的假治疗处理对照组相比时,接受1mg arc1905的患者平均到第12个月时存在相较于基线的ga生长百分比降低。总体数据表明处理组中的剂量响应关系。
[0112]
除使用平方根变换法(以毫米(mm)测量)分析平均ga面积变化率外,还使用mrm模型历时12个月使用所观测的ga面积(未进行平方根变换,以平方毫米(mm2)测量)分析平均ga面积变化率。如表5中所示,与对应的假治疗处理对照组相比,arc 1905 2-mg组历时12个月平均ga生长速率的降低为30.45%(p值=0.0059)(还参见图5),并且与对应的假治疗处理对照组相比,arc1905 4-mg组为25.59%(p值=0.0082)(还参见图6)。两种剂量组的这些数据也均为统计显著性的。
[0113]
表5.在接受玻璃体内arc1905注射和假治疗处理注射的患者之间使用非平方根分析计算的到第12个月时相较于基线的平均ga面积变化率的比较
[0114]
[0115][0116]a基于来自mrm模型的最小二乘均值,这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自用于zimura 2-mg比较的在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据
[0117]b预定的并且描述性的分析
[0118]
还使用mrm模型使用所观测的ga面积(未进行平方根变换,以平方毫米(mm2)测量)历时18个月分析平均ga面积变化率。表6中概括了与对应的假治疗处理对照组相比,zimura 2mg和zimura 4mg组中所观测的平均ga面积数据:
[0119]
表6.在接受玻璃体内arc1905注射和假注射的患者之间使用非平方根分析计算的到第18个月时相较于基线的平均ga面积变化率的比较
[0120][0121][0122]
(a)
基于来自mrm模型的最小二乘均值。
[0123]
(b)
这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据。
[0124]
第二功效终点为到第12个月时相较于基线的平均最佳矫正视敏度(etdrs字母)变化、到第12个月时相较于基线的平均低亮度最佳矫正视敏度(etdrs字母)变化、到第18个月时相较于基线的平均最佳矫正视敏度(etdrs字母)变化以及到第18个月时相较于基线的平均低亮度最佳矫正视敏度(etdrs字母)变化。结果在以下表7、表8、表9以及表10中示出。
[0125]
表7.在接受玻璃体内arc1905注射和假治疗处理注射的患者之间到第12个月时相较于基线的平均最佳矫正视敏度变化的比较
[0126][0127][0128]a基于来自mrm模型的最小二乘均值,这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自用于zimura 2-mg比较的在第1部分和第2部分具有
不同随机化比率的组的数据,并且不应解释为直接观测的数据
[0129]
表8.在接受玻璃体内arc1905注射和假治疗处理注射的患者之间到第12个月时相较于基线的平均低亮度最佳矫正视敏度变化的比较
[0130][0131][0132]a基于来自mrm模型的最小二乘均值,这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自用于zimura 2-mg比较的在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据
[0133]
表9.在接受玻璃体内arc1905注射和假治疗处理注射的患者之间到第18个月时相较于基线的平均最佳矫正视敏度变化的比较
[0134][0135][0136]
(a)
基于来自mrm模型的最小二乘均值
[0137]
(b)
这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据
[0138]
表10.在接受玻璃体内arc1905注射和假治疗处理注射的患者之间到第18个月时相较于基线的平均低亮度最佳矫正视敏度变化的比较
[0139][0140][0141]
(a)
基于来自mrm模型的最小二乘均值
[0142]
(b)
这些最小二乘均值为来自基于所有可获得的数据绘制的mrm模型的估计值,包括来自在第1部分和第2部分具有不同随机化比率的组的数据,并且不应解释为直接观测的数据。
[0143]
研究的安全性终点为:不良事件;生命体征(脉搏、收缩压和舒张压);眼部发现(眼内压[iop]、眼科检查、荧光素血管造影照片、faf以及光学相干断层扫描[oct]);心电图(ecg)(12-导联);以及实验室变量(血液:血液学、肾功能、肝功能以及电解质;尿分析)。
[0144]
在施用12个月之后,arc1905通常为良好耐受的。不存在arc1905相关炎症并且不存在arc1905相关停止研究。另外,不存在眼部严重不良事件或眼内炎病例的报道。在12个月期间,在未处理的对侧眼中脉络膜新血管形成的发生率为10个患者(3.5%),并且在研究眼中在假治疗处理对照组中为3个患者(2.7%),在arc1905 2-mg组中为6个患者(9.0%),并且在arc1905 4-mg组中为8个患者(9.6%)。最经常报道的眼部不良事件与注射程序有关。
[0145]
实施例3
[0146]
进行研究以评估当历时24个月时间在患有继发于干性amd的ga的对象中施用时arc1905玻璃体内施用的安全性和功效。
[0147]
在第1天以1:1比率将约400个对象随机化至施用(a)2-mg的arc1905或(b)假治疗处理剂量的每月处理组中。在第12个月时,以1:1比率对接受每月2-mg的arc1905的对象进行再随机化以接受(i)从第12个月到第23个月每月施用2-mg的arc1905,或者(ii)在第12个月、第14个月、第16个月、第18个月、第20个月以及第22个月施用假治疗处理剂量,并且在第13个月、第15个月、第17个月、第19个月、第21个月以及第23个月每隔一个月施用2-mg的arc1905。最初随机化至假治疗处理剂量(在第1天)的所有对象继续每月假治疗处理注射到第23个月。所有对象在第24个月时进行最终跟踪访视。
[0148]
研究的主要功效终点为在三个时间点通过faf测量的历时12个月的平均ga变化率:基线、第6个月以及第12个月(平方根变换)。安全性终点为不良事件(ae);生命体征(脉搏、收缩压和舒张压);眼部发现(最佳矫正视敏度、低亮度最佳矫正视敏度、眼内压[iop]以及眼科检查);心电图(ecg)(12-导联);以及实验室变量(血液:血液学、肾功能、肝功能以及电解质;尿分析)。
[0149]
选择用于研究的对象为任一性别,年龄为50岁或更年长,并且被诊断为患有继发于干性amd的地图样萎缩。
[0150]
将arc1905以20mg/ml的浓度在磷酸盐缓冲盐水中调配成无菌水溶液并且将由申办者供应于密封小瓶中。它是不含防腐剂的并且意在仅用于玻璃体内注射。2-mg剂量具有0.1ml(100μl)的总注射体积。
[0151]
研究的眼部纳入准则如下:
[0152]
■
继发于干性amd的非中央凹ga
[0153]
■
通过faf筛查图像确定,总ga面积2≥2.5并且≤17.5mm2(分别为1视盘面积和7视盘面积[da])。
[0154]
■
如果ga为多灶性的,那么至少一处局灶性病变应经测量≥1.25mm2(0.5da)。
[0155]
■
ga部分在距离中央凹中心1500微米内。
[0156]
■
萎缩性病变必须能够整体拍照。
[0157]
■
研究眼(se)中的最佳矫正视敏度在20/25-20/320之间(包括端点)。
[0158]
■
两只眼睛中眼部介质透明并且瞳孔舒张足够以允许所有成像程序,包括优质立体眼底照相术和眼底自发荧光。
[0159]
■
se中眼内压≤21mmhg或更低。
[0160]
研究的一般纳入准则如下:
[0161]
■
对象为任一性别,年龄≥50岁。
[0162]
■
女性必须使用两种有效避孕形式,在参加试验之前至少12个月为绝经后的,或手术不育的;如果有怀孕的可能,那么必须在首次注射之前14天内进行血清妊娠测试并具有阴性结果。在试验期间必须实施两种有效避孕形式并且在最后剂量的测试药物之后持续至少60天。
[0163]
■
提供书面知情同意。
[0164]
■
在研究的24月持续时间内的所有试验访视中能够返回。
[0165]
研究的眼部排除准则如下:
[0166]
■
任一眼睛中有cnv的证据。
[0167]
■
任一眼睛中有继发于除amd外的任何疾患的ga(例如药物诱导的)。
[0168]
■
针对amd(干性或湿性)的任何先前治疗或针对任一眼睛中的任何适应症的任何先前玻璃体内治疗,除了经口补充维生素和矿物质。
[0169]
■
se中在研究过程期间将发生进展从而可能影响中央视觉或以其他方式为混淆因素的任何眼部疾患。
[0170]
■
使用已知对晶状体、视网膜或视神经有毒的任何眼部或全身性药物的伴随治疗。
[0171]
■
存在眼内炎症(≥痕量细胞或闪辉)、黄斑裂洞、病理性近视、视网膜前膜、显著玻璃体黄斑牵拉的证据、玻璃体出血或无晶状体(具有或不具有完整囊膜的假晶状体不为排除准则)。
[0172]
■
任一眼睛中存在特发性或自体免疫相关葡萄膜炎或有特发性或自体免疫相关葡萄膜炎的历史。
[0173]
■
显著介质不透明性,包括白内障,这可妨碍视敏度、毒性评估、眼底照相术或眼底自发荧光。
[0174]
■
如果存在对象在研究期间在se中将需要白内障手术的可能性,那么他们不应参加。
[0175]
■
存在其他脉络膜新血管形成原因,包括病理性近视(等效球镜度为-8屈光度或更高,或轴长为25mm或更长)、眼部组织胞浆菌病综合征、血管样条纹、脉络膜破裂以及多灶性脉络膜炎。
[0176]
■
在参加试验3个月内有任何眼内手术或热激光。黄斑区域中的任何先前热激光,与适应症无关。
[0177]
■
在过去12周内有任何眼部或眼周感染(包括睑缘炎),或眼表面炎症。
[0178]
■
有以下程序中的任一者的历史:后侧玻璃体切除术、滤过手术(例如滤帘切除术)、青光眼引流装置、角膜移植或视网膜剥离。
[0179]
■
任一眼睛中有糖尿病性视网膜病变的任何迹象。
[0180]
研究的一般排除准则如下:
[0181]
■
以下基础疾病中的任一者,包括:重度心脏疾病(例如纽约心脏协会[new york heart association,nyha]功能iii类或iv类)的历史或证据;在最近6个月内有不稳定绞
痛、急性冠状动脉综合征、心肌梗塞或血管再形成的历史或临床证据;需要持续治疗的心室快速性心律失常;临床显著的周围性血管疾病的历史或证据,诸如间歇性跛行或先前截肢;临床显著的肾功能(血清肌酐》2.5mg/dl或肾脏移植后或正在接受渗析的状态)或肝功能受损;中风(在参加研究12个月内);或在参加试验1个月内有任何重大手术程序。
[0182]
■
在se的区域进行了先前治疗性辐射。
[0183]
■
在过去60天内针对任何疾患使用研究性剂进行了任何治疗。
[0184]
■
怀孕或哺乳的女性。
[0185]
■
已知对血管造影术中所用的染料中的荧光、聚维酮碘或对zimura制剂的组分严重过敏。
[0186]
■
过去有使用任何抗补体剂进行全身性治疗的历史或在研究期间有使用任何全身性抗补体剂进行治疗的可能性。
[0187]
*****
[0188]
前述描述仅出于清楚理解的目的而给出,并且不应由其理解为不必要的限制,因为在本发明范围内的修改对本领域技术人员来说可为显而易见的。
[0189]
在本说明书和权利要求书中,除非上下文另有要求,否则措辞“包含”和变化型式诸如“包括”和“涵盖”应理解为是指包括所陈述的整体或步骤或整体或步骤的组,但不排除任何其他整体或步骤或整体或步骤的组。
[0190]
在本说明书通篇中,在将组合物描述为包括组分或材料的情况下,除非另外描述,否则预期组合物还可基本上由所列组分或材料的任何组合组成,或由其组成。同样地,在将方法描述为包括特定步骤的情况下,除非另外描述,否则预期所述方法还可基本上由所列步骤的任何组合组成,或由其组成。本文适当地说明性地公开的发明可在不存在本文未具体公开的任何元素或步骤的情况下进行实践。
[0191]
本文所公开的方法以及其个别步骤的实践可人工地和/或借助于由电子设备提供的自动化来进行。虽然已参考特定实施方案对方法进行了描述,但本领域技术人员容易理解,可使用其他执行与方法相关的动作的方式。举例来说,除非另外描述,否则可在不背离所述方法的范围或精神的情况下改变各个步骤的顺序。此外,可将个别步骤中的一些组合、省略或进一步再分成额外的步骤。
[0192]
本文引用的所有专利、公布以及参考文献在此以引用的方式完全并入本文中。在本公开与所并入的专利、公布以及参考文献之间矛盾的情况下,应以本公开为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1