用于结合纤溶酶原的抗体
1.本发明涉及用于结合纤溶酶原的抗原结合蛋白及其相关片段,涉及所述抗原结合蛋白和片段的产生,并且涉及所述抗体和片段用于检测和治疗各种病症的用途。
2.相关申请
3.本技术要求澳大利亚临时申请au 2019904052的优先权,将其内容通过引用以其全文特此并入。
背景技术:
4.纤溶酶原(plg)是纤溶酶的无活性酶原形式,纤溶酶是一种丝氨酸蛋白酶,其对靶底物(包括纤维蛋白、纤维蛋白原、补体组分3和5(c3和c5)、玻连蛋白、骨钙素、因子v、因子viii和因子x以及一些胶原酶)具有广泛的特异性。因此,plg和plm一起参与各种重要的生理和病理过程,包括纤维蛋白溶解和止血、细胞外基质的降解、细胞迁移、胚胎发育、组织重塑、炎症、伤口愈合、血管生成和肿瘤侵袭。
5.plg主要在肝脏中合成,但也在主要器官和组织中合成。因此,在血浆和许多血管外液体中发现了大量的plg。在生理条件下,plg通过激活环中的切割被转化为活性形式纤溶酶(plm)。激活可由尿激酶纤溶酶原激活物(urokinase plasminogen activator,upa)或组织纤溶酶原激活物(tissue plasminogen activator,tpa)或各种其他蛋白酶介导,并将单链plg(氨基酸残基20-810)转化为由二硫键连接的重链a(残基20-580)和轻链b(残基581-810)组成的plm。重链a含有5个克林格勒(kringle)结构域(其经由赖氨酸结合区介导与底物的结合),并且轻链b对应于丝氨酸蛋白酶结构域。由前4个克林格勒结构域组成的片段已被命名为血管抑素,一种新的血管生成抑制剂。
6.纤溶酶原/纤溶酶系统与多种生理和病理过程(如纤维蛋白溶解、组织重塑、细胞迁移、炎症以及肿瘤侵袭和转移)有关。纤溶酶原的遗传性缺陷是血栓栓塞性疾病的诱发危险因素。
7.需要用于调节纤溶酶系统以治疗和/或预防各种病症的组合物和方法。
8.在本说明书中对任何现有技术的提及并不是承认或暗示此现有技术形成任何管辖权的公知常识的一部分,或者此现有技术可合理地预期被理解为被认为与本领域技术人员已知的其他现有技术是相关的和/或与之组合。
技术实现要素:
9.本发明提供了一种抗原结合蛋白,其包含结合纤溶酶原的抗原结合结构域,其中该抗原结合蛋白降低纤溶酶原的激活。
10.在任何方面,本发明的抗原结合蛋白可以减少任何一种或多种纤溶酶原激活物对纤溶酶原的激活。纤溶酶原激活物是可以切割arg
561-val
562
键(按照人纤溶酶原编号)的任何酶。示例性纤溶酶原激活物是切割纤溶酶原的丝氨酸蛋白酶,包括凝血蛋白因子ix、因子x和凝血酶原(因子ii)、蛋白c、胰凝乳蛋白酶和胰蛋白酶、各种白细胞弹性蛋白酶、链激酶
(streptokinase,sk)、葡激酶、尿激酶纤溶酶原激活物(upa)、组织纤溶酶原激活物(tpa)和纤溶酶。优选地,纤溶酶原激活物选自由以下组成的组:链激酶(sk)、尿激酶纤溶酶原激活物(upa)和组织纤溶酶原激活物(tpa)。优选地,在纤溶酶原/纤溶酶的一种或多种配体或底物存在下,减少了sk、upa和/或tpa介导的纤溶酶原的激活。优选地,辅因子选自由以下组成的组:ε-氨基己酸(eaca)或其他赖氨酸类似物、纤维蛋白原(fg)和纤维蛋白(fn)。测量纤溶酶原激活的方法是本领域已知的,并且可以用于确定本发明的抗原结合蛋白对纤溶酶原激活的减少。本文描述了示例性方法。纤溶酶原激活的减少可以通过测量活性纤溶酶形成量的减少来确定。
11.在任何方面,本发明的抗原结合蛋白不可检测地抑制或显著抑制纤溶酶的活性。在进一步的方面,本发明的抗原结合蛋白不可检测地结合纤溶酶的活性位点(即催化三联体)。抗原结合蛋白与纤溶酶的结合可以通过本文所述的任何方法来测定。
12.在任何方面,本发明的抗原结合蛋白结合纤溶酶原的克林格勒结构域,优选地结合克林格勒结构域5。在任何方面,本发明的抗原结合蛋白结合纤溶酶原的克林格勒结构域和丝氨酸蛋白酶结构域。在本发明的任何方面,抗原结合蛋白结合纤溶酶原的克林格勒结构域、激活环和丝氨酸蛋白酶结构域。在任何方面,本发明的抗原结合结构域仅结合纤溶酶原的一个区域,该区域包括纤溶酶原的激活环和克林格勒结构域,优选克林格勒5,但不包括丝氨酸蛋白酶结构域。换句话说,本发明的抗原结合结构域优选地不结合不包括激活环的纤溶酶原区域。在任何方面,本发明的抗原结合蛋白结合纤溶酶原的丝氨酸蛋白酶结构域,但不结合克林格勒结构域。在进一步的方面,本发明的抗原结合蛋白也与丝氨酸蛋白酶结构域相互作用。
13.在任何方面,本发明的抗原结合蛋白结合包含纤溶酶原的激活环的纤溶酶原区域。优选地,包含激活环的区域包含纤溶酶原的arg
493
至his
569
之间的氨基酸序列(按照seq id no:65中提供的人纤溶酶原编号),或包含lys
468
和his
569
之间的序列,更优选地,其中激活环包含根据seq id no:65中所示编号的纤溶酶原的ala
543
至arg
582
的序列。优选地,抗原结合蛋白结合包含如seq id no:66中所示的序列或其片段的肽。优选地,本发明的抗原结合蛋白结合纤溶酶原的纤溶酶原环中残基arg
561
和val
562
中的一个或多个。
14.在任何方面,本发明的抗原结合蛋白在arg
493
、ser
495
、ile
496
、asp
516
、gly
517
、asp
518
、val
519
、tyr
525
和tyr
533
的位置或等同位置处结合纤溶酶原的克林格勒5结构域的一个或多个残基。优选地,本发明的抗原结合蛋白在表2所示的位置或等同位置处结合纤溶酶原的克林格勒5结构域的一个或多个残基。优选地,结合纤溶酶原的克林格勒5结构域的一个或多个残基的本发明抗原结合蛋白的残基是所定义的残基,或者是与表2中所示等同位置处的氨基酸残基。
15.在任何方面,本发明的抗原结合蛋白在lys
468
、arg
493
、ser
495
、ile
496
、asp
516
、gly
517
和tyr
525
的位置或等同位置处结合纤溶酶原的克林格勒5结构域的一个或多个残基。优选地,本发明的抗原结合蛋白在表3所示的位置或等同位置处结合纤溶酶原的克林格勒5结构域的一个或多个残基。优选地,结合纤溶酶原的克林格勒5结构域的一个或多个残基的本发明抗原结合蛋白的残基如所定义,或者是与表3中所示等同位置处的氨基酸残基。
16.在任何方面,本发明的抗原结合蛋白在glu
554
、lys
556
、lys
557
、his
569
和asp
751
的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,本发明的
抗原结合蛋白在表2所示的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基的本发明抗原结合蛋白的残基如所定义,或者是与表2中所示等同位置处的氨基酸残基。
17.在任何方面,本发明的抗原结合蛋白在glu
554
、lys
556
、lys
557
、arg
561
和his
569
的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,本发明的抗原结合蛋白在表3所示的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基的本发明抗原结合蛋白的残基如所定义,或者是与表3中所示等同位置处的氨基酸残基。
18.在任何方面,本发明的抗原结合蛋白在asp
676
、arg
677
、arg
712
、glu
714
和asn
769
的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,本发明的抗原结合蛋白在表4所示的位置或等同位置处结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基。优选地,结合纤溶酶原的丝氨酸蛋白酶结构域的一个或多个残基的本发明抗原结合蛋白的残基如所定义,或者是与表4中所示等同位置处的氨基酸残基。
19.本发明还提供了一种抗原结合蛋白(例如,抗体),其在表2或3中为g05抗体指定的残基的位置或等同位置处具有相同或基本上相同的氨基酸。
20.本发明还提供了一种抗原结合蛋白(例如,抗体),其在表4中为g11抗体指定的残基的位置或等同位置处具有相同或基本上相同的氨基酸。
21.本发明还提供了一种结合或特异性结合纤溶酶原的抗原结合蛋白,并且其中该抗原结合蛋白竞争性抑制g05或g11抗体(即,包含:包含seq id no:8中所示序列的vh和包含seq id no:7中所示序列的vl;或包含seq id no:40中所示序列的vh和包含seq id no:39中所示序列的vl)与纤溶酶原的结合。
22.在本发明的任何方面,本发明抗原结合蛋白的残基与纤溶酶原的残基的相互作用可以由x射线晶体学和0至(包括端值)的接触距离分析定义。
23.本发明还提供了一种抗原结合蛋白,其与包含含有如seq id no:8中所示氨基酸序列的vh结构域的抗体结合纤溶酶原上的相同表位,其中该抗原结合蛋白减少或抑制纤溶酶原的激活。
24.本发明还提供了一种抗原结合蛋白,其与包含含有如seq id no:8中所示氨基酸序列的vh结构域和含有如seq id no:7中所示氨基酸序列的vl结构域的抗体结合纤溶酶原上的相同表位,其中该抗原结合蛋白减少或抑制纤溶酶原的激活。在一个实施例中,该表位由x射线晶体学定义。优选地,该表位由x射线晶体学和0至(包括端值)的接触距离分析定义。优选地,抗原结合蛋白覆盖约1000至的seq id no:65的纤溶酶原表面积。
25.本发明还提供了一种抗原结合蛋白,其与包含含有如seq id no:40中所示氨基酸序列的vh结构域和含有如seq id no:39中所示氨基酸序列的vl结构域的抗体结合纤溶酶原上的相同表位,其中该抗原结合蛋白减少或抑制纤溶酶原的激活。在一个实施例中,该表位由x射线晶体学定义。优选地,该表位由x射线晶体学和0至(包括端值)的接触距离分析定义。
26.在任何方面,本发明的抗原结合蛋白可以结合纤溶酶原,并表现出小于15nm、小于10nm或等于约8nm或更小的kd。优选地,使用如本文所述的任何测定法,例如表面等离子体共振(spr)来确定kd。
27.在任何方面,本发明的抗原结合蛋白可以结合纤溶酶原,并表现出大于约1
×
104、大于约1
×
105,或者大于或等于约4
×
105的ka(m-1
s-1
)。
28.在任何方面,本发明的抗原结合蛋白可以结合纤溶酶原,并表现出小于约1
×
10-3
、小于约5
×
10-3
,或者小于或等于约2
×
10-3
或小于约10
×
10-4
的kd(s-1
)。优选地,kd为约7
×
10-4
,或如本文所述的任何值。
29.在本发明的任何方面,本发明的抗原结合蛋白可以抑制链激酶、tpa或upa介导的纤溶酶原激活,其ic
50
小于500nm、300nm、250nm、200nm、150nm、100nm、80nm、60nm或50nm。优选地,当在eaca存在下在溶液中测量时,ic
50
等于约18nm或如本文所述的任何值。可替代地,当在纤维蛋白存在下测量时,ic
50
等于约290nm或如本文所述的任何值。
30.本发明的抗原结合蛋白可以结合衍生自seq id no:65的肽。例如,本发明的抗原结合蛋白可以结合由seq id no:65序列的4、5、7、8、9、10或更多个连续氨基酸残基组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的493-533残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的468至525残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的493至533残基、基本上由其组成或由其组成的肽,并且结合包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽。在一些实施例中,本发明的抗原结合蛋白结合包含seq id no:65的468至525残基、基本上由其组成或由其组成的肽,并且结合包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽。在仍进一步的实施例中,本发明的抗原结合蛋白结合包含seq id no:65的468至525残基、基本上由其组成或由其组成的肽,并且结合包含seq id no:65的554至751残基、基本上由其组成或由其组成的肽
31.在优选的实施例中,本发明的抗原结合蛋白不结合仅包含丝氨酸蛋白酶结构域的纤溶酶原或纤溶酶区域。换句话说,本发明的抗原结合蛋白是一种结合包含激活环的纤溶酶原区域的蛋白质,该激活环存在于称为克林格勒5的区域和丝氨酸蛋白酶结构域之间。
32.在进一步的实施例中,本发明的抗原结合蛋白不可检测地结合包含丝氨酸蛋白酶结构域的催化三联体的纤溶酶原区域。因此,在某些实施例中,本发明的抗原结合蛋白不结合包含seq id no:65的氨基酸序列570至741或由其组成的肽,优选地包含seq id no:65的his
603
至ala
741
的氨基酸序列或由其组成。
33.在任何方面,抗原结合蛋白不会显著降低纤溶酶的活性。优选地,如使用本文所述的能够测定纤溶酶活性的任何测定所测量,抗原结合蛋白不会导致纤溶酶活性的显著降低。
34.在任何方面,抗原结合蛋白不会显著降低tpa、凝血酶、胰蛋白酶、因子xa(fxa)和血浆激肽释放酶中任何一种或多种的活性。
35.在某些实施例中,抗原结合蛋白的cdr可以使用imgt结构域间隙编号系统来确定。
36.本发明提供了一种用于结合纤溶酶原的抗原结合蛋白,该抗原结合蛋白包含:
37.fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,以及
38.fr1a-cdr1a-fr2a-cdr2a-fr3a-cdr3a-fr4a,
39.其中:
40.fr1、fr2、fr3和fr4各自是框架区;
41.cdr1、cdr2和cdr3各自是互补决定区;
42.fr1a、fr2a、fr3a和fr4a各自是框架区;
43.cdr1a、cdr2a和cdr3a各自是互补决定区;
44.其中这些框架区或互补决定区中任一个的序列如本文所述。
45.本发明提供了一种用于结合纤溶酶原的抗原结合蛋白,该抗原结合蛋白包含:
46.fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4,以及
47.fr1a-cdr1a-fr2a-cdr2a-fr3a-cdr3a-fr4a,
48.其中:
49.fr1、fr2、fr3和fr4各自是框架区;
50.cdr1、cdr2和cdr3各自是互补决定区;
51.fr1a、fr2a、fr3a和fr4a各自是框架区;
52.cdr1a、cdr2a和cdr3a各自是互补决定区;
53.其中这些互补决定区中任一个的序列具有如下表1中所述的氨基酸序列。优选地,框架区具有也如下表1中所述的氨基酸序列,包括特定残基处的氨基酸变化,这种变化可以通过比对衍生自每种抗体的各个框架区来确定。本发明还包括cdr1、cdr2和cdr3是来自vh的序列,cdr1a、cdr2a和cdr3a是来自vl的序列的情况,或者cdr1、cdr2和cdr3是来自vl的序列,cdr1a、cdr2a和cdr3a是来自vh的序列的情况。
54.在一个实施例中,抗原结合蛋白包含:
55.fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4-接头-fr1a-cdr1a-fr2a-cdr2a-fr3a-cdr3a-fr4a。
56.如本文所定义,接头可以是化学物质、一个或多个氨基酸、或两个半胱氨酸残基之间形成的二硫键。
57.本发明提供了一种抗原结合蛋白,其包含以下(按n末端至c末端或c末端至n末端的顺序)的氨基酸序列、基本上由其组成或由其组成:
58.·
seq id no:7和8;或
59.·
seq id no:39和40。
60.本发明还提供了一种包含抗体的抗原结合结构域的抗原结合蛋白,其中该抗原结合结构域结合或特异性结合纤溶酶原,其中该抗原结合结构域包含以下至少一项:
61.(i)vh,该vh包含含有与seq id no:4中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的互补决定区(cdr)1,含有与seq id no:5中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr2,以及含有与seq id no:6中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr3;
62.(ii)vh,该vh包含与seq id no:8中所示的序列至少约95%或96%或97%或98%或99%相同的序列;
63.(iii)vl,该vl包含含有与seq id no:1中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr1,含有与seq id no:2中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr2,以及含有与seq id no:3中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr3;
64.(iv)vl,该vl包含与seq id no:7中所示的序列至少约95%相同的序列;
65.(v)vh,该vh包含含有seq id no:4中所示的序列的cdr1,含有seq id no:5中所示的序列的cdr2,以及含有seq id no:6中所示的序列的cdr3;
66.(vi)vh,该vh包含seq id no:8中所示的序列;
67.(vii)vl,该vl包含含有seq id no:1中所示的序列的cdr1,含有seq id no:2中所示的序列的cdr2,以及含有seq id no:3中所示的序列的cdr3;
68.(viii)vl,该vl包含seq id no:7中所示的序列;
69.(ix)vh,该vh包含含有seq id no:4中所示的序列的cdr1,含有seq id no:5中所示的序列的cdr2,以及含有seq id no:6中所示的序列的cdr3;以及vl,该vl包含含有seq id no:1中所示的序列的cdr1,含有seq id no:2中所示的序列的cdr2,以及含有seq id no:3中所示的序列的cdr3;或
70.(x)vh,该vh包含seq id no:8中所示的序列;和vl,该vl包含seq id no:7中所示的序列。
71.在本发明的任何方面,该抗原结合结构域进一步包含以下至少一项:
72.(i)vh,该vh包含含有与seq id no:21中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的框架区(fr)1,含有与seq id no:22中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr2,含有与seq id no:23中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr3,以及含有与seq id no:24中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr4;
73.(ii)vl,该vl包含含有与seq id no:17中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr1,含有与seq id no:18中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr2,含有与seq id no:19中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr3,以及含有与seq id no:20中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr4;
74.(iii)vh,该vh包含含有seq id no:21中所示的序列的fr1,含有seq id no:22中所示的序列的fr2,含有seq id no:23中所示的序列的fr3,以及含有seq id no:24中所示的序列的fr4;
75.(iv)vl,该vl包含含有seq id no:17中所示的序列的fr1,含有seq id no:18中所示的序列的fr2,含有seq id no:19中所示的序列的fr3,以及含有seq id no:20中所示的序列的fr4;或
76.(v)vh,该vh包含含有seq id no:21中所示的序列的fr1,含有seq id no:22中所示的序列的fr2,含有seq id no:23中所示的序列的fr3,以及含有seq id no:24中所示的序列的fr4;以及vl,该vl包含含有seq id no:17中所示的序列的fr1,含有seq id no:18中所示的序列的fr2,含有seq id no:19中所示的序列的fr3,以及含有seq id no:20中所示的序列的fr4。
77.本发明还提供了一种包含抗体的抗原结合结构域的抗原结合蛋白,其中该抗原结合结构域结合或特异性结合纤溶酶原,其中该抗原结合结构域包含以下至少一项:
78.(i)vh,该vh包含含有与seq id no:36中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的互补决定区(cdr)1,含有与seq id no:37中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr2,以及含有与seq id no:38中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr3;
79.(ii)vh,该vh包含与seq id no:40中所示的序列至少约95%或96%或97%或98%或99%相同的序列;
80.(iii)vl,该vl包含含有与seq id no:33中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr1,含有与seq id no:34中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr2,以及含有与seq id no:35中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的cdr3;
81.(iv)vl,该vl包含与seq id no:39中所示的序列至少约95%相同的序列;
82.(v)vh,该vh包含含有seq id no:36中所示的序列的cdr1,含有seq id no:37中所示的序列的cdr2,以及含有seq id no:38中所示的序列的cdr3;
83.(vi)vh,该vh包含seq id no:40中所示的序列;
84.(vii)vl,该vl包含含有seq id no:33中所示的序列的cdr1,含有seq id no:34中所示的序列的cdr2,以及含有seq id no:35中所示的序列的cdr3;
85.(viii)vl,该vl包含seq id no:39中所示的序列;
86.(ix)vh,该vh包含含有seq id no:36中所示的序列的cdr1,含有seq id no:37中所示的序列的cdr2,以及含有seq id no:38中所示的序列的cdr3;以及vl,该vl包含含有seq id no:33中所示的序列的cdr1,含有seq id no:34中所示的序列的cdr2,以及含有seq id no:35中所示的序列的cdr3;或
87.(x)vh,该vh包含seq id no:40中所示的序列;和vl,该vl包含seq id no:39中所示的序列。
88.在本发明的任何方面,该抗原结合结构域进一步包含以下至少一项:
89.(i)vh,该vh包含含有与seq id no:53中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的框架区(fr)1,含有与seq id no:54中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr2,含有与seq id no:55中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr3,以及含有与seq id no:56中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少
99%相同的序列的fr4;
90.(ii)vl,该vl包含含有与seq id no:49中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr1,含有与seq id no:50中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr2,含有与seq id no:51中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr3,以及含有与seq id no:52中所示的序列至少约80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少99%相同的序列的fr4;
91.(iii)vh,该vh包含含有seq id no:53中所示的序列的fr1,含有seq id no:54中所示的序列的fr2,含有seq id no:55中所示的序列的fr3,以及含有seq id no:56中所示的序列的fr4;
92.(iv)vl,该vl包含含有seq id no:49中所示的序列的fr1,含有seq id no:50中所示的序列的fr2,含有seq id no:51中所示的序列的fr3,以及含有seq id no:52中所示的序列的fr4;或
93.(v)vh,该vh包含含有seq id no:53中所示的序列的fr1,含有seq id no:54中所示的序列的fr2,含有seq id no:55中所示的序列的fr3,以及含有seq id no:56中所示的序列的fr4;以及vl,该vl包含含有seq id no:49中所示的序列的fr1,含有seq id no:50中所示的序列的fr2,含有seq id no:51中所示的序列的fr3,以及含有seq id no:52中所示的序列的fr4。
94.如本文所述,抗原结合蛋白可以是以下形式:
95.(i)单链fv片段(scfv);
96.(ii)二聚scfv(双-scfv);
97.(iii)与抗体的恒定区、fc或重链恒定结构域(ch)2和/或ch3连接的(i)或(ii)中之一;或
98.(iv)与结合免疫效应细胞的蛋白质连接的(i)或(ii)中之一。
99.进一步地,如本文所述,抗原结合蛋白可以是以下形式:
100.(i)双体抗体;
101.(ii)三体抗体;
102.(iii)四体抗体;
103.(iv)fab;
104.(v)f(ab’)2;
105.(vi)fv;
106.(vii)双特异性抗体或其他形式的多特异性抗体;
107.(viii)与抗体的恒定区、fc或重链恒定结构域(ch)2和/或ch3连接的(i)至(vii)之一;或
108.(viv)与结合免疫效应细胞的蛋白质连接的(i)至(vii)之一。
109.前述抗原结合蛋白也可称为抗体的抗原结合结构域。
110.优选地,如本文所述的抗原结合蛋白是抗体或其抗原结合片段。典型地,抗原结合蛋白是抗体,例如单克隆抗体。抗原结合蛋白可以为重组或经修饰的抗体形式(例如,嵌合
抗体、人源化抗体、人抗体、cdr移植抗体、灵长类化抗体、去免疫抗体、同人源化抗体、半抗体、双特异性抗体、三特异性抗体或多特异性抗体)。抗体可以进一步包含化学修饰,如与活性剂或放射性标记或用于提高溶解度的试剂缀合或本文所述的其他修饰。
111.如本文所述,抗原结合蛋白可以是可变结构域。
112.本发明还提供了一种包含轻链可变区和重链可变区的纤溶酶原抗体,
113.其中所述轻链可变区包含:
114.如seq id no:1中所示的cdr l1、如seq id no:2中所示的cdr l2以及如seq id no:3中所示的cdr l3;并且
115.其中所述重链可变区包含:
116.如seq id no:4中所示的cdr h1、如seq id no:5中所示的cdr h2以及如seq id no:6中所示的cdr h3。
117.在本发明的任何方面,纤溶酶原抗体包含含有seq id no:7的序列的轻链可变区。
118.在本发明的任何方面,纤溶酶原抗体包含含有seq id no:8的序列的重链可变区。
119.在本发明的任何方面,纤溶酶原抗体包含含有如seq id no:17中所示的fr l1、如seq id no:18中所示的fr l2、如seq id no:19中所示的fr l3以及如seq id no:20中所示的fr l4的轻链可变区。
120.在本发明的任何方面,纤溶酶原抗体包含含有如seq id no:21中所示的fr h1、如seq id no:22中所示的fr h2、如seq id no:23中所示的fr h3以及如seq id no:24中所示的fr h4的重链可变区。
121.本发明还提供了一种包含轻链可变区和重链可变区的纤溶酶原抗体,
122.其中所述轻链可变区包含:
123.如seq id no:33中所示的cdr l1、如seq id no:34中所示的cdr l2以及如seq id no:35中所示的cdr l3;并且
124.其中所述重链可变区包含:
125.如seq id no:36中所示的cdr h1、如seq id no:37中所示的cdr h2以及如seq id no:38中所示的cdr h3。
126.在本发明的任何方面,纤溶酶原抗体包含含有seq id no:39的序列的轻链可变区。
127.在本发明的任何方面,纤溶酶原抗体包含含有seq id no:40的序列的重链可变区。
128.在本发明的任何方面,纤溶酶原抗体包含含有如seq id no:49中所示的fr l1、如seq id no:50中所示的fr l2、如seq id no:51中所示的fr l3以及如seq id no:52中所示的fr l4的轻链可变区。
129.在本发明的任何方面,纤溶酶原抗体包含含有如seq id no:53中所示的fr h1、如seq id no:54中所示的fr h2、如seq id no:55中所示的fr h3以及如seq id no:56中所示的fr h4的重链可变区。
130.在任何方面或实施例中,抗体为裸抗体。具体而言,抗体为非缀合形式且不适于形成缀合物。
131.在某些实施例中,本发明的抗原结合蛋白的互补决定区序列(cdr)可以根据imgt
编号系统来定义。
132.本文提到的“结合”纤溶酶原的蛋白质或抗体为“特异性结合(binds specifically to)”或“特异性结合(specifically binds to)”纤溶酶原的蛋白质或抗体提供了文字支持。
133.本发明还提供了前述抗体的抗原结合结构域或抗原结合片段。
134.本发明还提供了包含如本文所述的抗原结合蛋白、免疫球蛋白可变结构域、抗体、dab(单结构域抗体)、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体的融合蛋白。
135.本发明还提供了一种为与标记或细胞毒性剂缀合的如本文所述抗原结合蛋白、免疫球蛋白可变结构域、抗体、dab、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体或融合蛋白形式的缀合物。
136.本发明还提供了一种抗体,用于结合如本文所述的抗原结合蛋白、免疫球蛋白可变结构域、抗体、dab、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体、融合蛋白或缀合物。
137.本发明还提供了一种编码如本文所述的抗原结合蛋白、免疫球蛋白可变结构域、抗体、dab、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体、融合蛋白或缀合物的核酸。
138.在一个实例中,这种核酸包含在其中该核酸与启动子可操作地连接的表达构建体中。这种表达构建体可以在载体中,例如在质粒中。
139.在涉及单多肽链抗原结合蛋白的本发明实例中,表达构建体可包含与编码该多肽链的核酸连接的启动子。
140.在涉及形成抗原结合蛋白的多条多肽链的实例中,表达构建体包含编码含有例如与启动子可操作地连接的vh的多肽的核酸和编码含有例如与启动子可操作地连接的vl的多肽的核酸。
141.在另一个实例中,表达构建体是双顺反子表达构建体,例如,包含按5’到3’顺序的以下可操作连接的组分:
142.(i)启动子
143.(ii)编码第一多肽的核酸;
144.(iii)内部核糖体进入位点;以及
145.(iv)编码第二多肽的核酸,
146.其中该第一多肽包含vh,并且第二多肽包含vl,反之亦然。
147.本发明还设想了单独的表达构建体,其中一个编码包含vh的第一多肽,且另一个编码包含vl的第二多肽。例如,本发明还提供一种组合物,该组合物包含:
148.(i)第一表达构建体,其包含编码含有与启动子可操作连接的vh的多肽的核酸;以及
149.(ii)第二表达构建体,其包含编码含有与启动子可操作连接的vl的多肽的核酸。
150.本发明提供了包含本文所述载体或核酸的细胞。优选地,该细胞是分离的、基本纯化的或重组的。在一个实例中,该细胞包含本发明的表达构建体或:
151.(i)第一表达构建体,其包含编码含有与启动子可操作连接的vh的多肽的核酸;以
及
152.(ii)第二表达构建体,其包含编码含有与启动子可操作连接的vl的多肽的核酸,
153.其中第一和第二多肽缔合以形成本发明的抗原结合蛋白。
154.本发明的细胞的实例包括细菌细胞、酵母细胞、昆虫细胞或哺乳动物细胞。
155.本发明还提供了一种包含seq id no:65的554至569残基、基本上由其组成或由其组成的肽,结合包含seq id no:65的493至533残基、基本上由其组成或由其组成的肽,并且结合包含seq id no:65的468至525残基、基本上由其组成或由其组成的肽。
156.本发明还提供了一种药物组合物,其包含抗原结合蛋白或包含如本文所述的cdr和/或fr序列或如本文所述的免疫球蛋白可变结构域、抗体、dab(单结构域抗体)、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体、融合蛋白或缀合物以及药学上可接受的载体、稀释剂或赋形剂。
157.本发明还提供了一种诊断组合物,其包含抗原结合蛋白或包含如本文所述的cdr和/或fr序列或如本文所述的抗原结合位点、免疫球蛋白可变结构域、抗体、dab、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体、融合蛋白或缀合物、稀释剂以及任选地标记。
158.本发明还提供了一种试剂盒或制品,其包含抗原结合蛋白或包含如本文所述的cdr和/或fr序列或如本文所述的免疫球蛋白可变结构域、抗体、dab、双-scfv、scfv、fab、fab'、f(ab')2、fv片段、双体抗体、三体抗体、四体抗体、线性抗体、单链抗体分子或多特异性抗体、融合蛋白或缀合物。
159.如本文所述的抗原结合蛋白可包含人恒定区,例如igg恒定区,如igg1、igg2、igg3或igg4恒定区或其混合物。在包含vh和vl的抗体或蛋白质的情况下,vh可连接到重链恒定区,且vl可连接到轻链恒定区。
160.在一个实例中,如本文所述的抗原结合蛋白包含igg4抗体的恒定区或igg4抗体的稳定的恒定区。在一个实例中,蛋白质或抗体包含在位置241处(根据kabat的编号系统(kabat等人,sequences of proteins of immunological interest[具有免疫学意义的蛋白质的序列]华盛顿特区美国卫生和公共服务部(washington dc united states department of health and human services),1987和/或1991))具有脯氨酸的igg4恒定区。
[0161]
在一个实例中,如本文所述的抗原结合蛋白或如本文所述的抗原结合蛋白的组合物包含重链恒定区(包括稳定的重链恒定区),其包含完全或部分具有或不具有c末端赖氨酸残基的序列的混合物。
[0162]
在一个实例中,抗原结合蛋白包含本文披露的连接到或融合到igg4恒定区或稳定的igg4恒定区(例如,如上所述)的vh以及连接到或融合到κ轻链恒定区的vl。
[0163]
本发明的抗原结合蛋白的功能特征将被视为经必要的修改后应用于本发明的抗体。
[0164]
如本文所述的抗原结合蛋白可以是纯化的、基本上纯化的、分离的和/或重组的。
[0165]
本发明的抗原结合蛋白可以是取自表达本发明抗原结合蛋白的杂交瘤已在其中生长的培养基的上清液的一部分。
[0166]
本发明还提供了一种在受试者中恢复止血或抑制纤溶酶原激活的方法,该受试者
已经遭受创伤或已经遭受大出血或正在大出血(例如,由于手术、创伤或分娩后),该方法包括向受试者施用本发明的抗原结合蛋白,从而在受试者中恢复止血或抑制纤溶酶原激活。
[0167]
本发明提供了一种用于在有需要的受试者中抑制纤维蛋白溶解的方法,该方法包括向受试者施用本发明的抗原结合蛋白,从而在受试者中抑制纤维蛋白溶解。如本文所用,需要抑制纤维蛋白溶解的受试者可以包括已经遭受创伤(例如,车祸、跌倒或其他重大损伤)、已经经历手术、由于分娩或需要抑制纤维蛋白溶解的任何其他原因而正在经历大出血的受试者。
[0168]
本发明还提供了一种在受试者中治疗或预防细菌感染或降低其严重程度或进展的方法,该方法包括向受试者施用本发明的抗原结合蛋白,从而在受试者中治疗或预防细菌感染或降低其严重程度或进展。在这方面,抗原结合蛋白可用于预防感染的复发,并且这被认为是预防该感染。
[0169]
本发明还提供了一种用于在受试者中治疗与细菌相关或由细菌引起的病症的方法,该方法包括向受试者施用有效量的本发明的抗原结合蛋白,从而在受试者中治疗与细菌感染相关或由细菌感染引起的病症。与细菌感染相关或由细菌感染引起的病症可以是本文所述的任何病症。在任何实施例中,细菌感染可以是慢性或急性的。
[0170]
本发明还提供了一种在受试者中降低细菌感染的严重程度的方法,该方法包括向受试者施用本发明的抗原结合蛋白,从而在受试者中降低细菌感染的严重程度。
[0171]
仍进一步,本发明提供了一种在受试者中治疗或预防癌症的方法,该方法包括向受试者施用本发明的抗原结合蛋白,从而在受试者中治疗或预防癌症。如本文所用,治疗癌症的方法包括抑制、预防或最小化癌症的扩散或进展,包括抑制或预防癌症的转移的方法。
[0172]
在本发明的任何治疗方法中,该方法可以包括施用本发明的任何抗原结合蛋白的组合。在某些实施例中,该组合包含第一抗原结合蛋白,该第一抗原结合蛋白具有包含seq id no:39的序列的轻链可变区和包含seq id no:40的序列的重链可变区;和第二抗原结合蛋白,该第二抗原结合蛋白具有包含seq id no:7的序列的轻链可变区和包含seq id no:8的序列的重链可变区。
[0173]
本发明还提供了本发明的纤溶酶原结合抗原结合蛋白在制造用于在受试者中恢复止血或抑制过度的纤溶酶原激活的药物方面的用途,该受试者已经遭受创伤,或在手术或分娩后需要恢复止血或抑制纤溶酶原激活。
[0174]
本发明还提供了本发明的纤溶酶原结合抗原结合蛋白在制造用于在受试者中恢复或止血或抑制过度的纤溶酶原激活的药物方面的用途,该受试者已经遭受创伤。
[0175]
本发明提供了本发明的抗原结合蛋白在制造用于在有需要的受试者中抑制纤维蛋白溶解的药物方面的用途。如本文所用,需要抑制纤维蛋白溶解的受试者可以包括已经遭受创伤(例如,车祸、跌倒或其他重大损伤)、已经经历手术、由于分娩或需要抑制纤维蛋白溶解的任何其他原因而正在经历大出血的受试者。
[0176]
本发明还提供了本发明的纤溶酶原结合抗原结合蛋白在制造用于治疗或预防细菌感染的药物方面的用途。
[0177]
本发明还提供了本发明的纤溶酶原结合抗原结合蛋白在制造用于治疗、预防由细菌感染引起或与其相关的任何病症或疾病或降低其严重程度的药物方面的用途。
[0178]
仍进一步,本发明提供了本发明的抗原结合蛋白在制造用于在受试者中治疗或预
防癌症的药物方面的用途。该药物还可以用于抑制、预防或最小化癌症的扩散或进展,包括癌症的转移。
[0179]
在本发明的任何用途中,该用途包括本发明的任何抗原结合蛋白在制造药物方面的组合,优选地,其中该组合包含第一蛋白,该第一蛋白具有包含seq id no:39的序列的轻链可变区和包含seq id no:40的序列的重链可变区;和第二蛋白,该第二蛋白具有包含seq id no:7的序列的轻链可变区和包含seq id no:8的序列的重链可变区。
[0180]
本发明还提供了一种药物组合物,其包含本发明的纤溶酶原结合抗原结合蛋白和药学上可接受的赋形剂。
[0181]
该药物组合物优选地用于如本文所述的用途。因此,本发明提供了一种包含本发明的纤溶酶原结合抗原结合蛋白的药物组合物,用于在受试者中恢复止血或抑制过度的纤溶酶原激活,该受试者已经遭受创伤,或在手术或分娩后需要恢复止血或抑制纤溶酶原激活。
[0182]
本发明还提供了一种包含本发明的纤溶酶原结合抗原结合蛋白的药物组合物,用于在受试者中恢复或止血或抑制过度的纤溶酶原激活,该受试者已经遭受创伤。
[0183]
本发明提供了一种包含本发明的抗原结合蛋白的药物组合物,用于在有需要的受试者中抑制纤维蛋白溶解。如本文所用,需要抑制纤维蛋白溶解的受试者可以包括已经遭受创伤(例如,车祸、跌倒或其他重大损伤)、已经经历手术、由于分娩或需要抑制纤维蛋白溶解的任何其他原因而正在经历大出血的受试者。
[0184]
本发明还提供了一种包含本发明的纤溶酶原结合抗原结合蛋白的药物组合物,用于治疗或预防细菌感染。
[0185]
本发明还提供了一种包含本发明的纤溶酶原结合抗原结合蛋白的药物组合物,用于治疗、预防由细菌感染引起或与其相关的任何病症或疾病或降低其严重程度。
[0186]
此外,本发明提供了一种包含本发明的纤溶酶原结合抗原结合蛋白的药物组合物,用于在受试者中治疗或预防癌症。该药物组合物还可以用于抑制、预防或最小化癌症的扩散或进展,包括癌症的转移。
[0187]
在本发明的任何上述方法或用途中,细菌感染可以由形成孢子或非形成孢子的细菌引起。当感染是由形成孢子的细菌引起时,感染的特征可以是处于营养状态的细菌,或者可替代地,是处于孢子形式的细菌。应当理解的是,在靶向细菌的孢子形式时,本发明的抗原结合蛋白由此可以起到防止或降低再次感染该细菌的可能性的作用。
[0188]
在本发明的任何方面,该细菌是革兰氏阳性的,优选革兰氏阳性球菌。在任何方面,革兰氏阳性菌来自杆菌目、梭菌目或乳杆菌目。
[0189]
在本发明的任何方面,该细菌来自链球菌科。优选地,该细菌来自链球菌(streptococcus)属。更优选地,该细菌是a组链球菌(gas),优选化脓性链球菌(streptococcus pyogenes)。在某些实施例中,感染可以是由选自由以下组成的组的细菌引起的感染:化脓性链球菌、停乳链球菌(streptococcus dysgalactiae)、肺炎链球菌(streptococcus pneumonia)、无乳链球菌(streptococcus agalactiae)、犬链球菌(streptococcus canis)、类马链球菌(streptococcus equisimilis)、变异链球菌(streptococcus mutans)和猪链球菌(streptococcus suis)。
[0190]
在本发明的任何方面,该细菌来自芽孢杆菌科,优选地来自芽孢杆菌属,更优选
地,其中感染是炭疽杆菌(bacillus anthracis)和蜡状芽孢杆菌(bacillus cereus)物种的细菌感染。
[0191]
在本发明的任何方面,该细菌来自葡萄球菌科。优选地,该细菌来自葡萄球菌(staphylococcus)属。更优选地,感染可以是由选自由以下组成的组的细菌引起的感染:金黄色葡萄球菌(staphylococcus aureus),包括耐甲氧西林金黄色葡萄球菌(mrsa)、万古霉素中介的金黄色葡萄球菌(visa)和耐万古霉素金黄色葡萄球菌(vrsa)。在某些方面,该细菌是表皮葡萄球菌(staphylococcus epidermidis)。
[0192]
在本发明的任何方面,该细菌来自消化链球菌科。优选地,该细菌来自拟梭菌(clostridioides)属。更优选地,细菌感染是由选自由以下组成的组的细菌引起的感染:艰难梭菌(clostridium difficile)(也称为艰难拟梭菌(clostridioides difficile))。
[0193]
在任何方面,该细菌来自梭菌科。该细菌可以来自梭菌(clostridium)属,任选地,其中细菌感染是肉毒梭菌(clostridium botulinum)、破伤风梭菌(clostridium tetani)、产气荚膜梭菌(clostridium perfringens)和索氏梭菌(clostridium sordellii)中任一种的感染。
[0194]
在任何方面,该细菌来自紫单胞菌科,包括牙龈卟啉单胞菌(porphyromonas gingivalis)。
[0195]
在本发明的任何方面,该细菌是革兰氏阴性的,任选地来自肠杆菌目、弯曲菌目或拟杆菌目。
[0196]
在本发明的任何方面,该细菌来自耶尔森氏菌科,优选地来自耶尔森氏菌(yersinia)属,更优选地,其中感染是鼠疫耶尔森氏菌(yersinia pestis)、小肠结肠炎耶尔森氏菌(yersinia enterocolitica)物种的细菌感染。
[0197]
在本发明的任何方面,该细菌来自螺杆菌科,优选地来自螺杆菌属,更优选地,其中感染是幽门螺杆菌(helicobacter pylori)物种的细菌感染。
[0198]
因此,本发明的方法、用途或药物组合物可用于治疗、预防由本文提及的细菌引起或与其相关的任何疾病或降低其严重程度。例如,本发明的方法、用途或药物组合物可以用于治疗、预防由a组链球菌(gas)、葡萄球菌或芽孢杆菌物种引起或与其相关的任何疾病/感染或降低其严重程度,该疾病/感染包括但不限于咽炎、扁桃体炎、猩红热、蜂窝组织炎、丹毒、风湿热、皮肤和软组织感染、心内膜炎、骨和关节感染、感染的植入物、链球菌感染后的肾小球肾炎、坏死性筋膜炎、肌坏死性骨膜下脓肿、坏死性肺炎、化脓性肌炎、纵隔炎、心肌、肾周、肝和脾脓肿、脓毒性血栓性静脉炎和严重的眼部感染,包括眼内炎和淋巴管炎。
[0199]
本发明的方法、用途或药物组合物还可以用于治疗、预防由艰难拟梭菌(艰难梭菌)引起或与其相关的任何疾病/感染或降低其严重程度,该疾病/感染包括:胃肠道感染、轻度至中度腹泻和结肠炎。
[0200]
本发明的方法、用途或药物组合物还可以用于治疗、预防由艰难牙龈卟啉单胞菌引起或与其相关的任何疾病/感染或降低其严重程度,该疾病/感染包括:牙龈疾病和牙龈感染。
[0201]
本发明的方法、用途或药物组合物还可以用于治疗、预防由耶尔森氏菌属物种引起或与其相关的任何疾病/感染或降低其严重程度,该疾病/感染包括:鼠疫(肺鼠疫、败血症鼠疫或腺鼠疫)和耶尔森氏菌病。
[0202]
本发明的方法、用途或药物组合物还可以用于治疗、预防由螺杆菌引起或与其相关的任何疾病/感染或降低其严重程度,该疾病/感染包括:急性或慢性胃炎、胃溃疡、胃粘膜萎缩、十二指肠溃疡和胃癌的易感性或风险。
[0203]
在本发明的任何实施例中,用于治疗或预防细菌感染的方法或用途包括用于抑制或最小化细菌对宿主组织/器官的侵袭程度的方法或用途。
[0204]
本发明的方法和用途适用于癌症的治疗或预防。示例性癌症包括血液学癌症、上皮起源的癌症、肝癌、胰腺癌、胃癌、骨肉瘤、子宫内膜癌和卵巢癌。
[0205]
本发明进一步提供了一种编码本发明的抗原结合蛋白或其功能片段或衍生物的核酸分子。
[0206]
本发明还提供了包含本文所述载体或核酸分子的细胞。
[0207]
本发明还提供了一种包含本文所述细胞的动物或从其衍生的组织。
[0208]
在另一方面,本发明提供了一种试剂盒或制品,其包括如本文所述的本发明的抗原结合蛋白或本发明的药物组合物。
[0209]
在其他实施例中,提供了一种用于本文所述治疗或预防应用的试剂盒,该试剂盒包括:
[0210]-容纳本发明的抗原结合蛋白或药物组合物的容器;以及
[0211]-带有使用说明的标签或包装说明书。
[0212]
如本文所用,除非上下文另有要求,否则术语“包含”及该术语的变型如“包括”和“含有”并不旨在排除进一步的添加剂、组分、整体或步骤。
[0213]
前述段落中所述的本发明的进一步方面和这些方面的进一步实施例将从以举例方式给出并参考附图的以下描述中变得清楚。
附图说明
[0214]
图1:g05与纤溶酶原和纤溶酶的结合。g05被固定在nihc芯片上;(a)纤溶酶原和(b)纤溶酶的结合动力学通过多循环表面等离子体共振(spr)测定。虚线代表符合实验数据的1:1langmuir模型。(c)动力学常数(ka和kd)和亲和常数(kd)表。
[0215]
图2:g11与纤溶酶原和纤溶酶的结合。g11被固定在nihc芯片上;(a)纤溶酶原和(b)纤溶酶的结合动力学通过多循环表面等离子体共振(spr)测定。虚线代表符合实验数据的1:1langmuir模型。(c)动力学常数(ka和kd)和亲和常数(kd)表。
[0216]
图3:在eaca存在下,g05(a)和g11(b)在溶液中抑制tpa介导的纤溶酶原激活。
[0217]
图4:在纤维蛋白存在下,g05(a)和g11(b)抑制tpa介导的纤溶酶原激活。
[0218]
图5:g05不抑制纤溶酶活性;g11适度抑制纤溶酶活性。在g05或g11(0-2000nm);5nm纤溶酶存在下测量的纤溶酶活性。
[0219]
图6:g05抑制链激酶与纤溶酶原的结合。(a)在g05或初始鸡ab(gab)(0-500nm)存在下,使10nm纤溶酶原
r561a,s741a
通过固定在cm4芯片上的链激酶。g05显示出抑制作用,尤其是在高浓度下。对照的初始鸡抗体gab未显示出对plg与sk结合的抑制作用。(b)在500nm ab存在下sk结合的百分比,相对于无抗体对照归一化。
[0220]
图7:g05抑制链激酶介导的纤溶酶原激活。g05抑制sk对纤溶酶原的激活,因为在t=0和10分钟时早期添加该抗体完全消除了纤溶酶的生成。
[0221]
图8:g05和g11与重组丝氨酸蛋白酶结构域的结合。(a)尺寸排阻色谱,其显示g05与重组克林格勒5-丝氨酸蛋白酶结构域(k5sp)的结合。与单独的k5sp(虚线)或单独的g05(虚线)相比,观察到更高分子量的复合物(k5sp+g05,实线)。(b)尺寸排阻色谱,其显示g11与重组丝氨酸蛋白酶结构域(sp)的结合。与单独的sp(虚线)或单独的g11(虚线)相比,尺寸排阻色谱显示更高分子量的复合物(sp+g11,实线)。
[0222]
图9:与纤溶酶原的丝氨酸蛋白酶结构域结合的g05和g11的晶体结构。(a)kr5-sp/g05二元复合物的晶体结构显示,g05结合纤溶酶原激活环。kr5和sp被显示,激活环成条状,g05轻链(lc)和重链(hc)被标记。顶部是二元复合物的卡通表示,并且底部显示了如上所述参与分子间相互作用的被标记和编号的关键残基。虚线用于说明极性相互作用。(b)sp/g11二元复合物的晶体结构显示,g11与纤溶酶原/纤溶酶的丝氨酸蛋白酶结构域形成极性相互作用,使得经由扭曲催化口袋和周围的环来阻止纤溶酶的产生和活性。sp被显示,g11轻链(lc)和重链(hc)被标记。顶部是二元复合物的卡通表示,并且底部显示了如上所述参与分子间相互作用的被标记和编号的关键残基。虚线用于说明极性相互作用。
[0223]
图10:通过流式细胞术测量的g05抑制纤溶酶原与a组链球菌(gas)的结合。与gab和对照相比,荧光标记的纤溶酶原与gas的结合被g05抑制。还显示了凝血酸(txa)对纤溶酶原与gas结合的抑制。显示相对于各自scfv和对照绘制的中值荧光强度的条形图。
[0224]
图11:通过sds-page测量的g05抑制纤溶酶原与a组链球菌(gas)的结合。荧光标记的纤溶酶原与gas的结合通过以下方法测定:(a)sds page凝胶的荧光扫描,显示添加到测定中的总纤溶酶原(总量)、结合的、未结合的和测定过程中收集的洗涤物。(b)(a)上的纤溶酶原的条带强度相对于hbs对照进行归一化。在所有样品中,仅g05显示出对plg与gas细胞结合的显著抑制。
[0225]
图12:g05抑制a组链球菌(gas)的纤溶酶原激活(酶测定)。(上图)与g05结合的纤溶酶原与gas一起孵育。用荧光底物测量产生的纤溶酶。预计gas对纤溶酶原的激活是由链激酶(sk)介导的。(下图)在存在或不存在重组sk的情况下纤溶酶原激活的进展曲线。
[0226]
图13:hplg被募集到cdi损伤的肠道,加剧组织损伤和疾病,并有助于经感染宿主中的孢子传播。(a)来自未感染或感染艰难梭菌m7404 wt或m7404毒素突变体(a-b-)的hplg转基因小鼠或注入hplg的wt小鼠的代表性pas/阿尔新蓝染色盲肠切片。方括号([)表示隐窝增生,箭头(
▲
)表示上皮损伤,并且星号(*)表示水肿和炎症。比例尺代表200μm。(b)来自hplg转基因艰难梭菌未感染相比于经感染小鼠盲肠的标准量hplg的蛋白质印迹。包括了纯化的hplg作为阳性对照(泳道1)。显示了从未感染的hplg(泳道2)和艰难梭菌感染的hplg小鼠(泳道3)的盲肠,以及从注入hplg的未感染(泳道4)、m7404毒素突变体(a-b-)(泳道5)或m7404感染的c57bl/6小鼠(泳道6)的盲肠中提取的hplg。单位(100和75)是指蛋白质标准品的分子量,单位为kda。(c)粪便稠度,(d)笼子外观和(e)生理外观。(f)hplg转基因(n=20)和c57bl/6(n=13)艰难梭菌m7404感染小鼠的存活时间,hplg(n=7)和c57bl/6(n=11)小鼠的未感染对照。(g、h)来自艰难梭菌感染的hplg转基因小鼠或c57bl/6小鼠的粪便毒素水平,使用ht29细胞(tcda)(g)和vero细胞(tcdb)进行评估。(h)没有观察到毒素水平的统计学上显著差异。(i)艰难梭菌感染的hplg转基因小鼠或c57bl/6小鼠的肾脏、脾脏和胸腺中的艰难梭菌孢子数量。(j)hplg转基因感染和未感染小鼠的炎症。(k)mplg ko(n=18)和c57bl/6l(n=18)艰难梭菌m7404感染小鼠的存活时间,mplg ko(n=5)和c57bl/6(n=6)小
鼠的未感染对照。统计分析使用采用tukey多重比较的单向anova来确定(**p《0.005;***p《0.0005;****p《0.0001)(c、d、e、j)或使用曼惠特尼测试来确定(*p《0.05;**p《0.001;***p《0.0001)(f、g、h、i、k)。
[0227]
图14:hplg改变cdi期间的宿主炎症反应和组织完整性。(a)显示了使用22个plex细胞因子阵列和timp-1elisa测定来自注入pbs的(空心柱)或注入hplg的(空心柱)艰难梭菌m7404感染的小鼠盲肠的组织裂解物的细胞因子水平。倍数比代表经感染小鼠肠道组织中存在的细胞因子水平,该水平被归一化为从每个相应的未感染小鼠组获得的水平。仅显示了在注入hplg和pbs和经感染小鼠之间不同的细胞因子水平。(b)针对每个未感染小鼠组的盲肠显示了相同细胞因子的丰度(log
10
),该丰度在经感染的注入hplg(橙色方块)和经感染的注入pbs(黑色圆圈)的小鼠之间不同。注意,为了证实细胞因子表达的改变不是由hplg单独存在引起的,检查了未感染小鼠的细胞因子水平。注入hplg但未感染的小鼠中的细胞因子水平比注入pbs的未感染小鼠中的细胞因子水平稍低,但并不显著,然而,当与经感染小鼠相比时,两个未感染组中的细胞因子水平都较低。统计分析使用曼惠特尼测试来确定(*p《0.05;**p《0.001;***p《0.0001)。
[0228]
图15:人、马和猪但不是鼠plg结合艰难梭菌孢子。(a)使用抗人plg ab对艰难梭菌m7404营养细胞进行蛋白质印迹。指示了代表在不存在(v)或存在hplg(vp)的情况下孵育的营养细胞的样品。(b)人、马和猪plg与m7404孢子之间的相互作用(分别为黑色方块、紫色圆圈、橙色三角形)以及小鼠plg与孢子之间缺乏相互作用(蓝色菱形)的代表性biacore传感器曲线。数据符合一个位点特异性结合模型。(c)hplg与从来自不同位置和来源的菌株(m7404加拿大人流行病分离株(e1);r20291英国人流行病分离株(e2);jgs6133美国动物分离株(a-us);a135澳大利亚动物分离株(a-au);dll3109澳大利亚人流行病分离株(e-au);vpi10463美国人参考分离株(r)和cd37美国非产毒分离株(nt))中分离的艰难梭菌孢子的结合,并使用抗人plg ab进行检测。对于(a)和(c),指示了代表在不存在(s)或存在hplg(sp)的情况下孵育的孢子的样品。还包括了纯化的hplg(阳性对照)蛋白(p)和用结合缓冲液洗涤5次以除去任何未结合的plg(w)的孢子上清液作为对照。单位(100和75)是指蛋白质标准品的分子量,单位为kda。(d-f)使用结合hplg(红色)的抗孢子抗体(绿色)染色的体外衍生的m7404孢子的受激发射损耗(sted)显微术。(g-i)使用结合hplg(红色)的抗孢子抗体(绿色)染色的人来源的粪便艰难梭菌孢子的sted显微术。(j-l)小鼠来源的粪便m7404孢子的sted显微术。抗孢子抗体染色显示为绿色;hplg染色显示为红色。体外来源的孢子、人粪便来源的孢子和小鼠粪便来源的孢子的合并sted图像分别显示在f、i和l中。
[0229]
图16:纤溶酶结合艰难梭菌孢子重塑孢子表面并增加萌发效率。(a)未处理的或(b)纤溶酶结合的m7404孢子的横向tem切片。来自(a)和(b)的方框区域分别在(c)和(d)中放大显示。(e)从未处理的和纤溶酶结合的m7404孢子测量孢子外膜的平均长度(nm)(n=40个孢子/组,其中每个孢子测量5次)。统计分析使用曼-惠特尼u测试来确定(p《0.0001)。(f)在50μm牛磺胆酸钠存在下,未处理的(橙色方块)或纤溶酶结合的(蓝色三角形)m7404孢子的萌发率。包括了在不存在牛磺胆酸钠的情况下孵育的未处理的孢子(黑色方块)作为阴性萌发对照。数据表示每个时间点(od
600
(t))时的od
600
与时间0(od
600
(t0))时的od
600
之比,并随时间(分钟)进行测量。统计分析使用采用tukey多重比较测试的双向anova来确定(对于未处理的孢子相比于萌发剂存在下纤溶酶结合的孢子,p《0.01)。
[0230]
图17:当施用抗纤溶酶原抗体时,感染艰难梭菌的小鼠的疾病严重程度降低、发病延迟和存活增加。ip注射单独的hepes、g05抗体或初始鸡抗体的注入hplg和艰难梭菌m7404感染的小鼠的(a)笼子外观(b)粪便稠度(c)生理外观和(d)存活曲线。统计分析使用曼惠特尼测试来确定;*p《0.05.0。
[0231]
图18:g05和g11抗体的交叉反应性。g05抗体不显著抑制相关的丝氨酸蛋白酶,包括纤溶酶。除了纤溶酶之外,g11抗体不显著抑制相关的丝氨酸蛋白酶。
[0232]
图19:施用g05抗体减少出血。来自经受尾部出血实验的野生型c56bl/6(wt)小鼠和在编码纤溶酶原(plg-/-)的基因中含有纯合功能缺失突变的小鼠的出血量(如以od
550 nm测量)。所有动物均接受200μg人纤溶酶原和50μg抗体,gab(阴性对照)或g05。与接受初始抗体的小鼠相比,接受g05抗体的小鼠的出血量显著减少。
[0233]
图20:g11抑制红细胞和血小板存在下的全血凝块溶解。显示了g11、α2ap和抑肽酶实现50%全血凝块溶解(ic
50
)所需的时间。在抑制全血凝块溶解方面,g11比α2ap更有效大约2倍,并且比抑肽酶更有效大约2.5倍。
具体实施方式
[0234]
应当理解的是,在本说明书中披露和限定的本发明可扩展至所提及的或者从文本部分和附图部分显而易见的单个特征的两个或更多个的所有替代性组合。所有这些不同组合构成本发明的多个替代性方面。
[0235]
前述段落中所述的本发明的进一步方面和这些方面的进一步实施例将从以举例方式给出并参考附图的以下描述中变得清楚。
[0236]
现在将详细地参照本发明的某些实施例。虽然本发明将结合实施例来进行描述,但是应当理解的是,不意图将本发明限于那些实施例。相反,本发明旨在涵盖可以包括在如权利要求所限定的本发明范围内的所有替代性方案、修改方案以及等同方案。
[0237]
本发明人已经开发了抗原结合蛋白,例如抗体,其结合并抑制或减少纤溶酶原的激活。
[0238]
由于其结合并抑制或减少纤溶酶原激活的能力,并且如本文进一步解释的,本发明的抗原结合蛋白可用于治疗、预防由纤溶酶原激活为纤溶酶所介导的病症或疾病或延缓其进展。例如,本发明的抗原结合蛋白可用于抑制纤维蛋白溶解和促进创伤后止血,或手术、分娩后大出血,或需要抑制纤溶酶原激活的任何其他情况。
[0239]
本发明的抗原结合蛋白也可用于治疗或预防细菌感染,其中细菌病原体募集纤溶酶系统以促进宿主组织的侵袭。特别地,本发明的抗原结合蛋白可用于治疗或预防由链球菌属物种、葡萄球菌属物种、鼠疫耶尔森氏菌、幽门螺杆菌、大肠杆菌(e.coli)、沙门氏菌属物种(salmonella sp.)和牙龈卟啉单胞菌引起的感染。
[0240]
纤溶酶系统还可以被侵入的肿瘤用于促进血管生成和转移。因此,本发明的抗原结合蛋白还具有抑制或减少炎症、肿瘤生长和转移活性的一个或多个方面的能力。
[0241]
概况
[0242]
贯穿本说明书,除非另外具体说明或上下文另有要求,否则提及单个步骤、物质成分、步骤组或物质成分组时,应视为涵盖这些步骤、物质成分、步骤组或物质成分组中的一项和多项(即一项或多项)。因此,如本文所用,单数形式“一种/一个(a/an)”和“该”包括复
数方面,反之亦然,除非上下文另有清楚规定。例如,对“一种”的提及包括单种以及两种或更多种;对“一个”的提及包括单个以及两个或更多个;对“该”的提及包括单一以及两或更多;等等。
[0243]
本领域的普通技术人员将理解,本发明易受不同于具体所述的变化和修改的那些变化和修改的影响。应当理解,本发明包括所有这样的变化和修改。本发明还包括在本说明书中单独地或共同地提及的或指出的所有的步骤、特征和化合物,以及所述步骤或特征中的任何两个或更多个的任何及所有组合。
[0244]
本领域技术人员应认识到类似于或等同于本文所述的那些的可以在本发明的实践中使用的许多方法和材料。本发明绝不限于所述的方法和材料。
[0245]
本文提及的所有专利和公开物均通过引用以其全文并入。
[0246]
本发明的范围不受本文所述的具体实例的限制,这些实例仅旨在用于举例说明的目的。功能上等同的产品、组合物和方法显然在本发明的范围内。
[0247]
除非另外具体说明,否则本文中的本发明的任何实例或实施例应视为经必要修改后适用于本发明的任何其他实例或实施例。
[0248]
除非确切地另外定义,本文使用的所有技术和科学术语应视为具有与本领域(例如,细胞培养、分子遗传学、免疫学、免疫组织化学、蛋白质化学、以及生物化学)普通技术人员通常理解的相同的含义。
[0249]
除非另外指示,否则本披露中使用的重组蛋白、细胞培养和免疫学技术是本领域技术人员熟知的标准程序。此类技术的来源在整个文献中被描述和解释,如j.perbal,a practical guide to molecular cloning[分子克隆实用指南],约翰威利父子出版社(john wiley and sons)(1984)、j.sambrook等人molecular cloning:a laboratory manual[分子克隆:实验室手册],冷泉港实验室出版社(cold spring harbour laboratory press)(1989)、t.a.brown(编辑),essential molecular biology:a practical approach[基础分子生物学:实用方法],第1和2卷,irl出版社(1991)、d.m.glover和b.d.hames(编辑),dna cloning:a practical approach[dna克隆:实用方法],第1-4卷,irl出版社(1995和1996),和f.m.ausubel等人(编辑),current protocols in molecular biology[分子生物学现代方法],格林出版社联合公司以及威利跨学科(greene pub.associates and wiley-interscience)(1988,包括到目前为止的所有更新)、ed harlow和david lane(编辑)antibodies:a laboratory manual[抗体:实验室手册],冷泉港实验室,(1988),以及j.e.coligan等人(编辑)current protocols in immunology[免疫学现代方法],约翰威利父子出版社(john wiley&sons)(包括到目前为止的所有更新)。
[0250]
本文中可变区及其部分、免疫球蛋白、抗体及其片段的描述和定义可通过在kabat sequences of proteins of immunological interest[具有免疫学意义的蛋白质的kabat序列],美国国立卫生研究院(national institutes of health),贝塞斯达,马里兰州,1987和1991,bork等人,j mol.biol.[分子生物学杂志]242,309-320,1994,chothia和lesk j.mol biol.[分子生物学杂志]196:901-917,1987,chothia等人nature[自然]342,877-883,1989和/或al-lazikani等人,j mol biol[分子生物学杂志]273,927-948,1997中的讨论进一步澄清。
[0251]
术语“和/或”(例如“x和/或y”)应理解为“x和y”或“x或y”,并应被视为对两种含义
id no:65中示出。包含hplg激活环的序列在seq id no:66中示出。
[0259]
如本文所用,提及纤溶酶原是指具有纤溶酶原的至少一种生物化学或生物物理活性的分子。纤溶酶原的生物化学或生物物理活性和结构可以与纤溶酶的区别开来。
[0260]
短语“抑制纤溶酶原激活”或“减少纤溶酶原激活”被理解为意指本发明的抗原结合蛋白抑制或减少纤溶酶原转化为纤溶酶。此外,使用合适的体外、细胞或体内测定法测量活性,并且与在相同条件下但不含该抗原结合蛋白的相同测定法中的纤溶酶原激活相比,活性被阻断或降低至少1%、5%、10%、25%、50%、60%、70%、80%或90%或更多。优选地,纤溶酶原激活由任何一种或多种纤溶酶原激活物介导或诱导。纤溶酶原激活物是可以切割arg
561-val
562
键(按照人纤溶酶原编号)的任何酶。示例性的切割纤溶酶原的丝氨酸蛋白酶,即纤溶酶原激活物,包括凝血蛋白因子ix、因子x和凝血酶原(因子ii)、蛋白c、胰凝乳蛋白酶和胰蛋白酶、各种白细胞弹性蛋白酶、链激酶(sk)、尿激酶(upa)和组织纤溶酶原激活物(tpa)以及纤溶酶。优选地,纤溶酶原激活物选自由以下组成的组:链激酶(sk)、尿激酶纤溶酶原激活物(upa)和组织纤溶酶原激活物(tpa)。优选地,在一种或多种辅因子存在下,抑制或减少了纤溶酶原的激活。优选地,辅因子选自由以下组成的组:ε-氨基己酸(eaca)、纤维蛋白原(fg)和纤维蛋白(fn)
[0261]
术语“分离的蛋白质”或“分离的多肽”是如下的蛋白质或多肽,该蛋白质或多肽由于其起源或衍生来源而未与在其天然状态下伴随它的天然缔合组分缔合;基本上不含来自相同来源的其他蛋白质。可使用本领域已知的蛋白质纯化技术使蛋白质基本上不含天然缔合组分或通过分离进行基本纯化。“基本纯化”意指蛋白质基本上不含污染物,例如至少约70%或75%或80%或85%或90%或95%或96%或97%或98%或99%不含污染物。
[0262]
术语“重组”应理解为意指人工基因重组的产物。因此,在包含抗体抗原结合结构域的重组蛋白的上下文中,该术语不涵盖在受试者体内天然发生的作为b细胞成熟期间发生的天然重组产物的抗体。然而,如果分离出此类抗体,则其应被认为是包含抗体抗原结合结构域的分离的蛋白质。类似地,如果使用重组手段分离和表达编码该蛋白质的核酸,则所得蛋白质为包含抗体抗原结合结构域的重组蛋白质。重组蛋白还涵盖通过人工重组手段表达的蛋白质,在此情况下该蛋白质在细胞、组织或受试者中(例如,该蛋白在其中表达)。
[0263]
术语“蛋白质”应被视为包含单个多肽链,即一系列通过肽键连接的连续氨基酸或一系列彼此共价或非共价连接的多肽链(即多肽复合物)。例如,可以使用合适的化学物质或二硫键共价连接该系列多肽链。非共价键的实例包括氢键、离子键、范德华力和疏水相互作用。蛋白质可以包括一种或多种非天然氨基酸。
[0264]
术语“多肽”或“多肽链”将从前述段落理解为意指一系列通过肽键连接的连续氨基酸。
[0265]
如本文所用,术语“抗原结合结构域”应被视为是意指能够特异性结合抗原的抗体区域,即vh或vl或者包含vh和vl两者的fv。抗原结合结构域不需要在整个抗体的情况下,例如,它可以是分离的(例如,结构域抗体)或另一形式(例如,如本文所述,如scfv)。
[0266]
为了本披露的目的,术语“抗体”包括由于fv内包含的抗原结合结构域而能够特异性结合一种或几种密切相关抗原(例如,纤溶酶原)的蛋白质。该术语包括四链抗体(例如,两条轻链和两条重链)、重组或修饰抗体(例如,嵌合抗体、人源化抗体、人抗体、cdr移植抗体、灵长类化抗体、去免疫抗体、同人源化(synhumanized)抗体、半抗体、双特异性抗体)。
[0267]
抗体通常包含恒定结构域,其可排列成恒定区或恒定片段或可结晶片段(fc)。抗体的示例性形式包括作为其基本单元的四链结构。全长抗体包括两条共价连接的重链(约50至70kd)和两条轻链(约23kda)。轻链通常包含可变区(如果存在)和恒定结构域,并且在哺乳动物中为κ轻链或λ轻链。重链通常包含可变区和由铰链区连接到另外一个或多个恒定结构域的一个或两个恒定结构域。哺乳动物的重链属于以下类型之一:α、δ、ε、γ或μ。每条轻链也与其中一条重链共价连接。例如,这两条重链以及这些重链和轻链通过链间二硫键和非共价相互作用保持在一起。链间二硫键的数量在不同类型的抗体中可能有所不同。每条链都有n末端可变区(vh或vl,其中每个的长度为约110个氨基酸)和一个或多个c末端恒定结构域。轻链的恒定结构域(长度为约110个氨基酸的cl)与重链的第一恒定结构域(长度为330至440个氨基酸的ch1)对齐并二硫键合。轻链可变区与重链可变区对齐。抗体重链可包含2个或更多个另外的ch结构域(如ch2、ch3等),并可包含ch1和ch2恒定结构域之间的铰链区。抗体可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类。在一个实例中,抗体是鼠(小鼠或大鼠)抗体或灵长类(例如,人)抗体。在一个实例中,抗体重链缺失c末端赖氨酸残基。在一个实例中,抗体为人源化的、同人源化的、嵌合的、cdr移植的或去免疫化的。
[0268]
术语“全长抗体”、“完整抗体”或“整个抗体”可互换使用,以指处于其基本完整形式的抗体,与抗体的抗原结合片段相反。具体而言,整个抗体包括具有重链和轻链(包括fc区)的抗体。恒定结构域可以是野生型序列恒定结构域(例如,人野生型序列恒定结构域)或其氨基酸序列变体。
[0269]
如本文所用,“可变区”指如本文所定义的抗体的轻链和/或重链中能够特异性结合抗原的部分,并包含互补决定区(cdr;即cdr1、cdr2和cdr3)以及框架区(fr)的氨基酸序列。例如,可变区包含三个或四个fr(例如,fr1、fr2、fr3和任选地fr4)以及三个cdr。vh指重链的可变区。vl指轻链的可变区。
[0270]
如本文所用,术语“互补决定区”(同义词cdr;即cdr1、cdr2和cdr3)是指抗体可变区的氨基酸残基,其存在是特异性抗原结合的主要促成因素。每个可变区结构域(vh或vl)典型地有三个cdr,分别鉴定为cdr1、cdr2和cdr3。vh的cdr在本文中也分别称为cdr h1、cdr h2和cdr h3,其中cdr h1对应于vh的cdr1,cdr h2对应于vh的cdr 2,并且cdr h3对应于vh的cdr 3。同样,vl的cdr在本文中分别称为cdr l1、cdr l2和cdr l3,其中cdr l1对应于vl的cdr 1,cdr l2对应于vl的cdr 2,并且cdr l3对应于vl的cdr 3。在一个实例中,分配给cdr和fr的氨基酸位置根据以下定义:kabat sequences of proteins of immunological interest[具有免疫学意义的蛋白质的kabat序列],美国国立卫生研究院,贝塞斯达,马里兰州,1987和1991(本文中也称为“kabat编号系统”)。在另一个实例中,根据增强的chothia编号方案(enhanced chothia numbering scheme)(http://www.bioinfo.org.uk/mdex.html)定义分配给cdr和fr的氨基酸位置。本发明不限于由kabat编号系统定义的fr和cdr,而是包括所有编号系统,包括规范编号系统或chothia和lesk j.mol.biol.[分子生物学杂志]196:901-917,1987;chothia等人,nature[自然]342:877-883,1989;和/或al-lazikani等人,j.mol.biol.[分子生物学杂志]273:927-948,1997的编号系统;honnegher和pl
ü
kthun j.mol.biol.[分子生物学杂志]309:657-670,2001的编号系统;或giudicelli等人,nucleic acids res.[核酸研究]25:206-211 1997中讨论的imgt系统。在一个实例
中,根据kabat编号系统定义cdr。任选地,根据kabat编号系统的重链cdr2不包含本文所列的五种c末端氨基酸,或者那些氨基酸中的任一种或多种被另一种天然发生的氨基酸取代。在这方面,padlan等人,faseb j.[faseb杂志],9:133-139,1995确定重链cdr2的五个c末端氨基酸通常不参与抗原结合。
[0271]“框架区”(fr)是指除cdr残基以外的可变区残基。vh的fr在本文中也分别称为fr h1、fr h2、fr h3和fr h4,其中fr h1对应于vh的fr 1,fr h2对应于vh的fr 2,fr h3对应于vh的fr 3,并且fr h4对应于vh的fr 4。同样,vl的fr在本文中分别称为fr l1、fr l2、fr l3和fr l4,其中fr l1对应于vl的fr 1,fr l2对应于vl的fr 2,fr l3对应于vl的fr 3,并且fr l4对应于vl的fr 4。
[0272]
如本文所用,术语“fv”应被视为意指任何蛋白质,无论其由多个多肽还是单个多肽构成,其中vl和vh缔合并形成具有抗原结合结构域的复合物,即能够特异性结合抗原。形成抗原结合结构域的vh和vl可以位于单个多肽链中或位于不同的多肽链中。进一步地,本发明的fv(以及本发明的任何蛋白质)可具有可结合或可不结合相同抗原的多个抗原结合结构域。该术语应理解为涵盖直接衍生自抗体的片段以及对应于使用重组手段产生的此类片段的蛋白质。在一些实例中,vh未连接到重链恒定结构域(ch)1和/或vl未连接到轻链恒定结构域(cl)。示例性含有fv的多肽或蛋白质包含fab片段、fab’片段、f(ab’)片段、scfv、双体抗体、三体抗体、四体抗体或更高阶复合物、或者连接到其恒定区或结构域的前述任一项(例如,ch2或ch3结构域,例如微型抗体)。“fab片段”由免疫球蛋白的单价抗原结合片段组成,并且可通过木瓜蛋白酶消化整个抗体以生成由完整轻链和部分重链组成的片段来产生,或可使用重组方式产生。抗体的“fab”片段可通过用胃蛋白酶处理整个抗体,然后还原,以产生由完整轻链以及包含vh和单个恒定结构域的部分重链组成的分子来获得。以这种方式处理的每个抗体获得两个fab'片段。fab’片段也可以通过重组手段产生。抗体的“f(ab')2片段”由通过两个二硫键连接在一起的两个fab'片段的二聚体组成,并且通过用胃蛋白酶处理整个抗体分子(无需随后还原)来获得。“fab2”片段是包含使用例如亮氨酸拉链或ch3结构域连接的两个fab片段的重组片段。“单链fv”或“scfv”是包含抗体可变区片段(fv)的重组分子,其中轻链可变区和重链可变区通过合适的柔性多肽接头共价连接。
[0273]
如本文所用,术语“结合”在提及抗原结合蛋白或其抗原结合结构域与抗原的相互作用时意指该相互作用取决于抗原上特定结构(例如,抗原决定簇或表位)的存在。例如,抗体识别并结合特定的蛋白质结构,而不是一般情况的蛋白质。如果抗体与表位“a”结合,则含有表位“a”的分子(或游离的、未标记的“a”)在含有经标记的“a”和该蛋白质的反应中的存在将减少与抗体结合的经标记的“a”的量。
[0274]
如本文所用,术语“特异性结合(specifically binds或binds specifically)”应被视为意指本发明的抗原结合蛋白与特定抗原或表达相同抗原的细胞以与替代性抗原或细胞相比更频繁、更快速地、更大的持续时间和/或更大的亲和力反应或缔合。例如,抗原结合蛋白与纤溶酶原(例如,人纤溶酶原)结合的亲和力比与其他相关分子(如其他丝氨酸蛋白酶)结合的亲和力实质上更大(例如,1.5倍或2倍或5倍或10倍或20倍或40倍或60倍或80倍至100倍或150倍或200倍)。在本发明的一个实例中,抗原结合蛋白“特异性结合”纤溶酶原(优选人),其亲和力是与纤溶酶结合的至少1.5倍或2倍或更高(例如,5倍或10倍或20倍或50倍或100倍或200倍)。通常,但不是必须的,提及结合意味着特异性结合,并且每个术语
应理解为对另一个术语提供明确的支持。
[0275]
如本文所用,术语“不可检测地结合”应理解为意指抗原结合蛋白,例如抗体,以高于背景小于10%或8%或6%或5%的水平结合候选抗原。背景可以是在不存在蛋白质和/或存在阴性对照蛋白(例如,同种型对照抗体)的情况下检测到的结合信号水平和/或在存在阴性对照抗原的情况下检测到的结合水平。使用生物传感器分析(例如biacore)检测结合水平,其中抗原结合蛋白被固定并与抗原接触。
[0276]
如本文所用,术语“不显著地结合”应理解为意指本发明的抗原结合蛋白与多肽的结合水平在统计学上不显著高于背景,例如在不存在抗原结合蛋白和/或存在阴性对照蛋白(例如,同种型对照抗体)的情况下检测到的结合信号水平和/或在存在阴性对照多肽的情况下检测到的结合水平。使用生物传感器分析(例如biacore)检测结合水平,其中抗原结合蛋白被固定并与抗原接触。
[0277]
如本文所用,术语“表位”(同义词“抗原决定簇”)应理解为意指包含抗体的抗原结合结构域的抗原结合蛋白结合的纤溶酶原区域。除非另有定义,否则该术语不必限于抗原结合蛋白进行接触的特定残基或结构。例如,该术语包括跨越抗原结合蛋白所接触氨基酸的区域和该区域外的5-10个(或更多个)或2-5个或1-3个氨基酸。在一些实例中,表位包含一系列不连续的氨基酸,当抗原结合蛋白折叠时,这些氨基酸彼此靠近,即“构象表位”。熟练的技术人员还将意识到术语“表位”不限于肽或多肽。例如,术语“表位”包括分子的化学活性表面分组,如糖侧链、磷酰基侧链或磺酰基侧链,并且在某些实例中,可以具有特定的三维结构特征和/或特定的电荷特征。
[0278]
如本文所用,术语“病症”指正常功能的中断或干扰,并且不限于任何特定病症,并将包括疾病或障碍。
[0279]
如本文所用,术语“预防(preventing、prevent或prevention)”包括施用本发明的抗原结合蛋白以从而停止或阻碍病症的至少一种症状的发展。该术语还涵盖对缓解期受试者进行的用以预防或阻碍复发的治疗。
[0280]
如本文所用,术语“治疗(treating、treat或treatment)”包括施用本文所述的抗原结合蛋白以从而减少或消除特定疾病或病症的至少一种症状。
[0281]
如本文所用,术语“受试者”应指包括人在内的任何动物,例如哺乳动物。示例性受试者包括但不限于人和非人灵长类动物。例如,受试者是人。
[0282]
抗体
[0283]
在一个实例中,根据任何实例如本文所述的抗原结合蛋白或纤溶酶原结合蛋白是抗体。
[0284]
用于产生抗体的方法是本领域已知的和/或描述于harlow和lane(编辑)antibodies:a laboratory manual[抗体:实验室手册],冷泉港实验室,(1988)中。通常,在此类方法中,将任选地与任何合适或期望的载体、佐剂或药学上可接受的赋形剂一起配制的纤溶酶原(例如,人纤溶酶原)或其区域(例如,细胞外区域)或其免疫原性片段或表位或表达和展示其的细胞(即,免疫原)施用至非人动物,例如,小鼠、鸡、大鼠、兔子、豚鼠、狗、马、牛、山羊或猪。免疫原可以通过鼻内、肌内、皮下、静脉内、皮内、腹膜内或其他已知途径施用。
[0285]
多克隆抗体的产生可以通过在免疫后的不同时间点对免疫动物的血液取样来监
测。如果需要实现期望的抗体滴度,可以进行一次或多次进一步的免疫接种。重复加强和滴定的过程,直到实现合适的滴度。当获得期望水平的免疫原性时,将免疫的动物放血,并且分离和储存血清,和/或用动物来产生单克隆抗体(mab)。
[0286]
单克隆抗体是本发明考虑的抗体的一种示例性形式。术语“单克隆抗体”或“mab”是指能够结合一种或多种相同抗原,例如抗原内相同表位的同质抗体群。该术语并不旨在就抗体来源或其制备方式进行限制。
[0287]
对于mab的生产,可以使用许多已知技术中的任一种,例如像,在us 4196265或harlow和lane(1988),同上中举例说明的程序。
[0288]
例如,在足以刺激抗体产生细胞的条件下,用免疫原免疫合适的动物。啮齿动物如兔子、小鼠和大鼠是示例性动物。经基因工程化以表达人抗体的小鼠,例如不表达鼠抗体的小鼠,也可以用于产生本发明的抗体(例如,如wo 2002/066630中所述)。
[0289]
在免疫后,选择具有产生抗体潜力的体细胞,特别是b淋巴细胞(b细胞),用于mab产生方案。这些细胞可以从脾脏、扁桃体或淋巴结的活组织检查中获得,或者从外周血样中获得。然后将来自免疫动物的b细胞与永生骨髓瘤细胞(通常来源于与用免疫原免疫的动物相同的物种)融合。
[0290]
通过在选择性培养基中培养来扩增杂交体,该选择性培养基包含阻断组织培养基中核苷酸从头合成的试剂。示例性试剂是氨基蝶呤、甲氨蝶呤和重氮丝氨酸。
[0291]
使扩增的杂交瘤经受抗体特异性和/或滴度的功能选择,例如像通过流式细胞术和/或免疫组织化学和/或免疫测定(例如放射免疫测定、酶免疫测定、细胞毒性测定、噬斑测定、斑点免疫测定等)。
[0292]
可替代地,将abl-myc技术(美国麦迪逊wi 53713的neoclone公司(neoclone,madison wi 53713,usa))用于产生分泌mab的细胞系(例如,如largaespada等人,j.immunol.methods.[免疫学方法杂志]197:85-95,1996中所述)。
[0293]
还可以通过筛选展示文库,例如噬菌体展示文库来产生或分离抗体,例如,如us6300064和/或us 5885793中所述。例如,本发明人已经从噬菌体展示文库中分离了全人抗体。
[0294]
本发明的抗体可以是合成抗体。例如,该抗体是嵌合抗体、人源化抗体、人抗体同人源化抗体、灵长类化抗体或去免疫抗体。
[0295]
含抗体结合结构域的蛋白质
[0296]
单结构域抗体
[0297]
在一些实例中,本发明的蛋白质是或包含单结构域抗体(其可与术语“结构域抗体”或“dab”互换使用)。单结构域抗体是包含抗体的全部或部分重链可变区的单一多肽链。在某些实例中,单结构域抗体是人单结构域抗体(多曼提斯公司(domantis,inc.),沃尔瑟姆,马萨诸塞州;参见例如us 6248516)。
[0298]
双体抗体、三体抗体、四体抗体
[0299]
在一些实例中,本发明的蛋白质是或包含如wo 98/044001和/或wo 94/007921中所述的那些的双体抗体、三体抗体、四体抗体或更高阶蛋白质复合物。
[0300]
例如,双体抗体是包含两条缔合的多肽链的蛋白质,每条多肽链包含结构v
l-x-vh或v
h-x-v
l
,其中v
l
是抗体轻链可变区,vh是抗体重链可变区,x是包含不足以使单个多肽链
中的vh和v
l
缔合(或形成fv)的残基的接头或者不存在,并且其中一条多肽链的vh与另一条多肽链的v
l
结合以形成抗原结合结构域,即,形成能够特异性结合一种或多种抗原的fv分子。v
l
和vh在每条多肽链中可以相同,或者v
l
和vh在每条多肽链中可以不同,以形成双特异性双体抗体(即,包含两种具有不同特异性的fv)。
[0301]
单链fv(scfv)
[0302]
本领域技术人员将知道,scfv包含单个多肽链中的vh和v
l
区以及vh和v
l
之间的多肽接头,该接头使scfv能够形成抗原结合所期望的结构(即,使单个多肽链的vh和v
l
彼此缔合以形成fv)。例如,该接头包含超过12个氨基酸残基,其中(gly4ser)3是scfv的更有利接头之一。
[0303]
本发明还设想了二硫键稳定的fv(或difv或dsfv),其中将单个半胱氨酸残基引入vh的fr和v
l
的fr中,并且半胱氨酸残基通过二硫键连接以产生稳定的fv。
[0304]
可替代地或另外,本发明涵盖二聚scfv,即包含两个通过非共价或共价键连接的scfv分子的蛋白质,例如,通过亮氨酸拉链结构域(例如,衍生自fos或jun)连接。可替代地,两个scfv通过具有足够长度的肽接头连接,以使两个scfv形成并结合抗原,例如,如us 20060263367中所述。
[0305]
重链抗体
[0306]
重链抗体在结构上不同于许多其他形式的抗体,只要它们包含重链但不包含轻链。因此,这些抗体也被称为“仅重链抗体”。例如,在骆驼和软骨鱼中发现了重链抗体(也称为ignar)。
[0307]
为了将其与常规4链抗体中存在的重链可变区(称为“vh结构域”)和常规4链抗体中存在的轻链可变区(称为“v
l
结构域”)区分开,天然发生的重链抗体中存在的可变区在骆驼抗体中通常称为“v
hh
结构域”,并且在ignar中称为v-nar。
[0308]
对骆驼重链抗体及其可变区以及生产和/或分离和/或使用它们的方法的一般描述可在以下参考文献wo 94/04678、wo 97/49805和wo 97/49805中找到。
[0309]
关于软骨鱼重链抗体及其可变区以及生产和/或分离和/或使用它们的方法的一般描述尤其可在wo 2005/118629中找到。
[0310]
包含其抗原结合结构域的其他抗体和蛋白质
[0311]
本发明还设想了其他抗体和包含其抗原结合结构域的蛋白质,如:
[0312]
(i)如us 5731168中所述的“匙孔”双特异性蛋白质;
[0313]
(ii)异源缀合物蛋白质,例如,如us 4676980中所述;
[0314]
(iii)使用化学交联剂产生的异源缀合物蛋白质,例如,如us 4676980中所述;以及(iv)fab3(例如,如ep 19930302894中所述)。
[0315]
蛋白质突变
[0316]
本发明还提供了一种抗原结合蛋白或编码该蛋白的核酸,该核酸与本文披露的序列具有至少80%的同一性。在一个实例中,本发明的抗原结合蛋白或核酸包含与本文披露的序列至少约85%或90%或95%或97%或98%或99%相同的序列。
[0317]
可替代地或另外,抗原结合蛋白包含与本文根据任何实例所述的vh或v
l
的一个或多个cdr至少约80%或85%或90%或95%或97%或98%或99%相同的cdr(例如,三个cdr)。
[0318]
在另一个实例中,本发明的核酸包含与编码具有本文根据任何实例所述的功能的
抗原结合蛋白的序列至少约80%或85%或90%或95%或97%或98%或99%相同的序列。本发明还涵盖编码本发明的抗原结合蛋白的核酸,由于遗传密码的简并性,其不同于本文举例说明的序列。
[0319]
核酸或多肽的同一性%通过gap(needleman和wunsch.mol.biol.[分子生物学杂志]48,443-453,1970)分析(gcg程序)测定,其中间隙产生罚分=5,且间隙延伸罚分=0.3。查询序列的长度为至少50个残基,gap分析将两个序列在至少50个残基的区域上对齐。例如,查询序列的长度为至少100个残基,gap分析将两个序列在至少为100个残基的区域上对齐。例如,将两个序列在其整个长度上对齐。
[0320]
本发明还设想了在严格杂交条件下与编码本文所述抗原结合位点的核酸杂交的核酸。“中等严格”在本文中定义为在2x ssc缓冲液、0.1%(w/v)sds中在45℃至65℃范围内的温度或等同条件下进行的杂交和/或洗涤。“高严格”在本文中定义为在0.1x ssc缓冲液、0.1%(w/v)sds或较低盐浓度中,在至少65℃的温度或等同条件下进行的杂交和/或洗涤。本文提及的特定严格水平涵盖使用本领域技术人员已知的ssc以外的洗涤/杂交溶液的等同条件。例如,本领域已知用于计算双链核酸的链将解离的温度(也称为解链温度或tm)的方法。类似于(例如,在5℃或10℃内)或等于核酸tm的温度被认为是高严格。中等严格应被认为在计算的核酸tm的10℃至20℃或10℃至15℃内。
[0321]
本发明还设想了本发明的抗原结合蛋白的突变形式,该抗原结合蛋白的突变形式与本文所示序列相比包含一个或多个保守氨基酸取代。在一些实例中,抗原结合蛋白包含10个或更少,例如9或8或7或6或5或4或3或2或1个保守氨基酸取代。“保守氨基酸取代”是指其中氨基酸残基被具有类似侧链和/或亲水性和/或亲合性的氨基酸残基替换的取代。
[0322]
具有类似侧链的氨基酸残基的家族已在现有技术中定义,所述侧链包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)及芳族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。亲合性指数描述于例如kyte和doolittle j.mol.biol.[分子生物学杂志],157:105-132,1982中,并且亲水性指数描述于例如us 4554101中。
[0323]
本发明还设想了非保守氨基酸变化。例如,特别感兴趣的是用另一种带电荷的氨基酸和用中性或带正电的氨基酸取代带电荷的氨基酸。在一些实例中,抗原结合蛋白包含10个或更少,例如,9或8或7或6或5或4或3或2或1个非保守氨基酸取代。
[0324]
在一个实例中,一个或多个突变发生在本发明的抗原结合蛋白的抗原结合结构域的fr内。在另一个实例中,一个或多个突变发生在本发明的抗原结合蛋白的cdr内。
[0325]
用于产生抗原结合蛋白突变形式的示例性方法包括:
[0326]
·
dna突变(thie等人,methods mol.biol.[分子生物学方法]525:309-322,2009)或rna(kopsidas等人,immunol.lett.[免疫学快报]107:163-168,2006;kopsidas等人bmc biotechnology[bmc生物技术],7:18,2007;和wo 1999/058661);
[0327]
·
将编码该多肽的核酸引入突变细胞(例如xl-1red、xl muts和xl muts kanr细菌细胞(斯特拉塔根公司(stratagene)))中;
[0328]
·
dna改组,例如,如stemmer,nature[自然]370:389-91,1994中所披露;以及
[0329]
·
定点突变,例如,如dieffenbach(编辑)和dveksler(编辑)(于:pcr primer:a laboratory manual[pcr引物:实验室手册],纽约冷泉港实验室,1995中)所述。
[0330]
用于确定本发明的突变型抗原结合蛋白的生物活性的示例性方法对于本领域技术人员将而言是显而易见的和/或在本文中进行了描述,例如抗原结合。例如,本文描述了用于确定抗原结合、结合的竞争抑制、亲和力、缔合、解离和治疗功效的方法。
[0331]
恒定区
[0332]
本发明涵盖本文所述的抗原结合蛋白和/或包含抗体恒定区的抗体。这包括融合到fc的抗体的抗原结合片段。
[0333]
可用于产生本发明的蛋白质的恒定区序列可从许多不同来源获得。在一些实例中,蛋白质的恒定区或其部分衍生自人抗体。其恒定区或部分可衍生自任何抗体类别,包括igm、igg、igd、iga和ige;以及任何抗体同种型,包括igg1、igg2、igg3和igg4。在一个实例中,恒定区为人同种型igg4或稳定的igg4恒定区。
[0334]
在一个实例中,恒定区的fc区具有减少的诱导效应子功能的能力,例如,与天然或野生型人igg1或igg3 fc区相比。在一个实例中,效应子功能为抗体依赖性细胞介导的细胞毒性(adcc)和/或抗体依赖性细胞介导的吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)。用于评估含有fc区的蛋白质的效应子功能水平的方法是本领域已知的和/或在本文中进行了描述。
[0335]
在一个实例中,fc区是igg4 fc区(即,来自igg4恒定区),例如人igg4 fc区。合适的igg4 fc区的序列对于技术人员来说是显而易见的,和/或可以在公开可用的数据库中获得(例如,可以从国家生物技术信息中心(national center for biotechnology information)获得)。
[0336]
在一个实例中,恒定区是稳定的igg4恒定区。术语“稳定的igg4恒定区”将被理解为意指如下的igg4恒定区,该igg4恒定区已被修饰以减少fab臂交换或者经历fab臂交换的倾向或者半抗体的形成或者形成半抗体的倾向。“fab臂交换”是指对人igg4进行的一种类型的蛋白质修饰,其中igg4重链和附接的轻链(半分子)被转换为来自另一个igg4分子的重-轻链对。因此,igg4分子可能获得两个不同的fab臂,识别两种不同的抗原(产生双特异性分子)。fab臂交换在体内天然发生,并可通过纯化的血细胞或还原剂(如还原型谷胱甘肽)在体外诱导。当igg4抗体解离形成两个分子,每个分子包含单一重链和单一轻链时,就会形成“半抗体”。
[0337]
在一个实例中,稳定的igg4恒定区包含根据kabat系统的铰链区位置241处的脯氨酸(kabat等人,sequences of proteins of immunological interest[具有免疫学意义的蛋白质的序列]华盛顿特区美国卫生和公共服务部(washington dc united states department of health and human services),1987和/或1991)。根据eu编号系统(kabat等人,sequences of proteins of immunological interest[具有免疫学意义的蛋白质的序列]华盛顿特区美国卫生和公共服务部(washington dc united states department of health and human services),2001和edelman等人,proc.natl.acad.usa[美国国家科学院院刊],63,78-85,1969),该位置对应于铰链区的位置228。在人igg4中,这种残基通常是丝氨酸。在丝氨酸取代脯氨酸之后,igg4铰链区包含序列cppc。在这方面,本领域技术人员将知道,“铰链区”是抗体重链恒定区中富含脯氨酸的部分,其连接向抗体的两个fab臂赋予
移动性的fc和fab区。铰链区包含参与重链间二硫键的半胱氨酸残基。根据kabat的编号系统,它通常被定义为从人igg1的glu226延伸至pro243。通过将形成重链间二硫键(s-s)的第一个和最后一个半胱氨酸残基放置在相同位置,其他igg同种型的铰链区可与igg1序列对齐(例如,参见wo 2010/080538)。
[0338]
稳定的igg4抗体的其他实例是其中人igg4重链恒定区中位置409(根据eu编号系统)处的精氨酸被赖氨酸、苏氨酸、甲硫氨酸或亮氨酸取代的抗体(例如,如wo2006/033386中所述)。恒定区的fc区可另外或可替代地包含选自由以下组成的组的残基:对应于405的位置处的丙氨酸、缬氨酸、甘氨酸、异亮氨酸和亮氨酸(根据eu编号系统)。任选地,铰链区包含位置241处的脯氨酸(即,cppc序列)(如上所述)。
[0339]
在另一个实例中,fc区是经修饰以具有减少的效应子功能的区域,即“非免疫刺激fc区”。例如,fc区是包含在选自由268、309、330和331组成的组的一个或多个位置处的取代的igg1 fc区。在另一个实例中,fc区是包含一个或多个以下变化e233p、l234v、l235a以及g236的缺失和/或一个或多个以下变化a327g、a330s和p331s的igg1 fc区(armour等人,eur j immunol.[欧洲免疫学杂志]29:2613-2624,1999;shields等人,j biol chem.[生物化学杂志]276(9):6591-604,2001)。非免疫刺激性fc区的另外的实例描述于例如dall'acqua等人,j immunol.[免疫学杂志]177:1129-1138 2006;和/或hezareh j virol[病毒学杂志];75:12161-12168,2001中。
[0340]
在另一个实例中,fc区是嵌合fc区,例如,包含来自igg4抗体的至少一个ch2结构域和来自igg1抗体的至少一个ch3结构域,其中该fc区包含在选自由240、262、264、266、297、299、307、309、323、399、409和427(eu编号)组成的组的一个或多个氨基酸位置处的取代(如wo 2010/085682中所述)。示例性取代包括240f、262l、264t、266f、297q、299a、299k、307p、309k、309m、309p、323f、399s和427f。
[0341]
另外的修饰
[0342]
本发明还设想了对包含fc区或恒定区的抗体或抗原结合蛋白的另外的修饰。
[0343]
例如,抗体包含增加蛋白质半衰期的一个或多个氨基酸取代。例如,抗体包含含有增加fc区对新生儿fc区(fcrn)的亲和力的一个或多个氨基酸取代的fc区。例如,fc区在较低ph,例如约ph 6.0下对fcrn的亲和力增加,以促进fc/fcrn在核内体中的结合。在一个实例中,与在约ph 7.4下的亲和力相比,fc区在约ph 6下对fcrn的亲和力增加,这有利于fc在细胞再循环后重新释放到血液中。这些氨基酸取代而可用于通过减少从血液中的清除来延长蛋白质的半衰期。
[0344]
根据eu编号系统,示例性氨基酸取代包括t250q和/或m428l或t252a、t254s和t266f或m252y、s254t和t256e或h433k和n434f。另外或替代的氨基酸取代描述于例如us 20070135620或us 7083784中。
[0345]
蛋白质产生
[0346]
在一个实例中,通过在足以产生蛋白质的条件下(例如,如本文所述和/或本领域已知的)培养杂交瘤来产生本文根据任何实例所述的抗原结合蛋白质
[0347]
重组表达
[0348]
在另一个实例中,本文根据任何实例所述的抗原结合蛋白都是重组的。
[0349]
在重组蛋白的情况下,编码该重组蛋白的核酸可被克隆到表达构建体或载体中,
然后将这些表达构建体或载体转染到不以其他方式产生该蛋白质的宿主细胞中,例如大肠杆菌细胞、酵母细胞、昆虫细胞或哺乳动物细胞如猿猴cos细胞、中国仓鼠卵巢(cho)细胞、人胚肾(hek)细胞、或骨髓瘤细胞。用于表达蛋白质的示例性细胞为cho细胞、骨髓瘤细胞或hek细胞。实现这些目的的分子克隆技术是本领域已知的,并且描述于例如ausubel等人(编辑),current protocols in molecular biology[分子生物学现代方法],格林出版社联合公司以及威利跨学科(1988,包括到目前为止的所有更新)或sambrook等人,molecular cloning:a laboratory manual[分子克隆:实验室手册],冷泉港实验室出版社(1989)中。很多克隆和体外扩增方法适合于构建重组核酸。生产重组抗体的方法也是本领域已知的,参见例如us 4816567或us 5530101。
[0350]
分离后,将核酸可操作地连接到表达构建体或表达载体中的启动子,以进一步在无细胞系统或细胞中克隆(扩增dna)或表达。
[0351]
如本文所用,术语“启动子”要在其最广泛的背景下看待并包含基因组基因的转录调控序列,包括准确转录起始所需的tata盒或起始元件,具有或不具有改变核酸的表达(例如,响应于发育和/或外部刺激,或以组织特异性方式)的另外的调控元件(例如,上游激活序列、转录因子结合位点、增强子和沉默子)。在本上下文中,术语“启动子”还用于描述重组、合成或融合核酸,或者赋予、激活或增强与其可操作连接的核酸的表达的衍生物。示例性启动子可包含一个或多个特定调控元件的另外的拷贝,以进一步增强所述核酸的表达和/或改变其空间表达和/或时间表达。
[0352]
如本文所用,术语“可操作地连接到”意指相对于核酸定位启动子,使得核酸的表达由启动子控制。
[0353]
许多用于在细胞中表达的载体是可用的。载体组分通常包括但不限于以下一项或多项:信号序列、编码蛋白质的序列(例如,衍生自本文提供的信息)、增强子元件、启动子和转录终止序列。本领域技术人员将知道用于表达蛋白质的合适序列。示例性信号序列包括原核分泌信号(例如pelb、碱性磷酸酶、青霉素酶、ipp或热稳定肠毒素ii)、酵母分泌信号(例如转化酶前导物、α因子前导物或酸性磷酸酶前导物)或哺乳动物分泌信号(例如单纯疱疹病毒gd信号)。
[0354]
哺乳动物细胞中有活性的示例性启动子包括巨细胞病毒立即早期启动子(cmv-ie)、人延伸因子1-α启动子(ef1)、小核rna启动子(u1a和u1b)、α-肌球蛋白重链启动子、猿猴病毒40启动子(sv40)、罗斯肉瘤病毒启动子(rsv)、腺病毒主要晚期启动子、β-肌动蛋白启动子;包含cmv增强子/β-肌动蛋白启动子或免疫球蛋白启动子的混合调节元件或其活性片段。有用的哺乳动物宿主细胞系的实例为sv40转化的猴肾cv1系(cos-7,atcc crl 1651);人胚肾系(293或293细胞亚克隆,用于悬浮培养生长;幼仓鼠肾细胞(bhk,atcc ccl 10);或中国仓鼠卵巢细胞(cho)。
[0355]
适于在酵母细胞(例如像选自包括毕赤酵母、酿酒酵母和波姆酵母的组的酵母细胞)中表达的典型启动子包括但不限于adh1启动子、gal1启动子、gal4启动子、cup1启动子、pho5启动子、nmt启动子、rpr1启动子或tef1启动子。
[0356]
本领域技术人员已知用于将分离的核酸或包含其的表达构建体引入细胞中以进行表达的方法。用于给定细胞的技术取决于已知的成功技术。将重组dna引入细胞中的方法包括微注射、由deae-葡聚糖介导的转染、由脂质体介导的转染如通过使用脂质转染胺(吉
博科公司(gibco),马里兰州,美国)和/或cellfectin(吉博科公司,马里兰州,美国)、peg介导的dna摄取、电穿孔和微粒轰击如通过使用dna涂覆的钨或金颗粒(agracetus公司,威斯康星州,美国)等。
[0357]
用于产生该蛋白质的宿主细胞可在多种培养基中培养,取决于所用的细胞类型。可商购的培养基如ham的fl0(西格玛公司(sigma))、最低必需培养基((mem)(西格玛公司)、rpml-1640(西格玛公司)和杜尔贝科氏改良伊格培养基((dmem),西格玛公司)适合于培养哺乳动物细胞。用于培养本文讨论的其他细胞类型的培养基是本领域已知的。
[0358]
蛋白质的分离
[0359]
用于分离蛋白质的方法是本领域已知的和/或在本文中进行了描述。
[0360]
当抗原结合蛋白被分泌到培养基中时,可首先使用可商购蛋白质浓缩过滤器(例如,艾美康恩公司(amicon)或密理博皮里康恩公司(millipore pellicon)超滤装置)浓缩来自此类表达系统的上清液。可在前述任何步骤中包含如pmsf等的蛋白酶抑制剂以抑制蛋白质水解,且可包含抗生素以防止外来污染物的生长。可替代地或另外,可以从表达该蛋白质的细胞中过滤和/或分离上清液,例如,使用连续离心。
[0361]
从细胞制备的抗原结合蛋白可使用例如离子交换、羟基磷灰石色谱、疏水相互作用色谱、凝胶电泳、透析、亲和色谱(例如,蛋白质a亲和色谱或蛋白质g色谱)或前述的任何组合来纯化。这些方法是本领域已知的,并描述于例如wo 99/57134或ed harlow和david lane(编辑)antibodies:a laboratory manual[抗体:实验室手册],冷泉港实验室,(1988)中。
[0362]
本领域技术人员还将知道,该蛋白质可被修饰以包含便于纯化或检测的标签,例如聚组氨酸标签(例如六组氨酸标签)、或流感病毒血凝素(ha)标签、或猿猴病毒5(v5)标签、或flag标签、或谷胱甘肽s-转移酶(gst)标签。然后使用本领域已知的方法纯化(如亲和纯化)所得蛋白质。例如,通过使包含该蛋白质的样品与特异性结合固定在固体或半固体支持物上的六组氨酸标签的镍-次氮基三乙酸(ni-nta)接触,洗涤样品以去除未结合的蛋白质,随后洗脱结合的蛋白质,来纯化包含六组氨酸标签的蛋白质。可替代地或另外,在亲和纯化方法中使用结合标签的配体或抗体。
[0363]
抗原结合蛋白的活性测定
[0364]
与纤溶酶原及其突变体结合
[0365]
本领域技术人员从本文的披露内容中将清楚地看到,本发明的抗原结合蛋白结合纤溶酶原/纤溶酶。用于评估与蛋白质的结合的方法是本领域已知的,例如描述于scopes(于:protein purification:principles and practice[蛋白质纯化:原理与实践],第三版,施普林格维拉格(springer verlag),1994)中。这种方法通常涉及固定抗原结合蛋白并使其与标记抗原(纤溶酶原)接触。在洗涤以去除非特异性结合蛋白后,检测标记的量以及因此结合的抗原的量。当然,可以标记抗原结合蛋白并固定抗原。也可以使用平移式测定。可替代地或另外,可以使用表面等离子体共振测定。
[0366]
任选地,测定针对纤溶酶原或其表位的固定化抗原结合蛋白的解离常数(kd)、缔合常数(ka)和/或亲和常数(kd)。在一个实例中,纤溶酶原结合蛋白的“kd”或“ka”或“k
d”通过放射性标记或荧光标记的纤溶酶原配体结合测定法来测量。在“kd”的情况下,在一系列滴定的未标记的纤溶酶原存在下,该测定用最小浓度的标记的纤溶酶原或其表位平衡抗原
结合蛋白。在洗涤除去未结合的纤溶酶原或其表位后,测定标记的量,其指示蛋白质的kd。
[0367]
根据另一个实例,kd、ka或kd通过使用表面等离子体共振测定法来测量,例如,使用具有固定化纤溶酶原或纤溶酶或其区域或固定化抗原结合蛋白的biacore表面等离子体共振(新泽西州皮斯卡塔韦的biacore公司(biacore,inc.,piscataway,nj))。
[0368]
测定抑制活性
[0369]
本发明的抗原结合蛋白优选地能够抑制纤溶酶原激活和/或纤溶酶活性。
[0370]
本领域已知各种测定法用于评估蛋白质抑制或降低纤溶酶原激活为纤溶酶的能力。
[0371]
在一个实例中,抗原结合蛋白抑制任何纤溶酶原激活物(纤溶酶原激活物)与纤溶酶原的结合。优选地,本发明的抗原结合蛋白结合纤溶酶原并防止纤溶酶原在激活环中的结合和/或切割,优选地,其中arg
561-val
562
处的切割被防止、减少或抑制。
[0372]
优选地,本发明的抗原结合蛋白抑制或防止任何已知纤溶酶原激活物对纤溶酶原的激活,该纤溶酶原激活物包括但不限于:链激酶(sk)、组织-纤溶酶原激活物(tpa)或尿激酶-纤溶酶原激活物(upa)。其活性通过本发明的抗原结合蛋白与纤溶酶原的结合而被抑制的纤溶酶原激活物可以是由宿主生物体(例如,在人体中)产生的纤溶酶原激活物,或者可以是由细菌病原体分泌或产生的以激活宿主中的纤溶酶原。因此,宿主或病原体纤溶酶原激活物对纤溶酶原的激活可以被本发明的抗原结合蛋白抑制或阻止。
[0373]
本发明的抗原结合蛋白还可以抑制纤溶酶原与病原体的结合,包括抑制或防止纤溶酶原与细菌的结合。这种抑制作用可能与纤溶酶原与细菌孢子或细菌的营养形式的结合有关。抑制纤溶酶原与病原体的结合优选地抑制纤溶酶原激活为纤溶酶。
[0374]
例如在实例2、6和7中,本文描述了用于测定纤溶酶原激活的抑制、纤溶酶原激活物与纤溶酶原结合的抑制和纤溶酶原与病原体结合的抑制的示例性方法。
[0375]
测定抑制活性
[0376]
本发明的抗原结合蛋白还能够抑制纤溶酶活性,包括以与纤溶酶活性的生理抑制剂或纤溶酶活性的药理学抑制剂相当或显著更高的水平抑制纤溶酶介导的凝块溶解。
[0377]
本领域已知各种测定法用于评估蛋白质抑制或降低纤溶酶活性的能力。
[0378]
在一个实例中,抗原结合蛋白抑制纤溶酶对任何底物的蛋白水解。优选地,本发明的抗原结合蛋白结合纤溶酶,并防止丝氨酸蛋白酶结构域结合和/或切割纤溶酶底物。优选地,本发明的抗原结合蛋白结合或空间屏蔽纤溶酶的催化三联体,使得催化三联体不能切割纤溶酶底物,其中催化三联体包含seq id no:65的残基his603、asp646和ala/ser741(其等同于使用胰凝乳蛋白酶编号的his57、asp102和ser195)。因此,在优选的实施例中,本发明的抗原结合蛋白是抗催化抗原结合蛋白。
[0379]
优选地,本发明的抗原结合蛋白抑制或防止切割纤溶酶的任何已知底物,包括但不限于:纤维蛋白、纤维蛋白原、因子v、因子viii和因子x、蛋白酶激活受体i、纤连蛋白、血小板反应蛋白、层粘连蛋白、血管性血友病因子、玻连蛋白、前脑源性神经营养因子、补体c3和c5、腱生蛋白、骨钙素、含cub结构域的蛋白1和其他蛋白酶如胶原酶。
[0380]
例如在实例2和10中,本文描述了用于测定纤溶酶活性抑制的示例性方法。
[0381]
本发明的抗原结合蛋白还可用于需要检测生物样品中纤溶酶和/或纤溶酶原的应用中。例如,本发明的抗原结合蛋白可用于诊断应用,包括蛋白质用于组织学和elisa以及
类似应用,由此抗原结合蛋白与靶蛋白的结合可以提供有用的诊断信息。
[0382]
待治疗的病症
[0383]
本发明的抗原结合蛋白可用于治疗需要抑制纤溶酶原转化为纤溶酶(即,抑制纤溶酶原激活)和/或抑制纤溶酶活性的病症。
[0384]
活性纤溶酶对靶底物具有极其广泛的特异性。因此,纤溶酶靶包括纤维蛋白、纤维蛋白原、补体组分3、补体组分5、玻连蛋白、骨钙素、因子v、因子viii和因子x、蛋白酶激活受体、损伤诱导的聚集蛋白和一些胶原酶。纤溶酶还可以靶向关键的纤溶酶原激活物tpa和upa,以建立正反馈循环。
[0385]
纤溶酶是一种高效的酶,使得如果不加抑制,纤溶酶可以快速耗尽循环中纤维蛋白原的全部储备,从而导致在几分钟内出现全身性大出血状态。因此,在正常生理条件下,活性纤溶酶仅存在于靶位点的表面(如纤维蛋白凝块或细胞表面)上。
[0386]
在严重创伤患者中,在创伤的急性期经常观察到凝血病。创伤诱导的凝血病是由创伤本身引起的凝血病。创伤诱导的凝血病的病理生理学包括凝血激活、超纤维蛋白(基因)溶解和消耗性凝血病。这些病理生理机制是具有纤维蛋白溶解表型的dic的特征。
[0387]
纤维蛋白溶解失调是创伤性凝血病的重要机制。这是一个尚未完全理解的过程,包括从过度分解(纤溶亢进)到纤维蛋白溶解停止的范围。纤溶亢进和停止二者都与死亡率过高和创伤后器官衰竭相关。病理生理学似乎与内皮损伤和低灌注有关,鉴定出的几种分子标志物在其中发挥了作用。这种情况部分地是由促纤维蛋白溶解tpa过度上调介导的,而抗纤维蛋白溶解pai-1没有随之增加,从而导致纤溶酶原过度激活为纤溶酶。因此,在某些创伤病例中,需要抑制过度的纤溶酶原激活,这可以使用本发明的抗原结合蛋白来完成。
[0388]
仍进一步,一些以过度的纤溶酶原激活为特征的病症包括以血浆纤溶酶原激活物水平升高(其与人组织和血管内皮中的水平在物理上和免疫学上相关)为特征的病症。由于异常纤维蛋白溶解而引起的血栓性或大出血性障碍也可能由纤维蛋白溶解系统的先天性或获得性异常引起。
[0389]
本发明的抗原结合蛋白可用于最小化或减少手术、损伤后或凝血因子缺乏个体的大出血或出血。在这种情况下使用抗原结合蛋白抑制纤溶酶介导的纤维蛋白溶解或凝块解凝,从而减少失血并降低或最小化输血需求。输血伴随着高风险的不匹配、过敏反应、多器官功能障碍和感染,从而导致发病率和死亡率增加。
[0390]
本发明的抗原结合蛋白还可以用于预防其他病症(如血友病、月经过多、血管性血友病综合征)中的出血和血栓溶解诱导的出血。
[0391]
本发明的抗原结合蛋白可用于在许多临床情况下抑制纤维蛋白溶解,包括减少已经经历心脏手术、整形外科手术、神经外科手术、肝移植、血管手术、胸外科手术、妇科手术的患者,或患有终末期肾病、围产期出血、胃肠出血、创伤、创伤性脑损伤、颅内出血和蛛网膜下腔大出血的患者的出血。换句话说,本发明的抗原结合蛋白可用于抑制处于纤维蛋白溶解亢进状态的个体中的纤溶酶。
[0392]
因此,本发明的抗原结合蛋白可用于在需要抑制纤溶酶原激活和/或抑制纤溶酶活性的广泛情况下抑制纤维蛋白溶解。
[0393]
需要抑制纤溶酶原激活(和/或纤溶酶活性)的其他病症包括以过度出血(大出血)(包括分娩后和手术(包括移植、胸外科、心脏和整形外科手术)后)为特征的病症。
[0394]
本发明的抗原结合蛋白可用于治疗或预防与细菌病原体的存在或水平增加相关或由其引起的任何病症。
[0395]
侵袭性细菌病原体在不同阶段并且通过各种机制干预哺乳动物纤溶酶原/纤溶酶系统。大量病原体表达纤溶酶(原)受体,这些受体将纤溶酶(原)固定在细菌表面上,这是一种通过哺乳动物纤溶酶原激活物增强纤溶酶原激活的事件。细菌还影响哺乳动物细胞分泌纤溶酶原激活物及其抑制剂。例如,原核生物纤溶酶原激活物链激酶和葡激酶与纤溶酶(原)形成复合物,从而增强纤溶酶原激活。鼠疫耶尔森氏菌的pla表面蛋白酶在功能上类似于哺乳动物激活物,并通过有限的蛋白水解将纤溶酶原转化为纤溶酶。本质上,纤溶酶原受体和激活物利用宿主衍生的系统将细菌转化为蛋白水解生物体。
[0396]
下文进一步描述了可以用本发明的抗原结合蛋白治疗/预防的一些示例性细菌感染。然而,应当理解的是,本发明的抗原结合蛋白的用途不限于所述的那些细菌感染。更具体地,应当理解的是,本发明的抗原结合蛋白在治疗/减少细菌病原体的侵袭方面具有普遍应用,这些细菌病原体出于侵袭宿主组织的目的分泌纤溶酶原激活物。
[0397]
在革兰氏阴性菌中,丝状表面附属物菌毛和鞭毛形成了一组主要的纤溶酶原受体。在革兰氏阳性菌中,表面结合的酶分子以及m蛋白相关结构已被鉴定为纤溶酶原受体,前一种受体类型也出现在哺乳动物细胞上。因此,由流感嗜血杆菌(haemophilus influenzae)、鼠伤寒沙门氏菌(salmonella typhimurium)、肺炎链球菌(streptococcus pneumoniae)、鼠疫耶尔森氏菌和伯氏疏螺旋体(borrelia burgdorferi)产生或激活的纤溶酶已被证明能降解哺乳动物细胞外基质。在极少的情况下,纤溶酶原激活已被证明通过重建的基底膜或上皮细胞单层增强体外细菌转移。
[0398]
化脓性链球菌或a组链球菌(gas)是一种兼性的革兰氏阳性球菌,其以链状生长,并在人类中引起多种感染,包括咽炎、扁桃体炎、猩红热、蜂窝组织炎、丹毒、风湿热、链球菌感染后的肾小球肾炎、坏死性筋膜炎、肌坏死和淋巴管炎。
[0399]
特别地,由链球菌属物种(streptococcus sp.)分泌的链激酶(sk)可以克服免疫防御并激活循环中的纤溶酶原以促进感染。据报道,链激酶通过环绕纤溶酶原的丝氨酸蛋白酶结构域直接激活纤溶酶原的闭合构象,并且一旦结合,链激酶的n末端插入蛋白酶结构域激活环以产生活性纤溶酶。已经证明本发明的抗原结合蛋白抑制链激酶与纤溶酶原的结合,从而抑制链激酶对纤溶酶原的激活。据了解,纤溶酶原激活的一个类似但略有不同的机制在与葡萄球菌属物种分泌的一种重要毒力因子葡激酶结合时发生。因此,本发明的抗原结合蛋白在治疗由革兰氏阳性菌(如链球菌属物种、葡萄球菌属物种和肠球菌属物种(enterococcus sp))引起的感染、最小化其严重程度或延缓其进展方面具有特别的效用。
[0400]
本发明的抗原结合蛋白还可用于治疗由侵袭性革兰氏阴性菌(如幽门螺杆菌、鼠疫耶尔森氏菌、沙门氏菌属物种、埃希菌属物种(escherichia spp)、弯曲杆菌属物种(campylobacter spp.)和志贺氏菌属物种(shigella spp.)以及螺旋体疏螺旋菌(borellia)(莱姆病的致病因子))引起的感染。
[0401]
如本文所用,对细菌感染的任何治疗包括降低微生物感染的症状或体征的严重程度或防止感染的进展或恶化。应当理解的是,这种治疗、减少或预防包括减少细菌数量或防止细菌扩散到宿主内的其他部位(即,减少病原体的侵袭)。
[0402]
特别地,本发明人已经证明艰难梭菌孢子形成和毒力的促进是由纤溶酶原激活介
导的。特别地,本发明人证明了纤溶酶原特异性结合艰难梭菌孢子,并且活性纤溶酶降解其表面,从而促进快速萌发。更具体地,人纤溶酶原的结合和激活直接改变艰难梭菌孢子的结构和功能特性,从而导致在生理相关的宿主萌发剂存在下更快的萌发。这可能导致更早的疾病发作和严重的疾病后果。已经证明本发明的抗原结合蛋白在降低艰难梭菌(也称为艰难拟梭菌或cdi)感染的严重程度方面具有特别的效用。
[0403]
据报道,纤溶酶原激活与血管生成的促进相关,包括在癌症的增殖/转移中。此外,已经证明纤溶酶原激活的抑制剂(例如,pai-1)可用于在癌症的情况下抑制血管生成。
[0404]
因此,本发明的抗体也可用于在受试者中治疗癌症或癌症转移或延缓其进展。示例性癌症包括囊性和实体肿瘤、骨和软组织肿瘤,包括肛门组织、胆管、膀胱、血细胞、肠、脑、乳腺、类癌、宫颈、眼、食管、头颈、肾、喉、白血病、肝、肺、淋巴结、淋巴瘤、黑色素瘤、间皮瘤、骨髓瘤、卵巢、胰腺、阴茎、前列腺、皮肤(例如鳞状细胞癌)、肉瘤、胃、睾丸、甲状腺、阴道、外阴肿瘤。软组织肿瘤包括良性单体性施旺氏细胞瘤、硬纤维瘤、脂母细胞瘤、脂肪瘤、子宫平滑肌瘤、透明细胞肉瘤、皮肤纤维肉瘤、尤因肉瘤、骨外粘液样软骨肉瘤、粘液样脂肪肉瘤、腺泡横纹肌肉瘤和滑膜肉瘤。特定骨肿瘤包括非骨化性纤维瘤、单房性骨囊肿、内生软骨瘤、动脉瘤性骨囊肿、成骨细胞瘤、软骨母细胞瘤、软骨粘液纤维瘤、骨化性纤维瘤和釉质瘤、骨巨细胞瘤、纤维发育不良、尤文肉瘤嗜酸性肉芽肿、成骨肉瘤、软骨瘤、软骨肉瘤、恶性纤维组织细胞瘤和转移癌。白血病包括急性淋巴母细胞性白血病、急性成髓细胞性白血病、慢性淋巴细胞性白血病和慢性髓细胞性白血病。
[0405]
其他实例包括乳腺肿瘤、结直肠肿瘤、腺癌、间皮瘤、膀胱肿瘤、前列腺肿瘤、生殖细胞肿瘤、肝细胞瘤/胆管细胞癌、神经内分泌肿瘤、垂体肿瘤、小20圆细胞肿瘤、鳞状细胞癌、黑色素瘤、非典型纤维黄色瘤、精原细胞瘤、非精原细胞瘤、间质莱迪希细胞瘤、塞尔托立细胞瘤(sertoli cell tumor)、皮肤肿瘤、肾肿瘤、睾丸肿瘤、脑肿瘤、卵巢肿瘤、胃肿瘤、口腔肿瘤、膀胱肿瘤、骨肿瘤、宫颈肿瘤、食管肿瘤、喉肿瘤、肝肿瘤、肺肿瘤、阴道肿瘤和威尔姆氏肿瘤。
[0406]
如本文所用,“受试者”是指动物,如哺乳动物或鸟类,包括人、猿、马、牛、绵羊、山羊、狗和猫。
[0407]
受试者可能患有细菌感染、可能已经暴露于传染性细菌、可能处于发生细菌感染的风险中,或者可能比一般群体处于更大的发生细菌感染的风险中。处于更大的发生细菌感染的风险中的受试者的实例包括经历细菌感染治疗,由此正常肠道菌群被抗菌疗法抑制的患者、免疫功能受损(例如,免疫球蛋白缺乏、脾功能障碍、脾切除术、hiv感染、白细胞功能受损、血红蛋白病)的患者、老年人、患有某些恶性肿瘤(例如,多发性骨髓瘤、慢性淋巴细胞白血病、淋巴瘤)的人、职业风险增加的人(例如,公共服务工作者,如消防、水、卫生、警察、医疗和实验室工作者、医院工作者)、封闭群体(例如,监狱、军队、疗养院)中的人以及具有可能增加他们对细菌感染易感性的免疫缺陷的其他人。
[0408]
细菌感染通常是指:
[0409]
(1)与未感染的对照样品相比,取自受试者的样品中的细菌水平升高;
[0410]
(2)与未感染的对照样品中细菌的总水平相比,取自受试者的样品中一种或多种类型细菌的比例增加;
[0411]
(3)当与未感染的对照样品相比时,取自受试者的样品中细菌相对于一种或多种
其他细菌物种的比例增加;或
[0412]
(4)当在未感染的对照中检测不到相同的细菌时,与未感染的对照样品相比,样品中存在细菌。
[0413]
受试者可以通过本文所述或本领域已知的任何方法被诊断为患有细菌感染。生物样品,如体液样品(例如血液)或组织样品或刮擦物。然后制备样品(各种方式),接着在不同的琼脂平板上用确定的培养基培养,从而将微生物分类。实时pcr是可以用于鉴定样品中细菌的另一种方法。
[0414]
急性感染是指受试者中需要快速治疗的感染,通常在15至60分钟的范围内,否则该感染可能发展到危及受试者的生命。如本文所述,此类急性感染可能发生在婴儿或免疫功能低下的受试者中。
[0415]
在一方面,术语“感染”和“细菌感染”是指由革兰氏阳性菌引起的感染,也称为“革兰氏阳性感染”。
[0416]
革兰氏阳性菌是指通过革兰氏染色被染成蓝色或紫色的细菌,并且包括例如艰难拟梭菌(艰难梭菌)、化脓性链球菌、金黄色葡萄球菌、乳酸菌属物种(lactobacillus spp)、双歧杆菌(bifidobacteria)和韦格斯卡多维亚菌(scardovia wiggsiae)、炭疽杆菌等。革兰氏阳性菌的特征是在细胞膜周围具有厚的肽聚糖层,并且在细胞膜的外围没有外膜。革兰氏阳性菌不限于革兰氏阳性球菌或革兰氏阳性杆菌。
[0417]
本发明的抗原结合蛋白可用于减轻严重程度或预防中毒性休克。中毒性休克或中毒性休克综合征(tss)的症状因潜在原因而异。由感染细菌金黄色葡萄球菌引起的tss典型地在除此之外健康的受试者中经由包括以下的体征和症状表现出来:高烧、伴有低血压、不适和意识模糊,可能快速发展为昏沉、昏迷和多器官衰竭。特征性皮疹经常出现在病程的早期,类似于晒伤,并且可能涉及身体的任何区域,包括嘴唇、嘴、眼睛、手掌和脚掌。在感染初始阶段存活的患者中,皮疹在10-14天后脱落或剥落。
[0418]
相比之下,由细菌化脓性链球菌或tsls引起的tss典型地出现在已经存在该细菌皮肤感染的人群中。这些受试者经常经历皮肤感染部位的剧烈疼痛,随后出现如上所述tss症状的快速进展。与葡萄球菌引起的tss相比,链球菌引起的tss较少出现晒斑样皮疹。
[0419]
对于葡萄球菌中毒性休克综合征,诊断严格基于2011年定义的cdc标准,如下所示:
[0420]
1.体温》38.9℃(102.02
°
f)
[0421]
2.收缩压《90mmhg
[0422]
3.弥漫性黄斑红皮病
[0423]
4.发病后1-2周脱屑(尤其是手掌和脚掌)
[0424]
5.涉及三个或更多个器官系统:
[0425]
·
胃肠道(呕吐、腹泻)
[0426]
·
肌肉:严重肌痛或肌酸磷酸激酶水平是正常值上限的至少两倍
[0427]
·
粘膜充血(阴道、口腔、结膜)
[0428]
·
肾衰竭(血清肌酐》正常值的2倍)
[0429]
·
肝脏炎症(胆红素、ast或alt》正常值的2倍)
[0430]
·
血小板计数低(血小板计数《100,000/mm3)
[0431]
·
中枢神经系统受累(无任何局灶性神经学发现的混乱)
[0432]
6.以下的阴性结果:
[0433]
·
其他细菌(除金黄色葡萄球菌外)的血液、咽喉和csf培养物
[0434]
·
立克次氏体感染、钩端螺旋体病和麻疹的血清学检查呈阴性
[0435]
基于以下因素,病例被分类为已确认或可能:
[0436]
·
确认的:满足上述所有六项标准(除非患者在可能发生脱屑前死亡);以及
[0437]
·
可能的:符合上述六项标准中的五项。
[0438]
在某些实施例中,术语“感染”和“细菌感染”是指由革兰氏阴性菌引起的感染。感染可能是由肠杆菌引起的。由“肠杆菌科”引起的感染是指包括但不限于以下物种的该细菌家族中的任何革兰氏阴性菌:如沙门氏菌属物种、大肠杆菌、鼠疫耶尔森氏菌、克雷伯氏菌属物种(klebsiella spp.)、志贺氏菌属物种、变形杆菌属物种(proteus spp.)、肠杆菌属物种(enterobacter spp.)、沙雷氏菌属物种(serratia spp.)和柠檬酸杆菌属物种(citrobacter spp.)。感染可能由其他革兰氏阴性菌引起,包括螺杆菌科(如幽门螺杆菌)或弯曲杆菌科(如空肠弯曲杆菌(camplyobacter jejuni))。
[0439]
现在,在下文描述了可能导致感染并且本发明发现其在治疗、防止或预防方面具有特殊应用的示例性细菌。在不同类型细菌的情况下还描述了与包含该类型细菌或由其组成的细菌感染相关或由其引起的示例性病症。这些实例将被理解为不限制本发明的抗原结合蛋白的用途,这些抗原结合蛋白可用于与利用纤溶酶原激活促进发病机理的细菌相关的一系列病症。
[0440]
大肠杆菌是一种革兰氏阴性细菌,其是胃肠道正常菌丛的一部分。大肠杆菌有数百种菌株,其中大多数是无害的,并且生活在健康人类和动物的胃肠道中。目前,存在引起人类胃肠炎的四种公认类别的肠毒性大肠杆菌(“eec群”)。其中包括肠致病性(epec)菌株和其毒力机制与典型大肠杆菌肠毒素的分泌有关的菌株。大肠杆菌的此类菌株可以引起各种疾病,包括与胃肠道和泌尿道感染、败血症、肺炎和脑膜炎相关的疾病。抗生素对一些菌株无效,并且不一定能防止感染复发。
[0441]
例如,据估计大肠杆菌菌株0157:h7在美国每年导致10,000至20,000例感染(联邦疾病控制和预防中心)。出血性结肠炎是由大肠杆菌o157:h7引起的急性疾病的名称。学龄前儿童和老年人处于严重并发症的最大风险中。
[0442]
肠毒性大肠杆菌菌株的示例性序列包括genbank登录号ab011549、x97542、af074613、y11275和aj007716。
[0443]
鼠伤寒沙门氏菌是革兰氏阴性菌,其引起临床上范围为局部胃肠道感染、胃肠炎(腹泻、腹部绞痛和发热)至肠热病(包括伤寒)的各种病症,这些病症是严重的全身性疾病。沙门氏菌感染还导致牲畜的大量损失。
[0444]
典型的革兰氏阴性杆菌,沙门氏菌属物种的细胞壁含有一种复杂的脂多糖(lps)结构,其在细胞溶解时释放出来,并可能作为内毒素发挥作用,这有助于生物体的毒力。
[0445]
由于沙门氏菌在没有彻底煮熟的肉类和动物产品中存活的事实,受污染的食物是非伤寒沙门氏菌感染的主要传播方式。最常见的动物来源是鸡、火鸡、猪和牛;此外还有许多其他家畜和野生动物。伤寒和由沙门氏菌属物种引起的其他肠热病的流行病学与被人类粪便污染的水相关。
[0446]
假单胞菌属物种(pseudomonas spp.)是能动的革兰氏阴性杆菌,其在临床上是重要的,因为它们对大多数抗生素具有耐药性,并且是医院获得性(院内)感染的主要原因。感染最常见于:免疫功能低下的受试者、烧伤患者、使用呼吸器的受试者、留置导管的受试者、iv麻醉药使用者和患有慢性肺部疾病(例如,囊性纤维化)的受试者。虽然感染在健康受试者中很少见,但它可以发生在许多部位,并导致尿路感染、败血症、肺炎、咽炎和许多其他问题,并且治疗经常失败且死亡率更高。
[0447]
铜绿假单胞菌(pseudomonas aeruginosa)是一种革兰氏阴性、需氧、杆状细菌,具有单极能动性。机会性人类病原体铜绿假单胞菌也是植物的机会性病原体。像其他假单胞菌一样,铜绿假单胞菌分泌多种色素。铜绿假单胞菌的最终临床鉴定可以包括鉴定绿脓菌素和荧光素二者的产生,以及该生物体在42℃下生长的能力。铜绿假单胞菌还能够在柴油和喷气燃料中生长,为此它被称为利用碳氢化合物的微生物(或“hum虫”),从而导致微生物腐蚀。
[0448]
霍乱弧菌(vibrio cholerae)是一种革兰氏阴性杆菌,其感染人类并引起霍乱,这是一种通过恶劣的卫生条件传播的疾病,从而导致供水受到污染。霍乱弧菌可以在人小肠中定殖,在那里它产生一种毒素,该毒素破坏跨粘膜的离子转运,从而导致腹泻和失水。感染霍乱弧菌的受试者需要静脉或口服含电解质的溶液进行补液。这种疾病通常是自限性的;然而,死亡可能由于脱水和基本电解质的损失而发生。已经证明抗生素(如四环素)缩短了病程,并且口服疫苗目前正在开发中。
[0449]
淋病奈瑟菌(neisseria gonorrhoea)是一种革兰氏阴性球菌,其是常见性传播疾病淋病的致病因子。淋病奈瑟菌可以改变其表面抗原,从而防止对再感染的免疫发展。在美国,每年报告近750,000例淋病,估计每年还有750,000例未报告的病例,大多数在青少年和年轻成年人中。氨苄青霉素、阿莫西林或某种类型的青霉素曾被推荐用于治疗淋病。然而,耐青霉素淋病的发病率正在增加,并且通过注射给予的新抗生素,例如头孢曲松或大观霉素,现在被用于治疗大多数淋球菌感染。
[0450]
金黄色葡萄球菌是一种革兰氏阳性球菌,其通常定殖在人的鼻子中,有时也存在于皮肤上。葡萄球菌可以在医院环境中引起血流感染、肺炎和手术部位感染(即,院内感染)。金黄色葡萄球菌可能导致严重的食物中毒,并且许多菌株在食物中生长并产生外毒素。葡萄球菌对常用抗生素(例如,万古霉素)的耐药性已在美国和国外出现,成为社区和医院环境中的主要公共卫生挑战。最近,在日本也鉴定出了耐万古霉素的金黄色葡萄球菌分离株。
[0451]
结核分枝杆菌(mycobacterium tuberculosis)是一种革兰氏阳性细菌,其是结核病的致病因子,结核病有时是致残和致命的疾病。结核病在全球范围内呈上升趋势,并且是单一传染病的主要死因(目前的死亡率为每年三百万人)。它可以影响人体的一些器官,包括大脑、肾脏和骨骼,然而,结核病最常见地影响肺部。
[0452]
在美国,如阳性皮肤测试所示,大约一千万人感染了结核分枝杆菌,其中每年有大约26,000个活动性疾病的新病例。结核病(tb)病例的增加与hiv/aids、无家可归、药物滥用和活动性感染者的移民相关。目前用于药物敏感的tb的治疗方案包括服用两种或四种药物(例如,异烟肼、利福平、吡嗪酰胺、乙胺丁醇或链霉素)持续六至九个月的一段时间,因为单一药物不能破坏所有的tb病菌。另外,对结核分枝杆菌耐药和多重耐药菌株的观察呈上升
趋势。
[0453]
幽门螺杆菌(h.pylori)是一种微嗜气性、革兰氏阴性、生长缓慢、有鞭毛的生物体,具有螺旋或s形形态,其感染胃的内层。幽门螺杆菌是与慢性浅表性胃炎、消化性溃疡疾病和导致胃腺癌的慢性萎缩性胃炎相关的人类胃病原体。幽门螺杆菌是人类最常见的慢性细菌感染之一,并且在超过90%的活动性胃炎患者中发现。目前的治疗包括使用铋、甲硝唑和四环素或阿莫西林的三联药物疗法,这在大多数情况下根除幽门螺杆菌。三联疗法的问题包括患者依从性、副作用和甲硝唑耐药性。有希望的替代双重疗法方案是阿莫西林加甲硝唑或奥美拉唑加阿莫西林。
[0454]
肺炎链球菌是一种革兰氏阳性球菌,并且是细菌性肺炎以及中耳感染(中耳炎)和脑膜炎的最常见原因之一。在美国,每年肺炎球菌疾病导致大约50,000例菌血症;3,000例脑膜炎;100,000-135,000例住院治疗;以及700万例中耳炎。在美国,肺炎球菌感染每年导致估计40,000人死亡。小于2岁的儿童、大于65岁的成人和任何年龄的患有潜在医学病症(包括例如,充血性心脏病、糖尿病、肺气肿、肝病、镰状细胞病、hiv)的人,以及生活在特殊环境(例如,疗养院和长期护理机构)中的人处于最高的感染风险中。
[0455]
耐药性肺炎链球菌菌株在美国已经变得很常见,同时许多耐青霉素的肺炎球菌还对其他抗菌药物(如红霉素或甲氧苄啶-磺胺甲恶唑)耐药。
[0456]
梅毒密螺旋体(treponema pallidium)是一种导致梅毒的螺旋体。梅毒密螺旋体是唯一的一种导致梅毒、雅司病和非性病地方性梅毒或品他病的病原体。梅毒密螺旋体不能在体外生长,并且在不存在哺乳动物细胞的情况下确实复制。最初的感染在感染部位处引起溃疡;然而,该细菌在身体各处移动,随着时间推移损害许多器官。在其晚期,未经治疗的梅毒虽然不会传染,但会导致严重的心脏异常、精神障碍、失明、其他神经问题和死亡。
[0457]
流感嗜血杆菌(h.influenza)是革兰氏阴性菌的一个家族;其中六种类型是已知的,大多数流感嗜血杆菌相关疾病由b型或“hib”引起。直到开发出针对hib的疫苗之前,hib是中耳炎、鼻窦感染、支气管炎的常见原因,是脑膜炎的最常见原因,并且是肺炎、脓毒性关节炎(关节感染)、蜂窝织炎(软组织感染)和心包炎(心脏周围膜的感染)病例的常见罪魁祸首。b型流感嗜血杆菌在人类中广泛存在,并且通常生活在喉咙和鼻子中而不会引起疾病。5岁以下未接种疫苗的儿童处于患hib疾病的风险中。由流感嗜血杆菌感染引起的脑膜炎和其他严重感染可能会导致脑损伤或死亡。
[0458]
痢疾志贺氏菌(shigella dysenteriae)(shigella dys.)是一种革兰氏阴性杆菌,其可以导致痢疾。在结肠中,该细菌进入粘膜细胞并在粘膜细胞内分裂,从而导致广泛的炎症反应。志贺氏菌感染可能导致严重的腹泻,这可能导致脱水,并且对非常年幼、非常年老或患有慢性病的人来说可能是危险的。痢疾志贺氏菌形成一种强效毒素(志贺毒素),其具有细胞毒性、肠毒性、神经毒性并作为蛋白质合成的抑制剂。对抗生素(如氨苄青霉素和tmp-smx)的耐药性已经产生,然而,用更新、更昂贵的抗生素(如环丙沙星、诺氟沙星和依诺沙星)治疗仍然有效。
[0459]
李斯特菌属(listeria)是一种革兰氏阳性、运动性细菌,发现于人类和动物粪便中。单核细胞增多性李斯特菌(listeria monocytogenes)引起如李斯特菌病、脑膜脑炎和脑膜炎的疾病。这种生物体是食源性病原体导致死亡的主要原因之一,尤其是在孕妇、新生儿、老年人和免疫功能低下的受试者中。它存在于如腐烂的植物物质、污水、水和土壤的环
境中,并且它可以在极端的温度和盐浓度下存活,这使它成为一种极其危险的食源性病原体,尤其是在未经再加热的食物上。该细菌可以从肠道中的感染部位扩散到中枢神经系统和胎儿-胎盘单位。脑膜炎、胃肠炎和败血症可以由感染引起。在牛和绵羊中,李斯特菌感染导致脑炎和自然流产。
[0460]
奇异变形杆菌(proteus mirabilis)是一种肠道革兰氏阴性共生生物体,与大肠杆菌有远亲关系。它通常定殖在人类尿道中,但却是一种机会性病原体,其是导管插入受试者尿路感染的主要原因。奇异变形杆菌具有两个独特的特征:1)它具有非常快速的运动性,这表现为在培养板上的群集现象;和2)它产生脲酶,这赋予它降解尿素并在泌尿生殖道中存活的能力。
[0461]
鼠疫耶尔森氏菌是鼠疫(腺鼠疫和肺鼠疫)的致病因子,这是一种毁灭性的疾病,已在世界范围内造成数百万人死亡。该生物体可以通过被感染的跳蚤的叮咬从大鼠传播给人类,或者在广泛感染期间通过空气在人与人之间传播。鼠疫耶尔森氏菌是一种致病性极强的生物体,其仅需要很少的数量就能致病,并且如果不治疗,通常是致命的。该生物体是肠侵袭性的,并且能够在遍及整个宿主的系统扩散之前在巨噬细胞中存活和繁殖。
[0462]
炭疽杆菌也被称为炭疽。当人类接触到被污染的动物时,他们就会被感染。炭疽不会由于人与人之间的接触而传播。该疾病的三种形式反映了感染部位,包括皮肤(皮肤)、肺部(肺)和肠道。如果不治疗,肺部和肠道感染通常是致命的。孢子被巨噬细胞吸收并内化到噬溶酶体(膜室)中,于是萌发开始。一旦被感染的巨噬细胞溶解,则细菌被释放到血流中,于是它们快速繁殖,扩散到整个循环系统和淋巴系统,这一过程导致感染性休克、呼吸窘迫和器官衰竭。这种病原体的孢子已经被用作恐怖武器。
[0463]
鼻疽伯克霍尔德氏菌(burkholderia mallei)是一种引起鼻疽病的革兰氏阴性需氧细菌,鼻疽病是一种主要发生在马、骡和驴身上的传染病。它很少与人类感染相关,并且更常见于家养动物中。这种生物体与类鼻疽伯克霍尔德氏菌(b.pseudomallei)相似,并且区别在于不活动。该病原体是适应宿主的,并且不存在于其宿主之外的环境中。如果不用抗生素治疗,则鼻疽病通常是致命的,并且传播可以通过空气发生,或者更常见的是当接触受感染的动物时。快速发作的肺炎、菌血症(通过血液传播该生物体)、脓疱和死亡是感染期间的常见结果。尽管与鼠伤寒沙门氏菌相似的iii型分泌系统是必需的,但该毒力机制尚未被很好地理解。对于这种被认为有可能成为生物恐怖剂的潜在危险生物体,还没有疫苗。与相关的类鼻疽伯克霍尔德氏菌(下文)相比,这种生物体的基因组携带大量插入序列,以及大量可能在细胞表面蛋白的抗原变异方面起作用的简单序列重复。
[0464]
类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)是一种革兰氏阴性细菌,其导致人和动物的类鼻疽病。类鼻疽是一种在亚洲、泰国和澳大利亚的某些地区发现的疾病。类鼻疽伯克霍尔德氏菌典型地是一种土壤生物体,并且已从稻田和潮湿的热带土壤中回收,但作为一种机会性病原体,它可以在易受影响的受试者(如患有糖尿病的受试者)中引起疾病。该生物体可以存在于细胞内,并且导致肺炎和菌血症(通过血流传播该细菌)。潜伏期可能非常长,其感染比疾病早几十年,并且治疗可能需要几个月的抗生素使用,同时复发是经常观察到的现象。细胞间扩散可以经由在细胞的一极处诱导肌动蛋白聚合而发生,从而允许穿过细胞质和从细胞到细胞的运动。这种生物体携带许多小序列重复,这可能促进抗原变异,类似于在鼻疽伯克霍尔德氏菌基因组中发现的情况。
[0465]
洋葱伯克霍尔德氏菌(burkholderia cepacia)是一种革兰氏阴性细菌,其由至少七种不同的亚种组成,包括多囊伯克霍尔德氏菌(burkholderia multivorans)、越南伯克霍尔德氏菌(burkholderia vietnamiensis)、稳定伯克霍尔德氏菌(burkholderia stabilis)、新洋葱伯克霍尔德氏菌(burkholderia cenocepacia)和双向伯克霍尔德氏菌(burkholderia ambifaria)。洋葱伯克霍尔德氏菌是一种重要的人类病原体,其最常导致患有潜在肺疾病(如囊性纤维化)或免疫问题(如慢性肉芽肿性疾病)的人患肺炎。洋葱伯克霍尔德氏菌典型地存在于水和土壤中,并且可以在潮湿环境中存活很长时间。人与人之间的传播已有记录;因此,许多医院、诊所和囊性纤维化患者的营地制定了严格的隔离洋葱伯克霍尔德氏菌措施。感染该细菌的受试者通常在与未感染受试者分开的区域接受治疗,以限制传播。这是因为感染洋葱伯克霍尔德氏菌可能导致肺功能快速下降,从而导致死亡。洋葱伯克霍尔德氏菌的诊断包括从痰培养物中分离细菌。治疗很困难,因为洋葱伯克霍尔德氏菌对包括氨基糖甙类(如妥布霉素)和多粘菌素b在内的许多常见抗生素具有天然耐药性。治疗典型地包括多种抗生素,并且可以包括头孢他啶、多西环素、哌拉西林、氯霉素和复方新诺明。
[0466]
edward francis在20世纪早期首先注意到土拉弗朗西斯菌(francisella tularensis)是瘟疫样疾病的致病因子,该疾病影响了加利福尼亚州图莱里县(tulare county)的松鼠。该生物体现在以他的名字命名。该疾病被称为兔热病(tularemia),并且在整个有记录的历史中都有记载。该生物体可以通过受感染的蜱或鹿虻传播给人类,通过经感染的肉或经由气溶胶传播,因此是一种潜在的生物恐怖剂。它是一种水生生物体,并且可以在原生动物体内找到,类似于在军团菌中观察到的情况。它具有很高的传染率,并且可以侵入吞噬细胞和非吞噬细胞,从而快速繁殖。一旦进入巨噬细胞,则该生物体可以逃离吞噬体,并生活在胞质溶胶中。
[0467]
细菌感染还可以是牙龈卟啉单胞菌感染。牙龈卟啉单胞菌是一种革兰氏阴性、厌氧细菌,其与牙周病的发病机理有关,也存在于上胃肠道、呼吸道和结肠中。已知牙龈卟啉单胞菌的发病机理涉及纤溶酶原激活物的募集。
[0468]
本发明还可用于兽医应用。牲畜胃肠道中的健康微生物区系对于健康和相关食品的相应生产是至关重要的。与人类一样,健康动物的胃肠道含有多种类型的细菌(即,大肠杆菌、铜绿假单胞菌和沙门氏菌属物种),它们彼此生活在生态平衡中。这种平衡可能被饮食变化、压力或对抗生素或其他治疗性处理的反应所破坏,从而导致通常由细菌(如沙门氏菌、弯曲杆菌、肠球菌、兔热病和大肠杆菌)引起的动物细菌性疾病。这些动物中的细菌感染通常需要治疗性干预,这具有治疗成本,因为健康通常与生产力下降相关。
[0469]
如本文所用的术语“治疗(treat、treating或treatment)”还指施用本文讨论的组合物或药物活性成分中的一种或多种,有或没有另外的药物活性或惰性成分,以便:(i)减少或消除细菌感染或细菌感染的一种或多种症状,或(ii)延缓细菌感染或细菌感染的一种或多种症状的进展,或(iii)降低细菌感染或细菌感染的一种或多种症状的严重程度,或(iv)抑制细菌感染的临床表现,或(v)抑制细菌感染的不良症状的表现。此外,术语“治疗(treating和treatment)”可以包括以下中的一种或多种:改善受试者中细菌感染的症状、阻断或改善受试者中细菌感染症状的复发、降低受试者中细菌感染症状的严重程度和/或频率、停滞、减少或抑制受试者中细菌营养形式的生长、抑制受试者中的细菌孢子形成、抑
制受试者中细菌孢子的激活、抑制受试者中细菌孢子的萌发,以及抑制受试者中细菌孢子的长出。治疗意指相比于未施用本发明的抗原结合蛋白或组合物的受试者,改善、阻断、降低、减少或抑制约1%至约100%。优选地,相比于未施用本发明的抗原结合蛋白或组合物的受试者,该改善、阻断、降低、减少或抑制为100%、99%、98%、97%、96%、95%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%或1%。
[0470]
成功的治疗可能通常意味着与革兰氏阳性或革兰氏阴性细菌感染相关或由其引起的任何症状的改善,并且例如可以指任何以下症状的改善:发烧、炎症、肿胀、呕吐、疲劳、抽筋、咳嗽、打喷嚏、呼吸系统疾病、腹泻、脑膜炎、头痛、关节痛、身体疼痛、水疱、皮疹、恶心、寒战、头晕、嗜睡、失眠、呕吐、皮肤刺激、粘液生成过多(例如在眼睛、胃肠道、鼻窦或呼吸系统中)、溃疡、胃肠不适、皮肤缺损、脱发、坏死和器官功能障碍。根据本领域已知的标准方法和技术,可以容易地评估本文所述的任何这些症状或细菌感染或病症的改善。通过该疾病方法治疗的受试者群体包括患有不期望病症或疾病的受试者,以及处于该病症或疾病发展风险中的受试者。
[0471]
如本文所用,术语“抑制(inhibit、inhibiting和inhibition)”具有其普通和习惯的含义,并且包括以下中的一种或多种:抑制细菌的生长或功能、抑制细菌的营养形式的生长、抑制细菌的营养形式的功能、抑制细菌的繁殖、抑制细菌孢子形成、抑制细菌孢子的激活、抑制细菌孢子的萌发,以及抑制细菌孢子的长出。这种抑制是相比于未施用本发明的抗原结合蛋白或组合物的受试者中的活性,抑制约1%至约100%的特定活性。优选地,该抑制是相比于未施用本发明的抗原结合蛋白或组合物的受试者,抑制活性的100%、99%、98%、97%、96%、95%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%或1%。如本文所用,“孢子”是指常规使用的术语“孢子”和“内生孢子”二者。
[0472]
如本文所用,术语“预防(preventing和prevention)”具有其普通和习惯的含义,并且包括以下中的一种或多种:预防受试者中细菌的定殖、预防受试者中细菌群体生长的增加、预防受试者中细菌孢子的激活、萌发或长出、预防受试者中细菌的孢子形成、预防受试者中细菌引起的疾病的发展,以及预防受试者中细菌引起的疾病症状。如本文所用,在施用本发明的抗原结合蛋白或组合物后,预防持续至少约0.5、1、2、3、4、5、6、7、10、12、15、20、25、30、35、40天或更多天。
[0473]
如本文所用,“预防”包括抑制受试者中细菌产生性或进行性感染的发展,其中在施用本发明的抗原结合蛋白或组合物后,预防持续至少约0.5、1、2、3、4、5、6、7、10、12、15、20、25、30、35、40天或更多天。抑制细菌产生性或进行性感染的发展意指相比于未施用本发明的抗原结合蛋白或组合物的受试者,受试者中感染的严重程度降低约1%至约100%。优选地,严重程度的降低是严重程度降低100%、99%、98%、97%、96%、95%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%或1%。感染的严重程度可以基于受试者体内存在的细菌量、受试者体内可以检测到细菌的时间长度,和/或细菌感染症状的严重程度等因素。
[0474]
组合物
[0475]
在一些实例中,如本文所述的抗原结合蛋白可经口、肠胃外施用,通过吸入喷雾、吸附、吸收施用,局部、直肠、鼻、颊、阴道、脑室内施用,以含有常规无毒的药学上可接受的载体的剂量配制品经由植入贮存器施用,或通过任何其他方便的剂型施用。如本文所用,术
语“肠胃外”包括皮下、静脉内、肌肉内、腹腔内、鞘内、脑室内、胸骨内和颅内注射或输注技术。
[0476]
用于将抗原结合蛋白制备成适合于向受试者施用的形式(例如药物组合物)的方法是本领域已知的,并且包括例如以下中所述的方法:remington's pharmaceutical sciences[雷明顿药物科学](第18版,马克出版公司(mack publishing co.),伊斯顿,宾夕法尼亚州,1990)以及u.s.pharmacopeia:national formulary[美国药典:国家处方集](麦克出版公司(mack publishing company),伊斯顿,宾夕法尼亚州,1984)。
[0477]
本发明的药物组合物特别可用于肠胃外施用,如静脉内施用或向器官或关节的体腔或内腔施用。用于施用的组合物通常将包含抗原结合蛋白溶解在药学上可接受的载体(例如水性载体)中的溶液。可使用多种水性载体,例如缓冲盐水等。组合物可以含有如接近生理条件所需要的药学上可接受的辅助物质,如ph调节剂和缓冲剂、毒性调节剂等,例如乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。本发明的抗原结合蛋白在这些配制品中的浓度可以广泛变化,并且将主要根据所选择的特定施用方式和患者的需要,基于流体体积、粘度、体重等来选择。示例性载体包括水、生理盐水、林格氏溶液、右旋糖溶液和5%人血清白蛋白。也可以使用非水性媒介物,如混合油和油酸乙酯。脂质体也可用作载体。这些媒介物可含有少量的增强等渗性和化学稳定性的添加剂,例如缓冲剂和防腐剂。
[0478]
本发明的抗原结合蛋白可以被配制用于局部化或局部施用,如用于局部应用于需要治疗的皮肤或组织。用于局部施用的配制品典型地包含与一种或多种活性剂组合的局部媒介物,有或没有另外的任选组分。本发明的药物组合物可以为用于局部施用的喷雾剂、乳膏、凝胶、洗液等形式。
[0479]
合适的局部媒介物和另外的组分是本领域熟知的,并且显然媒介物的选择将取决于特定的物理形式和递送方式。局部媒介物包括有机溶剂,如醇(例如,乙醇、异丙醇或甘油)、二醇(如丁烯、异戊二烯或丙二醇)、脂肪醇(如羊毛脂)、水和有机溶剂的混合物以及有机溶剂的混合物(如醇和甘油)、基于脂质的物质(如脂肪酸)、酰基甘油,包括油(如矿物油),以及天然或合成来源的脂肪、磷酸甘油酯、鞘脂和蜡、基于蛋白质的物质(如胶原和明胶)、基于硅酮的物质(非挥发性和挥发性的),以及基于碳氢化合物的物质(如微海绵和聚合物基质)。
[0480]
组合物可以进一步包括一种或多种适于提高所应用配制品的稳定性或有效性的组分,如稳定剂、悬浮剂、乳化剂、粘度调节剂、胶凝剂、防腐剂、抗氧化剂、皮肤渗透促进剂、保湿剂和持续释放材料。此类组分的实例描述于martindale-the extra pharmacopoeia[马丁代尔大药典](伦敦英国医药出版社(pharmaceutical press,london)1993)和martin(编辑),remington's pharmaceutical sciences[雷明顿氏药物科学]中。配制品可以包含微胶囊,如羟甲基纤维素或明胶微胶囊、脂质体、白蛋白微球、微乳液、纳米颗粒或纳米胶囊。
[0481]
局部配制品可以制备成多种物理形式,包括例如固体、糊剂、霜剂、泡沫、洗剂、凝胶、粉末、含水液体、乳剂、喷雾剂和皮肤贴剂。此类剂型的物理外观和粘度可以由存在于配制品中一种或多种乳化剂和一种或多种粘度调节剂的存在和数量来控制。固体通常是坚硬的和不可倾倒的,并且通常被配制成条或棒,或颗粒形式。固体可以是不透明的或透明的,并且任选地可以含有溶剂、乳化剂、保湿剂、润肤剂、芳香剂、染料/着色剂、防腐剂以及增加
或增强最终产品功效的其他活性成分。霜剂和洗剂通常彼此相似,主要区别在于它们的粘度。洗剂和霜剂二者可以是不透明的、半透明的或透明的,并且通常含有乳化剂、溶剂和粘度调节剂,以及保湿剂、润肤剂、芳香剂、染料/着色剂、防腐剂以及增加或增强最终产品功效的其他活性成分。可以制备具有一定粘度范围(从粘稠或高粘度至稀薄或低粘度)的凝胶。这些配制品,像洗剂和霜剂一样,也可以含有溶剂、乳化剂、保湿剂、润肤剂、芳香剂、染料/着色剂、防腐剂以及增加或增强最终产品功效的其他活性成分。液体比霜剂、洗剂或凝胶更稀薄,并且通常不含乳化剂。液体局部用产品通常含有溶剂、乳化剂、保湿剂、润肤剂、芳香剂、染料/着色剂、防腐剂以及增加或增强最终产品功效的其他活性成分。
[0482]
用于局部配制品的乳化剂包括但不限于离子乳化剂鲸蜡硬脂醇、非离子乳化剂如聚氧乙烯油基醚、peg-40硬脂酸酯、鲸蜡硬脂醇聚醚-12、鲸蜡硬脂醇聚醚-20、鲸蜡硬脂醇聚醚-30、鲸蜡硬脂醇聚醚醇、peg-100硬脂酸酯和硬脂酸甘油酯。合适的粘度调节剂包括但不限于保护胶体或非离子胶,如羟乙基纤维素、黄原胶、硅酸镁铝、二氧化硅、微晶蜡、蜂蜡、石蜡和棕榈酸鲸蜡酯。凝胶组合物可以通过添加胶凝剂来形成,如脱乙酰壳多糖、甲基纤维素、乙基纤维素、聚乙烯醇、聚季铵盐、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、卡波姆或氨化甘草酸盐。合适的表面活性剂包括但不限于非离子、两性、离子和阴离子表面活性剂。例如,聚二甲基硅氧烷共聚醇、聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80、月桂酰胺dea、椰油酰胺dea和椰油酰胺mea、油基甜菜碱、椰油酰胺丙基磷脂酰pg-氯化二铵和月桂醚硫酸铵中的一种或多种可以用于局部配制品中。
[0483]
防腐剂包括但不限于抗菌剂,如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、山梨酸、苯甲酸和甲醛,以及物理稳定剂和抗氧化剂,如维生素e、抗坏血酸钠/抗坏血酸和没食子酸丙酯。合适的保湿剂包括但不限于乳酸和其他羟基酸及其盐、甘油、丙二醇和丁二醇。合适的润肤剂包括羊毛脂醇、羊毛脂、羊毛脂衍生物、胆固醇、矿脂、异硬脂醇新戊酸酯和矿物油。合适的芳香剂和颜色包括但不限于fd&c红40号和fd&c黄5号。可以包含在局部配制品中的其他合适的另外的成分包括但不限于研磨剂、吸收剂、抗结块剂、消泡剂、抗静电剂、收敛剂(如金缕梅)、酒精和草药提取物如甘菊提取物、粘合剂/赋形剂、缓冲剂、螯合剂、成膜剂、调理剂、推进剂、遮光剂、ph调节剂和保护剂。
[0484]
局部用组合物的典型递送方式包括使用手指施加、使用物理施加器(如布、纸巾、棉签、棒或刷子)施加、喷射(包括喷雾、气溶胶或泡沫喷射)、滴管施加、喷洒、浸泡和冲洗。还可以使用控释媒介物,并且组合物可以被配制用于透皮施用(例如,作为透皮贴剂)。
[0485]
在配制后,本发明的抗原结合蛋白将以与剂量配制品相容的方式和治疗/预防有效的量施用。配制品易于以各种剂型施用,如上述类型的可注射溶液,但还考虑了其他药学上可接受的形式,例如用于口服施用的片剂、丸剂、胶囊或其他固体、栓剂、阴道栓剂、鼻腔溶液或喷雾剂、气雾剂、吸入剂、脂质体形式等。还可以使用药物“缓释”胶囊或组合物。缓释配制品通常被设计成在较长时间内提供恒定的药物水平,并可以用于递送本发明的抗原结合蛋白。
[0486]
wo 2002/080967描述了用于施用包含用于治疗例如哮喘的抗体的雾化组合物的组合物和方法,其也适合于施用本发明的抗原结合蛋白。
[0487]
施用剂量和施用时间
[0488]
本发明的抗原结合蛋白的合适剂量将根据抗原结合蛋白的特异性、待治疗的病症
和/或正在治疗的受试者而变化。熟练的医师有能力确定合适的剂量,例如,从次优剂量开始,逐步修改剂量以确定最佳或可用剂量。可替代地,为了确定治疗/预防的适当剂量,使用来自细胞培养测定或动物研究的数据,其中合适的剂量在循环浓度的范围内,包括毒性很小或没有毒性的活性化合物的ed
50
。该剂量可以取决于所采用的剂型以及使用的施用途径而在该范围内变化。治疗/预防有效剂量可从细胞培养测定来进行初始估计。在动物模型中可配制剂量以达到循环血浆浓度范围,包括在细胞培养中测定的ic
50
(即达到症状的半最大抑制的化合物浓度或量)。这类信息可以用来更精确地确定用于人中的剂量。可以测量血浆中的水平,例如通过高效液相色谱法。
[0489]
在一些实例中,本发明的方法包括施用预防或治疗有效量的本文所述蛋白质。
[0490]
术语“治疗有效量”是指当向需要治疗的受试者施用时,改善受试者的预后和/或状态和/或将本文所述临床病症的一个或多个症状减少或抑制至低于作为该病症的临床诊断或临床特征观察到并接受的水平的量。给受试者的施用量取决于待治疗病症的特定特征、正治疗的病症的类型和阶段、施用方式、以及受试者的特征(如一般健康状况、其他疾病、年龄、性别、基因型和体重)。本领域技术人员将能够根据这些和其他因素确定适当的剂量。因此,该术语不应解释为将本发明限于特定量(例如一种或多种蛋白质的重量或量),而是本发明涵盖足以在受试者中实现所述结果的任何量的一个或多个抗原结合蛋白。
[0491]
如本文所用,术语“预防有效量”应被视为意指足以预防或抑制或延迟临床病症的一种或多种可检测的症状的出现的量的蛋白质。本领域技术人员将知道,这个量将根据例如施用的一种或多种特定抗原结合蛋白和/或特定受试者和/或病症的类型或严重程度或水平和/或病症的易感性(遗传或其他)而变化。因此,该术语不应解释为将本发明限于特定量(例如一个或多个抗原结合蛋白的重量或量),而是本发明涵盖足以在受试者中实现所述结果的任何量的一个或多个抗原结合蛋白。
[0492]
试剂盒
[0493]
本发明另外包括包含以下一项或多项的试剂盒:
[0494]
(i)本发明的抗原结合蛋白或一种或多种编码该抗原结合蛋白的表达构建体;
[0495]
(ii)本发明的细胞;
[0496]
(iii)本发明的复合物;或
[0497]
(iii)本发明的药物组合物。
[0498]
在用于检测纤溶酶原的试剂盒的情况下,该试剂盒还可以包括检测装置,例如,连接到本发明的抗原结合蛋白。
[0499]
在用于治疗/预防用途的试剂盒的情况下,该试剂盒可另外包含药学上可接受的载体。
[0500]
任选地,本发明的试剂盒与关于在本文根据任何实例所述的方法中使用的说明书一起包装。
[0501]
应当理解的是,在本说明书中披露和限定的本发明可扩展至所提及的或者从文本部分和附图部分显而易见的单个特征的两个或更多个的所有替代性组合。所有这些不同组合构成本发明的多个替代性方面。
[0502]
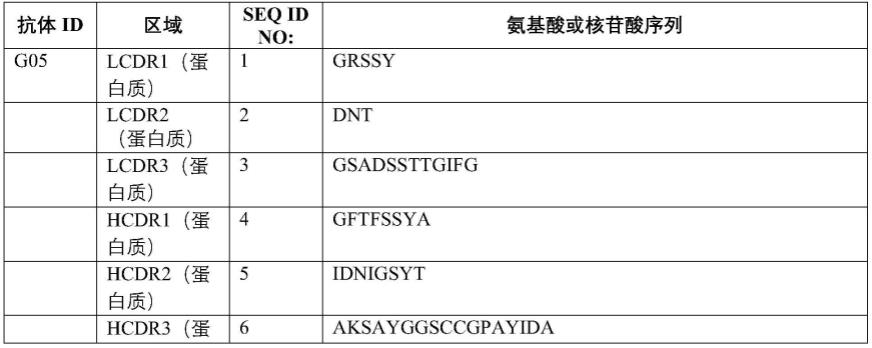
表1:氨基酸和核苷酸序列概述
[0503]
[0504]
[0505]
[0506]
[0507][0508]
表2:g05/kr5-sp的关键相互作用。涉及kr5和sp残基的相互作用分别以斜体和粗体突出显示。
[0509]
[0510][0511]
表3:g05/kr5-sp的关键相互作用。涉及kr5和sp残基的相互作用分别以斜体和粗体突出显示(数据来源于晶体不对称单元中的第二个复合物对)。
[0512]
200nm)混合30分钟。在孵育后,使用荧光底物(h-ala-phe-lys-amc,巴亨公司(bachem))在fluostar omega平板读数器(bmg labtech公司)中测量4nm tpa的纤溶酶原激活,激发和发射波长分别为355nm和460nm。在graphpad prism 6中,将进程曲线拟合到非线性指数方程:
[0528]
y=y0*exp(激活率*x)
[0529]
其中y0是x=0时的y值。相对于相应的g05或g11浓度绘制激活率,以产生抑制曲线,该曲线可以在graphpad prism 6用抑制剂相比于响应模型拟合:
[0530]
y=底部+(顶部-底部)/(1+((x
坡
)/(ic
50坡
)))
[0531]
其中顶部和底部是荧光读数中的平台,并且坡是曲线陡度的量度。ic
50
值,即抑制溶液中50%tpa介导的纤溶酶原激活的g05浓度,为17.29
±
2.73nm(图3a)。g11的ic
50
值为20nm(图3b)。
[0532]
关于纤维蛋白:
[0533]
在预制纤维蛋白凝块的表面上测量纤溶酶原激活,该凝块通过在37℃下混合3mg/ml纤维蛋白原(班克西亚科技公司(banksia scientific));1u牛凝血酶(jomar生命研究公司);和10nm tpa(勃林格殷格翰公司(boehringer ingelheim))2小时来制备。将与浓度(0-2μm)的g05或g11混合的100nm纤溶酶原添加到凝块的表面。如上所述,使用200μm荧光底物(h-ala-phe-lys-amc,巴亨公司)监测纤溶酶活性。如上所述计算纤溶酶原激活率和ic
50
。对于g05抑制纤维蛋白上tpa介导的纤溶酶原激活所获得的ic
50
值为292nm(图4a)。对于g11抑制纤维蛋白上tpa介导的纤溶酶原激活所获得的ic
50
值为47nm(图4b)。
[0534]
纤溶酶的无抑制作用
[0535]
在200μm荧光底物(h-ala-phe-lys-amc,巴亨公司)存在下,在fluostar omega平板读数器(bmg labtech公司)中,经由分别为355nm和460nm的激发和发射波长,测量纤溶酶(血液技术公司(haematologic technologies))活性。获得了g05和a01(一种非抑制性纤溶酶原抗体)在10:1抗体:纤溶酶比率下的进展曲线。与a01相比,g05显示出对plm活性的轻微激动作用。使用fluostar omega平板读数器(bmg labtech公司),经由分别为355nm和460nm的激发和发射波长,在37℃下测量20nm纤溶酶和抗体g05(0-200nm)。观察到弱的g05浓度依赖性激动作用(图5)。
[0536]
g05抑制链激酶与纤溶酶原的结合
[0537]
使用biacore t200(通用电气医疗集团)研究g05对链激酶与纤溶酶原结合的影响。在0、62.5、125、250和500nm的g05或初始鸡抗体(gab)存在下,使10nm纤溶酶原通过固定在cm4(通用电气医疗集团)芯片上的链激酶。g05在125nm及以上显示抑制作用。对照的初始鸡抗体gab未显示出抑制作用。在500nm g05和gab存在下sk结合的百分比,相对于无抗体对照归一化。
[0538]
图6中显示的结果表明g05部分与链激酶竞争纤溶酶原结合。
[0539]
抑制sk介导的纤溶酶原激活
[0540]
将链激酶对纤溶酶原的激活用于评估本发明抗体的能力。在37℃下,用5nm的重组链激酶激活50nm的纤溶酶原。使用200μm纤溶酶荧光底物h-ala-phe-lys-amc(巴亨公司),在fluostar omega平板读数器(bmg labtech公司)中,经由分别为355nm和460nm的激发和发射波长,监测纤溶酶原激活的进程。在该过程中,在特定时间点(t=0、t=60分钟和t=160分钟)分别添加0.5μm抗体。添加hepes缓冲盐水代替抗体作为阴性对照。
[0541]
图7中的结果显示,当在t=0和10时添加g05抗体时,其有效地抑制链激酶介导的纤溶酶原激活,并且在t=60分钟添加时部分地抑制。
[0542]
实例3:g05和g11与重组丝氨酸蛋白酶结构域的结合
[0543]
评估g05与重组克林格勒5-丝氨酸蛋白酶结构域(kr5-sp)的结合。g05与kr5-sp结合并形成稳定的二元复合物,该复合物可以通过尺寸排阻色谱进行共纯化。使用superdex 200 16/60柱(通用电气医疗集团),并且缓冲液是hepes缓冲盐水。如图8a所示,共复合物以58.8ml作为单峰被洗脱。作为参考,kr5-sp和g05抗体分别以66.7ml和74.6ml被洗脱,也作为单峰。
[0544]
g11与丝氨酸蛋白酶结构域(sp)结合并形成稳定的二元复合物,该复合物可以通过尺寸排阻色谱进行共纯化。使用superdex 75 16/60柱(通用电气医疗集团),并且缓冲液是hepes缓冲盐水。如图8b所示,共复合物以58.0ml作为单峰被洗脱。作为参考,sp和g11分别以82ml和66.2ml时的二聚体被洗脱。
[0545]
实例4:g05与单一重组克林格勒5-丝氨酸蛋白酶结构域结合的晶体结构
[0546]
在20℃下,在0.1m mes ph 6.5和10%(w/v)peg 20,000存在下,将纯化的g05/kr5-sp复合物以10mg/ml结晶。在20%(v/v)甘油存在下,将晶体在液体n2中闪蒸冷却。使用eiger x 16m像素检测器(瑞士dectris有限公司,也称为acrf检测器),在澳大利亚同步加速器mx2光束线上收集数据集。使用来自纤溶酶原结构(pdb id 4dur)和鸡单链片段可变区(pdb id 4p48)的kr5和sp结构域作为搜索模型,使用程序phaser(ccp4)通过分子置换解析晶体结构。使用coot进行多轮建模,并且使用phenix进行细化。图9a中显示的最终模型是使用pymol(www.pymol.org/)制备的。
[0547]
g05-kr5-sp复合物结构揭示了抗体与纤溶酶原的激活环形成极性相互作用,从而通过阻断纤溶酶原激活物切割激活环来防止纤溶酶产生。
[0548]
实例5:g11与单一重组丝氨酸蛋白酶结构域结合的晶体结构
[0549]
在20℃下,在0.1m mes ph 6.0、0.2m硫酸锂和20%(w/v)peg 4,000存在下,将纯化的g11/sp复合物以15mg/ml结晶。在20%(v/v)甘油存在下,将晶体在液体n2中闪蒸冷却。使用eiger x 16m像素检测器(瑞士dectris有限公司,也称为acrf检测器),在澳大利亚同步加速器mx2光束线上收集数据集。使用来自纤溶酶原结构(pdb id 4dur)和鸡单链片段可变区(pdb id 4p48)的sp结构域作为搜索模型,使用程序phaser(ccp4)通过分子置换解析晶体结构。使用coot进行多轮建模,并且使用phenix进行细化。显示的最终模型(图9b)是使用pymol(www.pymol.org/)制备的。
[0550]
g11-sp复合物结构揭示了该抗体与纤溶酶原/纤溶酶的丝氨酸蛋白酶结构域形成极性相互作用,使得经由扭曲催化位点和周围的环来阻止纤溶酶的产生和活性。这意味着该酶受到催化损害。
[0551]
实例6:纤溶酶原与gas结合的抑制
[0552]
在以下实验中使用一种未激活的纤溶酶原突变体来确定与gas的结合。
[0553]
通过流式细胞术
[0554]
在振荡培养箱中于37℃下,使gas细胞在来自甘油原液穿刺的todd-hewitt(th)肉汤中生长过夜。在实验当天,首先用新鲜th肉汤将培养物亚接种至od
600
为0.1,并使其如前所述在振荡培养箱中生长。将od
600
为0.35时的早期对数期gas用补充有2%纤溶酶原耗尽的
胎牛血清(fcs)的磷酸盐缓冲盐水(pbs)洗涤两次,并以等效体积重悬。将用alexa-fluor 647标记的重组纤溶酶原(22.2nm)与250μl经洗涤的gas细胞在4℃下孵育30分钟。然后洗涤细胞,并立即通过流式细胞术进行分析。为了确保分析同质细胞群体,对单细胞进行门控以排除较大的实体,这些实体最有可能是链球菌链。随后使用syto-9核酸染料(赛默飞世尔公司(thermofisher))来选择活细胞群体。
[0555]
图10中显示的结果揭示,在2.22μm下,g05将重组纤溶酶原与gas结合抑制约40%。作为对照,使用25mm氨甲环酸,其将重组纤溶酶原结合减少约80%。阴性对照初始鸡抗体gab未显示出抑制作用。
[0556]
通过sds-page
[0557]
除了od
600
为1.0之外,如上所述生长gas培养物。每种条件下使用1ml培养物。将细胞洗涤两次,重悬于250μl补充有2%纤溶酶原耗尽的fcs的pbs中,将0.2μm重组纤溶酶原与gas以及7.5μm g05、gab、13.5mm txa或单独的缓冲液对照一起孵育。在4℃下孵育30分钟后,回收上清液(未结合级分)。然后如上所述洗涤细胞两次,并且保留第二次洗涤用于sds-page。用50ul的500mm txa洗脱结合的纤溶酶原,将细胞重悬并再次离心。收集所得上清液作为“结合级分”。在12%sds-page上分离未结合、洗涤和结合级分以及0.2μm(总)的重组纤溶酶原,随后使用typhoon凝胶成像系统(amersham公司)在cy5过滤器下进行荧光扫描。使用imagequant tl软件(通用电气医疗集团)中的标准2d凝胶分析来确定条带的强度。
[0558]
图11中显示的结果表明与gab和hepes缓冲盐水对照相比,g05使重组纤溶酶原与gas的结合减少了70%。有趣的是,阳性对照txa没有显示出任何抑制作用。此结果表明,txa(一种纤溶酶抑制剂)可能不抑制gas与纤溶酶原结合。
[0559]
实例7:对a组链球菌(gas)抑制纤溶酶原激活(酶测定)。
[0560]
如上所述生长gas培养物,但od
600
为1.0。每个样品使用1ml培养物。将细胞洗涤两次,并将每个样品重悬于250μl补充有2%纤溶酶原耗尽的fcs的pbs中。80nm纤溶酶原和8μm g05/gab或13.5mm txa在室温下混合15分钟,随后与经洗涤的gas细胞在室温下孵育1小时。在孵育1小时后,将细胞洗涤两次,并最终重悬于50μl补充有2%纤溶酶原耗尽的fcs的pbs中。将2nm重组sk添加到一半的测试样品中,以测试是否需要替换sk。将10μl重悬的细胞添加到100μl反应混合物中,该反应混合物用25mm tris、150mm nacl、0.05%tween20 ph 7.4和200μm荧光底物h-ala-phe-lys-amc(巴亨公司)缓冲。在fluostar omega平板读数器(bmg labtech公司)中,经由分别为355nm和460nm的激发和发射波长,在37℃下测量纤溶酶活性。
[0561]
图12中显示的结果表明在存在和不存在重组sk的情况下,g05抑制纤溶酶原激活。不出所料,gab没有效果。txa将纤溶酶原从细胞表面解离,有助于增加在添加sk时观察到的活性(plg的溶液激活)。图12插图说明了在不存在gas细胞的情况下,重组sk最终激活溶液中的plg。
[0562]
实例8:hplg被募集到cdi损伤的肠道加剧组织损伤和疾病,并且抗纤溶酶原抗体降低疾病严重程度、延迟疾病的发作,并增加小鼠的存活率。
[0563]
艰难梭菌(现在的艰难拟梭菌)感染胃肠道,并导致严重的组织损伤。艰难梭菌感染(cdi)的一个关键驱动因素与这种细菌形成惰性和高度强健的孢子形式的能力有关,这种孢子形式允许该细菌在不利环境中存活。孢子引发并传播疾病,并且导致疾病复发-这一事件发生在多达30%的患者中。在结肠中,孢子萌发成营养细胞,这些营养细胞在肠道中定
殖并产生多达三种毒素:大梭菌毒素tcda和tcdb以及艰难梭菌转移酶(cdt)毒素。这些分子通过其对宿主细胞肌动蛋白细胞骨架的作用直接作用于损害和渗透结肠组织。艰难梭菌营养细胞也产生孢子,在经感染患者的每克粪便中发现高达1
×
107个孢子;这些孢子传播疾病并延续感染周期。
[0564]
肝脏产生的酶原纤溶酶原的活性形式纤溶酶是一种丝氨酸蛋白酶,在纤维蛋白溶解、细胞迁移和组织重塑方面起关键作用。已知某些病原体(包括a组链球菌和炭疽杆菌)通过募集和激活纤溶酶原至微生物表面来利用纤维蛋白溶解系统。由于其降解宿主组织的能力,微生物相关的纤溶酶大大增强了细菌对宿主的侵袭,从而增加了感染期间疾病的严重程度。
[0565]
在正常情况下,纤溶酶原在胃肠道中丰度低。然而,据推测,由于其在创伤愈合方面的作用,纤溶酶原系统可能被募集到感染部位,在那里它可以加剧或抑制疾病进展。为了测试这个想法,用艰难梭菌的产毒野生型(wt)菌株(m7404)或不再产生主要毒素tcda和tcdb的突变菌株(dll3121)感染注入人纤溶酶原(hplg)的小鼠或表达人纤溶酶原(hplg)的转基因小鼠。与未感染的小鼠相比,wt感染的小鼠展示出上皮损伤、水肿和炎症(图13a)。据发现,与所有对照相比,这些wt感染的小鼠盲肠中的hplg水平显著升高(图13b)。另外,与未感染的动物相比,在dll3121感染的小鼠中检测到略微升高的hplg水平(图13b)。这些结果表明,cdi和组织损伤导致hplg流入感染部位处的胃肠组织。主要毒素tcda和tcdb的作用似乎是hplg迁移到感染部位中的主要驱动因素,尽管其他细菌因子,如艰难梭菌二元毒素(cdt)或其他毒力因子足以介导部分hplg流入。总之,这些结果表明,艰难梭菌感染和组织损伤导致hplg流入感染部位处的胃肠组织。
[0566]
为了确定hplg组织流入是否影响感染结果,将野生型c57bl/6小鼠的疾病严重程度与在表达hplg的转基因小鼠中观察到的疾病严重程度进行比较,这两种小鼠都感染了产毒艰难梭菌。当存在hplg时,疾病大大加重,其中在表达hplg的小鼠中观察到更早的疾病发作,如由更高的粪便稠度得分(图13c)、筑巢材料的污染增加(图13d)和更差的生理条件(图13e)所证明。疾病症状的严重程度导致存活时间的显著减少,其中hplg转基因小鼠比wt小鼠提前24小时需要安乐死(图13f)。为了确保疾病加重不是由各组小鼠之间的定殖或毒素产生差异引起的,在感染后24小时收集粪便并进行分析。两组小鼠的tcda和tcdb产量相当(图13g、h),并且没有检测到从小鼠脱落的孢子数量的可辨别差异,其中所有小鼠均脱落5
×
10
6-1
×
107个孢子/g粪便。
[0567]
接下来研究在经感染动物中是否发生了肠内容物的渗漏和腔内容物向远端器官的扩散。据推断,这样的结果可以解释在hplg小鼠中观察到的疾病加重。因此,在感染后24小时收获胸腺、脾脏和肾脏,并检查孢子的存在。在hplg小鼠的肾脏、脾脏和胸腺中检测到孢子,但除了胸腺中非常低数量的孢子之外,在c57bl/6对照小鼠中未检测到孢子(图13i)。对在感染后24小时的时间点收获的盲肠组织的检查揭示,与c57bl/6小鼠相比,hplg小鼠中明显有更多的炎症(图13j)。这些发现得到了使用注入hplg的小鼠进行的实验的支持,这些小鼠还表现出加速的疾病症状。因此,在表达hplg或注入hplg的小鼠中看到的加重的疾病反映在小鼠的盲肠病理学中,这表明hplg在产毒艰难梭菌感染期间加剧了肠道炎症,从而导致更严重的疾病结果。经感染组织中hplg的存在也改变了宿主的炎症特征,其中与经感染的pbs对照小鼠相比,在经感染的hplg小鼠中检测到促炎细胞因子和抗炎细胞因子的产
生显著增加(图14a)。从pbs和hplg注入的小鼠收集的经感染相比于未感染盲肠组织的定量蛋白质组分析支持了这些发现(数据未示出)。综上所述,这些数据表明艰难梭菌能够在感染过程中募集hplg,并且这种蛋白酶的存在增强了炎症和疾病的严重程度,进而cdi促进了艰难梭菌孢子向肠外器官的移位,后者先前从未报道过。
[0568]
由于在这些感染实验中使用的小鼠除了hplg之外,还都产生鼠纤溶酶原(mplg),因此通过检查在用产毒艰难梭菌感染不再表达mplg(mplg ko)的遗传修饰小鼠和未经修饰的c57bl/6(wt)小鼠后的疾病结果来研究mplg在感染期间的作用。在两组之间没有观察到疾病进展或存活时间的差异(图13k),这表明在该感染模型中mplg不会导致疾病。
[0569]
由于几种不同的侵袭性病原体,包括细菌和寄生虫,在其表面上募集纤溶酶原以开启宿主侵袭并破坏宿主免疫反应,因此检查了艰难梭菌是否具有相同的能力。虽然通常是病原菌的营养形式结合纤溶酶原,但在炭疽杆菌中发现孢子形式结合纤溶酶原,尽管对疾病的严重程度或毒力没有影响。出乎意料地,发现hplg不结合艰难梭菌营养细胞(图15a),而是与孢子强烈结合,而与细菌菌株的来源(人或动物)、地理位置或产毒状态无关(图15a和c)。此外,免疫荧光(if)和sted超分辨率显微术证实hplg(对于if为alexa 488,且对于sted为alexa 647)与在实验室培养条件下产生的孢子结合(图15d-f)。重要的是,还发现来源于艰难梭菌感染的患者(图15g-i)或艰难梭菌感染的小鼠(图15j-l)的孢子在其表面上具有hplg,同时sted成像显示在所有情况下hplg都围绕孢子表面成簇结合(图15e、h、k)。此结果表明,在经感染宿主的情况下,孢子被hplg天然包被。
[0570]
表面等离子体共振证实hplg以高亲和力与艰难梭菌孢子结合(kd为13.4nm
±
3.2nm,k
on
为55,520(
±
6953)m/s且k
off
为7.3
×
10-4
(
±
1.1
×
10-4
)1/s)(图3b)。关键的是,没有检测到孢子和mplg之间的浓度依赖性相互作用(图15b)。这些数据支持以下发现:在wt相比于鼠纤溶酶原缺陷型小鼠之间没有观察到毒力的差异(图13k)。艰难梭菌孢子还与猪和马plg结合(图15b),尽管比与人plg的亲和力更低,这可能表明这些蛋白质也有助于此类宿主的疾病加重。
[0571]
plg向其最活跃形式纤溶酶的转化受到严格调节。hplg被宿主因子(如尿激酶纤溶酶原激活物(upa)和组织纤溶酶原激活物(tpa))转化为纤溶酶。因此,进行了在孢子结合形式的情况下的plg激活测定。将未结合或孢子结合的hplg与人或鼠upa(hupa和mupa)和人tpa(htpa)一起孵育。小鼠和人的因子二者都将hplg激活为未结合或孢子结合状态的纤溶酶,这表明孢子在其表面上具有纤溶酶,并且可以将这种活性蛋白酶转运到它们所占据的任何部位,无论是在肠道内还是肠道外。这个想法得到了蛋白质组学分析的支持,该蛋白质组学分析显示,仅在经感染的hplg小鼠中,纤溶酶原激活级联的小鼠变体的量有所增加(数据未示出),这表明hplg在这些动物的胃肠道中被激活并发挥功能。
[0572]
由于纤溶酶具有广泛的底物特异性,并且为了确定在艰难梭菌孢子情况下纤溶酶原激活的功能结果,我们研究了孢子结构以确定其是否改变,特别是在表面上。引人注目的是,透射电子显微镜显示,与孢子结合并使用hupa激活的hplg将孢子外膜或最外面的孢子层的厚度减少了一半,从未处理的孢子中的平均73.9nm减少到hplg结合的孢子中的34.6nm(图16a-e)。由于萌发剂在它们可以激活孢子萌发之前必须穿过孢子外层,因此该层的厚度和密度可能会影响萌发过程的效率。因此,在已知的宿主衍生的胆汁酸萌发剂牛磺胆酸盐的存在下,进行萌发测定,显示纤溶酶结合的孢子比未处理的孢子更快速地萌发(图16f)。
这一结果表明,hplg的结合和激活直接改变了艰难梭菌孢子的结构和功能特性,从而导致在生理相关的宿主萌发剂存在下更快的萌发,这可能有助于在前文描述的hplg-小鼠模型中看到的更早的疾病发作和严重的疾病结果。我们还检查了孢子-hplg结合和激活关于宿主相互作用的其他功能结果,并且表明纤溶酶结合的艰难梭菌孢子切割c3b和细胞外基质(ecm)蛋白纤连蛋白,这表明孢子-hplg结合和激活纤溶酶改变了孢子-宿主相互作用。纤溶酶介导的细菌细胞(在这种情况下是孢子)表面的修饰以前没有被证实,并且对病原体如何适应利用宿主蛋白的蛋白水解活性带来了新的理解。
[0573]
总之,迄今为止的这些发现表明,hplg的存在似乎通过诱导免疫反应、降解宿主组织和促进肠外孢子传播,以多因素的方式导致疾病加重。后一事件尤其可能与疾病复发有关。
[0574]
在这些发现的基础上,研究了靶向hplg治疗是否可以提出cdi的有效治疗。先前的研究表明,纤溶酶系统具有特异性抑制的挑战性,因为小分子纤溶酶抑制剂与凝血系统的其他关键蛋白酶交叉反应。为了克服这些问题,开发了特异性靶向纤溶酶原/纤溶酶系统的抗体。测试了两种抗体。发现一种抗体g05有效地抑制活性纤溶酶的产生。发现另一种抗体通过与纤溶酶的催化三联体结合而有效地抑制纤溶酶的活性。测定了g05的scfv片段与纤溶酶原的片段(kr5-sp)(称为kr5-sp,图9)的复合物的x射线晶体结构。g05/kr5-sp复合物结构揭示了该抗体与hplg的激活环特异性相互作用,从而阻止激活物(如tpa和upa)切割并激活酶原。
[0575]
对已经注入hplg并感染艰难梭菌的c57bl/6小鼠腹膜内注射单独的hepes缓冲盐水(hbs),或作为对照组的初始抗体,或抗体g05。当与对照组相比时,g05处理组的疾病发作没有那么快,同时在感染后24小时检测到的粪便稠度(图17b)和筑巢材料污染(图17a)得分均较低。g05处理组和对照组之间的生理表现也倾向于感染后24小时疾病严重程度的降低(图17c)。超过该时间点的小鼠存活也是惊人的,其中g05处理的小鼠比对照小鼠多存活24小时(图17d)。这些结果表明,施用纤溶酶生成抑制抗体g05(即,抑制纤溶酶原激活为纤溶酶的抗体)可预防严重疾病,并延长经感染小鼠的存活。
[0576]
这些数据表明,毒素损伤后胃肠道中hplg的失调和数量增加改变了艰难梭菌感染的动力学,并允许提出cdi进展的新模型。在这个模型中,毒素介导的肠道损伤将hplg募集到受损区域。hplg的异常定位和激活通过增加免疫细胞流入和宿主蛋白降解的炎症反应促进了进一步的组织损伤。一旦感染确定,则hplg可能被募集到摄入的孢子和肠道内新产生的孢子二者。纤溶酶诱导孢子快速萌发,增加产毒素营养细胞的数量,进一步加剧宿主组织损伤,并增强疾病的严重程度。纤溶酶结合的孢子还具有更大的侵袭潜力,并且可以在宿主中全身扩散,这可能增加疾病复发的倾向。支持这一模型的是,抑制纤溶酶原激活的抗体g05成功地降低了疾病严重程度。由于几种胃肠病原体通过损害组织完整性的产毒效应物来介导疾病,并且许多其他胃肠障碍导致类似的漏肠效应,因此这些结果对于理解肠道疾病的潜在机制具有更广泛的意义,并且提高了抑制人纤溶酶原或纤溶酶可能具有广泛治疗效用的可能性。
[0577]
实例9:施用抑制纤溶酶原激活的抗体可用于减少出血
[0578]
使野生型c56bl/6(wt)和在编码纤溶酶原的基因中含有双突变(plg敲除plg-/-)的小鼠经受尾部出血实验。
[0579]
给每只动物静脉注射200μg人纤溶酶原。在5分钟后,静脉施用50μg抗体(gab或g05)。通过将切割的尾部浸入温盐水中20分钟进行尾部出血实验。通过收集红细胞来测量出血量,然后将红细胞悬浮在固定体积的裂解缓冲液中;记录每只动物的od
550
。
[0580]
数据(图19中显示)显示,与接受初始(gab)抗体的小鼠相比,接受g05抗体的小鼠的出血量显著减少。这些结果表明,抑制纤溶酶原激活的抗体可用于抑制创伤诱导的出血模型中的出血。
[0581]
实例10:g05和g11抑制合成凝块和全血凝块的溶解
[0582]
通过在37℃下混合3mg/ml纤维蛋白原(班克西亚科技公司);1u牛凝血酶(jomar生命研究公司);和10nm tpa(勃林格殷格翰公司)2小时来形成合成纤维蛋白凝块。通过将与0-3μm g05;0-2μm g11;0-90nmα2ap;或0-6.25mm txa混合的45nm纤溶酶原添加到凝块的表面来启动纤维蛋白溶解。
[0583]
在37℃下在浊度计(bmg)上监测纤维蛋白溶解长达10小时。将实现50%凝块溶解所需的时间用于ic
50
计算。g05和g11的组合显著抑制凝块溶解,并且比单独使用任一抗体时高大约4至6倍。
[0584]
全血凝块是由从健康供体收集的人血形成的。通过在hbs中将全血与15%含有补充有合成磷脂(dade innovin,德国西门子公司(siemens germany))和67mm cacl2的重组组织因子的混合物以1:4的比率混合来产生晕状凝块。使用前将平板密封并在37℃下孵育60分钟。
[0585]
通过添加7nm的tpa和以下浓度的抗体或plm抑制剂来诱导凝块溶解:0-312.5nm b10;0-1000nmα2ap;0-1000nm抑肽酶;0-7.5mm txa。凝块溶解导致浊度增加,并且使用平板读数器在od6
10 nm处监测。
[0586]
在高浓度(例如高达1,000nm)下,α2ap和抑肽酶仅部分地抑制凝块溶解;浓度高达100μm的txa延迟了凝块溶解,并且在300μm及以上观察到凝块溶解的完全抑制(数据未示出)。
[0587]
将实现50%凝块溶解所需的时间用于ic
50
计算。对于g11所获得的ic
50
值比α2ap高大约2倍,并且比抑肽酶高大约2.5倍(图20)。
[0588]
因此,在非常类似生理系统的凝块溶解测定的情况下,抗体g11在抑制纤溶酶诱导的溶解方面比纤溶酶的生理抑制剂α2ap更有效,并且比纤溶酶的药理学抑制剂抑肽酶更有效。
[0589]
应当理解的是,在本说明书中披露和限定的本发明可扩展至所提及的或者从文本部分和附图部分显而易见的单个特征的两个或更多个的所有替代性组合。所有这些不同组合构成本发明的多个替代性方面。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1