双特异性抗CCL2抗体的制作方法
双特异性抗ccl2抗体
技术领域
1.本发明涉及与人ccl2上两个不同表位结合的双特异性抗ccl2抗体,其药物组合物,其制备,及用作治疗癌症、炎性疾病、自身免疫病及眼科疾病的药物的用途。
背景技术:
2.ccl2/ccr2轴是募集未成熟髓样细胞进入肿瘤的主要介质。ccl2被恶性细胞超表达,并与细胞外基质(ecm)结合,建立了趋化梯度。一旦它们到达肿瘤,髓源性抑制细胞(myeloid-derived suppressive cell,mdsc)通过分泌/上调抗炎细胞因子/受体而反过来抑制抗肿瘤t细胞反应的启动,从而促成原致肿瘤环境。以此方式,mdsc可降低或甚至削弱任何t细胞活化疗法的功效(meyer等人,2014)。因此,对这些未成熟髓样细胞募集的特异性抑制将提高检查点抑制剂、t细胞双特异性抗体(tcb)或其他癌症免疫疗法(cit)的功效。此外,ccl2也与促进血管生成、转移和肿瘤生长有关,有建议指出中和ccl2可能有助于多种抗肿瘤干预措施。
3.与其受体相反,靶向ccl2将特异性抑制不期望的ccl2介导的作用,从而避免那些可能通过相同受体(ccr2)但不同配体(例如ccl7、ccl8、ccl13)发出的信号,这些信号参与其他免疫细胞群,例如th1和nk细胞的募集。
4.在临床上,在一些针对中和由不同炎性疾病(例如类风湿性关节炎(haringman等人,arthritis rheum.2006aug;54(8):2387-92)、特发性肺纤维化(raghu等人,eur respir j.2015dec;46(6):1740-50)、糖尿病肾病(menne等人,nephrol dial transplant(2017)32:307-315)和癌症(sandhu等人,cancer chemother pharmacol.2013apr;71(4):1041-50))引起的升高的水平的研究中,ccl2是优选的抗体靶标。然而,其高合成速率与观察到的高体内抗体-抗原解离常数(kd)已被证明是阻碍常规抗体以临床可行剂量抑制游离ccl2的主要障碍(fetterly等人,j clin pharmacol.2013oct;53(10):1020-7)。
5.ccl2中和似乎与血清ccl2水平升高的患者更明显相关,这已在多种类型的癌症中观察到,例如乳腺癌(bc)、卵巢癌(ovca)、结直肠癌(crc)、胰腺癌和前列腺癌。然而,即使在这些适应症范围内的患者未表现出这种血清学但其肿瘤被髓系免疫细胞高度浸润,由于如上所述ccl2在肿瘤环境中起到的多种作用,患者可能从此新颖的治疗方法中获益。
6.igawa等人,immunological reviews 270(2016)132-151描述扫除(sweeping)技术,其中,生成的抗体携带ph依赖性cdr(用于酸性内体中的抗体-抗原解离,导致抗原降解)及具有优化等电点(pi)的工程化fc部分,并增强与fcγriib的结合(有利于免疫复合物的细胞摄取),并与新生儿fc受体具有中等亲和力,以维持可接受的药物代谢动力学特征。
技术实现要素:
7.本发明涉及与人ccl2上两个不同表位结合的双特异性抗ccl2抗体,其药物组合物,其制备,及用作治疗癌症、炎性疾病、自身免疫病及眼科疾病的药物的用途。
8.本发明的一个实施例为一种双特异性抗体,其包含与人ccl2上的第一表位(特异
性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二不同抗原结合位点,其中,该双特异性抗体包含人igg同种型的fc结构域。
9.本发明的一个实施例为一种双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二不同抗原结合位点,
10.其中,
11.a)i)所述第一抗原结合位点包含
12.vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
13.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
14.ii)所述第二抗原结合位点包含
15.vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
16.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
17.或者
18.b)i)所述第一抗原结合位点包含
19.vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
20.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
21.ii)所述第二抗原结合位点包含
22.vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
23.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
24.或者
25.c)i)所述第一抗原结合位点包含
26.vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
27.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
28.ii)所述第二抗原结合位点包含
29.vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
30.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;
31.或者
32.d)i)所述第一抗原结合位点包含
33.vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
34.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;并且
35.ii)所述第二抗原结合位点包含
36.vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
37.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
38.或者
39.e)i)所述第一抗原结合位点包含
40.vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
41.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;并且
42.ii)所述第二抗原结合位点包含
43.vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;以及
44.vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
45.或者
46.f)i)所述第一抗原结合位点包含
47.vh结构域,其包含:(a)cdr-h1,其包含seq id no:49的氨基酸序列;(b)cdr-h2,其包含seq id no:50的氨基酸序列;以及(c)cdr-h3,其包含seq id no:51的氨基酸序列;
48.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:52的氨基酸序列;(e)cdr-l2,其包含seq id no:53的氨基酸序列;以及(f)cdr-l3,其包含seq id no:54的氨基酸序列;并且
49.ii)所述第二抗原结合位点包含
50.vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;以及
51.vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
52.或者
53.g)i)所述第一抗原结合位点包含
54.vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
55.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
56.ii)所述第二抗原结合位点包含
57.vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
58.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
59.或者
60.h)i)所述第一抗原结合位点包含
61.vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
62.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
63.ii)所述第二抗原结合位点包含
64.vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
65.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;
66.或者
67.i)i)所述第一抗原结合位点包含
68.vh结构域,其包含:(a)cdr-h1,其包含seq id no:1的氨基酸序列;(b)cdr-h2,其包含seq id no:2的氨基酸序列;以及(c)cdr-h3,其包含seq id no:3的氨基酸序列;
69.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:4的氨基酸序列;(e)cdr-l2,其包含seq id no:5的氨基酸序列;以及(f)cdr-l3,其包含seq id no:6的氨基酸序列;并且
70.ii)所述第二抗原结合位点包含
71.vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
72.以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列。
73.在一个实施例中,双特异性抗体包含人igg同种型的fc结构域。
74.在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
75.在一个实施例中,双特异性抗体包含人igg同种型的恒定重链结构域。
76.在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。
77.在一个实施例中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g(kabat eu编号)的人igg1同种型的fcγ受体沉默恒定重链结构域(或其fc结构域)的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型的恒定重链结构域(或其fc结构域)的双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少两倍(在一个实施例中高至少5倍,在一个实施例中高至少10倍,在一个实施例中高至少20倍)。
78.本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
79.其中,
80.i)所述第一抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
81.vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
82.以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
83.ii)所述第二抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
84.vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
85.以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列。
86.在一个实施例中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g(kabat eu编号)的人igg1同种型的fcγ受体沉默恒定重链结构域(或其fc结构域)的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人类野生型igg1同种型的恒定重链结构域(或其fc结构域)的双特异性抗体后,人ccl2的体内清除率
(ml/天/kg)高至少15倍,特别地高至少20倍。
87.本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
88.其中,
89.i)所述第一抗原结合位点包含
90.vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
91.以及
92.vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
93.并且
94.ii)所述第二抗原结合位点包含
95.vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
96.以及
97.vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
98.本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
99.其中,
100.i)所述第一抗原结合位点包含
101.vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq idno:58的氨基酸序列gx1ix2fx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;(d)fr-h1,其包含seq id no:63的氨基酸序列qvqlvqsgaevkkpgssvkvsckasggtf;(e)fr-h2,其包含seq id no:64的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:65的氨基酸序列rvtitadeststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:66的氨基酸序列wgqgtlvtvss;
102.以及
103.vl结构域,其包含:(h)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(i)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(j)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;(k)fr-l1,其包含seq id no:67的氨基酸序列
eivltqspatlslspgeratlsc;(l)fr-l2,其包含seq id no:68的氨基酸序列wyqqkpgqaprlliy;(m)fr-l3,其包含seq id no:69的氨基酸序列gvparfsgsgsgtdftltisslepedfavyyc;以及(n)fr-l4,其包含seq id no:70的氨基酸序列gqgtkveik;
104.并且
105.ii)所述第二抗原结合位点包含
106.vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;(d)fr-h1,其包含seq id no:82的氨基酸序列qvqlvqsgaevkkpgssvkvsckasgltis;(e)fr-h2,其包含seq id no:83的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:84的氨基酸序列rvtitadtststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:85的氨基酸序列wgqgttvtvss;
107.以及
108.vl结构域,其包含:(h)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(i)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;(j)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;(k)fr-l1,其包含seq id no:86的氨基酸序列diqmtqspsslsasvgdrvtitc;(l)fr-l2,其包含seq id no:87的氨基酸序列wyqqkpgkapkllih;(m)fr-l3,其包含seq id no:88的氨基酸序列gvpsrfsgsgsgtdytltisslqpedfatyyc;以及(n)fr-l4,其包含seq id no:89的氨基酸序列fgggtkveik。
109.本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
110.其中,
111.a)i)所述第一抗原结合位点包含
112.vh结构域,其包含seq id no:71的氨基酸序列;
113.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
114.ii)所述第二抗原结合位点包含
115.vh结构域,其包含seq id no:90的氨基酸序列;
116.以及vl结构域,其包含seq id no:93的氨基酸序列;
117.或者
118.b)i)所述第一抗原结合位点包含
119.vh结构域,其包含seq id no:71的氨基酸序列;
120.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
121.ii)所述第二抗原结合位点包含
122.vh结构域,其包含seq id no:91的氨基酸序列;
123.以及vl结构域,其包含seq id no:93的氨基酸序列;
124.或者
125.c)i)所述第一抗原结合位点包含
126.vh结构域,其包含seq id no:71的氨基酸序列;
127.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
128.ii)所述第二抗原结合位点包含
129.vh结构域,其包含seq id no:90的氨基酸序列;
130.以及vl结构域,其包含seq id no:94的氨基酸序列;
131.或者
132.d)i)所述第一抗原结合位点包含
133.vh结构域,其包含seq id no:72的氨基酸序列;
134.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
135.ii)所述第二抗原结合位点包含
136.vh结构域,其包含seq id no:90的氨基酸序列;
137.以及vl结构域,其包含seq id no:94的氨基酸序列;
138.或者
139.e)i)所述第一抗原结合位点包含
140.vh结构域,其包含seq id no:73的氨基酸序列;
141.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
142.ii)所述第二抗原结合位点包含
143.vh结构域,其包含seq id no:90的氨基酸序列;
144.以及vl结构域,其包含seq id no:93的氨基酸序列;
145.或者
146.f)i)所述第一抗原结合位点包含
147.vh结构域,其包含seq id no:73的氨基酸序列;
148.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
149.ii)所述第二抗原结合位点包含
150.vh结构域,其包含seq id no:90的氨基酸序列;
151.以及vl结构域,其包含seq id no:94的氨基酸序列;
152.或者
153.g)i)所述第一抗原结合位点包含
154.vh结构域,其包含seq id no:73的氨基酸序列;
155.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
156.ii)所述第二抗原结合位点包含
157.vh结构域,其包含seq id no:92的氨基酸序列;
158.以及vl结构域,其包含seq id no:93的氨基酸序列;
159.或者
160.h)i)所述第一抗原结合位点包含
161.vh结构域,其包含seq id no:73的氨基酸序列;
162.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
163.ii)所述第二抗原结合位点包含
164.vh结构域,其包含seq id no:91的氨基酸序列;
165.以及vl结构域,其包含seq id no:93的氨基酸序列;
166.或者
167.i)i)所述第一抗原结合位点包含
168.vh结构域,其包含seq id no:72的氨基酸序列;
169.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
170.ii)所述第二抗原结合位点包含
171.vh结构域,其包含seq id no:90的氨基酸序列;
172.以及vl结构域,其包含seq id no:93的氨基酸序列;
173.或者
174.j)i)所述第一抗原结合位点包含
175.vh结构域,其包含seq id no:72的氨基酸序列;
176.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
177.ii)所述第二抗原结合位点包含
178.vh结构域,其包含seq id no:92的氨基酸序列;
179.以及vl结构域,其包含seq id no:93的氨基酸序列;
180.或者
181.k)i)所述第一抗原结合位点包含
182.vh结构域,其包含seq id no:72的氨基酸序列;
183.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
184.ii)所述第二抗原结合位点包含
185.vh结构域,其包含seq id no:91的氨基酸序列;
186.以及vl结构域,其包含seq id no:93的氨基酸序列;
187.或者
188.l)i)所述第一抗原结合位点包含
189.vh结构域,其包含seq id no:74的氨基酸序列;
190.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
191.ii)所述第二抗原结合位点包含
192.vh结构域,其包含seq id no:90的氨基酸序列;
193.以及vl结构域,其包含seq id no:93的氨基酸序列;
194.或者
195.m)i)所述第一抗原结合位点包含
196.vh结构域,其包含seq id no:74的氨基酸序列;
197.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
198.ii)所述第二抗原结合位点包含
199.vh结构域,其包含seq id no:90的氨基酸序列;
200.以及vl结构域,其包含seq id no:94的氨基酸序列;
201.或者
202.n)i)所述第一抗原结合位点包含
203.vh结构域,其包含seq id no:74的氨基酸序列;
204.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
205.ii)所述第二抗原结合位点包含
206.vh结构域,其包含seq id no:92的氨基酸序列;
207.以及vl结构域,其包含seq id no:93的氨基酸序列;
208.或者
209.o)i)所述第一抗原结合位点包含
210.vh结构域,其包含seq id no:74的氨基酸序列;
211.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
212.ii)所述第二抗原结合位点包含
213.vh结构域,其包含seq id no:91的氨基酸序列;
214.以及vl结构域,其包含seq id no:93的氨基酸序列;
215.或者
216.p)i)所述第一抗原结合位点包含
217.vh结构域,其包含seq id no:71的氨基酸序列;
218.以及vl结构域,其包含seq id no:75的氨基酸序列;并且
219.ii)所述第二抗原结合位点包含
220.vh结构域,其包含seq id no:92的氨基酸序列;
221.以及vl结构域,其包含seq id no:93的氨基酸序列。
222.本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
223.其中,
224.a)i)所述第一抗原结合位点包含
225.vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
226.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
227.ii)所述第二抗原结合位点包含
228.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d;
229.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)
cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
230.或者
231.b)i)所述第一抗原结合位点包含
232.vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
233.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
234.ii)所述第二抗原结合位点包含
235.vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为e;
236.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
237.或者
238.c)i)所述第一抗原结合位点包含
239.vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
240.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
241.ii)所述第二抗原结合位点包含
242.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
243.以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
244.或者
245.d)i)所述第一抗原结合位点包含
246.vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
247.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
248.ii)所述第二抗原结合位点包含
249.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
250.以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
251.或者
252.e)i)所述第一抗原结合位点包含
253.vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及
(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
254.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
255.ii)所述第二抗原结合位点包含
256.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
257.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
258.或者
259.f)i)所述第一抗原结合位点包含
260.vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
261.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
262.ii)所述第二抗原结合位点包含
263.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
264.以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81
h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
278.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
279.或者
280.i)i)所述第一抗原结合位点包含
281.vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
282.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
283.ii)所述第二抗原结合位点包含
284.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
285.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
286.或者
287.j)i)所述第一抗原结合位点包含
288.vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
289.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、
93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
290.ii)所述第二抗原结合位点包含
291.vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
292.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
293.或者
294.k)i)所述第一抗原结合位点包含
295.vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
296.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
297.ii)所述第二抗原结合位点包含
298.vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
299.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
300.或者
301.l)i)所述第一抗原结合位点包含
302.vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
303.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
304.ii)所述第二抗原结合位点包含
305.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
306.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
307.或者
308.m)i)所述第一抗原结合位点包含
309.vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
310.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
311.ii)所述第二抗原结合位点包含
312.vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列
gvfgffxh,其中,x为d或e;
313.以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
314.或者
315.n)i)所述第一抗原结合位点包含
316.vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
317.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
318.ii)所述第二抗原结合位点包含
319.vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
320.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
321.或者
322.o)i)所述第一抗原结合位点包含
323.vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
324.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:
61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
325.ii)所述第二抗原结合位点包含
326.vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
327.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
328.或者
329.p)i)所述第一抗原结合位点包含
330.vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
331.以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
332.ii)所述第二抗原结合位点包含
333.vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
334.以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
335.在一个实施例中,本文所述的双特异性抗体
336.i)在体外阻断ccl2与其受体ccr2的结合(报告基因测定,ic
50
=0.5nm);和/或
337.ii)在体外抑制髓样细胞的ccl2介导趋化性(ic
50
=1.5nm);和/或
338.iii)与食蟹猕猴ccl2及人ccl2有交叉反应。
339.在一个实施例中,本文所述的双特异性抗体与其他ccl同源物没有交叉反应,特别是与结合至ccl2相比,其显示出与其他ccl同源物(例如ccl8)的结合减少了100倍。
340.在一个实施例中,本文所述的双特异性抗体以离子依赖性方式与人ccl2上的第一和第二表位结合。
341.在一个实施例中,本文所述的双特异性抗体以ph依赖性方式与人ccl2结合,且其中,第一抗原结合位点和第二抗原结合位点二者在中性ph比在酸性ph下以更高的亲和力与ccl2结合。
342.在一个实施例中,本文所述的双特异性抗体在ph 7.4比在ph 5.8下以高10倍的亲和力与人ccl2结合。
343.在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的igg1重链恒定结构域(或其fc结构域)
344.i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
345.ii)l234y、l235w、g236n、p238d、t250v、v264i、h268d、q295l、t307p、k326t和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
346.iii)m428l、n434a和/或y436t(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
347.iv)q438r和/或s440e(适于抑制类风湿因子结合)。
348.在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的igg1重链恒定结构域(或其fc结构域)
349.i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
350.ii)l235w、g236n、h268d、q295l、k326t和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
351.iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
352.iv)q438r和/或s440e(适于抑制类风湿因子结合)。
353.在一个实施例中,本文所述的双特异性抗体包含含有下列突变(kabat eu编号)的igg1重链恒定结构域(或其fc结构域)
354.i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
355.ii)l235w、g236n、h268d、q295l、k326t和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
356.iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
357.iv)q438r和s440e(适于抑制类风湿因子结合)。
358.在一个实施例中,本文所述的双特异性抗体包含含有下列突变(kabat eu编号)的igg1重链恒定结构域(或其fc结构域)
359.i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
360.ii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
361.iii)q438r和/或s440e(适用于抑制类风湿因子结合)。
362.在一个实施例中,本文所述的双特异性抗体包含含有下列突变(kabat eu编号)的igg1重链恒定结构域(或其fc结构域)
363.q311r和p343r(适于增加pi以增强抗原的摄取)。
364.在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的igg1重链恒定结构域(或其fc结构域)
365.i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
366.ii)l234y、p238d、t250v、v264i、t307p和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
367.iii)m428l、n434a和/或y436t(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
368.iv)q438r和/或s440e(适于抑制类风湿因子结合)。
369.在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的igg1重链恒定结构域(或其fc结构域)
370.i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
371.ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
372.iii)m428l、n434a和y436t(适于增加与fcrn的亲和力以延长血浆半衰期);以及
373.iv)q438r和s440e(适于抑制类风湿因子结合)。
374.在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的igg1重链恒定结构域(或其fc结构域)
375.i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
376.ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
377.iii)n434a和(适于增加与fcrn的亲和力以延长血浆半衰期);以及
378.iv)q438r和s440e(适于抑制类风湿因子结合)。
379.在一个实施例中,本文所述的双特异性抗体包含两个含有(独立地或除上述突变之外)下列突变(eu编号)的igg1重链恒定结构域(或其fc结构域)
380.i)在重链恒定结构域之一中的s354c和t366w
381.ii)在其他重链恒定结构域中的y349c、t366s、l368a、y407v
382.本发明的一个实施例为一种(分离的)(单特异性)抗体,其与人ccl2(特异性地)结合,
383.其中,该抗体包含
384.a)vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
385.以及
386.vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
387.或者
388.b)vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
389.以及
390.vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
391.本发明的一个实施例为一种(分离的)(单特异性)抗体,其与人ccl2(特异性地)结合,
392.其中,该抗体包含
393.a)vh结构域,其包含seq id no:71的氨基酸序列;
394.以及vl结构域,其包含seq id no:75的氨基酸序列;
395.或者
396.b)vh结构域,其包含seq id no:72的氨基酸序列;
397.以及vl结构域,其包含seq id no:75的氨基酸序列;
398.或者
399.c)vh结构域,其包含seq id no:73的氨基酸序列;
400.以及vl结构域,其包含seq id no:75的氨基酸序列;
401.或者
402.d)vh结构域,其包含seq id no:74的氨基酸序列;
403.以及vl结构域,其包含seq id no:75的氨基酸序列;
404.或者
405.e)vh结构域,其包含seq id no:90的氨基酸序列;
406.以及vl结构域,其包含seq id no:93的氨基酸序列;
407.或者
408.f)vh结构域,其包含seq id no:91的氨基酸序列;
409.以及vl结构域,其包含seq id no:93的氨基酸序列;
410.或者
411.g)vh结构域,其包含seq id no:92的氨基酸序列;
412.以及vl结构域,其包含seq id no:93的氨基酸序列;
413.或者
414.h)vh结构域,其包含seq id no:90的氨基酸序列;
415.以及vl结构域,其包含seq id no:94的氨基酸序列;
416.本发明的一个实施例为一种编码根据前述实施例中任一项的(单特异性或双特异性)抗体的分离的核酸。
417.本发明的一个实施例为一种包含此类核酸的宿主细胞。
418.本发明的一个实施例为一种产生抗体的方法,其包含培养该宿主细胞以产生该抗体。
419.在本发明的一个实施例中,此类方法进一步包含从该宿主细胞回收抗体的步骤。
420.本发明的一个实施例为一种药物制剂,其包含如本文所述的双特异性抗体及药学上可接受的载体。
421.本发明的一个实施例为如本文所述的双特异性抗体,其用作药物。
422.本发明的一个实施例为如本文所述的双特异性抗体在制造药物中的用途。
423.在一个实施例中,此类药物用于治疗癌症。
424.在一个实施例中,此类药物用于治疗炎性疾病或自身免疫病。
425.本发明的一个实施例为用于治疗癌症的如本文所述的双特异性抗体。
426.本发明的一个实施例为用于治疗炎性疾病或自身免疫病的如本文所述的双特异性抗体。
427.本发明的一个实施例为一种治疗罹患癌症的个体的方法,其包含向该个体施用有效量的本文所述的抗体。
428.本发明的一个实施例为一种治疗患有炎性疾病或自身免疫病的个体的方法,其包含向该个体施用有效量的本文所述的抗体。
附图说明
429.图1:表面等离振子共振传感图显示单特异性抗ccl2抗体(cnto888(=cnto)、1a5、1g9及人源化11k2(=11k2)与重组ccl2和ccl2同源物结合。
430.图2a:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体cnto888-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体cnto888-sg105(fc受体结合沉默igg1)。
431.图2b:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体11k2-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体11k2-sg105(fc受体结合沉默igg1)。
432.图2c:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体abn912-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体abn912-sg105(fc受体结合沉默igg1)。
433.图2d:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1a4-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1a4-sg105(fc受体结合沉默igg1)。
434.图2e:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1a5-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1a5-sg105(fc受体结合沉默igg1)。
435.图2f:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1g9-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体1g9-sg105(fc受体结合沉默igg1)。
436.图2g:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实
线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体2f6-sg1(野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg单特异性抗ccl2抗体2f6-sg105(fc受体结合沉默igg1)。
437.图3:显示在i.v.注射下列之后,血清总小鼠ccl2浓度(图3a)和抗体-时间曲线(图3b)的时间过程,a)实线:20mg/kg单特异性抗ccl2抗体11k2-sg1(野生型igg1),及b)虚线:20mg/kg单特异性抗ccl2抗体11k2-sg105(fc受体结合沉默igg1)。
438.图4a:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体11k2//1g9-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体11k2//1g9-pglala(fc受体结合沉默igg1)。
439.图4b:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体cnto888//11k2-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体cnto888//11k2-pglala(fc受体结合沉默igg1)。
440.图4c:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体cnto888//1g9-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体11k2//1g9-pglala(fc受体结合沉默igg1)。
441.图4d:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体cnto888//1a5-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体cnto888//1a5-pglala(fc受体结合沉默igg1)。
442.图4e:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a5//1g9-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a5//1g9-pglala(fc受体结合沉默igg1)。
443.图4f:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体11k2//2f6-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体11k2//2f6-pglala(fc受体结合沉默igg1)。
444.图4g:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体abn912//11k2-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体abn912//11k2-pglala(fc受体结合沉默igg1)。
445.图4h:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a4//2f6-wt igg1(与完整fc受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a4//2f6-pglala(fc受体结合沉默igg1)。
446.图4i:i.v.注射预先形成的免疫复合物后一段时间内hccl2的血清浓度,包括a)实线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a5//2f6-wt igg1(与完整fc
受体结合的野生型igg1),或b)虚线:0.1mg/kg人ccl2(hccl2)和20mg/kg双特异性抗ccl2抗体1a5//2f6-pglala(fc受体结合沉默igg1)。
447.图5a:传感器图显示了四种经修饰的11k2和四种cnto888变体在ph7.4(黑线)及ph5.8(灰线)时与单体ccl2的结合曲线,及16种双特异性抗ccl2抗体cklo01至cklo16产生四种经修饰的11k2和四种cnto888变体各自结合抗原结合部分的结果。
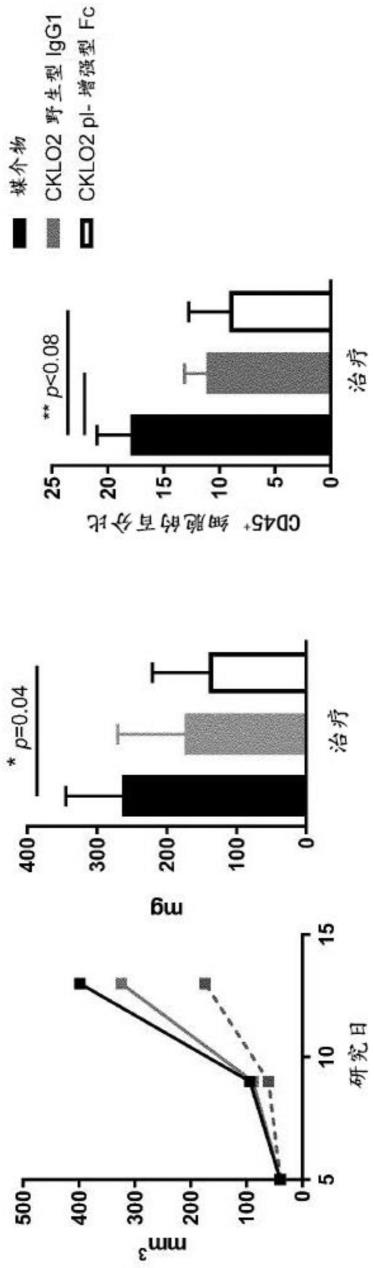
448.图5b:传感图显示了四种经修饰的11k2和四种cnto888变体的单体ccl2的结合曲线,及16种双特异性抗ccl2抗体cklo01至cklo16产生四种经修饰的11k2和四种cnto888变体各自结合抗原结合部分的结果。在ph 7.4的解离阶段后,立即将ph5.8的另一个解离阶段整合到分析中。
449.图6:传感图显示双特异性抗ccl2抗体cklo01、cklo02、cklo03和cklo04与单体ccl8在ph7.4(黑线)和ph5.8(灰线)的结合曲线。
450.图7a:将由hccl2和双特异性抗ccl2抗体(亲本cnto//11k2和ph依赖性变体cklo01、cklo02、cklo03和cklo04)所组成的预先形成的免疫复合物注射至scid小鼠后一段时间的hccl2血清浓度。
451.图7b:将由hccl2和cklo03(带有igg1野生型fc)或cklo03-sg1099(带有增强的i fc的cklo03)所组成的预先形成的免疫复合物注射至scid小鼠后一段期间的hccl2血清浓度。
452.图8:趋化性测定:具有相同cdr和可变区vh/vl的双特异性抗ccl2抗体,即cklo2-igg1野生型和cklo2-sg1095,但具有不同的fc部分,可以相同效力(ic
50
=0.2μg/ml;图8,左图)抑制thp-1细胞迁移。
453.同样地,ccl2-0048(cklo2的亲本未修饰双特异性抗体cnto888/11k2k2 igg1)为非ph依赖性,其也显示ic
50
为0.2μg/ml,因为ph依赖性对抗原清除至关重要,这种现象在该测定中不会发生。
454.对应的单特异性抗体cnto888 igg1和人源化11k2 igg1显示ic
50
值分别为0.3和0.7μg/ml,而huigg1同种型对照则显示无抑制作用(图8,右图)。
455.图9:基因修饰的小鼠模型中的体内抗肿瘤活性。以mab cklo2-igg1(fc野生型igg1)和cklo2-sg1099((=cklo2 pi增强)处理小鼠肿瘤模型。在研究结束时,肿瘤体积(左)、肿瘤重量(中)和m-mdsc浸润(右)。(黑色柱的媒介物、灰色柱的cklo2野生型igg1和白色柱/虚线的cklo2pi-增强fc(cklo2-sg1099))
456.图10:在体内抗肿瘤活性研究期间,(参见图9中的功效)在以双特异性抗ccl2抗体(黑色柱的媒介物,灰色柱的cklo2野生型igg1及白色柱/虚线的pi-增强的fc(cklo2-sg1099))治疗下,血清总(左)和游离的(右)ccl2水平。
457.图11:食蟹猕猴中ccl2清除效率的概念研究的证明。食蟹猕猴血清中总抗体浓度-时间曲线;左图:呈现了7天中四种抗体的平均浓度-时间曲线;第1组:单特异性cnto888
–
sg1(=igg1野生型)抗ccl2抗体(n=3只动物)作为最大总ccl2积累的对照;第2组:具有ph依赖性靶标结合但无fc修饰的双互补位(biparatopic)抗ccl2抗体cklo2-sg1(igg1野生型)(n=3);第3组:具有ph依赖性靶标结合和fc-pi并进一步修饰的双互补位抗ccl2抗体cklo2-sg1100(n=4);以及第4组:具有ph依赖性靶标结合、fc-pi和fcγriib亲和力增强并进一步修饰的双互补位抗ccl2抗体cklo2-sg1095(n=4);右图:呈现了在pk研究期间(70
天)个体4(第2组)的个体浓度-时间曲线。
458.图12:食蟹猕猴中ccl2清除效率的概念研究的证明。食蟹猕猴血清中总ccl2浓度-时间曲线;左图:呈现了7天中四种抗体的平均总ccl2浓度-时间曲线;右图:呈现了在pk研究期间(70天)个体4(第2组)的个体总ccl2浓度-时间曲线。
459.图13:食蟹猕猴血清中游离ccl2浓度-时间曲线;左图:呈现了7天中四种抗体的平均游离ccl2浓度-时间曲线;右图:呈现了在pk研究期间(70天)个体4(第2组)的个体游离ccl2浓度-时间曲线;对于低于检测限制的样品,使用0.01ng/ml(定量下限)的值计算平均曲线。
460.图14:食蟹猕猴中ccl2清除效率的pk/pd研究。食蟹猕猴血清中总ckl02-sg1095浓度-时间曲线(不同浓度的ckl02-sg1095处理(第1-3组));左图:呈现了7天中三种剂量水平的平均浓度-时间曲线(n=4);右图:呈现了在研究期间(98天)两只ada阴性个体动物(25mg/kg剂量组)的个体浓度-时间曲线。
461.图15:食蟹猕猴中ccl2清除效率的pk/pd研究。在不同浓度的ckl02-sg1095处理下(第1-3组)并且与以cnto888-sg1处理(第4组)相比,食蟹猕猴血清中总ccl2浓度-时间曲线;左图:呈现了7天中四个研究组的平均总ccl2浓度-时间曲线(误差线表示sd);右图:呈现了在pk研究期间(98天)第3组(n=2,误差线表示范围)和第4组(n=3,误差线表示sd)的ada阴性动物的个别总ccl2浓度-时间曲线。
462.图16:食蟹猕猴中ccl2清除效率的pk/pd研究。食蟹猕猴血清中游离ccl2浓度-时间曲线;左图:呈现了7天中四个研究组的平均游离ccl2浓度-时间曲线(误差线表示sd)(以不同浓度的ckl02-sg1095处理(第1-3组)以及与cnto888-sg1处理(第4组)比较);右图:呈现了在pk研究期间(70天)来自第3组(n=2,误差线表示范围)和第4组(n=3,误差线表示sd)的ada阴性动物的平均游离ccl2浓度-时间曲线;对于低于检测限制的样品,使用0.01ng/ml(定量下限)的值计算平均曲线。
具体实施方式
463.本发明涉及与人ccl2上两个不同表位结合的双特异性抗ccl2抗体,其药物组合物,其制备,及用作治疗癌症、炎性疾病、自身免疫病及眼科疾病的药物的用途。因此,抗体包含与人cc2上的第一表位(特异性地)结合的第一抗原结合位点及与不同的第二表位(特异性地)结合的第二不同抗原结合位点。
464.本发明包括双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
465.其中,
466.i)所述第一抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
467.vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
468.以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
469.ii)所述第二抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
470.vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
471.以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列。
472.在一个实施例中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预先形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g(kabat eu编号)的人igg1同种型(或其fc结构域)的fcγ受体沉默恒定重链结构域的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型(或其fc结构域)的恒定重链结构域的双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少15倍,特别地高至少20倍。
473.术语“表位”包括能够特异性结合抗体的任何多肽决定簇。在某些实施例中,表位决定簇包括分子的化学活性表面基团,例如氨基酸、糖侧链、磷酰基或磺酰基,且在某些实施例中,可具有特定的三维结构特征和/或特定的电荷特征。表位是被抗体结合的抗原区域。本发明涉及与人ccl2上的两个不同表位结合的双特异性抗ccl2抗体。术语第一和第二表位涉及人ccl2上的两个不同表位。因此,第二表位不同于第一表位,通过使用本领域已知的常规方法,可容易地确定抗体是否与参考抗ccl2抗原结合位点结合相同的表位,或与之竞争结合。例如,为了确定测试抗体是否结合在作为本发明参考抗ccl2抗原结合位点的相同表位,允许参考抗体在饱和条件下结合至ccl2域。其次,评估测试抗体结合人ccl2的能力。若在与参考抗ccl2抗原结合位点饱和结合后,测试抗体能够与人ccl2结合,则可以得出结论为测试抗体结合至与参考抗ccl2抗原结合位点不同的表位。另一方面,若在与参考抗ccl2抗原结合位点饱和结合后,测试抗体不能与人ccl2结合,则该测试抗体可结合至与本发明参考抗ccl2抗体所结合的表位相同的表位。然后可进行额外的常规实验(例如,肽突变和结合分析)以确认所观察到的测试抗体结合的欠缺实际上是由于与参考抗体结合相同表位或是空间阻断(或其他现象)是造成观察不到的结合的原因。可使用elisa、ria、表面等离振子共振(surface plasmon resonance)(例如biacore)、流式细胞仪或本领域可用的任何其他定量或定性抗体结合测定法进行此分类。根据本发明的某些实施例,通过竞争性结合检定测量,若一个抗体以1倍、5倍、10倍、20倍或100倍的过量来抑制另一抗体的结合至少50%、至少75%、至少90%或甚至99%,则认为两个抗体结合至相同(或重叠)表位(参见例如junghans等人,cancer res.1990:50:1495-1502)。
474.或者,若实质上抗原中所有减少或消除一种抗体结合的氨基酸突变减少或消除了另一种抗体的结合,则认为两个抗体与相同表位结合。若仅减少或消除一个抗体结合的氨基酸突变子集合而减少或消除另一抗体的结合,则认为两种抗体具有“重叠表位(overlapping epitope)”。
475.为了确定抗体是否与参考抗ccl2抗体竞争结合,上述结合方法以两个方向进行:在第一方向上,使参考抗体在饱和条件下结合ccl2,然后评估测试抗体与人ccl2的结合。在第二方向上,使测试抗体在饱和条件下结合ccl2分子,然后评估参考抗体与人ccl2的结合。
若在这方向中,只有第一种(饱和)抗体能够与ccl2分子结合,则可断定该测试抗体和参考抗体竞争结合ccl2。如本领域中具有普通技术人员将理解的,与参考抗体竞争结合的抗体可能未必结合至与参考抗体相同的表位,而是可能通过结合重叠或相邻的表位而在空间上阻断参考抗体的结合。
476.当在本文中使用时,术语“ccl2”、“人ccl2”(也称为“mcp-1”)意指ncbi记录登录号np_002973中引用的76个氨基酸序列,并分别称为ccl2,mcp-1(单核细胞趋化性蛋白1)、smc-cf(平滑肌细胞趋化因子)、ldcf(淋巴细胞衍生的趋化因子)、gdcf(神经胶质瘤衍生的单核细胞趋化因子)、tdcf(肿瘤衍生的趋化因子)、hcl1(人类细胞因子11)、mcaf(单核细胞趋化因子和活化因子)。基因符号为scya2,人类17号染色体上的je基因,新的名称为ccl2(zlotnik,yoshie 2000.immunity 12:121-127)。je是人类mcp-1/ccl2的小鼠同源物。
477.亨德尔(handel)等人(biochemistry.1996;35:6569
–
6584)确定ccl2二聚体的溶液结构。这些研究指出ccl2的二级结构由四个β-折叠组成。此外,zhang和rollins(mol cell biol.1995;15:4851
–
4855)描述负责ccl2二聚化界面的残基。蛋白质复合物似乎很细长,并且两个单体的取向使得它们形成一个大袋。也确定了两种晶体形式的单体和二聚体ccl2的结构,即所谓的i和p形式(lubkowski等人,nat struct biol.1997;4:64
–
69)。(paolini等人j immunol.1994sep 15;153(6):2704-17)描述了以在生理相关浓度,mcp1/ccl2以单体存在:通过分析纪录ccl2蛋白(购自peprotech)通过粒径筛析hplc、沉降平衡超速离心和化学交联的功能,它们可能显示mcp-1单体和二聚体形式的重量分数取决于体外浓度。最后,seo与其同事(j am chem soc.2013mar 20;135(11):4325-32)可能显示离子迁移质谱法,在生理条件下以单体和二聚体形式存在注射的ccl2。
478.因此,“野生型ccl-2”(wt ccl2)可作为单体存在,但实际上也可在生理浓度下形成二聚体。此单体-二聚体的平衡当然是不同的,在所有可能使用不同浓度的体外实验中,都必须谨慎考虑。为了避免任何不确定性,我们生成了点突变ccl2变体:ccl2的“p8a”变体在二聚化界面中携带突变,造成无法形成导致定义的纯ccl2单体的二聚体。相反地,ccl2的“t10c”变体导致ccl2的固定二聚体(j am chem soc.2013mar 20;135(11):4325-32)。
479.ccl2/ccr2轴是募集未成熟髓样细胞进入肿瘤的主要介质。ccl2被恶性细胞超表达,并与细胞外基质(ecm)结合,建立了趋化梯度。一旦它们到达肿瘤,髓源性抑制细胞(myeloid-derived suppressive cell,mdsc)通过分泌/上调抗炎细胞因子/受体而反过来抑制抗肿瘤t细胞反应的启动,从而促成原致肿瘤环境。以此方式,mdsc可降低或甚至削弱任何t细胞活化疗法的功效(meyer等人,2014)。因此,这些未成熟髓样细胞募集的特异性抑制将提高检查点抑制剂、t细胞双特异性和癌症免疫疗法的功效。此外,ccl2也与促进血管生成、转移和肿瘤生长有关,有建议指出中和ccl2可能有助于多种抗肿瘤干预措施。
480.与其受体相反,靶向ccl2将特异性抑制不期望的ccl2介导的作用,从而避免那些可能通过相同受体(ccr2)但不同配体(例如ccl7、ccl8、ccl13)发出的信号,这些信号参与其他免疫细胞群,例如th1和nk细胞的募集。
481.在临床上,在一些针对中和由不同炎性疾病(例如类风湿性关节炎(haringman等人,2006)、特发性肺纤维化(raghu等人,2015)、糖尿病肾病(menne等人,2016)和癌症(sandhu等人,2013))引起的升高的水平的研究中,ccl2是优选的抗体靶标。然而,其高合成速率与观察到的高体内抗体-抗原解离常数(kd)已被证明是阻碍习知抗体以临床可行剂量
抑制游离ccl2的主要障碍(fetterly等人,2013)。
482.ccl2中和似乎与血清ccl2水平升高的患者更明显相关,这已在多种类型的癌症中观察到,例如乳腺癌(bc)、卵巢癌(ovca)、结直肠癌(crc)、胰腺癌和前列腺癌。然而,即使在这些适应症范围内的患者未表现出这种血清学但其肿瘤被髓系免疫细胞高度浸润,由于如上所述ccl2在肿瘤环境中起到的多种作用,患者可能从此新颖的治疗方法中获益。
483.如本文所使用,抗体“与人ccl2结合”、“与人ccl2特异性地结合”、“与人ccl2结合”或“抗ccl2抗体”涉及以kd值为5.0x10-8
mol/l或更低的结合亲和力与人ccl2抗原特异性地结合的抗体,在一个实施例中,kd值为1.0x10-9
mol/l或更低,在一个实施例中,kd值为5.0x10-8
mol/l至1.0x10-13
mol/l。
484.结合亲和力以标准结合测定法确定,例如表面等离振子共振技术(ge-healthcare uppsala,sweden),例如使用包含ccl2细胞外结构域的构建体(例如其天然存在的3维结构)。在一个实施例中,使用例示性可溶性ccl2,以标准结合测定法确定结合亲和力。
485.抗体特异性涉及针对抗原的特定表位的抗体选择性识别。例如,天然抗体是单特异性的。
486.如本文所使用,术语“单特异性”抗体表示具有一个或多个结合位点的抗体,每个结合位点结合相同抗原的相同表位。
487.如本文所使用,术语“与(人)ccl2结合的双互补位抗体”、“与(人)ccl2结合的双特异性抗体”、“双互补位抗ccl2抗体”、“双特异性抗ccl2抗体”意指该抗体能够与(人)ccl2上的至少两个不同表位特异性地结合。一般而言,此类双特异性抗体包含两个不同的抗原结合位点(两个不同的互补位(paratope)),每个都对(人)ccl2的不同表位具有特异性。在某些实施例中,双特异性抗体能够结合ccl2上的两个不同且不重叠的表位,这意指两个不同的抗原结合位点不竞争结合ccl2。
[0488]“受体人框架(acceptor human framework)”作为本文中的目的是如下述定义的衍生自人类免疫球蛋白框架或人类共有框架、包含轻链可变结构域(vl)框架或重链可变结构域(vh)框架的氨基酸序列的框架。“衍生自(derived from)”人类免疫球蛋白框架或人类共有框架的受体人框架可包含与其相同的氨基酸序列,或其可含有氨基酸序列的变化。在一些实施例中,氨基酸变化数量为10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少、或2个或更少。在一些实施例中,vl受体人框架与vl人类免疫球蛋白框架序列或人类共有框架序列的序列相同。
[0489]
本文的术语“抗体”以最广义使用且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)及抗体片段,只要其展示出预期抗原结合活性即可。
[0490]“抗体片段”是指除完整抗体以外的分子,其包含结合完整抗体所结合抗原的完整抗体的一部分。抗体片段的实例包括但不限于fv、fab、fab’、fab
’‑
sh、f(ab’)2;双体抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。
[0491]
如本文所使用,术语“价(valent)”表示抗体中存在指定数量的抗原结合位点。因此,术语“单价结合抗原(monovalent binding to an antigen)”表示抗体中存在对抗原具有特异性的一个(且不超过一个)抗原结合位点。
[0492]
术语“抗原结合位点”涉及提供与抗原相互作用的抗体的位点或区域,即一个或多个氨基酸残基。例如,抗体的抗原结合位点包含来自互补决定区(cdr)的氨基酸残基。在一个实施例中,抗体的抗原结合位点包含来自vh和vl的氨基酸残基。天然免疫球蛋白分子通常具有两个抗原结合位点,fab分子通常具有单个抗原结合位点。“抗原结合部分”涉及包含与抗原决定簇特异性地结合的抗原结合位点的多肽分子。抗原结合部分包括如本文进一步定义的抗体及其片段。特定抗原结合部分包括抗体的抗原结合结构域,其包含抗体重链可变区和抗体轻链可变区。在某些实施例中,抗原结合部分可包括如本文进一步定义及本技术中已知的抗体恒定区。有用的重链恒定区包括五种同种型中的任何一种:α、δ、ε、γ或μ。有用的轻链恒定区包括两种同种型中的任何一种:κ和λ。
[0493]
如本文所使用,术语“抗原决定簇”或“抗原”涉及多肽大分子上与抗原结合部分/位点结合而形成抗原结合部分-抗原复合物的位点。例如,有用的抗原决定簇可存在于肿瘤细胞的表面上、受病毒感染的细胞的表面上、其他患病细胞的表面上、免疫细胞的表面上,不存在于血清中,且/或存在于细胞外基质(ecm)中。
[0494]
术语“嵌合”抗体涉及其中重链和/或轻链的一部分源自特定来源或物种,而重链和/或轻链的其余部分源自不同来源或物种的抗体。
[0495]
抗体的“类别”是指其重链所具有的恒定区或恒定区的类型。有五大类抗体:iga、igd、ige、igg、及igm,且其中的几种可进一步分为亚类(同种型(isotype)),例如igg1、igg2、igg3、igg4、iga1、及iga2。对应于不同类别的免疫球蛋白的重链恒定区分别称为α、δ、ε、γ和μ。优选地,本发明的双特异性抗体为人igg同种型,更优选地是人igg1同种型。如本文所使用的术语igg同种型和igg1同种型涉及人igg同种型和人igg1同种型。一般而言,基于igg亚类之间的等位基因变异,不同的igg同种型以略为不同的同种异型形式存在(参见vidarsson等人;front immunol 5(2014)article 520,1-17)。“有效量”的试剂,例如药物制剂,其涉及在所需剂量和时间段内有效达到所需治疗或预防效果的量。
[0496]
术语“fc结构域”或“fc区”在本文中用于定义包含至少一部分恒定区的免疫球蛋白重链的c-末端区。该术语包括天然序列fc区和变体fc区。尽管igg重链的fc区的边界可能略有变化,但通常将人igg重链的fc区定义为从cys226或pro230延伸至该重链的羧基端。但是,由宿主细胞产生的抗体可能经历重链c末端的一种或多种、特别是一种或两种氨基酸的翻译后切割。因此,由宿主细胞通过表达编码全长重链的特定核酸分子而产生的抗体可包括全长重链,或者可包括全长重链的切割变体(在本文中也称为“切割变体重链”)。重链的最后两个c-末端氨基酸为甘氨酸(g446)和赖氨酸(k447,根据kabat eu指数编号)。因此,可以存在或可以不存在fc区的c-末端赖氨酸(lys447)或c-末端甘氨酸(gly446)和赖氨酸(k447)。除非另有说明,否则包括fc结构域(或本文定义的fc结构域的亚基)的重链的氨基酸序列在本文中表示不含c-末端甘氨酸-赖氨酸二肽。在本发明的一个实施例中,根据本发明的抗体或双特异性抗体所含的重链(包含本文所指定的fc结构域的亚基)包含额外的c末端甘氨酸-赖氨酸二肽(g446和k447,根据kabat eu指数编号)。在本发明的一个实施例中,根据本发明的抗体或双特异性抗体所含的重链(包含本文所指定的fc结构域的亚基)包含额外的c末端甘氨酸残基(g446,根据kabat eu指数编号)。本发明的组合物,例如本文所述的药物组合物,其包含本发明的抗体或双特异性抗体的群体。该抗体或双特异性抗体的群体可包含具有全长重链的分子及具有切割变体重链的分子。该抗体或双特异性抗体的群体
可由具有全长重链的分子及具有切割变体重链的分子的混合物组成,其中,抗体或双特异性抗原结合分子的至少50%、至少60%、至少70%、至少80%或至少90%具有切割变体重链。在本发明之一个实施例中,包含本发明的抗体或双特异性抗体的群体的组合物包含含有重链的抗体或双特异性抗体,该重链包括本文指定的fc结构域的亚基及额外的c末端甘氨酸-赖氨酸二肽(g446和k447,根据kabat eu指数编号)。在本发明的一个实施例中,包含本发明的抗体或双特异性抗体的群体的组合物包含含有重链的抗体或双特异性抗体的群体,该重链包括本文指定的fc结构域的亚基及额外的c末端甘氨酸残基(g446,根据kabat eu指数编号)。在本发明的一个实施例中,这种组合物包含抗体或双特异性抗体的群体,该抗体或双特异性抗体的群体由以下分子组成:包含包括本文所指定的fc结构域的亚基的重链之分子;包含包括本文所指定的fc结构域的亚基及额外的c末端甘氨酸残基(g446,根据kabat eu指数编号)的重链的分子;以及包含包括本文所指定的fc结构域的亚基及额外的c末端甘氨酸-赖氨酸二肽(g446和k447,根据kabat eu指数编号)的重链的分子。除非本文另有说明,否则fc区或恒定区中氨基酸残基的编号“根据eu编号系统”进行,也称为“根据kabat的eu指数编号”或“kabat eu编号”,如kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md,1991中所述(另见上文)。如本文所用的fc结构域的“亚基”是指形成二聚fc结构域的两种多肽之一,即包含能够稳定地自我结合的免疫球蛋白重链的c-末端恒定区的多肽。例如,igg fc结构域的亚基包含igg ch2和igg ch3恒定结构域。
[0497]“框架(framework)”或“fr”是指除高变区(hypervariable region)(hvr)残基之外的可变结构域残基。可变结构域的fr通常由四个fr域组成:fr1、fr2、fr3和fr4。因此,hvr和fr序列通常以如下顺序出现在vh(或vl)中:fr-h1(l1)-cdr-h1(l1)-fr-h2(l2)-cdr-h2(l2)-fr-h3(l3)-cdr-h3(l3)-fr-h4(l4)。
[0498]
术语“全长抗体”、“完整抗体”及“全抗体”在本文中可互换使用,是指具有与天然抗体结构基本类似的结构或具有包含本文所定义的fc区域的重链的抗体。
[0499]“人抗体(human antibody)”为具有氨基酸序列的抗体,该氨基酸序列对应于由人或人细胞产生或自利用人抗体库(antibody repertoire)或其他人抗体编码序列的非人来源衍生的抗体的氨基酸序列。人抗体的该定义特定地排除包含非人抗原结合残基的人源化抗体。
[0500]“人类共有框架”是代表一系列人类免疫球蛋白vl或vh框架序列中最常见的氨基酸残基的框架。通常,系列人类免疫球蛋白vl或vh序列来源于可变结构域序列的亚组。一般而言,序列的亚组是如kabat,e.a.等人,sequences of proteins of immunological interest,第5版,bethesda md(1991),nih publication 91-3242,vols.1-3.中的亚组。在一个实施例中,对于vl,亚组是如kabat等人在上述文献中所述的亚组κi。在一个实施方案中,对于vh,亚组是如kabat等人在上述文献中所述的亚组iii。
[0501]“人源化(humanized)”抗体是指包含来自非人hvr的氨基酸残基及来自人fr的氨基酸残基的嵌合抗体。在某些实施例中,人源化抗体将包含基本上所有至少一个,且通常是两个可变结构域,其中,所有或基本上所有的cdr对应于非人抗体的那些,且所有或基本上所有的fr对应对于人抗体的那些。人源化抗体可选地可包含衍生自人抗体的抗体恒定区的至少一部分。抗体(例如非人抗体)的“人源化形式(humanized form)”是指已经历人源化的
抗体。
[0502]
如本文所使用,术语“互补决定区”或“cdr”涉及抗体可变结构域的每个区域,该区域在序列中是个可高变的和/或形成结构上定义的环(“高变环”)和/或包含抗原接触残基(“抗原接触处”)。一般而言,抗体包含六个hvr;三个在vh中(cdr-h1、cdr-h2、cdr-h3),及三个在vl中(cdr-l1、cdr-l2、cdr-l3)。在本文中,例示性cdr包括:
[0503]
(a)高变环存在于氨基酸残基26-32(cdr-l1)、50-52(cdr-l2)、91-96(cdr-l3)、26-32(cdr-h1)、53-55(cdr-h2)和96-101(cdr-h3)处(chothia and lesk,j.mol.biol.196:901-917(1987));
[0504]
(b)cdr存在于氨基酸残基24-34(cdr-l1)、50-56(cdr-l2)、89-97(cdr-l3)、31-35b(cdr-h1)、50-65(cdr-h2)和95-102(cdr-h3)处(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991));
[0505]
(c)抗原接触存在于氨基酸残基27c-36(cdr-l1)、46-55(cdr-l2)、89-96(cdr-l3)、30-35b(cdr-h1)、47-58(cdr-h2)和93-101(cdr-h3)处(maccallum等人,j.mol.biol.262:732-745(1996));以及
[0506]
(d)(a)、(b)和/或(c)的组合,包括cdr氨基酸残基24-34(cdr-l1)、50-56(cdr-l2)、89-97(vl3)、31-35(cdr-h1)、50-63(cdr-h2)和95-102(cdr-h3)。
[0507]
除非另有说明,否则可变结构域中的cdr残基和其他残基(例如fr残基)根据kabat等人,kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991)进行编号。
[0508]“个体”或“受试者”为哺乳动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、狗和马)、灵长类动物(例如人类及非人类灵长类动物诸如猴)、兔以及啮齿类动物(例如小鼠及大鼠)。在某些实施例,个体或受试者为人类。
[0509]“分离的”抗体是从其自然环境的组分中分离出来的抗体。在一些实施例中,将抗体纯化至大于95%或99%的纯度,通过(例如)电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或色谱(例如,离子交换或反相hplc)来测定。关于评估抗体纯度的方法的综述,参见例如flatman,s.等人,j.chromatogr.b 848(2007)79-87。
[0510]“分离的”核酸是指已经从其天然环境的组分中分离的核酸分子。分离的核酸包括通常包含核酸分子的细胞中所含的核酸分子,但是该核酸分子存在于染色体外或与天然染色体位置不同的染色体位置。
[0511]“编码一种或多种双特异性抗ccl2抗体的分离的核酸”涉及编码抗体重链和轻链(或其片段)的一种或多种核酸分子,包括在单个载体或分离载体中的此类核酸分子,且此类核酸分子存在于宿主细胞中的一个或多个位置。
[0512]
如本文所使用,术语“单克隆抗体”是指获自基本上同质的抗体群体的抗体,即群体中包含的受试者抗体系相同的且/或结合相同表位,但不包括,例如,含有天然生成的突变或产生于单克隆抗体制剂生产过程中的可能的变体抗体,这种变体通常是以少量存在。与通常包括针对不同决定簇(抗原决定基)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每个单克隆抗体是针对于抗原上的单一决定簇。因此,修饰词“单克隆”表示抗体的特征是从基本上同质的抗体群体中获得的,且不应解释为需要通过任何特定的方法产生抗
体。例如,根据本发明使用的单克隆抗体可通过多种技术来制造,包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法、及利用包含全部或部分人免疫球蛋白基因座的转基因动物的方法,本文描述这些方法及用于制备单克隆抗体的其他例示性方法。
[0513]“天然抗体”涉及具有不同结构的天然生成的免疫球蛋白分子。例如,天然igg抗体为大约150,000道尔顿的、由两条相同的轻链及两条相同的重链经二硫键键合所构成的异四聚体糖蛋白。从n末端至c末端,每条重链具有可变区(vh),也称为可变重链结构域或重链可变结构域,接着是三个恒定结构域(ch1、ch2和ch3)。类似地,从n末端至c末端,每条轻链具有可变区(vl),也称为可变轻链域或轻链可变结构域,接着是轻链恒定(cl)结构域。基于其恒定区的氨基酸序列,抗体的轻链可分为两种类型,称为卡帕(κ)和拉姆达(λ)。
[0514]
术语“包装插页”用于指通常包含在治疗性产品的商业包装中的说明书,该说明书包含有关使用此种治疗性产品的适应症、用法、剂量、给药途径、联合治疗、禁忌症和/或警告等信息。
[0515]
相对于参考多肽序列所述的“百分比(%)氨基酸残基同一性”,是指候选序列中氨基酸残基与参与多肽序列中的相同的氨基酸残基的百分比,在比对序列并引入差异后(如果必要),可实现最大的序列同一性百分比,并且不考虑将任何保守取代作为序列同一性的一部分。为确定氨基酸百分比序列同一性的目的而进行的比对可通过本领域中技术范围内的各种方式实现,例如,使用可公开获得的计算机软件诸如blast、blast-2、align或megalign(dnastar)软件。本领域的技术人员可确定用于比对序列的合适参数,包括在所比较的序列全长上实现最大比对所需的任何算法。然而,出于本文的目的,使用序列比较计算机程序align-2产生%氨基酸序列同一性值。align-2序列比较计算机程序由基因泰克公司编写,源代码已与用户文件一起存盘于美国版权局,华盛顿特区,20559,并以美国版权注册号txu510087进行注册。align-2程序可从加利福尼亚南旧金山的基因泰克公司公众可取得,也可以从源代码进行编译。align-2程序应编译在unix操作系统(包括数位unix v4.0d)上使用。所有序列比较参数均由align-2程序设置,并且不会改变。
[0516]
在使用align-2进行氨基酸序列比较的情况下,给定氨基酸序列a对于或相对于给定氨基酸序列b的%氨基酸序列同一性(其可选的表述为给定氨基酸序列a,其对于或相对于给定氨基酸序列b具有或包含一定%氨基酸序列同一性)计算如下:
[0517]
100乘以分数x/y
[0518]
其中,x为序列比对程序align-2在a与b程序比对中评分为同一匹配的氨基酸残基数,y是b中氨基酸残基的总数。应当理解的是,在氨基酸序列a的长度不等于氨基酸序列b的长度的情况下,a与b的%氨基酸序列同一性将不等于b与a的%氨基酸序列同一性。除非另有特别说明,否则如前一段所述,使用align-2计算机程序获得本文使用的所有%氨基酸序列同一性值。
[0519]
术语“药物制剂”是指一种制剂,其形式为允许其中所含的活性成分的生物活性有效,并且不包含对调配物将施用的受试者具有不可接受的毒性的其他组分。
[0520]“药学上可接受的载体”是指药物制剂中除对受试者无毒的活性成分以外的成分。药学上可接受的载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
[0521]
如本文中所使用的“治疗(treatment)”(及其语法变体,诸如“治疗(treat)”或“治疗(treating)”),是指试图改变受治疗受试者的疾病自然病程的临床干预,并且可进行预
或“daf”,其包含与ccl2以及另一种不同抗原或ccl2的两个不同抗原决定基结合的抗原结合位点(参见例如us 2008/0069820和wo 2015/095539)。
[0531]
多特异性抗体也可提供为不对称形式,其包含在一个或多个具有相同抗原特异性的结合臂中交叉的结构域,即通过交换vh/vl结构域(参见例如wo 2009/080252和wo 2015/150447)、ch1/cl域(参见例如wo 2009/080253)或完整的fab臂(参见例如wo 2009/080251、wo 2016/016299,另见schaefer等人,pnas,108(2011)1187-1191,及klein等人,mabs 8(2016)1010-20),也称为crossmabs。也可通过将带电荷或不带电荷的氨基酸突变引入域界面引导正确fab配对,从而工程化不对称的fab臂。参见例如wo 2016/172485.
[0532]
用于多特异性抗体的各种其他分子形式为本技术领域已知的并且包括在本文中(参见例如spiess等人,mol immunol 67(2015)95-106)。
[0533]
优选的双特异性抗体形式。
[0534]
根据本发明特定实施例,本文所述的双特异性抗体包含在一个或多个具有相同抗原特异性的结合臂中交叉的结构域,即通过交换vh/vl结构域(参见例如wo 2009/080252和wo 2015/150447)、ch1/cl域(参见例如wo 2009/080253)或完整的fab臂(参见例如wo 2009/080251、wo 2016/016299,另见schaefer等人,pnas,108(2011)1187-1191,和klein at al.,mabs 8(2016)1010-20)。
[0535]
此类双特异性抗体中的电荷修饰,尤其是那些具有vh/vl结构域交换的双特异性抗体(参见wo 2015/150447):本发明的双特异性抗体可在其中,所包含的fab分子中包含氨基酸取代,其特别有效地减少轻链与非匹配重链的错配(bence-jones型副产物),该错配可能发生在基于fab的双/多特异性抗原结合分子的制备中,其中,在其结合臂的一个(或多个,如果分子包含两个以上的抗原结合fab分子)中发生vh/vl交换(另见pct公开号wo 2015/150447,特别是其中,的实施例,其通过引用将其全部内容并入本文)。所需的双特异性抗体与不期望的副产物的比率,特别是在其结合臂之一中具有vh/vl结构域交换的双特异性抗体中发生的bence jones型副产物,可通过在ch1和cl域中的特定氨基酸位置引入带有相反电荷之带电荷氨基酸来改善(有时在本文中称为“电荷修饰”)。
[0536]
因此,在一些实施例中,其中,双特异性抗体的第一及第二抗原结合部分均为fab分子,且在抗原结合部分之一(特别是第二抗原结合部分)中,fab轻链及fab重链的可变结构域vl和vh彼此相互取代,
[0537]
i)在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被带正电荷的氨基酸(根据kabat编号)取代,且其中,在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸或位置213的氨基酸被带负电荷的氨基酸(根据kabat eu指数编号)取代;或
[0538]
ii)在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被带正电荷的氨基酸(根据kabat编号)取代,且其中,在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸或位置213的氨基酸被带负电荷的氨基酸(根据kabat eu指数编号)取代。
[0539]
双特异性抗体不包含在i)和ii)情况下所述的修饰。具有vh/vl交换的抗原结合部分的恒定结构域cl和ch1未被彼此取换(即保留未交换状态)。
[0540]
在一个更具体的实施例中,
[0541]
i)在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第一抗原结合部分的恒定结构域ch1
中,位置147的氨基酸或位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代;或
[0542]
ii)在第二抗原结合部分之恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸或位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0543]
在一个这样的实施例中,在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸或位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0544]
在另一个实施例中,在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0545]
在一个特定实施例中,在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,且位置123的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代,且位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0546]
在一个更特定的实施例中,在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)(根据kabat编号)取代,且位置123的氨基酸被赖氨酸(k)(根据kabat编号)取代,并且在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代,且位置213的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代。
[0547]
在一个甚至更特定的实施例中,在第一抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)(根据kabat编号)取代,且位置123的氨基酸被精氨酸(r)(根据kabat编号)取代,并且在第一抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代,且位置213的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代。
[0548]
在特定实施例中,如果根据上述实施例的氨基酸取代发生在第一抗原结合部分的恒定结构域cl及恒定结构域ch1中,则第一抗原结合部分的恒定结构域cl为κ同种型。
[0549]
可替代地,根据上述实施例的氨基酸取代可发生在第二抗原结合部分的恒定结构域cl及恒定结构域ch1中,而不是第一抗原结合部分的恒定结构域cl及恒定结构域ch1中。特别是,这种实施例,第二抗原结合部分的恒定结构域cl为κ同种型。
[0550]
因此,在一个实施例中,在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸或位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0551]
在另一个实施例中,在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0552]
在另一个实施例中,在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,且位置123的氨基酸被赖氨酸(k)、精氨酸(r)或组氨酸(h)(根据kabat编号)独立取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代,且位置213的氨基酸被谷氨酸(e)或天冬氨酸(d)(根据kabat eu指数编号)独立取代。
[0553]
在一个实施例中,在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)(根据kabat编号)取代,且位置123的氨基酸被赖氨酸(k)(根据kabat编号)取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代,且位置213的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代。
[0554]
在另一个实施例中,在第二抗原结合部分的恒定结构域cl中,位置124的氨基酸被赖氨酸(k)(根据kabat编号)取代,且位置123的氨基酸被精氨酸(r)(根据kabat编号)取代,并且在第二抗原结合部分的恒定结构域ch1中,位置147的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代,且位置213的氨基酸被谷氨酸(e)(根据kabat eu指数编号)取代。
[0555]
为了改善这些不对称(异二聚体)蛋白质的fc结构域的异源二聚化作用,在根据本发明这些方面的一实施例中,在fc结构域的第一亚基中,位置366的苏氨酸残基被色氨酸残基取代(t366w),并且在fc结构域的第二亚基中,位置407的酪氨酸残基被缬氨酸残基取代(y407v),并且可选地,位置366的苏氨酸残基被丝氨酸残基取代(t366s),并且位置368的亮氨酸残基被丙氨酸残基取代(l368a)(根据kabat eu指数编号)。
[0556]
在根据本发明这些方面的另一实施例中,在fc结构域的第一亚基中,位置354的丝氨酸残基又被半胱氨酸残基取代(s354c)或位置356的谷氨酸残基被半胱氨酸残基取代(e356c)(特别是位置354的丝氨酸残基被半胱氨酸残基取代),并且在fc结构域的第二亚基中,位置349的酪氨酸残基又被半胱氨酸残基取代(y349c)(根据kabat eu指数编号)。
[0557]
可替代的异源二聚化技术在以下的“fc结构域”的情况下描述,且也被认为是本发明的其他实施例。
[0558]
在根据本发明这些方面的另一实施例中,fc结构域为人igg
1 fc结构域。
[0559]
fc结构域及修饰
[0560]
在特定实施例中,本发明的双特异性抗体包含由第一亚基及第二亚基所构成的fc结构域。应当理解,本文所述相对于双特异性抗体的fc结构域的特征同样适用于本发明的抗体中所构成的fc结构域。
[0561]
双特异性抗体的fc结构域由包含免疫球蛋白分子的重链结构域的一对多肽链组成。例如,免疫球蛋白g(igg)分子的fc结构域为二聚体,其每个亚基包含ch2和ch3 igg重链恒定结构域。fc结构域的两个亚单位能够彼此稳定结合。在一个实施例中,本发明的双特异性抗体包含不超过一个fc结构域。
[0562]
在一个实施例中,双特异性抗体的fc结构域为igg fc结构域。在一个特定实施例
中,fc结构域为igg
1 fc结构域。在另一个实施例中,fc结构域为igg
4 fc结构域。在更具体的实施例中,fc结构域为igg
4 fc结构域,其包含在位置s228(根据kabat eu索引编号)的氨基酸取代,特别是氨基酸取代s228p。这种氨基酸取代减少体内igg4抗体的fab臂交换(参见stubenrauch等人,drug metabolism and disposition 38,84-91(2010))。在另一个特定实施例中,fc结构域为人fc结构域。在一个甚至更特定的实施例中,fc结构域为人igg
1 fc结构域。
[0563]
igg同种型的fc结构域的特征在于具有各种特性,例如基于它们与fcγ受体或新生儿fc受体(fcrn)的相互作用(参见,例如见于vidarsson等人;front immunol 5(2014)article 520,1-17)。
[0564]
促进异源二聚化的fc结构域修饰
[0565]
根据本发明的双特异性抗体包含不同的抗原结合部分,其可与fc结构域的两个亚基中的一个或另一个融合,因此fc结构域的两个亚基通常包含在两个不同的多肽链中。这些多肽的重组共表达和随后的二聚化导致两种多肽具有几种可能组合。为改善重组生产中双特异性抗体的产率和纯度,在双特异性抗体的fc结构域中引入促进所需的多肽缔合的修饰将为有利的。
[0566]
因此,在特定实施例中,根据本发明的双特异性抗体的fc结构域包含促进fc结构域的第一及第二亚基的缔合的修饰。人igg fc结构域的两个亚基之间最广泛的蛋白质-蛋白质相互作用位点在fc结构域的ch3结构域中。因此,在一个实施方案中,所述修饰在fc结构域的ch3结构域中。
[0567]
存在多种对fc结构域的ch3结构域进行修饰以便增强异源二聚化的方法,这些方法很好地描述于例如wo 96/27011、wo 98/050431、ep 1870459、wo 2007/110205、wo 2007/147901、wo 2009/089004、wo 2010/129304、wo 2011/90754、wo 2011/143545、wo 2012058768、wo 2013157954、wo 2013096291中。通常,在所有这些方法中,fc结构域的第一个单元的ch3结构域及fc结构域的第二亚基的ch3结构域均以互补的方式进行工程化,以使每个ch3结构域(或包含ch3结构域的重链)不再能够与自身发生同源二聚化,而是被迫与互补工程化的其他ch3结构域进行异源二聚化(使得第一ch3结构域及第二ch3结构域异源二聚化,并且在两个第一ch3结构域或两个第二ch3结构域之间不形成同源二聚体)。这些用于改善重链异源二聚化的不同方法被视为与双特异性抗体中重链-轻链修饰结合的不同选择(例如,一个结合臂中的vh和vl交换/置换,以及在ch1/cl界面中引入带有相反电荷的氨基酸的取代),其减少了重链/轻链错配及bence jones型副产物。
[0568]
在一个具体实施例中,所述促进fc结构域的第一亚基及第二亚基的缔合的修饰为所谓的“突出物入孔”修饰,其包括在fc结构域的两个亚基中的一个的“突出物”修饰及fc结构域的两个亚基中的另一个的“孔”修饰。
[0569]“突出物入孔”技术描述于例如:us 5,731,168;us 7,695,936;ridgway等人,prot eng 9,617-621(1996);以及carter,j immunol meth248,7-15(2001)。通常,该方法包括在第一多肽的界面上引入一个突起(“突出物”),并且在第二多肽的界面中引入一个对应的空腔(“孔”),以使该突起可定位于空腔中,从而促进异二聚体的形成并阻碍同源二聚体的形成。通过用较大侧链(例如酪氨酸或色氨酸)替换第一多肽界面上的较小的氨基酸侧链来构建突起。通过将较大氨基酸侧链替换为较小的氨基酸侧链(例如丙氨酸或苏氨酸),在第二
多肽的界面中形成与突起具有相同或相近大小的互补空腔。
[0570]
因此,在特定实施例中,在双特异性抗体的fc结构域的第一亚基的ch3结构域中,氨基酸残基被具有较大侧链体积的氨基酸残基取代,从而在第一亚基的ch3结构域内产生突起,该突起可定位在第二亚基的ch3结构域内的空腔中,并且在fc结构域的第二亚基的ch3结构域中,氨基酸残基被具有较小侧链体积的氨基酸残基取代,从而在第二亚基的ch3结构域内产生空腔,第二亚基的ch3结构域内的突起为可定位在该空腔内。
[0571]
优选地,所述具有较大侧链体积的氨基酸残基选自由以下各项所组成的群组:精氨酸(r)、苯丙氨酸(f)、酪氨酸(y)和色氨酸(w)。
[0572]
优选地,所述具有较小侧链体积的氨基酸残基选自由以下各项所组成的群组:丙氨酸(a)、丝氨酸(s)、苏氨酸(t)和缬氨酸(v)。
[0573]
可通过改变编码多肽的核酸(例如通过针对特定位点的诱变或通过肽合成)来制备突起和空腔。
[0574]
在一个具体实施例中,在fc结构域的第一亚基(“突出物”亚基)的(ch3结构域)中,位置366的苏氨酸残基被色氨酸残基取代(t366w),并且在fc结构域的第二亚基(“孔”亚基)的(ch3结构域)中,位置407的酪氨酸残基被缬氨酸残基取代(y407v)。在一个实施例中,在fc结构域的第二亚基中,位置366的苏氨酸残基又被丝氨酸残基取代(t366s),并且位置368的亮氨酸残基被丙氨酸残基取代(l368a)(根据kabat eu指数编号)。
[0575]
在又一个实施例中,在fc结构域的第一亚基中,位置354的丝氨酸残基又被半胱氨酸残基取代(s354c)或位置356的谷氨酸残基被半胱氨酸残基取代(e356c)(特别是位置354的丝氨酸残基被半胱氨酸残基取代),并且在fc结构域的第二亚基中,位置349的酪氨酸残基又被半胱氨酸残基取代(y349c)(根据kabat eu指数编号)。引入这两个半胱氨酸残基导致在fc结构域之两个亚基之间形成二硫键,从而进一步稳定二聚体(carter,j immunol methods 248,7-15(2001))。
[0576]
在一个特定实施例中,fc结构域的第一亚基包含氨基酸取代s354c和t366w,并且fc结构域的第二亚基包含氨基酸取代y349c、t366s、l368a和y407v(根据kabat eu指数编号)。
[0577]
在特定实施例中,与第二抗原结合的抗原结合部分与fc结构域的第一亚基(包含“突出物(knob)”修饰)融合(可选地,通过与ccl2和/或肽连接符结合者)。不希望被理论束缚,与第二抗原(例如活化t细胞抗原)结合的抗原结合部分与fc结构域之含突出物状物亚基的融合将(进一步)最最小化包含两个与活化t细胞抗原结合的抗原结合部分的生成(两个含突出物的多肽的空间碰撞)。
[0578]
可以设想将用于强制异源二聚化的ch3修饰的其他技术作为本发明的替代方案,并且这些技术描述于例如wo 96/27011、wo 98/050431、ep 1870459、wo 2007/110205、wo 2007/147901、wo 2009/089004、wo 2010/129304、wo 2011/90754、wo 2011/143545、wo 2012/058768、wo 2013/157954、wo 2013/096291中。
[0579]
在一个实施例中,可替换使用ep 1870459中所述的异源二聚化方法。该方法基于在fc结构域的两个亚基之间的ch3/ch3结构域界面的特定氨基酸位置引入带有相反电荷的氨基酸。本发明的双特异性抗体的一个优选实施例为(fc结构域的)两个ch3结构域的一个中的氨基酸突变r409d和k370e;以及fc结构域的两个ch3结构域的另一个中的氨基酸突变
d399k和e357k(根据kabat eu指数编号)。
[0580]
在另一个实施例中,本发明的双特异性抗体包含fc结构域之第一亚基的ch3结构域中的氨基酸突变t366w和fc结构域的第二亚基的ch3结构域中的氨基酸突变t366s、l368a、y407v,以及fc结构域的第一亚基的ch3结构域中的氨基酸突变r409d、k370e和fc结构域的第二亚基的ch3结构域中的氨基酸突变d399k、e357k(根据kabat eu指数编号)。
[0581]
在另一个实施例中,本发明的双特异性抗体包含fc结构域的第一亚基的ch3结构域中的氨基酸突变s354c、t366w和fc结构域的第二亚基的ch3结构域中的氨基酸突变y349c、t366s、l368a、y407v,或者所述双特异性抗体包含fc结构域的第一亚基的ch3结构域中的氨基酸突变y349c、t366w和fc结构域的第二亚基的ch3结构域中的氨基酸突变s354c、t366s、l368a、y407v,以及fc结构域的第一亚基的ch3结构域中的氨基酸突变r409d、k370e和fc结构域的第二亚基的ch3结构域中的氨基酸突变d399k、e357k(全部根据kabat eu指数编号)。
[0582]
在一个实施例中,可替换使用wo 2013/157953中所述的异源二聚化方法。在一个实施例中,第一ch3结构域包含氨基酸突变t366k,并且第二ch3结构域包含氨基酸突变l351d(根据kabat eu指数编号)。在另一个实施例中,第一ch3结构域进一步包含氨基酸突变l351k。在另一个实施例中,第二ch3结构域进一步包含选自y349e、y349d和l368e(优选的是l368e)(根据kabat eu指数编号)的氨基酸突变。
[0583]
在一个实施例中,可替换使用wo 2012/058768中所述的异源二聚化方法。在一个实施例中,第一ch3结构域包含氨基酸突变l351y、y407a,并且第二ch3结构域包含氨基酸突变t366a、k409f。在另一个实施例中,第二ch3结构域进一步包含位置t411、d399、s400、f405、n390或k392的氨基酸突变,所述位置选自例如:a)t411n、t411r、t411q、t411k、t411d、t411e或t411w;b)d399r、d399w、d399y或d399k;c)s400e、s400d、s400r或s400k;d)f405i、f405m、f405t、f405s、f405v或f405w;e)n390r、n390k或n390d;f)k392v、k392m、k392r、k392l、k392f或k392e(根据kabat eu指数编号)。在另一个实施例中,第一ch3结构域包含氨基酸突变l351y、y407a,并且第二ch3结构域包含氨基酸突变t366v、k409f。在另一个实施例中,第一ch3结构域包含氨基酸突变y407a,并且第二ch3结构域包含氨基酸突变t366a、k409f。在另一个实施例中,第二ch3结构域进一步包含氨基酸突变k392e、t411e、d399r和s400r(根据kabat eu指数编号)。
[0584]
在一个实施例中,可替换使用wo 2011/143545中所述的异源二聚化方法,例如,在选自由368和409(根据kabat eu指数编号)所组成的群组的位置处进行氨基酸修饰。
[0585]
在一个实施例中,可替换使用wo 2011/090762中所述的异源二聚化方法,该方法同样使用上述的“突出物入孔”技术。在一个实施例中,第一ch3结构域包含氨基酸突变t366w,并且第二ch3结构域包含氨基酸突变y407a。在一个实施例中,第一ch3结构域包含氨基酸突变t366y,并且第二ch3结构域包含氨基酸突变y407t(根据kabat eu指数编号)。
[0586]
在一个实施例中,双特异性抗体或其fc结构域属于igg2亚类,并且可替代地使用wo 2010/129304中所述的异源二聚化方法。
[0587]
在一个替代实施例中,促进fc结构域的第一亚基及第二亚基的缔合的修饰包括介导静电转向作用的修饰,例如pct公开wo 2009/089004中所述。通常,此方法涉及用带电荷的氨基酸残基取代两个fc结构域亚基界面上的一个或多个氨基酸残基,从而使同源二聚体
形成在静电上不利,但异源二聚化在静电上有利。在一个这样的实施例中,第一ch3结构域包含带负电荷的氨基酸(例如谷氨酸(e)或天冬氨酸(d),优选的是k392d或n392d)对k392和n392的氨基酸取代,并且第二ch3结构域包含带正电荷的氨基酸(例如赖氨酸(k)或精氨酸(r),优选的是d399k、e356k、d356k或e357k且更佳的是d399k和e356k)对d399、e356、d356或e357的氨基酸取代。在另一个实施例中,第一ch3结构域进一步包含带负电荷的氨基酸(例如谷氨酸(e)或天冬氨酸(d),更佳的是k409d或r409d)对k409或r409的氨基酸取代。在另一个实施例中,第一ch3结构域进一步或可替代地包含带负电荷的氨基酸(例如谷氨酸(e)或天冬氨酸(d))对k439和/或k370的氨基酸取代(全部根据kabat eu指数编号)。
[0588]
在又一个实施例中,可替代地使用wo 2007/147901中所述的异源二聚化方法。在一个实施例中,第一ch3结构域包含氨基酸突变k253e、d282k和k322d,并且第二ch3结构域包含氨基酸突变d239k、e240k和k292d(根据kabat eu指数编号)。
[0589]
在另一个实施例中,可替代地使用wo 2007/110205中所述的异源二聚化方法。
[0590]
在一个实施例中,fc结构域的第一亚基包含氨基酸取代k392d和k409d,并且fc结构域的第二亚基包含氨基酸取代d356k和d399k(根据kabat eu指数编号)。
[0591]
如本文所使用,用于双特异性抗ccl2抗体的术语“野生型(wt)igg或igg1”涉及包含igg或igg1恒定重链的双特异性抗体,其可包含上述促进异源二聚化的修饰/突变,但如下所述其不包含增加或减少fc受体结合和/或效应子功能的进一步fc结构域修饰/突变。
[0592]
增加或减少fc受体结合和/或效应子功能的fc结构域修饰/突变
[0593]
通过扫除技术修饰双特异性抗ccl2抗体
[0594]
使用扫除技术修饰双特异性抗ccl2抗体,以使双特异性抗ccl2抗体能够在更长的时间内消除游离的ccl2,从而在体内能够产生持续的生物效应,例如抗癌功效。
[0595]
扫除概念叙述于igawa等人,immunological reviews 270(2016)132
–
151、wo2012/122011、wo2016/098357和wo2013/081143,其等通过引用并入本文。
[0596]
本发明提供促进经抗体介导的抗原摄取进入细胞的方法,其通过将上述抗体在酸性ph范围内的抗原结合活性(结合能力)降低至小于其在中性ph范围内的抗原结合活性;此促进抗原摄取进入细胞。本发明还提供促进经抗体介导的抗原摄取进入细胞的方法,其基于改变上述抗体的抗原结合结构域中的至少一个氨基酸,以促进抗原摄取进入细胞。本发明还提供促进经抗体介导的抗原摄取进入细胞的方法,其基于以组氨酸取代至少一个氨基酸或将至少一个组氨酸插入上述抗体的抗原结合结构域中,以促进抗原摄取进入细胞。
[0597]
此处,经抗体介导的“抗原摄取进入细胞”是指通过胞吞作用将抗原摄入细胞中。同时,本文中,“促进摄取进入细胞”是指血浆中与抗原结合的抗体的细胞内摄取速率增加,和/或摄取的抗原向血浆的再循环量减少。这意味着,与在中性ph范围内增加抗体的人fcrn结合活性之前的抗体相比,或与在酸性ph范围内增加人fcrn结合活性并将抗体的抗原结合活性(结合能力)降低至小于其在中性ph范围内的抗原结合活性之前的抗体相比,摄取进入细胞的速率被促进。与完整的人igg相比,且更优选地与完整的人igg相比,该速率优选地提高。因此,在本发明中,可基于抗原摄取进入细胞的速率增加来评估抗体是否促进抗原摄取进入细胞。抗原摄取进入细胞的速率可例如通过以下方式来计算:在将抗原和抗体添加至培养基后,随时间监测含有人fcrn表达细胞的培养基中抗原浓度的降低,或者随时间监测摄入人fcrn表达细胞中的抗原的含量。使用本发明的方法来促进经抗体介导的抗原摄取进
入细胞的速率,例如,可通过施用抗体来提高从血浆中消除抗原的速率。因此,还可例如通过测试是否经由施用抗体来加速从血浆中去除抗原的速率或者是否降低血浆中的总抗原浓度来评估经抗体介导的抗原摄取进入细胞是否被促进。
[0598]
本文中,“血浆中总抗原浓度”是指抗体结合抗原与抗体未结合抗原浓度的和,或“血浆中游离抗原浓度”,即抗体未结合抗原浓度。测量“血浆中总抗原浓度”或“血浆中游离抗原浓度”的各种方法是本领域众所周知的,如下所述。
[0599]
如本文所使用,“完整人igg”(或“野生型(wt)人igg”)是指未经修饰的人igg(关于上述异源二聚化的潜在修饰除外),并且不限于特定种类的igg。这意味着人igg1、igg2、igg3或igg4可用作“完整人igg”,只要它可在酸性ph范围内结合人fcrn即可。优选地,“完整人igg”可为人igg1。
[0600]
本发明还提供增加单一抗体可结合的抗原数量的方法。更具体地,本发明提供增加单一抗体可结合的抗原数量的方法,在酸性ph范围内具有人fcrn结合活性的该单一抗体可以结合该抗原,该方法通过增加在中性ph范围内的抗体的人fcrn结合活性。本发明还提供增加单一抗体可结合的抗原数量的方法,在酸性ph范围内具有人fcrn结合活性的该单一抗体可以结合该抗原,该方法通过改变抗体的人fcrn结合结构域中的至少一个氨基酸。
[0601]
本发明提供促进经抗体介导的抗原摄取进入细胞的方法。更具体地,本发明提供通过在酸性ph范围内具有人fcrn结合活性的抗体来促进抗原摄取进入细胞的方法,其基于在中性ph范围内增加抗体的人fcrn结合活性。本发明还提供通过在酸性ph范围内具有人fcrn结合活性的抗体来改善抗原摄取进入细胞的方法,其基于改变抗体的人fcrn结合结构域中的至少一个氨基酸。
[0602]
本发明还提供通过在酸性ph范围内具有人fcrn结合活性的抗体来促进抗原摄取进入细胞的方法,其基于使用包含氨基酸序列的人fcrn结合结构域,该氨基酸序列以不同氨基酸取代选自包含亲本igg的fc结构域的人fcrn结合结构域的亲本igg fc结构域中的下列位置的至少一个氨基酸:位置237、238、239、248、250、252、254、255、256、257、258、265、270、286、289、297、298、303、305、307、308、309、311、312、314、315、317、325、332、334、360、376、380、382、384、385、386、387、389、424、428、433、434和436(eu编号)。
[0603]
本发明还提供促进经抗体介导的抗原摄取进入细胞的方法,其通过将上述抗体在酸性ph范围内的抗原结合活性(结合能力)降低至小于其在中性ph范围内的抗原结合活性;此促进抗原摄取进入细胞。本发明还提供促进经抗体介导的抗原摄取进入细胞的方法,其基于改变上述抗体的抗原结合结构域中的至少一个氨基酸,以促进抗原摄取进入细胞。本发明还提供促进经抗体介导的抗原摄取进入细胞的方法,其基于以组氨酸取代至少一个氨基酸或将至少一个组氨酸插入上述抗体的抗原结合结构域中,以促进抗原摄取进入细胞。
[0604]
此处,经抗体介导的“抗原摄取进入细胞”是指通过胞吞作用将抗原摄入细胞中。同时,本文中,“促进摄取进入细胞”是指血浆中与抗原结合的抗体的细胞内摄取速率增加,和/或摄取的抗原向血浆的再循环量减少。这意味着,与在中性ph范围内增加抗体的人fcrn结合活性之前的抗体相比,或与在酸性ph范围内增加人fcrn结合活性并将抗体的抗原结合活性(结合能力)降低至小于其在中性ph范围内的抗原结合活性之前的抗体相比,摄取进入细胞的速率被促进。与完整的人igg相比,且更优选地与完整的人igg相比,该速率优选地提高。因此,在本发明中,可基于抗原摄取进入细胞的速率增加来评估抗体是否促进抗原摄取
进入细胞。抗原摄取进入细胞的速率可例如通过以下方式来计算:在将抗原和抗体添加至培养基后,随时间监测含有人fcrn表达细胞的培养基中抗原浓度的降低,或者随时间监测摄入人fcrn表达细胞中的抗原的含量。使用本发明的方法来促进经抗体介导的抗原摄取进入细胞的速率,例如,可通过施用抗体来提高从血浆中消除抗原的速率。因此,还可例如通过测试是否经由施用抗体来加速从血浆中去除抗原的速率或者是否降低血浆中的总抗原浓度来评估经抗体介导的抗原摄取进入细胞是否被促进。
[0605]
本文中,“血浆中总抗原浓度”是指抗体结合抗原与抗体未结合抗原浓度的和,或“血浆中游离抗原浓度”,即抗体未结合抗原浓度。测量“血浆中总抗原浓度”或“血浆中游离抗原浓度”的各种方法是本领域众所周知的,如下所述。
[0606]
如本文所使用,“完整人igg”(或“野生型igg”)是指未经修饰的人igg(关于上述异源二聚化的潜在修饰除外),并且不限于特定种类的igg。这意味着人igg1、igg2、igg3或igg4可用作“完整人igg”,只要它可在酸性ph范围内结合人fcrn即可。优选地,“完整人igg”可为人igg1。
[0607]
如本文所使用,“亲本igg”是指未经修饰的igg,其随后被修饰以生成变体,只要亲本igg的修饰变体可在酸性ph范围内与人fcrn结合即可(因此,亲本igg酸性条件下不需要与人fcrn有结合活性)。亲本igg可为天然存在的igg,或天然存在的igg的变体或工程化形式。亲本igg可指多肽本身、构成该亲本多肽的组合物或编码该亲本多肽的氨基酸序列。应注意的是,“亲本igg”包括如下所述的已知商业、重组产生的igg。“亲本igg”的来源不受限制,且可得自非人类动物或人类的任何生物。优选地,该生物选自小鼠、大鼠、豚鼠、仓鼠、沙鼠、猫、兔、犬、山羊、绵羊、牛、马、骆驼和非人类灵长类动物。在另一个实施例中,“亲本igg”也可获自食蟹猕猴、绒猴、恒河猴、黑猩猩或人类。优选地,“亲本igg”获自人igg1,但不限于特定类别的igg。这意味着人igg1、igg2、igg3或igg4可适合用作“亲本igg”。在类似的方式中,来自上文中任何生物的igg的任何类别或亚类都可优选地用作“亲本igg”。天然存在的igg的变体或工程化形式的实例描述于curr opin biotechnol.2009dec;20(6):685-91,curr opin immunol.2008aug;20(4):460-70,protein eng des sel.2010apr;23(4):195-202、wo 2009/086320、wo 2008/092117、wo 2007/041635和wo 2006/105338,但不限于此。
[0608]
本发明还提供通过施用抗体来增加消除血浆抗原的能力的方法。在本发明中,“增加消除血浆抗原的能力的方法”与“提高抗体自血浆中消除抗原的能力的方法”同义。更具体地,本发明提供通过在酸性ph范围内具有人fcrn结合活性的抗体来增加消除血浆抗原的能力的方法,其通过在中性ph范围内增加抗体的人fcrn结合活性。本发明还提供通过在酸性ph范围内具有人fcrn结合活性的抗体来增加消除血浆抗原的能力的方法,其基于改变抗体的人fcrn结合结构域中的至少一个氨基酸。
[0609]
本发明还提供通过在酸性ph范围内具有人fcrn结合活性的抗体来增加消除血浆抗原的能力的方法,其通过使用包含至少一个氨基酸取代的氨基酸序列的人fcrn结合结构域,该至少一个氨基酸选自包含具有不同氨基酸的亲本igg的fc结构域的人fcrn结合结构域的亲本igg fc结构域中的下列位置:位置237、238、239、248、250、252、254、255、256、257、258、265、270、286、289、297、298、303、305、307、308、309、311、312、314、315、317、325、332、334、360、376、380、382、384、385、386、387、389、424、428、433、434和436(eu编号)。
[0610]
本发明还提供通过抗体增加消除血浆抗原的能力的方法,其通过降低上述抗体在
酸性ph范围内的抗原结合活性,该抗体与在中性ph范围内的抗原结合活性相比,具有改善的消除血浆抗原的能力。本发明还提供通过抗体增加消除血浆抗原的能力的方法,其通过改变上述具有改善的消除血浆抗原的能力的抗体的抗原结合结构域中的至少一个氨基酸。本发明还提供通过施用抗体来增加消除血浆抗原的能力的方法,其通过组氨酸取代至少一个氨基酸或将至少一个组氨酸插入上述具有改善的消除血浆抗原的能力的抗体的抗原结合结构域中。
[0611]
在本文中,“消除血浆抗原的能力”是指当体内施用或分泌抗体时,从血浆中消除抗原的能力。因此,“增加抗体消除血浆抗原的能力”在本文中是指与在中性ph范围内增加抗体的人fcrn结合活性之前,或在增加人fcrn结合活性并同时将其抗原结合活性在酸性ph范围内降低到小于中性ph范围之前,施用抗体后加速从血浆中消除抗原的速度。可以例如通过在体内施用可溶性抗原和抗体,并在施用后测量血浆中可溶性抗原的浓度来评估抗体从血浆中消除抗原的活性的增加。当通过在中性ph范围内增加抗体的人fcrn结合活性,或通过增加其人fcrn结合活性并同时降低其抗原浓度来降低施用可溶性抗原和抗体后血浆中的可溶性抗原浓度时,在酸性ph范围内的结合活性低于中性ph范围内的结合活性,可以判断抗体消除血浆抗原的能力增强。可溶性抗原的形式可为抗体结合抗原或抗体未结合抗原,其浓度可分别确定为“血浆中抗体结合抗原浓度”和“血浆中抗体未结合抗原浓度”(后者与“血浆中游离抗原浓度”同义)。由于“血浆中总抗原浓度”是指抗体结合抗原与抗体未结合抗原浓度的和,或“血浆中游离抗原浓度”,即抗体未结合抗原浓度,因此可将可溶性抗原的浓度确定为“血浆中总抗原浓度”。如下所述,用于测量“血浆中总抗原浓度”或“血浆中游离抗原浓度”的各种方法是本领域众所周知的。
[0612]
本发明还提供改善抗体药物代谢动力学的方法。更具体地,本发明提供改善在酸性ph范围内具有人fcrn结合活性的抗体的药物代谢动力学的方法,其通过在中性ph范围内增加抗体的人fcrn结合活性。此外,本发明提供通过改变抗体的人fcrn结合结构域中的至少一个氨基酸来改善在酸性ph范围内具有人fcrn结合活性的抗体的药物代谢动力学的方法。
[0613]
本发明还提供改善在酸性ph范围内具有人fcrn结合活性的抗体的药代药物代谢动力学的方法,其通过使用包含氨基酸序列的人fcrn结合结构域,该氨基酸序列以不同氨基酸取代选自包含igg的fc结构域的人fcrn结合结构域的亲本igg fc结构域中的下列位置的至少一个氨基酸:237、238、239、248、250、252、254、255、256、257、258、265、270、286、289、297、298、303、305、307、308、309、311、312、314、315、317、325、332、334、360、376、380、382、384、385、386、387、389、424、428、433、434和436位(eu编号)。
[0614]
未结合抗体的游离抗原的血浆浓度或游离抗原浓度与总浓度的比率可通过本领域技术人员已知的方法来确定,例如,通过pharm res.2006jan;23(1):95-103中所述的方法。或者,当抗原在体内呈现特定功能时,可通过测试抗原功能是否被中和来评估抗原是否与中和抗原功能(拮抗分子)的抗体结合。可通过测定反映抗原功能的体内标记来评估抗原功能是否被中和。可通过测定反映抗原功能的体内标记来评估抗原是否与活化抗原功能(对抗分子)的抗体结合。
[0615]
游离抗原的血浆浓度以及血浆中游离抗原的量与血浆中总抗原的量的比率的测定、体内标记测定及此类测量并没有特别限制;然而,测定优选地在施用抗体后经过一定时
间后进行。在本发明中,施用抗体后的一段时间并没有特别限制,本领域技术人员可根据所施用的抗体的特性等来确定合适的时间。此类时间包括例如施用抗体后的一天、施用抗体后的三天、施用抗体后的七天、施用抗体后的14天和施用抗体后的28天。在本文中,“血浆抗原浓度”是指抗体结合抗原与抗体未结合抗原浓度的和的“血浆中总抗原浓度”或“血浆中游离抗原浓度”,即抗体未结合抗原浓度。
[0616]
在与施用包含完整的人igg fc结构域作为人fcrn结合结构域的参考抗体相比,或与不施用本发明的抗原结合结构域分子时相比,通过施用2倍、5倍、10倍、20倍、50倍、100倍、200倍、500倍、1000倍、甚至更高倍数的本发明的抗体,可以降低血浆中的总抗原浓度。
[0617]
在另一方面,本发明提供呈现ph依赖性结合特征的双特异性抗ccl2抗体。如本文所使用,表述“ph依赖性结合”是指抗体呈现“与其在中性ph下的结合相比,在酸性ph下与ccl2的结合减少”(出于本公开的目的,两种表述可互换使用)。例如,“具有ph依赖性结合特征”的抗体包括在中性ph下比在酸性ph下以更高亲和力与ccl2结合的抗体。在某些实施例中,本发明的双特异性抗体在中性ph下以比在酸性ph下高至少2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更高倍数的亲和力与ccl2结合。在一些实施例中,抗体在ph 7.4下以比在ph 5.8下更高的亲和力与ccl2结合。在其他实施例中,该抗体在ph7.4下以比在ph5.8下高至少2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更高倍数的亲和力与ccl2结合。
[0618]
当抗原为可溶性蛋白时,抗体与抗原的结合可导致抗原在血浆中的半衰期延长(即,降低了抗原从血浆中的清除率),因为抗体在血浆中的半衰期可能比抗原本身更长,并且可作为抗原的载体。这是由于通过fcrn通过细胞胞内体途径的抗原-抗体复合物的再循环(roopenian,nat.rev.immunol.7(9):715-725(2007))。然而,由于抗体在中性细胞外环境中与其抗原结合,同时在进入细胞后将其释放到酸性内体区室,具有ph依赖性结合特征的抗体相对于以ph非依赖性方式结合的其对应物,在抗原中和以及清除方面具有优异的特征(igawa等人,nature biotechnol.28(11):1203-1207(2010);devanaboyina等人,mabs 5(6):851-859(2013);wo 2009/125825)。
[0619]
为了本公开的目的,抗体对ccl2的“亲和力”以抗体的kd表示。抗体的kd涉及抗体-抗原相互作用的平衡解离常数。抗体与其抗原结合的kd值越大,对特定抗原的结合亲和力越弱。因此,如本文所使用,表述“在中性ph下比在酸性ph下更高的亲和力”(或等效的表述“ph依赖性结合”)是指在酸性ph下与ccl2结合的抗体的kd大于在中性ph下与ccl2结合的抗体的kd。例如,在本发明的上下文中,若在酸性ph下与ccl2结合的抗体的kd比在中性ph下与ccl2结合的抗体的kd大至少2倍,则认为抗体在中性ph下比在酸性ph下对于结合ccl2具有更高的亲和力。因此,本发明包括在酸性ph下与ccl2结合的抗体,其kd比在中性ph下与ccl2结合的抗体的kd大至少2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更多倍。在另一个实施例中,抗体在中性ph下的kd值可为10-7m、10-8m、10-9m、10-10m、10-11m、10-12m或更小。在另一个实施例中,抗体在酸性ph下的kd值可为10-9m、10-8m、10-7m、10-6m或更大。
[0620]
在其他实施例中,若在ph5.8下与ccl2结合的抗体的kd比在ph7.4下与ccl2结合的抗体的kd大至少2倍,则认为抗体在中性ph下比在酸性ph下具有更高的亲和力。在一些实施例中,所提供的在ph5.8下与ccl2结合的抗体的kd比在ph7.4下与ccl2结合的抗体的kd大至少3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍,75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更多倍。在另一个实施例中,抗体在ph7.4下的kd值可为10-7m、10-8m、10-9m、10-10m、10-11m、10-12m或更小。在另一个实施例中,抗体在ph5.8下的kd值可为10-9m、10-8m、10-7m、10-6m或更大。
[0621]
抗体对特定抗原的结合特性也可用抗体的kd表示。抗体的kd涉及抗体相对于特定抗原的解离速率常数,并以秒之倒数(即sec-1)表示。kd值增加表示抗体与其抗原的结合较弱。因此,本发明包括在酸性ph下以比在中性ph下更高的kd值与ccl2结合的抗体。本发明包括在酸性ph下与ccl2结合的抗体,其kd比在中性ph下与ccl2结合的抗体的kd大至少2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更多倍。在另一个实施例中,抗体在中性ph下的kd值可为10-2
×
1/s、10-3
×
1/s、10-4
×
1/s、10-5
×
1/s、10-6
×
1/s或更小。在另一个实施例中,抗体在酸性ph下的kd值可为10-3 1/s、10-2 1/s、10-1 1/s或更大。本发明还包括在ph5.8下比在ph7.4下具有更高kd值的与ccl2结合的抗体。本发明包括在ph5.8下与ccl2结合的抗体,其kd比在ph7.4下与ccl2结合的抗体的kd大至少3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍,75倍、80倍、85倍、90倍、95倍、100倍、200倍、400倍、1000倍、10000倍或更多倍。在另一个实施例中,抗体的kd值在ph7.4下可为10-2 1/s、10-3 1/s、10-4 1/s、10-5 1/s、10-6 1/s或更小。在另一个实施例中,抗体的kd值在ph5.8下可为10-3 1/s、10-2 1/s、10-1 1/s或更大。
[0622]
在某些情况下,“与中性ph下的结合相比,在酸性ph下与ccl2的结合减少”表示为在酸性ph下与ccl2结合的抗体的kd值与在中性ph下与ccl2结合的抗体的kd值的比(反之亦然)。例如,出于本发明的目的,若抗体呈现2或更大的酸性/中性kd比,则该抗体可被认为“与其在中性ph下的结合相比,在酸性ph下与ccl2的结合减少”。在某些实施例中,本发明的抗ccl2抗体的ph5.8/ph7.4 kd比为2或更大。在某些例示性实施例中,本发明的抗体的酸性/中性kd比可为2、3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、400、1000、10000或更大。在另一个实施例中,抗体在中性ph下的kd值可为10-7m、10-8m、10-9m、10-10m、10-11m、10-12m或更小。在另一个实施例中,抗体在酸性ph下的kd值可为10-9m、10-8m、10-7m、10-6m或更大。在另外的情况下,若抗体呈现2或更大的ph5.8/ph7.4kd比,则该抗体可被认为“与其在中性ph下的结合相比,在酸性ph下与ccl2的结合减少”。在某些例示性实施例中,抗体的ph5.8/ph7.4 kd比可为3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、400、1000、10000或更大。在另一个实施例中,抗体在ph7.4下的kd值可为10-7m、10-8m、10-9m、10-10m、10-11m、10-12m或更小。在另一个实施例中,抗体在ph5.8下的kd值可为10-9m、10-8m、10-7m、10-6m或更大。
[0623]
在某些情况下,“与中性ph下的结合相比,在酸性ph下与ccl2的结合减少”表示为在酸性ph下与ccl2结合的抗体的kd值与在中性ph下与ccl2结合的抗体的kd值的比(反之亦然)。例如,出于本发明的目的,若抗体呈现2或更大的酸性/中性kd比,则该抗体可被认为“与其在中性ph下的结合相比,在酸性ph下与ccl2的结合减少”。在某些例示性实施例中,本
发明的抗体的ph5.8/ph7.4 kd比为2或更大。在某些例示性实施例中,本发明的抗体的酸性/中性kd比可为2、3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、400、1000、10000或更大。在另一个实施例中,抗体在中性ph下的kd值可为10-2
×
1/s、10-3
×
1/s、10-4
×
1/s、10-5
×
1/s、10-6
×
1/s或更小。在另一个实施例中,抗体在酸性ph下的kd值可为10-3 1/s、10-2 1/s、10-1 1/s或更大。在某些例示性实施例中,本发明的抗体的ph5.8/ph7.4 kd比可为2、3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、400、1000、10000或更大。在另一个实施例中,抗体的kd值在ph7.4下可为10-2 1/s、10-3 1/s、10-4 1/s、10-5 1/s、10-6 1/s或更小。在另一个实施例中,抗体的kd值在ph5.8下可为10-3 1/s、10-2 1/s、10-1 1/s或更大。
[0624]
如本文所使用,表述“酸性ph”是指4.0至6.5的ph。表述“酸性ph”包括4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4和6.5中任一ph值。在特定方面,“酸性ph”为5.8。
[0625]
如本文所使用,表述“中性ph”是指6.7至约10.0的ph。表述“中性ph”包括6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9和10.0中的任一ph值。在特定方面,“中性ph”为7.4。
[0626]
如本文所表述的,kd值和kd值可使用基于表面等离振子共振生物传感器来确定以表征抗体-抗原相互作用。kd值和kd值可在25摄氏度或37摄氏度下确定。
[0627]
在另一方面,本发明提供双特异性抗ccl2抗体,其与ccl2形成免疫复合物(即抗原-抗体复合物)。在某些实施例中,两种或多种双特异性抗ccl2抗体结合两个或多种ccl2分子以形成免疫复合物。这是可能的,因为ccl2以含有两个ccl2分子的同源二聚体而存在,而抗体具有两个抗原结合位点。
[0628]
一般而言,当两种或更多种抗体与两种或更多种抗原形成免疫复合物时,由于通过复合物中抗体的fc区的亲和力作用,所得的免疫复合物可与存在于细胞表面的fc受体强结合,然后可高效地被摄入细胞中。因此,上述能够形成包含两种或多种抗ccl2抗体和两种或多种ccl2分子的免疫复合物的抗ccl2抗体可由于亲和力作用而与fc受体强结合,从而导致ccl2从体内血浆中快速清除。
[0629]
此外,相对于以ph非依赖性方式结合的对应物,具有ph依赖性结合特征的抗体被认为在抗原中和以及清除方面具有优异的特征(igawa等人,nature biotech.28(11):1203-1207(2010);devanaboyina等人,mabs5(6):851-859(2013);wo 2009/125825)。因此,具有上述两种特征的抗体,即具有ph依赖性结合特征并形成包含两种或多种具有两种或多种抗原的抗体的免疫复合物的抗体,预期具有更优异的特征以从血浆中高速消除抗原(wo 2013/081143)。
[0630]
一方面,本发明提供包含具有增强的fcγriib结合活性的变体fc区的多肽,其包含至少两个氨基酸改变,包含:(a)236位的一个氨基酸改变,和(b)在选自由以下各项所组成的群组的至少一个位置处的至少一个氨基酸改变:231、232、233、234、235、237、238、239、264、266、267、268、271、295、298、325、326、327、328、330、331、332、334和396,根据eu编号。
[0631]
一方面,本发明提供包含具有增强的fcγriib结合活性的变体fc区的多肽,其包含在根据eu编号的236位的氨基酸改变。
[0632]
一方面,本发明提供包含具有增强的fcγriib结合活性的变体fc区的多肽,其包含至少两个氨基酸改变,包含:(a)236位的一个氨基酸改变,和(b)在选自由以下各项所组成的群组的至少一个位置处的至少一个氨基酸改变:231、232、235、239、268、295、298、326、330和396,根据eu编号。在另一个实施例中,变体fc区包含在选自由以下各项所组成的群组的至少一个位置处的氨基酸改变:231、232、235、239、268、295、298、326、330和396,根据eu编号。在另一个实施例中,变体fc区包含在选自由以下各项所组成的群组的至少一个位置处的氨基酸改变:268、295、326和330,根据eu编号。
[0633]
在另一方面,本发明提供包含具有增强的fcγriib结合活性的变体fc区的多肽,其包含下列(1)-(37)中任一个氨基酸改变:(1)位置231、236、239、268和330;(2)位置231、236、239、268、295和330;(3)位置231、236、268和330;(4)位置231、236、268、295和330;(5)位置232、236、239、268、295和330;(6)位置232、236、268、295和330;(7)位置232、236、268和330;(8)位置235、236、268、295、326和330;(9)位置235、236、268、295和330;(10)位置235、236、268和330;(11)位置235、236、268、330和396;(12)位置235、236、268和396;(13)位置236、239、268、295、298和330;(14)位置236、239、268、295、326和330;(15)位置236、239、268、295和330;(16)位置236、239、268、298和330;(17)位置236、239、268、326和330;(18)位置236、239、268和330;(19)位置236、239、268、330和396;(20)位置236、239、268和396;(21)位置236和268;(22)位置236、268和295;(23)位置236、268、295、298和330;(24)位置236、268、295、326和330;(25)位置236、268、295、326、330和396;(26)位置236、268、295和330;(27)位置236、268、295、330和396;(28)位置236、268、298和330;(29)位置236、268、298和396;(30)位置236、268、326和330;(31)位置236、268、326、330和396;(32)位置236、268和330;(33)位置236、268、330和396;(34)位置236、268和396;(35)位置236和295;(36)位置236、330和396;以及(37)位置236和396,根据eu编号。
[0634]
在另一个实施例中,具有增强的fcγriib结合活性的变体fc区包含选自由以下各项所组成的群组的至少一个氨基酸:(a)在231位的asp、glu、phe、gly、his、ile、lys、leu、met、asn、pro、gln、arg、ser、thr、val、trp、tyr;(b)在232位的ala、asp、glu、phe、gly、his、ile、lys、leu、met、asn、gln、arg、ser、thr、val、trp、tyr;(c)在233位的asp;(d)在234位的trp、tyr;(e)在235位的trp;(f)在236位的ala、asp、glu、his、ile、leu、met、asn、gln、ser、thr、val;(g)在237位的asp、tyr;(h)在238位的glu、ile、met、gln、tyr;(i)在239位的ile、leu、asn、pro、val;(j)在264位的ile;(k)在266位的phe;(l)在267位的ala、his、leu;(m)在268位的asp、glu;(n)在271位的asp、glu、gly;(o)在295位的leu;(p)在298位的leu;(q)在325位的glu、phe、ile、leu;(r)在326位的thr;(s)在327位的ile、asn;(t)在328位的thr;(u)在330位的lys、arg;(v)在331位的glu;(w)在332位的asp;(x)在334位的asp、ile、met、val、tyr;以及(y)在396位的ala、asp、glu、phe、gly、his、ile、lys、leu、met、asn、gln、arg、ser、thr、val、trp、tyr;根据eu编号。
[0635]
在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含选自由以下各项所组成的群组的至少一个氨基酸改变(例如,取代):(a)在231位的gly、thr;(b)在232位的asp;(c)在235位的trp;(d)在236位的asn、thr;(e)在239位的val;(f)在268位的asp、glu;(g)在295未的leu;(h)在298位的leu;(i)在326位的thr;(j)在330位的lys,arg;(k)在396位的lys、met;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包
含下列氨基酸改变(例如,取代):在236位的asn、在位置268位的glu、在330位的lys、在位置396位的met;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含下列氨基酸改变(例如,取代):在236位的asn、在268位的asp、在330位的lys;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含下列氨基酸改变(例如,取代):在236位的asn、在268位的asp、在295位的leu、在330位的lys;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含下列氨基酸改变(例如,取代):在236位的thr、在268位的asp、在330位的lys;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含下列氨基酸改变(例如,取代):在236位的asn、在268位的asp、在295位的leu、在326位的thr、在330位的lys;根据eu编号。在另一实施例中,具有增强的fcγriib结合活性的变体fc区包含下列氨基酸改变(例如,取代):在235位的trp、在236位的asn、在268位的asp、在位置295位的leu、在326位的thr、在330位的lys;根据eu编号。
[0636]
在另一方面,本发明提供包含具有增加的等电点(pi)的变体fc区的分离的多肽。在某些实施例中,本文所述的变体fc区包含在亲本fc区中至少两个氨基酸改变。在某些实施例中,与亲本fc区的等电点相比,每个氨基酸改变均增加变体fc区的等电点(pi)。其等基于以下发现:例如,当施用抗体至体内时,通过修饰至少两个氨基酸残基而增加pi的抗体可促进血浆中抗原的清除。
[0637]
在本发明中,pi可以是理论上或实验上确定的pi。pi的值可例如通过本领域技术人员已知的等电聚焦来确定。可使用例如基因和氨基酸序列分析软件(genetyx等)来计算理论的pi值。
[0638]
在一个实施例中,pi值与修饰之前相比可例如增加至少0.01、0.03、0.05、0.1、0.2、0.3、0.4、0.5或更多,至少0.6、0.7、0.8、0.9或更多,至少1.0、1.1、1.2、1.3、1.4、1.5或更多,或至少1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、3.0或更多。
[0639]
在某些实施例中,用于增加的pi的氨基酸可暴露于变体fc区的表面上。在本发明中,可在表面上暴露的氨基酸通常涉及位于构成变体fc区的多肽的表面上的氨基酸残基。位于多肽表面上的氨基酸残基涉及其侧链可与溶剂分子(通常主要是水分子)接触的氨基酸残基。然而,侧链不一定必须与溶剂分子完全接触,且即使侧链的一部分与溶剂分子接触,该氨基酸也被定义为“位于表面的氨基酸残基”。位于多肽表面上的氨基酸残基亦包括位于接近表面的氨基酸残基,因此可受到另一个氨基酸残基的电荷影响,该氨基酸残基的侧链甚至部分地与溶剂分子接触。本领域技术人员可例如使用市售软件来制备多肽的同源性模型。或者,可使用本领域技术人员已知的方法,例如x射线晶体学。例如,使用如insightii程序(accelrys)之类的计算器程序,使用来自三维模型的坐标确定可暴露在表面上的氨基酸残基。可使用技术领域中已知的算法来确定表面可暴露的位点(例如,lee and richards(j.mol.biol.55:379-400(1971));connolly(j.appl.cryst.16:548-558(1983))。可使用适于蛋白质模型化和三维结构信息的软件来确定可暴露于表面的位点。可用于此目的的软件包括,例如,sybyl biopolymer module软件(tripos associates)。当算法需要用户输入大小参数时,可将计算中使用的探针的“大小”设置为半径约1.4埃或更小。此外,pacios已经描述了使用个人计算机软件确定表面可暴露区域的方法(comput.chem.18(4):377-386(1994);j.mol.model.1:46-53(1995))。基于如上所述的信息,可选择位于构成变体fc区的多肽表面上的合适的氨基酸残基。
[0640]
在某些实施例中,多肽包含变体fc区及抗原结合结构域二者。在另外的实施例中,抗原是可溶性抗原。在一个实施例中,抗原存在于受试者的生物体液(例如血浆、间质液、淋巴液、腹水和胸膜液)中。抗原也可为膜抗原。
[0641]
在另外的实施例中,抗原结合结构域的抗原结合活性根据离子浓度条件而变化。在一个实施例中,离子浓度并无特别限制,且涉及氢离子浓度(ph)或金属离子浓度。在本文中,金属离子涉及除氢以外的i族元素的离子,例如碱金属和铜族元素,例如碱土金属和锌族元素的ii族元素,除硼外的iii族元素,除碳和硅外的iv族元素,viii族元素,例如铁族元素和铂族元素,属于v、vi和vii族的a亚族元素,及例如锑、铋和钋的金属元素。在本发明中,金属离子包括例如钙离子,如wo 2012/073992和wo2013/125667中所述。在一个实施例中,“离子浓度条件”可为聚焦于低离子浓度和高离子浓度之间抗原结合结构域生物学行为的差异的条件。此外,“根据离子浓度条件而变化的抗原结合结构域的抗原结合活性”是指抗原结合结构域的抗原结合活性在低离子浓度和高离子浓度之间变化(这样的抗原结合结构域在本文中称为“离子浓度依赖性抗原结合结构域”)。高离子浓度条件下的抗原结合结构域的抗原结合活性可能比低离子浓度条件下的抗原结合活性更高(更强)或更低(更弱)。在一个实施例中,离子浓度依赖性抗原结合结构域(例如ph依赖性抗原结合结构域或钙离子浓度依赖性抗原结合结构域)可通过已知方法获得,例如,wo 2009/125825、wo 2012/073992和wo 2013/046722中所述。
[0642]
在本发明中,在高钙离子浓度条件下的抗原结合结构域的抗原结合活性可比在低钙离子浓度条件下的更高。高钙离子浓度并不特别限于但可选自下列浓度:100μm至10mm之间、200μm至5mm之间、400μm至3mm之间,200μm至2mm之间、400μm至1mm之间,或500μm至2.5mm之间,优选为接近体内血浆(血液)钙离子的浓度。同时,低钙离子浓度并不特别限于但可选自下列浓度:0.1μm至30μm之间,0.2μm至20μm之间,0.5μm至10μm之间,1μm至5μm之间或2μm至4μm之间,优选接近于体内早期胞内体中钙离子的浓度。
[0643]
在一个实施例中,低钙离子浓度条件下的抗原结合活性与高钙离子浓度条件下的抗原结合活性之比不受限制,但低钙离子浓度条件下的解离常数(kd)与高钙离子浓度条件下的kd的比,即kd(低钙离子浓度条件)/kd(高钙离子浓度条件)为2或更多、10或更多或40或更多。该比率的上限可为400、1000或10000,只要可通过本领域技术人员已知的技术产生此类的抗原结合结构域即可。或者,例如,可使用解离速率常数(kd)代替kd。在此情况下,低钙离子浓度条件下的kd与高钙离子浓度条件下的kd之比,即kd(低钙离子浓度条件)/kd(高钙离子浓度条件)为2或更多、5或更多、10或更多或30或更多。该比率的上限可为50、100或200,只要可基于本领域技术人员的一般技术知识产生抗原结合结构域即可。
[0644]
在本发明中,在低氢离子浓度(中性ph)下的抗原结合结构域的抗原结合活性可高于在高氢离子浓度(酸性ph)下的抗原结合结构域的抗原结合活性。酸性ph可例如选自ph4.0至ph6.5,选自ph4.5至ph6.5,选自ph5.0至ph6.5或选自ph5.5至ph6.5,优选为接近早期胞内体中的体内ph。酸性ph也可例如为ph5.8或ph6.0。在特定的实施例中,酸性ph为ph5.8。同时,中性ph可例如选自ph6.7至ph10.0,选自ph6.7至ph9.5,选自ph7.0至ph9.0或选自ph7.0至ph8.0,优选为接近血浆(血液)中的体内ph。中性ph也可例如为ph7.4或ph7.0。在特定的实施例中,中性ph为ph7.4。
[0645]
在一个实施例中,在酸性ph条件下和中性ph条件下的抗原结合活性的比率不受限
制,但在酸性ph条件下的解离常数(kd)与在中性ph条件下的kd的比率,即kd(酸性ph条件)/kd(中性ph条件)为2或更多、10或更多或40或更多。该比率的上限可为400、1000或10000,只要可通过本领域技术人员已知的技术产生此类的抗原结合结构域即可。或者,例如,可使用解离速率常数(kd)代替kd。在此情况下,酸性ph条件下的kd与中性ph条件下的kd的比率,即kd(酸性ph条件)/kd(中性ph条件)为2或更多、5或更多、10或更多或30或更多。该比率的上限可为50、100或200,只要可基于本领域技术人员的一般技术知识产生抗原结合结构域即可。
[0646]
在一个实施例中,例如,至少一个氨基酸残基被侧链pka为4.0-8.0的氨基酸残基取代,和/或至少一个侧链pka为4.0-8.0的氨基酸残基被插入抗原结合结构域中,如wo 2009/125825中所述。只要在酸性ph条件下抗原结合结构域的抗原结合活性比在中性ph条件下弱于取代或插入之前,氨基酸可在任何位点被取代和/或插入。当抗原结合结构域具有可变区或cdr时,该位点可在可变区或cdr内。取代或插入的氨基酸数量可由本领域技术人员适当地确定;例如,该数目可以是一个或多个。侧链pka为4.0-8.0的氨基酸可根据氢离子浓度条件用于改变抗原结合结构域的抗原结合活性。此类氨基酸包括例如天然氨基酸,例如his(h)和glu(e),以及非天然氨基酸,例如组氨酸类似物(us2009/0035836)、m-no2-tyr(pka 7.45)、3,5-br2-tyr(pka 7.21)和3,5-i2-tyr(pka 7.38)(heyl等人,bioorg.med.chem.11(17):3761-3768(2003))。也可使用侧链pka为6.0-7.0的氨基酸,包括例如his(h)。
[0647]
在另一个实施例中,描述具有增加的pi的变体fc区的优选抗原结合结构域,且可通过wo2016/125495和wo2017/046994中所描述的方法获得。
[0648]
在某些实施例中,具有增加的pi的变体fc区包含在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:285、311、312、315、318、333、335、337、341、342、343、384、385、388、390、399、400、401、402、413、420、422和431,根据eu编号。
[0649]
在另外的实施例中,具有增加的pi的变体fc区包含在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:311、341、343、384、399、400、401、402和413,根据eu编号。
[0650]
在另一方面,本发明提供包含具有增加的pi的变体fc区的多肽,其包含下列(1)-(10)中任一个氨基酸改变:(1)位置311和341;(2)位置311和343;(3)位置311、343和413;(4)位置311、384和413;(5)位置311和399;(6)位置311和401;(7)位置311和413;(8)位置400和413;(9)位置401和413;(10)位置402和413;根据eu编号。
[0651]
一方面,本发明提供包含具有增强的f cγriib结合活性及增加的pi的变体fc区的多肽,其包含至少三个氨基酸改变,包含:(a)在选自由以下各项所组成的群组的至少一个位置处的至少一个氨基酸改变:231、232、233、234、235、236、237、238、239、264、266、267、268、271、295、298、325、326、327、328、330、331、332、334和396,根据eu编号,及(b)在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:285、311、312、315、318、333、335、337、341、342、343、384、385、388、390、399、400、401、402、413、420、422和431,根据eu编号。
[0652]
一方面,本发明提供包含具有增强的fcγriib结合活性及增加的pi的变体fc区的多肽,且其包含至少三个氨基酸改变,包含:(a)在选自由以下各项所组成的群组的至少一
个位置处的至少一个氨基酸改变:231、232、235、236、239、268、295、298、326、330和396,根据eu编号,及(b)在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:311、341、343、384、399、400、401、402和413,根据eu编号。
[0653]
在另一个方面,本发明提供包含具有增强的fcγriib结合活性及增加的pi的变体fc区的多肽,其包含下列(1)-(9)中任一个氨基酸改变:(1)位置235、236、268、295、311、326、330和343;(2)位置236、268、295、311、326、330和343;(3)位置236、268、295、311、330和413;(4)位置236、268、311、330、396和399;(5)位置236、268、311、330和343;(6)位置236、268、311、330、343和413;(7)位置236、268、311、330、384和413;(8)位置236、268、311、330和413;(9)位置236、268、330、396、400和413;根据eu编号。
[0654]
一方面,本发明提供包含具有增强的f cγriib结合活性及增加的pi的变体fc区的多肽,其包含至少三个氨基酸改变,包含:(a)在选自由以下各项所组成的群组的至少一个位置处的至少一个氨基酸改变:234、238、250、264、267、307和330,及(b)在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:285、311、312、315、318、333、335、337、341、342、343、384、385、388、390、399、400、401、402、413、420、422和431,根据eu编号。在其他实施例中,多肽包含在选自由以下各项所组成的群组的至少两个位置处的至少两个氨基酸改变:311、341、343、384、399、400、401、402和413,根据eu编号。
[0655]
在另一个方面,本发明提供包含具有增强的fcγriib结合活性及增加的pi的变体fc区的多肽,其包含下列(1)-(16)中任一个氨基酸改变:(1)位置234、238、250、264、307、311、330和343;(2)位置234、238、250、264、307、311、330和413;(3)位置234、238、250、264、267、307、311、330和343;(4)位置234、238、250、264、267、307、311、330和413;(5)位置234、238、250、267、307、311、330和343;(6)位置234、238、250、267、307、311、330和413;(7)位置234、238、250、307、311、330和343;(8)位置234、238、250、307、311、330和413;(9)位置238、250、264、267、307、311、330和343;(10)位置238、250、264、267、307、311、330和413;(11)位置238、250、264、307、311、330和343;(12)位置238、250、264、307、311、330和413;(13)位置238、250、267、307、311、330和343;(14)位置238、250、267、307、311、330和413;(15)位置238、250、307、311、330和343;(16)位置238、250、307、311、330和413;根据eu编号。
[0656]
另外,出于其他目所进行的氨基酸改变可结合在本文所述的变体fc区中。例如,改善fcrn结合活性的氨基酸取代(hinton等人,j.immunol.176(1):346-356(2006);dall'acqua等人,j.biol.chem.281(33):23514-23524(2006);petkova等人,intl.immunol.18(12):1759-1769(2006);zalevsky等人,nat.biotechnol.28(2):157-159(2010);wo 2006/019447;wo 2006/053301;以及wo 2009/086320),并可添加用于改善抗体异质性或稳定性的氨基酸取代(wo 2009/041613)。或者,描述于wo 2011/122011、wo 2012/132067、wo 2013/046704或wo 2013/180201中的具有促进抗原清除特性的多肽、描述于wo 2013/180200中的具有与目标组织特异性结合特性的多肽、描述于wo 2009/125825、wo 2012/073992或wo 2013/047752中的具有重复结合多个抗原分子性质的多肽可与本文所述的变体fc区组合。或者,为了赋予与其他抗原的结合能力,可将ep1752471和ep1772465中所公开的氨基酸改变组合在本文所述的变体fc区的ch3中。或者,为了增加血浆保留,可将降低恒定区pi的氨基酸改变(wo 2012/016227)组合在本文所述的变体fc区中。或者,为了促进摄取进入细胞,可将增加恒定区pi的氨基酸改变(wo 2014/145159)组合在本文所述的变体fc
l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
[0713]
ii)所述第二抗原结合位点包含
[0714]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[0715]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;
[0716]
或者
[0717]
i)i)所述第一抗原结合位点包含
[0718]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:1的氨基酸序列;(b)cdr-h2,其包含seq id no:2的氨基酸序列;以及(c)cdr-h3,其包含seq id no:3的氨基酸序列;
[0719]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:4的氨基酸序列;(e)cdr-l2,其包含seq id no:5的氨基酸序列;以及(f)cdr-l3,其包含seq id no:6的氨基酸序列;并且
[0720]
ii)所述第二抗原结合位点包含
[0721]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[0722]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列。
[0723]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[0724]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。
[0725]
在一个实施例中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g的人igg1同种型的fcγ受体静默恒定重链结构域(或其fc结构域)的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型的恒定重链结构域(或其fc结构域)的双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少两倍(在一个实施例中高至少5倍,在一个实施例中高至少10倍,在一个实施例中高至少20倍)。
[0726]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0727]
其中,
[0728]
i)所述第一抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
[0729]
vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[0730]
以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)
cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[0731]
ii)所述第二抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
[0732]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[0733]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列。
[0734]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[0735]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。
[0736]
在一个实施例中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g的人igg1同种型(或其fc结构域)的fcγ受体静默恒定重链结构域的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型(或其fc结构域)的恒定重链结构域的双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少15倍,特别地高至少20倍。
[0737]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0738]
其中,
[0739]
i)所述第一抗原结合位点包含
[0740]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0741]
以及
[0742]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
[0743]
并且
[0744]
ii)所述第二抗原结合位点包含
[0745]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0746]
以及
[0747]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[0748]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0749]
其中,
[0750]
i)所述第一抗原结合位点包含
[0751]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq idno:58的氨基酸序列gx1ix2fx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;(d)fr-h1,其包含seq id no:63的氨基酸序列qvqlvqsgaevkkpgssvkvsckasggtf;(e)fr-h2,其包含seq id no:64的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:65的氨基酸序列rvtitadeststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:66的氨基酸序列wgqgtlvtvss;
[0752]
以及
[0753]
vl结构域,其包含:(h)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(i)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(j)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;(k)fr-l1,其包含seq id no:67的氨基酸序列eivltqspatlslspgeratlsc;(l)fr-l2,其包含seq id no:68的氨基酸序列wyqqkpgqaprlliy;(m)fr-l3,其包含seq id no:69的氨基酸序列gvparfsgsgsgtdftltisslepedfavyyc;以及(n)fr-l4,其包含seq id no:70的氨基酸序列gqgtkveik;
[0754]
并且
[0755]
ii)所述第二抗原结合位点包含
[0756]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;(d)fr-h1,其包含seq id no:82的氨基酸序列qvqlvqsgaevkkpgssvkvsckasgltis;(e)fr-h2,其包含seq id no:83的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:84的氨基酸序列rvtitadtststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:85的氨基酸序列wgqgttvtvss;
[0757]
以及
[0758]
vl结构域,其包含:(h)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(i)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;(j)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;(k)fr-l1,其包含seq id no:86的氨基酸序列diqmtqspsslsasvgdrvtitc;(l)fr-l2,其包含seq id no:87的氨基酸序列wyqqkpgkapkllih;(m)fr-l3,其包含seq id no:88的氨基酸序列gvpsrfsgsgsgtdytltisslqpedfatyyc;以及(n)fr-l4,其包含seq id no:89的氨基酸序列fgggtkveik。
[0759]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0760]
其中,
[0761]
a)i)所述第一抗原结合位点包含
[0762]
vh结构域,其包含seq id no:71的氨基酸序列;
[0763]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0764]
ii)所述第二抗原结合位点包含
[0765]
vh结构域,其包含seq id no:90的氨基酸序列;
[0766]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0767]
或者
[0768]
b)i)所述第一抗原结合位点包含
[0769]
vh结构域,其包含seq id no:71的氨基酸序列;
[0770]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0771]
ii)所述第二抗原结合位点包含
[0772]
vh结构域,其包含seq id no:91的氨基酸序列;
[0773]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0774]
或者
[0775]
c)i)所述第一抗原结合位点包含
[0776]
vh结构域,其包含seq id no:71的氨基酸序列;
[0777]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0778]
ii)所述第二抗原结合位点包含
[0779]
vh结构域,其包含seq id no:90的氨基酸序列;
[0780]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[0781]
或者
[0782]
d)i)所述第一抗原结合位点包含
[0783]
vh结构域,其包含seq id no:72的氨基酸序列;
[0784]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0785]
ii)所述第二抗原结合位点包含
[0786]
vh结构域,其包含seq id no:90的氨基酸序列;
[0787]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[0788]
或者
[0789]
e)i)所述第一抗原结合位点包含
[0790]
vh结构域,其包含seq id no:73的氨基酸序列;
[0791]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0792]
ii)所述第二抗原结合位点包含
[0793]
vh结构域,其包含seq id no:90的氨基酸序列;
[0794]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0795]
或者
[0796]
f)i)所述第一抗原结合位点包含
[0797]
vh结构域,其包含seq id no:73的氨基酸序列;
[0798]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0799]
ii)所述第二抗原结合位点包含
[0800]
vh结构域,其包含seq id no:90的氨基酸序列;
[0801]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[0802]
或者
[0803]
g)i)所述第一抗原结合位点包含
[0804]
vh结构域,其包含seq id no:73的氨基酸序列;
[0805]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0806]
ii)所述第二抗原结合位点包含
[0807]
vh结构域,其包含seq id no:92的氨基酸序列;
[0808]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0809]
或者
[0810]
h)i)所述第一抗原结合位点包含
[0811]
vh结构域,其包含seq id no:73的氨基酸序列;
[0812]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0813]
ii)所述第二抗原结合位点包含
[0814]
vh结构域,其包含seq id no:91的氨基酸序列;
[0815]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0816]
或者
[0817]
i)i)所述第一抗原结合位点包含
[0818]
vh结构域,其包含seq id no:72的氨基酸序列;
[0819]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0820]
ii)所述第二抗原结合位点包含
[0821]
vh结构域,其包含seq id no:90的氨基酸序列;
[0822]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0823]
或者
[0824]
j)i)所述第一抗原结合位点包含
[0825]
vh结构域,其包含seq id no:72的氨基酸序列;
[0826]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0827]
ii)所述第二抗原结合位点包含
[0828]
vh结构域,其包含seq id no:92的氨基酸序列;
[0829]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0830]
或者
[0831]
k)i)所述第一抗原结合位点包含
[0832]
vh结构域,其包含seq id no:72的氨基酸序列;
[0833]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0834]
ii)所述第二抗原结合位点包含
[0835]
vh结构域,其包含seq id no:91的氨基酸序列;
[0836]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0837]
或者
[0838]
l)i)所述第一抗原结合位点包含
[0839]
vh结构域,其包含seq id no:74的氨基酸序列;
[0840]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0841]
ii)所述第二抗原结合位点包含
[0842]
vh结构域,其包含seq id no:90的氨基酸序列;
[0843]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0844]
或者
[0845]
m)i)所述第一抗原结合位点包含
[0846]
vh结构域,其包含seq id no:74的氨基酸序列;
[0847]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0848]
ii)所述第二抗原结合位点包含
[0849]
vh结构域,其包含seq id no:90的氨基酸序列;
[0850]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[0851]
或者
[0852]
n)i)所述第一抗原结合位点包含
[0853]
vh结构域,其包含seq id no:74的氨基酸序列;
[0854]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0855]
ii)所述第二抗原结合位点包含
[0856]
vh结构域,其包含seq id no:92的氨基酸序列;
[0857]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0858]
或者
[0859]
o)i)所述第一抗原结合位点包含
[0860]
vh结构域,其包含seq id no:74的氨基酸序列;
[0861]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0862]
ii)所述第二抗原结合位点包含
[0863]
vh结构域,其包含seq id no:91的氨基酸序列;
[0864]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0865]
或者
[0866]
p)i)所述第一抗原结合位点包含
[0867]
vh结构域,其包含seq id no:71的氨基酸序列;
[0868]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0869]
ii)所述第二抗原结合位点包含
[0870]
vh结构域,其包含seq id no:92的氨基酸序列;
[0871]
以及vl结构域,其包含seq id no:93的氨基酸序列。
[0872]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[0873]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。
[0874]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0875]
其中,
[0876]
i)所述第一抗原结合位点包含
[0877]
vh结构域,其包含seq id no:71的氨基酸序列;
[0878]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0879]
ii)所述第二抗原结合位点包含
[0880]
vh结构域,其包含seq id no:90的氨基酸序列;
[0881]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[0882]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0883]
其中,
[0884]
i)所述第一抗原结合位点包含
[0885]
vh结构域,其包含seq id no:71的氨基酸序列;
[0886]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0887]
ii)所述第二抗原结合位点包含
[0888]
vh结构域,其包含seq id no:91的氨基酸序列;
[0889]
以及vl结构域,其包含seq id no:93的氨基酸序列。
[0890]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0891]
其中,
[0892]
i)所述第一抗原结合位点包含
[0893]
vh结构域,其包含seq id no:71的氨基酸序列;
[0894]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0895]
ii)所述第二抗原结合位点包含
[0896]
vh结构域,其包含seq id no:90的氨基酸序列;
[0897]
以及vl结构域,其包含seq id no:94的氨基酸序列。
[0898]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0899]
其中,
[0900]
i)所述第一抗原结合位点包含
[0901]
vh结构域,其包含seq id no:72的氨基酸序列;
[0902]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[0903]
ii)所述第二抗原结合位点包含
[0904]
vh结构域,其包含seq id no:90的氨基酸序列;
[0905]
以及vl结构域,其包含seq id no:94的氨基酸序列。
[0906]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[0907]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[0908]
其中,
[0909]
a)i)所述第一抗原结合位点包含
[0910]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0911]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0912]
ii)所述第二抗原结合位点包含
[0913]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d;
[0914]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
[0915]
或者
[0916]
b)i)所述第一抗原结合位点包含
[0917]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0918]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0919]
ii)所述第二抗原结合位点包含
[0920]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序
列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为e;
[0921]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
[0922]
或者
[0923]
c)i)所述第一抗原结合位点包含
[0924]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0925]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0926]
ii)所述第二抗原结合位点包含
[0927]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0928]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0929]
或者
[0930]
d)i)所述第一抗原结合位点包含
[0931]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0932]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)
cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0933]
ii)所述第二抗原结合位点包含
[0934]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0935]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0936]
或者
[0937]
e)i)所述第一抗原结合位点包含
[0938]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0939]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0940]
ii)所述第二抗原结合位点包含
[0941]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0942]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0943]
或者
[0944]
f)i)所述第一抗原结合位点包含
[0945]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0946]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0947]
ii)所述第二抗原结合位点包含
[0948]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0949]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0950]
或者
[0951]
g)i)所述第一抗原结合位点包含
[0952]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0953]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0954]
ii)所述第二抗原结合位点包含
[0955]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0956]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0957]
或者
[0958]
h)i)所述第一抗原结合位点包含
[0959]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0960]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0961]
ii)所述第二抗原结合位点包含
[0962]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0963]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0964]
或者
[0965]
i)i)所述第一抗原结合位点包含
[0966]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0967]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0981]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0982]
ii)所述第二抗原结合位点包含
[0983]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0984]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0985]
或者
[0986]
l)i)所述第一抗原结合位点包含
[0987]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0988]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0989]
ii)所述第二抗原结合位点包含
[0990]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0991]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)
cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0992]
或者
[0993]
m)i)所述第一抗原结合位点包含
[0994]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[0995]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[0996]
ii)所述第二抗原结合位点包含
[0997]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[0998]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[0999]
或者
[1000]
n)i)所述第一抗原结合位点包含
[1001]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1002]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1003]
ii)所述第二抗原结合位点包含
[1004]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1005]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1006]
或者
[1007]
o)i)所述第一抗原结合位点包含
[1008]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1009]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1010]
ii)所述第二抗原结合位点包含
[1011]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1012]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1013]
或者
[1014]
p)i)所述第一抗原结合位点包含
[1015]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及
(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1016]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1017]
ii)所述第二抗原结合位点包含
[1018]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1019]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[1020]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[1021]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。
[1022]
在一个实施例中,本文所述的双特异性抗体
[1023]
i)在体外阻断ccl2与其受体ccr2的结合(报告基因测定,ic
50
=0.5nm);和/或
[1024]
ii)在体外抑制髓样细胞的ccl2介导趋化性(ic
50
=1.5nm);和/或
[1025]
iii)与食蟹猕猴ccl2及人ccl2有交叉反应。
[1026]
在一个实施例中,本文所述的双特异性抗体与其他人ccl同源物无交叉反应,特别是相较于与ccl2结合,它显示出与其他ccl同源物(选自ccl8、ccl7和ccl13的组别)的结合少100倍。
[1027]
在一个实施例中,本文所述的双特异性抗体以离子依赖性方式与人ccl2上的第一和第二表位结合。
[1028]
在一个实施例中,本文所述的双特异性抗体以ph依赖性方式与人ccl2结合,且其中,第一抗原结合位点和第二抗原结合位点二者在中性ph比在酸性ph下以更高的亲和力与ccl2结合。
[1029]
在一个实施例中,本文所述的双特异性抗体在ph 7.4下以比在ph 5.8下高10倍的亲和力与人ccl2结合。
[1030]
在一个实施例中,本文所述的双特异性抗体包含两个含有(独立地或除上述突变之外)下列突变(eu编号)的igg1重链恒定结构域(或其fc结构域)
[1031]
i)在重链恒定结构域之一中的s354c和t366w
[1032]
ii)在其他重链恒定结构域中的y349c、t366s、l368a、y407v
[1033]
在一个实施例中,双特异性抗体包含人igg1同种型的fc结构域。
[1034]
在一个实施例中,双特异性抗体包含人igg1同种型的恒定重链结构域。在一个实
施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的人igg1重链恒定结构域(或其fc结构域)
[1035]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1036]
ii)l234y、l235w、g236n、p238d、t250v、v264i、h268d、q295l、t307p、k326t和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
[1037]
iii)m428l、n434a和/或y436t(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
[1038]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1039]
在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的人igg1重链恒定结构域(或其fc结构域)
[1040]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1041]
ii)l235w、g236n、h268d、q295l、k326t和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
[1042]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
[1043]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1044]
在一个实施例中,本文所述的双特异性抗体包含人igg1重链恒定结构域(或其fc结构域),该人igg1重链恒定结构域包含以下突变(kabat eu编号)
[1045]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1046]
ii)l235w、g236n、h268d、q295l、k326t和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1047]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1048]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1049]
在一个实施例中,本文所述的双特异性抗体包含人igg1重链恒定结构域(或其fc结构域),该人igg1重链恒定结构域包含以下突变(kabat eu编号)
[1050]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1051]
ii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1052]
iii)q438r和s440e(适于抑制类风湿因子结合)。
[1053]
在一个实施例中,本文所述的双特异性抗体包含人igg1重链恒定结构域(或其fc结构域),该人igg1重链恒定结构域包含以下突变(kabat eu编号)
[1054]
q311r和p343r(适于增加pi以增强抗原的摄取)。
[1055]
在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的人igg1重链恒定结构域(或其fc结构域)
[1056]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1057]
ii)l234y、p238d、t250v、v264i、t307p和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
[1058]
iii)m428l、n434a和/或y436t(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
[1059]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1060]
在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中
的一个或多个的人igg1重链恒定结构域(或其fc结构域)
[1061]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1062]
ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1063]
iii)m428l、n434a和y436t(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1064]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1065]
在一个实施例中,本文所述的双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的人igg1重链恒定结构域(或其fc结构域)
[1066]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1067]
ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1068]
iii)n434a和(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1069]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1070]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,其中,
[1071]
a)i)所述第一抗原结合位点包含
[1072]
vh结构域,其包含seq id no:71的氨基酸序列;
[1073]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1074]
ii)所述第二抗原结合位点包含
[1075]
vh结构域,其包含seq id no:90的氨基酸序列;
[1076]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1077]
或者
[1078]
b)i)所述第一抗原结合位点包含
[1079]
vh结构域,其包含seq id no:71的氨基酸序列;
[1080]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1081]
ii)所述第二抗原结合位点包含
[1082]
vh结构域,其包含seq id no:91的氨基酸序列;
[1083]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1084]
或者
[1085]
c)i)所述第一抗原结合位点包含
[1086]
vh结构域,其包含seq id no:71的氨基酸序列;
[1087]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1088]
ii)所述第二抗原结合位点包含
[1089]
vh结构域,其包含seq id no:90的氨基酸序列;
[1090]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1091]
或者
[1092]
d)i)所述第一抗原结合位点包含
[1093]
vh结构域,其包含seq id no:72的氨基酸序列;
[1094]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1095]
ii)所述第二抗原结合位点包含
[1096]
vh结构域,其包含seq id no:90的氨基酸序列;
[1097]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1098]
其中,所述双特异性抗体为人igg同种型(优选为人igg1同种型)的全长抗体,具有
[1099]
a)在对应的i)下包含所述第一抗原结合位点的第一抗体的第一轻链和第一重链;以及
[1100]
b)在对应的ii)下包含所述第二抗原结合位点的第二抗体的第二轻链和第二重链,并且其中,第二抗体的第二轻链和第二重链中的可变结构域vl和vh被彼此替换;并且
[1101]
其中,在a)下的第一轻链的恒定结构域cl中,124位的氨基酸被赖氨酸(k)取代(根据kabat编号),而123位的氨基酸被赖氨酸(k)取代(根据kabat编号),
[1102]
并且其中,在a)下的第一重链的恒定结构域ch1中,147位的氨基酸被谷氨酸(e)取代(根据kabat eu指数编号),而213位的氨基酸被谷氨酸取代(e)(根据kabat eu指数编号)。
[1103]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,其中,
[1104]
i)所述第一抗原结合位点包含
[1105]
vh结构域,其包含seq id no:71的氨基酸序列;
[1106]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1107]
ii)所述第二抗原结合位点包含
[1108]
vh结构域,其包含seq id no:91的氨基酸序列;
[1109]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1110]
其中,所述双特异性抗体为(全长)抗体,其具有
[1111]
a)在i)下包含所述第一抗原结合位点的igg1同种型的第一κ或λ轻链和第一重链;以及
[1112]
b)在ii)下包含所述第二抗原结合位点的第二κ或λ轻链和第二igg1重链igg1同种型,且其中,第二抗体的第二轻链和第二重链中的可变结构域vl和vh被彼此替换;以及
[1113]
其中,在a)下的第一轻链的恒定结构域cl中,124位的氨基酸被赖氨酸(k)取代(根据kabat编号),而123位的氨基酸被赖氨酸(k)取代(根据kabat编号),
[1114]
并且其中,在a)下的第一重链的恒定结构域ch1中,147位的氨基酸被谷氨酸(e)取代(根据kabat eu指数编号),而213位的氨基酸被谷氨酸取代(e)(根据kabat eu指数编号)。
[1115]
在一个实施例中,此类双特异性抗体包含下列突变(kabat eu编号)
[1116]
i)在重链恒定结构域之一中的s354c和t366w
[1117]
ii)在其他重链恒定结构域中的y349c、t366s、l368a、y407v
[1118]
在一个实施例中,此类双特异性抗体另包含以下突变(kabat eu编号):
[1119]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1120]
ii)l235w、g236n、h268d、q295l、k326t和a330k(适于增加与人fcgriib的亲和力和
降低与其他人fcgr的亲和力);以及
[1121]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1122]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1123]
在一个替代实施例中,此类双特异性抗体另包含下列突变(kabat eu编号):
[1124]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1125]
ii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1126]
iii)q438r和s440e(适于抑制类风湿因子结合)。
[1127]
在一个替代实施例中,此类双特异性抗体另包含下列突变(kabat eu编号):
[1128]
q311r和p343r(适于增加pi以增强抗原的摄取)。
[1129]
在一个替代实施例中,此类双特异性抗体另包含下列突变(kabat eu编号):
[1130]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1131]
ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1132]
iii)m428l、n434a和y436t(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1133]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1134]
在一个替代实施例中,此类双特异性抗体另包含下列突变(kabat eu编号):
[1135]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1136]
ii)l234y、p238d、t250v、v264i、t307p和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1137]
iii)n434a和(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1138]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1139]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:112的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:113的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:114的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:115的序列至少98%或99%相同的氨基酸序列的多肽。
[1140]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:112的氨基酸序列的多肽、含有seq id no:113之氨基酸序列的多肽、含有seq id no:114的氨基酸序列的多肽和含有seq id no:115的氨基酸序列的多肽。
[1141]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:116的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:117的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:118的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:119的序列至少98%或99%相同的氨基酸序列的多肽。
[1142]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第
一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:116的氨基酸序列的多肽、含有seq id no:117之氨基酸序列的多肽、含有seq id no:118的氨基酸序列的多肽和含有seq id no:119的氨基酸序列的多肽。
[1143]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:120的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:121的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:122的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:123的序列至少98%或99%相同的氨基酸序列的多肽。
[1144]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:120的氨基酸序列的多肽、含有seq id no:121之氨基酸序列的多肽、含有seq id no:122的氨基酸序列的多肽和含有seq id no:123的氨基酸序列的多肽。
[1145]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:120的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:121的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:122的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:123的序列至少98%或99%相同的氨基酸序列的多肽。
[1146]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:120的氨基酸序列的多肽、含有seq id no:121之氨基酸序列的多肽、含有seq id no:122的氨基酸序列的多肽和含有seq id no:123的氨基酸序列的多肽。
[1147]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:155的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:156的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:157的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:158的序列至少98%或99%相同的氨基酸序列的多肽。
[1148]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:155的氨基酸序列的多肽、含有seq id no:156之氨基酸序列的多肽、含有seq id no:157的氨基酸序列的多肽和含有seq id no:158的氨基酸序列的多肽。
[1149]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的
第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:159的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:160的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:161的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:162的序列至少98%或99%相同的氨基酸序列的多肽。
[1150]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:159的氨基酸序列的多肽、含有seq id no:160之氨基酸序列的多肽、含有seq id no:161的氨基酸序列的多肽和含有seq id no:162的氨基酸序列的多肽。
[1151]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:163的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:164的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:165的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:166的序列至少98%或99%相同的氨基酸序列的多肽。
[1152]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:163的氨基酸序列的多肽、含有seq id no:164之氨基酸序列的多肽、含有seq id no:165的氨基酸序列的多肽和含有seq id no:166的氨基酸序列的多肽。
[1153]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:167的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:168的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:169的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:170的序列至少98%或99%相同的氨基酸序列的多肽。
[1154]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:167的氨基酸序列的多肽、含有seq id no:168之氨基酸序列的多肽、含有seq id no:169的氨基酸序列的多肽和含有seq id no:170的氨基酸序列的多肽。
[1155]
本发明的具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与结合人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有与seq id no:171的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:172的序列至少98%或99%相同的氨基酸序列的多肽、与seq id no:173的序列至少98%或99%相同的氨基酸序列的多肽,及与seq id no:174的序列至少98%或99%相同的氨基酸序列的多肽。
[1156]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的
第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:171的氨基酸序列的多肽、含有seq id no:172之氨基酸序列的多肽、含有seq id no:173的氨基酸序列的多肽和含有seq id no:174的氨基酸序列的多肽。
[1157]
本发明的一个实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,其中,
[1158]
i)所述第一抗原结合位点包含
[1159]
vh结构域,其包含seq id no:71的氨基酸序列;
[1160]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1161]
ii)所述第二抗原结合位点包含
[1162]
vh结构域,其包含seq id no:90的氨基酸序列;
[1163]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1164]
其中,所述双特异性抗体为人igg1同种型的(全长)抗体,其具有
[1165]
a)在i)下包含所述第一抗原结合位点的igg1同种型的第一κ或λ轻链和第一重链;以及
[1166]
b)在ii)下包含所述第二抗原结合位点的第二κ或λ轻链和第二igg1重链igg1同种型,且其中,第二抗体的第二轻链和第二重链中的可变结构域vl和vh被彼此替换;以及
[1167]
其中,在a)下的第一轻链的恒定结构域cl中,124位的氨基酸被赖氨酸(k)取代(根据kabat编号),而123位的氨基酸被赖氨酸(k)取代(根据kabat编号),
[1168]
并且其中,在a)下的第一重链的恒定结构域ch1中,147位的氨基酸被谷氨酸(e)取代(根据kabat eu指数编号),而213位的氨基酸被谷氨酸取代(e)(根据kabat eu指数编号)。
[1169]
在一个实施例中,此类双特异性抗体包含下列突变(kabat eu编号)
[1170]
i)在重链恒定结构域之一中的s354c和t366w
[1171]
ii)在其他重链恒定结构域中的y349c、t366s、l368a、y407v
[1172]
在一个实施例中,此类双特异性抗体另包含以下突变(kabat eu编号):
[1173]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1174]
ii)l235w、g236n、h268d、q295l、k326t和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1175]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1176]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1177]
在一个实施例中,本文所述的双特异性抗体包含含有下列突变(kabat eu编号)的igg1重链恒定结构域(或其fc结构域)
[1178]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1179]
ii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1180]
iii)q438r和s440e(适于抑制类风湿因子结合)。
[1181]
在一个实施例中,本文所述的双特异性抗体包含含有下列突变(kabat eu编号)的igg1重链恒定结构域(或其fc结构域)
[1182]
q311r和p343r(适于增加pi以增强抗原的摄取)。
no:135的序列至少98%或99%相同的氨基酸序列的多肽。
[1198]
本发明的一个具体实施例为一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点和与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,其中,该双特异性抗体包含含有seq id no:132的氨基酸序列的多肽、含有seq id no:133之氨基酸序列的多肽、含有seq id no:134的氨基酸序列的多肽和含有seq id no:135的氨基酸序列的多肽。
[1199]
重组方法和组合物
[1200]
可以使用重组方法和组合物来生产抗体,例如,如美国专利号4,816,567中所述。在一个实施例中,提供编码本文所述的抗ccl2抗体(双特异性或单特异性)的分离的核酸。此类核酸可编码包含一个或全部vl的氨基酸序列和/或包含单特异性或双特异性抗体的一个或全部vh的氨基酸序列(例如,抗体的轻链和/或重链)。在另一实施例中,提供了包含此类核酸的一种或多种载体(例如,表达载体)。在另一实施例中,提供了包含此类核酸的宿主细胞。在一个此类实施例中,宿主细胞包含(例如已经被下列转型):(1)载体,其包含核酸,其编码包含抗体的vl的氨基酸序列和包含抗体vh的氨基酸序列,或(2)第一载体,其包含核酸,其编码包含抗体的vl的氨基酸序列,以及第二载体,其包含核酸,其编码包含抗体的vh的氨基酸序列。在一个实施例中,宿主细胞是真核的,例如中华仓鼠卵巢(cho)细胞、hek293细胞或淋巴细胞(例如y0、ns0、sp20细胞)。在一个实施例中,提供一种制备抗ccl2抗体的方法,其中,该方法包括在适于抗体表达的条件下培养包含如上所述的编码该抗体的核酸的宿主细胞,并可任选地从宿主细胞(或宿主细胞培养基)回收该抗体。
[1201]
为了重组生产抗ccl2细胞,此类核酸可使用常规方法(例如,使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)轻易地分离并测序。
[1202]
适用于克隆或表达编码抗体的载体的宿主细胞包括本文所述的原核或真核细胞。例如,抗体可能在细菌中产生,特别是在无需糖基化和fc效应子功能的情况下。关于抗体片段和多肽在细菌中的表达,参见例如us5,648,237、us 5,789,199和us 5,840,523。(另参见charlton,k.a.,in:methods in molecular biology,vol.248,lo,b.k.c.(ed.),humana press,totowa,nj(2003),pp.245-254,描述了抗体片段在大肠杆菌(e.coli)中的表达。)表达后,抗体可与细菌细胞糊中的可溶性部分分离,并可经过进一步纯化。
[1203]
除原核生物以外,真核微生物(如丝状真菌或酵母菌)也为合适的多肽编码载体的选殖或表达宿主,包括其糖基化途径已被“人源化”的真菌和酵母菌株,从而导致具有部分或完全人糖基化模式的多肽的产生。参见gerngross,t.u.,nat.biotech.22(2004)1409-1414;和li,h.等人,nat.biotech.24(2006)210-215.
[1204]
用于表达糖基化多肽的合适的宿主细胞也来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已鉴定出许多杆状病毒株,它们可以与昆虫细胞结合使用,特别是用于转染草地贪夜蛾(spodoptera frugiperda)细胞。
[1205]
植物细胞培养物也可以用作宿主。参见例如美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了在转基因植物中生产抗体的plantibodies
tm
技术)。
[1206]
脊椎动物细胞也可以用作宿主。例如,可以使用适于在悬浮液中生长的哺乳动物细胞系。可用的哺乳动物宿主细胞株的其他实例为:由sv40(cos-7)转化的猴肾cv1细胞株;
人类胚胎肾细胞系(如graham,f.l.等人,j.gen virol.36(1977)59-74中所述的293或293t细胞);幼仓鼠肾细胞(bhk);小鼠塞尔托利氏细胞(如mather,j.p.,biol.reprod.23(1980)243-252中所述的tm4细胞);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck);布法罗大鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤细胞(mmt 060562);tri细胞(如mather,j.p.等人,annals n.y.acad.sci.383(1982)44-68所述);mrc 5细胞;以及fs4细胞。其他可用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub,g.等人,proc.natl.acad.sci.usa 77(1980)4216-4220);以及骨髓瘤细胞系,例如y0、ns0和sp2/0。有关某些适用于抗体生产的哺乳动物宿主细胞系的综述,参见例如:yazaki,p.和wu,a.m.,methods in molecular biology,第248卷,lo,b.k.c.主编,humana press,totowa,nj(2004),第255-268页)。
[1207]
在另一方面,本发明部分基于以下发现:本文所述的经修饰的单特异性抗体显示出改善的ph依赖性结合特性,因此对于本发明的双特异性抗体的产生特别有用。
[1208]
具有ph依赖性结合特性的单特异性抗ccl2抗体
[1209]
本发明的一个实施例为一种(分离的)(单特异性)抗体,其与人ccl2(特异性地)结合,
[1210]
其中,该抗体包含
[1211]
a)vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1212]
以及
[1213]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
[1214]
或者
[1215]
b)vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1216]
以及
[1217]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[1218]
本发明的一个实施例为一种(分离的)(单特异性)抗体,其与人ccl2(特异性地)结合,
[1219]
其中,该抗体包含
[1220]
a)vh结构域,其包含seq id no:71的氨基酸序列;
[1221]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1222]
或者
[1223]
b)vh结构域,其包含seq id no:72的氨基酸序列;
[1224]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1225]
或者
[1226]
c)vh结构域,其包含seq id no:73的氨基酸序列;
[1227]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1228]
或者
[1229]
d)vh结构域,其包含seq id no:74的氨基酸序列;
[1230]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1231]
或者
[1232]
e)vh结构域,其包含seq id no:90的氨基酸序列;
[1233]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1234]
或者
[1235]
f)vh结构域,其包含seq id no:91的氨基酸序列;
[1236]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1237]
或者
[1238]
g)vh结构域,其包含seq id no:92的氨基酸序列;
[1239]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1240]
或者
[1241]
h)vh结构域,其包含seq id no:90的氨基酸序列;
[1242]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1243]
用于诊断和检测的方法及组合物
[1244]
在某些实施例中,本文提供的任何单特异性或双特异性抗ccl2抗体有用于检测生物样品中ccl2的存在。如本文所用的术语“检测”,涵盖定量或定性检测。在某些实施例中,生物样品包含细胞或组织,例如免疫细胞或t细胞浸润物和/或肿瘤细胞。
[1245]
在一个实施例中,提供了用于诊断或检测方法的单特异性或双特异性抗ccl2抗体。在另一方面,提供了一种检测生物样品中是否存在ccl2的方法。在某些实施例中,该方法包含在允许单特异性或双特异性抗ccl2抗体与ccl2结合的条件下,使生物样品与本文所述的单特异性或双特异性抗ccl2抗体接触,并检测单特异性或双特异性抗ccl2抗体与ccl2之间是否形成复合物。这种方法可为体外或体内方法。在一个实施例中,使用单特异性或双特异性抗ccl2抗体来选择适合用单特异性或双特异性抗ccl2抗体治疗的受试者,例如其中,ccl2是用于选择患者的生物标志。
[1246]
在某些实施例中,提供经标记的单特异性或双特异性抗ccl2抗体。标记包括但不限于直接检测的标记或部分(例如荧光、发色、电子致密、化学发光和放射性标记),以及间接检测(例如,通过酶促反应或分子相互作用)的部分,例如酶或配体。示例性标记包括但不限于:放射性同位素
32
p、
14
c、
125
i、3h和
131
i;荧光团,例如稀土螯合物或荧光素及其衍生物;罗丹明及其衍生物、丹酰、伞形酮;萤光素酶,例如萤火虫萤光素酶和细菌萤光素酶(美国专利号4,737,456);萤光素;2,3-二氢二氮杂萘二酮;辣根过氧化物酶(hrp);碱性磷酸酶;β-半乳糖苷酶;葡糖淀粉酶;溶菌酶;糖氧化酶,例如葡萄糖氧化酶、半乳糖氧化酶和葡萄糖-6-磷酸脱氢酶;杂环氧化酶,例如尿酸氧化酶和黄嘌呤氧化酶;与采用过氧化氢氧化染料前体
的酶(例如hrp、乳过氧化物酶,或微过氧化物酶)偶联;生物素/抗生物素蛋白;纺丝标记;噬菌体标记或稳定自由基。
[1247]
e.医药制剂
[1248]
通过将具有所需纯度的抗体与一种或多种任选的药学上可接受的载体混合来制备冻干制剂或水溶液形式的本文所述的单特异性或双特异性抗ccl2抗体的医药制剂(remington's pharmaceutical sciences,第16版,osol,a.(ed.)(1980))。药学上可接受的载体在所用的剂量和浓度下通常对受体无毒,其包括但不限于:缓冲剂,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂(例如edta糖类);糖类,例如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,例如钠;金属络合物(例如锌蛋白质络合物);和/或非离子表面活性剂,例如聚乙二醇(peg)。本技术中的例示性药学上可接受的载体还进一步包括间质药物分散剂,例如可溶性中性活性透明质酸酶糖蛋白(shasegp),例如人可溶性ph-20透明质酸酶糖蛋白,诸如rhuph20(baxter international,inc.)。某些例示性shasegp及用法(包括rhuph20)描述于美国专利公开号2005/0260186和2006/0104968中。在一个方面,shasegp与一种或多种附加的糖胺聚醣酶诸如软骨素酶结合在一起。
[1249]
示例性冻干抗体制剂如美国第6,267,958号专利所述。水溶性抗体制剂包括在美国专利号6,171,586和wo 2006/044908中所述的,后者所述的制剂包括组氨酸-乙酸盐缓冲液。
[1250]
本文所述的制剂还可包含适合于所治疗的特定适应症的一种以上的活性成分,优选地,为那些相互无不利影响的具有互补活性成分。例如,可能需要进一步提供。这些活性成分适当地以对预期目的有效的量组合存在。
[1251]
活性成分可裹入例如通过凝聚技术或通过接口聚合所制备的微胶囊(例如,分别为羟甲基纤维素微胶囊或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中、胶体药物递送系统(例如脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊(nanocapsule))中或粗滴乳液中。这种技术公开于remington's pharmaceutical sciences,第16版,osol,a.(ed.)(1980)。
[1252]
可以制备缓释制剂。释放制剂的适当实例包括含有抗体的固体疏水聚合物的半透性基质,该基质为成型物品的形式,例如膜或微胶囊。
[1253]
用于体内给药的制剂通常是无菌的。无菌性可易于例如通过无菌过滤膜过滤来实现。
[1254]
f.治疗方法和组合物
[1255]
本文所提供的任何单特异性或双特异性抗ccl2抗体都可用于治疗方法。
[1256]
在一个方面,提供一种用作药物的单特异性或双特异性抗ccl2抗体。在其他方面,提供一种用于治疗癌症的单特异性或双特异性抗ccl2抗体。在某些实施例中,提供一种用
于治疗方法的单特异性或双特异性抗ccl2抗体。在某些实施例中,本发明提供单特异性或双特异性抗ccl2抗体用于治疗患有癌症的个体的方法,其包含施用该个体治效量的单特异性或双特异性抗ccl2抗体。
[1257]
在进一步的实施例中,本发明提供单特异性或双特异性抗ccl2抗体,其抑制肿瘤中的免疫抑制,并因此使肿瘤对例如抗pd1、抗pdl-1拮抗剂等免疫刺激剂敏感。
[1258]
因此,其一个方面是本文所述的单特异性或双特异性抗ccl2抗体与例如抗pd1,抗pdl-1拮抗剂等癌症免疫疗法的组合。
[1259]
如本文所使用,术语“癌症”可以是例如肺癌、非小细胞肺癌(nscl)、支气管肺泡细胞肺癌、骨癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内黑素瘤、子宫癌、卵巢癌、直肠癌、肛门癌、胃癌、结肠癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌,霍奇金病(hodgkin's disease)、食管癌、小肠癌、内分泌系统癌、甲状腺癌,甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、膀胱癌、肾癌或输尿管癌、肾细胞癌、肾盂癌、间皮瘤、肝细胞癌、胆管癌、中央神经系统(cns)瘤、脊柱轴肿瘤、脑干胶质瘤、多形性成胶质细胞瘤、星形细胞瘤、神经鞘瘤、室管膜瘤、成髓细胞瘤、脑膜瘤、鳞状细胞癌、垂体腺瘤、淋巴瘤、淋巴细胞白血病、包括上述任何癌症的难治形式,或上述一种或多种癌症的组合。
[1260]
根据上述任一实施例的“个体”优选地为人。在另一方面,本发明提供单特异性或双特异性抗ccl2抗体在药物制造或制备中的用途。在一个实施例中,该药物用于治疗癌症。在另一个实施例中,药物用于治疗癌症的方法中,该方法包含向患有癌症的个体施用治疗有效量的药物。在另一个实施例中,该药物用于诱导癌细胞的细胞介导的裂解。在另一个实施例中,该药物用于在患有癌症的个体中诱导癌细胞的细胞介导的裂解的方法,该方法包含对该个体施用有效量的药物以在癌细胞中诱导细胞凋亡/或抑制癌细胞增殖。根据上述任一实施例的“个体”可为人。
[1261]
在另一方面,本发明提供一种治疗癌症的方法。在一个实施例中,该方法包含向患有癌症的个体施用有效量的单特异性或双特异性抗ccl2抗体。根据上述任一实施例的“个体”可为人。
[1262]
在另一方面,本发明提供一种在患有癌症的个体中诱导癌细胞的细胞介导的裂解的方法。在一个实施例中,该方法包含向个体施用有效量的单特异性或双特异性抗ccl2抗体,以在患有癌症的个体中诱导癌细胞的细胞介导的裂解。在一个实施例中,“个体”为人。
[1263]
在本发明的另一方面,提供用于治疗炎性疾病或自身免疫病的单特异性或双特异性抗ccl2抗体。在某些实施例中,本发明提供单特异性或双特异性抗ccl2抗体用于治疗患有炎性疾病或自身免疫病的个体的方法,其包含施用该个体治效量的单特异性或双特异性抗ccl2抗体。
[1264]
在另一方面,本发明提供包含本文所提供的任何单特异性或双特异性抗ccl2抗体的药物制剂,例如用于以上任何治疗方法。在一个实施例中,药物制剂包含本文所提供的任何单特异性或双特异性抗ccl2抗体及药学上可接受的载体。
[1265]
在一些实施例中,炎性疾病或自身免疫病为自身免疫病、炎性疾病、纤维化疾病、粒细胞性(嗜中性或嗜酸性)疾病、单核细胞性疾病或淋巴细胞性疾病、或与正常或异常组织驻留细胞(例如肥大细胞、巨噬细胞或淋巴细胞)或基质细胞(例如成纤维细胞,肌成纤维细胞,平滑肌细胞,上皮细胞或内皮细胞)的数量或分布增加有关的病症。在一些实施例中,
该病症为肺部病症。在一些实施例中,肺部病症是与粒细胞性(嗜酸性和/或嗜中性)肺部炎症、感染诱导的肺部症状(包括与病毒(例如流感、副流感、鼻病毒、人类间质性肺炎病毒和呼吸道合胞病毒)、细菌或真菌(例如曲霉菌)触发物相关的那些。在一些实施例中,病症是过敏原诱导的肺部症状、毒性环境污染物诱导的肺部症状(例如,石棉沉滞、硅肺病或铍病)、胃抽吸引起的肺部症状或与免疫失调或炎性症状相关或具有遗传易感性,例如囊肿纤维化。在一些实施例中,所述疾病是物理创伤诱发的肺部症状(例如,呼吸机损伤)、肺气肿、香烟诱发的肺气肿、支气管炎,结节病、组织细胞增生症、淋巴管肌瘤病、急性肺损伤、急性呼吸窘迫综合征、慢性肺病,支气管肺发育不良、肺炎(例如,社区获得性肺炎、医院获得性肺炎、呼吸机相关性肺炎、病毒性肺炎、细菌性肺炎和重症肺炎)、呼吸道恶化和急性呼吸窘迫综合征(ards)。在一些实施例中,炎性肺疾病是copd。
[1266]
在一些实施例中,炎性肺疾病是哮喘。在一些实施例中,哮喘是具有可能危及生命的恶化症状(加重或发作)急性发作的持续性慢性重症哮喘。在一些实施例中,哮喘是特应性(也称为过敏性)哮喘、非过敏性哮喘(例如,经常由呼吸道病毒(例如,流感、副流感、鼻病毒、人偏肺病毒和呼吸道合胞病毒)感染引起或吸入刺激物(室内或室外甚至冷干空气中的空气污染物、烟雾、柴油颗粒、挥发性化学物质和气体)。
[1267]
在一些实施例中,哮喘是间歇性或运动诱发的哮喘,由于急性或慢性原发或暴露于二手“烟”(通常是香烟、雪茄、烟斗),吸入或“吸气”(烟草、大麻或其他物质)引起的哮喘,或因近期摄入阿司匹林或相关nsaids引发的哮喘。在一些实施例中,哮喘是轻度哮喘或皮质类固醇初发性哮喘、新诊断和未治疗的哮喘,或以先前不需要长期使用吸入的局部或全身性类固醇来控制症状(咳嗽、喘息、气短/呼吸困难或胸痛)。在一些实施例中,哮喘是慢性、皮质类固醇抗性哮喘、皮质类固醇难治性哮喘、不受皮质类固醇或其他慢性哮喘控制药物控制的哮喘。在一些实施例中,自身免疫病、炎性疾病、纤维化疾病、嗜中性细胞疾病或嗜酸性细胞疾病为肺纤维化。在一些实施例中,肺纤维化是特发性肺纤维化(idiopathic pulmonary fibrosis,ipf)。在一些实施例中,自身免疫性疾病、炎性病症、纤维化病症、粒细胞性(嗜中性或嗜酸性)病症,单核细胞性病症或淋巴细胞性病症是食道炎、过敏性鼻炎、非过敏性鼻炎、鼻窦炎伴随鼻息肉、鼻息肉、支气管炎、慢性肺炎、过敏性支气管肺曲菌病、呼吸道炎症、过敏性鼻炎、支气管扩张和/或慢性支气管炎。
[1268]
在一些实施例中,自身免疫病、炎性疾病、纤维化疾病、粒细胞性(嗜中性或嗜酸性)疾病、单核细胞性疾病或淋巴细胞性疾病为关节炎。在一些实施例中,关节炎是类风湿性关节炎。在一些实施例中,关节炎是骨关节炎、类风湿性关节炎、幼年型关节炎、幼年型类风湿性关节炎、早期关节炎、多关节类风湿性关节炎、全身发作性类风湿性关节炎、肠病性关节炎、反应性关节炎、牛皮癣性关节炎和/或受伤引起的关节炎。
[1269]
在一些实施例中自身免疫病、炎性疾病、纤维化疾病、粒细胞性(嗜中性或嗜酸性)疾病、单核细胞性疾病或淋巴细胞性疾病为胃肠炎性疾病。在一些实施例中,胃肠炎性疾病为ibd(炎性肠病)、溃疡性结肠炎(uc)、克罗恩氏病(crohn's disease,cd)、结肠炎(例如,由环境侵害引起的结肠炎(例如,由治疗方案引起或相关,例如化学疗法、放射疗法等)、传染性结肠炎、缺血性结肠炎、胶原性或淋巴细胞性结肠炎、坏死性小肠结肠炎、例如在慢性肉芽肿性疾病或乳糜泻病、食物过敏、胃炎、胃肠炎、传染性胃炎或小肠结肠炎(例如幽门螺杆菌感染的慢性活动性胃炎)以及其他由传染病引起的胃肠道炎症所引起的结肠炎,或不
确定性结肠炎。
[1270]
在一些实施例中,自身免疫病、炎性疾病、纤维化疾病、粒细胞性(嗜中性或嗜酸性)疾病、单核细胞性疾病或淋巴细胞性疾病、或与正常或异常组织驻留细胞(例如肥大细胞、巨噬细胞或淋巴细胞)或基质细胞(例如成纤维细胞、肌成纤维细胞、平滑肌细胞、上皮细胞或内皮细胞)为狼疮或全身性红斑狼疮(systemic lupus erythematosus,sle),或一种或多种狼疮的器官特异性表现(例如,影响肾脏的狼疮肾炎(lupus nephritis,ln)、或影响血液和/或淋巴器官(淋巴结、脾、胸腺和相关的淋巴管)和/或关节和/或其他器官,但不一定肾的肾外狼疮(extra-renal lupus,erl))。在一些实施例中,自身免疫病、炎性疾病或纤维化性疾病是关于败血症和/或创伤、hiv感染或特发性(病因学未知)例如anca相关的血管炎(aav)、肉芽肿性多血管炎(以前称为韦格纳(wegener's)肉芽肿)、白塞氏病(behcet’s disease)、心血管疾病、嗜酸性细胞支气管炎、雷特氏综合征(reiter's syndrome)、sea综合征(血清阴性、肠病、关节炎综合征)、强直性脊柱炎、皮肌炎、硬皮病,例如系统性硬皮病(也称为系统性硬化症)、血管炎(例如巨细胞动脉炎(giant cell arteritis,gca),也称为颞动脉炎、颅动脉炎或霍顿病(horton))、肌炎、多发性肌炎、皮肌炎、结节性多发性动脉炎、动脉炎、风湿性肌痛、结节病、原发性胆汁硬化症、硬化性胆管炎、干燥综合征(sjogren's syndrome)、银屑病、斑块型银屑病、点滴状银屑病、反向银屑病、脓疱型银屑病、红皮病性银屑病、皮炎、特应性皮炎、天疱疮(例如寻常性天疱疮)、动脉粥样硬化、狼疮、斯蒂尔病、重症肌无力、乳糜泻、复发-缓解型(rrms)或原发进行性(ppms)或继发进行性(spms)亚型的多发性硬化症(ms)、格林-巴利(guillain-barre)病、第i型糖尿病(t1dm)或胰岛素依赖型(iddm)或青少年dm型、甲状腺炎(例如graves病)、腹腔疾病、查格-施特劳斯综合征、肌痛综合征、嗜酸性细胞增多综合征、水肿反应包括发作性血管性水肿、蠕虫感染、盘尾性皮炎、嗜酸性食管炎、嗜酸性肠炎、嗜酸性结肠炎、阻塞性睡眠呼吸暂停、心内膜纤维化、阿狄森氏(addison)病、雷诺氏(raynaud)病或现象、自身免疫性肝炎、移植物抗宿主病(gvhd)或器官移植排斥反应。
[1271]
本发明的免疫复合体(及任何其他治疗剂)可通过任何合适的方式施用,包括肠胃外、肺内和鼻内施用,并且如果需要局部治疗,则可以采用病灶内施用。肠胃道外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。给药可通过任何合适的途径进行,例如通过注射,例如静脉内或皮下注射,部分取决于短暂给药还是长期施用。本文中考虑各种给药方案,其包括但不限于在不同时间点单次或多次施用、快速注射施用和脉冲输注。
[1272]
本发明的抗体将按照与良好医学实践一致的方式进行配制、给药和施用。此背景中考虑的因素包括待治疗的具体障碍、待治疗的具体哺乳动物、个体患者的临床病症、障碍的原因、递送药物的部位、施用方法、施用时间表及医疗从业者已知的其他因素。该抗体并非必须、但可以任选与一种或多种目前用于预防或治疗所述疾病的药物一起配制。这些其他药物的有效量取决于制剂中存在的抗体量、疾病或治疗的类型以及上述讨论的其他因素。这些药物通常以与本文中所述相同的剂量和施用途径,或本文中所述剂量的约1%至99%,或以经验上/临床上确定为适当的任意剂量和通过任意途径使用。
[1273]
对于疾病的预防或治疗,本发明的抗体的适当剂量(单独使用或与一种或多种其他治疗剂组合使用)将取决于待治疗的疾病的类型、抗体的类型、疾病的严重度和病程、为了预防或是治疗的目的施用该抗体、先前的治疗、患者的临床病史和对该抗体的反应及主
治医师的判断。在一次或一系列的治疗中适当地对给予患者施用抗体。根据疾病的类型和严重程度不同,约1μg/kg至15mg/kg(例如0.5mg/kg-10mg/kg)的抗体可为用于向患者施用的初始候选剂量,无论是例如通过一次或多次单独施用,还是通过连续输注。根据上述因素,一种典型的日剂量可在约1μg/kg至100mg/kg或更多的范围内。对于在几天或更长时间内重复施用,根据病情,治疗通常将持续进行直到出现所需的疾病症状抑制。抗体的一种示例性剂量将在约0.05mg/kg至约10mg/kg的范围内。因此,可以向患者施用约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg中的一种或多种剂量(或其任意组合)。此等剂量可间歇施用,例如每周或每三周施用(例如使患者接受约2至约20或.例如约6个剂量的抗体)。可以施用初始较高的负荷剂量,然后施用一种或多种较低的剂量。例示性的给药方案包括施用约4mg/kg的初始负荷剂量,然后每周约2mg/kg的抗体维持剂量。然而,可以使用其他剂量方案。通过常规技术和测定很容易检测这种治疗的进展。
[1274]
ii.制品
[1275]
本发明的另一方面提供包含用于治疗、预防和/或诊断上述疾病的制品。制品包括容器及容器上或与容器相关的标签或包装插页。合适的容器包括例如瓶子、小瓶、注射器、静脉注射(iv)溶液袋等。容器可由多种材料例如玻璃或塑料形成。该容器可容纳组合物,该组合物本身或与有效治疗、预防和/或诊断疾病的另一组合物结合使用,并可能具有无菌入口(例如,容器可为具有可通过皮下注射针头穿孔的塞子的静脉注射溶液袋或小瓶)。组合物中的至少一种活性剂是本发明的抗体。标签或包装说明书指示该组合物用于治疗所选择的疾病。此外,该制品可以包括(a)其中含有组合物的第一容器,其中,该组合物包含本发明的抗体;以及(b)其中包含有组合物的第二容器,其中,组合物包含其他细胞毒性或其他治疗剂。本发明的该实施例中的制品可以进一步包含指示组合物可以用于治疗特定疾病的包装说明书。可替代地或另外地,制品可以进一步包含第二(或第三)容器,该容器包含药学上可接受的缓冲剂,例如抑菌注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。从商业和用户角度来看,它可以进一步包含其他材料,其中包括其他缓冲液、稀释剂、过滤器、针头和注射器。
[1276]
在以下本发明具体实施例中列出:
[1277]
1.双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二不同抗原结合位点,其中,该双特异性抗体包含人igg同种型,优选为igg1同种型的fc结构域。
[1278]
2.根据实施例1的双特异性抗体,
[1279]
其中,
[1280]
a)i)所述第一抗原结合位点包含
[1281]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1282]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1283]
ii)所述第二抗原结合位点包含
[1284]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其
包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1285]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1286]
或者
[1287]
b)i)所述第一抗原结合位点包含
[1288]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1289]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1290]
ii)所述第二抗原结合位点包含
[1291]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1292]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
[1293]
或者
[1294]
c)i)所述第一抗原结合位点包含
[1295]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1296]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1297]
ii)所述第二抗原结合位点包含
[1298]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1299]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;
[1300]
或者
[1301]
d)i)所述第一抗原结合位点包含
[1302]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1303]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;并且
[1304]
ii)所述第二抗原结合位点包含
[1305]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其
包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1306]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1307]
或者
[1308]
e)i)所述第一抗原结合位点包含
[1309]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1310]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;并且
[1311]
ii)所述第二抗原结合位点包含
[1312]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;以及
[1313]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1314]
或者
[1315]
f)i)所述第一抗原结合位点包含
[1316]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:49的氨基酸序列;(b)cdr-h2,其包含seq id no:50的氨基酸序列;以及(c)cdr-h3,其包含seq id no:51的氨基酸序列;
[1317]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:52的氨基酸序列;(e)cdr-l2,其包含seq id no:53的氨基酸序列;以及(f)cdr-l3,其包含seq id no:54的氨基酸序列;并且
[1318]
ii)所述第二抗原结合位点包含
[1319]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;以及
[1320]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1321]
或者
[1322]
g)i)所述第一抗原结合位点包含
[1323]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1324]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
[1325]
ii)所述第二抗原结合位点包含
[1326]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其
包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1327]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
[1328]
或者
[1329]
h)i)所述第一抗原结合位点包含
[1330]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1331]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
[1332]
ii)所述第二抗原结合位点包含
[1333]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1334]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;
[1335]
或者
[1336]
i)i)所述第一抗原结合位点包含
[1337]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:1的氨基酸序列;(b)cdr-h2,其包含seq id no:2的氨基酸序列;以及(c)cdr-h3,其包含seq id no:3的氨基酸序列;
[1338]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:4的氨基酸序列;(e)cdr-l2,其包含seq id no:5的氨基酸序列;以及(f)cdr-l3,其包含seq id no:6的氨基酸序列;并且
[1339]
ii)所述第二抗原结合位点包含
[1340]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1341]
以及vl结构域,其包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列。
[1342]
3.根据实施例2的双特异性抗体,
[1343]
其中,
[1344]
a)i)所述第一抗原结合位点包含
[1345]
vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1346]
以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1347]
ii)所述第二抗原结合位点包含
[1348]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1349]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1350]
或者
[1351]
b)i)所述第一抗原结合位点包含
[1352]
vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1353]
以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1354]
ii)所述第二抗原结合位点包含
[1355]
vh结构域,其包含seq id no:23的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1356]
以及vl结构域,其包含seq id no:24的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
[1357]
或者
[1358]
c)i)所述第一抗原结合位点包含
[1359]
vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1360]
以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1361]
ii)所述第二抗原结合位点包含
[1362]
vh结构域,其包含seq id no:15的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1363]
以及vl结构域,其包含seq id no:16的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;
[1364]
或者
[1365]
d)i)所述第一抗原结合位点包含
[1366]
vh结构域,其包含seq id no:23的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1367]
以及vl结构域,其包含seq id no:24的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;并且
[1368]
ii)所述第二抗原结合位点包含
[1369]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1370]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1371]
或者
[1372]
e)i)所述第一抗原结合位点包含
[1373]
vh结构域,其包含seq id no:31的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1374]
以及vl结构域,其包含seq id no:32的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;并且
[1375]
ii)所述第二抗原结合位点包含
[1376]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1377]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1378]
或者
[1379]
f)i)所述第一抗原结合位点包含
[1380]
vh结构域,其包含seq id no:55的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:49的氨基酸序列;(b)cdr-h2,其包含seq id no:50的氨基酸序列;以及(c)cdr-h3,其包含seq id no:51的氨基酸序列;
[1381]
以及vl结构域,其包含seq id no:56的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:52的氨基酸序列;(e)cdr-l2,其包含seq id no:53的氨基酸序列;以及(f)cdr-l3,其包含seq id no:54的氨基酸序列;并且
[1382]
ii)所述第二抗原结合位点包含
[1383]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以
及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1384]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列;
[1385]
或者
[1386]
g)i)所述第一抗原结合位点包含
[1387]
vh结构域,其包含seq id no:15的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1388]
以及vl结构域,其包含seq id no:16的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
[1389]
ii)所述第二抗原结合位点包含
[1390]
vh结构域,其包含seq id no:23的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:17的氨基酸序列;(b)cdr-h2,其包含seq id no:18的氨基酸序列;以及(c)cdr-h3,其包含seq id no:19的氨基酸序列;
[1391]
以及vl结构域,其包含seq id no:24的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:20的氨基酸序列;(e)cdr-l2,其包含seq id no:21的氨基酸序列;以及(f)cdr-l3,其包含seq id no:22的氨基酸序列;
[1392]
或者
[1393]
h)i)所述第一抗原结合位点包含
[1394]
vh结构域,其包含seq id no:15的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:9的氨基酸序列;(b)cdr-h2,其包含seq id no:10的氨基酸序列;以及(c)cdr-h3,其包含seq id no:11的氨基酸序列;
[1395]
以及vl结构域,其包含seq id no:16的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:12的氨基酸序列;(e)cdr-l2,其包含seq id no:13的氨基酸序列;以及(f)cdr-l3,其包含seq id no:14的氨基酸序列;并且
[1396]
ii)所述第二抗原结合位点包含
[1397]
vh结构域,其包含seq id no:31的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1398]
以及vl结构域,其包含seq id no:32的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列;
[1399]
或者
[1400]
i)i)所述第一抗原结合位点包含
[1401]
vh结构域,其包含seq id no:7的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:1的氨基酸序列;(b)cdr-h2,其包含seq id no:2的氨基酸序列;以及(c)cdr-h3,其包含seq id no:3的氨基酸序列;
[1402]
以及vl结构域,其包含seq id no:8的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:4的氨基酸序列;(e)cdr-l2,其包含seq id no:5的氨基酸序列;以及(f)cdr-l3,其包含seq id no:6的氨基酸序列;并且
[1403]
ii)所述第二抗原结合位点包含
[1404]
vh结构域,其包含seq id no:31的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:25的氨基酸序列;(b)cdr-h2,其包含seq id no:26的氨基酸序列;以及(c)cdr-h3,其包含seq id no:27的氨基酸序列;
[1405]
以及vl结构域,其包含seq id no:32的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:28的氨基酸序列;(e)cdr-l2,其包含seq id no:29的氨基酸序列;以及(f)cdr-l3,其包含seq id no:30的氨基酸序列。
[1406]
4.根据权利要求1至3中任一项所述的双特异性抗体,其中,该包含人igg同种型的fc结构域的双特异性抗体为包含人igg1同种型的恒定重链结构域的双特异性抗体。
[1407]
5.根据实施例4的双特异性抗体,其中,当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠时,与施用包含含有突变l234a、l235a、p329g(kabat eu编号)的人igg1同种型的fcγ受体静默恒定重链结构域的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型的恒定重链结构域的双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少两倍(在一个实施例中高至少5倍,在一个实施例中高至少10倍,在一个实施例中高至少20倍)。
[1408]
6.一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二不同表位(特异性地)结合的第二抗原结合位点,
[1409]
其中,双特异性抗体包含人igg同种型的fc结构域,其中,
[1410]
i)所述第一抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
[1411]
vh结构域,其包含seq id no:39的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:33的氨基酸序列;(b)cdr-h2,其包含seq id no:34的氨基酸序列;以及(c)cdr-h3,其包含seq id no:35的氨基酸序列;
[1412]
以及vl结构域,其包含seq id no:40的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:36的氨基酸序列;(e)cdr-l2,其包含seq id no:37的氨基酸序列;以及(f)cdr-l3,其包含seq id no:38的氨基酸序列;并且
[1413]
ii)所述第二抗原结合位点与抗体一样结合ccl2上的相同表位,该抗体包含
[1414]
vh结构域,其包含seq id no:47的氨基酸序列,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:41的氨基酸序列;(b)cdr-h2,其包含seq id no:42的氨基酸序列;以及(c)cdr-h3,其包含seq id no:43的氨基酸序列;
[1415]
以及vl结构域,其包含seq id no:48的氨基酸序列,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:44的氨基酸序列;(e)cdr-l2,其包含seq id no:45的氨基酸序列;以及(f)cdr-l3,其包含seq id no:46的氨基酸序列。
[1416]
7.根据实施例6的双特异性抗体,其中,在与施用包含含有突变l234a、l235a、p329g(kabat eu编号)的人igg1同种型的fcγ受体沉默恒定重链结构域的双特异性抗体后的人ccl2体内清除率(ml/天/kg)相比,施用包含人野生型igg1同种型的恒定重链结构域的
双特异性抗体后,人ccl2的体内清除率(ml/天/kg)高至少15倍(特别是高至少20倍),当由20mg/kg的各双特异性抗体及0.1mg/kg人ccl2所组成的预形成的免疫复合物以10ml/kg的单剂量施用fcrn转基因小鼠。
[1417]
8.一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
[1418]
其中,
[1419]
i)所述第一抗原结合位点包含
[1420]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1421]
以及
[1422]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
[1423]
并且
[1424]
ii)所述第二抗原结合位点包含
[1425]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1426]
以及
[1427]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[1428]
9.一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
[1429]
其中,
[1430]
i)所述第一抗原结合位点包含
[1431]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq idno:58的氨基酸序列gx1ix2fx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;(d)fr-h1,其包含seq id no:63的氨基酸序列qvqlvqsgaevkkpgssvkvsckasggtf;(e)fr-h2,其包含seq id no:64的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:65的氨基酸序列rvtitadeststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:66的氨基酸序列wgqgtlvtvss;
[1432]
以及
[1433]
vl结构域,其包含:(h)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(i)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(j)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;(k)fr-l1,其包含seq id no:67的氨基酸序列
eivltqspatlslspgeratlsc;(l)fr-l2,其包含seq id no:68的氨基酸序列wyqqkpgqaprlliy;(m)fr-l3,其包含seq id no:69的氨基酸序列gvparfsgsgsgtdftltisslepedfavyyc;以及(n)fr-l4,其包含seq id no:70的氨基酸序列gqgtkveik;
[1434]
并且
[1435]
ii)所述第二抗原结合位点包含
[1436]
vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;(d)fr-h1,其包含seq id no:82的氨基酸序列qvqlvqsgaevkkpgssvkvsckasgltis;(e)fr-h2,其包含seq id no:83的氨基酸序列wvrqapgqglewmg;(f)fr-h3,其包含seq id no:84的氨基酸序列rvtitadtststaymelsslrsedtavyycar;以及(g)fr-h4,其包含seq id no:85的氨基酸序列wgqgttvtvss;
[1437]
以及
[1438]
vl结构域,其包含:(h)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(i)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;(j)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;(k)fr-l1,其包含seq id no:86的氨基酸序列diqmtqspsslsasvgdrvtitc;(l)fr-l2,其包含seq id no:87的氨基酸序列wyqqkpgkapkllih;(m)fr-l3,其包含seq id no:88的氨基酸序列gvpsrfsgsgsgtdytltisslqpedfatyyc;以及(n)fr-l4,其包含seq id no:89的氨基酸序列fgggtkveik。
[1439]
10.一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
[1440]
其中,
[1441]
a)i)所述第一抗原结合位点包含
[1442]
vh结构域,其包含seq id no:71的氨基酸序列;
[1443]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1444]
ii)所述第二抗原结合位点包含
[1445]
vh结构域,其包含seq id no:90的氨基酸序列;
[1446]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1447]
或者
[1448]
b)i)所述第一抗原结合位点包含
[1449]
vh结构域,其包含seq id no:71的氨基酸序列;
[1450]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1451]
ii)所述第二抗原结合位点包含
[1452]
vh结构域,其包含seq id no:91的氨基酸序列;
[1453]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1454]
或者
[1455]
c)i)所述第一抗原结合位点包含
[1456]
vh结构域,其包含seq id no:71的氨基酸序列;
[1457]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1458]
ii)所述第二抗原结合位点包含
[1459]
vh结构域,其包含seq id no:90的氨基酸序列;
[1460]
以及vl结构域,其包含seq id no:94的氨基酸序列;或者
[1461]
d)i)所述第一抗原结合位点包含
[1462]
vh结构域,其包含seq id no:72的氨基酸序列;
[1463]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1464]
ii)所述第二抗原结合位点包含
[1465]
vh结构域,其包含seq id no:90的氨基酸序列;
[1466]
以及vl结构域,其包含seq id no:94的氨基酸序列;或者
[1467]
e)i)所述第一抗原结合位点包含
[1468]
vh结构域,其包含seq id no:73的氨基酸序列;
[1469]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1470]
ii)所述第二抗原结合位点包含
[1471]
vh结构域,其包含seq id no:90的氨基酸序列;
[1472]
以及vl结构域,其包含seq id no:93的氨基酸序列;或者
[1473]
f)i)所述第一抗原结合位点包含
[1474]
vh结构域,其包含seq id no:73的氨基酸序列;
[1475]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1476]
ii)所述第二抗原结合位点包含
[1477]
vh结构域,其包含seq id no:90的氨基酸序列;
[1478]
以及vl结构域,其包含seq id no:94的氨基酸序列;或者
[1479]
g)i)所述第一抗原结合位点包含
[1480]
vh结构域,其包含seq id no:73的氨基酸序列;
[1481]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1482]
ii)所述第二抗原结合位点包含
[1483]
vh结构域,其包含seq id no:92的氨基酸序列;
[1484]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1485]
或者
[1486]
h)i)所述第一抗原结合位点包含
[1487]
vh结构域,其包含seq id no:73的氨基酸序列;
[1488]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1489]
ii)所述第二抗原结合位点包含
[1490]
vh结构域,其包含seq id no:91的氨基酸序列;
[1491]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1492]
或者
[1493]
i)i)所述第一抗原结合位点包含
[1494]
vh结构域,其包含seq id no:72的氨基酸序列;
[1495]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1496]
ii)所述第二抗原结合位点包含
[1497]
vh结构域,其包含seq id no:90的氨基酸序列;
[1498]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1499]
或者
[1500]
j)i)所述第一抗原结合位点包含
[1501]
vh结构域,其包含seq id no:72的氨基酸序列;
[1502]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1503]
ii)所述第二抗原结合位点包含
[1504]
vh结构域,其包含seq id no:92的氨基酸序列;
[1505]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1506]
或者
[1507]
k)i)所述第一抗原结合位点包含
[1508]
vh结构域,其包含seq id no:72的氨基酸序列;
[1509]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1510]
ii)所述第二抗原结合位点包含
[1511]
vh结构域,其包含seq id no:91的氨基酸序列;
[1512]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1513]
或者
[1514]
l)i)所述第一抗原结合位点包含
[1515]
vh结构域,其包含seq id no:74的氨基酸序列;
[1516]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1517]
ii)所述第二抗原结合位点包含
[1518]
vh结构域,其包含seq id no:90的氨基酸序列;
[1519]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1520]
或者
[1521]
m)i)所述第一抗原结合位点包含
[1522]
vh结构域,其包含seq id no:74的氨基酸序列;
[1523]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1524]
ii)所述第二抗原结合位点包含
[1525]
vh结构域,其包含seq id no:90的氨基酸序列;
[1526]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1527]
或者
[1528]
n)i)所述第一抗原结合位点包含
[1529]
vh结构域,其包含seq id no:74的氨基酸序列;
[1530]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1531]
ii)所述第二抗原结合位点包含
[1532]
vh结构域,其包含seq id no:92的氨基酸序列;
[1533]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1534]
或者
[1535]
o)i)所述第一抗原结合位点包含
[1536]
vh结构域,其包含seq id no:74的氨基酸序列;
[1537]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1538]
ii)所述第二抗原结合位点包含
[1539]
vh结构域,其包含seq id no:91的氨基酸序列;
[1540]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1541]
或者
[1542]
p)i)所述第一抗原结合位点包含
[1543]
vh结构域,其包含seq id no:71的氨基酸序列;
[1544]
以及vl结构域,其包含seq id no:75的氨基酸序列;并且
[1545]
ii)所述第二抗原结合位点包含
[1546]
vh结构域,其包含seq id no:92的氨基酸序列;
[1547]
以及vl结构域,其包含seq id no:93的氨基酸序列。
[1548]
11.一种(分离的)双特异性抗体,其包含与人ccl2上的第一表位(特异性地)结合的第一抗原结合位点及与人ccl2上的第二表位(特异性地)结合的第二抗原结合位点,
[1549]
其中,
[1550]
a)i)所述第一抗原结合位点包含
[1551]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1552]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1553]
ii)所述第二抗原结合位点包含
[1554]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d;
[1555]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
[1556]
或者
[1557]
b)i)所述第一抗原结合位点包含
[1558]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、
94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v,x2为p,且x3为h;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1559]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1560]
ii)所述第二抗原结合位点包含
[1561]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为e;
[1562]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f且x2为r;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w;
[1563]
或者
[1564]
c)i)所述第一抗原结合位点包含
[1565]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1566]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1567]
ii)所述第二抗原结合位点包含
[1568]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1569]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、
93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1570]
或者
[1571]
d)i)所述第一抗原结合位点包含
[1572]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1573]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1574]
ii)所述第二抗原结合位点包含
[1575]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1576]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1577]
或者
[1578]
e)i)所述第一抗原结合位点包含
[1579]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1580]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1594]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1595]
ii)所述第二抗原结合位点包含
[1596]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1597]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1598]
或者
[1599]
h)i)所述第一抗原结合位点包含
[1600]
vh结构域序列,其与seq id no:73的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1601]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1602]
ii)所述第二抗原结合位点包含
[1603]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1604]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)
cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1605]
或者
[1606]
i)i)所述第一抗原结合位点包含
[1607]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1608]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1609]
ii)所述第二抗原结合位点包含
[1610]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1611]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1612]
或者
[1613]
j)i)所述第一抗原结合位点包含
[1614]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1615]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1616]
ii)所述第二抗原结合位点包含
[1617]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、
94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1618]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1619]
或者
[1620]
k)i)所述第一抗原结合位点包含
[1621]
vh结构域序列,其与seq id no:72的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1622]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1623]
ii)所述第二抗原结合位点包含
[1624]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1625]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1626]
或者
[1627]
l)i)所述第一抗原结合位点包含
[1628]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1629]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1630]
ii)所述第二抗原结合位点包含
[1631]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1632]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1633]
或者
[1634]
m)i)所述第一抗原结合位点包含
[1635]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1636]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1637]
ii)所述第二抗原结合位点包含
[1638]
vh结构域序列,其与seq id no:90的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1639]
以及vl结构域序列,其与seq id no:94的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1640]
或者
[1641]
n)i)所述第一抗原结合位点包含
[1642]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1643]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1644]
ii)所述第二抗原结合位点包含
[1645]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1646]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1647]
或者
[1648]
o)i)所述第一抗原结合位点包含
[1649]
vh结构域序列,其与seq id no:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1650]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1651]
ii)所述第二抗原结合位点包含
[1652]
vh结构域序列,其与seq id no:91的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序
列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1653]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r;
[1654]
或者
[1655]
p)i)所述第一抗原结合位点包含
[1656]
vh结构域序列,其与seq id no:71的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1657]
以及vl结构域序列,其与seq id no:75的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;并且
[1658]
ii)所述第二抗原结合位点包含
[1659]
vh结构域序列,其与seq id no:92的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vh结构域包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1660]
以及vl结构域序列,其与seq id no:93的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,其中,该vl结构域包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[1661]
12.根据实施例8至11中任一项的双特异性抗体,其中,该双特异性抗体为人igg同种型,优选为人igg1同种型的fc结构域。
[1662]
13.根据实施例8至11中任一项的双特异性抗体,其中,该双特异性抗体包含人igg同种型,优选为人igg1同种型的恒定结构域。
[1663]
14.根据前述实施例中任一项的双特异性抗体,其中,该双特异性抗体
[1664]
i)在体外阻断ccl2与其受体ccr2的结合(报告基因测定,ic
50
=0.5nm);和/或
[1665]
ii)在体外抑制髓样细胞的ccl2介导趋化性(ic
50
=1.5nm);和/或
[1666]
iii)与食蟹猕猴及人ccl2有交叉反应。
[1667]
15.根据任一实施例中任一项的双特异性抗体,其中,该双特异性抗体与其他ccl
同源物无交叉反应(显示与结合ccl2相比,与其他ccl同源物(选自ccl8、ccl7和ccl13的组)的结合降低100倍。
[1668]
16.根据前述实施例中任一项的双特异性抗体,其中,该双特异性抗体以离子依赖性方式与人ccl2上的第一和第二表位结合。
[1669]
17.根据前述实施例中任一项的双特异性抗体,其中,该双特异性抗体以ph依赖性方式与人ccl2结合,且其中,该第一抗原结合位点和该第二抗原结合位点均在中性ph下以比在酸性ph下更高的亲和力与ccl2结合。
[1670]
18.根据前述实施例中任一项的双特异性抗体,其中,该双特异性抗体在ph 7.4下以比在ph 5.8下高10倍的亲和力与人ccl2结合。
[1671]
19.根据前述权利要求中任一项的双特异性抗体,其中,该双特异性抗体包含含有以下突变(kabat eu编号(中的一者或多者的人igg1重链恒定结构域
[1672]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1673]
ii)l234y、l235w、g236n、p238d、t250v、v264i、t307ph268d、q295l、k326t和/或a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);和/或
[1674]
iii)m428l、n434a和/或y436t(适于增加对fcrn的亲和力以延长血浆半衰期);和/或
[1675]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1676]
20.根据前述实施例中任一项的双特异性抗体,其中,该双特异性抗体包含含有以下突变(kabat eu编号)中的一个或多个的人igg1
[1677]
重链恒定结构域
[1678]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1679]
ii)l235w、g236n、h268d、q295l、k326t和/或a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);和/或
[1680]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);和/或
[1681]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1682]
21.根据前述任一实施例的双特异性抗体,其中,所述双特异性抗体包含含有下列突变(kabat eu编号)的人igg1重链恒定结构域
[1683]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1684]
ii)l235w、g236n、h268d、q295l、k326t和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1685]
iii)n434a(适于增加与fcrn的亲和力以延长血浆半衰期);以及
[1686]
iv)q438r和s440e(适于抑制类风湿因子结合)。
[1687]
22.根据前述权利要求中任一项的双特异性抗体,其中,该双特异性抗体包含含有以下突变(kabat eu编号(中的一者或多者的人igg1重链恒定结构域
[1688]
i)q311r和/或p343r(适于增加pi以增强抗原的摄取);和/或
[1689]
ii)l234y、p238d、t250v、v264i、t307v和/或a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);和/或
[1690]
iii)m428l、n434a和/或y436t(适于增加对fcrn的亲和力以延长血浆半衰期);和/或
[1691]
iv)q438r和/或s440e(适于抑制类风湿因子结合)。
[1692]
23.根据前述权利要求中任一项的双特异性抗体,其中,该双特异性抗体包含含有以下突变(kabat eu编号(中的一者或多者的人igg1重链恒定结构域
[1693]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1694]
ii)l234y、p238d、t250v、v264i、t307v和a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);以及
[1695]
iii)m428l、n434a和y436t(适于增加对fcrn的亲和力以延长血浆半衰期);以及
[1696]
iv)q438r和s440e(适于抑制类风湿因子)结合。
[1697]
24.根据前述权利要求中任一项的双特异性抗体,其中,该双特异性抗体包含含有以下突变(kabat eu编号(中的一者或多者的人igg1重链恒定结构域
[1698]
i)q311r和p343r(适于增加pi以增强抗原的摄取);以及
[1699]
ii)l234y、p238d、t250v、v264i、t307v和a330k(适于增加与人fcgriib的亲和力和降低与其他人fcgr的亲和力);以及
[1700]
iii)n434a(适于增加对fcrn的亲和力以延长血浆半衰期);以及
[1701]
iv)q438r和s440e(适于抑制类风湿因子)结合。
[1702]
25.根据前述任一实施例的双特异性其中,所述双特异性抗体包含含有下列突变(eu编号)的二种人igg1重链恒定结构域
[1703]
i)在重链恒定结构域之一中的s354c和t366w
[1704]
ii)在其他重链恒定结构域中的y349c、t366s、l368a、y407v26.一种与人ccl2(特异性地)结合的(分离的)抗体,
[1705]
其中,该抗体包含
[1706]
a)vh结构域,其包含:(a)cdr-h1,其包含seq id no:57的氨基酸序列shygxs,其中,x为i或t;(b)cdr-h2,其包含seq id no:58的氨基酸序列gx1ix2ifx3tanyaqkfqg,其中,x1为v、i或h,x2为p或h,且x3为h或g;以及(c)cdr-h3,其包含seq id no:59的氨基酸序列ydahygeldf;
[1707]
以及
[1708]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:60的氨基酸序列rasqhvsdayla;(e)cdr-l2,其包含seq id no:61的氨基酸序列dasdrae;以及(f)cdr-l3,其包含seq id no:62的氨基酸序列hqyihlhsft;
[1709]
或者
[1710]
b)vh结构域,其包含:(a)cdr-h1,其包含seq id no:76的氨基酸序列htymh;(b)cdr-h2,其包含seq id no:77的氨基酸序列ridpxnhntkfdpkfqg,其中,x为d或e;以及(c)cdr-h3,其包含seq id no:78的氨基酸序列gvfgffxh,其中,x为d或e;
[1711]
以及
[1712]
vl结构域,其包含:(d)cdr-l1,其包含seq id no:79的氨基酸序列kax1ediynrx2a,其中,x1为f或t且x2为r或l;(e)cdr-l2,其包含seq id no:80的氨基酸序列gatsleh;以及(f)cdr-l3,其包含seq id no:81的氨基酸序列qqfxsapyt,其中,x为w或r。
[1713]
27.一种与人ccl2(特异性地)结合的(分离的)抗体,
[1714]
其中,该抗体包含
[1715]
a)vh结构域,其包含seq id no:71的氨基酸序列;
[1716]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1717]
或者
[1718]
b)vh结构域,其包含seq id no:72的氨基酸序列;
[1719]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1720]
或者
[1721]
c)vh结构域,其包含seq id no:73的氨基酸序列;
[1722]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1723]
或者
[1724]
d)vh结构域,其包含seq id no:74的氨基酸序列;
[1725]
以及vl结构域,其包含seq id no:75的氨基酸序列;
[1726]
或者
[1727]
e)vh结构域,其包含seq id no:90的氨基酸序列;
[1728]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1729]
或者
[1730]
f)vh结构域,其包含seq id no:91的氨基酸序列;
[1731]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1732]
或者
[1733]
g)vh结构域,其包含seq id no:92的氨基酸序列;
[1734]
以及vl结构域,其包含seq id no:93的氨基酸序列;
[1735]
或者
[1736]
h)vh结构域,其包含seq id no:90的氨基酸序列;
[1737]
以及vl结构域,其包含seq id no:94的氨基酸序列;
[1738]
28.编码根据前述任一实施例的抗体的分离的核酸。
[1739]
29.一种宿主细胞,其包含如实施例28的核酸。
[1740]
30.一种产生抗体的方法,其包含培养实施例29的宿主细胞,从而产生抗体。
[1741]
31.如实施例第30项的方法,其进一步包含自该宿主细胞回收该抗体。
[1742]
32.一种医药制剂,其包含根据实施例1至25中任一项的双特异性抗体及药学上可接受的载体。
[1743]
33.根据实施例1至25中任一项的双特异性抗体,其用作药物。
[1744]
34.根据实施例1至25中任一项的双特异性抗体,其用于治疗癌症。
[1745]
35.根据实施例1至25中任一项的双特异性抗体,其用于治疗炎性疾病或自身免疫病。
[1746]
36.根据实施例1至25中任一项的双特异性抗体在制备药物中的用途。
[1747]
37.如实施例36的用途,其中,该药物用于治疗癌症。
[1748]
38.如实施例36的用途,其中,该药物用于治疗炎性疾病或自身免疫病。
[1749]
39.一种治疗患有癌症的个体的方法,其包含对该个体施用有效量的根据实施例1至25中任一项的双特异性抗体。
[1750]
40.一种治疗患有炎性疾病或自身免疫病的个体的方法,其包含向该个体施用有
效量的根据实施例1至25中任一项的双特异性抗体。
[1751]
提供以下实施例和图式以帮助理解本发明,其真实范围在后附的权利要求书中阐明。应理解的是,在不背离本发明精神的前提下,可对所提出的方法进行修改。
[1752]
氨基酸序列说明
[1753]
与不同表位结合的抗ccl2抗原结合部分(可变区和高变区(cdr)):
[1754]
[1755]
[1756]
[1757]
[1758][1759][1760]
cdr修饰抗ccl2抗原结合部分(可变区和高变区(cdr)):
[1761]
修饰的cnto888
[1762]
[1763][1764]
修饰的人源化11k2
[1765]
[1766]
[1767][1768]
示例性恒定轻链区:
[1769]
seq id no:95示例性人κ轻链恒定区
[1770]
seq id no:96示例性人λ轻链恒定区
[1771]
示例性恒定重链区:
[1772]
seq id no:97源自igg1的示例性人重链恒定区
[1773]
seq id no:98源自igg1具有突变l234a、l235a和p329g的示例性人重链恒定区(fcγ受体沉默)
[1774]
seq id no:99源自igg1的示例性人重链恒定区(sg1-igg1同种异型)seq id no:100源自具有突变的igg1的示例性人重链恒定区(sg105-igg1同种异型-fcγ受体沉默)
[1775]
seq id no:101sg1095-源自igg1的示例性人重链恒定区,包括突变(kabat eu编号):
[1776]-l235w/g236n/h268d/q295l/a330k/k326t(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[1777]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取;
[1778]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期;以及
[1779]-q438r/s440e(适于抑制类风湿因子结合
[1780]
seq id no:102sg1099-源自igg1的示例性人重链恒定区,包括突变(kabat eu编号):
[1781]
q311r/p343r(适于增加pi以增强抗原的摄取)
[1782]
seq id no:103sg1100-源自igg1的示例性人重链恒定区,包括突变(kabat eu编号):
[1783]-q311r/p343r(适于增加pi以增强抗原的摄取);
[1784]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[1785]-q438r/s440e(适于抑制类风湿因子结合)cnto888//11k2-wt igg1(示例性双特异性cnto888//11k2-wt igg1 crossmab)
[1786]
seq id no:104重链1-cnto888//11k2-wt igg1
[1787]
seq id no:105重链2-cnto888//11k2-wt igg1
[1788]
seq id no:106轻链1-cnto888//11k2-wt igg1
[1789]
seq id no:107轻链2-cnto888//11k2-wt igg1
[1790]
cklo2
–
igg1(示例性双特异性cklo2 igg1 crossmab)
[1791]
seq id no:108重链1-cklo2 igg1
[1792]
seq id no:109重链2-cklo2 igg1
[1793]
seq id no:110轻链1-cklo2 igg1
[1794]
seq id no:111轻链2-cklo2 igg1
[1795]
cklo2
–
sg1095(示例性双特异性clok2 crossmab,包括sg1095fc突变)
[1796]
seq id no:112重链1-cklo2
–
sg1095
[1797]
seq id no:113重链2-cklo2
–
sg1095
[1798]
seq id no:114轻链1-cklo2
–
sg1095
[1799]
seq id no:115轻链2-cklo2
–
sg1095
[1800]
cklo2
–
sg1099(示例性双特异性cklo2 crossmab,包括sg1099fc突变)
[1801]
seq id no:116重链1-cklo2
–
sg1099
[1802]
seq id no:117重链2-cklo2
–
sg1099
[1803]
seq id no:118轻链1-cklo2
–
sg1099
[1804]
seq id no:119轻链2-cklo2
–
sg1099
[1805]
cklo2
–
sg1100(示例性双特异性cklo2 crossmab,包括sg1100fc突变)
[1806]
seq id no:120重链1-cklo2
–
sg1100
[1807]
seq id no:121重链2-cklo2
–
sg1100
[1808]
seq id no:122轻链1-cklo2
–
sg1100
[1809]
seq id no:123轻链2-cklo2
–
sg1100
[1810]
cklo3
–
sg1095(示例性双特异性clok3 crossmab,包括sg1095fc突变)
[1811]
seq id no:124重链1-cklo3
–
sg1095
[1812]
seq id no:125重链2-cklo3
–
sg1095
[1813]
seq id no:126轻链1-cklo3
–
sg1095
[1814]
seq id no:127轻链2-cklo3
–
sg1095
[1815]
cklo3
–
sg1099(示例性双特异性cklo3 crossmab,包括sg1099fc突变)
[1816]
seq id no:128重链1-cklo3
–
sg1099
[1817]
seq id no:129重链2-cklo3
–
sg1099
[1818]
seq id no:130轻链1-cklo3
–
sg1099
[1819]
seq id no:131轻链2-cklo3
–
sg1099
[1820]
cklo3
–
sg1100(示例性双特异性cklo3 crossmab,包括sg1100fc突变)
[1821]
seq id no:132重链1-cklo3
–
sg1100
[1822]
seq id no:133重链2-cklo3
–
sg1100
[1823]
seq id no:134轻链1-cklo3
–
sg1100
[1824]
seq id no:135轻链2-cklo3
–
sg1100
[1825]
其他抗ccl2抗原结合部分:
[1826]
seq id no:136重链可变结构域vh 2f2
[1827]
seq id no:137轻链可变结构域vl 2f2
[1828]
seq id no:138重链可变结构域vh鼠11k2(=11k2m)
[1829]
seq id no:139轻链可变结构域vl鼠11k2(=11k2m)
[1830]
seq id no:140重链可变结构域vh 1h11
[1831]
seq id no:141轻链可变结构域vl 1h11
[1832]
示例性ccl2和同源物(无信号肽):
[1833]
seq id no:142示例性人ccl2(mcp1)-野生型(wt)
[1834]
seq id no:143示例性的人ccl2(mcp1)
–
p8a变体
[1835]
seq id no:144示例性的人ccl2(mcp1)
–
t10c变体
[1836]
seq id no:145示例性人ccl8(mcp2)-野生型(wt)
[1837]
seq id no:146示例性的人ccl8(mcp2)
–
p8a变体
[1838]
seq id no:147示例性人ccl7(mcp3)-野生型(wt)
[1839]
seq id no:148示例性人ccl13(mcp4)-野生型(wt)
[1840]
seq id no:149示例性食蟹猕猴ccl2-野生型(wt)
[1841]
seq id no:150示例性小鼠ccl2-野生型(wt)
[1842]
其他示例性恒定重链区:
[1843]
seq id no:151gg01-源自igg1的示例性人重链恒定区,包括突变(kabat eu编号):
[1844]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[1845]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[1846]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[1847]-q438r/s440e(适于抑制类风湿因子结合)
[1848]
seq id no:152gg02-源自igg1的示例性人重链恒定区,包括突变(kabat eu编号):
[1849]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[1850]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[1851]-m428l/n434a/y436t(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[1852]-q438r/s440e(适于抑制类风湿因子结合)
[1853]
seq id no:153gg03-源自igg1(包含igg1同种异型序列)的示例性人重链恒定区,包括突变(kabat eu编号):
[1854]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[1855]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[1856]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[1857]-q438r/s440e(适于抑制类风湿因子结合)
[1858]
seq id no:154gg04-源自igg1(包含igg1同种异型序列)的人
[1859]
重链恒定区,包括突变(kabat eu编号):
[1860]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[1861]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[1862]-m428l/n434a/y436t(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[1863]-q438r/s440e(适于抑制类风湿因子结合)
[1864]
cklo2
–
gg01(示例性双特异性clok2 crossmab,包括gg01 fc突变)
[1865]
seq id no:155重链1-cklo2
–
gg01
[1866]
seq id no:156重链2-cklo2
–
gg01
[1867]
seq id no:157轻链1-cklo2
–
gg01
[1868]
seq id no:158轻链2-cklo2
–
gg01
[1869]
cklo2
–
gg02(示例性双特异性clok2 crossmab,包括gg02 fc突变)
[1870]
seq id no:159重链1-cklo2 gg02
[1871]
seq id no:160重链2-cklo2 gg02
[1872]
seq id no:161轻链1-cklo2 gg02
[1873]
seq id no:162轻链2-cklo2 gg02
[1874]
cklo2
–
gg03(示例性双特异性clok2 crossmab,包括gg03 fc突变)
[1875]
seq id no:163重链1-cklo2
–
gg03
[1876]
seq id no:164重链2-cklo2
–
gg03
[1877]
seq id no:165轻链1-cklo2
–
gg03
[1878]
seq id no:166轻链2-cklo2
–
gg03
[1879]
cklo2
–
gg04(示例性双特异性cklo2 crossmab,包括gg04 fc突变)
[1880]
seq id no:167重链1-cklo2
–
gg04
[1881]
seq id no:168重链2-cklo2
–
gg04
[1882]
seq id no:169轻链1-cklo2
–
gg04
[1883]
seq id no:170轻链2-cklo2
–
gg04
[1884]
cklo2
–
gg03/gg04(示例性双特异性cklo2 crossmab,包括在突出物(knob)链中的gg03 fc突变和在孔(hole)链中的gg04 fc突变)
[1885]
seq id no:171重链1-cklo2
–
gg03/gg04
[1886]
seq id no:172重链2-cklo2
–
gg03/gg04
[1887]
seq id no:173轻链1-cklo2
–
gg03/gg04
[1888]
seq id no:174轻链2-cklo2
–
gg03/gg04
[1889]
用于本文所述的抗ccl2双特异性抗体的指定单特异性未修饰的抗ccl2抗体/抗原结合部分
[1890][1891][1892]
指定具有未修饰的vh/vl的双特异性抗ccl2为具有包括突变l234a、l235a和p329g(pglala)的igg1或igg1的crossmabs(参见wo 2016/016299)
[1893]
双特异性抗ccl2抗体别名11k2//1g9-wt igg1ccl2-004911k2//1g9-pglalaccl2-0043cnto888//11k2-wt igg1ccl2-0048cnto888//11k2-pglalaccl2-0042cnto888//1g9-wt igg1ccl2-0051cnto888//1g9-pglalaccl2-0045cnto888//1a5-wt igg1ccl2-0050cnto888//1a5-pglalaccl2-00441a5//1g9-wt igg1ccl2-00521a5//1g9-pglalaccl2-004611k2//2f6-wt igg1ccl2-005611k2//2f6-pglalaccl2-0053abn912//11k2-wt igg1ccl2-0047abn912//11k2-pglalaccl2-00411a4//2f6-wt igg1ccl2-00571a4//2f6-pglalaccl2-00541a5//2f6-wt igg1ccl2-00581a5//2f6-pglalaccl2-0055
[1894]
指定具有修饰的vh/vl的双特异性抗体为crossmab(参见wo 2016/016299)。根据所使用的重链恒定结构域(例如igg1野生型,pglala,sg1095,sg1099、1100),添加后缀igg1野生型,pglala,sg1095,sg1099、1100
[1895]
[1896][1897]
实施例:
[1898]
实施例a-1单特异性抗ccl2抗体
[1899]
单特异性抗ccl2抗体和ccl2抗原的生成
[1900]
重组dna技术
[1901]
使用标准方法操作dna,如叙述于sambrook,j.等人,molecular cloning:a laboratory manual;cold spring harbor laboratory press,cold spring harbor,new york,1989。根据制造商的说明书使用分子生物学试剂。
[1902]
基因和寡核苷酸合成
[1903]
在geneart gmbh(regensburg,germany),通过化学合成制备所需的基因片段。将合成的基因片段克隆至大肠杆菌质粒中以进行增殖/扩增。通过dna测序验证亚克隆基因片段的dna序列。或者,通过退火(annealing)化学合成的寡核苷酸或经由pcr来组装短的合成dna片段。通过metabion gmbh(planegg-martinsried,germany)制备对应的寡核苷酸由。metabion gmbh(德国planegg-martinsried)制备。
[1904]
基本/标准哺乳动物表达质粒的描述
[1905]
为了表达所需的基因/蛋白质(例如全长抗体重链、全长抗体轻链或ccl-2分子),使用包含下列功能元件的转录单位:
[1906]-来自包括内含子a的人巨细胞病毒(p-cmv)的立即早期增强子和启动子,
[1907]-人重链免疫球蛋白5’非翻译区(5'utr),
[1908]-鼠免疫球蛋白重链信号序列,
[1909]-待表达的基因/蛋白质(例如全长抗体重链或抗体轻链或ccl-2分子),和
[1910]-牛生长激素聚腺苷酸化序列(bgh pa)。
[1911]
除了包括所待表达的基因的表达单元/盒外,基本/标准的哺乳动物表达质粒含有
[1912]
来自载体puc18的复制起始点,其允许此质粒在大肠杆菌中复制,及
[1913]
β-内酰胺酶基因,其在大肠杆菌中赋予氨苄青霉素(ampicillin)抗性。
[1914]
用于重组单克隆抗体和ccl-2分子的表达质粒的生成
[1915]
用于瞬时表达单克隆抗体和ccl-2抗原的表达质粒除各自的表达盒外,还包含来自载体puc18的复制起始点(其可允许该质粒在大肠杆菌中复制),及赋予大肠杆菌氨苄青霉素抗性的β-内酰胺酶基因。
[1916]
对应的免疫球蛋白hc或lc或ccl-2分子的转录单位包含以下功能元件:
[1917]-来自包括内含子a的人巨细胞病毒(p-cmv)的立即早期增强子和启动子,
[1918]-人重链免疫球蛋白5’非翻译区(5'utr),
[1919]-鼠免疫球蛋白重链信号序列,及
[1920]-牛生长激素聚腺苷酸化序列(bgh pa)。
[1921]
各自的抗体1a4、1a5、1g9、2f6、cnto888、鼠源及人源化11k2、abn912基于它们的vh和vl被生成作为igg1野生型及作为igg1pglala/具有κ轻链的效应子沉默fc
[1922]
瞬时表达与纯化
[1923]
通过瞬时转染在f17培养基(invitrogen corp.)中培养的hek293细胞(人胚胎肾细胞系293来源)执行重组生产。为了产生单克隆抗体,将细胞与含有各自免疫球蛋白重链及轻链的质粒共转染。对于转染,使用“293-fectin”转染试剂(invitrogen)。按照制造商的说明执行转染。转染后三至七(3-7)天收获细胞培养上清液。将上清液在降低的温度(例如-80℃)下保存。
[1924]
关于人免疫球蛋白在例如hek293细胞中的重组表达的一般信息,提供于:meissner,p.等人,biotechnol.bioeng.75(2001)197-203。
[1925]
使用mabselectsure-sepharosetm(ge healthcare,sweden)和superdex200尺寸排阻(ge healthcare,sweden)色谱,通过亲和性色谱从细胞培养上清液中纯化抗体。简而言之,在以pbs缓冲液(10mm na2hpo4、1mm kh2po4、137mm nacl和2.7mm kcl,ph 7.4)平衡的mabselect sure树脂上捕获无菌过滤的细胞培养上清液,以平衡缓冲液洗涤并以25mm柠檬酸钠在ph 3.0下洗脱。合并洗脱的蛋白级分,以ph 9.0的2m tris中和,并使用以20mm组氨酸,140mm nacl,ph 6.0平衡的superdex 200 26/60gl(ge healthcare,sweden)柱,通过尺寸排阻色谱法进一步纯化。通过ce-sds(caliper life science,usa)分析尺寸排阻色谱级分,并将包含抗体的级分合并并储存在-80℃。
[1926]
重组ccl2的生成
[1927]
野生型ccl2可以作为单体存在,但实际上也可在生理浓度下形成二聚体。这种单体-二聚体的平衡可能是不同的,在所有可能使用不同浓度的体外实验中,都必须谨慎考虑。为了避免任何不确定性,我们生成了点突变ccl2变体:ccl2的p8a变体在二聚化界面中携带突变,造成无法形成导致定义的纯ccl2单体的二聚体。相反地,ccl2的t10c变体导致ccl2的固定二聚体(j am chem soc.2013mar 20;135(11):4325-32)。
[1928]
使用sp-sepharose hp(ge healthcare,sweden)和superdex 200尺寸排阻(ge healthcare,sweden)色谱,通过阳离子交换色谱从细胞培养上清液中纯化各自的可溶性
ccl2蛋白质(野生型,p8a或t10c变体)。简而言之,将无菌过滤的细胞培养物上清液以10mm kh2po4,ph 5.0稀释,以调节电导率《4ms/cm。将稀释的上清液上样至以10mm kh2po4,ph 5.0平衡的sp-sepharose树脂上,以平衡缓冲液洗涤,并使用梯度至10mm kh2po4、1m nacl,ph 5.0的溶液洗脱。合并洗脱的蛋白质级分,并使用以20mm组氨酸,140mm nacl,ph 6.0平衡的superdex 200 16/60gl(ge healthcare,sweden)柱,通过尺寸排阻色谱法进一步纯化。通过sds-page和分析型高性能尺寸排阻色谱来分析尺寸排阻色谱级分。合并含有ccl2的级分,并储存在-80℃。
[1929]
功能表征(结合)
[1930]
t200仪器安装有biacore series s sensor chip cm5。系统缓冲液为hbs-et(10mm hepes(ph 7.4),150mm nacl,1mm edta,0.05%(w/v)p20)。系统设定为37℃,对于每次测量,样品缓冲液均为系统缓冲液,另外还补充有1mg/ml cmd(羧甲基葡聚醣,fluka)。
[1931]
建立抗体捕获系统。如制造商所述,通过edc/nhs耦合将14000garfcγ(山羊抗兔fcγ)111-005-046,jackson immunoresearch)在25℃以25μg/ml固定于ph 5.0的10mm乙酸钠缓冲液中。通过以hbs缓冲液(100mm hepes ph 7.4,1.5m nacl,0.05%(w/v)tween 20)注入15秒钟,以20μl/min的速度将捕获系统再生,以10mm甘氨酸缓冲液ph 2.0注入1分钟,然后以10mm甘氨酸缓冲液ph 2.25两次注入1分钟。在另一个实施例中,通过将12700ru多克隆兔抗小鼠(ramigg,ge healthcare)抗体固定在如上所述的biacore series cm5传感器上,将鼠类单克隆抗体捕获在生物传感器上。通过3分钟注入ph 1.7的10mm甘氨酸缓冲液来再生传感器。
[1932]
将抗体克隆上清液在系统缓冲液中以1:2稀释,并以5μl/min捕获1分钟。捕获抗体后,将系统以2.5倍浓缩系统缓冲液以80μl/min的速度洗涤30秒钟,然后进行2分钟的基线稳定。以30μl/min进行分析物动力学。作为溶液中的分析物,使用wt人ccl2或单体ccl2 p8a变体ccl2。以90nm最高浓度注入分析物。分析物接触时间为3分钟,解离时间为10分钟,根据制造商gehc的说明使用biaevaluation软件v.3.0。应用具有rmax局部性的1:1结合模型来明显估计动力学速率。
[1933]
抗体与野生型(wt)人ccl2及人ccl2 p8a变体(单体)的结合
[1934][1935][1936]
从spr分析i所获得的总结ph依赖性ccl2结合动力学
[1937]
t200仪器安装有biacore series s sensor chip cm5。系统缓冲液为hbs-et(10mm hepes(ph 7.4),150mm nacl,1mm edta,0.05%(w/v)p20)。在其他实施例中,将系统
缓冲液的ph设置为ph 8.3、ph 7.9、ph 7.4、ph 7.1、ph 6.7、ph 6.3、ph 5.9、ph 5.5。系统设定为25℃,对于每次测量,样品缓冲液均为系统缓冲液,另外还补充有1mg/ml cmd(羧甲基葡聚醣,fluka)。
[1938]
建立抗体捕获系统。如制造商所述,通过edc/nhs耦合,将13000mab《h-fc-pan》m-r10z8e9-igg(roche)在25℃下以18g/ml固定在ph 5.0的10mm乙酸钠缓冲液中。通过以20μl/min注入hbs缓冲液(100mm hepes ph 7.4,1.5m nacl,0.05%(w/v)tween 20)将捕获系统再生,然后以10mm naoh进行1分钟15秒的注入及两次10mm甘氨酸缓冲液ph 2.5注入1分钟,各自的系统缓冲液中,以80nm浓度稀释的捕获抗体以10μl/min注入30秒钟。捕获抗体后,将系统以2.5倍浓缩系统缓冲液以50μl/min的速度洗涤30秒钟,然后进行2分钟的基线稳定。浓度依赖性分析物系列以1:3稀释步骤注入,从0nm(缓冲液对照)、0.4nm、1.1nm开始,于3.3nm、30nm两次注入。分析物接触时间为3分钟且解离时间为10分钟,以50μl/min执行分析物动力学。
[1939]
人抗体被捕获为传感器表面上的配体:
[1940]
·
人类正常igg作为阳性对照(h-n-igg,id.:11717570,roche),
[1941]
·
抗人ccl2 mab(人源化11k2:ccl2-0002),
[1942]
·
抗人ccl2 mab(ab912,ccl2-0003),及
[1943]
·
抗人ccl2 mab(cnto888,ccl2-0004);
[1944]
·
系统缓冲液作为阴性对照。
[1945]
根据制造商gehc的说明使用biaevaluation软件v.3.0。应用具有r
max
局部性的1:1结合模型来确定动力学速率。
[1946][1947]
交叉反应性ccl同源物
[1948]
由于ccl2(mcp-1)与ccl7(mcp-3)、ccl8(mcp-2)、ccl13(mcp-4)具有高度同源性,且这些ccl趋化因子能够与ccr2结合,评估抗ccl2抗体与这些同源物的结合。结果显示于图1。除了被描述为对ccl2具有选择性的cnto888(mol immunol.2012jun;51(2):227-33)以外,其他测试抗体均与ccl7或ccl8结合(显示出与ccl7或ccl8的交叉反应性)。
[1949]
biacore测定法:使用biacore t200仪器(ge healthcare),在25℃下评估抗ccl2抗体与例如ccl2(mcp-1)、ccl8(mcp-2)、ccl7(mcp-3)和ccl13(mcp-4)的ccl同源物的结合。根据制造商推荐的设置,使用胺偶联试剂盒(ge healthcare),将小鼠抗人igg(fc)(ge healthcare)固定在cm4传感器芯片的每个流动池上。将抗体和分析物稀释到aces ph 7.4缓冲液(20mm aces,150mm nacl,1mg/ml bsa,0.05%tween 20,0.005%nan3)中。将抗体捕获到抗fc传感器表面上,然后将重组人ccl同源蛋白质以5nm和20nm注入流动池上。野生型ccl2(mcp-1)、ccl8(mcp-2)、ccl7(mcp-3)和ccl13(mcp-4)可从r&d systems购得,而单体ccl2(p8a变体)是厂内生成的抗原。每个周期用3m mgcl2将传感器表面再生。使用biacore t200评估软件2.0版(ge healthcare)处理结合传感图。
[1950]
功能表征(生物学的)
[1951]
ccr2信号传导i
–
钙通量测定
[1952]
在rpmi 1640、10%fbs、1mm丙酮酸钠、10mm hepes、50μmβ-巯基乙醇(供货商thermo fisher scientific)中培养thp-1(人急性单核细胞白血病细胞系;atcc tib-202)细胞。在测定当天,在25.8ml测定培养基(rpmi 1640w/o fbs)中,将细胞密度调节至8.33
×
105个细胞/ml。钙测定试剂盒(flipr calcium 4assay kit,cat#r8142,molecular devices)用于以均相测定形式检测细胞内钙的变化。
[1953]
根据制造商molecular devices的说明,通过将两个小瓶的组分a与20ml的组分b混合(hbss缓冲液加20mm hepes,ph 7.4)来制备染料上样溶液。加入516μl 1m hepes(最终测定浓度:10mm),然后添加516μl 250mm丙磺舒(probenecid)(最终测定浓度:2.5mm)。对于储备溶液,将65.4mg丙磺舒(sigma p8761)溶于465μl 1n naoh中,并添加465μl 1x hbss(thermo fisher scientific)。将25.8ml上样缓冲液与25.8ml的测定培养基混合,该培养基具有足以用于例如四个微量滴定盘(需要52.6ml体积;106thp-1/ml)的细胞。将上样缓冲液中的120μl细胞悬浮液转移至黑色f型底部96孔细胞培养盘的每个孔中。混合物于室温孵育3-4小时。
[1954]
同时,制备抗体和配体溶液。已测试从30μg/ml至0.025μg/ml(无连续稀释,孔中最终浓度)的每种抗体的八种浓度。在两个盘上测试每种浓度。所有稀释液均在测定培养基中制成10倍浓缩溶液。作为参考抗体,使用人ccl2/je/mcp-1抗体(r&d systems cat#mab279)。通过将50μg ccl2冻干物溶解在500μl rpmi 1640(100μg/ml)中,并将400μl转移到10ml测定培养基(4μg/ml储备溶液)中来制备配体ccl2(r&d systems cat#279-mc-10)。作为刺激对照,使用离子霉素(ionomycin)(sigma cat#i-0634)(将1mg离子霉素溶于1340μl dmso(sigma cat#d-8779),1mm)。10μl 1mm储备溶液在1990μl测定培养基(5μm,最终测定浓度500nm)中稀释。将100μl移液到聚丙烯mtp的对应对照孔中。
[1955]
将抗体稀释液和ccl2在两个v形聚丙烯96孔盘中预孵育。将50μl的4μg/ml储备溶液ccl2(最终400ng/ml ccl2)和50μl的10倍浓缩抗体稀释液移液至孔中。将盘在室温孵育30-60分钟。
[1956]
孵育后,将细胞盘和化合物盘直接转移至3(molecular devices)的读取位置,并如系统手册中的描述进行钙测定(激发485nm,发射525nm)。读取间隔为几秒钟。
[1957]
结果
[1958]
表1:将40ng/ml pma和4μm离子霉素用作阳性对照。该表包括n=2的ec
50
平均值。
[1959][1960]
抗ccl2抗体抑制表达于单核细胞的ccr2受体的ccl2诱导内化作用的能力
[1961]
为了防止配体诱导的ccr2在髓样细胞上的内化,我们建立了一种体外测定法,并表征抗ccl2抗体。使用商业试剂盒(stemcell,目录号#15068),通过磁分离从健康供体的周边血液中分离单核细胞。为了阻断fc rs,将单核细胞与最终浓度为500μg/ml的正常人igg(privigen,csl behring)在facs缓冲液(pbs+0.2%bsa)中于冰上孵育50分钟。然后将细胞离心10分钟(300xg,4℃),以facs缓冲液再洗涤一次并保存在冰上。在96个u形底的孔(bd)中制备抗ccl2抗体稀释液(各50μl)(在4℃和37℃下同时进行)。拆分单核细胞,再悬浮于培养基(rpmi 1640;10%fcs;2mm l-谷氨酰胺)中,分别在4℃和37℃下孵育,直至进一步使用。将重组ccl2(50μl;最终浓度为100ng/ml)在4℃和37℃下添加至制备的抗体稀释液中(浓度可变),将100μl单核细胞悬浮液(2x105个细胞/孔)添加至总体积为200μl的ccl2/抗ccl2混合物中,并将细胞在4℃和37℃下孵育1小时30分钟,然后在300xg,4℃下离心。从现在开始,所有步骤均使用预冷的缓冲液进行:用250μl facs缓冲液洗涤细胞,此外,对细胞进行ccr2受体染色(根据标准facs协议,使用市售ccr2-apc缀合物或适当的同型ctrl-apc:等分试样以下述染色:5μl/106细胞具有cd192(ccr2)apc(biolegend,#357208,克隆k036cz/migg2a),以及适当的同型ctrl抗体:20μl/106细胞migg2a k apc bd biosciences,#400222,克隆mopc-173)。
[1962]
然后在facs canto ii上分析受体表达,并如下计算ccr2内化:
[1963]
·
无内化:在没有配体的情况下分析细胞(rec.ccl2)孵育。
[1964]
·
100%内化:最大程度地降低先前用rec孵育的细胞上的ccr2表达水平。ccl2
[1965][1966]
在人thp-1细胞上抑制ccl2介导的趋化性
[1967]
ccr2
+ thp1细胞向ccl2梯度的迁移如下测试。将单核细胞thp1细胞(tib-202
tm
)培养在rpm11640培养基(pan,目录号#p04-17500),其补充fcs和l-谷氨酰胺。通常将细胞继代2至3次,然后再用于迁移测定,然后在fsc含量降低(以1.5%代替10%fcs)的培养基中饥饿过夜。计数细胞并与10μg/ml正常人igg(invitrogen,目录号#12000;阻断fcgr)在室温下孵育15分钟。
[1968]
同时,将抗ccl2抗体(和/或对照)添加至hts transwell 96孔盘系统的下部腔室中(corning,目录号#3386;孔径3μm),含有无血清培养基及25ng/ml rhccl-2(r&d systems,目录号#279-mc)。然后将插入物盘粘贴到下部腔室盘中,并对各插入物添加含有或不含5μg/ml抗体/同型的75μl(1.5x105细胞)的上述细胞悬浮液(包括igg-阻断物)。将盘覆盖并在37℃下于co2培养箱(5%co2)中孵育过夜。
[1969]
移除插入物盘并将cell-titer-glo底物(promega,目录号#g758)添加至下部腔室盘的每个孔中,以测量迁移细胞的生存力。在300rpm的振荡器上孵育1小时(密封盖板)后,将各孔200μl转移至microfluor黑色96孔盘(vwr,目录号#735-0527),并测量发光度(发光读取器,例如bio-tek,tecan)。将倍数变化计算为迁移细胞(cell titer glo,rlu)带有igg对照抗体与抗ccl2抗体的数量比。下表2中显示每个条件5-10次重复的结果:
[1970]
表2
[1971][1972]
用小鼠中单特异性(单互补位)抗ccl2抗体清除人ccl2免疫复合物的评估
[1973]
为了评估单互补位抗体与野生型人ccl2形成免疫复合物的能力,将由抗ccl2单互
补位抗体(20mg/kg)和野生型人ccl2(0.1mg/kg)所组成的预形成的免疫复合物以10ml/kg的单一剂量经尾静脉施用人fcrn转基因小鼠(b6.cg-fcgrt
tm1dcr
tg(fcgrt)32dcr/dcrj,jackson laboratory)。施用后在5分钟、7小时、1天、2天、3天和7天收集血液。立即在4℃下以14,000rpm离心血液10分钟来制备血清,将血清储存在-80℃下或低于-80℃下直至测量。下表3列出测试的单互补位抗体。具有sg1 fc的抗体具有与野生型相似的fcγ受体结合,而具有sg105 fc的抗体为fcγ受体结合沉默。
[1974]
通过将具有fcγ受体结合的抗ccl2抗体(sg1,=具有完整fcγ受体结合的igg1野生型;实线)与具有fcγ受体结合沉默的抗ccl2抗体(sg105,=无fcγ受体结合的igg1;虚线)比较来评估各抗ccl2单互补位抗体的免疫复合物清除对体内hccl2清除的影响,如图2所示。图2a至2g各自显示在注射预形成的由hccl2和各自抗ccl2抗体所组成的免疫复合物至fcrn转基因小鼠后,随时间变化的hccl2血清浓度,(具有两个不同的fc部分:sg1=具有完整fcγ受体结合的igg1野生型,及sg105=无fcγ受体结合的igg1)。使用phoenix 64(pharsight/certara),通过非隔室分析来分析抗体曲线。通过线性对数梯形法则外推至无穷大来估计aucinf。清除率值定义为剂量/aucinf。此清除率的差异也表示为倍数变化,其通过将具有fcγ受体结合的抗体(sg1)的hccl2清除率除以具有fcγ受体结合沉默的抗体(sg105)的hccl2清除率来计算(下表3)。下表3中的数据表明,对于所有测试的单互补位抗体,通过fcγ受体结合抗体(sg1=具有完整fcγ受体结合的igg1野生型)对人ccl2的清除率与通过fcγ受体结合沉默抗体(sg105,无fcγ受体结合)对人ccl2的清除率相似。这表明通过测试的单互补位抗体进行的免疫复合物介导的ccl2清除是无效的。
[1975]
表3:在施用抗ccl2单特异性抗体(20mg/kg)及野生型人ccl2(0.1mg/kg)的预形成免疫复合物后,野生型ccl2的清除率值(igg1野生型(sg1)或igg1 fc受体沉默(sg105)
[1976][1977][1978]
通过电化学发光(ecl)测量血清中总人ccl2浓度
[1979]
通过ecl测量小鼠血清中总人ccl2浓度。将3ug/ml的抗ccl2抗体(f7(biolegend)或克隆mab679(r&d systems))固定在multi-array 96孔盘(meso scale discovery)上过夜,然后在阻断缓冲液中于30℃孵育2小时。抗ccl2 mab679用作捕获抗体,用于包含人源化
sensitive kit(meso scale discovery)。没有抗体在添加到盘中之前被掺入样品中。
[1990]
通过酶联免疫吸附测定法(elisa)测量血清中抗ccl2抗体的浓度
[1991]
通过elisa测量小鼠血清中抗ccl2抗体的浓度。将抗人iggκ链(抗体溶液)分配到nunc maxisorp盘(thermofisher)上,并使其在4℃下静置过夜以制备经抗人igg固定的盘。以1%合并的小鼠血清制备校准曲线和样品。然后,将样品分配到经抗人igg固定的盘上,并在室温下静置1小时。随后,添加小鼠抗人igg hrp(克隆jdc-10,southern biotech)在室温下反应30分钟。使用abts底物(kpl)作为底物进行显色反应,并通过酶标仪测量405nm处的吸光度。使用分析软件softmax pro(molecular devices)由校准曲线的吸光度计算小鼠血浆中的浓度
[1992]
用单特异性(单互补位)抗ccl2抗体进行的不同小鼠pk研究的结论
[1993]
总结小鼠pk研究的结果,确实没有测试的单互补位抗体显示出有效从循环中清除ccl2。这些数据表明,单互补位抗体不能与ccl2形成免疫复合物,无法有效地将其从循环中清除。
[1994]
相比之下,如下所述,具有两个不同抗原结合部分/位点的双特异性抗ccl2抗体(双互补位抗ccl2抗体)能有效与ccl2形成免疫复合物并将其从循环中清除。
[1995]
实例b-1
[1996]
双特异性(双特异性)抗ccl2抗体
[1997]
生成几种具有与人ccl2上两个不同特异性表位结合的两个不同抗原结合部分(互补位)的双特异性抗ccl2抗体
[1998]
简介
[1999]
为了测试抗原的单一结合或交联是否对体内ccl2清除有显著影响,我们使用双特异性crossmab technology(参见例如,wo 2009/080252、wo 2015/150447)、wo 2009/080253、wo 2009/080251、wo 2016/016299、schaefer等人,pnas,108(2011)1187-1191和klein at al.,mabs 8(2016)1010-20),生成具有与ccl2的2个不同表位结合的2个不同抗原结合部分/位点的双特异性抗ccl2抗体(双特异性(=双互补位)crossmabs)。先将这些分子在体外就其生物化学和功能特性进行了表征,但在小鼠共注射研究中,它们也用作体内ccl2清除率评估的工具。为了评估基于fcγ受体(fcgr)结合介导清除的清除潜能(例如,在igawa等人,immunological reviews 270(2016)132
–
151、wo2012/122011和wo2016/098357和wo2013/081143中),我们生成所有crossmab,其是与fcgr结合并具有修饰的人igg1恒定链的野生型huigg1,其已减少/消除对于fcgr效应子沉默分子的结合(例如,具有突变l234a、l235a、p329g的igg1(kabat eu编号)。
[2000]
鉴定适当抗ccl2抗体对-通过夹心elisa选择双互补位抗体臂。
[2001]
执行夹心elisa,以鉴定不竞争结合人ccl2的抗体对。将384孔maxisorp(nunc)盘以1μg/ml的7种所示捕获抗体(arm 1)包被,并用2%bsa阻断。将生物素化(nhs-peo
4-biotin,pierce)的wt人ccl2(20ng/ml)与过量的相同7种抗体(arm 2)(1μg/ml)或阻断缓冲液在37℃孵育1小时。孵育后,将混合物添加至阻断的elisa盘中,并在室温孵育1小时。使用链霉亲和素(streptavidin)hrp,之后使用tmb one component底物(lifetech),执行盘结合的ccl2检测。通过1n hcl酸(wako)终止信号的产生。对于每种捕获抗体,将没有竞争性抗体的孔的o.d.设置为100%信号。未添加ccl2的空白孔的o.d.设置为0%信号。选择在两个
方向上均未显示出对ccl2结合的强烈竞争性的九对抗体作为生成双特异性crossmab抗体的候选者。
[2002][2003]
双互补位抗ccl2抗体和免疫复合物的生成和表征
[2004]
双特异性crossmab形式重组dna技术中生成双互补位抗ccl2抗体
[2005]
使用标准方法操作dna,如叙述于sambrook,j.等人,molecular cloning:a laboratory manual;cold spring harbor laboratory press,cold spring harbor,new york,1989。根据制造商的说明书使用分子生物学试剂。
[2006]
基因和寡核苷酸合成
[2007]
在geneart gmbh(regensburg,germany),通过化学合成制备所需的基因片段。将合成的基因片段克隆至大肠杆菌质粒中以进行增殖/扩增。通过dna测序验证亚克隆基因片段的dna序列。或者,通过退火(annealing)化学合成的寡核苷酸或经由pcr来组装短的合成dna片段。通过metabion gmbh(planegg-martinsried,germany)制备对应的寡核苷酸由。metabion gmbh(德国planegg-martinsried)制备。
[2008]
基本/标准哺乳动物表达质粒的描述
[2009]
为了表达所需的基因/蛋白质(例如抗体重链或抗体轻链),使用包含下列功能元件的转录单位:
[2010]
·
来自包括内含子a的人巨细胞病毒(p-cmv)的立即早期增强子和启动子,
[2011]
·
人重链免疫球蛋白5’非翻译区(5'utr),
[2012]
·
鼠免疫球蛋白重链信号序列,
[2013]
·
待表达的基因/蛋白质(例如全长抗体重链或mhc第i类分子),及
[2014]
·
牛生长激素聚腺苷酸化序列(bgh pa)。
[2015]
·
除了包括所待表达的基因的表达单元/盒外,基本/标准的哺乳动物表达质粒含有
[2016]
·
来自载体puc18的复制起始点,其允许此质粒在大肠杆菌中复制,及
[2017]
·
β-内酰胺酶基因,其在大肠杆菌中赋予氨苄青霉素(ampicillin)抗性。
[2018]
生成用于重组单克隆抗体的表达质粒
[2019]
重组单克隆抗体基因编码各自的免疫球蛋白重链和轻链。
[2020]
除了免疫球蛋白重链或轻链表达盒外,用于瞬时表达单克隆抗体分子的表达质粒还包含允许此质粒在大肠杆菌中复制的来自载体puc18的复制起始点,及在大肠杆菌中赋
予氨苄青霉素抗性的β-内酰胺酶基因。
[2021]
各自的抗体重链或轻链的转录单位包含以下功能元件:
[2022]
·
来自包括内含子a的人巨细胞病毒(p-cmv)的立即早期增强子和启动子,
[2023]
·
人重链免疫球蛋白5’非翻译区(5'utr),
[2024]
·
鼠免疫球蛋白重链信号序列,
[2025]
·
各自的抗体重链或轻链cdna序列和
[2026]
·
牛生长激素聚腺苷酸化序列(bgh pa)。
[2027]
瞬时表达和分析表征
[2028]
通过瞬时转染在f17培养基(invitrogen corp.)中培养的hek293细胞(人胚胎肾细胞系293来源)执行重组生产。为了产生单克隆抗体,将细胞与含有各自免疫球蛋白重链和轻链的质粒共转染。对于转染,使用“293-fectin”转染试剂(invitrogen)。按照制造商的说明执行转染。转染后三至七(3-7)天收获细胞培养上清液。将上清液在降低的温度(例如-80℃)下保存。
[2029]
关于人免疫球蛋白在例如hek293细胞中的重组表达的一般信息,提供于:meissner,p.等人,biotechnol.bioeng.75(2001)197-203。为了产生下列双特异性抗体,使用wo 2016/016299中所述的crossmab技术,其中,vh/vl已在一个抗体臂中交换,而另一个抗体臂的ch1/cl接口已通过电荷修饰进行修饰,结合ch3/ch3界面中的突出物入孔(knobs-into-holes)技术以促进异源二聚化。对于cnto888//11k2-wt igg1,提供应用此技术的所有四个抗体链的示例性序列(参见seq id no:104至seq id no:107)
[2030]
产生的具有野生型igg1(wt igg1)的双特异性(双互补位)抗ccl2crossmab抗体的列表(野生型igg1表示没有会影响fc受体结合的修饰/突变,然而包括异源二聚化技术,如突出物(knob)进入孔(hole)中)
[2031]
[2032][2033]
具有包括fcγ受体沉默突变l234a、l235a、p329g(kabat eu编号)的igg1的双特异性(双互补位)抗ccl2 crossmab抗体的列表(igg1-pglala)
[2034][2035]
双互补位抗ccl2抗体的纯化
[2036]
通过多达三个色谱步骤进行过滤和纯化含有细胞培养上清液的双互补位抗ccl2抗体。根据捕获步骤洗脱液的纯度,在捕获和完善化抛光步骤之间可选地实施离子交换色谱步骤。
[2037]
使用mabselectsure-sepharosetm(ge healthcare,sweden)、poros 50hs(thermofisher scientific)和superdex 200尺寸排阻(ge healthcare,sweden)色谱,通过亲和性色谱从细胞培养上清液中纯化双互补位抗ccl2抗体。简而言之,在以pbs缓冲液(10mm na2hpo4、1mm kh2po4、137mm nacl和2.7mm kcl,ph 7.4)平衡的mabselect sure树脂上捕获无菌过滤的细胞培养上清液,以平衡缓冲液洗涤并以25mm柠檬酸钠在ph 3.0下洗
脱。合并洗脱的蛋白级分并以2m tris,ph 9.0中和。
[2038]
离子交换色谱法是可选的第二步纯化步骤,使用以poros 50hs(thermofisher scientific)进行,平衡并以20mm组氨酸ph 5.6洗涤,并加载稀释的捕获步骤洗脱液,用20mm组氨酸,0.5m nacl在ph 5.6下进行梯度色谱,离子交换色谱级分以ce-sds labchip gx ii(perkinelmer)分析,并合并含有crossmab的级分。
[2039]
superdex 200(ge healthcare)上的尺寸排阻色谱法用作第二或第三纯化步骤。尺寸排阻色谱法是在20mm组氨酸缓冲液,0.14m nacl,ph 6.0中进行。通过ce-sds labchip gx ii(perkinelmer)分析尺寸排阻色谱级分,并合并含crossmab的级分并储存在-80℃。
[2040]
在将superdex 200(ge healthcare)上的poros 50hs(thermofisher scientific)尺寸排阻色谱法替换为在hiprep 26/10desalting(ge healthcare)上的脱盐色谱法(在20mm组氨酸缓冲液,0.14m nacl,ph 6.0中)后的情况,可获得满意的产品质量。
[2041]
使用基于氨基酸序列计算的摩尔消光系数,通过测量280nm处的光密度(od)来确定抗体制剂的蛋白质浓度。
[2042]
使用带有protein express chip和ht protein express kit的labchip gx ii(perkinelmer),通过ce-sds分析抗体的纯度和完整性。使用biosuite high resolution sec,5μm分析尺寸排阻柱(waters gmbh),使用200mm k2hpo4/kh2po4,250mm kcl,ph 7.0作为运行缓冲液,通过高性能sec测定抗体制剂的总含量。当以ce-sds分析,平均纯度在94-100%之间,且单体含量》95%(sec)。
[2043]
双特异性(双互补位)抗ccl2抗体的功能特征
[2044]
亲和力测量(结合)
[2045]
捕获系统的大约1200共振单位(ru)(20μg/ml山羊抗人igg fc;订购号:109-005-098;jackson immuno research)通过使用ge healthcare所提供的胺偶联试剂盒,在ph 5.0耦合至c1芯片(ge healthcare br-1005-35)上。样品和系统缓冲液是pbs-t(包括0.05%tween20的10mm磷酸盐缓冲盐水),ph 7.4。流动池设置为25℃,及样品块设置为12℃,并以运行缓冲液灌注两次。通过以10μl/min的流速注入2μg/ml溶液60秒钟来捕获双特异性抗体。通过以30μl/min的流速从30nm的1:10稀释开始,以不同浓度的溶液注入人ccl2(wt)150秒来测量缔合。监测解离阶段达1200秒,并通过从样品溶液转换到运行缓冲液来触发。通过以0.85%h3po4溶液,以10μl/min的流速洗涤60秒将表面再生。通过减去从山羊抗人igg fc表面获得的反应来校正整体折射率差(bulk refractive index difference)。空白注射也被减去(=双重参考)。为了计算动力学参数,使用langmuir 1:1模型。
[2046][2047]
在野生型抗原存在下天然免疫复合物的形成。
[2048]
使用透析或离心超滤装置,将所有蛋白质样品(双特异性抗ccl2crossmab抗体及抗原)在1x pbs,ph 7.4中重新缓冲。
[2049]
制备从2.0到0.1mg/ml的crossmab样品稀释系列。同样地,pbs中抗原溶液的浓度范围为0.012至0.23mg/ml。选择浓度以允许混合等体积来实现恒定的摩尔比1:1(抗体:ccl2复合物)。在本研究中使用以下抗原:野生型ccl2。
[2050]
将等体积的预稀释crossmab和ccl2制剂混合并在37℃下孵育1小时,然后将样品施加到superose6(ge healthcare#2039)柱上,以pbs预平衡,并以0.5ml/min的流速洗脱。总共施加100μg或最大可能体积250μl,并将抗体和抗原单独用作对照。
[2051]
使用optilab rex折射率检测器和minidawn treos malls检测器(均来自wyatt inc.)记录sec-malls数据。使用astra v5软件(wyatt)处理sec-malls信号。
[2052][2053]
图例
[2054]
+++
ꢀꢀꢀ
大量的多聚物/寡聚物
[2055]
++
ꢀꢀꢀꢀ
中等数量的多聚物/寡聚物
[2056]
+
ꢀꢀꢀꢀꢀ
少量的多聚物/寡聚物
[2057]0ꢀꢀꢀꢀꢀ
只有二聚体或更少
[2058]
ccr2报告基因测定研究抗ccl2抗体的中和特征
[2059]
tango
tm ccr2-bla u2os细胞购自德国invitrogen,以研究ccl2中和抗体构建体的影响。这些报告细胞包含与tev蛋白酶位点相连的人类趋化因子(c-c基序(motif))受体2(ccr2)及稳定整合到tango
tm gpcr-bla u2os亲代细胞系中的gal4-vp16转录因子。该亲代细胞系在uas反应元件的控制下稳定表达β-视紫红质(arrestin)/tev蛋白酶融合蛋白和β-内酰胺酶(bla)报告基因。添加天然配体mcp1=ccl2导致报告基因活性的指示,其可通过切割具有fret功能的底物来测量。
[2060]
原则上,测定和细胞处理程序是根据提供者手册进行的。简而言之,将ccr2-u2os细胞以密度2x104个细胞/孔接种(96er黑色透明底盘,目录号#655090,greiner bio-one)在50μl测定培养基(freestyle 293expression medium,目录号#12338-018,invitrogen)。同时地,以c=4x最终浓度制备不同测试抗体及ccl2-抗原溶液的系列稀释液。然后,制备ccl2-抗原/抗体混合物,并在室温下预孵育2至3小时(hrs)。将50μl所示的ccl2/抗体溶液转移到表达ccr2的u2os细胞中,并在37℃和5%co2的加湿培养箱中孵育18小时。仅使用测定培养基作为对照。
[2061]
第二天,ccf4底物(目录号#k1089,invitrogen)以β-内酰胺酶上样溶液制备(目录号#k1085,invitrogen),并将其以20μl/孔加入细胞中。将底物溶液在黑暗中于室温下孵育2小时。
[2062]
最后,使用spectra max(m4)读取器(molecular devices)在下列波长(ex/em=
409nm/460nm=蓝色*;ex/em=409nm/530nm=绿色**)下确定荧光波长,并根据下列公式:比率=(样品-蓝色*-对照-蓝色*)/(样品-绿色**-对照-绿色**),计算在减去测定培养基对照后的蓝色/绿色荧光比。
[2063]
在进行ph工程化后,我们针对最终的lo候选物(cklo1-4)表征了其抑制ccl2诱导的ccr2信号传导的能力。在此情况下,仅通过rec的单体变体评估中和特性。ccl2蛋白,其最终浓度约为15ng/ml。
[2064][2065][2066]
小鼠中以双互补位抗体清除人ccl2免疫复合物的评估
[2067]
为了评估双互补位抗体与野生型人ccl2形成免疫复合物的能力,将单一剂量10ml/kg的由抗ccl2双互补位抗体(20mg/kg)及野生型人ccl2(0.1mg/kg)所组成的预先形成的免疫复合物尾静脉施用balb/c小鼠。施用后5分钟、7小时、1天、3天和7天收集血液。立
即在4℃下以14,000rpm离心血液10分钟来制备血清,将血清储存在-80℃下或低于-80℃下直至测量。测试的双互补位列于下表4中。具有wt igg1 fc的抗体具有与野生型相似的fcγ受体结合,而具有pglala fc的抗体为fcγ受体结合沉默。结果显示于图4a至4i。
[2068]
通过比较具有fcγ受体结合的抗ccl2抗体(实线)与具有fcγ受体沉默的抗ccl2抗体(pglala,虚线),评估在体内各种抗ccl2双互补位抗体的免疫复合物清除对hccl2清除率的影响,如图4a-4i所示。使用phoenix 64(pharsight/certara),通过非隔室分析来分析抗体曲线。通过线性对数梯形法则外推至无穷大来估计aucinf。清除率值定义为剂量/aucinf。清除率的这种差异也表示为倍数变化,其通过将具有fcγ受体结合的抗体(sg1)的hccl2清除率除以具有fcγ受体结合沉默的抗体(pglala)的hccl2清除率来计算(下表4)。下表4中的数据表明,fcγ受体(fcgr)结合抗体(wt igg1)对人ccl2的清除率优于fcγ受体结合沉默抗体(pglala,具有含突变l234a、l235a、p329g突变的igg1 fc结构域(abat eu编号))的清除率。这表明通过测试的双互补位抗体实现的ccl2的免疫复合物介导的清除更为有效。此外,数种双互补位抗体显示清除率值有较大倍数变化,例如cnto//人源化11k2(cnto//11k2)。
[2069]
通过将具有wt fcγr(fcgr)结合的抗体的hccl2清除率除以具有pglala的抗体的hccl2清除率来计算倍数变化。如图4a-4i和下表4所示,cnto//11k2在具有fcgr结合的igg1野生型(wt)的抗体与fcgr结合沉默的抗体(pglala)之间显示最大21.5倍的变化。这表明在所有变体中,通过cnto//11k2-wt igg1的免疫复合物介导的清除是最有效的。
[2070]
表4:预先形成的抗ccl2双互补位抗体(20mg/kg)和野生型人ccl2(0.1mg/kg)的免疫复合物后,野生型ccl2的清除率值
[2071][2072][2073]
通过电化学发光(ecl)测量血清中总人ccl2浓度
[2074]
通过ecl测量小鼠血清中总人ccl2浓度。将3ug/ml的抗ccl2抗体2f2-sg1固定于multi-array 96孔盘(meso scale discovery)上过夜,然后在阻断缓冲液中于30℃孵育2小时。将人ccl2校准曲线样品、质量对照样品及稀释的小鼠血清样品与9%sds所组成的变性缓冲液在37℃下孵育30分钟,或与ph2.0-2.5甘氨酸hcl缓冲液所组成的变性缓冲液在37℃孵育10分钟。变性缓冲液的目的是使人ccl2与双互补位抗体解离。之后,将样品稀释10倍,并添加至经抗ccl2固定的盘上,并在30℃下结合1小时,然后洗涤。然后,加入sulfo tag标记mcp-1抗体,并将盘在30℃下孵育1小时,然后洗涤。立即将read buffer t(x4)(meso scale discovery)添加至盘中,并以sector imager 2400(meso scale discovery)检测信号。使用分析软件softmax pro(molecular devices),基于校准曲线的反应来计算人ccl2浓度。
[2075]
通过酶联免疫吸附测定法(elisa)测量血清中抗ccl2抗体的浓度
[2076]
通过elisa测量小鼠血清中抗ccl2抗体的浓度。将抗人iggκ链(抗体溶液)分配到nunc maxisorp盘(thermofisher)上,并使其在4℃下静置过夜以制备经抗人igg固定的盘。
以1%合并的小鼠血清制备校准曲线和样品。然后,将样品分配至经抗人igg固定的盘上,并在30℃下静置1小时。随后,添加具有hrp缀合物的山羊抗人igg(γ-链特异性)(southern biotech),在30℃下反应1小时。使用abts底物(kpl)作为底物进行显色反应,并通过酶标仪测量450nm处的吸光度。使用分析软件softmax pro(molecular devices)从校准曲线的吸光度计算小鼠血浆中的浓度。
[2077]
研究总结
[2078]
总结小鼠pk研究数据,与相同剂量的单互补位抗体相比,被测试的双互补位抗体对人ccl2的清除更为有效。对于单互补位抗体,具有wt fcgr结合与fcgr结合沉默的抗体之间的抗原清除率差异很小(表3)。相反地,在具有wt fcgr结合与fcgr结合沉默的双互补位抗体之间,抗原清除率存在较大差异(表4),此表明所测试的双互补位抗体可有效清除人ccl2。选择cnto888//11k2的组合用于进一步的抗体工程化,因为它在清除率上显示出最大的机会。
[2079]
实施例b-2具有修饰的可变结构域和cdr(离子依赖性/ph依赖性结合)的抗ccl2抗体
[2080]
修饰导致离子依赖性/ph依赖性结合
[2081]
为了生成ph依赖性抗ccl2抗体,对mab cnto888和人源化11k2的所有cdr进行组氨酸扫描诱发突变。使用in-fusion hd cloning kit(clontech inc.或takara bio company),根据制造商的说明,将cdr中的每个氨基酸分别突变为组氨酸。通过定序确认每个变体正确突变后,通过下列方法瞬时表达和纯化变体:根据制造商的说明,使用freestyle fs293-f细胞和293fectin(life technologies)瞬时表达重组抗体。重组抗体以蛋白a(ge healthcare)纯化,并在d-pbs或his缓冲液(20mm组氨酸,150mm nacl,ph6.0)中洗脱。如果需要,进一步进行尺寸排阻色谱法以移除高分子量和/或低分子量组分。与上述方法相比,所有的组氨酸取代的变体均通过改良的测定进行评估。简而言之,在ph7.4的解离阶段后,立即将ph5.8的另一个解离阶段整合到分析。这是为了评估抗体(ab)与抗原(ag)之间在ph7.4形成的复合物的ph依赖性解离,而不是在ph5.8进行对应的解离。通过使用scrubber 2.0(biologic software)曲线拟合软件处理并拟合数据,确定在ph5.8缓冲液的解离速率。
[2082]
与ph7.4解离阶段相比,选择并组合导致ph5.8下结合反应降低的单个组氨酸取代。为了鉴定在ph7.4时改善亲和力的突变,使用在组氨酸取代步骤中生成的至少一种变体,分别生成针对重链和轻链的500多种变体。这些变体的cdr中的每个氨基酸都被18个其他氨基酸取代,原始氨基酸和半胱氨酸除外。使用4000仪器(ge healthcare)在ph7.4下于37℃评估变体与人ccl2的结合能力。如前所述,在ph7.4的解离阶段后,立即将另一个ph5.8的解离阶段整合到测定中。通过使用scrubber 2.0(biologic software)曲线拟合软件处理并拟合数据,确定在ph5.8缓冲液的解离速率。
[2083]
选择改善的ph7.4亲和力和改善的ph依赖性的变体,并将这些突变合并。在下表中,以四个11k2变体和四个cnto888变体为例。
[2084]
表:设计用于ph依赖性结合的四个修饰的11k2和四个cnto888变体
[2085]
修饰的11k2变体(vh/vl)修饰的cnto888变体(vh/vl)11k2h1503/11k2l1338cnto888h0625/cnto888l0616
11k2h1510/11k2l1338cnto888h0634/cnto888l061611k2h1503/11k2l1201cnto888h0635/cnto888l061611k2h1514/11k2l1338cnto888h0695/cnto888l0616
[2086]
为了评估经修饰的11k2和cnto888变体的组合效果,将各11k2变体与四个修饰的cnto888变体组合,并以crossmab型式表示为双互补位ccl2抗体。在下表中例示说明,其中,4
×
4组合导致产生16种双互补位抗体,称为cklo01至cklo16。
[2087]
表:四个经修饰的11k2和四个修饰的cnto888变体的组合,产生16个双特异性(双互补位)抗体。
[2088][2089][2090]
为了产生双特异性抗体,使用wo 2016/016299中所述的crossmab技术,其中,vh/vl已在一个抗体臂中交换,而另一抗体臂的ch1/cl接口已通过电荷修饰进行修饰,结合ch3/ch3界面中的突出物入孔(knobs-into-holes)技术以促进异源二聚化。对于cklo2 igg1,提供应用此技术的所有四个抗体链的示例性序列(参见seq id no:108至seq id no:111)。取决于使用的重链恒定结构域(例如igg1野生型(无fc受体结合沉默突变)、pglala、sg1095、sg1099、1100
–
对于sg1095、sg1099、1100,参见下文说明或序列说明),添加后缀igg1、pglala、sg1095、sg1099、1100
[2091]
具有修饰的可变结构域和cdr(离子依赖性/ph依赖性结合)的双互补位抗ccl2抗体的功能表征
[2092]
亲和力测量(参见上述方法)
[2093]
对于所有16种生成的双特异性抗ccl2抗体(均为igg1野生型),均确定它们的ph依赖性结合人ccl2。
[2094]
图5a显示传感图,显示四个修饰的11k2和四个cnto888变体以及组合后的16个crossmab在ph7.4(黑线)和ph5.8(灰线)下与单体ccl2的结合曲线。
[2095]
图5b显示传感图,显示四个修饰的11k2和四个cnto888变体以及与单体ccl2组合后的16个crossmab的结合曲线,其中,在ph7.4的解离阶段后立即将ph5.8的另一个解离阶段整合至测定中。
[2096]
交叉反应性结合ccl8
[2097]
使用biacore t200仪器(ge healthcare),在37℃下评估与重组单体人ccl2和重组单体人ccl8结合的ph依赖性。根据制造商推荐的设置,使用胺偶联试剂盒(ge healthcare)将抗人fc(ge healthcare)固定在cm4传感器芯片的每个流动池上。将抗体和分析物稀释到aces ph 7.4或ph 5.8缓冲液(20mm aces,150mm nacl,1mg/ml bsa,0.05%tween 20、0.005%nan3)中。将抗体捕获于抗fc传感器表面上,然后将重组单体人ccl2以8nm的浓度注射到流动池上。监测分析物与抗体的缔合阶段120秒,然后进行180秒的解离阶段。每个周期用3m mgcl2将传感器表面再生。结合传感图通过对捕获水平的结合反应的标准化以tibco spofire处理。
[2098]
通过改良的biacore测定,检查在ph 7.4形成的抗体/抗原复合物的ph依赖性解离评估。简而言之,在ph 7.4的解离阶段之后,立即将ph 5.8的另一个解离阶段整合到biacore测定中。结合传感图通过对捕获水平的结合反应的标准化以tibco spofire处理。
[2099]
重组人ccl8 p8a单体的表达和纯化:野生型人ccl8的序列获自genbank(ncbi:np_005614.2)为了制备单体ccl8,将成熟ccl8蛋白质的位置8的脯氨酸突变为丙氨酸。根据制造商的说明转染expi 293细胞(lifetech)。使用sp-sepharose hp(ge healthcare)和superose 200尺寸排阻(ge healthcare)色谱,通过阳离子交换色谱法使用相同的方法从细胞培养上清液中纯化ccl8野生型和p8a单体蛋白质。简而言之,将细胞培养上清液用milliq水(millipore)稀释2.5倍,加载至以pbs平衡的hi-trap sp-hp柱上,用平衡缓冲液洗涤,并使用0-2m nacl梯度洗脱。合并洗脱的蛋白级分,并经尺寸排阻色谱法进一步纯化,使用hiload 16/600superose 200(ge healthcare)柱,以20mm组氨酸,150mm nacl,ph 6.0平衡。通过尺寸排阻色谱法和sds-page分析级分。合并含有ccl8蛋白质的级分,浓缩并储存在-80℃
[2100]
人ccl8与ccl2具有高度同源性,并且也能与ccr2结合。由于11k2臂能够结合ccl8(参见图1),因此有必要鉴定突变以减少这种结合,避免中和ccl8的脱靶效应。此外,移除11k2臂上的ccl8结合对于有效形成与ccl2的免疫复合物很重要。由于cnto臂不结合ccl8,因此ccl8与11k2臂的结合将干扰与ccl2形成的免疫复合物,这可能会降低ccl2从血浆中的清除率。
[2101]
为了鉴定降低11k2与人ccl8的结合及赋予对人ccl2选择性的突变,将一些cdr位置取代,例如cklo02的11k2 vh中的d101e或cklo03的11k2 vl中的w92r,以移除与huccl8的交叉反应性。如图6所示,通过工程化11k2可显著降低双互补位crossmab中的ccl8结合。cklo01变体未经过优化以减少ccl8的结合,而cklo04、cklo03和cklo02包含突变以降低ccl8结合。所有四个crossmab均与ccl8具有ph依赖性结合。
[2102]
在ph7.4和ph5.8下的抗ccl2抗体与重组ccl2和ccl8的结合亲和力
[2103]
为了确定亲代cnto888h/11k2h2的亲和力及ph依赖性结合,使用biacore t200仪器(ge healthcare)在37℃下评估cklo1、cklo2和cklo3与人ccl2和ccl8的结合。根据制造商推荐的设置,使用胺偶联试剂盒(ge healthcare)将抗人fc(ge healthcare)固定在cm4传感器芯片的每个流动池上。将抗体和分析物稀释到aces ph 7.4或ph 5.8缓冲液(20mm aces,150mm nacl,1mg/ml bsa,0.05%tween 20、0.005%nan3)中。将抗体捕获到抗fc传感器表面上,然后将重组人ccl2 p8a变体(单体)或ccl8 p8a变体(单体)以两倍连续稀释制备的1.25nm至20nm注入流动池。每个周期用3m mgcl2将传感器表面再生。通过使用biacore t200评估软件2.0版(ge healthcare)处理数据并将其拟合为1:1结合模型来确定结合亲和力。在ph 7.4和ph 5.8下抗ccl2抗体对重组ccl2和ccl8的结合亲和力显示于下表5中。
[2104]
表5:在ph 7.4和ph 5.8下的抗ccl2抗体与重组ccl2和ccl8的结合亲和力
[2105][2106]
注意:n.d.由于结合反应低,无法确定kd。
[2107]
表5中的数据表明,对于cklo2和cklo3,在ph7.4时与ccl8的结合被消除,同时在ph7.4时保持强大的亲和力以及与ccl2的ph依赖性结合。结果表明,基于将cnto888和11k2的亲代双特异性抗体的可变区和cdr中引入的不同修饰成功地生成亲和力成熟的变体cklo1、cklo2、cklo3,与亲代ab在ph 7.4相比,具有对ccl2增强的结合亲和力。同时,cklo1、cklo2、cklo3显示对于ccl2强的ph依赖性结合。与ph7.4时的kd值相比,ph 5.8时与ccl2的结合亲和力的kd弱1000倍以上
[2108]
野生型人ccl2的清除率
[2109]
为了评估ph依赖性双特异性抗体增强野生型人ccl2清除的能力,以10ml/kg的单剂量施用由抗ccl2单互补位抗体(20mg/kg)和野生型人ccl2(0.1mg/kg)所组成的预形成的免疫复合物至scid小鼠的尾静脉中。施用后5分钟、1小时、4小时、7小时、1天和7天收集血液。将血清储存在-80℃下或低于-80℃下直至测量。测试的crossmab抗体是亲代cnto//11k2,以及四个ph工程化变体cklo01、cklo02、cklo03和cklo04。所有抗体均具有igg1野生型fc部分(无突变沉默/消除fc(γ)受体结合)。如上所述(在“评估小鼠中以双互补位抗体清除的人ccl2免疫复合物”,表4之后),进行小鼠血清中总人ccl2和抗ccl2抗体浓度的测量。
[2110]
结果如图7a所示:将由hccl2和双特异性抗ccl2抗体(亲代cnto//11k2和ph依赖性变体cklo01、cklo02、cklo03和cklo04)所组成的预形成免疫复合物注射至scid小鼠后一段时间的hccl2血清浓度。所有这四个ph工程化变体均显示人ccl2的快速清除。对于cklo02、cklo03,人ccl2在第1天均低于检测限度。对于亲代cnto//11k2,最初观察到人ccl2的快速清除,直到第1天,但此后,人ccl2的清除缓慢。
[2111]
实施例b-3具有修饰的可变结构域和cdr的抗ccl2抗体(离子依赖性/ph赖性结合)及fc介导的清除
[2112]
通过扫除技术修饰双特异性抗ccl2抗体
[2113]
使用清除技术修饰双特异性抗ccl2抗体,以使该双特异性抗ccl2抗体能够在更长的时间内消除游离ccl2,从而在体内能够持续生物学效应,例如抗癌功效或抗炎性功效。
[2114]
清除概念叙述于igawa等人,immunological reviews 270(2016)132
–
151、wo2012/122011、wo2016/098357和wo2013/081143,其等通过引用并入本文。
[2115]
pi fc介导的清除
[2116]
已证明ph工程化的双互补位抗体可在体内加速ccl2清除率,我们接下来评估具有pi-增加取代的抗体以增强野生型人ccl2清除率的能力。将由抗ccl2单互补位抗体(20mg/kg)和野生型人ccl2(0.1mg/kg)所组成的预形成免疫复合物以10ml/kg的单剂量施用scid小鼠的尾静脉。施用后5分钟、30分钟、1小时、2小时、4小时和7天收集血液。将血清储存在-80℃下或低于-80℃下直至测量。测试的crossmab抗体是带有igg1的亲代cklo03及带有pi增强fc的cklo03、cklo03-sg1099。如上所述(在“评估小鼠中以双互补位抗体清除的人ccl2免疫复合物”,表4之后),进行小鼠血清中总人ccl2和抗ccl2抗体浓度的测量。
[2117]
结果显示于图7b:将由hccl2和cklo03(带有igg1野生型fc)或cklo03-sg1099(带有增强的i fc的cklo03)所组成的预形成免疫复合物注射至scid小鼠后一段期间的hccl2血清浓度。与具有igg1的cklo03相比,含有fc取代q311r/p343r(eu kabat编号)的cklo03-sg1099显示出对人ccl2的更快的清除率/降低。这表明具有pi-增加突变的ph依赖性双互补位抗体可加速ccl2的清除率。
[2118]
具有fcγriib增强的fc变体和其他fc修饰的双互补位抗ccl2抗体的生成
[2119]
在此实例中,说明了增强ccl2清除率的fc工程化。
[2120]
在wo 2013/125667中已证明,可通过施用包含对fcγriib表现出增加亲和力的fc结构域的抗原结合分子(例如抗体)来增强可溶抗原的清除率。此外,在wo 2012/115241和wo 2014/030728中已说明可显示出人fcγriib增强结合的fc变体。也已经说明,这些fc变体可显示出对于人fcγriib的选择性地增强结合和对于其他活性fcγ受体(fcγrs)的降低结合。此fcgrmriib结合的选择性增强不仅有利于清除可溶性抗原,而且还有助于降低不期望的效应子功能和免疫反应的风险。
[2121]
为了开发抗体药物,应在药物具有医药活性下于非人动物中评估功效、药物代谢动力学和安全性。如果仅在人类中有活性,则必须考虑其他方法,例如使用代用抗体(int.j.tox.28:230-253(2009))。然而,使用替代抗体来精确预测人类的fc区与fcγr之间的相互作用的影响并不容易,因为非人类动物中fcγr的表达模式和/或功能并不总是和人类中一样。优选的抗体药物的fc区应与非人类动物,特别是对食蟹猕猴具有交叉反应性,所述食蟹猕猴具有接近于人类的fcγrs的表达模式和功能,从而在非人类动物中所获得的结果可推断至人类。
[2122]
生成双特异性抗ccl2抗体的以下igg1恒定结构域/fc变体,在fc部分的位置处具有突变(eu kabat编号)
[2123]
sg1095-源自igg1,包括突变(kabat eu编号):
[2124]-l235w/g236n/h268d/q295l/a330k/k326t(适于增加对人fcgriib的亲和力并与
减少对其他人fcgr的亲和力);
[2125]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[2126]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[2127]-q438r/s440e(适于抑制类风湿因子结合)
[2128]
源自igg1的sg1099包括突变(kabat eu编号):
[2129]
q311r/p343r(适于增加pi以增强抗原的摄取)
[2130]
sg1100-源自igg1,包括突变(kabat eu编号):
[2131]-q311r/p343r(适于增加pi以增强抗原的摄取);
[2132]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期;以及
[2133]-q438r/s440e(适于抑制类风湿因子结合)
[2134]
源自igg1的gg01,包括突变(kabat eu编号):
[2135]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[2136]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[2137]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[2138]-q438r/s440e(适于抑制类风湿因子结合)
[2139]
源自igg1的gg02,包括突变(kabat eu编号):
[2140]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[2141]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[2142]-m428l/n434a/y436t(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[2143]-q438r/s440e(适于抑制类风湿因子结合)
[2144]
gg03-衍生自igg1(sg1-igg1同种异型),包括突变(kabat eu编号):
[2145]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[2146]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[2147]-n434a(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[2148]-q438r/s440e(适于抑制类风湿因子结合)
[2149]
gg04-源自igg1(sg1-igg1同种异型),包括突变(kabat eu编号):
[2150]-l234y/p238d/t250v/v264i/t307p/a330k(适于增加与人fcgriib的亲和力和与其他人fcgr的亲和力);
[2151]-q311r/p343r(适于增加等电点(pi)以增强抗原的摄取);
[2152]-m428l/n434a/y436t(适于增加与fcrn的亲和力以延长抗体的血浆半衰期);以及
[2153]-q438r/s440e(适于抑制类风湿因子结合)
[2154]
具有修饰的可变结构域和cdr(离子依赖性/ph依赖性结合)及具有或没有fc介导的清除的双特异性抗ccl2抗体的功能表征
[2155]
cklo2的fc变体sg1095、gg01、gg02、gg03/04的spr结合
[2156]
在biacore 8k仪器上进行的spr测定中,研究单体人ccl2及食蟹猕猴ccl2与4种不同抗体p1ad8325、p1af8137、p1af8139和p1af8140在ph 7.4和5.8下的结合。
[2157]
在此设置中,使用胺偶联方法将captureselect
tm human fab-κ(thermofisher scientific)固定在cm3传感器芯片上,捕获各种抗体作为配体,并以0、10、100和1000nm单体人ccl2或食蟹猕猴ccl2作为分析物,在两个不同ph值下执行测量。
[2158]
cklo2-sg1095、cklo2-gg01、cklo2-gg02、cklo2-gg03/04显示出与单体人ccl2和食蟹猕猴ccl2几乎相同的结合曲线,它们在10、100和1000nm结合且在ph 7.4下同样快速解离,而在ph 5.8下观察到没有稳定的结合。结果显示于下表中。
[2159]
表:与cklo2-sg1095、cklo2-gg01、cklo2-gg02、cklo2-gg03/04的单体人ccl2和食蟹猕猴ccl2的结合显示与单体人ccl2和食蟹猕猴ccl2几乎相同的结合曲线
[2160][2161]
趋化性测定
[2162]
方法说明
[2163]
将thp-1细胞培养3天,直至8x10e5细胞/ml。将总细胞数5000细胞/孔接种在微量滴定盘的上部腔室中,并使其在37℃下沉降,在具有或没有抗ccl2抗体的情况下,将重组huccl2以50ng/ml的最终浓度移量至底部腔室中(当执行测定以测试代用抗体时,改用重组muccl2,浓度为100ng/ml)。将上部腔室和底部腔室合并在一起,避免形成气泡,然后将盘在37℃下孵育24小时,根据制造商的建议,通过cell titer glo方法对迁移细胞进行定量,并使用tecan infinite 200reader测量发光。
[2164]
结果示出于图8:趋化性测定:具有相同cdr和可变区vh/vl的双特异性抗ccl2抗体,即cklo2-igg1野生型和cklo2-sg1095,但具有不同的fc部分,可以相同效价(ic
50
=0.2μg/ml;图8,左图)抑制thp-1细胞迁移。
[2165]
相似地,ccl2-0048(cklo2的亲代vh/vl-未修饰的双特异性抗体cnto888/11k2,其为非ph依赖性)也显示ic
50
为0.2μg/ml,因为ph依赖性对于清除抗原至关重要,这种测定法中不会发生的现象。
[2166]
对应的单互补位抗体cnto888 igg1和人源化11k2 igg1显示ic
50
值分别为0.3和0.7μg/ml,而huigg1同型对照则显示无抑制作用(图8,右图)。
[2167]
在其他类似实验中,确定了cklo2-gg01(0.2μg/ml)、cklo2-gg02(0.2μg/ml)和gg03/gg04(0.3μg/ml)的ic
50
值。
[2168]
在转基因小鼠模型中的体内生物活性
[2169]
材料与方法
[2170]
b16-huccl2/ccl2-假设模型
[2171]
生成本模型的目的是测试抗人ccl2抗体,而不会干扰具有免疫能力的荷瘤小鼠的小鼠ccl2。为此,选择了小鼠肿瘤细胞系b16-f10,因为它不分泌mccl2,并且已知在c57/bl6系的小鼠体内生长,这是ccl2剔除小鼠的遗传背景。
[2172]
为了生成表达huccl2的b16f10肿瘤细胞的稳定库,将它们用编码huccl2的质粒dna和潮霉素b(hygromycin b)选择盒进行转染。因此,将细胞以2.0e+05个细胞/孔的密度接种到6孔盘中的生长培养基(dmem+10%fcs+2mm l-谷氨酰胺)中。24小时后,将由每孔1μg dna和含lipofectamine 2000的opti-mem培养基所组成的转染混合物加入。随后,将细胞用含有潮霉素-b(0.5mg/ml)的培养基进行选择。培养20天后,基于fsc/ssc-散射,使用bd facs aria iii对活的单一细胞进行分选。12天后,与野生型b16f10细胞相比,使用来自ebioscience的elisa ready-set-go(cat#88-7399-86)筛选来自单一细胞选克隆的细胞培养物上清液中人ccl2的表达(数据未显示)。
[2173]
将选择的b16-f10_homsa_ccl2肿瘤细胞选克隆1a5、2a3和2b2在37%的水饱和气压中于5%co2下,常规培养于含有10%fcs和2mm l-谷氨酰胺的dmem中(pan biotech gmbh,germany)。以胰蛋白酶/edta 1x(pan biotech gmbh,germany)每周分样两次执行培养继代。
[2174]
在雌性b6.129s4-ccl2tm1rol/j小鼠(jackson laboratories)到达7至10周龄时,接种b16-f10_homsa_ccl2肿瘤细胞克隆:在当天(研究第0天),从培养瓶中收获肿瘤细胞,转移到培养基中,洗涤一次并再悬浮于pbs中。使用细胞计数器和分析仪系统(vi-cell,beckman coulter)确定细胞数。用于s.c.注射的细胞力价调整为1
×
10e7细胞/ml,并以100μl皮下注射至小鼠右侧腹部,其使用冷却的1.0ml结核菌素注射器(dispomed,germany)和小针头(0.45x12mm)。在以小动物的吸入单位的异氟烷(isoflurane)(cp pharma,德国)全身麻醉下进行细胞接种。
[2175]
每天监测肿瘤生长,并在研究第15天处死小鼠,此时b16-f10_homsa_ccl2肿瘤细胞克隆1a5和2a3达到约1000mm3(此时,由于生长速度较慢,因此2b2肿瘤约为600mm3)。在终点时,如上所述采集血液样品用于ccl2测量,并将肿瘤移出并以流式细胞术分析。
[2176]
发现小鼠免疫细胞浸润所有肿瘤,证实人ccl2能够吸引小鼠ccr2+细胞的观点。b16-f10_homsa_ccl2肿瘤细胞克隆1a5表现出最高的cd45+总浸润率和最高的相对mmdsc(源自单核细胞的抑制细胞)组成(图2)。即使2a3细胞导致血清总ccl2水平与1a5细胞相似,克隆2a3和2b2在肿瘤中的免疫细胞频率也较低,而2b2克隆却显示出明显较低的ccl2血清浓度(数据未显示)。
[2177]
如上所述,将雌性b6.129s4-ccl2tm1rol/j小鼠接种b16-f10_homsa_ccl2肿瘤细胞克隆1a5。
[2178]
细胞接种5天后开始研究组的治疗。第1组接受人igg媒介物对照治疗,而第2和第3组分别以mab cklo2-igg1(fc野生型igg1)和cklo2-sg1099((基于igg1的cklo2 pi-增强的fc,与具有突变q311r/p343r(kabat eu编号)),每天以3,7mg/kg经i.p.治疗9天。在研究的第14天,将小鼠处死并移植肿瘤。使用酶消化和细胞滤器从每个肿瘤块生成单一细胞悬浮液,通过流式细胞术进行非蓄集分析。为了检测目标免疫细胞群,使用以下标记和荧光染
料:cd45-buv395、cd11b-buv737、f4/80-bv421、cd11c-bv605、ly6c-af488、ly6g-percp-cy5.5、cd206-bv711、cd4-bv510、cd8a-apc-h7、nk1.1-pe-cy7、cd279-apc和cd274-pe。使用bd lsr-fortessa流式细胞仪采集样品,并使用bd diva software分析。
[2179]
在研究的第6、8、11和14天抽取血清样品以测量总huccl2及游离huccl2。
[2180]
下文“食蟹猕猴中ccl2清除效率的概念验证研究”中详细介绍检测游离ccl2的方法。为了分析此研究中的游离人ccl2,将重组食蟹猕猴ccl2置换为重组人ccl2,以制备校准物和qc。
[2181]
用未经验证但合格的特异性夹心elisa分析总ccl2血清样品。简而言之,将生物素化的抗ccl2捕获抗体(cnto888 ccl2-0004)、阻断缓冲液、预处理的测试样品和检测试剂(地高酰化(digoxigenylated)的抗ccl2抗体(m-1h11-igg))逐步添加到384孔链霉亲和素包被微量滴定盘中,在每个步骤中将盘置于非剧烈振荡器中孵育1小时。为了在预处理步骤中解离ccl2-药物复合物,将校准物或qc在ph 5.5下于37℃酸化10分钟。将酸化的样品添加到sa-mtp中。为了检测固定的免疫复合物,添加多克隆抗地高辛(digoxigenin)-pod缀合物,并将盘孵育60分钟。在各步骤后,将盘洗涤三次以除去未结合的物质。
[2182]
将abts加入板中,并在室温下振荡孵育。在405/490nm波长处测量吸收。使用分析软件xlfit(idbs),基于校准曲线的反应计算人ccl2浓度。
[2183]
依据统计分析的数据集,相应地应用了t-测试或单向anova与tukey测试进行多次比较。
[2184]
结果
[2185]
在研究结束时,接受cklo2-sg1099(cklo2 pi-增强的fc)的那些小鼠的肿瘤体积和肿瘤重量显著降低(图9)。仔细观察肿瘤浸润,发现单核细胞髓源性抑制细胞(monocytic myeloid-derived suppressor cell,m-mdsc)的肿瘤浸润减少,如ccl2阻断所预期的(图9)。
[2186]
此外,血清分析证实该疗法的有效性:与igg1野生型fc cklo2分子相比,pi优化确实导致总ccl2积累的减少,而游离ccl2(未与抗体结合)在检测极限下被完全抑制(图10)。因此,本模型适合使用抗huccl2双互补位清除抗体cklo2-sg1099(cklo2 pi-增强的fc)研究在肿瘤中ccl2阻断的作用。在随后的研究中研究最佳剂量方案其为每周一次或两次以较低剂量给予cklo2-sg1099(cklo2 pi-增强的fc),并在数周内监测游离ccl2抑制作用的扩展。此外,在此模型中还探索了与t细胞活化疗法(即t细胞双特异性,pd-l1阻断)的组合。
[2187]
在另外的类似实验中,分析其他变体,例如cklo2-sg1095、cklo2-gg01、gg02和gg03/gg04。
[2188]
食蟹猕猴ccl2清除效率的概念验证(poc)研究
[2189]
方法。此研究的主要目的是评估食蟹猕猴中ccl2抑制作用的扩展和四种抗ccl2(mcp-1)抗体的清除效率。次要目的是评估这些抗体的药物代谢动力学(pk)特性。在30分钟内,以25mg/kg的单次iv输注方式对所有3至4岁的雄性动物施用所有抗体,并在70天内测量血清中的总ccl2和抗体浓度。研究的抗ccl2抗体由对照抗体(第1组和第2组)以及经过特殊工程化以增强消除ccl2-药物复合物(以下称为抗原清除或简称为清除)的抗体组成。第1组:cnto888
–
sg1(=igg1野生型)抗ccl2抗体(n=3只动物)作为最大ccl2总累积的对照;第2组:具有ph依赖性目标结合但无fc修饰的双互补位抗ccl2抗体cklo2-sg1(igg1野生型)(n
=3);第3组:具有ph依赖性目标结合和fc-pi并进一步修饰的双互补位抗ccl2抗体cklo2-sg1100(n=4)及第4组:具有ph依赖性目标标结合、fc-pi fcγrii和进一步修饰的双互补位抗ccl2抗体cklo2-sg1095(n=4)。
[2190]
在此研究中,定量抗体的总血清浓度、总(游离和抗体-结合的ccl2)及游离靶。此外,评估抗药物抗体(ada)的存在。使用phoenix 64(pharsight/certara),通过非隔室分析来分析抗体、总ccl2及游离ccl2曲线;数据使用graphpad prism v.6.07(graphpad software)说明。
[2191]
对于抗体,使用通用的人夹心elisa方法分析血清样品。通过elisa测量猴血清中总抗体的浓度。将2μg/ml抗人κ链抗体固定在maxisorp 96孔盘上过夜,然后在阻断缓冲液中于30℃下孵育2小时。在洗涤之前,将抗体校准曲线样品、质量控制样品和猴血清样品在盘上于30℃孵育1小时。接下来,添加抗人igg-hrp,并在洗涤前于30℃孵育1小时。将abts底物孵育10、20和30分钟,然后用酶标仪在405nm处检测。使用分析软件softmax pro(molecular devices),基于校准曲线的反应来计算抗体浓度。
[2192]
使用未经验证但合格的特定夹心ecl方法测定来分析总ccl2血清样品。将3μg/ml的抗ccl2抗体(r2f2-sg1)固定在multi-array 96孔盘(meso scale discovery)上过夜,然后在阻断缓冲液中于30℃孵育2小时。将食蟹猕猴ccl2校准曲线样品、质量控制样品及食蟹猕猴稀释血清样品与ph5.5酸性缓冲液在37℃下孵育10分钟。之后,将样品在30℃的抗ccl2固定盘上孵育1小时,然后洗涤。接下来,添加sulfo tag标记mcp-1抗体,并在洗涤前于30℃孵育1小时。立即将read buffer t(x4)(meso scale discovery)添加至盘中,并以sector imager 2400(meso scale discovery)检测信号。使用分析软件softmax pro(molecular devices),基于校正曲线的反应来计算食蟹猕猴ccl2的浓度。
[2193]
以未经验证但合格的gyrolabtm免疫测定法,在gyrolab xplore上运行分析游离的ccl2血清样品。使用生物素化的抗ccl2抗体(m-2f6-igg)作为捕获试剂,并选择alexa647标记抗ccl2抗体(m-1h11-igg)进行检测。将两种试剂以pbs,0.1%tween,1%bsa稀释至1μg/ml,然后转移至96孔pcr盘(fisher scientific)。食蟹猕猴ccl2校准曲线样品、qc和未稀释的血清样品也转移至96孔pcr盘中。将两个盘与gyrolab bioaffy 200nl盘(gyros protein technologies ab)一起装入仪器。选择三步测定方案(200-3w-001)。简而言之,该方案描述将捕获试剂、样品和检测试剂依序添加到gyrolab bio affy 200圆盘的指定链霉亲和素柱中,在圆盘上进行短暂的旋转步骤后,每种试剂会同时到达柱,每个步骤后,用0.05%tween pbs洗涤柱,最后在仪器内记录雷射诱导的荧光值。使用xl fit软件(idbs),基于校准曲线的反应计算游离食蟹猕猴ccl2浓度。
[2194]
使用其他处所述的方法分析ada(stubenrauch等人,2010)。总之,将生物素化mab抗人fcγ-pan r10z8e9以0.5μg/ml的浓度结合至经链霉亲和素包被的高结合盘,并孵育1小时,将样品和标准物以测定缓冲液稀释至5%食蟹猕猴血清,并在洗涤后添加至经包被的盘的各孔中,并振荡孵育1小时。洗涤后,加入0.1μg/ml的地高辛化抗食蟹猕猴(cyno)igg,并振荡孵育1小时。洗涤后,加入25mu/ml的多克隆抗地高辛-hrp缀合物,并振荡温孵1小时。将abts加入盘中,并在室温下振荡孵育10分钟。以用酶标仪在405/490nm波长处测量吸收。使用分析软件softmax pro(molecular devices),基于校准曲线的反应来计算ada浓度。
[2195]
结果。在无ada的动物(即第14天之前)的时间内评估pk行为。在此时期,所有抗
ccl2抗体的血清浓度-时间曲线是相似的(参见图11左图),且在第1、2、3和4组分别为1490、1810、1210和1320天μg/ml的不同组之间,部分平均auc值(auc
0-7d
)相当。相似地,平均c
max
值分别与第1、2、4和4组的620、764、616和664μg/ml相当。ada的发展程度在动物和各组别之间差异很大,并导致第7天后的高度可变的pk曲线(数据未显示)。在70天的整个观察期内,第2组的一只动物为ada阴性(见图11右图)。在此动物中,通过非隔室分析,抗ccl2抗体的清除率、分布体积和终末半衰期分别为7.34ml/(天.kg)、76.2ml/kg和10.9天。
[2196]
在抗体治疗开始之前,评估每只动物血清中ccl2的基线水平。基础ccl2水平范围为0.126至0.357ng/ml(几何平均数(%cv):0.199ng/ml(32.2%,n=14))。由于ccl2的游离形式具有比ccl2的抗体结合形式更高的消除率,预期抗体治疗后总ccl2血清浓度会增加。在所有组别中均确实观察到了这点(图12左图),表明所有抗体均与目标结合。在治疗下,第1、2、3和4组的总ccl2的c
max
值分别增至824、575、106、32.7ng/ml。第1、2、3和4组的auc
0-7d
值分别为3060、2970、522和181天.ng/ml。在动物为ada阴性期间,摩尔药物浓度仍然超过总ccl2浓度。与常规抗体(第1组)相比,两种清除抗ccl2抗体(第3组和第4组)在总ccl2血清浓度上显示基于血清c
max
值分别为约8倍和25倍及基于总ccl2的auc
0-7d
值约6和17倍的可观降低。第2组的ada阴性动物表现出总ccl2浓度的持续目标接合(高原区明显)(图12右图)。
[2197]
用所有抗体进行的治疗均导致血清中游离ccl2水平的显著降低(图13左图),但这种降低部分仅在开始时。在第1组中,一天后所有个体的游离ccl2含量均再次达到可量化水平。在第2组中,两天后所有个体的游离ccl2含量均再次达到可量化水平。在第3组和第4组中,每组有两个个体显示七天的游离ccl2抑制。在第3组中,两只具有中等ada反应并保持足够抗体浓度的动物在21天的检测限度内表现出游离的ccl2抑制。在ada阳性动物中,抗体消除显著增加,且由于失去目标结合的结果,ccl2水平迅速恢复到其原始基线(此处未显示)。
[2198]
在另外的类似实验中,分析其他变体,例如cklo2-sg1099、cklo2-gg01、gg02和gg03/gg04。
[2199]
食蟹猕猴ccl2清除效率的pk/pd研究
[2200]
研究大纲和目标。pk/pd研究是基于使用抗ccl2抗体ckl02-sg1095进行的poc研究结果而设计的。由于poc研究证明了高度的抗药物抗体(ada)形成,因此在pk/pd研究中加入(obinituzumab)治疗,目的是减少ada反应。为了此目的,在整个研究中通过静脉输注施用30mg/kg剂量的gazyva四次:第-14、-7、8和36天。在第1天(第1-3组),在30分钟内以iv输注向每剂量组别四只动物(2/2只雄性和雌性)以2.5、10和25mg/kg的剂量给药ckl02-sg1095。为了比较,在第1天的30分钟内iv输注25mg/kg常规抗ccl2抗体(cnto888-igg1)(第4组;与上述poc研究的第1组相同的对照)。将总pk(ckl02-sg1095)、总ccl2和游离ccl2浓度评估直至第99天(即给药后14周)。
[2201]
pk/pd研究的目的是证实与非人类灵长类动物中的常规抗ccl2抗体(具有野生型igg1 fc部分的cnto888)相比,ckl02-sg1095的游离ccl2的延长抑制期间。
[2202]
方法。在此研究中,定量总pk及总ccl2和游离ccl2。然而,由于血清样品中存在gazyva,与本文所述的poc研究相比,对总pk测定、总ccl2测定和ada测定进行一些修正。对于cnto888 igg1,未开发pk分析。
[2203]
通过elisa测量猴血清中总抗体ckl02-sg1095的浓度。对于elisa生物素化重组人ccl2(抗原),将预处理的测试样品、阳性对照标准物(校准品)或qc(品质对照)和地高辛化
抗人igg(m-1.19.31-igg)依次添加至384孔链霉亲和素包被的微量滴定盘(sa-mtp)中。为了解离ccl2-药物复合物,在ph 5.5下执行测试样品的预处理20分钟。在加入sa-mtp之前,将酸化的样品中和。以多克隆抗地高辛-pod缀合物检测经固定的免疫复合物。在各步骤后,将盘洗涤三次以除去未结合的物质。将abts作为底物添加至盘中,并在室温下孵育。在405/490nm波长处测量吸收。使用分析软件xlfit(idbs),基于校准曲线的反应计算抗体浓度。
[2204]
用未经验证但合格的特异性夹心elisa分析总ccl2血清样品。简而言之,将生物素化抗ccl2捕获抗体*、预处理的测试样品和检测试剂(地高辛化抗ccl2抗体(1h11-igg1))逐步添加至384孔抗链霉亲和素包被的微量滴定盘中,并在无剧烈振动的振荡器上孵育,分别进行1小时的捕获和采样步骤,以及50分钟的检测试剂。为了在预处理步骤中解离ccl2-药物复合物,将校准物或qc在ph 5.5下酸化20分钟。将酸化的样品添加到sa-mtp中。为了检测固定的免疫复合物,添加多克隆抗地高辛(digoxigenin)-pod缀合物,并将盘孵育50分钟。在各步骤后,将盘洗涤三次以除去未结合的物质。
[2205]
将abts加入板中,并在室温下振荡孵育。在405/490nm波长处测量吸收。使用分析软件xlfit(idbs),基于校准曲线的反应计算食蟹猕猴ccl2浓度。*用于分析第1组至第3组的捕获抗体:抗ccl2 cnto8888igg1,用于分析第4组的捕获抗体:抗ccl2 2f2 igg1。
[2206]
用桥接夹心elisa在384孔盘中筛选ada。将第1组、第2组和第3组动物的测试样品、质量控制样品和阳性对照与生物素化捕获抗体ckl02-sg1095及地高辛化检测抗体ckl02-sg1095以及两种其他抗ccl2抗体(2f6-igg1和1h11-igg1)于室温、在mtp振荡器上以500rpm孵育过夜;添加这些抗体以中和ccl2。对于第4组的动物样品,分别使用生物素标记cnto888-sg1和地高辛化cnto888-sg1。将形成的免疫复合物转移至链霉亲和素(sa)包被的mtp,通过生物素标记(bi)捕获抗体固定免疫复合物。抽吸上清液后,通过反复洗涤除去未结合的物质。通过添加抗地高辛pod(p)共轭抗体和abts底物溶液来完成检测。亮度确定反应的颜色强度(在405nm-490nm处参考波长处的吸收)。若发现信号高于盘的特定切割点,则将样品定义为ada阳性。该切割点是在分析鉴定期间定义的。
[2207]
结果。尽管进行(obinituzumab)预处理,但在以ckl02-sg1095治疗的12只动物中的10只及四分之一经cnto888治疗的动物中发展出ada,对药物和生物标志物的浓度有影响。然而,ckl02-sg1095的两只ada阴性动物位于25mg/kg剂量组,可直接与cnto888组的ada阴性动物进行比较。在无ada的动物(即第10天之前)的时间内评估pk行为。ckl02-sg1095的三个不同剂量组的pk曲线显示在图14左图中。对于2.5、10和25mg/kg剂量水平的部分平均auc值(auc
0-7d
)分别为229/191(雄性/雌性)、696/813和1492/1346天.μg/ml。对于2.5、10和25mg/kg剂量水平的c
max
值分别为115/122(雄性/雌性)、369/491和869/941μg/ml。在最高剂量水平下,这些发现与poc研究一致。对于两只ada阴性动物,通过非隔室分析估计ckl02-sg1095的清除率、分布体积和终末半衰期分别为10.5-17.4ml/(天.kg)、116-118ml/kg和5.8-11.6天(参见图14右图)。
[2208]
至于上述的poc研究,在以抗ccl2抗体处理后观察到总ccl2的累积(参见图15左图)。在给药前,在五个时机点评估ccl2的基线水平(包括在(obinituzumab)治疗前的一个时机点);平均ccl2基线值为0.742ng/ml,且(obinituzumab)治疗不影响基础ccl2水平。总ccl2累积程度(括号中的数值表示相对于各个基线的中位数倍数变化)取决于剂量和构建体。对于ckl02-sg1095,在2.5、10和25mg/kg剂量水平下,总ccl2水平增加
ab32144)。按照标准染色方案(cc1用于64',omni-ultramap hrp dab检测系统检测系统),在ventana discovery ultra上使用针对单核细胞标记物cd14的小鼠单克隆抗体(cell marque epr3653,rtu)。按照标准染色方案(cc1用于32',ds2中cd163 rtu//cd68浓度为0.6μg/ml,以dab和red检测系统检测),在ventana bxt上使用对巨噬细胞和m2样tam(tumor-associated macrophage,肿瘤相关巨噬细胞)cd163/cd68(dab cd163 mouse mrq-26cell marque rtu//red cd68 mouse pg-m1 dako)的双重染色。所有图像均使用ventana进行扫描。对组织切片进行半定量分析。
[2228]
1.结果
[2229]
ccl2和ccr2患病率
[2230]
所有分析的肿瘤适应症均显示一些肿瘤具有可变水平的ccl2上调和可变量量的tam上ccr2的存在。(下表6)。对于ccl2和ccr2二者,在卵巢癌中均观察到最高表达,其次是pdac和gc
[2231]
肿瘤类型特有的特征
[2232]
具有高活性ccl2-ccr2的肿瘤与高mdsc吸引力和m2极化的肿瘤生长增强的免疫状态有关,代表了ccl2阻断治疗的优选肿瘤。ccr2 ihc显示出与mdsc和m2样巨噬细胞的良好相关性,从而证实其生物学作用,并证实此途径与ccl2 ihc测量相比在作为生物标志物上具有更高的相关性。从本研究的结论可以总结出以下有关ccl2治疗的建议:
[2233]
·
由于最高的ccl2和ccr2患病率及m2极化程度,因此建议将ovc用于ccl2靶向治疗;
[2234]
·
由于相较于其他分析的肿瘤类型,mdsc的含量最高,且因为ccr2和m2以相当高的水平及含量存在,因此可将pdac推荐用于ccl2靶向治疗。ccl2在pdac中也很高,且相较于其他肿瘤类型,在免疫细胞中的存在要比在肿瘤细胞中高出非常多。pac显示在ccl2/ccr2与mdsc吸引力/m2极化之间良好的相关性。这些结果支持在分析的pdac中,ccl2-ccr2的角色是高度集中在免疫细胞的吸引。
[2235]
·
对于ccl2靶向治疗,建议使用bc,尤其是tnbc:bc显示ccl2、ccr2、mdsc和m2具有相当高的水平和含量。尤其是tnbc病例,特征在于m2和mdsc含量高于非tnbc,尽管与其他肿瘤适应症相比,非tnbc在肿瘤细胞中显示出最高的ccl2产生。
[2236]
以下肿瘤适应症似乎对ccl2-ccr2-轴的依赖性较小,因此可能不建议用于ccl2靶向治疗:
[2237]
·
crc:与其他肿瘤类型相比,ccl2较低,尤其是与pac相比。同样在此,与其他肿瘤类型相比,量测到m2样巨噬细胞的量最低。ccr2和mdsc的含量不定。有趣的是,仅在此适应症中,可检测到ccl2和ccr2之间呈正相关的趋势。然而,整体的发现支持在crc中ccl2-ccr2的角色集中在肿瘤细胞的存活上而不是免疫细胞的吸引。
[2238]
·
尽管ccl2较高,但观察到ccr2的gc较低,并且mdsc的含量最低。m2样巨噬细胞以不定量存在。
[2239]
表6:在本研究中,分析的不同肿瘤类型的肿瘤细胞(tc)和免疫细胞(ic)中的ccl2和ccr2阳性表达。
[2240][2241]
·
在prc中,ccr2以不定水平存在。(未测量m2和mdsc)
[2242]
相关分析
[2243]
研究结果可总结如下:
[2244]
·
在肿瘤ccl2和ccr2(ihc)之间,正相关仅存在crc中。
[2245]
·
血清ccl2(elisa)与肿瘤中的任何测量参数均不相关,包括ccl2、ccr2、巨噬细胞和mdsc。仅在prc中发现与肿瘤ccl2正相关的趋势,这两种方法均显示非常低的值。
[2246]
·
ccr2表达与m2样巨噬细胞及cd14
+
细胞的存在呈正相关,与m1/m2的比率呈负相关,并证实ccr2的生物学作用。与mdsc吸引力相比,ccr2的水平与m2极化的相关性更好。
[2247]
·
ccl2显示与mdsc吸引力和m2极化呈正相关趋势。因此,单独的ccl2水平似乎并不是mdsc和m2样极化存在的主要因素。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1