pH响应性组合物、调配物和对肿瘤成像的方法与流程
ph响应性组合物、调配物和对肿瘤成像的方法
1.相关申请的交叉引用
2.本技术要求于2019年11月18日提交的美国临时申请第62/937,141号的权益,其全部内容通过引用并入本文。
3.关于联邦赞助的研究的声明
4.本发明是在美国国立卫生研究院授予的ca217528的政府支持下完成的。政府拥有本发明的某些权利。
背景技术:
5.在2019年预计将诊断出约170万新癌症病例,并且预计约610,000美国人将死于癌症。需要有效的成像剂来检测原发性和转移性肿瘤组织。
6.所有时期的实体癌的治疗指南均主要包括手术摘除原发性肿瘤以及处于危险中或涉及的淋巴结。尽管这些肿瘤类型之间存在生物学和解剖学差异,但术后边缘状态是局部肿瘤控制的最重要的预后因素之一,并且因此成为复发性疾病或肿瘤转移的机会。
7.实体瘤的手术切除是肿瘤疗效与最小化正常组织切除之间的平衡,并且因此是功能不全与美观之间的平衡。这也适用于为诊断和治疗目的执行的淋巴结切除术,其通常与原发性癌的摘除同时进行。是否存在淋巴结转移是胃肠癌、乳腺癌和许多其它实体癌存活的最重要的决定因素。虽然用于分期的身体检查或成像方式在检测肿大或异常的淋巴结方面是成功的,并且有助于手术治疗计划,但是对于很大部分的患者,淋巴结转移的水平太小而无法通过目前的方法检测到,这导致分期低下。由于隐匿性淋巴结转移较常见,选择性区域淋巴结清扫和组织学检查是许多实体癌(特别是当局部晚期时)的标准治疗。这会导致过度治疗,很可能导致治疗相关的不全。
8.基于细胞成像、天然自体荧光和拉曼散射,光学成像策略已经快速地适用于在术中对组织成像。光学成像提供了在手术期间进行实时反馈的可能性,并且有各种现成的照相机系统可以提供广泛的手术视野。克服手术期间由于癌基因型和组织学表型的多样性而遇到的复杂性的一个策略是靶向癌症中普遍存在的代谢脆弱性。有氧糖酵解,称为瓦博格(warburg)效应,在所有实体癌中均发生,并且表示一种此靶标,其中癌细胞优先摄取葡萄糖并将其转化为乳酸。
技术实现要素:
9.在一些情况下,本文呈现的组合物利用ph作为实体癌的通用生物标志物,其中癌性组织与正常组织之间普遍存在ph差异,并且在被细胞摄取后提供高度灵敏和特异性的荧光响应,从而允许检测肿瘤组织、肿瘤边缘和转移性肿瘤,包括淋巴结和腹膜转移。
10.在一些情况下,本文所述的化合物是可用于检测原发性和转移性肿瘤组织(包括淋巴结)的成像剂。手术期间的实时荧光成像有助于外科医生划定肿瘤组织与正常组织,目的是实现阴性边缘和完全肿瘤切除,以及检测转移性淋巴结。手术成果改善的临床益处包括如肿瘤复发率和再手术率降低、避免不必要的手术、保留功能、美容和告知患者治疗计
划。
11.在某些实施例中,本文提供了式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0012][0013]
其中:n=90至140;x为50至200;y为0至3;z为0至3;并且x1为卤素、-oh或-c(o)oh。
[0014]
在一些实施例中,x1为卤素。在一些实施例中,x1为-br。在一些实施例中,n为100至120。在一些实施例中,n为113。在一些实施例中,x为60至150。在一些实施例中,y为0.5至1.5。在一些实施例中,y为0。在一些实施例中,z为1.5至2.5。在一些实施例中,z为0。
[0015]
在某些实施例中,本文提供了一种胶束,该胶束包含一或多种式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。
[0016]
在某些实施例中,本文提供了一种ph响应性组合物,该ph响应性组合物包含ph转变点和发射光谱。在一些实施例中,ph转变点为4.8至5.5。在一些实施例中,ph转变点为约4.8、4.9、5.0、5.1、5.2、5.3、5.4或5.5。在一些实施例中,发射光谱为700至900nm。在一些实施例中,组合物具有小于1个ph单位的ph转变范围(δph
10-90%
)。在一些实施例中,ph转变范围小于0.25个ph单位。在一些实施例中,ph转变范围小于0.15个ph单位。在一些实施例中,组合物具有大于25的荧光活化比率。在一些实施例中,组合物具有大于50的荧光活化比率。
[0017]
在某些实施例中,本文提供了一种成像剂,该成像剂包含一或多种具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,成像剂包含聚(环氧乙烷)-b-聚(甲基丙烯酸二丁基氨基乙酯-r-甲基丙烯酸氨基乙酯盐酸盐)共聚物吲哚菁绿和乙酸缀合物。
[0018]
在某些实施例中,本文提供了一种包含胶束的药物组合物,其中该胶束包含1)一或多种具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0019][0020]
其中:n为90至140;x为50至200;y为0至3;z为0至3;并且x1为卤素、-oh或-c(o)oh;以及2)稳定剂。
[0021]
在一些实施例中,稳定剂为冷冻保护剂。在一些实施例中,稳定剂为糖、糖衍生物、去污剂或盐。在一些实施例中,稳定剂为单糖、二糖、三糖、水溶性多糖或糖醇或其组合。在一些实施例中,稳定剂为果糖、半乳糖、葡萄糖、乳糖、蔗糖、海藻糖、麦芽糖、甘露醇、山梨醇、核糖、糊精、环糊精、麦芽糖糊精、棉子糖或木糖或其组合。在一些实施例中,稳定剂为海藻糖。
[0022]
在一些实施例中,药物组合物包含约0.5%至约25%w/v(重量/体积百分比)、约1%至约20%w/v、约5%至约15%w/v、约6%至约13%w/v、约7%至约12%w/v或约8%至约11%w/v的稳定剂。在某些实施例中,药物组合物包含约5%w/v、约6%w/v、约7%w/v、约8%w/v、约9%w/v、约10%w/v、约11%w/v、约12%w/v、约13%w/v、约14%w/v或约15%w/v的稳定剂。
[0023]
在一些实施例中,药物组合物还包含液体或水性载剂。在一些实施例中,液体载剂选自无菌水、盐水、d5w或林格氏乳酸盐溶液。
[0024]
在一些实施例中,药物组合物包含约1.0mg/ml至约5.0mg/ml的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约0.1mg/kg至约3mg/kg或约0.1至约1.2mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1mg/kg、2mg/kg、3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg或约7mg/kg的式(ii)的嵌段共聚物。在一些实施例中,该组合物包含约0.1mg/kg、0.3mg/kg、0.5mg/kg、0.8mg/kg、1mg/kg、1.2mg/kg、1.4mg/kg、1.6mg/kg、1.8mg/kg、2mg/kg、2.5mg/kg或3mg/kg的式(ii)的嵌段共聚物。
[0025]
在另一方面,本文提供了一种药物组合物,该药物组合物包含约3mg/ml的具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0026][0027]
其中:n为90至140,x为60至150,y为0至3;z为0至3;并且x1为br;以及约10%w/v的海藻糖水溶液。在一些实施例中,药物组合物被配制用于口服、肌内、皮下、肿瘤内或静脉内施用。在某些实施例中,药物组合物被配制用于静脉内(i.v.)施用。
[0028]
在另一方面,本文提供了一种对细胞内或细胞外环境的ph成像的方法,该方法包含:(a)将本公开的药物组合物与环境接触;以及(b)检测来自环境的一或多种光学信号,其中检测到的光学信号指示胶束已经达到其ph转变点并且解缔合。在一些实施例中,光学信号是荧光信号。在一些实施例中,对细胞内环境成像,在适于引起摄取ph响应性组合物的条件下将细胞与ph响应性组合物接触。在一些实施例中,细胞内环境是细胞的一部分。在一些实施例中,细胞外环境是肿瘤或血管细胞的细胞外环境。在一些实施例中,细胞外环境是血管内或血管外的。在一些实施例中,肿瘤是实体瘤。在一些实施例中,肿瘤是癌症的肿瘤,其中该癌症是乳腺癌、结肠直肠癌、膀胱癌、食道癌、头颈癌(hnssc)、肺癌、脑癌、前列腺癌、卵巢癌或皮肤癌(包括黑素瘤和肉瘤)。
[0029]
在另一方面,本文提供了一种切除患者的肿瘤的方法,该方法包含:(a)检测来自施用有效剂量的本文所述的药物组合物的患者的肿瘤或其试样的一或多种光学信号,其中检测到的光学信号指示肿瘤的存在;以及(b)经由手术切除肿瘤。在一些实施例中,光学信号指示肿瘤的边缘。在一些实施例中,肿瘤被切除至少90%、95%或99%。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、肺癌、卵巢癌、前列腺癌、膀胱癌、尿道癌、食道癌、脑癌、胰腺癌、皮肤癌、黑素瘤、肉瘤、胸膜转移、肾癌、淋巴结癌、宫颈癌或结肠直肠癌。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、食道癌、结肠直肠癌、卵巢癌或前列腺癌。
[0030]
在一些实施例中,在手术之前施用本文公开的药物组合物。在一些实施例中,在对肿瘤或淋巴结成像之前施用药物组合物。在一些实施例中,在临床成果的患者管理之前施用本文公开的药物组合物。在一些实施例中,在手术之前至少1小时、至少2小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少24小时、至少28小时、至少32小时、至少80小时、至少1天、至少2天、至
少3天、至少4天、至少5天、至少6天、至少1周或至少2周施用该药物组合物。在一些实施例中,在手术之前约1小时至约32小时、约2小时至约32小时、16小时至约32小时、约20小时至约28小时、约1小时至约5小时或约3小时至约9小时施用该药物组合物。在一些实施例中,该药物组合物作为注射剂或输注剂施用。在一些实施例中,该药物组合物以单剂量或多剂量施用。
[0031]
在另一方面,本文提供了一种治疗癌症的方法,该方法包含:(a)在施用有效剂量的本文所述的药物组合物的有需要的癌症患者中检测一或多种光学信号,其中检测到的光学信号指示癌性肿瘤的存在。在一些实施例中,该方法还包含在从患者摘除后,任选地通过后台荧光引导成像,对癌症患者的体腔成像,或对癌性肿瘤或其切片或样本(例如,新鲜的或福尔马林固定的)成像。
[0032]
在另一方面,本文提供了一种使癌症复发最小化至少五年的方法,该方法包含:(a)在施用有效剂量的本文公开的药物组合物的有需要的癌症患者中检测一或多种光学信号,其中检测到的光学信号指示癌性肿瘤的存在,并且其中肿瘤的存在指示癌症的复发;以及(b)如果检测到该一或多种光学信号,则治疗该癌症以最小化该复发。在一些实施例中,该方法还包含切除肿瘤。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、肺癌、卵巢癌、前列腺癌、膀胱癌、尿道癌、食道癌、结肠直肠癌、脑癌或皮肤癌。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、食道癌、胸膜转移、肾癌、淋巴结癌、宫颈癌、胰腺癌或结肠直肠癌。在一些实施例中,在对患者成像之前至少1小时、至少2小时、至少4小时、至少6小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少24小时、至少28小时、至少32小时、至少80小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少1周或至少2周施用药物组合物。在一些实施例中,在对患者成像之前约1小时至约32小时、约2小时至约32小时、16小时至约32小时、约20小时至约28小时、约1小时至约5小时或约3小时至约9小时施用该药物组合物。在一些实施例中,该药物组合物作为注射剂或输注剂施用。在一些实施例中,该药物组合物以单剂量或多剂量施用。在一些实施例中,该方法还包含对癌症患者成像,该成像包含术中照相机或内窥镜照相机。在一些实施例中,有需要的患者是人患者。在一些实施例中,有需要的患者是犬科动物、猫科动物、牛、马、猪或兔患者。
[0033]
本文所述的嵌段共聚物、方法和组合物的其它目的、特征和优点将从以下具体实施方式中变得显而易见。然而,应当理解,具体实施方式和具体实例虽然指示了具体实施例,但仅以说明的方式给出,因为通过该具体实施方式,在本公开的精神和范围内的各种改变和修改对于本领域技术人员将变得显而易见。
[0034]
通过引用并入本文
[0035]
本说明书中提及的所有出版物、专利和专利申请均以引用的方式并入本文中,其程度与每个单独的出版物、专利或专利申请被具体并单独地指示以引用的方式并入的程度相同。
附图说明
[0036]
在所附权利要求中具体阐述了本公开的各个方面。通过参考以下阐述说明性实施例(在这些说明性实施例中利用了本公开的原理)的具体实施方式和以下附图将获得对本
公开的特征和优点的更好理解。
[0037]
图1a至1b显示了在单次静脉内给药包含0.1、0.3、0.5、0.8或1.2mg/kg的化合物1的药物组合物后阶段1a平均血浆浓度与时间的关系。图1a显示了平均血浆浓度(log)与时间的关系。图1b显示了平均线性血浆浓度与时间的关系。
[0038]
图2公开了平均10分钟时药物组合物血浆浓度(c
10m
)与化合物1的剂量之间的相关性。
[0039]
图3公开了平均auc
0-24hr
与化合物1的剂量之间的相关性。
[0040]
图4a至4b显示了在单次静脉内给药包含1.2mg/kg的化合物1的药物组合物后阶段1b受试者(患者)血浆浓度与时间的关系。图4a显示了患者血浆浓度(log)的平均血浆浓度剂量与时间的关系。图4b显示了患者血浆浓度(线性)与时间的关系。
[0041]
图5a至5b显示了在单次静脉内给药包含0.1、0.3、0.5、0.8或1.2mg/kg的化合物1的药物组合物后阶段1a和阶段1b平均血浆浓度与时间的关系。图5a按剂量显示了阶段1a和阶段1b平均血浆浓度(log)与时间的关系。图5b按剂量显示了阶段1a和阶段1b平均血浆浓度(线性)与时间的关系。
[0042]
图6显示了10分钟时阶段1a和阶段1b平均(
±
sd)血浆浓度与化合物1的剂量的关系。
[0043]
图7显示了阶段1a和阶段1b平均(
±
sd)auc
0-24hr
与剂量的关系。
[0044]
图8a至8j按肿瘤类型显示了化合物1的平均血浆浓度。图8a按肿瘤类型显示了阶段1a(1.2mg/kg)和阶段1b平均血浆浓度(log)与时间的关系;图8b按肿瘤类型显示了阶段1a(1.2mg/kg)和阶段1b平均血浆浓度(线性)与时间的关系;图8c显示了乳腺癌中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(log)与时间的关系;图8d显示了结肠直肠癌肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(log)与时间的关系;图8e显示了食道癌肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(log)与时间的关系;图8f显示了头颈(hnscc)肿瘤中阶段1a(1.2mg/kg)和阶段1b个体血浆浓度(log)与时间的关系;图8g显示了乳腺癌肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(线性)与时间的关系;图8h显示了结肠直肠癌肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(线性)与时间的关系;图8i显示了食道癌肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(线性)与时间的关系;图8j显示了hnscc肿瘤中阶段1a(1.2mg/kg)和阶段1b患者血浆浓度(线性)与时间的关系。
[0045]
图9a至9b显示了来自三名患者的术中图像,他们分别用0.5mg/kg(图9a)和1.2mg/kg(图9b)的化合物1给药并使用诺瓦达克(novadaq)公司spy elite照相机成像。左栏显示了白光图像,并且右栏显示了荧光图像。
[0046]
图10a至10b显示了3名患者的图像拍摄的术后样本,他们分别用0.5mg/kg(图10a)和1.2mg/kg(图10b)的化合物1给药并使用利科(li-cor)公司pearl照相机成像。
[0047]
图11a至11b显示了对比噪声比(cnr,图11a)和肿瘤本底比(tbr,图11b)荧光强度对比率。
[0048]
图12a至12b显示了样本(福尔马林固定的(ff)或新鲜的)的经组织学证实的肿瘤和正常组织的术后平均荧光强度与剂量的关系(图12a)以及经组织学证实的肿瘤和正常组织的术后平均荧光强度与初始血浆浓度的关系(图12b)。
[0049]
图13a至13b显示了cnr(图13a)和tbr(图13b)荧光比率,它们分别使用从病理学家
针对5个剂量水平下的所有15名患者选择的面包条切片(福尔马林固定的(ff)或新鲜的)的经组织学证实的肿瘤和正常区域获得的术后平均荧光强度计算。
[0050]
图14示出了研究设计。在手术之前24小时(
±
8小时)执行化合物1的静脉内施用。随后进行十天的安全性评估(实验室、pk、ecg),监测不良事件至第17天(a)。手术期间,在切开之前和切除手术腔之后获得术中图像(b)。切除后立即对样本成像,以确定是否存在阳性手术边缘(c)。在所有标准病理学处理阶段期间获得荧光图像(d、e),并且将h/e切片与标准组织病理学切片相关联(f至h)。ecg心电图,h/e苏木精-伊红,soc标准治疗。
[0051]
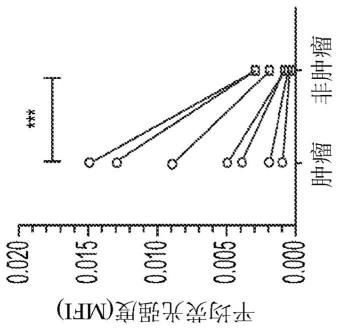
图15示出了不同肿瘤组织切片的荧光图像。头颈鳞状细胞舌癌(a至f);乳腺癌(g至l);食道癌(m至r),结肠直肠癌(s至x)。肿瘤在h/e切片(c、i、o、u)中描画为实心黑线。描述了每个肿瘤类型的肿瘤组织和非肿瘤组织切片的平均荧光强度(mfi)(y)。圆点表示来自1.2mg/kg组群的单个组织切片(约3个/受试者)的mfi。hnscc,7名受试者,p《0.0001;bc,5名受试者,p=0.0001;ec,3名受试者,p=0.0010;以及威尔科克斯(wilcox)检验,双侧。crc,3名受试者,由于仅有3个数据点可用,未执行统计。
[0052]
图16显示了不同肿瘤类型的术后组织样本的化合物1荧光结果。图像示出了来自具有阴性手术边缘的受试者的舌头的头颈鳞状细胞癌的代表性实例。肿瘤(a、c、g、i)中荧光的体内和体外可视化,其中在手术腔中或手术切除处没有荧光信号(b、h、d、j)。组织切片上的荧光信号与组织学(e、k、f)的相关性,其中肿瘤阴性手术边缘为6.4mm。具有肿瘤阳性手术边缘(l、m、n、o)的乳腺癌手术(即乳房肿瘤切除术)的代表性实例。体内和切除(r、s、t、u)之后立即在腹侧手术边缘处检测到荧光,其与组织切片上的荧光定位(p、v)和最终组织病理学(q)相对应。肿瘤在h/e切片(f、q)上描画为实心黑线。h/e苏木精-伊红,soc标准治疗。
[0053]
图17显示了hnscc和bc的临床相关图像。(a至c)显示了术中检测到的腹膜转移(pm)。(d至f)显示了在切除下颌骨的头颈鳞状细胞癌(hnscc)之后在手术腔中检测到的附加的肿瘤病变。(g至i)示出了来自唾液腺组织的假阳性荧光病变。(j至o)示出了在两名bc受试者中检测到原发性肿瘤病变的附加附属转移,并通过最终组织病理学检查证实。(p至r)示出了在来自bc受试者的新鲜组织切片上检测到附加原发性肿瘤病变,示出了在手术之前和手术期间未检测到的三阴性乳腺癌。(c、f、l、o、r)示出了肿瘤在h/e载玻片中描画为实心黑线。(i)示出了假阳性不含存活的肿瘤组织。
[0054]
图18a至18b描述了证实化合物1的肿瘤特异性活化的荧光显微镜检查。图18a显示了在切除后直接将化合物1喷雾到新鲜冰冻的hnscc样本的组织切片上之后体外执行的荧光显微镜检查。dapi用于核染色(a),并且化合物1用于荧光可视化(b)。观察到肿瘤与基质组织之间荧光的明确描画(c),并且其与用苏木精和伊红染色的对应组织病理学组织切片相关联(d)。图18b示出了化合物1在人血浆中的ph依赖性活化。将增加量的化合物1加入到未示出任何荧光增加的人血浆中。当使用hcl重复实验以向血浆供应质子时,随着加入增加量的完整化合物1,荧光增加,这表明酸中毒正在以剂量依赖性方式活化化合物1并因此活化荧光。rfu:相对荧光单位。
[0055]
图19将荧光手术边缘评估与最终组织病理学结果相关联。可以通过对手术腔的术中荧光成像或后台对切除样本荧光成像来进行荧光引导手术期间手术边缘的术中评估。最终的组织病理学与乳腺癌受试者(a)和头颈鳞状细胞癌受试者(b)的荧光图像相关联。
[0056]
图20描述了肿瘤组织与非肿瘤组织之间的非剂量依赖性平均荧光强度分离。肿瘤和非肿瘤组织平均荧光强度(mfi):来自0.1mg/kg组群,p=0.0005(a);来自0.3mg/kg组群,p=0.0078(b);来自0.5mg/kg组群,p=0.0020(c);来自0.8mg/kg组群,p=0.0078(d);以及来自1.2mg/kg组群,p《0.0001,威尔科克森(wilcoxon)检验,双侧(e)。圆点代表单个组织切片的mfi。受试者工作特征曲线基于从1.2mg/kg剂量组群计算的肿瘤和正常组织的mfi,p《0.0001;曲线下面积0.9875,n=59,置信区间为95%,使用威尔逊/布朗(wilson/brown)方法(f)。roc受试者工作特征曲线,auc曲线下面积。**p≤0.01;***p≤0.001;****p≤0.0001。
[0057]
图21示出了使用化合物1荧光的体内成像。使用化合物1荧光的体内成像数据的代表性实例。使用化合物1体内可视化具有中心坏死性溃疡的大舌癌(a)。使用化合物1体内可视化位于右下颌骨/口底的癌症(b)。使用化合物1可视化具有中心坏死性溃疡的大舌癌(c)。使用化合物1体内可视化具有广泛腹膜转移的结肠直肠癌(d)。
[0058]
图22示出了在给药化合物1后3至9小时和1至5小时的乳腺癌和hnscc肿瘤的荧光成像。用spy elite和视觉传感(visionsense)公司照相机示出图像。
[0059]
图23使用具有更新后的软件和硬件的达芬奇萤火虫(da vinci firefly)照相机展示了化合物1在术中通过薄前列腺囊在前列腺癌中发荧光。在手术床中未检测到荧光,这与通过病理学证实的阴性边缘一致。
[0060]
图24使用视觉传感照相机展示了卵巢癌(在阴道断端处复发)中的化合物1荧光。在以3mg/kg的化合物1给药6
±
3小时之后执行切除前体内成像。
[0061]
图25示出了在对应于病理学证实的肿瘤区域的面包条载玻片(bls)组织样本上的化合物1荧光。
[0062]
图26示出了使用spy elite照相机在具有3至5小时的给药时间表安排的所有可见bc和hnscc肿瘤中验证了化合物1荧光。
[0063]
图27示出了从犬患者切除的肥大细胞肿瘤。施用化合物1之后从犬患者切除的肥大细胞肿瘤的代表性白光(左)和荧光图像(右)。
[0064]
图28示出了软组织肉瘤的代表性图像。肥大细胞肿瘤的白光图像在(a)中是明显的,并且在(b)中在切除之前使用上述定制的nir照相机也可以容易地在术中观察到。在(c)中示出了具有组织边缘的切除肿瘤的白光照片,并且由利科pearl成像的切除肿瘤的对应荧光图像与白光图像重叠以示出荧光与白光解剖学的共定位(d)。组织病理学证实了切除组织的恶性肿瘤。
[0065]
图29示出了患有骨肉瘤的犬患者的代表性图像。(a)示出了切断的腿上病变的白光照片;绿色和黑色虚线分别指示正常和癌性组织横截面的位置。(b)示出了使用滨松(hamamatsu)公司pde nir照相机拍摄的nir肿瘤图像。(c)示出了来自如(a)中所述的正常(左,较小)和癌性组织(右,较大)的横截面的白光照片。(d)示出了(c)中所示的相同正常(非荧光)和癌性(荧光组织)的横截面的nir图像。
[0066]
图30示出了患有软组织肉瘤的犬患者的代表性图像。切除的具有边缘的软组织肉瘤的白光图像在图的左侧示出,并且肿瘤组织的荧光图像(与白光重叠)在图的右侧示出。组织病理学证实了切除组织的恶性肿瘤。
[0067]
图31示出了患有原发性软组织耳廓肉瘤的犬患者的图像。软组织耳廓肉瘤的白光
图像在左上和左下图片上示出。使用滨松pde在耳朵切断后拍摄的nir图像示出了肿瘤通过皮肤发荧光(下部中间图片)。还使用利科系统对耳朵成像,示出了在执行核心钻取活组织检查后的剩余荧光(分别为右下方和嵌图图像)。钻取活组织检查的组织病理学分析证实了组织的恶性肿瘤。
[0068]
图32示出了患有原发性软组织肉瘤和远端肿瘤累及淋巴结的犬患者的图像。左上图片的白光图像示出了原发性软组织肉瘤。在手术摘除该肿块期间,观察到腘淋巴结肿大(最右上图片),并且其被摘除并使用利科成像(最中心图片)。荧光图像示出了横断的淋巴结是患病的,并且这通过组织病理学而确证。
具体实施方式
[0069]
本文提供的一些实施例描述了基于胶束的荧光成像剂。在一些实施例中,该胶束包含聚乙二醇(peg)和二丁基氨基取代的聚甲基丙烯酸甲酯(pmma)的二嵌段共聚物,其通过nhs化学在甲基丙烯酸2-氨基乙酯盐酸盐单体上共价缀合至吲哚菁绿(icg)。在一些实施例中,peg包含稳定胶束的壳或表面。在一些实施例中,胶束尺寸《100nm。
[0070]
i.化合物
[0071]
在一些实施例中,本文提供了一种具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0072][0073]
其中:
[0074]
x1为卤素、-oh或-c(o)oh;
[0075]
n为90至140;
[0076]
x为50至200;
[0077]
y为0至3;并且
[0078]
z为0至3。
[0079]
在一些实施例中,式(ii)的嵌段共聚物为化合物。在一些实施例中,式(ii)的嵌段共聚物为二嵌段共聚物。在一些实施例中,式(ii)的嵌段共聚物为包含亲水性聚合物链段
和疏水性聚合物链段的嵌段共聚物。
[0080]
亲水性聚合物链段包含聚环氧乙烷(peo)。在一些实施例中,亲水性聚合物链段的尺寸为约2kda至约10kda。在一些实施例中,亲水性聚合物链段的尺寸为约2kda至约5kda。在一些实施例中,亲水性聚合物链段的尺寸为约3kda至约8kda。在一些实施例中,亲水性聚合物链段的尺寸为约4kda至约6kda。在一些实施例中,亲水性聚合物链段的尺寸为约5kda。
[0081]
在一些实施例中,嵌段共聚物包含疏水性聚合物链段。在一些实施例中,疏水性聚合物链段包含叔胺。在一些实施例中,疏水性聚合物链段包含:
[0082][0083]
其中x总共约为50至200。在一些实施例中,x为约60至150。在一些实施例中,x为约60至约150的整数。在一些实施例中,亲水性链段包含二丁胺。
[0084]
在一些实施例中,存在n个重复聚环氧乙烷重复单元。在一些实施例中,n为90至140。在一些实施例中,n为95至130。在一些实施例中,n为100至120。在一些实施例中,n为100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119或120。在一些实施例中,n为114。在一些实施例中,n为113。
[0085]
在一些实施例中,y为0至3。在一些实施例中,y为0.5至2.5。在一些实施例中,y为1.5至2.5。在一些实施例中,y为0.5至1.5。在一些实施例中,y为0.5、1、1.5、2、2.5或3。在一些实施例中,y为1、2或3。在一些实施例中,y为0.5。在一些实施例中,y为1.5。在一些实施例中,y为0。
[0086]
在一些实施例中,z为0至3。在一些实施例中,z为1.5至2.5。在一些实施例中,z为1、1.5、2、2.5或3。在一些实施例中,z为1、2或3。在一些实施例中,z为1.5。在一些实施例中,z为0。
[0087]
在一些实施例中,共聚物嵌段单元(x、y和z)可以任何顺序或构型发生。在一些实施例中,x、y和z如式(ii)所述依序发生。
[0088]
在某些实施例中,嵌段共聚物包含通过胺缀合的荧光染料。在一些实施例中,荧光染料为ph不灵敏染料。在一些实施例中,荧光染料为花青染料或其衍生物。在一些实施例中,荧光染料为吲哚菁绿(icg)。吲哚菁绿(icg)用于医学诊断。
[0089]
在一些实施例中,嵌段共聚物不缀合至荧光染料或其衍生物。在一些实施例中,嵌段共聚物不缀合至吲哚菁绿(icg)。
[0090]
在一些实施例中,式(ii)的嵌段共聚物为聚(环氧乙烷)-b-聚(甲基丙烯酸二丁基氨基乙酯-r-甲基丙烯酸氨基乙酯盐酸盐)共聚物吲哚菁绿和乙酸缀合物。在一些实施例中,式(ii)的嵌段共聚物为peo
90-140-b-p(dba
60-150-r-icg
0-3-r-ama
0-3
),(化合物1)。
[0091]
在一些实施例中,x1为末端集团。在一些实施例中,末端封端基团是原子转移自由基聚合(atrp)反应的产物。在一些实施例中,x1为卤素。在一些实施例中,x1为br。在一些实
施例中,x1为-oh。在一些实施例中,x1为酸。在一些实施例中,x1为-c(o)oh。在一些实施例中,x1为h。
[0092]
术语“r”是指不同嵌段共聚物单元/链段(例如,由x、y和z表示)之间的连接。在一些实施例中,每个r独立地为连接单元/链段的碳原子的键,或烷基-(ch2)
n-,其中n为1至10。在一些实施例中,共聚物嵌段链段/单元(例如,由x、y和z表示)可以以任何顺序、次序或构型发生。在一些实施例中,共聚物嵌段单元如式(ii)所述依序发生。
[0093]
在一些实施例中,式(ii)的嵌段共聚物具有式(ii-a)的结构或其药学上可接受的盐、溶剂化物或水合物:
[0094][0095]
在一些实施例中,式(ii)的嵌段共聚物是胶束或纳米颗粒的形式。胶束的尺寸通常为纳米级(即,直径为约1nm至1μm)。在一些实施例中,胶束的尺寸为约10至约200nm。在一些实施例中,胶束的尺寸为约20至约100nm。在一些实施例中,胶束的尺寸为约30至约50nm。在一些实施例中,胶束的直径小于约1μm。在一些实施例中,胶束的直径小于约100nm。在一些实施例中,胶束的直径小于约50nm。
[0096]
在另一方面,本文提供了一种ph响应性组合物,该ph响应性组合物包含一或多种式(ii)的嵌段共聚物。
[0097]
在一些实施例中,ph响应性组合物具有ph转变点和发射光谱。在一些实施例中,ph转变点为4至8或6至7.5。在一些实施例中,ph转变点为4.8至5.5。在一些实施例中,ph转变点为约4.8、4.9、5.0、5.1、5.2、5.3、5.4或5.5。在一些实施例中,ph转变点为4.8。在一些实施例中,ph转变点为4.9。在一些实施例中,ph转变点为5.0。在一些实施例中,ph转变点为5.1。在一些实施例中,ph转变点为5.2。在一些实施例中,ph转变点为5.3。在一些实施例中,ph转变点为5.4。在一些实施例中,ph转变点为5.5。
[0098]
在一些实施例中,ph响应性组合物具有700至900nm的发射光谱。在一些实施例中,ph响应性组合物具有750至800nm的发射光谱。在一些实施例中,ph响应性组合物具有750至850nm的发射光谱。
[0099]
在一些实施例中,ph响应性组合物具有ph转变范围(δph
10-90%
)。在一些实施例中,
ph响应性组合物具有小于1个ph单位的ph转变范围。在一些实施例中,ph响应性组合物具有小于0.25个ph单位的ph转变范围。在一些实施例中,ph响应性组合物具有小于0.15个ph单位的ph转变范围。
[0100]
在一些实施例中,组合物具有荧光活化比率。荧光活化比率如下定义:来自ph《ph
t
(调配物的转变ph)的缓冲剂中的调配物的标准化荧光强度与来自ph》ph
t
的缓冲剂中的调配物的标准化荧光强度的比率。在一些实施例中,荧光活化比率大于25。在一些实施例中,荧光活化比率大于50。
[0101]
ii.药物组合物
[0102]
本文公开的药物组合物包含一或多种ph响应性胶束和/或纳米颗粒,该胶束和/或纳米颗粒包含嵌段共聚物和荧光染料吲哚菁绿。该嵌段共聚物包含亲水性聚合物链段和疏水性聚合物链段,其中该疏水性聚合物链段包含可离子化的胺基以赋予ph灵敏度。该ph灵敏度用于提供适合作为成像诊断工具的药物组合物(例如,以帮助肿瘤切除和分期)。
[0103]
在一个方面,本文提供了一种包含胶束的药物组合物,其中该胶束包含
[0104]
一或多种具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0105][0106]
其中:
[0107]
x1为卤素、-oh或-c(o)oh;
[0108]
n为90至140;
[0109]
x为50至200;
[0110]
y为0至3;并且
[0111]
z为0至3;以及
[0112]
稳定剂。
[0113]
在一些实施例中,该药物组合物包含胶束,其中该胶束包含一或多种具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物是基于胶束的荧光成像剂。在一
些实施例中,式(ii)的嵌段共聚物为聚(环氧乙烷)-b-聚(甲基丙烯酸二丁基氨基乙酯-r-甲基丙烯酸氨基乙酯盐酸盐)共聚物吲哚菁绿和乙酸缀合物。在一些实施例中,式(ii)的嵌段共聚物为peo
90-140-b-p(dba
60-150-r-icg
0-3-r-ama
0-3
),(化合物1)。在一些实施例中,该嵌段共聚物是能够形成胶束或纳米颗粒的共聚物。
[0114]
在一些实施例中,药物组合物包含约1mg/ml至约5mg/ml的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约1mg/ml、约1.5mg/ml、约2mg/ml、约2.5mg/ml、约3mg/ml、约3.5mg/ml、约4mg/ml、约4.5mg/ml或约5mg/ml的式(ii)的嵌段共聚物。
[0115]
在一些实施例中,药物组合物包含约3.0mg/ml的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。
[0116]
在一些实施例中,药物组合物包含约0.1mg/kg至约8mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.5mg/kg至约7mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.1mg/kg至约3mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.1至约1.2mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。
[0117]
在一些实施例中,药物组合物包含约0.5mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg或7mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.1mg/kg、0.3mg/kg、0.5mg/kg、0.8mg/kg、1mg/kg、1.2mg/kg、1.4mg/kg、1.6mg/kg、1.8mg/kg、2mg/kg、2.5mg/kg或3mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.1mg/kg、0.3mg/kg、0.5mg/kg、0.8mg/kg、1mg/kg或1.2mg/kg的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物。在一些实施例中,药物组合物包含约0.1mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约0.3mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约0.5mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约0.8mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1.2mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1.4mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1.6mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约1.8mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约2mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约2.5mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约3mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约3.5mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约4mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约5mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约6mg/kg的式(ii)的嵌段共聚物。在一些实施例中,药物组合物包含约7mg/kg的式(ii)的嵌段共聚物。
[0118]
在本文公开的药物组合物的一些实施例中,式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物是基本上纯净的。在本文公开的药物组合物的一些实施例中,式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物基本上不含杂质。在本文公
开的药物组合物的一些实施例中,基本上不含杂质被定义为杂质含量小于约10%、约5%、约3%、约1%、约0.5%、约0.1%或约0.05%。在本文公开的药物组合物的一些实施例中,基本上不含杂质被定义为杂质含量小于约1%。在本文公开的药物组合物的一些实施例中,基本上不含杂质被定义为杂质含量小于约0.5%。在本文公开的药物组合物的一些实施例中,基本上不含杂质被定义为杂质含量小于约0.1%。
[0119]
在本文公开的药物组合物的一些实施例中,式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物为至少约90%、约95%、约98%或约99%纯净。
[0120]
在本文公开的药物组合物的一些实施例中,式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物为至少约99.1%、约99.2%、约99.3%、约99.4%、约99.5%、约99.6%、约99.7%、约99.8%、约99.9%或约100%纯净。
[0121]
术语“稳定剂”是指一种试剂,当其加入到生物活性材料中时,与当在不存在稳定剂的情况下储存材料时相比,将防止或延迟材料的生物活性随时间的损失。已经发现,当在环境温度下以基本脱水的形式储存时,这些添加剂中的一些将生物活性材料的保存期限延长到数月或更长。附加地,当生物材料被干燥或冷冻时,抗冻添加剂和抗冻剂的变体已经被用作赋形剂以帮助和保留生物活性。保护性物质是水溶性糖类,如单糖、二糖、三糖、水溶性多糖、糖醇、多元醇或它们的混合物。单糖、二糖和三糖的实例包括但不限于葡萄糖、甘露糖、甘油醛、木糖、来苏糖、塔罗糖、山梨糖、核酮糖、木酮糖、半乳糖、果糖、蔗糖、海藻糖、乳糖、麦芽糖和棉子糖。水溶性多糖包括某些水溶性淀粉和纤维素。糖醇的实例是甘油。起稳定剂作用的其它物质包括例如氨基酸如精氨酸以及蛋白质如白蛋白。
[0122]
在一些实施例中,药学上可接受的赋形剂是抗冻剂或稳定剂。在一些实施例中,药学上可接受的赋形剂是稳定剂。在一些实施例中,稳定剂为糖、糖衍生物、去污剂和盐。
[0123]
在一些实施例中,稳定剂为单糖、二糖、三糖、水溶性多糖、糖醇或多元醇或其组合。在一些实施例中,稳定剂为果糖、半乳糖、葡萄糖、乳糖、蔗糖、海藻糖、麦芽糖、甘露醇、山梨醇、核糖、糊精、环糊精、麦芽糖糊精、棉子糖或木糖或其组合。在一些实施例中,稳定剂为海藻糖。在一些实施例中,稳定剂为海藻糖二氢化物。
[0124]
在一些实施例中,药物组合物包含约0.5%w/v至约25%w/v、约1%至约20%w/v、约5%至约15%w/v、约6%至约13%w/v、约7%至约12%w/v或约8%至约11%w/v的稳定剂。在一些实施例中,药物组合物包含约7%至约12%w/v的稳定剂。在一些实施例中,药物组合物包含约8%至约11%w/v的稳定剂。
[0125]
在一些实施例中,药物组合物包含约5%w/v、约6%w/v、约7%w/v、约8%w/v、约9%w/v、约10%w/v、约11%w/v、约12%w/v、约13%w/v、约14%w/v或约15%w/v的稳定剂。在一些实施例中,药物组合物包含约9%w/v的稳定剂。在一些实施例中,药物组合物包含约10%w/v的稳定剂。在一些实施例中,药物组合物包含约11%w/v的稳定剂。在一些实施例中,药物组合物包含约12%w/v的稳定剂。在一些实施例中,药物组合物包含约13%w/v的稳定剂。在一些实施例中,药物组合物包含约14%w/v的稳定剂。在一些实施例中,药物组合物包含约15%w/v的稳定剂。
[0126]
在一些实施例中,药物组合物还包含液体载剂。在一些实施例中,液体载剂为水性溶液。在一些实施例中,液体载剂选自无菌水、无菌注射用水(swfi)、生理盐水、半生理盐水、右旋糖(如水性右旋糖;例如5%右旋糖水溶液d5w),或林格氏乳酸盐溶液(rl)或其中的
组合(如50%右旋糖和50%生理盐水)。在一些实施例中,液体载剂选自无菌水。
[0127]
在一些实施例中,药物组合物包含至少约3mg/ml的具有式(ii)的结构的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物:
[0128][0129]
其中:
[0130]
x1为br;
[0131]
n为90至140;
[0132]
x为60至150;
[0133]
y为0至3;并且
[0134]
z为0至3;以及
[0135]
约10%w/v的海藻糖水溶液。
[0136]
本公开的药物组合物可以被配制成与预期的施用方法或途径相容;本文阐述了示例性施用途径。
[0137]
在一些实施例中,本文公开的药物组合物为用于通过口服、静脉内(i.v.)、肌内、皮下、肿瘤内或皮内注射给药或施用的形式。在一些实施例中,药物组合物被配制用于口服、肌内、皮下或静脉内施用。在一些实施例中,药物组合物被配制用于肿瘤内施用。在一些实施例中,药物组合物被配制用于静脉内施用。在一些实施例中,药物组合物被配制成用于静脉内(i.v.)施用的水性溶液或悬浮液。在一些实施例中,药物组合物被配制成作为单剂量施用。在一些实施例中,药物组合物被配制成作为多剂量施用。在一些实施例中,本文公开的药物组合物被配制成通过i.v.作为大丸剂施用。
[0138]
在药物组合物的一些实施例中,其中形式为i.v.剂型,ph为约3.5至约8.5。在一些实施例中,i.v.剂量的ph为约3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0或8.5。
[0139]
水性悬浮液含有活性材料,其与适于其制造的赋形剂混合。此些赋形剂可以是悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、聚乙烯吡咯烷酮、黄蓍胶和阿拉伯树胶;分散剂或润湿剂,例如天然发生的磷脂(例如,卵磷脂),或环氧烷与脂肪酸的缩合产物(例如,聚氧乙烯硬脂酸酯),或环氧乙烷与长链脂族醇的缩合产物(例
如,十七乙烯氧基十六醇),或环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物(例如,聚氧乙烯山梨糖醇单油酸酯),或环氧乙烷与衍生自脂肪酸和己糖醇酐的偏酯的缩合产物(例如,聚乙烯山梨糖醇酐单油酸酯)。水性悬浮液还可以含有一种或多种防腐剂。
[0140]
油性悬浮液可以通过将活性成分悬浮在植物油(例如花生油、橄榄油、芝麻油或椰子油)或矿物油(如液体石蜡)中来配制。油性悬浮液可以含有增稠剂,例如蜂蜡、硬石蜡或鲸蜡醇。可以加入甜味剂(如以上阐述那些)和增味剂以提供适口的口服调配物。
[0141]
适于通过加入水来制备水性悬浮液的可分散粉剂和颗粒剂提供了与分散剂或润湿剂以及任选的一种或多种悬浮剂和/或防腐剂混合的活性成分。本文例举了合适的分散剂或润湿剂和悬浮剂。
[0142]
本发明的药物组合物还可以是水包油乳剂的形式。油相可以是植物油,例如橄榄油或花生油,或矿物油,例如液体石蜡,或这些的混合物。合适的乳化剂可以是天然发生的树胶,例如阿拉伯树胶或黄蓍胶;天然发生的磷脂,例如大豆、卵磷脂和衍生自脂肪酸的酯或偏酯;己糖醇酐,例如山梨糖醇酐单油酸酯;以及偏酯与环氧乙烷的缩合产物,例如聚氧乙烯山梨糖醇酐单油酸酯。
[0143]
药物组合物通常包含治疗有效量的式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物,以及一种或多种药学上和生理学上可接受的配调配物。合适的药学上可接受或生理学上可接受的稀释剂、载剂或赋形剂包括但不限于抗氧化剂(例如,抗坏血酸和硫酸氢钠)、防腐剂(例如,苯甲醇、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯、对羟基苯甲酸丁酯)、乳化剂、悬浮剂、分散剂、溶剂、填充剂、疏松剂、洗涤剂、缓冲剂、媒介物、稀释剂和/或佐剂。例如,合适的媒介物可以是生理盐水溶液或柠檬酸盐缓冲盐水,可能补充有用于肠胃外施用的药物组合物中常见的其它材料。中性缓冲盐水或与血清白蛋白混合的盐水是另外的示例性媒介物。本领域技术人员将容易地意识到可用于本文设想的药物组合物和剂型的多种缓冲剂。典型的缓冲剂包括但不限于药学上可接受的弱酸、弱碱或其混合物。例如,缓冲剂组分可以是水溶性材料,如磷酸、酒石酸、乳酸、琥珀酸、柠檬酸、乙酸、抗坏血酸、天冬氨酸、谷氨酸及其盐。可接受的缓冲剂包括例如三羟甲基氨基甲烷缓冲剂;n-(2-羟乙基)哌嗪-n'-(2-乙磺酸)(hepes);2-(n-吗啉代)乙磺酸(mes);2-(n-吗啉代)乙磺酸钠盐(mes);3-(n-吗啉代)丙磺酸(mops);以及n-三[羟甲基]甲基-3-氨基丙烷磺酸(taps)。
[0144]
在配制药物组合物之后,可以将其作为溶液、悬浮液、凝胶、乳剂、固体或脱水或冻干粉剂储存在无菌小瓶中。此些调配物可以以即用形式、使用之前需要重构的冻干形式、使用之前需要稀释的液体形式或其它可接受的形式储存。在一些实施例中,药物组合物提供于一次性容器(例如,一次性小瓶、安瓿、注射器或自动注射器)中,而在其它实施例中提供了可多次使用的容器(例如,可多次使用的小瓶)。
[0145]
调配物还可以包括载剂以保护组合物免于从身体快速降解或消除,如控释调配物,包括脂质体、水凝胶、前药和微囊化递送系统。例如,可以使用延时材料,如单独使用单硬脂酸甘油酯或硬脂酸甘油酯,或将其与蜡组合使用。任何药物递送设备均可用于递送式(ii)的嵌段共聚物或其药学上可接受的盐、溶剂化物或水合物,包括植入物(例如,可植入泵)和导管系统、缓慢注射泵和装置,所有这些均是本领域技术人员熟知的。
[0146]
药物组合物可以是无菌可注射水性或油质悬浮液的形式。此悬浮液可以根据已知
技术使用本文提及的那些合适的分散剂或润湿剂和悬浮剂配制。无菌可注射调配物也可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如在1,3-丁二醇中的溶液。可以使用的可接受的稀释剂、溶剂和分散介质包括水、林格氏溶液、等渗氯化钠溶液、el(巴斯夫(basf)公司,帕西波尼,新泽西(parsippany,nj))或磷酸盐缓冲盐水(pbs)、乙醇、多元醇(例如,甘油、丙二醇和液态聚乙二醇)、无菌注射用水(swfi)、d5w及其合适的混合物。此外,无菌不挥发性油通常用作溶剂或悬浮介质;为此目的,可以使用任何温和的不挥发性油,包括合成的甘油单酯或甘油二酯。另外,脂肪酸(如油酸)可以用于制备可注射剂。特定可注射调配物的延长吸收可以通过包括延迟吸收的试剂(例如,单硬脂酸铝或明胶)来实现。
[0147]
iii.使用方法
[0148]
在一些实施例中,本文所述的药物组合物用于ph响应性组合物中。在一些实施例中,ph响应性组合物用于对涉及细胞内或细胞外ph(例如,癌性肿瘤的酸性ph)变化的生理和/或病理学过程成像。在一些实施例中,本文所述的药物组合物胶束可以用于检测原发性和转移性肿瘤组织(包括腹膜转移和淋巴结),从而使肿瘤复发率和再手术率降低。在一些实施例中,ph灵敏成像剂可以以高肿瘤对比度与背景荧光响应比率(cnr和tbr)从周围正常组织检测肿瘤。
[0149]
有氧糖酵解,称为瓦博格效应,在所有实体癌中均发生,其中癌细胞优先摄取葡萄糖并将其转化为乳酸或其它酸。由于单羧酸转运蛋白或其它转运蛋白,乳酸或其它酸优先积聚在细胞外空间。所导致的细胞外空间的酸化为进一步的肿瘤侵袭和转移促进细胞外基质的重塑。
[0150]
手术期间的实时荧光成像将帮助外科医生检测或描画肿瘤与正常组织或转移性疾病(如来自患病淋巴结)的关系,目的是实现阴性边缘和完全肿瘤切除并帮助分期。这些改善的手术成果转化为显著的临床益处,如降低肿瘤复发率和再手术率、避免不必要的手术、保留功能和美观。
[0151]
癌症手术的另一关键目的是辅助病理学分期以作出治疗决定。由于隐匿性淋巴结转移,淋巴结状态是癌症分期的关键组成部分。选择性综合区域淋巴结清扫是头颈癌的标准治疗(soc),因为手术期间简单的淋巴结取样低估了淋巴结转移。例如对于结肠直肠癌,高达25%的“淋巴结阴性”患者死于旧病复发和转移,指示存在残留的隐匿性疾病,并且淋巴结转移增加了预后价值,特别是对于ii期结肠直肠癌患者而言。准确地检测这些患者的淋巴结转移可以引起分期上升和辅助治疗强化,使疗法与疾病更好地匹配。
[0152]
因此,能够选择性和准确地改善肿瘤边缘、隐匿性肿瘤和肿瘤阳性淋巴结以及其它转移性疾病的术中可视化的技术将潜在地改善手术切除的完整性、辅助疗法选择的适当性、实体瘤患者的病理学分期和肿瘤学成果。
[0153]
本文提供的一些实施例描述了在生理ph(7.35至7.45)下形成胶束的嵌段共聚物。在一些实施例中,本文所述的嵌段共聚物缀合至icg染料。在一些实施例中,胶束具有大于2
×
107道尔顿的分子量。在一些实施例中,胶束具有~2.7
×
107道尔顿的分子量。在一些实施例中,icg染料在生理ph(7.35至7.45)下(例如在血液循环期间)螯合在胶束核心内,导致荧光猝灭。在一些实施例中,当胶束遇到酸性环境(例如,肿瘤组织)时,胶束解离成平均分子量为约3.7
×
104道尔顿的单独化合物,从而允许来自icg染料的荧光信号活化,引起酸性环
境(例如,肿瘤组织)特异性地发荧光。在一些实施例中,胶束在低于ph转变点(例如,肿瘤微环境的酸性状态)的ph下解离。
[0154]
在一些实施例中,由于在预定义的低ph下在疏水性驱动的胶束自组装(非荧光off状态)与这些胶束的协同解离(荧光on状态)之间发生的明确相转变,荧光响应较强烈。
[0155]
在一些实施例中,本文所述的胶束具有ph转变点和发射光谱。在一些实施例中,ph转变点为4至8或6至7.5。在其它实施例中,ph转变点为4.8至5.5。在某些实施例中,ph转变点为约4.8、4.9、5.0、5.1、5.2、5.3、5.4或5.5。在一些实施例中,发射光谱为700至900nm。在一些实施例中,发射光谱为750至850nm。
[0156]
在一些情况下,本文所述的ph灵敏胶束组合物具有窄的ph转变范围。在一些实施例中,本文所述的胶束具有小于1个ph单位的ph转变范围(δph
10-90%
)。在各种实施例中,胶束具有小于约0.9、小于约0.8、小于约0.7、小于约0.6、小于约0.5、小于约0.4、小于约0.3、小于约0.2、小于约0.1个ph单位的ph转变范围。在一些实施例中,胶束具有小于约0.5个ph单位的ph转变范围。在一些实施例中,ph转变范围小于0.25个ph单位。在一些实施例中,ph转变范围小于0.15个ph单位。
[0157]
在一些实施例中,ph灵敏组合物具有荧光活化比率。在一些实施例中,荧光活化比率大于25。在一些实施例中,荧光活化比率大于50。
[0158]
在一些实施例中,当对细胞内环境成像时,细胞在适于引起胶束摄取的条件下与胶束接触。在一些实施例中,细胞内环境是细胞的一部分。在一些实施例中,该细胞的该部分是溶酶体或核内体。在一些实施例中,细胞外环境是肿瘤或血管细胞的细胞外环境。在一些实施例中,细胞外环境是血管内或血管外的。在一些实施例中,对细胞内或细胞外环境的ph成像包含对转移性疾病成像。在一些实施例中,转移性疾病是癌症。在一些实施例中,肿瘤来自实体癌。在一些实施例中,肿瘤来自非实体癌。在一些实施例中,对肿瘤环境的ph成像包含对一或多个淋巴结成像。在一些实施例中,对肿瘤环境的ph成像允许在手术期间确定肿瘤尺寸或肿瘤边缘。
[0159]
在另一方面,提供了一种对细胞间或细胞外环境的ph成像的方法,该方法包含:
[0160]
(a)将细胞内或细胞外环境与本文公开的嵌段共聚物或药物组合物接触;以及
[0161]
(b)检测来自细胞内或细胞外环境的一或多种光学信号,其中检测到的光学信号指示包含一或多种式(ii)的嵌段共聚物的胶束已达到其ph转变点并解离。
[0162]
在一些实施例中,光学信号是荧光信号。
[0163]
在一些实施例中,细胞外环境是肿瘤或血管细胞。在一些实施例中,细胞外环境是血管内或血管外的。
[0164]
在一些实施例中,细胞内或细胞外环境的ph包含对肿瘤环境的ph成像。在一些实施例中,对肿瘤环境的ph成像包含对一或多个淋巴结成像。前哨淋巴结是引流癌症的第一个淋巴结或一组淋巴结,并且是癌细胞从肿瘤转移到的第一个器官。在一些实施例中,对一或多个淋巴结的ph成像告知淋巴结的手术切除。在一些实施例中,对一或多个淋巴结的ph成像告知癌症转移的分期。在一些实施例中,对一或多个淋巴结的ph成像实现患者管理。
[0165]
在一些实施例中,对肿瘤环境的ph成像允许确定肿瘤尺寸或肿瘤边缘。在一些实施例中,对肿瘤环境的ph成像允许肿瘤分期。在一些实施例中,对肿瘤环境的ph成像允许患者成果的管理。在一些实施例中,对肿瘤环境的ph成像允许在手术期间更精确地摘除肿瘤。
在一些实施例中,对肿瘤环境的ph成像能够检测残留的转移性疾病。在一些实施例中,对肿瘤环境的ph成像告知确定附属、多病灶或隐匿性肿瘤。
[0166]
在一些实施例中,对肿瘤环境的ph成像告知检测到隐匿性疾病。
[0167]
在一些实施例中,在对肿瘤成像之前将药物组合物施用于有需要的患者。在一些实施例中,在手术之前对肿瘤成像以进行分期之前,将药物组合物施用于有需要的患者。
[0168]
在一些实施例中,在手术之前将药物组合物施用于有需要的患者。在一些实施例中,在手术之后将药物组合物施用于有需要的患者。在一些实施例中,手术是肿瘤切除。
[0169]
在另一方面,提供了一种切除有需要的患者的肿瘤的方法,该方法包含:
[0170]
(a)检测来自施用有效剂量的本文公开的嵌段共聚物或药物组合物的患者的肿瘤或其试样的一或多种光学信号,其中检测到的光学信号指示肿瘤的存在;以及
[0171]
(b)经由手术切除肿瘤。
[0172]
在一些实施例中,光学信号指示肿瘤的边缘。
[0173]
在一些实施例中,光学信号是荧光信号。
[0174]
在一些实施例中,肿瘤被切除至少90%。
[0175]
在一些实施例中,肿瘤被切除至少95%。
[0176]
在一些实施例中,肿瘤被切除至少99%。
[0177]
在一些实施例中,肿瘤与干净的边缘一起被切除。在一些实施例中,干净的边缘是非发荧光组织。在一些实施例中,非发荧光组织是非癌性组织。在一些实施例中,摘除肿瘤或切除淋巴结后的创面中缺乏荧光指示摘除了肿瘤。
[0178]
在一些实施例中,肿瘤是实体瘤。在一些实施例中,肿瘤是泛肿瘤。在一些实施例中,实体瘤来自癌症。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、肺癌、卵巢癌、前列腺癌、膀胱癌、尿道癌、食道癌、结肠直肠癌、脑癌或皮肤癌(包括黑素瘤和肉瘤)。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、食道癌或结肠直肠癌。在一些实施例中,癌症是乳腺癌。在一些实施例中,癌症是头颈鳞状细胞癌(nhscc)。在一些实施例中,癌症是卵巢癌。在一些实施例中,癌症是前列腺癌。在一些实施例中,癌症是食道癌。在一些实施例中,癌症是结肠直肠癌。在一些实施例中,癌症是脑癌。在一些实施例中,癌症是可通过莫氏(mohs)手术治疗的皮肤癌。
[0179]
在另一方面,提供了一种治疗癌症的方法,该方法包含:
[0180]
(a)在施用有效剂量的本文公开的嵌段共聚物或药物组合物的有需要的癌症患者中检测一或多种光学信号,其中检测到的光学信号指示癌性肿瘤的存在;以及
[0181]
(b)摘除癌性肿瘤,从而治疗癌症。
[0182]
在一些实施例中,该方法还包含在从患者摘除后,任选地通过后台荧光引导成像,对癌症患者的体腔成像,或对癌性肿瘤或其切片或样本(例如,新鲜的或福尔马林固定的)成像。在一些实施例中,治疗癌症的方法还包含在摘除后对癌性肿瘤成像以确保干净的边界。在一些实施例中,干净的边界由创面中缺乏肿瘤来指示。在一些实施例中,当在试样或创面中没有检测到荧光时,指示干净的边界。在一些实施例中,干净的边界指示整个癌性肿瘤已被摘除。在一些实施例中,干净的边界指示所有癌变已经被摘除。
[0183]
在另一方面,提供了一种使癌症复发最小化至少五年的方法,该方法包含:
[0184]
(a)在施用有效剂量的本文公开的嵌段共聚物或药物组合物的有需要的癌症患者
中检测一或多种光学信号,其中检测到的光学信号指示癌性肿瘤的存在;以及
[0185]
(b)如果检测到该一或多种光学信号,则治疗该癌症以最小化该复发。
[0186]
在另一方面,提供了一种检测癌性肿瘤的方法,该方法包含:
[0187]
(a)在施用有效剂量的本文公开的嵌段共聚物或药物组合物的有需要的癌症患者中检测一或多种光学信号,其中肿瘤的存在指示癌症的复发;以及
[0188]
(b)治疗该癌症的复发。
[0189]
在一些实施例中,肿瘤来自癌症。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、肺癌、卵巢癌、前列腺癌、膀胱癌、尿道癌、食道癌、结肠直肠癌、脑癌、皮肤癌(包括黑素瘤和肉瘤)。在一些实施例中,癌症是乳腺癌、头颈鳞状细胞癌(nhscc)、食道癌或结肠直肠癌。在一些实施例中,癌症是卵巢癌。在一些实施例中,癌症是前列腺癌。
[0190]
在一些实施例中,该方法还包含用术中照相机或内窥镜照相机对肿瘤成像。在一些实施例中,术中照相机是近红外(nir)照相机。在本文公开的方法的一些实施例中,术中照相机或内窥镜照相机是与吲哚菁绿兼容的照相机。
[0191]
给药
[0192]
在一些实施例中,将药物组合物施用于有需要的患者。在一些实施例中,有需要的患者是哺乳动物。在一些实施例中,有需要的患者是人。在一些实施例中,哺乳动物不是人。在一些实施例中,哺乳动物是犬科动物、猫科动物、牛科动物、猪、兔或马。在一些实施例中,哺乳动物是犬科动物或猫科动物。在一些实施例中,哺乳动物是猫。在一些实施例中,哺乳动物是马。在一些实施例中,哺乳动物是牛。在一些实施例中,哺乳动物是猪。在一些实施例中,哺乳动物是兔。在一些实施例中,哺乳动物是犬科动物。
[0193]
本公开的式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐可以是适于向受试者施用的组合物的形式。通常,此些组合物是“药物组合物”,其包含式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐和一种或多种药学上可接受的或生理学上可接受的稀释剂、载剂或赋形剂。在某些实施例中,式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐以治疗上可接受的量存在。该药物组合物可以用于本发明的方法中;因此,例如,药物组合物可以体外或体内施用于受试者,以便实践本文所述的治疗和预防方法和用途。
[0194]
在一些实施例中,在手术之前约1至2周施用药物组合物。在一些实施例中,在手术之前约2周施用药物组合物。在一些实施例中,在手术之前约1周施用药物组合物。在一些实施例中,在手术之前约16小时至约80小时施用药物组合物。在一些实施例中,在手术之前约24小时至约32小时施用药物组合物。在一些实施例中,在手术之前约16小时至约32小时施用药物组合物。在一些实施例中,在手术之前约1小时至约5小时施用药物组合物。在一些实施例中,在手术之前约3小时至约9小时施用药物组合物。
[0195]
在一些实施例中,,在手术之前至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时、至少7小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少24小时、至少28小时、至少32小时、至少80小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少1周或至少2周施用药物组合物。
[0196]
在一些实施例中,在对肿瘤成像之前约1至2周施用药物组合物。在一些实施例中,
在对肿瘤成像之前约2周施用药物组合物。在一些实施例中,在对肿瘤成像之前约1周施用药物组合物。在一些实施例中,在对肿瘤成像之前约16小时至约80小时施用药物组合物。在一些实施例中,在对肿瘤成像之前约24小时至约32小时施用药物组合物。在一些实施例中,在对肿瘤成像之前约16小时至约32小时施用药物组合物。在一些实施例中,在对肿瘤成像之前约3小时至约9小时施用药物组合物。在一些实施例中,在对肿瘤成像之前约1小时至约5小时施用药物组合物。在一些实施例中,在对肿瘤成像之前约1小时至约32小时、约2小时至约32小时、16小时至约32小时或约20小时至约28小时施用药物组合物。
[0197]
在一些实施例中,在对肿瘤成像之前至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少6小时、至少7小时、至少8小时、至少10小时、至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少24小时、至少28小时、至少32小时、至少80小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少1周或至少2周施用药物组合物。
[0198]
在一些实施例中,本文所述的式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐药物组合物以式(ii)的嵌段共聚物的最大耐受剂量(mtd)提供。在其它实施例中,所施用的式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐药物组合物的量为最大耐受剂量(mtd)的约10%至约90%、mtd的约25%至约75%或mtd的约50%。在一些其它实施例中,所施用的式(ii)的嵌段共聚物或其水合物、溶剂化物、互变异构体或药学上可接受的盐药物组合物的量为式(ii)的嵌段共聚物的mtd的约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更高,或其中可推导出的任何范围。
[0199]
定义
[0200]
除非另有说明,否则本技术中使用的以下术语具有以下给出的定义。术语“包括(including)”以及其它形式(如“包括(include)”、“包括(includes)”和“包括(included)”)的使用不是限制性的。本文使用的章节标题仅用于组织目的,并且不应被解释为限制所描述的主题。
[0201]
如本文所用,“药学上可接受的”是指不消除嵌段共聚物的生物活性或特性并且相对无毒的材料,如载剂或稀释剂,即,该材料施用于个体而不会引起不合需要的生物效应或以有害方式与含有该材料的组合物的任何组分相互作用。
[0202]
术语“药学上可接受的盐”是指由阳离子形式的治疗活性剂与合适的阴离子组合组成的治疗活性剂的形式,或在替代实施例中,其由阴离子形式的治疗活性剂与合适的阳离子组合组成。“药用盐手册:特性、选择和使用(handbook of pharmaceutical salts:properties,selection and use)”国际纯粹与应用化学联合会,wiley-vch出版社2002.s.m.伯奇,l.d.拜雷,d.c.蒙克豪斯(s.m.berge,l.d.bighley,d.c.monkhouse)《药学科学杂志(j.pharm.sci.)》1977,66,1-19.p.h.斯特尔和c.g.韦穆特(p.h.stahl,c.g.wermuth),编辑,《药用盐手册:特性、选择和使用》,魏因海姆/苏黎世:wiley-vch/vhca,2002。与非离子种类相比,药用盐通常在胃液和肠液中更易溶解和更快速地溶解,并且因此可以用于固体剂型。此外,因为它们的溶解度通常是ph的函数,所以在消化道的一个或另一部分中的选择性溶解是可能的,并且这种能力可以作为延迟和持续释放行为的一个方面来操纵。而且,因为成盐分子可以与中性形式平衡,所以可以调节通过生物膜的通道。
[0203]
在一些实施例中,药学上可接受的盐通过将式(ii)的嵌段共聚物与酸反应而获得。在一些实施例中,式(a)的嵌段共聚物(即,游离碱形式)是碱性的并且与有机酸或无机酸反应。无机酸包括但不限于盐酸、氢溴酸、硫酸、磷酸、硝酸和偏磷酸。有机酸包括但不限于1-羟基-2-萘甲酸;2,2-二氯乙酸;2-羟基乙磺酸;2-氧代戊二酸;4-乙酰氨基苯甲酸;4-氨基水杨酸;乙酸;己二酸;抗坏血酸(l);天冬氨酸(l);苯磺酸;苯甲酸;樟脑酸(+);樟脑-10-磺酸(+);羊蜡酸(癸酸);羊油酸(己酸);羊脂酸(辛酸);碳酸;肉桂酸;柠檬酸;环拉酸;十二烷基硫酸;乙烷-1,2-二磺酸;乙磺酸;甲酸;富马酸;半乳糖二酸;龙胆酸;葡萄庚酸(d);葡萄糖酸(d);葡萄糖醛酸(d);谷氨酸;戊二酸;甘油磷酸;羟基乙酸;马尿酸;异丁酸;乳酸(dl);乳糖酸;月桂酸;马来酸;苹果酸(-l);丙二酸;扁桃酸(dl);甲磺酸;萘-1,5-二磺酸;萘-2-磺酸;烟酸;油酸;草酸;棕榈酸;双羟萘酸;磷酸;丙酸;焦谷氨酸(-l);水杨酸;癸二酸;硬脂酸;琥珀酸;硫酸;酒石酸(+l);硫氰酸;甲苯磺酸(p);以及十一碳烯酸。
[0204]
在一些实施例中,式(ii)的嵌段共聚物被制备为氯化物盐、硫酸盐、溴化物盐、甲磺酸盐、马来酸盐、柠檬酸盐或磷酸盐。
[0205]
在一些实施例中,药学上可接受的盐通过将式(ii)的嵌段共聚物与碱反应而获得。在一些实施例中,式(ii)的嵌段共聚物是酸性的并且与碱反应。在此些情况下,式(ii)的嵌段共聚物的酸性质子被金属离子例如锂、钠、钾、镁、钙或铝离子替代。在一些情况下,本文所述的嵌段共聚物与有机碱配位,该有机碱诸如但不限于乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、葡甲胺、n-甲葡糖胺、二环己胺、三(羟甲基)甲胺。在其它情况下,本文所述的嵌段共聚物与氨基酸(诸如但不限于精氨酸、赖氨酸等)形成盐。用于与包含酸性质子的嵌段共聚物形成盐的可接受的无机碱包括但不限于氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠、碳酸钾、氢氧化钠、氢氧化锂等。在一些实施例中,本文提供的嵌段共聚物被制备为钠盐、钙盐、钾盐、镁盐、三聚氰胺盐、n-甲葡糖胺盐或铵盐。
[0206]
应当理解,提及药学上可接受的盐包括溶剂添加形式。在一些实施例中,溶剂化物含有化学计量或非化学计量的量的溶剂,并且在与药学上可接受的溶剂如水、乙醇等结晶的过程期间形成。当溶剂是水时形成水合物,或者当溶剂是醇时形成醇化物。本文所述的化合物的溶剂化物在本文所述的过程期间方便地制备或形成。此外,本文提供的化合物任选地以非溶剂化形式以及溶剂化形式存在。
[0207]
本文所述的方法和调配物包括使用具有式(ii)的结构的嵌段共聚物的n-氧化物(如果适当的话)或药学上可接受的盐,以及具有相同类型活性的这些化合物的活性代谢物。
[0208]
在另一实施例中,本文所述的化合物被同位素标记(例如,用放射性同位素)或通过另一种其它方式标记,包括但不限于使用发色团或荧光部分、生物发光标记或化学发光标记。
[0209]
本文所述的化合物包括同位素标记的化合物,其与本文呈现的各种配方和结构中所详述的那些相同,但事实上一或多种原子被具有与通常在自然界中发现的原子质量或质量数不同的原子质量或质量数的原子替代。可掺入本发明化合物的同位素的实例包括氢、碳、氮、氧、硫、氟、氯、碘、磷的同位素,如2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
35
s、
18
f、
36
cl、
123
i、
124
i、
125
i、
131
i、
32
p和
33
p。在一个方面,本文所述的同位素标记的化合物,例如其中掺入放射性同位素(如3h和
14
c)的那些,可以用于药物和/或底物组织分布测定。在一个方面,用同位素如
氘进行取代提供了由更高的代谢稳定性产生的某些治疗优势,如增加的体内半衰期或降低的剂量需求。
[0210]
如本文所用,“ph响应性系统”、“ph响应性组合物”、“胶束”、“ph响应性胶束”、“ph灵敏胶束”、“ph可活化胶束”和“ph可活化胶束(pham)纳米颗粒”在本文中可互换使用以指示包含一种或多种化合物的胶束,其根据ph(例如,高于或低于某一ph)而解离。作为非限制性实例,在某一ph下,式(ii)的嵌段共聚物基本上呈胶束形式。当ph改变(例如,降低)时,胶束开始解离,并且当ph进一步改变(例如,进一步降低)时,式(ii)的嵌段共聚物基本上以解离(非胶束)形式存在。
[0211]
如本文所用,“ph转变范围”指示胶束解离的ph范围。
[0212]
如本文所用,“ph转变值”(ph)指示一半胶束解离时的ph。
[0213]“纳米探针”在本文中用于指示包含成像标记部分的ph灵敏胶束。在一些实施例中,标记部分是荧光染料。在一些实施例中,荧光染料是吲哚菁绿染料。
[0214]
如本文所用,术语“施用(administer)”、“施用(administering)”、“施用(administration)”等是指可用于将化合物或组合物递送至期望的生物作用部位的方法。这些方法包括但不限于口服途径、十二指肠内途径、肠胃外注射(包括静脉内、皮下、腹膜内、肌内、血管内、肿瘤内或输注)、局部和直肠给药。本领域技术人员熟悉可以与本文所述的化合物和方法一起使用的施用技术。在一些实施例中,本文所述的化合物和组合物口服施用。在一些实施例中,本文所述的组合物静脉内施用。
[0215]
如本文所用,术语“共同施用”等意在涵盖向单个患者施用所选治疗剂,并且旨在包括其中试剂通过相同或不同施用途径或在相同或不同时间施用的治疗法。
[0216]
如本文所用,术语“有效量”或“治疗有效量”是指施用的试剂或化合物的足够量,其将在一定程度上缓解所治疗的疾病或病症的一种或多种症状。结果包括疾病的病征、症状或病因的减少和/或减轻,或生物系统的任何其它期望的改变。例如,用于治疗用途的“有效量”是提供疾病症状的临床显著减少所需的包含本文公开的化合物的组合物的量。在任何个体情况下,适当的“有效”量任选地使用技术(如剂量递增研究)来确定。
[0217]
如本文所用,术语“增强(enhance)”或“增强(enhancing)”是指增加或延长期望作用的效力或持续时间。因此,关于增强治疗剂的作用,术语“增强(enhancing)”是指在效力或持续时间方面增加或延长其它治疗剂对系统的作用的能力。如本文所用,“增强有效量”是指足以增强另一种治疗剂在期望系统中的作用的量。
[0218]
术语“受试者”或“患者”涵盖哺乳动物。哺乳动物的实例包括但不限于哺乳动物类的任何成员:人、非人灵长类,如黑猩猩和其它猿类和猴类;农场动物,如牛、马、绵羊、山羊、猪;家畜,如兔、犬和猫;实验室动物,包括啮齿动物,如大鼠、小鼠和豚鼠等。在一个方面,哺乳动物是人。
[0219]
如本文所用,术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”包括减轻、缓和或改善疾病或病症的至少一种症状、预防附加症状、抑制疾病或病症,例如阻止疾病或病症的发展、缓解疾病或病症、引起疾病或病症的消退、缓解由疾病或病症引起的病症,或预防和/或治疗地结束疾病或病症的症状。
[0220]
尽管本公开支持仅指替代方案和“和/或”的定义,但权利要求中使用的术语“或”用于表示“和/或”,除非明确指出仅指替代方案或者替代方案是相互排斥的。在整个本技术
中,术语“约”用于指示一个值包括用于确定该值的装置或方法的标准差,例如规定数字的约
±
10%或低于规定范围所列值的下限10%并高于其上限10%。根据长期专利法,除非特别指出,否则例如当在权利要求或说明书中与词语“包含”结合使用时,词语“一(a)”和“一(an)”表示一或多种。
[0221]
实例
[0222]
实例1.嵌段共聚物的合成
[0223]
本文所述的式(ii)的嵌段共聚物使用标准合成技术或使用本领域已知的方法合成。
[0224]
除非另有指示,否则使用质谱、nmr、hplc、蛋白质化学、生物化学、重组dna技术和药理学的常规方法。使用标准有机化学技术制备嵌段共聚物,如在《march高等有机化学(march's advanced organic chemistry)》,第6版,约翰威立公司(john wiley and sons,inc.)中描述的那些技术。
[0225]
本文使用的一些缩写如下:
[0226]
dcis
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
原位导管癌
[0227]
dcm:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[0228]
dmap:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-二甲基氨基吡啶
[0229]
dmf:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基甲酰胺
[0230]
dmf-dma:
ꢀꢀꢀꢀꢀꢀꢀ
n,n-二甲基甲酰胺二甲基缩醛
[0231]
edci:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-乙基-3-(3-二甲基氨基丙基)碳二亚胺
[0232]
etoac:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0233]
etoh:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇
[0234]
icg-osu:
ꢀꢀꢀꢀꢀꢀꢀ
吲哚菁绿琥珀酰胺酯
[0235]
meoh:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[0236]
pmdeta:
ꢀꢀꢀꢀꢀꢀꢀꢀ
n,n,n
′
,n
″
,n
″‑
五甲基二亚乙基三胺
[0237]
tea:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三乙基胺
[0238]
auc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
曲线下面积
[0239]
auc
all
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
从时间=0到最后时间点(包括浓度=0)的auc
[0240]
auc
last
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
从时间=0到具有可报告浓度的最后一个时间点的auc
[0241]
auc
0-24hr
ꢀꢀꢀꢀꢀꢀꢀ
时间0至24小时的auc
[0242]
bc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乳腺癌
[0243]
bls
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
面包条载玻片
[0244]
bql
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
低于定量限
[0245]c10m
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10分钟时的血浆浓度
[0246]cmax
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
最大血浆浓度
[0247]
cnr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
对比噪声比
[0248]
crc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
结肠直肠癌
[0249]
ec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
食道癌
[0250]
ffpe或ff
ꢀꢀꢀꢀꢀꢀꢀ
福尔马林固定石蜡包埋的或福尔马林固定的
[0251]
gmp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
良好生产规范
[0252]
glp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
良好实验室规范
[0253]
gpc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
凝胶渗透色谱法
[0254]
hnscc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
头颈鳞状细胞癌
[0255]
hr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[0256]
isr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
已测试样再分析
[0257]
iv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
静脉内
[0258]
kg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
千克
[0259]
lloq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
测定的定量下限
[0260]
mfi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
平均荧光强度
[0261]
mg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫克
[0262]
ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升
[0263]
μg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微克
[0264]
nc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
未计算
[0265]
nr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
未报告
[0266]
oc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
卵巢癌
[0267]
pk
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
药代动力学
[0268]
ppv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
阳性预测值
[0269]
prc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
前列腺癌
[0270]
roi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
感兴趣区域
[0271]
r2adj
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
针对试样尺寸调节的确定系数
[0272]
sec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
尺寸排阻色谱
[0273]
soc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
标准治疗
[0274]
sop
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
标准操作程序
[0275]
tbr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
肿瘤本底比
[0276]
t
1/2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
半衰期
[0277]
t
max
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
最大浓度时间。
[0278]
使用5步法合成式(ii)的嵌段共聚物。步骤1至4在受控的制造环境中执行。通过3(peg-br,大分子引发剂)、7((二丁基氨基)乙基甲基丙烯酸酯,dba-ma)和4(甲基丙烯酸氨基乙酯盐酸盐,ama-ma)的原子转移自由基聚合(atrp,步骤4)合成中间体8(聚二丁胺,pdba)。最后一个步骤包括通过将8(pdba的二嵌段共聚物主链)共价附接到9(icg荧光团(icg-osu))来制备化合物1。在步骤5中,所使用的所有原料、溶剂和试剂均经过国家处方集(nf)或美国药典(usp)验证,除了中间体9(icg-osu),其作为gmp制造材料采购的。作为预防措施,将化合物1储存在-80℃
±
15℃下并避光储存。
[0279]
方案1和2提供了工艺流程图,随后是制造工艺的详细描述。
[0280]
方案1.
[0281]
步骤1:
[0282]
[0283]
步骤2:
[0284][0285]
步骤3:
[0286][0287]
步骤1:
[0288]
合成:在冰浴中冷却二氯甲烷(ch2cl2)中的聚(乙二醇)甲基醚(peg-oh)1a、三甲胺,4-(二甲基氨基)吡啶(dmap)。然后将二氯甲烷中的α-溴异丁酰溴1b滴加到烧瓶中,同时将烧瓶保持在冰浴中。将反应混合物升温至室温(rt)并搅拌16小时。
[0289]
纯化:然后在搅拌下将反应混合物缓慢加入到含有约10倍体积过量的乙醚的烧杯中以沉淀粗制产物3。然后将粗制产物过滤并在真空烘箱中干燥。将干燥的粗制3从乙醇中重结晶五次,并在真空烘箱中干燥,产出纯化的3(peg-br大分子引发剂)。产率通常为40%至70%,纯度》93%(高效液相色谱[hplc]面积%)。
[0290]
步骤2:
[0291]
重结晶:将粗制2-甲基丙烯酸氨基乙酯盐酸盐(ama-ma单体)、2-丙醇4a和乙酸乙酯组合并加热至70℃直至固体溶解。通过含有硅藻土的预热布氏漏斗过滤溶液。将过滤后的溶液冷却至室温,然后进一步冷却至2至8℃,以在8至16小时内结晶。将所得结晶固体升温至室温,然后过滤并用冷乙酸乙酯洗涤3次。将分离的结晶产物在真空下干燥以得出纯化的4并且在-80℃下储存以用于步骤4。产率通常为40%至70%,纯度通过使用测试中的溶解度以及在102至124℃范围内的明确熔点(≤3℃)指示。
[0292]
步骤3:
[0293]
合成:将2-(二丁基氨基)乙醇(dba-etoh,5)、三甲胺、氯化铜(i)(cucl)和二氯甲烷在烧瓶中组合,并在冰浴中冷却。然后将甲基丙烯酰氯6滴加到烧瓶中,同时保持在冰浴中。将反应混合物升温至室温并搅拌16小时。然后将反应混合物在冰浴中冷却并过滤。将滤液转移到分液漏斗中,并且将有机相用饱和碳酸氢钠水性溶液(nahco3)洗涤两次,随后用去离子水洗涤一次。然后将有机相经无水硫酸钠(na2so4)干燥,过滤并使用旋转蒸发器真空除去溶剂,以产出单体产物7,为液体。
[0294]
纯化:加入附加cucl作为稳定剂并通过真空蒸馏纯化产物。将澄清至淡黄色的馏出物7(dba-ma)转移到琥珀色小瓶中并且在-80℃下储存以用于步骤4。产率通常为30%至60%,纯度>93%(hplc面积%)。
[0295]
方案2.
[0296]
步骤4:
(dba
80-150-r-ama
1-3
),pdba)在真空下干燥并且在-80℃下储存以用于步骤5。产率通常为60%至90%,纯度》93%(hplc面积%)。在一些情况下,产物是缀合和非缀合聚合物的混合物。
[0303]
步骤5:
[0304]
合成:借助于超声浴将中间体8(pdba)溶解在甲醇(meoh)中。然后将甲醇溶液加入到9(icg-osu)中。将反应物在室温下搅拌16小时,同时避光。在反应结束时,向反应混合物中加入6倍过量的乙酸酐并将其混合1至1.5小时以产生粗制产物化合物1。
[0305]
纯化:使用甲醇通过切向流过滤用10k2微型超滤模块纯化粗制产物。真空除去过滤后的溶液的溶剂以产生化合物1,将其避光并且在-80℃下储存。产率通常为》70%,纯度为nlt 95%(sec)。
[0306]
分析:相对摩尔质量分布的分析经由具有折射率(ri)检测和两个安捷伦(agilent)plgel mixed-d 300
×
7.5mm柱的定制凝胶渗透色谱(gpc)方法进行。将试样色谱图与由580至1,074,000g/mol的聚苯乙烯标准物构建的校准曲线进行比较,以计算摩尔质量分布。
[0307]
实例2.储存化合物1
[0308]
用于注射的化合物1当前呈现为在-80℃下储存的3mg/ml的绿色水性溶液。将小瓶解冻至室温,然后静脉内给药15mg/min(阶段1)和30mg/min(阶段2)。
[0309]
实例3.化合物1的稳定性
[0310]
稳定性数据指示,3.0mg/ml的化合物1注射液在-80℃的长期储存条件下稳定长达24个月,持续时间至今。在测定或相关物质和杂质的水平或在储存条件下测试的任何其它属性中未观察到显著变化。更新后的稳定性结果在表1和表2中提供。
[0311]
表1.化合物1在-80℃下0至12个月的稳定性结果
[0312][0313]
表2.化合物1在-80℃下持续18至24个月的稳定性结果
[0314][0315]a在ind 139686中提交的验收标准;在批次制造时根据适当的gmp稳定性标准评价结果
[0316]b每年执行稳定性测试
[0317]
loq=定量限(0.3%);nlt=不少于;nmt=不多于;nd=未检测到;rrt=相对保留时间;sec=尺寸排阻色谱;wt=重量
[0318]
实例4.人体pk效应
[0319]
阶段1研究目标
[0320]
阶段1是一项单主要调查者、非随机、开放性、单臂、横断面研究,旨在评价化合物1在需要手术切除的实体癌患者中的安全性、pk曲线和成像可行性。本研究的主要目的是调查化合物1作为术中光学成像剂用于检测实体癌中的肿瘤和转移性淋巴结的安全性、pk和可行性。本研究旨在调查化合物1的最佳剂量范围,以在给药后24(
±
8)小时术中和使用icg兼容照相机和成像装置从体外样本中获得足够的荧光tbr和cnr。
[0321]
阶段1招募了30名实体癌(hnscc、乳腺癌、食道癌或结肠直肠癌)患者,这些患者经活组织检查证实确诊患有相应肿瘤类型,并计划进行肿瘤的手术切除。研究设计包括剂量递增部分的标准3+3设计(阶段1a;n=18最大值),随后是剂量扩展部分(阶段1b;n=15)。所有患者均接受单i.v.剂量的化合物1,随后在输注化合物1后大约24小时进行常规手术。
[0322]
阶段1a是在5个组群中进行的剂量探索研究,每个组群3名患者。评价的剂量水平依次为0.3、0.5、0.8、0.1和1.2mg/kg。前一组群的最后一名患者完成第10天安全性评估后,进行组群间剂量递增。在研究的阶段1a和1b部分均评价了安全性、pk和成像可行性。在研究期间和给药后长达10天评估患者安全性。
[0323]
在手术期间,使用nir照相机从原发性肿瘤和转移性淋巴结以及包括正常非癌性组织的周围组织获得化合物1荧光的术中图像。这可以是对切除样本的体内和/或体外成像。如果外科医生认为它是安全的,则从具有化合物1荧光的区域收集最多10份研究相关活
组织检查,这些区域在临床上疑似为肿瘤。评价了使用多个nir照相机用化合物1对肿瘤成像的可行性。
[0324]
根据临床癌症护理中使用的标准病理学实践对肿瘤标本进行组织学处理。提供了边缘诊断、临床决策所需的选定组织学特征。从肿瘤和淋巴结样本以及研究相关活组织检查收集荧光图像。边缘宽度和阳性边缘数量被记录下来,并与边缘中荧光的位置相关联。由此计算化合物1荧光与组织病理学之间的相关性。
[0325]
处置和人口统计特征
[0326]
所有患者均接受单剂量的化合物1并完成研究。所有患者均包括在成像、pk和安全性分析中。
[0327]
患有4种不同肿瘤类型的30名患者(hnscc,n=13;bc,n=11名患者;crc,n=3;ec,n=3)进行常规手术,在计划的手术之前24(
±
8)小时接受单剂量的onm-100(表3)。
[0328]
在阶段1a,共有3名男性和12名女性患者参与了本研究,年龄为34至80岁,体质指数为17.4至37.1kg/m2。所有患者均为白种人(高加索人),并且无患者为西班牙裔或拉丁美洲裔。共有8名患者诊断为hnscc,并且7名患者诊断为bc。
[0329]
在阶段1b,共有5名男性和10名女性患者参与了本研究,年龄为45至85岁,体质指数为18.9至39.4kg/m2。所有患者均为白种人(高加索人),并且无患者为西班牙裔或拉丁美洲裔。共有5名患者诊断为hnscc,4名患者诊断为bc,3名患者诊断为crc,并且3名患者诊断为ec。阶段1b的平均年龄(68岁)高于阶段1a(58岁)。
[0330]
表3.患者人口统计和基线特征
[0331][0332]
药代动力学结果
[0333]
研究设计:在阶段1a,将单化合物1iv剂量作为1至5分钟iv输注剂施用至五个组群的患者(0.1、0.3、0.5、0.8和1.2mg/kg),每个组群三名患者,并且在阶段1b,以1.2mg/kg的
剂量施用至15名患者。阶段1a的患者人口统计信息(包括肿瘤类型)呈现在表4和表5中,并且阶段1b的患者人口统计信息呈现在表5中。天祥医药服务(intertek pharmaceutical services)公司(圣地亚哥,加利福尼亚州(sandiego,ca))使用经确认的直接荧光读取器测定确定了化合物1血浆浓度。太平洋生物开发(pacific biodevelopment)公司(戴维斯,加利福尼亚州(davis,ca))执行了pk分析。
[0334]
试样收集:在输注之前和输注之后10分钟和0.5、1、3、8、24、48、72和240小时收集血样。
[0335]
表4.阶段1a患者剂量、人口统计和处置信息
[0336][0337]
f=女性;m=男性
[0338]
表5.阶段1a通过非房室分析估计的药代动力学参数
[0339]
[0340][0341]1由于在24和48小时的两个bql值之后观察到72小时处》lloq浓度,因此auc可能被高估。
[0342]2无法报告,r2《0.8。
[0343]
分析:为每名患者生成血浆浓度-时间曲线。使用phoenix winnonlin(8.0版本)估计药代动力学参数。根据sop,将报告为bql的浓度设为0,但受试者#on1102的0.5h试样(设为lloq/2(参数计算中使用5μg/ml值))以及24和48h试样除外。
[0344]
估计的参数是c
max
、t
max
、t
1/2
、auc
last
、auc
all
和auc
0-24hr
。如果在曲线的终末阶段存在少于三个数据点,则程序不计算t
1/2
(nc)。如果终末斜率估计的确定系数小于0.8,则不报告t
1/2
(nr)。对于任何数据集均未报告外推至无穷大的auc,因为在所有情况下,%外推auc均大于20%,并且因此auc
inf
估计值不可靠。还报告了每名患者在10分钟时的浓度,即测量的第一个时间点(c10m)。
[0345]
通过线性梯形法估计从给药到具有可测量浓度的最后时间点的血浆浓度-时间曲线下的面积(auc
last
)。最后三个或更多个时间点用于估计消除速率常数(λz),其用于从以下等式估计终末阶段半衰期(t
1/2
)和从零到无穷大的auc(auc
inf
):
[0346]
t
1/2
=ln(2)/λz
[0347]
auc
inf
=auc
0-t
+c
t
/λz
[0348]
其中c
t
是最后可测量浓度。
[0349]
阶段1a
[0350]
阶段1a的患者人口统计数据呈现在表4中。个体血浆浓度如表6所示。个体药代动力学参数估计和组汇总统计数据呈现在表6中。平均血浆浓度(log和线性)与时间的关系的图呈现在图1a至1b中。
[0351]
在0.1mg/kg的剂量后,化合物1在任何受试者试样中均不可测量。
[0352]
暴露与剂量相关。c
max
、auc
last
、auc
all
和auc
0-24hr
随着剂量的增加而增加。给药后10分钟的浓度和auc
0-24hr
与剂量的关系分别绘制在图2和图3中。这些图示出了对参数与剂量的关系的数据执行线性回归的结果。将所有血浆值均报告为bql的0.1mg/kg剂量组的数据从这些图中排除。本研究没有能力对剂量比例性执行统计分析;然而,线性回归指示了暴露与剂量之间的强相关性。
[0353]
在0.3、0.5、0.8和1.2mg/kg的剂量下,平均c
10
值分别为12.0、17.3、19.8和31.7μg/ml。平均auc
0-24h
为197、289、383和495μg-h/ml。平均终末阶段半衰期值只能从0.8和1.2mg/kg剂量组量化,并且分别为79.0和36.5h。
[0354]
表6.阶段1a个体受试者血浆浓度
[0355][0356]
[0357]
a bql(《10μg/ml),设置=0以用于pk分析
[0358]
ns=无试样
[0359]
注:lloq=10μg/ml
[0360]
阶段1b
[0361]
阶段1b的患者人口统计数据呈现在表7中。患者的个体血浆浓度如表8所示。个体药代动力学参数估计和组汇总统计数据呈现在表9中。个体血浆浓度(log和线性)与时间的关系的图呈现在图4a至4b中。
[0362]
平均c
10m
为33.2μg/ml,并且平均auc
0-24hr
为638μg-hr/ml。平均终末阶段半衰期为46.4h。
[0363]
表7.以1.2mg/kg的化合物1给药的阶段1b患者人口统计和处置
[0364][0365][0366]
表8.阶段1b患者血浆浓度
[0367][0368]
a bql(《10μg/ml),设置=0以用于pk分析
[0369]
ns=无试样
[0370]
注:lloq=10μg/ml
[0371]
表9.阶段1b:通过非房室分析估计的药代动力学参数
[0372]
[0373][0374]1无法报告,r2《0.8
[0375]
阶段1a和1b组合
[0376]
对于阶段1a和阶段1b组合的所有患者,在图5a(log图)和图5b(线性图)中按剂量组绘制了平均血浆浓度与时间的关系。对于阶段1a和阶段1b的所有患者,在图6和图7中绘制了平均10分钟时浓度(c
10m
)和auc
0-24hr
与剂量的关系的图。该数据支持基于阶段1a数据做出的观察,即暴露与剂量成比例。
[0377]
用1.2mg/kg治疗的阶段1a和阶段1b的所有患者的个体患者药代动力学参数和按肿瘤类型组织的汇总统计数据呈现在表10中。基于肿瘤类型估计的药代动力学参数之间没有明显差异。c
10m
值范围为31.2至35.5μg/ml,并且auc
0-24hr
值范围为585至677μg-hr/ml。
[0378]
每种肿瘤类型的平均血浆浓度与时间的关系的图在图8a(log图)和图8b(线性图)中示出。这些图说明在测试的肿瘤类型中,化合物1药代动力学没有明显差异。每种类型的肿瘤的个体血浆浓度与时间的关系的图呈现在图8c至8f(log图)和图8g至8j(线性图)中。
[0379]
表10.通过对按照癌症类型分类的接受1.2mg/kg(阶段1a和阶段1b)的患者进行非房室分析估计的药代动力学参数
[0380]
[0381][0382]1无法报告,r2《0.8
[0383]
本研究没有能力对剂量比例性执行统计分析,但c10似乎与0.3至1.2mg/kg的剂量成比例(图6),并且auc
0-24h
似乎与1.2mg/kg的剂量成比例(图7)。
[0384]
实例5.荧光成像采集和图像处理
[0385]
使用诺瓦达克spy elite或手术视觉(surgvision)公司explorer air获得“开放手术”的术中图像和视频。根据手册说明,explorer air照相机到肿瘤的距离大约为20cm,并且诺瓦达克spy照相机到肿瘤的距离大约为30cm。诺瓦达克spy照相机只能制作荧光视频,在后处理期间可以将其转换为图像。该照相机的原始数据采集设置是固定的。对于explorer air,尝试对每名患者使用相同的设置(曝光时间和增益),以允许直接比较从两个系统获得的图像,然而,根据手术期间可见的荧光量,在某些情况下由于照相机系统的饱
和而需要进行调节。在一些患者中,在未进行开放手术时使用奥林巴斯(olympus)公司nir腹腔镜和达芬奇萤火虫照相机系统。根据制造商手册使用系统。
[0386]
首先,制作肿瘤和周围区域的切除前荧光图像和/或影像。在手术切除之后,获得创面的图像。在创面中可以看到荧光区域的情况下,在可行时进行活组织检查,并且在手术室中后台对切除样本的所有侧面上成像。如果适用,则在可能的情况下,在原位和后台对淋巴结成像,之后再次对淋巴结清扫的创面成像。
[0387]
指定成像研究人员执行荧光成像。外科医生切除前成像不知情,以避免对标准手术造成任何偏倚,但在执行手术程序时,能够在第二监视器上查看白光图像。外科医生辅助创面和后台成像。在成像程序中,关闭手术室中的环境光以防止与荧光成像程序本身可能发生的相互作用。
[0388]
使用斐济(fiji)(imagej,2.0.0版本)处理图像。基于每像素的最大和最小荧光强度,以每名患者为基础对图像进行缩放。
[0389]
术中后台和术后成像采集
[0390]
在组织处理的所有阶段期间,将样本尽可能地储存在黑暗中以防止成像剂可能的光漂白。
[0391]
切除后,立即使用指定的术中照相机系统以及利科trilogy系统在样本手术切除后60分钟的最大持续时间内在所有6个切除平面(例如,正面、背面、外侧、内侧、尾部和头部)上对整个样本成像(术中后台成像)。两种装置的组合成像时间最多为5分钟。用蓝色和黑色油墨对样本涂墨,以标示切除平面。使用两种颜色油墨的限制不会影响病理学家处理组织的soc,但如果需要第三种油墨颜色,则使用绿色油墨来限定感兴趣的附加病理学切除边缘。
[0392]
调整术后组织切片成像的时间安排,以适应不同肿瘤类型样本处理的soc差异。简而言之,bc样本是在手术当天将新鲜切片且然后用福尔马林固定,其它肿瘤类型在手术后1至3天将整个切除样本福尔马林固定后切片。通常,将手术样本连续切成
±
0.5cm厚的组织切片。出于定向目的,在切片期间和切片后直接拍摄白光照片。切片后,在不透光环境中对每个组织切片的两侧进行荧光成像(利科trilogy系统)。因此,bc切片在切除后大约120分钟成像,其它肿瘤类型在切除和福尔马林固定后的第二天(或更多天)被切片和成像。
[0393]
每个bls在4%多聚甲醛/磷酸盐缓冲盐水中进行过夜福尔马林固定。然后病理学家根据soc宏观取样部分bls(ffpe包埋)用于进一步分析,并制备4μm切片用于苏木精和伊红(h/e)染色以描画肿瘤组织用于组织病理学关联。通过病理学家的常规宏观视觉检验,除了soc检查之外,可以基于bls的荧光成像而嵌入附加ffpe块。执行标准化工作流程以将最终组织病理学结果与所记录的感兴趣组织切片的荧光图像互相关联。7至14天后使用奥德赛平板扫描仪(odyssey flatbed scanner)(利科生物科学)扫描ffpe块。
[0394]
实例6.组织学关联
[0395]
在执行soc病理学程序后(阶段1a大约7至10天,并且阶段1b大约7至14天),由专门委员会认证的病理学家审查并讨论h/e切片的相应肿瘤类型。
[0396]
实例7.术后荧光测量
[0397]
h/e切片与荧光图像(即,面包条切片或bls)之间的关联使用奥多比(adobe)公司
illustrator和斐济(imagej)进行。在基于组织病理学成果精确和手动绘制包含肿瘤和背景的感兴趣区域(roi)之后,针对每名患者的单独bls的每个利科pearl图像计算cnr。基于所有可用的含有肿瘤的bls计算中值cnr。使用斐济(imagej)执行荧光测量以获得
[0398]
·
平均荧光强度(mfi;每像素的荧光强度)
[0399]
·
对比(肿瘤组织的mfi)
[0400]
·
噪声(不含肿瘤的组织的mfi(例如,健康肌肉、纤维化、脂肪))
[0401]
·
噪声标准差
[0402]
·
cnr(对比噪声比):
[0403][0404]
·
tbr(肿瘤本底荧光比率):
[0405][0406]
术中荧光测量
[0407]
在肿瘤区域的可见白光与对应的荧光图像之间进行宏观关联。在绘制含有宏观肿瘤的roi和含有背景的roi后,计算肿瘤和背景区域的mfi。按照上述计算,在每名患者的基础上(每名患者3次测量)计算荧光比率(cnr、tbr)。
[0408]
实例8.统计方法
[0409]
化合物1用于实体瘤和淋巴结转移的术中成像的可行性评估包括量化化合物1荧光的荧光信号cnr、灵敏度和定位模式。此外,通过对术中体内和体外荧光信号(诺瓦达克成像系统)连同体外检查(例如,组织学检查、nir平板扫描)的组合评估来计算对应于足够cnr的安全剂量范围。
[0410]
实例9.患者人口统计特征和样本特征
[0411]
为了评价化合物1的肿瘤不可知成像可行性,在阶段1b,用选自阶段1a的最佳剂量的化合物1(1.2mg/kg)对附加的患有4种不同肿瘤类型(hnscc、bc、ec或crc)的15名患者给药。阶段1b患者患有hnscc(n=5)、bc(n=4)、ec(n=3)以及crc(n=3)。样本特征呈现在表11中。
[0412]
表11.手术/病理学样本特征
[0413]
[0414][0415][0416]
a.分数指示淋巴结病理学为肿瘤阳性(例如,35/37指示摘除的37个淋巴结中,35
个淋巴结病理学为肿瘤阳性)
[0417]
b.除了作为研究协议一部分的肿瘤之外,on1128和on1129患者各自患有按照指示安排手术的第二种肿瘤类型。这些肿瘤类型未用于成像总结或任何定量分析。
[0418]
实例10.荧光成像结果
[0419]
阶段1a
[0420]
对于所有15名患者均可获得完成的阶段1研究阶段1a剂量递增部分的荧光成像结果;组群1(0.3mg/kg),组群2(0.5mg/kg),组群3(0.8mg/kg),组群4(0.1mg/kg)和组群5(1.2mg/kg)各有3名患者,并且阶段1b的另外15名患者为1.2mg/kg。
[0421]
荧光图像
[0422]
呈现了来自在组群2(0.5mg/kg)和组群5(1.2mg/kg)中给药的3名患者的术中(图9a)和术后(图9b)图像。在组群2中,患者on1104和on1106患有hnscc,并且患者on1105患有乳腺癌。在组群5中,患者on1113和on1114患有hnscc,并且患者on1115是乳腺癌患者。
[0423]
术中成像被定义为在手术1小时内执行的体内成像和全样本后台成像的组合。在接受0.1至1.2mg/kg的化合物1的所有8名hnscc患者中清楚地证明了用化合物1术中对肿瘤成像的可行性。7个bc患者肿瘤中的两个用化合物1可视化。剩余的5个bc肿瘤位于深部并被正常组织包围,并且通过化合物1荧光成像在术中不可见。这并不令人惊讶,因为nir成像的组织穿透有限。重要的是,这5个bc肿瘤中没有一个有阳性边缘。这些结果清楚地证明了用化合物1对hnscc和bc进行术中成像的可行性。
[0424]
术后组织样本成像清楚地示出了化合物1在所有15名患者肿瘤样本中的成像可行性。化合物1的这些图像示出了亮荧光区域与暗区域之间的明确边界(图10a、15和16)。坏死肿瘤的核心不示出荧光。对于所有患者,荧光区域对应于标示有感兴趣区域的h/e图像。从基于组织病理学相关性识别为肿瘤或正常的区域观察到高肿瘤本底荧光比率(cnr、tbr)。在阶段1a,在每个测试剂量水平下,获得了所有15名患者的类似图像。
[0425]
平均荧光强度阶段1a-原发性肿瘤
[0426]
术中成像
[0427]
在阶段1a,所有(8个中的8个)hnscc患者肿瘤和7个bc患者肿瘤中的2个(其宏观肿瘤体内可见)体内示出化合物1荧光(剂量范围为0.1至1.2mg/kg)。在所有这些患者中,来自肿瘤组织的mfi高于来自周围正常组织的mfi。
[0428]
由于每种手术环境的独特呈现,无法对患者或剂量水平之间的术中荧光强度进行标准化和比较。如照相机角度、照相机-组织距离、肿瘤位置和其它组织或脂肪的覆盖范围的多个变量会影响荧光信号的绝对值。因此,针对每名患者计算肿瘤和非肿瘤组织的体内荧光比率。如图11a的cnr和图11b的tbr所示,所有患者的术中tbr和cnr值均较高。这指示对于单个手术,肿瘤组织与正常组织之间的荧光强度有清楚分界,这是可能帮助外科医生在手术切除期间实时实现肿瘤可视化的关键因素。这些比率是可变的,并且未示出随剂量的任何系统性增加或减少。
[0429]
术后成像
[0430]
为了将化合物1荧光与肿瘤和正常组织的组织病理学发现相关联的目的,从在标准病理学的每个步骤制备的术后样本(bls样本)捕获化合物1荧光图像。利科pearl,一种具有标准化成像和荧光量化能力的实验室照相机,被用于比较多个样本的荧光强度。
[0431]
图12a示出了以5个剂量水平给药的所有15名患者(来自bc患者的新鲜试样和来自nhscc患者的福尔马林固定(ff)试样)通过标准病理学选择的多个bls的组织学证实的肿瘤和正常组织区域的mfi。肿瘤mfi随剂量增加。正常组织mfi也随剂量增加。当针对每名患者在10分钟时的血浆浓度绘图时(图12b),组织学证实的肿瘤和正常组织样本的mfi示出了每名患者(n=15)的清楚分界(无重叠)。这对于实时图像引导手术而言是重要的关键因素,以帮助外科医生从背景组织描画肿瘤。与剂量类似,mfi随着初始血浆浓度的增加而增加。这些图还示出,福尔马林固定处理(ff)与新鲜组织或hnscc与bc组织之间的荧光信号没有系统趋势。
[0432]
与术中成像一样,使用来自组织学证实的肿瘤和正常区域的术后荧光计算的tbr(图13a)和cnr(图13b)示出了高可变性并且随剂量保持相对恒定。
[0433]
阶段1a总结
[0434]
在进行soc bc或hnscc癌症手术的15名患者中,在手术之前24
±
8小时施用单静脉内剂量的化合物1后,使用开放视野和封闭视野nir照相机执行术中和术后荧光成像。评价在0.1至1.2mg/kg的剂量之间的五(5)个不同的剂量水平。这些数据证明了用化合物1在所有hnscc和bc患者中对肿瘤成像的可行性。用检测icg的多个nir照相机进行化合物1成像是可行的。mfi在每名患者的肿瘤组织与正常组织之间能很好地分界。肿瘤和正常组织的mfi在所评价的剂量范围内均略有增加。荧光比率(cnr和tbr)可变但较高,进一步说明了肿瘤与正常组织荧光之间的明确分界。cnr和tbr未示出出随剂量的任何系统性增加或减少,并且对于bc和hnscc肿瘤很类似。
[0435]
选择来自阶段1研究的阶段1a部分的最高剂量(1.2mg/kg)用于进一步评价化合物1在研究的阶段1b部分中的安全性、pk和成像可行性。在研究的阶段1b部分中,附加的15名患有4种肿瘤类型(bc、hnscc、crc和ec)的患者在给药后24
±
8小时的手术/成像时间接受化合物1(1.2mg/kg)。
[0436]
用于研究的阶段1b部分的1.2mg/kg剂量水平的化合物1的选择基于来自阶段1a部分的以下结果。在阶段1a研究中,安全性曲线在所研究的所有剂量水平上是相当的,并且在较高剂量下未引起任何特定的安全性问题或趋势。化合物1血浆暴露随剂量成比例增加。平均荧光强度随着化合物1血浆暴露而增加;cnr和tbr值是可变的,但保持较高(在2至15的范围内),并且对于体内肿瘤和术后样本荧光均未随剂量降低。这些数据支持使用具有较高荧光强度的最高可行剂量/暴露来评价附加肿瘤类型和内窥镜照相机以及潜在的其它困难场景(如正常组织覆盖的肿瘤、具有解剖学挑战的肿瘤位置、原位导管癌、多病灶肿瘤和小淋巴结转移)的成像可行性。
[0437]
选择来自阶段1研究的阶段1a部分的最高剂量(1.2mg/kg)用于进一步评价化合物1在研究的阶段1b部分中的安全性、pk和成像可行性。在研究的阶段1b部分中,附加的15名患有4种肿瘤类型(bc、hnscc、crc和ec)的患者在给药后24
±
8小时的手术/成像时间接受化合物1(1.2mg/kg)。
[0438]
荧光图像
[0439]
化合物1在15个患者肿瘤中的10个(包括5个hnscc中的5个、4个bc中的3个、3个crc中的2个)中术中发出荧光。1个位于较深部的直肠肿瘤和1个位于较深部的bc肿瘤在术中无法可视化,由于穿透深度有限,这对于nir成像并不奇怪。管腔外成像未检测到三(3)个管腔
内ec肿瘤(1名ec患者有病理学完全缓解)。与阶段1a一样,化合物1荧光在阶段1b检测到所有阳性边缘bc和hnscc患者。管腔内或位于深部的肿瘤在最终病理学上均无阳性边缘。与阶段1a一样,术后化合物1在来自所有患者和肿瘤类型(包括3名患有存活肿瘤的ec患者中的2名)的组织切片中均发荧光。术后图像清楚地示出了亮荧光区域与蓝/暗区域之间的明确边界。
[0440]
阶段1b证实了在bc和hnscc中的成像可行性(与阶段1a一样),并且证明了在肿瘤与正常组织之间具有类似明确边界的其它实体瘤中的成像可行性。
[0441]
平均荧光强度阶段1a和阶段1b-原发性肿瘤
[0442]
术中成像
[0443]
在下面的分析中,组合了在阶段1a和阶段1b以1.2mg/kg给药的所有患者的数据。共有患有hnscc(n=7)、bc(n=5)、ec(n=3)和crc(n=3)的18名患者在阶段1a和阶段1b接受1.2mg/kg的化合物1。
[0444]
计算术中成像可行的患者肿瘤的术中mfi、cnr和tbr(18个患者肿瘤中的11个,见表15)。所有患者的术中cnr和tbr值均较高,指示单个手术的肿瘤组织与正常组织之间的荧光强度有清楚分界。这是一个重要的关键因素,可能有助于外科医生在手术切除期间实时从背景描画肿瘤。这些cnr和tbr结果还指示阶段1b结果证实了阶段1a结果。
[0445]
阶段1b结果总结
[0446]
来自阶段1b的数据清楚地示出了化合物1在1.2mg/kg的剂量下被良好耐受并且允许在bc、hnscc、crc、腹膜转移和可能的ec(如通过术后成像所示)中的术中和术后荧光肿瘤可视化,支持化合物1在实体泛肿瘤成像中的肿瘤不可知作用机制。
[0447]
·
使用化合物1(诺瓦达克和奥林巴斯和pearl)以及管腔外crc(诺瓦达克)在2名患者中将腹膜转移可视化。
[0448]
·
可以用化合物1体内和后台检测bc患者的原位导管癌(dcis),以指示向术中引导和决策。
[0449]
·
通过化合物1检测bc患者的小叶癌(和原位小叶癌)。
[0450]
·
使用化合物1(在整个样本和bls上)在切除后直接对样本进行边缘评估似乎是可行的。
[0451]
无法评价使用化合物1在术中对ec成像的值,因为微创照相机系统缺乏灵敏度所以不能在术中收集图像。然而,使用利科pearl照相机用化合物1成像将ec组织切片可视化。优化用于成像的化合物1剂量/时间表以及改善照相机技术可以克服此限制。
[0452]
阶段1研究的阶段1b部分进一步证实了用设计用于检测icg的多个nir照相机进行化合物1成像的可行性。
[0453]
对于手术视觉open air和诺瓦达克spy elite荧光照相机两者,使用1.2mg/kg剂量的化合物1的术中荧光成像在临床上是可行的。
[0454]
使用奥林巴斯荧光腹腔镜和具有萤火虫照相机的达芬奇机器人用化合物1进行肿瘤的术中可视化具有挑战性,因为与手术视觉和诺瓦达克spy相比,这两个照相机的灵敏度较低。最佳成像性能可能需要更高的剂量。
[0455]
实例11.淋巴结成像
[0456]
淋巴结清扫之后,由主治病理学家识别淋巴结,并且如果存在,则切下淋巴结。在
切下之后,在使用pearl成像进一步处理之前对单个淋巴结成像。使用imagej(斐济)处理图像。无论荧光是否存在,荧光图像均由两名对组织学不知情的独立研究人员审查。病理学家(对荧光图像不知情)基于h/e染色评价淋巴结是否对肿瘤侵袭或分离的肿瘤细胞呈阳性。
[0457]
各患者结果呈现在表12中。在获得自4种肿瘤类型的进行淋巴结切除术的患者的403个淋巴结中,64个淋巴结含有病理学证实的肿瘤(35个淋巴结来自单个患者),其中化合物1在30个淋巴结中发荧光。化合物1准确地在339个病理学阴性淋巴结中的293个中不发荧光。
[0458]
表12.化合物1在检测淋巴结转移中的性能特征
[0459][0460]
id=身份识别号
[0461]
总体性能特征呈现在表13中。
[0462]
化合物1的总体灵敏度=(真阳性)/(真阳性+假阴性)=30/(30+34)=0.47。
[0463]
化合物1的总体特异性=(真阴性)/(假阳性+真阴性)=293/(46+293)=0.86。
[0464]
表13.化合物1在淋巴结中的总体灵敏度和特异性
[0465][0466]
h/e=苏木精和伊红
[0467]
转移性淋巴结的准确术中检测是一项高度未满足的需求并且在技术上具有挑战性。假设在成像时间≥24小时时,由于原发性肿瘤荧光引流到淋巴结中,淋巴结中可能存在非特异性荧光。低灵敏度可能是由于与原发性肿瘤相比,由于淋巴结的尺寸小(即,绝对荧光较小),化合物1在转移性淋巴结中的量相对较小。因此,较早成像时间的更高剂量可以为原发性肿瘤和转移性淋巴结的化合物1荧光成像提供改善的诊断性能。
[0468]
实例12.化合物1荧光成像-临床效用
[0469]
用化合物1荧光成像在所有患有存活肿瘤的患者(30名患者中的29名)中和对于所评价的所有4种肿瘤类型(hnscc、bc、crc或ec)均是可行的,图15和16。在术中(在手术的1小时内体内和后台成像的组合),所有13个hnscc肿瘤、11个位于表面的bc肿瘤中的5个,以及3个crc肿瘤中的2个均可以通过化合物1荧光可视化。11个位于较深部的bc肿瘤中的6个、3个管腔内ec中的2个(3个ec中的1个被证实为有病理学完全缓解),以及3个crc(远端直肠肿瘤)肿瘤中的1个无法可视化。在这些情况中的一些情况中不存在术中荧光可能是由于当肿瘤被正常组织覆盖时nir穿透深度受到限制、当前机器人和内窥镜照相机的灵敏度较低、最佳剂量/时间表和进入某些解剖位置的物理挑战。值得注意的是,这些管腔内或位于深部的肿瘤在最终组织病理学上均无阳性边缘。
[0470]
术后,根据标准、荧光、术后工作流程分析,无论肿瘤类型或剂量如何,所有肿瘤均发出荧光,而健康组织样本均未发出荧光。
[0471]
图11a至11b和定量荧光数据清楚地示出了肿瘤荧光与背景荧光良好地分界。对于在多名患者中评价的4种肿瘤类型,化合物1帮助从正常组织明确描画而使肿瘤可视化的这种能力确立了化合物1图像引导手术在实体癌中的肿瘤不可知成像可行性。
[0472]
肿瘤阳性边缘的荧光检测
[0473]
在共计24名患者(hnscc:13;bc:11)中,9名患者(hnscc:6;bc:3)具有在soc手术期间未检测出的组织学证实的肿瘤阳性手术边缘。以每名患者为基础执行荧光引导的边缘评估。化合物1成像可视化了所有这些手术边缘患者,产生100%的灵敏度。所有荧光阴性手术边缘均与最终组织病理学评估相关联(无假阴性)。15个假阳性中有5个(特异性为67%),其中通过组织病理学评估未证实荧光检测到的组织是肿瘤。14名患者中有5名(36%)的荧光组织为肿瘤阴性(ppv:64%)。
[0474]
按照肿瘤类型,化合物1检测阳性边缘患者的灵敏度和特异性对于bc分别为100%和75%,对于hnscc分别为100%和57%。在组织学边缘状态可得并且为阴性的3名ec患者中的2名和3名crc患者中的1名中,化合物1荧光为阴性。这些初步数据表明了肿瘤不可知诊断性能,并证明了在手术期间使用化合物1成像准确检测肿瘤阳性边缘的可行性。
[0475]
表14总结了所有4种肿瘤类型的个体患者的边缘状态的病理学与荧光相关性的关系。
[0476]
表14.化合物1荧光与手术边缘状态的相关性
[0477][0478][0479]
bc=乳腺癌;crc=结肠直肠癌;dcis=原位导管癌;ec=食道癌;hnscc=头颈鳞状细胞癌;n/a=不适用;pm=腹膜转移;tp=真阳性;tn=真阴性,fp=假阳性
[0480]
a:“切断”是指最近肿瘤阳性边缘为0mm时。
[0481]
b:手术边缘状态基于荷兰指南(dutch guidelines)
[0482]
c:在手术切除1小时内,使用后台术中照相机和利科pearl trilogy执行术后全样本成像。通过组合来自腔荧光和样本边缘荧光的荧光数据来进行边缘评估。
[0483]
假阳性荧光边缘
[0484]
在3名hnscc患者(on1108、on1114、on1121)和2名bc患者(on1123、on1151)中,通过最终组织病理学检查检测到不含肿瘤的假阳性荧光边缘。在hnscc患者中,假阳性荧光对应于1名患者的神经组织、另一名患者的唾液腺和第三名患者的样本边缘上的荧光斑点。在2名bc患者中,假阳性荧光边缘对应于胸肌的主筋膜,以及在组织学上分类为阴性边缘的dcis组织。
[0485]
在乳房切除术患者的皮肤中术中清楚地检测到以及在体外样本中清楚地检测到化合物1荧光。在乳房切除术患者中,在乳头中观察到化合物1荧光。
[0486]
实例13.隐匿性疾病的化合物1检测
[0487]
化合物1荧光检测到5个附加隐匿性病变(1名hnscc患者和4名bc患者),这些病变会被soc术前手术或手术期间或术后病理学遗漏。在1名具有荧光和组织病理学阳性手术边缘的hnscc患者(on1113)中,通过化合物1荧光图像引导手术在创面中检测到附属转移,该附属转移无法通过标准治疗手术检测到。
[0488]
一名bc患者(on1151)的创面和后台样本边缘荧光均被分类为假阳性结果(即,由外科肿瘤学会(society of surgical oncology)和美国放射肿瘤学会(american society for radiation oncology)指南定义的组织病理学阴性边缘),荧光对应于dcis,小管壁内有癌细胞的实体,并且根据国际指南可能需要附加的手术,突出了检测该病变的临床效用。
[0489]
在其它3名bc患者中,在组织病理学处理期间的荧光成像检测到了附加的癌症,这些癌症以其它方式会被遗漏。其中,患者on1101和on1128在组织切片中通过化合物1检测到了bc的附加附属转移。在患者on1115中,化合物1检测到了第二原发性肿瘤病变(三阴性bc),其在术前检查和手术期间被遗漏。
[0490]
在3名crc患者中,外科医生在手术期间和按照soc程序检测到了1名患者(on1130)的意外的腹膜转移。第二名crc患者呈现出腹膜转移的术前临床怀疑(on1120)。在这两名患者中,腹膜转移是荧光肿瘤阳性病变(图17)并通过最终组织病理学证实为恶性。
[0491]
以类似的高灵敏度和特异性跨肿瘤类型检测肿瘤阳性边缘和隐匿性疾病的能力突出了化合物1图像引导手术在帮助进行手术和术后患者管理的临床决策方面的显著潜力。
[0492]
化合物1诊断性能
[0493]
在该阶段1研究中,术中和术后成像数据被用于化合物1的诊断性能的初步分析。体内和在组织切片中计算性能参数如mfi、cnr和tbr,以表征化合物1从背景描画肿瘤组织的能力。使用组织样本荧光评价从邻近正常组织检测肿瘤组织的灵敏度和特异性,并将其呈现为roc曲线。在患者水平获得化合物1荧光在检测病理学证实的肿瘤阳性边缘方面的灵敏度、特异性和ppv。
[0494]
表15总结了所有肿瘤类型和患者的体内和体外cnr和tbr值,对于这些患者体内成像可行或组织切片可用以允许荧光量化。这些比率可变但较高,指示肿瘤组织的mfi总是高于背景组织的mfi,这是荧光引导手术的重要因素。cnr和tbr值未示出随剂量或肿瘤类型的任何系统性变化。
[0495]
术中体内cnr和tbr
[0496]
对于体内成像可行的所有患者(18名患者中的11名:hnscc,7名患者中的7名;bc,5
名患者中的3名;ec,3名患者中的0名;以及crc,3名患者中的1名),1.2mg/kg时的体内cnr和tbr值在所有肿瘤类型中均较高。仅使用直接暴露于可进行可靠评价的表面的粘膜肿瘤(hnscc),1.2mg/kg时的中值cnr为5.6,四分位差为17.6,并且中值tbr为2.6,四分位差为1.4。这些高cnr和tbr比率意味着每名患者手术时肿瘤组织从背景组织的明确描画,这是准确图像引导手术的关键要求。
[0497]
检测手术边缘的术中诊断性能
[0498]
化合物1在检测肿瘤阳性手术边缘患者方面示出了100%灵敏度,无假阴性。化合物1检测手术边缘患者的特异性和ppv分别为67%和64%。按照肿瘤类型,化合物1检测手术边缘患者的灵敏度和特异性对于bc分别为100%和75%,对于hnscc分别为100%和57%。在组织学边缘状态可得并且为阴性的3名ec患者中的2名和3名crc患者中的1名中,化合物1荧光为阴性。这些初步数据表明了肿瘤不可知诊断性能,并证明了在手术期间使用化合物1成像准确检测肿瘤阳性边缘的可行性。
[0499]
表15.按照肿瘤类型使用开放视野照相机进行的术中体内成像以及使用利科pearl封闭视野照相机进行的术后组织切片成像的cnr和tbr荧光比率值
[0500][0501]
注:n/a:体内成像对于11名bc患者中的5名、3名ec患者中的3名,以及3名crc患者
中的2名不可行。术后cnr/tbr计算不可行对于30名患者中的4名不可行。“n”是指每名患者使用的体内图像数量和每名患者使用的组织切片数量,它们分别用于体内成像和组织切片成像的cnr和tbr计算。患者on1116、on1120、on1122、on1130无组织切片:on1116(bc):小肿瘤被大量dcis包围导致样本不足,on1120(crc-pm):pm活组织检查导致样本不足,on1122(ec):完全缓解导致无肿瘤,on1130(crc):样本不足,无阴性对照。
[0502]
术后mfi、cnr、tbr和roc曲线
[0503]
由于每种手术环境的独特呈现,无法对患者或剂量水平之间的术中荧光强度进行标准化和比较。如照相机角度、照相机-组织距离、肿瘤位置和其它组织或脂肪的覆盖范围的多个变量会影响荧光信号的绝对值。为了能够直接比较跨患者和剂量的mfi,用利科pearl(可标准化的近视野照相机)使用荧光的标准术后工作流程对患者组织切片成像。在具有组织病理学证明的存活肿瘤组织的所有患者中,与正常组织相比,肿瘤组织示出了更高的荧光信号强度,在组织切片上具有明确的形态学描画,而与剂量和肿瘤类型无关。在所研究的剂量范围内,mfi随剂量略有增加,然而,cnr和tbr是可变的并保持较高,并且未示出随剂量或肿瘤类型的任何系统性变化。对这些组织切片在测量水平上执行的roc曲线分析示出曲线下面积为0.9726,p《0.0001,示出了优异的性能。这些数据支持化合物1的高度灵敏和特异性以及肿瘤不可知性能特征。
[0504]
为了进一步确认术中澄清,体外工作流程分析示出,与正常组织相比,具有组织病理学证明的存活肿瘤组织的所有受试者的肿瘤组织显示出了更高的荧光信号强度,在组织切片中具有明确的形态学描画,而与肿瘤类型和剂量组群无关(图16,图片y)。肿瘤的平均荧光强度(mfi)随剂量增加(图20,图片a)。在所有组群中,肿瘤mfi显著高于非肿瘤组织。切片的所有组织(n=97,来自26名受试者)的中值肿瘤本底比(tbr)为4.5,四分位差(iqr)为3.1。根据阶段1b研究,肿瘤检测和灵敏度的最佳剂量为1.2mg/kg(tbr4.5,iqr 3.0),并且在可用组织切片中的每一个中,剂量组肿瘤组织的mfi显著高于正常组织。这些组织切片的受试者工作特征(roc)曲线分析示出,auc为0.9875(图20,图片g)。
[0505]
实例14.针对图像引导癌症手术的对肿瘤酸中毒的纳米级大分子协同响应
[0506]
在该首次人荧光图像引导手术研究中,有说服力的体内和体外数据指示,肿瘤酸中毒导致的低ph可以被用作各种实体瘤(包括hnscc、bc、ec和crc)患者的癌症的肿瘤不可知生物标志物。ph灵敏荧光成像剂化合物1被肿瘤酸中毒特异性并持久地活化,从正常组织明确地描画肿瘤,并且在若干情况下提供关于soc未获得的隐匿性癌症的信息:术中检测hnscc患者的所有阳性边缘(9个中的9个)、dcis和附属癌,以及体外检测病理学样本中的3个附加附属病变和第二原发性病变。
[0507]
由于化合物1的设计克服了不同患者与肿瘤之间的代谢和表型可变性,所以肿瘤ph用于成像的成功临床开发是可能的。使用化合物1荧光成像检测所有组织学证明的肿瘤阳性手术边缘(9个中的9个)是可行的。最重要的是,对于任何给定的患者,在肿瘤与背景荧光之间没有重叠。已经描述了由于ph响应性单体的协同行为而在阈值酸性ph下抑制背景活化和完全且不可逆的解猝灭。这种协同性不是通过研究单个单体而预测的,它是由多个单独的聚合物作为胶束相互作用而产生的突生现象,并且是我们观察到的临床作用的原因。
[0508]
结论
[0509]
临床成功需要准确和清晰地描画癌症位置,因为外科医生通常已经具有了有关肿
瘤位置的大量信息。光学成像输出改善手术成果的能力是基于提供外科医生在术前成像和术中检验中没有的信息。soc未提供的化合物1的附加信息可能会显著影响临床护理。
[0510]
在该首次人体阶段1研究中:
[0511]
·
化合物1荧光成像在所评价的所有4种肿瘤类型(hnscc、bc、crc或ec)中均可行,证明了通过其作用机制所预期的化合物1的肿瘤不可知成像的可行性。
[0512]
·
化合物1荧光在组织学证实的肿瘤与正常组织之间表现出明确的分界,具有高cnr和tbr值,这是实时图像引导手术的关键因素。
[0513]
·
化合物1成像在切除的1小时内使用体内创面成像与对切除样本的后台成像的组合检测所有9名肿瘤阳性边缘患者。体内创面成像检测到常规手术遗漏的2个其它隐匿性肿瘤,并通过标准病理学证实,这证明了化合物1图像引导手术在临床决策和患者管理中具有显著价值的潜力。
[0514]
·
通过本研究中使用的多个nir照相机(诺瓦达克spy elite、手术视觉explorer air和利科pearl成像系统)可以检测化合物1荧光。
[0515]
因此,化合物1(静脉内施用的、ph可活化的nir荧光成像剂)允许体内和后台荧光可视化,同时从正常组织清楚描画实体瘤(hnscc、bc、crc和ec)。结果证明了化合物1检测(以其它方式被遗漏)多名患者中的所有肿瘤阳性手术边缘和隐匿性疾病的能力,并且在所有调查的肿瘤类型中显示了肿瘤的肿瘤不可知荧光可视化。这些数据突出了化合物1在治疗计划的临床决策和手术期间和手术后的患者管理中的显著潜力。
[0516]
实例15.来自初始阶段2研究的多个nir照相机系统和多个临床试验地点的给药后3至6小时的乳腺、hnscc、前列腺和卵巢肿瘤评价
[0517]
在阶段2临床研究期间,对于乳腺癌、hnscc、前列腺癌和卵巢癌患者,证明了在i.v.注射化合物1后3至6小时对肿瘤成像的能力(图22至26).本研究还利用了从不同nir照相机和从多个地点收集的数据。所有患者均接受单i.v.剂量的化合物1,随后在输注化合物1后大约3至6小时进行常规手术。来自在手术之前6
±
3小时给药化合物1(2mg/kg)的乳腺癌患者(101-001;宾夕法尼亚大学(upenn);视觉传感nir照相机)和在手术之前6
±
3小时给药化合物1(3mg/kg)的hnscc癌症患者(102-007;得克萨斯大学西南医学中心(utsw);诺瓦达克spy elite nir照相机)的肿瘤的切除前和切除后的术中和后台可视化示出在图22中。在每种情况下,切除前或切除后的肿瘤/样本的白光成像与观察到的荧光和白光图像的叠加并置,指示肿瘤的存在。来自在切除肿瘤之前6
±
3小时给药化合物1(3mg/kg)的两名患者(102-008和102-009;得克萨斯大学西南医学中心;具有更新后的软件和硬件的达芬奇萤火虫nir照相机)的前列腺癌的术中/体内成像和肿瘤切除后的创面成像示出在图23中。在每种情况下,切除前的肿瘤/样本和手术创面的白光成像与观察到的荧光图像并置。数据示出了切除前来自肿瘤的荧光,以及切除后手术创面中缺少荧光。来自给药化合物1(3mg/kg,6
±
3小时)的卵巢癌患者(101-005)的肿瘤在切除前被体内成像,如图24所示。白光图像与观察到的荧光和白光图像的叠加并置,指示肿瘤的存在。来自图22至26的数据证明了化合物1在给药后3至6小时和使用多种类型的nir照相机以及不同的临床部位对肿瘤成像的能力。
[0518]
实例16.在患有实体瘤的犬中评价肿瘤选择性成像剂
[0519]
材料和方法:在为研究评价和招募后,对犬患者进行(a)术前分析以识别可能的病变类型,和(b)在手术之前18至78小时以0.5至2.0mg/kg施用化合物1示踪剂。在手术期间
(c),在肿瘤摘除之前和之后(或在截肢之后),使用滨松pde或定制nir照相机执行术中成像。用利科pearl成像站对切除组织(d)成像,并相应地计算肿瘤与正常组织的比率。然后(e)保留切除组织用于组织病理学确认。通过身体检查、实验室测试和从输注到出院的不良事件的记录,分别在不良事件方面评估安全性。
[0520]
结果:来自为研究招募的已切除卵巢或阉割的犬患者的数据总结如下所示(表16)。呈现了来自共计七只不同品种的犬的结果(年龄为4至12岁,体重范围为20.9至59.5kg),以及一系列肿瘤,包括存在多于一种肿瘤的情况。至今研究的剂量范围为0.5至2.0mg/kg。在几乎所有情况下,均执行了一些术前测试,如x线摄影、骨活组织检查或细针抽吸和细胞学检查,并将其记录在表中的脚注中。按照上述程序,将化合物1施用于动物(“剂量”)并在24或72小时(“时间”)后开始手术以摘除肿瘤。将切除组织送往兽医病理学家以证实病变,并在表中注明解剖位置。从注射到动物出院和随访预约(取出缝线)期间监测急性和慢性不良反应并记录。
[0521]
表16.犬患者信息、化合物1给药法和组织病理学研究
[0522][0523][0524]
sf=切除卵巢的雌性
[0525]
来自表16描述的研究的结果证明(i)在从注射化合物1到其康复的任何时期,在手术后的任何阶段均未观察到任何犬的不良反应,(ii)在基于来自术前活组织检查和组织病理学的数据的组合而预期有患病组织的地方观察到荧光信号,组织病理学在广泛的肿瘤中观察,以及(iii)在一种情况中,在摘除原发性肿瘤的手术期间识别出了隐匿性疾病。
[0526]
在图27至32中示出了具有白光和使用利科pearl成像站得到的nir荧光图像的犬科患者的结果。图27示出了肥大细胞肿瘤切除。左侧的白光图像示出了切除组织,并且通过执行竖直切除也露出了肿瘤组织。疑似癌性组织在图右侧的nir荧光图像中清楚可见,并且与每个图右侧的切除的远端组织(箭头)区分开。图28示出了通过截肢从犬患者切除并在白光下成像的骨肉瘤。使用滨松pde和利科pearl执行了体外成像。图32示出了犬患者淋巴结中远端软组织肉瘤中检测到隐匿性疾病。在从犬科患者手术摘除位于左跖骨区域的原发性软组织肉瘤期间,观察到淋巴结发荧光,并且其在术中通过白光切除并成像,然后体内使用滨松pde nir照相机、体外使用利科pearl nir成像站成像。
[0527]
结论:在犬患者研究中评价了共计7只患有骨肉瘤、软组织肉瘤、肥大细胞肿瘤、滤泡囊肿和其它患病组织的犬。至今获得的结果已经证明:(i)在注射化合物1至出院后所有
犬均无不良反应,(ii)对于所有测试的恶性肿瘤,化合物1推导出的癌性组织位置与来自身体检查、术前活组织检查和切除后组织病理学的数据相关联;以及(iii)识别出了研究中犬患者中的一个的隐匿性疾病(转移性腘淋巴结)。附加地,用3个照相机进行荧光成像是可能的,所有照相机均检测icg,这表明可以用能够检测icg荧光的任何照相机执行成像。这些结果支持化合物1的安全性和其对广泛肿瘤的疗效(这些肿瘤的致癌基因型显著不同),并且其给药法在临床上与人体试验相关。
[0528]
虽然本文已经示出并描述了本发明的优选实施例,但是对于本领域的技术人员显而易见的是,此些实施例仅作为实例提供。在不脱离本发明的情况下,本领域技术人员将想到许多变化、改变和替换。应当理解,在实践本发明时可以采用本文所述的本发明实施例的各种替代方案。以下权利要求旨在限定本发明的范围,并且这些权利要求及其等同物的范围内的方法和结构由此被涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1