组织再生多药物混合剂及其递送器械
组织再生多药物混合剂及其递送器械
1.相关申请的交叉引用
2.本技术要求2019年12月6日提交的美国临时申请系列号62/944,707的优先权权益,其整个内容通过引用并入本文。
3.关于联邦资助研究或开发的声明
4.本发明在美国国立卫生研究院(national institutes of health)授予的ar055993的资助下在政府支持下完成。政府享有本发明的某些权利。
发明领域
5.本发明的领域涉及再生医学。更具体地,本公开内容涉及用于在受试者表面或在有此需要的受试者内部促进组织再生的器械、组合物和方法。所公开的器械包括可穿戴的套管,并且所公开的组合物包括再生组合物。
6.背景
7.仅在美国,预计人肢体丧失的发生率在未来30年内显著增加,在2050年之前每年影响360万人(ziegler-graham等人,2008),留下糖尿病患者、战争退伍军人、创伤幸存者、以及患有外周动脉疾病的那些人(在截肢的情况下选择有限)。
8.先前的努力已经试图诱导肢体再生,包括使用电刺激(borgens(1982)science 217,747-750;leppik等人(2015)sci.rep.,5,18353;smith,(1981)bioelectrochem.and bioenergetics,8(6),661-670)、组织引导生物材料(suckow等人(1999)j.of invest.surg.,12(5),277-287)、祖细胞移植(lin等人,(2013)dev.cell,24(1),41-51)和调节关键分子途径(kawakami等人,(2006)genes&dev.,20(23),3232-3237;yokoyama等人,(2001)dev.biology,233(1),72-79)。但是,它们在恢复新肢体的显著生长和成型(patterning)方面的成功有限。
9.组织再生涉及一系列生物事件,这些事件完全组合以重建在创伤或截肢过程中丧失的切除物或附肢。在典型的创伤愈合应答和再生应答之间存在明显差异。这两个过程虽然在许多实施方案中是相似的,但产生完全不同的终产物。在正常的创伤愈合过程中,许多复杂的生物结构诸如汗腺、导管和毛囊无法重建,因为这样做的生物机制不可用。在典型的成年哺乳动物皮肤创伤中,这些结构不会再生,因为这些组织和器官的发育涉及高度特异性的生理学过程。此外,正常的创伤闭合和瘢痕形成不会为这些结构的再生提供适当环境。另一方面,割处再生是所有原始结构都被原始结构的复制品替换的过程。
10.虽然一些复杂的动物诸如美西螈在其终生中天然再生肢体、眼和其它整个器官,但哺乳动物通常表现出有限的再生,并且通常不表现出像有尾目动物那样的可塑性和转分化能力。当暴露于通过植入截肢组织中的缓释珠子递送的再生诱导剂时,已经向青春期成熟的无尾动物可以再生其截断的或受伤的肢体。用于诱导再生过程的组织祖细胞也可能有用;幼虫肢体祖细胞已经被证实活化相同的wnt、shh信号传递以促进成型。
11.但是,尚不清楚完全非再生的、强烈变态后的(成年的)非洲蟾蜍(xenopus)如何充当有用的再生动物模型,因为成年蛙在截肢后无法再生其后肢,而是产生无特征的软骨尖
刺(suzuki等人,(2006)sci.world j.,6:26-37)。
12.再生套管已被用于受创伤组织的组织再生。常规套管包括允许针头在创伤空间内重复交换介质的隔片、保持创伤湿润的液体蓄池和防止液体离开套管的液体密封件。但是,常规套管受到若干限制。在某些情况下,液体密封件太紧,并可能导致组织坏死。通过针头更换介质可能直接影响创伤床(wound bed)。
13.另外,常规组织再生装置通常利用胶附接到受试者,这不利于长期治疗。使用胶来附接再生装置具有两个主要缺点。胶缺乏在附接后对装置进行调整的灵活性。此外,在外科手术和装置过程中存在操作复杂性。
14.因此,改进的器械和再生组合物是合乎需要的并且被需要。
技术实现要素:
15.公开了用于促进组织的再生的器械、组合物和方法,所述组织是例如存在于活受试者的附肢上或受试者体内的受创伤、受损或受伤部位,诸如存在于器官上或器官内的受创伤、受损或受伤部位。所公开的器械、组合物和方法包括或利用可穿戴的套管和再生组合物。
16.在一个方面,本公开内容提供了用于促进组织的治疗组合物。在某些实施方案中,所述再生组合物可以包括多种组分。在某些实施方案中,所公开的再生组合物在所公开的器械中用作治疗组合物,例如,其存在于接触受创伤、受损或受伤组织的内套管的材料中。
17.在一个方面,所述治疗组合物包含生长因子、脯氨酰羟化酶结构域(phd)酶的抑制剂、维生素a或其衍生物和脂质介质。
18.在特定实施方案中,所述治疗组合物包含生长因子,所述生长因子选自脑源性神经营养因子(bdnf)、神经生长因子(ngf)、神经营养因子-3(nt-3)、神经营养因子-4(nt-4)、胶质细胞源性神经营养因子(gdnf)、睫状神经营养因子(cntf)和白血病抑制因子(lif)、及其组合。在特定实施方案中,所述治疗组合物包含神经生长因子。在特定实施方案中,所述治疗组合物包含脑源性神经营养因子(bdnf)。
19.在某些实施方案中,所述治疗组合物包含phd酶的抑制剂,所述抑制剂选自4,4α-二氢-4-氧代-1,10-菲咯啉-3-甲酸(1,4-dpca)、n-[(1,3-二环己基六氢-2,4,6-三氧代-5-嘧啶基)羰基]-甘氨酸、6-氨基-1,3-二甲基-5-[(2-吡啶基硫基)乙酰基]-2,4(1h,3h)-嘧啶二酮、6-氨基-1,3-二甲基-5-[[2-(2-吡啶基)-4-喹啉基]羰基]-2,4(1h,3h)-嘧啶二酮、n-[(4-羟基-1-甲基-7-苯氧基-3-异喹啉基)羰基]-甘氨酸、铁螯合剂、及其组合。在特定实施方案中,所述phd抑制剂是4,4α-二氢-4-氧代-1,10-菲咯啉-3-甲酸(1,4-dpca)。在特定实施方案中,所述治疗组合物包含4,4α-二氢-4-氧代-1,10-菲咯啉-3-甲酸(1,4-dpca)。
[0020]
在某些实施方案中,所述治疗组合物包含维生素a的衍生物,所述衍生物选自视黄酸、视黄醇、视黄基羧酸酯、维a酸、他扎罗汀、及其组合。
[0021]
在某些实施方案中,所述治疗组合物包含脂质介质,所述脂质介质选自消退素(resolvin)、ω-3脂肪酸的代谢产物、二十碳五烯酸的衍生物、二十二碳六烯酸的衍生物、及其组合。在某些实施方案中,所述脂质介质是消退素。在特定实施方案中,所述治疗组合物包含消退素,所述消退素选自消退素5、白介素6(il-6)、白介素4(il-4)、肿瘤坏死因子-α(tnf-α)、活化b细胞的核因子κ-轻链增强子(nf-kb)、及其组合。
[0022]
在某些实施方案中,所述治疗组合物包含在近端-远端(proximo-distal)位置信息中起作用的药剂,其中所述药剂选自骨形态发生蛋白9(bmp9)、结节生长分化因子、激活素、转化生长因子-β(tgf-β)、成纤维细胞生长因子8(fgf8)、及其组合。
[0023]
在某些实施方案中,所述治疗组合物包含肽或蛋白激素。在某些实施方案中,所述治疗组合物包含肽激素,所述肽激素选自生长激素(gh)、胰岛素样生长因子-1(igf-1)、转化生长因子-β-1(tgfβ-1)、表皮生长因子(egf)、粒细胞-集落刺激因子(g-csf)、成纤维细胞生长因子fgf、及其组合。
[0024]
在某些实施方案中,所述生长因子以从0.1μg/ml至1μg/ml的剂量存在于治疗组合物内。在某些实施方案中,所述phd抑制剂以从0.004μg/ml至0.024μg/ml的剂量存在于治疗组合物内。在某些实施方案中,所述维生素a或其衍生物以从0.03μg/ml至0.27μg/ml的剂量存在于治疗组合物内。在某些实施方案中,所述脂质介质以从0.006μg/ml至0.054μg/ml的剂量存在于治疗组合物内。在某些实施方案中,所述肽或蛋白激素以从0.1μg/ml至1.0μg/ml的剂量存在于治疗组合物内。
[0025]
在另一个方面,本公开内容提供了一种在哺乳动物中促进组织再生的方法,其中所述方法包括将所提供的治疗组合物以足以在所述哺乳动物中促进组织再生的量施用给哺乳动物。
[0026]
在另一个方面,本公开内容提供了所述治疗组合物用于在有此需要的哺乳动物中刺激组织再生的用途。
[0027]
在另一个方面,所公开的器械包括具有组织接收和/或插入末端的外套管、与组织接收末端相对的按压构件接收末端、以及被构造成接收和/或容纳所述组织的内部腔室。所述器械进一步包括设置在所述外套管内的内套管,所述内套管具有用于接收受创伤、受损或受伤组织或附肢的末端,用于接合按压构件的接合接收末端,以及被构造成接收和/或容纳受创伤、受损或受伤组织的内部腔室。所述按压构件被构造成穿过按压构件接收末端延伸到外套管的内部腔室中,并且将内套管的接合接收末端朝向组织偏压,使得受试者的受创伤、受损或受伤组织的至少一部分被放置成与内套管的内部腔室的一部分接触。所述内套管可以包含聚合材料和/或可以由聚合材料形成,所述聚合材料包括、但不限于丝水凝胶材料。所述器械进一步包括第一端帽和第二端帽,所述第一端帽可与外套管的组织接收末端接合并包含开口,所述开口被构造成接收组织并将组织维持在装置中,所述第二端帽可与外套管的按压构件接收末端接合。
[0028]
在某些实施方案中,所述组织是附肢或器官的一部分。
[0029]
在某些实施方案中,所述器械包括可设置在所述外套管的组织接收末端内的第一螺纹适配器,其用于选择性地将可与组织接收末端接合的第一端帽联接至所述外套管。在某些实施方案中,所述第一端帽包括凹槽,所述凹槽被构造成接收第一螺纹适配器的螺纹。
[0030]
在某些实施方案中,所述器械包括可设置在所述外套管的按压构件接收末端内的第二螺纹适配器,其用于选择性地将可与按压构件接合的第二端帽联接至所述外套管。在某些实施方案中,所述第二端帽包括凹槽,所述凹槽被构造成接收第二螺纹适配器的螺纹。
[0031]
在某些实施方案中,所述按压构件包括被构造成接收内套管的接合接收末端的座部分,或包括被构造成安置在第二端帽的座部分上的接合末端。
[0032]
在某些实施方案中,所述内套管的接合接收末端包括多孔过滤介质,其密封地包
封在接合接收末端上的内部腔室。在某些实施方案中,所述多孔过滤介质是合成的或聚合的膜。在某些实施方案中,所述器械包括定位在所述多孔过滤介质和所述按压构件之间的可压缩构件。在某些实施方案中,所述可压缩构件包含棉花或封装的凝胶。
[0033]
在某些实施方案中,所述内套管包含蛋白或聚合物基质,其至少部分地填充所述内套管的内部腔室。在某些实施方案中,所述蛋白或聚合物基质包含三维多孔支架。在某些实施方案中,所述多孔支架可以包括形成定向图案的孔。在某些实施方案中,所述多孔支架包括排齐(aligned)的孔,所述孔形成基本上排齐的通道。所述蛋白或聚合物基质中排齐的通道可以与所述内套管的纵向轴线平行地布置。在某些实施方案中,所述蛋白或聚合物基质选自丝纤蛋白(silk fibroin)、胶原蛋白或它们的组合。
[0034]
在某些实施方案中,所述器械包括包含阳极和阴极的电刺激装置,所述阳极和所述阴极被构造成电连接至电源的对应接线端子,且所述阴极的一部分设置在所述内套管中。
[0035]
在另一个方面,所公开的器械包括按压构件,所述按压构件可响应于在受创伤、受损或受伤组织的部位处的生长而移动,例如,在朝向和/或远离受创伤、受损或受伤组织的轴向方向上移动。在某些实施方案中,所述按压构件将内套管的接合接收末端朝向组织偏压,使得受试者的受创伤、受损或受伤组织的至少一部分被放置成与内套管的内部腔室的一部分接触,并且随着组织再生和/或受创伤、受损或受伤组织愈合,再生的组织和/或愈合的组织使所述按压构件轴向地移动远离创伤,以与接合接收末端直接或间接接触。
[0036]
在某些实施方案中,所述按压构件是弹性的或包括响应于生长组织而压缩的弹性构件。所述弹性构件可以是弹簧。
[0037]
在某些实施方案中,所述器械包括可设置在所述外套管的按压构件接收末端内的螺纹适配器,其用于选择性地将可与按压构件接合的第二端帽联接至所述外套管。所述第二端帽可以包括凹槽,所述凹槽被构造成接收所述螺纹适配器的螺纹。所述弹性构件可以在所述螺纹适配器的座部分和所述按压构件的座部分之间延伸。
[0038]
在所公开的器械的某些实施方案中,所公开的器械的内套管包括在内套管中的蓄池内的材料,当受创伤、受损或受伤组织被插入到所述器械中时,所述材料接触所述受创伤、受损或受伤组织。所述内套管的材料可以包含润湿受创伤、受损或受伤组织的水凝胶。所述材料另外可以包含促进组织再生和/或愈合的治疗组合物和/或抗微生物剂。
[0039]
在另一个方面,所公开的器械包括内套管,所述内套管包括具有第一开口的末端和具有第二开口的接合接收末端,所述第一开口的尺寸被设计成接收受创伤、受损或受伤组织,所述内套管限定在所述第一开口和所述第二开口之间延伸的内部腔室,所述内部腔室的尺寸被设计成接收所述受试者的受创伤、受损或受伤组织。所述器械进一步包括设置在所述内套管的内部腔室中的基质,其中所述基质包含多孔支架,所述多孔支架具有形成基本上排齐的通道的孔。所述基质可以包含以下材料和/或可以由以下材料形成,包括、但不限于聚合材料诸如蛋白,其可以包括、但不限于任何适合形式的胶原蛋白和丝纤蛋白。所述多孔支架的排齐的通道可以与所述内套管的纵向轴线平行地布置。所述基质可以包括本文中公开的治疗组合物诸如再生组合物或再生混合剂(cocktail)。
[0040]
在某些实施方案中,所述基本上排齐的通道与所述内套管中的纵向轴线基本上平行或平行,与所述第一开口和第二开口正交。在某些实施方案中,所述内部腔室包含在所述
过滤介质和所述蛋白基质之间的水溶液或分散介质的蓄池。
[0041]
在某些实施方案中,所述器械进一步包括过滤介质,所述过滤介质的尺寸被设计成包封在所述内套管的接合接收末端上的第二开口。在某些实施方案中,所述过滤介质的孔径大到足以允许空气进入所述器械,但又小到足以防止微生物进入器械。
[0042]
在某些实施方案中,所提供的器械的内套管的内部腔室包括所提供的治疗组合物。
[0043]
在另一个方面,本公开内容提供了一种在哺乳动物中促进组织再生的方法。所述方法包含将所提供的器械附接至哺乳动物的受创伤附肢或组织。
[0044]
在另一个方面,本公开内容提供了所述器械用于在有此需要的哺乳动物中刺激组织再生的用途。
[0045]
本公开内容的前述和其它实施方案和优点将从以下描述中显现。在描述中,参考了形成其一部分的附图,并且其中通过图解的方式显示了一个非限制性实施例实施方案。但是,该实施方案不一定代表本公开内容的全部范围,因此参考本文中的整个公开内容来解释本公开内容的范围。
[0046]
附图简述
[0047]
下文将参考附图描述本公开内容,其中相同的参考数字表示相同的元件。
[0048]
图1是根据本公开内容的一些实施方案的用于在受试者的创伤部位刺激组织再生的器械的侧截面、部分分解视图的示意图。
[0049]
图2是根据本公开内容的一些实施方案的用于在受试者的创伤部位刺激组织再生的器械的侧截面、部分分解视图的示意图。
[0050]
图3是显示截肢线的小鼠趾的图解表示。
[0051]
图4是根据本公开内容的一些实施方案的用于在受试者的创伤部位刺激组织再生的器械的侧截面图的示意图,所述器械具有可移动的按压构件。
[0052]
图5是根据本公开内容的一些实施方案的处于压缩状态的图4的器械的侧截面图的示意图。
[0053]
图6是图1的器械的示意图,但包括根据本公开内容的一些实施方案的电刺激装置。
[0054]
图7是根据本公开内容的一些实施方案安装到受试者的图6的器械的图解表示。
[0055]
图8a是根据本公开内容的一些实施方案显示丝纤蛋白支架的sem图,所述丝纤蛋白支架具有沿着长轴排齐的通道状孔。
[0056]
图8b是根据本公开内容的一些实施方案显示丝支架的sem图,所述丝支架具有垂直于长轴排齐的孔。
[0057]
图8c解释了根据本公开内容的一些实施方案具有沿着长轴排齐的孔的胶原蛋白支架。
[0058]
图8d解释了根据本公开内容的一些实施方案具有垂直于长轴排齐的孔的胶原蛋白支架。
[0059]
图9是在暴露于以下处理条件之一以后作为截肢后月数(mpa)的函数的右后肢长度的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物以后,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0060]
图10是在已经暴露于以下处理条件之一的再生体的远端尖部处通过von frey filaments评估的在17mpa以后的触觉应答的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物以后,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。呈现了平均值和sd。
[0061]
图11是在暴露于以下处理条件之一以后作为截肢后月数(mpa)的函数的通过微ct和x-射线图像评估的右后肢骨长度的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物以后,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0062]
图12是在暴露于以下处理条件之一以后作为截肢后月数的函数的通过微ct和x-射线图像评估的右后肢骨体积的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物以后,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0063]
图13是在18mpa截肢后和暴露于以下初始处理条件之一以后在右后肢中通过乙酰化的α-微管蛋白(aat)染色测量的att+神经束数目的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0064]
图14是在18mpa后和暴露于以下初始处理条件之一以后在右后肢中通过乙酰化的α-微管蛋白(aat)染色测量的神经束直径(mm)的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0065]
图15是在18mpa后和暴露于以下初始处理条件之一以后通过纤连蛋白表达评估的颗粒复杂性(像素2)的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0066]
图16是在18mpa时和暴露于以下初始处理条件之一以后获得的再生体中通过层粘连蛋白和sma+表达测量的层粘连蛋白/平滑肌肌动蛋白(sma+)束的数目的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0067]
图17是在0.5mpa时和暴露于以下初始处理条件之一以后获得的创伤闭合直径(cm)的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0068]
图18是在0.5mpa时和暴露于以下初始处理条件之一以后获得的创伤部位中sox2+细胞的数目的图示:(i)最初24-小时暴露于所提供的多药物治疗(mdt)组合物,(ii)暴露于biodome装置24-小时以后,和(iii)无处理。
[0069]
图19是药物从所提供的mdt组合物中的累积释放的图示。
[0070]
详细描述
[0071]
这些专利、专利申请和出版物的公开内容以其整体特此通过引用并入本技术,以便更全面地描述在本文描述和要求保护的本发明的日期时本领域技术人员已知的现有技术状态。在专利、专利申请和出版物与本公开内容之间存在任何不一致的情况下,以本公开内容为准。
[0072]
在详细解释本公开内容的任何实施方案之前,应当理解,本公开内容的应用不限于在以下描述中阐述或在以下附图中示出的部件的构造和布置的细节。本公开内容能够具有其它实施方案并且能够以各种方式实践或执行。
[0073]
应当理解,本文使用的短语和术语是为了描述的目的,并且不应被视为限制性的。“包括”、“包含”或“具有”及其变体在本文中的使用意在包括此后列出的项目及其等同物以及额外项目。除非另有说明或限制,否则术语“安装”、“连接”、“支持”和“联接”及其变体被广泛使用,并且包括直接和间接的安装、连接、支持和联接。进一步,“连接”和“联接”不限于物理或机械连接或联接。
[0074]
本文中使用的术语“组织”定义为来自相同来源的相似细胞和它们的细胞外基质的集合,它们一起执行特定功能。本文中使用的“组织”可以存在于附肢上,所述附肢包括、但不限于趾骨(诸如手指和脚趾)、臂、腿等。本文中使用的“组织”可以存在于器官(诸如肝、肺、胰腺等)上。
[0075]
术语“治疗组合物”、“再生组合物”、“再生混合剂”和“多药物治疗性化合物”或“mdt”包括这样的制剂:其包含刺激或启动组织再生的治疗药物的组合,并且在某些实施方案中,当施用给受试者时具有协同效应。
[0076]
呈现以下讨论以使本领域技术人员能够制作和使用本公开内容的实施方案。对所示实施方案的各种修改对于本领域技术人员来说将是容易明白的,并且本文的一般原理可以应用于其它实施方案和应用而不背离本公开内容的实施方案。因此,本公开内容的实施方案无意限于所示的实施方案,而是要符合与本文公开的原理和特征一致的最宽范围。将参考附图阅读以下详细描述,其中不同附图中的相同元件具有相同的参考数字。不一定按比例绘制的附图描绘了选定的实施方案,并且无意限制本公开内容的实施方案的范围。熟练的技术人员将认识到,本文提供的实施例具有许多有用的替代实施例并且落入本公开内容的实施方案的范围内。
[0077]
用于组织再生的器械
[0078]
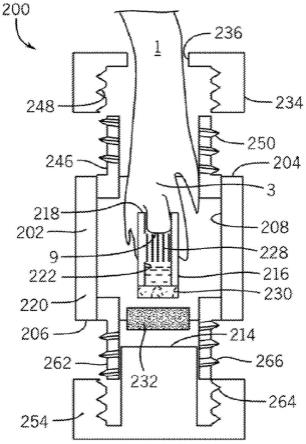
本公开内容提供了用于帮助组织再生的器械。参考图1-3,显示了用于刺激受试者1的组织再生的器械200。在某些实施方案中,将器械200用于包封受试者1的受创伤或受伤组织9。受创伤或受伤组织9可以位于受试者1的外部或内部位置上。在所示实施方案中,关于刺激位于附肢3(例如,小鼠趾)上的创伤组织9的组织再生来描述器械200,其中尖部2已经沿着穿过远端趾骨4的至少一部分的线5被截断,由此再生的组织可以包括骨组织6、肌肉组织7和皮肤组织8以及其它组织。在描述图1-7中,出于示例性目的,可以参考“附肢”作为包含示例性“组织”。
[0079]
在某些实施方案中,用于使用器械200刺激组织再生的受创伤或受伤组织9包括上皮组织、结缔组织、肌肉组织或神经组织。用于再生的示例性受创伤或受伤组织9包括、但不限于鳞状上皮、立方上皮、移行上皮、假复层柱状上皮、柱状上皮、腺上皮、骨、肌腱、韧带、脂肪、蜂窝组织、血液组织、内脏肌肉、平滑肌、骨骼肌、心肌和神经组织。
[0080]
参考图1-2,器械100包括在附肢接收末端204和按压构件接收末端206之间延伸的外套管202。在某些实施方案中,外套管202是限定内部腔室208的中空圆柱体,所述内部腔室208的尺寸被设计成接收待治疗的组织3(例如,附肢)和受创伤或受伤组织9。内部腔室208形成在附肢接收末端204上的第一开口和按压构件接收末端206上的第二开口之间延伸的通道。在某些实施方案中,在附肢接收末端204上的第一开口的尺寸被设计成接收附肢3,并且第二开口的尺寸被设计成接收按压构件214。
[0081]
外套管202可以由透明材料形成,以允许在使用器械200时观察创伤9。在某些实施方案中,外套管202具有足够的刚性以防止在使用期间体壁的任何偏斜或凹陷,以确保维持
期望的创伤空间体积,并保护受创伤或受伤组织9。用于外套管202的构造的示例性材料包括、但不限于透明尼龙管。外套管202可以包括一个或多个开口(未显示)以促进外套管202的内部腔室208内的流体的更换。例如,一个或多个开口可以包括允许针头进入并更换在内部腔室208内的流体的隔片。
[0082]
器械200包括在创伤接收末端218和与创伤接收末端218相对的接合接收末端220之间延伸的内套管216。在某些实施方案中,内套管216是限定内部腔室222的中空圆柱体,所述内部腔室222的尺寸被设计成接收创伤9。内部腔室222形成在创伤接收末端218上的第一开口和在接合接收末端220上的第二开口之间延伸的通道。当器械200被组装时,内套管216被构造成包封创伤9,并且按压构件214被构造成将接合接收末端220朝向附肢3偏压,使得创伤9被放置成与内部腔室222的至少一部分接触。在某些实施方案中,按压构件214使创伤9接触被设置在内套管216的内部腔室222内的蛋白基质228。蛋白基质228可以定向地引导组织生长和/或为创伤9提供治疗剂以刺激组织再生。
[0083]
在某些实施方案中,接合接收末端220包括密封内套管216的第二开口的多孔过滤介质230。在器械200中并入多孔过滤介质230会防止污染并允许与周围环境进行空气和介质交换。多孔过滤介质230有助于保持创伤9湿润和高细胞生存力,同时减少坏死。可压缩构件或介质交换构件232可以定位在过滤介质230和按压构件214之间,以提供与内部腔室222流体连通的水溶液或分散介质的蓄池。在某些实施方案中,外套管202可以包含水溶液或分散介质,其可以被放置成通过过滤介质230与内套管216的内部腔室222流体连通。在某些实施方案中,可压缩构件或介质交换构件232包含凝胶或包含任选地被水溶液或分散介质润湿的棉花。在某些实施方案中,蛋白基质228通过水溶液或分散介质的蓄池从过滤介质230中替换。
[0084]
合适的水溶液或分散介质包括、但不限于水、细胞培养基、缓冲液(例如,磷酸盐缓冲盐水)、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)和它们的合适混合物。在某些实施方案中,所述分散介质包括治疗剂。
[0085]
器械200包括可与外套管202的附肢接收末端204接合的第一端帽234。第一端帽234包括开口236,开口236的尺寸被设计成接收受试者1的附肢3。在某些实施方案中,垫圈或隔片238可以定位在第一端帽234和外套管202的附肢接收末端204之间。垫圈或隔片238包括通孔240,通孔240的尺寸被设计成接收附肢3,并提供防止液体从外套管202的内部腔室208逸出的密封。在某些实施方案中,隔片238包括由硅组成的柔性侧242和包含聚四氟乙烯(ptfe)的刚性侧244。
[0086]
器械200可以包括可设置在附肢接收末端204内的第一可调节适配器246,其用于将可与附肢接收末端204接合的第一端帽234选择性地联接至外套管202。在某些实施方案中,可调节适配器246是螺纹适配器并且第一端帽234包括凹槽248以接收可调节适配器246的螺纹250。当组装时,第一端帽234可以被拧紧,使得垫圈或隔片238被放置成与可调节适配器246的前端(leading end)252接触,以将附肢3固定在外套管202内。
[0087]
器械200包括可与外套管202的按压构件接收末端206接合的第二端帽254。第二端帽254联接至按压构件214以将按压构件214朝向内套管216的接合接收末端220偏压。参考图1,按压构件214可以直接附接到第二端帽254或形成第二端帽254的一部分。参考图2,按压构件214可以与第二端帽254分离。在某些实施方案中,按压构件214包括被构造成安置在
第二端帽254的座部分258上的接合末端256。在某些实施方案中,按压构件214包括与接合末端256相对的座部分260,其被构造成接收内套管216的接合末端220。按压构件214可以由刚性材料或弹性材料形成,所述弹性材料响应于在创伤9处组织的生长而变形或压缩。
[0088]
器械200可以包括可设置在按压构件接收末端206内的第二可调节适配器262,其用于将可与按压构件接收末端206接合的第二端帽254选择性地联接至外套管202。在某些实施方案中,第二可调节适配器262是螺纹适配器,并且第二端帽254包括被构造成接收第二可调节适配器262的螺纹266的凹槽264。可以调节第二端帽254以控制在创伤9处的压力。常规装置的一个缺点是,缺乏对在创伤9界面处的压力的控制,如果存在任何类型的间隙(流体收集、空气等),这会导致组织再生结果的可变性。器械200有利地提供足以保持蛋白基质228与创伤9接触的可调压力。此外,与常规装置不同,器械200有助于长期附接(数周、数月、数年或更长)并且可以调节以促进再生组织的生长。
[0089]
参考图4-5,在某些实施方案中,器械200包括可移动的或可调节的按压构件214。例如,按压构件214可以响应于组织生长而移动或延伸(在图4和5中由δx表示)。在某些实施方案中,弹性构件268被构造成在按压构件214上的座部分270和第二可调节适配器262上的座部分272之间延伸。在某些实施方案中,弹性构件268(例如,弹簧、可压缩材料、可变形材料)产生造成向后线性平移的阻力(例如,当拧下第二端帽254时)。在某些实施方案中,可调节的按压构件214包括可以响应于组织生长而随时间延伸的互锁间隔件或螺钉延伸系统。
[0090]
参考图6-7,在某些实施方案中,器械200也包括电刺激装置300以建立穿过创伤部位9的纵向电场,其被认为提供内部创伤残肢电流并提供电引导信号以对创伤部位附近的细胞类型进行神经支配和迁移。电刺激装置300包括阳极302和阴极304,它们通过引线308、310电连接到电源306的对应接线端子。
[0091]
在某些实施方案中,阴极304呈设置在创伤9附近的不锈钢线的形式。阴极304的一部分安设在器械200外部并可连接到引线308,阴极304的一部分安设在内套管的内部腔室222内。阳极302是可以在远离创伤部位9的位置处插入受试者1中的导线。在其中将器械200设置在附肢3上的所示实施方案中,阳极302设置在附肢3从其上延伸的肢体(后腿)的上部。阳极302可以包含铂/铱合金线,其通过引线310连接到电源306。阳极302可以被永久植入,或者根据需要暂时插入。
[0092]
电源306包括电池组312和电路314,它们二者被包封在外壳316中并且被构造成在连接到电极302、304时向电极302、304提供恒定的低电平电流。在图6所示的实施方案中,电源306安设在受试者1的外部,并且电极302、304被构造成可拆卸地连接到电源306。在这种布置中,当使用电刺激时,阴极304和阳极302在电刺激治疗期间电连接到电源306,并然后在电刺激治疗之间断开。由于电源306和引线308、310可与相应的电极302、304拆卸,因此这种布置在仅间歇地使用电刺激的治疗范例中方便地减小组合的器械200和电刺激装置300的整体体积。
[0093]
在某些实施方案中,蛋白基质228包含生物相容的聚合物。适合与器械100一起使用的生物相容的聚合物包括、但不限于聚氧化乙烯(peo)、聚乙二醇(peg)、胶原蛋白、纤连蛋白、角蛋白、聚天冬氨酸、聚赖氨酸、海藻酸盐、壳聚糖、甲壳质、透明质酸、果胶、聚己内酯、聚乳酸、聚乙醇酸、聚羟基脂肪酸酯、葡聚糖、聚酸酐、聚合物、pla-pga、聚酸酐、聚原酸
酯、聚己内酯、聚富马酸酯、胶原蛋白、丝纤蛋白、壳聚糖、海藻酸盐、透明质酸和其它生物相容的和/或可生物降解的聚合物。在某些实施方案中,蛋白基质228是丝纤蛋白和/或胶原蛋白。
[0094]
在某些实施方案中,蛋白基质228由丝溶液(例如,水溶液)加工而成,所述丝溶液具有在约1%丝至约50%丝之间的丝溶液浓度。在某些实施方案中,基于丝纤蛋白的材料由丝溶液加工以形成不同的材料形式,诸如纤维、泡沫、颗粒、薄膜和/或水凝胶。
[0095]
在某些实施方案中,蛋白基质228是多孔的或具有孔隙率。本文中使用的术语“孔隙率”可以表示材料中空隙空间的量度,并且是空隙的体积占总体积的分数,以0至100%之间的百分比表示。使用标准技术,例如,汞孔隙率测定法和气体吸附(例如,氮吸附)来确定孔隙率是熟练的技术人员已知的。
[0096]
在某些实施方案中,蛋白基质228包括孔,所述孔与在器械200中附连在其上的组织的组织表面积(大小)相匹配以优化受创伤或受伤组织的再生长。在某些实施方案中,蛋白基质228具有在约1μm至约1500μm、或约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm、约1050μm、约1100μm、约1150μm、约1200μm、约1300μm、约13350μm、约1400μm、约1450μm、或约1500之间的孔径。就孔径而言,通常,约100μm至约300μm或约100μm、约150μm、约200μm、约250μm或约300μm适合支持足够的氧、营养物和废物运输,同时为细胞和组织生长提供合适的小生境(niche)。在其它实施方案中,较小的孔直径诸如约50μm至约100μm或约50μm、约60μm、约70μm、约80μm、约90μm或约100μm适合较小组织诸如神经或血细胞。较高的孔隙率由于改善的营养物转移和废物除去,可以促进改善的组织结果。
[0097]
蛋白基质228可以具有形成定向图案的孔,其用于引导在创伤9处的组织生长。在某些实施方案中,定向图案包括排齐的孔,所述孔形成基本上排齐的通道。排齐的孔可以布置成与内套管216的纵向轴线平行。在某些实施方案中,通过在导电基底(例如,铝板)上用陡峭温度梯度冷冻蛋白溶液(例如,丝或胶原蛋白溶液)而形成排齐的孔,所述陡峭温度梯度由导电基底与冷源(例如,液氮)合并而诱导。考虑从冷表面生长的手指状冰晶柱在冷冻的蛋白内部产生通道状结构。然后将冷冻的蛋白低压冻干一段时间(例如,24小时)以除去水。所得产物是具有基本上排齐的孔的蛋白基质228。
[0098]
在某些方面,蛋白基质包含丝纤蛋白。本文中使用的“丝纤蛋白”或“sf”可以表示从蚕丝心蛋白(fibroin)和昆虫或蜘蛛丝蛋白生产的生物聚合物。例如,可用于本公开内容的丝纤蛋白可以是由许多物种生产的丝纤蛋白,所述物种包括、但不限于:印度柞蚕(antheraea mylitta);柞蚕(antheraea pernyi);天蚕(antheraea yamamai);大蜡螟(galleria mellonella);家蚕(bombyx mori);野桑蚕(bombyx mandarina);大蜡螟(galleria mellonella);络新妇蛛(nephila clavipes);nephila senegalensis;乳突棘腹蛛(gasteracantha mammosa);蔽日蛛(argiope aurantia);十字园蛛(araneus diadematus);几何寇蛛(latrodectus geometricus);araneus bicentenarius;tetragnatha versicolor;大腹园蛛(araneus ventricosus);dolomedes tenebrosus;euagrus chisoseus;plectreurys tristis;三带金蛛(argiope trifasciata);和nephila madagascariensis。可替换地,在本公开内容中利用的丝可以通过人工方法制备,例如,涉及细胞或生物体的基因工程(例如,基因工程改造的细菌、酵母、哺乳动物细胞、非人生物
体,包括动物或转基因植物)。
[0099]
与胶原蛋白一样,sf是一种结构蛋白,但具有独特的特性:它是由一个活的复杂生物体将氨基酸溶液挤出到外部环境中而产生,而胶原蛋白是在体内在细胞外空间中通过细胞产生的单体的自组装产生,并且不分泌到外部环境。sf性能源于其结构,其由疏水性嵌段与亲水性酸性间隔物交错组成。在其自然状态下,sf被组织成半结晶材料,其中β-片层晶体与无定形区域交替,这为由蛋白形成的蛋白材料提供强度和弹性。可以在低至高蛋白浓度和低至高分子量加工的再生的sf的多种形式使其对几种高科技应用具有吸引力。
[0100]
sf的加工通常涉及用众多技术(例如溶剂浇铸、冷冻干燥、盐浸、声处理)对丝心蛋白溶液(约1重量%至约15重量%的蛋白质含量)的部分或全部脱水,以形成例如薄膜、海绵、凝胶、球体(微米至纳米尺寸)和泡沫。这些制造工艺提供了将机械强度与生化性能组合的结实材料。
[0101]
在本文提供的方法和组合物中使用的丝纤蛋白溶液可以从含有溶解的蚕丝(例如,来自家蚕)的溶液获得。可替换地,所述丝纤蛋白溶液可以从含有溶解的蜘蛛丝(例如,来自络新妇蛛)的溶液获得。所述丝纤蛋白溶液还可以从含有基因工程改造的丝(例如来自细菌、酵母、哺乳动物细胞、转基因的动物或转基因植物)的溶液获得。参见,例如,wo 97/08315和美国专利5,245,012。基因工程改造的丝还可以包含例如治疗剂,例如与细胞因子、酶或任何数目的基于激素或肽的药物、抗微生物剂和相关底物的融合蛋白。
[0102]
可以通过本领域技术人员已知的任何常规方法制备丝纤蛋白溶液。在某些实施方案中,丝溶液是丝水溶液。在其它实施方案中,丝溶液可以含有第二聚合物以促进向固态的转变(例如,聚乙二醇、胶原蛋白、透明质酸等)。
[0103]
蚕茧丝含有两种结构蛋白:丝心蛋白重链(约350kda);和丝心蛋白轻链(约25kda),它们与被称为丝胶的非结构蛋白家族相关,其将丝心蛋白链胶粘在一起形成茧。重和轻丝心蛋白链在两个亚基的c-端处通过二硫键连接(参见takei,等人,j.cell biol.,105:175,1987;也参见tanaka,等人,.j.biochem.114:1,1993;tanaka,等人,biochim.biophys.acta.,1432:92,1999;kikuchi,等人,gene,110:151,1992)。丝胶是丝的高分子量可溶性糖蛋白组分,其给材料赋予粘性。这些糖蛋白是亲水性的,并可以通过在水中煮沸“脱胶”容易地从茧除去)。
[0104]
在某些实施方案中,根据本发明组合物利用的丝多肽组合物基本上不含有丝胶(例如,不含可检测的丝胶,或含有相关领域的普通技术人员认为对于特定用途而言可忽略的水平的丝胶)。
[0105]
在获得丝多肽组合物的一种示例性方法中,将家蚕(b.mori)茧在水溶液(诸如,但不限于约0.02m na2co3)中煮沸约30分钟。煮沸(脱胶)时间是在约5分钟至约120分钟的范围内,且煮沸(脱胶)温度是在约30℃至约120℃的范围内。可以将茧例如用水冲洗以提取丝胶蛋白,并将提取的丝溶解在盐水溶液中。用于此目的的示例性非限制性盐包括溴化锂、硫氰酸锂、硝酸钙和其它能够溶解丝的化学物质。例如,将提取的丝溶解在约9m至约12m libr溶液中。然后除去盐,例如通过透析。
[0106]
如果需要的话,然后可以使用本领域已知的任何方法浓缩溶液。例如,可以对吸湿性聚合物(例如,peg、聚氧化乙烯、直链淀粉或丝胶)进行透析。peg具有约8,000g/mol至约10,000g/mol的分子量并且具有约25%至约50%的浓度。可以使用任何透析系统,例如,
slide-a-lyzer透析盒(pierce,mw co 3500)。将溶液透析足够长的时间段以产生在约1%至约30%之间的丝水溶液的最终浓度。在某些情况下,透析约2小时至约12小时是足够的。
[0107]
在某些实施方案中,本公开内容提供了将器械200附接到需要组织再生的受试者的附肢或组织的方法。所述方法包括使受试者1的受创伤附肢或组织9接触到内套管216的创伤接收末端218。可以将受创伤附肢或组织9放置成接触或邻近包含所提供的治疗组合物的蛋白基质228。在某些实施方案中,在使受创伤附肢或组织9接触到蛋白基质228之前,使受创伤附肢或组织9滑过垫圈或隔片238和第一端帽234的开口236。
[0108]
所述方法进一步包括将受试者的附肢3放置穿过外套管202的附肢接收末端204,使得内套管216定位在外套管202的内部腔室208内。在某些实施方案中,所述方法包括将第一端帽234和第二端帽254选择性地接合到外套管202,使得按压构件214将接合接收末端220朝向附肢3偏压。在某些实施方案中,所述方法包括将按压构件214朝向附肢3偏压,使得创伤9被放置成与内套管的内部腔室222的至少一部分接触。通过选择性地接合或脱离第二端帽254(例如,通过凹槽264和螺纹266收紧或松开第二端帽254),可以调节在受创伤附肢或组织9和蛋白基质228之间的接触压力。
[0109]
在某些实施方案中,将受创伤附肢或组织9在器械200内维持一段时间以促进组织再生。在某些实施方案中,所述持续时间为约1分钟、或约10分钟、或约30分钟、或约1小时、或约2小时、或约3小时、或约4小时、或约5小时、或约6小时、或约12小时、或约24小时、或2天、或约3天、或约4天、或约5天、或约1周、或约2周、或约3周、或约1个月、或约6个月、或约1年,或在由这些值中的任一个限定的持续时间范围内。在持续期间,可以通过添加或更换内套管216内的缓冲溶液来保持蛋白基质228湿润。
[0110]
用于组织再生的治疗组合物
[0111]
本文还公开了用于组织再生的治疗组合物和“多药物治疗”组合物(mdt)。所述治疗组合物可以单独使用或与所公开的器械结合使用。
[0112]
与根据本发明的器械一起使用的治疗组合物可以是刺激、启动或直接或间接帮助组织再生的任何组合物。可替换地,根据本发明的治疗组合物可以是协同地起作用以刺激或启动或直接或间接帮助组织再生的组分的组合。例如,在治疗组合物中的所提供的组分(例如,两种或更多种组分,诸如生长因子、脯氨酰羟化酶结构域(phd)酶的抑制剂、维生素a或其衍生物、脂质介质或肽/蛋白激素)协同地起作用以相对于未处理的对照实验在受创伤附肢或组织部位处增加再生速率(例如,增加组织再生,如通过软组织长度、骨长度、骨体积、增加的触觉应答、att+神经束数目、att+神经束直径、通过纤连蛋白表达评估的再生颗粒复杂性、层粘连蛋白/sma+束的数目、减少的治疗开始时的创伤直径、sox2+细胞的数目所测量的)。
[0113]
在某些实施方案中,所提供的治疗组合物中的至少两种组分协同地起作用以增加再生速率,或至少三种组分、或至少四种组分、或至少五种组分、或全部组分协同地起作用以增加再生速率。
[0114]
在一个实施例中,所公开的器械可以包含在内套管内(例如,在内套管中的蓄池内)的治疗组合物。所述治疗组合物可以存在于接触创伤部位的材料或基质中,并且当将器械佩戴在受试者的附肢上时,所述治疗组合物可以被递送到创伤部位。包含和递送治疗组合物的可穿戴器械是本领域已知的。(参见,例如,herrera-rincon等人,cell reports25,
1593-1609(2018)。
[0115]
所公开的治疗组合物可以存在于聚合材料中,例如但不限于丝水凝胶材料。用于将治疗组合物和药物装载到水凝胶材料中的方法是本领域已知的。例如,可以如下制备装载了治疗组合物的丝水凝胶材料。可以将治疗组合物添加到丝溶液(例如,3%w/v丝溶液)中,然后通过添加试剂诸如辣根过氧化物酶(例如,至约20u/ml丝溶液的浓度)与过氧化氢(例如,至0.01%w/v的浓度)来诱导其胶凝。作为许多选择中的一些,丝也可以用这种酶促反应、通过降低ph、添加能量(诸如通过声处理或涡旋)、施加电场或添加甲醇来胶凝。
[0116]
所公开的治疗组合物可以包含一种或多种增加轴突/神经突生长和/或一般细胞增殖的药剂。优选地,所公开的治疗组合物不促进细胞中的多能性和/或导致畸胎瘤形成。
[0117]
所公开的治疗组合物可以包含一种或多种促进组织再生和/或愈合的药剂。在某些实施方案中,所述治疗组合物包含以下一种或多种:生长因子、抑制低氧诱导因子1-α(hif1-α)的抑制剂的药剂、维生素a或其衍生物、脂质介质诸如ω-3脂肪酸的代谢产物,并且可以衍生自二十碳五烯酸或二十二碳六烯酸、生长激素、类固醇和去极化剂。
[0118]
在某些实施方案中,所公开的治疗组合物可以包括生长因子,诸如神经营养因子。神经营养因子是一种在发育过程中促进神经细胞的生长和存活并促进成体神经细胞的维持的蛋白(参见,例如,terenghi,j.anat.1999;194(pt 1):1-14。示例性的神经营养因子包括、但不限于脑源性神经营养因子(bdnf)、神经生长因子(ngf)、神经营养因子-3(nt-3)、神经营养因子-4(nt-4)、胶质细胞源性神经营养因子(gdnf)、睫状神经营养因子(cntf)、白血病抑制因子(lif)、及其组合。生长因子可以以至少约0.1μg/ml、约0.2μg/ml、约0.3μg/ml、约0.4μg/ml、约0.5μg/ml、约0.6μg/ml、约0.7μg/ml、约0.8μg/ml、约0.9μg/ml、或约1.0μg/ml或在由这些值中的任一个限定的剂量范围内的剂量存在于治疗组合物中。当生长因子存在于所公开的器械的部件中时(例如,当生长因子装载在内套管中或内套管的部件中时),所述器械可以包含至少约0.1μg/器械、约0.2μg/器械、约0.3μg/器械、约0.4μg/器械、约0.5μg/器械、约0.6μg/器械、约0.7μg/器械、约0.8μg/器械、约0.9μg/器械、或约1.00μg/器械或在由这些值中的任一个限定的浓度范围内的生长因子浓度。生长因子促进一种或多种组织类型的生长。
[0119]
所公开的治疗组合物可以包括脯氨酰羟化酶结构域(phd)酶抑制剂(即,phd抑制剂),例如,以稳定hif-1α蛋白的组成型表达(参见,例如,ariazi等人,j.pharmacol.expt.therap.(2017),363(3)336-347;和nangaku等人,arterioscler.,thromb.vas.biol.2007;27:2548-2554)。合适的phd抑制剂可以包括、但不限于4,4α-二氢-4-氧代-1,10-菲咯啉-3-甲酸(1,4-dpca)、n-[(1,3-二环己基六氢-2,4,6-三氧代-5-嘧啶基)羰基]-甘氨酸(即,gsk1278863或daprodustat)、6-氨基-1,3-二甲基-5-[(2-吡啶基硫基)乙酰基]-2,4(1h,3h)-嘧啶二酮(即,tm6089)、6-氨基-1,3-二甲基-5-[[2-(2-吡啶基)-4-喹啉基]羰基]-2,4(1h,3h)-嘧啶二酮(即,tm60008)、n-[(4-羟基-1-甲基-7-苯氧基-3-异喹啉基)羰基]-甘氨酸(即,fg4592或罗沙司他(roxadustat))、铁螯合剂、及其组合。任选地,phd抑制剂可以以至少约0.004μg/ml、约0.006μg/ml、约0.008μg/ml、约0.010μg/ml、约0.012μg/ml、约0.014μg/ml、约0.016μg/ml、0.018μg/ml、约0.020μg/ml、约0.022μg/ml、或0.024μg/ml或在由这些值中的任一个限定的剂量范围内的剂量存在于治疗组合物中。当phd抑制剂存在于所公开的器械的部件中时(例如,当phd抑制剂装载在内套管中或内套管
的部件中时),所述器械可以包含至少约0.087μg/器械、约0.092μg/器械、约0.097μg/器械、约0.102、约0.107μg/器械、约0.112μg/器械、约0.117μg/器械、约0.122μg/器械、约0.127μg/器械或约0.132μg/器械或在由这些值中的任一个限定的浓度范围内的phd抑制剂浓度。phd抑制剂控制在创伤部位处的过量胶原蛋白沉积。
[0120]
公开的组合物可以包括维生素a或其代谢物或衍生物或在近端-远端位置信息中起作用的任何药剂。维生素a的示例性衍生物包括、但不限于视黄酸、视黄醇、视黄基羧酸酯(例如,乙酸视黄酯、丙酸视黄酯和棕榈酸视黄酯)、维a酸和他扎罗汀、及其组合。可以在近端-远端位置信息中起作用的药剂包括、但不限于骨形态发生蛋白9(bmp9)、结节生长分化因子(即,htx5或nodal)、激活素、转化生长因子-β(tgf-β)和成纤维细胞生长因子8(fgf8)。维生素a或其代谢物或衍生物或在近端-远端位置信息中起作用的任何药剂可以以至少约0.03μg/ml、约0.06μg/ml、约0.09μg/ml、约0.12μg/ml、约0.15μg/ml、约0.18μg/ml、约0.21μg/ml、约0.24μg/ml、或约0.27μg/ml或在由这些值中的任一个限定的剂量范围内的剂量存在于治疗组合物中。当维生素a或其衍生物(或在近端-远端位置信息中起作用的药剂)存在于所公开的器械的部件中时(例如,当维生素a或其衍生物或在近端-远端位置信息中起作用的药剂装载在内套管中或内套管的部件中时),所述器械可以包含至少约0.03μg/器械、约0.06μg/器械、约0.09μg/器械、约0.12μg/器械、约0.15μg/器械、约0.18μg/器械、约0.21μg/器械、约0.24μg/器械、或约0.27μg/器械或在由这些值中的任一个限定的浓度范围内的维生素a或其衍生物或在近端-远端位置信息中起作用的药剂的浓度。
[0121]
所公开的治疗组合物可以包括促进炎症应答消退的脂质介质和/或ω-3脂肪酸代谢副产物(即,抗炎剂)。合适的脂质介质可以包括促进炎症应答消退(即,抗炎)的ω-3脂肪酸的衍生物(例如,代谢副产物),和/或二十碳五烯酸或二十二碳六烯酸的衍生物。示例性的脂质介质可以包括、但不限于消退素诸如消退素5、白介素6(il-6)、白介素4(il-4)、肿瘤坏死因子-α(tnf-α)、活化b细胞的核因子κ-轻链增强子(nf-kb)、及其组合。任选地,脂质介质可以以至少约0.006μg/ml、约0.012μg/ml、约0.018μg/ml、约0.024μg/ml、约0.030μg/ml、约0.036μg/ml、约0.042μg/ml、约0.048μg/ml、或约0.054μg/ml或在由这些值中的任一个限定的剂量范围内的剂量存在于治疗组合物中。当脂质介质存在于所公开的器械的部件中时(例如,当脂质介质装载在内套管中或内套管的部件中时),所述器械可以包含至少约0.005、μg/器械、约0.011μg/器械、约0.017μg/器械、约0.023μg/器械、约0.029μg/器械、约0.035μg/器械、约0.041μg/器械、约0.047μg/器械、或约0.053μg/器械或在由这些值中的任一个限定的浓度范围内的脂质介质浓度。
[0122]
所公开的治疗组合物可以包括肽激素,例如,刺激生长、细胞繁殖和细胞再生的肽激素(参见,例如,schmidmaier等人,bone(2002)31(1):165-72;和schneider等人,j.clin.invest.115(8):2083-98。示例性的激素肽或蛋白包括、但不限于生长激素(gh)、胰岛素样生长因子-1(igf-1)、转化生长因子-β-1(tgfβ-1)、表皮生长因子(egf)、粒细胞-集落刺激因子(g-csf)和成纤维细胞生长因子fgf。生长激素或类固醇可以以至少约0.1μg/ml、约0.2μg/ml、约0.3μg/ml、约0.4μg/ml、约0.5μg/ml、约0.6μg/ml、约0.7μg/ml、约0.8μg/ml、约0.9μg/ml、或约1.0μg/ml或在由这些值中的任一个限定的剂量范围内的剂量存在于治疗组合物中。当生长激素或类固醇存在于所公开的器械的部件中时(例如,当生长激素或类固醇装载在内套管中或内套管的部件中时),所述器械可以包含至少约0.1μg/器械、约
0.2μg/器械、约0.3μg/器械、约0.4μg/器械、约0.5μg/器械、约0.6μg/器械、约0.7μg/器械、约0.8μg/器械、约0.9μg/器械、或约1.0μg/器械或在由这些值中的任一个限定的浓度范围内的生长激素或类固醇浓度。
[0123]
所公开的治疗组合物可以包括去极化剂。合适的去极化剂可以包括、但不限于离子载体(例如,离子通道开放剂或阻滞剂)。合适的去极化剂可以包括、但不限于莫能星、葡萄糖酸钾、葡萄糖酸钠等。
[0124]
所公开的治疗组合物可以用于治疗需要治疗的受试者。本文中使用的“受试者”是指人或动物。通常,动物是脊椎动物诸如灵长类动物、啮齿动物、家养动物或狩猎动物。灵长类动物包括黑猩猩、食蟹猴、蜘蛛猴和猕猴,例如,恒河猴。啮齿类动物包括小鼠、大鼠、土拨鼠、雪貂、兔和仓鼠。家养和狩猎动物包括牛、马、猪、鹿、野牛、水牛、猫科动物物种(例如,家养猫)、犬科动物物种(例如,狗、狐狸、狼)、禽物种(例如,鸡、鸸鹋、鸵鸟)和鱼(例如,鳟鱼,鲶鱼和鲑鱼)。在本文所述方面的某些实施方案中,所述受试者是哺乳动物,例如,灵长类动物,例如,人。受试者可以是雄性或雌性。优选地,所述受试者是哺乳动物。所述哺乳动物可以是人、非人灵长类动物、小鼠、大鼠、狗、猫、马或牛,但不限于这些例子。除了人类以外的哺乳动物可以用作代表组织修复、再生和/或重建的动物模型的受试者。此外,本文所述的方法和组合物可以用于治疗驯化的动物和/或宠物。
[0125]
在某些实施方案中,所公开的治疗组合物可以用于治疗需要刺激组织再生的受试者的受创伤或受伤附肢或组织。所述组织或附肢可以是在受试者内部或外部。在受试者体内需要再生的示例性受创伤或受伤组织包括、但不限于鳞状上皮、立方上皮、移行上皮、假复层柱状上皮、柱状上皮、腺上皮、骨、肌腱、韧带、脂肪、蜂窝组织、血液组织、内脏肌肉、平滑肌、骨骼肌、心肌和神经组织。
[0126]
在某些实施方案中,本公开内容提供了给受试者施用有效量的所公开的治疗性化合物(包含所公开的化合物)以再生受创伤或受伤附肢或组织的至少一部分的方法。在某些实施方案中,所述方法包括使受创伤或受伤附肢或组织与治疗性化合物接触,所述治疗性化合物可能存在于或不存在于所提供的水凝胶中。在某些实施方案中,所提供的治疗性化合物或所提供的水凝胶在本文所提供的器械内与受创伤或受伤附肢或组织接触。
[0127]
所公开的器械和/或治疗组合物促进组织再生。通过本领域已知的任意方法,诸如,但不限于相对于未用所公开的器械和/或治疗组合物治疗的组织,在用根据本公开内容的器械和/或治疗组合物治疗的组织中测量yamanaka因子、sox2、oct3/4、klf4和/或c-myc的表达,可以测量组织再生。
[0128]
动物模型试验
[0129]
当暴露于通过植入截肢组织中的缓释珠子递送的再生诱导剂时,已经成熟到青春期的无尾动物可以再生其截断或受伤的肢体。但是,完全非再生的、强烈变态后(成年)非洲蟾蜍在截肢后无法再生其后肢,而是产生无特征的软骨尖刺(suzuki等人,(2006)thescientificworldjournal,6.)。该模型用于试验再生诱导剂是否可以刺激再生。
[0130]
如以下实施例所述,对成年非洲蟾蜍后腿截肢的复杂干预进行了试验,以解决肢体再生的几个方面。使用可穿戴生物反应器(“biodome”)来实现对体内创伤的局部微环境的控制。寻求一种机制,由此在没有持续微观管理的情况下,向再生混合剂的短暂暴露阶段会启动漫长的内源性形态发生级联。选择了多种刺激,它们诱导促再生活性,诸如减少炎
症、促进神经保留(neural sparing)和诱导整体生长的药剂。
[0131]
发现向可穿戴生物反应器的短暂暴露阶段(例如,24小时)会在非洲蟾蜍截肢后诱导显著的生长晕、成型和感觉运动功能,所述生物反应器含有注入几种小分子化合物的丝。治疗的动物表现出创伤闭合的明显延迟,随后是长期(约16个月)生长结果,包括增加的骨长度、软组织成型和神经肌肉修复。在组织学上,新的肢体含有神经、指示血管的平滑肌、以及参与肢体重塑的细胞外基质蛋白的重组。转录组学分析鉴定出了芽基干预的立即和短期途径和转录靶标。rna-seq试验还揭示了在脑中对完整治疗装置(与假对照相比)的快速应答。再生的骨表现出野生型形态特有的解剖特征,并且远端肢体软组织表现出趾样突出物。此外,所述动物使用新形成的肢体来行走,类似于野生型青蛙。此外,在暴露于完全处理条件的动物中,感觉运动途径得以恢复,这表明组织再成型包括感觉传入神经和神经肌肉组织界面的重新延伸或再生长。
[0132]
这些数据证实,成年非洲蟾蜍能够通过短暂触发而被诱导产生非常显著的、长时间的再生应答,不需要基因疗法或干细胞植入,并揭示了在创伤处和在远端脑处发生的这一过程的分子、细胞和组织水平组分。
[0133]
以下实施例详细阐述了可以使用或实施本公开内容的方式,并且将使本领域普通技术人员能够更容易地理解其原理。以下实施例通过举例说明呈现,并不意味着以任何方式进行限制。
实施例
[0134]
动物
[0135]
在实验前允许测量5cm至6.25cm(从鼻到尾)(nasco,fort atkinson,wi)的成年雌性非洲爪蟾(xenopus laevis)(n=115)适应储罐2周。将动物在18℃维持在含有规定的青蛙水(frog water)(reef salt,seachem laboratories,约1.65kω电导率,7.8-8.0ph)的10l塑料罐中并暴露于12小时光照-黑暗循环。在实验之前,将动物浸泡在广谱庆大霉素抗生素中2小时(gibco,fisher scientific,美国)以尽量减少截肢后残肢的细菌污染。
[0136]
肢体截肢
[0137]
根据golding等人(2016),plos one 11,e0155618和herrera等人(2018),cell rep 25,1593-+公开的先前建立的方案进行后肢截肢手术。简而言之,首先将动物全身浸入含有0.05%苯佐卡因的缓冲青蛙水中进行麻醉。在脚趾捏反射消失后,将75mg/kg丁丙诺啡皮下注射到将要截肢的腿的对侧的侧线刚好下方。将右后肢在胫腓骨的中点处用无菌显微手术刀片使用直切口截肢。没有进行骨切除,也没有在创伤部位缝合组织瓣。在止血后,动物恢复意识并允许其在无菌青蛙水中恢复至少60分钟。
[0138]
装置附接
[0139]
将动物随机分配到三种处理条件之一:无装置、仅biodome或具有混合剂处理的biodome(在下文“biodome制造和混合剂组成”中描述)。在装置附接程序之前是第二次麻醉(0.05%苯佐卡因浸泡液,75mg/kg丁丙诺啡)。然后给无意识的动物配备装置,所述装置使用单丝手术缝线(7-0monosof,18”p-16cutting,covidien,美国)附连到截肢部位残端。两条缝线穿过腿任一侧上的真皮层。这些缝线足以保持装置就位,并没有损坏下面的深筋膜层。在附接后,将动物送回其居住罐,在那里它们恢复意识并被允许自由游泳。对照动物的
处理方式与接受装置的动物类似,但创伤残端没有附接装置。使用缝合的biodome产生本文呈现的结果。
[0140]
可替换地,可以使用可调节的biodome。可调节的biodome的附接程序包括将截断的肢体穿过帽和环形隔片推入适当位置,并使用生物粘合剂skin-tite bioadhesive,smooth-on,pa)固定肢体。将含有支架的biodome插入物附接到截断的趾,并用少量粘合剂固定。将丙烯酸保护帽旋入顶帽,然后用定制垫圈将插入物推至靠近创伤床,并用第二个帽封闭。为了在附接期间保持组织湿润,使用31g针头将约4μl无菌磷酸盐缓冲盐水(pbs)1x缓慢注入插入物中。每2天更换pbs以除去细胞废物并保持组织新鲜。将装置保持附接直到动物被处死用于后续分析。
[0141]
biodome制造
[0142]
缝合的biodome包含一个软硅插入物,该插入物又含有丝水凝胶作为控释基质和药物载体。装置的制造已在其它地方报道(golding等人,(2016)plos one 11,e0155618)。简而言之,通过在3d打印模具上浇铸硅弹性体(dragon skin 10,smooth-on,macungie,pa)来制造外部圆柱形硅套管(20-mm h x 18-mm d),所述3d打印模具使用cad软件(solidworks,waltham,ma,美国)设计并使用formlab 3d打印机(somerville,ma,美国)打印。
[0143]
可调节的biodome包含被切割成1-cm长的圆柱形管的丙烯酸管(#8532k13,mcmaster-carr,elmhurst,il),其被用作器械100的主体。螺纹适配器使用3-d cad软件(inventor professional,autodesk,san rafael,ca)进行设计并使用立体平版印刷术3-d打印机(form2,formlab,somerville,ma)打印。使用医用级强力胶将适配器粘至丙烯酸管上。2-ml hplc瓶帽(agilent,(santa clara,ca)。将ptfe/有机硅隔片用3-mm活检打孔器打孔,以产生动物肢体的进入孔。为了给动物的腿提供更多的空间来穿过孔,将隔片在四个位置沿着中心孔切割,彼此相距四分之一圆。定制垫圈要么使用软平版印刷术从pdms制成,要么使用3d打印机进行3d打印。器械100插入物的圆柱形壁从透明聚酯膜过滤器(0.45μm孔径,12-μm厚,#1300016,sterlitech,kent,wa)制成。将过滤器切成矩形(7mm x 5mm)并围绕1.5-mm直径的金属棒(#8907k62,mcmaster)滚动。然后使用有机硅粘合剂(dragon skin 10fast,smoothon,macungie,pa)将壁粘合至有机硅底部分以完成插入物。
[0144]
保护笼由螺纹帽、透明丙烯酸主体和适配器组装而成。提供了一个只允许单向弯曲的环形隔片,以防止由于动物运动和干预(tampering)而导致器械脱离。定制垫圈与底帽一起提供可调节的压力,其足以将支架插入物保持紧靠在创伤床上,以及在长期实验中保持其位置稳定。它还带有一个用于介质交换的进入孔。该器械插入物含有一个膜状侧壁和一个有机硅底。所述侧壁可以容纳保持组织湿润以及促进气体交换所需的液体,有机硅底用作用于插入针头进行介质交换的隔片。
[0145]
装置拆卸和维护
[0146]
24h以后,将动物麻醉并如前所述用镇痛剂治疗。然后通过剪断腿的任一侧上的单根缝线移除装置,并将青蛙放回装有杀真菌剂(kordon亚甲蓝,浓度为1ml/10l青蛙水)的罐中。另外24小时后,用新鲜的100%青蛙水代替水。一旦他们的装置被移除,就将动物在每天更换的青蛙水中维持18个月。通过全身浸入含有0.2%苯佐卡因的青蛙水中进行终点安乐死。将再生体、对侧肢体和脑组织收集并处理用于组织学分析。
[0147]
丝加工
[0148]
如下制备丝纤蛋白溶液:将5g蚕(家蚕)茧(tajima shoji,yokohama,日本)切割并在0.02m碳酸钠(na2co3)溶液中脱胶45min以除去非必需的蛋白底物(即,丝胶)。将纤维在去离子(di)水中洗涤数次以除去na2co3,并然后在22℃在通风橱内干燥过夜。然后将干丝纤维溶解在9.3m溴化锂(sigma-aldrich,st.louis,mo)的20%(w/v)溶液中,并放入设置至60℃的烘箱中4小时。然后将溶液使用透析盒(3.5kda的分子量截止,thermo fisher scientific,waltham,ma)在去离子水中透析,同时轻轻搅拌。在48小时阶段中换水六次。将透析的溶液在13,000g、4℃离心3次,每次20分钟,然后穿过细胞过滤网(40-μm孔径,thermo fisher)过滤以除去杂质。为了确定过滤的溶液的浓度,将0.5ml样品在烘箱中完全干燥过夜。已经蒸发水分后,将干燥的丝称重,并计算作为干燥丝的重量与其0.5ml初始体积的比率的以%(wt/v)为单位的浓度。
[0149]
通过交联液体丝纤蛋白形成丝水凝胶。将45-mb丝(3%w/v)和辣根过氧化物酶(hrp)溶液(20u/ml)倒入24孔板中,并在37℃温育45分钟以完成胶凝。根据golding等人(2016),plos one 11,e0155618的方法试验凝胶的凝胶压缩强度和模量。
[0150]
具有排齐孔的支架
[0151]
使用5μl的4%(wt/v)丝溶液制造具有排齐孔的丝支架。将溶液放置在铝板的顶部,并通过在液氮(ln2)中合并板来诱导陡峭的温度梯度。从冷表面生长的手指状冰晶柱随着它固化在丝溶液内部建立通道状结构。冷却10分钟后,将冷冻溶液低压冻干24小时以上以除去水。将海绵修整以适合作为插入物放入biodome,并在环氧乙烷中灭菌,并在无菌条件下在室温储存直至使用。
[0152]
通过1.5%(wt/wt)胶原蛋白溶液的受控定向冷冻和冷冻干燥(以与丝支架类似的方式),制造具有排齐的通道状多孔结构的胶原蛋白支架。将支架切割成圆柱形形状(4-mm长和1.5-mm直径),并使用镊子放置在biodome插入物内。
[0153]
材料表征
[0154]
使用扫描电子显微术(sem)和荧光光学显微术表征支架的形态。对于sem成像,使用剃须刀片将支架切成两半以暴露孔的内部几何形状。在成像之前,将支架溅射镀金以增加电导率。在设置为5kv的显微镜(zeiss evo ma10)上进行sem成像。对于荧光成像,将支架在pbs中用2μg/ml异硫氰酸荧光素(fitc)染色,并使用keyence显微镜(bz-x800,keyence,日本)成像。使用instron testing system确定支架的压缩刚度和弹性模量。图8a是具有沿长轴排齐的通道状孔的丝支架。图8b是具有垂直于长轴排齐的孔的丝支架。图8c是具有沿长轴排齐的孔的胶原蛋白支架的sem图像。图8d是具有垂直于长轴排齐的孔的胶原蛋白支架。
[0155]
治疗组合物
[0156]
使用3%(w/v)丝溶液、20u/ml的辣根过氧化物酶(hrp)和0.01%wt/v的过氧化氢(h2o2)的最终浓度制备水凝胶。将液体溶液倒入硅套管中,并使其胶凝30分钟,然后附接至动物的肢体残端。对于装有混合剂的装置,将0.014μg/ml的1,4(二氢菲咯啉-4-酮-3-甲酸)dpca(目录号71220,caymen chemicals,mi,美国)、0.5μg/ml的脑源性神经营养因子(bdnf)(目录号450-02,peprotech,ma,美国)、0.5μg/ml的生长激素(gh)(目录号100-40,peprotech,ma,美国)、0.036μg/ml的消退素d5(目录号10007280,caymen chemicals,mi,美
国)、0.015μg/ml的视黄酸(目录号11017,caymen chemicals,mi,美国)装载进液体丝溶液中,然后插入硅套管并胶凝。
[0157]
体外释放研究.
[0158]
为了确定在本实施例中使用的药物的释放曲线,将50μl加载有特定量的特定药物的每种水凝胶溶液加入1.5-ml微量离心管中,并在37℃温育45min以完成胶凝。然后,将1ml的dulbecco氏磷酸盐缓冲盐水(dpbs 1x,gibco)添加到每个瓶中,然后在37℃温育。在固定的时间点,收集300μl上清液用于分析。将无药物丝水凝胶的释放溶液用作对照。通过测量具有已知浓度的溶液的光密度来确定标准曲线。一式三份地进行所有释放实验以确保准确性。对于ra和1,4-dpca,使用由softmax pro 6软件运行的微量培养板读数器spectramax m2(molecular devices,san jose,ca)在紫外透明的96-孔板(corning,corning,ny)上测定释放溶液的光密度。分别在280nm和350nm波长对1,4-dpca和ra溶液进行检测。
[0159]
使用酶联免疫吸附测定(elisa)试剂盒确定在释放样品中的bdnf和gh的浓度,所述试剂盒含有为bdnf和gh设计的单克隆抗体(#bgk23560和#bgk01241,peprotech,rocky hill,nj,美国)。根据制造商的方案进行样品制备和测量。使用spectramax m2平板读数器在450nm处读出制备的样品的光密度。将消退素d5的释放样品用蛋白过滤柱(mwco=3kda,#ufc500324,fisher)过滤以除去高分子量丝心蛋白内容物。然后使用spectramax m2平板读数器在244nm的波长处测定样品的光密度。
[0160]
软组织成像
[0161]
在18个月的维持期内定期评价动物的软组织再成型和骨再生长。如前所述对动物进行麻醉,并使用dslr照相机(canon eos rebel t7i)捕获其创伤部位的高分辨率图像和再生体尺寸。为了确保可复制性,截肢平面用作所有测量的标准参考点。截肢部位容易识别,因为在切口点处肢体逐渐变细。每次测量由截肢部位和再生体的最远端之间的长度的线性评估组成。
[0162]
体内、x-射线和微ct骨成像
[0163]
除了软组织测量外,根据golding等人(2016)plos one 11,e0155618和herrera-rincon,等人,(2018)cell rep 25,1593-+的成像方案,使用手持式x-射线装置(nomad pro 2tm)使用60kv、2.5ma的标准成像设置和0.20s的曝光时间评估骨长度。每只动物在固定的时间点接受相同的剂量(0.12msv)。在viva ct 40扫描仪(scanco medical,瑞士)中进行计算机化断层摄影(ct)以可视化在苯佐卡因剂量过量(0.2%全身浸入)安乐死后18个月再生阶段结束时骨的详细微结构。将远端小梁骨和中轴骨皮质切片(615个切片/动物,76μm/切片,300ms的积分时间)可视化并呈现为3-d图像以进一步量化。辐射剂量按照既定的制造商指南使用本地ct剂量指数(ctdi),范围从453mgy至1255mgy。
[0164]
组织学和免疫组织化学
[0165]
为了表征治疗对截肢后肢体再生长和再成型的影响,随着时间的推移在固定的间隔对再生体和对侧肢体进行组织学分析。在18mpa收集组织。将长期再生组织在pbs中的4%低聚甲醛(pfa)中固定过夜,并通过暴露于递增浓度(10%-15%)的乙二胺四乙酸(edta)(ph7.4)脱钙2周。一旦脱钙(使用x-射线确认),将组织逐渐平衡至30%蔗糖,然后嵌入oct(sakura finetek,美国)。将样品在液氮中冷冻。将肢体组织使用低温恒温器(leica cm1850)以14μm做出连续切片并放置在载玻片上。从原始截肢部位上方的胫腓骨区域至肢
体末端的成型区域,以14μm的间隔跨肢体截取横切面。为了使成型可视化,以14μm的间隔对肢体的末端部分做出水平切片。将切片在-80℃储存前干燥至少1小时。
[0166]
对于免疫组织化学,在染色前将载玻片平衡至室温至少2小时。将载玻片在4%pfa中后固定5分钟,并然后在封闭缓冲液(含0.1%triton x-100和10%正常山羊血清的pbs)中封闭1小时。使用针对乙酰化的α-微管蛋白(1:100)、tgf-β(1:250)、平滑肌肌动蛋白(1:100)、层粘连蛋白(1:100)、纤连蛋白(1:500)和磷酸组蛋白h3(1:250)的一级抗体。除抗-平滑肌肌动蛋白和抗-层粘连蛋白(将它们一起染色)外,将载玻片用每种抗体单独染色。将一级抗体在载玻片上温育过夜。在pbs中洗涤后,将alexa-fluor二抗(1:500,thermofisher scientific)应用于封闭缓冲液中2小时。将载玻片再次在pbs中洗涤并在pbs中用dapi 1:200染色20分钟。将载玻片安装在fluoromount-g(thermofisher scientific)中,并在成像前固化(cure)至少24小时。
[0167]
使用evos fl自动化成像系统(thermofisher scientific)对切片进行成像。收集全部切片并缝合在一起进行分析。
[0168]
免疫染色的切片分析
[0169]
在ibm spss 20版软件中进行所有统计分析。在使用参数检验(包括anova、t-检验和相关分析(pearson’s r))之前检验了正态性假设。进行非参数分析、mann whitney wilcoxon检验或kruskal-wallis检验以进行数据非正态分布的对比。如果p值低于0.05的阈值(双尾假设检验),则假定显著性差异。
[0170]
感觉运动阈值的评估
[0171]
为了评价再生体的感觉运动能力,将动物在截肢后18个月进行评估。将每只动物放入装有2l青蛙水的玻璃罐中并适应5分钟,直到运动完全停止。将摄像机(ipod touch第5代,apple,ca,美国)放置在外壳上方以捕获试验程序的记录。将标准化的von fry纤丝(touch test,stoelting,il,美国)用于评估再生体的感觉阈值。将在0.008g至300g力范围内的纤丝施加到再生体的远端部分,力从最低到最高。记录引起明确应答(从静止位置移动)的第一纤丝。在2天阶段内对动物试验两次,并报告平均阈值。
[0172]
统计分析
[0173]
使用imb spss v20进行所有统计分析。首先,通过levene氏检验对数据进行同方差性检验。通过未配对的双尾student氏t-检验(两个独立组)或单因素方差分析检验(多个独立组)和随后的事后scheffe氏检验(当p《0.05时),对正态分布数据进行单因素分析。当考虑变量“时间”时,通过双因素方差分析进行双因素分析。通过使用student氏t-检验确定在每个特定时间点治疗组(无装置、仅biodome和混合剂治疗)之间的统计学显著性差异。在非正态分布数据中,分别进行了kruskal-wallis检验和随后的事后dunn检验(当p《0.05时)。在所有情况下,将显著性水平设置为0.05。将统计值报告为平均值
±
标准差或平均值
±
平均值标准误差,在指明的情况下。在适当时,使用点图或散布图来突出每个实验组内的个体变异性。
[0174]
rna提取
[0175]
在截肢、装置附接和移除、以及24小时治疗后,在截肢后11、24和72小时收获再生组织用于下一代测序(ngs)。样品由来自远端创伤部位的1cm厚组织块组成。也收集脑并快速冷冻。根据制造商的方案使用trizol(thermofisher scientific)提取组织,并使用
nanodrop分光光度计(thermofisher scientific)评估总rna质量和数目。
[0176]
下一代测序(ngs)
[0177]
将1.1μg的总rna送至tufts genomic core。通过生物分析仪评估rna质量,并使用带有ribozero gold(invitrogen)的truseq链rna文库制备试剂盒将高质量rna用于文库制备。然后对文库进行多路复用,并在illumina hiseq 2500上进行单末端50nt测序。将原始读出文件发送到joslin糖尿病中心的生物信息学和生物统计学中心(bioinformatics and biostatistics core at joslin diabetes center)。
[0178]
ngs分析
[0179]
从ncbi基因组数据库的集合gca_001663975.1下载非洲爪蟾的参考基因组。使用star校准器(dobin等人,bioinform.(2013);29(1):15-21.doi:10.1093/bioinformatics/bts635.10月25日电子公开.pubmed pmid:23104886;pubmed central pmcid:pmc3530905.)校准读出,并将校准的读出值使用featurecounts(liao等人,(2014)bioinform.30(7):923-30)计数。在分析中包括在至少3个样品中具有超过百万分之一计数(cpm)的表达计数的基因,并将计数通过m-值的加权修剪平均值(tmm,robinson等人,(2010)genome biol.11,r25.)归一化。进行了voom转化(law等人,genome biol.15,r29),以将计数转化为logcpm,其中cpm=1e+6*基因计数/(样品的总计数*样品的归一化因子)。voom转化还估计均值-方差关系并使用它来计算适当的观察级权重,使得更大的读出深度给出更大的权重。为了进一步降低离群值的权重,收集样品特异性的质量权重(ritchie等人,(2006)bmc bioinform.7,261.)并与观察级权重组合。
[0180]
使用limma鉴定差别表达的基因(ritchie等人,nucl.acids res.43,e47.)。进行适度的t检验以检测两组之间差别表达的基因。具有fdr《0.25的基因被认为发生了显著变化。
[0181]
用于途径分析的基因集从msigdb collections获得,并且选择了属于经典途径(cp)或基因本体(go)的基因集。在limma r包中在旋转基因集检验(rotation gene set test)(roast)中用fry函数进行分析(wu等人,(2010)bioinform.26,2176-2182.)。如果p《0.05且fdr《0.05,则认为协调向上、协调向下和混合的基因集均具有显著性。
[0182]
网络分析
[0183]
基于截肢后11小时、24小时和7天对照组和混合剂治疗组的logcpm值,通过在r(russo等人,2018)中的cemitool中的共表达分析鉴定基因模块。在cemitool中,应用方差稳定变换来消除均值和方差参数之间的依赖性,并在p《0.1的阈值基于表达水平过滤基因。基于自动生成的缩放值(scaling value)β(β=10)和30个基因的最小模块大小,在数据集中鉴定共表达基因的模块。为了评估这些模块的丰富度如何随时间和组而变化,根据样品注释计算模块丰富度。为了确定哪些生物学功能与每个模块相关,使用来自reactome的途径数据库进行过度表示分析,并且在p《0.05时,途径被认为是显著的。带注释的模块图组合了来自京都基因和基因组数据库(kegg)和chemical and genetic perturbations(cgp)的基因-基因相互作用数据,以绘制在每个模块中包含的相互作用基因。
[0184]
qpcr方法
[0185]
将提交用于rnaseq分析的相同总rna使用rq1无rna酶dna酶试剂盒(promega corp.,madison,wi,美国)进行dna酶处理。将得到的rna(0.5μg)进行第二次dna酶处理,然
后使用verso cdna合成试剂盒(thermofisher scientific)进行cdna合成。使用step one plus real time system(applied biosystems,美国)对基因产物的量进行定量分析。每个10μl反应一式两份地运行并包含:5μl的2xpowerup sybr green master mix(applied biosystems,美国)、0.5μl的10μm正向和反向基因特异性引物、以及1.33μl的稀释的cdna模板。使用δ-δct方法分析相对表达,其中跨时间点的所有nd表达的平均值用作所有样品的校准物。
[0186]
结果
[0187]
1.通过多药物再生处理诱导腿再生
[0188]
将成年非洲蟾蜍后肢在胫骨和腓骨的中点处截断,并配备biodome装置,该装置包含具有5-药物多药物治疗(mdt)的基于丝的水凝胶或仅水凝胶。对照动物被截肢后未治疗。在向biodome暴露24小时后,移除装置,并将动物维持至多18个月,并定期评估后肢再生体的再生和再成型。根据alibardi(2018)的计算来选择延长的观察窗口,该计算基于使用蝾螈残肢直径的投影模型预测需要约1.5年来再生无尾动物肢体。
[0189]
获取x-射线图像以测量肢体长度作为截肢后月数的函数。x-射线显示,在4个月后,与仅biodome和多药物治疗(mdt)条件相关的再生体比对照(无装置)再生体更长,这种效果在4个月后消失,并然后在8个月时再次出现并随时间推移持续存在(双因素方差分析,受试者之间因素处理暴露,受试者内因素再生时间f(2,19)=61.9,p《0.05)。早至截肢后0.5个月(mpa)并持续到4mpa,mdt组相对于其它组的肢体长度(相对于截肢部位)更大(p《0.05),从而提示,mdt增加了早期生长速率。在第6-8个月,生长显著放缓,并且与仅biodome组相关的后肢再生体达到了与暴露于mdt的动物相当的长度(p》0.05)。在9mpa后晚期生长中的二次增加表明,mdt组再次显示相对于其它组更长的肢体,这种效果持续到在18mpa的最终测量(p《0.01)。因此,与其它治疗组相比,mdt组不仅显示腿长度的最终增加,而且还显示在其它治疗组、特别是无装置组中不存在的二次生长阶段。这些数据提示,向mdt和biodome的短暂暴露有助于更长的腿再生长。
[0190]
不仅腿长增加,而且与无装置组的无特征的、重度色素沉着的尖刺相比,76%的暴露于mdt的动物还表现出更厚、更复杂的再生体形态。具体来说,与mdt组相关的后肢再生体的远端区段呈现出扁平的桨状结构,具有趾特有的突出芽。相比之下,无装置和仅biodome条件仅与无特征的再生尖刺相关,所提供的mdt条件可靠地产生了成型的桨状形态,并存在远端芽。biodome组具有中间表型,其中20%的biodome动物表现出较厚的软骨尖刺和钩状远端突出物,但成型有限。无装置组中的动物都没有显示出独特表型。
[0191]
2.诱导的腿表现出感觉功能
[0192]
接下来,为了评估18mpa再生体是否已经恢复感觉功能,进行了感觉运动评估。使用标准化的von frey(vf)纤丝(最小力:0.008g;最大力:300g),在最远侧端部用递增强度的纤丝探测再生的右后肢,直到施加最大力。记录引起明确应答(从静止位置移动)的第一纤丝,并将行为测定在2天中平均化。mdt处理的后肢再生体显示出与非截肢组相当的刺激-应答模式(p》0.01;图10),表明显著的神经再支配和神经肌肉重新整合。在biodome组中,应答在各个动物之间显著不同,其中一组表现出接近正常的水平,另一组不能检测到刺激(56.6
±
98.8g),而未经处理的动物可靠地未能对高达且包括300g的任何值的力的施加表现出任何应答。因此,我们得出结论,mdt处理促进了类似于未截断的肢体的感觉运动整合。
令人感兴趣的是,单独biodome组有时也能够促进具有完整感觉系统的肢体的再生长,这表明水合作用和结构支持对于维持神经支配和促进神经再生长而言可能是重要的。
[0193]
3.mdt暴露增加后肢骨长度和复杂性
[0194]
使用微ct和x-射线图像表征再生体的内部结构。由于治疗显著改善了总后肢长度(图9),随后研究了再生体的骨组分。再生体的微ct和x-射线图像显示,与仅biodome和对照相比,与所提供的mdt组合物相关的骨体积和长度增加。
[0195]
x-射线图像证实了相对于仅biodome和无装置对照实验,mdt再生体中存在复杂的形态和增加的骨长度。从在2.5mpa的测量开始,在mdt和biodome组中观察到从截肢部位向外突出的致密组织,但在无装置对照组中没有观察到。mdt组还在再生体的远侧端部出显示致密的分段骨碎片。正如预测的那样,mdt条件显示相对于其它条件增加的骨长度,这从4mpa开始(p《0.05),拐点在大约8mpa(类似于软组织测量)。如在图11中所示,定期观察mdt和biodome组之间的骨长度差异,但那些组和无装置对照之间的长度差异始终保持(p《0.05)。
[0196]
为了更好地理解再生骨的微结构,在18mpa进行微ct。微ct成像允许在不干扰外部软组织的情况下可视化底层骨的3维绘制并且测量骨体积。微ct数据证实了mdt后肢远端区域存在明显的骨碎片。值得注意的是,碎片不会发生在截肢部位,而是在一段生长后在相当于对侧关节的骨骼点处自发出现。这些重新成型的分段在mdt组中很常见。如在图12中所示,相对于其它组而言,关于mdt组的后肢再生体,通过微ct数据测量的骨体积更大。体积定量证实在提供的mdt再生体中增加的生长(单因素方差分析(f(2,15)=11.15,p《0.001))。x线断层照片还显示未截肢的和mdt处理的骨骼解剖结构之间的显著相似性。在所提供的mdt再生体中再成型是明显的,包括通常与肌肉附着相关的骨特征的重新表达。具体来说,在17mpa,mdt组显示肌肉附着特有的骨特征以及关节分段的存在。这些数据表明,mdt条件与骨骼解剖结构的显著重塑相关,与重塑骨骼的主动过程一致,并最终实现接近截断前肢体的特征的形态复杂性。
[0197]
4.再生的肢体的复杂性
[0198]
虽然mdt处理的动物确实显示增加的骨生长,但也评估了再生肢体中在细胞水平的分子变化。进行免疫组织化学以评估在18mpa后与再生和再成型相关的组织结构。如在图13中所示,通过乙酰化的α-微管蛋白(aat)染色测量的神经再支配显示,与无装置组相比,与24小时mdt条件相关的aat+神经束的数目显著增加(u=13,p=0.0014)。在对比无装置和仅biodome组时,aat束的数目是相当的,表明mdt处理影响再生体的神经束再生长和神经支配。不仅有更多的束,而且24小时mdt组还表现出相对于无装置组显著更大的aat束直径,如在图14中所示。在仅biodome和无装置组之间不存在束尺寸的显著增加。
[0199]
kruskal-wallis检验表明,在18mpa时aat阳性束的数目在不同条件下存在显著差异,h(15.12)=p《0.005。mann-whitney u事后分析揭示,方差的主要来源是,与未受伤动物相比,与24小时mdt条件相关的aat束的增加,u=13,p=0.0014。当对比未受伤动物和仅biodome组时,aat束的数目是相当的(p=0.1812)。接下来,我们检查了att束尺寸,揭示了不同条件下的显著差异,h(11.74)=p=0.0028。相对于未受伤动物,24小时mdt组表现出更大的att束直径。在对比仅biodome和未受伤动物组时,仍然没有鉴定出显著差异。
[0200]
为了评估结缔组织结构的变化,我们评估了在18mpa后的纤连蛋白表达模式。如在
图15中所示,在mdt处理的再生体中增加的颗粒复杂性反映了在mdt条件下观察到的结构复杂程度。具体来说,荧光图像揭示了在初始截肢并暴露于多药物治疗后18个月在再生体中增加的神经再生和细胞外基质再成型。与其它结果一致,24小时mdt组相对于仅biodome和无装置组显示增加的颗粒复杂性,表明mdt本身可能有助于再生体中软骨和结缔组织的精细化。
[0201]
为了评估再生体的血管形成,在不同条件之间对比了在18mpa时的层粘连蛋白和平滑肌肌动蛋白(sma)表达,如在图16中所示。将截肢后18个月获得的再生体的横切面的荧光图像关于血管形成的两种标志物进行双重染色,一种标志物与平滑肌相关(sma-红色),另一种标志物与基膜相关(绿色)。切片的对比揭示,与仅装置或未治疗组相比,在多药物治疗组中sma/层粘连蛋白阳性束的显著增加(h(19.84)=p《0.001)。与仅biodome和无装置组相比,在每个切片中识别的血管数目在mdt处理组中显著更大(h(19.84)=p《0.001),表明mdt促进了再生体的血管形成,与无装置条件相比,在mdt处理的再生体中血管数目是其两倍以上。
[0202]
5.创伤闭合、增加的sox2表达和重新上皮形成
[0203]
考虑到显著的长期结果,在该过程的早期阶段评估了mdt在截肢后早期时间点的影响。我们首先注意到,与无装置动物相比,mdt组在0.5mpa时的创伤闭合显著减少(p《0.05;图17)。暴露于mdt的动物显示2.02cm
±
0.40cm的平均创伤直径,明显大于biodome组(1.25cm
±
0.41cm)或无装置组(0.56cm
±
0.17cm)。延迟的创伤闭合预示着在18mpa时的成功再成型,在0.5mpa时具有最大创伤部位的动物在18mpa时表现出最多的生长和再成型。
[0204]
不受限于特定理论,考虑较大的创伤部位将提供较大的芽基,这可能为肢体再生长贡献更多的材料。如在图18中所示,通过sox2(一种增殖性细胞标志物)的免疫组织化学评估了芽基增殖。与其它组相比,在mdt组中存在明显更多的表达sox2的细胞(p《0.05),表明更多的增殖组织产生新的肢体。最后,与对照组相比,在2.5个月时的软组织具有类似的预测性,其中mdt后肢的组织更厚,骨长度增加。在2.5mpa获得的荧光图像揭示,向mdt组合物的24小时暴露会增加干性,创伤形成的抑制导致在早期再生过程中更长的再生体。在mdt暴露组中在截肢后2.5个月也观察到增加的软组织生长和重新上皮形成,这反映了通过x-射线成像证实的骨组织长度增加。
[0205]
6.再生诱导的转录组分析
[0206]
为了更仔细地理解响应于向mdt处理的急性暴露的基因表达变化,对干预下游的转录机制进行了表征。进行了rna-测序(rnaseq),其对比在截肢后11小时、24小时和7天相对于未处理动物从mdt获得的芽基的转录组。将mdt动物的基因表达水平与无装置处理进行对比的热图显示,在11hpa时基因表达存在显著差异,持续到24hpa。但是,在7dpa之前,动态基因表达水平恢复正常,表明在截肢的24小时内有动态基因表达的阶段。
[0207]
在多次试验校正p值后,确定差别表达的基因的数目。将q值设置在0.05的假发现率(fdr),且差别表达的基因被认为是通过该fdr的那些转录物和显示2的log2倍数变化的那些转录物。当将mdt动物的芽基与未治疗的动物进行对比时,在截肢后的7天内表达谱有大的动态变化。在7天后活性转换后,表达过度或表达不足的相同基因经历24小时。为了缩小这些基因的显著改变的表达,将fdr设置为log3或3的倍数变化,并在组之间对比前15个差别表达的基因。当将mdt处理的芽基组织与野生型芽基组织进行对比时,发现前15个高度
上调的基因与脑中的神经调节相关(例如,脑特异性激酶(brsk)、神经肽ff、d1c多巴胺受体、neuroligin),其在截肢后11小时具有最高表达。该表达水平在截肢后24小时和7天(dpa)下降。wnt7a(一种参与前后轴发育的基因)在截肢后11小时(hpa)也上调,并随后在截肢后7天增加。相反,下调的主要基因主要与肌肉结构(肌球蛋白-4、微纤丝相关的糖蛋白)和代谢(例如,肌脂蛋白)相关。mdt处理的芽基和对照芽基之间这些差别表达基因的模式与上调基因的模式相反,因为下调基因的表达从11hpa到7dpa增加。
[0208]
将mdt动物中的高度受调节基因与无装置动物中的基因进行了对比。上调的基因包括神经系统特异性转录物,其提示在刚截肢后神经保护蛋白的重要作用。下调的基因包括代谢和肌肉相关的转录物,从而提示资源正从肌肉维持转向组织稳定。代谢和生物合成途径的go分析揭示了早期下调(在11hpa和24hpa),其速率在7dpa增加。表1解释了在11hpa、24hpa和7dpa与无装置处理相比mdt动物的基因表达水平。
[0209]
表1
[0210][0211]
[0212]
鉴定基因类别的丰富度分析显示组之间生物过程的概况的显著差异。基于网络的cemitool(共表达模块识别工具)版本用于识别mdt(ct)和无装置(nd)动物中的共变基因集。高倍变化的共变基因集被分类为模块(m1-m4)。
[0213]
在截肢后早期(11hpa),有更多的基因参与代谢调节,这在mdt和对照之间是不同的。此外,在这个时间点有更多的动态基因表达。这会在以后(7dpa)消退,以及mdt与重组组织或重置细胞功能景观(cell function landscape)之间的显著变化。
[0214]
为了揭示受mdt暴露调节的过程的类型,考虑“大规模功能”将富集的途径分组。共表达分析在截肢后11小时、24小时和7天识别了跨对照组和混合剂治疗组的4个基因模块。这些模块代表基于它们共享的表达水平和统计显著性的基因分类。模块1含有607个基因,这些基因在细胞外基质组构、胶原蛋白形成、胶原蛋白生物合成和修饰酶以及止血途径中显著呈现(p《0.00509),它们可能是损伤后的组织破坏的代表。模块2含有142个基因,这些基因在与细胞连接组构、层粘连蛋白相互作用、细胞-细胞通信、细胞粘附蛋白的细胞凋亡裂解以及非整联蛋白膜ecm相互作用相关的途径内显著呈现(p《0.00009),它们可能是细胞-细胞通信和粘附的代表。模块3中的105个基因在肌肉收缩、乙酰胆碱活性和肌发生途径中显著呈现(p《0.01096)。模块4含有54个基因,这些基因在葡萄糖代谢、肌肉收缩、糖原异生和糖酵解途径中显著(p《0.00142)过多呈现。当模块2、3和4在所有时间点在mdt处理的芽基中显著富集(p《0.00024)和上调时,表明相对于仅biodome和无装置对照,接受促再生混合剂的青蛙具有与细胞通信、肌发生和葡萄糖代谢有关的基因的持续上调。相反,在评估的所有时间点在未接受治疗装置的组中,这些模块得到富集(p《0.012),但下调。但是,在7天时间点,模块2在同一未治疗组中显著上调(p=0.00074),表明在截肢后1周在治疗组和未治疗组之间在细胞-细胞通信途径的丰富度方面几乎没有差异。在所有时间点,ecm和胶原蛋白富集的模块1在未处理的组中上调(p《0.011),在未处理的样品中下调(p《0.00027)。
[0215]
一般而言,在所有时间点与nd条件相比,m2、m3和m4在mdt条件下上调,在24hpa达到峰值。例外是m1,它在mdt条件下下调,在11hpa时达到最高,并降低直到7dpa。
[0216]
7.所提供的mdt组合物中药物的累积释放
[0217]
为了评估在装置水凝胶中多药物治疗(mdt)的累积释放,将载有每种mdt药物的水凝胶悬浮于1x dpbs(thermofisher)中,并在37℃温育25分钟。每5分钟收集上清液,并通过微量培养板读数器测定每种药物的浓度。每种药物/水凝胶混合物表现出相似的释放动力学,在10分钟内释放总药物浓度的约70%,并且释放负载总量不超过80%(除视黄酸外,它在25分钟之前释放所有药物)。
[0218]
本公开内容的其它特征、目的和优点在下面的详细描述中是显而易见的。但是,应当理解,详细描述虽然指示了本公开内容的实施方案,但仅以说明而非限制的方式给出。根据详细描述,在本公开内容范围内的各种变化和修改对于本领域技术人员将变得显而易见。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1