具有改善的奥拉帕尼的溶解度和生物利用率的组合物的制作方法
1.本发明涉及一种包含作为难溶性药物的奥拉帕尼的具有改善的溶解度和生物利用率的口服用组合物及其制备方法。
背景技术:
2.作为杂环聚芳醚衍生物药物的奥拉帕尼(olaparib)是2014年批准的第一个parp抑制剂,并且是用于治疗乳腺癌和卵巢癌的药物。奥拉帕尼具有pka 12.07的弱酸性,是一种在生理ph范围内的水溶解度极低(0.1-0.13mg/ml)的难溶性物质,其透过率也不高,因此认为其属于bcs第4类(class)。这种药物活性成分的低溶解度和生物利用率成为药物制剂化中的一个问题,因此尝试了通过改变晶型或制备盐型等各种方法进行改善。
3.虽然市售制剂lynparza
tm
胶囊也使用脂质赋形剂gelucire
tm
44/14改善了药物的溶解度,但在制剂中药物含量为10%,50mg的奥拉帕尼填充在0号大小的硬胶囊中,在400mg的治疗剂量的情况下,需要一次服用8粒胶囊而引起不便。
4.因此,为了改善患者的服药依从性,需要通过提高生物利用率的同时增加制剂中的药物的含量来减少一次给药单位,并且正在进行对此的各种研究。
技术实现要素:
要解决的技术问题
5.本发明的第一目的在于提供一种包含奥拉帕尼的具有改善的溶解度(水溶解度)和生物利用率的固体分散体。
6.本发明的另一个目的在于提供一种包含奥拉帕尼的具有改善的溶解度和生物利用率的口服用组合物。
7.本发明的另一个目的在于提供一种制备具有改善的溶解度和生物利用率的含有奥拉帕尼的口服固体制剂的方法。技术方案
8.本发明的一个方面涉及一种包含奥拉帕尼和聚甲基丙烯酸酯共聚物的固体分散体。
9.在一个具体实施方案中,所述奥拉帕尼是奥拉帕尼一水合物。
10.在一个具体实施方案中,所述聚甲基丙烯酸酯共聚物是具有甲基丙烯酸二甲基氨基乙酯的阳离子聚合物。
11.在一个具体实施方案中,所述聚甲基丙烯酸酯共聚物是聚(甲基丙烯酸丁酯-共聚-(2-二甲基氨基乙基)甲基丙烯酸酯-共聚-甲基丙烯酸甲酯)。
12.在一个具体实施方案中,所述聚甲基丙烯酸酯共聚物具有3000-200000g/摩尔(mole)的重均分子量。
13.在一个具体实施方案中,相对于1重量份的奥拉帕尼,所述固体分散体包含0.05-10重量份的聚甲基丙烯酸酯共聚物。
14.在一个具体实施方案中,所述固体分散体还包含d-α-生育酚聚乙二醇琥珀酸酯。
15.在一个具体实施方案中,相对于1重量份的奥拉帕尼,所述固体分散体还包含0.001-2重量份的d-α-生育酚聚乙二醇琥珀酸酯。
16.在一个具体实施方案中,所述固体分散体是通过喷雾干燥获得的。
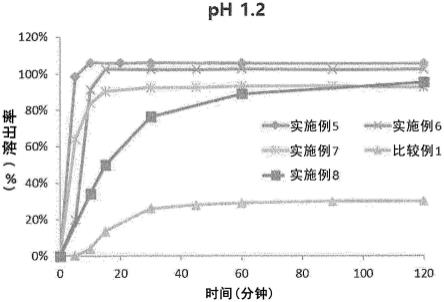
17.在一个具体实施方案中,所述固体分散体是非晶型的。
18.本发明的另一个方面涉及一种制备固体分散体的方法,其包括以下步骤:将奥拉帕尼与聚甲基丙烯酸酯共聚物一同溶解在溶剂中或者分散在溶剂中,然后从所得溶液或分散液中去除溶剂。
19.在一个具体实施方案中,所述溶剂的去除通过喷雾干燥进行。
20.本发明的另一个方面涉及一种口服用组合物,其包含所述固体分散体和药学上可接受的一种以上的添加剂。
21.本发明的另一个方面涉及一种制备口服用组合物的方法,其包括以下步骤:将所述固体分散体与药学上可接受的一种以上的添加剂进行混合。有益效果
22.本发明中公开的奥拉帕尼组合物是一种口服用制剂,其可以使药物稳定地非晶化来增加溶解度和溶解速度,从而提高药物的体内吸收率,与市售制剂相比,通过减少添加剂的使用来增加制剂中药物的含量,减少一次服用的制剂的单位数量,从而可以改善患者的服药依从性。此外,通过利用更有利于配制的组成和制备工艺,预期在制备和包装等生产性方面也具有优势。
附图说明
23.图1是实施例1至实施例3中分别制备的固体分散体和奥拉帕尼api(活性成分)的xrpd图案,其示出用于制备固体分散体的奥拉帕尼api本身为晶型,但实施例1至实施例3中制备的固体分散体中包含的奥拉帕尼均为非晶型。
24.图2示出实施例5至实施例8中制备的片剂和比较例1在ph 1.2的溶液中的溶出模式。
25.图3示出实施例5、比较例1和比较例4在水(蒸馏水,dw)中以及在ph 6.8的溶液中的溶出模式。
具体实施方式
26.术语的定义
27.除非另有明确说明,本说明书全文中使用的几种术语可以定义为如下。
28.除非在本说明书全文中另有说明,“包含”或“含有”是指包含任何组成要素(或组成成分)而没有特别限制,并且不应解释为排除其它组成要素(或组成成分)的添加。
29.技术方案的发现
30.为了改善难溶性药物的溶解度,可以利用各种方法,如制备盐或晶型、前体药物(prodrug)等药物本身的修饰、制备微乳液或纳米乳液、固体分散体、通过减小药物的粒径的微粉化或纳米化、形成胶束等。就这种物理性能的改善而言,每种药物的溶解度、ph、pka、熔点、分子量、官能团、立体结构、结晶度、透过率、吸收部位、分解性、有效的药物剂量等特
性彼此不同,因此一种技术不能共同应用于所有药物,需要寻找适合于特定药物的方式。
31.本发明人为了评价各种物质对奥拉帕尼的溶解度所产生的影响而做出大量努力的结果,发现了对改善奥拉帕尼的溶解度和生物利用率具有显著效果的固体分散体及利用该固体分散体的口服用组合物。
32.详细的说明
33.本发明的一个方面提供一种包含奥拉帕尼和聚甲基丙烯酸酯共聚物的固体分散体。
34.所述“奥拉帕尼”可以是奥拉帕尼碱(没有单独的盐的游离碱药物)、其药学上可接受的盐、其异构体或它们的混合物。此外,在每种情况下,可以形成各种水合物,并且在每种情况下可以形成各种晶型。例如,可以为奥拉帕尼水合物或奥拉帕尼酐的晶型或它们的非晶型或其混合物。
35.在一个具体实施方案中,所述奥拉帕尼可以是奥拉帕尼一水合物。
36.所述奥拉帕尼可以为各种形态,例如,可以是微粉化为几微米至几十微米的尺寸的形态,更优选地,可以是微粉化为几微米尺寸的形态,进一步优选地,可以是纳米化为几百纳米尺寸的形态。随着药物的粒径减小,提升溶解速度,从而可以增加溶解度和生物利用率。
37.在一个具体实施方案中,所述聚甲基丙烯酸酯共聚物可以是具有甲基丙烯酸二甲基氨基乙酯的阳离子聚合物(cationic polymer with dimethyl-aminoethyl methacrylate),更具体可以是聚(甲基丙烯酸丁酯-共聚-(2-二甲基氨基乙基)甲基丙烯酸酯-共聚-甲基丙烯酸甲酯)。所述聚(甲基丙烯酸丁酯-共聚-(2-二甲基氨基乙基)甲基丙烯酸酯-共聚-甲基丙烯酸甲酯)中,各单体可以以1:2:1的摩尔比形成聚合物。
38.作为具体的实例,所述聚甲基丙烯酸酯共聚物可以是epo(赢创公司,德国)或e 100(赢创公司,德国)。e聚合物是常规的包衣剂,其使用目的是在需要保护药物免受潮气或患者的服药依从性降低时,封装敏感的药物或者屏蔽药物的味道和气味以缓解患者对服药的抗拒心理,并提供柔软且有光泽的表面以使药物易于吞咽,但在本发明中用作改善奥拉帕尼的溶解度和生物利用率的聚合物。
39.所述聚甲基丙烯酸酯共聚物的重均分子量可以为3000-200000g/摩尔、5000-150000g/摩尔、10000-100000g/摩尔、20000-80000g/摩尔或37000-57000g/摩尔。当聚甲基丙烯酸酯共聚物的重均分子量小于3000g/摩尔时,水溶解度改善效果可能低,当聚甲基丙烯酸酯共聚物的重均分子量超过200000g/摩尔时,可能会延迟崩解。
40.对所述聚甲基丙烯酸酯共聚物的状态没有特别限制,但可以为颗粒或粉末状态。
41.在一个具体实施方案中,以1重量份的奥拉帕尼为基准,在所述固体分散体中包含的聚甲基丙烯酸酯共聚物的量可以为0.05重量份以上、0.1重量份以上、0.5重量份以上、1重量份以上或1.5重量份以上,并且可以为10重量份以下、9重量份以下、8重量份以下、7重量份以下、6重量份以下、5重量份以下,4重量份以下或3重量份以下,但不限定于此。
42.例如,以1重量份的奥拉帕尼为基准,所述固体分散体可以包含0.05-10重量份、0.1-6重量份、0.1-5重量份、0.5-4重量份、1-3重量份或1.5-3重量份的聚甲基丙烯酸酯共聚物。当固体分散体中的聚甲基丙烯酸酯共聚物的含量少于上述的下限范围时,奥拉帕尼
的溶解度的改善和生物利用率的改善效果可能不充分,当固体分散体中的聚甲基丙烯酸酯共聚物的含量超过上述的上限范围时,制剂(例如,胶囊或片剂)变得过大,患者在服用时可能会引起不便。
43.在一个具体实施方案中,所述固体分散体还可以包含亲水性聚合物。
44.所述亲水性聚合物例如可以是选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(例如)、羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、聚乙酸乙烯酯(pva)、羧甲基纤维素(钠盐和钙盐)、乙基纤维素、甲基纤维素、羟乙基纤维素、乙基羟乙基纤维素、羟丙基纤维素(hpc)、l-hpc(低取代度的hpc)、聚乙烯醇、丙烯酸及其盐的聚合物、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(例如,科利当va64、巴斯夫(basf))、polycoat ir、明胶、瓜尔胶、部分水解淀粉、藻酸盐、黄原胶及它们的混合物中的一种以上,但并不限于此。或者,所述亲水性聚合物可以是聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(例如,)、羟丙基甲基纤维素(hpmc)或它们的混合物。
45.在一个具体实施方案中,以1重量份的奥拉帕尼为基准,所述亲水性聚合物例如可以以0.1-10重量份、0.1-5重量份、0.1-3重量份、0.5-3重量份或1-3重量份的量包含在固体分散体中。当亲水性聚合物的含量少于上述的下限范围时,奥拉帕尼的溶解度的改善和生物利用率的改善程度可能会微乎其微,当亲水性聚合物的含量超出上述的上限范围时,制剂(例如,胶囊或片剂)变得过大,患者在服用时可能会引起不便。
46.在一个具体实施方案中,所述固体分散体还可以包含d-α-生育酚聚乙二醇琥珀酸酯(生育酚(vitamin e)tpgs或tpgs)。在这种情况下,可以获得显著改善奥拉帕尼的溶解度和溶解速度的效果。
47.以1重量份的奥拉帕尼为基准,所述tpgs例如可以以0.001-2重量份、0.001-1重量份、0.005-1重量份或0.01-0.1重量份的量包含在固体分散体中。当tpgs的含量少于上述的下限范围时,奥拉帕尼的溶解度的改善和生物利用率的改善程度微乎其微,因此效果可能降低,当tpgs的含量超过上述的上限范围时,涂层过于粘稠(sticky),不仅在制备过程中引起困难,而且在成膜、储存时可能会引起困难。
48.在一个具体实施方案中,所述固体分散体可以通过喷雾干燥获得。所述固体分散体不是包衣的灭活核的形式,因此可以用于制备片剂,以便在尺寸尽可能小的片剂中可以含有更多的奥拉帕尼,并且可以预防崩解速度和溶出率急剧增加或减小的现象。
49.在一个具体实施方案中,所述固体分散体为非晶型。当固体分散体为非晶型时,与晶型相比溶解度增加,因此具有进一步提高生物吸收率的优点。
50.本发明中使用的术语固体分散体是指被分散物(通常为药物)以晶型或非晶型的形式分散在非晶型的聚合物(连续相)中的形式。更优选为非晶型的药物分散在非晶型的聚合物中的形式。上述固体分散体通常包含药物和聚合物,根据情况可以包含诸如表面活性剂、增塑剂、崩解剂的其它药物添加剂。
51.在一个具体实施方案中,所述固体分散体可以不包含表面活性剂。
52.在一个具体实施方案中,所述固体分散体还可以进一步包含表面活性剂。
53.所述表面活性剂例如可以是阴离子型表面活性剂。阴离子型表面活性剂可以是十二烷基硫酸钠、月桂醇硫酸钠,n-月桂酰肌氨酸钠、n-长链酰基谷氨酸盐、蔗糖脂肪酸酯、聚
氧乙烯氢化蓖麻油、山梨糖醇酐脂肪酸酯、聚氧乙烯和聚氧丙烯的共聚物或它们的组合,或者阴离子型表面活性剂可以是十二烷基硫酸钠。
54.本发明的另一个方面提供一种制备固体分散体的方法,其包括以下步骤:将奥拉帕尼与聚甲基丙烯酸酯共聚物一同溶解在溶剂中或者分散在溶剂中,然后从所得溶液或分散液中去除溶剂。
55.在一个具体实施方案中,为了制备所述固体分散体而使用的溶剂可以是水混溶性有机溶剂、水或它们的混合物,也可以包含超临界流体。作为水混溶性有机溶剂例如可以使用选自醇、丙酮、四氢呋喃、乙酸、乙腈、二氧六环及它们的组合,但不限定于此。水混溶性有机溶剂例如可以是碳原子数为1至5的低级醇、丙酮或它们的混合物,或者水混溶性有机溶剂可以是乙醇、丙酮或它们的混合物,或者水混溶性有机溶剂可以是乙醇。
56.所述溶剂的去除可以利用真空干燥、喷雾干燥、盘式干燥、冷冻干燥及其它干燥技术进行,在一个具体实施方案中,所述溶剂的去除通过喷雾干燥进行。其中,喷雾干燥中可以使用喷雾干燥机、流化床干燥机、其它干燥机。
57.如上所述制备的固体分散体可以通过与其它附加的组成成分混合来进行粉剂化和颗粒剂化、将混合物压片来进行片剂化或者填充于胶囊中来进行胶囊化。
58.本发明的另一个方面提供一种包含所述固体分散体和药学上可接受的一种以上的添加剂的具有改善的溶解度和生物利用率的口服用组合物。
59.本发明的另一个方面提供一种制备具有改善的溶解度和生物利用率的口服用组合物的方法,其包括以下步骤:将所述固体分散体与药学上可接受的一种以上的添加剂进行混合。
60.所述口服用组合物可以用于治疗癌症。
61.在一个具体实施方案中,所述癌症选自乳腺癌和卵巢癌。
62.所述口服用组合物例如可以为片剂、胶囊剂、颗粒剂或粉末形式的固体口服制剂,特别是可以为片剂或胶囊剂的形式。在一个具体实施方案中,所述口服用组合物为片剂。
63.以1重量份的总组合物为基准,所述口服用组合物可以包含0.01-0.9重量份、0.01-0.8重量份、0.05-0.8重量份、0.1-0.7重量份、0.3-0.7重量份或0.4-0.7重量份的所述固体分散体。当口服用组合物包含超过上述范围的量的固体分散体时,压片性降低,难以配制,当口服用组合物包含小于上述范围的量的固体分散体时,制剂的尺寸变得过大,患者在服用时可能会引起不便。
64.所述药学上可接受的一种以上的添加剂例如可以是稀释剂、崩解剂、润滑剂、表面活性剂、ph调节剂、包衣剂或它们的组合。在一个具体实施方案中,所述口服用组合物可以包含稀释剂、崩解剂、润滑剂、ph调节剂或它们的组合。
65.所述稀释剂例如可以是选自乳糖(酐或水合物,例如一水合物)、纤维素粉末、微晶纤维素、硅化微晶纤维素、淀粉、磷酸二钙、磷酸三钙、三硅酸镁、甘露醇、麦芽糖醇、山梨糖醇、木糖醇、乳糖、右旋糖、麦芽糖、蔗糖、葡萄糖、果糖、麦芽糊精及它们的混合物中的一种以上,但并不限于此。优选地,可以选择乳糖、甘露醇、微晶纤维素或它们的混合物。最优选地,可以选择微晶纤维素或甘露醇。
66.此时,以100重量份的片剂的总重量为基准,所述稀释剂例如可以以1-70重量份的量、5-50重量份的量或10-40重量份的量使用。当稀释剂的量少于上述的下限范围时,压片
性降低,从而难以制成片剂,当稀释剂的量超过上述的上限范围时,片剂变得过大,患者在服用时可能会引起不便。
67.所述崩解剂例如可以是交联羧甲基纤维素钠(croscarmellose sodium,croscmc-na)、羧甲基纤维素、交联聚维酮(交联的聚乙烯吡咯烷酮)、l-hpc(低取代度羟丙基纤维素)、淀粉(小麦、大米、玉米或马铃薯淀粉)、羧甲基淀粉钠、马铃薯淀粉的乙醇酸钠、部分水解淀粉及它们的混合物中的一种以上,但并不限于此。优选地,可以是交联羧甲基纤维素钠(croscarmellose sodium,croscmc-na)或淀粉的乙醇酸钠、l-hpc(低取代度羟丙基纤维素)或它们的混合物。
68.此时,以100重量份的片剂的总重量为基准,例如,所述崩解剂可以以1-30重量份、2-20重量份、2-10重量份或2-6重量份的量使用。当崩解剂的量少于上述的下限范围时,可能会存在延迟崩解速度引起的延迟溶出速度的问题,当崩解剂的量超过上述的上限范围时,可能会存在压片障碍等生产性问题。
69.所述润滑剂例如可以是选自硬脂酸镁、富马酸、硬脂酸、硬脂酸钙、硬脂富马酸钠、聚乙二醇、淀粉(小麦、大米、玉米或马铃薯淀粉)、滑石、高分散型(胶体型)二氧化硅、氧化镁、碳酸镁、山嵛酸甘油酯、单硬脂酸甘油酯、二氧化硅、硅酸钙、硅酸镁及它们的混合物中的一种以上,但并不限于此。优选地,润滑剂可以是硬脂酸镁。作为所述润滑剂可以单独使用硬脂酸镁。
70.此时,以100重量份的片剂的总重量为基准,所述润滑剂例如可以以0.1-3重量份、0.2-3重量份、0.5-2.5重量份或0.5-2重量份的量使用。当润滑剂的量少于上述的下限范围时,可能会存在压片障碍等生产性问题,当润滑剂的量超过上述的上限范围时,可能会存在溶出延迟或生产性问题。
71.所述ph调节剂是改变制剂中的酸碱平衡的化合物的总称,具体可以是羧酸、丙烯酸、酒石酸、柠檬酸、苹果酸、马来酸、富马酸、乙酸、琥珀酸、乳酸、丙二酸、戊二酸或它们的混合物。所述ph调节剂可以用于改善聚甲基丙烯酸酯共聚物的根据水溶剂的ph的溶解度的差异。
72.在一个具体实施方案中,ph调节剂是一种酸性化合物,其包含具有羧酸的有机酸,优选可以是具有2个羧基官能团的二元酸,但并不限于此。所述二元酸例如可以是马来酸、酒石酸、柠檬酸、富马酸或它们的混合物,在一个具体实施方案中,所述ph调节剂是富马酸、马来酸或它们的混合物。
73.在一个具体实施方案中,ph调节剂可以根据各成分的pka和稳定性等物理性能使用适当的量,例如,相对于1重量份的聚甲基丙烯酸酯共聚物,可以以0.01-5重量份、0.05-3重量份、0.1-1重量份、0.1-0.5重量份、0.1-0.3重量份、0.1-0.25重量份或0.3-0.8重量份的量使用。当ph调节剂的量少于上述的下限范围时,根据ph变化的溶解度的减小效果不足,当ph调节剂的量超过上述的上限范围时,根据反应性强的物质的特性,可能会影响制剂的稳定性。
74.在另一个具体实施方案中,所述口服用组合物可以不包含表面活性剂。
75.所述包衣剂是亲水性聚合物,例如可以是选自聚乙烯吡咯烷酮(pvp)、聚乙酸乙烯酯(pva)、羟丙基甲基纤维素(hpmc)、羧甲基纤维素(钠盐和钙盐)、乙基纤维素、甲基纤维素、羟乙基纤维素、乙基羟乙基纤维素、羟丙基纤维素(hpc)、l-hpc(低取代度的hpc)、聚乙
烯醇、丙烯酸及其盐的聚合物、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(例如,va64、巴斯夫(basf))、polycoat ir、明胶、瓜尔胶、部分水解淀粉、藻酸盐、黄原胶及它们的混合物中的一种以上,但并不限于此。优选可以是聚乙酸乙烯酯(pva)或羟丙基甲基纤维素(hpmc)。
76.以100重量份的包衣前的片剂(未包衣的片剂)为基准,所述包衣剂例如可以以0.2-10重量份的量,优选可以以1-7重量份的量,更优选可以以3-5重量份的量使用。当包衣剂的量少于上述的下限范围时,可能会存在未包衣的片剂的整个表面没有被包衣剂完全覆盖的问题,当包衣剂的量超过上述的上限范围时,可能会存在溶出速度过度延迟的问题。
77.所述固体分散体可以与其它附加的组成成分混合来进行粉末剂化和颗粒剂化,将混合物压片来进行片剂化,或者填充于胶囊中来进行胶囊化。
78.当利用所述固体分散体制备口服用组合物时,例如,制成片剂时,可以利用包括以下步骤的制备方法:将固体分散体、稀释剂及ph调节剂进行混合;进一步混合崩解剂;进一步混合润滑剂;以及进行压片,但并不限于此。
79.以下,为了帮助理解本发明而提出实施例。然而,下述实施例仅用于例示本发明,并不通过任何方式限制本发明。
80.[实施例]
[0081]
实施例1至实施例4:包含奥拉帕尼的固体分散体的制备
[0082]
将奥拉帕尼水合物(晶型)(作为一水合物,同下)、eudragit e po或soluplus及tpgs(d-α-生育酚聚乙二醇琥珀酸酯(d-α-tocopheryl polyethylene glycol succinate))以如下表1的含量完全溶解在etoh中,然后进行喷雾干燥(spray drying)以去除溶剂,从而获得包含奥拉帕尼的固体分散体。
[0083]
[表1] 实施例1实施例2实施例3实施例4奥拉帕尼(g)2222eudragit e po(g)542-soluplus(g)
‑‑‑
5tpgs(g)0.10.10.10.1etoh(ml)200200200200
[0084]
实施例5至实施例8:包含奥拉帕尼固体分散体的片剂的制备
[0085]
利用实施例1至实施例4中制备的固体分散体分别制备实施例5至实施例8的片剂。具体地,首先按照下表2的组成混合固体分散体、微晶纤维素及富马酸,然后添加交联羧甲基纤维素钠并混合,混合作为润滑剂的硬脂酸镁,然后进行压片,从而制备以600mg的总重量分别包含100mg的奥拉帕尼的片剂。确认了该片剂在生理ph条件下的溶出模式。
[0086]
比较例1
[0087]
使用了市售中的lynparza
tm
(奥拉帕尼为50mg)胶囊。
[0088]
[表2]
[0089]
比较例2和比较例3:奥拉帕尼简单混合物(重量比为1:2.5)的制备
[0090]
作为实施例1的比较例,将2.0g的奥拉帕尼水合物(晶型)、5.0g的eudragit e po及0.1g的tpgs进行简单混合,并将其作为比较例2。
[0091]
此外,作为实施例4的比较例,将2.0g的奥拉帕尼水合物(晶型)和5.0g的soluplus及0.1g的tpgs进行简单混合,并将其作为比较例3。
[0092]
将制备的比较例2和比较例3用于试验例1的溶解度的分析。
[0093]
比较例4:不包含有机酸的奥拉帕尼固体分散体片剂的制备
[0094]
作为实施例5的比较例,按照如下表的组成混合实施例5的包含固体分散体的片剂组合物中除了作为ph调节剂的富马酸之外的添加剂,并压片成100mg的奥拉帕尼片剂。
[0095]
[表3][表3]
[0096]
试验例1:在奥拉帕尼和聚合物的简单混合物和固体分散体状态下的药物溶解度的比较
[0097]
向20ml的蒸馏水和ph 1.2的缓冲液中分别加入对应于400mg的奥拉帕尼的量的实施例1和实施例4的固体分散体以及比较例2和比较例3的简单混合物,并在37℃的培养箱中以100rpm搅拌1小时。将该试液用rc针式过滤器(syringe filter)(0.2μm)进行过滤,然后取1ml的滤液,加入2ml的以下稀释液并进行稀释,然后按照奥拉帕尼含量分析法测量含量。将其结果示于表4中。
[0098]
含量分析条件
[0099]
1)稀释液的制备
[0100]
稀释液-水(蒸馏水(dw)):乙腈(can)=1:1
[0101]
2)操作
[0102]
检测器:紫外分光光度计254nm
[0103]
色谱柱:nova-pak c18色谱柱(column)、4μm、3.9mm
×
150mm
[0104]
流量:1.2ml/分钟
[0105]
注入量:5μl
[0106]
色谱柱温度:35℃
[0107]
运行时间(run time):16分钟
[0108]
流动相
[0109]
[表4][表4]
[0110]
[表5]
[0111]
试验例2:通过xrpd分析的药物结晶度的测量
[0112]
按照下表5的分析条件对实施例1至实施例3和奥拉帕尼原料进行xrpd分析,并将固体分散体中的奥拉帕尼结晶度示于图1中。试验结果,在实施例1至实施例3的固体分散体的情况下,未显示原料中观察到的奥拉帕尼的结晶峰,因此确认奥拉帕尼以非晶型的形式存在。
[0113]
[表6]
[0114]
试验例3:稳定性比较
[0115]
为了评价实施例的固体分散体的稳定性,进行了加速试验。将实施例1中制备的固体分散体与干燥剂一起放入铝袋中并密封,然后在作为加速条件的40℃、75%的相对湿度(rh)的储存条件下储存3个月。对于样品,在储存前、储存后经过1个月的时间点、储存后经过3个月的时间,通过xrpd分析确认药物的晶型,并测量溶出率。将其结果示于下表6中。
[0116]
溶出条件
[0117]
准确称取对应于400mg的奥拉帕尼的固体分散体的量,并在以下条件下进行溶出试验。取6分钟时间点的样品,并通过hplc分析测量药物的溶出率。比较例1的情况下,已经在初始时间点确认了低溶出率并形成晶型,因此没有进行进一步的试验。
[0118]
试液:900ml的ph 1.2缓冲液
[0119]
搅拌速度:100rpm
[0120]
温度:37℃
[0121]
[表7]1)在xrpd中观察到的结晶峰2)n/d:未检测出
[0122]
试验例4:奥拉帕尼固体分散体片剂的溶出试验
[0123]
对于实施例5至实施例8的片剂和比较例1(lynparza
tm
胶囊剂),分别在与胃液相同的条件的ph 1.2的溶液条件下,测量根据时间的溶出率,并将其结果示于图2中。
[0124]
溶出条件
[0125]
试液:ph 1.2
[0126]
搅拌速度:100rpm
[0127]
温度:37℃
[0128]
溶出基准时间点:5分钟、10分钟、15分钟、30分钟、45分钟、60分钟、90分钟、120分钟
[0129]
分析方法:hplc分析法
[0130]
试验例5:包含eudragit e的奥拉帕尼固体分散体片剂的中性ph溶液中的溶出试验
[0131]
对于实施例5和比较例4的片剂,在水和ph 6.8条件下测量根据时间的溶出率,并将其结果示于图3中。
[0132]
溶出条件
[0133]
试液:水、ph 6.8的溶液
[0134]
搅拌速度:100rpm
[0135]
温度:37℃
[0136]
溶出基准时间点:5分钟、10分钟、15分钟、30分钟、45分钟、60分钟、90分钟、120分
钟
[0137]
分析方法:hplc分析法
[0138]
试验例6:奥拉帕尼固体分散体的药代动力学(pk)试验
[0139]
为了比较实施例5和比较例1的体内行为,利用sd大鼠作为实验动物进行药代动力学试验。将15只sd大鼠分为两组,每组5只,第一组分为比较例1,第二组分为实施例1。将各组的组合物分散为奥拉帕尼的浓度为4mg/ml,并以10mg/kg的剂量向保持禁食状态的实验动物口服给药。施用后,以预定的时间间隔进行采血至24小时,并且从血液样品中分离血浆后冷冻储存,使用lc/ms/ms装置分析浓度,测量根据时间的血液中的浓度,并从该数据计算auc(血浆浓度-时间曲线下面积)和c
最大(max)
(血液中的最大浓度)。将其结果示于下表8中。
[0140]
[表8] auc(ng/ml
·
小时)c
最大
(ng/ml)比较例1236.294.3实施例5469.3587.6
[0141]
药代动力学实验结果,确认了根据本发明的包含奥拉帕尼的固体分散体组合物表现出与现有的包含奥拉帕尼的市售用硬胶囊制剂相比更高的auc和c
最大
,因此与市售制剂相比,具有更优异的药代动力学特性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1